Nosokomiale Infektionen
Werbung

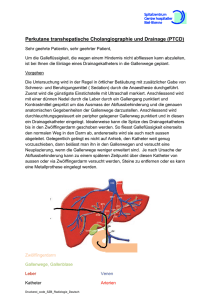
Katheterinfektionen Heinz Burgmann Verteilung nosokomialer Infektionen auf der Intensivstation Harnwegsinfektionen 31% Pneumonien 27% Bakteriämien 19% Gastro. Infekte 5% CVS 4% EENT 4% URTI 4% Andere 6% Richards et al. Crit.Care Med 1999 Infektionen auf der ICU Katheterinfektionen 5% der Patienten mit Katheter entwickeln Bakteriämie Poportional zu Liegedauer, Katheterschenkel und Manipulationen 25% der Katheter kolonisiert (> 15CFU) 20-30% der kolonisierten Katheter resultieren in Kathetersepsis Infektionen auf der ICU Katheterinfektionen 10-20% erhöhte Morbidität und Mortalität 7-14 d verlängerter Spitalsaufenthalt (survivor: 24d) 10 000 Dollar/Hospitalisation ESGNI-006 Study (European Study Group on Nococomial Infections) Cross Sectional Survey von ZVKInfektionen: 22-26. Oktober 2001 Mikrobiologisch nachgewiesenen Katheterinfektionen 107 Spitäler aus 21 EU-Staaten ESGNI-006 Study (European Study Group on Nococomial Infections) 1.55 ZVK-Septikämie /1000 Aufnahmen Lokale Zeichen der Infektion < 50% 44% Jugularvenenkatheter 70% Katheterliegedauer > 7d TPN in 40% über Multilumenkatheter Munoz P, CMI 2004:843-860 ESGNI-006 Study (European Study Group on Nococomial Infections) Häufigsten Keime KNS S. aureus Enterobacter spp. Candida spp. Klebsiella spp. Pseudomonas spp. Enterococcus spp. Munoz P, CMI 2004:843-860 34% 17% 9% 9% 6% 6% 6% Wie entsteht nun eine Katheterinfektion? KATHETERINFEKTION Eintrittspforten Katheterinfektionen < 10 Tage: Infektion erfolgt von der Kathetereintrittsstelle aus > 10 Tage: Infektion erfolgt vom Lumen aus (Manipulation, Hand) KATHETERINFEKTION PATIENT KATHETER BAKTERIUM Proteine Thrombozyten Neutrophilenfunktion Elektrische Ladung Thrombogenität Polymer Elektrische Ladung Biofilmbildung Katheterlokalisation Verweildauer TPN Sterilität bei Implantation Kontamination Erregeradhärenz Kolonisation Multiplikation Erregerfreisetzung KATHETER-ASSOZIIERTE SEPSIS Biofilm Katheterinfektionen Biofilmbildung und Kolonisation kann innerhalb von 24h nach Katheterapplikation entstehen Anzahl der Kolonien korreliert mit Wahrscheinlichkeit einer Bakteriämie Bakteriämie findet erst ab einem gewissen Anzahl von Bakterien statt. Wie wird die Katheterinfektion definiert? Definitionen Katheter-Kolonisation: Signifikantes Wachstum einer semi-quantitativen oder quantitativen Kultur auf einer Katheterspitze, subkutanen Kathetersegment oder KatheterAnsatzstück. Infektionen auf der ICU Katheterinfektionen CDC-Kriterien: Klinische Zeichen der Infektion und Positives Blutaspirat aus dem Katheter oder Kathersegment und Eine oder mehrere Blutkulturen Polderman et al. Intensive Care Med 2002 Definitionen: Exit-site Infektion Mikrobiologisch: Exsudat an Katheteraustrittsstelle +/- gleichzeitiger Nachweises des Keimes in der BK Klinisch: Erythem, Induration +/- Spannung innerhalb von 2 cm der Einstichstelle- kann mit Zeichen der Infektion wie Fieber, Pus aus der Eintrittsstelle assoziiert sein mit oder ohne positiver BK Definitionen Tunnel- Infektion: Spannung, Erythem, oder Induration > 2 cm von der Eintrittsstellesubcutan entlang des Katheterverlaufs mit oder ohne positive BK Taschen-Infektion: Infizierte Flüssigkeit in der subkutanen Tasche eines total implantierten Katheters oft assoziiert mit Spannung, Erythem, Induration. Spontane Ruptur oder Drainage bzw. Nekrose der darüber liegenden Haut; mit oder ohne positive BK Welche Methoden des mikrobiologischen Nachweises gibt es ? Katheter-assoziierte Bakteriämie (CR-BSI) Kulturmethoden nach Katheterentfernung Druskin Technik (qualitativ) Maki-Technik (semiquantitativ) Cleri-Technik (quantitativ) Brun-Buisson Technik (quantitativ) Katheter-assoziierte Bakteriämie (CR-BSI) Maki-Technik (semiquantitativ) N Engl J Med 1977 Katheterentfernung Ausrollen der Spitze auf Agar Cut off 15 CFU Keime von der äußeren Oberfläche Intravaskuläre Katheter Infektionsverdacht – geeignetes Untersuchungsmaterial: Sekret von der Einstichstelle + 2 peripher abgenommene Blutkulturen Falls Katheter entfernt wird: 5 cm vom distalen Ende (incl. Spitze) in steriles Röhrchen (mit 0.5 ml phys. NaCl oder H2O) Intravaskuläre Katheter Quantitative Kultur = „State of the Art“ Katheter = Infektionsquelle ? Entscheidender Hinweis bei Wachstum von ≥ 15 Kolonien + selber Keim in Blutkultur daher: Katheter NICHT in Nährbouillon einsenden! Katheter-assoziierte Bakteriämie (CR-BSI) Brun-Buisson Technik (quantit) Arch Intern Med 1987 Katheterentfernung 1 ml H2O + Katheterspitze – Zentrifuge Ausimpfen von 0.1 ml auf Agar Cut off > 103 CFU/ml Sens 97%; Spez 88% Katheter-assoziierte Bakteriämie (CR-BSI) Kulturmethoden bei Katheter in-situ Quantitative Blutkultur (zentral und peripher) Differential Time-to-positivity (DTP) (Blot et al.) Catheter brush (Kite et al) Katheter-assoziierte Bakteriämie (CR-BSI) Direktmethoden bei Katheter in situ Gram Färbung Acridin orange leucocyte cytospin test (AOLC) Katheter-assoziierte Bakteriämie (CR-BSI) AOLC plus Gramfärbung (Kite et al Lancet 1999) 1 ml Blut aus Katheter Leukozyten-Cytospin Zentrifuge Acridinorange- und Gram-Färbung Positiv bei Nachweis von Bakterien und Pilzen Katheter-assoziierte Bakteriämie (CR-BSI) AOLC plus Gramfärbung (Kite et al Lancet 1999)– Hintergrund Hohe Keimzahlen im Katheterblut ergeben positives Präparat Niederige Keimzahlen im peripheren Blut bei Bakteriämie anderer Ursache ergeben negatives Präparat Katheter-assoziierte Bakteriämie (CR-BSI) Kite et al Lancet 1999 CR-BSI: 44% der 112 Katheter bei V. a. CRBSI Gram/AOLC Maki brush Sensitivity 96 90 92 Specificity 92 55 98 Katheter-assoziierte Bakteriämie (CR-BSI) Differential Time-to-positivity (Blot et al, Lancet 1999) Blutkultur zentral und peripher Detektion im automatisiertem BK Gerät Messung der Time-to-positivity Cut off: 120 min zw. Zentraler und peripherer BK Katheter-assoziierte Bakteriämie (CR-BSI) Jeden ZVK Schenkel untersuchen? Ja Jeder Schenkel kann CRBSI verursachen (Dobbins, Crit Care Med 2003) Jein Jeder Schenkel kann CRBSI verursachen Fast immer PE-Schenkel Fast immer gleiche Keime (Krause, JCM 2004) Katheter-assoziierte Bakteriämie (CR-BSI) Routine-Screening ? (klinisch, mikrobiologisch?) Nein! Pat mit TPN (Catton, Clin Nutr 2004) Empfehlungen Kultur des Katheters nur wenn Infektion vermutet wird Quantitative oder semiquantitative Kultur Kultur soll von Katheterspitze oder dem subkutanen Segment angelegt werden. Wenn möglich sollte Acridin orange Färbung durchgeführt werden Empfehlungen 2 BK, davon zumindest 1 peripher bei Verdacht auf Katheterinfektion Gepaarte quantitative oder qualitative BK sollten vor allem bei Kathetern durchgeführt werden, die schwer entfernt werden können. Empfehlungen: Nicht getunnelte zentral-venöse Katheter Bei Fieber und nur milder Erkrankung muss der Katheter nicht routinemäßig entfernt werden Katheter sollte entfernt werden Erythem oder Pus an der Einstichstelle od. Klinische Zeichen der Sepsis Empfehlungen: getunnelte Zentralvenöse Katheter Klinische Untersuchung, dass Katheter Ursache ist für die Infektion Bei komplizierten Infektionen muss Katheter entfernt werden Zur Rettung eines Katheters bei unkomplizierter Infektion kann ein antimikrobieller Lock gemeinsam mit einer systemischen antimikrobiellen Therapie durchgeführt werden Bei Tascheninfektion oder Portabszess muss Katheter entfernt plus 7-10 Tage antimikrobielle Therapie Empfehlungen: getunnelte Zentralvenöse Katheter Ein neuer tunnelierter Katheter oder Port soll erst nach einer systemischen antimikrobiellen Therapie plaziert werden und dem Nachweis negativer BK (Antimikrobielle Tx + 5 Tage nach Beendigung negative BK) Therapie der Katheterinfektion Katheterassoziierte Infektionen konservativer Therapieversuch Avirulente Erreger KNS Diphtheroide (Corynebacterium species non-jeikeium) alpha-hämolysierende Streptokokken Infektion der Einstichstelle Bakteriämie beim neutropenischen Patienten mit GIKeim meist gram-negative Erreger, die innerhalb von 3 Tagen auf die antibiotische Therapie ansprechen Katheter entfernen Positive Blutkulturen mit virulentem oder gut-haftendem Keim Blutkultur nach 72h antibiotischer Therapie immer noch positiv erneute Bakteriämie mit selbem Erreger nach adäquater Therapiedauer Tunnelinfektion Infektion der subkutanen Tasche bei Port-a-Caths septische Thrombophlebitis Katheterinfektion KNS Bei Ansprechen auf Therapie nach 48-72h Gesamttherapiedauer von 7 Tage wahrscheinlich ausreichend. Therapieeffekt unabhängig von der Entfernung des Katheters. Allerdings: wenn Katheter belassen wird ist die Relapsewahrscheinlichkeit 20% (vs. 3%) Katheterinfektion S. aureus Komplikationen: septische Thrombose, fatale Sepsis, Endokarditis, Osteomyelitis Retention des Katheters kann zu Persistenz, Relaps und erhöhter Mortalität führen 2 Wochen Therapie bei unkompliziertem Verlauf zumindest 4-6 Wochen bei Komplikation Katheterinfektion Gram negative Bakterien E. coli und K. pneumoniae sind seltene Ursachen Pseudomonas, Acinetobacter, Stenotrophomonas Entfernung des Katheters 1 Woche antibiotische Therapie Katheterinfektion Candida Entfernung des Katheters Systemische Therapie für zumindest 14 Tage Belassung des Katheters ist unabhängiger Risikofaktor für Persistenz der Candidämie und Mortalität Tunnelierter Katheter Unkompliziert KNS ZVK in situ Lock+ AB 10-14d ZVK ex Bei klin. Verschlecht. od. persist. Bakteriämie S . aureus Candida ZVK ex 14d AB bei TEESalvage: TEELock +14d AB ZVK ex Bei klin Verschl Gram ZVK ex + 10-14d AB ZVK ex AB 14d Wenn TEE+ AB 4-6 W Salvage: Lock +14d AB Nicht Ansprechen ZVK ex + 10-14d AB Tunnelierter Katheter Katheter assoziierte Infektion? Komplikationen? Persitierende Bakteriämie Septische Thrombose Retinitis Endokarditis Eingangs od. Tunnelinf. Passender Keim Quantitative CVC/PBC > 5:1 CVC/PBC Zeit > 2h Keine andere Ursache Positive BK unter Tx Fundoskopie TEE+ Tunnelierter ZVK Kompliziert Tunnel Infektion Port Abszess ZVK ex 10-14d AB Septische Thrombose Endokarditis Osteomyelitis ZVK ex AB Tx für Mind. 4-8 Wochen Prevention Katheterimprägnierung Außenseite gecoated mit Chlorhexidin/Silber sulphadiazin: Außen und Innenseite Minocyclin/Rifampicin: 50% Reduktion der Kolonisation 4 fach geringere Wahrscheinlichkeit einer Bakteriämie 3 fach geringere Wahrscheinlichkeit einer Bakteriämie Katherimprägnierung mit Rifampicin/Minocyclin führt zu besserer antimikrobiellen Aktivität als Chlorhexidin/Silber Silberkatheter Kontaminierte Katheter Kontamination/1000 Kathetertage Infektion Siberimprägnierte Katheter 20 Kontroll katheter 15.6 24.6 12% 21% 29.8 Stoiser et al. J Hosp Inf 2002 Multilumen vs. Single-Lumen Die Aussage, dass Multilumen-Katheter ein Risikofaktor für Infektionen sind stammt von schlechten prospektiven bzw. retrospektiven Studien. Eine Metaanalyse von standardisierten und gut kontrollierten Studien zeigt, dass Multilumenkatheter kein erhöhtes Infektionsrisiko zeigen in Vergleich zu SingleLumen Katheter Dezfulian C, Crit Care Med 2003: 2385 Katheterinfektionen Infektionsgefahr durch Wahl der Insertionsstelle: Femoralvene > Jugularvene > Subclavia Liegedauer < 3d: fast 0% Infektionsrate; bei > 7d: 5-10% Raad, Lancet 1998 Prävention von ZVK Infektionen Asepsis Kutane Desinfektion Controversiell! Subclavia? Katheter Material Chlorhexidin Katheter Team Lokalisation Händedesinfektion, Steriler Mantel, Maske, Handschuhe Antimikrobielle Beschichtung, Antiseptica, Heparin Abdeckung der Einstichstelle Anzahl der Katheterlumina Mehr Infektionen bei multiplen Lumina (Controversiell) Zusammenfassung Katheterinfektionen Auswahl des Katheters: (möglichst wenig Lumina), weich, nicht zu lang – soll in V. cava liegen Imprägnierte Katheter bei Hochrisikopatienten Tunnelierung bei langer Liegedauer Sterile Applikation Rasche Entfernung von Notfallkathetern Max. 2 Fehlversuche unerfahrener Kollegen Polderman et al. Intensive Care Med 2002