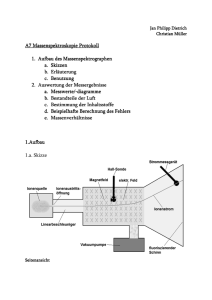
1. Chemische Thermodynamik, Kinetik und Gleichgewicht
Werbung
1. Chemische Thermodynamik, Kinetik und Gleichgewicht
chemische Reaktion
Chemische Reaktionen sind Umwandlungen von Ausgangsstoffen in Reaktionsprodukte mit anderen
Eigenschaften. Wesentliches Merkmal ist die Stoffumwandlung. Sie wird von anderen Erscheinungen,
zum Beispiel Energieabgabe oder Energieaufnahme begleitet. Chemische Reaktionen bilden eine
Einheit aus Stoff- und Energieumsatz.
chemische Systeme
Als chemisches System wird der jeweils untersuchte reine Stoff, die Stoffmischung oder das
Stoffgemische betrachtet.
•
abgeschlossenes System
Es
findet
kein
Stoffübergang
mit
der
Umgebung statt.
findet
kein
• Es
Energieübergang mit der
Umgebung statt.
•
geschlossenes System
Es
findet
kein
Stoffübergang
mit
der
Umgebung statt.
• Es findet Energieübergang
mit der Umgebung statt.
•
offenes System
Es findet Stoffübergang mit der
Umgebung statt.
•
Es findet Energieübergang mit
der Umgebung statt.
chemische Zustandsgrößen
Zur quantitativen Beschreibung stofflicher Systeme dienen Größen und Größengleichungen. Dabei
werden extensive und intensive Größen unterschieden.
•
•
extensive Größen
Extensive Größen sind solche Größen,
deren Wert sich bei der Vereinigung zweier
chemischer Systeme verdoppelt.
Die Symbole extensiver Größen sind meist
Kleinbuchstaben (außer beim Volumen).
Größe
Stoffmenge,
Objektmenge
Volumen
Symbol
n
Einheit
mol
V
m³, l
Masse
m
kg, g
innere Energie
u
J
•
•
•
intensive Größen
Intensive Größen sind solche Größen, deren
Wert bei der Vereinigung zweier gleicher
chemischer Systeme gleich bleibt.
Viele intensive Größen werden durch die
Division zweier extensiver Größen gebildet.
Die Symbole intensiver Größen sind meist
Großbuchstaben.
Größe
Temperatur
molares
Volumen
molare
Masse
Druck
Dichte
Heizwert
Symbol
T
Einheit
K
Bildung
Vm
l * mol-1
Vm = V / n
M
g * mol-1
M=m/n
p
ρ
H
Pa
g * cm-1
KJ * kg-1
M / Vm
H = Q /m
Energie eines stofflichen Systems
Jedes stoffliche System besitzt einen Vorrat an innerer und äußerer Energie.
•
innere Energie
Die durch innere Zusammenhänge in einem
stofflichen System vorhandene Energie
heißt innere Energie.
•
äußere Energie
Die Energie, die sich aus der Lage eines
stofflichen
Systems
in
elektrischen,
magnetischen
und
Gravitationsfeldern
(potentielle Energie) oder aus der Bewegung
gegenüber anderen Systemen (kinetische
Energie) ergibt, wird als äußere Energie
•
•
•
•
Die innere Energie lässt sich nicht
bestimmen, da sich kein Nullpunkt
festlegen lässt.
Die innere Energie u umfasst vereinfacht
die drei Energieformen Kernenergie uK,
chemische Energie uch und thermische
Energie uth.
u = uK + uch + uth
Die Änderung der inneren Energie Δu lässt
sich bestimmen.
•
bezeichnet.
Die äußere Energie lässt sich nicht bestimmen,
da sich kein Nullpunkt festlegen lässt.
1. Hauptsatz der Thermodynamik
•
•
•
Bei einem Prozess kann Energie weder erschaffen noch vernichtet werden. Energie kann nur aus
einer Form in andere Energieformen umgewandelt werden.
Der erste Hauptsatz der Thermodynamik oder auch Satz von der Erhaltung der Energie ist ein
Erfahrungssatz.
Geräte, die gegen ihn verstoßen sollen, heißen Perpetuum mobile erste Art.
Reaktionsenergie
•
•
•
•
•
Während physikalischen oder chemischen Prozessen innerhalb eines stofflichen Systems ändert
sich dessen innere Energie.
Diese Änderung Δu erfolgt von einem Anfangszustand u1 zu einem davon verschiedenen
Endzustand u2.
In der chemischen Thermodynamik wird davon ausgegangen, dass die Änderung der inneren
Energie in einem geschlossenen System ihre Ursache im Energieübergang in Form von Arbeit w
und Wärme q über die Systemgrenzen hat.
Δu = u2 - u1 = q + w
Die Reaktionsenergie ist eine extensive Größe.
Volumenarbeit bei chemischen Reaktionen
•
•
•
w = wmech = -p * ΔV
Das Minuszeichen ergibt sich aus der Überlegung, dass eine Volumenzunahme eine Abgabe von
Volumenarbeit bedeutet, und umgekehrt.
Δu = q - p * ΔV
Enthalpie
•
•
•
•
•
•
qp = (u2 + p * V2) - (u1 + p * V1)
Die Gleichung für die Reaktionswärme bei isobarer Prozessführung als Differenz zweier Terme
dargestellt, die jeweils den Anfangs- und Endzustand eines chemischen Systems darstellen.
Da sie sich nur aus Zustandsgrößen zusammensetzen, werden sie zu einer Zustandsgröße
zusammengefasst.
Diese neue Zustandsgröße ist die Enthalpie h und ist die Summe aus der inneren Energie eines
Systems und dem oft als Volumenenergie bezeichneten Produkt aus Druck und Volumen.
h=u+p*V
Da die innere Energie nicht bestimmt werden kann, kann auch die Enthalpie nicht bestimmt werden.
Reaktionsenthalpie
•
•
•
•
Die Reaktionsenthalpie ΔRh entspricht der Differenz der Enthalpien zweier Zustände eines
chemischen Systems.
Δh = h2 - h1 = (u2 + p * V2) - (u1 + p * V1)
Damit entspricht sie bei isobarer Prozessführung der Reaktionswärme.
Chemische Reaktionen, deren Reaktionswärme kleiner als Null ist, werden als exotherme
•
•
Reaktionen bezeichnet. Das stoffliche System gibt Energie in Form von Wärme an die Umgebung
ab.
Chemische Reaktionen, deren Reaktionswärme größer als Null ist, werden als endotherme
Reaktionen bezeichnet. Das stoffliche System nimmt Energie in Form von Wärme von der
Umgebung auf.
Die Reaktionsenthalpie ist eine extensive Größe.
molare Reaktionsgrößen
Molare Reaktionsgrößen bestimmen sich aus den nicht-Molaren Reaktionsgrößen geteilt durch die
Stoffmenge der Formelumsätze nF.
Größe
molare Reaktionsenergie
molare Reaktionsenthalpie
molares Reaktionsvolumen
ΔRU
ΔRH
ΔRVm
Symbol
Berechnung
= ΔRu / nF
= ΔRh / nF
= ΔRV / nF
experimentelle Bestimmung von Reaktionsenthalpien
•
•
•
•
•
•
•
•
•
•
•
•
•
Das Standardmäßig verwendete Verfahren zur Bestimmung von Reaktionsenthalpien ist die
Kalorimetrie.
Um die Reaktionsenthalpie zu bestimmen, wird die Wärme bestimmt, die während einer Reaktion
abgegeben oder aufgenommen wird.
Für die übertragene Wärme gibt es kein Messgerät, sie kann jedoch über die Temperaturänderung
des, das stoffliche System umgebende, Medium bestimmt werden.
c ist die spezifische Wärmekapazität des umgebenden Stoffes.
[c] = J * g-1 * K-1
q = c * m * ΔT
m ist die Masse des umgebenden Stoffes.
c (H 2 O ) * m (H 2 O ) * Δ T
Damit gilt für die Reaktionsenthalpie: Δ R H = −
nF
Als umgebender Stoff wird meist Wasser mit c = 4,19 J * g-1 * K-1 verwendet.
Die chemische Reaktion muss schnell verlaufen.
Die chemische Reaktion muss weitgehend vollständig.
Die chemische Reaktion muss eine ausreichend große Reaktionswärme haben..
Verbrennungsenthalpie ΔVH
Bildungsenthalpie ΔBH
Gilt für die Bildungsreaktion • Gilt für die
•
Verbrennungsreaktion
eines Stoffes.
eines Stoffes.
Auf der rechten Seite der • Ist die (meist exotherme) •
Reaktionsgleichung steht
Reaktion mit Sauerstoff.
nur der Stoff mit der
Stöchiometriezahl 1.
Auf der linken Seite der
•
Reaktionsgleichungen
stehen nur die
Elementsubstanzen in der
unter den
Reaktionsbedingungen
stabilen Form, aus denen
der Stoff besteht.
Die Bildungsenthalpien von
Elementsubstanzen sind 0.
Neutralisationsenthalpie
Gilt für die Neutralisation einer
Säure mit einer Base, welche
exotherm ist.
Neutralisationen laufen sehr
schnell, exotherm und in
wässriger Lösung ab.
Daher kann die Lösung
gleichzeitig als
Kaloriemtrieflüssigkeit
verwendet werden, deren
spezifische Wärmekapazität
und Dichte der von Wasser
entspricht.
Mit einem Kaloriemeter, das mit 400g Wasser
gefüllt ist, wird bei der Reaktion von 4,48 g Eisen
mit 2,26 g Schwefel eine Temperaturerhöhung des
Kaloriemeterwassers um 4,5 K ermittelt. Berechne
die Bildungsenthalpie von Eisen(II)sulfid!
Fe + F ' FeS
Die Reaktion von 40 ml Natronlauge (c = 1 mol*l-1)
mit 40 ml Salzsäure (c = 1 mol*l-1) bewirkt eine
Temperaturerhöhung der wässrigen Lösung um
6,7 K. Berechne die molare Reaktionsenthalpie der
Neutralisation!
(Die Dichte von Wasser beträgt 1 g*ml-1.)
H3O+(aq) + OH-(aq) ' 2 H2O
c(H2O) * m(H2O) * ΔT * M(FeS)
m(FeS)
-1
ΔBH = -94,19 kJ * mol
Δ BH =
c(H2O) * ρ(H2O) * ( VSäure + VBase ) * ΔT
VBase * c 0 (OH− )
c(H2 O) * ρ(H2 O) * ( V(HCl) + V(NaOH)) * ΔT
Δ RH = −
V(NaOH) * c 0 (NaOH)
Δ RH = −
Eisen und Schwefel wurden im stöchiometrischen
Verhältnis zur Reaktion gebracht, daher gilt:
ΔRH = -56 kJ * mol-1
Satz von Hess
•
•
•
Die molare Reaktionsenthalpie hängt nur vom Anfangs- und Endzustand des chemischen Systems
ab.
Sie ist vom Reaktionsweg unabhängig.
ΔRH = νRp * ΔBHRp - νAs * ΔBHAs
exotherme und endotherme Reaktionen
•
exotherme Reaktionen
Bei exothermen Reaktionen ist ΔRH kleiner als •
Null.
endotherme Reaktionen
Bei endothermen Reaktionen ist ΔRH größer
als Null.
•
Energiediagramm einer exothermen Reaktion, •
bei der Volumenarbeit vom System verrichtet
Energiediagramm
einer
endothermen
Reaktion, bei der Volumenarbeit vom System
•
•
wird.
z.B. Mg + 2 HCl ' MgCl2 + H2
•
Energiediagramm einer exothermen Reaktion, •
bei
der
Volumenarbeit
vom
System
aufgenommen wird.
z.B. N2 + 3 H2 ' 2NH2
•
verrichtet wird.
z.B. CaCO3 ' CaO + CO2
Energiediagramm
einer
endothermen
Reaktion, bei der Volumenarbeit vom System
aufgenommen wird.
Prinzip des Energieminimums
•
Es ist für den freiwilligen Ablauf einer Reaktion günstig, wenn die Reaktionsenthalpie kleiner als
Null ist.
2. Hauptsatz der Thermodynamik
•
•
•
•
Ein chemischer oder physikalischer Vorgang verläuft in einem abgeschlossenen System stets in der
Richtung, in der die Unordnung zunimmt.
Bei Vorgängen in abgeschlossenen Systemen bleibt die Entropie bei ideal umkehrbarem
(reversiblem) Verlauf konstant (Δs = 0), beim tatsächlichen Ablauf in der Natur und Technik nimmt
sie stets zu (Δs > 0).
Der zweite Hauptsatz der Thermodynamik ist ein Erfahrungssatz.
Geräte, die gegen ihn verstoßen sollen, heißen Perpetuum mobile zweiter Art.
Entropie
•
•
•
•
•
•
Die Entropie s ist ein Maß für die Unordnung eines Systems.
Je größer die Entropie eines Systems ist, desto größer ist die Unordnung des Systems.
R
W
R
thermodynamische
* ln W
Δs =
* ln Ende
Nach Boltzmann gilt: s =
W ≙ Wahrscheinlichkeit
NA
NA
W Anfang
Im Gegensatz zur Enthalpie besitzt die Entropie einen Nullpunkt, der beim absoluten Nullpunkt der
Temperatur (0 K) erreicht wird.
Entropieänderung und molare
Q
q
reversible übertragene
qrev,
ΔS = rev
Δs = rev
Entropieänderung
Qrev ≙ Wärme
T
T
Eine chemische Reaktion läuft freiwillig ab, wenn die Entropie des sie umgebenden stofflichen
Systems zunimmt.
Prinzip des Entropiemaximums
•
Es ist günstig für den freiwilligen Ablauf einer chemischen Reaktion wenn die Entropieänderung
größer als Null ist.
molare Standardreaktionsentropie
•
•
•
Die molare Standardreaktionsenthalpie ΔRS⊖ einer chemischen Reaktion entspricht der Differenz
aus den Standardentropien der Reaktionsprodukte und den Standardentropien der Ausgangsstoffe.
Die Reaktionsentropie kann auch kleiner Null sein, wenn das stoffliche System nicht abgeschlossen
ist.
ΔRS⊖ = νRp * S⊖Rp - νAs * S⊖As
Freie Enthalpie
•
•
•
•
•
•
•
•
•
•
Die Entropieänderung eines stofflichen Systems kann man auf Änderungen seiner Zustandsgrößen
(z.B. durch eine chemische Reaktion) zurückführen.
Darum wurde eine weitere Zustandsgröße, die Gibbssche Energie g definiert.
Gibbssche Energie: g = h – T * s
Molare Gibbssche Energie
G=H–T*S
Da sie die Enthalpie enthält, kann auch die Gibbssche Energie eines stofflichen Systems nicht
konkret angegeben, sondern nur ihre Änderung ΔG bestimmt werden.
ΔG
= ΔH – ΔT * ΔS
Bei isotherm-isobarer Prozessführung
ΔG
= ΔH – T * ΔS
Gibbs-Helmholtz-Gleichung, für chemische Reaktionen
ΔRG = ΔRH – T * ΔRS⊖
molare Gibbssche Reaktionsenthalpie, freie Reaktionsenthalpie
Die molare Gibbssche Reaktionsenthalpie entspricht der maximalen Arbeit je Mol Formelumsatz,
die durch die Reaktion im Reaktionsverlauf verrichtet werden kann. Temperatur und Druck sind
konstant.
ΔRH = ΔRG – T * ΔRS⊖
T * ΔRS⊖ entspricht der molaren gebundenen Reaktionsenthalpie, die unter keinen Umständen in
nutzbare Energie umgewandelt werden kann.
Die Richtung chemischer Reaktionen
•
•
Exergonisch
chemisches Gleichgewicht
ΔRG < 0
• ΔRG = 0
•
gilt
das •
Die Reaktion verläuft freiwillig • Es
Massewirkungsgesetz.
(von rechts nach links).
• Dabei wird Arbeit verrichtet.
1. ΔRH < 0 und ΔRS⊖ > 0
Die Reaktion läuft immer •
freiwillig ab.
C5H12 + 8 O2 ' 5 CO2 + 6 H2O
2. ΔRH > 0 und ΔRS⊖ > 0
Endotherme Reaktionen mit
steigender Entropie laufen nur
bei hoher Temperatur freiwillig
ab (T * ΔRS⊖ > ΔRH).
H2O + C ' CO + H2
3. ΔRH < 0 und ΔRS⊖ < 0
Exotherme Reaktionen mit
sinkender Entropie laufen nur
unterhalb
einer
gewissen
Grenztemperatur freiwillig ab
(|T * ΔRS⊖| < |ΔRH |).
2 H2 + O2 ' 2 H2O
Endergonisch
ΔRG > 0
Die
chemische
Reaktion
verläuft nur unter Aufwand von
Arbeit.
1. ΔRH > 0 und ΔRS⊖ < 0
Siehe
chemisches
Die Reaktion läuft nie freiwillig
Gleichgewicht.
ab.
3 O2 ' 2 O3
2. Siehe links
Endotherme Reaktionen mit
steigender Entropie laufen bei
geringer
Temperatur
nicht
freiwillig ab.
3. Siehe links
Exotherme Reaktionen mit
sinkender Entropie laufen bei
hoher
Temperatur
nicht
freiwillig ab.
Reaktionsordnung
•
•
•
•
Die Ordnung einer chemischen Reaktion entspricht der Summe der Stöchiometriezahlen der
Ausgangsstoffe.
Reaktion 1. Ordnung
A
' Reaktionsprodukte
Reaktion 2. Ordnung
A+B
' Reaktionsprodukte
2A
' Reaktionsprodukte
Reaktion 3. Ordnung
A + B + C ' Reaktionsprodukte
2A+B
' Reaktionsprodukte
3A
' Reaktionsprodukte
Reaktionsgeschwindigkeit
•
•
•
•
•
•
•
•
•
•
•
•
Die Reaktionskinetik beschäftigt sich mit dem zeitlichen Ablauf chemischer Reaktionen.
Die Reaktionsgeschwindigkeit v ist von vielen Faktoren (z.B. Konzentration, Temperatur,
Grenzfläche, Anwesendheit eines Katalysators) abhängig.
Δc(i) bzw.
Δp(i) mit Partialdrücken anstatt Konzentrationen bei Gasen. [v ] = mol * l −1 * s −1
v=
v=
Δt
Δt
i ≙ Reaktionsteilnehmer i
In geschlossenen Systemen ist die Reaktionsgeschwindigkeit nicht konstant, sie wird ständig
kleiner, da die Konzentrationen der Ausgangsstoffe ständig abnehmen.
Δc( Ausgangsstoff )
bzw v = − Δp( Ausgangsstoff )
Durchschnittsgeschwindigkeit: v = −
ν( Ausgangsstoff ) * Δt .
ν( Ausgangsstoff ) * Δt
d c( AS)
1
bzw v = − 1 * d p( AS)
v=−
*
Augenblicksgeschwindigkeit:
.
dt
ν( AS)
ν( AS)
dt
Die Reaktionsgeschwindigkeit ist skalar und immer positiv.
Mit Geschwindigkeitskonstanten k als Proportionalitätsfaktor wird eine Gleichung für die
Reaktionsgeschwindigkeit erhalten, die als Geschwindigkeitsgleichung oder Zeitgesetz bezeichnet
wird.
a A + b B + c C + .... ' Reaktionsprodukte → v = k * ca(A) * cb(B) * cc(C) * ....
Die Einheit der Geschwindigkeitskonstante ist von der
[k ] = (l * mol −1 )Re aktionsordnung−1 * s −1
Reaktionsordnung abhängig.
Das Zeitgesetz kann nur für Reaktionen die in einem Schritt verlaufen aus der Reaktionsgleichung
abgeleitet werden.
E
EA
− A
≙ Arrheniussche Aktivierungsenergie
Arrhenius-Gleichung: k = A * e R*T
A
≙ Frequenzfaktor (Aktionskonstante)
Abhängigkeit der Reaktionsgeschwindigkeit
...von der Konzentration
...von der Temperatur
•
Die
Geschwindigkeit •
chemischer Reaktionen in
homogenen
Systemen
hängt
von
den
Konzentrationen
der
Ausgangsstoffe ab.
•
Dies kann aus dem •
Zeitgesetz
der
Reaktionsgeschwindigkeit
abgelesen werden.
•
•
•
•
...von der Anwesendheit eines
Katalysators
Um reagieren zu können, • Die Reaktionsgeschwindigkeit
kann
auch
von
Stoffen
müssend die Teilchen der
beeinflusst werden, die nach
Ausgangsstoffe
der Reaktionsgleichung nicht
zusammenstoßen. Doch nur
zu
den
Ausgangsstoffen
ein
Bruchteil
dieser
gehören.
Zusammenstöße ist auch
wirksam, d.h. eine Reaktion
• Katalysatoren wirken selektiv.
findet statt.
Dafür ist eine günstige • Katalysatoren beeinflussen die
Reaktionsgeschwindigkeit
räumliche Lage und eine
durch ihre Anwesendheit.
Mindestenergie der Teilchen
notwendig.
sind
Diese
Energie
ist
die • Katalysatoren
Reaktionspartner, die jedoch
molekulare
nach
der
Reaktion
in
Aktivierungsenergie ε und sie
unveränderter Form wieder
wird verwendet, um alte
vorliegen.
Bindungen zu lösen und neue
zu bilden.
Bei höherer Temperatur ist die • Bei positiver Katalyse steigt die
Reaktionsgeschwindigkeit,
mittlere kinetische Energie der
während sie bei negativer
Teilchen und somit die
Katalyse
(Katalysator
wird
Wahrscheinlichkeit wirksamer
Inhibitor genannt) sinkt.
Zusammenstöße größer.
Mit steigender Temperatur • Wirkt ein Reaktionsprodukt als
Katalysator,
so
ist
dies
steigt
die
Autokatalyse.
Reaktionsgeschwindigkeit.
RGT-Regel:
Eine • Durch Verlauf der Katalyse
über Zwischenstufen wird die
Temperaturerhöhung um 10 K
molekulare Aktivierungsenergie
bewirkt eine Verdoppelung bis
•
Siehe Zeitgesetz
•
Vervierfachung
der
Reaktionsgeschwindigkeit.
Siehe Arrheniusgleichung
•
ε gesenkt.
Im
Körper
Biokatalysatoren.
wirken
chemisches Gleichgewicht
Einstellung des chemischen Gleichgewichts
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
Wird eine chemische Reaktion in einem geschlossenen System durchgeführt ohne das eine
Reaktionshemmung vorliegt, laufen sowohl Hin- als auch Rückreaktion gleichzeitig ab.
Am Anfang läuft nur die Hinreaktion ab, weil noch keine Reaktionsprodukte vorhanden sind.
Liegen dann auch Reaktionsprodukte vor, so beginnt die Rückreaktion.
Im Verlauf wird die Konzentration der Ausgangsstoffe ständig kleiner, währen die der
Reaktionsprodukte ständig ansteigt.
Dadurch sinkt die Geschwindigkeit der Hinreaktion und die der Rückreaktion steigt.
Irgendwann wird ein Zustand erreicht, bei dem genauso viele Reaktionsprodukte durch die
Hinreaktion entstehen wie durch die Rückreaktion verbraucht werden.
Die Konzentrationen der Ausgangsstoffe und Reaktionsprodukte ändern sich nicht mehr.
Δc = 0
Die Geschwindigkeiten der Hin- und Rückreaktion sind gleichgroß aber ungleich null.
vHinreaktion = vRückreaktion ≠ 0
Die Gesamtreaktionsgeschwindigkeit ist deshalb gleich null.
VGesammt = vHinreaktion – vRückreaktion = 0
Es handelt sich also um ein dynamisches Gleichgewicht.
Ein solches System wird als chemisches Gleichgewicht bezeichnet.
Die Zeit bis zur Einstellung des chemischen Gleichgewichts wird als Einstellzeit bezeichnet.
Chemische Gleichgewichte können sich von beiden Seiten her einstellen.
Massenwirkungsgesetz
•
•
•
Im Chemischen Gleichgewicht ist bei einer bestimmten Temperatur der Quotient des Produktes der
Konzentrationen der Reaktionsprodukte und des Produktes der Konzentrationen der
Ausgangsstoffe eine konstante Größe.
c(C) ν( C ) * c(D) ν(D )
ν(A) A + ν(B) B ' ν(C) C + ν(D) D → K c =
c( A ) ν( A ) * c(B) ν (B )
−1 Δν
mit Δν = ν(C) + ν(D) − [ν( A ) + ν(B)]
[K c ] = (mol * l )
Kinetische Herleitung des Massenwirkungsgesetzes
•
•
•
•
Im chemischen Gleichgewicht gilt für die Geschwindigkeiten der Hin- und Rückreaktion:
vHinreaktion
= kHinreaktion * c(AS1)ν(AS1) * c(AS2)ν(AS2) * …
vRückreaktion = kRückreaktion * c(RP1)ν(RP1) * c(RP2)ν(RP2) * …
Auch gilt: vHinreaktion = vRückreaktion
Und somit:
k Hinreaktion
c(AS1)ν(AS1) * c(AS2)ν(AS2) * ...
=
= Kc
k Rückreaktion c(RP1)ν(RP1) * c(RP2) ν(RP2) * ...
Der Quotient zweier Geschwindigkeitskonstanten
Gleichgewichtskonstante Kc.
ergibt
wiederum
eine
Konstante,
die
Prinzip von Le Châtelier und Braun
•
Wird auf ein sich im chemischen Gleichgewicht befindendes stoffliches System ein Zwang
ausgeübt, dann weicht dieses System dem Zwang so aus, dass die Wirkungen des Zwangs
verringert werden.
•
Temperaturerhöhung
Dem
äußeren
Zwang
einer •
Temperaturerhöhung weicht ein sich im
Temperatursenkung
Dem
äußeren
Zwang
einer
Temperatursenkung weicht ein sich im
•
chemischen Gleichgewicht befindendes
stoffliches
System
durch
eine
endotherme Reaktion aus, bis sich ein
neues
chemisches
Gleichgewicht
eingestellt hat.
Druckerhöhung
Dem
äußeren
Zwang
einer •
Druckerhöhung weicht ein sich im
chemischen Gleichgewicht befindendes
stoffliches System durch eine Reaktion
aus, die unter Volumenabnahme
verläuft, bis sich ein neues chemisches
Gleichgewicht eingestellt hat.
chemischen Gleichgewicht befindendes
stoffliches
System
durch
eine
exotherme Reaktion aus, bis sich ein
neues
chemisches
Gleichgewicht
eingestellt hat.
Drucksenkung
Dem
äußeren
Zwang
einer
Drucksenkung weicht ein sich im
chemischen Gleichgewicht befindendes
stoffliches System durch eine Reaktion
aus, die unter Volumenzunahme
verläuft, bis sich ein neues chemisches
Gleichgewicht eingestellt hat.
Estergleichgewicht
• organische Säure + Alkohol ' Ester + Wasser
+ Ethanol
'
• Beispiel: Essigsäure
CH3COOH
+ C2H5OH
'
Essigsäureethylester
CH3COOC2H5
+ Wasser
+ H2O
Gasgleichgewicht
•
Löslichkeitsgleichgewicht
•
Gibt man Bariumchlorid in eine Sulfatlösung, so fällt schwerlösliches
Bariumsulfat als Niederschlag aus. Nach Beendigung dieser Fällung ist
das System jedoch noch nicht zum Stillstand gekommen, von dem
gefällten Bariumsulfat lösen sich ständig Bariumionen, die im selben Maß
wieder ausfallen.
Ba2+(aq) + SO42-(aq)
•
•
•
•
•
•
•
•
•
•
•
'
BaSO4(s)
Für das Löslichkeitsgleichgewicht eines Salzes kann
(AmBn) (s) ' m An+(aq) + n Bm-(aq)
folgende Reaktionsgleichung angegeben werden:
Für die Sättigung der Lösung ist es unwesentlich, ob viel oder wenig Niederschlag im System
vorhanden ist.
Daher wird er in der Gleichung für das Massenwirkungsgesetz KL(AmBn) = cm(An+) * cn(Bm-)
nicht beachtet:
[KL(AmBn)] = molm+n * l-(m+n)
Diese vereinfachte Ableitung gilt nur für schwerlösliche Salze, da nur hier die Konzentrationen
ausreichend gering sind, so dass sich die Ionen nicht gegenseitig beeinflussen.
Oft wird der Löslichkeitsexponent pKL angegeben: pKL = -lg {KL}.
Die Konzentration eines Stoffes in seiner gesättigten Lösung (Sättigungskonzentration cS) wird als
Löslichkeit l des Stoffes (in dem verwendeten Lösungsmittel) bezeichnet.
K (A B )
Für die Löslichkeit eines schwerlöslichen Salzes in reinem Wasser gilt:
l( A mBn ) = m+n L m m nn
m *n
Erniedrigung der Löslichkeit (KCLO4)(s) ' K+(aq) + ClO4-(aq)
werden K+- oder ClO4--Ionen hinzugefügt, sinkt die Löslichkeit.
durch gleichionigen Zusatz:
Da fremdionige Zusätze die Hydrathüllen der Ionen beeinflussen, kann durch sie die Löslichkeit
leicht erhöht werden.
Erhöhen
der
Löslichkeit AgCl(s) ' Ag+(aq) + Cl-(aq)
Ag+(aq) + 2 NH3 ' [Ag(NH3)2]+(aq)
durch Komplexbildung:
Durch Komplexbildung werden Silberionen aus der Lösung entfernt.
Erniedrigung der Löslichkeit durch Komplexe entsteht, wenn Komplexbildner vor allem mit Kationen
(+) schwerlösliche Komplexe bilden.
•
Erhöhung der Löslichkeit Wird Calciumchloridlösung mit Natriumfluorid versetz, so fällt
durch Säurezusatz:
Calciumfluorid aus.
CaCl2 + 2 NaF ' CaF2n + 2 NaCl
Bei Salzsäurezusatz lost sich dieser Niederschlag wieder auf:
(CaF2)(s) ' Ca2+(aq) + 2 F-(aq)
Fluoridionen haben mit den Hydroniumionen der Säure unter
Fluorwasserstoffbildung reagiert.
F + H3O+ ' HF + H2O
Dadurch kann weiteres Calciumfluorid in Lösung gehen.
Gleichgewicht an der Phasengrenze
•
•
Taucht
ein
Metallstab
in
eine
verdünnte
Metallsalzlösung ein, so bilden sich an seiner
Oberfläche Metallionen. Diese gehen als positive
Ladungsträger in die zunächst noch elektrisch
neutrale Lösung über und lassen freiwerdende
Elektronen im Metallstab zurück. Dadurch wird die
Lösung
dem
Metallstab
gegenüber
positiv
aufgeladen. Es bildet sich eine Ladungsdifferenz, das
Elektrodenpotential auf. Dadurch entsteht eine
Anziehung, die einige geladene Ionen an der
Oberfläche des Metalls festhält, wodurch eine
elektrochemische Doppelschicht entsteht.
Das elektrochemische Gleichgewicht einer Metall/Metallionenionen-Elektrode ist durch folgende
vier Merkmale gekennzeichnet:
1. Die Bildung hydratisierter Metallionen (Hinreaktion) und die Bildung von Metallionen
(Rückreaktion) erfolgt mit der gleichen Geschwindigkeit.
2. Im elektrochemischen Gleichgewicht ist der Übertritt geladener Teilchen und damit der
zwischen den Phasen fließende Strom in beide Richtungen gleich.
3. Die bei der Bildung hydratisierter Ionen stattfindende Ladungstrennung führt zur Ausbildung
einer elektrischen Potentialdifferenz zwischen den Phasen.
4. Aufgrund der elektrischen Potentialdifferenz zwischen den Phasen bildet sich eine
elektrochemische Doppelschicht aus.
2. Atombau und chemische Bindung
Atommodelle
Elementarteilchen
•
206
Pb
nach der Form
A
X.
•
Üblich ist die Atomschreibweise, z.B.
•
A ≙ Massezahl
•
•
•
•
X ≙ Elementsymbol
A=Z+N
Ionen sind Atomarten mit von der Kernladungszahl verschiedener Elektronenanzahl.
Isotope sind Atomkernarten mit gleicher Protonenanzahl aber unterschiedlicher Neutronenanzahl.
Kernradien sind sehr viel kleiner als Atomradien.
•
Proton
Elementarteilchen des
Atomkerns,
Ladung: +1 e
•
•
•
82
Z
Z ≙ Kernladungszahl ≙ Anzahl der Protonen im Kern ≙ Anzahl der Elektronen im Atom
N ≙ Anzahl der Neutronen im Kern
•
•
Neutron
Elementarteilchen des
Atomkerns.
Ladung: ±0 e
•
•
Elektron
Elementarteilchen der
Atomhülle.
Ladung: -1 e
•
•
Masse: 1,6726231*10-27 kg
≈1u
Anzahl im Atom: Z
•
•
1,6749286*10-27 kg
≈1u
Anzahl im Atom: N = A – Z
Masse:
•
•
Masse : 9,1093897*10-31 kg
≈0u
Anzahl im Atom = Z
Bohr-Sommerfeldsches Atommodell
•
•
•
•
•
•
•
•
•
Aus den Atomspektren wurden von Bohr Vorstellungen über den Atomaufbau abgeleitet.
Elektronen umkreisen den Atomkern auf Bahnen.
Die Stabilität wird durch ganzzahlige Vielfache des Planckschen Wirkungsquantums h
charakterisiert.
Der Faktor des Planckschen Wirkungsquantums h wird als Quantenzahl (bzw. Hauptquantenzahl) n
bezeichnet. Durch sie werden die Energieniveaus beschrieben.
Dadurch konnten die Spektrallinien des Wasserstoffs berechnet werden.
Die durch Zahlenwerte von n charakterisierten Bahnen werden als Schalen (n=1: K-Schale; n=2: LSchale; n=3: M-Schale usw.) bezeichnet.
Da außer Kreisbahnen im Atom noch elliptische Bahnen möglich sind, wurde die
Nebenquantenzahl l eingeführt, die deren Form beschreibt.
Jedes Elektron besitzt einen Spin, welcher entweder mit oder entgegengesetzt zur Kreisbahn
verläuft. Dieser wird durch die Spinquantenzahl s beschrieben.
Die magnetische Quantenzahl m dient zur Erklärung der Aufsplittung von Spektrallinien im
magnetischen und elektrischen Feld.
Welle-Teilchen-Dualismus
•
•
•
•
•
•
In einigen Experimenten verhalten sich Elektronen wie Teilchen (sie können z.B. andere Elektronen
aus Metallen herausschlagen), in anderen zeigen sie jedoch Wellencharakter (Beugung an Gittern).
Der Wellencharakter wird des Elektrons wird besonders bei Interferenz am Doppelspalt deutlich.
Man benötigt also sowohl ein Teilchen- als auch ein Wellenmodell, um die Eigenschaften der
Elektronen zu beschreiben. Daher spricht man vom Welle-Teilchen-Dualismus.
Um die Bahnkurve eines Elektrons beschreiben zu können, wird sowohl sein Ort als auch sein
Impuls (p = m * v) benötigt. Da aber jede Ortsbestimmung eines Elektrons dessen Impuls ändern
würde, ist es nie möglich, sowohl Ort als auch Impuls gleichzeitig genau anzugeben. Dies ist nur mit
einer gewissen Unschärfe möglich.
Die Heisenbergsche Unschärferelation lautet: Δp * Δx ≥ h. Δp ≙ Impulsunschärfe
Δx
≙ Ortsunschärfe
≙ Plancksches Wirkungsquantum
h
Aus der Heisenbergschen Unschärferelation folgt, dass Atommodelle ohne die Vorstellung von
Atombahnen auskommen müssen. Bestimmbar ist lediglich die Aufenthaltswahrscheinlichkeit in
einem bestimmten Bereich in der Atomhülle.
Bohrsches Postulat
•
Elektronen sind elektrische Ladungen und bewegen sich um den Atomkern. Ein
Elektromagnetisches Feld entsteht, die Elektronen geben Energie ab. Dadurch werden sie
langsamer und stürzen eines Tages in den Atomkern. Dies trifft nicht zu!
Wellenmechanisches Atommodell bzw. Quantenmechanisches Atommodell
•
•
•
•
•
•
Die Wellenbewegung der Elektronen in der Hülle ist von drei Raumkoordinaten und der Zeit
abhängig. Sie wird durch eine Differentialgleichung zweiter Ordnung beschrieben.
Die Lösungen dieser Gleichung sind selbst Funktionen, die die Aufenthaltswahrscheinlichkeit der
Elektronen in einem bestimmten Bereich in der Atomhülle wiedergeben.
Solche Bereiche werden als Orbitale bezeichnet. Sie werden meist so begrenzt, dass die
Aufenthaltswahrscheinlichkeit eines Elektrons 90% beträgt.
Ihre geometrische Ausrichtung wird durch die Quantenzahlen n, l und m bestimmt.
s-Orbitale sind kugelförmig.
p-Orbitale sind Hantelförmig.
•
•
•
•
•
•
•
•
d-Orbitale sind rosettenförmig.
Die Besetzung der Orbitale mit Elektronen wird als Elektronenkonfiguration bezeichnet.
Sie wird durch die vier Quantenzahlen bestimmt, für die folgende Regeln gelten:
n
1, 2, 3, ...
K-, L-, M-Schale, ...
n wird als Radialquantenzahl bezeichnet.
l
0 bis n-1
in ganzzahligen Schritten l wird als Bahnrehimpulsquantenzahl bezeichnet.
M -l bis +l
In ganzzahligen Schritten
s
-½, +½
Auf ein Orbital können jeweils zwei Elektronen mit entgegengesetztem Spin Platz finden. Dies wird
als Spinkopplung bezeichnet.
n
1
2
3
4
5
l
0
0
1
0
1
2
0
1
2
3
0
1
2
3
Quantenzahlen
m
0
0
+1; 0; -1
0
+1; 0; -1
+2; +1; 0; -1; -2
0
+1; 0; -1
+2; +1; 0; -1; -2
+3; +2; +1; 0; -1; -2; -3
0
+1; 0; -1
+2; +1; 0; -1; -2
+3; +2; +1; 0; -1; -2; -3
Orbitalbezeichnung
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
5s
5p
5d
5f
Elektronenanzahl
2
2
6
2
6
10
2
6
10
14
2
6
10
14
Schale
2
K-Schale
8
L-Schale
18
M-Schale
32
N-Schale
32
O-Schale
Pauli-Prinzip
•
Die Elektronen im gleichen Atom müssen sich in mindestens einer Quantenzahl unterscheiten.
Demnach kann ein Orbital nur mit zwei Elektronen entgegengesetzten Spins besetzt werden.
Energetisches Aufbau-Prinzip
•
•
Die Elektronenkonfiguration der Atome entspricht
der energetischen Reihenfolge der Orbitale. Diese
ist bei Mehrelektronensystemen nicht immer mit der
Reihenfolge der Hauptquantenzahlen identisch. So
ist die Energie des 4s-Orbitals niedriger als die des
3d-Orbitals.
Die energetische Wertigkeit kann mit der Summe
n + l abgeschätzt werden.
Hundsche Regel
•
Orbitale gleicher Energie eines Atoms werden zunächst mit Elektronen gleichen Spins besetzt,
bevor die Doppelbesetzung unter Spin-Paarung erfolgt.
Elektronenkonfiguration
•
•
•
In der ausführlichen Schreibweise werden die einzelnen Orbitale als Kästchen dargestellt, in denen
Pfeile Elektronen symbolisieren. Ihre entgegengesetzte Richtung drückt den entgegengesetzten
Spin aus.
In vereinfachter Schreibweise wird die Hauptquantenzahl, und das Orbitalsymbol gefolgt von der
Anzahl der Elektronen auf dem Orbital (hochgestellt) notiert.
N: 1s2 2s2 2p3
Oft wird die Elektronenkonfiguration abgekürzt, indem nur diejenigen Orbitale erwähnt werden, die
sich von der Konfiguration des vorangegangenen unterscheiden, dessen Symbol in eckigen
Klammern dargestellt wird.
Calcium: ||Ar|| 4s2
Aufbau des Periodensystems der Elemente
•
•
•
•
•
•
Die Ordnungszahl eines Atoms gibt die Gesamtzahl der Elektronen im Atom an.
Die waagerechten Zeilen heißen Perioden.
Die senkrechten Spalten heißen Gruppen.
Die Nummer der Periode entspricht der Anzahl der Energieniveaus und somit der
Hauptquantenzahl.
Die Gruppe eines Elements entspricht der Anzahl seiner Valenzelektronen, also den Elektronen auf
den unvollständig besetzten Außenschale.
Das äußerste besetzte Orbital der Elemente der 1. und 2. Hauptgruppe ist das s-Orbital (ebenso
beim Helium).
•
•
•
Das äußerste besetzte Orbital der Elemente der 3. bis 8. Hauptgruppe ist das p-Orbital (außer
Helium).
Das äußerste besetzte Orbital der Nebengruppenelemete (mit Lanthan und Actinium; außer den
Lathanoiden und Actinoiden) ist das d-Orbital.
Das äußerste besetzte Orbital der Lathanoide und Actinoide ist das f-Orbital.
chemische Bindungen
•
Atombindung
•
Metallbindung
•
polare Atombindung
•
Ionenbindung
Eine Atombindung besteht, wenn Atome durch gemeinsame
Elektronenpaare zusammengehalten werden.
Elektronegativitätswertdifferenz: 0 – 0.8
Eine Metallbindung besteht, wenn Teilchen durch Anziehungen zwischen
positiv
geladenen
Metallionen
und
beweglichen
Elektronen
zusammengehalten werden.
Eine polare Atombindung besteht, wenn bei einer Atombindung ein Atom
das gemeinsame Elektronenpaar stärker anzieht/beansprucht als das
andere.
Elektronegativitätswertdifferenz: 0.9 – 1.6
Eine Ionenbindung besteht, wenn Teilchen durch Anziehungen zwischen
entgegengesetzt geladenen Ionen zusammengehalten werden.
Elektronegativitätswertdifferenz: ab 1.7
σ-Bindung im Wasserstoffmolekül
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
Um ein Wasserstoffmolekül in zwei einzelne Atome zu zerlegen muss die Bindungsenergie
zugeführt werden.
Diese wird auch bei der Bildung eines Wasserstoffmoleküls wieder frei.
Aufgrund elektrischer Abstoßungskräfte nähern sich die beiden Atome nur bis auf eine bestimmte
Entfernung, der Bindungslänge.
Diese stellt ein Energieminimum dar.
Durch die Wechselwirkungen der einzelnen 1s-Orbitale der Wasserstoffelektronen entstehen ein
bindendes und ein antibindendes Molekülorbital.
Das bindende wird durch Überlappung der beiden 1s-Atomorbitale gebildet und ist
rotationssymmetrisch zur Kernverbindungsachse der beiden Atomkerne.
Solche zur Kernverbindungsachse rotationssymmetrische Orbitale werden als σ-Orbitale
bezeichnet und die dadurch entstehenden Bindungen σ-Bindungen.
Die Elektronendichte ist deshalb zwischen den beiden Kernen am größten.
Beim antibindenden Orbital ist die Elektronendichte geringer, es wird σ*-Orbital genannt.
Es ist energetisch höherwertiger als das σ-Orbital und wird deshalb nicht mit Elektronen besetzt.
Das Molekülorbital des Wasserstoffmoleküls wird als 1s-s-σ-Molekülorbital bezeichnet.
Verbindet sich ein Atom mit einem anderen, so werden alle seine Orbitale mit den entsprechenden
Orbitalen (1s mit 1s, 3px mit 3px...) des anderen Atoms verbunden.
Dabei entsteht je ein bindendes und ein antibindendes Orbital.
Werden doppelt besetzte Orbitale kombiniert, so müssen auch die antibindenden Orbitale besetzt
werden.
Die energetische Höherwertigkeit eines antibindenden Orbitals hebt sich in etwa mit der
energetischen Niederwertigkeit eines bindenden Orbitals auf, darum spielen nur die äußersten
Orbitale eine wesentliche Rolle bei Molekülbildungen.
Im Valenzbindungsmodell werden deshalb nur diese Orbitale betrachtet.
Hybridisierung am Ethanmolekül
•
•
•
•
•
Das Ethanmolekül hat die Summenformel C2H6, die Bindungswinkel betragen 109,5°.
Das Kohlenstoffmolekül besitzt in der äußeren Schale ein Elektronenpaar und zwei ungepaarte
Elektronen (Kohlenstoff: 1s2 2s2 2p2).
Um nach dem Valenzbindungsmodell vier Atombindungen ausbilden zu können, sind vier einfach
besetzte Orbitale notwendig.
Durch Energiezufuhr wird ein Elektron aus dem 2s-Orbital in ein 2p-Orbital überführt.
Dies wird als angeregter Zustand bezeichnet.
•
•
•
Die so entstandenen vier gleichartigen q-Hybridorbitale zeigen die räumliche Orientierung eines
Tetraeders. Das von den p-Orbitalen verschiedene 2s-Oribtal wurde nämlich nun energetisch und
räumlich diesen angeglichen.
An der Hybridisierung sind ein 2s- und drei 2p-Orbitale beteiligt, darum wird das q-Hybridorbital
auch als 2sp3-Hybridorbital bezeichnet.
Drei der sp3-Hybridorbitale bilden nun eine sp3-s-σ-Bindung mit Wasserstoffatomen aus, während
das vierte eine sp3-sp3-σ-Bindung mit dem anderen Kohlenstoffatom ausbildet.
π-Bindung im Ethenmolekül
•
•
•
•
•
•
•
•
•
•
•
Das Ethenmolekül hat die Summenformel C2H4 die Bindungswinkel betragen 120°. Das Molekül ist
planar.
Zwischen Wasser- und Kohlenstoffatomen bestehen Atombindungen gleicher Bindungsenergie, die
Kohlenstoffatome sind jedoch durch Doppelbindungen verbunden.
Die Bindungsenergie einer Doppelbindung ist geringer als die zweier Einfachbindungen, daraus
folgt, dass die zweite Bindung schwächer ist.
Im angeregten Zustand entstehen drei Hybridorbitale aus einem 2s- und zwei 2p-Atomorbitalen,
während das dritte 2p-Orbital nicht mit hybridisiert wird und sich somit von den anderen Orbitalen
energetisch und räumlich unterscheidet.
Die drei 2sp2-Hybridorbitale liegen in einer Ebene, nach den Ecken eines gleichseitigen Dreiecks
ausgerichtet, während das unveränderte 2p-Orbital senkrecht zu dieser Ebene steht.
Zwei der 2sp2-Hybridorbitale bilden mit den 1s-Atomorbitalen der Wasserstoffatome sp2-s-σBindungen aus.
Das dritte der 2sp2-Hybridorbitale bildet mit dem 2sp2-Hybridorbital des anderen Kohlenstoffatoms
eine sp2-sp2-σ-Bindungen aus.
Die σ-Bindungen im Atom liegen rotationssymmetrisch zu den Kernverbindungsachsen.
Die beiden nichthybridisierten 2p-Orbitale der Kohlenstoffatome bilden auch ein bindendes
Molekülorbital, welches senkrecht zur Ebene der 2sp2-Hybridorbitale angeordnet ist.
Solche Orbitale heißen π-Orbitale, die dadurch entstehenden Bindungen π-Bindungen.
π-Bindungen sind weniger stabil als σ-Bindungen, da sie energetisch höherwertiger sind.
kumulierte Doppelbindung
Zwei
2sp2-hybridisierte
Kohlenstoffatome im Molekül
vorhanden,
jedoch
nicht
benachbart.
1,2-Pentadien
CH2=C=CH2-CH3
sp2
sp2
konjugierte Doppelbindung
isolierte Doppelbindung
Vier
benachbarte
2sp2- Vier
2sp2-hybridisierte
hybridisierte Kohlenstoffatome im Kohlenstoffatome im Molekül
Molekül vorhanden.
vorhanden,
jedoch
nicht
durchgehend benachbart.
1,3-Pentadien
1,4-Pentadien
CH2=CH-CH=CH-CH3
CH2=CH-CH2-CH=CH2
sp2 sp2 sp2 sp2
sp2 sp2
sp2 sp2
Bindungen im Ethinmolekül
•
•
•
•
•
•
Ethin hat die Summenformel C2H2, die Atome im Molekül sind linear angeordnet,
Die Kohlenstoffatom sind durch eine Dreifachbindung verbunden, der Bindungswinkel beträgt 180°.
Im angeregten Zustand entstehen aus je einem 2s- und einem 2p-Orbital zwei 2sp-Hybridorbitale.
Die anderen zwei 2p-Orbitale sind nicht an der Hybridisierung beteiligt.
Eines der Hybridorbitale bildet ein sp-s-σ-Molekülorbital mit dem 1s-Orbital des Wasserstoffatoms
aus, während das andere eine sp-sp-σ-Bindung mit dem anderen Kohlenstoffatom ausbildet.
Aus den beiden nicht hybridisierten 2p-Orbitalen entstehen p-p-π-Bindungen mit dem anderen
Kohlenstoffatom.
Polare Atombindungen
•
•
•
Beträgt die Elektronegativitätswertdifferenz zweier an einer Atombindung beteiligter Atome
zwischen 0,9 und 1,6, so ist die Bindung polar.
Das Atom mit dem höheren Elektronegativitätswert zieht die bindenden Elektronen stärker zu sich
hin.
Das Molekülorbital hat daher in der nähe des Atoms mit dem höheren Elektronegativitätswert eine
größere Ladungsdichte.
•
Darum hat dieses Atom eine negative (δ-) und das andere eine positive Partialladung (δ+).
Dipolmoleküle
•
Befinden sich die Schwerpunkte der positiven und negativen Partialladungen in Molekülen mit
polaren Atombindungen an verschiedenen Orten, so handelt es sich um Dipolmoleküle.
Chlorwasserstoff
•
•
•
•
Im Chlorwasserstoffmolekül besteht eine s-p-σ-Bindung zwischen dem 1s-Atomorbital des
Wasserstoffatoms und einem 3p-Orbital des Chloratoms.
Auf Grund der Elektronegativitätswerte (Chlor: 3,0; Wasserstoff: 2.1) ist diese Bindung polar.
Das Chloratom erhält eine negative und das Wasserstoffatom eine positive Partialladung.
Auf Grund der räumlichen Trennung der Partialladungen handelt es sich um ein Dipolmolekül.
Wasser
•
•
•
•
•
•
•
Im Sauerstoffatom entstehen aus dem 2s- und drei 2p-Orbitalen vier 2sp3-Hybridorbitale, die nach
den vier Ecken eines Tetraeders ausgerichtet sind.
Zwei der 2sp3-Hybridorbitale sind bereits doppelt besetzt.
Die anderen beiden überlappen sich mit den 1s-Atomorbitalen der Wasserstoffatome und bilden ssp3-σ-Bindungen aus.
Da die bereits doppelt besetzten Orbitale auf Grund der Abstoßung der Elektronen mehr Platz
benötigen, beträgt der Bindungswinkel 104,5°.
Auf Grund der Elektronegativitätswerte (Sauerstoff: 3,5; Wasserstoff: 2.1) ist die Bindung polar.
Das Sauerstoffatom ist partiell negativ geladen, während die beiden Wasserstoffatome eine positive
Partialladung innehaben.
Wegen dem gewinkelten Bau des Wassermoleküls fallen die Partialladungen nicht zusammen und
es handelt sich um ein Dipolmolekül.
aromatischer Bindungszustand
•
•
•
•
•
•
•
•
•
•
•
Das Reaktionsverhalten eines Aromaten wie Benzen ist das eines gesättigten Kohlenwasserstoffs.
Die Kohlenstoffatome im Benzen sind sp2-hybridisiert, der Ring ist planar aufgebaut.
Dadurch ist eine optimale Überlappung aller pz-Orbitale der Kohlenstoffatom gewährleistet.
Daraus resultieren π-Molekülorbitale, die sich über das gesamte Ringsystem erstrecken.
Die sechs π-Elektronen sind völlig gleichartig über die sechs Kohlenstoff-Kohlenstoff-Bindungen
verteilt.
Sie sind delokalisiert und bilden ein mesomeres System, das π-Elektronensextett.
Für die Darstellung mesomerer Systeme werden Grenzformeln verwendet, die den Zustand des
Moleküls eingrenzend beschreiben, aber nicht real existieren.
Diese Formeln werden durch den Mesomeriepfeil Q verbunden.
Die vollständige Delokalisierung des π-Elektronensextetts ist mit einer energetischen Stabilisierung
des Systems verbunden.
Diese Energie wird als Mesomerieenergie bezeichnet.
Bei chemischen Reaktionen der aromatischen Verbindungen muss diese Energie aufgebracht
werden, wenn der aromatische Zustand temporär oder entgültig aufgehoben werden soll.
Hückel-Regel
•
•
Cyclische, konjugierte, planare Verbindungen sind dann aromatisch, wenn im Ringsystem 4n+2 πElektronen vorhanden sind.
Daher sind Ringsysteme mit 2, 6, 10, 14 π-Elektronen aromatisch, solche mit 4, 8, 12 jedoch nicht.
Struktur und Eigenschaften von Molekülsubstanzen
•
Eigenschaften von Substanzen werden direkt auf deren Bau zurückgeführt.
van-der-Waals-Kräfte
•
•
•
•
•
•
•
•
•
•
In den Molekülsubstanzen wirken neben den Atombindungen noch andere Anziehungskräfte
zwischen den Molekülen. Sie werden als van-der-Waals-Kräfte bezeichnet.
Die van-der-Waals-Kräfte in unpolaren Molekülen haben ihre Ursache in kurzen
Elektronenverschiebungen in deren Hüllen, weswegen sich kurzzeitige Dipole ausbilden.
Diese induzieren in ihren Nachbarmolekülen ebenfalls Dipole.
Zwischen diesen kurzzeitigen und induzierten Dipolen bestehen elektrostatische Anziehungskräfte,
die Dispersionskräfte.
In großen Molekülen lassen sich die Elektronenhüllen ihrer Atome leicht verformen, da sich deren
Elektronen weiter vom Kern entfernt befinden.
Die Dispersionskräfte hängen von der Anzahl der vorhandenen Elektronen ab, ihre Stärke ist der
molaren Masse proportional.
Neben den Dispersionskräften wirken in polaren Molekülen noch andere Anziehungskräfte, DipolDipol-Kräfte.
Die van-der-Waals-Kräfte sind größer, wenn außer den Dispersionskräften noch solche
Anziehungskräfte zwischen permanenten Dipolen wirken.
Darum sind die Siedetemperaturen polare Molekülsubstanzen höher als die von unpolaren.
Die van-der-Waals-Kräfte sind zwischen Molekülkristallen und flüssigen Molekülsubstanzen
schwach, weshalb solche Stoffe eine niedrige Schmelz- und Siedetemperatur haben.
Wasserstoffbrückenbindungen
•
•
•
•
•
•
•
•
Wasser hat eine ungewöhnlich hohe Schmelz- und Siedetemperatur. Ebensolches gilt auch für
andere Wasserstoffverbindungen der Elemente der V. und VII. Hauptgruppe.
In solchen Stoffen sind Wasserstoffatome jeweils mit einem Partner besonders großer
Elektronegativität verbunden, weshalb sie partiell positiv (δ+) geladen sind, während der
Bindungspartner eine negative Partialladung (δ-) innehat.
Die Bindung ist auf Grund der großen Elektronegativitätswertdifferenz sehr stark polar.
Zwischen dem Wasserstoffatom eines Moleküls und dem partiell negativ geladenen Atom eines
anderen Moleküls bildet sich eine Wasserstoffbrückenbindung aus.
Die Wasserstoffbrückenbindung ist eine elektrostatische Anziehung zwischen dem partiell positiven
Wasserstoffatom und einem freien Elektronenpaar eines stark elektronegativen Atoms eines
anderen Moleküls.
Die molare Bindungsenergie von Wasserstoffbrückenbindungen beträgt 4-25 KJ/mol und ist damit
bedeutend geringer als die von Atombindungen.
Sie wird in Elektronenschreibweise als gestrichelte Linie dargestellt.
Sie ist für die hohen Schmelz- und Siedetemperaturen von Fluorwasserstoff, Wasser, Ammoniak,
Alkoholen, Karbonsäuren und Aminen verantwortlich.
Molekülgitter
•
•
•
•
•
•
Molekülgitter, in denen zwischen den Molekülen Wasserstoffbrückenbindungen vorliegen sind
relativ stabil und besitzen charakteristische Strukturen.
Beim Eis bilden die Sauerstoffatome im Molekül je zwei Wasserstoffbrückenbindungen aus.
Mit den beiden schon vorhandenen Atombindungen entsteht so wiederum eine Tetraederform.
Dadurch wird die größtmögliche Anzahl von Wasserstoffbrückenbindungen erreicht und ein
netzartiges Gitter mit hexagonalen Hohlräumen erzeugt.
Der große Raumbedarf dieses Gitters bewirkt die geringere Dichte von Eis im Vergleich mit
flüssigem Wasser.
Dieser Aspekt wird als Dichteanomalie des Wassers bezeichnet, da dieses bei 4°C die größte
Dichte besitzt.
Löslichkeit
•
•
Eine Lösung besteht aus einem Lösungsmittel und einer gelösten Substanz.
Eine Lösung die trotz Berührung mit dem zu lösenden Stoff nicht mehr von diesem aufnehmen
kann ist gesättigt.
•
•
•
Die Konzentration der gesättigten Lösung ist die Löslichkeit.
Beim Lösen werden die Moleküle des zu lösenden Stoffes aus dem Molekülkristall abgespalten und
dann von Molekülen des Lösungsmittels umschlossen. Dieser Vorgang wird als Solvation
bezeichnet (ist Wasser Lösungsmittel, so heißt er Hydration).
Je ähnlicher sich Lösungsmittel und zu lösender Stoff hinsichtlich ihrer Polarität sind, desto größer
ist die Löslichkeit.
Struktur und Eigenschaften von Ionensubstanzen
•
•
•
•
•
•
•
•
•
•
•
Ionensubstanzen sind aus entgegengesetzt geladenen Ionen aufgebaut.
Insgesamt sind sie elektrisch neutral.
Durch die elektrischen Felder umgeben sich die positiven Ionen symmetrisch mit negativ geladenen
und umgekehrt.
Dies bezeichnet man als das Prinzip der höchsten Symmetrie.
Diese regelmäßige Anordnung der Ionen im Kristall wird durch das Modell des Ionengitters
verdeutlicht.
Auf Grund der abwechselnden Anordnung von entgegengesetzt geladenen Ionen brechen
Ionenkristalle sehr leicht. Durch Druck werden nämlich die Ionen gegeneinander verschoben und
elektrisch gleich geladene können sich gegenüber stehen und stoßen sich ab.
Die Koordinationszahl eines Gitters gibt die Anzahl der Nachbarn eines Gitterbausteins an.
Bei Salzen hängt die Struktur des Ionengitters von den Radienverhältnissen der Kationen zu den
Anionen ab.
Bei einem Radienverhältnis unter 0,73 bilden die Anionen eine dichteste Kugelpackung.
Die Kationen liegen in den Lücken dieser Packung.
Für Verbindungen des Typs AB ergeben sich folgende Gitterstrukturen:
ZnS-Typ
Radienverhälnis:
< 0,41
Koordinationszahl: 4
Form:
tetraedrisch
Zinkblende-Typ; Zinksulfid; BeO;
ZnSe
NaCl-Typ
Radienverhälnis:
< 0,73
Koordinationszahl: 6
Form:
oktaedrisch
Natriumchlorid; Steinsalz-Typ;
viele Salze; NaI; KCl
CsCl-Typ
Radienverhälnis:
> 0,73
Koordinationszahl: 8
Form:
Würfelartig
Caesiumchlorid-Typ; CsI, CsBr
Vorgänge beim Lösen
•
•
•
•
•
•
•
•
•
•
•
•
•
Wassermoleküle sind im Vergleich zu den Ionen im Kristallgitter eher klein.
Um eine Ionensubstanz in Wasser zu Lösen, wird diese vollständig mit Wasser bedeckt.
Dabei lagern sich die Wassermoleküle mit ihren Partialladungen an die entgegengesetzt geladenen
Ionen der Kristalloberfläche an. Auch dringen sie wegen ihrer geringen Größe in die Baufehler des
Kristalls ein.
Hier und an seinen Ecken und Kanten sind die elektrischen Felder, die die Ionen umgeben, am
größten, deshalb erfolgt dort die intensivste Wasseranlagerung.
Dringt Wasser in den Kristall ein, so wird die Coulombkraft, welche den Kristall zusammenhält,
abgeschwächt.
An den Kanten und Ecken werden nun zuerst Ionen aus der Substanz gelöst und vollständig von
Wasserdipolen umschlossen. Diesen Vorgang bezeichnet man als Hydration bzw. Solvation.
Dabei werden die noch vorhandenen Anziehungskräfte zwischen den Ionen durch die entstehenden
Hydrathüllen weiter abgeschwächt.
Die gelösten Ionen bilden die Vorraussetzung für elektrische Leitfähigkeit der Lösung.
Aus energetischer Sicht betrachtet wird zuerst die Gitterenthalpie ΔGH des Kristalls überwunden.
Danach wird bei der Hydration Energie in Form der Hydrationsenthalpie ΔHH frei.
Der Vorgang verläuft stark in Richtung höhere Entropie, da Teilchen aus einem Zustand hoher
Ordnung in einen Zustand der Unordnung übergehen. Daher ist er auch meist exergonisch und
verläuft freiwillig.
Ob ein Auflösungsvorgang insgesamt exotherm oder endotherm erfolgt, kann mit Hilfe der molaren
Lösungsenthalpie ΔLH bestimmt werden.
Für sie gilt: ΔLH = ΔHH - ΔGH
Kreisprozess nach Haber-Born
•
•
•
•
Für die Bildung positiv geladener Ionen wird Energie benötigt.
Diese wird bei der Bildung des Ionengitters abgegeben und als Gitterenthalpie bezeichnet.
Diese
Gitterenthalpie
lässt
sich
experimentell nur sehr schwer ermitteln,
deshalb wird die Bildung eines Ionengitters
nach dem Born-Haber-Kreisprozess in
Einzelschritte zerlegt.
Durch Summierung der Enthalpien der
Teilschritte ergibt sich die Gitterenthalpie.
1. Die Stoffe werden in Atome überführt.
Natrium wird verdampft.
Die erforderliche Sublimationsenthalpie
ΔSH wird ermittelt.
2. Die Natriumatom werden ionisiert und
die Ionisierungsenthalpie ΔIH ermittelt.
3. Die Bindung der Chlormoleküle wird
gelöst und die Dissoziationsenthalpie
ΔDH bestimmt.
4. Chlorid-Ionen werden gebildet und die
Elektronenaffinität ΔEH ermittelt.
5. Die Ionensubstanz wird gebildet und die
Bildungsenthalpie ΔBH bestimmt.
6. Berechnung
der
molaren
Gitterenthalpie ΔGH.
Struktur und Eigenschaften von Metallen
•
•
Metalle haben Eigenschaften wie elektrische Leitfähigkeit (nimmt mit steigender Temperatur ab),
gute Wärmeleitfähigkeit, metallischen Glanz und plastische Verformbarkeit gemeinsam.
Diese Eigenschaften können mit Hilfe des Elektronengasmodells und des Energiebändermodells
erklärt werden.
Elektronengasmodell
•
•
•
•
•
•
•
•
Elektronen sind bewegliche Ladungsträger im Metall.
Die Gitterplätze im Metall sind durch positive Atomrümpfe besetzt, den Metall-Ionen, deren
Valenzelektronen als „Elektronengas“ sich frei im Metall bewegen können.
Im Gegensatz zu Molekülverbindungen sind also die Valenzelektronen nicht an bestimmte Atome
gebunden.
Die Bindungskräfte zwischen positiven Atomrümpfen und dem Elektronengas sind ungerichtet,
weshalb diese sich dicht zusammenlagern.
Die gute Verformbarkeit von Metallen lässt sich dadurch erklären, dass sich die einzelnen
Gitterebenen leicht gegeneinander verschieben lassen, da sich an der Umgebung der Atomrümpfe
durch das Elektronengas nichts ändert.
Dies kann durch den Einbau von Fremdatomen wie bei Legierungen verhindert werden.
Die gute elektrische und thermische Leitfähigkeit von Metallen beruht auf den frei beweglichen
Elektronen im Elektronengas.
Die sinkende elektrische Leitfähigkeit bei steigender Temperatur hat ihre Ursache in der stärkeren
Schwingung der Atomrümpfe und der daraus resultieren Behinderung der Elektronenbewegung.
Energiebändermodell
•
•
Zur Erklärung der unterschiedlichen Leitfähigkeiten von Metallen, Halbmetallen und Isolatoren dient
das Energiebändermodell.
Bei der Bildung des Metallkristalls aus isolierten Atomen bilden sich Molekülorbitale die sich über
den gesamten Kristall erstrecken und sich energetisch kaum unterscheiden.
•
•
•
•
•
•
•
•
•
Die bestehenden Energiedifferenzen sind so gering, dass die Molekülorbitale zu Energiebändern
zusammengefasst werden.
Bei der Besetzung von Energiebändern im Atom gilt die Pauli-Regel.
Das äußerste besetzte Band wird als Valenzband bezeichnet. (bei Lithium 2s-Band)
Das nächst höhere Band ist das Leitungsband. (bei Lithium 2p-Band)
Durch die Überlappung von Valenz- und Leitungsband ist bei Metallen nur sehr wenig Energie
nötig, um die Elektronen vom Valenz- in das Leitungsband zu heben.
Diese Elektronen können sich nun frei im Metall bewegen, weshalb Metalle gute Leiter sind.
Bei Isolatoren ist das Valenzband voll besetzt und durch eine breite Lücke, der verbotenen Zone,
vom Leitungsband getrennt.
Darum sind Isolatoren keine elektrischen Leiter.
Ist die Lücke zwischen dem voll besetzten Valenz- und dem Leitungsband schmal, tritt
Eigenhalbleitung auf, Elektronen gelangen bei höherer Temperatur leichter auf das Leitungsband.
Metallgitter
•
•
•
•
•
•
Die meisten Metalle haben kristallinen Aufbau.
Sie bestehen aus kleinen Kriställchen, den Kristalliten, in denen Atome, ähnlich wie im Ionengitter,
feste Plätze einnehmen.
Alle Atome im Metallkristall haben die gleiche Größe.
Die Anziehungskräfte sind ungerichtet, weshalb der kristalline Aufbau wieder mit dem Modell der
Kugelpackung erklärt werden kann.
kubisch raumzentriert
lockere Kugelpackung
Wolfram
Koordinationszahl: 8
•
•
kubisch flächenzentriert
dichteste Kugelpackung
Kupfer
Koordinationszahl: 12
hexagonal
• dichteste Kugelpackung
• Magnesium
• hexagonales Prisma
Koordinationszahl: 12
3. Nebengruppenelemente und Redoxreaktionen
•
•
•
•
•
•
•
•
Elemente, deren Atome als energetisch höchstes, besetztes Orbital ein d-Orbital haben, sind
Nebengruppenelemente.
Wichtig sind drei Gruppen dieser sogenannten d-Elemente:
3d-Reihe: Scandium bis Zink
(Außenorbital ist 3d-Orbital)
4d-Reihe: Yttrium bis Cadmium
(Außenorbital ist 4d-Orbital)
5d-Reihe: Hafnium bis Quecksilber
(Außenorbital ist 5d-Orbital)
Dazu kommen zwei Gruppen von f-Elementen:
4f-Reihe:
Lanthanoide
Cer bis Lutetium
5f-Reihe:
Actinoide
Thorium bis Lawrencium
(Außenorbital ist 4f-Orbital)
(Außenorbital ist 5f-Orbital)
Infolge von Wechselwirkungen zwischen Elektronen ist das 3d-Orbital energetisch niederwertiger
als das 4s-Orbital, weshalb bei Ionenbildungen zuerst die beiden 4s-Elektronen abgegeben werden.
Darum bilden die meisten Nebengruppenelemente meist zweifach positiv geladene Ionen.
Nebengruppenelemente besitzen ausschließlich positive Oxidationszahlen.
Die höchste Oxidationszahl eines Nebengruppenelements entspricht der Elektronenkonfiguration
des vorangegangenen Edelgases.
Sie kann bestimmt werden aus 8 - Nebengruppennummer.
Oxidationszahlen:
Sc
±0; +3
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
±0; +2; ±0...+5 ±0...+6 ±0...+7 ±0...+6 ±0...+4 ±0...+4 ±0...+3 ±0; +2
+3; +4
**************** atombau-eigenschaft fe, mn, cr ****************
Redoxreaktion
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
Die Oxidationszahl eines Atoms in einer
Verbindung entspricht der Ladung, die es hätte,
wenn es ein Ion wäre.
Oxidation ist die Abgabe von Elektronen.
Dadurch steigt die Oxidationszahl.
Reduktion ist die Aufnahme von Elektronen.
Dadurch sinkt die Oxidationszahl.
Ein Oxidationsmittel kann Elektronen
aufnehmen, es ist ein Elektronenakzeptor und
oxidiert andere Stoffe.
Ein Reduktionsmittel kann Elektronen abgeben,
es ist ein Elektronendonator und reduziert
andere Stoffe.
Elektronenabgabe kann nur erfolgen, wenn ein
Stoff da ist, der Elektronen aufnehmen kann
(und umgekehrt).
Daher sind Oxidation und Reduktion stets gekoppelt.
Sie werden als Redoxreaktion zusammengefasst und sind Elektronenübertragungsreaktionen.
Mit Hilfe des Elektrischen Stroms sind Oxidation an einer Anode (anodische Oxidation) und
Reduktion an einer Katode (katodische Reduktion) möglich.
Oxidation und Reduktion sind umkehrbare Vorgänge.
Aus Reduktionsmitteln (Red) entstehen durch Elektronenabgabe Oxidationsmittel (Ox) und
umgekehrt.
Dies wird als korrespondierendes Redoxpaar bezeichnet: Red ' Ox + z eZwischen einem Reduktionsmittel und dem korrespondierenden Oxidationsmittel besteht eine
Potentialdifferenz, das Redoxpotential.
An einer Redoxreaktion sind stets zwei
Red 1 + Ox 2 ' Ox 1 + Red 2
korrespondierende Redoxpaare beteiligt:
- - - - Oxidation - - - - "
Red 1
' Ox 1
- - - - Reduktion - - - - ! - - - - Oxidation - - - - Ox 2
+ b e' Red 2
- - - - Reduktion - - - -
+
a e-
1. korrespondierendes Redoxpaar
2. korrespondierendes Redoxpaar
- - - - Oxidation - - - - "
b Red 1 + a Ox 2
' b Ox 1
+ a Red 2
- - - - Reduktion - - - -
Redoxreaktion
pH-abhängige Redoxreaktionen
•
•
•
Bei vielen Redoxreaktionen ist der Elektronenübergang an einen Protonenübergang gekoppelt.
Der Ablauf solcher Reaktionen ist dann an den pH-Wert gebunden.
Am Beispiel Kaliumpermanganat bedeutet dies:
- In sauerer Lösung gehen Permanganationen in Mangan(II)-Ionen über.
MnO4- + 8 H3O+ + 5 e- ' Mn2+ + 12 H2O
Dabei ändert sich die Oxidationszahl Mangans von +7 auf +2 (fünf Elektronen wurden
aufgenommen).
- In alkalischer Lösung entstehen verschiedene Mangan(IV)-Verbindungen, wobei nur drei
elektronen aufgenommen werden.
- Nicht nur die Oxidationszahl, sondern auch die Stärke eines Oxidationsmittels kann vom pH-Wert
beeinflusst werden.
- In stark sauer Lösung ist Kaliumpermangant ein stärkeres Oxidationsmittel als in schwach
sauerer Lösung.
4. Komplexchemie
Verbindungen höherer Ordnung
•
•
•
•
•
•
Viele nach außen neutrale Metallverbindungen sind in der Lage, Moleküle oder Ionen anzulagern
und Verbindungen höherer Aggregation zu bilden.
Diese Reaktionen heißen Komplexreaktionen, die entstehenden Verbindungen
Komplexverbindungen.
In Formeln für Komplexverbindungen werden charakteristische Atomgruppen in eckigen Klammern
zusammengefasst.
Meist handelt es sich um komplexe Salze, welche in wässriger Lösung dissoziieren und komplexe
Anionen oder komplexe Kationen bilden (und ebenso die dazugehörenden Kat- und Anionen).
Die Ladung eines Komplexes entspricht der Summe der Ladungen aller komplex gebundenen
Ionen.
Gleichen sich die Ladungen aus, entstehen Neutralkomplexe.
Aufbau der Komplexe
•
•
•
•
•
•
•
•
•
Komplexe bestehen aus Zentralion oder Zentralatom und Liganden.
Meist treten Metallkationen als Koordinationszentrum auf.
Die Liganden sind entweder Ionen (meist Anionen) oder Moleküle (meist Dipole), die über ein freies
Elektronenpaar verfügen.
Die Bindung der Liganden an das Zentralion erfolgt durch Haftatome (meist Nichtmetalle).
Die Anzahl der am Liganden vorhandenen Haftatome bezeichnet man als Zähnigkeit.
Die Anzahl der Haftatome von Liganden, mit denen das Zentralion verbunden ist, als dessen
Koordinationszahl.
Diese ist von dem Größenverhältnis Zentralion-Liganden, den Anziehungs- und Abstoßungskräften
zwischen den Liganden und der Elektronenkonfiguration des Zentralions abhängig.
Oft greifen Liganden mit mehreren Haftatomen am Zentralion an, dabei entstehen ringförmige
Verbindungen, die Chelate, in denen der Ligand das Zentralatom scherenartig umschließt.
Koordinationszahl 2
lineare Anordnung
[Ag(NH3)2]+
•
•
Koordinationszahl 4
tetradrische Anordnung
[Al(OH)4]-, [CoCl4]2planar-quadratische-Anordnung
[Ni(CN)4]2-, [Pt(NH3)4]2+
•
Koordinationszahl 6
oktaedrische Anordnung
[Fe(CN)6]4-, [Co(H2O)6]2+
Namen von Komplexverbindungen
•
•
•
•
•
In den Formeln von Komplexen steht das Zentralion vorn, gefolgt von anionischen, neutralen und
kationischen Liganden.
Die Formeln werden in eckige Klammern gesetzt.
Die Namen setzen sich wie folgt zusammen:
- Anzahl der Liganden
Die Anzahl wird durch griechische Zahlwörter 8 Die Formeln werden in Klammern gesetzt., tri,
tetra, penta, hexa...) ausgedrückt, bei Liganden mit komplizierten Namen werden nutzt man
Zahlwörter wie bis, tris, tetrakis vor dem in Klammern gesetzten Liganden.
- Art der Liganden
Die Namen der Liganden werden in alphabetischer Reihenfolge genannt.
Anionische Liganden erhalten die Endung –o.
Bei einigen häufigen Liganden werden Kurznamen verwendet.
- Name des Zentralatoms oder –Ions
Bei Anionen wird der lateinische Wortstamm mit der Endung –at verwendet, bei anderen der
normale deutsche Namen.
- Oxidationszahl des Zentralions
Römisch. Wird in Klammern gesetzt.
Die Namen salzartiger Komplexe werden um die zugehörigen Kat- bzw. Anionen erweitert, wobei
zuerst das Kation genannt wird.
Kat- und Anion sind durch Bindestrich getrennt.
komplexes
Anion
Al
Ag
Au
Co
Cu
Fe
Name
Aluminat
Argentat
Aurat
Cobaltat
Cuprat
Ferrat
anionischer oder
neutraler Ligand
NH3
H2O
SCNCNF-, Cl-, Br-, IO2O22S2O32S2-
Name
ammin
aqua
cyanato
cyano
fluoro, chloro, bromo, iodo
oxo
peroxo
sulfato
thio
chemische Bindungen in Komplexen
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
Auf Grund elektrostatischer Wechselwirkungen ziehen sich entgegengesetzt geladene Ionen oder
Dipolmoleküle an.
Oft finden am Zentralion mehr ionische Liganden Platz, als zum Ladungsausgleich notwendig.
Ionische Liganden stoßen einander stärker ab als Neutralliganden.
Daher haben Komplexe mit neutralen Liganden oft höhere Koordinationszahlen.
Als Ergebnis der Wechselwirkungen zwischen den Teilchen, die von Größenverhältnis, Ladungen
und Dipolwirkungen abhängig sind, ordnen sich die Liganden symmetrisch am Zentralion an.
Alle enthalten freie Elektronenpaare an den Haftatomen, so dass Atombindungen zum Zentralion
entstehen.
Hierbei stammen die bindenden Elektronen jedoch nur von einem Reaktionspartner, dem Liganden.
Dies wird als koordinative Bindung bezeichnet.
Häufig erreichen die Zentralionen durch Aufnahme von Komplexen Edelgaskonfiguration.
Nach der Valenzbindungstheorie kommt die Bindung zwischen Zentralion und Ligand durch
Überlappung der Ligandenorbitale mit den Hybridorbitalen des Zentralions zustande.
Bei tetraedrischen Komplexen liegt eine sp3-, bei planar-quadratischen eine dsp2- und bei
oktaedrischen Komplexen eine d2sp3-Hybridisierung vor.
In der 3d-Reihe stehen bei oktaedrischen Komplexen zur Hybridisierung neben dem 4s- und den
drei 4p-Orbitalen noch entweder zwei 3d- oder zwei 4d-Orbitale zur Verfügung.
Daher unterscheidet man inner-Orbital und outer-Orbital-Komplexe, wobei inner-Orbital-Komplexe
eine geringere Anzahl von Elektronen mit paralleler Spin-Orientierung besitzen, und darum auch als
low-spin und die outer-Orbital-Komplexe als high-spin bezeichnet werden.
Komplexe der Nebengruppenelemte
sind meist farbig, während Komplexe der
Hauptgruppenelemente oft farblos sind.
Die Ligandenfeldtheorie betrachtet darum die Wechselwirkung eines vom Liganden erzeugten
elektrischen Feldes mit den d-Orbitalen.
Im freien Ion sind diese energetisch gleich (entartet), weisen jedoch unterschiedliche räumliche
Orientierung auf.
Durch die vom Ligandenfeld vorgegebene Symmetrie werden sie darum verschieden beeinflusst,
und die energetische Gleichheit (Entartung) wird teilweise aufgehoben.
Elektronenübergänge zwischen den d-Orbitalen sind leicht möglich, welche durch sichtbares Licht
anregbar und die Ursache für die Farbigkeit von Komplexen sind.
Dadurch entstehen unterschiedliche Elektronenverteilungen auf deren Oberfläche.
Es ist z.B. möglich, nur einige d-Orbitale unter Spinkopplung zu besetzen (low-spin) oder aber alle
d-Orbitale mit Elektronen parallelem Spins zu füllen (high-spin).
Daraus resultiert auch das unterschiedliche magnetische Verhalten der Komplexe.
Komplexbildung und –zerfall
•
•
•
An viele Metallionen werden leicht Wassermoleküle angelagert, daher enthalten auch viele
Metallsalze Kristallwasser. In wässriger Lösung liegen Komplexionen mit Wasserliganden meist mit
der Koordinationszahl 6 vor.
Diese Liganden lassen sich schrittweise durch andere Liganden verdrängen (Ligandenaustausch),
was oft von Farbänderungen begleitet ist.
Dipolmoleküle werden von Zentralionen nur schwach angezogen, sie können leicht durch ionische
Liganden ausgetauscht werden.
•
•
Gleichgewichtskonstanten liefern Aussagen über die Stabilität von Komplexen und werden daher
als Komplexstabilitätskonstanten bezeichnet.
K1 ist die Bruttostabilitätskonstante und K2 ist die individuelle Stabilitätskonstante.
Chelatkomplexe
•
•
•
•
•
•
•
Chelate sind Komplexe, bei denen Liganden mit mehreren Haftatomen das Zentralion scherenartig
umschließen.
Sie sind stabiler als Komplexe mit Einzelliganden gleicher Haftatome, was als Chelateffekt
bezeichnet wird.
Die Chelatbildung wird durch einen Entropieeffekt begünstigt.
Greift ein mehrzähniger Ligand mit einem Haftatom am Zentralion an, so ist die Wahrscheinlichkeit
groß, dass sich weitere Bindungen geknüpft werden.
Das führt zur Verdrängung anderer Liganden, wodurch sich die Teilchenzahl erhöht, was eine
thermodynamische Stabilität bewirkt.
Kinetisch stabil oder inert sind Komplexe, die sehr langsam zerfallen, sich jedoch auch nur sehr
langsam bilden.
Die Geschwindigkeit von Ligandenaustauschen hängt von der Elektronenkonfiguration der
Zentralionen ab.
isomere Komplexe
•
•
•
•
•
•
Isomere Komplexe unterscheiden sich durch unterschiedliche Anordnung der Liganden am
Zentralion.
Bei der Cis-trans-Isomerie können Liganden in oktaedrischen oder planar-quadratischen
Komplexen entweder benachbart sein oder sich gegenüberstehen.
Optische Isomerie tritt auf, wenn sich Komplexe zueinander wie Bild und Spiegelbild verhalten, was
bei oktaedrischer oder tetraedrischer Anordnung möglich ist.
Solche Komplexe sind optisch aktiv, sie drehen die Schwingungsebene polarisierten Lichtes.
Hydratisomerie tritt auf, wenn Wassermoleküle in der Koordinationsphase gegen Anionen
ausgetauscht werden, die dann fest mit dem Zentralion verbunden sind.
Bindungsisomerie liegt vor, wenn ein Ligand verschiedene Haftatome betätigen kann, was zum
Beispiel bei SCN- der Fall ist, welches entweder durch das Schwefel- oder das Stickstoffatom
gebunden wird.
Komplexometrie
•
•
•
•
•
•
•
•
Komplexbildungsreaktionen können zur quantitativen Bestimmung von Metallionen durch Titration
dienen (Komplexometrie).
Dafür sind Komplexe hoher Stabilität geeignet, die sich in mölichst wenigen Schritten möglichst
schnell bilden.
Ligand und Komplex müssen wasserlöslich sein.
Dies erfüllt vor allem die Ethylendiamintetraessigsäure H4edta.
Oft wird darum das Natriumsalz Na2H2edta * 2 H2O verwendet, welches nach Abgabe der Protonen
ein sechszähniger Ligand wird, welcher auf Grund des Chelateffektes sehr stabile Komplexe bildet.
Zur Erkennung des Äquivalenzpunktes werden Metallindikatoren verwendet, welche
komplexbildende Farbstoffe sind, deren Metallkomplexe andere Färbungen aufweisen als der freie
Ligand.
Da sie auch Säure-Base-Indikatoren sind, muss während der Titration der pH-Wert konstant
gehalten werden.
Die Härte des Wassers, welche durch die gelösten Stoffe Sulfate, Chloride und Hydrogencarbonate
von Magnesium und Calcium bestimmt wird, kann auf komplexometrischen Wege ermittelt werden.
Bedeutung und Verwendung von Komplexen
•
•
Farbreaktionen und Löslichkeitsänderungen (z.B. Fällungsreaktionen), die mit Komplexbildung
verbunden sind, dienen häufig zum quantitativen und qualitativen Nachweis von Stoffen.
Die Eigenschaft komplexbildender Substanzen, Metallverbindungen aufzulösen, wird zum
Aufschluss von Erzen und Mineralien genutzt.
•
•
•
•
•
So wird Aluminium nach dem Bayer-Prozess und Gold mit Cyanidlaugung gewonnen.
Ebenso ist das Fixieren im fotographischen Prozess eine Komplexreaktion.
Katalytische Wirkungen von Metallen beruhen auf Reaktionsverläufen über Metallkomplexe.
In der Natur spielen Komplexe eine wichtige Rolle, sie sind zum Beispiel im Hämoglobin (Häm) und
Chlorophyll sowie Vitamin B12 enthalten.
Sie dienen der Photosynthese, Redoxreaktionen in Organismen und der Regulation des
Zellwachstums.
Auch werden sie bei der Ausschaltung störender Ionen in Reaktionen zur sogenannten Maskierung
genutzt.
5. Säure-Base-Gleichgewicht
Entwicklung des Säure-Base-Begriffs
•
•
•
•
•
•
•
Nach Arrhenius sind Säuren Stoffe, die in wässriger Lösung Wasserstoffionen abspalten, während
Basen in wässriger Lösung Hydroxidionen abspalten.
Damit führte er den sauren Charakter einer Lösung auf das Vorhandensein von H+- und OH--Ionen
zurück.
Zwischen Säuren und Basen gibt es nach Arrhenius keinen funktionellen Zusammenhang, nur die
Neutralisation (H+ + OH- ' H2O) ist eine Säure Base-Reaktion.
Nach Lewis sind Säuren Stoffe, die in ihrer äußeren Schale eine Elektronenpaarlücke aufweisen,
Base besitzen mindestens ein freies Elektronenpaar.
Säuren sind somit Elektronenpaar-Akzeptoren während Basen Elektronenpaar-Donatoren sind.
Säure-Base-Reaktionen sind nach Lewis Ausbildungen einer koordinativen Bindung.
Nach Brönsted wurden Säure-Base-Reaktionen als Reaktionen mit Protonenübergang
charakterisiert.
Säure-Base-Definition nach Brönsted
•
•
•
•
•
•
•
•
•
•
•
Säuren sind Teilchen, die bei Reaktionen Protonen abgeben, und daher Protonendonatoren.
Sie enthalten Wasserstoffatome mit positiver Partialladung.
Basen sind Teilchen, die bei Reaktionen Protonen aufnehmen, also Protonenakzeptoren.
Sie besitzen mindestens ein freies Elektronenpaar, dass die Ausbildung einer koordinativen
Bindung mit einem Proton ermöglicht.
Ampholyte sind Teilchen, die sowohl als Säure wie auch als Base reagieren können, denn sie sind
säure-base-amphoter.
Neben Wassermoleküle sind z.B. auch Hydrogen-Anionen Ampholyte.
Chemische Reaktionen mit Protonenübergang werden als Säure-Base-Reaktionen oder Protolysen
bezeichnet.
Säuren, Basen und Ampholyte werden unter der Bezeichnung Protolyte zusammengefasst.
Die saure Eigenschaft des Chlorwasserstoffs lässt sich durch folgende Gleichung beschreiben:
HCl ' ClSäure ' Base
+ H+
+ Proton
Aus dem Säuremolekül entsteht durch Protonenabgabe ein Basemolekül, aus dem umgekehrt
durch Protonenaufnahme wieder ein Säuremolekül entstehen kann.
Eine Säure und eine Base, die auf solche Weise miteinander verknüpft sind, bezeichnet man als
korrespondierendes Säure-Base-Paar.
Das Chlorwasserstoffmolekül ist die korrespondierende Säure des Chloridions, während dieses die
korrespondierende Base des Chlorwasserstoffmoleküls ist.
Protolysegleichgewicht
•
•
Die Abgabe eines Protons durch eine Säure kann nur erfolgen, wenn eine Base da ist, die dieses
Proton aufnehmen kann.
An einer Reaktion mit Protonenübergang sind stets zwei korrespondierende Säure-Base-Paare
beteiligt:
HCl
' H+
+
Cl-
1. korrespondierendes Säure-Base-Paar
' H+
Säure 1
+
+
+
H2O
Base 2
HCl
+
Säure 1 +
H2O
Base 2
H
H+
•
•
•
' H3O
' Säure 2
+
Base 1
+
' H3O+
+
' Säure 2 +
2. korrespondierendes Säure-Base-Paar
ClBase 1
Säure-Base-Reaktion (Protolyse)
Da Säure-Base-Reaktionen oft nicht vollständig verlaufen, stellt sich ein chemisches Gleichgewicht,
das Säure-Base-Gleichgewicht (oder Protolysegleichgewicht) ein.
Wegen der sehr niedrigen Aktivierungsenergie für Protonenübergänge sind Säure-Base-Reaktionen
immer reversibel.
Darum stellen sich Säure-Base-Gleichgewichte auch sehr schnell ein.
Autoprotolyse des Wassers
•
•
•
•
•
•
•
•
•
•
•
•
•
Wasser enthält stets Ionen (H3O+, OH-), die bei einer Säure-Base-Reaktion des Wassers mit sich
selbst, einer Autoprotolyse, entstehen.
Das Ampholyt Wassermolekül geht durch Protonenübergang in seine korrespondierende Säure
Hydroniumion (H3O+) und seine korrespondierende Base Hydroxidion (OH-) über.
Ein sich bildendes chemisches Gleichgewicht, dass Autoprotolysegleichgewicht, liegt auf der Seite
der Wassermoleküle.
2 H2O(l) ' H3O+(aq) + OH-(aq)
ΔRH = 57,4 KJ/mol
Daraus ergibt sich folgende Gleichgewichtskonstante für
c ( H 3 O + ) * c ( OH − )
K
=
das Massenwirkungsgesetz:
c 2 (H 2 O )
Aus der Reaktionsgleichung geht hervor, dass in reinem Wasser die Konzentrationen der
Hydronium- und der Hydroxidionen gleich sind.
Bei 24°C betragen sie jeweils 10-7 mol/l, wobei die Konzentration des Wassers mit 55,6 mol/l
wesentlich größer ist.
Wenn durch Zusatz einer Säure oder Base die Konzentration der Hydronium- bzw. der
Hydroxidionen vervielfacht wird, bleibt die Konzentration des Wassers auf Grund des sehr großen
Wasserüberschusses praktisch konstant.
Sie
kann
darum
in
der
Gleichung
des
KW = c(H3O+) * c(OH-)
Massenwirkungsgesetzes vernachlässigt werden:
Die Gleichgewichtskonstante KW für das Autoprotolysegleichgewicht des Wassers wird als
Ionenprodukt des Wassers bezeichnet.
In reinem Wasser bei 24°C beträgt sie 10-14 mol²/l², sie ist von der Temperatur abhängig.
Das Ionenprodukt des Wassers gilt auch für jede wässrige Lösung eines Stoffes.
So ist in sauren Lösungen mit hoher Hydroniumionenkonzentration ist demzufolge die
Hydroxidionenkonzentration gering, so dass das Produkt beider Konzentrationen wieder KW = 10-14
mol²/l² ergibt..
Neben Wasser zeigen alle Ampholyte in wässriger Lösung Autoprotolyse.
pH-Wert
•
•
•
•
•
•
Der pH-Wert entspricht dem negativen dekadischen Logarithmus des Zahlenwertes der
Hydroniumionenkonzentration.
Der pOH-Wert entspricht dem negativen dekadischen Logarithmus des Zahlenwertes der
Hydroxidionenkonzentration.
pH = -lg {c(H3O+)}
pOH = -lg {c(OH-)]
In analoger Weise wird oft mit Gleichgewichtskonstanten chemischer Reaktionen verfahren, so
ergibt sich der Ionenexponent des Wassers:
pKW = -lg {KW}
pKW = pH + pOH = 14
Die pH-Skala umfasst die Werte von 0 bis 14.
Reines Wasser hat den pH-Wert 7, es ist neutral.
Lösungen mit pH-Werten kleiner als 7 sind sauer, Lösungen mit pH-Werten größer als 7 sind
alkalisch oder basisch.
•
•
•
•
•
Lösungen mit pH-Werten unter 0 werden als übersauer, mit pH-Werten über 14 als überalkalisch
bezeichnet.
Bei solchen Lösungen werden in den Definitionsgleichungen die Konzentrationen durch Aktivitäten
ersetzt.
Ionen dieser Lösungen sind so stark konzentriert, dass sie sich gegenseitig behindern und darum
eine geringere chemische Wirksamkeit (Aktivität) haben.
Die Aktivität a bestimmt sich aus a = γ * c, wobei γ der Aktivitätskoeffizient (meist ≤ 1) ist.
Wird die Geschwindigkeit einer Reaktion vom pH-Wert beeinflusst, so liegt eine Säure-BaseKatalyse vor.
Stärke von Säuren und Basen
•
•
•
•
•
•
Die pH-Werte gleich konzentrierter Säure und Basen können verschieden sein.
Die
Konzentrationen
der
Hydroniumund
Hydroxidionen
werden
bei
gleichen
Ausgangskonzentrationen der Protolyte nur durch das unterschiedliche Ausmaß ihrer Protolyse
bestimmt.
Die Reaktionen von Säuren und Basen mit Wasser liefern Vergleichswerte für deren Stärke.
HA
B-
+
+
•
•
•
•
•
•
•
•
•
•
•
+
+
AReaktion einer Säure mit Wasser
HB+ Reaktion einer Base mit Wasser
Je weiter das Protolysegleichgewicht auf der Seite der Protolyseprodukte liegt, desto stärker ist das
Protolyt.
Um eine quantitative Aussage über diese Stärke zu ermöglichen, wird das Massenwirkungsgesetz
auf das Protolysegleichgewicht angewendet, wobei die Konzentration des Wassers, wegen seines
großen Überschusses, als konstant angesehen werden kann.
Die Gleichgewichtskonstante für die Reaktion einer Säure mit Wasser wird als Säurekonstante KS,
die einer Base mit Wasser als Basekonstante KB bezeichnet.
KS =
•
•
H2O ' H3O+
H2O ' OH-
c (H 3 O + ) * C ( A − )
c ( HA )
KB =
c ( OH − ) * C ( HB + )
c (B )
Je größer die Säurekonstante einer Säure, desto stärker ist sie. Analoges gilt für Basen.
Auch hier ist es üblich, den negativen dekadischen Logarithmus, den Säureexponenten pKS und
den Baseexponenten pKB, zu verwenden, wobei gilt:
pKS = -lg {KS}
pKB = -lg {KB}
Säure- und Baseexponenten haben bei starken
Säuren und Basen kleine Werte.
Zwischen der Stärke einer Säure und der Stärke
ihrer korrespondierenden Base besteht der
Zusammenhang KS * KB = KW.
Daraus folgt auch: pKS + pKB = pKW = 14.
Je stärker eine Säure ist, umso schwächer ist
also ihre korrespondierende Base und
umgekehrt.
Schwache Säuren und Basen vollziehen mit
Wasser keine Säure- oder Basereaktion.
Im Bezug auf Protolysen in wässriger Lösung
kann man sie vernachlässigen.
Sehr starke Protolyte (pK ≤ -1,74) reagieren mit
Wasser vollständig.
Es liegt kein Protolysegleichgewicht mehr vor.
Da
neben
ihren
sehr
schwachen
korrespondierenden Partnern nur noch die sehr
starke Säure Hydroinumion bzw. die sehr starke
Base Hydroxidion vorliegen, erscheinen sehr
starke Protolyte jeweils gleichstark.
Ihre unterschiedlichen Stärken werden durch das
Wasser auf das Niveau der Hydronium- bzw.
Hydroxidionen nivelliert.
Daher besitzen gleichkonzentrierte Lösungen verschiedener sehr Starker Säuren bzw. Basen den
•
•
•
•
•
gleichen pH-Wert.
Die Wertigkeit einer Säure entspricht der Anzahl der Protonen, die sie abgeben kann.
Mehrwertige Säuren und Basen protolysieren stufenweise, wobei nur die erste Protolysestufe im
Protolysegleichgewicht eine Rolle spielt, da sich die Protolysekonstanten meist um etwa 5
Zehnerpotenzen unterscheiden.
Werden verschiedenstarke Protolyte gemischt, so bestimmt nur der stärkere Protolyt den pH-Wert.
Ionen liegen in Lösungen hydratisiert vor, an positive Kationen sind Wassermoleküle mit ihrem
negativen Ladungsschwerpunkt am Sauerstoffatom angelagert, wodurch diese stärker polarisiert
werden und leichter Protonen abgeben können.
Daher reagieren kleine, mehrfach positiv geladene, hydratisierte Metallkationen wie in einigen
Komplexen (z.B. [Fe(H2O)6]3+) als Säuren.
wässrige Lösungen
•
•
•
sehr starker Protolyte
pK ≤ -1,74
KS/B > 10
1,74
•
•
mol/l
Sehr starke Protolyte sind in
wässriger Lösung vollständig •
protolysiert.
•
starker Protolyte
-2 < pK < 2
10
−2
mol / l <
=
KS
K
S /B
c
< 10
•
2
mol / l
Diese Gleichung wird gelöst,
da
die
Näherung
c(H3O+)≪c0(HA) nicht gilt.
+
+
0 = c²(H3O )+KS*c(H3O )-KS*c0(HA)
•
c(H3O )
= c0(HA)
•
c(H3O )
•
c(OH-)
= c0(B)
•
K
⎛K ⎞
= − S + ⎜ S ⎟ + KS * c0 (HA)
2
⎝ 2⎠
c(OH-)
=−
pH
= -lg {c0(HA)}
pH
= -lg {c(H3O+)}
pOH
= -lg {c0(B)}
pOH
= -lg { c(OH-)}
•
•
•
+
pH
•
•
+
•
KS/B < 10-4 mol/l
•
Im
Protolysegleichgewicht
sind die Konzentrationen der
korrespondierenden SäureBase-Paare aufgrund der
stöchiometrischen
Verhältnisse gleich.
Es gilt c(H3O+) ≪ c0(HA)
•
c(HA)
= c0(HA) - c(A-)
pH
=
•
c 2 (H3 O + )
c 0 (HA) − c(H3 O + )
0
2
KB
⎛K ⎞
+ ⎜ B ⎟ + KB * c0 (B)
2
⎝ 2⎠
2
•
•
•
•
•
= 14 - pOH
mittelstarker bis sehr
schwacher Protolyte
pK > 4
c(H3O+) = c(A− ) = KS * c0 (HA)
pOH
1
(pK S − lg{c 0 (HA )})
2
1
= (pK B − lg{c 0 (B)})
2
c2(H3O+ )
c (H O+ )
≈ 2 3
+
c0(HA) − c(H3O ) c0(HA)
KS
=
pH
= 14 - pOH
Ampholyte
•
•
•
•
•
•
HB- + H2O ' H3O+ + B2HB- + H2O ' OH- + H2B
Ist die Differenz der pKS- und pKB-Werte dieser Stoffe gering, so liefern sie etwa gleich viele
Hydronium- und Hydroxidionen, welche miteinander zu Wasser reagieren und darum
vernachlässigbar wenig gegenüber den korrespondierenden Partnern der Ampholyte sind.
' H2B + B2Die bestimmende Reaktion ist denn seine Autoprotolyse
2 HB2Dies ist bei fast allen wichtigen Protolyten der Fall, so das gilt c(H2B) ≈ c(B ).
Ampholyte reagieren mit Wasser sowohl als Säure als auch als Base:
Aus c(H2B) =
c(H3O + ) * c(HB − )
K (HB − ) * c(HB − )
= c(B 2− ) = S
K S (H2B)
c(H3O + )
-
-
folgt c(H3O+ ) = K S (H2B) * K S (HB− )
.
-
pH = ½ (pKS(H2B) + pKS(HB )) = ½ [pKW + pKS(HB ) – pKB(HB ) ] = ½ (14 + pKS – pKB).
Protolysegrad
•
Der Protolysegrad gibt den Anteil der Säure oder Base, der bis zur Einstellung des Gleichgewichts,
mit Wasser reagiert hat, wieder.
•
•
Protolysegrad der Säure αS
HA + H2O ' H3O+ + AαS =
c(H3O + ) c( A − )
=
c 0 (HA) c 0 (HA)
•
•
Protolysegrad der Base αB
B + H2O ' HB+ + OHαB =
c(OH − ) c(HB + )
=
c 0 (B)
c 0 (B)
•
•
Sehr starke Protolyte reagieren mit Wasser vollständig, ihr Protolysegrad beträgt 1 (100%), der von
schwachen Protolyten ist sehr gering.
Der Protolysegrad ist vom pH-Wert der Lösung abhängig.
Ostwaldsches Verdünnungsgesetz
•
•
•
•
•
•
KS =
α s2
* c 0 (HA)
1 − αS
KB =
αB2
* c 0 (B)
1 − αB
Aus den Gleichungen geht hervor, das der Protolysegrad mit abnehmender Ausgangskozentration
der Protolyte, also zunehmender Verdünnung, steigt.
Protolysegrad und pH-Wert sind daher ungeeignet für die Charakterisierung der Stärke eines
Protolyten.
sehr starke Protolyte:
αS = 1
αS =
starke Protolyte:
mittelstarke bis schwache Protolyte: αS =
− K S + K S2 + 4K S * c 0 (HA)
2c 0 (HA)
KS
c 0 (HA )
KS = αS2 * c0(HA)
Puffersysteme
•
•
•
•
•
•
•
•
Setzt man einer Lösung einer mittelstarken Säure ihre korrespondierende Base zu, so wird ihr
Protolysegleichgewicht verändert.
Ein neues Gleichgewicht stellt sich, wofür Hydroniumionen verbraucht werden, weshalb der pHWert steigt.
Wird der Zusatz entsprechend gewählt, sind also die Konzentrationen der Säure und ihrer
korrespondierenden Base gleich, so entsteht eine Pufferlösung.
Werden dieser Pufferlösung Hydroniumionen zugesetzt, so regieren diese mit der
korrespondierenden Base zur korrespondierenden Säure und Wasser, bis sich das Gleichgewicht
wieder einstellt.
Zugeführte Hydroxidionen verbinden sich mit der korrespondierenden Säure zur
korrespondierenden Base und Wasser.
Beide Male sind die pH-Wertänderungen sehr gering.
Die korrespondierende Säure einer solchen Lösung wird als Puffersäure, die korrespondierende
Base als Pufferbase und beide zusammen als Puffersystem bezeichnet.
Für solche Puffersysteme gilt die Puffergleichung, auch Henderson-Hasselbach-Gleichung genannt:
KS =
•
•
•
•
•
•
•
•
•
•
•
•
•
c(H3O + ) * c( A − )
c(HA )
pH = pK S + lg
c( A − )
c(HA )
Der pH-Wert der Pufferlösung wird hochgradig durch den pKS-Wert der Puffersäure bestimmt.
Der pH-Wert der Pufferlösung bestimmt das Konzentrationsverhälnis von Puffersäure und
Pufferbase und ebenso umgekehrt.
Sind die Konzentrationen von Puffersäure und Pufferbase gleich, so gilt: pH = pKS.
Die graphische Darstellung der Puffergleichung wird als Pufferungskurve bezeichnet.
Am Wendepunkt der Pufferungskurve gilt pH = pKS und c(A-) = c(HA), hier ist die Steigung der
Kurve am kleinsten.
Die Steigung (und damit der pH-Wert) ändert sich selbst bei erheblicher Veränderung des
Verhältnisses c(A-):c(HA), nur wenig.
Unter der Pufferkapazität β versteht man die Stoffmenge eines einwertigen sehr starken Protolyten,
die ein Liter einer Pufferlösung neutralisieren kann, ohne dass sich der pH-Wert signifikant ändert.
Sie ist im Bereich des Wendepunktes der Pufferungskurve, bei pH = pKS, am größten.
Die Pufferkapazität steigt mit der Konzentration des Puffersystems.
Stark sauer bzw. basische Lösungen puffern ohne Zusatz.
Durch den Einsatz mehrerer Puffersysteme in einer Lösung bzw. mehrwertiger Puffersäure kann ein
breiter Pufferbereich erzielt werden.
Da der pH-Wert oft eine bestimmende Reaktionsbedingung und wichtig für die Stabilität eines
Systems ist, sind Pufferlösungen sehr bedeutend.
Biologische Systeme wie der Erdboden und das Blut sind durchgehend gepuffert.
Säure-Base-Titration
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
Die Maßanalyse (Volumetrie) ist ein klassisches Verfahren der quantitativen Analyse.
Ein genau gemessener Teil der Analyseprobe wird gelöst.
Diese Lösung heißt Analyselösung.
Sie enthält den zu bestimmenden Titranden.
Ein genau gemessenes Volumen der Analyselösung wird in ein Titriergefäß gebracht.
Diese wird dann so lange mit einer Maßlösung aus einer Bürette titriert, bis der Endpunkt
(Äquivalenzpunkt) der Reaktion erreicht ist.
Die Maßlösung enthält den Titrator.
Liegt dieser Analyse eine Säure-Base-Reaktion zu Grunde, so wird sie als Säure-Base-Titration
bzw. Neutralisationsanalyse bezeichnet.
Zur Ermittlung des Äquivalenzpunktes der Neutralisation wird der Lösung ein Säure-Base-Indikator
zugesetzt.
Reagieren bei einer Neutralisationstitration eine Säure und eine Base gleicher Wertigkeit, so gilt am
Äquivalenzpunkt n1 = n2, wenn n1 die Stoffmenge des Protolyten in der Analyselösung und n2 die
Stoffmenge des in der Maßlösung verbrauchten Protolyten ist.
Da n = c * V gilt auch c1 * V1 = c2 * V2.
c 2 * V2
Stoffmengenkonzentration des zu bestimmenden Protolyten: c1 =
V1
Stoffmenge des zu bestimmenden Protolyten:
n1 = c2 * V2.
M * c * V2
β1 = 1 2
Massekonzentration des zu bestimmenden Protolyten:
V1
Masse des zu bestimmenden Protolyten:
m1 = M1 * c2 * V2.
Oft werden Normallösungen als Maßlösungen verwendet.
Die Konzentration einer Normallösung wird als Stoffmengenkonzentration ihrer chemischen
Äquivalente angegeben.
Chemische Äquivalente sind stöchiometrisch einwertige Elementargruppen (also Moleküle, Ionen
oder Bruchteile dieser Teilchen).
Bezeichnet z die stöchiometrische Wertigkeit, dann ist der z-te Teil eines Moleküls oder Iones ein
chemisches Äquivalent.
Die Schwefelsäure ist zweiwertig (z=2). Ein chemisches Äquivalent entspricht demzufolge der
Elementargruppe ½ H2SO4. Die Stoffmengenkonzentration c(H2SO4) = 1 mol/l entspricht einer
Stoffmengenkonzentration an Schwefelsäureäquivalent von c(½ H2SO4) = 2 mol/l.
Für die Substanz A gilt: z * c(A) = c(1/z A)
Die Arbeit mit Normallösungen ist vorteilhaft, denn gleiche Volumina von Normallösungen gleicher
Stoffmengenkonzentration sind zu einander äquivalent.
Titrationskurven
•
•
•
•
•
•
•
•
•
Der Titrationsgrad τ für die Neutralisation, auch Neutralisationsgrad genannt, ist wie folgt definiert:
τ=
Stoffmenge des zugesetzten Titrantors
Stoffmenge des vorgelegten Titranden
Die Abhängigkeit des pH-Wertes vom Titrationsgrad wird in der Titrationskurve dargestellt.
Die Titrationskurve wird am Beispiel der Neutralisation von 100 ml der sehr starken Säure
Salzsäure (c=0,1 mol/l) durch die sehr starke Base Natronlauge (c=1 mol/l) ermittelt.
Vor Beginn des Zusatzes von Maßlösung hat die Salzsäure den pH-Wert 1.
Nach Zugabe von 9 ml Natronlauge sind 90% der anfangs vorhandenen Hydroniumionen
neutralisiert, der Titrationsgrad beträgt 90%.
Die Konzentration der Hydronium-Ionen beträgt nur noch ein Zehntel der Ausgangskonzentration,
also gilt pH = 2.
Ein Zusatz von 9,9 ml Natronlauge entspricht einem Titrationsgrad von 99% und einem pH-Wert
von 3, während ein Zusatz von 9,99 ml Natronlauge einem Titrationsgrad von 99,9% und einem pHWert von 4 entspricht.
Wurden 10 ml Natronlauge zugeführt, so ist der Äquivalenzpunkt erreicht.
Der Titrationsgrad beträgt 100% und der pH-Wert 7.
•
•
•
•
Werden nun weitere 0,1 ml Natronlauge zugegeben, so wird diese auf etwa das 10³-fache verdünnt,
der pH-Wert beträgt dann etwa 11.
Der Titrationsgrad steigt auf 101%.
Zu Beginn steigt der pH-Wert also langsam (die stark saure Lösung puffert), während am
Äquivalenzpunkt schon ein Tropfen Natronlauge einen großen pH-Sprung bewirkt.
Je schwächer Säuren oder Basen sind, desto geringer ist der pH-Sprung am Äquivalenzpunkt, bei
schwachen Protolyten ist er bereits nicht mehr messbar.
Säure-Base-Indikatoren
•
•
•
•
•
•
•
•
•
Säure-Base-Indikatoren sind organische Farbstoffe mit schwach saurem oder schwach basischem
Charakter, deren Säure eine andere Farbe hat als die korrespondierende Base.
In wässriger Lösung liegt die Indikatorsäure HIn als Protolysegleichgewicht vor:
HIn
+ H2O
Indikatorsäure
(z.B. rot)
' H3O+ +
InIndikatorbase
(z.B. gelb)
Die Farbe des Indikators durch das Verhältnis c(IN-):c(HIn) in der Lösung bestimmt.
c(In − )
pH = pK S (HIn) + lg
Es gilt die Puffergleichung:
c(HIn)
Bei Säurezusatz (Senkung des pH-Wertes)
verschiebt sich das Indikatorgleichgewicht
nach links, die Lösung hat die Farbe der
Indikatorsäure.
Bei Basezusatz (Erhöhung des pH-Wertes)
verschiebt sich das Indikatorgleichgewicht
nach rechts, die Lösung hat die Farbe der
Indikatorbase.
Bei pH = pKS(HIn) mit c(HIn) = c(In-) liegt
der Umschlagspunkt des Indikators.
Aufgrund
der
Ungenauigkeit
des
menschlichen Auges wird der Bereich pH =
pKS(HIn) ± 1 als Umschlagsbereich
verwendet.
Universalindikatoren sind Mischungen aus Indikatoren mit unterschiedlichen, sich überlappenden
Umschlagsbereichen.
Vergleich von Säure-Base-Reaktion mit Redoxreaktion
Säure-Base-Reaktion
Redoxreaktion
• Reaktion mit Protonenübergang
• Reaktion mit Elektronenübergang
• Das Proton ist das kleinste Kation und besitzt • Das Elektron ist das kleinste „Anion“ und besitzt
keinen Atomkern.
keine Atomhülle.
Aufgrund der geringen Größe und hohen Reaktionsfähigkeit existieren sowohl Elektronen als auch
Protonen nicht frei.
• Protonendonatoren sind Säuren.
• Elektronendonatoren sind Reduktionsmittel.
Protonenakzeptoren
sind
Basen.
•
• Elektronenakzeptoren sind Oxidationsmittel.
Es
sind
stets
zwei
korrespondierende
Säure• Es sind stets zwei korrespondierende
•
Redoxpaare an Reaktion beteiligt.
Base-Paare an Reaktion beteiligt.
Wertigkeit
eines
• Die Wertigkeit einer Säure/Base entspricht der • Die
Reduktionsmittels/Oxidationsmittels entspricht
Anzahl
von
Protonen
die
sie
der
Anzahl
von
Elektronen
die
es
abgeben/aufnehmen kann.
abgeben/aufnehmen kann.
1. korrespondierendes
1. korrespondierendes
' O1
S1
' B1 + H+
+ a eR1
Säure-Base-Paar
Redoxpaar
2. korrespondierendes
2 korrespondierendes
+
B2 + H
' S2
O2
+ b e- ' R2
Säure-Base-Paar
Redoxpaar
S1 + B2 ' S2 + B1 Säure-Base-Reaktion
b R1 + a O2 ' b O1 + a R2 Redoxreaktion
Es stellt sich ein chemisches Gleichgewicht ein.
• Die Einstellung des Redoxgleichgewichts ist oft
kinetisch gehemmt.
• Teilchen, die säure-base-amphoter sind, • Teilchen, die redoxamphoter sind, können
Elektronen sowohl aufnehmen als auch
können Protonen sowohl aufnehmen als auch
abgeben.
abgeben.
• Das sind Ampholyte.
• Das sind Teilchen, die Atome mittlerer
Oxidationszahlen enthalten.
• Die Stärke des Donator-Akzeptor-Verhaltens • Die Stärke des Donator-Akzeptor-Verhaltens
eines korrespondierenden Redoxpaares unter
eines korrespondierenden Säure-Base-Paares
Standardbedingungen
ist
durch
das
unter Standardbedingungen ist durch den
Säureexponenten pKS gekennzeichnet.
Standardpotential E⊖ gekennzeichnet.
Der elektrochemischen Spannungsreihe der korrespondierenden Redoxpaare entspricht die pKS-Reihe
der korrespondierenden Säure-Base-Paare.
Je kleiner die pKS- bzw. E⊖ Werte, desto größer die Donatortendenz.
Der Übergang von Protonen und Elektronen erfolgt unter Standardbedingungen stets von dem Teilchen
der größeren Donatortendenz zum Teilchen mit der größeren Akzeptortendenz.
• Die Gleichgewichtskonstante K einer Säure- • Für Redoxreaktionen gilt Analog:
Base-Reaktion kann aus den Säurekonstanten
der beiden am chemischen Gleichgewicht
beteiligten korrespondierenden Säure-BasePaaren berechnet werden.
• K = KS1 * 1/KS2
• pK = pKS1 – pKS2
• pK = (z/0,059 V) * (E⊖2 - E⊖1)
Das chemische Gleichgewicht liegt immer auf der Seite der schwächeren Protolyte bzw. der
schwächeren Reeduktions- und Oxidationsmittel.
Die Stärke der Donator-Akzeptor-Tendenz der korrespondierenden Partner ist auch abhängig vom
Konzentrationsverhältnis dieser Partner zu einander.
• Diese Abhängigkeit bestimmt sich mit der • Diese Abhängigkeit bestimmt sich mit der
Henderson-Hasselbach-Gleichung Gleichung
Nernstschen Gleichung bestimmen.
bestimmen.
• pH-Wert
• Redoxpotential E
• Säure-Base-Pufferung
• Redoxpufferung
pH-Farbindikatoren
•
• Redox-Farbindikatoren
Die
Säure-Base-Pufferungsund
• Die Redox-Pufferungskurve und die Redox•
Titrationskurve werden mit der Nernstschen
Neutralisationskurve
werden
mit
der
Gleichung bestimmt.
Henderson-Hasselbach-Gleichung bestimmt.
6. E-Chemie
Echte und potentielle Elektrolyte
•
•
•
•
•
•
•
•
•
•
•
Echte Elektrolyte sind in festem Zustand aus Ionen in einem Ionenkristall aufgebaut.
Stoffe, in deren Molekülen mindestens eine polare Atombindung vorhanden ist, können durch
chemische Reaktionen in Wasser hydratisierte Ionen bilden.
Molekülsubstanzen, bei denen erst durch chemische Reaktionen in Wasser Ionen entstehen, sind
potentielle Elektrolyte.
Solche chemische Reaktionen sind meist exotherm.
Die unter Einfluss eines Lösungsmittels stattfindende Bildung hydratisierter Ionen wird
elektrolytische Dissoziation genannt.
Starke Elektrolyte sind in wässriger Lösung vollständig in Ionen dissoziiert.
Starke Elektrolyte sind die meisten echten Elektrolyte und viele potentielle Elektrolyte wie HCl.
Schwache Elektrolyte sind potentielle Elektrolyte, die bei der Reaktion mit Wasser nur teilweise
dissoziieren, z.B. Essigsäure und Ammoniak.
Die Stärke eines Elektrolyts kann durch den Dissoziationsgrad α (auch Protolysegrad) bestimmt
werden.
Je mehr hydratisierte Ionen gelöst sind, desto höher ist die elektrische Leitfähigkeit der Lösung.
Die Wechselwirkungen zwischen hydratisierten Ionen und Wasserteilchen werden als Ionenreibung
bezeichnet.
elektrolytische Leitfähigkeit
•
•
•
•
•
•
Hydratisierte Ionen bewegen sich im Wasser ungerichtet.
Wirkt ein äußeres elektrisches Feld auf sie ein, so bewegen sie sich in Folge der Kraft F gerichtet.
F=q*E
F=z*e*U/I
Die positiven Kationen wandern zur negativ geladenen Katode.
Die negativen Anionen wandern zur positiv geladenen Anode.
Die Leitfähigkeit von Elektrolytlösungen und -Schmelzen kann genutzt werden zum Ionentransport
im elektrischen Feld, zur Stofftrennung und -Gewinnung bei technischen Prozessen und als
Grundlage verschiedener Analysemethoden.
Elektrochemische Doppelschicht und Potentialbildung
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
Die Kombination von einem elektronenleitenden Stoff, z.B. einem Metall, und einer Elektrolytlösung
nennt man elektrochemische Elektrode.
Diese Elektrode besteht aus einer metallischen Phase und einer Elektrolytlösungsphase. Zwischen
denen Übergänge von Ladungsträgern (Elektronen, Ionen) auftreten.
In der Elektrolytlösung bilden sich hydratisierte Metallionen.
Für die Kupfer/Kupfer(II)-Ionen-Elektrode gilt die Redoxreaktion: Cu(s) ' Cu2+(aq) + 2 eSie erhält das Symbol Cu/Cu2+.
Taucht ein Metallstab in eine Metallsalzlösung ein, so findet an der eingetauchten Oberfläche eine
chemische Reaktion statt, bei der positive Metallkationen gebildet werden.
Die dabei frei werdenden Elektronen bleiben im Metallstab zurück, weshalb sich die Lösung
gegenüber dem Stab positiv auflädt.
Aufgrund der Ladungstrennung zwischen Metall und Elektrolyt bildet sich eine elektrische
Potentialdifferenz aus, die Elektrodenpotential genannt wird.
Sie ist umso größer, je mehr sich hydratisierte Metallionen an der Phasengrenze bilden.
Dadurch entstehen elektrostatische Anziehungskräfte, die einen Teil der hydratisierten Ionen an der
Phasengrenze der Elektrode festhalten.
Es entsteht eine elektrochemische
Doppelschicht
und
ein
elektrochemisches Gleichgewicht stellt
sich ein.
Dieses Gleichgewicht ist durch vier
Merkmale gekennzeichnet:
1. Die Bildung hydratisierter Ionen
(Hinreaktion) und die Bildung von
Metallionen
(Rückreaktion)
verlaufen
mit
gleicher
Geschwindigkeit.
2. Der Übertritt geladener Teilchen und
damit der elektrische Strom ist in
beiden Richtungen gleich.
3. Die Ladungstrennung bei der
Bildung hydratisierter Ionen führt zu
einer elektrischen Potentialdifferenz.
4. Wegen
dieser
elektrischen
Potentialdifferenz bildet sich eine
elektrochemische
Doppelschicht
aus.
Die Potentialdifferenz zwischen metallischer Phase und Elektrolytlösung ist nicht direkt messbar,
Vergleiche zweier Elektrodenpotentiale sind aber möglich, indem man beide miteinander kombiniert
und die zwischen ihnen auftretende elektrische Spannung misst.
Kombinationen von Elektroden heißen galvanisches Element, galvanische Zelle oder – Kette,
einzelne Elektroden werden darum auch als Halbelement, Halbzelle oder Halbkette bezeichnet.
Abhängigkeit des Elektrodenpontentials von
Temperatur
Konzentration
Art des Metalls
Ebenso wie die chemischen
• Je unedler das Metall, desto
Gleichgewichte werden auch
stärker ist seine Tendenz zur
die
elektrochemischen
Gleichgewichte durch die
Temperatur bestimmt.
•
Je höher die Temperatur, •
desto
größer
das
Elektrodenpotential.
Je größer die Konzentration •
der Elektrolytlösung, desto
größer
das
Elektrodenpotential
Bildung hydratisierter Ionen,
desto mehr
hydratisierte
Ionen bilden sich bis zur
Einstellung
des
Gleichgewichts.
Je unedler das Metall, desto
größer
das
Elektrodenpotential..
elektrochemische Spannungsreihe
•
•
•
•
•
•
•
•
•
•
Um die Potentialdifferenz zwischen einer
metallischen Phase und einer Elektrolytlösung
messen zu können muss die Metall/MetallionenElektrode immer mit einer Bezugselektrode
kombiniert werden.
Als
Bezugselektrode
wird
die
Standardwasserstoffelektrode verwendet.
Sie besteht aus einem Platinblech, das von
Wasserstoff umspült wird und sich in einer
Säurelösung der Konzentration c = 1 mol/l als
Elektrolytlösung befindet.
Der Druck des Wasserstoffs beträgt 101,3 kPa,
also Standarddruck.
Unter
diesen
Bedingungen
ist
das
Elektrodepotential
der
StandardWasserstoffelektrode auf E⊖ (H2/2 H3O+) = 0,00 V
bei allen Temperaturen festgelegt.
Die bei einer Temperatur von T = 298 K gegen die Standard-Wasserstoffelektrode gemessenen
Elektrodenpotentiale elektrochemischer Elektroden werden als Standard-Elektrodenpotentiale E⊖
bezeichnet.
Um diese zu ermitteln, wird die Standard-Wasserstoffelektrode mit den jeweiligen Elektroden
kombiniert und die Zellspannung zwischen ihnen gemessen.
Man bezeichnet das Standard-Elektrodenpotential auch
Metall ' MetallIonz+ + z eals Redoxpotential der zugehörigen Redoxreaktion:
Red ' Ox
+ z eDurch das Standard-Elektrodenpotential können Zellspannungen zwischen zwei Elektroden
berechnet und der Ablauf von Redoxreaktionen bestimmt werden.
Die Anordnung der Metall/Metallionen-Elektroden in der Reihenfolge ihrer Standardpotentiale wird
als elektrochemische Spannungsreihe bezeichnet.
Nernstsche Gleichung
•
Um das Redoxpotential E berechnen zu können, wenn die Bedingungen von den
Standardbedingungen abweichen (z.B. c ≠ 1 mol/l), wurde die Nernstsche Gleichung entwickelt:
Metall ' MetallIonz+
Red ' Ox
•
+ z e+ z e-
Unter Standardbedingungen ergibt sich
E = EΘ +
R*T
c(Ox )
* ln
z*F
c(Re d)
E = EΘ +
0,059V
* lg{c(Ox z+ )}
z
F
= Faraday-Konstante
= 9,648 53 * 104 As/mol
.
•
•
Die Nernstsche Gleichung gilt nur für stark verdünnte Lösungen, bei denen angenommen wird,
dass keine Wechselwirkungen zwischen den Ionen stattfinden.
Die Spannung galvanischer Zelle ΔE berechnet sich nach ΔE = E1 – E2.
•
Für Konzentrationszellen gilt die vereinfachte Gleichung:
ΔE =
c
0,059 V
* lg 1
2
c2
elektrochemische Reaktionen
•
•
Unter elektrochemischen Reaktionen versteht man Redoxreaktionen an einer Phasengrenze, bei
denen ein Ladungstransport über die Phasengrenze erfolgt.
Bei Reaktionen verdünnter Säuren mit unedlen Metallen bildet sich Wasserstoff, da unedle Metalle
ein kleineres Standardpotential als das System H2/H3O+ haben.
elektrochemische Fällung von Metallen
•
•
•
Die Tendenz eines Metalls, Ionen zu bilden, ist umso größer, je kleiner das Standardpotential der
zugehörigen Metall/Metallionen-Elektrode ist.
Taucht man ein Metall mit einem niedrigen Standardpotential in eine Elektrolytlösung, die
Metallionen eines Metalls mit hohem Standardpotentials enthält, so findet eine Redoxreaktion statt,
in derem Verlauf sich aus dem Metall niedrigen Standardpotentials Ionen bilden, die in Lösung
gehen (Oxidation), während Ionen des anderen Metalls aus der Lösung zu Metallatomen reduziert
werden.
Zn(s)
Cu2+(aq)
Zn(s)
+
+
-
2e
Cu2+(aq)
' Zn2+(aq)
' Cu(s)
' Zn2+(aq)
+
2 e-
+
Cu(s)
Oxidation
Reduktion
Redoxreaktion
Im umgekehrten Fall findet keine Reaktion statt.
technische Anwendung
galvanische Elemente
•
•
•
In galvanischen Elementen wird chemische Energie in nutzbare elektrische Energie umgewandelt.
Galvanische Elemente, bei denen nur die Umwandlung chemischer Energie in elektrische technisch
nutzbar ist, also Zellen, die nur so lange einsetzbar sind, bis die notwendigen Ausgangsstoffe
(Reduktions- und Oxidationsmittel) umgesetzt sind, heißen Primärelemente.
Können galvanische Elemente durch Zufuhr elektrischer Energie wieder in den Ausgangszustand
zurückversetzt werden, so handelt es sich um Sekundärelemente bzw. Akkumulatoren.
Primärelemente
•
•
•
•
•
•
•
Eines der ersten technisch brauchbaren Elemente war das Daniell-Element.
Es besteht aus einer Kupfer/Kupfer(II)-Ionen-Elektrode und einer Zink-Zink-Ionen-Elektrode.
Durch die Oxidation von Zink und die Reduktion von Kupfer erhält man eine Standard-Zellspannung
von ΔE⊖ = +1,1 V.
Zn(s)
Cu2+(aq)
Zn(s)
+
+
-
2e
Cu2+(aq)
' Zn2+(aq)
' Cu(s)
' Zn2+(aq)
+
2 e-
+
Cu(s)
Oxidation
Anode
Reduktion
Katode
Redoxreaktion
Das einfache Zink-Kohle-Element besteht aus einer Zinkelektrode
und einer Kohleelektrode mit 20%iger Ammoniumchloridlösung (mit
Stärke angedickt) als Elektrolyt.
Die Zellspannung beträgt U = 1 V.
Um den Wiederstand der Zelle, der durch Wasserstoffbildung an der
Katode entsteht, zu senken, wird diese nach Leclanché von einem
Gemisch aus Mangan(IV)-Oxid (Braunstein) und Graphit umgeben.
Dadurch wird die Zellspannung sogar auf U = 1,5 V erhöht.
+
•
•
•
•
•
Zn(s)
2 H3O+(aq)
Zn(s)
+
+
-
2e
2 H3O+(aq)
' Zn2+(aq)
' H2(g)
' Zn2+(aq)
+
+
+
2 e2 H2O
H2(g)
+
Oxidation
Anode
Reduktion
Katode
2 H2O Redoxreaktion
Die Alkali-Mangan-Zelle ist eine Weiterentwicklung des LeclanchéElements.
Es wird Zinkpulver mit einer großen Oberfläche als Elektrode und
Kalilauge als Elektrolytlösung verwendet.
Die Zelle ist bis –60°C einsetzbar.
Früher wurde die Zinkoberfläche mit Quecksilber aktiviert.
In der Zink-Luft-Zelle wird anstatt von Mangan(IV)-Oxid Luftsauerstoff
als Oxidationsmittel verwendet.
Zn(s)
½ O2(q)
+ H2O(l)
-
+ 2e
' Zn2+(aq) + 2 e' 2 OH-(aq)
Oxidation
Reduktion
Zink-Luft-Zelle
Quecksilberoxid-Zelle
•
•
•
•
•
•
•
In der Quecksilberoxid- und Silberoxid-Zelle dienen Quecksilberoxid bzw. Silberoxid als
Oxidationsmittel, während Kalilauge als Elektrolyt verwendet wird.
Zn(s)
HgO(s)
Ag2O(s)
+ H2O(l)
+ H2O(l)
-
+2e
+ 2 e-
' Zn2+(aq)
' Hg(l)
' 2 Ag(s)
+ 2 e+ 2 OH-(aq)
+ 2 OH-(aq)
Oxidation
Reduktion
Reduktion
Anode
Katode
Katode
+ Bzw.
+
Lithium-Zellen verwenden Lithium als Anode, weshalb besonders hohe Spannung von bis zu 4 V
erreicht werden können.
Im
Gegensatz
zu
allen
bisher
genannten
Primärelementen ist bei Brennstoffzellen der Vorrat an
Oxidations- und Reduktionsmitteln nicht begrenzt, sie
werden kontinuierlich zugeführt.
Die einfachste Brennstoffzelle ist die WasserstoffSauerstoff-Zelle, bei der die Oxidation des Wasserstoffs
und die Reduktion des Sauerstoffs räumlich getrennt
stattfinden.
Mit Kaliumhydroxidlösung als Elektrolytlösung kann eine
Zellspannung von U = 1,23 V erreicht werden.
Der Wirkungsgrad von Brennstoffzellen ist wesentlich
höher als der von anderen Primärzelle und die
Oxidationsprodukte schädigen die Umwelt nicht.
Es müssen jedoch stets Brennstoff und Sauerstoff
kontinuierlich
zur
Verfügung
stehen
und
die
Reaktionsprodukte aus dem Elektrolyten entfernt werden
sowie ein bestimmter Temperaturbereich eingehalten
werden.
Sekundärelemente
•
•
•
•
Das am häufigsten eingesetzt Sekundärelement ist der Bleiakkumulator oder Bleisammler.
Im geladenen Zustand besteht die Oberfläche der einen Elektrode aus Blei, die andere aus Blei(IV)Oxid.
Um eine große Oberfläche zu erzielen sind die an den Elektroden wirksamen Stoffe sind feinkörnig
und es werden viele Elektrodenplatten eingesetzt.
Als Elektrolytlösung dient 32%ige Schwefelsäure, die bei dieser Konzentration ihr
•
•
•
•
•
•
•
•
Leitfähigkeitsmaximum hat.
Beim Entladen des Akkus laufen folgende Reaktionen ab.
Pb(s) + SO42-(aq)
' PbSO4(s) + 2 e(s)
+
2PbO2 + 4 H3O (aq) + SO4 (aq) + 2 e ' PbSO4(s) + 6 H2O
Anode
Katode
Oxidation
Reduktion
' PbO2(s) + 4 H3O+(aq) + SO42-(aq) + 2 e- Anode
' PbO2(s) + 4 H3O+(aq) + SO42-(aq) + 2 e- Katode
Reduktion
Oxidation
Diese Prozesse liefern eine Zellspannung von 2 V.
Beim Laden laufen folgende Reaktionen ab:
PbSO4(s) + 6 H2O
PbSO4(s) + 2 eInsgesamt ergibt sich:
PbO2(s) + Pb(s) + 4 H3O+(aq) + 2 SO42-(aq)
' 2 PbSO4(s) + 6 H2O(l)
Die Konzentration der Schwefelsäure ist im entladenen Zustand
geringer, daher sinkt auch die Dichte des Elektrolyts.
Nickel-Cadmium-Akkumulatoren erreichen eine Zellspannung von U
= 1,35 V.
Es laufen folgende Reaktionen ab:
Cd
2 NiO(OH)
Cd
' Cd(OH)2
+ 2 e ' 2 Ni(OH)2
+ H2O ' 2 Ni(OH)2
+ 2 OH+ H2O
+ 2 NiO(OH)
-
+ 2 e+ 2 OH
+
+ Cd(OH)2
elektrochemische Korrosion
•
•
•
•
•
•
•
•
•
•
•
•
Wird ein metallischer Werkstoff durch elektrochemische Reaktionen von seiner Oberflächer her
zerstört, so spricht man von Korrosion.
Hauptursache für elektrochemische Korrosion ist die Bildung galvanischer Elemente, sogenannter
Lokalelemente.
Es gibt drei Arten galvanischer Elemente: Daniell-Element (Elektroden verschiedenen Materials in
verschiedenen Elektrolyten), das Konzentrationselement (unterschiedliche Konzentrationen) und
das Temperaturelement (unterschiedliche Temperaturen).
Am häufigsten sind sogenannte Daniell-Elemente.
Korrosion tritt nur auf, wenn auf der betreffenden Metalloberfläche eine Elektrolytlösung vorhanden
ist, welche sich durch Luftfeuchtigkeit bilden kann.
Da Zinn ein relativ hohes Standardpotential E⊖ (Sn/Sn2+) = 0,14 V hat und von Lebensmitteln nicht
angegriffen wird, ist es als Überzug für Gefäße geeignet.
Wird die Zinkschicht jedoch beschädigt, kommt es zu Korrosion, da Eisen ein niedrigeres
Standardpotential hat und eine Anode bildet.
Fe(s)
4 Fe2+(aq) + 18 H2O(l)
2 H3O+(aq) + 2 e-
+ O2(g)
' Fe2+(aq)
+ 2 e' 4 Fe(OH)3(s) + 8 H3O+(aq)
' H2(g)
+ 2 H2O(l)
Anode
Katode
Oxidation
Folgereaktion
Reduktion
Zink bildet eine dichte, gut schützende Oxidschicht und darum als Überzug von Stahlbauteilen
einen langen Schutz gegen Luft- und Wassereinwirkung.
Wird diese beschädigt, so kommt es nur langsam zu Korrosion, da Zink ein niedrigeres
Standardpotential als Eisen hat, welches im Lokalelement die Katode bildet.
Zn(s)
2 H3O+(aq)
Zn2+(aq)
+
+
' Zn2+(aq)
' H2(g)
' Zn(s)
-
2e
2 e-
+ 2 e+ 2 H2O
Anode
Katode
eventl.
Oxidation
Reduktion
Reduktion
Eisenwerkstoffe unterliegen ungeschützt relativ stark der Korrosion, dem sogenannten Rosten.
Ursache ist die Bildung von Wasserinseln und Lokalelementen auf der Oberfläche.
Durch chemische Reaktion des Eisens mit dem gelösten Luftsauerstoff sinkt dessen Konzentration
in der Mitte der Wasserinsel, weshalb ein lokales Konzentrationselement entsteht.
Fe(s)
½ O2(g)
2 H3O+
Fe2+(aq)
-
+ H2O(l)
+2e
+ 2 e+ 2 OH-(aq)
'
'
'
'
Fe2+(aq)
2 OH-(aq)
H2 (g)
Fe(OH)2(s)
+ 2 e+ 2 H2O(l)
Anode
Oxidation
Katode Reduktion
…wenn H3O+ da
2 Fe(OH)2
' 2 FeO(OH)(s)
+ ½ O2(g)
+ H2O(l)
= Rost
Oxidation
Korrosionsschutz
1. Einsatz korrosionsbeständiger bzw. korrosionsarmer Metalle oder Kunststoffe und Keramik die nicht
der Korrosion unterliegen.
2. Anbringen von nichtleidenden Lack- und Bitumenschichten zum Schutz der Phasengrenze zweier
unterschiedlicher Metalle vor äußeren Einflüssen.
3. Aufbringen von Korrosionsschutzschichten vor und während der Montage.
4. Vermeiden von Konstruktionen mit Stellen, wo sich Wasser sammeln kann.
• Korrosionsschutzschichten sind oft Anstriche oder Metallüberzüge (aufgedampft, aufgespritz, durch
galvanische Vorgänge).
• Einige Metalle (z.B. Aluminium) bilden dichte Oxidschichten aus, die weitere Korrosion verhindern.
• Dies kann auf chemischem Wege (Eloxieren) forciert werden.
• Aufbringen von Phosphatschichten (Phosphatierung).
• Ausbessern kleinerer Rostschäden durch Rostumwandler.
• Emailieren der Oberfläche.
• Elektrochemischer Schutz durch Verwendung von Opferanoden aus unedlen Metallen.
7. Organik
Ermittlung der Struktur und Zusammensetzung organischer Stoffe
Strukturmerkmale organischer Stoffe
sp3- sp2- sp-Hybridisierung der Kohlenstoffatome LB. S.36 ff.
Funktionelle Gruppen
Funktionelle Gruppe
Hydroxylgruppe
Formel
-OH
Aldehydgruppe
-CHO
Carboxylgruppe
-COOH
Ketogruppe
Aminogruppe
Peptidbindung
Esterbindung
Ether
-CO-NH2
-CO-NHR-CO-O-R
R-O-R
Nachweis
Reaktion mit Na unter Wasserstoffbildung, Bildung
charakteristischer Ester, Borsäuremethylester brennt grün
(Nachweis von Methanol)
reduzierende Wirkung, Nachweis mit Fehlingscher Lsg.
Ammoniakalischer Silbernitratlösung (Tollens Reagenz) und
Fuchsinschweflige Säure
Protolyse in Wasser, Nachweis der Hydroniumionen mit
Säure-Base-Indikatoren, Reaktion mit unedlen Metallen
unter Wasserstoffbildung, bildet mit Alkoholen Ester
charakteristisch riechender Art
Nachweis des Ammoniaks (Unitest blau) nach Erhitzen
Nachweis von C, H, O, N, S, Halogenen in organischen Stoffen
•
Oxidieren :
•
Ehitzen :
C über CO2 (Ba(OH)2)
H Über H2O (Cobaltchlorid) (blau nach rosa)
Erhitzen unter Luftabschluss mit Mg, Nachweis des MgO mit Wasser und Unitest
(blau)
N über Ammoniak, färbt feuchtes Unitestpapier blau
S über Beiacetat, bildet schwarzes Bleisulfid (Sulfidnachweis)
Bestimmung der qualitativen Zusammensetzung:
•
•
•
Verhältnisformel nach Liebig LB. S.86
Bestimmung der molaren Masse leicht flüchtiger Stoffe Dampfvolumenbestimmung ab S.88
experimentelle Bestimmung der chemisch :
funktionelle Gruppen
Strukturmerkmale
Mehrfachbindung
Physikalisch : Chromatographie
Massenspektrometrie
IR Spektroskopie
NMR Spektroskopie
Aromaten
•
•
Hückelregel
Benzen
•
Phenol
•
•
mehrkernige Aromaten
Heterocyclen
Aromat = 4n + 2 π-Elektronen
Vorkommen, Eigenschaften, Verwendung
Mesomerie
Derivate Styrol C6H5-CH=CH
Toluol C6H5-CH3
Benzylakohol C6H5-CH2-OH
Benzaldehyd C6H5-CHO
Benzoesäure C6H5-COOH
o-, m-, p-Xylol
Vorkommen, Eigenschaften, Verwendung, Säurecharakter, I- und MEffekte
z. B. Anthracen, Naphthalin
also mit z. B. Stickstoff im Ringsystem
typische organische Reaktionen
•
•
•
•
•
•
radikalische
Substitution
radikalische Addition
und Polymerisation
elektrophile
Substitution
nucleophile
Substitution
elektrophile Addition
Eliminierungen
Bromierung von Hexan und Toluol
Kettenstart (z. B. durch organisches Peroxid R-O-O-R)
Kettenfortpflanzung
Kettenabbruch
Bromierung und Nitrierung von Benzol
Bildung des Bromkation ( durch Katalysator {AlCl3} )
Anlagerung an den Aromat (elektrophil)
π-Komplex, σ-Komplex, π-Komplex
Abgabe eines Protons
SN1, SN2
LB.S. 113, stereochemische Konsequenzen
Verseifung, Veresterung, Polykondensation
Enantiomer, asymmetrisches (chirales) C-Atom, Racemat
Bromierung von Ethen S.118
LB. S. 116
Ionische Eliminierungen, monomolekulare (E1) und bimolekulare (E2)
Eliminierungen
HOFFMANN und SAITZEW-Produkt
8. Makromolekulare Stoffe
Kunststoffe
•
•
•
Polymerisate
Polykondensate
Polyaddukte
PE, PVC, PP, PS usw.
Polyester, Polyamide, Phenoplaste, Aminoplaste
PUR Polyaddition
Zusammensetzung, Struktur und Eigenschaften von Duroplasten, Thermoplasten und
Elasten
LB. S. 166
Kunststoffrecycling
•
Gelbe Tonne, Grüner Punkt usw.
Kohlenhydrate
•
•
•
•
•
Ketosen, Aldosen
Bau, Eigenschaften, Struktur von Monosacchariden, Disacchariden und Polysacchariden
Glykosidische Bindung wirkt reduzierend, siehe Nachweise
Nachweise Glukose, Fruktose, mit Fehling (ziegelroter Niederschlag) und Ammoniakalischer
Maltose
Silbernitratlösung (Silberspiegel)
Fruktose
Seliwanoff-Reaktion: Erwärmen mit Resorzin und Salzsäure =
Rotfärbung
Stärke
Iod-Kaliumiodid-Lösung
(Lugolsche
Lösung)
blau
bis
dunkelschwarz
Zellulose
Chlor-Zink-Iod-Lösung braun
Chiralität
Darstellung in Fischerprojektion
Eiweiße
•
Basizität der Amine
•
Aminosäuren
•
•
•
Chiralität
Peptidbindung
Proteine
•
Nachweise
•
Hydrolyse
•
Chromatographie
Amine (Stoffe mit Aminogruppe reagieren basisch NH2-R + H2O _ NH3+-R +
OH-)
wichtige Beispiele, Struktur, Eigenschaften
Aminosäuren sind säure-base-amphoter (haben ja zusätzlich die
Carboxylgruppe)
Isoelektrischer Punkt: pH-Wert, an dem die max. Konzentration an
Zwitterionen vorliegt
Zwitterion: Aminogruppe positiv und Carboxylgruppe negativ geladen, durch
die positive und gleichzeitig
negative Ladung in einem Molekül starke Anziehungskräfte elektrostatischer
Art also hohe Schmelz- und Siedetemperatur
Nachweis mit Ninhydrinlösung (färbt sich blauviolett) S. 154
-CO-NHPrimärstruktur
Sekundärstruktur
AS-Sequenz
Faltblatt, Helix, Stabilisierung durch innermolekulare
Wasserstoffbrücken zwischen -CO- und -NHTertiärstruktur
vollst.
Räumliche
Anordnung
des
Proteins,
Stabilisierung durch Wasserstoffbrücken aber wichtiger
Disulfidbrücken -S-S- zwischen Ketten und Faltblättern
Quartärstruktur
Räumliche zusammenstzung eines Toffes aus zwei
oder mehr Proteinen
Xanthoproteinreaktion Eiweiß + konz. Salpetersäure = gelb
Biuretreaktion
Eiweiß + verdünnte KOH + Kupfersulfatlösung = lila
Abbau, meist enzymatisch, Aufspaltung der Peptidbindung unter
Wasseranlagerung
Trennung eines AS-Gemischs durch untersch. Laufgeschwindigkeit mit
bekannten AS als Vergleich zum Identifizieren, Sichtbarmachen mit
Ninhydrin (blauviolett)
Fette
•
Ester aus Glycerin und Fettsäuren (langkettige Carbonsäuren)
•
•
•
gesättigte und ungesättigte Fettsäuren; Nachweis der Mehrfachbindungen mit Bromwasser
Iodzahl gibt Gehalt an Mehrfachbindungen an
Fette sind die Naturstoffe, die die größte Energiemenge in kleinstem Volumen speichern
•
•
•
•
•
•
•
•
•
•
•
Kohlenstoff
C
Wasserstoff
H
Sauerstoff
O
•
Stickstoff
N
•
1.
Schwefel
S
2.
•
•
•
Halogen
F, Cl, Br, I, Ar
1.
Hydroxylgruppe
-OH
2.
Aldehydruppe
-C=O
└H
Carboxylgruppen
-C=O
└OH
1.
2.
1.
2.
•
Mehrfachbindungen
C=C
1.
Reduzierende
Zucker
Glucose
C6H12O6
Fructose
C6H12O6
Cellulose
n * D-Glucose
Stärke
Amylose und
Amylopektin
Amminosäuren
2.
•
•
•
•
•
•
•
•
•
Oxidieren des organischen Stoffes mit Kupfer(II)-oxid (CuO)
Entweichendes Gas in Bariumhydroxidlösung (BaOH) einleiten
Weißer Niederschlag
Oxidieren des organischen Stoffes mit Kupfer(II)-oxid (CuO)
Kondensat mit Cobalt(II)-chlorid-papier (CoCl2) prüfen
Blaue Farbe, wird blassrosa
Organischen Stoff mit Magnesium mischen
Unter Luftabschluss erhitzen
Mit Universalindikator (Unitest) prüfen
Blaufärbung
Umsetzen des organischen Stoffes mit konzentrierter
Natriumhydroxidlösung (NaOH)
Entstehendes Gas (Ammoniak) mit feuchtem Universalindikatorpapier
prüfen
Blaufärbung
• Zersetzen des organischen Stoffes durch erhitzen
• Entstehendes Gas (Sulfid-Ion) mit Bleiacetatpapier prüfen
• Schwarzfärbung
• Umsetzen des organischen Stoffes mit Kaliumnitrat
• Entstehende Sufationen mit Bariumchloridlösung nachweisen
• Weißer Niederschlag
Zersetzen des organischen Stoffes in Anwesenheit eines
Kupferdrahtes
Kupfer(II)-halogenid entsteht (CuX2)
Grünfärbung, wenn Kupfer(II)-halogenid in Flamme gehalten wird
• Alkohole enthalten Hydroxylgruppen im Molekül
• Durch Reaktion mit Säuren entstehen Ester mit charakteristischen
Eigenschaften
• Alkohole bilden mit Borsäure Ester
• Diese zeigen bei der Verbrennung einen grünen Flammensaum
• Ist der Alkohol Mathanol, so ist die Flamme durchgängig grün
• den Stoff mit fuchsinschwefliger Säure mischen
• violette Färbung
• Aldehyde haben reduzierende Eigenschaften
• Mit ammoniakalischer Silbernitratlösung mischen
• Metallisches Silber wird ausgefällt
• Niedrigmolekulare Alkansäuren bilden mit niedrigmolekularen
Alkoholen charakteristische Ester
• Carboxylgruppen haben saure Wirkung
• Universalindikator wird daher rot gefärbt
Stoffe mit Mehrfachbindungen addieren Brom
•
•
•
•
•
Stoff mit Tollens Reagenz mischen
Farbänderung
Lösung der Substanz zu Fehlingscher Lösung geben
Bis nahe zum Sieden erhitzen
ziegelrote Färbung
Schiffs Reagenz mit Stoff mischen
Seliwanoff-Reaktion:
Stoff in Lösung mit Salzsäure und Resorcinkristallen mischen
Farbänderung
Stoff mit Chlor-Zink-Iod-Lösung mischen
Blau-lilane bis schwarz-braune Färbung
Stärke mit Iodkaliumioditlösung mischen
Blaue bis braune Färbung
Ninhydrinreagens mit Methanol uns Stoff mischen
Nachweise
Ag+
Pb2+
Cu2+
Sn2+
Fe3+
Fe2+
Co2+
Ni2+
Zn2+
Mn2+
Al3+
Cr3+
Mg2+
Ca2+
Sr2+
Ba2+
Li+
Na+
K+
-OH
-CHO
-COOH
-CO-NH2
-CO-NHR-CO-O-R
R-O-R
CO2
H2O
O2
NH3
N
S
Glucose
Fructose
Maltose
Sacharose
Cellulose
Stärke
Proteine
+ Na2S ' Ag2S ↓
+ Na2S ' PbS ↓
+ Na2S ' CuS ↓
+ Na2S ' SnS ↓
+ Na2S ' FeS ↓
+ NaOH ' Ag2O ↓
+ NaOH ' Pb(OH)2 ↓
+ NaOH ' Cu(OH)2 ↓
+ NaOH ' Sn(OH)2 ↓
+ NaOH ' Fe(OH)3 ↓
+ Cl- ' AgCl ↓
+ Cl- ' PbCl2 ↓
+ NH3 ' [Cu(NH3)4]2+
+ K4[Fe(CN)6] '
KFe[Fe(CN)6] ↓
wie Fe3+, aber erst nach + H2O2
+ KSCN ' Fe(SCN)3
+ NaOH ' Fe(OH)2 ↓
+ Na2S ' FeS ↓
+ NaOH ' Co(OH)2 ↓
+ CH2COOH + KCl + NaNO2 ' K3[Co(NO2)6] ↓
+ Na2S ' CoS ↓
+ Na2S ' NiS ↓
+ NaOH ' Ni(OH)2 ↓ + NH3 + Diacetyldioxim ↓ + NH3 (Komplexlösung)
+ Na2S ' ZnS ↓
+ NaOH ' Zn(OH)2 ↓ ZnS/Zn(OH)2 erhitzen → gelb (kalt: weiß)
+ Na2S ' MnS ↓ + NaOH ' Mn(OH)2 ↓ + 6fache Menge KNO3 + K2CO3 schmelzen
22+ NaOH ' Al(OH)3 ↓ + verdünnte Co(NO3) /CoCl Lsg., glühend in Flammensaum
+ NaOH ' Cr(OH)3 ↓ + 2fache Menge KNO3 + K2CO3 schmelzen
+ NaOH ' Mg(OH)2 ↓ + (Na2HPO4 + NH4Cl + NH3) Lösung ' weiß, feinkristallin
in Flamme
+ NaOH ' Ca(OH)2
+ SrSO3 ↓
+ BaSO4 ↓
in Flamme
+ NaOH ' Sr(OH)2
+ SrSO3 ↓
+ BaSO4 ↓
in Flamme
+ NaOH ' Ba(OH)2
+ SrSO3 ↓
+ BaSO4 ↓
in Flamme
in Flamme
in Flamme
+ Na ' H2
+ Borsäuremethylester in Flamme
charakteristische Esther
+ Fehling + heiß
ammoniakalische Silbernitratlösung
fuchsinschweflige Säure
+ Unitest
+ unedles Metall ' H2
+ Alkohol ' Ester
Erhitzen + Unitest
+ Ba(OH)2 ↓
+ Cobaltchlorid
mit Mg unter Luftabschluß erhitzen + H2O + Unitest
Unitest
über NH3
über Bleiacetat ' PbS ↓
Fehling + heiß
ammoniakalische Silbernitratlösung
Fehling + heiß
ammoniakalische Silbernitratlösung
Fehling + heiß
ammoniakalische Silbernitratlösung
siehe Glucose
+ Chlor-Zink-Iod-Lösung
+ Iod-Kaliumioditlösung
+ konz. H2SO4
+ verdünnte. KOH + Kupfersulfatlsg.
Resorcin + Salzsäure + heiß
file:///E:/stuff/Homepage/TU%20Chemnitz/uni/anderes/chem/nachw.htm
Nachweise
Ag+
Na2S → Ag2S ↓
NaOH → Ag2O ↓
Cl- → AgCl ↓
verdünnte Co(NO3)2-/CoCl2- Lsg., glühend im
Al3+
NaOH → Al(OH)3 ↓
Ba2+
in Flamme
NaOH → Ba(OH)2
SrSO3 ↓
BaSO4 ↓
Ca2+
in Flamme
NaOH → Ca(OH)2
SrSO3 ↓
BaSO4 ↓
Flammensaum
Cellulose
Chlor-Zink-Iod-Lösung
-CHO
fuchsinschweflige Säure
Co2+
Na2S → CoS ↓
CO2
Ba(OH)2-Lsg. ↓
-COOH
Cr3+
Fehlingsche Lsg. (erhitzt)
NaOH → Co(OH)2 ↓
unedles Metall → H2 ↑
Unitest
NaOH → Cr(OH)3 ↓
ammoniakalische Silbernitratlösung
CH2COOH + KCL + NaNO2 → K3[Co(NO2)6] ↓
Alkohol → Ester
zweifache Menge KNO3 + K2CO3 schmelzen
Cu2+
Na2S → CuS ↓
NaOH → Cu(OH2) ↓
NH → [Cu(NH)4]2+
Fe3+
Na2S → FeS ↓
NaOH → Fe(OH)3 ↓
KSCN → Fe(SCN)4
Fe2+
Na2S → FeS ↓
NaOH → Fe(OH)2 ↓
weiteres wie Fe3+, aber erst nach + H2O2
Fructose
Fehlingsche Lsg. (erhitzt)
ammoniakalische Silbernitratlsg.
Glucose
Fehlingsche Lsg. (erhitzt)
ammoniakalische Silbernitratlsg.
H2O
in Flamme
Li+
in Flamme
Mg2+
Mn2+
Fehlingsche Lsg. (erhitzt)
ammoniakalische Silbernitratlsg.
NaOH → Mg(OH)2 ↓
(Na2HPO4 + NH4Cl + NH3) Lösung → weiß, feinkristallin
Na2S → MnS ↓
NaOH → Mn(OH)2 ↓
N
über NH3 Nachweis
Na+
in Flamme
-NH2
Unitest (erhitzt)
NH3
Unitest
Ni2+
Na2S → NiS ↓
O2
Mg + H2O + Unitest (erhitzt, Luftabschluss)
NaOH → Ni(OH)2 ↓
-OH
Na → H2 ↑
charakteristische Ester
Pb2+
Na2S → PbS ↓
NaOH → Pb(OH)2 ↓
Proteine
S
Sacharose
Resorcin + HCl (erhitzt)
Cobaltchlorid
K+
Maltose
K[Fe(CN)6] → KFeFe(CN)6] ↓
konz. H2SO4
sechsfache Menge KNO3 + K2CO3 schmelzen
NH3 (Komplexlösung)
Borsäuremethylester in Flamme
Cl- → PbCl2 ↓
verdünnte KOH + Kupfersulfatlsg.
Bleiacetat → PbS ↓
Fehlingsche Lsg. (erhitzt)
NH3 + Diacetyldioxim ↓
ammoniakalische Silbernitratlsg.
file:///E:/stuff/Homepage/TU%20Chemnitz/uni/anderes/chem/nachw.htm (1 von 2)25.10.2006 08:47:05
file:///E:/stuff/Homepage/TU%20Chemnitz/uni/anderes/chem/nachw.htm
Sn2+
Na2S → SnS ↓
NaOH → Sn(OH)2 ↓
Sr2+
in Flamme
NaOH → Sr(OH)2
Stärke
Iod-Kaliumioditlösung
Zn2+
Na2S → ZnS ↓
NaOH → Zn(OH)2 ↓
SrSO3 ↓
BaSO4 ↓
ZnS/Zn(OH)2 (erhitzt)
(erkaltet)
Anderes
file:///E:/stuff/Homepage/TU%20Chemnitz/uni/anderes/chem/nachw.htm (2 von 2)25.10.2006 08:47:05
Startseite
Periodensystem
Periodensystem der Elemente
Ein Klick auf die Elementsymbole öffnet ein Fenster mit den Elementdaten.
Haupgruppe
Periode
I
1
1
Haupgruppe
III
II
IV
V
VI
VII
VIII
2
1.00797
He
Wasserstoff
2
3
6.941
1
Li
Helium
4
9.0122
Na
K
Rb
Cs
44.9559
22
47.88
23
50.9415
1.3
Sc
1.5
Ti
1.6
V
88.9059
40
91.224
41
92.9064
42
95.94
Y
1.4
Zr
1.6
Nb
1.8
Mo
Ba
57 138.9055 72
La
1.1
178.49
Hf
1.3
Lathanoide 57-71
Ac*
1.1
Actinium
Radium
Francium
Tantal
105
W
1.7
Wolfram
Ns*
Kurtschatovium
Nielsbohrium
59
140.9077
60
144.24
61
[145]
62
150.4
Ce
1.1
Pr
1.1
Nd
1.1
Pm*
1.2
Sm
Th*
1.3
Halbmetall
flüssig
12.011
7
14.0067
C
3
N
2.5
Kohlenstoff
8
15.9994
9
18.9984
O
4
F
3.5
Stickstoff
Sauerstoff
VIII
VIII
I
II
Al
1.5
Praseodymium
1.3
Pa*
Proactinium
Hauptgruppenmetall
fest
Neodymium
54.938
Mn
26 55.847
1.9
Tc*
Technetium
1.9
Re
44 101.07
Ru
2.2
Ruthenium
U*
Prometium
Uranium
Nebengruppenmetall
künstliches
Element
1.3
1.8
58.7
29
63.546
30
65.39
Ni
1.9
Cu
1.6
Zn
1.8
45 102.9055 46 106.4
2.2
Rh
Pd
2.2
47 107.868 48
77
192.22
Os
2.2
Ir
112.41
1.7
Cd
Cadmium
Silber
Palladium
Rhodium
Ag
1.9
78 195.08 79 196.9665
80
200.59
Au
1.9
Hg
Pt
2.2
2.4
Gold
Platin
Iridium
31 69.723 32
Ga
1.6
Quecksilber
P
2.1
33 74.9216 34
Ge
2
As
In
Sn
1.8
81 204.37 82
Tl
207.2
Pb
1.8
79.904
2.8
Br
52
127.6
2.1
Te
Brom
Samarium
63 151.96 64 157.25
1.2
Eu
Europium
Gd
1.2
Gadolinium
Np*
Neptunium
1.3
Pu*
Plutonium
1.3
Am*
Americium
1.3
Cm*
Curium
65 158.9254 66
1.2
Tb
Terbium
162.5
1.2
Dy
Dysprosium
97 [247.07] 98 [251.08]
1.3
Bk*
Berkelium
1.3
Cf*
Californium
67 164.9304 68 167.26
1.2
Ho
Holmium
1.2
Er
Erbium
99 [252.08] 100 [257.1]
1.3
Es*
Einsteinium
1.3
Fm*
Fermium
absoluter Nullpunkt
T0 0 K = -273.15 °C
atomare Masseeinheit
u
molares Normvolumen
Vn 22.414 l/mol
Normdruck
pn 101 325 Pa
1.013 25 bar
Normtemperatur
Tn 273.15 K = 0 °C
AVOGADRO-Konstante NA 6.022 136 * 1023 pro mol
universelle Gaskonstante R
* Alle Isotope sind Radioaktiv
file:///E:/stuff/Homepage/TU%20Chemnitz/uni/anderes/chem/pse/index.htm (1 von 2)25.10.2006 08:48:22
8.314 510 J/(K*mol)
FARADAY-Konstante
0.083 145 1 bar/(K*mol)
F
Tm
Thulium
101
1.3
[258.1]
Md*
Mendelevium
1.660 540 * 10-27 kg
9.648 456 * 104 C/mol oder As/mol
1.2
I
Iod
Tellur
Bi
1.9
2
Po*
Polonium
Bismut
Yb
1.2
131.3
Xe
Xenon
At*
2.2
Astat
Lu
Ytterbium
Luthetium
102 [259.1]
103 [260.11]
1.3
Kr
53 126.9045 54
2.5
83.8
Krypton
69 168.9342 70 173.04 71 174.967
1.2
36
83 208.9804 84 [208.98] 85 [209.99] 86 [222.02]
Blei
Thallium
35
Se
Sb
Ar
Argon
78.96
121.75
Antimon
Zinn
Indium
1.8
1.9
18 39.948
Cl
Chlor
Selen
Arsen
Germanium
49 114.82 50 118.71 51
1.7
2.4
Ne
Neon
35.453
3
Schwefel
72.6
1.8
S
2.5
Phosphor
Silizium
Gallium
Zink
Kupfer
Nickel
Cobalt
Osmium
Rhenium
Co
190.2
2.2
92 [238.029] 93 [237.0482] 94 [244.06] 95 [243.06] 96 [247.07]
1.4
27 58.9332 28
Eisen
Mangan
43 [98.9062]
Fe
1.8
Si
1.8
10 20.179
Fluor
[262]
Ku*
140.12
Thorium
gasförmig
Ta
1.1
90 [232.0381] 91 [231.0359]
Actinoide 89-103
[261]
Molybdän
58
Cerium
Nichtmetall
VIII
73 180.9479 74 183.85 75 186.207 76
1.5
Hafnium
Lanthan
Ra*
Niobium
Zirkonium
Yttrium
1.5
Chromium
1.3
137.33
0.9
Cr
1.6
39
Barium
Fr*
24 51.9961 25
Sr
87 [223.02] 88 [226.0254] 89 [227.0278] 104
0.7
Vanadium
Titanium
Scandium
Strontium
Cäsium
7
VII
87.62
0.9
6
Aluminium
21
1
55 132.9054 56
0.7
VI
Ca
Calcium
Rubidium
6
V
40.078
1
37 85.4678 38
0.8
IV
Magnesium
Kalium
5
B
13 26.9815 14 28.0855 15 30.9738 16 32.066 17
III
Mg
19 39.0983 20
0.8
10.811
2
Bor
24.305
1.2
Natrium
4
5
Beryllium
11 22.9898 12
0.9
Nebengruppe
Be
1.5
Lithium
3
4.0026
H
2.1
No*
Nobelium
1.3
Lr*
Lawrencium
Elektron Ruhemasse
Ladung
me
9.109 389 7 * 10-31 kg
e
1.602 177 * 10-19 C
spezifische Ladung e/me 1.758 819 62 * 1011 C/kg
Neutron Ruhemasse
mn
1.674 928 6 * 10-27 kg
Proton
mp
1.672 623 1 * 10-27 kg
Ruhemasse
Rn*
Radon
Vorklausur Chemie
Aufgabenteil A
1.1
Erläutern Sie das Lösen von Ionensubstanzen in Wasser!
Ionen sind Atome, die auf Grund von Elektronenabgabe oder –Aufnahme ihre elektrische
Neutralität verloren haben, sie sind elektrisch geladene Teilchen. Ionensubstanzen meist
Feststoffe, welche aus unterschiedlich geladenen Ionen aufgebaut sind. Diese sind in
gitterförmiger Struktur abwechselnd angeordnet.
Wasser ist eine Flüssigkeit, die aus dem Dipolmolekül H2O aufgebaut ist. Die beiden
Wasserstoffatome sind auf Grund des Elektronegativitätswertunterschieds von 1,4 polar an das
Sauerstoffatom gebunden. Dabei sind sie partiell positiv, das Sauerstoffatom dagegen partiell
negativ geladen. Wassermoleküle sind im Vergleich zu den Ionen im Kristallgitter eher klein.
Um eine Ionensubstanz in Wasser zu Lösen, wird diese vollständig mit Wasser bedeckt. Dabei
lagern sich die Wassermoleküle mit ihren Partialladungen an die entgegengesetzt geladenen
Ionen der Kristalloberfläche an. Auch dringen sie wegen ihrer geringen Größe in die Baufehler
des Kristalls ein. Hier und an seinen Ecken und Kanten sind die elektrischen Felder, die die
Ionen umgeben, am größten, deshalb erfolgt dort die intensivste Wasseranlagerung. Dringt
Wasser in den Kristall ein, so wird die Coulombkraft, welche den Kristall zusammenhält,
abgeschwächt. An den Kanten und Ecken werden nun zuerst Ionen aus der Substanz gelöst
und vollständig von Wasserdipolen umschlossen. Diesen Vorgang bezeichnet man als
Hydration bzw. Solvation. Dabei werden die noch vorhandenen Anziehungskräfte zwischen den
Ionen durch die entstehenden Hydrathüllen weiter abgeschwächt. Die gelösten Ionen bilden die
Vorraussetzung für elektrische Leitfähigkeit der Lösung.
AB ' A+(aq) + B-(aq)
Aus energetischer Sicht betrachtet wird zuerst die Gitterenthalpie ΔGH des Kristalls
überwunden. Danach wird bei der Hydration Energie in Form der Hydrationsenthalpie ΔHH frei.
Der Vorgang verläuft stark in Richtung höhere Entropie, da Teilchen aus einem Zustand hoher
Ordnung in einen Zustand der Unordnung übergehen. Daher ist er auch meist exergonisch und
verläuft freiwillig.
1.2
Erklären Sie, dass das Lösen von Ionensubstanzen in Wasser eine chemische Reaktion ist!
Bei dem Lösen einer Ionensubstanz ändert sich deren Aggregatzustand, sie geht vom festen in
den hydratisierten Zustand über. Dadurch ändern sich die mechanischen, physikalischen und
chemischen Eigenschaften des Stoffes. Außerdem wird Energie abgegeben oder
aufgenommen. Dies hat zur Folge, dass sich die Temperatur des Lösungsmittels ändert.
Damit entspricht der Lösungsvorgang in jeder Hinsicht der Definition einer chemischen
Reaktion.
1.3
Welcher pH-Wert ist nach dem Lösen von Ammoniumchlorid in Wasser zu erwarten?
Begründen Sie mit Hilfe von Reaktionsgleichungen!
Ammoniumchlorid ist eine Ionensubstanz, ein aus einem Ammniumion und einem Chloridion
bestehendes Salz. Löst man es in Wasser, werden folgende Reaktionen ablaufen:
NH4Cl ' NH4+(aq) + Cl-(aq)
+
NH4 (aq) + H2O ' H3O+(aq) + NH3
H2O + Cl-(aq) ' HCl + OH-(aq)
Das Ammoniumion hat eine Säurestärke pKS von 9,25, während die Basestärke des
Chloridions nur pKB = 21 beträgt. Demnach sollte der pH-Wert der Lösung kleiner als sieben,
und somit sauer sein. Damit läuft die Bildung von Hydroniumionen in weit höherem Maße ab,
als die Bildung von Hydroxydionen und die Lösung ist deshalb sauer.
2.1
Worauf ist die unterschiedliche Säurestärke von Wasser und Ethanol zurückzuführen?
Nach Brönsted sind Säuren Stoffe, die Protonen aufnehmen können (Protonenakzeptoren).
Dazu müssen sie über mindestens ein freies Elektronenpaar im Molekül verfügen. Basen sind
demnach Stoffe, die Protonen abgeben können (Protonendonatoren), also über mindestens ein
polar gebundenes und partiell positiv geladenes Wasserstoffatom im Molekül verfügen.
Wasser ist eine Flüssigkeit, die aus dem Dipolmolekül H2O aufgebaut ist. Die beiden
Wasserstoffatome sind auf Grund des Elektronegativitätswertunterschieds von 1,4 polar an das
Sauerstoffatom gebunden. Dabei sind sie partiell positiv, das Sauerstoffatom dagegen partiell
negativ geladen. Wassermoleküle können Wasserstoffionen sowohl aufnehmen als auch
abgeben. Sie sind daher
Ampholyte. Auch dissoziieren sie
zu gleichen Teilen in
Hydroniumionen und Hydroxydionen. Daher ist Wasser insgesamt chemische neutral und hat
den pH-Wert sieben.
H+ + H2O ' H3O+
H2O ' H+ + OH2 H2O ' H3O+ + OHEthanol ist ein Alkanol, welches aus einem Ethanmolekül mit einem durch eine Hydroxylgruppe
substituierten Wasserstoffatom. Es verfügt ebenfalls über eine polare Bindung im Molekül,
welche sich in der funktionellen Gruppe befindet. Genau wie das Sauerstoffatom im Wasser
besitzt auch das im Ethanol zwei freie Elektronenpaare, an die sich ein Wasserstoffion anlagern
könnte. Damit ist es meiner Meinung nach auch ein Ampholyt, da es sowohl über freie
Elektronenpaare als auch partiell positiv geladenen Wasserstoff verfügt. Es müsste ebenfalls
eine Autoprotolyse ablaufen.
H+ + C2H5OH ' C2H5OH2+
C2H5OH ' C2H5O- + H+
2 C2H5OH ' C2H5OH2+ + C2H5OHDa sich der pH-Wert jedoch auf das Lösungsmittel Wasser bezieht, wird Ethanol, welches an
sich neutral ist, als schwache oder sehr schwache Säure agieren, da mir die Protonenabgabe
wahrscheinlicher als die Protonenaufnahme in wässriger Lösung erscheint.
2.2
Wie kann die Säurestärke von Ethanol durch Einführen von Substituenten erhöht werden?
Nennen Sie die wesentliche Eigenschaft, die die Substituenten besitzen müssen und
begründen Sie an Hand eines Beispiels!
Dies schreibe ich gegen meinen Willen, da ich nach wie vor die Methode, eine Carboxylgruppe
anzusubstituieren für ästhetischer halte.
Um die Säurestärke von Ethanol zu erhöhen, muss man die Protonenabgabe erleichtern. Die
einzige polare Bindung zu einem Wasserstoffatom im Molekül befindet sich in der funktionellen
Hydroxylgruppe.
Substituiert man irgendwo am Ethanolmolekül Atome oder Ionen an, die dafür sorgen, dass das
Sauerstoffatom der Hydroxylgruppe das gemeinsame Elektronenpaar näher zu sich zieht, also
elektronegativer wird, so kann das Wasserstoffatom leichter abgegeben werden.
Dafür eignen sich alle Substituenten, deren Elektronegativitätswert höher ist als der des
Kohlenstoffs (2.5) bzw. wenigstens höher als der des Wasserstoffs (2.1). Besonders geeignet
sind demnach Halogene wie F, Cl, Br und notfalls I. Diesen Effekt bezeichnet man als –I-Effekt,
da die höhere Elektronegativität sich von Atom zu Atom überträgt.
CH3-CH2-OH + Cl-Cl ' CH2Cl-CH2-OH + H-Cl
CH3-CH2-OH + H-H ' H3O+ + CH2Cl-CH2-OLagert sich also an das zweite Kohlenstoffatom des Ethanols ein Chloratom an, so zieht es das
gemeinsame Elektronenpaar der sp3-p-δ-Bindung weiter zu sich hin als es das
Wasserstoffatom in der sp3-s-δ-Bindung zuvor getan hat. Dadurch wird die Bindung leicht
polarisiert und der Elektronegativitätswert des Kohlenstoffatom etwas erhöht. Dies bedeutet,
dass das zweite Kohlenstoffatom das gemeinsame Elektronenpaar (sp3-sp3-δ-Bindung) mit
dem ersten Kohlenstoffatom stärker zu sich zieht als vorher. Damit wird dieses wiederum leicht
polarisiert, wenn auch in geringerem Maße als das erste. Dadurch verlagert sich die sp3-p-δBindung mit dem Sauerstoff mehr in seine Richtung, wodurch dessen s-p-δ-Bindung mit dem
Wasserstoffatom stärker polarisiert wird, weshalb sich dieses leichter lösen lässt.
3.
Essigsäure und Salzsäure gleicher Stoffmengenkonzentration werden mit Magnesium zur
Reaktion gebracht. Das Endvolumen des entstehenden Gases wird gemessen.
3.1
Entwickeln Sie die Reaktionsgleichungen in Ionenschreibweise!
I.
II.
III.
3.2
H2O + CH3-COOH ' H3O+ + CH3-COOH2O + H-Cl ' H3O+ + Cl2 H3O+ + Mg ' Mg2+ + H2 + 2 H2O
Vergleichen Sie die Reaktion hinsichtlich ihrer Reaktionsgeschwindigkeit und des Endvolumen
des entstehenden Gases! Begründen Sie!
Essigsäure (I.) und Salzsäure (II.) bilden mit Wasser Hydroniumionen. Da nur diese mit
Magnesium zu Magnesiumionen (III.) reagieren, ist die Endreaktion bei beiden Säuren gleich,
und wird nur einmal dargestellt.
Essigsäure und Salzsäure reagieren im Lösungsmittel Wasser beide sauer. Dabei hat
Essigsäure eine geringere Säurestärke (pKS = 4,75) als Salzsäure (pKS = -7).
Dies bedeutet, dass sich in der Essigsäurelösung (I.) die Hydroniumionen langsamer und
zunächst in geringerem Maße bilden, als bei der Salzsäure (II.). Da weniger Ausgangsstoff zur
Verfügung steht, verläuft die Endreaktion (III.) auch langsamer als bei Salzsäure. Das Gas
Wasserstoff entsteht also auch langsamer. Betrachtet man jedoch dessen Endvolumen, so ist
dieses genauso groß wie das bei der Salzsäure entstandene. Während Salzsäure vollständig
dissoziiert und dies so entstehenden Hydroniumionen sofort durch die Endreaktion (III.)
verbraucht werden, gehen bei der Essigsäure für verbrauchte Hydroniumionen immer neue
Essigsäuremoleküle in Dissoziation. Aus jedem dissozierten Essigsäuremolekül kann, genau
wie bei der Salzsäure, ein Hydroniumion gewonnen werden kann. Schritt für Schritt dissoziieren
langsam auch alle Essigsäuremoleküle, so dass letztendlich gleich viel Wasserstoff entsteht.
4.
Säure- und Redoxreaktionen kennzeichnen Gemeinsamkeiten. Erstellen Sie eine Übersicht mit
mindestens 4 Beispielen!
Säure-Base-Reaktion
Reaktionen mit Protonenübergang
Proton ist das kleinstes Kation, besitz keine
Elektronenhülle
Ein Proton ist sehr Reaktionsfähig und existiert in
Lösungen nicht frei.
Protonendonatoren sind Säuren.
Protonenakzeptoren sind Basen.
Korrespondierende Säure-Base-Paare
Bei der Säure-Base-Reaktion sind stets zwei
korrespondierende Säure-Base-Paare beteiligt.
Die Wertigkeit einer Säure entspricht der Anzahl
der Protonen, die abgegeben werden können.
Redoxreaktion
Reaktionen mit Elektronenübergang
Elektron ist das kleinste Anion und besitzt
keinen Atomkern.
Ein Elektron ist sehr Reaktionsfähig und
existiert in Lösungen nicht frei.
Elektronendonatoren sind Reduktionsmittel.
Elektronenakzeptoren sind Oxidationsmittel.
Korrespondierende Redoxpaare
Bei der Redoxreaktion sind stets zwei
korrespondierende Redoxpaare beteiligt.
Die Wertigkeit eines Reduktionsmittels
entspricht der Anzahl der Elektronen, die
abgegeben werden können.
Die Wertigkeit einer Base entspricht der Anzahl
Die Wertigkeit eines Oxidationsmittels
der Protonen, die aufgenommen werden können. entspricht der Anzahl der Elektronen, die
aufgenommen werden können.
Es stellen sich chemische Gleichgewichte ein.
Es stellen sich chemische Gleichgewichte
ein.
Es gibt Teilchen, die Protonen sowohl abgeben
Es gibt Teilchen, die Elektronen sowohl
als auch aufnehmen können.
abgeben als auch aufnehmen können.
Diese Stoffe bezeichnet man als amphoter.
Diese Stoffe bezeichnet man als
redoxamphoter.
Das Protonendonatorverhalten wird durch den
Das Elektronendonatorverhalten wird durch
Säureexponent pKS charakterisiert.
das Standardpotential EΘ charakterisiert.
Säure-Base-Reaktion:
Redoxreaktion:
S1
B2 + n2 * H+
n2 * S1 + n1 * B2
5.
'
'
'
Red1
' Ox1 + z1 * eOx2 + Z2 * e
' Red2
z2 * Red1 + z1 * Ox2 ' z2 * Ox1 + z1 * Red2
B1+ n1 * H+
S2
n2 * B1 + n1 * S2
0,01 Mol Essigsäure werden in 1 l Wasser gelöst. Berechnen Sie die Stoffmengenkonzentration
von Essigsäure, Acetation, Hydronium- und Hydroxydion!
Geg.:
n0 = 0,01 mol
V = 1l
pKsEssigsäure = 4,75
Ges.:
cEssigsäure in mol * l-1
cActation in mol * l-1
cHydroniumion in mol * l-1
cHydroxydion in mol * l-1
Lös.:
c0Essigsäure = n0 / V
c0Essigsäure = 0,01 mol * l-1
Essigsäure ist eine mittelstarke bis schwache Säure.
pH = ½ * (pKsEssigsäure – lg {c0Essigsäure} )
pH = 3,375
cHydroniumion =10-pH
cHydroniumion = 0,0004216965 mol *l-1
cHydroxydion = 10-(14-pH)
cHydroxydion = 2,371373706 * 10-11 mol * l-1
cAcetation = cHydroniumion
cAcetation = 0,0004216965 mol *l-1
cEssigsäure = c0Essigsäure – cAcetation
cEssigsäure = 0,00957830349 mol * l-1
Die Konzentration der Essigsäure beträgt 0,0095 mol*l-1, die der Acetationen
0,00042 mol*l-1, die der Hydroniumionen 0,00042 mol*l-1 und die der Hydroxydionen
2,3 * 10-11 mol*l-1.
Aufgabenteil B
1.
Zink wird aus Zinkblende (ZnS) gewonnen. Das Material wird zuerst geröstet (mit Luftsauerstoff
oxidiert) und dann mit Schwefelsäure ausgelaugt.
1.1
Entwickeln Sie die Reaktionsgleichungen!
Es entsteht entweder SO2
oder SO3.
Stufenweise Dissoziation
der Schwefelsäure.
Endreaktion:
1.2
2 ZnS + 3 O2
2 ZnS + 4 O2
H2O + H2SO4
H2O + HSO42 H2O + H2SO4
2 H3O+ + ZnO + SO42-
'
'
'
'
'
'
2 ZnO + 2 SO2
2 ZnO + 2 SO3
H3O+ + HSO4H3O+ + SO422 H3O+ + SO42Zn2+ + 3 H2O + SO42-
Zur elektrolytischen Abscheidung von 20 kg Zink ist eine elektrische Arbeit von 64 kWh nötig.
Die Badspannung beträgt 3,5 V. Berechnen Sie den Wirkungsgrad!
Geg.:
m = 20 kg = 20’000 g
W = 64 kWh = 64000 Wh = 230’400'000 Ws
U = 3,5 V
F = 9,64853 * 104 C*mol-1
MZn = 65,39 g*mol-1
z=2
Ges.
η
Lös:
NZn = m / MZn
NZn = 305,8571647 mol
I*t=F*n*z
W=P*t
P=U*I
W=U*I*t
I*t=W/U
I * t = 65’828’571,43 As
nE = (I * t) / (F * z)
nE = 341,1326463 mol
η = nZn / nE
η = 0,8965930645
Der Wirkungsgrad beträgt 90%.
1.3
Diskutieren Sie die Möglichkeit der elektrolytischen Zinkgewinnung aus einer wässrigen Lösung
von Zinkionen!
Wenn Zink(II)-Ionen aus einer wässrigen Lösung elektrochemisch gewonnen werden sollen, so
ist es dafür notwendig, das Standardpotential dieser Reaktion zu überwinden. Bei dem
Redoxpaar Zink/Zink(II)-Ion beträgt es –0,76 V. Dieses ist niedriger als das der
Standardwasserstoffelektrode, welches mit 0,00 V angesetzt wird. Es gilt: Je geringer das
Standardpotential eines Metalls ist, desto höher ist seine Tendenz, Ionen zu bilden. Taucht man
ein Metall niedrigen Standardelektronenpotentials in eine Elektrolytlösung, welche Metallionen
höheren Standardelektronenpotentials enthält, so werden diese zu Metallatomen reduziert und
fallen aus, währen das eingetauchte Metall zu Ionen oxidiert, hydratisiert und in Lösung gehen
wird. Diesen Vorgang nennt man auch elektrochemische Fällung. Legt man an eine
Elektrolytlösung, welche sowohl Ionen eines Metalls mit hohem als auch Ionen eines Metalls
mit niederem Standardelektronenpotential enthält eine Spannung an, so gilt umgekehrt, dass
zuerst die Ionen des Metalls mit hohem Standardelektronenpotential reduziert werden, und erst
danach die Ionen des Metalls mit niedrigem Standardelektronenpotential.
Da Zink ein niedrigeres Standardelektronenpotential als Wasser hat, so würde beim Anlegen
einer Spannung zuerst die Hydrolyse des Wassers ablaufen und sich dieses in Wasserstoff und
Sauerstoff spalten. Es bliebe eine Bodensatz von nicht-reduzierten Zinkionen übrig, nachdem
alles Wasser gespalten wäre. Selbst wenn dieses Produkt Ziel einer elektrolytischen
Zinkgewinnung wäre, so gäbe es doch weit kostengünstigere Methoden es zu gewinnen.
Dennoch ist die elektrolytische Abscheidung Zinks auf Grund eines elektrochemischen
Phänomens, der Überspannung, doch bedingt durchführbar. Da dieses Stoffgebit jedoch noch
nicht im Unterricht behandelt wurde, fällt es bei der Lösung der Aufgabe weg.
Eine elektrolytische Zinkgewinnung ist also im großtechnischen Maßstab weder effektiv
durchführbar, rentabel noch sinnvoll.
2.
In Komplexverbindungen ist das zweiwertige Eisen (Koordinationszahl 6) stabiler, ansonsten
das dreiwertige Eisen.
Die Stabilität von Atomen hängt stets mit deren Elektronenkonfigurationen zusammen.
Eisen hat die Koordinationszahl 6, was bedeutet, dass es in Komplexen sechs koordinative
Bindungen mit Liganden eingehen kann. Bei koordinativen Bindungen spendet der Ligand das
gemeinsame Elektronenpaar allein. Dies bedeutet, dass Eisen in Komplexen zwölf Elektronen
aufnimmt. Die verschiedenwertigen Eisenatome haben also im Komplex folgende
Elektronenkonfiguration:
Fe(II)
Fe(III)
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 = [Kr]
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 = [Br]
Alle Orbitale des Eisen(II)-Komplexes sind vollbesetzt. Dies stellt einen energetisch sehr
günstigen Zustand dar, den man als Edelgaskonfiguration bezeichnet. Während Eisen(II) die
Elektronenkonfiguration des Kryptons erreicht, verfügt Eisen(III) in Komplexen nur über die des
Broms, welche weniger stabil ist.
3.
Es besteht die Möglichkeit, allein aus Silberdraht, Silbernitratlösung und einigen Glasgeräten
elektrochemische Spannungsquellen aufzubauen. Erläutern Sie die zwei möglichen Varianten!
Konzentrationselement
Temperaturelement
Die
erste
Möglichkeit,
eine
elektrochemische Spannungsquelle zu
konstruieren,
wäre
ein
Konzentrationselement.
Silberdrähte
werden in je zwei, räumlich von einander
getrennte, Silbernitratlösungen getaucht.
Diese unterschieden sich in der
Konzentration
des
Silbernitrats.
Zwischen den Drähten kann nun eine
Spannung abgegriffen werden.
Die zweite Möglichkeit wäre ein, vom
räumlichen
Aufbau
her
gleiches,
Temperaturelement. Hier beruht die
Zellspannung auf den verschiedenen
Temperaturen der gleichkonzentrierten
Lösungen. Die dritte Möglichkeit wäre
eine Kombination von Temperatur und
Konzentrationselement,
um
den
Wirkungsgrad zu optimieren.
Aufgabenteil C1
1.
Sie erhalten 5 Proben unterschiedlicher Kohlenhydrate. Entwickeln Sie einen Plan zur
Identifizierung! Fordern Sie die notwendigen Nachweismittel beim aufsichtsführenden Lehrer
an!
Führen Sie die Nachweise durch und geben Sie an, welches Kohlenhydrat im jeweiligen
Reagenzglas enthalten war!
Hinweis : Es handelt sich um zwei Monosacharide, ein Disacharid und zwei Polysacharide.
Schritt 1
Schritt 2
Schritt 3
Schritt 4
Reagenz 1:
Reagenz 2:
Reagenz 3:
Alle Stoffe werden in Wasser gelöst. Die Reagenzien 3 und 4 lösen sich nicht.
Damit sind die beiden Polysacharide.
Diese beiden Stoffe werden mit Iodkaliumioditlösung vermischt. Reagenz 4 zeigt
eine dunkelbraune bis lilane Färbung, damit handelt es sich um Stärke. Reagenz 3
ist somit Cellulose.
Seliwanowreaktion. Teile der Proben werden mit Salzsäure (c=1 mol*l-1) vermischt.
Einige Resocinkristalle werden hinzugegeben. Die Reagenzien werden erhitzt. Die
Reagenz 1 färbt sich rot, Reagenz 2 wird dunkelrot. Reagenz 2 ist somit Fructose
und Reagenz 1 das Disacharid und muss Fructose enthalten.
Fehlingsche Lösung I und II werden zu gleichen Teilen gemischt und zu den noch
unidentifizierten Proben gegeben. Anschließend werden diese erhitzt. Die beiden
Reagenzien 5 und 1 zeigen ziegelrote Färbung. Sie enthalten beide Glukose. Da
Reagenz 1 aber ein Disaccharid ist, kann es sich nur um Sascharose handeln.
Sacharose
Fructose
Cellulose
Reagenz 4:
Reagenz 5:
Stärke
Glucose
Organik
Ermittlung der Struktur und Zusammensetzung organischer Stoffe
Strukturmerkmale organischer Stoffe
sp3- sp2- sp-Hybridisierung der Kohlenstoffatome LB. S.36 ff.
Funktionelle Gruppen
Hydroxylgruppe -OH
Reaktion mit Na unter Wasserstoffbildung, Bildung charakteristischer
Ester, Borsäuremethylester brennt grün (Nachweis von Methanol)
reduzierende Wirkung, Nachweis mit Fehlingscher Lsg. Ammoniakalischer
Aldehydgruppe -CHO
Silbernitratlösung (Tollens Reagenz) und Fuchsinschweflige Säure
Carboxylgruppe -COOH Protolyse in Wasser, Nachweis der Hydroniumionen mit Säure-BaseIndikatoren, Reaktion mit unedlen Metallen unter Wasserstoffbildung, bildet
mit Alkoholen Ester charakteristisch richender Art
Ketogruppe
-CONachweis des Ammoniaks (Unitest blau) nach Erhitzen
Aminogrupp e -NH2
Peptidbindung -CO-NHEsterbindung R-CO-O-R
Ether
R-O-R
Nachweis von Elementen in organischen Stoffen C, H, O, N, S, Halogene
-
Oxidieren
C über CO2 (Ba(OH)2)
H Über H2O (Cobaltchlorid) (blau nach rosa)
Erhitzen unter Luftabschluss mit Mg, Nachweis des MgO mit Wasser und
Unitest (blau)
N über Ammoniak, färbt feuchtes Unitestpapier blau
S über Beiacetat, bildet schwarzes Bleisulfid (Sulfidnachweis)
oder Erhitzen
Bestimmung der qualitativen Zusammensetzung:
-
Verhältnisformel nach Liebig LB. S.86,
Bestimmung der molaren Masse leicht flüchtiger Stoffe Dampfvolumenbestimmung ab S.88
experimentelle Bestimmung der Strukturmerkmale - chemisch - funktionelle Gruppen
- Mehrfachbindung
Zusatzè physikalisch - Chromatographie
- Massenspektrometrie
- IR Spektroskopie
- NMR Spektroskopie
Aromaten
-
-
-
Hückelregel Aromat = 4n + 2 π-Elektronen
Benzen:
Vorkommen, Eigenschaften, Verwendung
Mesomerie
Derivate
(Styrol C6H5-CH=CH2, Toluol C6H5-CH3, Benzylakohol C6H5-CH2-OH,
Benzaldehyd C6H5-CHO, Benzoesäure C6H5-COOH, o-, m-, p-Xylol)
steht im Tafelwerk
Phenol: Vorkommen, Eigenschaften, Verwendung
Säurecharakter, I- und M-Effekte
mehrkernige Aromaten (z. B. Anthracen, Naphthalin)
Zusatz Heterocyclen also mit z. B. Stickstoff im Ringsystem
typische organ. Reaktionen
-
radikalische Substitution
-
radikalische Addition und Polymerisation
-
elektrophile Substitution
-
nucleophile Substitution
-
elektrophile Addition
Bromierung von Hexan und Toluol
Kettenstart (z. B. durch organisches Peroxid R-O-O-R)
Kettenfortpflanzung
Kettenabbruch
Bromierung und Nitrierung von Benzol
SN1, SN2
LB.S.
Bildung des Bromkation ( durch Katalysator {AlCl3} )
Anlagerung an den Aromat (elektrophil)
π-Komplex, σ-Komplex, π-Komplex
Abgabe eines Protons
113, stereochemische Konsequenzen
Verseifung, Veresterung, Polykondensation
Enantiomer, asymmetrisches (chirales) C-Atom, Racemat
Bromierung von Ethen S.118
-
Eliminierungen LB. S. 116 Ionische Eliminierungen, monomolekulare (E1) und bimolekulare (E2) Eliminierungen
HOFFMANN und SAITZEW-Produkt
Makromolekulare Stoffe
Kunststoffe
-
Polymerisate
-
Polykondensate Polyester, Polyamide, Phenoplaste, Aminoplaste
-
Polyaddukte
-
PE, PVC, PP, PS usw.
PUR
Polyaddition
Zusammensetzung, Struktur und Eigenschaften von Duroplasten, Thermoplasten und Elasten
LB. S. 166
-
Kunststoffrecycling Gelbe Tonne, Grüner Punkt usw.
Kohlenhydrate
-
Ketosen, Aldosen
Bau, Eigenschaften, Struktur von Monosacchariden, Disacchariden und Polysacchariden
Glykosidische Bindung wirkt reduzierend, siehe Nachweise
Nachweise:
Glukose, Fruktose, Maltose mit Fehling (ziegelroter Niederschlag) und Ammoniakalischer
-
Silbernitratlösung (Silberspiegel)
Fruktose: Seliwanoff-Reaktion: Erwärmen mit Resorzin und Salzsäure = Rotfärbung
Stärke: +Iod-Kaliumiodid-Lösung (Lugolsche Lösung) blau bis dunkelschwarz
Zellulose: +Chlor-Zink-Iod-Lösung braun
Darstellung in Fischerprojektion
Chiralität:
Eiweiße
-
Basizität der Amine
-
Aminosäuren
+
-
Amine (Stoffe mit Aminogruppe reagieren basisch NH2-R + H2O _ NH3 -R + OH )
wichtige Beispiele, Struktur, Eigenschaften
Aminosäuren sind säure-base-amphoter (haben ja zusätzlich die Carboxylgruppe)
Isoelektrischer Punkt: pH-Wert, an dem die max. Konzentration an Zwitterionen vorliegt
Zwitterion: Aminogruppe positiv und Carboxylgruppe negativ geladen, durch die positive und
gleichzeitig negative Ladung in einem Molekül starke Anziehungskräfte elektrostatischer Art also
hohe Schmelz- und Siedetemperatur
Nachweis mit Ninhydrinlösung (färbt sich blauviolett) S. 154
-
Chiralität: ...
Peptidbindung
Proteine
-
Nachweise
-
Hydrolyse
Chromatographie
-CO-NHPrimärstruktur
Sekundärstruktur
=
=
AS-Sequenz
Faltblatt, Helix, Stabilisierung durch innermolekulare Wasserstoffbrücken
zwischen -CO- und -NHTertiärstruktur
=
vollst. Räumliche Anordnung des Proteins, Stabilisierung durch
Wasserstoffbrücken aber wichtiger Disulfidbrücken -S-S- zwischen Ketten
und Faltblättern
Xanthoproteinreaktion: Eiweiß + konz. Salpetersäure = gelb
Biuretreaktion
:
Eiweiß + verdünnte KOH + Kupfersulfatlösung = lila
Abbau, meist enzymatisch, Aufspaltung der Peptidbindung unter Wasseranlagerung
Trennung eines AS-Gemischs durch untersch. Laufgeschwindigkeit mit bekannten AS als Vergleich
zum Identifizieren, Sichtbarmachen mit Ninhydrin (blauviolett)
Fette
-
Ester aus Glycerin und Fettsäuren (langkettige Carbonsäuren)
gesättigte und ungesättigte Fettsäuren; Nachweis der Mehrfachbindungen mit Bromwasser
Iodzahl gibt Gehalt an Mehrfachbindungen an
Fette sind die Naturstoffe, die die größte Energiemenge in kleinstem Volumen speichern
Bau von Molekülen
a) Elektronenpaar-Abstoßungsmodell
Wasserstoffmolekül
H–H
E
kJ/mol
74 pm
0
Abstand
-436
Anzahl der Atombindungen im Molekül:
Oktettregel:
SO42-
A Methanmolekül
CH4
NH3
H 2O
b) Orbitalmodell
Es entsteht bei der Wechselwirkung
der 1s-Atomorbitale ein bindendes und
ein antibindendes Molekülorbital. Das
σ-Molekülorbital ist
rotationssymmetrisch zur
Kernverbindungsachse.
HCl
Chemische Bindung zwischen C – H:
sp3 – s - σ - Bindung
B Ethen
C Grundzustand
Bindungen:
hybridisierter Zustand
C – H: sp² - s - σ - Bindung
C – C: p – p - π - Bindung
C Ethin
C Grundzustand
Bindungen:
hybridisierter Zustand
C – H: sp – s - σ - Bindung
C – C: sp – sp - σ - Bindung, 2 mal p – p - π- Bindung
Für 1 C-Atom
Ionensubstanzen
Anionen: el. negativ geladen
Kationen: el. positiv geladen
Ionensubstanzen dissoziieren in wäßriger Lösung in el. positiv geladene Kationen und el. negativ geladene
Anionen.
Kation
3 K+
Kalium
Anion
PO43- phosphat
Komplexes Kation
[Cu(H2O)4]2+
Tetraaquakupfer(II) -
Anion
2 Cl- chlorid
Kation
3 K+
Kalium -
Komplexes Anion
[Fe(CN)6]3- hexacyanoferrat
Komplexverbindungen
1.
Aufbau
Liganden „sitzen“ mit einem
Haftatom am Zentralion
Anzahl der Haftatome =
Zähnigkeit
Anzahl der einzähnigen Liganden, die gebunden werden können = Koordinationszahl
Bsp.:
1. Natrium-di(thiosulfato)-argentat(I): Na3[Ar(S2O3)2]
2. Pentaaqua-hydroxo-aluminium(III)-Ion: [Al(H2O)5OH)]2+
3. Kalium-tetraiodo-mercurat(II): K2[HgI4]
4. K3[Fe(CN)6]: Kalium-hexacyanoferrat(III) | K4[...]: Kalium-hexacyanoferrat(II)
5. [Zn(NH3)4]2+: Tetraamminzinkat(II)-Ion
6. Li[AlH4]: Lithium-tetrahydritoaluminat(III)
Versuch:
1. CuSO4 × 5 H2O stark erhitzen: blau → weiß (da wasserfrei)
2. Abkühlen
3.
Mit wenig H2O versetzen: CuSO4 + 5 H2O ↔ CuSO4 × 5 H2O ΔRH=-x kJ/mol
Mit mehr H2O versetzen:
CuSO4 ↔ Cu2+ + SO42Mit viel H2O versetzen:
Cu2+ + 4 H2O ↔ [Cu(H2O)4]2+
Mit Ammoniak versetzen: [Cu(H2O)4]2+ + 4 NH3 ↔ [Cu(NH3)4] 2+ + 4 H2O
(Zwischenschritt):
[Cu(H2O)4]2+ +NH3 ↔ [Cu(H2O)3(NH3)] 2+ + H2O É schrittweise
Î Komplexe mit mehrzähnigen Liganden nennt man Chelat. Der Effekt der stärkeren Stabilität dieser
Komplexe heißt Chelateffekt.
Bindungsverhältnisse in Komplexen
a) elektrostatische Wechselwirkungen: Anziehungskräfte zwischen el. entgegengesetzt geladenen Zentralion
(+) und den Liganden (-) oder Liganden sin Dipole und lagern sich mit ihrem neg. Ladungsschwerpunkt am
Zentralion an.
-
regelmäßige Anordnung der Liganden wird durch deren gegenseitige Abstoßung erklärt
Problem: Planarquadratische Struktur läßt sich mit diesem Modell nicht erklären.
b) Atombindungsmodell (Koordinative Bindung)
Elektronenzahl: Co
Elektronen aus den Lig. (6×2)
Σ
c)
[Co(NH3)6]2+
25
12
37
Valenzbindungstheorie
inner-orbital: wenig parallele Elektronenspinorientierung
outer-orbital: viel/hohe parallele Elektronenspinorientierung
high spin: entspricht outer-orbital
low spin: entspricht inner-orbital
diamagnetisch: geringfügig magnetisch
paramagnetisch: scheinbar magnetisch
Ligandenfeldtheorie
(Weiterentwicklung der elektrostatischen Erhöhungstheorie)
Exp.:
1. Fe2+-Lsg. mit K3[Fe(CN)6] versetzen → blau
2. Fe3+-Lsg. mit K4[Fe(CN)6] versetzen → blau
Fe4[Fe(CN)6]3
es entsteht Berliner Blau
[Co(NH3)6]3+
24
12
36
Infrarotspektroskopie
Prinzip:
Infrarotstrahlung ist eine, für das menschliche Auge nicht sichtbare, elektromagnetische Strahlung. IRspektroskopische Messungen werden als Absorbtions- und Reflexionsmessungen durchgeführt. Bei den
Absorbtionsmessungen entnehmen die Analysesubstanzen dem eingestrahlten Kontinuum Energie zur
Anregung von Schwingungen und Rotationen der Moleküle. Nach der spektralen Zerlegung sind die
Absorbtionsbereiche der Substanz als Lücken im Kontinuum zu erkennen. Ihre Lage wird durch die
Wellenlänge oder die Wellenzahlen als reziproke Größe angegeben.
IR-Spektroskopie umfaßt die elektromagnetische Strahlung im Bereich der mittleren Infrarotstrahlung:
400 bis 4000 cm-1, 25 bis 2,5 µm, 12 bis 120 THz bzw. 50 bis 500 meV, wobei alle Angaben äquivalent
zueinander sind.
Verfahren:
Das von der Strahlungsquelle (1) kommende
Infrarotlicht trifft auf den Strahlteiler (3), einen
halbdurchlässigen Spiegel. Der Strahl wird zu
gleichen Teilen reflektiert und durchgelassen. Die
so entstandenen zwei Strahlen treffen jeweils auf
einen festen (4) und einen beweglichen Spiegel (5)
und werden zum Strahlteiler zurückreflektiert. Nach
dem Strahlteiler überlagern sich die Wellenzüge. Es
entsteht ein Interferenzmuster. Sind die optischen
Wege beider Wellenzüge gleich lang oder um k * λ
verschoben, so kommt es zur Verstärkung. Durch
die
Bewegung
des
Spiegels
werden
Gangunterschiede erzeugt. Die Probe (6) befindet
sich nach dem Strahlteiler und vor dem Detektor (7)
und kann so bei bestimmten Wellenlängen
Strahlung absorbieren. Die Synchronisation des
Interferometers mit dem Abtasten der Daten wird
durch einen Referenzlaser (2) gewährleistet. Bei
einer kontinuierlichen Spiegelbewegung erhält man
nach der Fouriertransformation des Detektorsignals
ein Spektrum.
Ablauf:
Fourir-Transformations-Infrarot-Spektrometer
sind
meist
Einstrahlgeräte, die in einem Interferrogramm die gesamte
Information des IR-Spektrums liefern. Ein typisches Verfahren
zur Bestimmung des Transmissionsgrades besteht darin,
zunächst ein Referenzinterferogramm einer Bezugsprobe (meist
trockene, C02- arme Luft oder leere Küvette bzw. KBr- Tablette)
aufzunehmen. Diese Daten werden als Background-Spektrum
gespeichert. Dann wird eine Probe in den Strahlengang gebracht
und der Vorgang wiederholt. Anschließend wird das Verhältnis
der spektralen Daten von Probe und Referenz berechnet. Als
Ergebnis erhält man den Transmissionsgrad der Probe bei
verschiedenen Wellenzahlen.
Die Identifizierung einer organischen Verbindung anhand eines
Spektrums ist ein Zweistufenprozeß. Im ersten Schritt bestimmt
man, welche funktionellen Gruppen sehr wahrscheinlich
vorliegen, indem man den Bereich der gruppenspezifischen
Frequenzen überprüft (circa 3600 cm-1 bis etwa 1200 cm-1). Im
zweiten Schritt erfolgt ein genauer Vergleich des Spektrums der
unbekannten Verbindung mit den Spektren reiner Verbindungen,
die all jene funktionellen Gruppen enthalten, die im ersten Schritt
gefunden wurden. Eine besonders wertvolle Hilfe hierbei ist der
Fingerprintbereich (1200 cm-1 bis 600 cm-1).
Darstellung
Spektren, die mit Hilfe der Infrarotspektroskopie ermittelt werden, werden als Interferrogramme
dargestellt. Das sind Diagramme, bei denen an der Abszisse die Wellenzahlen und an der Ordinate der
Absorbtionsgrad eingetragen wird. Dabei ergeben sich wie in der Darstellung auf der Rückseite Berge
(Peaks) und Täler. Für die Stoffbestimmung werden hauptsächlich die Peaks genutzt, da diese die
Stellen im Spektrum angeben, an denen der Stoff die meiste Energie absorbiert hat.
Stoff
reines Wasser (H2O)
kristalliner Zucker (C6H12O6)
Essigsäure (CH3COOH)
charakteristische Peaks in cm-1
3300; 1630
3560; 3310; 2930; 2350; 1435-1235; 1240-840
3030; 1700; 1400; 1290; 1000
1. Chemieklausur 11/1
1.
Sauerstoff kann im Labor durch Zerfall von Wasserstoffperoxid dargestellt werden.
Bei einem Experiment wurde im Verlaufe der Reaktion die Stoffmengenkonzentration des
Wasserstoffperoxids c in Abhängigkeit von der Zeit t gemessen.
Folgende Werte wurden beobachtet:
t in min
c in mol * l-1
0
0,5
5
0,38
10
0,31
15
0,25
20
0,20
30
0,12
40
0,08
50
0,05
60
0,30
70
0,02
1.1. Zeichnen Sie anhand der Messwerte ein c/t-Diagramm für den Zerfall des Wasserstonperoxids.
1.2. Zeichnen Sie in die grafische Darstellung jeweils die Zeiten t1, t2, t3 ein, in denen die Ausgangskonzentration
jeweils auf die Hälfte, ein Viertel, ein Achtel abgesunken ist.
Wie groß ist das Zeltintervall tH zwischen diesen Zeiten?
Was stellen Sie hinsichtlich der Konzentrationsabhängigkeit der Zeit tH fest?
1.3. Ermitteln Sie aus den Größeneinheiten der Geschwindigkeitsgleichung für die Reaktion 1. Ordnung und die
Reaktion 2. Ordnung jeweils die Größeneinheit von k.
Entscheiden Sie, welche Reaktionsordnung im untersuchten Fall vorliegt.
1.4. Berechnen Sie das Sauerstoffvolumen, das sich bei 25 °C und unter Normaldruck vom Beginn der Reaktion
bis zur 25. Minute aus 100 ml Wasserstoffperoxidlösung entwickelt hat. Entnehmen Sie erforderliche Werte
aus dem c/t Diagramm.
2.
Beschreiben Sie das Prinzip der kalorimetrischen Reaktionsenthalpiebestimmung an einem selbstgewählten
Beispiel!
3.
Was besagt der Satz von HESS? Geben Sie ein Beispiel!
4.
Eine Probe Wasserstoff nimmt bei 28,6 °C und 108943 Pa ein Volumen von 60 l ein.
Berechnen Sie das Volumen unter Standardbedingungen (273,15 K, 101325 Pa)!
5.
6.
Berechnen Sie, ob die chemische Reaktion C + H2O ⎯→ CO + H2
a) bei Zimmertemperatur
b) bei 1000K
freiwillig abläuft!
Stellen Sie Ihre Ergebnisse graphisch dar!
Die im Hochofen ablaufenden chemischen Reaktionen können vereinfacht in folgender chemischer
Gleichung zusammengefaßt werden:
Fe2O3 + 3 C ⎯→ 2 Fe + 3 CO
Beim Hochofenprozeß dient der eingesetzte Koks als Reduktionsmittel und als Energieträger.
6.1. Berechnen Sie die Masse an Reduktionsmittel Kohlenstoff, die zur Herstellung von 1t Roheisen bei
vollständigem Stoffumsatz benötigt wird!
6.2. Berechnen Sie die molare Reaktionsenthalpie für diese chemische Reaktion! Koks hat einen Heizwert von
29 000 kJ kg-1. Welche Masse an Koks wird theoretisch zur Gewinnung der Energie benötigt, die für die
Herstellung dieser 1 t Roheisen aufgewendet werden muß?
In der Praxis ist zur Produktion von 1 t Roheisen etwa 1 t Koks erforderlich. Begründen Sie den Unterschied zu
den theoretisch berechneten Werten.
→ „chemische Systeme“
Chemische Reaktionen
Chemische Reaktionen sind mit Energieumwandlungen verbundene Stoffumwandlungen.
Es reagieren Ausgangsstoffe zu Reaktionsprodukten.
Aktivierungsenergie beschleunigt die Teilchen und bricht so die Teilchenbindungen auf.
Eine Stoffumwandlung findet nun statt.
2 Mg
+
silbern glänzendes Metall
Metall
A u s g a n g s s
⎯⎯→
O2
t o
farbloses Gas
Molekülsubstanz
f f e
2 MgO
weißes Pulver
Ionensubstanz
Reaktionsprodukt
Q = Energie der Reaktionsprodukte - Energie der Ausgangsstoffe
endotherme Reaktion
exotherme Reaktion
Bei endothermen Reaktionen ist die chemische Energie der Reaktionsprodukte größer als die der
Ausgangsstoffe. Folglich ist Q stets positiv.
Bei exothermen Reaktionen ist die chemische Energie der Reaktionsprodukte geringer als die der
Ausgangsstoffe. Folglich ist Q stets negativ.
Der Elektronegativitätswert ist ein Vergleichsmaß für die Anziehungskräfte von Atomen unterschiedlicher
Elemente auf gemeinsame Elektronenpaare.
Die Arten der chemischen Bindungen bestimmt man durch die Differenz der Elektronegativitätswerte der
einzelnen Stoffe.
Arten von chemischen Bindungen:
1. Atombindung:
Eine Atombindung besteht, wenn Atom durch gemeinsame Elektronenpaare
zusammengehalten werde.
0 – 0.8
2. Metallbindung:
Eine Metallbindung besteht, wenn Teilchen durch Anziehungen zwischen positiv
geladenen Metallionen und beweglichen Elektronen zusammengehalten werden.
3. polare Atombindung: Eine polare Atombindung besteht, wenn bei einer Atombindung ein Atom das
gemeinsame Elektronenpaar stärker anzieht/beansprucht als das andere.
0.9 – 1.6
4. Ionenbindung:
Eine Ionenbindung besteht, wenn Teilchen durch Anziehungen zwischen
entgegengesetzt geladenen Ionen zusammengehalten werden.
1.7 – J (3.3 ist bekanntes Maximum)
Energie eines chemischen Systems
u = ukern + uchemisch + uthermisch
Energie ist die Fähigkeit eines Systems Arbeit zu verrichten.
Es gibt drei Arten chemischer Systeme:
1.
2.
3.
abgeschlossenes System: Es findet weder Stoff- noch Energieaustausch mit der Umwelt statt.
geschlossenes System: Es findet Energie- aber kein Stoffaustausch mit der Umwelt statt.
offenes System:
Es findet Energie- und Stoffaustausch mit der Umwelt statt.
Extensive und Intensive Größen
Zur quantitativen Beschreibung
stofflicher Systeme dienen Größen und
Größengleichungen. Man unterscheidet
extensive und intensive Größen.
Extensive Größen sind solche Größen,
deren Wert sich bei der Vereinigung
zweier gleicher stofflicher Systeme
verdoppelt.
Intensive Größen ändern bei der
Vereinigung zweier gleicher stofflicher
ihren Wert nicht Viele intensive
Größen werden durch die Division
zweier extensiven Größen gebildet.
Besondere Bedeutung haben die
molaren Größen.
ΔU
= U2 - U1 = Q + W
W = F * Δs
W steht für die Volumenarbeit
W = F * A / A * Δs
ΔU
= U2 – U1 = Q - p * ΔV
W = -p * ΔV
VM = 22,414 l/mol
T = 273,15K
Zustandsgleichung eines idealen Gases:
p = 101 325 Pa
p * V / T = konstant
Der konstante Wert entspricht der universellen
Gaskonstante R (8, 314 510 J / (K * mol)).
p1 * V1 / T1 = p2 * V2 / T2
Berechne die Volumenarbeit.
Mg(s)
+
VH2 = 22,414
W = -101 325 Pa * 22,414 l
V * (101 325 N/m²) / 294,5 K = R
Begriffsklärung:
⎯⎯→
2 HCL(l)
W = -p * ΔV
Isobar
Isotherm
Isochor
Reaktionsenthalpie Δrh
MgCl2 +
H2
ΔV = 22,414
W = -101 325 N/m² * 22,414 dm²
V = 24,123 l
Der Druck bleibt konstant.
Die Temperatur bleibt konstant.
Das Volumen bleibt konstant.
Molare Reaktionsenthalpie ΔrH
Bei Prozessen, die isobar ablaufen nennt man die Reaktionswärme Q Reaktionsenthalpie ΔRH.
h =u+p*V
Δh = h2 – h1 = (u2 + pV2) – (u1 + pV1)
Δrh = qp (Das kleine p bedeutet, das der Druck konstant ist).
Kaloriemetrische Bestimmung der Reaktionsenthalpie
Voraussetzungen für die kaloriemetrische Bestimmung der Reaktionsenthalpie sind
das die Reaktion ohne große Volumenänderung aber vollständig abläuft. Es muß
auch ein gut meßbarer Wärmeumsatz vorhanden sein.
ΔRH = mH2O * cH2O * ΔT / n
ΔRH = mH2O * cH2O * ΔT * MRp / mRp
c...spezifische Wärmekapazität
mH2O = 950 g
T1 = 24,0°C
T2 = 30,0°C
TΔ = 6,0 °K
mFe = 15,0 g
mS = 8,6 g
mRp = 23,6 g
cH2O = 4,19KJ / (Kg * K)
MRp =MFe + MS = 87,92 g/mol
ΔRH = 0,95 Kg * 4,19KJ / (Kg * K) * 6,0 K * 87,92 g/mol / 23,6 g
ΔRH = 88,97 KJ * K / mol
Mögliche Fehlerquellen bei der kaloriemetrischen Messung der Reaktionsenthalpie sind: Der Reaktionsumsatz
war möglicherweise nicht vollständig, schon die Wärmekapazität des Reagenzglases verfälscht das Ergebnis und
die Isolierung konnte unter Umständen eine Wärmeabgabe an die Umwelt nicht verhindern.
ΔU
= U2 - U1 = Q + W; W steht für die Volumenarbeit.
exotherme Reaktionen
endotherme Reaktionen
Energiediagramm einer exothermen Reaktion, bei der
Volumenarbeit vom System verrichtet wird.
Energiediagramm einer endothermen Reaktion,
Bei der Volumenarbeit vom System verrichtet
wird.
z.B. CaCO3 ⎯→ CaO + CO2
z.B. Mg + 2HCl ⎯→ MgCl2 + H2
Energiediagramm einer exothermen Reaktion, bei der
Volumenarbeit vom System aufgenommen wird.
z.B. N2 + 3H2 ⎯→ 2NH2
Energiediagramm einer endothermen Reaktion,
Bei der Volumenarbeit vom System
aufgenommen wird.
z.B. ???
Für die Zersetzung von zwei mol CaCO3 beträgt die Energieänderung ΔrU 350,2 KJ.
Ermittle die Reaktionsenthalpie ΔrH und Die Volumenarbeit W.
CaCO3 ⎯→ CaO + CO2
ΔV
= 22,414 l da die beiden Feststoffe CaCO3 und CaO etwa das gleiche Volumen haben, aber ein mol CO2
hinzugekommen ist und als Gas ein Volumen von 22,414 l hat.
Dieses Volumen wird in m³ umgerechnet, ergibt also 0,022414m³.
Als Druck wird der Normdruck von 101 325 Pa angenommen.
W = p * ΔV; Die Volumenarbeit ist, da sie vom System verrichtet wird, negativ.
W = -101 325 Pa * 0,022414 m³
W = -2271,0986 J = -2,271 KJ
ΔU = Q + W
(ΔU / 2)– W = Q = ΔrH; da die Reaktionswärme der Reaktionsenthalpie entspricht und 2 mol umgesetzt wurden.
(350,2 KJ / 2) - -2,271 KJ = 177,3711 KJ / mol
Die Reaktionsenthalpie beträgt 177,4 KJ / mol und die Volumenarbeit –2,271 KJ.
Bestimme die Reaktionsenthalpie ΔRH der Reaktion von Magnesium und
Salzsäure experimentell!
Mg + 2HCL ⎯→ MgCl2 + H2
Zwei Bechergläser werden ineinander gestellt, um den Wärmeverlust
möglichst klein zu halten. Zuerst wird die Salzsäure eingefüllt und die
Temperatur gemessen. Danach wird das Magnesium hinzugegeben und
das Becherglas abgedeckt. Man wartet, bis sich die Temperatur des ganzen
nicht mehr ändert und notiert diese schließlich.
Da die Salzsäure selbst Wasser enthält, braucht man nur deren Erwärmung
zum Berechnen der Enthalpie.
Wir nahmen 50ml einmolaren Salzsäure und 597,25 mg Magnesium. Die
Anfangstemperatur T1 betrug 23°C und die Endtemperatur T2 55,7°C.
Klärung: einmolar ist die Konzentration (c), errechnet aus n/v.
vHCL = 50ml
nHCL = 0,05 mol (da ein mol pro Liter)
mMg = 597,25mg
nMg = 0,024568 mol; da MMg = 24,31 g/mol
T2 = 55,7°C
T1 = 23°C
ΔT = 32,7 K
mH2O = mHCL = 50 g = 0,05 Kg (da die Dichte von Wasser 1g / ml beträgt)
MRP = 2 * MCl + MMg = 95,21 g / mol
mRP = nMg * MRP (da weniger Magnesium als Salzsäure vorhanden ist, und nur so viel reagieren kann, wie da ist)
mRP = 2,340 g
cH2O = 4,19 KJ / (Kg * K) → c ist hier die spezifische Wärmekapazität, nicht mit Konzentration (c) verwechseln
ΔRH = (mH2O * cH2O * ΔT * MRP) / mRP
ΔRH = -278,7264 KJ/mol (da Reaktion exotherm ist die Reaktionsenthalpie negativ).
Die Reaktionsenthalpie der Reaktion Mg + 2HCL ⎯→ MgCl2 + H2 beträgt –278,7 KJ / mol.
Die Bestimmung der Neutralisationsenthalpie:
Bestimme die Neutralisationsenthalpie der Reaktion zwischen
Kaliumhydroxid und Salzsäure!
100ml 1M HCl reagieren mit 100 ml 1M KOH.
HCl + KOH ⎯→ H2O + KCl
100ml HCl sind 0,1 mol
100ml KOH sind auch 0,1 mol.
Die Anfangstemperatur beträgt 22,4°C und die Endtemperatur 28°C.
ΔT = 5,6 K
100 ml einmolarer Salzsäure reagieren mit 100ml einmolarer
Kaliumhydroxid-Lauge zu 200ml ½ molarer Kaliumchloridlösung.
Der Formelumsatz beträgt 0,1 mol.
Wieder werden die 200ml in KOH und HCL enthaltene Wasser als
Wärmespeicher benutzt.
ΔRH = mH2O * cH2O * ΔT / n
ΔRH = 0,2 Kg * 4,19 KJ / (Kg * K) * 5,6 K / 0,1 mol
ΔRH = -46,928 KJ / mol (negativ da Reaktion exotherm)
Die Neutralisationsenthalpie der Reaktion zwischen Salzsäure und Kaliumhydroxid beträgt –47 KJ / mol.
Der Satz von Hess
Die molare Bildungsenthalpie ΔBH gibt die Energie die bei der Bildung eines Mols der Entsprechenden Substanz
aus den Elementen frei bzw. aufgenommen wird an.
Die molare Bildungsenthalpie ist bei Elementsubstanzen wie z.B. O2 oder H2 stets 0.
Bestimme die Reaktionsenthalpie ΔRH der Reaktion von Schwefeltrioxid und Wasser!
SO3 + H2O ⎯→ H2SO4
ΔRH = ΔBHH2SO4 - ΔBHH2O - ΔBHSO3
ΔRH = -814 KJ/mol - -285 KJ/mol - -396 KJ/mol
ΔRH = -133 KJ/mol
Die Reaktionsenthalpie ΔRH der Reaktion von Schwefeltrioxid und Wasser beträgt –133 KJ/mol.
Bestimme die Reaktionsenthalpie der Photosynthese.
6 CO2 + 6 H2O ⎯→ C6H12O6
ΔBHCO2 = -393,5 KJ/mol
ΔBHH2O = -285 KJ/mol
ΔBHC6H12O6 = -1260 KJ/mol
ΔRH = ΔBHC6H12O6 - 6 * ΔBHCO2 - 6 * ΔBHH2O
ΔRH = 2811 KJ/mol
Achtung! Die Stöchiometriezahlen werden mit der Bildungsenthalpie ΔBH multipliziert!
Gegeben seien folgende drei Reaktionen, berechne die Reaktionenthalpie der vierten!
I
II
III
IV
C + O2 ⎯→ CO2
H2 + ½ O2 ⎯→ H2O
CH4 + 2 O2 ⎯→ CO2 + 2 H2O
C + 2 H2 ⎯→ CH4
ΔRHI = -393,5 KJ/mol
ΔRHII = -286 KJ/mol
ΔRHIII = -890,7 KJ/mol
ΔRHIV = ???
Da Elementsubstanzen eine molare Bildungsenthalpie von 0 KJ/mol besitzen, kann man aus der ersten
Reaktionsgleichung die Bildungsenthalpie von CO2 herleiten: ΔBHCO2 = ΔRHI – 0 KJ/mol – 0 KJ/mol = ΔRHI = 393,5 KJ/mol.
Nun benötigen wir die Bildungsenthalpie von Wasser, ΔBHH2O und die wird aus der zweiten Gleichung genau
wie die von CO2 errechnet: ΔBHH2O = ΔRHII – 0 KJ/mol - 0 KJ/mol = -286 KJ/mol, da O2 und H2 beides
Elementsubstanzen sind.
Jetzt können wir die Bildungsenthalpie von Methan ΔBHCH4 errechnen: ΔBHCH4 = 2 * ΔBHH2O - ΔBHCO2 - ΔRHIII =
2 * -286 KJ/mol + -393,5 KJ/mol – -890,7 KJ/mol = -74,8 KJ/mol, da sich die Reaktionsenthalpie Differenz der
Bildungsenthalpien der Reaktionsprodukte und der Bildungsenthalpien der Ausgangsstoffe ergibt.
Da nun O2 und CO2 Elementsubstanzen sind, entspricht die Reaktionsenthalpie der vierten Reaktion ΔRHIV der
Bildungsenthalpie von Methan, nämlich –74,8 KJ/mol.
Energetische Betrachtungen chemischer Verfahren
Kalkbrennen
Berechne die Menge von Koks, die benötigt wird, um eine Tonne Kalk zu brennen!
Kalkbrennen: CaCO3 ⎯→ CaO + CO2
ΔBHCO2 = -393,5 KJ/mol
ΔBHCaO = -635 KJ/mol
ΔBHCaCO3 = -1207 KJ/mol
ΔRHCaCO3 = ΔBHCaO + ΔBHCO2 - ΔBHCaCO3
ΔRHCaCO3 = 178,5 KJ/mol
Die Reaktionsenthalpie gilt für ein Mol, sie muß also auf eine Tonne
umgerechnet werde; dazu berechnet man zuerst, wieviel Mol Kalk eine
Tonne wiegen, um dann die erhaltene Stoffmenge mit der (molaren)
Reaktionsenthalpie zu multiplizieren.
MCaCO3 = MCa + MC + 3 MO = 100,087 g/mol
1t = 1 000 000g
nCaCO3 = mCaCO3 / MCaCO3 = 9991,3076 mol
ΔRhCaCO3 = nCaCO3 * ΔRH = 178,5 KJ/mol * 9991,3076 mol = 1783448,4 KJ
Um nun zu errechnen, wieviel Mol Koks man verbrennen muß, um diese Energie freizusetzen, berechnet man
zuerst die molare Reaktionsenthalpie bei eben dieser Verbrennung um dann die benötigte Energie zum
Kalkbrennen durch den Betrag davon zu dividieren.
Koksverbrennung: C + O2 ⎯→ CO2
Diese Reaktion muß exotherm soviel Energie freisetzen, wie das Kalbenden endotherm benötigt.
ΔBHC = 0 KJ/mol (Elementsubstanzen haben stets eine Bildungsenthalpie von 0 KJ/mol)
ΔBHO2 = 0 KJ/mol
ΔBHCO2 = -393,5 KJ/mol
ΔRHCO2 = -393,5 KJ/mol
nC = ΔRhCaCO3 / ΔRHCO2 = 1788444,1 KJ / 393,5 KJ/mol = 4532,2704 mol
Um nun schließlich und endlich die Masse Koks zu errechnen multipliziert man die Stoffmenge Koks mit der
molaren Masse von Koks.
MC = 12,01 g/mol
mC = MC * nC = 4550,7482 mol * 12,01 g/mol = 54432,567 g.
Die Masse Koks, die benötigt wird, um eine Tonne Kalk zu brennen, beträgt 54,4 Kg.
Eisenherstellung
C + O2 ⎯→ CO2
ΔRH = -393,5 KJ/mol
ΔRH = +172 KJ/mol
C + CO2 ⎯→ 2 CO
Fe2O3 + 3 CO ⎯→ 2 Fe + 3 CO2 ΔRH = -23,5 KJ/mol
Die Richtung chemischer Reaktionen
Frage: Wann laufen chemische Reaktionen freiwillig ab?
Teilchen versuchen bei chemischen Reaktionen einen möglichst stabilen Zustand zu erreichen.
Je energieärmer ein Teilchen ist, desto stabiler ist sein Zustand.
Daraus folgt:
Chemische Reaktionen laufen dann freiwillig ab, wenn ein möglichst energiearmer Zustand erreicht wird, d.h.
exotherme Reaktionen sollten immer freiwillig ablaufen, endotherme dagegen nicht.
Experiment I:
Experiment II:
Ein in Aceton getränkter Wattebausch wird um ein Thermometer gewickelt.
Das Aceton verdunstet und das Thermometer zeigt deutlich eine Abkühlung an.
Bariumhydroxid (Ba(OH)2) und NH4(SCN) werden in einem Reagenzglas vermischt.
Die beiden Pulver reagieren miteinander und das Gefäß kühlt stark ab
Aus diesen Experimenten wird ersichtlich: Es gibt aber auch endotherme Reaktionen die freiwillig ablaufen
Der 2. Hauptsatz der Thermodynamik lautet: Bei Vorgängen in einem abgeschlossenen System bleibt die
Entropie s bei ideal umkehrbarem (reversiblem) Verlauf konstant, beim tatsächlichen Ablauf in Natur und
Technik nimmt sie stets zu.
Die Entropie s ist ein Maß für die Unordnung eines Systems: Je größer die Entropie eines Systems ist, desto
größer ist die Unordnung.
Die molare Standardreaktionsentropie ΔRSθ einer chemischen Reaktion ist gleich der Differenz aus den
Standardentropien der Reaktionsprodukte und den Standardentropien der Ausgangsstoffe.
Die Reaktionsentropie einer chemischen Reaktion kann auch kleiner als null sein, wenn das stoffliche System
kein abgeschlossenes System ist.
Siehe auch → Leben und Energie
Die Standardentropie ist die Entropie eines Stoffes bei Zimmertemperatur (25°C) und Normdruck.
ΔS
=Q/T
Die Gibbssche Energie oder auch freie Enthalpie ΔG
Δ RG = Δ RH – T * Δ S
Reaktionen, bei denen die freie Reaktionsenthalpie kleiner als 0 KJ/mol ist, laufen freiwillig ab, man nennt sie
exergonisch.
Ist bei einer Reaktion die freie Reaktionsenthalpie größer als 0 KJ/mol, so läuft diese nicht freiwillig ab (durch
Zuführen von Energie usw. kann sie aber dennoch ablaufen). Diese Reaktionen heißen endergonische
Reaktionen.
Sollte die freie Reaktionsenthalpie gar 0 KJ/mol betragen, so befindet sich das chemische System im
Gleichgewicht.
Läuft die Verbrennung von Koks bei Zimmertemperatur freiwillig ab?
C + O2 ⎯→ CO2
Zuerst müssen wir die Reaktionsenthalpie ΔRH bestimmen, diese errechnen wir aus der Differenz der
Bildungsenthalpien ΔBH der Reaktionsprodukte und der Bildungsenthalpien der Ausgangsstoffe. In Unserem
Fall sind die Ausgangsstoffe C (Kohlenstoff = Koks) und O2 beides Elementsubstanzen und haben deshalb eine
Bildungsenthalpie von 0 KJ/mol. Das Reaktionsprodukt, Kohlenstoffdioxid (CO2), hat eine Bildungsenthalpie
von –393,5 KJ/mol. Also beträgt die Reaktionsenthalpie der Verbrennung von Koks –393,5 KJ/mol – 0 KJ/mol –
0 KJ/mol, nämlich –393,5 KJ/mol.
Als nächstes müssen wird die Zimmertemperatur T, 25°C, in Kelvin umrechnen: 25°C + 273,15 K = 298,15 K.
Danach rechnen wir die Änderung der Entropie, ΔS, aus der Differenz der Standardentropien der
Reaktionsprodukte und der Standardentropien ΔRSθ der Ausgangsstoffe aus. Koks (C) hat eine Standardentropie
von 6 J/(mol * K), Sauerstoff hat eine von 205 J/(mol * K) und Kohlenstoffdioxid eine von 214 J/(mol * K).
Nach der Gleichung ΔS = 214 J/(mol * K) – 205 J/(mol * K) – 6 J/(mol * K) ergibt sich eine Entropieänderung
von 3 J/(mol/K). Diese 3 Joule pro Mol und Kelvin müssen wir noch in KJ/(mol * K) umrechnen, dann ergibt
sich ΔS = 0,003 KJ/(mol * K). Jetzt haben wir alle Größen, die wir in die Gleichung zu Bestimmung der freien
Enthalpie ΔRG einsetzen müssen.
ΔRG = ΔRH – T * ΔS
ΔRG = -393,5 KJ/mol – 298,15 K * 0,003 KJ/(mol * K) = -392,6555 KJ/mol.
Die molare freie Reaktionsenthalpie ΔRG beträgt bei der Verbrennung von Koks bei Zimmertemperatur also
-392,6 KJ/mol, die Reaktion ist also exergonisch und läuft freiwillig ab.
Läuft diese Reaktion immer freiwillig ab?
Eine Reaktion läuft nicht mehr freiwillig ab wenn die freie Reaktionsenthalpie größer als 0 KJ/mol ist. Die
Reaktionsenthalpie und die Entropieänderung haben wir oben bereits ausgerechnet, nun müssen wir nur noch für
die freie Reaktionsenthalpie ΔRG 0 KJ/mol einsetzen.
0 KJ/mol < -393,5 KJ/mol – T * 0,003 KJ/(mol * K)
Diese Gleichung stellen wir nach der Temperatur T um, und erhalten die Temperatur, unterhalb der die Reaktion
nicht mehr freiwillig abläuft.
ΔRG < ΔRH – T * ΔS
ΔRG - ΔRH < -T * ΔS
(ΔRG - ΔRH) / ΔS < -T
-(ΔRG - ΔRH) / ΔS > T
So, jetzt setzen wir die entsprechenden Werte ein und erhalten
–(0 KJ/mol - -393,5 KJ/mol) / 0,003 KJ/(mol * K) > T, ausgerechnet ergibt sich eine Temperatur von
–131166 2/3 K. Da die Kelvinskala aber nur bis zum Absoluten Nullpunkt von 0K reicht, und keine reale
Temperatur darunter liegen kann, ist dieses Ergebnis unmöglich. Das bedeutet, das die Reaktion immer freiwillig
abläuft.
Die Reaktionsgeschwindigkeit
Reaktionsgeschwindigkeit
Experiment:
Es wird zu Magnesium je 1; 0,5 und
0,25 Molare Salzsäure gegeben und die Zeit gemessen,
die benötigt wird um ein bestimmtes Volumen Gas
(Wasserstoff) herzustellen.
⎯→
v = Δn / Δt
Ausblick: v = dc / dt.
Die Reaktionskinetik untersucht den zeitlichen Ablauf
einer chemischen Reaktion und die Möglichkeiten,
diesen zu verändern.
1
0,8
t in s
da die Konzentration c der Stoffanzahl n durch das
Volumen V entspricht und das Volumen konstant
bleibt folgt c~n, also gilt v = Δc / Δt .
1,2
0,6
0,4
0,2
0
0
5
10
15
20
c in mol/l
25
30
35
Reagiert der Stoff A zum Stoff B, so gelten folgende Gleichungen für die Reaktionsgeschwindigkeiten.
A ⎯→ B
Durchschnittsgeschwindigkeit:
Augenblicksgeschwindigkeit:
vR = - ΔcA / Δt = ΔcB / Δt
vR = -dcA / dt = dcB / dt
Die Augenblicksgeschwindigkeit entspricht der Durchschnittsgeschwindigkeit, wenn Δt gegen 0 geht.
Die Reaktionsgeschwindigkeit vR einer chemischen Reaktion ist gleich dem Differentialquotienten der
Konzentration nach der Zeit.
Die Reaktionsordnungen
Die Ordnung einer chemischen Reaktion entspricht der Summe der Stöchiometriezahlen der Ausgangsstoffe.
Reaktion 1. Ordnung:
Reaktion 2. Ordnung:
Reaktion 3. Ordnung:
.
.
.
Reaktion n. Ordnung:
A
A + B
2A
A + B + C
A + 2B
2A + B
3A
nA
.
.
.
A + B + ...
⎯→
⎯→
⎯→
⎯→
⎯→
⎯→
⎯→
Reaktionsprodukte (RP)
RP
RP
RP
RP
RP
RP
⎯→ RP
⎯→ RP
Die Exponenten der Konzentrationen der Ausgangsstoffen entsprechen ihren Stöchiometriezahlen.
Die Stoßtheorie
Damit Teilchen der Ausgangsstoffe zu Teilchen der Reaktionsprodukten Reagieren können, müssen diese
zusammenstoßen. Nicht bei jedem Zusammenstoß von Teilchen klappt das jedoch, denn es müssen drei
Bedingungen erfüllt sein:
1. Die Teilchen müssen von den richtigen Stoffen sein (bei der Reaktion H2 + Cl2 ⎯→ HCl bringt es nichts,
wenn zwei Wasserstoffmoleküle zusammenstoßen).
2. Die Geschwindigkeit der Teilchen muß groß genug sein, so daß der Zusammenstoß heftig genug ist um die
Bindungen der Ausgangsstoffe aufzubrechen und die Teilchen reagieren können.
3. Und schließlich müssen die Teilchen sich auch noch an der richtigen Stelle treffen, um reagieren zu können.
Worin äußert sich das chemisch?
Erhöht man die Konzentration eines Ausgangsstoffes, so
erhöht sich auch die Wahrscheinlichkeit, das sich Teilchen
von en richtigen Stoffen mit der richtigen Geschwindigkeit
an der richtigen Stelle treffen. Die Reaktionsgeschwindigkeit steigt also.
Gleiches gilt bei Temperaturerhöhung, denn die Teilchen prallen weit heftiger zusammen.
Daraus ergeben sich folgende Gleichungen für die Reaktionsgeschwindigkeit:
Reaktion 1. Ordnung:
Reaktion 2. Ordnung:
A
2A
A + B
Reaktion 3. Ordnung:
3A
A + 2B
2A + B
A + B + C
.
.
.
Reaktion n. Ordnung:
nA
.
.
.
A + B + ...
⎯→ RP
⎯→ RP
⎯→ RP
⎯→
⎯→
⎯→
⎯→
RP
RP
RP
RP
vR = k1 * cA
vR = k2 * cA²
vR = k2 * cA * cB
vR
vR
vR
vR
=
=
=
=
k3 * cA³
k3 * cA * cB²
k3 * cA² * cB
k3 * cA * cB * cC
⎯→ RP
vR = kn * cAn
⎯→ RP
vR = kn * cA * cB * ...
k ist die Reaktionsgeschwindigkeitskonstante.
Bei einer Reaktion 1. Ordnung ist die Reaktionsgeschwindigkeit proportional zur Konzentration der zerfallenden
Moleküle.
Beispiel:
S2O8- + 2 I- ⎯→ 2 SO42- + I2
Dies ist eine Reaktion 3. Ordnung (1 * S2O8- + 2 * I-) = 3
vR = cS2O8- + cI-²
Die Arrheinus-Gleichung
k = A * e–EA / (R * T)
EA ist die (Arrheniusche) Aktivierungsenergie
A ist der Frequenzfaktor (die Aktionskonstante bzw. Aktivitätskonstante)
T ist die Temperatur
R ist die universelle Gaskonstante
Reaktionshemmung und Aktivierungsenergie
Der Einfluß eines Katalysators auf die Aktivierungsenergie
Der Einfluß eines Katalysators auf die Aktivierungsenergie wird mit Hilfe des Zerfalls von Wasserstoffperoxid
mit und ohne den Katalysator Kaliumdichromat.
2 H2O2 → 2 H2O + O2
ohne Katalysator:
mit Katalysator:
nichts passiert
Die Flüssigkeit schäumt schwarz auf,
Gas entsteht und entweicht, dann beruhigt
sich das Ganze und wird Orange
Katalysatoren erhöhen die Reaktionsgeschwindigkeit und senken die
Aktivierungsenergie.
2 H2O2 ⎯→ 2 H2O + O2 (aber eben seeehr langsam..)
2 H2O2 + Kat ⎯→ 2 H2O2 – Kat* ⎯→ Kat + 2 H2O + O2
Der Katalysator geht stets unverändert aus der Reaktion hervor, obwohl sie an ihr teilnehmen.
Die Wirkung eines Katalysators ist substratspezifisch, ein Katalysator wirkt also nicht auf alle Substanzen
gleich.
Katalysatoren wirken selektiv, sie können bestimmte Reaktionen verstärken (positive Katalyse) und andere
hemmen (negative Katalyse) und auf wieder andere überhaupt keine Wirkung haben.
Man unterscheidet die heterogene Katalyse, bei der die Ausgangsstoffe (das Substrat) und der Katalysator
verschiedene Aggregatzustände innehaben (Beispiel: Autokatalysator), und die homogene Katalyse, bei der
Ausgangsstoffe (Substrat) und Katalysator den gleichen Aggregatzustand besitzen.
Beispiel Autokatalysator:
In den Motorblock des Autos wird der Treibstoff (Kohlenwassertoffe CHx) und Luft (O2, N2) gepumpt. Im Motor
wird der Treibstoff zu Wasser und Kohlenstoffdioxid, bei unvollständiger Verbrennung auch zu
Kohlenstoffmonoxid, verbrannt. Etwas Treibstoff wird auch so wie er reinkam wieder in die Umwelt
hinausgepustet. Durch die hohe Temperatur im Motor wird auch der Luftstickstoff zu NOx oxidiert. Nur die
Stickoxide und das Kohlenstoffmonoxid sind umweltschädlich, sie müssen als im Autokatalysator umgewandelt
werden.
Folgende Reaktion findet statt: x CO + 2 NOx → x CO2 + N2. Die geschieht durch den Einfluß des PlatinRhodium-Gemisch im Kern des Katalysators.
Beispiel Seltersflasche:
Steckt man einen Strohalm in eine Seltersflasche (mit Selters drin), so bilden sich sofort an ihm kleine Bläschen
Kohlenstoffdioxid.
⎯→
Strohalm
H2CO2
= Katalysator
CO2 + H2O
Reaktion mit unvollständigem Stoffumsatz – chemische Gleichgewichte
'
abkühlen
Stärke
+
Jodlösung
Jodstärke
erhitzen
Stärke ist ein Polysacharid aus Alphaglucose. Gibt man Jod zu stärke, so lagert sich dieses in die Alphaglucose
ein. Man kann das Jod schlechter sehen, da es verdeckt wird, die Mischung wird bräunlich. Wenn man das
Gemisch erhitzt, so steigt die kinetische Energie der Jodmoleküle und diese verlassen die Glucosemoleküle,
werden besser sichtbar und die Mischung wird blau, die Farbe des Jodes in freier Wildbahn.
Experiment zum chemischen Gleichgewicht
Modellexperiment zum chemischen Gleichgewicht:
40
35
30
v in ml
25
AS
RP
20
15
10
5
0
0
10
20
30
40
50
60
70
Man nehme zwei Meßbecher und fülle den einen mit
einer farbigen Flüssigkeit (bei uns mit 38ml rot gefärbtem
Wasser). Nun werden zwei Glasröhrchen pro Zeiteinheit
in je einen Meßbecher getaucht, oben zugehalten (damit
die Flüssigkeit drinbleibt), und in den je anderen
Meßbecher entleert. Nach einer gewissen Zeit ändert sich
der Stand der Flüssigkeit in beiden Meßbechern nicht
mehr, ein Gleichgewicht hat sich eingestellt.
80
Zeiteinheiten
A + B ⎯→ C + D
Merkmale eines chemischen Gleichgewichts:
Das chemische Gleichgewicht ist ein dynamisches Gleichgewicht.
vHinreaktion = vRückreaktion
vGesamt = 0
ΔcA = ΔcB = ΔcC = ΔcD = 0
Das chemische Gleichgewicht stellt sich von beiden Seiten her ein.
Die Lage des chemischen Gleichgewichts entspricht dem Verhältnis der Ausgangsstoff zu den
Reaktionsprodukten.
Die Gleichgewichtskonstante Kc:
vHinreaktion
vRückreaktion
= kHinreaktion * cA * cB
= kRückreaktion * cC * cD
kHinreaktion / kRückreaktion
Kc
= cC * cD / (cA * cB)
= cC * cD / (cA * cB)
Kc ist proportional zu den Konzentrationen der Reaktionsprodukte und umgekehrt proportional zu den
Konzentrationen der Ausgangsstoffe.
Die Gleichgewichtskonstante Kc wird hauptsächlich bei Reaktionen angewandt, deren Ausgangsstoffe bzw.
Reaktionsprodukte keine Gase sind.
Stöchiometriezahlen beachten! Siehe Stoßtheorie/Reaktionsgeschwindigkeit!
Beispiel:
N2 + 3 H2 ⎯→ 2 NH3
Kc NH3 = c²NH3 / (cN2 * c³H2)
Das Massenwirkungsgesetz: Im chemischen Gleichgewicht ist bei einer bestimmten Temperatur der Quotient
des Produktes der Konzentrationen der Reaktionsprodukte und des Produktes der Konzentrationen der
Ausgangsstoffe eine konstante Größe.
Die Gleichgewichtskonstante Kp:
Für Gasreaktionen wird die Gleichgewichtskonstante Kp verwendet:
Kp = pC * pD / (pA * pB)
Es gilt: p * V = n * R * T und n / v = c und P = c * R * T und c = P / (R * T) woraus folgt:
ν...Änderung der Stoffmenge der Gase
Kp = Kc * (R * T)Δν
Aufgabe 1:
Die Gleichgewichtskonstante für die Bildung von Essigsäureethylester aus Essigsäure und Ethanol beträgt bei
25°C Kc = 4.
Wie groß ist die Stoffmenge an Ester, wenn von 5 mol Essigsäure und 3 mol Ethanol ausgegangen wird.
Reaktionsgleichung
Start
Gleichgewicht
4
n²
0
n½
n1
n2
=
=
=
=
=
=
CH3COOH
5 mol
5 mol – n
+
C2H5OH
3 mol
3 mol – n
' CH3COOC2H5
0 mol
n
+
H2O
0 mol
n
n² / ((5 mol – n)(3 mol – n))
4 n² - 32 mol * n + 60 mol²
n² - 32/3 mol * n + 20 mol²
16/3 mol ± √(256 / 9 mol² - 20 mol²)
8,24 mol (geht nicht, da nie mehr als einer der Ausgangsstoffe rauskommen kann!)
2,43 mol
Die Ausbeute η
Die Ausbeute η eines Reaktionsproduktes gegenüber einem Ausgangsstoff ist der Quotient aus der erhaltenen
Stoffmenge des Reaktionsproduktes und der Stoffmenge des Ausgangsstoffes, die am Beginn der Reaktion
vorhanden war. Normalerweise wird der Ausgangsstoff eingesetzt, der mit der geringsten Stoffmenge am
Reaktionsbeginn vorhanden war.
Der Wirkungsgrad einer Reaktion entspricht der Ausbeute des gewünschten Reaktionsproduktes gegenüber dem
Ausgangsstoff, der mit der geringsten Stoffmenge eingesetzt wurde.
Aufgabe 2:
Berechne die Ausbeute an Essigsäureethylester gegenüber Ethanol aus den Werten von Aufgabe 1 auf der
vorherigen Seite.
nEthanolStart
nEsterEnde
= 3 mol
= 2,43 mol
η = 2,43 mol / 3 mol
η = 0,81 = 81 %
Der Satz von Henri Le Châtelier und Karl-Ferdinand Braun
Wird aus ein sich im chemischen Gleichgewicht befindendes stoffliches System ein Zwang ausgeübt, dann
weicht dieses System dem Zwang so aus, daß die Wirkungen des Zwangs verringert werden.
Erklärung an der Beispielreaktion:
C(f)
+
H2O(g)
'
CO(g)
+
H2(g)
Bei der Hinreaktion wird aus einem Mol Gas zwei, das Volumen nimmt also zu (Reaktion mit
Volumenzunahme) und sie ist endotherm (ΔRH = 131 KJ/mol). Für die Rückreaktion gilt also das Gegenteil.
1.
Erhöhung der Konzentration eines Stoffes begünstigt die Reaktion, welche diesen Stoff verbraucht.
Gibt man also mehr Wasserdampf zu, so wird die Hinreaktion gefördert, bei Erhöhung
Kohlenstoffmonoxidkonzentration entsteht mehr Kohlenstoff und Wasserdampf.
2.
Verringerung der Konzentration eines Stoffes begünstigt die Reaktion, welche diesen Stoff erzeugt.
Senkt man also die Wasserstoffkonzentration, so wird die Hinreaktion verstärkt
3.
Erhöht man den Druck auf das Gleichgewicht, so wird die Reaktion verstärkt, welche das Gesamtvolumen
der Stoffe im Gleichgewicht senkt.
Erhöht man den Druck, verlagert sich das Gleichgewicht mehr in Richtung Ausgangsstoffe, da die
Rückreaktion das Volumen senkt (aus zwei Mol Gas wird eins).
4.
Senkt man den Druck, so wird die Reaktion mit der größten Volumenzunahme gefördert, bei unserem
Beispiel würde sich das Gleichgewicht mehr in Richtung Reaktionsprodukte verlagern.
5.
Erhöht man die Temperatur, so wird die Reaktion gefördert, die die meiste Wärme verbraucht.
Da unsere Beispielreaktion endotherm ist, würde sich das Gleichgewicht in Richtung Reaktionsprodukte
verlagern, da die Hinreaktion gefördert würde.
6.
Senkt man die Temperatur, so wird die Reaktion verstärkt, die die meiste Reaktionswärme freisetzt.
Bei uns ist das die Rückreaktion, es würden also mehr Ausgangsstoffe entstehen.
7.
Katalysatoren beeinflussen die Lage des chemischen Gleichgewichtes nicht, so verkürzen nur dessen
Einstellzeit (bei positiver Katalyse).
Hierbei wird deutlich, das die Gleichgewichtskonstanten Kc und Kp druck- (nur Kp) , temperatur- und
konzentrationsabhängig sind.
Das Löslichkeitsgleichgewicht
Gibt man Bariumchlorid in eine Sulfatlösung, so fällt schwerlösliches Baiumsulfat als
Niederschlag aus. Nach Beendigung dieser Fällung ist das System jedoch noch nicht
zum Stillstand gekommen, von dem gefällten Bariumsulfat lösen sich ständig
Bariumionen, die im selben Maß wieder ausfallen. Es liegt also ein dynamisches
Gleichgewicht vor.
Ba2+(aq) + SO42-(aq)
'
BaSO4(s)
Das Gleichgewicht hat sich dann eingestellt, wenn sich von dem Niederschlag, egal wie sehr man ihn auch rührt,
kein Bariumsulfat mehr löst. Dann ist die Lösung gesättigt und wird als Löslichkeitsgleichgewicht bezeichnet.
Der Niederschlag und die Lösung darüber bilden ein heterogenes System.
Werden Salze in Wasser gelöst, so werden die verschiedenen Ionen hydratisiert, d.h. das dipolare Wasser lagert
sich an ihre Hüllen an. (siehe → „Cytologie“, 4. Chemische Bestandteile der Zelle, 1.Wasser)
Experiment:
Je 1 ml einer gesättigten Bleinitratlösung wird mit
a) 1 ml gesättigter Kaliumjoditlösung
b) 1 ml gesättigter Natriumchloridlösung vermischt.
Beobachtung:
Es werden Ionen ausgefällt.
a) weißer Niederschlag
b) gelber Niederschlag
Das Löslichkeitsprodukt
Für die Sättigung der Lösung ist es egal, ob und wieviel Niederschlag vorhanden ist, dieser wird darum in der
Gleichung weggelassen.
Für das Löslichkeitsgleichgewicht
KL(MaLb)
= (cMm+)a
[KL(MaLb)]
Aufgabe:
*
'
MaLb
aMm+ + bLn- gilt:
(cLn-)b
1 mola+b * l-(a + b)
=
Wie groß ist die Stoffmengenkonzentration der Silberionen, die überschritten werden muß,
damit aus Natriumchloridlösung (c = 0,1 mol * l-1) Silberchlorid ausgefällt wird?
Geg:
cNaCl
KL(AgCl)
Ag+ + Cl-
Ges:
cAg
Lös:
KL(AgCl)
cAg+
cAg+
cAg+
= 0,1 mol*l-1
= 2 * 10-10 mol² * l-²
' AgCl
=
=
=
=
cAg+ * cClKL(AgCl) / cCl2 * 10-10 mol2 * l-2 / 0,1 mol * l-1
2 * 10-9 mol * l-1
Der Löslichkeitsexponent pKL
pKL = -lg{KL}
Die Van’t Hoffsche Temperaturregel
Die Van’t Hoffsche Temperaturregel (RGT) macht Aussagen über die Änderung der Reaktionsgeschwindigkeit
wenn sich die Temperatur ändert.
Die Geschwindigkeit des menschlichen Stoffwechsels halbiert sich zum Beispiel, wenn die Temperatur um 10K
sinkt.
Es gilt: vStoffwechsel2 = vStoffwechsel1 * 0,5ΔT/10
Die Van’t Hoffsche Temperaturisobare
(d ln{K}) / dT
=
ΔRH∅ / (R * T²)
R........... universelle Gaskonstante
ΔRH∅.... molare Reaktionsenthalpie
Die Lösungsenthalpie beim Lösen von Salzen
Beim Lösen von Salze werden die Ionen durch die elektrostatischen Wechselwirkungen mit den dipolaren
Wassermolekülen aus dem Kristallgitter gerissen.
Beim herausreißen der Ionen muß jedoch die Gitterenergie oder Gitterenthalpie ΔGH überwunden werden, die
die Ionen im Kristallgitter hält.
Sind die Ionen gelöst, so bilden sie eine Hydrathülle, wobei die Energie der Hydratationsemthalpie ΔHH frei
wird.
Man berechnet die Lösungsenthalpie ΔLH = ΔHH - ΔGH.
Ist dieser Wert negativ, so wird die Lösung durch die abgegebene Energie erwärmt, ist er positiv wird ihr
Energie entzogen und sie kühlt ab.
Die Färbung des Niederschlags bei Salzen / Fällungsreaktion
Positives Ion
Ag+
Ag+
Ag+
Fe2+
Ba2+ / Ca2+
||
Negatives Ion
ClBrIS2CO32|| + HCl
Färbung
weiß
gelbweiß
gelb
schwarz
weiß
löst sich auf
Positives Ion
Pb2+
Pb2+
Pb2+
Pb2+
Ba2+ / Ca2+
||
Negatives Ion
ClBrIS2SO42|| + HCl
Färbung
weiß
weiß
gelb
schwarz
weiß
löst sich nicht
Die Löslichkeit l
Die Konzentration eines Stoffes in seiner gesättigten Lösung wird als Löslichkeit l dieses Stoffes in dem
verwendeten Lösungsmittel bezeichnet.
Gilt die Reaktionsgleichung
so berechnet sich das Löslichkeitsprodukt
MaLb
'
aMm+ + bLn-,
KL(MaLb) = (cMm+)a * (cLn-)b.
Für die Löslichkeit gilt:
lMaLb
=
√( KL(MaLb) / aa * bb)
a+b
Beispiel:
In einer gesättigten Lösung von Silberchromat liegt folgendes Löslichkeitsgleichgewicht vor:
Ag2CrO4
'
2 Ag+ + (1) CrO42Das Löslichkeitsprodukt wird also so errechnet:
KL(Ag2CrO4)
=
(cAg+)² * cCrO42Die Reaktionsgleichung zeigt uns, das die Konzentration der Silberionen in der Lösung genau
doppelt so groß ist, wie die der Chromationen.
Ebenso entspricht die Löslichkeit des Silberchromats der der Chromationen und der Hälfte
der der Silberionen. Man könnte also schreiben:
lAg2CrO4 = cCrO42- = ½ cAg+
Für das Löslichkeitsprodukt erhält man dann:
KL(Ag2CrO4)
=
(2 * lAg2CrO4)² * lAg2CrO4
KL(Ag2CrO4)
=
4 * lAg2CrO43
Für die Löslichkeit des Silberchromats gilt also:
3
lAg2CrO4
=
√( KL(Ag2CrO4) / 4)
Aufgabe:
Ein Niederschlag von Silberchlorid wird mit 400ml Wasser gewaschen. Welche Masse an
Silberchlorid geht dabei verloren?
Geg:
vH2O
=
400 ml
=
0,4 l
KLAgCl
AgCl
MAgCl
Ges:
mAg in g
Lös:
KLAgCl
KLAgCl
lAgCl
lAgCl
nAgCl
nAgCl
mAgCl
mAgCl
mAgCl
=
'
=
2 * 10-10 mol² * l-2
Ag+
+
Cl143,32 g/mol
=
=
=
=
=
=
=
=
=
cAg+
*
cCl(lAgCl)²
√ KLagCl
3,162277 * 10-5 mol * l-1
lAgCl * vH2O
1.26911 * 10-5 mol
nAgCl * MAgCl
1.26911 * 10-5 mol * 143,32 g/mol
1,812870 * 10-3 g
Es gehen also 1,8 Milligramm Silberchlorid verloren.
Verringerung der Löslichkeit durch gleichionigen Zusatz:
Beispiel:
AgCl
'
Ag+
+
ClErhöht man die Konzentration der Chloridionen in einer bereits gesättigten Lösung, so sinkt die
Konzentration der Silberionen und Silberchlorid fällt aus.
Warum solches? Das Löslichkeitsprodukt KLAgCl ist konstant und errechnet sich folgendermaßen:
KLAgCl =
cAg+
*
cCl-.
Wenn man Chloridionen zugibt, so muß die Silberionenkonzentration sinken, damit KLAgCl
konstant bleiben kann.
Da die einzelnen Ionen jedoch nicht ausfallen können (sag‘ ich jetzt mal so...), muß also
Silberchlorid ausfallen.
Dies entspricht auch dem Satz von Henri Le Châtelier und Karl-Ferdinand Braun, der besagt,
dass das Gleichgewicht immer den Folgen eines ausgeübten Zwangs entgegenwirkt. Der
Anstieg der Reaktionsproduktkonzentration wäre hier die Folge, also werden
Reaktionsprodukte (Silber- und Chloridionen) in Silberchlorid umgewandelt, welches ausfällt.
Erhöhung der Löslichkeit durch Komplexbildung
Wenn man die mehr Silberchlorid im Wasser lösen, als es deren Löslichkeit zuläßt, so kann man Ammoniak
hinzugeben, und simsalabim – es geht!
Warum? Das Silberchlorid und der Ammoniak im Wasser reagieren miteinander wie folgt:
AgCl
+
2 NH3
'
[Ag(NH2)2]+
+
Cl-
Es entstehen Diamminsilberionen und Chloridionen, welche sich besser lösen, als nur Silber- und Chloridionen.
Dadurch werden die Silberionen aus dem Löslichkeitsgleichgewicht entfernt und es können sich mehr lösen.
Diesen Vorgang bezeichnet man als Komplexbildung.
Ab hier geht’s mit dem Atombau weiter.
Redoxreaktion
Redoxreaktionen sind chemische Reaktionen bei denen sich die Oxidationszahlen einzelner Elemente ändern.
Es finden Elektronenübergänge statt.
Eperiment:
Eise(III)Chloridlösung wird mit Kaliumjoditlösung vermischt.
-
Das Gemisch färbt sich dunkelbraun.
Bei der Extraktion mit Pentan färbt sich dieses lila.
2 Fe³+ + 3 Cl- + 2 K+ + 2 I→
I2+ + 2 Fe2+ 3 Cl- + 2 K+
Die braune und lilane Färbung rührt von dem Jod.
⏐
Oxidation_______
↓
±0
2 F3+ + 2 I→
2 Fe2+ + I2
|
Reduktion______ ↑
+3
-1
+2
Bei einer Oxidation nimmt die Oxidationszahl des entsprechenden Elements zu. Es findet eine Elektronenabgabe
statt.
Bei einer Reduktion nimmt die Oxidationszahl des entsprechenden Elements ab. Es findet eine
Elektronenaufnahme statt.
Das Oxidationsmittel (OM) wird reduziert, es ist ein Mittel zum oxidieren.
Das Reduktionsmittel (RM) wird oxidiert, es ist ein Mittel zum reduzieren.
Es gilt:
OM1
+
OM1:
Fe³+
RM2
'
RM1
+
OM2
RM1:
Fe2+
OM2:
I-
RM2:
I2
Redoxreaktionen bei der Eisengewinnung
⏐
Oxidation__________
↓
±0
±0
C
+
+3
O2
→
CO2
|
Reduktion_ __ ↑
⏐
-2
Fe2O3
|
+4 -2
CO2
|
±0
+4 -2
+
3 CO2
Das Aluminuthermische Schweißen als Redoxreaktion
⏐
Oxidation_____________________
±0
8 Al
±0
+
3 Fe3O4
|
±0
+4 -2
Oxidation_________
↓
3 CO →
2 Fe
Reduktion________↑
+2 -2
+
⏐
'
9 Fe
Reduktion______↑
↓
+3 -2
+
4 Al2O3
+
Oxidation___
↓
C
→
2 CO
Reduktion_________↑
+2 -2
PH-Wert abhängige Redoxreaktionen
Experiment:
a)
Kaliumpermanganatlösung wird mit Eisen(II)Sulfatlösung versetzt.
+7 -2
+4 -2
+2
MnO4-/MnO2
Oxidation:
Reduktion:
+3
Fe2+/Fe3+
Fe2+
MnO4- +
+
2 H 2O
'
'
MnO4- +
2 H 2O
'
-
3e
Fe3+
MnO2
+
+
e4 OH-
MnO2
+
4 OH-
Durch Ausgleichen errechnet man:
Redoxreaktion: 3 Fe2+
+
3 Fe3+
+
b) Kaliumpermanganatlösung wird mit Eisen(II)Sulfatlösung versetzt und mit H2SO4 angesäuert.
Oxidation:
Reduktion:
Fe2+
MnO4- +
Redoxreaktion: MnO4- +
'
'
-
5e
5 Fe2+
8 H+
+
Fe3+
Mn2+
+
+
e4 H2O
'
5 Fe3+
+
Mn2+
4 H2O
→
→
CO2
Mn2+
+
+
2 e4 H2O
+
2 Mn2+ +
8 H 2O
+
10 CO2
→
→
CO2
2 Cr3+
+
+
2 e7 H2O
+
2 H+
6 CO2
+
2 Cr3+
+
7 H2O
Weitere Beispiele:
Ox:
Red:
HOOC-COOH
MnO4-
Und die Redoxreaktion:
5 HOOC-COOH +
Oxidation:
Reduktion:
+
-
5e
6 H+
2 MnO4- +
HOOC-COOH
Cr2O72-
-
+
6e
Cr2O72-
Redoxreaktion: 3 HOOC-COOH +
→
→
2 H+
Die Photographie als Redoxreaktion
In der Belichtungsphase reagiert Silberbromid in den Punkten, auf die
Licht trifft, unter Energiezufuhr (Lich) zu Silber- und Bromionen.
→
n AgBr
Agn+
+
n Br+
Bei der Entwicklung wird mit Hilfe des Entwicklers, einem
Reduktionsmittel, das Silber reduziert.
Agn
→
Br+
Ag
AgBr +
red-
+
ox
In der Fixage wird nun das restliche, unbelichtete Silberbromid entfernt:
AgBr
+
2 Na2S2O3
→
[Ag(S2O3)4]3
+
+
Br4 Na
Dies wird zweimal durchgeführt, da man nach der ersten Fixage an den
Stellen, wo Licht war, nun Dunkelheit hat, man muß also den Film
sozusagen noch einmal photographieren.
Bau von Molekülen
a) Elektronenpaar-Abstoßungsmodell
Wasserstoffmolekül
H–H
E
kJ/mol
74 pm
0
Abstand
-436
Anzahl der Atombindungen im Molekül:
Oktettregel:
SO42
CH4
NH3
H2O
b) Orbitalmodell
Es entsteht bei der Wechselwirkung
der 1s-Atomorbitale ein bindendes und
ein antibindendes Molekülorbital. Das
σ-Molekülorbital ist
rotationssymmetrisch zur
Kernverbindungsachse.
HCl
Chemische Bindung zwischen C – H:
sp3 – s - σ - Bindung
Ethen
C Grundzustand
Bindungen:
hybridisierter Zustand
Für 1 C-Atom
C – H: sp² - s - σ - Bindung
C – C: p – p - π - Bindung
Ethin
C Grundzustand
Bindungen:
hybridisierter Zustand
C – H: sp – s - σ - Bindung
C – C: sp – sp - σ - Bindung, 2 mal p – p - π- Bindung
Ionensubstanzen
Anionen:
Kationen:
elektrisch negativ geladen
elektrisch positiv geladen
Ionensubstanzen dissoziieren in wäßriger Lösung in el. positiv geladene Kationen und el. negativ geladene
Anionen.
Kation
3 K+
Kalium
Anion
PO43- phosphat
Komplexes Kation
[Cu(H2O)4]2+
Tetraaquakupfer(II) -
Anion
2 Cl- chlorid
Kation
3 K+
Kalium -
Komplexes Anion
[Fe(CN)6]3- hexacyanoferrat
Komplexverbindungen
1.
Aufbau
Liganden „sitzen“ mit einem
Haftatom am Zentralion
Anzahl der Haftatome =
Zähnigkeit
Anzahl der einzähnigen Liganden, die gebunden werden können = Koordinationszahl
Beispiele:
1. Natrium-di(thiosulfato)-argentat(I): Na3[Ar(S2O3)2]
2. Pentaaqua-hydroxo-aluminium(III)-Ion: [Al(H2O)5OH)]2+
3. Kalium-tetraiodo-mercurat(II): K2[HgI4]
4. K3[Fe(CN)6]: Kalium-hexacyanoferrat(III) | K4[...]: Kalium-hexacyanoferrat(II)
5. [Zn(NH3)4]2+: Tetraamminzinkat(II)-Ion
6. Li[AlH4]: Lithium-tetrahydritoaluminat(III)
Versuch:
1. CuSO4 × 5 H2O stark erhitzen: blau → weiß (da wasserfrei)
2. Abkühlen
3.
Mit wenig H2O versetzen: CuSO4 + 5 H2O ↔ CuSO4 × 5 H2O ΔRH=-x kJ/mol
Mit mehr H2O versetzen:
CuSO4 ↔ Cu2+ + SO42Mit viel H2O versetzen:
Cu2+ + 4 H2O ↔ [Cu(H2O)4]2+
Mit Ammoniak versetzen: [Cu(H2O)4]2+ + 4 NH3 ↔ [Cu(NH3)4] 2+ + 4 H2O
(Zwischenschritt):
[Cu(H2O)4]2+ +NH3 ↔ [Cu(H2O)3(NH3)] 2+ + H2O É schrittweise
Î Komplexe mit mehrzähnigen Liganden nennt man Chelat. Der Effekt der stärkeren Stabilität dieser
Komplexe heißt Chelateffekt.
Bindungsverhältnisse in Komplexen
a) elektrostatische Wechselwirkungen
Anziehungskräfte zwischen elektrisch entgegengesetzt geladenen Zentralion (+) und den Liganden (-) oder
Liganden sin Dipole und lagern sich mit ihrem neg. Ladungsschwerpunkt am Zentralion an.
-
regelmäßige Anordnung der Liganden wird durch deren gegenseitige Abstoßung erklärt
Problem: Planarquadratische Struktur läßt sich mit diesem Modell nicht erklären.
b) Atombindungsmodell (Koordinative Bindung)
Elektronenzahl: Co
Elektronen aus den Lig. (6×2)
Σ
c)
inner-orbital:
outer-orbital:
high spin:
low spin:
diamagnetisch:
paramagnetisch:
[Co(NH3)6]2+
25
12
37
Valenzbindungstheorie
wenig parallele Elektronenspinorientierung
viel/hohe parallele Elektronenspinorientierung
entspricht outer-orbital
entspricht inner-orbital
geringfügig magnetisch
scheinbar magnetisch
d) Ligandenfeldtheorie
(Weiterentwicklung der elektrostatischen Erhöhungstheorie)
Exp.:
1. Fe2+-Lsg. mit K3[Fe(CN)6] versetzen → blau
2. Fe3+-Lsg. mit K4[Fe(CN)6] versetzen → blau
Fe4[Fe(CN)6]3
es entsteht Berliner Blau
[Co(NH3)6]3+
24
12
36
Chemievorlesungen Organik
Organische Chemie
Als umfangreichstes Teilgebiet der Chemie umfaßt die O. C. alle Verb. des Kohlenstoffs mit Ausnahme der
Wasserstoff-freien Chalkogenide u. deren Deriv., der salzartigen u. metall. Carbide sowie der Metallcarbonyle.
Zur Anorganischen Chemie rechnet man neben diesen außerdem alle Kohlenstoff-freien Verb. u. die chem.
Elemente einschließlich Kohlenstoff. Die Zahl der bekannten organischen Verbindungen, d.h. aller natürlichen u.
synthet. Kohlenstoff-Verb., die nicht in den Bereich der Anorg. Chemie fallen, hat bereits die Grenze von 7
Millionen weit überschritten, während die der anorg. Verb. nur etwa 2% davon beträgt. Etwa 90% der org. Verb.
bestehen aus C, H u. O in wechselnden Mengenverhältnissen;
Verb., die nur aus C u. H bestehen, heißen Kohlenwasserstoffe
Zahlreiche org. Verb. enthalten auch noch N, während S, P u. die Halogene wesentlich seltener anzutreffen sind,
doch kann grundsätzlich jedes Element in org. Verb. eingebaut werden – beispielsweise weist das Gebiet der
Metall-organischen Verbindungen eine hohe Zuwachsrate auf. Die Vielfalt u. Vielzahl der org. Verb. – die Zahl
erhöht sich jährlich z.Z. um > 300 000 – ist auf die bes. Fähigkeit der Kohlenstoff-Atome, untereinander Ketten
u./od. Ringe zu bilden, zurückzuführen; die übrigen Elemente sind hierzu u. auch zur Isomerie nicht od. nur in
bescheidenem Umfang befähigt. Die Mannigfaltigkeit der org. Verb. wird auch durch die Tetraeder-Struktur des
C-Atoms bedingt, die es zum idealen Baustein für komplizierte räumliche Gebilde macht.
Bei der system. Einteilung der C,H-Grundkörper der org. Verb. unterscheidet man zwischen
kettenförmiger
ringförmiger Anordnung
Eine weitere Unterteilung ergibt sich dadurch, daß auch Heteroelemente in reinen C,H-Strukturen eingebaut
werden können. Makromol. Kohlenstoff-Verb.:
Eiweißstoffe
Nucleinsäuren
Polysaccharide
Biopolymere
sowie synthet. Polymere sind natürlich auch org. Verb. u. lassen sich jeweils in dieser Systematik
unterbringen. Wegen der durch ihren makromol. Charakter bedingten Sonderstellung werden sie heute meist in
Lehrbüchern u. Monographien als makromolekulare Stoffe behandelt. Im Jahre 1865 kannte man etwa 3000–
4000 org. Verb., 1880 waren es rund 15000, 1910 150 000, 1935 ca. 350 000, 1965 ca. 1 300000, u. heute
schätzt man – wie erwähnt – die Anzahl auf ì 7 000 000 – der Zuwachs spiegelt sich logischerweise auch im
exponentiellen Anwachsen der zu bewältigenden chemischen Literatur – Chemical Abstracts registrierten 1977
die vier-, 1981 die fünf-, 1983 die sechs-, u. 1990 die siebenmillionste chem. Verbindung!
Geschichtl.: Die Bez. „Organische Chemie“ soll schon auf den Dichter u. Philosophen Novalis (um 1800)
zurückgehen; nach anderen Quellen wurde sie 1806 von Berzelius geprägt. Verständlicherweise wurde die Bez.
damals auf solche chem. Verb. beschränkt, die allein durch den lebenden Organismus aufgebaut werden
konnten. Nachdem es jedoch schon seit 1816 (Döbereiner, später Wöhler 1828: Harnstoff-Synth. aus
Ammoniumcyanat) gelungen war, körpereigene Substanz aus anorg. Material zu gewinnen, setzte sich
allmählich die Erkenntnis durch, daß auch die O. C. einer breiten präparativen Bearbeitung zugänglich ist, zumal
bald eine Reihe weiterer, aus org. Materie isolierter Verb. synthet. hergestellt werden konnten. Bereits 1838
schrieben Liebig u. Wöhler:
„Die Philosophie der Chemie wird aus dieser Arbeit den Schluß
ziehen, daß die Erzeugung aller org. Materien, in so weit sie
nicht mehr dem Organismus angehören, in unsern Laboratorien
nicht allein wahrscheinlich, sondern als gewiß betrachtet werden muß.“
Dennoch setzte sich die Erkenntnis, daß der Kohlenstoff-Gehalt das wesentliche Charakteristikum einer org.
Verb. ist, erst in der Mitte des 19. Jh. allg. durch. Die Abtrennung der „Chemie der Kohlenstoff-Verb.“ als O. C.,
unter Einschluß auch solcher Verb., die nicht in org. Material auftreten, also nur synthet. gewonnen werden
können, von der Anorg. Chemie geht vor allem auf L. Gmelin, Kolbe u. Kekulé zurück. Letzterer etablierte dann
mit seiner Erkenntnis von der 4-Wertigkeit des Kohlenstoffs u. von der Struktur des Benzols die O. C. endgültig
als autonomes Forschungsgebiet. Tatsächlich weisen die org. Verb. des Kohlenstoffs in der Zusammensetzung u.
im chem. Verhalten so charakterist. Unterschiede gegenüber den meisten anorg. Verb. auf, daß man die auf
anorg. Gebiet gewonnenen Erkenntnisse nicht ohne weiteres auf org. Verb. übertragen darf u. umgekehrt. So
haben sich im Laufe der letzten 100 Jahre Denkweise u. Nomenklatur der Anorg. Chemie u. der Org. Chemie
voneinander fortentwickelt. In letzter Zeit scheint sich jedoch eine Rückbesinnung auf die gemeinsamen
Ausgangspunkte bemerkbar zu machen, was besonders an dem rasch wachsenden Gebiet der Metall-organischen
Chemie, mit ihren fließenden Übergängen zwischen anorg.- u. org. Systematik u. Methodik, deutlich wird. Die
immer stärker vordringende dynam. Betrachtungsweise von org.-chem. Reaktionen lehrt mittels moderner allg.
Theorien wie z.B. der Elektronentheorie der chem. Valenz, der MO-Theorie, quantentheoret. Betrachtungen usw.
nicht nur den Mechanismus chem. Umsetzungen zu verstehen, neue Reaktionen vorherzusagen od. die jeweils
besten Versuchsbedingungen zu wählen, sie führt vielmehr auch den Lernenden vom „Symptomwissen“
(Kenntnis von Einzelreaktionen) zum „Kausalwissen“, indem sie die Vielfalt von Einzelreaktionen nach den
ihnen innewohnenden Gesetzmäßigkeiten – den sog. Reaktionsmechanismen – ordnet, überschaubar u. für die
prakt. Arbeit verfügbar macht. In neuerer Zeit sind auf diesem Gebiet weitere Anstrengungen unternommen
worden, zumal durch Eindringen des Computers in die chem. Laboratorien, verallgemeinerungsfähige
retrosynthet. Betrachtungsweisen für eine strategische Synth.-Planung zur Verfügung stehen, die durch
mathemat. Algorithmen angegangen werden können .
Molekülorbitale
(Abk.: MO)
Mol. Einelektronenwellenfunktionen, d.h. von den Ortskoordinaten eines Elektrons abhängige Funktionen. M.
werden heutzutage häufig über das Hartree-Fock-Self-Consistent-Field berechnet, wobei ab initio- od.
semiempirische Verfahren eingesetzt werden. Die M. werden meistens durch Linearkombination von
Atomorbitalen (AO) dargestellt. Wie bei chemische Bindung beschrieben, können anstelle der delokalisierten
kanon. M. in gleichwertiger Weise auch lokalisierte M. zur Beschreibung der Elektronenstruktur eines Mol.
herangezogen werden (sofern die Lokalisierung gelingt
Valenz
(von lat.: valens=stark, wirksam, wert sein)
1. Insbes. in der Anorg. Chemie Synonym für Wertigkeit. In diesem Sinne wird V. auch verstanden in
zusammengesetzten Begriffen, die in einem Zusammenhang mit chemischer Bindung u. Bindigkeit stehen;
Beisp.: Kovalente Bindung, Restvalenzen, Hypervalente Moleküle, Mischvalenz (s. Wertigkeit),
Partialvalenzen, vgl.a. Wertigkeit u. die hier folgenden Stichwörter u. Verweisungen.
2. In der Theoret. Chemie ist die Valence-Bond-Methode (VB-Methode) eine Alternative zur MO-Theorie, die
v.a. auf qualitat. Ebene zur Diskussion von Bindungsverhältnissen Anw. findet.
3. In der Immunologie versteht man unter V. die Zahl der Haftstellen (Determinanten, Haptene) eines Antigens
(bzw. Antikörpers) für Antikörper (bzw. Antigene).
Valenzelektronen
Elektronen, die sich bevorzugt in der äußeren Elektronenschale (Valenzschale) eines Atoms od. Mol. aufhalten.
Die Elektronen, die sich überwiegend in der Nähe der Atomkerne aufhalten, nennt man Rumpfelektronen.
Valence-Bond-Methode
(VB-Methode, Valenzstrukturmethode, HLSP-Methode)
Näherungsverf. der Quantenchemie, welches in engem Zusammenhang mit der klass. (vorquantenmechan.)
Valenztheorie von Lewis steht. Die V.-B.-M. wurde kurz nach der Entwicklung der Quantenmechanik
begründet; Ausgangspunkt ist die 1927 erschienene Veröffentlichung von Heitler u. London über die chemische
Bindung im H2-Mol.. Die Erweiterung auf Mol. mit mehr als 2 Elektronen wurde v.a. von Pauling, Slater u.
Eyring vorgenommen.
Die V.-B.-M. geht von der Vorstellung aus, daß die Atome in einem Mol. weitgehend erhalten bleiben. Die
Wellenfunktion eines Mol. mit 2 od. mehr Elektronen wird daher in der V.-B.-M. im Gegensatz zur MO-Theorie
direkt aus Atomorbitalen (AO), d.h. atomaren Einelektronenwellenfunktionen aufgebaut.
Rumpfelektronen werden mit antiparallelen Spins in den Aos untergebracht
Valenzelektronen sind zu einem Singulett gekoppelt
Während die MO-Theorie eine zwanglose Erklärung dafür liefert, daß das Sauerstoff-Mol. im elektron.
Grundzustand ein Triplett ist, hat die V.-B.-M. in diesem Fall mehr Schwierigkeiten.
Es gibt viele Mol., die sich nicht durch eine einzige Lewis-Formel adäquat beschreiben lassen. In solchen Fällen
ist auch der einfachste VB-Ansatz komplizierter, d.h. es sind mehrere „Grenzstrukturen“ zu berücksichtigen u.
die Gesamtwellenfunktion ist eine Linearkombination hiervon, die nach Pauling auch als Resonanzhybrid
bezeichnet wird. Wie in den bisherigen Beisp. werden die Spins von jeweils zwei Elektronen zu einem Singulett
gekoppelt, so daß Elektronenpaarbindungen resultieren. Auf qual. Ebene gehört die V.-B.-M. zum
Handwerkszeug eines jeden Chemikers, das zur Diskussion von Bindungsverhältnissen u. Reaktivität eingesetzt
wird. Die qualit. Aspekte der V.-B.-M. sind v.a. in Paulings Buch ausführlich dargestellt. Den Versuch einer
Synth. von VB- u. MO-Theorie stellt die Molecular Orbital Valence Bond (MOVB)-Theorie von Epiotis dar.
Räumliche Ausrichtung
2 sp²
3 sp²
4 sp³
- linear
- planar, trigonal 120°
- tetraedrisch 109°
Tetraeder
griech.: tetra = vier u. hedra = Fläche
abgeleitete Bez. für Vierflächner, eine Pyramide mit dreieckiger Grundfläche. Das von vier gleichseitigen
Dreiecken begrenzte regelmäßige T. zählt zu den 5 platonischen Körpern. Das T.-Modell des vierbindigen
Kohlenstoffs wurde 1874 unabhängig voneinander von van't Hoff u. Le Bel aufgestellt u. ist eine der Grundlagen
der Stereochemie org. Verb.. Eine theoret. Begründung des T.-Modells liefert die Quantenchemie, insbes. die
Valence-Bond-Methode. Tetraedr. Strukturen findet man nicht nur bei Verb. der 4. Hauptgruppe, sondern auch
bei zahlreichen Koordinationsverb. mit der Koordinationszahl 4.
Aufbauprinzip
Regeln zur Ermittlung der Elektronenkonfiguration eines Mehrelektronenatoms mit der niedrigsten
Gesamtenergie. Die Atomorbitale werden hierbei nach zunehmender Orbitalenergie unter Berücksichtigung des
Pauli-Prinzips u. bei entarteten od. fastentarteten Orbitalen auch der Hundschen Regeln besetzt. Für die
Orbitalenergien der energetisch tiefsten Atomorbitale gilt die Reihenfolge: 1s<2s<2p<3s<3p. Das A. läßt sich
auch auf Moleküle anwenden; anstelle der Atomorbitale sind dann Molekülorbitale zu verwenden.
Konfiguration
Begriff aus der Stereochemie. Unter K. versteht man die räumliche Anordnung eines Mol. ohne
Berücksichtigung der verschiedenen Atomanordnungen, die sich voneinander nur durch Rotationen um
Einfachbindungen unterscheiden. Mol. mit gleicher Konstitution aber unterschiedlicher K. nennt man
Konfigurationsisomere. Zur gegenseitigen Umwandlung von Konfigurationsisomeren müssen Atombindungen
getrennt u. neu gebildet od. wenigstens stark geschwächt werden, weswegen die zwischen ihnen existierende
Energiebarriere ziemlich groß ist. Konfigurationsisomere sind daher als stoffliche Individuen isolierbar u.
charakterisierbar; die Reaktionsgeschw. für ihre Umwandlung ineinander ist bei Raumtemp. äußerst klein. Dies
steht im Gegensatz zu den Konformationsisomeren, deren gegenseitige Umwandlung nur wenig Energie
erfordert u. entsprechend rasch abläuft. In vielen Fällen unterscheiden sich Konfigurationsisomere dadurch, daß
sie sich wie Bild u. Spiegelbild verhalten, die nicht zur Deckung gebracht werden können; man bezeichnet sie
dann als Enantiomere. Voraussetzung für das Auftreten von Enantiomeren ist das Vorliegen von Chiralität. Alle
anderen Konfigurationsisomeren sind Diastereomere. Zur Beschreibung der K. von Spiegelbild-Isomeren
verwendete man früher dreidimensionale Darst., heute jedoch bevorzugt man die Projektionsformeln nach Emil
Fischer od. Darst. wie die bei Enantiomerie od. Diastereo(iso)merie gewählten, bei Kohlenhydraten die sog.
Haworth-Projektionen.
Die absolute Konfiguration einer Verb., d.h. die tatsächliche Anordnung der an asymmetr. Atome gebundenen
Gruppen, wurde erstmals von J. M. Bijvoet et al. durch röntenograph. Unters. des Natriumrubidiumtartrats u. des
Isoleucinhydrobromids ermittelt. Dabei ergab sich, daß die von E. Fischer vermutete Anordnung der ans
asymmetr. C-Atom gebundenen Gruppen den tatsächlichen Verhältnissen entspricht.
Zur Herst. von opt. akt. Verb. erwünschter K. bedient man sich der bei asymmetrische Synthese, Chiralität u.
Racemattrennung erwähnten Methoden, u. die Enantioselektivität der Reaktion kennzeichnet man als optische
Ausbeuten, vgl. Enantiomerie. Für die physikal. Eig. von Kunststoffen ist die K. der Monomeren u. die daraus
resultierende Taktizität wesentlich. In anderem Zusammenhang benutzt die Theoretische Chemie den Begriff K.,
nämlich zur Beschreibung des Besetzungszustands von Elektronenniveaus bei Mol. u. Atomen
(Elektronenkonfiguration). Häufig wird auch – etwas salopp – von einer Konfigurations-Zustandsfunktion als
einer K. geredet.
Standartkonfiguration aller Elemente
1s² 2s² 2s6 3s² 3s6 4s² 3d10 4s6 5s² 4d10 5p6 4f14...
Konstitution
Bez. für die unverwechselbare u. für jede chem. Verb. charakterist. Anordnung der Atome, Atomgruppen u.
Valenzelektronen (Bindungen) im Mol. ohne Berücksichtigung von räumlichen Richtungen. In der Praxis
werden die Termini Struktur u. K. meist unterschiedslos nebeneinander gebraucht, obwohl erstere eigentlich
räumliche Vorstellungen impliziert. Entsprechend wird nur selten zwischen Struktur- u. K.-Formel
unterschieden, obwohl strenggenommen Strukturformeln den räumlichen Aufbau von Mol., ggf. sogar
Konfiguration u. Konformation erkennen lassen sollten, während K.-Formeln nur das Atom-Gerüst
kennzeichnen, wenn sie auch informativer als Bruttoformeln sind. Verb. mit der gleichen Bruttoformel, aber
unterschiedlicher K. bezeichnet man als Konstitutionsisomere (od. Stellungsisomere). Man nennt die von Kekulé
eingeführten K.-Formeln, die z.B. durch Doppel- od. Dreifachbindung behelfsmäßige Annahmen über die AtomVerkettung machen, auch aufgelöste Formeln. Unter diesem Gesichtspunkt sind auch die Elektronenformeln als
K.-Formeln zu betrachten. Die Ableitung der K. eines Stoffs aus seinen Analysendaten nennt man
Konstitutionsermittlung. Die K. einer chem. Verb. ist verantwortlich nicht nur für ihre chem. u. physik., sondern
auch für ihre physiolog. Eig. Man bemüht sich daher, quant. Beziehungen zwischen K. u. physiolog. Wirkung
aufzustellen u. gezielt Substanzen zu synthetisieren, die eine bestimmte sensor. od. pharmakolog. Wirkung
zeigen. Andererseits ist es gerade die räumliche Struktur einer Verb., die eine bestimmte physiolog. Wirkung
hervorruft. Man denke z.B. an die unterschiedlichen Eig. von zwei Enantiomeren einer konstitutionell
einheitlichen Verb.
Konformation
(Konstellation).
Ein von Haworth 1929 erstmals benutzter Begriff aus der Stereochemie. Hierunter versteht man die genaue
räumliche Anordnung von Atomen od. Atomgruppen eines Mol. definierter Konstitution u.
Konfiguration.Verschiedene K. werden durch Rotation um Einfachbindungen erzeugt u. lassen sich nicht zur
Deckung bringen; theoretisch existieren bei einem Mol. gegebener Konfiguration unendlich viele K.
Entsprechen diese einem Energieminimum, so redet man von Konformationsisomeren od. Konformeren, insbes.
bei offenkettigen Verb. auch von Rotationsisomeren od. Rotameren. Die Energiebarrieren zwischen
Konformeren sind meistens so klein, daß eine Isolierung verschiedener Konformere nicht möglich ist. Isolierbar
werden Konformere, wenn die Energiebarriere bei Raumtemp. bei etwa 70 kJ mol–1 liegt. Im Fall von 2
Substituenten wird bei den gestaffelten K. zwischen der antiperiplanaren Form (trans-Form) u., zwei synclinalen
(synschiefen, windschiefen; E skew od. gauche) Formen unterschieden, wovon letztere im gegenseitigen
Verhältnis von Bild u. Spiegelbild stehen. Desgleichen gibt es 3 eklipt. Formen (anticlinal u. synperiplanar), die
energiereicher u. daher unwahrscheinlicher sind. K.-Betrachtungen werden bes. bei Ketten angestellt, d.h. bei
linearen Makromolekülen. Die IUPAC-Regeln zur Stereochemie von Polymeren legen nicht nur die
Benennungen von Konfigurationen fest, sondern auch die von K. u. der Taktizität von Makromolekülen. Noch
früher als bei acyl. Verb. sind K.-Überlegungen bei gesätt. cyclischen Verbindungen zur Deutung zahlreicher
Phänomene herangezogen worden, insbes. solcher, die die Baeyer-Spannungs-Theorie vom ebenen Bau der
Ringe unerklärt ließ. Dagegen forderte schon die Sachse-Mohr-Theorie den nichtebenen Bau des Cyclohexans
u.a. Ringe. Die Vorstellungen Sachses (1890) konkretisierten sich im Sessel-Wanne-Modell des Cyclohexans.
Die Konformationsanalyse untersucht die bevorzugten K. eines Mol. Zur Konformationsanalyse werden physik.
u. theoret. Meth. herangezogen. Von bes. Bedeutung ist die K.-Analyse bei den Biopolymeren, da sich daraus
Eig. wie die Sekundär-, Tertiär- u. Quartärstruktur von Proteinen, Helix-Coil-Umwandlungen, die
Rechtshändigkeit der DNA-Helix u.a. ableiten. Die K.-Unters. biolog. wichtiger kleiner Mol. haben zu
Erklärungen für die erstaunliche Spezifität vieler enzymat. Reaktionen, pharmakolog. od. olfaktor. (geruchlicher)
Eig. geführt u. Theorien für die Wirkungsweise von Zellmembranen gestützt.
Struktur
lat.: structura = Bau, Bauart
abgeleitete Bez. wird in der Chemie in vielerlei – hier im allg. in Einzelstichwörtern behandelten –
Zusammenhängen gebraucht, häufig zwar auf die Anordnung der Atome u. Atomgruppen in einem Mol. – im
Rahmen der Strukturchemie im Sinne von Konstitution – beschränkt, nicht selten auch pauschal als Oberbegriff
zu Konfiguration u. Konformation.
Praktischerweise unterscheidet man 3 Typen von S.:
1. Mit Modellvorstellungen verbundene S.:
Elektronen-S. der Atome,
Bindungs-S. der chemischen Bindung (mit Elektronendichteverteilungen aufgrund theoret.
Vorstellungen z.B. der MO-Theorie od. ermittelt durch Kristall- bzw. Röntgenstrukturanalyse)
etc.
2.
Geometr. S.:
S. der Moleküle als Konstitution (durch Strukturformeln symbolisiert),
Konfiguration u. Konformation (durch räumliche Darst. versinnbildlicht),
Kristall-S. (die ggf. Hinweise auf die Mol.-S. gibt),
S. von Gläsern,
amorphe Strukturen,
S. von Makromol. (Primär- bis Quartär-S.) etc.
3. Zeitabhängige S.:
S. von Flüssigkeiten u. Lsg.,
S. von Mol. mit Fluktuierenden Bindungen,
von Nichtstarren Mol.,
von oszillierenden Systemen (dissipative Strukturen),
von ionotropen Gelen, Liesegangschen Ringen u.ä. Phänomenen, wie sie evtl. in der Evolution
eine Rolle gespielt haben (Synergetik).
In das Schema lassen sich auch Begriffe wie Grenzstrukturen, Strukturisomerie einbauen.
Die S.-Aufklärung wird häufig als eigenständiges Arbeitsgebiet (Strukturchemie) angesehen. In Anbetracht der
Vielzahl möglicher S. für eine Verb. ist nicht nur die Konstitutionsermittlung einschließlich der Aufklärung der
Stereochemie eine wichtige Aufgabe, sondern auch die Erfassung der S. durch die Mittel der Datenverarbeitung.
Hiermit in Zusammenhang steht die Speicherung von org. S. u. Partialstrukturen für die Zwecke der
Dokumentation, wofür eine Reihe von Notationen u. ein selbsttätig arbeitendes, sog. topolog. Codierungsverf.
entwickelt worden sind. Überdies sollte die chem. Nomenklatur in der Lage sein, geometr. S. von Mol. eindeutig
zu beschreiben, u. zwar selbst von komplizierten Mol. wie
Käfig- od. Kronenverb.,
Kryptaten,
Koordinationsverb.
od. synthet. u. natürlichen Makromolekülen
Zur Benennung bedient sich die Nomenklatur u.a. sog. Strukturpräfixe wie
cis,
trans,
synperiplanar,
icosahedro,
mer,
fac,
nido,
a,
b,
E,
Z,
R,
S usw.
Einprägsamer als der Name einer chem. Verb. ist oft das mit Hilfe der chemischen Zeichensprache erstellte
Formelbild.
Es hat nicht an Versuchen gefehlt, die Beziehungen zwischen der S. von Stoffen u. ihren physik. Eig. (Schmelzu. Siedepunkt, Lsg.-Eig., Farbe etc.) nicht nur durch empir. Regeln (Parachor, Refraktion, MolrotationsDifferenzen etc.) zu erfassen, sondern mit den Meth. der Quantenchemie abzuleiten. Hier sind erste Teilerfolge
zu verzeichnen, zu denen Gruppen- u. Ligandenfeldtheorie, MO-Theorie u. Valence Bond-Methode, Kraftfeld-,
Symmetrie- u. Topologie-Betrachtungen Interpretationshilfe geleistet haben.
Strukturformel
Bez. für die symbol. Darst. der Struktur eines Mol. unter Verw. von Elementsymbolen, Strichen, Punkten,
Sonderzeichen etc..
Gelegentlich, aber nicht konsequent, unterscheidet man zwischen
Konstitutionsformel
Æ gibt die Konstitution des Mol. unter Verzicht auf die Darst. seiner Stereochemie wieder
Strukturformel
Æ soll die auch die räumliche Geometrie deutlich machen
Für bes. Konfigurations- u. Konformations-Betrachtungen können sog. Projektionsformeln von Vorteil sein. In
der org. Chemie sind Skelettformeln als Konstitutionsformeln gang u. gäbe; hier bedeutet jeder Knick od.
Eckpunkt eine CHn-Gruppierung. Die Bez. Struktur u. Strukturformel wurden von Butlerow, die Bez.
Konstitutionsformel dagegen von Kekulé geprägt. Zur graph. Darst. von S. bedient man sich zweckmäßigerweise
der Formelschablonen, od. man verwendet Letraset-Symbole.
Isoelektronisch
Bez. für den Zustand, daß die gleiche Zahl u. Anordnung der Elektronen bei verschiedenen Atomen, Ionen u.
dgl. vorliegt; Beisp.: O2–/F–/Ne/Na+/Mg2+/Al3+ od. HF/OH–.
Hydrid-Verschiebungssatz
Die von Grimm aufgestellte, auch als Grimmscher H. bezeichnete Regel besagt: Durch Aufnahme von n
Wasserstoff-Atomen nehmen Atome (bzw. die so gebildeten Pseudoatome) formal die Eig. der im Periodensyst.
n Stellen rechts neben ihnen stehenden Atome an, was durch die gleiche Ladungszahl verursacht wird.
Beispielsweise lassen sich folgende Analogien aufstellen:
Innerhalb der senkrechten Kolonnen sind die Gruppen bzw. Pseudoatome isoelektronisch, nicht dagegen isoster.
Die „Pseudoelemente“ F bis CH3 treten (z.T. neg.) einwertig, Na bis CH5 bevorzugt in Form pos. Ionen auf. Der
H. macht plausibel, daß sich Fluorid- u. Hydroxid-Ionen in Silicaten gegenseitig vertreten können.
Isoelektronisch verhalten sich auch die „Dimeren“ Sauerstoff (O=O), Diimin (HN=NH) u. Ethylen (H2C=CH2)
sowie Stickstoff (NºN) u. Acetylen (HCºCH). Auf dem Grimmschen H. aufbauend hat Haas ein „periodisches
System funktioneller Gruppen“ entworfen.
Isosterie
Von Langmuir (1919) geprägte Bez. für den bes. isoelektronischen Zustand, daß Mol. od. Ionen bei gleicher
Anzahl an Atomen die gleiche Gesamtzahl an Elektronen, die gleiche Elektronenkonfiguration u. die gleiche
Gesamtladung besitzen.
Isostere Verb.-Paare lassen sich aufgrund einer einfachen Regel auffinden, wenn man von zwei Atomen einer
beliebigen Verb. das eine durch ein Atom mit einer um x höheren, das andere durch ein Atom mit einer um x
kleineren Ordnungszahl ersetzt. Die physik. Eig. von isosteren Verb. sind einander sehr ähnlich; man kann
deshalb aufgrund von bekannten Eig. einer Verb. auf diejenigen ihrer isosteren Partner schließen, was die Suche
nach Verb. mit gewünschten Eig. sehr erleichtert. Deshalb hat man I.-Überlegungen auch in die pharmazeutische
Chemie einbezogen u. benutzt sie bei der Suche nach neuen Pharmaka mit agonist. u. antagonist. Wirkung (sog.
Bioisosterie).
In verwandtem Sinne spricht man von I. bei solchen Effektoren, die eine kompetitive Hemmung von Enzymen
aufgrund ihrer Ähnlichkeit mit dem Enzymsubstrat hervorrufen, s. dagegen Allosterie.
Isomerie
1.
2.
In der Chemie Bez. für die Erscheinung, daß die Mol. von Verb. aus den gleichen Anzahlen der gleichen
Atome bestehen, sich jedoch hinsichtlich ihrer Anordnung unterscheiden können, wodurch unterschiedliche
Eig. der Verb. bedingt werden. Isomer sind somit chem. Verb. mit gleichen Brutto-, jedoch verschiedenen
Strukturformeln. Die zueinander im Verhältnis der I. stehenden Verb. werden Isomere oder Isomeren
genannt. Die Konformations-I. – ebenfalls eine Form der Stereo-I. – ist demgegenüber nur selten mit dem
Auftreten optischer Aktivität verbunden. Sie kommt zustande durch Rotation von Gruppen um
Einfachbindungen. Bei gehinderter Rotation kann es zur Ausbldg. von Atropisomerie kommen. Bei
Komplexen kennt man weitere I.-Möglichkeiten, bei Hydraten die sog. Hydratisomerie, bei Verb.-Klassen
wie Catenanen, Knoten u. dgl. od. Einschlußverb. die sog. topologische I., bei Verb. mit fluktuierenden
Bindungen (Topomeren) I. durch Topomerisierung. Die Zahl der möglichen Isomeren zu einer gegebenen
Bruttoformel wächst mit der Zahl der Atome rasch an. Auf die Bedeutung der I. in Chemie u. Physiologie
braucht wohl nicht hingewiesen zu werden – man denke an die Unterschiede hinsichtlich Geruch,
pharmakolog. od. tox. Wirkung, die bei Isomeren zu beobachten sind.
Geschichtl.: Die frühesten Überlegungen zur I. sollen von Jungius stammen, die ersten systemat.
Beobachtungen machte Meinecke , bevor Liebig 1823 bei der Elementaranalyse feststellte, daß Stoffe trotz
ihrer chem. Verschiedenheiten die gleiche Bruttoformel besitzen. Wenige Jahre später synthetisierte F.
Wöhler (1828) den isomeren Harnstoff u. damit eine org. Verb. durch Isomerisierung aus einer anorg.
Verbindung. Der Begriff I. wurde 1830 von Berzelius in die Chemie eingeführt; er verstand darunter Stoffe,
die „die gleichen Elementaratome, aber in ungleicher Weise zusammengelegt“ enthalten.
In der Kernphysik u. Kernchemie tritt Kernisomerie auf.
Nomenklatur
(von lat.: nomenclatio = Benennung mit Namen)
Unter N. im allg. Sinne kann man eine Art „Sprachregelung“ verstehen, derer sich manche Wissenschaftszweige
zur sprachlichen Beschreibung u. Gliederung ihrer spezif. Gegenstände bedienen – beispielsweise spricht man
von der N. der Enzyme, der Viren u. Bakterien, der Biologie, Botanik, Zoologie, Genetik, Medizin, Physik,
Geologie etc., u. auch die Pharmakopöen der Apotheker u. Listen von Freinamen u. Common Names kann man
als N. betrachten, ja sogar die sog. Brüsseler Nomenklatur. Die chem. Wissenschaft kann sich glücklich
schätzen, daß sich ihre charakterist. Gegenstände u. Sachverhalte oft durch recht einfache Definitionen
erschließen u. in Klassifikationen ordnen lassen, auch wenn die definitor. Abgrenzung nichtmaterieller Begriffe
(z.B. Cycloaddition, Umlagerung, Reaktionsordnung u. -kinetik etc.) noch in den Anfängen steckt. Ob man
überhaupt dgl. Definitionen als Teil der chem. N. ansieht od. sie einer Terminologie der Chemie zurechnet u. in
einen Thesaurus einordnet, ist hier nicht zu diskutieren. Darum sei hier unter N. im Bereich der Chemie die von
den Fachgremien, v.a. den N.-Kommissionen der IUPAC, festgelegten od. zumindest vorgeschlagenen
Richtsätze zur Benennung der chem. Elemente u. Verb. verstanden. Auch die Festlegung von Abk. für systemat.
Namen ist zweifellos Bestandteil der N., nicht dagegen Notationen u. Codierungen von chem. Strukturen, die
man zur Symbolik, mit Einschränkungen auch zur chemischen Zeichensprache, rechnen kann. Noch weniger mit
N. hat das Registry Number-System von Chemical Abstracts zu tun.
Org. Chemie: In den ältesten Zeiten benannte man die chem. Substanzen regellos u. willkürlich nach ihrem
Vork. in der Natur, nach ihrer Herkunft aus anderen Stoffen od. nach gewissen äußerlichen Merkmalen; so hieß
z.B. jeder salzig schmeckende Stoff Salz, jeder flüchtige Stoff Spiritus usw. Erst gegen Ende des 18. Jh.
versuchte Lavoisier, eine planmäßige, systemat. Benennung der Stoffe einzuführen, in welcher die chem.
Zusammensetzung zum Ausdruck kam. Diese Art der Stoffbez. wurde von Berzelius, Gerhardt, Laurent, Kekulé,
A. W. von Hofmann u.a. weitergeführt. Mit der zahlenmäßigen Zunahme an analysierten u. synthetisierten Verb.
u. der Intensivierung des internat. Gedankenaustausches entwickelte sich auch das Bedürfnis nach einer
Vereinheitlichung der chem. Namen. Daher beauftragte der Internat. Chemikerkongreß in Paris 1889 eine
Kommission mit der Ausarbeitung von Vorschlägen für die chem. Namengebung. Diese Vorschläge wurden in
den Sitzungen des Genfer Kongresses 1892, an dem sich 34 Chemiker aus 8 europäischen Ländern beteiligten,
beraten u. als Empfehlungen verabschiedet (Genfer Nomenklatur). Für die Benennung der org. Verb. wurde ein
umfangreiches, auch der heutigen N. der org. Chemie zumeist zugrunde liegendes Regelwerk rationeller Namen
– heute spricht man von systemat. Namen – aufgestellt: Die aliphat. u. cycloaliphat. Verb. werden durch das
Vorsetzen od. Anhängen von in diesem Lexikon separat abgehandelten Vor- u. Nachsilben (Präfixen u. Suffixen)
an die Stammnamen (E parent names) benannt. Diese gehen häufig zurück auf griech. Zahlwörter, die die
Anzahl der Kohlenstoff-Atome in einer Kette beschreiben od. auf Trivialnamen.
An die Stammnamen hängt man die Endungen (keine Suffixe im engeren Sinne):
-an (gesätt. aliphat. Kohlenwasserstoffe),
-en (ungesätt. aliphat. Kohlenwasserstoffe mit Doppelbindung),
-in (ungesätt. aliphat. Kohlenwasserstoffe mit Dreifachbindung),
-yl (einwertige Radikale);
- die Vorsilbe iso- sollte zur Benennung verzweigter Ketten dienen
- Alkohole sollten das Suffix -ol (Ethanol)
- Aldehyde -al (Hexanal)
- Ketone -on (2-Butanon)
- für Kohlenhydrate bzw. Enzyme sollten die Endungen -ose bzw. -ase charakterist. sein
Bes. Beachtung verlangte die N. im Fall der Isomerie. Zur Kennzeichnung von Substitutionsstellen wird die
(unverzweigte) Kette von einem Ende zum anderen durchnumeriert; diese Nummern (Stellungsziffern) nennt
man Lokanten (E locants). Bei Verw. von griech. Buchstaben statt Ziffern beginnt das Alphabet mit „a“ an
demjenigen C-Atom, das die charakterist. Gruppe trägt.
Räumliche Anordnungen sollten durch die Vorsilben
cis- od. syn-,
trans- od. anti-,
meso-,
epi-,
cyclo- usw.
gekennzeichnet werden; heute sind die Benennungen mit (E)- u. (Z)- u. mit (R)- u. (S)- hinzu- od. an die Stelle
getreten. Die Deriv. von Stammverb. komplizierten Molekülbaues sollten durch (systemat.) Abwandlung der
Trivialnamen der Grundverb. benannt werden.
Die Funktionsgruppe mit der höchsten Priorität erscheint als Suffix. Die früher vielfach verwendeten Namen mit
2 Suffixen (z.B. ...olon) sind nicht mehr zugelassen. Es ist nicht möglich, an dieser Stelle die seit 1978 gültigen
N.-Regeln wiederzugeben: Das wegen seiner Einbandfarbe auch „Blaues Buch“ genannte N.-Werk der Org.
Chemie „Nomenclature of Organic Chemistry“ umfaßt 560 Seiten.
Es gliedert sich in 7 Sektionen:
A. Kohlenwasserstoffe
B. Heterocycl. Syst.
C. Charakterist. Gruppen (mit C, H, O, N, Halogen, S, Se, Te)
D. Elementorg. Gruppen (mit P, As, Sb, Bi, Si, B, Metalle)
E. Stereochemie
F. Naturstoffe
G. Isotopenmodifizierte Verb.
Neben diesen N.-Regeln existieren gültige Richtsätze z.B. für die Benennung von Aminosäuren, Steroiden,
Vitaminen, Carotinoiden, Kohlenhydraten, Corrinoiden u.a. Naturstoffen, von Verb. in abweichenden
Wertigkeits- bzw. Bindigkeitszuständen, für die Klinische Chemie, für die Photochemie usw. Ebenso wie die
neu synthetisierten org.-chem. Verb. komplizierter werden, nimmt auch die N. an Komplexität zu, u. es
entstehen ggf. unhandliche, wenn auch meist eindeutige Namen. Eine der wesentlichsten Aufgaben der N.Kommissionen der IUPAC ist es, das Regelwerk flexibel zu halten. Für die Zwecke der Chemie-Dokumentation
u. Information, d.h. für die Verschlüsselung, Speicherung u. Wiederauffindung von Stoffbez. scheinen die von
den N.-Kommissionen erarbeiteten Regeln zu schwerfällig u. zudem nicht immer eindeutig interpretierbar zu
sein.
Anorg. Chemie: Für das Gebiet der Anorg. Chemie wurden von der 1921 gegr. Anorg. Nomenklaturkommission
der IUPAC neue Richtlinien ausgearbeitet. Die Neufassung wurde 1959 veröffentlicht. Das wegen seiner
Einbandfarbe oft auch kurz als „Rotes Buch“ bezeichnete N.-Werk wurde gleichlautend publiziert. Das
Regelwerk legt die Namen der Elemente, Verb., Ionen u. Radikale fest u. gibt Empfehlungen zur systemat.
Benennung von
Säuren u. Salzen,
Iso- u. Heteropolyanionen,
nichtstöchiometr. Verb.,
Leg.,
Bor-Verb.
u. Komplexen einschließlich deren Stereochemie
Selbstverständlich findet man auch Hinweise auf
die Anw. der Suffixe ...id, ...it, ...at etc.,
die Benutzung des Ewens-Bassett- u. des Stock-Systems,
die Zulässigkeit von Gruppennamen wie
Chalkogenide,
Erdalkalimetalle,
Halogenide
Halide,
die Notwendigkeit der Ersetzung von Bi... durch Hydrogen...,
Einschränkungen im Gebrauch von Ortho... usw.
Reaktionsmechanismen
Im Gegensatz zur Brutto-Reaktionsgleichung machen R. Aussagen über das Geschehen während der Reaktion.
Dem im Dtsch. früher gelegentlich synonym verwendeten Begriff Chemismus hat die Bez. R. voraus, daß in ihr
sowohl das Steuerbare als auch das selbsttätig Ablaufende eines Mechanismus (von griech.: mechanema =
Kunstgriff, Maschine) anklingen. Im folgenden soll – unter Bezug auf das Stichwort Reaktionen – versucht
werden, anhand von Beisp. v.a. aus der org. Chemie einige vielgebrauchte Begriffe zu definieren u. sie in
Beziehung zueinander zu setzen. Während die Stöchiometrie einer Reaktion eine Aussage über die
Mengenverhältnisse der an ihr beteiligten Stoffe macht u. die Ableitung von Gleichungen für die sog.
Bruttoreaktion erlaubt, sollen R. beschreiben, wie es im einzelnen zur Bldg. bzw. Nicht-Bldg. des od. der Prod.
kommt. Dabei muß man zunächst festzustellen versuchen, ob die betrachtete Reaktion eine einfache od.
zusammengesetzte Reaktion (Stufenreaktion) ist. Beispielsweise kann die Isomerisierung einer Verb. A in einem
Lsgm. (M) in einer einfachen Reaktion direkt zum Isomeren A' führen, sie kann aber auch als Stufen-Reaktion –
z.B. unter Beteiligung des Lsgm. – vor sich gehen. Da die meisten chem. Reaktionen Gleichgew.-Reaktionen
sind, sind selbstverständlich nicht nur die sog. Hinreaktionen, sondern auch die Rückreaktionen zu
berücksichtigen. In der Mehrzahl der Fälle liegen Reaktionssequenzen mit Verzweigung vor. Die Aufklärung der
zeitlichen Abfolge dieser verschiedenen Elementarreaktionen u. Zwischenreaktionen als Simultanreaktionen
(Parallelreaktionen, Konkurrenzreaktionen) u. Sukzessivreaktionen (Folgereaktionen) ist eine äußerst diffizile
Aufgabe für die Reaktionskinetik. Diese muß versuchen, über die Reaktionsgeschwindigkeiten (z.B. die
Halbwertszeiten) die Reaktionsordnungen zu ermitteln u. über Konz.-Abhängigkeiten die
Reaktionsmolekularitäten festzustellen, d.h. ob eine Elementar-Reaktion unimol. abläuft od. ob sie eine bimol.
od. höhermol. Reaktion ist. Zur Klärung derartiger Fragen stehen heute Verf. der physik. Analyse zur
Verfügung, mit denen sich auch sehr schnelle Reaktionen untersuchen lassen. Daneben stehen chem. Meth. zur
Verfügung, mit denen z.B. reaktive Zwischenstufen wie Radikale, Carbenium- u. Carbonium-Ionen,
Carbanionen, Carbene etc. durch zweckmäßig geplante Abfang-, d.h. Konkurrenzreaktionen nachgewiesen bzw.
wahrscheinlich gemacht werden können . Durch Unters. ders. Reaktion sowohl in wäss. als auch nichtwäss.
Lsgm. od. in der Gasphase, durch Unters. des Einflußes von Salzen (Salzeffekte), Schweratomen, Säuren od.
Basen, Radikalfängern, Sensibilisatoren u. Katalysatoren od. mit anderem rein chem. Rüstzeug kann der
Chemiker feststellen, ob eine Reaktion nach radikal., ion. od. elektroneutralen Gesichtspunkten abläuft, ob sie
einen Protonierungsschritt enthält, katalyt. beeinflußbar ist od. welchem der beteiligten Mol. die photochem.
zugeführte Aktivierungsenergie zugute kommt usw. Wichtige Hilfsmittel sind auch markierte Verbindungen.
Erst bei Kenntnis der erwähnten kinet. Parameter (u. natürlich der chem. Konstitution der Ausgangs-, Zwischenu. Endprod.) kann man versuchen, den mol. Mechanismus einer Reaktion zu beschreiben. Oft wird unter dem
„eigentlichen R.“ überhaupt nur dieser Teil der Reaktionsaufklärung verstanden, der unter Zuhilfenahme von
Strukturformeln, Elektronendichteverteilungen u. Ladungsschwerpunkten an einzelnen Atomen,
Bindungsabständen etc. u. Berücksichtigung des Energieinhalts der verschiedenen Zustände verständlich zu
machen sucht, warum ein Mol. mit einem anderen Mol., Atom, Radikal, Ion, so u. nur so reagiert, wie dies
beobachtet wird. Resultate derartiger Überlegungen an einer Vielzahl jeweils gleichartiger Reaktionen waren
zunächst empir. Regeln für die
Oxidation,
Reduktion,
Substitution,
Eliminierung u. Fragmentierung,
Addition,
Hydrolyse,
Veresterung,
Salzbildung,
Dissoziation,
Cyclisation u.a. Ringreaktionen,
Umlagerung,
Valenzisomerisierung,
Keto-Enol-Tautomerie,
Polymerisation etc.
In diesen nur phänomenolog. abgeleiteten Regeln waren bereits die Einflüsse von funktionellen Gruppen, von
Substituenten, von Nachbargruppen, von Hyperkonjugation, ster. Hinderung etc. auf den Reaktionsverlauf
berücksichtigt, u. auch die Stereochemie einer Reaktion war in Grenzen voraussagbar, beispielsweise, ob sie mit
Inversion od. Retention der Konfiguration verbunden sein würde. Ähnlich beschreibend, wenn auch mit der
Kenntnis der Bindungsverhältnisse formuliert, sind Begriffe wie
Resonanz,
Push-pull,
Akzeptor/Don(at)or,
Capto-dativ,
Mesomerer u. Induktiver Effekt,
Ortho-Effekt,
Elektromerie,
Käfig-Effekt,
Pseudorotation od. Turnstile-Prozesse,
Umpolung usw.,
bei R. der anorg. Chemie bes. das
HSAB-Prinzip,
Rückbindung,
Cluster
Mit dem Eindringen der Quantentheorie-Betrachtungen in die chem. Theorie, d.h. mit dem Aufkommen der
Quantenchemie, fanden diese empir. abgeleiteten Gesetzmäßigkeiten teilweise ihre theoret. Untermauerung.
Insbes. die semiempir. Molekülorbital-Theorie hat seit den 60er Jahren viel zum Verständnis der R. beigetragen.
Gleichwertige Aussagen zu R. erhält man häufig bei Anw. des Frontorbital-Konzepts von Fukui, bei dem die
Elektronen-Delokalisierung zwischen den HOMO u. LUMO genannten Molekülorbitalen untersucht wird.
Heutzutage werden in vielen Labors quantenchem. Verf., sowohl ab initio als auch semiempirische Verfahren,
eingesetzt, um die Geometrien u. Energien von Übergangszuständen zu berechnen. Oft wählt man zur
Beschreibung der energet. Verhältnisse innerhalb einer Reaktion die Darst. ihres Energieprofils.
HOMO-LUMO-Modell
(Grenzorbitalkonzept).
Zuerst v.a. von K. Fukui (Nobelpreis 1981) propagiertes Konzept, wonach die Grenzorbitale
HOMO: highest occupied molecular orbital
LUMO: lowest unoccupied molecular orbital
der Reaktanden wesentlich die Reaktivität bestimmen. Nach Fukui ist die Elektronendelokalisierung zwischen
HOMO u. LUMO im allg. der Hauptfaktor, der die Leichtigkeit einer chem. Reaktion u. ihre Stereoselektivität
bestimmt; dies gilt sowohl für intermolekulare als auch für intramolekulare Prozesse. Bei Rechnungen mit dem
H.-L.-M. wird von den Grenzorbitalen der ungestörten Reaktanden ausgegangen; die HOMO-LUMOWechselwirkung wird dann mit Hilfe der Störungstheorie berücksichtigt. Das H.-L-M. findet in der Chemie
vielfältige Anw. Bes. fruchtbar erwies es sich in der theoret. Behandlung pericyclischer Reaktionen unter
Berücksichtigung des „Prinzips der Erhaltung der Orbitalsymmetrie“.
Isomerisierung
Bez. für die Überführung einer Verb. in ein Isomer(es). Da es mehrere Formen der Isomerie gibt, sind auch
ebenso viele I. möglich. I.-Reaktionen als typische intramolekulare Vorgänge sind Bestandteile nahezu aller
Umlagerungs-Reaktionen der org. Chemie. Einige I. sind reversibel, andere nicht.
Die Mehrzahl der I. benötigt zur Auslösung die Ggw. von
Katalysatoren,
Einwirkung von UV-Bestrahlung,
Hitze,
Protonen,
Isomerasen
Bei der Valenz-I., auch als Bindungs-I. bezeichnet, werden Bindungen (Einfach- od. Mehrfachbindungen)
verschoben. In günstigen Fällen lassen sich I. spektroskop. verfolgen (NMR-Spektroskopie). Es gibt aber auch
Fälle, in denen die Isomeren ununterscheidbar sind, z.B. bei sog. degenerierten Umlagerungen od.
Automerisierungen, die man heute Topomerisierungen nennt.I. treten nicht nur in vitro, sondern – in
lebenswichtigen Funktionen – in vivo in Erscheinung, d.h. im pflanzlichen u. tierischen Stoffwechsel. In der
Technik sind die I. im allg. übersichtlicher. Von erheblicher Bedeutung sind die Beckmann-Umlagerungen von
Oximen zu Lactamen, die gezielte Verschiebung von Doppelbindungen, bes. aber die Umwandlung
geradkettiger Paraffine in verzweigte, klopfbeständige Typen (Isobutan, Isopentan usw.).
Halogenierung
Bez. für die Überführung eines Elementes od. einer Verb. in ein Halogenid od. Einführung von Halogen-Atomen
in eine org. Verb. durch Addition, Substitution od. doppelte Umsetzung. Hierbei kann das Halogen in freier
Form od. als Säure, Sauerstoffsäure, Salz od. Nichtmetall-Verb. zur Anw. kommen. Während in der Regel die
Chlorierung u. Bromierung nach einander ähnelnden Meth. erfolgen, sind für die Fluorierung u. Iodierung bes.
Arbeitsweisen notwendig. Die für org. Synth. bes. wichtige H. kann z.B. in einer Addition von Halogenen (X2)
bzw. Halogenwasserstoffen (HX, Hydrohalogenierung) an eine C,C-Doppelbindung bestehen od. in der
substituierenden Einführung von Halogen-Atomen in Alkane bzw. aromat. Ringe durch Ersatz von Wasserstoff
usw., wobei häufig photochem. Prozesse u.a. mit dem Auftreten freier Radikale verbundene Reaktionen eine
Rolle spielen. Wichtige H.-Reaktionen sind z.B. die H. mit N-Halogensuccinimiden, Photohalogenierungen, die
Sandmeyer-Reaktion, Hell-Volhard-Zelinsky-Reaktion usw. Die Umkehrung der H. ist die Dehalogenierung.
Acetylierung
Bez. für die Einführung der Acetyl-Gruppe in org. Verb., die OH-, SH- od. NH2-Gruppen enthalten. Im Falle
von OH-Gruppen führt die Acylierung zu Acetaten. Die A. einer geeigneten CH-Gruppe ist ebenfalls möglich u.
liefert Ketone. Die A. spielt in der Analytik der Fette, Öle u. Wachse eine Rolle bei der Best. der Acetyl-Zahl.
Gewöhnlich erhitzt man die zu acetylierende Verb. zusammen mit Essigsäureanhydrid od. Acetylchlorid in
Gegenwart eines Lsgm. In manchen Fällen wird die A. durch Zusatz saurer od. basischer Katalysatoren
beschleunigt. Auch gemischte Anhydride eignen sich zur A.
Hydratisierung
Nicht scharf definierte u. gegenüber Hydratation u. Hydrolyse abgegrenzte Bez. für die Anlagerung von H2O an
org. Substrate. Hier wird unter H. ausschließlich die durch chem. Reaktion u. kovalent erfolgende Bindung von
H u. OH (aus Wasser) an zwei benachbarte Atome verstanden. Im lebenden Organismus laufen ständig – durch
Hydratasen/Dehydratasen katalysierte – H. u. Dehydratisierungen nebeneinander ab. Die in Ggw. von (sauren)
Katalysatoren (meist Schwefelsäure) ausgeführten H. dienen zur großtechn. Herst. von Aldehyden (aus
Acetylenen) u. Alkoholen, wobei mengenmäßig die H.-Verf. zur Herst. von Ethanol u. 2-Propanol die von
Butanolen bei weitem überwiegen . Auch im Laboratorium eignet sich die H. zur Synth. von Hydroxy-Verb.,
wobei der Eintritt der OH-Gruppe meist der Markownikoffschen Regel folgt. Streng nach der MarkownikoffRegel verläuft die als Oxymercurierung bezeichnete H. von Alkenen mit Quecksilber(II)-acetat. QuecksilberSalze katalysieren auch die H. von Alkinen, wobei, außer im Falle von Acetylen selbst, Ketone gebildet werden.
Die H. von Carbonyl-Verb. führt oft zu instabilen gem-Dihydroxy-Verb., die fachsprachlich als „Hydrate“
bezeichnet werden u. nur in Ausnahmefällen isoliert werden können.
Hydrolyse
(von Hydro... u. ...lyse)
Unter H. versteht man eine chem. Reaktion, bei der eine Verb. durch Einwirkung von Wasser gespalten wird.
Bei der analogen Reaktion mit Deuteriumoxid spricht man von Deuterolyse. Der Begriff H. wurde von
Arrhenius verwendet, um den experimentellen Befund zu erklären, daß wäss. Lsg. von Salzen schwacher Säuren
od. Basen nicht neutral, sondern basisch bzw. sauer reagieren.
Allg. Schema für diese „Salzhydrolyse“:
Salz + Wasser Ù Säure + Base
Diese H. ist demnach die Umkehrung der Neutralisation. Heutzutage wird die Salz-H. im allg. in das
allgemeinere Säure-Base-Konzept von Brønsted eingeordnet.
Techn. wichtige H. sind die
Spaltung von
Fetten,
Saccharose in Glucose u. Fructose (Inversion),
Stärke u. Cellulose in Glucose.
Verseifung von Estern:
Ester + Wasser Ù Säure + Alkohol
Spaltung von Eiweißstoffen in Aminosäuren (Eiweiß-Hydrolysate)
Präparativ nutzbare, mikrobielle H. werden durch Hydrolasen bewirkt. Durch H. lassen sich auch Hydrosole
herstellen u. zwar dann, wenn das eine H.-Prod. prakt. in Wasser unlösl. ist, während sich das andere aus dem
Wasser entfernen läßt. H. kann zu einer Verminderung od. Aufhebung tox. Wirkungen führen. Die H.-Geschw.
wird deshalb oft als Kriterium für die Beurteilung der Umweltverträglichkeit herangezogen. Für viele Verb. läßt
sich die H.-Geschw. berechnen. Im angelsächs. Schrifttum wird mit H. oft auch die Aquotisierung gemeint.
Verseifung
Im engeren Sinne Bez. für die der Veresterung entgegengesetzte hydrolyt. Spaltung von Estern mit Hilfe von
Laugen, Wasser, Säuren od. Enzymen (Esterasen), wobei unter Wasseraufnahme Alkohole u. Säuren entstehen.
Für V. u. Veresterung gilt die Taft-Gleichung. Prinzipiell kann man die Umesterung als V. mit nachfolgender
Veresterung auffassen. Mit Hilfe von Alkalien (meist NaOH) erhält man bei diesem Vorgang Glycerin u. die als
Seife bekannten Natriumsalze der entsprechenden Fettsäuren, während die hydrolyt. Hochdruckspaltung mit od.
ohne Katalysator direkt die freien Fettsäuren zus. mit Glycerin liefert. Verbleibende Rückstände bezeichnet man
als Unverseiftes od. Unverseifbares. In der Analytik der Fette bestimmt man die Verseifungszahl (VZ) als
Kenngröße. Im weiteren Sinne wird als V. jede hydrolyt. Spaltung bezeichnet, z.B. von Nitrilen zu Amiden
(Hydrolyse) od. selbst von Eiweißstoffen u. Polysacchariden. Die Überführung einer Carbonsäure in ihr
Alkalisalz wird in der Technik immer noch als „Verseifung“ bezeichnet.
Addition
Reaktionstyp in der org. Chemie, der speziell die Reaktivität von ungesättigten Verb. wie Alkene (Olefine),
Alkine u. anderen mit Kohlenstoff-Heteroelement-Doppelbindung bzw. -Dreifachbindung bestimmt. Die Prod.
von A.-Reaktionen werden gelegentlich als Addukte nicht aber als Additionsverbindungen bezeichnet, da dieser
Begriff in der Hauptsache den Molekülverb. vorbehalten ist. Je nach Art der ungesättigten Verb. u. des
addierenden Reagenz kann die A. einstufig od. zweistufig ablaufen, es können offenkettige od. ringförmige
Addukte gebildet werden, bei konjugierten Dienen kann die A. in 1,2- od. 1,4-Stellung erfolgen u. die A. kann,
was in neuster Zeit von immer größerer Bedeutung für die synthetische org. Chemie wird, stereoselektiv bzw.
stereospezifisch erfolgen. Zweistufige A. können als elektrophile, nucleophile od. radikalische Reaktionen
ablaufen, wobei neben den beteiligten A.-partnern die Lösungsmittel-Polarität u. die Gegenwart von A.Beschleunigern wie Radikal-Startern od. eine Säure-Base-Katalyse, die Reaktionsweise bestimmen. Die A. von
Halogenwasserstoffen an Alkene wird als zweistufige, elektrophile A. aufgefaßt. Bei unsymmetrischen Alkenen
kann anhand der Markownikoffschen Regel die Regiochemie der A. vorhergesagt werden. Die A. von
Carbanionen an a,b-ungesättigte Carbonyl-Verb. ist ein Beispiel für eine nucleophile A., während radikalische
A. beispielsweise bei der Dimerisation von Halogenalkenen beobachtet werden.
Elektrophile Reaktionen
Unter e. R. faßt man im wesentlichen die elektrophile Addition u. elektrophile Substitution zusammen. E. R.
verlaufen in der Regel zweistufig, wobei zunächst ein elektrophiles (elektronenliebendes) Teilchen ein Substrat
mit erhöhter Elektronendichte, z.B. das p-System einer aromatischen Verbindung angreift. Als elektrophile
Spezies kommen vor allem positive Ionen (z.B. Carbenium-Ionen), die positiven Enden eines Dipols (z.B.
Carbonyl-Deriv.) od. induzierten Dipols, Lewis-Säuren usw. in Frage. Ob die Reaktion als Substitution od.
Addition weiterläuft hängt von der thermodynamischen Stabilität des Endproduktes ab. Während arom. Verb.
praktisch ausschließlich unter Substitution reagieren, addieren Alkene u. Alkine das zum Elektrophil vorhandene
Gegenion. Am besten untersucht sind die elektrophilen aromatischen Substitutionen.
Reaktionstypen:
Halogenierung,
Nitrierung,
Sulfonierung,
Alkylierung,
Acylierung
Nucleophile Reaktionen
(anionoide Reaktionen)
Ion. Reaktionen der org. Chemie, bei denen ein Nucleophil ein elektrophiles Substrat angreift. N. R. können als
Additionen, Eliminierungen, Substitutionen od. Umlagerungen – wobei hier nur die wichtigsten Reaktionstypen
aufgeführt sind – ablaufen. In manchen Fällen wird ein Einelektronentransfer SET-Mechanismus unter
Beteiligung von Radikal-Anionen durchlaufen. In mechanist. Hinsicht sehr gut untersucht ist die nucleophile
Substitution.
Radikalische Reaktionen
Radikale können 6 unterschiedliche Elementarreaktionen eingehen. Es sind dies
Atomabstraktionen,
Additions-,
Eliminierungs-,
Umlagerungs-,
Elektronen-ÜbertragungsKombinations-Disproportionierungs-Reaktionen
Umlagerungsreaktionen spielen bei r. R., im Gegensatz zur Chemie der Carbenium-Ionen, eine untergeordnete
Rolle, da bei synchronem Verlauf der Umlagerung eine energet. ungünstige Dreielektronen-DreizentrenBindung durchlaufen wird . Von großer Bedeutung dagegen sind Elektronen-Übertragungsreaktionen (SETReaktionen).
Freie Radikale
Die meisten Chemiker verstehen unter f.R. Mol. od. Mol.-Bruchstücke, bei denen nicht alle Elektronen gepaart
vorliegen, die einen von Null verschiedenen Spin besitzen u. damit paramagnetisch sind. Diese Definition ist
aber nicht ganz unproblematisch. Spektroskopiker verwenden häufig eine heuristische Definition, wonach alle
Spezies als f.R. bezeichnet werden, die unter normalen Laborbedingungen in der Gasphase eine kurze
Lebensdauer besitzen. Hiernach zählen praktisch alle reaktiven Zwischenstufen zu den f.R., stabile Mol. in
Nicht-Singulett-Grundzuständen wie NO od. O2 hingegen nicht. Zusammenfassend läßt sich festhalten, daß es
keine eindeutige, allg. akzeptierte Definition des Begriffes f.R. gibt. Die Existenz f.R. im Sinne der
„Spektroskopiker-Definition“ wurde von Paneth (1929) bewiesen; bei den f.R. handelte es sich hierbei um
Methyl-Radikale (CH3), die durch thermische Zersetzung von Bleitretramethyl, Pb(CH3)4, erzeugt wurden.
Beiden genannten Definitionen genügende kurzlebige Spezies lassen sich hauptsächlich folgendermaßen
erzeugen:
1. durch homolytischen Bindungsbruch A–B Ù A+B; der Bindungsbruch kann hierbei thermisch od.
durch Bestrahlen mit energiereicher Strahlung wie UV-Strahlung erfolgen;
2. durch Reaktion mit anderen f.R.
3. durch Einelektronen-Übertragung (Oxidation od. Reduktion)
Zur Untersuchung von f.R. werden spektroskopische Meth. herangezogen. Ein chem. Nachweis f.R. erfolgt
durch Abfangexperimente, bei denen reaktive f.R. mittels sog. Radikal-Fänger („spin traps“) in langlebige
Spezies umgewandelt werden. In der Biologie ist Vitamin E ein wichtiger Radikal-Fänger. F.R. spielen als
reaktive Zwischenstufen bei vielen Reaktionen eine wichtige Rolle, z.B. bei Reaktionen in der Atmosphäre, in
Flammen, Ketten-Reaktionen in der präparativen Chemie, bei der radikalischen Polymerisation od. in der
Strahlenchemie.
Newman-Projektion
Von M. S. Newman eingeführte Projektion zur Beschreibung der Konformation eines Mol. Hierbei projiziert
man in die Richtung der Bindung zwischen zwei Atomen. Die von diesen Atomen ausgehende, durch Striche
symbolisierte Bindungen ähneln den Speichen eines Rades.
Katalyse
Von griech.: Auflösung hergeleitete Bez. für die Erscheinung, daß die Geschw. einer chem. Reaktion durch die
Ggw. eines Stoffes (des Katalysators) beeinflußt wird, der die Reaktion scheinbar unverändert übersteht. Der
Katalysator wird in der Brutto-Reaktionsgleichung nicht berücksichtigt; für seine Wirkungsweise gelten die
folgenden Regeln:
1. Die Zusammensetzung des Katalysators bleibt während der Reaktion scheinbar unverändert.
2. Oft genügt bereits eine kleine Menge, um die Umsetzung einer großen Menge der reagierenden
Substanz zu beeinflussen.
3. Eine Reaktion, welche thermodynamisch nicht möglich ist, kann auch durch einen Katalysator
nicht ausgelöst werden; er kann lediglich die Reaktionsgeschwindigkeit od. besser die Geschw., mit
der sich ein chemisches Gleichgewicht einstellt, beeinflussen. Die Ursache hierfür ist, daß die
Aktivierungsenergie der Reaktion in Ggw. des Katalysators (K) kleiner ist als die der
unkatalysierten Reaktion.
Eine quantenmechan. Behandlung der Katalyse zeigt, daß sich zahlreiche Gesetzmäßigkeiten anhand von stat.
Kugelspielen verdeutlichen lassen. Bei einer verzögernden Wirkung des Katalysators auf die Einstellung des
chem. Gleichgew. spricht man von neg. K. od. Antikatalyse. Gelegentlich werden die Begriffe Antikatalyse u.
Inhibition gleichgesetzt; dies sollte vermieden werden, da die Wirkungsweise von Inhibitoren u./od.
Hemmstoffen (diese verbrauchen sich u.U. bei der Reaktion) eine andere sein kann als die eines Katalysators.
Dagegen wird die Desaktivierung mitunter als neg. K. bezeichnet. Bei der Autokatalyse entsteht der Katalysator
erst während der Reaktion. Begriffe wie Pseudo-, Autokatalyse, intramol. K., K.-gifte, Physi- u. Chemisorption,
Aktivitätszentrum, Substrat u. dgl. wurden von der IUPAC verschiedentlich definiert. Kann ein Einsatzstoff auf
unterschiedlichen Reaktionswegen zu unterschiedlichen Prod. reagieren, so besteht durch die Verw. eines
geeigneten Katalysators die Möglichkeit, den Weg der Reaktion, d.h. deren Selektivität zu beeinflussen.
Definition: Man unterscheidet zwischen homogener u. heterogener K. Bei der homogenen K. gehört der
Katalysator der gleichen Phase an wie das Reaktionssyst.; bei der heterogenen K. liegt der Katalysator im allg.
als Feststoff vor, d.h. die Reaktanden (flüssig od. gasf.) u. der Katalysator sind einander berührende, jedoch
verschiedene Phasen. Katalysatoren aller Art spielen in den Organismen (als sog. Biokatalysatoren, insbes. die
Enzyme) u. in der Technik eine außerordentlich wichtige Rolle. Manche Katalysatoren (bes. die Enzyme) wirken
selektiv, d.h., auf bestimmnte Stoffe od. Reaktionen. Diese Eigenart der Biokatalysatoren macht sich die
Biotechnologie zunutze, wobei die in den letzten Jahren entwickelten Meth. der Immobilisierung die
Durchführung heterogener K. selbst in großtechn. Umfang ermöglicht haben. Dagegen sind techn. Katalysatoren
oft sehr vielseitig. Die Entwicklung neuer Katalysatoren ist u.U. sehr aufwendig.
Unters.-Meth.: Im Fall der heterogenen K. erfolgt die Reaktion an der Oberfläche des Katalysators. Dabei
werden die Edukte bei der Adsorption an der Katalysatoroberfläche in einen akt. Zustand versetzt. Einen tieferen
Einblick in Struktur u. Wirkungsweise von Katalysatoren gewinnt man heute mit einer Vielzahl von physik.chem. Unters.-Meth. Mit Hilfe dieser Meth. lassen sich Aussagen zu folgenden Katalysatoreig. machen:
Chem. Zusammensetzung,
Oxidationsstufen,
Säure/Base-Eig.,
Struktur adsorbierter Spezies,
Oberfläche,
Porenstruktur/-radien/-vol.,
Partikelgröße
Markownikoffsche Regel
Eine von W. W. Markownikoff (1838–1904) 1869 aufgestellte Regel, wonach
„bei der elektrophilen Addition von unsymmetr. elektrophilen Reagenzien
(Halogenwasserstoffe, Wasser, Alkohole, u.a.) an unsymmetr. Alkene, dasjenige Regioisomere gebildet wird, bei dem sich der elektrophilere Teil des
Additionsreagenz an dem Kohlenstoff-Atom der Doppelbindung wiederfindet, das die meisten Wasserstoff-Atome besitzt“
Das tiefere Verständnis für die M.-R. ergibt sich daraus, daß bei der zweistufig verlaufenden, elektrophilen
Addition, das Elektrophil an die Doppelbindung so addiert, daß das stabilere Carbenium-Ion als Zwischenstufe
gebildet wird. Geht man von der Gültigkeit des Hammond-Postulates aus, so sollte die Bldg. des stabileren
Carbenium-Ions durch den niedrigeren Übergangszustand bewirkt werden. Alkene mit ElektronenakzeptorResten können die M.-R. verletzen, da in diesen Fällen das zu erwartende Carbenium-Ion einem anderen
positivierten Atom benachbart ist, was energetisch ungünstig ist. Verläuft die Addition nicht elektrophil sondern
nach einem radikal. Mechanismus, so wird die M.-R. ebenfalls verletzt. Grund hierfür ist, daß sich das stabilere
u. sterisch günstigere Radikal als Zwischenstufe bildet.
Chemische Verbindungen
Bez. für homogene reine Stoffe, deren kleinste Einheiten (Moleküle) aus mindestens zwei Atomen verschiedener
Elemente zusammengesetzt sind. Nicht zu den c.V. zählt man daher die mehratomigen Modif. der Elemente. Die
Eig. der c.V. unterscheiden sich grundlegend von denen der Gemische aus gleichen Anteilen der sie aufbauenden
Elemente. Die Atome sind durch chemische Bindung in bestimmten zahlenmäßigen Verhältnissen miteinander
verbunden.
Nach der Anzahl der beteiligten Elemente (Atomarten) unterscheidet man
binäre,
ternäre,
quaternäre usw. Verbindungen
andererseits spricht man im Hinblick auf die chem. Bindung der Atome auch von
polaren,
apolaren
intermetall. Verbindungen
Einfache od. Verb. 1. Ordnung können nur in Elemente od. bruchstückartige Atomgruppen (Radikale, Ionen)
gespalten od. aus solchen (ohne Umsetzung) aufgebaut werden; zusammengesetzte od. Verb. höherer Ordnung
entstehen durch Zusammentreten einfacher c.V.. Während einer Reaktion vorübergehend entstehende, nicht im
Endprod. enthaltene c.V. nennt man intermediäre Verb. od. Zwischenstufen. Eine bes. Gruppe sind die
nichtstöchiometrischen Verbindungen, die man früher als Berthollide den Daltoniden (c.V. mit stöchiometr.
Zus.) gegenüberstellte.
Verbindungsklassen
Bez. für Gruppen solcher chemischer Verbindungen, die infolge des Besitzes gleicher funktioneller Gruppen od.
gleicher Ionen gleichartige chem. Reaktionen aufweisen.
Funktionelle Gruppen
Org. Kohlenwasserstoffe sind in der Regel reaktionsträge u. oft nur an den Stellen, die polare Atom-Bindungen
besitzen angreifbar. Solche Stellen bezeichnet man daher als funktionelle Gruppen, da sie die Reaktivität einer
Stoffklasse bestimmen. Sie dienen auch, neben der Einteilung der Verb. in Kohlenstoff-Gerüste, als Kriterium,
um die org. Chemie zu systematisieren . Die wichtigsten f.G. mit ihren zugehörigen Stoffklassen sind in der
Tab. aufgeführt:
C
NH2
C
OH
C
O
C
NH
C
OH
O
C
O
NH2
von oben nach unten:
Amino-Gruppe
Hydroxy-Gruppe
Carbonyl-Gruppe
Imino-Gruppe
Carboxy-Gruppe
Carboxamid-Gruppe
Æ Amine
Æ Alkohole
Æ Aldehyde/ Ketone
Æ Imine/ Acormethine
Æ Schiff´sche Basen/ Carbonsäuren
Æ Carbonamine
Alkane
Sammelbez. für früher auch – weil sie bis zur Grenze ihrer Aufnahmefähigkeit Wasserstoff-gesätt. sind –
Grenzkohlenwasserstoffe od. auch Paraffine genannte
gesätt. aliphat. Kohlenwasserstoffe der allg. Formel CnH2n+2
in verzweigten (Isoalkane, Isoparaffine)
unverzweigten (n-Alkane, n-Paraffine) Ketten
ringförmige gesätt. Kohlenwasserstoffe besitzen die
allg. Formel CnH2n
u. werden Cycloalkane genannt. Nach den Nomenklatur-Regeln werden A. im Namen durch die Endung -an
gekennzeichnet:
Methan
Ethan
Propan
Butan
Pentan
Hexan
Heptan
Oktan
Nonan
Dekan
Die A. mit mehr als 4 C-Atomen erhalten ihre Namen unter Zuhilfenahme der griech. Zahlwörter, z.B. Dodecan
(C12H26), Eicosan (C20H42). Vom Butan ab können aufgrund von Kettenverzweigungen Isomere auftreten,
d.h. Verb. gleicher Bruttozusammensetzung wie das entsprechende lineare Alkan. Für die ersten Glieder dieser
verzweigten A. sind noch Trivialnamen in Gebrauch, doch sollte die eindeutige Zuordnung durch Verw. der
IUPAC-Nomenklatur vorgenommen werden, da schon vom Decan beispielsweise 75, beim Eicosan bereits über
300000! Isomere denkbar sind.
Unter Normalbedingungen sind die A.
von C1 bis C4 Gase
von C5 bis C16 Flüssigkeiten
die höheren A. sind (z.T. wachsartige) Festkörper
Der Schmp. 100° wird etwa bei C60 erreicht. A. mit MG. >1000 rechnet man meist schon zu den Polyolefinen.
Wie schon der frühere Gattungsname Paraffine besagt, sind die A. im allg. nicht sehr reaktionsfreudig (lat.
parum = wenig, affinis = geneigt), wenn auch unter drast. Bedingungen Protonierungen, Oxygenierungen ,
Pyrolyse , Radiolyse u. Photolyse möglich sind. Die Oxidaton der A. läßt sich auch elektrochem. bewirken .
Auch einige Mikroorganismen vermögen A. abzubauen. Vor allem die niederen Glieder sind leicht entflammbar
u. bilden mit Luft explosive Gemische; ihre Löslichkeit in Wasser ist sehr gering. In der Natur finden sich die A.
im Erdöl u. Erdgas, woraus sie techn. durch Dest. u. Extraktion gewonnen werden.
Verw.:Als Lsgm., Brennstoffe, Treibstoffe, zur Fettsynthese, zur Überführung in Olefine, die als Ausgangsstoffe
für Alkylbenzole eine große Rolle für die Synth. biolog. abbaubarer Waschmittel spielen, zur Gewinnung von
Fettsäuren durch Luftoxidation , zur Herst. von SCP (Eiweiß) usw.
Alkohole
Gruppenbez. für Hydroxy-Deriv. von aliphat. u. alicycl. gesätt. u. ungesätt. Kohlenwasserstoffen.
Man spricht von
ein-,
zwei-,
dreietc.-wertigen A.,
je nachdem, wie viele Hydroxy-Gruppen das Molekül enthält. Zweiwertige A. nennt man, wenn die HydroxyGruppen benachbart sind, nach ihrem einfachsten Vertreter Glykol auch Glykole, anderenfalls Diole. Die
höherwertigen, mit den Zuckern verwandten A. (Zuckeralkohole) werden nach den Nomenklaturregeln der
Aldite benannt. Diese werden gelegentlich mit anderen mehrwertigen A. zu Polyolen zusammengefaßt. Wenn
bei Benzol-Abkömmlingen die OH-Gruppe an einem der 6 C-Atome des Ringes sitzt, handelt es sich um
Phenole, die auf Grund ihres besonderen Verhaltens nicht mehr zu den A. gerechnet werden; dagegen spricht
man von A., wenn die OH-Gruppe in den aliphat. Seitenketten aromat. Kohlenwasserstoffe vorliegt (z.B.
Benzylalkohol).
Wenn die OH-Gruppe bei aliphat. A. an einem
endständigen C-Atom fixiert ist, spricht man von primären,
an mittelständigen C-Atomen von sekundären
an Verzweigungsstellen von tertiären Alkoholen.
Die systemat. Namen werden von denen der Stamm-Kohlenwasserstoffe durch Anhängen des Suffixes -ol od.
durch Vorhängen des Präfixes Hydroxy... abgeleitet, wobei gegebenenfalls Ziffern die Stellung der OH-Gruppe
im Mol. kennzeichnen. Zu den A. gehören auch die Enole, die Acyloine (als Hydroxyketone), Aminoalkohole
(z.B. die Alkanolamine) u. die Hydroxycarbonsäuren, die ggf. intramol. Ester (Lactone) bilden können.
Vork.: In der Natur kommen so viele A. frei od. verestert vor, daß hier nur oberflächlich darauf eingegangen
werden kann: Fett- u. Wachsalkohole kommen in Fetten, fetten Ölen u. Wachsen vor, ein Bestandteil wichtiger
Nervensubstanzen ist der A. Sphingosin (ein Aminoalkohol), das exotische Dolichol kommt im Nierengewebe
vor, die Mehrzahl der physiolog. akt. Steroide (Cholesterin, Östradiol, Testosteron etc.) sind ebenso A. wie die
Catecholamine, wie Zucker u. Kohlenhydrate, viele Pharmaka sind A., in Harzen und Gummen sind aliphat.
Tetrole gebunden . A. gehören zu den wichtigsten Riechstoffen , die in vielen etherischen Ölen vorkommen. Auf
das Auftreten der niederen A. bei Gärungsprozessen braucht nicht besonders hingewiesen zu werden –
schließlich wird Ethanol umgangssprachlich als „Alkohol“ schlechthin bezeichnet. Einige A. treten auch im
Stoffwechselgeschehen in Erscheinung. Niedere A. hemmen bei Pflanzen die Samenkeimung .
Die einwertigen prim. A. mit 1–3 C-Atomen sind leichtbewegliche Flüssigkeiten, die sich mit Wasser beliebig
mischen; die A. mit 4–12 C-Atomen sind ölige Flüssigkeiten, die höheren A. sind bei gewöhnlicher Temp. fest,
geruchlos, wachsähnlich u. nur noch in org. Lsgm. löslich. Mehrwertige A. lösen sich in Wasser leichter auf; ihre
Süßigkeit steigt im allg. mit der Zahl der OH-Gruppen. Die Siedepunkte der A. liegen infolge WasserstoffBrückenbindungen bedeutend höher als die der entsprechenden Kohlenwasserstoffe; mit jedem weiteren Atom
steigt der Sdp. um durchschnittlich 19°, die Schmelzpunkte erhöhen sich mit wachsender Molmasse weniger
regelmäßig. Die sek. u. tert. A. haben tiefere Siedepunkte als die prim. Alkohole.
In chem. Hinsicht sind die A. sehr reaktionsfähig, wobei jedoch die Isomeren deutliche Unterschiede in ihrem
Verhalten zeigen. So lassen sich prim. u. sek. A. meist unter milden Bedingungen, tert. dagegen nur unter
drastischen od. gar nicht mit Carbonsäuren zu Estern umsetzen. Ähnlichen Unterschieden begegnet man in der
Reaktion mit Metallen, mit denen Alkoholate gebildet werden, sowie in der Substitution der OH-Gruppe durch
Halogen-Atome, wozu meist Phosphorhalogenide bzw. Thionylchlorid herangezogen werden. Charakterist. ist
das
Verhalten gegenüber Oxidationsmitteln:
prim. A. werden zu Aldehyden u. weiter zu Carbonsäuren oxidiert,
aus sek. A. Ketone;
tert. A. bleiben unter analogen Bedingungen unverändert
Von mehrwertigen A. leiten sich mehrere Oxidationsprod. (bei Ethylenglykol insgesamt 5) ab. Durch
Einwirkung dehydratisierender Mittel wie Säuren, Metall-Salzen etc. lassen sich aus A. Alkene od. Ether
gewinnen. Additions-Reaktionen der A. an C,C-Mehrfachbindungen lassen Ether, solche an C,ODoppelbindungen Acetale entstehen. Der Wasserstoff der OH-Gruppe ist „sauer“, wobei die Acidität von
Methanol zu Neopentylalkohol zunimmt . Die Beweglichkeit des Wasserstoffs ist auch die Ursache für die
leichte Bildung von deuterierten Verbindungen. Aus der Vielzahl der Herst.-Meth. für A. seien die
Hydratisierung von Alkenen, die Hydrolyse von Alkylhaliden, die Verseifung von Estern sowie die Reduktion
von Carbonyl- bzw. Carboxy-Gruppen (z.B. mit Lithiumaluminiumhydrid) genannt.
Spezielle Meth. sind die
Aldol-Addition,
Grignard-Reaktion,
Oxo-Synthese,
Hydroborierung,
Cannizzaro-Reaktion,
Bouveault-Blanc-Reaktion
Meerwein-Ponndorf-Verley-Reduktion
Zum Nachweis u. zur Best. von A. wird von alters her die Bildung schwerlösl. u. ggf. gefärbter Ester
herangezogen. Üblicherweise setzt man die A. in der Schotten-Baumann-Reaktion mit Carbonsäurechloriden
um.
Verw.: Als Lsgm. in Laboratorium u. Technik, zur Herst. von Estern für die Aromen-, Parfüm- u. PharmaIndustrie, von Tensiden, von Monomeren u. als Rohstoffe für die Herst. anderer Organika.
Aldehyde
Von Liebig (1835) eingeführte Bez. (Alcohol dehydrogenatus), weil die A. durch Entziehung von 2H-Atomen
aus Alkoholen erhalten werden können. A. sind
durch die Aldehyd-Gruppe –C(=O)H charakterisiert.
Ihre Benennung erfolgt
1. durch Trivialnamen
2. ersetzt man bei den lat. Namen der Säuren, die bei der Oxidation der betreffenden A. entstehen, die
Endung durch –aldehyd
3. fügt man an den systemat. Namen des zugrunde liegenden Kohlenwasserstoffs die Endung -al an
4. hängt man an die Namen vor allem alicycl. u. aromat. Kohlenwasserstoffe die Endung -carbaldehyd
an
5. hat eine andere funktionelle Gruppe eine höhere Priorität, so muß die A.-Funktion durch das Präfix
Formyl... bezeichnet werden
Die A.-Gruppe ist eine wichtige osmophore Gruppe: Viele A. haben einen angenehmen, obst- od. blumenartigen
Geruch. Die Siedepunkte der A. steigen mit den Molmassen u. liegen niedriger als die der zugehörigen
Alkohole; die niederen A. sind wasserlösl., die höheren nicht. Die A. reagieren neutral od. höchstens schwach
sauer; sie können leicht zu den entsprechenden org. Säuren oxidiert werden u. wirken als Redukitonsmittel auf
Fehlingsche u. ammoniakal. Silbernitrat-Lösung.
Nachw.: Schiffs Reagenz färbt sich nach Zusatz von A. blaurot; mit 12-Molybdokieselsäure in alkal. Lsg. geben
A. eine blaue Farbreaktion.
Vork.: In Organismen treten A. als Zwischenprod. des Stoffwechsels auf , wobei Oxidation u. Reduktion durch
Dehydrogenasen bewirkt werden. In der Natur kommen A. in gebundener Form in den Polysacchariden
(Kohlenhydraten) überall, in freier Form meist nur in geringen Konz. in ether. Ölen vor.
Herst.: Die techn. Herst. der A. geht meist von den zugehörigen Alkoholen aus, die mit CrO3 in Pyridin, HMPT
od. Graphit, mit HNO3, NO2 od. katalyt. mit Luft oxidiert werden; auch die Reduktion von Carbonsäuren, ihren
Halogeniden od. Salzen kommt als Herst.-Meth. in Frage, doch werden großtechn. benötigte A. meist nach
speziellen Verfahren gewonnen.
Die A. sind sehr reaktionsfähige Verb.; die Carbonyl-Gruppe geht leicht Additionen, Kondensationen u.
Polymerisationen ein. Aufgrund ihrer vielfältigen Einsatzmöglichkeiten haben die A. große techn.Bedeutung.
Anw.: Die niederen als Rohstoffe für Synth., für Kunststoffe u. Kunstharze (Aminoplaste, Phenoplaste), als
Desinfektionsmittel, zum Gerben etc., die höheren zur Herst. von Riechstoffen. Aromat. A. werden zu Aromen,
Pharmazeutika, Pflanzenschutzmitteln u. Farbstoffen verarbeitet.
Ketone
Von Aceton abgeleiteter Gruppenname für
Verb. der allg. Formel R1R2C=O,
wobei die org. Reste Alkyl- u./od. Aryl-Gruppen darstellen bzw. zum Ring geschlossen sein können. Die
Benennung der K. kann
1. von Trivialnamen Gebrauch machen (Aceton, Testosteron)
2. die beiden Reste R1 u. R2 als Präfixe vor die Gruppenbez. setzen
3. durch Anhängen des Suffixes... ...on mit Stellungsbez. an den Namen des StammKohlenwasserstoffs geschehen
4. in geeigneten Fällen durch Bez. als Acyl-Rest vorgenommen werden, insbes. wenn andere
Substituenten vorhanden sind
5. bei Vorliegen eines Substituenten mit höherer Priorität muß die Benennung durch Voransetzen des
Präfixes Oxo... (früher Keto...) vor den Namen der bereits anderweitig substituierten Verb. erfolgen
Einfache niedermol. K. sind stabile, farblose Flüssigkeiten von angenehmem, leicht aromat. Geruch. Sie sind
relativ flüchtig mit Siedepunkten, die nur wenig über denen der entsprechenden Alkane liegen. Bis C5 sind
aliphat. K. in Wasser lösl. u. finden als excellente Lsgm. vielfache Verw. in der chem. Ind. Die aliphat.-aromat.
bzw. aromat. Ketone sind dagegen hochsiedende Flüssigkeiten bzw. Feststoffe. Ihre Hauptverw. liegt in der org.
Synth.
Nachw.: Im allg. durch Kondensations-Reaktionen mit Stickstoff-Verb., die zu schwerlösl., leicht zu
charakterisierenden u. oft farbigen Derivaten führen. Mit Hilfe der IR-Spektroskopie können K. anhand der
charakterist. CO-Valenzschwingung erkannt werden. Aus Gemischen lassen sich K. evtl. mit Girard-Reagenzien
abtrennen.
Vork.: In der Natur sind K. sehr verbreitet, z.B. in Form von Sexualhormonen u.a. Steroidketonen, als
Terpenketone in ether. Ölen u. Duftstoffen, als Stoffwechselzwischenprod. im Organismus, als Substrate in biol.
Redoxreaktionen, als Biogenesezwischenstufen usw. Sog. Keton-Körper sammeln sich bei bestimmten
Stoffwechselstörungen u. auch bei Hunger im Organismus an (Acetonurie).
Herst.: Aliphat. K. erhält man leicht durch Oxid. od. Dehydrierung von sek. Alkoholen. Ein historisch altes Verf.
ist die Pyrolyse der Calcium-Salze von Carbonsäuren, die nur in Ausnahmefällen brauchbare Ergebnisse liefert.
Mit Hilfe der Umpolung ist es auch möglich, einen Aldehyd in ein Keton umzuwandeln. In der industriellen
Synth. werden K. meistens durch eine Direktoxid. von Alkanen mit Sauerstoff an spezif. Katalysatoren, durch
Gasphasen-Dehydrierung von sek. Alkoholen od. nach dem Wacker-Verf. aus Alkenen hergestellt.
Reaktionen: Die Fähigkeit der K. zur Enolisierung ist die Grundlage für die Bldg. von Salzen. K. reagieren in
Additions- u. Kondensations-Reaktionen wie Aldehyde, da das Reaktionsverhalten nur von der Carbonyl-Gruppe
bestimmt wird. Im allg. sind die Ketone jedoch reaktionsträger. Für die Red. von K. zu Alkoholen, Diolen u.
Kohlenwasserstoffen gibt es viele Meth. Von z.T. techn. Bedeutung sind die katalyt. Hydrierung, die Red. mit
Zn/Hg u. Salzsäure, mit komplexen Hydriden, die Wolff-Kishner-Reduktion mit der Variante der HuangMinlon-Reduktion, die Meerwein-Ponndorf-Verley-Reduktion. In Ggw. von Nickel als Katalysator lassen sich
K. mit NH3 u. H2 zu Aminen reduzieren (reduktive Aminierung). Grignard-Verb. setzen sich mit K. zu tert.
Alkoholen um. Die reduktiven Kupplungen verlaufen über Elektronentransfer vom Metall zum K. unter Bldg.
eines Radikal-Anions, das dann dimerisiert. Mit den üblichen Oxid.-Mitteln reagieren K. erst unter drastischen
Bedingungen über Peroxide u. C,C-Spaltung zu Carbonsäuren. Aus cycl. Ketonen lassen sich so gezielt
Dicarbonsäuren herstellen.
Verw.: Aceton, Cyclohexanon, 2-Butanon (Methylethylketon) u. 4-Methyl-2-pentanon (Methylisobutylketon)
gehören zu den meist produzierten industriellen Chemikalien. Während die drei acycl. K. als Lsgm. Verw.
finden, wird Cyclohexanon vorwiegend für die Herst. von e-Caprolactam (Polyamid-Herst.) gebraucht. K. finden
auch Verw. als Ausgangsstoffe für synthet. Prod. in der pharmazeut.-, Farbstoff-, Riechstoff-,
Schädlingsbekämpfungs- u. Kunststoff-Ind..
Carbonsäuren
Bez. für eine große Gruppe von org. Säuren, die eine od. mehrere Carboxy-Gruppen enthalten;
Formel: R–COOH
entspr. kennt man
Mono-,
Di-,
Tricarbonsäuren,
Polycarbonsäuren usw.
Die Carboxy-Gruppen können mit (gesätt. od. ungesätt.) Alkyl- od. Cycloalkyl-Resten od. mit aromat. Resten
verbunden sein; die ersteren bezeichnet man auch als Fettsäuren. Die Nomenklatur der C. greift entweder auf
Trivialnamen zurück oder bildet die systemat. Namen entweder aus dem Namen des Stammkohlenwasserstoffs
R durch Anhängen der Nachsilbe „...carbonsäure“ od. aus dem Namen des Kohlenwasserstoffs (R+1) unter
Anhängen von „...säure“.
Bekannte C. sind
Ameisen-,
Essig-,
Butter-,
Stearinsäure (gesätt. Fettsäuren),
Acrylsäure,
Crotonsäure,
Ölsäure (ungesätt. Fettsäuren),
Oxal-,
Malon-,
Bernstein-,
Adipinsäure (gesätt. Dicarbonsäuren),
Benzoe- u. Phthalsäure (aromat. Mono- u. Dicarbonsäure)
Die Gegenwart weiterer Substituenten am Grundgerüst der C. vergrößert die Zahl der C. erheblich; zu diesen
substituierten C. zählen die Aminosäuren, Hydroxy- u. Oxosäuren. Durch Ersatz des Carbonyl- u./od.
Hydroxysauerstoffs durch Stickstoff- bzw. Schwefel-haltige Gruppen gelangt man zu Imid-, Hydroxam-,
Thiosäuren etc. Die niederen aliphat. C. (bis ca. C10) sind bei Raumtemp. fast alle flüssig, die höheren ebenso
wie die aromat. fest. Alle C. haben sehr hohe Sdp., was auf die Neigung zur Assoziation zurückzuführen ist. Bis
etwa C8 sind die C. wasserlöslich. Im allg. sind die C. schwächere Säuren als die gängigen anorg. Säuren,
obwohl z.B. halogenierte C. weitgehend dissoziiert sind. Mit Basen bilden die C. feste Salze u. mit Alkoholen
Ester. Findet die Veresterung innerhalb desselben Moleküls (Hydroxy-C.) statt, so entstehen die Lactone. Die
Einwirkung wasserentziehender Mittel auf C. führt zur Bldg. von Säureanhydriden. Mit Ammoniak bilden die C.
Amide, mit Aminen die entsprechenden N-Alkylamide u. mit Amino-Gruppen innerhalb desselben Moleküls
(Amino-C.) Lactame. Thermisch erweisen sich viele C. als labil; sie verlieren beim Erhitzen, ggf. in Ggw. von
Katalysatoren, Kohlendioxid:
R–COOH Ù R–H + CO2 (Decarboxylierung).
Mit Reduktionsmitteln reagieren viele C. unter Bldg. der Alkohole. Wegen der Reaktionsfreudigkeit der
Carboxy-Gruppe ist es oft nötig, Schutzgruppen einzuführen, wenn an anderer Stelle des C.-Mol. Reaktionen
durchgeführt werden sollen.
Vork.: In der Natur kommen veresterte C. in Ölen, Fetten u. Wachsen vor, ferner in natürlichen Aromen u.
Harzen. In freier Form treten die niederen aliphat. C. u. einige aromat. C. als Bestandteile von Pflanzensäften,
Schweiß u.a. Tiersekreten in Erscheinung. Die bemerkenswerte Bevorzugung der aliphat. C. mit geradzahliger
C-Zahl in der Natur ergibt sich aus dem Aufbaumechanismus über Acetyl-CoA. Umgekehrt unterliegen
geradzahlige C. leichter dem biologischen Abbau als ungeradzahlige u. verzweigte.
Nachw.: Durch die Herst. von krist. Deriv. wie Aniliden, Aminen, Phenacylestern usw., durch Überführung in
Hydroxamsäuren, die mit FeCl3 eine charakterist. Färbung geben.
Herst.: Durch Oxidation von Alkoholen od. Aldehyden, durch Hydrolyse der Nitrile, durch Oxidation, z.B. mit
Luft in Ggw. von Katalysatoren, von Alkylbenzolen zu aromat. C. u. durch Hydrierung derselben zu alicycl.
Carbonsäuren. Während in diesen Verfahren, die auch techn. Verw. finden, die C. die gleiche Anzahl C-Atome
enthalten wie das Ausgangsmaterial, gibt es eine große Anzahl von meist in Einzelstichwörtern behandelten sog.
Aufbaureaktionen, mit deren Hilfe sich C. mit höherer C-Zahl aus Rohstoffen mit niedrigerer synthetisieren
lassen. Zur Techn. Herst. einzelner C. sind meist Spezialverfahren entwickelt worden, wozu auch die oxidative
Spaltung höhermol. Olefine bzw. ungesätt. Fettsäuren zu rechnen ist u. die katalysierte Luft od. SauerstoffOxidation von Petrochemikalien. Ein großer Prozentsatz techn. C. wird auch auf dem Gärungswege gewonnen.
Ester
Von Gmelin (1850) aus Essigäther gebildete Bez. für eine wichtige Gruppe von Carbonsäure-Deriv. Entspr. den
Benennungen bei anorg. Salzen erhalten die E. die Endung ...at, od. man reiht an den Namen der Säure den
Alkyl- od. Aryl-Rest des Alkohols u. setzt das Wort E. an den Schluß (Essigsäureethylester statt Ethylacetat).
Formel: R1 – C(=O) – O – C – R2
Wegen der Vielfalt der Säure- od. Alkohol-Komponenten ist die E.-Gruppe sehr variantenreich; in der Natur ist
sie in Form der Fette u. fetten Öle, Wachse, Lecithine, Phosphatide u. Riechstoffe von Früchten u. Blüten
(Aromen) sehr häufig anzutreffen. Die E. von niedermol. Komponenten sind flüssig, die der höhermol. fest.
Herst.: Die wichtigste Herst.-Meth. für E. ist die durch Säuren katalysierte Umsetzung von Carbonsäuren mit
Alkoholen. Diese sog. Veresterung
ist eine typische Gleichgewichtsreaktion, die durch das
Massenwirkungsgesetz bestimmt wird. Die Veresterung profitiert von einem Alkohol-Überschuß od. von einem
kontinuierlichen Entfernen des gebildeten Wassers, das beispielsweise durch azeotrope Destillation erfolgen
kann. Der Mechanismus der Veresterung wird durch säurekatalysierte Additions-Eliminierungs-Schritte mit
tetraedrischer Zwischenstufe beschrieben. Nicht alle Carbonsäuren lassen sich nach diesem Mechanismus
verestern, insbesondere wenn sterische Hinderung vorliegt. In diesen Fällen hat sich das Eintragen der Säure in
konz. Schwefelsäure (Bildung eines Acyl-Kations R-CO+) mit nachfolgender Zugabe zu dem gewünschten
Alkohol bewährt. Neben den E. der Carbonsäuren gibt es auch E., die sich von anorg. Säuren ableiten. Bekannte
Vertreter sind Schwefelsäuredialkylester, Glycerintrinitrat, Salpetrigsäureester. Mehrwertige Alkohole können
an sämtlichen Hydroxy-Gruppen verestert sein, wobei auch unterschiedliche Säure-Reste vorhanden sein dürfen.
Zu nennen sind hier die natürlich vorkommenden Fette, Öle, Wachse u. Phospholipide, die den dreiwertigen
Alkohol Glycerin als Alkohol-Komponente enthalten (Triglyceride, Phosphoglyceride).
Reakt.: E. finden vielfache Verw. in der org. Synthese. Die Umkehrung der Veresterung ist die Hydrolyse der E.
in Carbonsäure u. Alkohol. Die säurekatalysierte Hydrolyse ist wie die Veresterung selbst eine
Gleichgewichtsreaktion, während die alkalische Hydrolyse (Verseifung) infolge der Bildung des reaktionsträgen
Carboxylat-Anions praktisch irreversibel verläuft.
Verw.: In der Analytik dienen E. zum Nachw. von Alkoholen u. als leichter handhabbare Deriv. ansonsten
empfindlicher Stoffe. Techn. wichtige E. sind u.a. die Fette, fetten Öle, Wachse, Cellulosenitrat, Celluloseacetat,
Glycerintrinitrat, Lecithine, Phosphatide, Trikresylphosphat, Phosphor- u. Thiophosphorsäureester als
Insektizide, Alkydharze für Lacke, Polyester für Esterharze u. Chemiefasern. Viele Pharmawirkstoffe liegen als
E. vor , u. E. spielen infolge ihres Wohlgeruchs in der Parfümerie eine wichtige Rolle. Niedermol. E. werden als
Lsgm. z.B. in der Anstrichmittelind. u. als Weichmacher gebraucht, einige anorg. auch als Alkylierungsmittel.
Amine
Man kann die A. als Substitutionsprod. des Ammoniaks durch Alkyl- od. Aryl-Reste auffassen; je nachdem, ob
1, 2 od. alle 3H-Atome des NH3 durch solche Reste R ersetzt sind, liegen Mono-, Di- od. Trialkylamine bzw. die
entsprechenden aromat. A. vor. Zugleich sind diese Verb. Vertreter für prim., sek. u. tert. A.. Durch
Quaternisierung entstehen quartäre Ammonium-Verbindungen. Auch von alicycl. Verb. leiten sich A. ab, u.
selbstverständlich existieren auch gemischt aliphat.-aromat. A. Andererseits können aliphat. bzw. aromat. Verb.
auch mehrere Amino-Gruppen enthalten. In Analogie zur Keton-Enol-Tautomerie können Imine in Form von
Enaminen vorliegen, u. auch Inamine sind bekannt. Amidine u. Aminale lassen sich ebenfalls als A. auffassen,
während man Amide nicht zu den A. rechnet. Die Namen der A. werden, soweit nicht Trivialnamen wie Anilin
etc. zugelassen sind, entweder durch Anhängen des Suffixes ...amin an den Namen des KohlenwasserstoffRadikals gebildet od. durch Vorsetzen des Präfixes Amino... Die Radikale des Typs NR1R2 werden Aminyle
genannt .
Reakt.: Alle A. reagieren als Basen, wobei die Alkylamine stärker bas. sind als die aromat. A. (Aniline).
Aufgrund der nucleophilen Eigenschaften lassen sich A. leicht alkylieren od. acylieren. Die Oxidation der A.
liefert je nach Art des A. verschiedene Produkte. Die prim. aliphat. A. sind im Normalzustand Gase (C1–C2),
Flüssigkeiten (C3–C11) bzw. Festkörper; mit steigender Molmasse ändert sich ihr Geruch von Ammoniak-artig
über fischartig bis zur Geruchlosigkeit. Außer Di- u. Trimethylamin sind die niedrigen sek. u. tert. A. flüssig, die
höheren fest. Aromat. A. sind hochsiedende, viskose Flüssigkeiten od. Festkörper. Die Löslichkeit der aliphat. A.
in Wasser nimmt mit steigender Molmasse u. Substitutionsgrad ab u. auch die der aromat. A. ist gering; dagegen
sind alle A. in org. Lsgm. gut löslich.
Vork.: Unsubstituierte A., die im Organismus im allg. als Decarboxylierungsprod. aus Aminosäuren hervorgehen
(Biogene Amine), spielen als Hormone u. in der Neurochemie ebenso wie N-alkylierte A. eine große Rolle.
Diese A. werden je nach Konstitution oft als Monoamine od. als Catecholamine zusammengefaßt. Das Fehlen
od. die Hemmung eines spezif. Enzyms, der Monoaminoxidase, hat eine das ZNS aktivierende Wirkung. Als
Stimulantien dienen die Amphetamine u.a. Weckamine. Auch andere Nervensubstanzen enthalten A. Die
Entfernung der NH2-Gruppe auf enzymat. Wege kann als reduktive od. oxidative Desaminierung erfolgen.
Wegen ihrer ausgeprägten pharmakolog. Wirkung finden sich unter den Arzneimitteln viele A. Andererseits
können sich – auch im Organismus – aus manchen A. mit Nitriten od. salpetriger Säure die Nitrosamine bilden,
von denen viele als Carcinogene bekannt sind.
Nachw.: Prim. A. reagieren mit HNO2 zu N2, Alkoholen u. H2O, sek. zu gefärbten Nitrosaminen, tert. gar nicht,
u. aromat., prim. A. bilden Diazonium-Salze. Ein Nachweis für prim. A. ist die Bildung von Isocyaniden.
Herst.: Aliphat. A. lassen sich durch Umsetzung von Alkylhalogeniden od. Alkoholen mit NH3 (Ammonolyse),
durch sog. reduktive Aminierung von Ketonen od. Aldehyden, durch Aminoalkylierung etc. od. Katalysatoren
herstellen.
Verw.: Aliphat. A. (insbes. Fettamine) dienen als Ausgangsmaterialien für die Herst. von Lsgm., Textil- u.
Flotationshilfsmitteln, Invertseifen, Tensiden, Bakteriziden, Korrosionsinhibitoren, Antischaummitteln,
Additiven u. Pharmazeutika, die aromat. A. darüber hinaus vorwiegend zur Herst. von Farbstoffen, insbes. AzoFarbstoffen. In jüngerer Zeit gewinnen Polyamine, auch makrocycl., an Interesse wegen ihrer chelatisierenden
Eigenschaften, die sie als Co-Katalysatoren geeignet erscheinen lassen .
Imine
1.
2.
3.
4.
Eine Gruppe von leicht hydrolysierenden org. Verb., in denen formal das Sauerstoff-Atom von CarbonylVerb. durch die
Imino-Gruppe (NH)
ersetzt ist u. in denen analog der Keto-Enol-Tautomerie eine Imin-Enamin-Tautomerie möglich ist, wobei
das Gleichgew. in der Regel auf der Imin-Seite liegt. Bei den I. sind in vielen Fällen Stereoisomere zu
erwarten. Bei der Oxid. entstehen oft Oxaziridine. Ersetzt man in Sulfoxiden bzw. Sulfonen formal den
Sauerstoff durch die Imino-Gruppe, so erhält man analoge Sulfimide bzw. Sulfoximide.
Nach IUPAC-Regel werden die Azomethine als substituierte I. aufgefaßt. Die Bez. Iminium-, Imonium- od.
Immonium-Salz für Imin-Strukturen mit pos. geladenem Stickstoff ist nach IUPAC nicht zulässig. Solche
Salze müssen als Onium-Verb. benannt werden.
Ebenfalls Bez. für org. Verb., in denen die Atom-Gruppierung –NH– (Imido...) ident. Molekülteile mit
Benennungspriorität verbindet.
Früher bezeichnete man als Alkylenimine ringförmige Verb. mit der NH-Gruppe als Ringglied; die
systemat. Benennung sollte jedoch nach den IUPAC-Regeln für heterocycl. Verb. vorgenommen werden.
Nitrile
Bez. für org. Verb., die sich als Deriv. der Blausäure auffassen lassen, d.h. als org. Cyanide. Weil sich aus den N.
durch Hydrolyse Carbonsäuren herstellen lassen, werden die N. auch als Säurenitrile bezeichnet. Für die
systemat. Benennung der N. existieren verschiedene Möglichkeiten:
1. Durch Anhängen der Endung „...nitril“ an den Namen des Stammkohlenwasserstoffes;
2. Bei Verwandtschaft zu Säuren mit zulässigem Trivialnamen durch Auswechseln von „...(oe)säure“ gegen
„...(o)nitril“;
3. Bei Ableitung von Carbonsäuren, die mit „...carbonsäure“ zu benennen sind, durch Austausch dieses Suffix
gegen „...carbonitril“;
4. Veraltet ist die Formulierung als Cyanid, d.h. als Blausäureester des entsprechenden Alkohols;
5. Durch Voransetzen des Präfixes „Cyan(o)...“, falls in der Verb. bereits Substituenten mit einer höheren
Priorität vorhanden sind.
Die einfachen aliphat. u. aromat. N. bis ca. C12 sind farblose, angenehm riechende Flüssigkeiten, die allerdings
in der Regel ziemlich tox. sind. Mit Ausnahme der einfachsten Vertreter sind die N. in Wasser wenig od. gar
nicht, in org. Lsgm. dagegen gut löslich u. stark assoziiert. Einige N. wurden im interstellaren Raum
nachgewiesen.
Herst.: Die Alkylierung von Cyaniden, die Dehydratisierung von Carbonsäureamiden u.a. Carbonsäure-Deriv.
sowie die von Aldoximen sind die wichtigsten Labormethoden.
Verw.: In Umkehrung ihrer Bldg. gehen N. beim Erhitzen mit Basen od. Säuren in Carbonsäuren mit der
gleichen Anzahl C-Atome über, was zur präparativen Synth. von Carbonsäuren ausgenutzt werden kann. N.
lassen sich zu Aminen reduzieren u. sind in Analogie zur Aldol-Addition zu Dimerisierungen u. Cyclisierungen
fähig.
Halogenkohlenwasserstoffe
Sammelbez. für Kohlenwasserstoffe, bei denen H-Atome durch Halogene ersetzt sind.
Wenn alle Wasserstoff-Atome durch Halogene ersetzt sind, spricht man von perhalogenierten
Kohlenwasserstoffen od. Halogenkohlenstoffen. Die meist flüssigen bis festen H. werden durch Halogenierung
od. durch Austausch anderer Gruppen gegen Halogen hergestellt. Die auch als Halogenide aufzufassenden H.
sind nützliche Zwischenprod. für org. Synth., für nucleophile Substitutionen, für Eliminierungen
(Dehydrohalogenierung), für elektrophile Substitutionen.
Außerdem finden sie Verw. als
- Lsgm.,
- Anästhetika,
- Feuerlösch-,
- Kälte- Treibmittel usw.
Einige der flüchtigen H. werden gelegentlich als Schnüffelstoffe mißbraucht , andere – bes. die
Chlorfluorkohlenstoffe, die im allg. Sprachgebrauch als FCKW's abgekürzt werden – sind in letzter Zeit wegen
möglicher Umwelt-Belastung – insbes. wegen schädlicher Einflüsse auf die Ozon-Schicht der Atmosphäre – in
Mißkredit gekommen. Das Auftreten von H. in der Umwelt ist aufgrund der zahlreichen Verw. prakt. ubiquitär.
Bes. bei der industriellen Anw. treten abhängig vom Verarbeitungsprozeß u. dem Alter der Produktionsanlagen
mehr od. minder große Stoffverluste über das Abwasser u. die Luft auf, wodurch es häufig zu
Grundwasserschäden kommt. Zu deren Sanierung sind recht aufwendige Verf. nötig.
Analytik: Die analyt. Best. der leichtflüchtigen H. erfolgt nach flüssig/flüssig Extraktion mittels
Gaschromatographie. Neben den leichtflüchtigen H. zählen auch die chlorierten Paraffine, die chlorierten
Aromaten, von denen die polychlorierten Biphenyle (PCB) zu den bekanntesten gehören, u. eine Reihe weiterer
Chlor-org. Stoffe zu den H. Bei den PCB handelt es sich um eine Vielzahl tox. , persistenter u. ubiquitär
verbreiteter Verb. (z.B. in Altöl, Trafoöl), die aufgrund ihrer Fettlöslichkeit vermehrt im Körpergewebe u. sogar
in Frauenmilch zu finden sind .
Planck
Max Karl Ernst Ludwig (1858–1947), Prof. für Physik in Kiel u. Berlin, Präsident der Kaiser-Wilhelm-Ges.
1930–1937. Arbeitsgebiete: 2. Hauptsatz, Strahlungsvorgänge, Temp.-Strahlung des schwarzen Körpers,
Nernstsches Wärmetheorem, Postulat der Energiequantelung u. damit Begründung der Quantentheorie (1900),
wofür er 1918 den Nobelpreis für Physik erhielt.
Plancksches Wirkungsquantum
Eine nach Planck benannte Naturkonstante mit der Dimension einer Wirkung (Energie·Zeit). Die Energie E von
Lichtquanten (Photonen) ist bei den verschiedenen Arten von Strahlungen proportional der Frequenz n der
jeweiligen Strahlung, d.h. es gilt
E=hn
Der Proportionalitätsfaktor h wird als das Plancksche Wirkungsquantum od. Elementarquantum bezeichnet u. zu
den sog. Grundkonstanten gerechnet. Das P. W. hat den Wert
h=6,6260755·10–34 J·s
Cyclische Verbindungen
(griech.: kyklos = Kreis)
Sammelbez. für chem. Verb., in denen einige od. alle der mehr als einwertigen Atome zu Ringstrukturen
angeordnet sind. Obwohl es auch anorg. c.V. gib, verbindet man doch mit dem Begriff der c.V. meist die
Vorstellung von ringförmigen org. Verb. Je nachdem, ob die Ringe aus Atomen des gleichen od. von mindestens
zwei verschiedenen Elementen bestehen, unterscheidet man iso- od. homocyclische – in der org. Chemie insbes.
carbocyclische – u. heterocyclische Verbindungen. Zu den c.V. gehören als wirtschaftlich bedeutendste Gruppe
die aromatischen Verbindungen. Die Aromaten können carbocycl. od. heterocycl. Struktur sein, u. sie können
ein- od. mehrkernig vorliegen; in letzterem Fall spricht man von kondensierten Ringsystemen od. polycycl.
Ringsystemen. Eine noch größere Vielfalt des Molekülbaus trifft man bei den partiell ungesätt. u. bei den gesätt.
c.V. an, die auch alicyclische Verbindungen, Alicyclen od. Cycloaliphaten genannt werden. Untergruppen dieser
in der Natur sehr weit verbreiteten Verbindungsklasse sind die Cycloalkane (Cyclane) od. Cycloparaffine,
Cycloalkene od. Cycloolefine, auch Cyclodiene usw., Cycloalkine, Spiro-Verbindungen, Brücken- u.
Käfigverbindungen. Da zu den c.V. so verschiedenartige Verb. gehören, ist keine allg. Reaktionsweise dieser
Ringverb. zu erwarten. Soweit die Ringsyst. nicht durch evtl. natürliches Vork. vorgegeben sind, entstehen c.V.
aus acycl. Ausgangsstoffen durch Cyclisierung, Cycloaddition, Cyclodimerisation od. Cyclooligomerisation. Zu
diesen Ringschlußreaktionen treten als weitere Bildungsweisen noch Ringerweiterungs- u. verengerungsreaktionen hinzu. Die cycl. Struktur bringt es mit sich, daß c.V. über bes. Formen der
Stereoisomerie verfügen.
Cycloalkane
(Cycloparaffine)
Gruppenbez. für gesätt. cycl. Kohlenwasserstoffe, die ausschließlich Kohlenstoff-Atome im Ring enthalten; die
allg. Bruttoformel der monocycl. C. ist CnH2n
Sie können als Untergruppe der alicyclischen Verbindungen (cycloaliphat. Verb.) aufgefaßt werden. Die Namen
der C. leiten sich von denen der Alkane mit gleicher C-Zahl durch Voransetzen des Präfixes Cyclo... ab;
bekannte Vertreter sind Cyclopropan, -butan, -pentan, -hexan usw. sowie deren Alkyl-Substitutionsprodukte.
Aufgrund ihrer nicht ganz einheitlichen Reaktionsweisen kann man die C. in Gruppen verschiedener Ringgröße
einteilen. Aufgrund des Valenzwinkels zwischen den einzelnen Kohlenstoff-Atomen sind die C. nicht eben
gebaut. Unter Normalbedingungen sind die C. von C3 u. C4 Gase, die von C5 bis etwa C10 Flüssigkeiten, u. die
höheren C. sind Festkörper. Chem. sind die C. ziemlich reaktionsträge, weshalb sie als Lsgm. Verw. finden
können. In der Natur kommen lediglich Cyclopentan, -hexan u. -heptan im Erdöl vor; wegen dieser Herkunft
werden die C. gelegentlich auch als Naphthene bezeichnet, wenn auch diese unpräzise Bez. wohl meist nur auf
die Deriv. des Cyclopentans u. -hexans angewendet wird. Aus Alkanen entstandene C. werden als
Zwischenprod. beim Reformieren diskutiert. Alkyl-substituierte C. kommen ferner in ether. Ölen (Terpene) vor.
Zur Herst. der C. geht man entweder von ungesätt. cycl. Verb. aus (Cycloalkene, aromat. Verb.), die man
hydriert, von Alkanen, die man der Dehydrocyclisierung unterwirft, od. man reduziert die durch Cyclisierung
zugänglichen cycl. Ketone bis zur Kohlenwasserstoff-Stufe.
Konformation Cylohexan: seat – boat – twistboat
Æ Substituenten bevorzugen im Cyclohexan äquatoriale Gruppen
Spiro-Verbindungen
Von v. Baeyer 1900 geprägte u. von Spiro... abgeleitete Bez. für Verb. „brezelartiger“ Struktur, in denen 1
Kohlenstoff-Atom (Spiroatom) zwei Ringen gemeinsam angehört. Die Namen der S. werden nach den IUPACRegeln durch Voransetzen des Präfixes Spiro... vor den Namen des acycl. Kohlenwasserstoffs mit gleicher CZahl gebildet, wobei die durch eckige Klammern eingeschlossenen u. durch Punkt getrennten Ziffern die Zahl
der jeweiligen Ringglieder mit Ausnahme des zentralen Spiroatoms angeben. Die Bezifferung beginnt im
kleineren Ring an dem dem Spiroatom benachbarten C-Atom. Nach den gleichen Prinzipien werden auch S. mit
Heteroatomen benannt. Die Vorsilbe Spiro... ist ein bei alphabet. Sortierung zu berücksichtigender Bestandteil
des Stammnamens. Di-, Tri-, Tetraspiro-Verb. enthalten analog 2, 3 od. 4 Spiroatome. Dieses Verf. gilt für S.
mit monocycl. Partialgerüsten. Bei polycycl. Gerüsten behalten diese ihren Namen bei. Die zweidimensionale
Darst. der Formelbilder läßt die bes. Stereochemie der S. nicht erkennen; prinzipiell stehen die Ringe wegen der
sp3-Hybridisierung des zentralen Spiroatoms senkrecht aufeinander. Der Aufbau der S. bedingt zusätzliche
Isomeriemöglichkeiten (Dissymmetrie), die sich ggf. auch im Auftreten optischer Aktivität äußern können. Für
S. wird oft eine sog. Spirokonjugation diskutiert. Als polycycl. S. lassen sich die Rotane auffassen, u.
Orthocarbonate wie z.B. Ethylenorthocarbonat kann man als Tetraoxa-S. ansehen. In der Natur treten SpiroStrukturen auf bei Terpenen, Sesquiterpenen, Alkaloiden, Steroiden, Antibiotika usw. Synthet. sind S. durch eine
Vielzahl von Reaktionen zugänglich. Auch photochem. od. Metall-org. katalysierte Cycloadditionen können zu
S. führen, die Acetalisierung von Ketonen auch zu S. mit 1,3-Dioxolan-Struktur. Weitere S. leiten sich von
Pentaerythrit durch Kondensation mit Ketonen ab; aus 1,4-Cyclohexandionen sind auf diese Weise auch
polymere S. zugänglich. Manche heterocycl. S. (Spiropyrane) sind wegen ihrer Photochromie auch auf Eignung
für reprograph. Syst. untersucht worden.
Carbokationen
Bez. für positiv geladene organische Spezies, die im allg. nur als reaktive Zwischenstufen bei chem. Reaktionen
auftreten. In Ausnahmefällen, insbes. wenn Heteroelemente die positive Ladung stabilisieren od. wenn sie Teil
eines aromatischen Ringsystems ist, können mehr od. weniger stabile Salze der C. isoliert werden. Man
unterscheidet zwei Untergruppen der C.: die Carbenium-Ionen u. die Carbonium-Ionen.
Geschichtl.: Die salzartigen Eigenschaften von Triphenylmethylchlorid in Lösung ließen Baeyer, Gomberg,
Walden u.a. die Existenz einer Zwischenstufe logisch erscheinen, der sie kationische Eigenschaften zuschrieben
u. die sie Carbonium-Ion nannten. Der Name wurde später in Carbenium-Ion umgewandelt, der logischer ist, da
die Endung ...onium solchen Spezies vorbehalten sein soll, die durch Anlagerung einer positiven Ladung an ein
gesättigtes Atom gebildet werden. Bis ca. 1970 findet man – bes. in der angloamerikanischen Lit. die Bez.
Carbonium für Carbenium-Ionen. Die heutige rationale Einteilung geht auf die fundamentalen Arbeiten von
Olah zurück, der die Namen Carbokation, Carbenium-Ion u. Carbonium-Ion neu definiert hat. Die Umlagerung
von Camphen in Isobornylchlorid machte für Meerwein die Existenz von Carbenium-Ionen wahrscheinlich. Sir
C. Ingold u. Hughes entwickelten das Konzept der nucleophilen Substitution, die im Falle der sog. SN-Reaktion
über Carbenium-Ionen verläuft. Kinetische u. stereochemische Kriterien wurden entwickelt, um die Beteiligung
von C. an chem. Reaktionen sicherzustellen. Das Konzept des „nicht klassischen“ C. wurde von Winstein
entwickelt, um zu erklären, weshalb Nachbargruppen die Heterolyse zu C. beschleunigen. Die Erzeugung von C.
bei tiefen Temp. in supersaurem Medium od. in der Gasphase läßt direkte Beobachtung zu, so z.B. mit Hilfe der
NMR-Spektroskopie der Massenspektroskopie u. ESCA-Methode u. macht auch das Auftreten von CarboniumIonen plausibel.
Strukt.: Carbenium-Ionen besitzen einen dreibindigen Kohlenstoff, der die positive Ladung trägt u. der nur 6
Valenzelektronen besitzt. In Abwesenheit sterisch sperriger Gruppen ist der Carbenium-Kohlenstoff sp2
hybridisiert u. die drei Bindungen zu den Substituenten sind coplanar. Die positive Ladung wird in dem leeren
2p-Orbital lokalisiert, das senkrecht auf der von den 3 sp2-Hybridorbitalen aufgespannten Ebene steht. Im
Gegensatz dazu sind Carbonium-Ionen Deriv. des fünfbindigen Kohlenstoffs, die CS-Symmetrie besitzen. Diese
Spezies sind anders als Carbenium-Ionen Elektronenmangel-Verbindungen, da sie eine ungenügende Anzahl an
Valenzelektronen zur vollständigen Ausbildung von Elektronenpaar-Bindungen besitzen. Die Beteiligung einer
Zweielektronen-Dreizentrenbindung zur Beschreibung der Struktur ist deshalb notwendig; solche
Bindungsverhältnisse finden sich auch bei den Borhydriden u. die Analogie im Reaktionsverhalten zwischen
Carbonium-Ionen u. Bor-organischen Verbindungen ist bemerkenswert. Das 2-Norbornyl-Kation kann als ein
Paar schnell äquilibrierender Carbenium-Ionen od. als ein einziges Carbonium-Ion beschrieben werden, womit
der Begriff „verbrücktes“ od. „nicht klassisches“ Carbenium-Ion verbunden ist.
Bez. für die Erscheinung, daß bei manchen org. Reaktionen, z.B. Substitutions- od. Umlagerungs-Reaktionen,
eine dem Reaktionszentrum benachbarte Gruppe einen beschleunigenden od. verzögernden Einfluß auf die
Geschw. der Reaktion u. auf die Stereochemie (Konfigurationserhalt od. Konfigurationsumkehr an einem
asymmetr. Zentrum) ausübt. Wie bei anchimere Hilfe dargelegt kann der N.-E. nicht nur von Atomen mit freien
Elektronenpaaren (N-, O- u. S-Atome), sondern auch von C,C-Doppel- u. C,C-Einfachbindungen ausgehen,
wodurch nichtklass. Strukturen als Zwischenstufen solcher Reaktionen diskutiert werden; s. anchimere
(synartetische) Hilfe, Carbokationen u. Nichtklassische Ionen. Man kann die N.-E. als Beisp. für
Proximitätseffekte – zu denen man im allg. auch transannulare u. Throughspace- od. Through bondWechselwirkungen rechnet – auffassen.
Nucleophile Substitution
Bez. für eine nucleophile Reaktion, bei der das angreifende Teilchen (das Nucleophil Y) unter Einbeziehung
eines Elektronenpaars eine neue Bindung zu einem Substrat knüpft, wobei ein anderes Teilchen (das Nucleofug)
mit einem Elektronenpaar das Substrat verläßt. In allen Fällen muß Y – neg. geladen od. neutral – eine LewisBase sein. Ist das Nucleophil auch gleichzeitig Lsgm., so spricht man von Solvolyse. Die bei weitem wichtigste
n. S. ist die an aliphat. C-Atomen, während solche an aromat. C-Atomen geringere Bedeutung besitzen. Mehrere
Mechanismen werden für die n. S. diskutiert, die in Abhängigkeit von Nucleophil, Nucleofug, Substrat u.
Reaktionsbedingungen ablaufen können; die bei weitem wichtigsten sind der SN1- u. der SN2-Mechanismus.
Beim SN1-Mechanismus (unimol. nucleophile Substitution) werden zwei Reaktionsschritte – nämlich die
Ionisation des Substrates in ein Carbenium-Ion u. das Nucleofug als reaktionsbestimmender Schritt sowie die
schnelle Reaktion zwischen dem Carbenium-Ion u. dem Nucleophil – angenommen; bei opt. akt. Verb. erfolgt
Racemisierung, da das als Zwischenstufe durchlaufende Carbenium-Ion durch das Nucleophil von zwei Seiten
angegriffen werden kann. Bei einer n. S. nach dem SN2-Mechanismus (bimol. nucleophile Substitution) greift
das Nucleophil von der Rückseite zum austretenden Nucleofug das Substrat an, wobei die neue u. die alte
Bindung des Substrates zum Nucleophil bzw. Nucleofug gleichzeitig gebildet bzw. gebrochen wird; bei opt. akt.
Verb. erfolgt Konfigurationsumkehr. Allg. kann man sagen, daß n. S. nach dem SN1-Mechanismus bevorzugt an
tert.-C-Atomen, solche nach SN2 bevorzugt an prim.-C-Atomen ablaufen. N. S. an aromat. C-Atomen sind auf
aromat. Verb. beschränkt, die durch elektronenziehende Gruppen desaktiviert sind, z.B. Nitroaromaten,
Elektronenmangel-Heterocyclen wie Pyridin.
Induktiver Effekt
(I.-Effekt)
Bes. von G. N. Lewis u. Sir C. Ingold erarbeitetes Konzept, das die Einflüsse zu erfassen sucht, die elektropos.
od. -neg. Substituenten in org. Mol. auf die Reaktivität ausüben. Der i.E. kommt durch über s-Bindungen
übertragene Polarisation des restlichen Mol. durch die Substituenten zustande. Angaben über die Stärke des i.E.
erhält man aus Dipolmomenten. Man bezieht im allg. alle i.E. auf Wasserstoff als Standard-Substituenten.
Atome od. Atomgruppen, die stärker elektronenanziehend sind als H, zeigen einen –I-Effekt,
elektronenschiebende Substituenten einen +I-Effekt. Bes. ausgeprägt ist der i. E. bei elektro- bzw. nucleophilen
Substitutionen von aromat. Verb., wo er mit dem Resonanz- (od. Mesomerie-)Effekt konkurriert. Wird letzterer
durch das p-Elektronensyst. fortgeleitet, so ersterer durch s-Bindungen od. durch den Raum (engl.: through
space). Seine Stärke nimmt mit wachsender Entfernung des Reaktionszentrums vom dirigierenden Substituenten
ab. Hingewiesen sei auch auf die Verwandtschaft des i. E. mit dem Ortho-Effekt u. den als Push-PullMechanismen, als Hyperkonjugation u. durch die Hammett-Gleichung beschriebenen Effekten.
H
N
H
N
N
Pyrazol
H
N
S
O
O
N
N
N
Imidazol
N
Oxazol
Isoxazol
(1,3-Oxazol) (1,2-Oxazol)
6-Ring-Heteroaromaten
N
N
N
N
Thiazol
N
1,2,3-Triazol
N
Pyridin
Chinolin
Isochinolin
Acridin
N
N
N
N
N
N
Pyridazin
(1,2-Azin)
N
N
N
N
H
9H-Purin
N
N
Pyrazin
(1,4-Azin)
Pyrimidin
(1,3-Azin)
N
Phenazin
N
N
N
Pteridin
+M/ -M-Effekt
Den dirigierenden Einfluß im Mol. bereits vorhandener funktioneller Gruppen bei Substitutions-Reaktionen
bezeichnet man als R.- od. Mesomerie-Effekt (R- od. M-Effekt), wenn er durch Delokalisierung der p- od. pElektronen des Substituenten über das p-Elektronensyst. im restlichen Mol. zustandekommt. Werden diesem
Elektronen geliehen, d.h. wird seine Elektronendichte erhöht, dann können elektrophile Reaktionen leichter
eintreten (+M- od. +R-Effekt); umgekehrt verhält es sich mit dem –M- od. –R-Effekt u. nucleophilen
Reaktionen. Ein +M- od. +R-Effekt liegt z.B. im Anilin vor, das leichter elektrophil zu substituieren ist als
Benzol.
+M-Effekt und Halogene: o-/ und p-Stellung
-M-Effekt: m-Stellung
Bromierung
Einführung von Brom in eine organische Verbindung durch Addition od. Substitution. Für die elektrophile B.
von C,C-Doppelbindungen werden Bromonium-Ionen als Zwischenstufen angenommen; Substitutionen
verlaufen häufig radikalisch.
Nitrierung
Unter N. versteht man im allg. die Einführung von Nitro-Gruppen in org. Verb., wobei im Falle der Substitution
an C-Atomen Nitro-Verbindungen entstehen. Die N. von Alkanen (Paraffinen) geschieht in der Regel in der
Gasphase bei Temp. um 400°, wobei ein Radikal-Kettenmechanismus angenommen wird. Die N. verläuft nicht
einheitlich, da Mono-, Di- u. Polynitrierung eintritt; z.T. erfolgt im beträchtlichen Ausmaß C,CBindungsspaltung. Für die präparative Chemie von großer Bedeutung ist die elektophile N. von aromat. Verb.,
zum einen, weil fast alle Aromaten mit einem geeigneten Nitrierungsreagenz nitriert werden können, u. zum
anderen, weil die aromat. Nitro-Gruppe leicht in andere funktionelle Gruppen umgewandelt werden kann. Das
einfachste Nitrierungsreagenz ist eine Mischung aus Salpeter- u. Schwefelsäure (Nitriersäure); empfindlichere
Aromaten, wie aromat. Amine od. Phenole werden jedoch besser mit Salpetersäure allein od. mit Salpetersäure
in Wasser, Essigsäure od. Acetanhydrid nitriert. Bei all diesen N. wird angenommen, daß das Nitronium-Ion
NO2+ das angreifende elektrophile Teilchen ist. Da eine einmal eingeführte Nitro-Gruppe desaktivierend auf
eine weitere Substitution wirkt, ist eine Mononitrierung leicht zu verwirklichen; unter verschärften Bedingungen
sind aber auch Mehrfachnitrierungen möglich, wobei die zweite Nitro-Gruppe in meta-Stellung zur ersten
eingeführt wird, da resultierende kation. Zwischenstufe (s-Komplex) im Falle der ortho- od. para-Substitution
durch das zwangsläufige Auftreten zweier benachbarter positiver Ladungen destabilisiert wird.
Sulfonierung
Bez. für die Umsetzung von Estern od. olefin. ungesätt. Stoffen mit Sulfiermitteln (Schwefelsäure, Oleum,
Chlorsulfonsäure, Amidosulfonsäure, Schwefeltrioxid, s.a. Sulfierung) unter Einführung der Sulfo-Gruppe
(SO3H) in das Molekül. So liefert die S. von Aromaten auf dem Wege einer nucleophilen Substitution
Arylsulfonate. Bei der S. von Fettsäureestern werden Prod. erhalten, die eine Sulfonat-Gruppe in a-Stellung zur
Carboxy-Funktion aufweisen. Im Gegensatz zur Sulfatierung werden auf dem Weg der S. Sulfonate mit einer C–
S-Bindung erhalten, die gegenüber dem Angriff von Säuren stabil ist.
Das Quecksilber-Herz
Geräte:
Uhrglas (10cm), evtl. Stativmaterial, evtl. Overheadprojektor und Leinwand
Chemikalien:
Quecksilber, verd. Schwefelsäure (ca. 14%ig), stark verd. Kaliumpermanganatlösung,
Eisennagel oder -draht
Vorbereitende Arbeiten: Auf ein Uhrglas bringt man einen Quecksilbertropfen von ca. 2 cm Durchmesser,
übergießt ihn mit verdünnter Schwefelsäure und fügt dann noch etwa 1 ml stark
verdünnte Permanganatlösung hinzu, so daß die Lösung hellrot gefärbt ist.
Durchführung: Man führt einen Eisenstift mit feiner Spitze vorsichtig an das Quecksilber heran, bis die Spitze
das Quecksilber eben berührt.
Ergebnis:
Der Quecksilbertropfen gerät in zuckende Bewegung.
Hinweise:
a)
b)
Erläuterung:
um diesen Versuch einem größerem Zuschauerkreis zugänglich zu machen, kann man
ihn auf dem Overheadprojektor durchführen. Der Quecksilbertropfen erscheint dann auf
der Leinwand als schwarze, zuckende Scheibe.
Da evtl. beim Zuschauer der Eindruck entstehen könnte, die zuckende Bewegung würde
durch geschicktes Anstoßen des Tropfens zustande kommen, hält man den Eisenstift
nicht mit der Hand fest, sondern spannt ihn in ein Stativ ein und überläßt dann den
Versuch sich selbst.
„In dem Augenblick, in dem die Nadel das Quecksilber berührt entsteht ein galvanisches
Element Hg/H2SO4/Fe. Eisen als das unedlere Metall löst sich auf, ist also die Anode;
Quecksilber ist die Kathode. Permanganat ist das Oxidationsmittel, das reduziert wird. Die auf
dem Quecksilber adsorbierten Elektronen vermehren die Ladungsdichte auf der Oberfläche, die
Oberflächenspannung wächst. Infolgedessen krümmt sich die Oberfläche stärker ein (Abb. 1,
gestrichelt). Die Verbindung mit dem Eisen wird unterbrochen. Die Elektronen werden jetzt
vom Oxidationsmittel übernommen. Damit sinkt erneut die Oberflächenspannung, der Tropfen
flacht sich ab und berührt wiederum die Nadel, der Vorgang beginnt von neuern.“
Hinweise zum Arbeiten mit Quecksilber und Quecksilberverbindungen:
a)
Gesundheitsschädigende Wirkung. Quecksilber ist ein flüssiges, silberglänzendes, an der Luft
beständiges Metall. Bei gewöhnlicher Temperatur hat es einen Sättigungsdampfdruck von
0,0013 mm, weswegen eine mit Quecksilberdampf gesättigte Luft 15 mg Quecksilber pro m3
enthält. Da Quecksilberdampf sehr giftig ist, kann in einem schlecht gelüfteten Labor schon
verspritzten Quecksilber zu chronischer Quecksilbervergiftung führen. Ähnlich wie Quecksilber
sind auch die meisten seiner Verbindungen äußerst giftig. Die Vergiftungserscheinungen zeigen
sich folgendermaßen: Entzündung der Mundschleimhaut und des Zahnfleisches, brennender
Schmerz in Speiseröhre und Magen, blutiges Erbrechen und blutiger Durchfall, schwere
Nierenschädigung, Kopfschmerzen, Gedächtnisschwund, schwere Schädigung des
Nervensystems.
b)
Arbeiten mit Quecksilber und Quecksilberverbindungen
-
-
im Abzug arbeiten.
Quecksilbergefäß niemals offen stehen lassen; mit Quecksilber nur an glatten, mit erhöhtem
Rand versehen Tische arbeiten; nach Möglichkeit Quecksilberauffangwanne oder
Fotoschale als Arbeitsunterlage benutzen; nur in Räumen mit fugenlosem Fußboden
arbeiten.
verschüttetes Quecksilber sofort und restlos aufnehmen (große Tropfen mit der Quecksilberzange, kleine Tropfen mit einem Streifen Zinkblech oder mit Zinkstaub unter Amalgambildung aufnehmen).
-
-
Reste von Quecksilber und Quecksilberverbindungen nicht in Abfallgefäße oder Ausguß
geben; Sie sind zu sammeln und später zu vernichten.
mit Quecksilber und Quecksilberverbindungen in Berührung gekommene Geräte sind
zunächst mit einer Paste aus Zinkstaub und Wasser, dann mit konz. Salzsäure und evtl.
konz. Salpetersäure zu behandeln,
nach dem Experimentieren sind die Hände gründlich mit warmem Wasser, Seife und Bürste
zu reinigen.
Schaumstoffpilze
Geräte: Becherglas (1l), Polyäthylenbeutel, Holzstab, anstelle des Becherglases kann auch ein Trinkbecher aus
Kunststoff (Polystyrol) ohne Polyäthylenbeutel benutzt werden.
Chemikalien:
Desmophen-Aktivatorgemisch, Desmodur 44 V
Vorbereitende Arbeiten: Die Durchführung des Versuches in einem Glasgefäß ist nicht ratsam, da nach
Herausdrehen des erkalteten Pilzes Schaumstoffreste an den Wandungen des Gefäßes
kleben, die sehr schwer zu entfernen sind. Auf Grund dessen schützt man das Becherglas mit einem passenden Polyäthylenbeutel. Die beiden Chemikalien sind sirupartig.
Daher ist es nicht sinnvoll, Sie vor dem Zusammengießen in zwei getrennte Gefäße
abzuwiegen. Beim Zusammengießen bleibt nämlich sehr viel von den beiden
Substanzen an den Gefäßwänden haften, so daß man die angegebene Menge nicht
einhalten kann. Abgesehen davon entsteht ein unnötiger Verbrauch an Chemikalien.
Man behilft sich folgendermaßen: das Gefäß, in dem die Reaktion stattfinden soll,
stellt man auf eine entsprechende Waage. Nun gießt man aus den Vorratsflaschen
nacheinander die vorgeschriebenen Mengen ein. Wenn man auf diese Weise eine
Vorstellung gewonnen hat, welches Volumen die jeweils benötigte
Chemikalienmenge einnimmt, so läßt sich auch durch Abschätzen das richtige
Mischungsverhältnis finden. In das mit einem Polyäthylenbeutel geschützte
Becherglas gibt man zuerst 33 g Desmophen-Aktivatorgemisch und dann 50 g
Desmodur 44 V. Mit einem Holzstab rührt man die Mischung so lange, bis
Gasentwicklung feststellbar ist. Die nun anlaufende Reaktion überläßt man sich
selbst.
Ergebnis:
Aus der sirupartigen Mischung wächst langsam eine gelbe, das Becherglas auffüllende,
schaumartige Substanz nach oben, die nach einiger Zeit so fest wird, daß man Sie aus dem
Glas nehmen kann.
Hinweise:
a) Sollte Desmodur bzw. Desmophen auf die Haut gelangen, so ist die entsprechende Hautstelle
sofort unter fließendem Wasser intensiv zu spülen.
b) Man kann den Versuch auch mit entsprechend kleineren Mengen Desmophen und Desmodur
durchführen. Dabei ist darauf zu achten, daß man das Volumen des Reaktionsgefäßes klein
genug wählt, so daß ein Teil des entstehenden Schaumstoffes über den Rand des Gefäßes
fließen kann. Dadurch bekommt das Reaktionsprodukt ein pilzförmiges Aussehen.
Erläuterung:
Der entstandene Stoff gehört zu der großen Gruppe der Polyurethan-Kunststoffe. Diese
Kunststoffe entstehen durch Polyaddition von Di-oder Polyhydroxyverbindungen an Di- oder
Polyisocyanate. Ein Polyaddition ist dadurch gekennzeichnet, daß zwei funktionelle Gruppen
ohne Abspaltung eines Nebenproduktes, allerdings unter Wanderung von Wasserstoffatomen,
miteinander reagieren. Der Mechanismus der Polyurethan-Reaktion sieht folgendermaßen aus:
jenachdem welche Ausgangsstoffe man wählt, erhält man lineare oder vernetzte Polyurethane.
Die Schaumbildung wird durch Kohlendioxidentwicklung wirkt. Dieses Kohledioxid entsteht
infolge einer Reaktion des Isocyanates mit dem im Desmophen-Aktivatorgemisch
vorhandenen Wasser:
Kohle aus der Retorte
Geräte:
schmales, hohes Becherglas (11), große Kristallisierschale, Chemikalienflasche
Chemikalien:
Saccharose, konz. Schwefelsäure.
Vorbereitende Arbeiten: In die Chemikalienflasche gibt man 100 ml konz. Schwefelsäure. Das 1-Ltr.
Becherglas wird zu 1/4 mit Saccharose gefüllt, welche dann mit etwa 100 ml Wasser
zu einem Brei verrührt wird. Das Becherglas stellt man vorsichtshalber in eine große
Kristallisierschale.
Durchführung:
Die konz. Schwefelsäure wird in die Zuckerlösung gegossen.
Ergebnis:
Die Mischung färbt sich zunächst schwarz und bläht sich dann unter starker Gasentwicklung
derart auf, daß Sie zylinderförmig in dem Becherglas nach oben wächst und schließlich über
den Rand des Gefäßes quillt .
Hinweise:
a)
b)
Erläuterung:
C12H22011 →
Wegen der starken Gasentwicklung wird dieser Versuch unter dem Abzug
durchgeführt.
Auf Grund der großen Affinität von konz. Schwefelsäure zu Wasser ist ein
Vermischen der beiden Substanzen mit intensiver Wärmeentwicklung verbunden.
Man sollte daher das Reaktionsgefäß nicht anfassen und vor evtl. herausspritzender
Flüssigkeit achtgeben. (Schutzbrille)
Saccharose wird von konz. Schwefelsäure durch Wasserentzug zerstört:
12 C + 11 H20
Gleichzeitig wirkt die konz. Schwefelsäure auch oxidierend auf die organische Substanz, wobei Sie selbst zu
schwefeliger Säure reduziert wird, die dann in S02 und H20 zerfällt.
pH-Muskel
Geräte:
Standzylinder (4 cm, Höhe 40 cm)
Chemikalien:
pH-Muskel (Bezugsquelle-siehe Hinweise), konz. Salzsäure, konz. Natronlauge, dest. Wasser
Vorbereitende Arbeiten: Man füllt einen Standzylinder mit dest. Wasser und hängt den blau gefärbten
Folienstreifen (Länge mit Gewicht: 12cm) hinein. Der Streifen dehnt sich aus und hat
nach kurzer Zeit etwa die doppelte Länge angenommen .
Durchführung I: In den Standzylinder gibt man einige ml konz. Natronlauge.
Ergebnis I:
Der pH-Muskel dehnt sich um ca. 10 cm aus.
Durchführung II: in den Standzylinder gibt man einige ml konz. Salzsäure.
Ergebnis II:
Der pH-Muskel verkürzt sich um fast die Hälfte seiner Länge. Kontraktion und Dilatation des
Muskels läßt sich durch abwechselnde Lauge-und Säurezugabe mehrmals wiederholen.
Allerdings sind die Gestaltsänderungen dabei nicht mehr so ausgeprägt wie zu Anfang des
Versuches. Vermutlich wirkt die zunehmende Salzkonzentration (NaCI) hemmend.
Hinweis:
Man erhält den pH-Muskel, gebrauchsfertig mit angeklebtem Holzstäbchen und Gewicht
(Ring), bei folgender Bezugsquelle: Fa. R. Kind, 862 Lichtenfels, Postfach 1208.
Erläuterung:
Der pH-Muskel besteht aus einer quellbaren, jedoch in Wasser nicht löslichen
Polyvinylalkohol-Folie (PVAI-Folie), die Polyacrylsäure (PAS) enthält.
Der Effekt des Versuches beruht auf spezielle Eigenschaften der PAS:
In wässriger Lösung ist die als Molekülknäuel vorliegende Säure verhältnismäßig schwach
dissoziiert. Erst im alkalischen Bereich liegen praktisch alle Carboxylgruppen als -COO- vor,
die sich gegenseitig abstoßen und das Knäuel dadurch in eine gestreckte Form überführen:
Die lediglich als Stützsubstanz dienende PVAI-Folie folgt den Bewegungen der PAS (bzw.
deren ionisierter Form).
Kollagen-Muskel
Geräte: großes Bücherglas, 2 Tropftrichter, Abzweigstück (z. B. Stromschlüssel), Korkstopfen, schwarze
Pappe, Stativmaterial
Chemikalien:
Kollagenfaden (Bezugsquelle—siehe Hinweise), dest. Wasser, Lithiumchlorid bzw.
Lithiumbromid
Vorbereitende Arbeiten:
- Man legt den Kollagenfaden für ca. I Std. in dest. Wasser.
- 45 g LiCI werden in 100 ml Wasser gelöst (Vorsicht: sehr starke Erhitzung)
- Versuchsaufbau nach Abb. 3; den Kollagenfaden befestigt man mit Hilfe eines kurzen
Schlauches an dem Abzweigungsstück; als Gewicht nimmt man einen Korkstopfen (ca. 3 g);
um den Faden (Länge 1,20m) besser sichtbar zu machen, verwendet man als Hintergrund
schwarze Pappe; ein Tropfrichter wird mit konz. LiCI-Lsg. gefüllt, der andere mit dest.
Wasser.
Durchführung 1: Man läßt LiCI-Lsg. an dem Kotlagenfaden herabfließen.
Ergebnis 1:
Der 1,20 m lange Faden verkürzt sich um ca. 50—60 cm.
Durchführung 2: Man läßt Wasser an dem Faden herabfließen.
Ergebnis 2:
Der Faden wird wieder länger. Allerdings erreicht er nicht mehr seine ursprüngliche Länge,
sondern er wird nur noch ca. I m lang. Die Kontraktion und Entspannung des Fadens läßt sich
beliebig oft wiederholen.
Hinweise:
a)
Der Kollagenfaden für diesen Versuch wurde von der Firma Carl Freudenberg,
Weinheim/Bergstr. bezogen. Diese Firma stellt allerdings seit einiger Zeit diese
Fäden nicht mehr her. Da Nähfäden für Operationen meistens auch aus Kollagen
bestehen, läßt sich der vorliegende Versuch evtl. mit derartigen Fäden durchführen.
b)
Will man den Versuch mehrmals wiederholen, so benutzt man aus Kostengründen
zwei Auffanggefäße: eines für das Wasser und das andere für die LiCI-Lsg., die sich
mehrmals verwenden läßt.
Erläuterung:
Der Kollagenfaden besteht aus schraubenförmigen, parallel zur Längsachse angeordneten
Molekülen. (Helixstruktur). Taucht man einen solchen Faden in heißes Wasser, so zieht er sich
zusammen, da sich die relativ gestreckte Schraubenstruktur in ein ungeordnetes Knäuel
zusammenballt. Das Material ist von einem quasi kristallinen Zustand in den amorphen
übergegangen, ein Prozeß, der dem Schmelzvorgang entspricht.
Bekanntlich wird die Schmelztemperatur von Eis durch Salzzugabe erniedrigt. Ganz ähnlich
verhält sich der Kotlagenfaden gegenüber einer hinreichend konzentrierten Salzlösung: er
zieht sich schon bei Zimmertemperatur zusammen.
Pharaoschlange
Geräte:
Glasstab, Klebstoff
Chemikalien:
Quecksilber (Il)-rhodanid (Quecksilberthiorhodanat), Salpeter-papier
Vorbereitende Arbeiten:
a)
Herstellung von Salpeterpapier: 15 g Kaliumnitrat werden in 100
ml Wasser gelöst. Mit dieser Lösung tränkt man Filterpapier,
welches man anschließend gut trocknen läßt.
b)
Aus Salpeterpapier wird ein einseitig geschlossenes Röhrchen her
gestellt, (1 cm, Länge ca. 8 cm), welches mit Quecksilber (Il)rhodanid gefüllt wird. Mit einem Glasstab preßt man das weiße
Pulver in dem Röhrchen etwas zusammen.
Durchführung:
Das Röhrchen wird an dem offenen Ende angezündet.
Ergebnis:
Aus dem langsam verglimmenden Röhrchen kriecht unter Zischen eine lange, gelbe Schlange
hervor.
Hinweis:
Da beim Entzünden der Schlange giftige Quecksilberdämpfe entstehen, muß dieser Versuch
unter dem Abzug durchgeführt werden. Auch die entstandene Asche kann noch giftiges
Quecksilber enthalten (siehe auch "Hinweise zum Arbeiten mit Quecksilber und
Quecksilberverbindungen", Versuch 1).
Erläuterung:
Quecksilber (Il)-rhodanid zerfällt beim Erhitzen unter Hinterlassung einer zusammenhaltenden, volumenreichen Asche, die aus Stickstoff, Kohlenstoff und Schwefel besteht. Diese
Asche nimmt etwa das 25-50-fache Volumen der ursprünglichen Substanz ein. Das
Experiment sollte nur im Freien durchgeführt werden, da beim Zerfallprozeß auch
Quecksilberdampf entsteht.
Raaf schildert eine ungiftige Pharaoschlange. 2 Emser Bastillen wenden in Zigarettenasche gesteckt, die mit
Alkohol getränkt wurde. Beim Anzünden entquilltaus den Bastillen die "Schlange".
Chemischer Garten
Geräte: Küvette (500 ml), Präparateglas, verschließbare Flasche
Chemikalien: Kristalle von Kupfer(ll)-sulfat, Nickel(ll)-nitrat, Kobalt(ll)-nitrat, Eisen(ll)-sulfat, Eisen(ll)chlorid, Mangan(ll)-chlorid, Calciumnitrat, Magnesiumchlorid, Aluminiumsulfat, Bleinitrat und andzren
Erdalkali- und Schwermetallsalzen; Natronwasserglas, dest. Wasser
Vorbereitende Arbeiten:
a) Man mischt gewöhnliches Natronwasserglas mit der doppelten Menge dest.
Wasser und füllt 500 ml davon in eine verschließbare Flasche.b) in ein Präparateglas
gibt man einige erbsengroße Kristalle der oben ange-gebenen Salze.
Durchführung: in die mit Wasserglaslösung gefüllte Küvette schüttet man den Inhalt des Präparateglases, so daß
der Boden gleichmäßig mit den Kristal-len bedeckt ist.
Ergebnis: Nach kurzer Zeit wachsen aus den Kristallen moos-, algen-, tang-und pilzähnliche Gebilde in die
Wasserglaslösung hinein, und verwandeln die Lösung in eine "bunte, üppig blühende Vegetation".
Hinweise:
a) Man kann die "Pflanzen" auch trocken gewinnen, wenn man die Lösung vorsichtig absaugt.
b) Eisen(lll)-chlorid-Kristalle bilden dicke, braune, oft verzweigte und eingeschnürte Äste, die
sehr rasch wachsen und innerhalb von wenigen Minu-ten die restlichen Kristalle überwuchern
können. Sehr schnell ist auch das Wachstum von Mangan(ll)-chlorid-Kristallen, die weiße,
eiszapfenähnliche Gebilde hervorbringen.
c) Das schnelle Wachstum der Eisen(lll)-chlorid-Kristalle läßt sich folgendermaßen auf einer
Leinwand verfolgen: man füllt eine große Kristallisierschale mit Wasserglaslösung und wirft
einige Eisen(lll)-chlorid-Kristalle hinein. Dann läßt man auf der Wasserglaslösung eine leichte
Glasplatte oder eine etwas kleinere Kristallisierschale schwimmen. Dadurch werden die
Kristalle in ihrem Wachstum waagerecht abgelenkt, was sich mit einem Overheadpro-jekt
orsehr gut auf eine Leinwand projizieren läßt.
Erläuterung: Das in der Wasserglaslösung sich auflösende Metallsalz bildet mit dem Lösungsmittel
augenblicklich einen unlöslichen Niederschlag eines entsprechenden Metasilikates (Me2+ +SiO32 → MeSiO3),
der den Kristall in Form eines kleinen Häutchens umgibt. Diese Membran ist semipermeabel. Wegen dieses
Sachverhalts diffundiert Wasser in den Zwischenraum zwischen Kristall und Membran und löst dort ein wenig
von dem Metallsalz. Da diese Metallsalzlösung das Bestreben hat, sich zu verdünnen, zieht sie weiteres Wasser
zu sich hinein. Dadurch steigt der osmotische Druck und die Membran platzt schließlich. Die ausfließende
Salzlösung bildet an der Berührungsstelle mit dem Wasserglas sofort eine neue Haut, die das Loch verschließt.
Ent-sprechend dem Ausmaß der Eruption der Metallsalzlösung ist das Gebilde gewachsen.
Die Salzkonzentration innerhalb des Häutchens ist auf Grund der Schwerkraft am höchsten Punkt der Hülle am
niedrigsten. Die hier entstehende Membran ist daher sehr dünn und platzt bevorzugt. Deshalb wachsen die
Pflanzen nach oben.
Erläuterung: Erklärung siehe Versuch 7
K4[Fe(CN)6] + 2 CuCI2 → Cu2 [Fe(CN)6] + 4 KCI)
8. Harmlose Seeschlange
Geräte: Becherglas (100 ml)
Chemikalien: dest. Wasser, Kaliumhexacyanoferrat(ll), Kupfer(ll)-chlorid
Vorbereitende Arbeiten: 3 g Kaliumhexacyanoferrat(ll) werden in 100 ml x
dest. Wasser gelöst.
Durchführung: Man wirft einen etwa erbsengroßen Kristall von Kupfer(ll)-chlorid in die Lösung.
Ergebnis: Aus der Kristalloberfläche wächst innerhalb kurzer Zeit ein heller,
fast durchsichtiger, bräunlicher Schlauch in die Höhe.
9. Untergehende Sonne
Gerate: Diaprojektor, Rundkolben (250 ml), Leinwand, Stativmaterial, 2 Erlenmeyerkolben
Chemikalien: verd. Salzsäure, dest. Wasser, Natriumthiosulfat-5-Hydiat (Fixiersalz)
Vorbereitende Arbeiten: Folgende Lösungen werden hergestellt: Lsg. A: 10 ml verd. Salzsäure in 90 ml dest.
Wasser Lsg. B: 2 g Natriumthiosulfat-5-Hydrat in 100 ml dest. Wasser Der Rundkolben wird unmittelbar vor
die Linse gestellt (s. Abb. 4).
Durchführung: Nachdem das Licht gelöscht worden ist, schaltet man den Diaprojektor ein und schüttet die
beiden Lösungen in den Rundkolben.
Ergebnis: Der zunächst auf der Leinwand erscheinende helle Kreis zeigt -ähnlich wie die untergehende Sonneallmählich eine Farbänderung über Gelb, Orange, Rot, Dunkelrot.
Hinweis: Der Versuch läßt sich auch sehr gut mit einem Overheadprojektor durchführen. Zu diesem Zweck
deckt man die Leuchtplatte mit einem Stück Pappe ab, in welches man ein kreisrundes Loch geschnitten hat.
Auf diese Öffnung wird eine Kristalvisierschale gestellt, in die man dann die beiden Lösungen schüttet.
Erläuterung: Das Thiosulfation reagiert mit dem Wasserstoffion, wobei die Geschwindigkeit dieser Reaktion
konzentrationsabhängig ist:
S2032- + 2 H+ → S↓ + SO2 ↑+ H20
Der langsam kolloid ausfallende Schwefel bewirkt durch Lichtabsorption die beobachtbare Farbänderung.
mit Quecksilberchlorid verhindert bzw. eine schen vorhandene Oxidschicht wird zerstört, da Quecksilber
entsteht (3 HgCI2+2AI<2AICI34 311g), welches mit Aluminium ein Amalgan bildet. In einem solchen
amalgamierten Aluminiumblech sind zwischen den Aluminiumatomen Quecksilberatome einge-bettet. Das
Aluminium kann daher die zusammenhängende, schützende Oxidhaut nicht mehr ausbilden. Es oxidiert nun an
der Luft außerordentlich leicht unter Bildung von Aluminiumoxidhydrat.
10. Verschimmerndes Aluminium
Gerate: Baumwollappen
Chemikalien: Aluminiumblech oder -folie (5 x 5 cm), Quecksilber (Il)-chloridlösung
Durchführung: Einige Tropfen Quecksilber(ll)-chloridiösung werden auf ein Stück Aluminiumblech gegeben
und mit einem Lappen verrieben, bis die Siel Fläche wieder trocken erscheint.
Ergebnis: Nach kurzer Zeit schießen weiße Fasern aus dem Aluminium hervor und b-decken das Blech wie mit
einer Vegetation von Schimmel.
Hinweis: Quecksilber(ll)-chlorid ist sehr giftig; 0,5 g können bereits tödlich wirken (siehe auch Hinweise—
Versuche 1).
Erläuterung: Aluminium zeigt ein sehr großes Bestreben, sich mit Sauerstoff zu verbinden. Da es allerdings mit
einer fest anhaftenden, zusammenhängenden Oxidschicht bedeckt ist, ist es an der Luft beständig und korridiert
nicht. Die Bildung dieser schützenden Aluminiumoxidschicht wird durch Einreiben
11. Vulkan
Geräte: Becherglas (100 ml), Asbestpappe
Chemikalien: granuliertes Ammoniumdichromat, (evtl. etwas Aceton)
Vorbereitende Arbeiten: Das mit granuliertem Ammoniumdichromat gefüllte Becherglas wird so auf die
Asbestpappe ausgeschüttet, daß die Substanz die Form eines Kegels bekommt.
Durchführung: Die Spitze des Kegels wird angezündet. (Befeuchtet man die Kegelspitze mit etwas Aceton,
dann läßt sich das Ammoniumdichromat leichter anzünden.)
Ergebnis: Unter lebhaftem Glühen und Rauschen bildet sich aus der orangen Substanz ein lockeres, grünes
Pulver, welches ein größeres Volumen einnimmt als die Ausgangssubstanz.
Das Reaktionsprodukt (Cr203) gehört zu den Giften der Abteilung 3 des Giftgesetzes Dichromate und
chromhaltiger Staub werden außerdem karzinogenen Stoffen zugeordnet.
Erläuterung: Ammoniumdichromat zerfällt beim Erhitzen:
(NH4)2Cr207 → 2NH3 + 2CrO3 + H20.
Das dabei entstehende CrO3 ist ein äußerst starkes Oxidationsmittel, welches den Ammoniak unter
Feuererscheinung und Rauschen (Stickstoffentwicklung) zu Stickstoff oxidiert:
2 NH3 + 2 CrO3 → N2 + Cr203 + 3 H20 + 734,8 kJ
Das grüne Reaktionsprodukt besteht aus Cr203.
12. Mottenkugeltanz
Gerate: Standzylinder, Mottenkugeln
Chemikalien: Natriumhydrogencarbonat, Essigsäuren
Durchführung: Der Standzylinder wird mit Wasser gefüllt. Dazu gibt man etwas Essigsäure und
Natriumhydrogencarbonat, das ganz allmählich hinzu geschüttet werden muß, da es sonst zu sehr schäumt. In
diese schäumende Flüssigkeit werden nun einige Mottenkugeln geworfen.
Ergebnis: Die Mottenkugeln sinken zunächst, aber nach kurzer Zeit erhebt sich eine Kugel nach der anderen,
steigt bis zur Wasseroberfläche und sinkt_
dann wieder. Auf den Boden des Gefäßes angelangt steigt die Kugel erneut wieder nach oben etc.
Hinweise:
a) Sind die Kugeln zu glatt, dann können sich keine Gasbläschen daran festsetzen. Deshalb
müßte man Sie evtl. vorher etwas aufrauhen. Sind die Kugeln allerdings zu rauh, so lösen sich
an der Wasseroberfläche die Bläschen nicht vor den Kugeln und Sie sinken nicht mehr nach
unten.
b) Hat man keine Mottenkugeln zur Hand, so kann man sich folgendermaßen behelfen:
Styroporkugeln werden in Knetmasse "eingepackt"! Die Menge der Knete muß so bemessen
sein, daß die Kugeln in Wasser gerade untergehen. Auf Grund der günstigen
Oberflächenbeschaffenheit der Knete und des optimalen Gewichtes der selbsthergestellten
Kugeln gelingt der Versuch recht gut.
Erläuterung: Das bei der Reaktion zwischen Essigsäure und Natriumhydrogencarbonat entstehende
Kohlendioxid setzt sich in kleinen Bläschen auf den Kugeln ab und bewirkt so einem Auftrieb. An der
Wasseroberfläche ent-weichen die Bläschen in die Luft und die Kugeln sinken wieder.
14. Hüpfender Kitt
Geräte: Hammer, Amboß
Chemikalien: Borpolysiloxan ("hüpfender Kitt"), normaler Glaserkitt
Durchführung 1: Man formt aus Siliconkitt eine Kugel von 2—3 cm Durchmesser und läßt Sie auf den Boden
fallen oder wirft Sie kräftig gegen die Wand. Dasselbe geschieht mit einer Kugel aus Glaserkitt.
Ergebnis 1: Die Kugel aus Siliconkitt ist hochelastisch und prallt zurück, ohne ihre Kugelgestalt zu verlieren;
die Glaserkittkugel hingegen wird platt gedrückt.
Durchführung 2: Eine Siliconkugel wird auf eine horizontale Unterlage gelegt.
Ergebnis 2: Nach einigen Minuten hat Sie ihre Kugelgestalt verloren, da Sie wie eine sehr zähe Flüssigkeit
auseinandergeflossen ist (siehe Abb. 5).
Durchführung 3: Stangenförmig ausgerollter Siliconkitt wird auf einen Amboß gelegt. Mit der Schmalseite des
Hammers schlägt man kräftig auf die Mitte der Stange.
Ergebnis 3: Der Siliconkitt verhält sich wie ein spröder Körper; er zerbricht in zwei Teile.
Hinweise:
a) Man erhält den "hüpfenden Kitt' bei folgender Bezugsquelle: Wacker-Chemie GmbH, Werk
Burghausen, 8263 Burghausen/Obb., Postfach 1260.
b) Interessante gummielastische Eigenschaften finden sich auch bei Synthese-Kautschuk: Ein
Kautschukband (20 cm) wird im gereckten Zustand festgehalten und in Eis eingebettet.
Nimmt man nach ca. 10 Sekunden das Band aus dem Eis heraus so bleibt es im gereckten
Zustand. Die elastische Eigenschaft kehrt sofort zurück, wenn man es in heißes Wasser wirft.
Dieser Versuch läßt sich beliebig oft wiederholen.
Erläuterung: Der "hüpfende Kitt" besteht aus Siliconketten (siehe Versuch 15) in die Boratome eingebaut
worden sind:
—Si—O—B—O—Si—.
Der Borgehalt beträgt 1 Boratom auf 3 bis 100 Siliciumatome. Der Siliconkitt verhält sich gegenüber langsam
wirkenden Kräften als plastische, leicht knetbare Masse. Bei stoßartigen Kräften aber ist er hochelastisch. Die
Rückprallelastizität beträgt mehr als 50%. Diese hohe Elastizität ist um so erstaunlicher, als das Material Borpolymethylsiloxan- aus verhältnismäßig kurzkettigen Molekülen besteht. Man nimmt zur Erklärung eine
vorübergehende Vernetzung an, welche wahrscheinlich dadurch zustandekommt, daß die freien Elektronen am
Siloxansauerstoff in die Okettlücken der Boratome "einschnappen".
15. Wasserscheues Gewebe
Geräte: Becherglas (50 ml)
Chemikalien: Wasser, Sand, siliconisierte Verbandsgaze.
Durchführung 1: Auf ein Stück siliconisierte Verbandsgaze, welche leicht Gespannt gehalten wird, schüttet man
Sand.
Ergebnis : Der Sand fällt durch.
Durchführung 2: Auf das grobmaschige Gewebe gießt man vorsichtig 20 bis 40 ml Wasser.
Ergebnis 2: Das Wasser bleibt als Riesentropfen auf dem Gaze liegen.
Durchführung 3: Man stößt leicht gegen das Gewebe.
Ergebnis 3: Das Wasser läuft heraus.
Hinweise:
a) Man erhält die siliconisierte Verbandsgaze bei folgender Bezugs-quelle: Wacker-Chemie
GmbH Werk Burghausen, 8263 Burghausen/Obb., Postfach 1260.
b) Ein Taschentuch wird kräftig mit Bärlappsporen (Lycopodium) eingerieben. Die Farbe des
Gewebes soll so beschaffen sein, daß man die gelbe Farbe der Bärtappsporen nicht bemerkt.
Man hält das Taschentuch an den vier Ecken fest, so daß es die Form eines Beutels bekommt,
und schüttet dann ein Glas Wasser hinein. Es fließt kein Wasser heraus.
Erläuterung: Unter Silicone versteht man eine große Gruppe von Verbindungen mit folgender allgemeiner
Formel:
—SiR2—O—n (R: organische Gruppe).
Sie bilden Öle, Pasten, "Fette", gummiartige Massen und Harze.
Gegenstände (Gewebe, Papier, Ziegelsteine etc.), die mit bestimmten Siliconlösungen behandelt worden sind,
erweisen sich beim Aufbringen von Wasser als unbenetzbar. Diese hydrophobe Wirkung läßt sich vermutlich
auf eine orientierte Absorption der Siliconmoleküle zurückführen: die SiO-Gruppe wendet sich dem Gegenstand
zu, während die hydrophobe organische Gruppe dem Gegenstand abgewandt ist und eine wasserabweisende
Schicht bildet.
16. Trockene Flüssigkeit
Geräte: Becherglas
Chemikalien: Bärlappsporen (Lycopodium), Wasser oder Tinte
Vorbereitende Arbeiten: Ein Becherglas wird mit Wasser oder Tinten gefüllt.
Durchführung 1: Man taucht einen Finger in die Flüssigkeit.
Ergebnis 1: Der Finger wird naß, bzw. farbig.
Durchführung 2: Man schüttet Bärtappsporen auf die Flüssigkeit und taucht dann einen Finger hinein.
Ergebnis 2: Der Finger wird nicht benetzt und bleibt trocken. Hinweis: Siehe Hinweise Versuch 15.
17. Gefangenes Gas
Geräte: Kippscher Gasentwickler, 2 gewinkelte Glasröhren mit Hahn, Schlauch, Erlenmeyerkolben, Stopfen,
Filtriermaterial, Reibschale mit Pistill
Chemikalien: Hydrochinon, Salzsäure (10%-ig), Eisensulfid, dest. Wasser
Vorbereitende Arbeiten:
a) Zur Herstellung von Schwefelwasserstoff wird ein Kippscher Apparat mit 10%iger Salzsäure und Eisensulfid beschickt. Man kann auch eine einfache Gasentwicklungsapparatur aus einem Erlenmeyerkolben und einem Tropftrichter
verwenden
b) Man bereitet eine warm gesättigte Hydrochinonlösung, indem man 10g Hydrochinon in 100 ml warmen Wasser löst. Auf diese Lösung leitet man Schwefelwasserstoff (siehe Abb. 6). Hahn A wird nach Verdrängen der Luft geschlossene
Hahn B bleibt geöffnet, so daß ein leichter Schwefelwasserstoffdruck auf der Lösung
vorhanden ist. Man schüttelt den Kolben etwas. Die beim Abkühlen entstehenden
Kristalle werden abfiltriert und getrocknet. bis kein Schwefelwasserstoffgeruch mehr
wahrnehmbar ist.
Durchführung: Einige Kristalle werden in der Reibschale zerrieben.
Ergebnis: Der charakteristische Geruch von Schwefelwasserstoff ist wahrnehmbar.
Hinweis:
a) Vorsicht bei der Schwefelwasserstoffherstellung: Schwefelwasserstoff ist ein farbloses Gas
mit unangenehmem Geruch, der allerdings in hoher Konzentration nicht mehr wahrnehmbar
ist. Es ist ein gefährliches Gift wie die Blausäure. Unmittelbare Einatmung des Gases (2 mg/)
kann zu plötzlichem Tod durch Atemlähmung führen. Für gewöhnlich verhindert aber sein
außer-ordentlich unangenehmer Geruch, daß bedenkliche Mengen eingeatmet werden.
b) "Als Staub oder als konzentrierte Lösung wirkt Hydrochinon ätzend auf die Haut.
Besonders schwere Schäden können durch Berühren der Substanz mit Horn- oder Bindehaut
des Auges entstehen. Daher Schutzhandschuhe und Schutzbrille tragen!"
Erläuterung: Hydrochinon bildet mit Schwefelwasserstoff kristalline Hydrochinon-Addukte (siehe Abb. 7), die
praktisch unbegrenzt haltbar sind. Sie ermöglichen bei Versuchen eine bequeme Handhabung des
Schwefelwasserstoffes ohne größere Geruchsbelästigung. Werden die Kristalle zerrieben, so wird der
Kristallkäfig zerstört und Schwefelwasserstoff entweicht.
18. Uri-Geller-Löffel
Geräte: Thermoskanne, Tasse
Chemikalien: Woodsches Metall, Kaffee (70°C), Zucker
Vorbereitende Arbeiten: Aus dem Woodschen Metall wird ein Löffel hergestellt. Dazu gießt man die
Metallschmelze in eine Gipsform. Einfacher ist es aber, das verflüssigte Metall auf eine Eternit- oder
Porzellanplatte in Löffelform auszugießen, was nach einiger Übung gut gelingt.
Durchführung: Aus der Thermoskanne wird heißer Kaffee in die Tasse geschüttet. Nun gibt man einen Löffel
Zucker hinzu und rührt um.
Ergebnis: Der eingetauchte Teil des Löffels ist verschwunden.
Hinweise:
a) Der Kaffee darf selbstverständlich nicht mehr für Genußzwecke verwendet werden.
b) ,, Woodsche Legierung ist käuflich, läßt sich aber nach folgendem Rezept leicht selbst herstellen:
In einer flachen Eisenschale erhitzt man auf dem Asbestdrahtnetz über dem Brenner ein Gemisch von je 12,5 g
Zinn und Cadmium, 25 g Blei und 50 g Wismut unter ständigem Rühren, bis sich eine einheitliche, silbrige,
leicht fließende Schmelze gebildet hat. Das Zusammenschmelzen in einem Porzellantiegel auf Tondreieck über
der offenen Flamme empfiehlt sich nach langer Erfahrung nicht, da sich Komponenten des Gemisches unter
Ausstoßen brauner Dämpfe leicht entzünden und zu Asche verglühen. Sollten sich beim Zusammenschmelzen
doch Oxidschlacken auf der flüssigen Legierung gebildet haben, so kann man diese durch Eingießen der
Schmelze in heißes Wasser leicht trennen.'
Erläuterung: Bekanntlich gibt es leichtschmelzende Legierungen (sogen. ,,Eutektika"), von denen das Weichlot
des Klempners (eine Blei-Zinn-Legierung) am bekanntesten sein dürfte; auch viele Schüler kennen es vom
Elektrobasteln her. Das Woodsche Metall übertrifft dieses aber an Tiefe des Schmelzpunktes bei weitem, es
schmilzt schon bei etwa 6O°C. Bei Thermosicherungen findet es auch eine praktische Anwendung in Geräten;
sein Durch- schmelzen unterbricht den Stromkreis und schützt so vor Überhitzung.
19.
Unheimliche Träne
Geräte: Zange, Becherglas, Handschuhe, Schutzscheibe, Schutzbrille
Chemikalien: 2 Bologneser Glastränen, Wasser
Durchführung 1: Man zwickt mit einer Zange die Glastropfenspitze ab.
Ergebnis 1: Der Glastropfen zerfällt explosionsartig zu staubfeinem Pulver.
Durchführung II: Der unter 1 geschilderte Versuch wird in einem mit Wasser gefüllten Becherglas
durchgeführt.
Ergebnis II: Das Becherglas wird zertrümmert.
Hinweise: a) Bei diesem Versuch ist für ausreichenden Splitterschutz zu sorgen.
b) Durch Abschmelzen eines Glasstabes im Gebläsebrenner und Abschrecken der dabei entstehenden
Glastropfen in Wasser kann man die Bologneser Träne selbst herstellen.
Erläuterung: siehe Erläuterung Versuch 20.
20. Bologneser Flasche
Geräte: Breitkopfnagel, Stück Weichholz, Glassplitter oder spitzes Steinchen, Handschuhe, Schutzbrille,
Schutzscheibe
Chemikalien: Bologneser Flasche
Durchführung I: Man schlägt mit der Bologneser Flasche einen Breitkopfnagel in ein Stück Weichholz
(vorsorglich Splitterschutz!).
Ergebnis I: Die Flasche bleibt unbeschädigt.
Durchführung II.. Man läßt durch den Flaschenhals einen kleinen Glassplitter fallen.
Ergebnis II: Die ganze Flasche wird augenblicklich zertrümmert.
Hinweise :
a) Bei diesem Versuch ist für ausreichenden Splitterschutz zu sorgen.
b) Die Bologneser Flasche ist bei der Gerresheimer Glashütte zu beziehen.
Erläuterung: In zu schnell abgekühlten Glaswaren treten starke Spannungen auf. Da die Bologneser Flasche nur
innen solche Spannungen aufweist, kann man unbesorgt mit ihr einen Nagel einschlagen, während ein in die
Flasche fallengelassenes spitzes Steinchen die ganze Flasche sofort zerstört.
22. Flüssiger Stickstoff
,,Ein weithalsiges 1- oder 2 l-Dewar-Gefäß wird zu zwei Drittel mit flüssigem Stickstoff gefüllt. Man benutzt
ihn für eine Reihe von Tieftemperaturdemonstrationen. Mindestens ein Dutzend luftgefüllte Ballons können vor
der Veranstaltung in das Gefäß einkondensiert werden. Während der Vorführung gibt man noch ein paar dazu;
dann werden alle mit einer Zange herausgenommen, und man läßt Sie sich ausdehnen. Besonders wirkungsvoll
sind große Ballonfiguren.
Eine Banane wird mindestens eine Minute lang in den flüssigen Stickstoff getaucht. Sie wird dann dazu benutzt,
um einen Nagel in ein Stück Balsaholz einzuschlagen. Zum Anfassen der gefrorenen Gegenstände sollte man
Asbesthandschuhe benutzen. Eine Blume - Rose, Chrysantheme oder Nelke - läßt sich einfrieren und dann in
viele Splitter zerschlagen.
Ein hohler Gummiball wird 30-60 Sekunden in den flüssigen Stickstoff eingetaucht. Man achte darauf, daß er
durch Drehen gleichmäßig abkühlt. Der Ball kann dann an einer Wand zerschlagen werden.
23. Feuer essen
Geräte: Messer, Korkbohrer
Chemikalien: Marzipan (bzw. Apfel, weiße Rübe), Mandel kern
Vorbereitende Arbeiten: Aus dem Marzipan formt man evtl. mit Hilfe des Korkbohrers - eine Kerze. Als Docht
wird der entsprechend zugeschnittene Mandelkern an einem Ende hineingesteckt.
Durchführung: Die Kerze wird entzündet, dann schiebt man Sie brennend in den Mund und ißt Sie auf.
Hinweis: Damit man sich nicht Zunge und Mund verbrennt, muß dieser Versuch geübt werden. Entweder läßt
man die brennende Kerze in den hochgehaltenen Mund fallen, wobei man Sie ausbläst oder man umschließt die
Kerze mit dem Mund derart, daß die Flamme aus Sauerstoffmangel gleich ausgeht. Der ölhaltige Mandeldocht
wird durch das Brennen sehr heiß. Daher sollte man nach dem Abbeißen versuchen den heißen Mandelkern
möglichst rasch mit Marzipanmasse zu umgeben.
24. Der unverbrannte Faden
Geräte: 2 kleine Messingringe, Stativ
Chemikalien: Kochsalz, Wasser, Garn
Vorbereitende Arbeiten: Etwa 1 m Garn wird in eine gesättigte Kochsalzlösung gelegt. Nach etwa 24 Stunden
nimmt man den Faden heraus und läßt ihn trocknen. Er hat sich äußerlich kaum verändert. Dieser präparierte
Faden wird zusammen mit einem normalen Faden sichtbar aufgehängt. An den Enden der beiden Fäden
befestigt man jeweils noch einen kleinen Messingring.
Durchführung: Beide Fäden werden entzündet.
Ergebnis: Der normale Faden verbrennt zu Asche; dabei fällt der Ring herunter. Der präparierte Faden brennt
auch, allerdings zerfällt die Asche nicht und der Ring bleibt hängen.
Erläuterung: Die Salzkristalle halten den Aschefaden so zusammen, daß er den Ring noch tragen kann.
25. Magisches Pulver
Geräte:
2 Reagenzgläser
Chemikalien:
Blei(II)-nitrat, Kaliumjodid
Vorbereitende Arbeiten: In das eine Reagenzglas füllt man 2 g Blei(II)-nitrat, in das andere 2 g Kaliumjodid.
Durchführung:
Der Inhalt der beiden Reagenzgläser wird zusammengeschüttet und die Mischung kräftig
geschüttelt.
Ergebnis:
Die weiße Mischung färbt sich gelb.
Hinweis:
Blei(II)-nitrat gehört zu den Giften der Klasse 3.
Erläuterung:
Beim Mischen der beiden Substanzen bildet sich das gelbe Bleijodid. Es liegt hier eine
Reaktion im festen Zustand vor.
26. Alternative Energie
Geräte: 2 Reagenzgläser, Reagenzglasständer, 2 Stopfen
Chemikalien:
Ammoniumchlorid, Natriumhydroxid
Vorbereitende Arbeiten: In das eine Reagenzglas wird 1 g Ammoniumchlorid, in das andere
1 g Natriumhydroxid gegeben.
Durchführung:
Beide Reagenzgläser werden mit etwa 10 ml Wasser gefüllt, verschlossen und geschüttelt.
Man läßt einige Zuschauer die Temperatur der beiden Reagenzgläser feststellen.
Ergebnis:
Das eine Reagenzglas fühlt sich sehr heiß an, das andere sehr kalt.
Hinweise:
a) Natriumhydroxid ist sehr ätzend!
b) Löst man wasserfreies CaCl2 in Wasser, so wird eine beachtliche Energie frei. Geht man
von 11,1 g CaCl2 aus (1/10 mol) + 16 ml Wasser, so steigt die Temperatur etwa von 18°C auf
88°C.
CaCl2+6H2O~CaCl2 * 6H2O bzw. [Ca(H2O)6] Cl2
Aus dem aquotisierten Salz läßt sich das wasserfreie Salz durch Wärmezufuhr wieder gewinnen (festes
aquotisiertes Calciumchlorid wird in einer Porzellanschale erhitzt bis das Kristallwasser verdampft),
Calciumchlorid kann also als Wärmespeicher verwendet werden.
27.
Flüssiges Pulver
Geräte: 2 Abdampfschalen, Glasstab
Chemikalien:
Bariumhydroxid, Ammoniumthiocyanat
Vorbereitende Arbeiten: In die eine Abdampfschale wird etwa 30 g Bariumhydroxid, in die andere 15 g
Ammoniumthiocyanat gegeben*
Durchführung:
Die beiden weißen Pulver werden zusammengeschüttet und mit dem Glasstab gut vermischt.
Ergebnis:
Das Reaktionsgemisch wird zunehmend flüssiger und läßt sich demonstrativ in ein anderes
Gefäß schütten. Das Reaktionsgemisch kühlt beim Flüssigwerden sehr stark ab, außerdem ist
auch deutlich ein Geruch von NH3 wahrnehmbar*
Hinweis:
Bariumhydroxid gehört zu den Giften der Klasse 3.
Erläuterung:
Ba(OH)2 * 8H2O +2NH4SCN → Ba(SCN)2 +2NH3 +2H2O Das Reaktionsgemisch wird
zunehmend flüssiger durch das entstehende und freiwerdende Wasser. Gleichzeitig tritt eine
Temperaturerniedrigung um etwa 54,5°C ein. Bei einer Zimmertemperatur von I9,5°C erreicht
man somit im Reaktionsgefäß -35°C. Stellt man das Reaktionsgefäß auf einen nassen
Schwamm, so gefriert er sofort an*
28. Schnelles Kristallwachstum
Geräte:
2 Erlenmeyerkolben, Kristallisierschale, Bunsenbrenner, Dreifuß, Asbestdrahtnetz,
Filtriermaterial, Watte
Chemikalien:
Natriumsulfat-10-Hydrat, dest. Wasser, Eis
Vorbereitende Arbeiten: 100 ml dest. Wasser und 100 g Natriumsulfat-10- Hydrat werden in einen
Erlenmeyerkolben gegeben und unter Umschütteln solange erwärmt, bis sich das Salz
aufgelöst hat. Die Lösung nimmt ein Volumen von ca. 160 ml ein. Man filtriert die warme
Lösung in einen zweiten Erlenmeyerkolben, verschließt diesen mit einem Wattebausch und
erhitzt bis zum Sieden. Den heißen Erlenmeyerkolben stellt man zum Abkühlen in eine mit
Eiswasser gefüllte Kristallisierschale. Nach ca. 15 Minuten ist die Lösung genügend abgekühlt
- ihre Temperatur beträgt etwa 15 °C -, so daß man zur Versuchsdurchführung übergehen
kann.
Durchführung.
Man nimmt den Erlenmeyerkolben mit der abgekühlten Lösung unter Vermeidung von
Erschütterung aus dem Eiswasser, entfernt den Wattebausch und wirft einen kleinen
Natriumsulfatkristall hinein.
Ergebnis:
Aus dem hineingeworfenen Kristall wachsen nach allen Richtungen Kristallnadeln in die
Lösung, welche innerhalb weniger Sekunden den Kolbeninhalt in eine eisartig aussehende
Masse verwandeln.
Um zu zeigen, daß der Inhalt fest geworden ist, kann man den Erlenmeyerkolben mit der
Öffnung nach unten halten.
Hinweis:
Lösungen von Natriumsulfat neigen zur Übersättigung. Die Durchführung des Versuches muß
nicht sofort nach der 15-minütigen Abkühlungszeit stattfinden. Man kann die verschlossene
Lösung ca* 1 Stunde im Eiswasser stehenlassen - Sie hat dann eine Temperatur von etwa 5 °C
-, bevor man den Versuch vorführt. Länger sollte man allerdings nicht warten, da Sie dann
meistens von selbst auskristallisiert.
Erläuterung: 100 g Wasser lösen bei
0
12,6
10
23,04
15
36
20
58,35
25
98,5
30
184
34
412
°C
Gramm Na2SO4⋅ 10H2O
Beim Abkühlen der Lösung auf 15°C müßten 100 g-36 g = g Natriumsulfat-l0-Hydrat auskristallisieren. Da aber
das Filtrieren und Kochen der Lösung zu einer Entfernung von Kristallisationspunkten geführt hat, erhält man
eine übersättigte Lösung. Eine solche Lösung steht in einem sehr labilen Zustand und bei Zugabe eines
Kristallisationskernes kristallisiert das überschüssig gelöste Salz sofort aus.
29.
Künstlicher Kaviar
Geräte:
Tropftrichter, Kristallisierschale (300 ml), Stativmaterial, Glasstab, Büchnertrichter
Chemikalien:
Kupfersulfat-5-Hydrat, Natriumalginat, dest. Wasser
Vorbereitende Arbeiten: Folgende Lösungen werden hergestellt:
Lsg. A: 1 g Natriumalginat werden in 100 ml kochendem Wasser gelöst.
Lsg. B: 8 g Kupfersulfat-5-Hydrat in 100 ml Wasser. Versuchsaufbau nach Abb. 9.
Durchführung:
a) Man läßt die Natriumalginatlösung in die Kupfersulfatlösung eintropfen. Dabei entstehen
kaum sichtbare, kleine Kügelchen, die auf der Kupfersulfatlösung schwimmen. Um ein
Zusammenbacken dieser Kügelchen mit der eintropfenden Flüssigkeit zu vermeiden, rührt
man hin und wieder mit einem Glasstab in der Lösung*
b) Sobald die Natriumalginatlösung verbraucht ist, wird die Kupfersulfatlösung in einen
Büchnertrichter geschüttet. Man läßt die Flüssigkeit abfließen und gibt den Rückstand in eine
Kristallisierschale.
Ergebnis:
Es sind durchscheinende, türkisfarbene Kügelchen (ca. 5 mm) entstanden, die in ihrem
Aussehen an Froscheier erinnern.
Hinweis:
Verwendet man statt Kupfersulfat Silbernitrat, so erhält man durchscheinend weiße
Kügelchen, die allerdings nicht so fest und elastisch sind wie die türkisfarbenem. Ähnlich
schwammige und unstabile Kügelchen bekommt man beim Eintropfen der Natriumalginatlösung in Salzsäure.
Erläuterung:
Alginsäure ist ein farbloses, Carboxylgruppen enthaltendes Polysaccharid (MG 100 000-240
000), welches sich in beträchtlichen Mengen in Braunalgen findet (bis zu 40%
Trockensubstanz), wo es ähnlich wie die Zellulose eine Stützfunktion ausübt* In kaltem
Wasser ist diese Substanz unlöslich, in siedendem Wasser löst Sie sich mit schwach saurer
Reaktion. Die Alkalisalze und Magnesiumsalze der Alginsäure sind wasserlöslich. Technische
Verwertung finden Alginsäure und Alginate als Verdickungsmittel für Speiseeis, Marmeladen,
Fertigsuppen, Leimen, Kosmetika etc.
Ausgehend von der Annahme, daß das Kupfersalz der Alginsäure in Wasser unlöslich ist, läßt
sich die Kügelchenbildung folgendermaßen erklären: beim Eintropfen der Natriumalginatlösung kommt die Oberfläche der Tropfen mit der Kupfersulfatlösung in Berührung;
es bildet sich das unlösliche Kupfersalz der Alginsäure, welches die Tropfen mit einer festen,
zusammenhaltenden Schicht überzieht. Daneben bildet sich auf Grund der sauren Reaktion
der Kupfersulfatlösung vermutlich auch noch die wasserunlösliche Alginsäure. Da das Innere
der Tropfen keinen Kontakt mit der Kupfersulfatlösung hatte, bleibt es flüssig.
31. Nylon-Seil-Trick
Geräte:
3 Bechergläser, Pinzette, Trichter, Stativmaterial, Glasstäbe, Stopfen
Chemikalien:
Hexamethylendiamin, Adipinsäuredichlorid (oder Sebacinsäuredichlorid) Tetrachlormethan
(oder Tetrachloräthylen), Phenolphthalein, dest. Wasser
Vorbereitende Arbeiten:
a) Versuchsaufbau nach Abb. 10, die beiden Glasstäbe werden zweckmäßigerweise jeweils
in einen durchbohrten Stopfen geschoben, welcher dann am Stativ befestigt wird. Um
eine genügend große Fallhöhe für den Nylonfaden zu erreichen, spannt man das
Becherglas, in das die beiden Lösungen kommen, am oberen Ende einer Stativstange ein.
b) Folgende Lösungen werden hergestellt:
Lsg. A: In einem kleinen Becherglas werden etwa 2 ml Adipinsäuredichlorid (oder
Sebacinsäuredichlorid) in 50 ml Tetrachlormethan (oder Tetrachloräthylen) gelöst. Man
erhält eine braungelbe Lösung.
Lsg. B: In einem anderen Becherglas löst man ca. 2 g Hexamethylendiamin in 50 ml
Wasser. Durch Zugabe von etwas Phenolphthalein färbt man die Lösung rot.
Durchführung:
Lsg. A wird in das eingespannte Becherglas gegeben. Dann wird mit Hilfe eines Trichters
vorsichtig Lsg. B auf Lsg. A geschichtet (siehe Abb. 10).
Ergebnis:
An der Berührungsstelle der beiden Lösungen entsteht eine dünne Haut, die man mit der
Pinzette in der Mitte der Oberfläche erfaßt und aus der Lösung zieht. Da die Haut sich
augenblicklich neu bildet, läßt sich ein zusammenhängender Faden herausziehen, der viele
Meter lang wird. Sollte der Faden reißen, so kann man natürlich mit der Pinzette einen neuen
Faden aus der Lösung ziehen. Dieser Faden wird so über zwei Glasstäbe gelegt, daß er alleine
durch sein Eigengewicht nach unten sinkt (siehe Abb. 10) und sich dabei langsam aus der
Lösung zieht. Das nötige Eigengewicht wird bei einer Fadenlänge von ca. 2 m erreicht. Man
läßt ihn daher von einem hohen Stativ auf den Fußboden fallen. Weil der Faden nicht trocken
ist, empfiehlt es sich, eine alte Zeitung unterzulegen. Der Versuch ist beendet, wenn das
Becherglas leer ist.
Erläuterung:
An der Berührungsstelle der beiden Lösungen bildet sich unter Abspaltung von HCl Nylon
(Grenzflächenkondensation).
Anstatt Sebacinsäuredichlorid kann man auch Adipinsäuredichlorid verwenden. Man erhält
dann Nylon 6,6. Die beiden Zahlen geben die Anzahl der Kohlenstoffatome in den
monomeren Ausgangsstoffen an.
Die unverzweigten Moleküle des Nylons bilden untereinander Wasserstoffbrücken aus:
32.Wandernde Stoffe
Geräte: 2 Reagenzgläser (3 cm, Länge 18 cm), 2 passende Stopfen
Chemikalien: Campher, Brennspiritus, Chloralhydrat (Trichloräthanal-Hydrat), Salicylsäurephenylester
Vorbereitende Arbeiten: Die beiden Reagenzgläser werden folgendermaßen präpariert:
Rg. A: Man füllt das Reagenzglas vollständig mit Salicylsäurephenylester (ca. 20 g) und hält es über
die Flamme eines Bunsenbrenners. Sobald die Masse flüssig geworden ist (Schmp. liegt bei 43°C),
erhitzt man noch einige Zeit weiter, um auch die kleinsten Kristalle zu schmelzen. Das Schmelzprodukt
nimmt etwa das halbe Volumen des Reagenzglases ein. Man läßt das Reagenzglas abkühlen. Dabei
verfestigt sich die Substanz nicht. Sie bleibt ca. 2~3 Stunden flüssig und ist relativ beständig gegenüber
Bewegung.
Lsg. B: Campher und Chloralhydrat werden fein pulverisiert. Den Campher feuchtet man vor der
Pulverisierung mit einigen Tropfen Alkohol an. Das Reagenzglas füllt man zunächst zur Hälfte mit
Campher (ca. 15 g), darüber schichtet man das pulverisierte Chloralhydrat (ca. 5 g), so daß das
Reagenzglas schließlich zu 3/4 gefüllt ist.
Durchführung: Die beiden Reagenzgläser werden mit den Stopfen verschlossen und dann gleichzeitig kräftig
geschüttelt.
Ergebnis: Die feste Substanz ist flüssig geworden, die flüssige fest. Die beiden Stoffe haben also ihren Platz
gewechselt. Die beim Schütteln des flüssigen Salicylsäurephenylesters entstehenden Kristalle haften am
Reagenzglas und täuschen so eine Volumenzunahme vor. Das Volumen der Campher-Chloralhydrat-Mischung
nimmt beim Flüsssigwerden ab (siehe Abb. 11).
Hinweise:
a) Salicylsäurephenylester wird beim Auskristallisieren warm!
b) Da der aromatische Geruch von Campher zu sorglosem Umgang mit dieser Substanz verleiten
kann, soll kurz auf seine Giftwirkung hingewiesen werden. In geringer Menge ist Campher
anregend, in größerer Menge wirkt es allerdings lähmend auf Atmung, Herztätigkeit und
Zentralnervensystem. Für ein Kind ist die Aufnahme von 1 g Campher über die Verdauungswege
bereits tödlich. Chloralhydrat findet als Schlafmittel Verwendung. Es ist ein Nervengift. Innerlich
eingenommen wirken O,9-12 g tödlich.
33. Kupfer-Silber-Gold
Geräte: kleineres Becherglas, Glasstab, Tiegelzange, Bunsenbrenner, Dreifuß, Asbestdrahtnetz
Chemikalien: konz. Natronlauge, Kupfermünzen, Zinkstaub
Vorbereitende Arbeiten: Die benötigten Chemikalien und Geräte werden bereitgestellt.
Durchführung I: In das Becherglas gibt man konz. Natronlauge, etwas Zinkstaub und einige gereinigte
Kupfermünzen. Dann erhitzt man unter Umrühren bis zum Sieden. Nach einiger Zeit nimmt man mit der
Tiegelzange die Münzen aus der Lösung und spült sie mit Wasser gut ab.
Ergebnis I: Die Münzen sind mit einer silberglänzenden Schicht überzogen.
Durchführung II: Die Münzen werden kurz in der Brennerflamme erwärmt.
Ergebnis II: Es bildet sich ein goldener Überzug.
Hinweis: Alkalische Flüssigkeiten neigen zum Siedeverzug. Um ein plötzliches Herausschleudern der stark
ätzenden, heißen Flüssigkeit zu vermeiden, sollte die Natronlauge beim Erhitzen mit einem Glasstab gerührt
werden.
Erläuterung: Zink löst sich vor allem in der Wärme in starker Alkalilauge. Dabei bildet sich vermutlich
Natriumtetrahydroxozinkat. Das Tetrahydroxozinkation dissoziiert in wässriger Lösung:
[Zn(OH)4]2- → Zn2+ +4 OHDie entstehenden Zinkionen scheiden sich als Zinküberzug auf dem Kupfer, an dem sie entladen werden, ab.
Wird die verzinkte Kupfermünze in einer Flamme erwärmt, so bildet sich eine Kupfer-Zink-Legierung. Diese,
als Messing bekannte Legierung, besitzt goldähnliches Aussehen.
34. Verkupfern mit einem Schlag
Geräte: 2 Bechergläser, Glasstab, etwas Draht
Chemikalien: 5%ige Kupfersulfatlösung, konz. Salpetersäure (min. 80 Gew.%), Eisenblech, Benzol
Vorbereitende Arbeiten: Das Eisenblech wird an einer Seite durchbohrt. Eventuell vorhandenen Rost beseitigt
man durch Schmirgeln, bis eine metallisch blanke Oberfläche vorliegt. Dann spült man das Blech mit dest.
Wasser, trocknet es mit einem sauberen Tuch und entfettet es mit Benzol (p. a). An der Bohrung befestigt man
ein Stück Draht, mit dem das Eisenblech bei der Versuchsdurchführung gehalten wird. Das eine Becherglas
wird mit konz. HNO3 gefüllt, das andere mit 5 %iger CuSO4-Lsg. Die beiden Bechergläser müssen so bemessen
sein, daß das Eisen. blech gut hineinpaßt und von den eingefüllten Lösungen vollständig bedeckt werden kann.
Durchführung: Man taucht das an einem Draht aufgehängte Eisenblech in die konz. Salpetersäure und
unmittelbar darauf in die Kupfersulfatlösung.
Ergebnis: Nach Herausnahme aus dem Kupfersulfatbad zeigt sich auf dem Eisenblech kein Kupferniederschlag.
Erst ein leichter Stoß mit einem Glasstab auf das Blech läßt in Sekundenschnelle von der Aufschlagstelle aus
einen Kupferüberzug auf dem Eisen entstehen.
Hinweise:
a) Wegen der konz. Salpetersäure wird der Versuch unter dem Abzug durchgeführt.
b) Da das passivierte Eisen anfällig gegen Erschütterung ist, muß der Draht gut befestigt sein,
und darf nicht an dem Blech scheuern. Auch sollte man beim Eintauchen jegliche Berührung
des Eisens mit dem Glasgefäß vermeiden.
c) Der vorliegende Versuch läßt sich folgendermaßen erweitern: zunächst taucht man ein
Eisenblech für einige Sekunden in die blaue Kupfersulfatlösung und zeigt dann das
verkupferte Blech vor. Nach diesem, schon für sich spektakulärem Ergebnis, geht man mit
einem anderen Eisenblech zur eigentlichen Versuchsdurchführung über. Zum Schluß
verwandelt man die beiden verkupferten Eisenbleche wieder in Eisen, indem man Sie mit
konz. Salpetersäure behandelt (Abzug!).
Erläuterung: Das Element Kupfer ist mit einem Normalpotential von +0,34 Volt edler als das Element Eisen,
welches ein Normalpotential von -0,44 Volt aufweist. Auf Grund dessen verdrängt Eisen das Kupfer aus der
Lösung seines Salzes:
Fe+Cu2+ +SO42- → Fe2+ +S042- + Cu
Kupfersulfat
Eisensulfat
Diese Reaktion läuft nicht ab, wenn man Eisen vorher in konz. Salpetersäure taucht und dadurch passiviert. In
diesem Zustand verhält es sich ähnlich wie ein Edelmetall: von konz. und verd. Salpetersäure wird es nicht
angegriffen und aus einer Silbersalzlösung scheidet es kein Silber aus. Das Phänomen der Passivierung zeigen
auch andere unedle Metalle. Es läßt sich bis heute noch nicht restlos erklären. Nach der sog. „Oxidhauttheorie"
wird die Passivität durch Bildung einer sehr dünnen, zusammenhängenden Sauerstoff - bzw. Oxidschicht
verursacht. Da diese Schutzschicht sehr labil ist, wird die Passivierung des Eisens durch Erschütterung
aufgehoben und das Metall verhält sich wieder unedel.
36. Versilbertes Glas
Geräte: 1 Rundkolben (250 ml), 2 braune Flaschen, 1 weites Becherglas, Dreifuß, Bunsenbrenner,
Asbestdrahtnetz, Stativmaterial, Filtriermaterial, Thermometer
Chemikalien: Silbernitrat, verd. Ammoniaklösung, Seignettesalz (Kaliumnatriumtartrat), dest. Wasser, konz.
Salzsäure, Kaliumdichromat
Vorbereitende Arbeiten:
a) Folgende Lösungen werden hergestellt:
Lsg.. A:
Man löst 2,5 g Silbernitrat in 125 ml dest. Wasser und gibt tropfenweise soviel verd.
Ammoniaklösung hinzu, bis der anfänglich auftretende Niederschlag. sich wieder
auflöst. 125 ml dieser Lösung werden in eine braune Flasche gefüllt.
Lsg. B:
Man bringt 250 ml dest. Wasser zum Sieden und löst darin zunächst 0,5 g Silbernitrat
und dann 0,4 g Seignettesalz. Man filtriert die Lösung heiß und füllt 125 ml in eine
braune Flasche.
b) Damit das Silber gut haftet und sich gleichmäßig niederschlägt, muß der Rundkolben sorgfältig gereinigt
werden. Zu diesem Zweck gibt man in das Glasgefäß einige ml konz. Schwefelsäure, fügt eine Spatelspitze
Kaliumdichromat hinzu und erwärmt unter vorsichtigem (!) Umschütteln auf etwa 50°C. Nach einiger Zeit
schüttet man die Lösung weg und spült den Kolben zunächst mit Leitungswasser, dann mit dest. Wasser gut aus.
c) Versuchsaufbau bau Nach Abb. 13, das Wasser im Becherglas wird auf 70-80°C erhitzt.
Durchführung: Man gibt Lsg. A und Lsg. B gleichzeitig in den Rundkolben, den man dann für ca. 60 Sekunden
in das heiße Wasser taucht.
Ergebnis: Die Innenseite des Rundkolbens überzieht sich vollständig mit einer spiegelnden Silberschicht.
Hinweis: Der Rundkolben läßt sich mit konz. Salpetersäure reinigen (Abzug!), das Silber wird dabei wieder zu
Silberionen oxidiert und löst sich auf.
Erläuterung: Die ammoniakalische Silbernitratlösung ist durch das Seignettesalz zu metallischem Silber
reduziert worden.
38. Rote Stichflamme
Geräte: 2 Präparategläser, Asbestpappe, Pipette, Blatt Papier
Chemikalien:
Kaliumchlorat, Zucker, Strontiumnitrat, konz. Schwefelsäure
Vorbereitende Arbeiten: Die beide Präparategläser werden folgendermaßen gefüllt:
Glas A: 5 g Kaliumchlorat
Glas B: 5 g Zucker und 5 g Strontiumnitrat
Durchführung: Der Inhalt der beiden Gläser wird auf einem Blatt Papier vorsichtig (!) durch ineinander schütten
(nicht durch verreiben) vermischt und dann auf einer Asbestplatte zu einem Kegel gehäuft. Mit der Pipette läßt
man auf die Spitze des Kegels einen Tropfen konz. Schwefelsäure fallen.
Ergebnis:
Es entsteht eine rote Stichflamme.
Hinweis:
Dieser Versuch muß unter dem Abzug durchgeführt werden.
Erläuterung: Schwefelsäure setzt aus dem Kaliumchlorat Chlorsäure in Freiheit:
KClO3 + H2SO4→ HClO3 + KHSO4.
Unter Einwirkung der konz. Schwefelsäure zerfällt die Chlorsäure: 3 HclO3 → HClO4 + H2O +2 ClO2.
Das dabei entstehende Chloroxid ist eine sehr unbeständige Verbindung, die bei Erwärmung oder Berührung
mit brennbaren Substanzen in Sauerstoff und Chlor zerfällt.
Die Zündung der vorliegenden Mischung wird durch Chloroxid verursacht. Die dabei entstehende Verbrennungswärme sorgt für die Fortpflanzung der Reaktion. Das beigemischte Strontiumsalz verleiht der Flamme
die karminrote Farbe.
Hinweise zum Arbeiten mit Kaliumchlorat
Kaliumchlorat gehört zu den Giften der Abteilung 3 des Giftgesetzes, wird allerdings nach den Arbeitsschutzrichtlinien in Schulen wie Gift 1 behandelt. Wegen seiner oxidativen Wirkung ist es für den Blutfarbstoff
gefährlich - ca. 10 g können für einen Erwachsenen tödlich wirken.
Mit leicht entzündlichen Stoffen (z. B. Staub) ist es hoch explosiv. Schon durch Stoß oder Schlag können
Explosionen ausgelöst werden. Daher sollte man nur analysenreine Substanz verwenden. Bei der Herstellung
von Gemischen aus Kaliumchlorat und leicht entzündlichen Stoffen ist folgendes zu beachten:
-
nur kleine Mengen mischen
nicht mir harten Gegenständen mischen (z. B. Spatel), sondern das Mischen am besten durch
mehrmaliges Umschütten auf Papier vornehmen
unbedingt Schutzbrille tragen
Schüler durch Schutzscheibe sichern
39. Feuer ohne Streichholz
Geräte: Asbestpappe, Pipette, Schutzbrille
Chemikalien: Chrom(Vl)-oxid, Äthanol
Vorbereitende Arbeiten: Man gibt eine Spatelspitze trockenes Chrom(Vl)oxid auf die Asbestpappe. Die Pipette
wird mit etwas Äthanol gefüllt.
Durchführung: Man tropft vorsichtig 1 2 Tropfen Äthanol auf die roten Kristalle.
Ergebnis: Es entsteht sofort eine Stichflamme.
Hinweise:
a) Schutzbrille und Schutzscheibe verwenden; nur mit kleinen Mengen arbeiten!
b) Das ätzend wirkende Chrom(Vl)-oxid ist giftig, 2 g können tödlich wirken.
Erläuterung: Chrom(Vl)-oxid ist ein äußerst kräftiges Oxidationsmittel. Seine Oxidationswirkung reicht aus,
um den leicht brennbaren Äthylalkohol zu entzünden.
4CrO3 +C2H5OH → 2Cr2O3 + 2CO2 + H2O
40. Selbstentzündung durch Wasser
Geräte: 2 Präparategläser, Asbestpappe
Chemikalien: Zinkstaub, Ammoniumnitrat, Ammoniumchlorid, Bariumnitrat, Wasser
Vorbereitende Arbeiten: In die beiden trockenen Präparategläser gibt man jeweils folgende Substanzen:
Glas A: 4 g Zinkstaub
Glas B: 4 g Ammoniumnitrat, 1 g Ammoniumchlorid und 0,5 g Bariumnitrat
Durchführung: Der Inhalt der beiden Gläser wird vereinigt und durch Schütteln gut vermischt. Die Mischung
schüttet man auf die Asbestpappe und bespritzt sie (z. B. durch Schütteln der nassen Hand) mit einigen Tropfen
Wasser.
Ergebnis: Aus der Mischung schießt eine Flamme empor. Hinweise: a) Der Versuch ist unter dem Abzug
durchzuführen. Schutzbrille tragen!
Erläuterung:
Die Zündung des Gemischs wird durch die bei der Oxidation des feuchten Zinkstaubs
entstehende Wärme hervorgerufen. Als Reaktionsprodukte entstehen u. a. Zinkoxid und Ammoniak. Das
Bariumsalz färbt die Flamme grün.
b) Ein Gemisch von pulverisiertem Kaliumpermanganat (1 g) und pulverisiertem Zucker (1 g) läßt sich durch
einige Tropfen Wasser zur Entzündung bringen.
c) Ein Gemisch aus Na2O2 (20 g) und trockenem Sägemeh! (etwa das halbe Volumen) verbrennt lebhaft, wenn
man mit der Pipette einige Tropfen Wasser zufügt (Abzug, Schutzbrille). Diese Mischung darf aber auf keinen
Fall vorbereitet und aufgehoben werden, da sie sich an feuchter Luft nach einiger Zeit von selbst entzündet.
Na2O2 ist ein sehr hygroskopisches Pulver, das sich in Wasser unter lebhafter Sauerstoffentwicklung löst:
Na2O2 + H2O → 2 NaOH + ½O2
41. Gefährliches Filterpapier
Geräte: Reagenzglas, Halter, Filterpapier, Asbestpappe, Stativmaterial
Chemikalien:
Weißer Phosphor, Schwefelkoh!enstoff
Vorbereitende Arbeiten: Die Chemikalien und Geräte werden bereitgestellt.
Durchführung: Ein linsengroßes Stück weißer Phosphor wird in etwas Schwefelkohlenstoff gelöst. Mit einem
Teil dieser Lösung tränkt man ein Filterpapier, das dann über ein Stück Asbestpappe aufgehängt wird.
Ergebnis: Nach einiger Zeit fängt das Filterpapier an zu brennen. Führt man diesen Versuch im Dunkeln durch,
so leuchtet das Filterpapier zunächst, bevor es sich entzündet.
Hinweis: Vorsicht beim Arbeiten mit Schwefelkohlenstoff! Bereits bei gewöhn- licher Zimmertemperatur
verdunstet es außerordentlich stark. Da seine Dämpfe ca. zweieinha!bmal so schwer wie Luft sind, sinken sie zu
Boden und können dort weiterkriechen. Der Dampf ist sehr leicht entzündbar (ein heißer Glasstab über
Schwefelkohlenstoff gehalten führt schon zur Entzündung). Schwefel- kohlenstoff gehört zu den Giften der
Abteilung 3 des Giftgesetzes. Es ist ein Atem- und Hautgift und ruft akute und chronische Vergiftungen hervor,
in deren Gefolge Sehstörungen bis zur Erblindungen beobachtet werden. Weißer Phosphor ist ebentalls sehr
giftig.
Beim Arbeiten mit diesen Substanzen sollte man folgendes beachten:
unter dem Abzug arbeiten
alle Flammen löschen
kleinste Mengen benutzen
mit Schwefelkohlenstoff, auf Grund der Brand- und Explosionsgefahr, aber auch weil es biologisch
nicht abbaubar ist, nicht in den Abguß geben sondern mit saugfähigem Brennmaterial unter dem Abzug
verbrennen.
Erläuterung: Weißer Phosphor ist im Schwefelkohlenstoff gut löslich. Ein mit einer derartigen Phosphorlösung
getränktes Stück Papier enthält nach dem Verdunsten des Schwefelkohlenstoffs Phosphor in fein verteilter
Form. In diesem fein verteilten Zustand neigt der Phosphor sehr leicht zur Selbstentzündung.
- Hinweise zum Arbeiten mit weißem Phosphor:
a)
Eigenschaften des weißen Phosphors:
Der weiße Phosphor stellt eine der drei Modifikationen des Phosphors dar. Er bildet eine wachsweiche,
durchscheinende Masse von charakteristischem Geruch (knoblauchartig), die in Wasser schwer und in
Schwefelkohlenstoff gut löslich ist. Seine Dichte bei 20°C beträgt 1,82 g cm-3, der Schmelzpunkt liegt
bei 44°C und der Siedepunkt bei 28O°C.
Weißer Phosphor zeigt eine große Reaktionsfähigkeit: in kompakten Stücken entzündet er sich schon
wenig oberhalb von 5O°C, in fein verteiltem Zustand allerdings schon bei Zimmertemperatur. Sein
charakteristisches Leuchten im Dunkeln beruht auf der Oxidation der von ihm ständig spurenweise
abgegebenen Dämpfe durch den Luftsauerstoff.
Weißer Phosphor ist äußerst giftig. Er gehört zu den Giften der Abteilung ! des Giftgesetzes. Die
tödliche Dosis liegt zwischen 50-500 mg; sie kann durch Mund, Wunden und auch intakte Haut in den
Körper gelangen. Das dauernde Einatmen der Phosphordämpfe führt zu chronischen Knochenschäden.
Auf Grund seiner großen Giftigkeit und seiner leichten Entzündbarkeit werden im folgenden einige
Hinweise gegeben, die beim Arbeiten mit Phosphor zu beachten sind.
b)
-
Arbeiten mit weißem Phosphor
unter dem Abzug arbeiten
weißen Phosphor nie mit bloßen Händen berühren Phosphorstangen nur unter Wasser schneiden
(Vorsicht vor Verspritzen von weißem Phosphor oder des giftigen Absperrwassers)
-
-
brennenden Phosphor nicht mit Wasser, sondern mit Sand löschen
Lösungen von weißem Phosphor in Schwefelkohlenstoff jeweils frisch zubereiten und unter keinen
Umständen aufbewahren
Reste von weißem Phosphor und Phosphorlösungen unmittelbar nach dem Gebrauch durch Abbrennen
unter dem Abzug unschädlich machen.
mit weißem Phosphor in Berührung gekommene Metallgeräte sind nach Gebrauch auszuglühen.
mit weißem Phosphor in Berührung gekommene Glasgeräte sind nach Gebrauch mehrmals mit konz.
Salpetersäure zu spülen und dann mit einer 5 %igen Kupfersulfat- oder Kaliumpermanganatlösung
nachzuspülen.
Phosphorbrandwunden sofort mit reichlich Wasser und einer 5 %igen Natriumhydrogencarbonatlösung
oder einer 2%igen Natriumcarbonat- lösung oder einer 1 %igen Kupfersulfatlösung spülen.
nach dem Arbeiten sind die Hände gründlich zu reinigen.
43. Schwebende Flamme
Geräte: Rundkolben, Glasrohr (Länge ca. 1 m), Stativmaterial, Bunsenbrenner, Dreifuß, Asbestdrahtnetz
Chemikalien: weißer Phosphor, Wasser
Vorbereitende Arbeiten: Versuchsaufbau nach Abb. 14; in den mit Wasser gefüllten Rundkolben gibt man ein
halberbsengroßes Stück weißen Phosphor.
Durchführung: Man verdunkelt den Raum und erhitzt den Kolbeninhalt bis zum Sieden.
Ergebnis: Sobald die Flüssigkeit siedet, steigt im Glasrohr eine kleine, gelb- grüne Flamme langsam nach oben
und erscheint schließlich über dem oberen
Ende des Rohres. Unterbricht man die Wärmezufuhr, so fällt die Flamme in den Rundkolben zurück. Dieser
Vorgang läßt sich durch entsprechende Wärmeregulierung sehr oft wiederholen.
Wird der Raum derart abgedunkelt, daß man die Versuchsapparatur nicht sieht (Pilzheizhaube benutzen), so
erhält man den Eindruck, als ob die aus dem ,,Nichts" entstandene Flamme frei im Raum hoch und runter
schwebt.
Hinweis: Der Versuch wird unter dem Abzug durchgeführt (siehe dazu ,,Hinweise zum Arbeiten mit weißem
Phosphor", Versuch 41).
Erläuterung: Auf Grund des großen Dampfdruckes des weißen Phosphors verflüchtigt er sich leicht mit
Wasserdampf. An der Stelle des Glasrohres, an der sich der Wasserdampf kondensiert, kommt der weiße
Phosphor mit der von oben eindringenden Luft in Berührung. Der Phosphor wird an dieser Stelle des Rohres
oxidiert. Die Oxidation erfolgt in zwei Stufen. Zunächst entsteht Phosphortrioxid (P2O3), das dann unter
Lichtabgabe (Chemilumineszenz) zu Phosphorpentoxid (P2O5) weiteroxidiert wird. Im Dunkeln läßt sich daher
an dieser Stelle eine Leuchterscheinung beobachten.
46.Kalte Flamme
Geräte: Glaskolben (1 l), gewinkeltes Glasrohr, Gummischlauch
Chemikalien: Weißer Phosphor, Kohlendioxid, Wasser
Vorbereitende Arbeiten: Die benötigten Geräte und Chemikalien werden bereitgestellt. Aus praktischen
Gründen benutzt man Kohlendioxid aus der Stahlflasche.
Durchführung: Versuchsaufbau nach Abb. 15
In den Glaskolben gibt man ein kleines Stückchen Phosphor und soviel Wasser, daß der Phosphor nicht völlig
bedeckt ist. Nachdem man den Kolben mit mäßig warmem Wasser etwas erwärmt hat, löscht man das Licht und
leitet in einem langsamen Strom Kohlendioxid in das Glasgefäß.
Ergebnis: Nach einigen Sekunden tritt aus der Halsöffnung des Kolbens eine fahle Flamme. (Die Flamme ist so
kalt, daß man ohne Gefahr die Hand hineinhalten kann. Danach Hände sorgfältig waschen!) Stoppt man nun die
CO2-Zufuhr, so fällt die Flamme in den Kolben zurück und ruft ein schlierenförmiges Leuchten hervor.
Hinweise:
a) Siehe ,,Hinweise zum Arbeiten mit weißem Phosphor" Versuch 41.
b) Um zu demonstrieren, daß die Flamme kalt ist, sollte man aus Sicherheitsgründen nicht die
Hand, sondern besser ein Stück Papier benutzen.
c) Da die Phosphorflamme aus weiter Entfernung nicht gut sichtbar ist, ist dieser Versuch nur
für einen kleineren Zuschauerkreis geeignet.
Erläuterung: Bei der Lumineszenz des weißen Phosphors leuchtet nicht der feste Phosphor selbst, sondern der
von ihm spurenweise abgegebene Dampf, der oxidiert wird (siehe Erläuterung zu Versuch 43). Leitet man nun
Kohlendioxid in den Kolben, so wird die das Leuchten hervorrufende Oxidation des Phosphordampfes
unterbunden und das Gefäß kann sich vollständig mit dampfförmigem Phosphor anfüllen. An der Halsöffnung
des Glaskolbens kommt dieser Dampf mit dem Luftsauerstoff in Berührung und leuchtet.
50.
Phosphorlampe
Geräte: Wasserstrahlpumpe, Vakuumschlauch (ca. 1,5 m), Rundkolben. doppelt durchbohrter Stopfen,
pneumatische Wanne, Einweghahn
Chemikalien: Schwefelkohlenstoff, weißer Phosphor
Durchführung I: Ein Stück Phosphor wird in Schwefelkohlenstoff gelöst. Man schwenkt diese Lösung in dem
Rundkolben, so daß über die Hälfte der Glas- wand von der Lösung benetzt wird. Gleichzeitig schließt man die
Wasserstrahlpumpe an, so daß in etwa 5 Minuten das Lösungsmittel verdunstet ist. Nachdem der Raum
verdunkelt ist, läßt man bei geringer Saugwirkung der Pumpe langsam Luft in die ,,Lampe" eintreten. Ein
Glashahn wird des besseren Regulierens wegen vorgeschaltet.
Ergebnis I: Der Rundkolben leuchtet soweit er von dem weißgrauen Überzug des Phosphors bedeckt ist grün
auf.
Durchführung II: Der Glashahn wird geschlossen bzw. die Pumpe abgestellt.
Ergebnis II: Der Leuchteffekt verschwindet. Man kann auf diese Weise die Lampe beliebig ,,an - und
ausknipsen".
Hinweise:
a) Siehe Hinweise zum Arbeiten mit weißem Phosphor, Versuch 41.
b) ,,Es empfiehlt sich mit der Lampe unter Wasser zu bleiben, damit die- geringe Oxidationswärme sofort
abgeleitet wird, was der Lebensdauer der Lampe- zugute kommt. In diesem Fall muß man eine geräumige
pneumatische Wanne bereitstehen haben."
Erläuterung.' Siehe ,,Erläuterung", Versuch 43 und 65.
51.
Fliegendes Feuer
Geräte: Bunsenbrenner, Glasrohr
Chemikalien: Bärlappsporen (Semen Lycopodii )
Vorbereitende Arbeiten: Ein Glasrohr wird spitz ausgezogen und locker mit Bärlappspore-n gefüllt.
Durchführung: Man hält die Spitze des Glasrohres horizontal nahe an die Flamme eines Bunsenbrenners und
bläst die Bärlappsporen durch die Flamme.
Ergebnis: Die Bärlappsporen entzünden sich und es entsteht ein fliegendes Feuer, das manchmal 1 bis 1,5 m
lang ist, aber bald wieder verschwindet.
Hinweise:
a) In der Nähe des Versuches dürfen sich keine leichtentzündlichen Stoffe befinden. Auch sollte- das Glasrohr
nicht allzu kurz sein, damit der Experimentator nicht gefährdet wird.
b) Der Versuch sollte vorher ausprobiert werden. Denn die günstigste Form des Blasrohres und die nötige
Menge der Sporen hängt von der Lungenkraft des Experimentators ab. Man achte darauf, daß die Sporen
hinreichend trocken sind. Eventuell müssen Sie im Exsiccator getrocknet werden.
Erläuterung: Dicht gepackte Bärlappsporen brennen verhältnismäßig schlecht. Nur im Gemisch mit
Luftsauerstoff können die etherischen, gut brennbaren Öle der Bärlappsporen blitzartig verbrennen.
53. Weiterschießen einer Kerzenflamme
Geräte: Schreckschußpistole, 2 Kerzenhalter
Chemikalien:
weißer Phosphor, 2 Kerzen
Vorbereitende Arbeiten:
a) Der aus dem Wachs herausragende Docht einer Kerze wird fest mit feuchtem, weißen Phosphor geknetet.
Damit sich der Docht nicht vorzeitig entzündet, darf die Kerze erst kurz vor der Vorführung präpariert werden.
b) Die beiden Kerzen werden in einem Abstand von etwa 50 bis 30 cm voneinander aufgestellt. Die normale
Kerze wird entzündet.
Durchführung: Aus einem Abstand von 0,5 bis 1 m zielt man durch die Flamme der ersten Kerze auf den mit
Phosphor präparierten Docht der zweiten Kerze und drückt ab.
Ergebnis:
Die erste Kerze erlischt und die zweite entzündet sich.
Hinweise:
a) Siehe ,,Hinweise zum Arbeiten mit weißem Phosphor" Versuch 41.
b) Mit der Schreckschußpistole nie auf Nahesitzende zielen, sondern immer vom Publikum weg schießen.
c) Man achte darauf, daß der Phosphor fest mit dem Docht verknetet ist und nicht durch die Gewalt des
Mündungsfeuers vom Docht gerissen und auf den Boden geschleudert wird.
d) Der vorliegende Versuch läßt sich folgendermaßen verändern: Mit Phosphorpräparierte Kerzen werden auf
den Experimentiertisch gestellt. Nach einiger Zeit entzünden sich die Kerzen von selbst.
Erläuterung: Die heißen Verbrennungsgase der Schreckschußpistole entzünden den weißen Phosphor.
54.
Funkengarbe
Geräte: Trichter mit Filter, Reagenzgläser, Reagenzglasständer, Brenner, Reagenzglashalter' Spatel, Watte
Chemikalien: Eisen(II)-Ammoniumsulfat (Mohrsches Salz), Ammoniumethandiatlösung (10% ige
Ammoniumoxalatlösung).
Vorbereitende Arbeiten: Man löst einen Spatel Eisen(II)-Ammoniumsulfat in 10 ml Wasser, versetzt mit
l0%iger Ammoniumethandiatlösung und erwärmt etwas. Es bildet sich ein schwachgelber Niederschlag von
Eisen(II)-ethandiat. Der Niederschlag wird abfiltriert und an der Luft bei Raumtemperatur getrocknet.
Frühestens am nächsten Tag wird der (gut getrocknete) Niederschlag in ein trockenes Reagenzglas gegeben, mit
einem Wattebausch verschlossen und für die Vorführung bereit gehalten.
Durchführung: Das mit einem Wattebausch verschlossene Reagenzglas wird erhitzt. Nach beendeter Zersetzung
des Eisen(II)-ethandiats entfernt man den Wattebausch und schleudert das schwarze Glühprodukt, das noch
muß, heraus.
Ergebnis:
Es entsteht eine Funkengarbe.
Hinweis:
Nicht gegen Personen oder brennbare Gegenstände schleudern!
Erläuterung:
Aus Eisen(II)-sulfat und Ammoniumethandiat entsteht ethandiat:
Beim Erhitzen zerfällt das Eisen(Il)-ethandiat, wobei sich pyrophores Eisen bildet:
Bei Berührung mit dem Sauerstoff der Luft bildet das pyrophore Eisen unter Aufglühen Eisen(III)-oxid:
4 Fe +3 O2 → 2 Fe2O3
55. Violetter Rauch
Geräte: Abdampfschale, Pipette, Glasstab
Chemikalien: Jodpulver, Magnesiumpulver, Wasser
Durchführung: Magnesium- und Jodpulver werden in eine Abdampfschale gegeben und mit einem Glasstab gut
miteinander vermischt. Zu der Mischung gibt man ein paar Tropfen Wasser.
Ergebnis: Es erfolgt eine heftige Reaktion, bei der rotvioletter Rauch (Joddampf) gebildet wird.
Hinweis: Der Versuch muß unter dem Abzug durchgeführt werden! Jod ist bei gewöhnlicher Temperatur ein
festes Element, das erst bei 184 °C siedet. Aber schon bei Zimmertemperatur ist es merklich flüchtig. Seine
Dämpfe sind giftig und führen zu Entzündungen der Nasen- und Augenschleimhäute. Eingenommen wirkt es
stark giftig.
Erläuterung: Die heftige Reaktion beruht auf Salzbildung:
Mg + J2 → MgJ2 + Energie
Die bei dieser Reaktion freiwerdende Energie verdampft einen Teil des Jods.
56.
Rauchringe
Geräte: 2 Waschflaschen. Handgebläse, Schlauch, Pappschachtel, Pergament, Klebstoff
Chemikalien: halbkonz. Salzsäure, halbkonz. Ammoniaklösung
Vorbereitende Arbeiten:
a) Versuchsaufbau nach Abb. 17
b) Man schneidet aus dem Boden einer Pappschachtel eine Kreisscheibe von etwa 3 cm Durchmesser. Der
Deckel der Schachtel wird durch ein Stück Pergament ersetzt (mit Klebstoff befestigen)
Durchführung: Man drückt mit Hilfe des Handgebläses Luft durch die beiden Waschflaschen und erzeugt
dadurch einen NH4Cl-Rauch, den man durch die kreisrunde Öffnung in die Pappschachtel leitet.
Man schnippt mit dem Finger gegen die Rückwand der rauchgefüllten Pappschachtel.
Ergebnis: Aus der Öffnung schießen weiße Rauchringe hervor. Stellt man vor die Öffnung eine brennende
Kerze, so erlischt Sie, wenn ein Rauchring den Docht berührt. Die Kerze wird auch dann zum Erlöschen
gebracht, wenn die Schachtel leer ist und nur noch unsichtbare Wirbelringe der Luft die Kerzenflamme
erreichen.
57.
Künstlicher Nebel
Geräte: Abdampfschale, Spatel, Waage, Meßzylinder, Asbestpappe
Chemikalien: Zinkpulver, Tetrachlormethan, Zinkoxid, Schwefel, Kaliumnitrat, Salpeterpapier
Vorbereitende Arbeiten:
a) In einer Abdampfschale verrührt man 10 g Zinkpulver mit 15 ml Tetrachlormethan und gibt dann so viel
Zinkoxid oder Kieselgur (dient als Saugmaterial) zu, bis eine teigige Masse entsteht.
b) Zur Entzündung dieses Gemischs benötigt man einen Streifen Salpeter
Vorwort zur 7. Auflage
Faszinierende Experimente zeigen die Fülle der Möglichkeiten auf, Chemie in all ihrer Mannigfaltigkeit zu
erleben. Im Chemieunterricht entfalten solche Experimente eine beachtenswerte Motivationskraft und regen an,
sich mit Chemie zu beschäftigen. Die in diesem Buch vorgestellten Experimente sind bis auf wenige
Ausnahmen Demonstrationsexperimente, die vom Lehrer oder einem erfahrenen Experimentator vorgeführt
werden müssen. Es läßt sich nicht vermeiden, daß faszinierende Experimente mit Substanzen durchgeführt
werden, die im Sinne der auch für Schule und Hochschule gültigen Gefahrstoffverordnung als giftig, ätzend,
leicht entzündlich oder sogar mit Verdacht auf Krebserregung eingestuft werden. In der neuen Auflage dieses
bewährten Buches wurden deshalb die Konsequenzen aus der Gefahrstoffverordnung eingearbeitet, um den
Experimentator vor Schaden zu bewahren und um die Umwelt zu schonen. Im einzelnen wirkt sich das wie folgt
aus:
1. Neben der jeweiligen Versuchsbeschreibung im Buch sind die für die verwendeten Chemikalien
erforderlichen Gefahrensymbole dargestellt. Dieses Symbole enthalten auch die entsprechenden
Kennbuchstaben.
2. Im Anhang sind alle nach Versuchen geordneten Chemikalien mit ihren R-und S-Sätzen aufgeführt. Es ist
deshalb sinnvoll, vor der Durchführung eines Versuchs, diese Sätze zu lesen und deren Bedeutung in einer Liste
der R- und S-Sätze nachzulesen.
3. Für jeden Versuch findet man bei der Versuchszusammenstellung im Anhang einen Entsorgungsvorschlag,
wie er sich aus der Gefahrstoffverordnung ergibt. Es werden sechs Gefäße genannt, in denen die Substanzen
nach dem Versuch aufgenommen werden. Lesen Sie bitte immer nach Beendigung eines Versuchs den
Entsorgungshinweis nach. Wenn kein besonderes Gefäß aufgeführt wird, so ist die Entsorgung über den
normalen Ausguß oder in einem Papierkorb vorzunehmen.
Es gibt einige Exprimente, die mit besonderes gefährlichen Stoffen durchgeführt werden. Aber auch diese
Experimente sind mit den nötigen Vorsichtsmaßnahmen als Lehrerversuch im Abzug möglich. Es wird auch
empfohlen, das Benzol (Versuch 58) durch das harmlosere Toluol zu ersetzen.
Besondere Vorsicht ist bei den Versuchen mit weißem Phosphor (Versuche 41, 43, 46, 53, 65), mit Quecksilber
und Quecksilbersalzen (Versuche 1, 6, 10, 35, 68), mit Kohlenstoffdisulfid (Versuche 50, 65) und mit
Tetrachlormethan (Versuche 31, 57) geboten.
Prof. Dr. H. Schmidtkunz, im Herbst 1990
Einleitung
Die Umwelt des in der heutigen Zivilisation lebenden Menschen ist zu einem großen Teil durch die Ergebnisse
chemischer Forschung geprägt. Aufgabe des Chemieunterrichtes ist es nun, dem Schüler die Einsichten,
Kenntnisse und Fertigkeiten zu vermitteln, die ihm helfen, Erscheinungen seiner Umwelt und späteren
Arbeitswelt zu deuten und zu erklären. Um dieser Aufgabe im Unterricht nachkommen zu können, ist es
wichtig, beim Schüler Interesse und Aufgeschlossenheit für das Fach Chemie zu wecken und zu fördern.
Für jeden Chemielehrer ergibt sich oft die Gelegenheit, sei es die erste Chemiestunde zu Anfang des Schuljahres
oder sei es bei Schulfesten, Karneval und anderen ähnlichen Anlässen, mit der Vorführung ausgefallener,
verblüffender Versuche beim Schüler Verwunderung und Neugier hervorzurufen und die Freude an der Chemie
ein wenig anzufeuern.
Die vorliegenden Ausführungen sollen eine Hilfestellung zur Gestaltung derartiger Stunden bieten. In ihr
werden Versuche beschrieben, die auf Grund ihres effektvollen und unerwarteten Verlaufs einen entspannten,
unterhaltsamen Umgang mit der Chemie ermöglichen. Bei diesen Versuchen kommt es nicht so sehr auf die
chemischen Tatbestände an, sondern darauf, daß durch ihren eindrucksvollen Ablauf beim jungen Menschen
Begeisterung und Interesse für die Experimentalchemie hervorgerufen werden. Die Motivationswirkung dieser
Schauversuche für das Fach Chemie macht natürlich einen gut geplanten und interessant gestalteten Unterricht
nicht überflüssig, sondern Sie stellt statt dessen eine Chance dar, die im normalen Chemieunterricht geschickt
aufgegriffen und ausgebaut werden sollte.
Die beschriebenen Experimente sind für sich schon spektakulär, allerdings läßt sich durch entsprechende
Auswahl und Anordnung der Versuche, geeignete Kostüm- und Raumdekoration und gekonntes Vorführen die
Wirkung der Experimente noch bedeutend steigern. Von der Darstellung einer derartigen "Vorführung" wurde
hier abgesehen. Zum einen würde Sie über den Rahmen der vorliegenden Arbeit hinausgehen, zum anderen
erscheint eine solche Darstellung nicht zweckmäßig: die schulischen Gegebenheiten
(Verdunkelungsmöglichkeiten, Ausstattung an Chemikalien und Geräten, Vorhandensein eines Abzugs, Zahl
der Schüler, zur Verfügung stehende Zeit. . .) sind überall verschieden und somit hätte eine Zusammenstellung
der Versuche zu einer zusammenhängenden, dezidiert beschriebenen "Vorführung" keine allzugroße praktische
Bedeutung. Aus diesem Grund werden in der vorliegenden Arbeit die Versuche einzeln und unabhängig
voneinander vorgestellt und beschrieben. Dies bietet die Möglichkeit, entsprechend der jeweiligen Situation die
passenden Experimente selbständig auszusuchen, zusammenzustellen und gegebenfalls humorvoll zu
kommentieren.
Bei manchen Versuchen entsteht eine heftige Reaktion oder es ergeben sich giftige Stoffe. Auf die
Gefährlichkeit des Experimentierens wird dann besonders hingewiesen. Es muß immer Grundsatz für den
Experimentator sein, sich genau und gewissenhaft an die Versuchsvorschriften zu halten und die
Vorsichtsmaßnahmen zu beachten. Eine Schutzbrille sollte immer getragen werden.
Die einfache Aneinanderreihung der einzelnen Versuche führt zu einer nüchternen Darstellungsweise, die der
Absicht der beschriebenen Experimente, nämlich Freude und Interesse an Chemie zu vermitteln, nicht gerecht
wird. Deshalb wurden an geeigneten Stellen Bilder, die den Effekt des entsprechenden Versuches in
humorvoller Weise wiedergeben, eingefügt. Sie dienen der Auflockerung des Textes und sollen zur Erheiterung
und auch Neugier des Lesers beitragen.
Die Bilder wurden von Frau Barbara Krämer angefertigt, der auch an dieser Stelle herzlich gedankt sei. Auf
dem ersten Bild sieht man wie ein zu einem Chemiker umgewandeltes Reagenzglas versucht, sachkundig und
mit großem Geschick, eine Suppe zu salzen.
Die einzelnen Versuche sind in sich abgeschlossen dargestellt. Um das Nachvollziehen eines Versuches zu
erleichtern, wurde die Versuchsbeschreibung nach einem bestimmten Schema vorgenommen:
Gerate: Hier werden die zur Versuchsdurchführung benötigten Geräte (und Chemikalien) aufgezählt. Diese
Aufzählung dient zunächst einer ersten Übersicht, inwieweit der vorliegende Versuch überhaupt mit den
vorhandenen Geräten (und Chemikalien) durchgeführt werden kann. Daneben trägt Sie aber auch zu einer
Erleichterung der Versuchsvorbereitung bei.
Chemikalien: s. o.—Geräte
Vorbereitende Arbeiten: Dieser Abschnitt enthält genaue Anweisungen zur Vorbereitung des Versuches, wie
etwa die Beschreibung des Versuchsaufbaus oder die Herstellung benötigter Lösungen. Die Mengenangaben
wurden überall genau festgelegt, so daß bei Einhaltung dieser Angaben der Versuch gelingt.
Durchführung: Die Demonstration des Experimentes wird beschrieben.
Ergebnis: Die Versuchsdurchführung soll derart gestaltet sein, daß der hier beschriebene Effekt des Versuches
auch allgemein zur Geltung kommt.
Hinweise: Die Durchführung einiger Versuche ist nicht ganz gefahrlos. Es wird daher auf die zu beachtenden
Gefahrenquellen hingewiesen. Die aufgeführten Gefahrenhinweise erheben allerdings keinen Anspruch auf
Vollständigkeit — gewisse Erfahrungen im Experimentieren werden vorausgesetzt. Da einige gefährliche
Chemikalien (z.B. Quecksilber, Kaliumchlorat) in mehreren Versuchen vorkommen, werden die bei ihrem
Umgang notwendigen Vorsichtsmaßnahmen in einem gesonderten Abschnitt behandelt, auf den dann jeweils
verwiesen wird.
Daneben finden sich evtl. in diesem Abschnitt auch noch Hinweise anderer Art, wie etwa Angaben von
Bezugsquellen, Abänderungen des vorliegenden Versuches u. ä.
Erläuterung: Soweit es in diesem Rahmen sinnvoll ist, wird auf die den Versuchen zu Grunde liegenden
chemischen Tatbestände eingegangen.
88.Rezepte
Die Vorführung der beschriebenen Experimente ist mit viel Arbeit und Konzentration verbunden. Die beiden
letzten Versuche dienen daher zur Stärkung des erschöpften Experimentators. Es versteht sich von selbst, daß
nur mit absolut reinen Chemikalien und Geräten gearbeitet werden darf.
Partieller thermischer Abbau von α-D-Glucapyrnnasyl-ß- D-Fructofuranosid (Saccharose) unter Einschluß
gesättigter Triglyceride (Speisefett)
Geräte: Gasbrenner, Dreifuß mit Asbestdrahtnetz bzw. Tondreieck, Porzellanschale, Tiegelzange, Glasstab,
Aluminiumfolie, Schutzbrille
Chemikalien: Gemisch gesättigter Triglyceride, α-D-Glucopyranosyl-ß-Dfructofuranosid (Zucker und Butter).
Vorbereitende Arbeiten: 5 g eines Gemisches gesättigter Triglyceride, dem die Vitamine A, D, E und F in
geringen Mengen beigegeben sind, werden in einer Porzellanschale auf dem Asbestdrahtnetz bzw. dem
Tondreieck mit der gerade noch leuchtenden Flamme des Gasbrenners unter ständigem Rühren (Porzellanschale
mit Tiegelzange festhalten) mit dem Glasstab bis zum Sieden erhitzt. (Vorsicht! Gefahr von Verbrennungen
durch Verspitzen!) Dann gibt man unter andauerndem Rühren 20 g α-D-Glucopyranosyl-ß-Dfructofuranosid
hinzu und erhitzt vorsichtig weiter, bis eine homogene, hellbraungefärbte Masse enstanden ist. (Verkohlung
vermeiden, gegebenenfalls Brenner vorher kurzzeitig entfernen). Der Brenner wird dann ausgestellt, die
Porzellanschale mit Hilfe der Tiegelzange vom Asbestdrahtnetz bzw. Tondreieck genommen und ihr Inhalt auf
ein in Form eines Backblechs gefaltetes Stück Aluminiumfolie gegossen.
Durchführung: Nach dem Erkalten des Reaktionsproduktes wird ein kleines Stück davon abgebrochen und
vorsichtig auf seinen Geschmack geprüft. Falls dieser nicht unangenehm erscheint, sollte das gesamte
Reaktionsprodukt redlich geteilt werden, um es dann einer weitern Reihe enzymatisch gesteuerter
Abbaureaktionen im Magen-Darm-Trakt zu unterwerfen.
Ergebnis: Der Experimentator ist nun gestärkt für das letzte Experiment.
Hinweis: Die Porzellanschale muß noch heiß sofort von allen Resten gründlich befreit werden, indem sie unter
fließendem Wasser ausgewaschen und anschließend abgetrocknet wird. Auch alle anderen Geräte, die mit der
Masse in Berührung gekommen sind (z. B. Glasstab, Tiegelzange) sind ebenso sorgfältig zu reinigen.
Partialthermolyse eines homogenisierten Triglycerid-saccharid-protein-gemischs Geräte: Dreituß mit
Asbestdrahtnetz, Gasbrenner, 400 ml Becherglas, Rührstab, Spatel, Aluminiumfolie, Kalandrierwalze, scharfe
Platte aus nichtoxidierendem Stahl;
Chemikalien: wasserhaltiges gesättigtes Triglyceridgemisch, α-D-Glucopyranosyl-ß-D-fructofuranosid,
lecithinhaltiges Lipoid-Protein-Gemisch, 4-Hydroxy-3-methoxybenzaldehyd-Saccharose-Gemisch,
Ammoniumhydrogencarbonat, Natriumchlorid, Polysaccharidgemisch aus Amylose und Amylopektin
Vorbereitende Arbeiten: Man erwärmt auf Dreifuß und Asbestdrahtnetz in einem 400 ml Becherglas mit dem
Gasbrenner 25 g einer 80%igen wäßrigen Emulsion gesättigter und vitaminierter Triglyceride gerade zum
Schmelzen, entfernt dann den Brenner und fügt unter ständigem Rühren nacheinander 25 g α-DGlucopyranosyl-ß-D-fructofuranosid, 1 Löffel eines stark lecithin- haltigen Lipoid-Protein-Gemischs, 100 mg
eines Gemisches von 4-Hydroxy- 3-methoxy-benzaldehyd mit Saccharose, 20 mg Ammoniumhydrogencarbonat, 5 mg Natriumchlorid sowie 50 g eines Polysaccharidgemischs von Amylose und
Amylopektin hinzu.
Wenn die Masse sehr zähflüssig geworden ist, wird sie vollständig dem Becher- glas entnommen und auf einem
30 mal 30 großen Stück Aluminiumfolie solange mechanisch bearbeitet-nötigenfalls spatelweise weiters
AmyloseAmylopektin-Gemisch zusetzen-, bis sie nicht mehr an der Unterlage haftet und zu einer maximal 0,5
cm dicken Folie kalandriert werden kann. Diese wird anschließend mit Hilfe von scharfen Platten aus
nichtoxidierendem Stahl durch Zerschneiden geformt und dann 10-15 min. lang bei 200°C im Trockenschrank
zur Reaktion gebracht. Alle verwendeten Geräte sind unterdessen mit Hilfe von Tensiden gründlich zu reinigen.
Durchführung: Nach dem Erkalten wird das Reaktionsprodukt einer Reihe enzymatisch gesteuerter Prozesse
unterworfen.
Ergebnis: Chemie ist eine schmackhafte Wissenschaft.
Hinweis: Um größere gesundheitliche Schäden zu vermeiden sollte man anschließend sofort gründlich die
Zähne putzen.
48. Bengalisches Feuer
Geräte:
2 Präparategläser, Porzellanscherbe, Salpeterpapier, Schutzbrille
Chemikalien:
Holzkohlenpulver, Schwefelblume, Strontiumnitrat, Kaliumchlorat
Vorbereitende Arbeiten:
a) Herstellung des Salpeterpapiers: siehe Versuch 6.
b) Die Präparategläser werden folgendermaßen gefüllt: Glas A: 3,5 g Kaliumchlorat Glas B: eine Mischung aus 1 g Holzkohlepulver, 11 g Schwefelblume
und 32 g Strontiumnitrat
Durchführung:
Der Inhalt der beiden Gläser wird vorsichtig (!) auf einem glatten Papier miteinander vermischt und dann kegelförmig auf das Ende eines ca. 10 cm langen
Salpeterpapierstreifens ausgeschüttet. Man löscht das Licht und entzündet den
Salpeterpapierstreifen.
Ergebnis:
Die Mischung brennt mit einer intensiv roten Flamme ab. Brenndauer: ca. 45
Sekunden
Hinweise:
a) Schon bei der Herstellung des Gemisches ist eine Schutzbrille zu tragen.
b) Das Gemisch nicht direkt mit dem Bunsenbrenner zünden - Explosions- und
Verbrennungsgefahr!
c) Siehe Hinweise zum Arbeiten mit Kaliumchlorat, Versuch 83.
d) Mischt man statt Strontiumnitrat 50 g Bariumnitrat unter das Gemenge, so zeigt
die Flamme eine fahlgrüne Färbung.
e) Verschiedene Flammenfärbungen lassen sich auch mit Alkohol und bestimmten
Salzzusätzen erreichen. Diese flammenfärbenden Zusätze werden in eine
Porzellanschale gegeben und mit Brennspiritus zu einer breiartigen Masse
verrührt und dann im Dunkeln entzündet. Dabei ergibt:
Indiumchlorid
Lithiumchlorid
blau
rot
Borsäure
Natriumchlorid
Zinkchlorid
Erläuterung:
grün
gelb
weiß
Da das Gemisch aus kräftigen Oxidationsmitteln (Chlorate, Nitrate) und Reduktionsmitteln (Schwefel, Kohlenstoff) besteht, brennt es nach dem Entzünden heftig
ab. Die rote Flammenfärbung wird durch das Strontiumsalz verursacht
49.
Blitze unter Wasser
Geräte:
Reagenzglas, Becherglas, Pipette, Stativmaterial
Chemikalien:
Brennspiritus, konz. Schwefelsäure, Kaliumpermanganat, Wasser
Vorbereitende Arbeiten:
Versuchsaufbau nach Abb. 16
Das trockene Reagenzglas wird 2 cm hoch mit konz. Schwefelsäure gefüllt. Man
achte darauf, daß die obere Glaswand von der Säure nicht benetzt wird. Dann läßt
man aus einer Pipette vorsichtig eine 4 cm hohe Schicht Brennspiritus auf die
Schwefelsäure fließen.
Durchführung:
Ein kleines Kriställchen von Kaliumpermanganat (Höchstgewicht 0,05 g) wird in
das Reagenzglas geworfen. Das Kristall sinkt durch das Äthanol hindurch in die
Schwefelsäure.
Ergebnis:
Nach kurzer Zeit lassen sich an der Grenzfläche zwischen Schwefelsäure und
Brennspiritus helle, blitzartige Funken beobachten. Die Funkenerscheinung unter
der Flüssigkeit dauert einige Zeit an.
Hinweise:
a) Auf Grund der guten Mischbarkeit von Brennspiritus und konz. Schwefelsäure
muß der Spiritus vorsichtig auf die Säure geschichtet werden. Eine
Vermischung der beiden Flüssigkeiten kann zu einer gefährlichen Erhitzung
führen, die evtl. den Reagenzglasinhalt herausschleudert.
Da konz. Schwefelsäure eine Dichte von ca. 1,8 und Brennspiritus eine Dichte
von ca. 0,8 hat, bleiben die beiden Flüssigkeiten längere Zeit voneinander
getrennt.
b) Verwendet man zu große Kristalle, so läuft man Gefahr, daß die Reaktion zu
heftig wird und Flüssigkeit herausspritzt.
c) Läßt das blitzartige Leuchten nach, so kann man es durch erneut hineingeworfene Kriställchen wieder hervorrufen.
Erläuterung:
Läßt man konz. Schwefelsäure auf Kaliumpermanganatkristalle einwirken, so
entsteht Manganheptoxid:
2MnO4- +2H+ → 2HMnO4 → Mn2O7 +2H2O
Dieses Oxid ist allerdings sehr unbeständig, es zerfällt in Manganoxid (bewirkt
Braunfärbung der Grenzzone) und Sauerstoff
2 Mn2O7 → 4 MnO2 + 3 O2
Der Sauerstoff oxidiert an der Grenzfläche der beiden Flüssigkeiten den
Brennspiritus unter leichter Feuererscheinung zu CO2 und H2O.
52.
Brennender Schneeball
Chemikalien:
Kampfer, Schnee
Vorbereitende Arbeiten:
Man steckt ein Stück Kampfer in einen Schneeball. Durchführung: Der Schneeball
wird angezündet.
Ergebnis:
Der Schneeball brennt mit leuchtender, leicht rußender Flamme.
Hinweise:
a)
Zur Giftigkeit von Kampfer siehe Versuch 32.
b)
Der Effekt steigt, wenn man vorher reine Schneebälle ins Publikum wirft. Hat
man keinen Schnee zur Verfügung kann man sich mit fein zerstoßenem Eis
behelfen. Allerdings muß es möglichst fein zerstoßen oder zermahlen sein,
damit es so weiß wie Kampfer aussieht.
45. Feuerfestes Taschentuch
Geräte:
Taschentuch. Tiegelzange, 2 Bechergläser
Äthanol Wasser, Natriumcarbonat, verd. Salzsäure
Vorbereitung:
a)
Man bedeckt den Boden eines großen Becherglases mit konz. Natriumcarbonatlösung und
stellt eine Flasche mit verd. Salzsäure bereit.
b) In einem Becherglas wird ein Gemisch aus 30 ml Äthanol und 30 ml Wasser hergestellt.
Durchführung: Ein Taschentuch wird gründlich mit dem Äthaol 1-Wasser- Gemisch getränkt und
angezündet. Nach ca. 30 Sekunden löscht man die Flammen mit folgender Anordnung:
Man schüttet einige ml Salzsäure in die konz. Natriumcarbonatlösung und taucht dann das
brennende Taschentuch in das entstehende Kohlendioxid.
Ergebnis:
Das Taschentuch ist unversehrt geblieben.
Hinweis:
Da evtl. brennendes Äthanol vom Taschentuch herunter tropfen kann, ist es ratsam,
Asbestpappe unterzulegen.
Erläuterung:
Das Taschentuch ist nicht zerstört worden. da nur das Äthanol brannte:
C2H5OH + 3O2 → 2CO2 + 3H2O
57.
Künstlicher Nebel
Geräte:
Abdampfschale, Spatel, Waage, Meßzylinder, Asbestpappe
Chemikalien:
Zinkpulver, Tetrachlormethan, Zinkoxid, Schwefel, Kaliumnitrat, Salpeterpapier
Vorbereitende Arbeiten:
a) In einer Abdampfschale verrührt man 10 g Zinkpulver mit 15 ml Tetrachlormethan und gibt dann so viel Zinkoxid oder Kieselgur (dient als Saugmaterial)
zu, bis eine teigige Masse entsteht.
b) Zur Entzündung dieses Gemischs benötigt man einen Streifen Salpeter
56.
Rauchringe
Geräte:
2 Waschflaschen. Handgebläse, Schlauch, Pappschachtel, Pergament, Klebstoff
Chemikalien:
halbkonz. Salzsäure, halbkonz. Ammoniaklösung
Vorbereitende Arbeiten:
a) Versuchsaufbau nach Abb. 17
b) Man schneidet aus dem Boden einer Pappschachtel eine Kreisscheibe von
etwa 3 cm Durchmesser. Der Deckel der Schachtel wird durch ein Stück
Pergament ersetzt (mit Klebstoff befestigen)
Durchführung:
Man drückt mit Hilfe des Handgebläses Luft durch die beiden Waschflaschen und
erzeugt dadurch einen NH4Cl-Rauch, den man durch die kreisrunde Öffnung in die
Pappschachtel leitet.
Man schnippt mit dem Finger gegen die Rückwand der rauchgefüllten Pappschachtel.
Ergebnis:
Aus der Öffnung schießen weiße Rauchringe hervor. Stellt man vor die Öffnung
eine brennende Kerze, so erlischt Sie, wenn ein Rauchring den Docht berührt. Die
Kerze wird auch dann zum Erlöschen gebracht, wenn die Schachtel leer ist und nur
noch unsichtbare Wirbelringe der Luft die Kerzenflamme erreichen.
44. Überraschungswatte
Bei dem Arbeiten sollte man hier besonders vorsichtig sein. Das Tragen einer Schutzbrille ist unerläßlich.
Geräte:
3 Bechergläser, Glasstäbe, Meßzylinder (50 ml), Trichter (~ 10 cm), Porzellanschalen, Waage, Bunsenbrenner
Chemikalien:
konz. Salpetersäure (65 %ig), konz. Schwefelsäure (96%ig), Watte, Indikatorpapier, Filterpapier, Kaliumnitrat, Schwefelpulver, Holzkohlenpulver
Vorbereitende Arbeiten:
Herstellung der nitrierten Cellulose: ,,Man laßt zu 20 ml konz. Salpetersäure in ein
250 ml-Becherglas das unter dem Abzug in einer Schale mit kaltem Wasser steht,
langsam unter Umrühren 40 ml konz. Schwefelsäure zufließen. In das auf
Zimmertemperatur abgekühlte Gemenge beider Säuren trägt man 2 g Watte ein,
die mit einem Glasstab in der Flüssigkeit ständig bewegt wird, so daß alle Fasern
mit der Nitriersäure in Berührung kommen. Nach 15 Min. gießt man die Säure
möglichst vollständig ab, wobei die Watte mit dem Glasstab zurückgehalten und
ausgedrückt wird. Man läßt die Watte in ein großes mit Leitungswasser gefülltes
Becherglas (11) gleiten, wo Sie durch schnelles Hinundherbewegen gründlich
gewaschen wird. Das Waschwasser wird noch mindestens 2 mal erneuert. Das
letzte Waschwasser, das mit Indikatorpapier auf Säurefreiheit geprüft wird, läßt
man durch einen Trichter abfließen, schiebt die Watte dann ebenfalls in den
Trichter und spült Sie noch etwa 5 Min. unter fließendem Wasser aus. Man preßt
die Watte zunächst zwischen zwei dicken Glasplatten und danach zwischen
Filtrierpapier gründlich aus und stellt Sie fein zerrupft noch 2 bis 3 Std. bei 40 ° C
in den Trockensehrank. Ausbeute: Aus 2 g Watte erhält man etwa 3,3 g nitrierte
Cellulose."
Herstellung des Schwarzpulvers:,,Zur Herstellung von Schwarzpulver werden
zunächst 14 g Kaliumnitrat fein zerrieben und dann mit 2 g Schwefel und 4 g
Holzkohle, die beide vorher für sieh fein gepulvert wurden, sehr sorgfältig und
gründlich vermischt. Um eine vorzeitige Entzündung auszuschließen, wird die
Mischung in einer Reib- schale mit einem Spatel oder einem Plastiklöffel, statt mit
dem Pistill (Vermeidung von Reibungsdruck und damit örtliche Erwärmung)
vorgenommen.
Durchführung I:
Man legt einen kleinen Bausch Schießbaumwolle (nitrierte Watte) in eine
Porzellansehale und berührt ihn mit der Sparflamme des Bunsenbrenners.
Ergebnis I:
Die Watte brennt blitzartig schnell mit heller, gelber Flamme ab ohne einen
Rückstand zu hinterlassen.
Durchführung II:
Man legt einen Bausch nitrierte und nicht nitrierte Watte jeweils auf ein Stück
Filterpapier und entzündet beide.
Ergebnis II:
Die Verbrennung der nitrierten Watte erfolgt so schnell, daß Sie die brennbare
Unterlage nicht angreift. Die nicht nitrierte Watte hingegen verbrennt sehr langsam
und kohlt dabei das darunterliegende Papier an.
Durchführung III:
Schießbaumwolle und normale Watte werden jeweils auf ein kleines Häufchen
Schwarzpulver gelegt und gezündet (Abzug).
Die langsam brennende Watte bringt das Schwarzpulver er zur Entzündung, die
schnell brennende Schießbaumwolle nicht.
Ergebnis III:
Durchführung IV:
Eine kleine Flocke Schießbaumwolle wird auf der Handfläche entzündet (dieser
Versuch darf erst durchgeführt werden. wenn man sich von der hohen
Verbrennungsgeschwindigkeit des selbsthergestellten Präparates überzeugt hat).
Ergebnis IV:
Die Schießbaumwolle brennt ab, ohne daß die Haut angegriffen wird.
Durchführung V:
Man legt eine kleine Flocke Schießbaumwolle auf einen Amboß und schlägt mit
dem Hammer kräftig darauf.
Ergebnis V:
Es erfolgt ein schußartiger Knall (Mund etwas öffnen).
Hinweis:
a) Schießbaumwolle unterliegt bei längerem Aufbewahren. vor allem wenn Sie
noch Spuren von Säure enthält, der Selbstzersetzung, die durch die dabei
entstehenden nitrosen Gase explosionsartig verlaufen kann (autokatalytischen Reaktion). Die selbsthergestellte Nitrocellulose soll daher im
Labor nur feucht in keinem Fall im Exsikkator - aufbewahrt werden.
b) Statt Watte kann man auch Papier nitrieren. Am besten eignet sich dazu
Seidenpapier. Man entzündet das Papier mit einem Streichholz oder - etwas
mysteriöser wirkt -~ mit einem Tropfen der Flüssigkeit aus Versuch 41. Das
Papier wird beim Entzünden mit der Zange gehalten. Nachdem es entflammt
ist, läßt man es fallen. Das Papier ist verbrannt, ehe es den Boden erreicht.
Erläuterung:
Bei Einwirkung von Salpetersäure auf Cellulose bildet sich, je nach Reaktionsbedingungen, Salpetersäureester mit ein, zwei oder drei Nitratgruppen auf sechs
Kohlenstoffatome.
Das unter den obigen Bedingungen gewonnene Cellulosenitrat liegt mit einem
Stickstoffgehalt von etwa 12,7% zwischen dem Trinitrat (14,14% N2) und dem
Dinitrat (11,1 % N2). Die Bildung des Cellulosenitrats verläuft folgendermaßen:
(C6H11O5)x + 3 x HNO3 → (C6H7O2(O NO2)3)x + 3 x H2O
Wie aus der Strukturformel ersichtlich ist, befindet sich der für die Verbrennung
notwendige Sauerstoff gleichmäßig verteilt in dem langkettigen Cellulosetrinitratmolekül. Augrund dessen zerfällt diese Verbindung bei Energiezufuhr
(Erwärmung, Schlag) blitzschnell und stark exotherm, wobei nur gasförmige
Reaktionsprodukte gebildet werden. Da aber mit der Ausdehnung dieser großen
Gasmassen eine starke Abkühlung verbunden ist, reicht die freiwerdende
Wärmemenge zur Entzündung des Schwarzpulvers nicht aus.
42. Violette Flammenerscheinung
Geräte:
Porzellanschale, Pipette
Chemikalien:
Glycerin, Kaliumpermanganat
Vorbereitende Arbeiten: Drei Spatel fein pulverisiertes Kaliumpermanganat werden in einer Porzellanschale
zu einem Kegel aufgehäuft, dessen Spitze etwas eingedellt wird.
Durchführung:
Mit einer Pipette läßt man einige Tropfen Glycerin in die
Vertiefung der Kegelspitze tropfen.
Ergebnis:
Nach wenigen Sekunden entzündet sich das Gemisch; die Flamme zeigt violette
Färbung.
Hinweis:
Da die Reaktion mitunter etwas verzögert, dann aber explosionsartig einsetzt, ist
eine Schutzbrille zu tragen.
Erläuterung:
,,Kaliumpermanganat ist ein starkes Oxidationsmittel, das bestimmte organiche
Stoffe schon bei Zimmertemperatur heftig oxidiert Propantriol (Glycerin) mit
seiner Häufung an Alkoholgruppen ist hierfür besonders gut geeignet. Die
Reaktion verläuft stark exotherm, so daß sich das Gemisch schon nach kurzer
Zeit selbst entzündet und mit Flammenerscheinung abläuft. Die Flamme zeigt die
typische violette Färbung, die durch Kalium hervorgerufen wird. Die
Oxidationsprodukte können nicht genau definiert werden, so daß sich die
reaktionsgleichung nicht genau angeben läßt.“
Erläuterung: ,,Kaliumpermanganat ist ein starkes Oxidationsmittel, das bestimmte organische Stoffe schon bei
Zimmertemperatur heftig oxidiert. Propantriol (Glycerin) mit seiner Häufung an Alkoholgruppen ist hierfür
besonders gut geeignet. Die Reaktion verläuft stark exotherm, so daß sich das Gemisch schon nach kurzer Zeit
selbst entzündet und mit Flammenerscheinung abläuft. Die Flamme zeigt die typische violette Färbung, die
durch Kalium hervorgerufen wird. Die Oxidationsprodukte können nicht genau definiert werden, so daß sich
eine Reaktionsgleichung nicht genau angeben läßt."
55. Violetter Rauch
Geräte:
Abdampfschale, Pipette, Glasstab
Chemikalien:
Jodpulver, Magnesiumpulver, Wasser
Durchführung:
Magnesium- und Jodpulver werden in eine Abdampfschale gegeben und mit einem Glasstab
gut miteinander vermischt. Zu der Mischung gibt man ein paar Tropfen Wasser.
Ergebnis:
Es erfolgt eine heftige Reaktion, bei der rotvioletter Rauch (Joddampf) gebildet wird.
Hinweis:
Der Versuch muß unter dem Abzug durchgeführt werden! Jod ist bei gewöhnlicher
Temperatur ein festes Element, das erst bei 184 °C siedet. Aber schon bei Zimmertemperatur
ist es merklich flüchtig. Seine Dämpfe sind giftig und führen zu Entzündungen der Nasen- und
Augenschleimhäute. Eingenommen wirkt es stark giftig.
Erläuterung:
Die heftige Reaktion beruht auf Salzbildung:
Mg + J2 → MgJ2 + Energie
Die bei dieser Reaktion freiwerdende Energie verdampft einen Teil des Jods.
47. Wunderkerzen
Geräte:
Becherglas, Glasstab, Draht
Chemikalien:
Bariumnitrat' Aluminiumpulver' Eisenpulver, Stärke Vorbereitende Arbeiten: Herstellung der
Wunderkerzen: Man vermengt ein Gemenge aus 55 g Bariumnitratpulver' 5 g Aluminiumpulver,
25 g Eisenpulver und 15 g Stärke mit etwas kochendem Wasser zu einem steifen Brei und
überzieht damit die oberen zwei Drittel von 10 20 cm langen Drähten, die man dann im
Trockenschrank gut trocknet. Durchführung: Diese Wunderkerzen werden entzündet.
Ergebnis:
Während des Brennens schleudern die Kerzen viele sternartige Funken ab.
Erläuterung:
Die Eisen- und Aluminiumkörnchen werden durch den vom Bariumnitrat in konzentrierter Form
gelieferten Sauerstoff blitzartig verbrannt. Die Stärke dient lediglich als Bindemittel für die
pulverförmigen Bestandteile.
35. Falschgeld
Geräte: Porzellanschale, Pinzette, Tuch
Chemikalien:
Quecksilber(II)-chlorid, Kupfermünze, dest. Wasser
Vorbereitende Arbeiten:
In der Porzellanschale löst man eine Spatelspitze Quecksilber(II)-chlorid in einigen
ml Wasser.
Durchführung:
Eine blanke Kupfermünze wird mit der Pinzette in die Quecksilber(Il)-chloridlösung. getaucht und darin etwas bewegt. Sie überzieht sich mit einem grauen
Belag. Nach einiger Zeit entfernt man die Münze aus de Lösung, spült Sie mit
Wasser gut ab und reibt Sie mit einem Tuch.
Ergebnis:
Die Münze wird silberglänzend.
Hinweise:
a) Quecksilber(II)-chlorid ist sehr giftig. Schon 0,5 g. können eine erwachsenen
Menschen töten.
b) Kupferamalgam ist nicht sehr beständig. Im Laufe der Zeit wird Quecksilber
frei! (siehe auch: ,,Hinweise zum Arbeiten mit Quecksilber und Queck
silberverbindungen", Versuch 1).
Erläuterung:
Nach der Spannungsreihe der Metalle ist Quecksilber edler als Kupfer. Auf Grund
dessen wird das Quecksilberion von dem metallischen Kupfer zu Quecksilber
reduziert:
Hg2+ + Cu → Cu2+ + Hg.
Dabei scheidet sich das metallische Quecksilber auf dem überschüssigen Kupfer ab
unter Bildung einer Quecksilber-Kupfer-Legierung (Kupferamalgam).
Auswertung der Infrarotspektroskopie
Probe
1
2
3
4
5
6
7
8
9
Auffällige Peaks (Berg)
In Wellennummern
Wasser
3300
1630
kristalliner Zucker 3560
3310
2930
2350
1435-1235
1240-840
Puderzucker
Wie Zucker, nur die ersten
Peaks weniger ausgeprägt
Zuckerlösungen g/l Allgemein: Die Spitzen sind
bei allen Proben vorhanden,
1
nur sind sie unterschiedlich
5
stark ausgeprägt. Bei der
10
schwächsten sind die Peaks
15
im Regelfall höher als bei
20
den stärker konzentrierten.
50
1260 Zuckerbande1
1100 Zuckerbande2.1
1050 Zuckerbande2.2
1010 Zuckerbande2.3
unterschiedliche Höhe der
Getränke
Wasserbanden
Limonade
unterschiedlich hohe
Cola1
Banden bei
Cola2
charakteristischen
Sportgetränk
Fructosebanden
Johannisbeersaft
Milch
bei Honig und Marmelade
Brotaufstrich
charakteristische
Marmelade
Wasserbanden und am
Honig
Ende charakteristische
Nutella
Zuckerbanden, jene sind
auch bei Nutella vorhanden
Wasserbanden
Obst
charakteristische
Banane
Fructosebande am Ende
Essigsäure
Der Anteil der
Wasserbanden nimmt zu.
Essigsäure pur
Es sind Kohlendioxidbanden
Essigsäure 1:2
vorhanden.
Essigsäure 1:10
3030 Essigsäurepeak1
1700 Essigsäurepeak2
1400 Essigsäurepeak3
1290 Essigsäurepeak4
1000 Essigsäurepeak5
Essigsäuren2
charakteristische
Vermutung
Wasser-Peak-1
Wasser-Peak-2
Charakteristischer Zucker-Peak-1
Wasser-Peak-1
Charakteristischer Zucker-Peak-2
CO2-Peak
Charakteristischer Zucker-Peak-3
Charakteristischer Zucker-Peak-4
Ist Zucker, nur feinkörniger und enthält
weniger Wasser.
Unterschiedlicher Wassergehalt der Proben
enthält statt Normalzucker, Fructose. Bei
Milch ist es wahrscheinlich Lactose.
Honig und Marmelade enthalten Formen der
Glukose
Banane enthält Fructose
Dadurch, daß weniger Wasser enthalten ist,
kommt es zu einer charakteristischeren
Ausbildung der Essigbanden.
Weinessig, Kräuteressig und Apfelessig
Weinessig
Kräuteressig
Apfelessig
Aceto balsamico
Ausprägung, wie bei
Essigsäure 1:10
Die Kohlendioxidbande von
Weinessig ist ebensowenig
ausgeprägt, wie die von
Aceto balsamico.
Letzterer besitzt zu dem
noch einen zusätzlichen
Peak bei 1100. Zudem ist
bei ihm die
Essigsäurenbanden am
Schluß stärker ausgeprägt.
unterscheiden sich in ihrem Aufbau nur
unwesentlich. Die letzten Essigbanden sind
beim Weinessig stärker ausgeprägt, als bei
den anderen zweien.
Die Besonderheiten bei Aceto balsamico sind
auf seinen andersartigen Bau zurück
zuschließen.
Kohlenhydrate
Kohlenhydrate, auch Saccharide genannt, ist die Sammelbezeichnung für eine Klasse von zumeist
festen und geruchlosen Stoffen, zu denen alle Zucker-, Stärke-, und Zellulosearten gehören.
Gemeinsam ist den meisten Kohlenhydraten der chemische Grundaufbau (CH2O).
Man kann sehr vereinfacht zwei Arten verwertbarer Kohlenhydrate hinsichtlich ihrer chemischen
Merkmale, ihrer Bausteine und Molekülgröße unterscheiden:
1) Zucker:
Einfache Zucker sind Monosaccharide, die nicht weiter spaltbar sind. Zu den
Monosacchariden gehören Glukose (Traubenzucker), Fruktose (Fruchtzucker) und Galaktose
(Bestandteil des Milchzuckers). Verbindungen von zwei Monosacchariden heißen
Disaccharide. So ist Saccharose (der Haushaltszucker aus Zuckerrüben oder Zuckerrohr) aus
Glukose und Fruktose zusammengesetzt. Weitere Disaccharide sind Laktose (Milchzucker)
und Maltose (Malzzucker). Sind bis zu 10 Zucker-Bausteine miteinander verbunden, spricht
man von Oligosacchariden. Gemeinsam ist diesen Kohlenhydraten, daß sie wasserlöslich sind
und süß schmecken.
Zucker gibt es z.B. als Haushaltszucker, im Honig, in Obst oder in Konfitüren und Süßwaren.
2) Stärke:
Bis zu mehrere tausend Monosaccharid-Bausteine bilden die sogenannten Polysaccharide.
Sie sind praktisch geschmacksfrei und wasserunlöslich. Bekanntester Vertreter der
verwertbaren Polysaccharide ist die Stärke. Stärke ist in Brot, im Mehl, in Teigwaren, im Reis,
in Getreideprodukten, in Kartoffeln und in Hülsenfrüchten enthalten.
Kohlenhydrate zählen zu den energieliefernden Nährstoffen.
Zucker
Es lassen sich drei grundlegenden Zuckersorten unterscheiden:
Isolierter Zucker: Der chemisch reine, industriell gewonnene raffinierte Zucker, dessen Herstellung
gerade beschrieben wurde. Er kommt in vielen verschiedenen Formen auf den Markt und ist in fast
allen vorbereiteten, abgepackten Nahrungsmitteln enthalten. Diesem Industriezucker wurden alle
Vitalstoffe und andere lebenswichtige Substanzen entzogen. Es ist diese Art von Zucker, die für den
Organismus völlig unnötig ist, ihm sogar Schaden zufügen kann.
Natürlicher Zucker in Lebensmitteln: Dies sind die Zuckersorten, die ein Lebensmittel, wie z.B.
Früchten, auf natürliche Weise süß machen, und die in nahezu allen Pflanzen in einem bestimmten
Anteil vorkommen, allerdings mit den zur Verdauung nötigen Vitalstoffen. Ißt man beispielsweise
einen Apfel, dann liefert diese Frucht neben ihrer natürlichen Süße auch die Stoffe, die der Körper
benötigt, um den im Apfel enthaltenen Zucker problemlos aufzunehmen und zu verarbeiten und den
Apfel als Ganzes zu verdauen und zu verwerten.
Blutzucker: Blutzucker in der Form von Glukose ist für die Energieversorgung des Körpers notwendig.
Wichtig für einen normalen Ablauf aller Körperfunktionen ist eine gleichmäßige und konstante
Glukosemenge im Blutkreislauf. Diese wird vom Körper aus Kohlenhydraten (v.a. Brot, Reis, Nudeln,
Hülsenfrüchte) bezogen. Es ist völlig falsch zu behaupten, man müsse Fabrikzucker essen, um die
Energieversorgung des Körpers aufrechtzuerhalten. Ganz im Gegenteil! Die Zufuhr von isoliertem
Zucker bringt den natürlichen Glukosespiegel im Blut aus dem Gleichgewicht und schafft für den
Körper eine Reihe von Problemen.
Monosaccharide
Eine andere Bezeichnung für Einfachzucker. Dazu gehören Glukose, Fruktose und Galaktose. Sie
bestehen aus nur einer Zuckereinheit.
Fruchtzucker / Fruktose
Fruchtzucker ist ein Einfachzucker oder Monosaccharid (d.h. er besteht aus einer Zuckereinheit) wie
z.B. Glukose oder Galaktose. Fruchtzucker kommt in der Natur vor allem in Früchten und Honig vor.
Traubenzucker / Glukose
Traubenzucker ist ein Monosaccharid bzw. ein Einfachzucker, wie auch Fruktose und Galaktose.
Disaccharide
bestehen aus zwei Monosaccharid- (Einfachzucker-) Einheiten. Zu ihnen gehören z.B. die Laktose
Milchzucker / Laktose
Milchzucker ist ein Disaccharid und besteht aus je einem Molekül Glukose und Galaktose. Milchzucker
ist für den Säugling längere Zeit das einzige Kohlenhydrat in seiner Nahrung. Das für die Spaltung des
Milchzuckers erforderliche Enzym Laktase kann bei manchen Menschen in nicht ausreichender
Menge vorhanden sein oder von Geburt an fehlen. Dadurch kann es bei manchen Menschen zu einer
Milchunverträglichkeit kommen.
Rohrzucker / Saccharose
Rohrzucker, der auch als Haushaltszucker bezeichnet wird, ist ein sog. Disaccharid. D.h. Rohrzucker
oder Saccharose besteht aus zwei Zuckermolekülen (Glukose und Fruktose).
Karamel
Braune, nichtkristallisierende Masse, die durch Erhitzen von Glukose oder Saccharose auf 150-180'C
entsteht.
Polysaccharide
sind aus einer Vielzahl von Monosaccharid- (Einfachzucker-) Einheiten zusammengesetzt. Zu ihnen
gehören z.B. die Stärke und die Zellulose.
Invertzucker
Gemisch von gleichen Anteilen Traubenzucker und Fruchtzucker, das durch Auflösung (Inversion) von
Saccharose entsteht. Findet in der Nahrungsmittelindustrie Verwendung. Ist z. B. in Honig enthalten.
Kandiszucker
Sammelbezeichnung für grobe Zuckerkristalle von unterschiedlicher Größe und weißer oder brauner
Farbe. Kandis wird aus reinen Zuckerlösungen durch langsames Auskristallisieren gewonnen, beim
braunen Kandis wird karamelisierter Zucker zugesetzt. Kandis hat die gleiche Wirkung wie normaler
weißer Fabrikzucker.
Essigsäure
alchemistisches Zeichen
(17. Jahrhundert)
atomtheoretische Formel
(J. Dalton, ca. 1810)
"Wurstformel"
(A. Kekulé, 1861)
heute übliche Formel
"Formel des 21. Jahrhunderts"
Seite 63 Aufgabe 1
Erklären Sie, warum sich bei Eisenwerkstoffen wie Grauguß oder Stahl an der Luft kein luftdichter Oxid/Hydroxidüberzug bildet!
Eisenoxid ist porös und luftdurchlässig, es kommt also ständig Luft an das noch unoxidierte eisen, die dieses
oxidiert.
Eisenwerkstoff wie Stahl und Grauguß unterliegen der Korrosion im ungeschützten zustand relativ stark.
Der kompliziert verlaufende Prozeß der Korrosion an Eisenwerkstoffen heißt Rosten. Ursache für das Rosten
sind Sauerstoff, Luftfeuchtigkeit und Kohlenstoffdioxid sowie die Bildung von Lokalelementen in Wasserinseln
auf der Metalloberfläche. Schon nach wenigen Stunden ist am Rand von Wasserinseln auf der Eisenoberfläche
die beginnende Rostbildung zu beobachten. Die chemische
Reaktion zwischen Eisen und dem gelösten Sauerstoff führt zu
einer Konzentrationserniedrigung des Sauerstoffs im Zentrum der
Wasserinsel. Dadurch entsteht ein galvanisches Element, weil das
Konzentrationsgefälle durch den Sauerstoffumsatz im Zentrum und
die Sauerstoffzufuhr an der Grenze zwischen Luft und Wasser
aufrecht erhalten wird. Das Metall im Zentrum der Wasserinsel
wird zur Anode, am Rand der Wasserinsel wird das Metall zur
Katode (siehe Grafik)
Sehr vereinfacht laufen folgende Reaktionen ab:
Anode: Fe(s)
Katode: ½ O2(g) + H20(l) + 2 e
→
→
Fe2+(aq) + 2 e
2 OH-(aq)
Oxidation
Reduktion
und bei Vorhandensein von Hydronium-Ionen teilweise auch
2 H3O+(aq) + 2 e
→
H2(g) + 2 H2O(l)
Eisen(II)-Ionen bilden mit Hydroxid-Ionen schwerlösliches Eisen(II)-hydroxid, das mit weiterem Sauerstoff zum
rot-braunem Eisen(III)-oxid-hydroxid (Rost) oxidiert wird und sich am Rande der Wasserinsel absetzt.
Fe2+(aq) + 2 OH-(aq)
2 Fe(OH)2(s) + ½ O2(g)
→
→
Fe(OH)2(s)
2 FeO(OH) (s) + H2O(l)
Da die Größe der Wasserinseln durch Kondensieren und Verdampfen zeitlich wechselt, wird durch die
Korrosion allmählich die gesamte Eisenoberfläche überzogen. Rost ist ein poröser Stoff mit geringer Festigkeit.
Daher wird die weitere Korrosion durch gebildete Rostschichten nicht behindert.
Seite 63 Aufgabe 2
Geben Sie Beispiele für unvollständig ablaufende Reaktionen an! Nennen Sie die jeweilige Ursache für den
unvollständigen Stoffumsatz!
Folgende chemische Reaktionen sind reversible, sie laufen gleichzeitig als Hin- und als Rückreaktion ab. Daher
können die Ausgangsstoffe nie völlig umgesetzt werden, es entsteht eine chemisches Gleichgewicht.
CH4COOH + C2H5OH
C2H4 + H2
NH3 + H2O
N 2O 4
'
'
'
'
CH2COOC2H5 + H2O
C2H6
NH4+ + OH
2 NO2
Bei den nächsten drei Reaktionen werden Metalle oxidiert, welche an ihrer Oberfläche eine luft- und somit
sauerstoffundurchlässige Oxidschicht bilden. Sie können also nicht vollständig oxidieren, da alles was unter
dieser Oxidschicht liegt, nicht mit dem Sauerstoff in Kontakt kommt.
Allerdings sind diese Reaktionen nur Reaktionen mit unvollständigem Stoffumsatz, wenn die Metalle in
genügend großem Volumen vorhanden sind, kleine Metallkügelchen mit 0,01 mm Durchmesser z.B. würden
vollständig oxidieren.
2 Zn + O2
4 Cu + O2
4 Al + 3 O2
→
→
→
2 ZnO
2 Cu2O
2 Al2O3
Seite 64 Aufgabe 1
Erklären Sie die unterschiedlichen Zeiten vom Reaktionsstart (Zugabe von Wasser bzw. Salzsäure) bis zum
sichtbaren Reaktionsbeginn bei den Experimenten 1 und 2!
Experiment 1
Auf einer Glastüpfelplatte mit erhöhtem Rand werden in eine Vertiefung eine Spatelspitze Ammoniumchlorid (Xn) und 2
Plätzchen Natriumhydroxid (C) gegeben. Eine zweite Vertiefung, von der ersten zwei bis drei Vertiefungen entfernt, wird mit
Wasser gefüllt, dem man zwei Tropfen Universalindikatorlösung hinzufügt. Die Tüpfelplatte ist auf die Projektionsebene
eines Tageslichtprojektors zu stellen. Danach sind drei Tropfen Wasser in die Vertiefung 1 zu geben und die Tüpfelplatte ist
mit einer Glasplatte abzudecken. Vorsicht, Ammoniak (T)! Beobachten Sie die Veränderungen in der Vertiefung 2! Stellen Sie
die Reaktionsgleichungen auf!
Experiment 2
Die Durchführung des Experiments erfolgt analog der des Experiments 1. In die erste Vertiefung wird eine Spatelspitze Ammoniumchlorid (Xn) gegeben, in der zweiten Vertiefung wird Wasser mit Indikatorlösung versetzt. Auf dem Projektor werden
in die Vertiefung 1 drei Tropfen konzentrierte Schwefelsäure (C) gegeben. Die Platte ist abzudecken. Vorsicht,
Chlorwasserstoff (C)! Beobachten Sie die Veränderungen in der Vertiefung 2! Stellen Sie die Reaktionsgleichungen auf!
1.
2.
3.
4.
Von den ganzen Anweisungen versteh‘ ich nur Glastüpfelnatriumchloridexperimentprojektor!
Ich habe keine Ahnung was da eigentlich passieren soll!
Wer denkt sich so etwas überhaupt aus?
Warum ich?
Die unterschiedlichen Zeiten vom Reaktionsstart bis zum optischen Reaktionsbeginn erkläre ich mir durch die
unterschiedlichen Reaktionsgeschwindigkeiten der Reaktionen bzw. der jeweiligen Hin- und Rückreaktionen.
Seite 65 Aufgabe 2
Erörtern Sie, ob sich in einem offenen stofflichen System ein chemisches Gleichgewicht einstellen kann!
Bei einem offenen stofflichen System finden ständig Stoff- und Energieaustausch mit der Umwelt statt. Es wird
also ständig entweder etwas von den Ausgangsstoffen oder Reaktionsprodukten an die Umwelt abgegeben. Dies
wiederum bedeutet, daß sich die Konzentration der Ausgangsstoffe bzw. der Reaktionsprodukte ständig ändert.
Dadurch widerspricht die Reaktion aber der Eigenschaft Δc = 0, die für alle chemische Gleichgewichte gilt.
Daraus folgt, daß sich in einem offenem stofflichen System kein chemisches Gleichgewicht einstellen kann.
Ein chemisches Gleichgewicht kann sich in einem offenen stofflichen System nicht einstellen, da ein
geschlossenes oder abgeschlossenes stoffliches System Voraussetzung für das Entstehen eines chemischen
Gleichgewichtes ist.
Seite 67 Aufgabe 1
Begründen Sie, daß Δc = 0 ein notwendiges, aber kein hinreichendes Merkmal für ein chemisches Gleichgewicht
ist!
Δc = 0 ist ein notwendiges Merkmal für chemische Gleichgewichte, da sich die Konzentration der
Ausgangsstoffe und Reaktionsprodukte nicht ändern darf, da das chemische Gleichgewicht andernfalls auch
Reaktionen mit einschließen würde, bei denen sich die Konzentration der Ausgangsstoffe und Reaktionsprodukte
ändern. Dies wären somit sämtliche chemische Reaktionen, egal ob sich das Verhältnis der Konzentration der
Ausgangsstoffe und Reaktionsprodukte schließlich auf einen konstanten Wert einstellt, also ein Gleichgewicht
bildeten.
Seite 67 Aufgabe 2
Warum ist das chemische Gleichgewicht ein dynamisches Gleichgewicht?
Das chemische Gleichgewicht ist ein dynamisches Gleichgewicht, da die Hin- und die Rückreaktion gleichzeitig
ablaufen.
Seite 67 Aufgabe 3
Erläutern Sie die Voraussetzungen und Merkmale eines chemischen gleichgewichts am Beispiel des Systems
N2O4/NO2!
N 2O 4
'
2 NO2
Das chemische Gleichgewicht ist ein besonderer, stabiler und zeitunabhängiger Zustand eines stofflichen
Systems, der bei konstanten äußeren Bedingungen (Temperatur, Druck) beliebig lange bestehen bleibt. Das
chemische Gleichgewicht ist ein stabiles dynamisches Gleichgewicht.
Voraussetzungen für die Herausbildung eines chemischen Gleichgewichts sind die Umkehrbarkeit chemischer
Reaktionen, die bei der Reaktion von N2O4 zu zwei NO2 gegeben ist, und der Ablauf dieser Reaktion in einem
geschlossenen oder abgeschlossenen System, was sich mit N2O4 auch leicht realisieren läßt, indem man es
einfach in eine Flasche füllt und oben einen Deckel draufmacht.
Das chemische Gleichgewicht besitzt folgende Merkmale:
•
•
•
Hin- und Rückreaktion laufen gleichzeitig und mit gleicher Geschwindigkeit ab
vHinreaktion = vRückreaktion ≠ 0.
Also gut, wir haben unser N2O4 brav in eine Flasche gefüllt und den Deckel fest zugeschraubt, und schon
nach kurzer Zeit können wir nicht beobachten, das sich, grob vereinfacht, jedesmal, wenn ein N2O4-Molekül
in zwei NO2-Moleküle zerfällt, auch aus zwei NO2-Molekülen ein neues N2O4-Molekül bildet. Beobachten
kann man es deshalb nicht, weil es auf molekulare Ebene passiert, was für unsere Augen ein wenig zu klein
ist, und es sich bei den beiden Stoffen, sollte mich nicht alles täuschen, um zwei farblose Gase handelt.
Nichts desto trotz stimmt es aber, die Geschwindigkeiten der Hin- und Rückreaktionen sind, nach der
Einstellzeit, gleich.
Die Reaktionsgeschwindigkeit für die umkehrbare chemische Reaktion ist null.
vgesamt = vHinreaktion – vRückreaktion = 0.
Da die Hin- und Rückreaktionsgeschwindigkeit gleich sind, ergibt ihre Differenz logischer Weise 0.
Die Ausgangsstoffe und Reaktionsprodukte liegen nebeneinander vor. Ihre Konzentrationen bleiben
unverändert
Δc = 0.
Wie bei • Nummer 1 erklärt, wandeln sich die Moleküle der Ausgangsstoffe und Reaktionsprodukte
gleichschnell ineinander um, und durch logisches schließen kommt man zu der Erkenntnis, das es deshalb
immer konstant viel N2O4 und NO2-Moleküle gibt, deren Konzentration also gleich bleibt.
Seite 67 Aufgabe 4
Erläutern Sie, warum die Stöchimetriezahlen einer Reaktionsgleichung in der Gleichung des
Massenwirkungsgesetz die Exponenten der Konzentrationen sind!
Bei der Reaktion wA + xB ' yC + zD lautet die Gleichung für das Massenwirkungsgesetz
Kc = (cCy * cDz) / (cAw * cBx). Warum das so ist, wird am besten durch die Herleitung zu dieser Gleichung
deutlich:
Bei einem chemischen Gleichgewicht laufen Hin- und Rückreaktion gleichzeitig ab.
Die Lage des chemischen Gleichgewichtes hängt von den Reaktionsgeschwindigkeiten der
Hin- und Rückreaktionen ab.
Für die Hin- und die Rückreaktionsgeschwindigkeit gelten folgende Gleichungen:
vHinreaktion
= kHinreaktion * cAw * cBx
vRückreaktion
= kRückreaktion * cCy * cDz
In diesen Gleichungen sind die Söchiometriezahlen bereits als Exponenten der
Konzentrationen vertreten.
Um eine Relation zwischen Hin- und Rückreaktionsgeschwindigkeit zu bilden, verbindet man
die beiden Gleichungen wie folgt:
kHinreaktion / kRückreaktion
= cCy * cDz / (cAw * cBx)
kHinreaktion / kRückreaktion werden nun noch zusammengefaßt und als Kc bezeichnet:
= (cCy * cDz) / (cAw * cBx).
Kc
Man erhält also die obige Gleichung, aber warum sind die Stöchiometriezahlen in den
Gleichungen für die Reaktionsgeschwindigkeiten als
Exponenten vertreten?
Nun, erhöht man bei einer Reaktion die
Konzentration eines der Ausgangsstoffe,
verdoppelt sie zum Beispiel, so erhöht
sich die Wahrscheinlichkeit, das die
richtigen Teilchen der Ausgangsstoffe
wirksam zusammenstoßen, um das
vierfache.
Seite 69 Aufgabe 1
Stellen Sie für die Reaktion A + 3 B ' 2 C die Gleichung des Massenwirkungsgesetzes auf! Geben Sie die
Einheit der Gleichgewichtskonstante Kc an!
A+3B
'
2C
Kc
=
cC² / (cA * cB³)
[Kc]
[Kc]
[Kc]
=
=
=
(mol * l-1)² / ( (mol * l-1) * (mol * l-1)³) = (mol * l-1)² / (mol * l-1)4 =
(mol * l-1)-2 = mol-2 * l² ⇒
1 mol-² * l²
Seite 69 Aufgabe 2
Leiten Sie die Beziehung zwischen den Gleichgewichtskonstanten Kc und Kp der Ammoniaksynthese her!
Geben sie die Einheiten beider Gleichgewichtskonstanten an!
N2 + 3 H2
'
2 NH3
Kc
[Kc]
=
=
cNH32 / (cN2 * cH2³)
1 mol-² * l²
Kp
=
Kp
=
pVNH3 / (pVN2 * pVH2)
=
p44,828 l / (p22,414 l * p67,242 l) =
p-44,828 l
[Kp]
=
1 Pa-44,828 l
p*V
p
n/V
p
Kp
=
=
=
=
=
n*R*T
n/V*R*T
c
c*R*T
Kc * (R * T)Δv
Da aus vier Mol Gas zwei Mol Gas werden, gilt:
Kp
Kp
=
=
Kc * (R * T)2*22,414 l
Kc * (R * T)44,828 l
(bei Stoffumsatz von einem Mol)
?
Der Atombau
Geschichte
•
•
•
•
Demokrit (460-371 v. Chr.)
Dalton (1766-1844)
Ernest Rutherford (1871 – 1917)
Niels Bohr (1886-1965)
„Alle Stoffe bestehen aus Atomen“
Kugelmodell der Atome
„Atome bestehen aus einem positiven Kern mit einer negativen
Hülle, die aus Elektronen besteht“
Entwickelt sein Atommodel mit Hilfe der Spektralanalyse und findet
heraus, dass sich die Elektronen nur auf bestimmten Bahnen
bewegen.
1. Das Bohrsche Atommodell
z.B. Natrium
Atome bestehen aus einem positiv
geladenem Kern, der Protonen und
Neutronen enthält, und der von den
negativ geladenen Elektronen auf genau
definierten Bahnen („Schalen“) umkreist
wird.
Die maximale Anzahl der Elektronen pro
Schale beträgt 2n², wobei die äußerste
Schale stets maximal 8 Elektronen
aufnehmen kann.
Wird den Elektronen Energie zugeführt, so
kann stets nur ein charakteristischer Betrag aufgenommen werden,
nämlich genau der Betrag, der benötigt wird um das Elektron auf eine der
höheren Schalen springen zu lassen.
Elektronen können sich nicht zwischen diesen Bahnen aufhalten.
Man sagt, die Energiezustände der Elektronen sind gequantelt.
2. Wellenmechanisches / quantenmechanisches Atommodell
Bohrsches Postulat:
Elektronen sind elektrische Ladungen und bewegen sich um den Atomkern.
Ein elektromagnetisches Feld entsteht, die Elektronen geben Energie ab.
Dadurch werden sie langsamer und stürzen eines Tages in den Atomkern.
Dies trifft nicht zu!
Elektronen haben wie das Licht Teilchen und Welleneigenschaften (Welle-Teilchen-Dualismus).
Heißenbergsche Unschärferelation:
Betrachtet man das Elektron als Teilchen, so ist es nicht möglich,
seinen genauen Aufenthaltsort zu bestimmen, da die Energie die
dafür aufgewendet würde die Lage des Elektrons ändern würde.
Man kann lediglich den etwaigen Aufenthaltsort des Elektrons in der Atomhülle bestimmen, diesen bezeichnet
man als Orbital.
Die Orbitale hängen von den Quantenzahlen ab.
Die Hauptquantenzahl n entspricht dem Energieniveau der Bahn des Elektrons, wie in der Skizze auf der anderen
Seite.
Die Nebenquantenzahl l kann Werte von 0 bis l – 1 annehmen und bestimmt die Form der Bahn des Elektrons.
Die Aufspaltung der Spektrallinien wird durch die Magnetquantenzahl m charakterisiert, welche die Werte von
-l bis +l annehmen kann.
Die Spinquantenzahl, welch die Drehrichtung der Elektronen beschreibt, ist immer entweder –½ oder +½.
Haupquante
n-zahl n
Nebenquantenzahl l
Name des
Orbitals
1
2
0
0
s
s
1
p
-1
0
1
0
1
s
p
2
d
0
-1
0
1
-2
-1
0
1
2
0
1
s
p
2
d
3
4
Magnetquantenzahl
m
0
0
0
-1
0
1
-2
-1
0
1
2
Spinquantenzahl s
Elektronen
auf Orbital
Elektronen
auf Schale
±½
±½
2
2
2
8
±½
±½
±½
±½
±½
±½
±½
±½
±½
±½
±½
±½
±½
±½
±½
±½
±½
±½
±½
±½
±½
6
2
6
18
10
2
6
10
32
3
Pauli-Prinzip / Pauli-Verbot:
f
-3
-2
-1
0
1
2
3
±½
±½
±½
±½
±½
±½
±½
14
Die Elektronen in einem Atom müssen sich in mindestens einer Quantenzahl
unterscheiden.
Jeder Nebenquantenzahl ist ein Orbital zugeordnet, das je maximal 4l + 2 Elektronen aufnehmen kann.
Das s-Orbital ist kugelförmig und der Nebenquantenzahl 0
zugeordnet, es nimmt maximal 2 Elektronen auf.
Die hantelförmigen p-Orbitale sind der Nebenquantenzahl 1
zugeordnet und nehmen maximal 6 Elektronen auf.
Die d-Orbitale, welche keulenförmig sind, und der
Nebenquantenzahl 2 entsprechen, nehmen maximal 10
Elektronen auf.
Der Nebenquantenzahl 3 entsprechen die f-Orbitale, sie
nehmen maximal 14 Elektronen auf.
Die energetisch niedrigwertigsten Orbitale eines Atoms
werden immer zuerst besetzt. In der Darstellung eines
Orbitals steht ein Quadrat je für Plätze für zwei Elektronen
mit entgegengesetztem Spin.
Die energetische Wertigkeit der Orbitale wird im
Energieniveauschema der Atomorbitale dargestellt.
Energetisches Aufbauprinzip:
Es werden immer die energetisch niedrigwertigsten Orbitale eines Atoms
zuerst mit Elektronen besetzt.
Man kann die Energieverhältnisse eines Orbitals mit der Gleichung n + l abschätzen.
Hundsche Regeln:
Orbitale gleicher Energie eines Atoms werden zunächst mit Elektronen
gleichem Spins besetzt, bevor die Doppelbesetzung unter Spinpaarung
eintritt.
Darstellung der Elektronenkonfiguration:
Die Anordnung der Orbitale eines Orbitals kann durch Kästchen, ihre
Besetzung durch in die Kästchen eingezeichnete Pfeile und der Spin der
Elektronen durch die Richtung der Pfeile dargestellt werden.
Jeder Pfeil entspricht einem Elektron.
Steht ein Elementsymbol in eckigen Klammern vor der
Elektronenkonfiguration (z.B. [Kr]), so bedeutet dies, das die folgenden
Orbitale zur Elektronenkonfiguration dieses Atoms addiert werden.
In der vereinfachten Schreibweise wird die Besetzung eines Orbitals als
hochgestellte Zahl hinter das Orbital geschrieben.
H
He
Li
Be
B
C
N
O
F
Ne
1s1
1s²
1s² 2s1
1s² 2s²
1s² 2s² 2p1
1s² 2s² 2p2
1s² 2s² 2p3
1s² 2s² 2p4
1s² 2s² 2p5
1s² 2s² 2p6
Na
Mg
Al
Si
P
S
Cl
Ar
1s² 2s² 2p6 3s1
1s² 2s² 2p6 3s²
1s² 2s² 2p6 3s2 3p1
1s² 2s² 2p6 3s2 3p2
1s² 2s² 2p6 3s2 3p3
1s² 2s² 2p6 3s2 3p4
1s² 2s² 2p6 3s2 3p5
1s² 2s² 2p6 3s2 3p6
Lage im Periodensystem der Elemente
1./2. Hauptgruppe, außer Helium (8. Hauptgruppe)
3.-8. Hauptgruppe
Nebengruppen
Lanthanoide oder Actinoide
Letztes besetztes Orbital
s-Orbital
p-Orbital
d-Orbital
f-Orbital
Edelgase sind Elemente, deren letztes Orbital ein vollbesetztes d-Orbital ist bzw. es ist nur ein s-Orbital
vorhanden, welches vollbesetzt ist vorhanden
Stabile Zustände:
Atome streben immer den energetisch niedrigsten Zustand an, die sie erreichen, indem sie Elektronen abgeben
oder aufnehmen.
Das bedeutet das letzte Orbital ist - vollbesetzt
- leer
- zur Hälfte voll besetzt (alle Elektronen haben den gleichen Spin).
Daraus ergeben sich folgende stabile Zustände:
Die Oxidationszahlen eines
Elements geben an, ob eine
Atom in einer chemischen
Bindung Elektronen
aufgenommen oder abgegeben
hat. Bei Elektronenaufnahme
sind sie negativ, bei
Elektronenabgabe positiv und
anderenfalls ±0.
Sie beschreiben die Ladung, die
das Atom hätte, wenn es ein Ion
wäre.
Am Beispiel des Chlors:
Cl
Cl-1
Cl+1
Cl+3
Cl+5
Cl+7
1s² 2s² 2p6 3s2 3p5
[Ar]
[Ne] 3s1 3p5
[Ne] 3s2 3p3
[Ne] 3s2 3p0
=
[Ne] 3s0 3p0
=
z.B. in Cl2
z.B. in Cl2O7
[Ne] 3s2
[Ne]
Nächstes Thema: „chemische Reaktionen“