pdf-file
Werbung

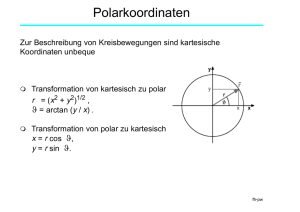
Chemische Bindung • • • • • • • • • • • • • • Ue Mol 1 Periodensystem - Atome - Moleküle Periodensystem(e) Nichtmetalle - Metalloide Eigenschaften der Elemente Bindungstypen Ionenbindung Kovalente, homöopolare Bindung Kovalente Bindung: Beispiele Beispiele: Oktett-Theorie Vergleich: kovalente-ionische Bindung Metallische Bindung Orbitale Hybridorbitale Molekülformen 2 3 5 6 7 8 10 11 12 13 14 15 16 17 fh-pw Periodensystem - Atome - Moleküle 109 bekannte Elemente • 87 Metalle • 26 sind radioaktiv • 16 sind künstlich • 11 sind gasförmig • 2 sind flüssig Mendeleev (1871): „Eigenschaften der chemischen Elemente variieren periodisch“ Eigenschaften der Metalle: • glänzend, scheinend, formbar • Wärme- und Stromleiter • alle sind fest bei Raumtemperatur (Ausnahme: Hg) • geben Elektronen ab, bei Reaktionen mit Nichtmetallen Ue Mol 2 fh-pw Periodensystem(e) Periodic spiral of T. Benfey Stowe's physicists periodic table Ue Mol 3 fh-pw Periodensystem(e) Triangular periodic table by E. Zmaczynski Alexander 3D arrangement of the elements Ue Mol 4 fh-pw Nichtmetalle - Metalloide Eigenschaften der Nichtmetalle: • schlechte Wärme- und Stromleiter • Vorkommen als Gase (Cl2), Flüssigkeiten (Br2)und Festkörper (I2) • nehmen Elektronen bei Reaktionen mit Metallen auf, teilen Elektronen bei Reaktionen mit anderen Nichtmetallen Eigenschaften der Metalloide: • Halbleiter-Eigenschaften • verhalten sich wie Metalle bei Reaktionen mit Nichtmetallen • verhalten sich wie Nichtmetalle bei Reaktionen mit Metallen • zeigen unterschiedliche chemische Eigenschaften Ue Mol 5 fh-pw Eigenschaften der Elemente Atomdurchmesser nimmt mit jeder Elektronenschale zu und innerhalb einer Periode ab Ue Mol 6 fh-pw Bindungstypen Bindung Bindungsenergie • • • Ionenbindung (heteropolare Bindung) Kovalente Bindung (homöopolare Bindung) Van der Waals Bindung Wasserstoffbrückenbindung • Metallische Bindung -1 eV .. -10 eV -1 eV .. -10 eV -0,01 eV .. -0,1 eV bis -0,5 eV -1eV .. -10 eV Bindungsenergie ist negativ: bei der Molekülbindung wird diese Bindungsenergie freigesetzt (der stabilste Zustand ist der Zustand mit der minimalsten Energie) Ionenbindung und kovalente Bindung sind nichtreale Grenzfälle der chemischen Bindung (d.h. es gibt keine rein ionische oder rein kovalente Bindung!) Ue Mol 7 fh-pw Ionenbindung Edelgase besitzen Elektronenkonfigurationen mit abgeschlossenen Elektronenschalen. Diese vollständige Besetzung der Schalen bewirkt die chemische Inaktivität der Edelgase. 5 Äußere Elektronenschalen 4 He 1s2 ↑↓ Ne 2s 2 ↑↓ 2p ↑↓ ↑↓ ↑↓ Ar 3s2 ↑↓ 3p6 ↑↓ ↑↓ ↑↓ 6 W.Kossel (1915) Ionenbindung = Elektronenaustausch der Bindungspartner, damit ihre Atomhüllen Edelgaskonfiguration annehmen. Atome werden durch elektrostatische Kräfte zusammengehalten. 3 113 ? ... 118 ? 6 5f 99 Es ...112 ? 14 6d 89 Ac ... 98 Cf 10 7s 87 Fr ... 88 Ra 2 6p 81 Tl ... 86 Rn 6 5d 71 Lu ... 80 Hg 10 4f 57 La ... 70 Yb 14 6s 55 Cs ... 56 Ba 2 5p 49 In ... 54 Xe 6 4d 39 Y ... 48 Cd 10 5s 37 Rb ... 38 Sr 2 4p 31 Ga ... 36 Kr 6 3d 21 Sc ... 30 Zn 10 4s 19 K ... 20 Ca 2 3p 13 Al ... 18 Ar 6 3s 11 Na ... 12 Mg 2 2p 5 B ... 10 Ne 6 2s 3 Li ... 4 Be 2 1s 1 H ... 2 He 2 nl Z Element # 2 1 n Ue Mol 8 7p fh-pw Ionenbindung Zwei Partner bei Ionenbindung: (Ziel → Edelgaskonfiguration der beteiligten Ionen) 1) 2) Element mit niedriger Ionisationsenergie - wenig Energie ist notwendig um Elektron(en) vom Atom zu entfernen Element mit großer Elektronenaffinitätsenergie (= Energie, die frei wird, wenn ein Elektron an ein neutrales Atom angelagert wird) Beispiele : Na + Cl → Na + + Cl− → NaCl P + 3H → P3- + 3H+ → PH3 P + 5Cl → P5 + + 5Cl− → PCl5 Si + 2O → Si4+ + 2O 2− → SiO 2 Valenz (maximale Wertigkeit): maximale Anzahl der Elektronen, die ein Atom aufnehmen bzw. abgeben kann, um Edelgaskonfiguration zu erreichen Ue Mol 9 fh-pw Kovalente, homöopolare Bindung Nur eine geringe Anzahl der chemischen Verbindungen sind ionisch gebunden Speziell bei der Bildung von zweiatomigen Molekülen mit gleichen Partnern versagt die Theorie der Ionenbindung. Lewis entwickelte die „Oktett-Theorie“, mit deren Hilfe die kovalente Bindung gedeutet werden konnte. Quantentheorie liefert eine Erklärung für die homöopolare Bindung. Gilbert N. Lewis (1916) Für die Hüllenelektronen ist die Edelgaskonfiguration am günstigsten: 2s +6p Elektronen = 8 Elektronen (Oktett) Homöopolare Bindung durch Bildung von Elektronenpaaren. Die Elektronenpaare gehören beiden Bildungspartnern! Beispiel: H2-Molekül ( H-H ) Ue Mol 10 fh-pw Kovalente Bindung: Beispiele Oktett-Regel: wenn Atome eine kovalente Bindung eingehen, versuchen sie so viele Elektronen zu teilen, daß die äußerste Elektronenschalen auf 8 Elektronen aufgefüllt werden (H und He auf 2 Elektronen) Jeder Punkt stellt ein Valenzelektron dar. Elektronen, die zu zwei Atomen gehören, werden als Strich eingezeichnet. Stickstoff-Molekül Chlor-Molekül O2-Molekül CO2-Molekül Siehe auch: http://library.thinkquest.org/3659/ Ue Mol 11 fh-pw Beispiele: Oktett-Theorie CH4 NH3 Oft werden nur jene Elektronen eingezeichnet, die zur Bindung beitragen. Ue Mol 12 H2O H2SO4 Die Oktetttheorie geht davon aus, dass 8 Valenzelektronen zur Edelgaskonfiguration beitragen. Abweichungen treten auf, wenn, wie im Fall von Schwefel, nicht nur s- und p-Elektronen, sondern auch d-Elektronen die Valenzelektronenschale bilden. Daher ist es auch möglich, dass im H2SO4 Molekül die beiden freien O-Atome durch Doppelbindungen mit dem S-Atom verbunden sind und nicht, wie erwartet, nur mit einer Einfachbindung. fh-pw Vergleich: kovalente-ionische Bindung Ue Mol 13 fh-pw Metallische Bindung Metalle und Legierungen haben besondere Eigenschaften, u.a.: • hohe Festigkeit und Dehnbarkeit • großes Absorptions- und Reflexionsvermögen • hohe elektrische und thermische Leitfähgkeit Drude postulierte 1900, dass diese Eigenschaften nur durch die sog. metallische Bindung ermöglicht werden: • eine vollständige Delokalisation der Valenzelektronen • Metallgitter besteht aus postiven Ionen • im Feld der Gitterionen können sich die Valenzelektronen quasifrei bewegen (Elektronengas) • Quantentheorie liefert die Erklärung für die metallische Bindung Ue Mol 14 fh-pw Orbitale Orbitale sind Elektronenzustände in einem Atom (quantenmechanisch gekennzeichnet durch die Quantenzahlen n, m, l) 3s orbital 3d orbitals Ue Mol 15 fh-pw Hybridorbitale Bestimmte Bindungen lassen sich oft nur dadurch erklären, daß sich die Elektronenhüllen der Bindungspartner wesentlich von der der ungebundenen Atome im Grundzustand unterscheiden. Beispiel: CH4, 4-Wertigkeit des Kohlenstoffes Kohlenstoff besitzt 2 s- und 2 p-Elektronen. Im CH4 Molekül jedoch bilden sich vier gleichwertige Bindungen mit den H-Atomen. Die Bildung des Moleküls erfolgt über den Umweg eines angeregten Zustandes des C-Atoms (Promovierung) und der Bildung von sog. sp3 - Hybridorbitalen (Hybridisierung) aus einem s und drei p Elektronen. Der Endzustand ist energetisch günstiger als der Ausgangszustand. Bei der Hybridisierung bilden sich 4 gleichwertige sp3 Hybridorbitale. C sp3 Hybridisierung C s1p3 Promovierung (angeregter Zstd) C s2p2 Grundzustand CH4 Bindungszustand Ue Mol 16 fh-pw Molekülformen Lineare Form BeCl2 Planare Gewinkelt dreieckige Form H2O BCl3 Tetraeder Trigonale Bipyramiden Octaeder CH4 PCl5 SF6 Die vorhandenen Orbitale bzw. Hybridorbitale sind mitverantworlich für die geometrische Form der Moleküle. • • • Die Anzahl der Valenzelektronen bestimmt die Molekülform: (Be: 2s2, B: 2s22p1, C: 2s22p2, P: 3s23p3, S: 3s24p4). Die Molekülformen bleiben auch erhalten, wenn ein oder mehrere Elektronen nicht mit anderen Elementen geteilt werden. Doppel- oder Dreifachbindungen kann man als einfache Bindung behandeln. Beispiel: CO2 , O=C=O, zentrales Atom mit zwei Bindungen, daher lineare Form Ue Mol 17 fh-pw