Labordiagnostik im Notfall - Ernst-Moritz-Arndt
Werbung

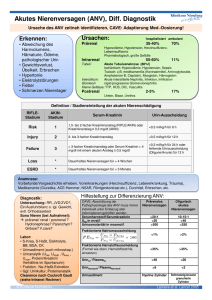
Labordiagnostik im Notfall Dr. med. Christin Spielhagen Institut für Klinische Chemie und Laboratoriumsmedizin Ernst-Moritz-Arndt-Universität Greifswald Was ist im Notfall zu beachten? - präanalytisch - analytisch Einflussgrößen, die Veränderung der Analyseergebnisse bewirken: • Blutentnahmezeitpunkt • Körperlage bei Übergang Liegen zum Stehen treten ca. 8% der intravasalen Körperflüssigkeit in den extravasalen Raum über Anstieg der Konzentration der Analyte, die nicht im gleichen Ausmaß verschoben werden (Blutzellen, Proteine, an Proteine gebundene Stoffe wie Calcium und Cholesterin) besonders ausgeprägt bei Patienten mit Ödemen • Stauungstechnik bei Blutentnahme -> Hämolyse • körperliche Belastung Hämokonzentration, Enzymfreisetzungen (LDH, CK, ASAT) • Medikamenteneinnahme, Nahrungsaufnahme Patient 1 • • • • 45 jährige Frau Aufnahme mit zunehmender Dyspnoe und US-Ödemen seit 3 Monaten RR 110/60 mmHg, Hf 90/min, Af 20/min Medikamente: Betablocker, ACE-Hemmer, Diuretikum Differentialdiagnose Dyspnoe • Atemantrieb (Enzephalitits, medikamentös tox., Hyperventilation) • Muskuloskeletal (Muskel-, Zwerchfellerkr., Thoraxdeformitäten, Schädigung N. phrenicus) • Pleural (Pleuraerguss, Pneumothorax) • Atemwege (Trachealstenose, obstruktive Atemwegserkr.) • Gasaustausch (Pneumonie, Lungenembolie) • Kardiovaskulär (Linksherzinsuffizienz) • Hämatologisch (Anämie) Verdachtsdiagnose Herzinsuffizienz (HI) Definition Herzinsuffizienz • Unfähigkeit des Herzens, das benötigte Herzzeitvolumen bei normalem enddiastolischen Ventrikeldruck zu fördern • Klinisches Symptom unterschiedlicher Ätiologie (häufigste Ursachen sind HT, KHK) Herzinsuffizienzdiagnose WHO • verminderte körperliche Belastbarkeit aufgrund ventrikulärer Funktionsstörung Einteilung nach subjektiven Beschwerden in NYHA-Stadien I-IV Klinik Links-HI • Vorwärtsversagen = vermindertes HZV (niedriger RR, periphere Minderperfusion, Muskelschwäche, reduzierte Leistungsfähigkeit) • Rückwärtsversagen = Lungenstauung (Dyspnoe, Lungenödem, Zyanose) Klinik Rechts-HI • Rückstau in großen Kreislauf (Venenstauung z.B. HVES, Ödeme, Stauungsleber, Aszites) Globalinsuffizienz = Links- + Rechts-Herzinsuffizienz Diagnostik HI • Anamnese • Klinik • ECHO • EKG • Labor (ursächliche Erkrankungen, Herzinsuffizienzmarker) • Bildgebung (Röntgen, MRT) • Biopsie, Koronarangiographie NTpro-BNP • Eigenschaften nicht spezifisch • Labordiagnostik Prüfmaterial: Serum, Plasma, Immunoassay BNP= brain natriuretic peptide NTpro-BNP= N-terminales Fragment NTpro-BNP • im Rahmen eines Kompensationsmechanismus bei HI • infolge Dehnung der Vorhöfe oder Kammern von Myokardzellen freigesetzt (Wandspannung, neurohumerale Stimulation) • aus Vorläuferprotein proBNP entsteht in äquivalenten Mengen BNP und NTpro-BNP NTpro-BNP • BNP - wirkt vasodilatatorisch, natriuretisch-diuretisch - Salz- und Wasserhomöostase, Regulation des Blutdrucks • NTpro-BNP - biologisch inaktiv - in höherer Konzentration im Blut - längere Halbwertzeit - ist im Serum stabil -> mit großer Genauigkeit zu messen NTpro-BNP mit zunehmender Herzinsuffizienz steigt NTpro-BNP-Spiegel • Höhe des Spiegels korreliert mit Verlauf und klinischen Schweregrad der Herzinsuffizienz • Zuordnung zum NYHA-Stadium ist mittels alleiniger Bestimmung von NTpro-BNP nicht möglich • bei Patienten mit bekannter Herzinsuffizienz zur Risikostratifikation und Verlaufskontrolle bei HI ist Mortalität mit steigendem NTpro-BNP-Spiegel erhöht NTpro-BNP • aufgrund des hohen negativ prädiktiven Wertes bei niedrigen Konzentrationen (< 100 pg/ml) -> HI bei symptomatischen Patienten weitgehend ausgeschlossen • hoher positiver prädiktiver Wert bei Konzentrationen (> 500 pg/ml) -> HI bei symptomatischen Patienten wahrscheinlich (Unterschiedliche Cut-Offs werden verwendet!) Einsatzmöglichkeiten NTpro-BNP • Differentialdiagnose akute Dyspnoe, Hinweis HI • chronische Dyspnoe, Einschätzung linksventrikulärer EF, Schweregrad HI • Einschätzung Prognose bei bekannter HI • Einschätzung Prognose nach AMI • Titration Therapie HI NTpro-BNP • kein Screening ohne Berücksichtigung klinischer Symptome -> gezielter Einsatz • neben linksventrikulärer EF (bei Reduktion +), haben Geschlecht (W +), Alter (+), Grad der Kompensation, linksventrikuläre Masse (Erhöhung +), Adipositas (+), Nierenfunktion (NI +), Hyperthyreose (+), Malignome (+) und Pharmakotherapie (z.B. ACE-Hemmer, Diuretika -) Einfluss auf die Konzentration • trotz hohen negativ prädiktiven Wertes: Herzinsuffizienz kann auch bei niedrigen Werten vorliegen Herzinsuffizienz kann bei hohen Werten nicht Ursache sein Fallbeispiel NTpo-BNP H. S., 27.11.31, männlich Dyspnoe, HF 80/min, RR 87/47 mmHg, Pulmo: RG's bds., US-Ödeme bds. bekannte Diagnosen: 3-Gefäß-KHK, Z. n. Bypass-OP 2002, NSTEMI 2009 -> Diagnose: HI, ECHO: EF 20%, rekompensierende Therapie Patient 2 • 20 jährige Frau • vom Notarzt gebracht • in Häuslichkeit bewusstlos aufgefunden bei bekanntem Diabetes mellitus Typ 1 (insulinpflichtig) Verdachtsdiagnose Hypoglykämie Definition Hypoglykämie • Verminderung BZ unter 2,8 mmol/l in Verbindung mit Symptomatik • Verschwinden der Symptome nach Glukosegabe • BZ zwischen 2,8-3,3 mmol/l auch bei Gesunden Symptome Hypoglykämie BZ < 3,0 mmol/l: • vegetative=autonome Symptome - parasympathikoton: Hunger, Übelkeit, Erbrechen - sympathikoton: Schwitzen, Tremor, Tachykardie, Blässe, Unruhe BZ < 2,6 mmol/l: • neuroglykopenische Symptome (Koordinationsstörungen, Konzentrationsstörungen, Bewusstseinsstörung, Doppelbilder, Sprachstörungen, Krampfneigung) • hypoglykämischer Schock Ursachen Hypoglykämie • verminderte endogene Glukosebildung, mangelnde Glukoseaufnahme • gesteigerter Glukoseverbrauch • Mangel an Insulinantagonisten Ursachen Hypoglykämie • Überdosierung Insulin, oralen Antidiabetika (Sulfonylharnstoffe) • Insulinom, paraneoplastisch • Leberfunktionsstörung (Glukoseproduktion vermindert, Glykogenmangel) • Alkoholintoxikation (Hemmung Glykogenolyse, Glukoneogenese) • Nebenniereninsuffizienz (Mangel Insulin-Antagonisten- Noradrenalin, Cortisol) • schwere Infektion, Sepsis • extreme körperliche Anstrengung Therapie Hypoglykämie • Glukosezufuhr (p.o., i.v. 1 bis 2 BE/KHE) • Glukagon s.c, i.m. • BZ steigt nur relativ langsam, korreliert nicht direkt mit der spürbaren Erholung Patienten • Vitalzeichen überprüfen • ggf. Kontrolle des BZ mit einem Blutzuckermessgerät Glukosemessung mit Messgerät amperometrische Messung • Blut im Teststreifen über Kapillare auf Testfeld eingesaugt • Reaktion Glukose mit Glukoseoxidase -> Glukonsäure + Wasserstoffperoxid • Wasserstoffperoxid an Platinelektrode detektiert • Änderung des elektrischen Potential an Elektrode • -> Rückschluss auf BZ • erlaubte Schwankungsbreite der Messergebnisse+/- 11 % von Messung zu Messung -> Messgerät nicht für Diagnostik DM geeignet Glukosemessung mit Messgerät falsche Messergebnisse: • Zuckerreste an Blutentnahmestelle (z.B. von Obst) • zu starkes „Ausmelken“ der Fingerbeere • Teststreifen Feuchtigkeit ausgesetzt (Entnahmebehälter unmittelbar wieder verschließen!) • Haltbarkeit Teststreifen überschritten • bei Anbruch neuer Packung, Code nicht erneuert (Eich-Prinzip) falsch niedrige Messwerte im Labor • Analytik zeitverzögert Patient 3 • • • • • 55 jähriger Mann Aufnahme mit linksthorakalen Schmerzen, Dyspnoe RR 145/80 mmHg, Hf 80/min Raucher Medikamente: Betablocker, ACE-Hemmer aus dem Netter-Atlas Verdachtsdiagnose Akuter Myokardinfarkt (AMI) Definition AMI • ischämische Myokardnekrose durch hochgradige Stenose bzw. Verschluss einer Koronararterie • meist auf Boden einer KHK (Manifestation der Arteriosklerose in den Koronararterien) • andere Genese z.B. embolisch • Form der symptomatischen KHK und des akuten Koronarsyndroms • bei Schädigung der Herzmuskelzelle werden zytosolische Komponenten und Bestandteile des kontraktilen Apparates freigesetzt Akutes Koronarsyndrom • instabile Angina pectoris (AP) - AP ohne Anstieg von Troponin - Risiko für akuten Infarkt (20%), Linksherzinsuffizienz oder Rhythmusstörungen • NSTEMI= non ST-segment-elevation myocardial infarction - AMI ohne ST-Streckenhebung - mit Anstieg von Troponin • STEMI= ST-segment-elevation myocardial infarction - AMI mit ST-Streckenhebung und Anstieg von Troponin Klinik AMI • starke anhaltende AP-Schmerzen= Brustschmerzen= Präkordialschmerzen, die nicht durch Ruhe od. Nitroglyzerin beeinflussbar • Cave: stumme Infarkte, anderer Schmerzcharakter • Angst, Schwäche • Vegetative Begleitsymptomatik (Schwitzen, Übelkeit, Erbrechen) • Rhythmusstörungen • Bewusstlosigkeit • Hypotonie • Dyspnoe Risikofaktoren KHK HAUPTRISIKOFAKTOREN • Nikotin • Hypertonus • Erhöhung LDL-Cholesterol • Erniedrigung HDL-Cholesterol • Alter (m>45J., w>55J.) • Diabetes mellitus • familiäre Belastung weitere Risikofaktoren • atherogene Ernährung • Übergewicht • körperliche Inaktivität • andere Lipidstoffwechselstörungen • gestörte Glukosetoleranz • Entzündungszustände • Thromboseneigung • Hyperhomocysteinämie • Hyperfibrinogenämie Diagnostik AMI • Anamnese, Klinik • EKG • ECHO • Labor • Koronarangiographie Infarktdiagnose WHO 2 der 3 folgenden Faktoren: • typische Symptome • EKG-Veränderungen • Labormarker einer Myokardschädigung Labormarker AMI unspezifische begleitende Marker • Leukozyten, BSG, CRP, Glukose kardiale Marker • ASAT, LDH (nicht muskelspezifisch, früher für Spätdiagnose) • Myoglobin, CK, CKMB (nicht herzspezifisch) • Troponin I/T (herzspezifisch) kardiale Troponine • myofibrilläre Proteine des Herzmuskels • Freisetzung aus geschädigten Herzmuskelzelle: - aus Zytoplasma (freies cTnI und cTnT) - aus zellulären Myofibrillen (cTnI/T/C-Komplex= für Regulation Interaktion Myosin und Aktin) • TroponinI= Aktin-Myosin-Wechselwirkung hemmende Einheit • TroponinT= Tropomyosin bindende Einheit • kardiale Troponin= hochsensitive (hohe Konzentration im Myokard und schnelle Freisetzung) und hochspezifische (nur bei Myokardschaden nachweisbar) klin. chem. Kenngröße für den Myokardinfarkt kardiales Troponin I • Eigenschaften breites diagnostisches Fenster wird bereits bei Mikroläsionen des Myokardgewebes freigesetzt und ist über Tage nachweisbar frühester Marker für Myokardnekrosen • Labordiagnostik Material: Serum, Plasma, Immunoassay • Infarktdiagnostik und Verlaufskontrolle 2-6 h nach Infarktbeginn, 8-16 h Gipfel, 5-20 d Rückkehr in den Normalbereich Höhe des Anstiegs zur Risikoabschätzung Ursachen Troponin-Erhöhung • • • • • • • • • AMI Rhythmusstörungen Lungenembolie Infektionen (Myokarditis, Sepsis) kardiales Trauma Z. n. Herztransplantation kardiotoxische Substanzen Tumorinfiltration Niereninsuffizienz bei zusätzlicher Schädigung Kardiomyozyten Myoglobin • Eigenschaften nicht herzspezifisch, da Vorkommen in quergestreifter Muskulatur (Herzmuskulatur, Skelettmuskulatur) sauerstoffbindendes Hämprotein • Labordiagnostik Prüfmaterial: Serum, Plasma, Immunoassay • Infarktdiagnostik frühester Marker 2-4 h nach Infarktbeginn, nach 1-3 d wieder im Normalbereich ASAT, LDH, CK • Eigenschaften nicht herzspezifisch • Labordiagnostik Prüfmaterial: Serum, Plasma, Enzymdiagnostik Enzymdiagnostik (ASAT, LDH, CK) • Enzyme haben: - Reaktionsspezifität= Katalyse einer chemischen Reaktion erfolgt durch speziell erforderliches Enzym - Substratspezifität= nur bestimmte Substanz/Substanzgruppe dient als Reaktionspartner und wird umgesetzt Enzymdiagnostik • unterschiedliche Methoden verfügbar, kinetische Tests • sehr niedrige Massen-/Stoffmengenkonzentrationen Konzentrationsbestimmung i. d. R. nicht praktikabel • sondern Aktivitätsbestimmung Umsatz pro Zeiteinheit= Reaktionsgeschwindigkeit 1 Unit= 1 µmol/min= Enzymmenge, die 1 µmol Substrat in 1 min umsetzt 1 kat (Enzymeinheit)= katalytische Aktivität, die 1 mol Substrat pro s umsetzt = 1 µkat/l = 1 µmol / s ∙l Umrechnung in U/l x 0,0167= µkat/l • anschließende photometrische Messung Enzymdiagnostik 1. Enzym (blau) im Serum enthalten 2. Zusatz von Substrat (grau) 3. unter geeigneten Reaktionsbedingungen (pH-Wert, Temperatur optimal, ausreichend Substrat) setzt Enzym Substrat in Produkt (orange) um . 4. photometrisch gemessene Absorptionsänderung bei bestimmten Wellenlänge eines Indikators (Coenzym, umgesetzte Substrat, entstehende Produkt) pro Zeiteinheit als Maß der Reaktionsgeschwindigkeit Reaktionsgeschwindigkeit proportional der Enzymkonzentration Creatinkinase (CK) • Eigenschaften Gesamt-CK nicht herzspezifisch • Labordiagnostik Prüfmaterial: Serum, Plasma, Photometrie • Infarktdiagnostik und Verlaufskontrolle schneller Anstieg nach 4-8 h, nach 2-4 Tag wieder im Normbereich Höhe des Anstiegs und Infarktausdehnung korrelieren Isoenzyme • Enzymvarianten • Enzyme, die gleiche Reaktion katalysieren, aber unterschiedliche Proteinstruktur aufweisen • Unterschiedliche Affinität zum Substrat, Hitzelabilität usw. • für Regulation organspezifischer Stoffwechselvorgänge Creatinkinase (CK) • Eigenschaften katalysiert Reaktion: Creatinphosphat + ADP <-> Creatin + ATP • durch postsynthetische Modifikation der CK 4 Isoformen aus Untereinheiten M (muscle), B (brain) zytoplasmatisch CK-MM (Skelettmuskeltyp): - 97% der Gesamt-CK-Aktivität im Blut, - aus Skelettmuskel und zu geringem Anteil aus Herzmuskel CK-MB (Myokardtyp): - zu 97-99% aus Herzmuskel, aber 1-3% aus Skelettmuskel CK-BB (Hirntyp): - aus Gehirn, glatter Muskulatur von Harnblase, Prostata, Uterus, Plazenta, GIT, Gefäßwände, Lunge CK-MB • CK-MB-Aktivität= Messung der CK-Restaktivität nach Blockierung der CK-M-Untereinheit durch spezifische AK, weniger sensitiv für AMI, labortechnisch einfache photometrische Immuninhibitionsmethode • CK-MB-Masse= Konzentration, höhere Sensitivität, labortechnisch aufwendiger Immunoassay CK-MB photometrische Immuninhibitionsmethode da CK-MB auch zu 1-3% in Skelettmuskelzellen exprimiert -> CK/CK-MB-Index soll Spezifität für Herzmuskelschädigung erhöhen • CK-MB-Anteil: 6 -25% der Gesamt-CK = wahrscheinlich Enzymfreisetzung aus Myokardgewebe • CK-MB-Anteil: >25% = Vorliegen einer Makro-CK oder CK-BB, die fälschlicherweise als CK-MB „bestimmt“ wird Ursachen CK-Erhöhung • • • • • • • • • • • • • • • Perikarditis, Myokarditis Z. n. elektrischer Kardioversion, Reanimation Z. n. Herztransplantation kardiotoxische Substanzen Skelettmuskelerkrankungen starke körperliche Anstrengung i.m.-Injektion, Trauma, Operation Alkoholintoxikation, Intoxikationen, Medikamentennebenwirkung arterieller Verschluss, arterielle Embolie Malignome Lungenembolie cerebrale Erkrankungen z.B. epileptische Anfälle, SHT, SAB Entbindung (CK-BB aus Uterus) nekrotisierende Pankreatitis, Leberzellnekrose Infektionen Stellenwert des Labors bei Diagnostik/Therapie AMI DGK 2004 Fallbeispiele AMI S. M., 22.5.66, männlich intermittierendes retrosternales Druckgefühl, Ausstrahlung in Hals, keine Dyspnoe, Nikotinabusus 10-15 Zigaretten/d seit 29 Jahren, keine EKG-Veränderungen -> Diagnose: NSTEMI N. R., 7.3.40, weiblich retrosternaler Druckschmerz, Angst, Kaltschweißigkeit, Übelkeit, Erbrechen bekannte Diagnosen: arterieller Hypertonus, DM 2 -> Diagnose: ST-Hebungsinfarkt, koronare 3-Gefäßerkrankung, begleitende Harnwegsinfektion, Therapie: PTCA und Implantation von 2 Stents L. J., 26.7.53, männlich Reanimation bei kardiogenem Schock infolge eines Vorderwandinfarktes Patient 4 • • • • 80 jähriger Mann Aufnahme mit Bewusstseinstrübung, nachlassender Diurese hatte Tage zuvor Diarrhoe lebt allein, versorgt sich selbst Verdachtsdiagnose Akutes Nierenversagen (ANV) Definition ANV • akut einsetzende, rasche Abnahme der Nierenfunktion, die über Tage anhält und reversibel ist • Leitsymptom Oligo-, Anurie, Anstieg Kreatinin >50% Ausgangswert • Folgen: Retention harnpflichtiger Substanzen, Störung Flüssigkeit-, Elektrolyt-, Säure-Basen-Haushaltes Formen ANV • Prärenal (verminderte Perfusion, vermehrter Proteinkatabolismus) • Intrarenal (Tubulusnekrosen, Obstruktion der Tubuli) • Postrenal (Abflussstörung) Definition chronisches NV • irreversible Verminderung der glomerulären, tubulären und endokrinen Nierenfunktion Pathophysiologie NV • Versagen der exkretorischen Nierenfunktion (Konzentrierungsdefekt, Retention harnpflichtiger Substanzen) -> Messung von Kreatinin und Harnstoff -> Messung von Cystatin C • Störung Flüssigkeits- Elektrolythaushalt - Salz-, Wasserretention (fraktionelle Natriumausscheidung erschöpft, Hypertonie) -> Messung der Elektrolyte - Hyperkaliämie (verminderte Kaliumausscheidung bei Oligurie, infolge Azidose, tubuläre und intestinale Sekretionskapazität überschritten) • Störung Säure-Basen-Haushalt (tubulärer H+-Sekretionsdefekt -> metabolische Azidose) Pathophysiologie NV • Abnahme inkretorischen Nierenfunktion (verminderte Erythropoietinsynthese, Aktivierung 25(OH)Vitamin D3 zu 1,25-(OH)2-Vit.D3=Calcitriol) -> Messung von Blutbild, Ferritin, Transferrinsättigung, Vitamin B12, keine Messung des Erythropoietins • renale Osteopathie/sekundärer Hyperparathyreoidismus (ossäre Kalziumfreisetzung infolge Azidose; Hypokalziämie infolge gestörter intestinaler Reabsorption, Hyperphosphatämie infolge Phosphatretention, Mangel Calcitriol) -> Messung von Kalzium, Phosphat, Parathormon, Vitamin D Klinik NV • oft unspezifisch • Komplikationen: - Überwässerung (Lungen-, Hirnödem, Pleuraergüsse, USÖdeme, Hypertonie) - Hyperkaliämie (Rhythmusstörungen) - metabolische Azidose - Enzephalopathie (Krämpfe, Bewusstseinsstörung) - gastrointestinal (hämorrhagische Gastritis, Blutungsneigung) - Anämie - Infektionsneigung Diagnostik ANV • Anamnese • Klinik • Diuresemenge • Labor (ursächliche Erkrankung) • Bildgebung (Sonographie) erste Laborparameter bei ANV • Urin: Urinstatus, Urinsediment • Blut: Kreatinin, Harnstoff, Elektrolyte, SBH, Blutbild • Kreatinin-Clearance Harnstoff • • • • • • • Eigenschaften Endprodukt Harnstoffzyklus harnpflichtige Substanz Konzentration spiegelt Funktionsfähigkeit der Nieren wieder von Glomeruli frei filtriert und in Tubuli teilweise rückresorbiert osmotische Wirksamkeit wird für Harnkonzentrierung genutzt Konzentration im Blut variiert mit Proteinzufuhr in Nahrung und Proteinabbaurate • Labordiagnostik Prüfmaterial: Serum, Plasma, enzymatische Messung (Harnstoff durch Urease in NH3 und CO2, Messung der Absorptionsabnahme eines zugegeben Coenzyms, welches bei Reaktion verbraucht wird) Kreatinin • Eigenschaften • entsteht im Muskelstoffwechsel aus Phosphokreatin (Energiespeichersubstanz im Muskel) • harnpflichtige Substanz • Konzentration spiegelt Funktionsfähigkeit Nieren wieder • glomerulär frei filtriert, tubulär nicht rückresorbiert, teilweise sezerniert • erhöhte Konzentration im Blut erst, wenn GFR < 50% • unter Annahme, dass Kreatininproduktion konstant (gleichbleibende Muskelmasse, Muskeltätigkeit): steigt Kreatininkonzentration mit fallender GFR • Labordiagnostik Prüfmaterial: Serum, Plasma, enzymatische Messung (Jaffé-Reaktion: aus Kreatinin durch Pikrinsäure orangefarbene Verbindung; Verfälschung durch andere Chromogene und Pseudokreatinine) Cystatin C • Eigenschaften • Proteaseinhibitor: neutralisiert von Lysosomen freigesetzte oder aus apoptotischen Zellen stammende Proteasen • in allen Körperzellen mit konstanter Rate gebildet • Konzentration spiegelt Funktionsfähigkeit Nieren wieder • nur glomerulär filtriert • sensitiverer und spezifischerer Marker bei leichter Einschränkung der GFR • Konzentration korreliert gut mit GFR • kaum von anderen Faktoren beeinflusst: nicht von Alter, Geschlecht, Muskelmasse • Einschätzung der Nierenfunktion bei Pat. mit geringer Muskelmasse • Labordiagnostik Prüfmaterial: Serum, Plasma, Immunoassay Fallbeispiele ANV 2jähriges Kind mit maligner Erkrankung 35jähriger Mann auf ITS H. M., 16.06.26, weiblich multimorbide demente Pat. mit Exsikkose, Hämatemesis, Hyperglykämie, trockene Schleimhäute -> Diagnose: prärenales ANV (Kreatinin im Vorbefund normal) K. S., 19.10.40, weiblich Somnolenz, seit 1 Wo. Schwächegefühl, seit 3 d Husten ohne Auswurf, kein Fieber, Pollakisurie, keine Algurie; Labor: metabolische Azidose und -> Diagnose: prärenales ANV bei HWI bei chronischer NI