Ondansetron-Actavis i.v. 2 mg/ml
Werbung

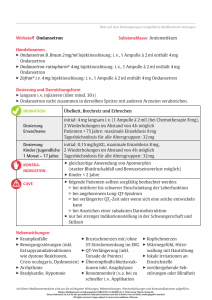
Gebrauchsinformation: Information für Anwender Ondansetron-Actavis i.v. 2 mg/ml Injektionslösung 8 mg/4 ml Ondansetronhydrochlorid-Dihydrat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen. • Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen. • Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal. • Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie. • Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4. Was in dieser Packungsbeilage steht 1.Was ist Ondansetron-Actavis i.v. 2 mg/ml und wofür wird es angewendet? 2.Was sollten Sie vor der Anwendung von Ondansetron-Actavis i.v. 2 mg/ml beachten? 3.Wie ist Ondansetron-Actavis i.v. 2 mg/ml anzuwenden? 4. Welche Nebenwirkungen sind möglich? 5.Wie ist Ondansetron-Actavis i.v. 2 mg/ml aufzubewahren? 6.Inhalt der Packung und weitere Informationen 1. WAS IST ONDANSETRON-ACTAVIS I.V. 2 MG/ML UND WOFÜR WIRD ES ANGEWENDET? Ondansetron-Actavis i.v. 2 mg/ml gehört zur Arzneimittelgruppe der so genannten Antiemetika. Antiemetika helfen, Übelkeit und Erbrechen zu kontrollieren. Ondansetron-Actavis i.v. 2 mg/ml gehört zu einer besonderen Gruppe der Antiemetika, die als 5HT3-Antagonisten bezeichnet werden. Ondansetron-Actavis i.v. 2 mg/ml wird zur Vorbeugung und Behandlung von Übelkeit oder Erbrechen angewendet, die verursacht wurden durch: • eine Behandlung mit Krebsmedikamenten (zytostatische Chemotherapie) und Strahlentherapie (Radiotherapie) • eine Operation Bei Kindern über 6 Monaten wird Ondansetron-Actavis i.v. 2 mg/ ml zur Vorbeugung und Behandlung von Übelkeit und Erbrechen angewendet, die durch eine Behandlung mit Krebsmedikamenten (zytostatische Chemotherapie) oder durch Bestrahlung (Radiotherapie) hervorgerufen werden. Bei Kindern im Alter über 1 Monat wird Ondansetron-Actavis i.v. 2 mg/ ml zur Vorbeugung und Behandlung von Übelkeit und Erbrechen als Folge von chirurgischen Eingriffen angewendet. 2. WAS SOLLTEN SIE VOR DER ANWENDUNG VON ONDANSETRONACTAVIS I.V. 2 MG/ML BEACHTEN? Ondansetron-Actavis i.v. 2 mg/ml darf nicht angewendet werden, - wenn Sie allergisch gegen Ondansetron oder einen der in Abschnitt 6. genannten sonstigen Bestandteile dieses Arzneimittels sind. - wenn Sie Apomorphin (Arzneistoff zur Behandlung der Parkinsonkrankheit) einnehmen. - bei Kindern mit einer Körperoberfläche von weniger als 0,6 m2 bzw. mit einem Körpergewicht bis zu 10 kg. Für diese Patientengruppe stehen geeignetere Darreichungsformen mit einem niedrigeren Wirkstoffgehalt zur Verfügung (Ondansetron-Actavis i.v. 2 mg/ml Injektionslösung 4 mg/2 ml) - wenn Sie allergisch gegen ähnliche Arzneimittel aus derselben Wirkstoffgruppe (sog. 5HT3-Antagonisten, wie z.B. Granisetron oder Dolasetron) sind. Warnhinweise und Vorsichtsmaßnahmen Bitte sprechen Sie mit Ihrem Arzt, Apotheker oder derm medizinischen Fachpersonal, bevor Sie Ondansetron-Actavis i.v. 2 mg/ml anwenden. • wenn Sie einen Darmverschluss haben oder unter einer starken Darmverstopfung leiden. Ondansetron-Actavis i.v. 2 mg/ml kann eine Darmverstopfung verursachen, daher sollte der Arzt Sie sorgfältig auf entsprechende Anzeichen hin überwachen. • wenn Sie eine Herzerkrankung haben. Besondere Vorsicht ist geboten: − bei gleichzeitiger Verabreichung von Ondansetron-Actavis i.v. 2 mg/ml und Narkosemitteln an Patienten mit unregelmäßigem Herzschlag oder Herzüberleitungsstörungen. − bei gleichzeitiger Verabreichung von OndansetronActavis i.v. 2 mg/ml an Patienten, die Arzneimittel gegen unregelmäßigen Herzschlag (Antiarrhythmika) oder bestimmte blutdrucksenkende Arzneimittel (Betablocker) einnehmen. Bitte informieren Sie Ihren Arzt, wenn Sie eine Herzerkrankung haben, da eine der oben genannten Warnhinweise auf Sie zutreffen könnte. • bei Kindern und Jugendlichen, wenn sie mit Arzneimitteln behandelt werden, die die Leberfunktion beeinflussen (z. B. Krebsmedikamente). • wenn bei Ihnen eine Mandelentfernung geplant ist. Die Anwendung von Ondansetron-Actavis i.v. 2 mg/ml kann dazu führen, dass Blutungen nicht bemerkt werden, daher muss der Arzt Sie sorgfältig auf solche Anzeichen hin überwachen. • wenn bei Ihnen eine Störung der Blutsalze, z.B. der Kalium-, Natriumoder Magnesium-Blutspiegel vorliegt. • wenn Sie Unruhe, Verwirrtheit, Durchfall, hohe Körpertemperatur, hohen Blutdruck, übermäßiges Schwitzen und schnellen Herzschlag bei sich feststellen. Diese Symptome kommen bei dem sogenannten Serotonin-Syndrom vor. Es kann auftreten, wenn Sie OndansetronActavis i.v. 2 mg/ml gleichzeitig mit bestimmten anderen Arzneimitteln (wie SSRI oder SNRI zur Behandlung von Depressionen) anwenden. Ondansetron verlängert dosisabhängig das QT-Intervall (d. h. eine im EKG sichtbare Verzögerung der Erregungsausbreitung im Herzmuskel mit der Gefahr lebensbedrohlicher Herzrhythmusstörungen). Außerdem wurden bei Patienten, die Ondansetron erhielten, Fälle von Torsade de Pointes (besondere Form der Herzrhythmusstörung) berichtet. Bei Patienten mit angeborenem Long-QT-Syndrom (erbliche, evtl. bereits im Säuglingsalter manifeste Erkrankung, gekennzeichnet durch bestimmte EKG-Veränderungen) sollte die Anwendung von Ondansetron vermieden werden. Bei Patienten, die die oben beschriebenen EKG-Veränderungen aufweisen oder diese entwickeln können, sollte Ondansetron mit Vorsicht angewendet werden. Zu dieser Gruppe gehören Patienten mit Elektrolytstörungen, Herzschwäche, verlangsamtem Herzschlag oder Patienten, die andere Arzneimittel einnehmen, die eine Verlängerung des QT-Intervalls oder Elektrolytstörungen hervorrufen. Anwendung von Ondansetron-Actavis i.v. 2 mg/ml zusammen mit anderen Arzneimitteln Informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel einnehmen/anwenden, kürzlich andere Arzneimittel eingenommen/ angewendet haben oder beabsichtigen andere Arzneimittel einzunehmen/anzuwenden. Ondansetron-Actavis i.v. 2 mg/ml kann die Wirkung anderer Arzneimittel beeinflussen oder diese können ihrerseits die Wirksamkeit von Ondansetron-Actavis i.v. 2 mg/ml beeinflussen. Der behandelnde Arzt wird Ihnen sagen, ob Sie diese Arzneimittel zusammen einnehmen können. • Bestimmte Arzneimittel gegen Epilepsie (Phenytoin und Carbamazepin) können die Konzentration von Ondansetron im Körper verringern und so die Wirkung von Ondansetron herabsetzen. • Das Arzneimittel Rifampicin zur Behandlung von Juckreiz, Tuberkulose und Lepra kann ebenfalls die Konzentration von Ondansetron im Körper verringern und so die Wirkung von Ondansetron herabsetzen. • Die schmerzstillende Wirkung von Tramadol kann durch die gleichzeitige Anwendung mit Ondansetron abgeschwächt werden. • Bestimmte Krebsmedikamente, sogenannte Anthrazykline (Doxorubicin, Daunorubicin) oder Trastuzumab können durch Wechselwirkung mit Ondansetron den Herzrhythmus beeinflussen. • Antiarrhythmika (wie Amiodaron), die zur Behandlung eines unregelmäßigen Herzschlags verwendet werden, können durch Wechselwirkung mit Ondansetron den Herzrhythmus beeinflussen. • Betablocker (wie Atenolol oder Timolol), die zur Behandlung von bestimmten Herz- oder Augenerkrankungen, Angstzuständen oder zur Vorbeugung gegen Migräne verwendet werden, können durch Wechselwirkung mit Ondansetron den Herzrhythmus beeinflussen. • Bestimmte Arzneimittel zur Behandlung von Infektionen (wie Erythromycin oder Ketoconazol) können durch Wechselwirkung mit Ondansetron den Herzrhythmus beeinflussen. • Bestimmte Arzneimittel zur Behandlung von Depressionen (wie SSRI und SNRI) können bei gleichzeitiger Anwendung mit Ondansetron ein Serotonin-Syndrom verursachen. Durch die Anwendung von Ondansetron mit Arzneimitteln, die eine Verlängerung der QT-Zeit verursachen, kann die QTZeit zusätzlich verlängert werden (d. h. eine im EKG sichtbare Verzögerung der Erregungsausbreitung im Herzmuskel mit der Gefahr lebensbedrohlicher Herzrhythmusstörungen). Die gleichzeitige Anwendung von Ondansetron mit kardiotoxischen Arzneimitteln (Arzneimittel mit schädlichen Auswirkungen auf das Herz), wie z. B. Anthracycline, kann das Risiko für das Auftreten von Herzrhythmusstörungen (Arrhythmien) erhöhen. Die gleichzeitige Anwendung von Ondansetron-Actavis i.v. 2 mg/ml mit Arzneimitteln, die eine Verlängerung des QT-Intervalls und/oder Elektrolytstörungen hervorrufen, sollte mit Vorsicht erfolgen (siehe auch „Warnhinweise und Vorsichtsmaßnahmen“). Anwendung von Ondansetron Actavis i.v. 2 mg/ml zusammen mit Nahrungsmitteln und Getränken Die Einnahme von Nahrungsmitteln und Getränken hat keinen Einfluss auf die Wirksamkeit von Ondansetron-Actavis i.v. 2 mg/ml. Schwangerschaft und Stillzeit Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein oder beabsichtigen, schwanger zu werden, fragen Sie vor der Anwendung dieses Arzneimittels Ihren Arzt um Rat. Es liegen keine ausreichenden Daten vor, um beurteilen zu können, ob Ondansetron in der Schwangerschaft sicher ist. Wenn Sie schwanger sind, wird die Anwendung von Ondansetron-Actavis i.v. 2 mg/ml nicht empfohlen. In Untersuchungen wurde gezeigt, dass Ondansetron in die Muttermilch übergeht. Daher dürfen Sie während einer Ondansetron-Behandlung nicht stillen. Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Bisher wurden keine nachteiligen Wirkungen von Ondansetron-Actavis i.v. 2 mg/ml auf die Fähigkeit zum Auto fahren oder Bedienen von Maschinen festgestellt. Ondansetron-Actavis i.v. 2 mg/ml enthält Natrium Ondansetron-Actavis i.v. 2 mg/ml enthält Natrium, aber weniger als 1 mmol (23 mg) Natrium pro 4 ml, d.h. es ist nahezu „natriumfrei“. 3. WIE IST ONDANSETRON-ACTAVIS I.V. 2 MG/ML ANZUWENDEN? Wenden Sie dieses Arzneimittel immer genau nach Absprache mit Ihrem Arzt oder Apotheker an. Fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht sicher sind. Ondansetron-Actavis i.v. 2 mg/ml wird normalerweise durch einen Arzt oder medizinisches Fachpersonal durch Einspritzen in eine Vene (intravenöse Injektion) oder durch langsames Einfließen in eine Vene (intravenöse Infusion) verabreicht. Übliche Dosierungen sind: Bei Übelkeit und Erbrechen durch Chemotherapie oder Strahlentherapie: • Erwachsene Es wird unterschieden zwischen der hoch emetogenen Chemotherapie (mit hohem Risiko für das Auftreten von Übelkeit) und der emetogenen Chemotherapie und/oder Strahlentherapie (mit geringerem Risiko für das Auftreten von Übelkeit): Behandlung mit Chemotherapie und/oder Strahlentherapie, die möglicherweise Übelkeit und Erbrechen auslöst (emetogene Therapie) Die empfohlene Dosis ist 8 mg als intravenöse Injektion oder Kurzinfusion über 15 Minuten unmittelbar vor der Chemotherapie, gefolgt von einer Einnahme von insgesamt 8 mg Ondansetron in Tablettenform 12 Stunden danach. Behandlung mit einer Chemotherapie, bei der mit hoher Wahrscheinlichkeit Übelkeit und Erbrechen ausgelöst werden (hoch emetogene Therapie) Eines der folgenden Dosierungsschemata wird empfohlen: • 8 mg als langsame intravenöse Injektion unmittelbar vor der Chemotherapie. • 8 mg als intravenöse Injektion oder intravenöse Infusion über 15 Minuten unmittelbar vor der Chemotherapie, gefolgt von zwei weiteren intravenösen Gaben von je 8 mg im Abstand von 2 - 4 Stunden oder von einer intravenösen Infusion von 1 mg/Stunde Ondansetron über bis zu 24 Stunden. • 8 ml (2 Ampullen zu 4 mg) Injektionslösung (16 mg Ondansetron) als intravenöse Infusion über mindestens 15 Minuten unmittelbar vor der Chemotherapie. Aufgrund des dosisabhängig steigenden Risikos einer QT-Verlängerung darf die Einzeldosis 16 mg nicht Ondansetron IV 8 mg/4 ml solution, PIL, Germany [email protected] approved for print/date item no: FAAA1170 dimensions: 170 x 400 mm print proof no: 4 pharmacode: origination date: 27.06.2014 min pt size: 8,5 pt colours/plates: 1.black 2. 3. 4. 5. 6. originated by: IA revision date: 14.08.2014 Technical Approval revised by: IA date sent: 27.06.2014 supplier: PrestigePromotions technically app. date: 02.07.2014 Non Printing Colours 1. 2. 3. überschreiten (siehe auch „Warnhinweise und Vorsichtsmaßnahmen“ und „Welche Nebenwirkungen sind möglich?“). Aufgrund des dosisabhängig steigenden Risikos einer QT-Verlängerung darf die Einzeldosis 16 mg nicht überschreiten (siehe auch „Warnhinweise und Vorsichtsmaßnahmen“ und „Welche Nebenwirkungen sind möglich?“) Nach Ablauf der ersten 24 Stunden können Ondansetron-haltige Tabletten (8 mg zweimal täglich) über einen Zeitraum von bis zu 5 Tagen zur Vorbeugung von verzögert auftretendem Erbrechen oder Behandlung eines anhaltenden Erbrechens eingenommen werden. • Kinder und Jugendliche Bei der Verschreibung von Ondansetron-Actavis i.v. 2 mg/ml zur Anwendung bei Kindern älter als 6 Monate und von Jugendlichen muss die Dosierung dem Körpergewicht und der Körpergröße angepasst werden. Das Arzneimittel wird unmittelbar vor der Chemotherapie als intravenöse Injektion über 15 Minuten verabreicht, gefolgt von der Einnahme einer 2-mg oder 4-mg-Tablette 12 Stunden später. Die Behandlung wird für bis zu 5 Tagen nach der Chemotherapie fortgeführt. Je nach der Körpergröße und dem Körpergewicht des Kindes beträgt die Dosis 2 mg oder 4 mg zweimal täglich. Über die Anwendung von Ondansetron zur Vorbeugung und Behandlung von Übelkeit und Erbrechen nach einer Chemotherapie oder Strahlentherapie bei Kindern liegen keine Daten vor. Übelkeit und Erbrechen nach Operation: • Erwachsene Die übliche Dosis bei Erwachsenen beträgt 4 mg als langsame intravenöse Injektion, gegeben vor der Operation zur Vorbeugung oder nach der Operation zur Bekämpfung von Übelkeit und Erbrechen. • Kinder und Jugendliche Bei Kindern älter als 1 Monat und Jugendlichen beträgt die übliche Dosis 0,1 mg/kg Körpergewicht bis zu einer Maximaldosis von 4 mg, gegeben vor der Operation zur Vorbeugung oder nach der Operation zur Bekämpfung von Übelkeit und Erbrechen. Über die Anwendung von Ondansetron-Actavis i.v. 2 mg/ml zur Behandlung von Erbrechen nach einem chirurgischen Eingriff bei Kindern unter 2 Jahren liegen keine Daten vor. • Patienten mit eingeschränkter Nierenfunktion Es ist keine Dosisanpassung erforderlich. • Patienten mit eingeschränkter Leberfunktion Wenn Sie unter einer mäßigen bis schweren Leberfunktionsstörung leiden, sollte eine tägliche Gesamtdosis von 8 mg nicht überschritten werden. Mischbarkeit von Ondansetron-Actavis i.v. 2 mg/ml: Verdünnungen von Ondansetron-Actavis i.v. 2 mg/ml mit 0,9 % iger Kochsalzlösung, 5 % iger Glucoselösung, 10 % iger Mannitollösung und Ringer Lactatlösung sind bis zu 48 Stunden bei 25° C physikalisch und chemisch stabil. Aus mikrobiologischen Gründen sollen die Lösungen sofort verwendet werden. Werden die Lösungen nicht sofort verwendet, liegen die Dauer der Aufbewahrung der gebrauchsfertigen Lösungen und die Aufbewahrungsbedingungen in der Verantwortung des Verbrauchers. Die Lösungen sollen vor Gebrauch frisch zubereitet werden. Verabreichung mit anderen Arzneimittellösungen: Dexamethason-21-dihydrogenphosphat, Dinatriumsalz 20 mg Dexamethason-21-dihydrogenphosphat, Dinatriumsalz können als langsame intravenöse Injektion über 2 – 5 Minuten mittels eines Y-Stückes dem Ondansetron enthaltenden Infusionssystem zugesetzt werden, mit dem 8 oder 16 mg Ondansetron in 50 – 100 ml einer kompatiblen Infusionslösung (s. Mischbarkeit von Ondansetron) als Kurzzeit-Infusion über ca. 15 Minuten verabreicht werden. Die folgenden Infusionslösungen dürfen nur über ein Y-Stück dem Ondansetron enthaltenden Infusionssystem zugegeben werden, wobei die Ondansetron-Konzentration im Bereich von 16 – 160 µg/ml (z. B. 8 mg/500 ml bzw. 8 mg/50 ml) und die Ondansetron-Infusionsrate bei 1 mg/Stunde liegen sollte. Cisplatin-haltige Lösungen Die Konzentration Cisplatin-haltiger Lösungen, die über einen Zeitraum von einer bis acht Stunden gegeben werden können, darf 0,48 mg/ml (z. B. 240 mg/500 ml) nicht überschreiten. Carboplatin-haltige Lösungen Die Konzentration Carboplatin-haltiger Lösungen, die über einen Zeitraum von 10 Minuten bis zu einer Stunde gegeben werden können, darf den Bereich 0,18 mg/ml bis 9,9 mg/ml (z. B. 90 mg/500 ml bzw. 990 mg/ 100 ml) nicht überschreiten. Fluorouracil-haltige Lösungen Die Konzentration Fluorouracil-haltiger Lösungen, die mit einer Infusionsrate von mindestens 20 ml/Stunde (500 ml/24 Stunden) gegeben werden können, darf 0,8 mg/ml (z. B. 2,4 g/3 l oder 400 mg/500 ml) nicht überschreiten. Höhere Fluorouracil-Konzentrationen führen zu einer Fällung des Ondansetrons. Die Fluorouracil-haltigen Lösungen können Magnesiumchlorid bis zu einer Konzentration von 0,045 % (m/v) enthalten. Etoposid-haltige Lösungen Die Konzentration Etoposid-haltiger Lösungen, die über einen Zeitraum von 30 Minuten bis zu einer Stunde gegeben werden können, darf den Bereich 0,14 mg/ml bis 0,25 mg/ml (z. B. 70 mg/500 ml bzw. 250 mg/1 l) nicht überschreiten. Ceftazidim-haltige Lösungen Ceftazidim-Dosen von 250 – 2000 mg, die nach den Angaben des Herstellers zubereitet werden (2,5 ml Wasser für Injektionszwecke für 250 mg und 10 ml für 2 g Ceftazidim), können als intravenöse Bolusinjektion über ca. 5 Minuten gegeben werden. Cyclophosphamid-haltige Lösungen Dosen von 100 mg – 1 g Cyclophosphamid, die nach den Angaben des Herstellers zubereitet werden (5 ml Wasser für Injektionszwecke für 100 mg Cyclophosphamid), werden als i.v. Bolusinjektion über ca. 5 Minuten gegeben. Doxorubicin-haltige Lösungen Dosen von 10 – 100 mg Doxorubicin, die nach den Angaben des Herstellers zubereitet werden (5 ml Wasser für Injektionszwecke für 10 mg Doxorubicin), werden als i.v. Bolusinjektion über ca. 5 Minuten gegeben. Hinweis: Ondansetron-Actavis i.v. 2 mg/ml darf nicht im Autoklaven sterilisiert werden. Nach Anbruch der Ampullen den Rest verwerfen. Wenn Sie mehr oder weniger als die zulässige Dosis OndansetronActavis i.v. 2 mg/ml erhalten haben Ondansetron Actavis 2 mg/ml wird Ihnen in der Regel durch den Arzt oder das medizinische Fachpersonal verabreicht. Informieren Sie bitte Ihren Arzt oder das medizinische Fachpersonal, wenn Sie glauben, eine Anwendung versäumt oder eine höhere als die übliche Dosis erhalten zu haben. Nach Verabreichung von Ondansetron Actavis i.v. 2 mg/ml Ondansetron Actavis fängt üblicherweise bereits kurz nach der Injektion an zu wirken. Teilen Sie Ihrem Arzt oder dem medizinischen Fachpersonal bitte mit, wenn Sie dennoch Übelkeit oder einen Brechreiz verspüren. Wenn Sie weitere Fragen zur Anwendung dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal. 4. WELCHE NEBENWIRKUNGEN SIND MÖGLICH? Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen. Es werden zur Bewertung der Nebenwirkungen folgende Häufigkeitsangaben zugrunde gelegt: Sehr häufig: Häufig: Gelegentlich: Selten: Sehr selten: Nicht bekannt: betrifft mehr als 1 Behandelten von 10 betrifft 1 bis 10 Behandelte von 100 betrifft 1 bis 10 Behandelte von 1.000 betrifft 1 bis 10 Behandelte von 10.000 betrifft weniger als 1 Behandelten von 10.000 Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar Erkrankungen des Immunsystems Selten: Allergische Sofortreaktionen, manchmal schwerer Verlauf bis hin zur Anaphylaxie. Die Anaphylaxie geht einher mit plötzlich auftretendem Engegefühl in der Brust oder mit Kurzatmigkeit, mit Schwellung von Augenlidern, Gesicht oder Lippen; Hautausschlag, roten Punkten oder kleinen Erhebungen auf der Haut (Nesselausschlag bzw. Urtikaria) und/oder einem Ohnmachtsanfall Erkrankungen des Nervensystems Sehr häufig: Kopfschmerzen Gelegentlich: Verdrehen der Augen nach oben; ungewöhnliche Muskelsteifheit, unwillkürliche Bewegungen oder Zittern; Fallsucht (Epilepsie) Selten: Benommenheit, kann bei zu schneller intravenöser Gabe von Ondansetron auftreten Augenerkrankungen Selten: Vorübergehendes Verschwommensehen (Sehstörungen) Sehr selten: Vorübergehende Erblindung Herzerkrankungen Gelegentlich: Brustschmerzen, unregelmäßiger Herzschlag (Arrhythmie) und verlangsamter Herzschlag (Bradykardie) Selten: Verlängerung der QT-Zeit im EKG einschließlich einer besonderen Form der Herzrhythmusstörung (so genannte Torsade de Pointes), die einen plötzlichen Bewusstseinsverlust verursachen kann Gefäßerkrankungen Häufig: Wärmegefühl und plötzliches Erröten oder Glühen des Gesichts Gelegentlich: Niedriger Blutdruck (Hypotonie) Erkrankungen der Atemwege, des Brustraums und Mediastinums Gelegentlich: Schluckauf Erkrankungen des Gastrointestinaltrakts Häufig: Verstopfung Allgemeine Erkrankungen: Häufig: Es kommt mitunter zu Hautreaktionen an der Injektionsstelle (z. B. Hautausschlag, kleine Erhebungen, Juckreiz), die sich auf der Haut entlang der Vene, in der das Arzneimittel verabreicht wurde, ausbreiten können. Kinder und Jugendliche Das Nebenwirkungsprofil bei Kindern und Jugendlichen war mit dem bei Erwachsenen beobachteten Nebenwirkungsprofil vergleichbar. Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt über das nationale Meldesystem anzeigen. Indem Sie Nebenwirkungen melden, Können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden. Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Website: http://www.bfarm.de 5. WIE IST ONDANSETRON-ACTAVIS I.V. 2 MG/ML AUFZUBEWAHREN? Bewahren Sie das Arzneimittel für Kinder unzugänglich auf. Sie dürfen dieses Arzneimittel nach dem auf dem Behältnis und der äußeren Umhüllung nach „Verwendbar bis“ angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich auf den letzten Tag des angegebenen Monats. Entsorgen Sie Arzneimittel nicht im Abwasser. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr verwenden. Sie tragen damit zum Schutz der Umwelt bei. Vor Licht schützen! 6. INHALT DER PACKUNG UND WEITERE INFORMATIONEN Was Ondansetron-Actavis i.v. 2 mg/ml enthält Der Wirkstoff ist: Ondansetronhydrochlorid. Jede Ampulle Ondansetron-Actavis i.v. 2 mg/ml enthält 10 mg Ondansetronhydrochlorid – Dihydrat, entsprechend 8 mg Ondansetron. Die sonstigen Bestandteile sind: Natriumchlorid, Natriumcitrat 2H2O, Citronensäure–Monohydrat, Wasser für Injektionszwecke Wie Ondansetron-Actavis i.v. 2 mg/ml aussieht und Inhalt der Packung Ondansetron-Actavis i.v. 2 mg/ml ist in einer Packung mit 5 Ampullen (N2) zu je 4 ml erhältlich. Pharmazeutischer Unternehmer Actavis Group PTC ehf. Reykjavikurvegur 76-78, 220 Hafnarfjördur, Island Mitvertrieb Actavis Deutschland GmbH & Co.KG Willy-Brandt-Allee 2, 81829 München Telefon: 089/558909-0 Telefax: 089/558909-240 Hersteller Actavis Deutschland GmbH & Co.KG Willy-Brandt-Allee 2, 81829 München oder Laboratorio Reig Jofré Gran Capitán, 10, 08970 Sant Joan Despi (Barcelona), Spanien Diese Gebrauchsinformation wurde zuletzt überarbeitet im Juli 2013. GI-975-0713-05 FAAA1170 Ondansetron IV 8 mg/4 ml solution, PIL, Germany [email protected] approved for print/date item no: FAAA1170 dimensions: 170 x 400 mm print proof no: 4 pharmacode: origination date: 27.06.2014 min pt size: 8,5 pt colours/plates: 1.black 2. 3. 4. 5. 6. originated by: IA revision date: 14.08.2014 Technical Approval revised by: IA date sent: 27.06.2014 supplier: PrestigePromotions technically app. date: 02.07.2014 Non Printing Colours 1. 2. 3.