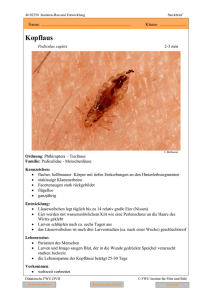
Aus dem Institut für Parasitologie der Tierärztlichen Hochschule
Werbung

Aus dem Institut für Parasitologie der Tierärztlichen Hochschule Hannover und der Serengetipark-GmbH Hodenhagen ___________________________________________________________________________ Untersuchungen zum Endoparasitenbefall bei afrikanischen Wildwiederkäuern unter Berücksichtigung der Weideinfestation im Serengeti-Park Hodenhagen INAUGURAL - DISSERTATION zur Erlangung des Grades einer DOKTORIN DER VETERINÄRMEDIZIN (Dr. med. vet.) durch die Tierärztliche Hochschule Hannover Vorgelegt von Susanne Koch aus Fredenbeck Hannover 2005 Wissenschaftliche Betreuung: Apl.-Prof. Dr. Michael Böer 1. Gutachter: Apl.-Prof. Dr. M. Böer 2. Gutachter: Univ.-Prof. Dr. K.-H. Waldmann Tag der mündlichen Prüfung: 24.11.2005 MEINEN ELTERN IN DANKBARKEIT Inhaltsverzeichnis___________________________________________________________________________________________ INHALTSVERZEICHNIS 1. Einleitung...............................................................................................................................9 2. Literaturübersicht...............................................................................................................10 2.1 Systematik der wichtigsten Endoparasiten der Wiederkäuer Mitteleuropas und Afrikas.10 2.2 Endoparasiten bei Wiederkäuern.......................................................................................11 2.3 Jahreszeitliche Unterschiede der Eiausscheidung..............................................................11 2.4 Entwicklung, Überleben und Verbreitung infektiöser Stadien auf der Weide..................14 2.5 Systematik, Lebensweise und zoologische Daten der untersuchten Wildwiederkäuer.....18 2.6 Nachweise von Endoparasiten bei den in dieser Studie untersuchten Wildwiederkäuerarten in Freiland und Zoo..........................................................................................32 2.7 Das Wirt-Parasiten-Verhältnis bei Zootieren.....................................................................35 2.8 Anthelminthische Therapie bei den untersuchten Wildwiederkäuerarten in Zoo- und Gehegehaltung...................................................................................................................37 2.9 Ansätze zu Parasitenkontrollprogrammen in der Literatur................................................40 3. Eigene Untersuchungen......................................................................................................43 3.1 Material..............................................................................................................................43 3.1.1 Bestände der untersuchten Wildwiederkäuerarten im Untersuchungszeitraum..........43 3.1.2 Vergesellschaftung mit anderen Tierarten...................................................................44 3.1.3 Haltung, Fütterung und Tränke....................................................................................45 3.1.4 Anthelminthische Behandlungen im Untersuchungszeitraum.....................................47 3.2 Methoden............................................................................................................................47 3.2.1 Untersuchungszeitraum und Daten der Probennahmen...............................................47 3.2.2 Identifikation der Tiere................................................................................................48 3.2.3 Probennahme................................................................................................................49 3.2.3.1 Kotprobensammlung.............................................................................................49 3.2.3.2 Grasprobensammlung...........................................................................................49 3.2.4 Probenaufbereitung und -untersuchung.......................................................................50 3.2.4.1 Kotuntersuchung...................................................................................................50 3.2.4.2 Larvenkultur..........................................................................................................51 3.2.4.3 Grasprobenuntersuchung......................................................................................52 Inhaltsverzeichnis___________________________________________________________________________________________ 3.2.5 Statistische Auswertung...................................................................................................53 3.2.6 Auswertung der Larvenzahlen am Weidegras anhand der Wetterdaten........................53 4. Ergebnisse............................................................................................................................54 4.1 Kotuntersuchung und Larvenkultur (Übersichtstabelle)....................................................54 4.2 Graphische Darstellung der Kotprobenergebnisse.............................................................55 4.2.1 Giraffen.......................................................................................................................55 4.2.2 Elenantilopen..............................................................................................................59 4.2.3 Rappenantilopen.........................................................................................................63 4.2.4 Oryxantilopen.............................................................................................................67 4.2.5 Ellipsen-Wasserböcke.................................................................................................71 4.2.6 Impalas........................................................................................................................74 4.2.7 Nyalas..........................................................................................................................75 4.2.8 Pferdeantilopen...........................................................................................................77 4.2.9 Defassa-Wasserböcke.................................................................................................80 4.2.10 Litschi-Moorantilopen................................................................................................83 4.3 Statistische Auswertung der Kotuntersuchungsergebnisse................................................86 4.4 Meteorologische Daten......................................................................................................88 4.5 Darstellung der Warm- und Regenperioden von April bis November 2001.....................90 4.6 Grasprobenuntersuchungsergebnisse.................................................................................90 4.7 Zusammenfassende Darstellung der Kotproben- und Grasprobenergebnisse der verschiedenen Gehege........................................................................................................95 5. Diskussion..........................................................................................................................100 6. Zusammenfassung / Summary.........................................................................................114 7. Literaturverzeichnis..........................................................................................................122 8. Tabellenanhang.................................................................................................................143 9. Danksagung.......................................................................................................................183 Abkürzungen ___________ __________ _________________________________ Abkürzungen Diag. Diagramm EpG Eizahl pro g Kot ges. gesamt i. m. intramuskulär k. A. keine Angabe Kgw. Körpergewicht L I, L II, L III Larvenstadium I, II, oder III L/kg TM Larven pro kg Trockenmasse MDS Magen-Darm-Strongyliden MEZ Mitteleuropäische Zeit mg/kg Kgw. Milligramm pro kg Körpergewicht MKS Maul- und Klauenseuche p. o. durch den Mund (lat. per os) s. c. subkutan sp. Spezies, Art (lat. species). Wird hinter den Gattungsnamen eines Parasiten gesetzt, wenn die Artbezeichnung unbekannt ist oder nicht aufgeführt werden soll spp. mehrere Spezies, Arten Tab. Tabelle Einleitung 1. 9 Einleitung Zielsetzung der vorliegenden Arbeit war es, die parasitologische Situation afrikanischer Wildwiederkäuer in einem Haltungssystem zu untersuchen, das durch seine weiten Grasausläufe zu besonderen Bedingungen führt. Vorteile ergeben sich für die Tiere durch das größere Platzangebot und die Möglichkeit des Grasens, das eine natürliche Verhaltensweise eines großen Teils der gehaltenen Tiere ist. Demgegenüber steht jedoch der Nachteil eines erhöhten Risikos parasitärer Infektionen. Im Gegensatz zu den kleineren Gehegen in zoologischen Gärten, in denen oft kaum ein Bewuchs vorhanden ist und die Flächen meist täglich von Kot befreit werden, ist die Situation in einem Safaripark eine völlig andere. Der Grasbewuchs bietet Parasiten gute Bedingungen zur Entwicklung. Eine komplette Kotentfernung wird aus organisatorischen und betriebstechnischen Gründen nicht durchgeführt. Um diesen Nachteil zu kompensieren, ist eine effektive Parasitenkontrolle nötig, für die jedoch möglichst genaue Kenntnisse über das Parasitenspektrum, Befallsextensitäten und -intensitäten sowie über epizootiologische Zusammenhänge vorhanden sein sollten. Für die dazu benötigten Untersuchungen standen 10 Tierarten mit je 3-13 Tieren in 3 Gehegen zur Verfügung. Während des Untersuchungszeitraumes vom 16.10.2000 bis 11.11. 2001 wurden in vierzehntägigen Abständen von einer festgelegten Anzahl der Tiere Kotproben gesammelt und mittels Kochsalzflotation, Auswanderverfahren, Sedimentation und Larvenkultur auf Endoparasiten untersucht. Gleichzeitig während der Weidesaison wurden Grasproben von allen genutzten Weiden auf zuvor festgelegten Diagonalen gesammelt und untersucht. Die Ergebnisse sollten Hinweise auf Infektionszyklen und die Zeitpunkte erhöhter Infektionsrisiken ergeben. Die routinemäßige Entwurmung der Antilopengruppen zur Aufstallung im Herbst wurde beibehalten. Im restlichen Untersuchungszeitraum sollten nur aufgrund der Kotuntersuchung unbedingt notwendige anthelminthische Therapien durchgeführt werden, um das Infektionsgeschehen möglichst ungestört beobachten zu können. Erkenntnisse aus den gesammelten Daten sollten eine verbesserte Parasitenkontrolle der afrikanischen Wiederkäuer des Safariparks Hodenhagen ermöglichen. Literaturübersicht 10 2. Literaturübersicht 2.1 Systematik der wichtigsten Endoparasiten der Wiederkäuer Mitteleuropas und Afrikas (Wenn nicht anders angegeben nach ECKERT et al. 2000). Die anderen Gattungen wurden mit Hilfe folgender Literatur hinzugefügt: BOOMKER 1977 (1), BOOMKER et al. 1986 (2) u. 1996 (3), DINNIK u. SACHS 1968 (4), PLETCHER et al. 1988 (5), TRONCY u. GRABER 1973 (6), URQUHART et al. 1987 (7), WARUIRU et al. 1995 (8). (Tab. 1): Reich Protozoa Animalia Stamm Apicomplexa Plathelmintha (Plattwürmer) Klasse Sporozoa Digenea (Überklasse: Trematoda) Cestodea Nemathelmintha (Schlauchwürmer) Nematodea (Rundwürmer) Ordnung Eucoccidiida Strigeidida Echinostomida Plagiorchiida Cyclophyllida Familie Eimeriidae Schistosomatidae Fasciolidae Paramphistomidae Dicrocoeliidae Anoplocephalidae Rhabditida Strongylida Strongyloididae Chabertiidae Ancylostomatidae Trichostrongylidae Ascaridida Enoplida (Überfamilie Trichostrongyloidea): Molineidae Dictyocaulidae (Überfamilie Metastrongyloidea): Protostrongylidae Ascarididae Trichuridae Gattungen Eimeria Schistosoma Fasciola, Fascioloides, Parafasciolopsis Paramphistomum, Calicophoron, Cotylophoron Dicrocoelium (Unterfamilie Anoplocephalinae:) Moniezia (Unterfamilie Thysanosomatinae:) Avitellina, Stilesia, Thysaniezia Strongyloides (Unterfamilie Chabertiinae): Chabertia (Unterfamilie Oesophagostominae): Oesophagostomum Bunostomum, Gaigeria, Agriostomum (7) Monodontella giraffae (2) (Unterfamilie Haemonchinae): Haemonchus (Unterfamilie Ostertagiinae): Ostertagia Bigalkenema (6), Longistrongylus (6), Kobusinema (6) (Unterfamilie Trichostrongylinae): Trichostrongylus (Unterfamilie Cooperiinae): Cooperia, Paracooperia (Unterfamilie Heligmosominae): Impalaia (1) Camelostrongylus (3), Gazellostrongylus (8) Cooperioides (5) Nematodirus Dictyocaulus Protostrongylus, Cystocaulus, Muellerius, Neostrongylus, Pneumostrongylus (4) Toxocara (Unterfamilie Trichurinae): Trichuris (Unterfamilie Capillariinae): Capillaria Literaturübersicht 11 2.2 Endoparasiten bei Wiederkäuern Die Tabellen im Anhang (Nr. 19, 20, 21) geben einen Überblick zur Entwicklung von Endoparasitengattungen bzw. -arten der Wiederkäuer, sowie zur Pathogenese und den Symptomen der entsprechenden Erkrankungen. 2.3 Jahreszeitliche Unterschiede der Eiausscheidung Nach CROFTON (1958) ist in Mitteleuropa im Frühling und im Spätsommer oder am Herbstanfang das Weidegras stark mit Wurmeiern kontaminiert. Ursachen für jahreszeitliche Schwankungen sind die Hypobiose, der sogenannte "spring rise", sowie das "periparturient rise"-Phänomen (PPR). MICHEL (1974) sieht die Funktion der Hypobiose darin, den Lebenszyklus des Parasiten mit dem des Wirtes oder mit jahreszeitlichen Veränderungen in der Umwelt zu synchronisieren. Die Würmer überleben nach COURTNEY u. KOLLIAS (1985) eine für die frei lebenden Stadien widrige Jahreszeit, indem sie normalerweise im 4. Larvenstadium im Wirt ihre Entwicklung unterbrechen. Dies kann z.B. in Schottland wegen des kalten Winters erfolgen, oder in Südafrika, um die Trockenzeit zu überbrücken (HORAK, 1981 b). Die Hypobiose wurde in zahlreichen Nematodenarten beobachtet (MICHEL, 1974; McKENNA, 1973; GIBBS, 1986). Auslöser für die Hypobiose können nach MICHEL (1974) von der Umwelt ausgehen (z.B. Temperaturänderungen) oder vom Wirt, durch z.B. Immunität aufgrund vorhergegangener Infektionen, die konkurrierende Anwesenheit adulter Würmer oder Infektionen mit sehr hohen Larvenzahlen. Es ist nach GIBBS (1986) umstritten, was die Fortführung der Entwicklung nach der Hypobiose auslöst. Es könnte eine feste vorherbestimmte Zeitdauer geben, die lang genug ist, um die ungünstigen Bedingungen zu überleben. Oder es könnte sich um eine Phase verringerter Immunabwehr handeln, wogegen sprechen würde, dass auf nicht immune Schafe übertragene hypobiotische Larven ihre Hypobiose nicht vorzeitig abbrachen. Literaturübersicht 12 Bei nicht laktierenden Schafen löst die verstärkte Weiterentwicklung hypobiotischer Larven eine Immunreaktion aus, so dass der Anstieg der Eiausscheidung, der "spring rise", niedrig ausfällt. In laktierenden Schafen erreichen durch eine vorübergehende Abschwächung der Immunität relativ viele hypobiotische, aber auch neu aufgenommene Larven die Geschlechtsreife. Sie zeigen nach O`SULLIVAN u. DONALD (1970) zusätzlich eine erhöhte Eiausscheidung. Der so entstandene "periparturient rise" erfolgt nach CROFTON (1954) 6-8 Wochen nach dem Lammen für eine Dauer von ca. 2 Wochen. Wird die Laktation durch Wegnahme der Lämmer unterbrochen, erfolgt ein rapider Abfall der Eiausscheidung (SALISBURY u. ARUNDEL, 1970; O`SULLIVAN u. DONALD, 1970). Die Hypothese von O`SULLIVAN und DONALD (1970) , dass der endokrine Status des laktierenden Schafes für eine verringerte Immunabwehr und damit für die Entstehung des PPR verantwortlich ist, wird von zahlreichen anderen Autoren geteilt (CROFTON, 1954; SALISBURY u. ARUNDEL, 1970; COURTNEY u. KOLLIAS, 1985). Die langjährige Annahme eines direkten Zusammenhangs des "periparturient rise" mit dem Prolaktin-Spiegel im Blut, wurde jedoch von JEFFCOATE et al. (1990) in Versuchen widerlegt. Der "periparturient rise" führt zu einer erhöhten Kontamination der Umwelt, wenn das empfindlichste Wirtsstadium, das Jungtier, zur Verfügung steht (GIBBS, 1986). Dies geschieht zu einem Zeitpunkt, an dem die Milchaufnahme des Jungtieres sinkt und die Grasaufnahme steigt (CROFTON, 1958; COURTNEY u. KOLLIAS, 1985). Die erhöhte Kontamination des Weidegrases im Herbst resultiert dann v.a. aus der Eiausscheidung der infizierten Jungtiere (CROFTON, 1958). Daten zu jahreszeitlichen Unterschieden der Eiausscheidung bei in zoologischen Gärten gehaltenen Wiederkäuern werden in der folgenden Tabelle aufgeführt. Literaturübersicht 13 Tab. 2: Jahreszeitliche Unterschiede der Eiausscheidung bei Wildwiederkäuern in zoologischen Gärten Jahr Autor 1964 SCHÄTZLE Tierarten Kudus, Oryxantilopen Schafe, Mufflons, Steinböcke, Zwergziegen Rentiere, Elche Lamas, Vikunjas, Guanacos, Trampeltiere Verlauf der Eiausscheidung Minimum Maximum November bis Februar Mai bis August weitere Bemerkungen November bis Februar Anstieg schon ab März November bis Februar Dezember bis Februar April bis Juni starker Anstieg in den Frühlingsmonaten, starker Abfall im Herbst Frühling / Sommer Anstieg schon ab März Juni bis September starker Anstieg in den Frühlingsmonaten von v.a. Trichostrongylus sp. und Ostertagia sp. ab August erstmalig starkes Auftreten von Nematodirus sp. Giraffen Wintermonate Juni und August v.a. Trichostrongylus sp. 1967 FORSTNER Oryxantilopen November bis Januar Mai bis August v.a. Trichostrongylus sp. ohne Saisonzyklus Strongyloides-Eier traten auch im Winter auf; erstmalig im Nematodirus-Eier: erstes Auftreten nicht wegen der Jahreszeit, Herbst sondern aufgrund der Infektion im ersten Lebensjahr Giraffen Dezember / Januar Juni bis August Trichostrongylus sp. ohne Saisonzyklus Trichuris-Eier in geringer Zahl ganzjährig 1968 RATHWisente Februar / März Mai bis September starker Anstieg im Mai, MANN fortschreitende Abnahme bis Februar / März 1986 CHURCH Pferdeantilopen (4000 EpG) Nematodirus sp. => starker Durchfall /Abmagerung April / Mai Juli / August Trichostrongylus sp. ohne klinische Anzeichen diese Pferdeantilopen nahmen Anthelminthika über das Futter schlecht auf; Haltung auf nassem Untergrund Rappenantilopen später August Trichostrongylus sp.; ohne klinische Anzeichen; monatlich Anthelminthika; Stallhaltung von November bis Februar; trockene Weide 1987 LOBSIGER Mufflon, Dam-/ deutliche Übereinstimmung zwischen EpG-Anstieg und den Setzzeiten => rasche Zunahme der Eiausscheidung Rothirsch, Markhor i. d. R. 2-4 Wochen post partum ( Rothirsch: 2 Wo.; Damhirsch: 1-2 Wo.; Markhor: < 1 Wo.; Mufflon: 2-4 Wo. ) Steinbock, Elch weniger deutliche Übereinstimmung: Steinbock: 6 Wochen post partum; Elch: 2-4 Wochen post partum Vietnamsika, Reh sehr schlechte Übereinstimmung Auerochse, Bison, Wisent , Moschusochse, Alpaka und Kaschmirziege: keine Übereinstimmung der EpG-Anstiege mit den Setzzeiten allgemein: mit den Geburtszeiten verschiebt sich auch der Zeitpunkt maximaler Eiausscheidung=> z.B. Mufflon: bereits im Mai; Cerviden: erst im Juni Literaturübersicht 14 2.4 Entwicklung, Überleben und Verbreitung infektiöser Stadien auf der Weide Nach CRAIG (1986) verhindern Austrocknung, extreme Hitze oder Kälte die Entwicklung von Eiern und Larven in der Umwelt. Die ersten und die zweiten Larven ernähren sich von Bakterien des Kothaufens. Die dritten Larven sind deutlich resistenter gegenüber kurzfristigen Klimaänderungen, da sie mit der Haut des 2. Larvenstadiums bescheidet sind (DONALD, 1968 u. CRAIG, 1986). Sie können jedoch keine Nahrung aufnehmen und nur so lange leben, wie die Nahrungsreserven der ersten beiden Stadien ausreichen. (CRAIG, 1986 u. LEVINE, 1963). Dabei ist der Energieverbrauch der 3. Larve von der Umgebungstemperatur abhängig: Die Larve kann im Winter länger überleben als im Sommer, wenn sie nicht durch Austrocknung zugrunde geht (CRAIG, 1986). Vor direkter Sonnenexposition schützen nach GOLDBERG (1968) hohe Gräser, die außerdem bodennah Feuchtigkeit halten. Nematodirus spp. verfolgen nach CRAIG (1986) eine besondere Strategie: In großen Eiern entwickeln sich die Larven bis zum infektiösen dritten Stadium geschützt vor Umweltverhältnissen. Sie schlüpfen nach KATES (1950) erst bei günstigen Klimabedingungen und sind dann im Vergleich zu anderen Gattungen besonders resistent gegen hohe wie niedrige Temperaturen und Austrocknung. ROSE (1975) zeigte, dass Nematodirus helvetianus- Larven erst ab Juni / Juli schlüpfen , während Nematodirus battusLarven schon ab März in so großer Anzahl vorhanden sein können, dass klinische Erkrankungen möglich sind. Larven von Dictyocaulus viviparus überleben nach ROSE (1956) im Winter besser als im Sommer, da sie auf Trockenheit besonders empfindlich reagieren. Bei 25 °C entwickeln sich die Drittlarven schon nach 3 Tagen, im Januar erst nach 4 Wochen. Literaturübersicht 15 Bei Strongyloides papillosus entwickeln sich zu Zeiten, in denen der Wirt besonders widerstandsfähig ist, oder die Eiausscheidung und Vitalität der Parasiten nachlassen, besonders viele frei lebende Geschlechtstiere ( SUPPERER u. PFEIFFER, 1965). Die höchste Entwicklungsrate (46 % ) wurde bei 20°C nachgewiesen. Die Lebensdauer bei optimalen Bedingungen kann bis zu 4 Monate betragen, im Winter jedoch nur 4 Wochen. Im Kälberkot (Kälber unter 18-20 Tage) unterbleibt die Entwicklung (wahrscheinlich wegen vermehrter Milchsäurebildung) (GRÄFNER, 1967). Tab. 3: Optimale Überlebensbedingungen von Magen-Darm-Strongyliden in verschiedenen Jahreszeiten (LOBSIGER, 1987). (USA; gemässigte Zone; im Winter wechseln sich Frostund Tauwetterperioden häufig ab). WETTERTYP TENAZITÄT VON MAGEN-DARMSTRONGYLIDENLARVEN Optimum Intermedium Minimum ( > 2 Monate) (1-2 Monate) ( < 1 Monat) Warm, feucht (heisser Sommer mit häufigem Cooperia Nematodirus Regenfall) Haemonchus Ostertagia Oesophagostomum Trichostrongylus Warm, trocken (heisser Sommer mit Cooperia Haemonchus geringem Regenfall) Nematodirus Oesophagostomum Trichostrongylus Ostertagia Kühl, feucht (Frühlingsanfang oder Nematodirus Cooperia Spätherbst mit milden Temperaturen und Ostertagia Haemonchus häufigem Regenfall) Trichostrongylus Oesophagostomum Kühl, trocken (Frühlingsanfang oder Spätherbst mit milden Termperaturen und geringem Regenfall Kalt (Winter mit Temperaturen unter dem Gefrierpunkt) Nematodirus Nematodirus Ostertagia Ostertagia Trichostrongylus Cooperia Haemonchus Oesophagostomum Cooperia Haemonchus Oesophagostomum Trichostrongylus GRÄFNER (1967) wies nach, dass sich lange geringgradige Frostperioden bei geschlossener Schneedecke günstig für das Überwintern auswirken. Nachteilig ist hingegen ein dauernder Wechsel zwischen Frost- und Tauwetter, da ansteigende Temperaturen die Larven anregen und Reservestoffe so schneller verbraucht werden. Weitere Veröffentlichungen zur Überwinterung werden in der folgenden Tabelle aufgeführt: Literaturübersicht 16 Tab. 4: Literaturangaben zur Überwinterung der Nematodenarten Autor ; Ort; Bedingungen KATES, 1950; Maryland, USA; typischer Winter: häufige Frost- u. Tauwetterperioden wechseln sich ab ENIGK u. DÜWEL, 1961 Wesermarsch und Raum Helmstedt-Hannover-Minden; an nur 2 Tagen -10°C u. kälter GRÄFNER, 1967 Ort: Bezirk Schwerin - 30 bzw. 47 Schneetage je Winter; - Minimaltemp.: um -20 °C BOAG u. THOMAS, 1977 Northumberland, Großbritannien keine Angabe zu Umweltbedingungen OAKLEY, 1979 Großbritannien; keine Angabe zu Umweltbedingungen BÜRGER et al. 1983 Ort: Raum Hannover; Versuche über 10 Jahre: sehr unterschiedliche Winter hinsichtlich Frost u. Schnee Arten, die überwintern Ostertagia sp. Nematodirus sp. Arten, die nicht überwintern Oesophagostomum sp., Haemonchus sp., Cooperia sp., Trichostrongylus sp., Chabertia sp., Bunostomum sp. Dictyocaulus viviparus Dictyocaulus viviparus, Protostrongylus rufescens, Muellerius capillaris, Haemonchus contortus, Ostertagia sp. , Trichostrongylus sp., Cooperia sp. Ostertagia circumcincta, Ostertagia pinnata, Ostertagia trifurcata, Nematodirus battus u. filicollis (im Ei), Trichostrongylus ovis, Cooperia ovina Dictyocaulus viviparus Dictyocaulus filaria, Bunostomum sp. , Strongyloides papillosus Haemonchus contortus, Trichostrongylus vitrinus, Trichostrongylus colubriformis,Cooperia curticei,Bunostomum trigonocephalum,Oesophagostomum venulosum Ostertagia ostertagi, Cooperia oncophora Tab. 5: Optimale Umweltbedingungen für Entwicklung, Überleben und Translation der infektiösen Stadien Nematodenarten (AUTOR) Haemonchus contortus Trichostrongylus sp. und Ostertagia sp. (LEVINE, 1963) Cooperia punctata, Trichostrongylus axei, Oesophagostomum radiatum (WILLIAMS u. MAYHEW, 1967) Oesophagostomum radiatum Ostertagia ostertagi Cooperia oncophora u. punctata Nematodirus helvetianus (GOLDBERG, 1968) Ostertagia ostertagi (WILLIAMS u. BILKOVICH, 1971) Entwicklung zum Überleben der 3. Larven infektösen Stadium monatl. Ø- monatl. Ge- monatl. Ø- monatl. GeTemp. (°C) samtnieder- Temp. (°C) samtniederschlag (cm) schlag (cm) 15 - 37 5 und mehr Translation (Wanderung auf die Vegetation) monatl. Ø- monatl. GeTemp. (°C) samtniederschlag (cm) 6 - 20 5 und mehr 13 - 26 5 -12 15,7 -21,3 2,64 - 9,53 21,0 13,77 12,8 - 21,3 2,64 - 9,53 6,7 - 21,3 4,14 - 13,77 15,7 - 21,3 15,7 - 21,0 2,64 - 9,53 4,50 - 13,77 10,5 - 24,2 21,0 - 23,7 4,14 - 13,77 2,67 - 20,98 13,0 - 23,0 7,5 - 17,0 8-26 8 - 23 5 - 17 7,5 - 17 Literaturübersicht 17 Tab. 6: Zeitabstände von der Eiablage über die Entwicklung bis zum Ende der Nachweisbarkeit der infektiösen Larven am Weidegras Nematodenart (Auslegezeitpunkt der Eier) (AUTOR) Ostertagia sp. u. Cooperia sp. (ausgelegt Ende April); Oesophagostomum sp. (ausgelegt Ende April) Haemonchus sp. (ausgelegt im Juli) Nematodirus sp. (GOLDBERG, 1968) Trichostrongylus colubriformis (DONALD, 1968) Cooperia oncophora Versuch ohne Kälber: Versuch mit Kälbern: (HERTZBERG et al. 1992) Ostertagia ostertagi Cooperia punctata Oesophagostomum radiatum (ausgelegt Ende Juni) (GOLDBERG 1970) höchste Larvenzahl im Kot nachweisbar nach höchste Larvenzahl am Gras nachweisbar nach Dauer der Nachweisbarkeit am Gras 2 Wochen 6 Wochen 24 -27 Wochen k.A. 6-7 Wochen 10 Wochen 1,5 - 5 Wochen 1,5 - 7 Wochen 3,5 - 6 Wochen k.A 11 Wochen 28 - 31 Wochen 5 Wochen 4 Wochen 2-3 Wochen 2 Wochen 1 Woche 4 Wochen 3 Wochen 24 Wochen 20,6 Wochen 1 Woche 2 Wochen 8 Wochen BÜRGER et al. (1983) geben die folgende zeitliche Reihenfolge von Bedingungen als nötig an, um ein beträchtliches Ansteckungsrisiko entstehen zu lassen: 1. Eine ausreichende Kontamination mit Eiern 2. Temperaturen über 18 °C für mehr als eine Woche, wodurch die Entwicklung eines hohen Anteils der Eier zu Drittlarven ermöglicht wird. 3. Anschließend eine wenigstens viertägige Periode mit gleichmäßigen, ergiebigen Regenfällen, die den Übergang der Larven vom Kot auf die Vegetation erlauben Nach HERTZBERG (1988) bzw. HERTZBERG et al. (1992) haben folgende Faktoren Einfluß auf die Weidekontamination: - Eine erhöhte Anzahl der Stunden wasserbenetzten Grases unterstützt die Translation - Ausgedehnte Regenfälle helfen größere Entfernungen zu überwinden, können aber auch zur Auswaschung führen - Eine hohe Tierbesatzdichte fördert die Verbreitung der Larven, da diese durch die Tiere selbst v.a. aus Bereichen der Tränke weitergetragen werden (1992). Literaturübersicht 18 2.5 Systematik, Lebensweise und zoologische Daten der untersuchten Wildwiederkäuer Die Ordnung der Artiodactyla (Paarhufer) umfaßt drei Unterordnungen, die Nonruminantia (Nichtwiederkäuer), die Tylopoda (Schwielensohler) und die Ruminantia (Wiederkäuer). Die Nonruminantia gliedern sich auf in die Familien Suidae (Schweine), Tayassuidae (Pekaris) und Hippopotamidae (Flußpferde). Zur Unterordnung der Tylopoda gehört nur die Familie der Camelidae (Kamele). Die Linie der Ruminantia beinhaltet fünf Familien, die Tragulidae (Hirschferkel), die Cervidae (Hirsche), die Giraffidae (Giraffen), die Antilocapridae (Gabelhorntiere) und die Bovidae (Hornträger) (SCHMITZ, 1988). Männchen und vielfach auch Weibchen der meisten Arten tragen Kopfwaffen in Gestalt von Geweihen, Hörnern oder hauerartigen Zähnen (SCHMITZ, 1988). Die Familie der Bovidae (Hornträger) beinhaltet 12 Unterfamilien, die 44 Gattungen mit insgesamt über 100 Arten umfassen. Es handelt sich um die Unterfamilien Cephalophinae (Ducker), Neotraginae (Böckchen), Tragelaphinae (Waldböcke), Bovinae (Rinder), Alcelaphinae (Kuhantilopen), Hippotraginae (Pferdeböcke), Reduncinae (Ried-und Wasserböcke), Aepycerotinae (Schwarzfersenantilopen), Antilopinae (Gazellenartige), Saiginae (Saigaartige), Rupicaprinae (Gemsenartige) und Caprinae (Böcke oder Ziegenartige) (SCHMITZ, 1988). Die Kennzeichen und Verhaltensweisen der Familie der Hornträger werden im folgenden nach WALTHER (1988) zusammengefaßt: Die Hörner sind das entscheidende Kennzeichen aller Hornträger. Ihre Hauptfunktion haben Hörner bei der Auseinandersetzung unter Artgenossen. Zur Verteidigung gegen Raubtiere werden sie selten und wenig erfolgreich eingesetzt. Die Kämpfe unter Hornträgern sind meist Ritualkämpfe, die die soziale Rangordnung festlegen. Literaturübersicht 19 Hinsichtlich ihrer Sozialstruktur lassen sich die Hornträger in gesellige meist steppenbewohnende und einzelgängerische meist waldbewohnende Arten einteilen. Einzelgänger sind vor allem die Ducker und Böckchen sowie der Buschbock. Bei den geselligen Arten kommt es zur Bildung von Sozialeinheiten, wie z.B. der „echten Haremsgruppe“, bei der ein Altbock oder –bulle mit mehreren Weibchen mindestens so lange zusammenlebt, bis mehrere oder alle Weibchen begattet sind. Beim häufigeren „Pseudoharem“ sind die Gruppe der Weibchen und der einzelne territoriale Mann zwei selbständige Sozialeinheiten, und die Weibchen sind jeweils nur so kurzfristig bei ihm, daß er bestenfalls eine oder zwei von ihnen decken kann. Die Weibchengruppen setzen sich aus Kühen oder Geißen aller Altersstufen mit oder ohne Jungtiere zusammen. In den Bock- oder Bullengruppen befinden sich je nach Art nur jugendliche Männchen, wie z.B. beim DefassaWasserbock oder alle Altersstufen, wie z.B. bei Spießböcken und Gazellen, aber nie Weibchen. Beim Kaffernbüffel kommen auch kleine „Altherrenverbände“ vor, die nur aus sehr alten Bullen bestehen. Gemischte Verbände, das heißt Gruppen, in denen nicht nur mehrere erwachsene Weibchen, sondern auch mehrere erwachsene Männchen vorhanden sind, treten erst bei größeren Rudeln von mindestens etwa 15 bis 20 Individuen auf. Charakteristisch sind sie für Arten wie Springbock, Thomsongazelle und Gnu, die gerade zu den Wanderzeiten oft Herden von Hunderten oder gar Tausenden formen. In den Klein- und Großrudeln besteht oft eine individuelle Rangordnung innerhalb der Geschlechter. Die großen Herden sind offene Verbände, in denen Mitglieder kommen und gehen. Kleine Gruppen können geschlossenen Verbänden nahekommen, wobei v.a. Weibchen nur selten die Gruppe verlassen können, weil sie vom Männchen bewacht werden. Rudel und Herden entwickeln Raum-Zeit-Systeme über Generationen. Im Unterschied zum Aufenthaltsgebiet ist ein Revier (Territorium) ein Platz, an dem sich ein Tier oft mit Hilfe bestimmter Sekret- und Kotmarken eine subjektive Grenze schafft. Der Revierinhaber zeigt sich innerhalb dieser Grenze besonders dominant gegenüber gleichgeschlechtlichen Artgenossen, hat oft geringere Fluchtdistanzen gegenüber Raubtieren, Menschen und Fahrzeugen und versucht Geschlechtspartner am Verlassen des Reviers zu hindern. Literaturübersicht 20 Einerseits gibt es die einzelgängerisch / territorialen Arten, bei denen ein Einzeltier oder ein Paar über lange Zeit in seinem Revier lebt. Bei den gesellig / territorialen Arten, wie z.B. Gazellen, Impala, Gnus oder einigen Wasserböcken gibt es neben Territorien auch Aufenthaltsgebiete. Jungtiere sind „Ablieger“ oder „Folger". Bei den „Abliegern“ (Gazellen, Waldböcke, Pferdeböcke, Ried- und Wasserböcke, Kuhantilopen, Ducker und Böckchen) verbringen die Jungtiere den größten Teil des Tages getrennt von ihren Müttern. Am Liegeplatz nimmt die Mutter an den ersten Tagen Kot und Urin des Jungtiers auf, was dazu beiträgt, dass das Jungtier für Raubfeinde geruchlich schwer auszumachen ist. Die Entwicklung vom "Ablieger" zum "Folger" ist am Ende des zweiten Lebensmonats abgeschlossen. Bei den „Folgern“ (Gnus, Leierantilopen, Schneeziegen, Gemsen, Wildschafe und –ziegen, sowie viele Rinder) liegen und fliehen die Jungtiere schon kurze Zeit post partum gemeinsam mit ihren Müttern und folgen ihnen direkt auf. Im Zoo ist zwischenartliches Verhalten viel häufiger als in freier Wildbahn, aufgrund der dauerhaft begrenzten Fläche, des Mangels an Artgenossen oder aggressionauslösender Situationen (Füttern am Trog o.ä.). Zwischenartliche Kämpfe mit ungleichen Hörnern und Kampftechniken sind viel gefährlicher als unter Artgenossen (WALTHER, 1988). Literaturübersicht 21 Nach HOFMANN (1988) können die Wiederkäuer mit Übergängen in drei Ernährungstypen eingeteilt werden: 1.) Konzentratselektierer / Concentrate Selectors (CS) 2.) Gras- und Rauhfutterfresser / Grass and roughage eaters (GR) 3.) Intermediärtypen / Intermediate, mixed feeders (IM) Sie haben nach HOFMANN (1988) folgende Eigenschaften: Konzentratselektierer besitzen einen kleinen Pansen. Wertvolle Pflanzeninhaltsstoffe werden direkt in den Labmagen geleitet. Unverdauliche Hemicellulose wird der Dickdarmfermentation zugeführt. Hierzu gehören u.a. die Giraffe und die Waldböcke. Gras- und Rauhfutterfresser nehmen große Mengen Cellulose auf. Es erfolgt eine effiziente Pflanzenzellwand-Vergärung (zu 85 %) in den Vormägen. Die verschiedenen Ernährungstypen unterliegen saisonalen Anpassungen mit z.T. zyklischen Umbauvorgängen u.a. der Pansenschleimhaut. Die Anpassungsfähigkeit gegenüber inadäquater Ernährung ist bei fast allen Wiederkäuern groß. Bei langfristiger Fehlernährung ergeben sich jedoch oft abrupte Zusammenbrüche des Ernährungsstoffwechsels. Nach MALOIY (1973) zeigen in Wüstengebieten viele Wiederkäuer Anpassungsphänomene ihrer Physiologie und ihres Verhaltens gegenüber Hitze und Trockenheit. Tiere wie Oryx- und Elenantilopen kommen ohne Oberflächenwasser aus, Impala und Gnu sind jedoch nur in weniger ariden Zonen anzutreffen, die nicht weit von Wasserläufen liegen, während Sitatunga und Wasserbock täglich Wasser aufnehmen müssen und sich stets in der Umgebung permanenter Wasserstellen aufhalten. Literaturübersicht 22 Systematik der Familie der Giraffidae, sowie Systematik und Gemeinsamkeiten innerhalb der Unterfamilien der untersuchten Antilopenarten 1. Giraffe Die Langhalsgiraffen (Unterfamilie Giraffinae) erscheinen im Jungmiozän und waren damals in Afrika und Eurasien weit verbreitet (THENIUS, 1988). Die Familie Giraffidae umfaßt zwei heute lebende Unterfamilien, die eigentlichen Giraffinae, Langhals- oder Steppengiraffen, und die Okapiinae, die als Kurzhals- oder Waldgiraffen bekannten Okapis. Beide sind Wiederkäuer und stehen anatomisch und physiologisch zwischen den Hirschen und den Hohlhornträgern. (PETZSCH und PIECHOCKI, 1992). Für die Abstammung beider Unterfamilien von einer gemeinsamen Stammform spricht auch der beiden gemeinsame Hakenwurm Monodontella giraffae (GRZIMEK, 1988). Die Unterfamilie der Langhals- oder Steppengiraffen umfaßt nur eine Art: Giraffa camelopardalis. Es sind acht Unterarten beschrieben, die sich untereinander paaren und fruchtbare Nachkommen zeugen können. (APFELBACH, 1988). 2. Waldböcke Die Waldböcke (Unterfamilie Tragelaphinae) mit drei Gattungen (den afrikanischen Waldböcken (Tragelaphinae), der indische Nilgauantilope (Boselaphus) und der Vierhornantilope (Tetracerus)) haben weiße Abzeichen im Gesicht ( Zwischenaugenstreifen und Wangenflecken), meist auch weiße Streifen am Hals und weiße senkrechte Flankenstreifen. Die Imponierhaltung der Waldböcke (wie bei Hornträgern üblich ein Hochrecken, sowie das Einnehmen einer Breitseitstellung) wird verstärkt durch das Aufstellen von Rücken- oder Halsmähne (WALTHER, 1988). Kreuzungen zwischen verschiedenen Waldbockarten sind möglich (JORGE et al., 1976; WALTHER, 1988). Literaturübersicht 23 3.) Wasserböcke und Riedböcke Die mit den Riedböcken in der Unterfamilie Reduncinae vereinten Wasserböcke sind heute mit verschiedenen (Unter-) Gattungen wie z.B. Kobus, Redunca und Adenota in Afrika heimisch. Ein Ursprung in Asien (Gattungen Cambayalla, Vishnucobus und Sivadenota aus dem Plio-Pleistozän) ist jedoch nicht auszuschließen (THENIUS, 1988). 4.) Schwarzfersenantilope (Impala) Die Impala oder Schwarzfersenantilope wird von WALTHER (1988) als eigene Unterfamilie mit nur einer Gattung und einer Art angesehen. Nachdem man sie lange Zeit den Gazellen nah eingeordnet hat und zu anderer Zeit auch den Wasser- und Riedböcken, gibt MURRAY (2001) Hinweise darauf, dass sie eine frühe Abspaltung der Alcelaphinae (Kuhantilopen) darstellt, zu denen z.B. auch die Gnus gehören. 5.) Pferdeböcke Die gegenwärtig in Afrika und Vorderasien beheimateten Pferdeböcke (Unterfamilie Hippotraginae) waren noch zur Eiszeit auch in Südasien (Gattungen Sivatragus, Sivoryx) verbreitet. (THENIUS, 1988). Nach WALTHER (1988) umfaßt die Unterfamilie Hippotraginae drei Gattungen: Pferdeantilopen (Hippotragus), Spießböcke (Oryx) und Mendesantilopen (Addax). Zur Gattung der Pferdeantilopen gehören drei Arten: die Pferdeantilope, die Rappenantilope und der Blaubock, der seit 1800 ausgestorben ist. Zur Gattung der Oryxantilopen gehören 4 Arten: der Südafrikanische Spießbock, der Ostafrikanische Spießbock, die Säbelantilope Nordafrikas und die Arabische oder Weiße Oryx. In den folgenden Tabellen werden die zoologischen Daten der untersuchten Tiergattungen zusammengefaßt. Literaturübersicht 24 Literaturübersicht 25 Tab. 7: Zoologische Daten der Giraffe (Giraffa camelopardalis) nach GRZIMEK 1968 (a), GRZIMEK 1988 (b), APFELBACH 1988 (c), PETZSCH und PIECHOCKI 1992 (d), FURSTENBURG und VAN HOVEN 1994 (e), MATERN und KLÖPPEL 1995 (f), DU TOIT 2001 (g), PELLEW 2001 (h). Unterarten; Aussehen; Verbreitung Unterarten: 1. Nubische Giraffe (G. c. camelopardalis); 2. Kordofan-Giraffe (G. c. antiquorum); 3. Tschad-Giraffe (G. c. peralta); 4. Netzgiraffe (G. c. reticulata); 5. Uganda-Giraffe (G. c. rothschildi); 6. Massai-Giraffe (G. c. tippelskirchi); 7. Angola-Giraffe (G. c. angolensis); 8. Kap-Giraffe (G. c. giraffa) (a) Physiologische Eigenschaften und Daten - Bewegungsablauf: nur Schritt und Galopp ; immer Kreuzgalopp (f) - optischer Sinn besser als Gehörund Geruchssinn (c) - Lautgebung nur in bedrohlichen Situationen (h) - Standhöhe: Bullen: 4,50-5,80 m Kühe: 3,90-4,50 m (b) - Gewicht: Bullen: 800-1900 kg Kühe: 550-1180 kg (b) Aussehen: - 2 bis 5 von Haut überzogene Knochen- Lebensalter: in Freiheit 20-25 zapfen (Vellericornia) (d) Jahre; im Zoo bis zu 28 Jahre (h) - langer Hals durch starke Verlängerung der - Geschlechtsreife: 7 Halswirbel (c) Bullen: 48 Monate - Fleckengröße, –form und –farbe unterKühe: 48-60 Monate (c) schiedlich je nach Unterart, Alter, - Tragzeit: 15 Monate; i.d.R. ein Geschlecht und Individuum; Fleckenfarbe Junges; Geburt erfolgt im Stehen (c) variiert von orange- über rotbraun bis - Geburtsgewicht: Bullen: ca. 102kg; schwarz; Fellzeichnung entspricht Kühe: ca. 95kg (c) individuellem Fingerabdruck (h) Verbreitung: -früher weiter verbreitet in allen Savannengebieten südlich der Sahara; in Westafrika heute nur noch in einer kleinen Region der Sahelzone um Niamey im Südwesten Nigers; im südlichen Afrika wieder weit verbreitet, fehlt in der Umgebung des Zambezi zwischen Zimbabwe und Zambia (h) -Entwöhnung: 15-17 Monate; aber Festnahrung schon ab 3. Woche (c) -Sterblichkeitsrate i. d. ersten 6 Lebensmonaten in der Serengeti knapp über 50 %; (c) -Raubfeinde: Löwen, Hyänen, Leoparden, Afrikanische Wildhunde (c) Nahrung und Verdauung Lebensweise und Verhalten - können mehrere Tage ohne Wasser auskommen (c) - Konzentratselektierer: Nahrung: Blätter, Triebe, Früchte, Blüten (h) - nur nach Regenfällen: saftige Gräser (h) - relativ kleiner Pansen; faser- und zellulosereiche Nahrung so schlechter aufschließbar; größere Speicheldrüsen und andere Mikroflora als bei Grasfressern (f) - Größe der Streifgebiete je nach Häufigkeit der Futterpflanzen: zwischen 300-600 km² in Süd- und Ostafrika und über 1500 km² in der dünner bewachsenen Sahelzone (h) - lockere Gruppen von Kühen, subadulten Bullen und Jungtieren; Einzeltiere kommen und gehen, wie sie wollen (h) -geschlechtsreife Bullen wandern ca. 20 km am Tag auf der Suche nach - Acacia nigrescens: macht 60 % der Kühen im Östrus; - sind meist allein und werden Giraffennahrung aus; schützt sich leichter von Löwen überrascht und vor zu starker Entlaubung durch getötet als in der Gruppe Erhöhung des Tanningehaltes und - deshalb gibt es in der Serengeti wird so 2-10 Minuten nach Beginn des Fressens bis zu 40 – 66 Stunden und im Krüger-Park doppelt so viele (h) lang ungenießbar (e) Kühe wie Bullen Giraffe sorgt für effektive Pollenverbreitung der Akazie; -besucht während Blütezeit (Blüten machen dann 25 % der Giraffennahrung aus) bis zu 100 Bäume täglich und verteilt im Fell hängenbleibenden Pollen (g) - innerhalb eines Streifgebietes darf sich nur der ranghöchste Bulle mit den Weibchen paaren; beim typischen Rivalenkampf schlagen Bullen mit Kopf und Hals gegen Körper und Beine des Gegners (c) - Jungtiere bilden „Kindergruppen“ mit bis zu 10 Kälbern, begleitet von 2-3 ausgewachsenen Kühen, die die Kälber mit Tritten auch gegen Löwen verteidigen (h) Literaturübersicht 26 Tab. 8: Zoologische Daten der Waldböcke oder Drehhornantilopen (Tragelaphus sp.) nach WALTHER 1968 (a), WALTHER 1988 (b), PETZSCH und PIECHOCKI 1992 (c), BURTON und BURTON 1994 (d), HALL und UNDERWOOD 2001 (e), SINCLAIR et al. 2001 (f), HOFMANN und STEWART 1972 (g). Art: Buschbock Tragelaphus scriptus (8 Unterarten) Standhöhe: Körpergewicht: ♂ 70-100 cm; ♀ 65-85 cm; ♂ 40-80 kg; ♀ 25-60 kg; bis 57 cm ( nur ♂) (b) ♂ dunkler als ♀; kurze Rückenmähne bei ♂ (b) Hornlänge: Fellfarbe und -beschaffenheit: Nahrung: Geschlechtsreife: Tragzeit: Jungtierverhalten: Lebensdauer: Sitatunga Tragelaphus spekei (5 Unterarten) ♂ 85-125 cm; ♀ 75-105 cm; ♂ 70-120 kg; ♀ 40-105 kg; bis 92 cm (b) ( nur ♂) ♂ dunkler als ♀; Halsmähne bei ♂; Fell lang, leicht ölig, wasserabstoßend (b) Blätter, Knos- Wasser- und pen, Triebe, SumpfFrüchte, aber pflanzen, auch Kräuter frisches Gras und Gräser (b) (b) 11-12 Monate ca. 6 Monate Ablieger Nyala Tragelaphus angasi Bergnyala Tragelaphus buxtoni ♂ 100-121 cm; ♀ 80-105 cm; ♂ 100-140 kg; ♀ 55-90 kg; bis 83 cm (b) ( nur ♂) ♂ schwarzbraun, mit Hals-, Rückenund Bauchmähne, ♀ rotbraun (b) Blätter, Triebe, Früchte, aber auch Kräuter und Gräser (b) ♂ 120-135 cm; ♀ 90-110 cm; ♂ 180-300 kg; ♀ 150-200 kg; bis 118 cm ( nur ♂) (b) ♂ und ♀ gleich, dunkel braungrau; ♂ mit Halsund Rückenkamm (b) Blätter, Knospen, Triebe, auch Kräuter und Gräser (b) ♂ 18 Monate ♀ 11-12 Mon. 7 ½ - 8 ½ Mon. 7-8 ½ Monate Ablieger Ablieger 2-2 ½ Jahre ab ca. 2 Jahre 7-9 Monate unbekannt um 12 Jahre(b) bis 19 Jahre (b) bis 16 Jahre (b) unbekannt (b) Kleiner Kudu Tragelaphus imberbis (2 Unterarten) Großer Kudu Tragelaphus strepsiceros (4 Unterarten) Bongo Tragelaphus (Taurotragus) euryceros Elenantilope Tragelaphus (Taurotragus) oryx ( 5 Unterarten) ♂ 95-112 cm; ♂ 130-150 cm; ♂ 110-130 cm; ♂ 140-180 cm; ♀ 90-100 cm; ♀ 120-140 cm; ♀ 110-130 cm; ♀ 130-160 cm; ♂ 95-105 kg; ♂ 225-315 kg; ♂ ca. 270 kg; ♂ 400-1000 kg ♀ 80-95 kg; ♀ 180-235 kg; ♀ ca. 240 kg; ♀ 300-600 kg; bis 91 cm bis 100 cm bis 181 cm bis 123 / 66cm ( nur ♂) (b) ( nur ♂) (b) (♂/♀) (b) (♂/♀) (b) ♂ blaugrau, ♂ und ♀ rotbraun, alte grau- bis mit Nackenbraungrau; ♂ werden orangebraun; und Rückenstarke Halsdunkler bis Halswamme, mähne, mähne bei ♂ Halskamm, schwarz; ♀ rotbraun Stirnschopf bei (b) Nacken und (b) (b) Rückenkamm ♂ bei ♂ (b) Blätter, Blätter, Gräser Blätter, Gräser Blätter, und Kräuter, und Kräuter auch Früchte, aber auch Kräuter und sowie Wurzeln (b) Gräser, Gräser und Früchte Kräuter (b) (b) (b) Browser (g) Browser (g) 1 ½ Jahre ♂ 21-24 Mon. ca. 20 Monate 15- 24 Monate ♀ 15-21 Mon. 7 ½ - 8 Monate 7-9 Monate 9 ½ Monate 8 ½ -9 ½ Mon. Ablieger Abliegerzeit Ablieger Ablieger relativ kurz > 15 Jahre (b) bis 23 Jahre (b) bis 19 Jahre (b) bis 16 Jahre (b) Literaturübersicht Lebensraum: Lebensweise: Herdengröße: Aufenthaltsgebiete: Besonderheiten: Heutige Verbreitung: Buschbock unterwuchsreiches Gelände bis zu 4000 m Höhe; in Wassernähe (b) 27 Sitatunga Sumpfwald, Schilfsümpfe, waldige Inseln in Flüssen u. Seen (b) Nyala lockere bis dichte Buschund Waldgebiete in Wassernähe; nicht im Bergland (b) Bergnyala Im Bergland zwischen 3000 und 3700 m Höhe, in Baumheiden, Dickichten und Morästen (b) einzeleinzelnur Altbullen weitgehend gängerisch, gängerisch, einzelunbekannt; nicht territorial nicht territorial gängerisch, wahrschl. nicht territorial nicht territorial 1 (selten 2-3) 1 (selten 2-3) 2-10 2-10 (b) (selten >20) (selten >20) keine Angabe (b) -flüchtet ins Wasser, oft bis zur Nase untertauchend; (b) -legt Schilfplattformen für ihre Jungtiere an (c) 300.000 Indivi- 100.000 Individuen in über duen in drei 35 Ländern separaten Afrikas (f) Gebieten Zentralafrikas (f) / (d) keine Angabe (b) -stärkster Geschlechtsdimorphismus in Größe, Farbe, Behaarung -auffälligstes Imponiergehabe (b) keine Angabe (b) -war in den frühen 90er Jahren infolge politischer Umbrüche dem Aussterben nah (f) -26.000 Individuen -nur im Süden Afrikas (f) -ca. 2000 Individuen -nur im äthiopischen Hochland (f) 1-3 ha / Tier (a) -guter Schwimmer; -lebt oft in Siedlungsnähe; -überspringt Zäune von 2 m Höhe (b) Kleiner Kudu trockenes DornbuschGelände, Galeriewald in Ebene und Hügelland (b) Großer Kudu locker bis dicht bewaldetes Flach-, Hügelund Bergland (b) Bongo dichtester tropischer Urwald, Buschund Bambusdschungel in Ebene und Gebirge bis 4000 m (b) -keine Angabe Elenantilope lichter Wald u. Busch, auch offenes Gelände bis hin zur Halbwüste, im Gebirge bis zu 4500 m (b) -nur Altbullen -Altbullen - gesellig einzelauch einzeln, - nicht gängerisch, nicht territorial territorial -1-2 oder nicht territorial -2-15 (selten 5-50 (z.T. Gruppen bis zu Gruppen bis zu -3-4 (höchstens 20-30) in ♂20 Tiere 25) in ♂-bzw. bzw. ♀Hunderten), oft ♀-Gruppen gemischte Gruppen oder Verbände gemischt bis zu 100 Tiere -keine Angabe -keine Angabe - 2-4 km² / Tier - 4 -12 km² (b) /Gruppe(b) (b) (b) - nutzt oft die - Gehege muß -mit Stirn- stark dezikünstlichen miert durch Versteckmög- schopf verteiWasserstellen lichkeiten Rinderkranklen ♂ Urinmarheiten:1994/95 der Farmen, beinhalten, kierungen; durch Rinder- - überspringt - erkennt in - trabt Zäune von 2 ½ Panik Zäune pest in Tsavo ausdauernd (b) m Höhe (b) nicht, wenn -1999 durch - Knie erzeuMilzbrand in Büsche dahin- gen KnackÄthiopien (f) ter sind (b) geräusche (d) -8000 Indivi-300.000 Indi- -keine Zahlen -50.000 Individuen der duen (f) viduen, v.a. im bekannt -in Äthiopien, Süden Afrikas, -kommt vor in gewöhnlichen seltener in Ost- WestzentralElenantilope Uganda, und Westzen- afrika, wenige - 5.000 IndiviSudan, tralafrika (f) auch in Kenia duen der RieSomalia, (f) senelenantilope Kenia, (in WestzenTansania (e) tralafrika) (f) Literaturübersicht 28 Tab. 9: Zoologische Daten der Wasserböcke und Riedböcke (Unterfamilie Reduncinae) nach WALTHER 1988 (a), BURTON und BURTON 1994 (b), MURRAY 2001 (c) und HOFMANN und STEWART 1972 (d). Art: KobWasserbock Kobus (Kobus) Kobus ellipsiprymnus (Adenota) kob (13 Unter(12 Unterarten) arten) Frau Gray`s Wasserbock Kobus (Onotragus) megaceros (Gemeiner) Riedbock Redunca redunca (7 Unterarten) Großer Riedbock Redunca arundinum (2 Unterarten) Bergriedbock Redunca fulvorufula (3 Unterarten) Rehantilope; Rehböckchen Pelea capreolus Standhöhe: ♂ 110-130 cm; ♀ 100-125 cm; ♂ 170-250 kg; ♀ 150-200 kg; 50-100 cm (nur ♂) (a) je nach U.-art gelbbraun, rotbraun o. grauschwarz; Fell lang u. eingefettet; Spiegel beim Ellipsenwasserbock dunkel mit weißem Ring, beim DefassaW. weiß, (a) Kreuzungen dazwischen (b) v.a. Gräser, wenig Laub; braucht täglich Wasser (a) Grazer (d) ♂ 100-105 cm; ♀ 80-85 cm; ♂ 90-120 kg; ♀ 60-90 kg; 45-87 cm (nur ♂) (a) Altböcke oberseits schwarzbraun mit weißem Nackenstreifen und Sattelfleck am Widerrist; Weibchen ockergelb ohne weiße Zeichnung (a) ♂ 70-90 cm; ♀ 65-80 cm; ♂ 45-65 kg; ♀ 35-55 kg; 20-41cm (nur ♂) (a) Fell hell lederfarben (c) Schwanz mit weißer Unterseite, nackte Hautfläche unter Ohransatz (Duftdrüse; Sekret verdampft und wird durch Ohren verteilt) (a) ♂ 80-105 cm; ♀ 65-95 cm; ♂ 60-95 kg; ♀ 50-85 kg; 25-46 cm (nur ♂) (a) graubraun bis dunkelbraun, sonst wie (Gemeiner) Riedbock (a) ♂ 60-80 cm ♀ 60-80 cm ♂ 20-30 kg ♀ 20-30 kg 13-23 cm (nur ♂) (a) Fell wollig; Körperoberseite graubraun; ♀ größer u. grauer als ♂, sonst wie (Gemeiner) Riedbock (a) ♂ 70-80 cm ♀ 70-80 cm ♂ 18-30 kg ♀ 18-30 kg 15-29 cm (nur ♂) (a) grau bis weißlich, kaninchenartiges Fell: kurz, weich, dicht und wollig (a) wie Gräser, KräuGräser, Kräu- v.a. Gräser, ter, Blätter; ter, Wassereinige Kräuter; (Gemeiner) pflanzen (a) stark wasserab- Riedbock (a) weniger wasserabhängig (a) hängig; (a) Grazer (d) Grazer (d) Gräser, Kräuter, Blätter; wasserabhängig (a) Körpergewicht: Hornlänge: Fellfarbe und -beschaffenheit: Nahrung: Wasserbock LitschiWasserbock, LitschiMoorantilope Kobus (Hydrotragus) leche (4 Unterarten) ♂ 80-105 cm; ♂ 85-110 cm; ♀ 70-85 cm; ♀ 85-95 cm; ♂ 65-120 kg; ♂ 85-130 kg; ♀ 50-70 kg; ♀ 60-95 kg; keine Angabe 45-92 cm (a) (nur ♂) (nur ♂) (a) je nach Unter- je nach art gelbbraun, Unterart rötlich-ocker gelbbraun bis bis haselnußfast schwarz; braun; nur (a) Weißohr-KobAltböcke schwarzbraun mit weißen Ohren und Lippen und weißer Augenumgebung und Kehle (a) Gräser u. Gräser, KräuKräuter; ter, Wasserbraucht täglich pflanzen; tägWasser (a) lich Wasser (a) Grazer (d) Literaturübersicht Geschlechtsreife: Tragzeit: Jungtierverhalten: Lebensdauer: Lebensraum: Lebensweise: Revier d. ♂: Herdengröße: Besonderheiten: Heutige Verbreitung: Wasserbock ♂ 14 Monate ♀ 13 Monate ca. 9 Monate Ablieger bis 18 Jahre (a) in Grasland mit Gebüsch in Wassernähe, Galeriewald (a) 29 Kob-Wasserb. ca. 13 Monate 8 ½-9 Monate Ablieger bis 17 Jahre (a) in reinem oder buschdurchsetztem Grasland, auch mit verhältnismässig hohem Gras, in Wassernähe (a) gesellig, Altgesellig, Alt-♂ böcke werden (3-4 -jährig) territorial territorial 60-250 ha 0,02-3 ha bis ca. 30 in meist 2-50, ♂-, ♀- oder ge- selten ♂-Grupmischten pen bis 600, ♀Gruppen; ♂ Gruppen bis erst 6 -7-jährig 1000 Tiere (a) territorial (a) -Kreuzungen -S-förmiges zw. DefassaGehörn; (a) und Ellipsenw. -Massenwanmöglich (b) derungen bei Weißohr-K. (c) -zahlreich in -reicht von großen Teilen Gambia östlich Afrikas südbis zum Sudan lich der Saha- und nach ra; Ellipsen-W. Äthiopien; östlich, Defas- auch in Ugansa-W. westlich da (c); nicht (b) gefährdet (a) Litschi-W. ♂ 2 ½ Jahre ♀ 1 ½ Jahre ca. 7-8 Monate Ablieger FrauGray`s W. ♂ 2 ½ Jahre ♀ 1 ½ Jahre ca. 7-8 Monate keine Angabe Riedbock ca. 1 ½ Jahre Großer Riedb. ca. 1 ½ Jahre Bergriedbock ca.1 ½ Jahre 7-7 ½ Monate keine Angabe 7 ¾ Monate Ablieger 7 ¾ Monate keine Angabe bis 15 Jahre (a) in Überflutungsmarschen, an Flüssen, Sümpfen und Seen, normalerweise 550 cm tief; (a) bis 10 Jahre (a) in Sümpfen, trockenen und überfluteten Grasmarschen und Steppengebieten und Schilfdickichten (a) gesellig, Altböcke wahrschl. territorial keine Angabe 50 bis mehrere hunderte oder tausende Tiere, Männchen in eigenen Gruppen (a) -starker Färbungsunterschied der Geschlechter (a) -Sudan, WestÄthiopien: Sümpfe des Weißen Nils und anderer Flüsse (c) -bedroht (a) 10 Jahre (a) In grasigem bis sumpfigem, mit Ried, Schilf o. Hochgras bedecktem Flach- und Hügelland in Wassernähe (a) Altböcke werden territorial 10 Jahre (a) wie (Gemeiner) Riedbock (a) gesellig, Altböcke werden territorial 20-80 ha bis 400 Tiere, in Männchen-, Weibchen- und gemischten Herden (a) -Hauptklauen lang, schmal, spreizbar, -kräftige Nebenklauen (a) -Rote Litschi: Botswana u. Zambia; gefährdet: -Schwarze L. (Zambia+Kongo );-Braune L. (Zambia) (c) Altböcke werden territorial 15-40 ha 30-60 ha 1-2 oder bis zu 1-2, nur in 12 Tiere, in Trockenzeit bis wenigen Gezu 20 Tiere (a) genden auch Herden von Hunderten (a) -legen sich bei -wie Gefahr ab oder (Gemeiner) fliehen, nach- Riedbock (a) dem sie gellend pfeifen (a) -nördliche -südliche SaSavannen vom vannen nördSenegal bis lich bis Tanzum Sudan u. zania u. westsüdlich bis lich bis nach Tanzania; (c) Angola; (c) sichere sichere Bestände (a) Bestände (a) Rehantilope 1-1 ½ Jahre 9 ½ Monate Ablieger keine 12 Jahre (a) Angabe (a) In grasigem, grasige Täler, offenem oder Hügel, Hochmit Büschen ebenen, mit durchsetztem, niedrigen steinigem Hü- Büschen; gel- oder Berg- möglichst in land bis 4200m Wassernähe (a) (a) gesellig, Altgesellig, Altböcke werden böcke werden territorial territorial keine Angabe keine Angabe 10-40 Tiere in 12-30 Tiere, ♂ eher einzellockeren Gruppen (a) gängerisch (a) -geselliger und vom Wasser unabhängiger als andere Riedböcke (a) -nur inselartig in Kamerun, Nordost- und Südostafrika -zur Zeit nicht gefährdet (a) -territoriale Altböcke markieren mit Urin (a) -teilweise im selben Gebiet wie Bergriedböcke, zur Zeit nicht gefährdet (a) Literaturübersicht 30 Tab. 10: Zoologische Daten der Impala (Aepyceros melampus) und der Pferdeböcke (Hippotraginae) nach WALTHER 1968 (a), WALTHER 1988 (b), BURTON u. BURTON 1994 (c), MURRAY 2001 (d), HOFMANN u. STEWART 1972 (e), TAYLOR 1968 (f). Art: Standhöhe: Körpergewicht: Hornlänge: Fellfarbe und -beschaffenheit: Nahrung: Geschlechtsreife: Tragzeit: Jungtiere: Lebensdauer: Schwarzfersenantilope, Impala Aepyceros melampus (6 Unterarten) ♂ 80-95 cm; ♀ 75-90 cm; ♂ 45-80 kg; ♀ 40-60 kg; bis 91 cm (nur ♂) (b) hell rotbraun, weisse Bauch(d), und Schwanzunterseite, schwarze Keulenstreifen, schwarzer Haarbusch oberhalb der hinteren Fesselgelenke (b) Gräser, Laub, Blüten, Früchte; Wasser nötig (b) -Mixed feeder (e) ♂ 1 ½ Jahre ♀ 1 Jahr 6 ½-7 Monate Ablieger bis 15 Jahre (b) Pferdeantilope, Roan Hippotragus equinus (6 Unterarten) Rappenantilope Hippotragus niger (3 Unterarten) Südafrikanischer Spießbock (b), Gemsbok (d) Oryx gazella Ostafrikanischer Spießbock Oryx beisa (4 Unterarten) ♂ 150-160 cm; ♀ 140-150 cm; ♂ 260-300 kg; ♀ 225-275 kg; bis 100 / 80cm (♂/♀) (b) sandfarben, rehbraun oder rötlichbraun(e) schwarzbraune Gesichtsmaske bei ♂, etwas heller bei ♀; Halsmähne; lange Haarpinsel an den Ohrspitzen (b) mittelhohe frische Gräser, wenig Laub; 2-3maliges Trinken täglich (b); 2 ½ -3 Jahre ♂ 127-143 cm; ♀ 117-135 cm; ♂ 200-270 kg; ♀ 190-230 kg; bis 165 /100cm (♂/♀) (b) Bauch u. Spiegel weiß; Gesicht weiß mit schwarzer Maske; Körperoberseite je nach Geschlecht und Unterart schwarz oder rotbraun. (b) wie Pferdeantilope; (b) ♂ 115-140 cm; ♀ 115-140 cm; ♂ 180-225 kg; ♀ 180-225 kg; 90-127 cm (♂und ♀) (b) weiß- bis bräunlich-grau; schwarze Gesichtszeichnung, Aalstrich, breites schwarzes Flankenband und Zeichnung an Läufen schwarz (b) Gräser, Kräuter, Saftwurzeln u.-früchte, Melonen, Blätter; Wasser entbehrlich; (b) 1 ½ -2 Jahre ♂ 110-120 cm; ♀ 110-120 cm; ♂ ca. 200 kg; ♀ ca. 150 kg; 75-120 cm (♂und ♀) (b) grau bis bräunlich; ähnlich Südafrikan. Oryx, aber Flankenband schmaler und Zeichnung nur an den Vorderläufen (b) Säbelantilope, Nordafrikanischer Spießbock Oryx dammah ♂ 110-125 cm; ♀ 110-125 cm; ♂ 180-200 kg; ♀ 180-200 kg; 102-127 cm (♂und ♀) (b) weißlich, Hals u. Brust rostbraun; bei manchen auch rostbraunes Flankenband u. Fleck an Oberschenkel; Gesichtsmaske nur schattenhaft braun (b) wie Südafrika- wie Südafrikanischer Spieß- nischer Spießbock; (b) bock (b) -Grazer (e) Arabischer Spießbock, Weiße Oryxantilope Oryx leucoryx ♂ 81-102 cm; ♀ 81-102 cm; ♂ 65-70 kg; ♀ 65-70 kg; 50-68 cm (♂und ♀) (b) weiß; schwarze Gesichtsmaske, schwarze Abzeichen an Vorder- u. Hinterläufen; schmaler schwarzer Flankenstreifen angedeutet o. fehlend (b) wie Südafrikanischer Spießbock (b) Mendesantilope, Addaxantilope Addax nasomaculatus ♂ 105-115 cm; ♀ 95-110 cm; ♂ 100-125 kg; ♀ 60-90 kg; bis 109 / 80 cm (♂und ♀) (b) im Sommer weiß, im Winter grau; Kopf hell rauchgrau mit weißem Streifen vom Augenwinkel zur Wangenmitte; dunkles Haarpolster auf der Stirn (b) Gräser, Kräuter, Buschlaub; kann Wasser vermutlich lange entbehren; (b) 2 ½ -3 Jahre wie Südafrika- 1 ½-2 Jahre 1 ½-2 Jahre ♀ 1 ½ Jahre; nischer Spieß♂ 3 Jahre ca. 9-10 Mon. ca. 9 Monate 8 ½-10 Monate bock (b) 8-8 ½ Monate 8 ½-9 Monate 8 ½-9 Monate keine Angabe Ablieger keine Angabe Ablieger Ablieger Ablieger k. Angabe (b) k. Angabe (b) bis 19 Jahre (b) bis 17 Jahre (b) bis 17 Jahre (b) bis 20 Jahre (b) Literaturübersicht Lebensraum: Lebensweise und Herdengröße: Impala Parklandschaft, Trockenwald, Galeriewald in Ebene u. Hügelland, offene Steppe (b) gesellig, Altböcke territorial; Revier: 20-90 ha ♂-Gruppen bis ca. 30 Tiere; ♀-Gruppen bis 200 Tiere; Haremsgruppen (b) Besonderheiten: -sind in Regenzeit Grazer und in Trockenzeit eher Browser (e) Heutige Verbreitung: -weit verbreitet in Süd- und Ostafrika, nur Angola-Impala (schwarzes Gesicht) stark gefährdet (b) 31 Pferdeantilope Buschsavanne, Galeriewald, lichte Gehölze in Wassernähe, in Flach- u. Hügelland (b) gesellig, nicht territorial; 5-20 Tiere in Haremsgruppen; ausgeprägte Rangordnung; ♂ ab 2-3 J. in Junggesellenrudeln; z.T. gemischte Verbände (b) -Altbullen nicht territorial, aber mit beweglicher Intoleranzzone von 300-500 m Umkreis. -hochempfindlich gegen Milzbrand (b) -weites Verbreitungsgebiet erreicht Äthiopien im Norden u. Senegal im Westen (c), -nach (b) zur Zeit nicht bedroht Rappenantil. wie Pferdeantilope, aber eher dichter Buschwald; nicht in offener Grassteppe (b) gesellig; Altbullen territorial; Revier: 25-250 ha; Gruppen etwas größer als bei Pferdeantilopen, sonst ähnliche Sozialstruktur (b) Südafr. Spießb. Trockensteppe, Busch-/ Baumsavanne, Ebene u. Hügelland, Halbwüste und Wüste (b) gesellig; Altbullen evtl. territorial; 2-20; manchmal Herden von 100-200 Tieren; zur Paarungszeit oft paarweise (b) Ostafr. Spießb. Kurzgrassteppe, Halbwüste, Buschu. Baumsavanne in Ebene u. Hügelland (b) gesellig; Altbullen evtl. territorial; wie Südafrik.Oryx: Männchen-, Weibchen- und gemischteVerbände mit ausgeprägterRangordnung (b) Säbelantilope magere Steppe, Halbwüste, Wüste; nomadisch Regenfällen nachziehend (b) gesellig; paarweise u. in Gruppen bis zu 50 Tieren, früher zur Wanderzeit Herden von Tausenden (b) Arab. Spießb. magere Steppe, Halbwüste u. Wüste (b) Mendesantil. Sand- und Steinwüsten, Halbwüsten, magere Steppen (b) keine genauen Angaben; Lebensweise wahrscheinlich ähnlich Süd- und Ostafrikanischem Spießbock (b) gesellig; 2-20 Tiere, bei Fernwanderungen in großen Herden, Sozialeinheiten wohl wie bei Süd- u Ostafrikan. Oryxantilope (b) -relativ wehrhaft und angriffslustig, auch gegen Löwen (a) - graben nach Grundwasser in ausgetrockneten Flußbetten; fressen wasserhaltige Früchte u. Wurzeln (b) -Futterpflanzen der Oryx beisa haben nachts und frühmorgens einen bedarfsdeckenden Wassergehalt für diese Tiere. (f) -wandert in der Regenzeit nordwärts in die Sahara und in der Trockenzeit südwärts in den Sudan (b) -kam früher in Arabien, auf der Sinai-Halbinsel und in südlichen Teilen Israels, Syriens, Jordaniens und des Iraks vor (b) -Transvaal, Angola u. Südost-Kenia; nur Riesenrappenantilope (500700 Individ. ) in Angola stark bedroht; (c) andere nicht bedroht (b) -Südwestafrika (d) -noch oder wieder gute Bestände besonders in Schutzgebieten (b) -Eritrea-Spießbock (Oryx beisa beisa) gebietsweise ausgerottet - BüschelohrOryx (Oryx b. callotis) in Ostafrika geschützt (b) -bis auf kleine Reste am südlichen Sahara-Rand ausgerottet - keine Schutzgebiete imVerbreitungsgebiet (b) -fast völlig ausgerottet; in Arabien wieder ausgesetzt (aus Zuchtgruppe des PhöenixZoo, Arizona); Weltbestand ca. 100 Tiere (b) -verbreiterte Klauen und Nebenklauen verhindern ein Versinken im Sand -gräbt Gruben im Schatten als Schutz vor Hitze (b) -höchstens 5000-6000 Individuen im Tschad und Sudan, vielleicht sogar nur 1000; keine sicheren Schutzgebiete (b) Literaturübersicht 32 2.6 Nachweise von Endoparasiten bei den in dieser Studie untersuchten Wildwiederkäuerarten in Freiland und Zoo Tab. 11 Parasitengattung Freiland Unterfamilie Tierart Gi Anzahl der vorliegenden Veröffentlichungen 9 Eimeria Schistosoma, Fasciola, Paramphistomum, S,F Calicophoron, Cotylophoron, Dicrocoelium Moniezia, Avitellina, Stilesia, Thysaniezia Strongyloides Chabertia, Oesophagostomum Bunostomum, Gaigeria, Agriostomum, Monodontella giraffae Haemonchus, Ostertagia, Bigalkenema, Longistrongylus, Kobusinema, Trichostrongylus, Cooperia, Paracooperia, Impalaia Camelostrongylus, Gazellostrongylus, Cooperioides Nematodirus Dictyocaulus Protostrongylus, Muellerius, Pneumostrongylus Toxocara Trichuris, Capillaria M Zoo Waldb. El N 16 7 E F, S, Co P, Ca Co M,S M A S O O A Pferdeböcke Or Ra Pf 9 6 8 F M S O Wasserböcke Ell De Lit 3 9 3 E E S,P F S,P F, S,F Ca Co Ca P, Ca Co M, M, S A,S A,S S O O O O A B H,I H,O H, H, H,I H, O, T,C O, O, I T, L,I C, K,P P,I T,C G Ca G N D Pr, Pn Pr, Pn N D Pr, T Pr, Pn H, H, T,C C I B H, C Imp 32 Gi 22 E S,F,P D Ca, Co Waldb. El N 12 5 E E Pferdeböcke Or Ra Pf 10(*3 6 5 E *E E D P M,A S,T S O M M M S O S C S B,G, A H,O, B,L, K,T, C,I B, M H, O, T, C Wasserböcke Ell De Lit Im 5 3 2 2 E E E E P M S C, O S *O S H,O O, H,O, T,C T L,T C O, L, T C H, O, T, C H, O, O, *T *T N *D Pr N *D D o. Pr, N N *N D C,T T, C, *C T O, *O *T *T G, Co Ca D Pr, Pn D T D Pr, M Pn T N D T, C T T,C C C, T C,T T, T *C Abkürzungen: Waldb. = Waldböcke; Gi = Giraffe; El = Elenantilope; N = Nyala; Or = Oryxantilope; (* 3 =davon 3 Veröffentlichungen zu Oryx gazella; Ra = Rappenantilope; Pf = Pferdeantilope; Ell = Ellipsen-Wasserbock; De = Defassa-Wasserbock; *fettgedruckt= durch eigene Untersuchungsergebnisse ergänzt Lit = Litschi-Moorantilope; Imp = Impala; Literaturübersicht 33 In der vorherigen Tabelle wurden Literaturangaben zum Auftreten der verschiedenen Endoparasiten bei den untersuchten Wildwiederkäuerarten im Freiland denen in Zoo- und Gehegehaltung ergänzt durch eigene Untersuchungsergebnisse gegenübergestellt. Ausführliche Tabellen mit den einzelnen Parasitenarten sowie den Literaturangaben befinden sich im Tabellenanhang (Tab. 22-26). Hierbei fallen die folgenden Unterschiede zwischen Freiland und Zoo auf: 1.)Protozoa: - die Gattung Eimeria kam in Zoo- und Gehegehaltung bei allen untersuchten Tierarten vor, im Freiland nur bei einigen. 2.)Trematoda: - in Zoo- und Gehegehaltung wurde die Gattung Dicrocoelium erwähnt, nicht jedoch die Gattung Fasciola; - im Freiland kamen neben der Leberegel-Gattung Fasciola, bis zu drei verschiedene Gattungen Pansenegel vor, sowie die nur außerhalb Mitteleuropas vorhandene (ROMMEL, 2000) Gattung Schistosoma. 3.) Cestodea: - in Zoo- und Gehegehaltung kamen gelegentlich Bandwürmer der Gattung Moniezia vor; - im Freiland gab es neben der Gattung Moniezia auch die nur außerhalb Mitteleuropas vorkommenden (SCHNIEDER, 2000) Gattungen Thysaniezia, Avitellina, Stilesia. 4.)Chabertiidae:- die Gattung Chabertia kam zwar gelegentlich in Zoo- und Gehegehaltung vor, nicht aber im Freiland. 5.)Ancylostomatidae: - der Hakenwurm der Giraffe Monodontella giraffae kam im Freiland sowie im Zoo (z.T. kurz nach Import) vor, von den anderen Hakenwürmern gab es Gaigeria und Agriostomum nur im Freiland und ohnehin nur außerhalb Europas (SCHNIEDER, 2000). Auch die Gattung Bunostomum war im Literaturübersicht 34 Freiland häufiger als im Zoo (nur Giraffe). Ihr fehlt in gemäßigten Klimazonen häufig die nötige Temperatur (SCHNIEDER, 2000). 6.)Trichostrongylidae: Im Vergleich zu der größeren Gattungsvielfalt im Freiland gab es im Zoo v.a. Haemonchus, Ostertagia, Trichostrongylus und Cooperia, gelegentlich kam die Gattung Longistrongylus vor (z.T. mehrere Generationen nach dem Import (GIBBONS u. KHALIL,1977)). 7.)weitere Trichostrongyloidea: Von den im Freiland vorkommenden Gattungen Camelostrongylus, Gazellostrongylus und Cooperioides, lag im Zoo nur ein Nachweis von Camelostrongylus in einer in Japan geborenen Giraffe vor (FUKUMOTO et al. 1996). 8.)Nematodirus: Von der Gattung Nematodirus waren im Zoo mehr Tierarten betroffen als im Freiland. 9.)Protostrongylidae: Die auf Zwischenwirte angewiesenen (SCHNIEDER, 2000) kleinen Lungenwürmer wurden im Zoo bei einer geringeren Tierartenzahl nachgewiesen als im Freiland. 10)Trichuridae: Die Gattungen Trichuris und Capillaria sind in Zoo- und Gehegehaltung bei je 9 von 10 Tierarten nachgewiesen worden, im Freiland waren nur 3 Tierarten von Trichuris und keine von Capillaria betroffen. Literaturübersicht 35 2.7 Das Wirt-Parasiten-Verhältnis bei Zootieren RAETHEL (1958), NICKEL (1971) und ROTH (1962) sehen im Wirt-Parasiten-Verhältnis ein labiles Gleichgewicht, das durch ungünstige Faktoren für das Wirtstier, wie z.B. Fang, Transport, Futterumstellung oder Klimaänderungen jederzeit zu Ungunsten des Wirtes gestört werden kann. MEISTER et al. (1993) halten eine vollständige Parasitentilgung weder für möglich, noch für erwünscht, da eine geringe Wurmbürde die Immunität des Wirtes fördert und somit auch zur Verminderung der Behandlungsfrequenz führt. Nach NICKEL und SCHWARZ (1974), sowie SOSNOWSKI und ZUCHOWSKA (1981) spielen „Geohelminthen“, die in ihrer exogenen Entwicklung nur von Klimafaktoren abhängig sind, in europäischen Zoos eine viel größere Rolle als „Biohelminthen“, für deren Larvenentwicklung Zwischenwirte nötig sind. Für FORSTNER et al. (1976) ist die im Tierpark nicht vermeidbare Haltung von vielen Tieren auf engem Raum ein Hauptgrund für die Entstehung von Ungleichgewichten. BOCH (1961) erwähnt zusätzlich die gegenüber den heimatlichen Bedingungen völlig anders gearteten klimatischen Verhältnisse. Dies sieht auch NICKEL (1971) als eine Dauerbelastung des Wirtstieres an, die stetig kompensiert werden muß. Er erwähnt als zusätzlichen Faktor Streßsituationen durch Rangfolgeauseinandersetzungen bei ungenügender Fluchtmöglichkeit. Die heute wieder häufige Haltung auf Naturboden mit Grasbewuchs begünstigt nach SCHULZE (1956), GÖLTENBOTH (1983) und FORSTNER et al. (1976) die Parasitenentwicklung, besonders bei feuchten Bodenverhältnissen. Nach BOCH (1961) ist das Ziel wirksamer anthelminthischer Behandlung nicht nur die Heilung bereits erkrankter Zootiere, sondern auch die Verringerung der großen Zahl von gesund erscheinenden Parasitenträgern, die dauernd Wurmeier ausscheiden und damit Ansteckungsquelle für alle jugendlichen oder aus anderen Gründen schwächlichen Tiere sind. KREIS (1952) erwähnt, dass das Tier mit steigendem Alter resistenter gegenüber Parasiteninvasionen wird. Was die verschiedenen Parasitenarten betrifft, kann eine Art in Literaturübersicht 36 einem Zoo, abhängig von den dortigen Verhältnissen ein großes Problem darstellen und in einem anderen kaum eine Rolle spielen. Auch bei den verschiedenen Tierarten gibt es Unterschiede im Wirt-Parasiten-Verhältnis. So gibt es viele Tierarten, die stark gefährdeten Tieren benachbart gehalten werden, bei denen jedoch durchgängig kein oder nur ein geringer Befall nachgewiesen wird (GÖLTENBOTH u. KLÖS, 1970; SOSNOWSKI u. ZUCHOWSKA, 1981). Eine ausführlichere Diskussion der dargestellten Thematik liefert KINGS (1999). Literaturübersicht 2.8 37 Anthelminthische Therapie bei den untersuchten Wildwiederkäuerarten in Zoo- und Gehegehaltung (Tab. 11) Jahr 1963 Autor ECKERT Tiere 3 Pferdeantilopen 1965 2 Giraffen 1967 NEUNHOEFFER SCHEEL 1 Giraffe 1971 LYON Giraffe 1974 1974 LYON 2,4 Giraffen MANZ u. 7 Elenantilope DINGELDEIN 1976 ENIGK u. DEY-HAZRA 6 Elenantilopen 5 Oryxantilopen 1977 1978 1978 1982 1983 FORSTNER Giraffe et al. ENIGK u. 8 Elenantilopen DEY-HAZRA MELBOURNE 7 von 21 Giraffen MOUCHA u. MIKULICA HORAK et al. (Untersuchungen im Krüger-Park, Südafrika) 1 Giraffe 6 Impalas (Sektionen nach Behandlung; zusätzlich Kontrollsektionen ohne vorherige Behandlung) Endoparasiten Trichostrongyliden Strongyloides sp. Monodontella giraffae Trichostrongylus sp. Ostertagia sp. Trichostrongylus sp. Trichuris sp. Trichuris sp. Trichostrongyliden Trichuris sp., Strongyloides sp. Haemonchus sp., Cooperia sp., Trichostrongylus sp. Haemonchus sp., Ostertagia sp. MDS; Trichuris sp. MDS Medikament Thiabendazol Thiabendazol Dosierung 1x 60 mg/kg; 4 Wo. später 100mg/kg 10 g/ 100 kg KGW Bemerkung -Befall war nicht nachhaltig zu beeinflussen -direkt nach Behandlung 50% Reduktion -erst nach 4 Wochen keine Eiausscheidung - nach Behandlung 6 Monate lang alle 3 Wochen kontrolliert => immer negativ k.A. Thiabendazol (Thibenzole ®) Thiabendazol 100 mg/ kg KGW Parbendazol PyrantelTartrat (Banminth ®) Fenbendazol 20 mg /kg 25 mg /kg; 2 Tage hintereinander oder im Wochenabstand 2 x 5 mg / kg -100%ige Reduktion der Eizahl Fenbendazol 3 x 5 mg / kg -100%ige Reduktion der Eizahl Mebendazol 14 Tage lang: 10 mg /kg / Tag 10,0 mg /kg -ab 2 Wochen nach Therapie negativ; (direkt nach Therapie noch 50 EpG MDS) - führte zu koprologisch negativem Befund k.A. Febantel (Rintal ®) Ostertagia sp., Cooperia Fenbendazol u. k.A. Thiabendazol sp., Haemonchus sp., Oesophag. sp., Trichostrong. sp., Trichuris sp. Dictyocaulus viviparus Mebendazol 15 mg / kg KGW (Mebenvet ®) 3 Tage lang Trichostr. colubriformis, Ivermectin 200 mcg /kg KGW Cooperia hungi, Cooperioides hamiltoni, Strongyloides sp. Trichostr. sp, Impalaia Ivermectin 200 mcg / kg KGW tuberculata, Gaigeria pachyscelis, Oesophagostomum columbianum -effektive Wirkung -Kontrollproben negativ -beide Präparate fast 1x monatlich abwechselnd; -trotzdem Kontrollproben nicht 100%ig negativ -Proben 1 Woche bzw. 1 Monat später negativ -vorne genannte Parasitenarten wurden trotz Behandlung bei Sektionen gefunden -vorne genannte Parasitenarten wurden nach Behandlung nicht bei Sektionen gefunden Literaturübersicht 38 Jahr 1984 Autor RÜEDI Tiere Giraffe Endoparasiten Moniezia sp. 1985 JANSSEN -verschiedene Antilopinae (u.a. Impala) und Hippotraginae (u.a. Pferde- u. Oryxantilopen) Strongyliden u. Nematodirus sp. Strongyloides sp. Medikament Praziquantel (Droncit ®) Fenbendazol Fenbendazol Trichuris sp. Dosierung 3 mg / kg KGW wiederholt < 5mg / kg oder > 5mg / kg KGW < 5mg / kg KGW > 5mg / kg KGW Bemerkung -führte zu negativer Eiausscheidung und leichter Kolik -immer 100%ige Reduktion der Eiausscheidung 80% Reduktion 99% Reduktion Antilopinae 88%, Hippotraginae 97% Red. < 5mg / kg KGW 88% Reduktion > 5mg / kg KGW 98% Reduktion Antilopinae 83%, Hippotraginae 100% Red. LD50 bei 0,226 ppm Versuch mit Larvenschlüpftest (Kontrolle: 0,0304 ) =>Benzimidazolresistenz k.A. trotzdem noch Eiausscheidung 1987 ISAZA et al. 3 Pferdeantilopen Haemonchus contortus Thiabendazol 1991 BOYCE et al. MDS Fenbendazol 1994 MIKOLON et al. EID u. RAWHIA KEYSERLINGK et al. Oryxantilope Rappenantilope 4-6 Rappenantilopen 6 Giraffen MDS Fenbendazol Trichuris sp. Ivermectin Strongyliden, Nematodirus sp., Strongyloides sp., Trichuris sp., Lungenwürmer, Askariden Febantel (Rintal ®) k. A. Eimeria sp. Toltrazuril (Baycox ®) Fenbendazol Ivermectin Benzimimdazol 20 mg/kg KGW, 2 Tage hintereinander 0,5 mg/kg 0,5 mg/kg k.A. 1996 1997 2000 YOUNG et al. Wildttiere des Safariparks Hodenhagen 4 Giraffen Haemonchus sp. Levamisole Benzimidazol + Levamisole Avermectin 1 Avermectin 2 114 g (bzw. 228g) pro Tonne Futter 10 mg / 50 kg KGW “ “ -insgesamt 6 x in 2 Jahren; jedesmal nach Behandlung koprologisch negativ -innerhalb einer Woche kein Nachweis mehr von Trichuris sp. - durch regelmäßige Behandlung und Kontrolluntersuchungen konnte der parasitäre Befall innerhalb von 2,5 Jahren von 70,7 % der Tierarten auf 30,7 % gesenkt werden - bei einzelnen Tierarten mußte Behandlung wiederholt werden 100 % Reduktion, 18 Tage nach Behandl. 71 % Reduktion, 14 Tage nach Behandl. Larvenschlüpftest: 99 % effizient = empfindlich 100 % effizient= “ 100 % effizient= “ “ “ 79 % effizient = resistenzverdächtig 100 % effizient= empfindlich Die nachfolgend aufgeführte Tabelle gibt einen Überblick über Wirkstoffe, Dosierungen und Einsatzmöglichkeiten von Anthelminthika bei Wiederkäuern. Literaturübersicht 39 Tab. 12: Wirksamkeit von Anthelminthika auf Wiederkäuer-Nematoden nach DÜWEL und SCHMID (1986). Chemische empfohlene Dosis Kurzbezeichnung große kleine Wiederkäuer (mg / kg KM) Albendazol (a) 7,5 p.o. 5,0 p.o. Febantel 7,5 p.o. 5,0 p.o. Fenbendazol 7,5 p.o. 5,0 p.o. Ivermectin 0,2 s.c. Levamisol 5,0 s.c./i.m. 5,0 s.c./i.m. 7,5 p.o. 7,5 p.o. 10,0 pour on Mebendazol 10-20 p.o. Oxfendazol 4,5 p.o. 5,0 p.o. Parbendazol 30,0 p.o Pyrantel 12,5 p.o. 25,0 p.o. Tiabendazol 75,0 p.o. 50,0 p.o. Trichostrongyliden Dictyocaulus 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 Legende: 1 = Wirksamkeit 95-100 %; 2 = Wirksamkeit ca. 80 %; (a) nicht in den ersten Monaten der Gravidität; Protostrongyliden immature Stadien (2) (2) 1 1 1 1 hypobiotische Stadien SicherheitsIndex * mehr als: (2) (2) 2 1(b) (2) (2) 3 3 = Wirksamkeit ca. 60 %; (b) betrifft Ostertagia Typ II *) Sicherheits-Index = maximal tolerierte Dosis durch therapeutische Dosis (nach Literatur) 1 3 3 (2) 2 ( ) = Wirksamkeit variabel 10 40 500 50 8 6 20 20 20 15 10 Literaturübersicht 40 2.9 Ansätze zu Parasitenkontrollprogrammen in der Literatur ROTH (1962) empfiehlt, als Ausgangspunkt der Überwachung, von jedem Tier mindestens ein- bis zweimal im Jahr eine Kotprobe zu untersuchen. Wenn dies nicht möglich ist, kann man sich auch mit wiederholter Untersuchung von gründlich gemischten Sammelkotproben begnügen, sofern es sich nicht um Muttertiere mit Jungtieren, geschwächte oder neuimportierte Tiere handelt. Bei diesen sind häufigere Kontrollen nötig, ebenso wenn die Befunde der routinemäßigen Untersuchungen auf eine größere Belastung hinweisen. Im Fall einer nötigen anthelminthischen Medikation ist es besonders wichtig, von den Patienten nicht nur vor sondern auch nach der Behandlung Kotproben zu untersuchen. NICKEL und SCHWARZ (1974) raten in Tiergruppen mit einer Helminthenpopulation, die eine Saisondynamik besitzt, zur Zeit der erhöhten Ei- bzw. Larvenausscheidung („Spring-risePhänomen“) zu Untersuchungen in kürzeren Intervallen. BARUTZKI et al. (1989) verglichen die Wirkung von 5 mg/kg Fenbendazol mit 0,714 mg/kg Fenbendazol jeweils an 7 aufeinanderfolgenden Tagen in Abständen von 8-10 Wochen an Gazellengruppen. Beide Dosierungen führten zu einer 100 %igen bzw. 80-100%igen Reduktion der Eiausscheidung, so daß die Autoren auch die kostengünstigere niedrige Dosierung empfehlen konnten (Sie entspricht in der Summe der Normaldosis von 5 mg/ kg.). Sie weisen jedoch auf die mögliche Gefahr einer Resistenzentwicklung hin, die zu verringern ist mit einem Behandlungsintervall, daß deutlich größer ist als die Präpatenz der vorhandenen Wurmarten, sowie durch einen Wirkstoffwechsel in jährlichen Intervallen. MEISTER et al. (1989) beschreiben ein Langzeitkonzept zur Endoparasitenprophylaxe im Tierpark. Im ersten Jahr wurden dazu wöchentlich Sammelkotproben untersucht und so die Tiere in Risiko- und Nichtrisikogruppen eingeteilt. Ab dem 2. Jahr wurden die Risikogruppen alle 2 Wochen und die Nichtrisikogruppen alle 4 Wochen, später alle 6 Wochen kontrolliert. Behandlungen führte man bei sehr hoher oder kontinuierlich ansteigender Eiausscheidung durch. Dieses Konzept verbesserte die parasitologische Situation deutlich. MEISTER et al. (1993) erwähnen abschließend als Vorteile dieses Programms u.a. einen verminderten Medikamentenverbrauch und eine frühzeitige Erkennung an Durchfall erkrankter Tiere. Literaturübersicht 41 KEYSERLINGK et al. (1997) führten im Safaripark Hodenhagen eine dreijährige Studie mit regelmäßigen Kontrolluntersuchungen und Behandlungen mit Rintal® durch. So konnten sie den Prozentsatz der mit Parasiten befallenen Tierarten von 70,7 % auf 30,7 % senken. Die Autoren empfehlen, nach einer Basistherapie mit nachfolgender Kontrolluntersuchung im ersten Jahr, den Einsatz des Medikaments auf eine zweimalige Applikation während der Stallhaltungsperiode zu beschränken und, wenn nötig, zu Beginn der Weidehaltungsperiode einem möglichen „spring-rise-Effekt“ mit einer 3. Behandlung zu begegnen. ISAZA et al. (1990) führten eine Umfrage zu Parasitenkontrollprogrammen in zoologischen Gärten der USA durch. In vielen Zoos wurden regelmäßig Kotproben untersucht, und nur wenn nötig Behandlungen durchgeführt, oder es erfolgten routinemäßige Behandlungen alle 2-3 Monate. Die Autoren zeigen sich überrascht, daß von keinem Zoo der Gebrauch eines strategischen, jahreszeitlich festgelegten Behandlungsprogramms erwähnt wurde, das durch weniger häufige Behandlung das Risiko der Resistenzentwicklung verringern würde. BOYCE et al. (1991) testeten ein strategisches Parasitenkontrollprogramm im San-DiegoWild-Animal-Park. Hierzu wurden im Oktober 1988, Januar 1989 und Mai 1989 parkweit anthelminthische Behandlungen mit Fenbendazol an je 4 aufeinanderfolgenden Tagen durchgeführt. 7 Tage lang davor und danach wurden Kotproben untersucht. Tiere, die vor der Behandlung > 100 EpG und /oder danach > 0 EpG in 2 oder mehr Untersuchungsperioden ausschieden, wurden als Zieltiere für genauere Kontrollen ausgewählt. Bei den Tieren mit Eiausscheidung nach der Behandlung handelte es sich meist um kleinere, schwächere Tiere, so dass vermutlich Abdrängen vom Futter und nicht eine Resistenzentwicklung die mögliche Ursache war. Das Programm erwies sich als hilfreich. Zur Verbesserung sollte der Zugang zum Futter auch für schwache Tiere sichergestellt werden. MIKOLON et al. (1994) führten ebenfalls im San-Diego-Wild-Animal-Park eine 2 Jahre dauernde Folgestudie mit verdoppelter Fenbendazoldosis durch, bei der auch die Larvenbelastung des Weidegrases bestimmt wurde. Die erhöhte Dosis ergab keine signifikante Verbesserung. Das strategische Bekämpfungsprogramm konnte nicht verhindern, dass ganzjährig infektiöse Larven auf der Weide vorkamen, was auf den milden Winter Literaturübersicht 42 zurückgeführt wurde. Jeweils 6 Wochen nach erhöhter Eiausscheidung wurde eine erhöhte Larvenzahl am Weidegras nachgewiesen, so daß eine 2. Behandlung 6 Wochen nach der ersten sinnvoll sein könnte, um eine sofortige Reinfektion zu verhindern. Regelmäßige Kotuntersuchungen, sowie Behandlungen werden weiterhin gebraucht, um parasitäre Infektionen zu kontrollieren. COURTNEY und KOLLIAS (1985) halten es für einen häufig begangenen Fehler, erst nach dem Nachweis einer pathogenen Wurmbürde zu behandeln. Es ist besser, einzugreifen, lange bevor größere Eimengen in die Umgebung ausgeschieden werden. Zur Etablierung eines Parasitenkontrollprogramms ist es wichtig, folgende Punkte zu wissen: - welche Parasitenarten sind für welchen Wirt wichtig ? - zu welcher Zeit im Jahr kommen pathogene Wurmbürden vor ? - welche Tiergruppen sind betroffen ? - zu welcher Zeit sind in der Umwelt Parasitenstadien in pathogener Anzahl vorhanden ? - wann und von welchen Individuen werden die dazu nötigen hohen Eizahlen ausgeschieden ? Die Autoren stellen verschiedene grundsätzliche Strategien vor: Bei Tieren, bei denen hypobiotische Parasitenstadien vorkommen, sollte gegen Ende der für die Larvenentwicklung ungünstigen Jahreszeit behandelt werden. Bei Wirten mit „Periparturient-rise-Phänomen“ sollte das Muttertier kurz vor oder nach der Geburt entwurmt werden, und von der Weide entfernt, oder nach der Geburt alle 3 Wochen behandelt werden, bis ihr Jungtier entwöhnt wird. Wenn Tiere nur geringe Larvenzahlen mit dem Weidegras aufnehmen, deren folgende Eiproduktion aber später in der Weidesaison zu pathogenen Wurmbürden führen, dann ist es sinnvoll, während der initialen Infektionsphase in 3-wöchigen Abständen zu behandeln. Um Resistenzen vorzubeugen, dürfen Wechsel zwischen Präparatgruppen nicht häufiger als 1 x jährlich vorgenommen werden. Neu eingestellte Tiere sollten während einer Quarantänezeit mehrmals mit nicht verwandten Präparaten behandelt werden, bevor sie in die Gruppe aufgenommen werden. Eigene Untersuchungen 3. Eigene Untersuchungen 3.1 Material 3.1.1 Bestände der untersuchten Wildwiederkäuerarten im Untersuchungszeitraum Tab. 13: Tierart Geschlecht: *Geburtsjahr (Tierzahl); Geburtsort, wenn nicht anders angegeben, immer Hodenhagen Giraffe Alttiere: ♂: *1983 (1) in München; *1995 (1) ♀: *1988 (1); *1989 (2); *1995 (1); *1996 (1); *1997 (1); *1998 (1) Jungtiere: ♂: *01.07.2000 (1), am 10.07.2001 nach China verkauft; *09.07.2000 (1) ( 1 Bulle aus Schweden: nur vom 18.06. bis 10.07.01 in Hodenhagen ) gesamt: 10 - 11 Giraffen (+1 für kurze Zeit) Elenantilope Alttiere: ♂: *1994 (1) ♀: *1989 (1); *1992 (1) Geburtsort unbekannt (Tierhandel); *1991 (1); *1996 (4); *1997 (1) Jungtiere: ♂: *30.03.2000 (1); *30.04.2000 (1) ♀: *20.03.2000 (1); *25.03.2000 (1) gesamt: 13 Elenantilopen EllipsenAlttiere: ♂: *1993 (1); *1998 (1) Wasserbock ♀: *1994 (1);*1995(1); *1996 (1); *1998 (1); *1999 (1); Jungtiere: ♂: *14.06.2000 (1); verendet am 20.01.01 ♀: *15.02.2001 (1) gesamt: 7 - 9 Ellipsen-Wasserböcke RappenAlttiere: ♂: *1996 (1) in Givskud (Dänemark); antilope *1995 (1) in Prag, am 21.01.2001 verendet; beide seit 1998 in Hodenhagen kastrierte ♂: *1994 (1); *1994 (2) in Prag, beide seit 1998 in Hodenhagen ♀: *1993 (1), in Hannover *1994 (1), in Hannover, am 03.05.2001 verendet Jungtiere: ♂:*2000 (1) gesamt: 6 - 8 Rappenantilopen OryxAlttiere: ♂: *1999 (1); antilope kastrierte ♂: *1994 (1); *1996 (1) in Stukenbrock, ab 15.10.2000 in Hodenhagen, am 01.06.2001 getötet (Fraktur) ♀: *1992 (1); *1997 (1) Jungtiere: ♂:*25.05.2000 (1) ♀: *25.02.2000 (1) gesamt: 6 - 7 Oryxantilopen Impala Alttiere: ♂: *1997 (1); (*2000 (1) in Hannover, ab 20.08.2001 in Hodenhagen, keine Probennahme, blieb einzeln im Stall) ♀: *1994 (1); *1996 (2), eine davon am 05.02.2001 getötet (Fraktur) gesamt: 3 - 4 Impalas (+1 ohne Probennahme) 43 Eigene Untersuchungen 44 ♂: *1997 (2) in Hannover, seit 1998 in Hodenhagen, einer davon am 10.10.2001 verendet ♀: *1994 (1); *1995 (2) Jungtiere: ♂: *12.08.2000 (1); *2000 (1) in Hannover, ab 04.07.2001 in Hodenhagen ♀: *03.08.2000 (1); *18.08.2001 (1) gesamt:7 - 9 Nyalas PferdeAlttiere: ♂: *1995 (1) in Dvůr Králové (Tschechien), ab 1996 in Hodenh. antilope *1997 (1) in Hannover, ab 1998 in Hodenhagen *1997 (1) in Dvůr Králové, ab 1998 in Hodenhagen gesamt: 3 Pferdeantilopen DefassaAlttiere: ♂: *1992 (1) in Hamburg, ab 22.03.1993 in Hodenhagen; Wasserbock *1998 (1) ♀: *1993 (1), *vor 1994 (2), beide verendet: 04. u. 06.04.2001 gesamt: 3 - 5 Defassa-Wasserböcke LitschiAlttiere: ♂: *1996 (2); *1998 (1) Moor♀: *1992 (1) in Dvůr Králové, ab 1993 in Hodenhagen; antilope *1996 (4); *1998 (3); *1999 (1) gesamt: 12 Litschi-Moorantilopen Nyala Alttiere: 3.1.2 Vergesellschaftung mit anderen Tierarten Die Wildwiederkäuer im Serengeti-Park Hodenhagen standen in drei verschiedenen Gehegen mit anderen Säugetier- und Vogelarten vergesellschaftet. Die Tabelle gibt einen Überblick über die Gruppenzusammensetzung und -stärke. Tab. 14 : Vergesellschaftung mit anderen Tierarten Gehege Afrika I Afrika II Tierarten Netzgiraffe (Giraffa camelopardalis reticulata) Elenantilope (Tragelaphus (Taurotragus) oryx) Ellipsen-Wasserbock (Kobus ellipsiprymnus ellipsiprymnus) Rappenantilope (Hippotragus niger) Südafrikanische Oryxantilope (Oryx gazella gazella) Impala (Aepyceros melampus) Streifengnu (Connochaetes taurinus) Bleßbock (Damaliscus dorcas philippsi) Nyala (Tragelaphus angasi) Bergriedbock (Redunca fulvorufula) Bleßbock (Damaliscus dorcas philippsi) Afrikanischer Strauß (Struthio camelus) Anzahl 10-12 13 7-9 6-8 6-7 3-5 4 2-3 7-9 2 2-3 14 Eigene Untersuchungen Afrika III Defassa-Wasserbock Litschi-Moorantilope Pferdeantilope Watussirind Breitmaulnashorn Chapmanzebra Afrikanischer Marabu 45 (Kobus ellipsiprymnus defassa) (Kobus hydrotragus leche) (Hippotragus equinus) (Bos primigenius hahni) (Ceratotherium simum) (Equus quagga antiquorum) (Leptoptilos crumeniferus) 3-5 12 3 11 9 5-7 7 3.1.3 Haltung, Fütterung und Tränke Die Tiere werden in Boxen, Ausläufen und Gehegen gehalten, deren Größe zwischen 20 % und 1000 % oberhalb der jeweils zulässigen Mindesthaltungsnormen für Säugetiere liegt. In jedem Gehege befinden sich künstlich angelegte Grundwasserseen mit Austausch und Filterwirkung über den jahreszeitlich schwankenden Wasserstand, oder Flachtränken mit Betonwanne, Abfluß und Zuwasserpumpe in höher gelegenen Gehegearealen, sowie mindestens 2 eingestreute Unterstände. Kot wird auf den Straßen täglich, und zusätzlich 2-3 x wöchentlich ca. 30 m links und rechts davon abgesammelt. Im Sommer wird Heu in Futterraufen in Kopfhöhe der Tiere z.T. über befestigtem Boden angeboten. Zusätzlich werden täglich Rüben, Wurzeln, Rote Beete, Mais oder Pellets (KleineWiederkäuer-Pellets für Schafe und Ziegen) an zahlreichen Stellen vom Boden zugefüttert. Für die Giraffen ist eine Futterraufe in Kopfhöhe mit Luzerneheu vorhanden. Während der Vegetationsperiode werden Äste mit Blättern (Buche, Birke, Weide, Eiche, Pappel oder Ahorn) ad libitum angeboten. Während des Sommers sind die Giraffen und die Rappenantilopen nachts im Stall untergebracht, alle anderen Antilopen bleiben Tag und Nacht im Gehege. Da bei den Giraffen zwei ausgewachsene Bullen vorhanden sind, werden diese in Phasen vermehrter Aggression tageweise abwechselnd mit der Gruppe ins Gehege Afrika I gelassen, um ernste Rangkämpfe zu vermeiden. Eigene Untersuchungen 46 Das Gehege Afrika I ist 7,6 ha groß. Während der ganzen Vegetationsperiode ist hier reichlich Gras vorhanden (bis zu 20 cm Halmlänge). Die Tiere haben außerdem Zugang zu einem Nebengehege (3000 m²) mit dichtem Laubbaumbestand. Das Gehege Afrika II hat eine Größe von 2,6 ha. Auf der gesamten Fläche stehen zahlreiche Rotkiefern, so daß der Boden zum großen Teil von Nadeln bedeckt ist. Es ist nur sehr wenig kurzes Gras vorhanden. Das Gehege Afrika III ist 11,1 ha groß und besteht zum größten Teil aus Grasflächen und einigen größeren Sandbereichen. Es steht ein kleines Nebengehege zur Verfügung, in das sich die Litschi-Moorantilopen zurückziehen können. Auf der gesamten Fläche werden oberirdische Teile der Gräser bis auf wenige mm Länge v.a. von Breitmaulnashörnern und Zebras abgegrast. Den Winter – je nach Witterung Anfang November /Anfang Dezember bis Ende Februar / Mitte März - verbringen alle untersuchten Tiere im Stall mit zeitweisem Zugang zu Vorgehegen bei gutem Wetter. Nur die Elenantilopen und die Rappen-Antilopen haben auch im Winter zeitweilig Zugang zum Gehege Afrika I. In den Boxen werden die Böcke bzw. Bullen einzeln gehalten, die weiblichen Tiere und Jungtiere in kleinen Gruppen. Im Winter wird gutes Heu ad libitum gefüttert, sowie Pellets (in einer Menge von 1/10 der täglichen Rauhfuttermenge), Quetschhafer, Wurzeln und Gemüse. Wasser steht im Stall in Trögen in Brusthöhe oder am Boden zur Verfügung. Die Elenantilopen bekommen gelegentlich je nach Kondition und Heuqualität Luzerneheu zugefüttert. Neben gutem Wiesenheu erhalten die Giraffen täglich 1-3 kg Luzerneheu pro Tier, sowie eine Futtermischung mit gekochtem Reis, Sojaschrot, Weizenkleie, Leinsamen und Vitamin-E / Selen-Zusatz (als ölige Suspension oder als Pulver). Eigene Untersuchungen 47 3.1.4 Anthelminthische Behandlungen im Untersuchungszeitraum (Tab. 15) Datum 17.10.00 09./ 10./ 11.11.00 16./17./ 18.11.00 08./09./ 19.03.01 15.03.01 17.04.01 13.06.01 18./ 19.06.01 24.06.01 26.06.01 16.07.01 12.10.01 Tier(e) Präparat / (Wirkstoff) 1 Oryxantilope (Zukauf aus Stukenbrock) Ivomec® (Ivermectin) alle Antilopengruppen Panacur® (Fenbendazol) 1 Oryxantilopen-Jungtier (Nachbehandlung) Panacur® (Fenbendazol) Oryxantilopen-Gruppe Panacur® (Fenbendazol) beide ausgewachsenen Giraffenbullen Ivomec® (Ivermectin) 1 Ellipsen-Wasserbock (Altbock) Ivomec® (Ivermectin) 1 Oryxantilope (Zukauf aus Stukenbrock) Ivomec® (Ivermectin) Pferdeantilopengruppe Panacur® (Fenbendazol) beide Oryxantilopen-Jungtiere Ivomec® (Ivermectin) Rappenantilopen-Jungbock Ivomec® (Ivermectin) 1 Giraffen-Jungtier Ivomec® (Ivermectin) 1 weibliche Rappenantilope Ivomec® (Ivermectin) Rappenantilopen-Jungbock 1 Oryxantilopen-Jungtier Dosis 0,2 mg / kg Kgw. i.m. per dart 15 mg / kg Kgw. p.o. 15 mg / kg Kgw. p.o. 15 mg / kg Kgw. p.o. 0,2 mg / kg Kgw. i.m. per dart 0,2 mg / kg Kgw. i.m. per dart 0,2 mg / kg Kgw. i.m. per dart 15 mg / kg Kgw. p.o. 0,2 mg / kg Kgw. i.m. per dart 0,2 mg / kg Kgw. i.m. per dart 0,2 mg / kg Kgw. i.m. per dart 0,2 mg / kg Kgw. i.m. per dart 3.2 Methoden 3.2.1 Untersuchungszeitraum und Daten der Probennahmen Die Kot- und Grasproben wurden in 14-tägigen Abständen (+ / - 1) gesammelt und untersucht. Abweichend davon konnten erst am 27.12.2000 Proben gesammelt werden, da an den Weihnachtsfeiertagen nicht genügend Tierpfleger im Dienst waren, um das zusätzliche Umsperren der Tiere zu ermöglichen. Aufgrund von Schutzmaßnahmen im Zuge einer MKS-Epidemie in den Niederlanden konnten am 2. März die Proben z.T. nicht gesammelt werden. An den folgenden Terminen bis zum 3. Mai 2001 wurde die Probennahme von Safaripark-Mitarbeitern durchgeführt. Eigene Untersuchungen 48 Das Sammeln der Grasproben wurde nur durchgeführt, wo noch ausreichend Gras vorhanden war (also im November und Dezember 2000 nur in Gehege Afrika 1). Nachfolgend sind die genauen Sammeltermine aufgeführt. Termine 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 Kotprobensammeltermine: 16.10.00 / 17.10.00 30.10.00 / 31.10.00 13.11.00 / 14.11.00 27.11.00 11.12.00 27.12.00 06.01.01 20.01.01 02.02.01 16.02.01 (02.03.01) 17.03.01 01.04.01 13.04.01 03.05.01 10.05.01 23.05.01 07.06.01 / 08.06.01 21.06.01 / 22.06.01 05.07.01 / 06.07.01 19.07.01 / 20.07.01 02.08.01 / 03.08.01 16.08.01 / 17.08.01 30.08.01 / 31.08.01 13.09.01 27.09.01 / 28.09.01 11.10.01 / 12.10.01 25.10.01 / 26.10.01 08.11.01 / 09.11.01 / 11.11.01 Grasprobensammeltermine: 17.10.00 (alle 3 Gehege) 31.10.00 ( “ ) 14.11.00 (nur Gehege Afrika1) 27.11.00 ( “ ) 11.12.00 ( “ ) 13.04.01 (alle 3 Gehege) 03.05.01 ( “ ) 10.05.01 ( “ ) 23.05.01 ( “ ) 08.06.01 ( “ ) 22.06.01 ( “ ) 05.07.01 ( “ ) 20.07.01 ( “ ) 02.08.01 ( “ ) 16.08.01 ( “ ) 31.08.01 ( “ ) 13.09.01 ( “ ) 28.09.01 ( “ ) 12.10.01 ( “ ) 26.10.01 ( “ ) 09.11.01 ( “ ) 3.2.2 Identifikation der Tiere Bei überschaubarer Gruppengröße, sowie individuellen Unterschieden in der Fellfarbe und -beschaffenheit, oder Hörnerform und –länge konnten Einzeltiere unterschieden werden, ansonsten wurden nach Möglichkeit Altersgruppe und Geschlecht notiert. Bei Stallhaltung ohne sichere Zuordnung der Tiere zu bestimmten Boxen war keine Identifikation möglich, ebensowenig bei der relativ großen Gruppe der Litschi-Moorantilopen, die außerdem eine große Fluchtdistanz aufwies. Eigene Untersuchungen 49 3.2.3 Probennahme 3.2.3.1 Kotprobensammlung Da eine rektale Entnahme des Kotes bei den Wildwiederkäuern nicht möglich ist, wurde der Kot mittels eines Plastikhandschuhs unmittelbar nach dem Absetzen vom Boden aufgelesen und die Kontamination mit Bodenpartikeln oder Einstreu möglichst ausgeschlossen. Das Abwarten des Kotabsatzes war nicht immer möglich. So konnten im Winter bei Stallhaltung nur frisch aussehende Proben in der entsprechenden Anzahl vom Stallboden eingesammelt werden. Dazu mußten die Tiere teilweise umgesperrt werden, oder sie befanden sich ohnehin in einem Auslauf. Waren Proben von Müttern und ihren Jungtieren im Stall zu nehmen, wie bei Giraffen und Oryxantilopen, ermöglichte die Größe der ausgeschiedenen Kotkugeln eine Unterscheidung zwischen Jung- und Alttier. In besonderen Ausnahmefällen mußte auf eine Probennahme verzichtet werden, um die Tiere nicht zu gefährden (z.B. wenn ein Umstallen nicht möglich war, und der Zugang zum Stall Panikverhalten hervorgerufen hätte). Grundsätzlich wurden alle Proben noch am selben Tag oder nach Lagerung in der Kühlzelle (bei 3-4 °C) an den darauffolgenden Tagen untersucht. 3.2.3.2 Grasprobensammlung Die Grasprobensammlung auf den Weideflächen wurde nach der von SIEVERS-PREKEHR (1973) beschriebenen Methode zur Ermittlung der Larvenzahlen pro Kilogramm Trockengewicht Gras durchgeführt. Auf jeder Fläche wurden zwei sich schneidende Diagonalen festgelegt. Auf diesen wurde eine nicht festgelegte Zahl von Sammelpunkten in Abständen von 10 Schritten verteilt. An jedem Sammelpunkt wurden 4 Grasproben möglichst bodennah abgerupft (eine direkt vor der sammelnden Person, eine rechts, eine links und die vierte dahinter ). Die Aufbewahrung aller Einzelproben einer Diagonale erfolgte in einem Gardinenstoffbeutel als Sammelprobe vereint. Eigene Untersuchungen 50 3.2.4 Probenaufbereitung und -untersuchung 3.2.4.1 Kotuntersuchung Die Untersuchung auf Nematodeneier erfolgte als Bestimmung der Eizahl pro Gramm Kot (EpG) nach der Mc-Master-Methode (GORDON u. WHITLOCK, 1939) in der Modifikation von SCHMIDT (1971). Dazu wurden 4 Gramm Kot in einer Reibschale mit gesättigter Kochsalzlösung (spezifisches Gewicht ca. 1,20 g/ml) versetzt und mit dem Pistill homogenisiert. Das Homogenat wurde durch ein Sieb mit einer Maschenweite von 500 bis 800 µm in einen Standzylinder überführt, mit einer Spritzflasche (mit gesättigter Kochsalzlösung) auf 60 ml aufgefüllt und anschließend in eine Schliffstopfenflasche übertragen. Aus der gut durchmischten Suspension wurden mithilfe einer Pipette die zwei Abteilungen einer Zählkammer (MDS-Agvet) gefüllt. Nach 5 Minuten Wartezeit zur Flotation parasitärer Gebilde wurden Eier unter dem Mikroskop ausgezählt. Da 4 g Kot in 60 ml NaCl-Lösung suspendiert wurden, ist entsprechend 1 g Kot in 15 ml enthalten. Unter dem Gitternetz der Zählkammer befinden sich 2 mal 0,15 ml, so dass die Eizahl in 0,30 ml gezählt wurde und mit 50 multipliziert der Eizahl pro Gramm entspricht. Die kleinste so erfassbare Eizahl betrug also 50 Eier pro Gramm Kot. Einzeltierergebnisse und daraus errechnete Mittelwerte wurden in Diagrammen dargestellt. Die Untersuchung auf Leberegeleier wurde mit der Sedimentation nach BENEDEK (1943) in der Modifikation von BORAY und PEARSON (1960) durchgeführt. Hierzu wurde eine Kot/Wassersuspension durch ein Metallsieb in einen Standtrichter gegeben. Nach 3minütiger Sedimention wurde der Überstand entfernt, und das Sediment erneut in Wasser suspendiert. Nach 3-maliger Sedimentation erfolgte eine Methylenblau-Färbung des Sedimentes und es wurde in einer Zählkammer unter dem Mikroskop untersucht. Zur Gewinnung von Lungenwurmlarven wurde das Auswanderverfahren (Trichterverfahren) nach BAERMANN (1917) genutzt. Hierzu wurde eine Kotprobe von ca. 20 g auf ein feinmaschiges Sieb aufgetragen und in einen mit einem Schlauch verlängerten Trichter gehängt. Der Trichter wurde mit soviel Wasser gefüllt, dass die Kotprobe etwa bis zur Hälfte ins Wasser eingetaucht war. Die im Kot vorhandenen Lungenwurmlarven wanderten über Nacht in die Flüssigkeit und sanken dann allmählich bis zur Schlauchklemme ab. Durch kurzes Öffnen der Klemme konnten die Larven in einer Petrischale aufgefangen und mikroskopisch nachgewiesen werden. Eigene Untersuchungen 51 Sie wurden in absoluten Zahlen angegeben (Diagramme, Tabellen im Anhang). Diese wurden im Text nach dem Schlüssel, der in der Diagnostik des Institutes für Parasitologie der Tierärztlichen Hochschule Hannover für dieses Verfahren gebräuchlich ist, eingestuft: 1 Larve = (+) vereinzelt bis 5 Larven = + geringgradig bis 10 Larven = ++ mittelgradig bis 20 Larven = +++ hochgradig über 20 Larven = ++++ massenhaft 3.2.4.2 Larvenkultur Zur Gewinnung von dritten Larven der Magen-Darm-Strongyliden wurde Material von jeder Kotprobe in ein Kulturglas überführt und nach der von ECKERT (1960) beschriebenen Methode gelagert und aufbereitet. Dazu wurden ca. 10 bis 50 g der Kotprobe zusammen mit Sägemehl in einem 500 ml Schraubglas zu einer krümeligen Masse vermengt. Der Deckel wurde zur Ermöglichung des Lufteintritts nur lose aufgelegt. Daraufhin erfolgte einer Lagerung bei 25 °C und 80 % Luftfeuchtigkeit für 8-10 Tage. Anschließend wurde das Kulturglas mit Leitungswasser aufgefüllt und in eine Petrischale umgestülpt. Der Rand zwischen Petrischale und Glas wurde mit Wasser befüllt. Die im Kot entstandenen dritten Larvenstadien wanderten durch den feinen Spalt zwischen Petrischale und Kulturglas in das Wasser. Dieses konnte am nächsten Tag mit der Pipette abgesogen und in ein Reagenzglas übertragen werden. In jeder Probe erfolgte anschließend die Auszählung von 100 Larven und die Bestimmung der einzelnen Gattungen anhand des Schlüssels von BÜRGER und STOYE (1968). In Proben mit weniger als 100 Larven wurden die absoluten Zahlen angegeben (Tabellen im Anhang). Bei der graphischen Darstellung der Larvenkultur wurde für jede Tiergruppe grundsätzlich der Mittelwert der absoluten Larvenzahlen gebildet, auch wenn in einer oder mehreren Proben weniger als 100 Larven vorhanden waren. Dadurch wird in den Diagrammen zum Mittelwert der absoluten Larvenzahlen der Larvenkultur optisch sichtbar, ob der Mittelwert aus Proben mit je 100 ausgezählten Larven gebildet wurde. Die Gesamtsäule erreicht dann die 100Larven-Marke und es liegt eine größere Genauigkeit vor, als bei mehreren Proben die deutlich unter 100 Larven enthielten und zu einer erheblich kleineren Gesamtsäule führten. So wird Eigene Untersuchungen 52 vermieden, dass stark abweichende Ergebnisse, die jedoch nur auf wenigen geschlüpften Larven beruhen, die relativen Anteile der Larvenarten übermässig verzerren, wie dies bei den Diagrammen zur Larvenzusammensetzung in % der Fall ist. An diesen lassen sich jedoch die mittleren prozentualen Anteile der Larvengattungen besser abschätzen. Das jeweils erste Diagramm (y-Achse: Mittelwert der absoluten Larvenzahlen) gibt also einen Hinweis auf den Grad der Genauigkeit der jeweiligen Säulen im zweiten Larvenkulturdiagramm (y-Achse: Larvenzusammensetzung in %). 3.2.4.3 Grasprobenuntersuchung Die Sammelgrasproben wurden getrennt voneinander in geschlossenen Plastiktüten transportiert und gegebenenfalls bis zum darauffolgenden Tag gekühlt (bei 3-4°C) aufbewahrt. Die Aufbereitung und Untersuchung erfolgte nach der von SIEVERS-PREKEHR (1973) beschriebenen Verfahrensweise: Jede Grasprobe (im Gardinenstoffbeutel) wurde einzeln in einer Trommelwaschmaschine mit sauberem Leitungswasser im Waschgang "Feinwäsche" gewaschen. Dabei erfolgen nach jeweils 15 Ruhesekunden dreieinhalb Trommelumdrehungen. Jede Grasprobe wurde 3 Spülgängen zu je 3 Minuten Länge unterzogen. Das Waschwasser wurde durch Siebe geleitet. Im ersten Sieb (250 µm Maschenweite) blieben gröbere, meist pflanzliche Partikel hängen. Im zweiten feinmaschigen Sieb (25 µm Maschenweite) wurden Larven und kleine Partikel aufgefangen. Diese wurden mit gesättigter Magnesiumsulfatlösung in ein auf einen Ring gespanntes Kondom gespült und in einem Zentrifugenglas bei 250 g (Gravitationsbeschleunigung) zwei Minuten lang zentrifugiert. Danach konnte durch Abklemmen des Kondoms das flotierte Material (Larven und andere leichte Partikel) in einen Wasserbecher (zur Verdünnung der MgS04-Lösung) abgeschüttet werden. Dem sedimentierten Material wurde erneut MgSO4-Lösung zu einer weiteren Zentrifugation hinzugefügt. Auf diese Weise wurde jede Probe viermal flotiert. Das flotierte Material mußte durch ein weiteres Sieb (25 µm Maschenweite) konzentriert und mit 10-20 ml Wasser in ein Sedimentationsröhrchen gespült werden. Nach mindestens 3-stündiger Sedimentation konnte das überstehende Wasser abgesaugt und die so konzentrierte Probe gegebenenfalls einige Wochen im Kühlschrank gelagert werden. Eigene Untersuchungen 53 Da die Proben dann meist neben den gesuchten Larven noch große Mengen Erdnematoden und pflanzliche Partikel enthielten, wurden sie zur Untersuchung, wenn nötig, etwas verdünnt, auf mehrere Zählkammern verteilt und nach BÜRGER und STOYE (1968) differenziert. Die gewaschenen Grasbeutel wurden einige Tage bei Zimmertemperatur getrocknet, anschließend 12 Stunden in einem Heissluftsterilisator bei 60°C weiter entfeuchtet und dann gewogen. So konnte die Anzahl der gefundenen Larven pro Kilogramm entfeuchtetem Weidegras angegeben werden. Pro Weide wurde anschließend der Mittelwert der beiden Diagonalen gebildet und als Gesamtbelastung der Weide angegeben. 3.2.5 Statistische Auswertung Aus dem gesamten Jahresverlauf wurde die durchschnittliche Zahl der pro Termin mit bestimmten Parasitengattungen befallenen bzw. nicht befallenen Tiere einer Gattungsgruppe (Waldböcke, Wasserböcke, Pferdeböcke) ermittelt, graphisch dargestellt und mithilfe des ChiQuadrat-Homogenitätstests und des Fisher`s Exact Tests auf signifikante Unterschiede zwischen den Antilopengattungsgruppen untersucht. 3.2.6 Auswertung der Larvenzahlen am Weidegras anhand der Wetterdaten Die Beurteilung möglicher Zusammenhänge zwischen Larvenzahlen am Weidegras und klimatischen Bedingungen wurde nach dem Konzept von BÜRGER et al. (1983) durchgeführt. Die Autoren definieren eine "Warmperiode" als einen Zeitraum, in dem die mittlere Tagestemperatur 7 - 10 Tage lang 18 oder 20°C überschreitet, und eine "Regenperiode" als mindestens 4 aufeinanderfolgende Tage mit meßbaren Niederschlägen, deren Summe im Sommer 20 mm übersteigt. Sie fanden heraus, dass einem Anstieg der Larvendichte am Weidegras zwar eine oder mehrere Warmperioden vorausgingen. Direkt ausgelöst wurde er jedoch kurzfristig von einer Regenperiode, die den Übergang der entwickelten Drittlarven aus dem Kot auf die Vegetation erst ermöglichte. Ergebnisse 54 4. Ergebnisse 4.1 Kotuntersuchung und Larvenkultur (Übersichtstabelle) Im Untersuchungszeitraum wurden insgesamt 1130 Kotproben gesammelt. Die Ergebnisse der Kochsalzflotationen, der Auswanderverfahren und der Larvenkulturen sind der folgenden Tabelle zu entnehmen. Die Sedimentationsuntersuchung auf Trematodeneier verlief in allen Proben negativ. Tab. 16: Anzahl der Larvenkulturen mit Pro- Anzahl der Proben mit Eiern, OoLarven folgender Spezies ben- zysten bzw. Larven folgender zahl Spezies / 2. Zeile: %-Anteil 2. Zeile: %-Anteil ges. M N S TC C E D O TS CO OE N S Giraffen 159 61 12 0 8 9 0 11 145 59 1 0 1 15 % 38,4 7,5 0 5,0 5,7 0 6,9 91,2 37,1 0,6 0 0,6 9,4 Elen143 26 13 0 12 30 64 18 90 13 0 0 0 3 antilopen 8,4 21,0 44,8 12,6 62,9 9,1 0 0 0 2,1 % 18,2 9,1 0 Oryx110 86 6 1 1 4 28 Antilopen 106 30 86 52 0 0 0 2 (* ) 0 0 1,9 % 78,2 5,5 0,9 0,9 3,6 25,5 28,3 81,1 49,1 0 Ellipsen- 122 15 3 0 1 1 68 0 51 52 0 0 1 4 Wasserb. 0,8 0,8 55,7 0 41,8 42,6 0 0 0,8 3,3 % 12,3 2,5 0 Rappen- 139 50 8 0 6 5 6 0 84 4 0 0 0 0 antilopen 4,3 3,6 4,3 0 60,4 2,9 0 0 0 0 % 36,0 5,8 0 Impala 27 0 0 0 0 0 0 0 6 1 0 0 0 0 0 0 0 0 0 0 22,2 3,7 0 0 0 0 % 0 Nyala 88 0 0 0 0 0 19 0 3 2 0 0 0 0 0 0 0 0 21,6 0 3,4 2,3 0 0 0 0 % 0 Defassa- 90 12 0 0 0 8 45 0 7 60 0 0 0 0 Wasserb. 0 0 8,9 50 0 7,8 66,7 0 0 0 0 % 13,3 0 Pferde84 22 1 0 9 7 4 0 63 68 35 6 0 0 antilopen % 26,2 1,2 0 10,7 8,3 4,8 0 75 81 41,7 7,1 0 0 Litschi168 14 0 0 1 7 120 0 9 58 0 0 0 0 Moorant. 0 0,6 4,2 71,4 0 5,4 34,5 0 0 0 0 % 8,3 0 Gesamt: 1130 M = Magen-Darm-Strongyliden; N = Nematodirus spp. ; S = Strongyloides sp. ; Tierart TC = Trichuris sp.; C = Capillaria sp.; E = Eimeria spp.; D = Dictyocaulus sp.; O = Ostertagia spp.; TS = Trichostrongylus spp.; CO = Cooperia sp.; OE = Oesophagostomum sp.; (* ) Von den Oryxantilopen war an einem Termin nicht genügend Probenmaterial für Auswanderverfahren und Larvenkultur vorhanden, so dass mit diesen Verfahren nur 106 Proben untersucht wurden. Ergebnisse 55 4.2 Graphische Darstellung der Kotprobenergebnisse Einzelergebnisse: X = Alttier ; □ = Jungtier ; Gruppenmittel: ▬▬ = Alttiere ; ▬▬ = Jungtiere 1.) EpG MDS 4.2.1 Giraffen Diag. 1-7 400 350 300 250 200 150 100 50 0 Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov 2.) EpG Nematodirus Nov Okt 250 200 150 100 50 0 Okt 3.) EpG Capillaria 120 100 80 60 40 20 0 Okt 4.) EpG Trichuris 120 100 80 60 40 20 0 Okt Ergebnisse 56 25 5.) Larvenanzahl Dictyocaulus 20 15 10 5 0 Mai Jun Mai Mai Jun Nov Mai Apr Okt Apr Mär Sep Mär Feb Aug Feb Jan Jul Jan Dez Nov Okt 6.) Mittelwerte der absoluten Larvenzahlen 100 80 60 40 20 Nov Okt Cooperia Strongyloides Sep Trichostrongylus Aug 80 Ostertagia Jul Dez Nov 100 Okt 7.) Larvenzusammensetzung in % 0 Nematodirus 60 40 20 0 Nov Okt Strongyloides Sep Aug Jul Cooperia Jun Mai Mai Trichostrongylus Apr Mär Feb Jan Dez Nov Okt Ostertagia Nematodirus Erläuterungen zu den Diagrammen der Giraffengruppe: In der Regel wurden 4 Kotproben von Alttieren und 2 Proben von Jungtieren gesammelt. Ab dem 19.07.01 war nur noch ein Jungtier vorhanden, da die anderen verkauft worden waren. Ergebnisse 57 Diag. 1: Magen-Darm-Strongyliden-Eiausscheidung Die mittlere MDS-Eizahl der Alttiere erreichte ihre höchsten Werte (87,5 EpG) am 30.10.00, am 02.08.01, sowie am 25.10.01. Weitere relativ hohe Werte waren am 21.06.01 (75 EpG), am 27.12.00, am10.05.01 und am 13.09.01 vorhanden (je 62,5 EpG). Im Dezember, Februar und August gingen die Ergebnisse auf 0 EpG zurück. Der Mittelwert der MDSEiausscheidung der Jungtiere schwankte ab dem 27.11.00 zwischen 25 EpG und den Höchstwerten von 150 EpG am 27.12.00 und am 02.02.01. Im Zeitraum zwischen dem 16.03.01 und dem 06.07.01 erfolgten Schwankungen zwischen 0 und 75 EpG. Ab Juli wurde nur noch ein Jungtier beprobt, bei dem sich die EpG-Zahl nach einer Entwurmung bis Oktober auf 0 hielt, um dann bis November auf 100 EpG anzusteigen. Diag. 2: Nematodirus-Eiausscheidung Nematodirus-Eier wurden v.a. von Jungtieren ausgeschieden. Vom 13.11.00 bis zum 20.01.01 mit einer Unterbrechung Ende Dezember wurden jeweils bei einem Jungtier Eier der Gattung Nematodirus nachgewiesen. Die Eiausscheidung sank dabei von 200 EpG im November bis 50 EpG Ende Januar. Positive Befunde traten erst wieder am 17.03.01, am 07.06.01, sowie erstmals bei zwei Jungtieren zugleich am 06.07.01 auf . Das einzelne verbleibende Jungtier wurde entwurmt und zeigte keine positiven Befunde mehr bis zum Ende des Untersuchungszeitraumes. Nachweise von Nematodirus-Eiern bei einzelnen Alttieren erfolgten am 27.12.00 (50 EpG), am 02.08.01 (50 EpG), sowie am 25.10.01 (100 EpG). Diag. 3: Capillaria-Eiausscheidung Einzelne Befunde von 50 EpG der Gattung Capillaria traten bei je einem Jungtier am 16.02.01, am 13.04.01 und am 27.09.01 auf. Bei je einer Alttierprobe wurden 50 bzw. 100 Capillaria-EpG am 16.10.00, am 02.02.01, am 13.04.01, am 21.06.01, am 19.07.01 und am 02.08.01 ermittelt. Diag. 4: Trichuris-Eiausscheidung Der Mittelwert der Trichuris-Eiausscheidung der Jungtiere lag am 16.10.00, am 13. und 27.11.00 und am 02.02.01 bei 25 EpG. Am 19.07.01 erreichte das eine verbliebene Jungtier 100 EpG. Danach wurde es entwurmt, und es konnten bis zum Ende des Untersuchungszeitraumes keine Eier der Gattung Trichuris mehr nachgewiesen werden. Ergebnisse 58 Positive Proben adulter Individuen (100 EpG am 06.01.01, sowie 50 EpG am 02.08.01 und 27.09.01) erhöhten den Mittelwert der ansonsten negativen Alttiere entsprechend. Diag. 5: Dictyocaulus-Larvenausscheidung In den beiden Jungtierproben wurde am 07.06.01 je 1 Larve der Gattung Dictyocaulus nachgewiesen und am 27.09.01 nochmals 1 Larve bei dem verbleibenden Jungtier. Nur am 03.05.01 wurde ein Alttier mit einem mittelgradigen Befall (9 Larven ), sowie am 23.05.01 ein Alttier mit einem hochgradigen Befall (12 Larven) festgestellt. Im Zeitraum vom 21. 06. bis 8.11. traten bei 6 Proben geringgradig (1, 2 bzw. 3) Larven auf. Pro Termin war nie mehr als eine Probe positiv. Diag. 6: Mittelwerte absoluter Larvenzahlen der Larvenkulturen Die mittleren Larvenzahlen der Gattung Ostertagia varriierten zwischen 42,2 (19.07.01) und 94,2 Larven (11.12.00). Larven der Gattung Trichostrongylus wurden in wesentlich geringeren mittleren Anzahlen (0,4 bis 17,6), jedoch auch an den meisten Sammelterminen gefunden. Nur im Zeitraum zwischen Anfang Februar und Ende Juli wurden an 9 Probennahmeterminen Larven der Gattung Strongyloides nachgewiesen (0,3 bis 3 Larven im Mittel). An jeweils nur einem Sammeltermin befanden sich Larven der Gattung Cooperia (0,2 am 30.08.01) bzw. der Gattung Nematodirus (2,7; 06.07.01) in den Larvenkulturen der untersuchten Proben, wobei im Fall von Nematodirus ein einzelner Probenbefund von 16 Larven in der Probe eines Jungtieres zu diesem Mittelwert führte. Nur an einem Sammeltermin, dem 25.10.01, konnten in allen Larvenkulturen 100 Larven ausgezählt werden. Diag. 7: Quantitative Verteilung des Artenspektrums in % der Larvenkulturen Larven der Gattung Ostertagia machten an allen Terminen den größten Anteil aus (zwischen 82 % (am 08.11.01) und 100 %). Larven der Gattung Trichostrongylus waren zu Anteilen zwischen 0 % und 18 % (am 08.11.01) vorhanden. Die Gattung Cooperia kam nur am 30.08.01 mit 0,2 % vor, die Gattung Nematodirus nur am 06.07.01 mit 3 %. Die Gattung Strongyloides war zu Anteilen von 0 % bis 3,6 % (am 23.05.01) vertreten. Ergebnisse 59 4.2.2 Elenantilopen Diag. 8-15 Einzelergebnisse: X = Alttier ; □ = Jungtier ; Gruppenmittel: ▬▬ = Alttiere ; ▬▬ = Jungtiere 8.) EpG MDS 250 200 150 100 50 0 Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov 9.) EpG Nematodirus Nov Okt 300 250 200 150 100 50 0 Okt 10.) EpG Capillaria 500 400 300 200 100 Okt Okt 11.) EpG Trichuris 0 400 350 300 250 200 150 100 50 0 Mai Mai Jun Jul Aug Sep Okt Nov Apr Mai Mai Jun Jul Aug Sep Okt Nov Mär Apr Mai Mai Jun Nov Dez Jul Aug Okt Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Nov Apr Mär Feb Nov Mär Feb Jan Okt Feb Jan Okt Jan Dez Sep Dez Nov Okt Strongyloides Trichostrongylus Strongyloides Ostertagia Trichostrongylus 80 Ostertagia Sep Nov Okt 100 80 60 40 20 14.) Mittelwerte der absoluten Larvenzahlen 20 15 10 5 13.) Larvenzahl Dictyocaulus 25 Okt 100 60 40 20 0 15.) Larvenzusammensetzung in % 1500 1000 500 12.) EpG Eimeria 60 Ergebnisse 2000 0 0 0 Ergebnisse 61 Erläuterungen zu den Diagrammen der Elenantilopengruppe Am 02.03.01 wurde während der Probennahme entschieden, aufgrund des MKS-Risikos das Sammeln abzubrechen, so dass nicht mehr als 2 Alttier- und 1 Jungtierprobe zur Untersuchung gelangten. Diag. 8: MDS-Eiausscheidung Gelegentliche Einzelbefunde bei den Alttieren von 50 bzw. 100 EpG bis zum 23.05.01 führten zu einem entsprechend schwankenden Mittelwert, der seinen Höchstwert von 33,3 EpG am 27.12.00, 06.01.01 und 23.05.01 erreichte. Danach wurden bei den Alttieren keine Eier mehr nachgewiesen. Die mittlere Eiausscheidung der Jungtiere schwankte im gesamten Untersuchungszeitraum zwischen 0 und dem Höchstwert von 100 EpG, der am 06.07.01 aufgrund des Einzelbefundes eines Jungtieres von 200 EpG erreicht wurde. Diag. 9: Nematodirus-Eiausscheidung Eier der Gattung Nematodirus traten v.a. bei Jungtieren auf. Der höchste Befund (250 EpG) wurde jedoch bei einem Alttier (am 20.01.01) nachgewiesen. Außer einem weiteren Einzelergebnis von 50 EpG am 17.03.01 wurden bei allen anderen Alttieren keine Nematodirus-Eier gefunden. Bei den Jungtieren wurden zwischen dem 11.12.00 und dem 10.05.01 an den meisten Terminen Eier der Gattung gezählt (50 bzw.100 EpG). Nach den Sommermonaten ohne nachgewiesene Nematodirus-Eiausscheidung folgte ein weiterer Befund (50 EpG) am 11.10.01. Der Mittelwert der Jungtiere erreicht seinen Höchstwert am 20.01.01 (75 EpG). Diag. 10: Capillaria-Eiausscheidung Eier der Gattung Capillaria wurden nur an 5 Terminen mit je 50 EpG bei je einem Alttier nachgewiesen (27.11.-27.12.00,am 16.02.01 und am 08.11.01). Bei den Jungtieren wurden jedoch an 24 von 29 Sammelterminen in einer Probe Eier gezählt, aber nur an 2 Terminen in beiden Jungtierproben. Der höchste Mittelwert der Jungtiere wurde am 10.05.01 mit 225 EpG erreicht. Danach schwankte er zwischen 25 und 150 EpG, bevor er erstmals am 13.09.01 den 0-Punkt wieder erreichte, um am 27.09.01 noch einmal auf 150 EpG anzusteigen. Ergebnisse 62 Diag. 11: Trichuris-Eiausscheidung Eier der Gattung Trichuris wurden nur an 2 Terminen bei je einem Alttier mit je 50 EpG nachgewiesen (06.01.01 und 10.05.01). An 10 Terminen kamen über das Jahr verteilt in je einer Jungtierprobe Trichuris-Eier vor. Der höchste Einzelwert lag bei 350 EpG am 13.04.01. Diag. 12: Eimeria-Oozystenausscheidung Gelegentliche Einzelbefunde zwischen 50 und 350 Oozysten pro Gramm bei Alttieren über den Untersuchungszeitraum verteilt führten zu entsprechenden Schwankungen des Mittelwertes. Am 25.10.01 führte ein Einzelergebnis von 850 Oozysten pro Gramm zum höchsten Mittelwert der Alttiere (283,3 EpG). Der Mittelwert der Jungtiere erreichte relativ hohe Werte am 16.10.00 (825 EpG), den Höchstwert von 1025 am 27.11.00, am 27.09.01 650 EpG und ebensoviel am 02.03.01, an dem allerdings wegen der MKS-Problematik nur eine Probe von den Jungtieren genommen wurde. Diag. 13: Dictyocaulus-Larvenausscheidung Dies ist möglicherweise der erste Nachweis dieser Parasitengattung bei der Elenantilope. Bei den Alttieren wurde in 4 Proben je eine Larve gezählt, in 3 Proben waren geringgradig Larven vorhanden (3-5 Larven; am 27.12.00, 27.09.01 und am 11.10.01). In einer Alttierprobe wurde der Befund als mittelgradig beurteilt (7 Larven am 27.12.00). In den Jungtierproben wurde 3 mal je eine Larve nachgewiesen, 5 mal waren 2-5 Larven vorhanden (= geringgradig; zwischen dem 27.11.00 und dem 13.04.01), am 20.01.01 wurde in einer Probe ein mittelgradiger Befund von 9 Larven erhoben und am 11.12.00 ein hochgradiger Befund von 12 Larven. Diag. 14: Mittelwerte absoluter Larvenzahlen der Larvenkulturen Nur in den 3 genommenen Proben vom 02.03.01 entwickelten sich keine Larven. An allen anderen Terminen waren Larven der Gattung Ostertagia dominierend mit Mittelwerten zwischen 3,2 (11.12.00) und 55 Larven (27.12.00). Larven der Gattung Trichostrongylus kamen an 8 Terminen vor mit mittleren Larvenzahlen zwischen 0,2 und 9,2 (am 20.01.01). Larven der Gattung Strongyloides wurden an 3 Terminen nur in einer Jungtierprobe nachgewiesen (29 Larven am 27.12.00 Mittelwert 5,8; bzw. je 2 Larven am 20.01.01 und 23.05.01). Ergebnisse 63 Diag. 15: Quantitative Verteilung des Artenspektrums in % der Larvenkulturen Larven der Gattung Ostertagia machten stets den größten Anteil aus (zwischen 85 % (am 20.01.01) und 100 %). Trichostrongylus-Larven kamen zu Anteilen zwischen 0 % und 14,3 % (am 20.01.01) vor. Larven der Gattung Strongyloides waren 3 mal mit bis zu 11,6 % (am 27.12.00) vertreten. X = Alttier ; □ = Jungtier ; 4.2.3. Rappenantilopen Einzelergebnisse: Diag. 16 - 22 Gruppenmittel: ▬▬ = Alttiere ; 16.) EpG MDS 2500 2000 1500 1000 500 Okt Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov Okt Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov 17.) EpG Nematodirus 0 160 140 120 100 80 60 40 20 0 18.) EpG Capillaria 120 100 80 60 40 20 0 Okt Mai Jun Jul Aug Sep Okt Nov Mai Mai Jun Jul Aug Sep Okt Nov Mai Mai Jun Jul Aug Sep Okt Nov Aug Sep Okt Nov Apr Apr 0 Mär 100 Mär Feb Jan Dez Nov 60 40 20 0 22.) Larvenzusammensetzung in % Okt Okt Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Mai 250 200 150 100 50 20.) EpG Eimeria Apr Mär Feb Jan Dez Nov Okt Trichostrongylus Ostertagia Trichostrongylus Ostertagia 80 Feb Jan 20 100 Dez 40 80 Nov 300 Okt 60 21.) Mittelwerte der absoluten Larvenzahlen 800 600 400 200 19.) EpG Trichuris 64 Ergebnisse 1000 0 0 Ergebnisse 65 Erläuterungen zu den Diagrammen der Rappenantilopen In der Regel wurden 5 Proben pro Termin gesammelt. Am 02.02.01 konnten jedoch die Tiere aufgrund von Neuschnee nicht nach draußen gelassen werden, so dass keine Probennahme möglich war. Am 02.03.01 konnten nur 4 Proben vor Abbruch der Probennahme (MKS) genommen werden. Diag. 16: MDS-Eiausscheidung Ab dem 01.04.01 wurden meist in mehreren Proben Eier von Magen-Darm-Strongyliden nachgewiesen. Der Mittelwert der MDS-Eiausscheidung der Alttiere erreichte seine höchsten Werte am 11.10.01 (287,5 EpG) und am 08.11.01 (210 EpG). Das Jungtier wurde nach Probenergebnissen von 1000 EpG (am 23.05.01) und 850 EpG (am 21.06.01) am 26.06.01 entwurmt, woraufhin mit diesem Verfahren bis zum 30.08.01 keine MDS-Eier nachgewiesen wurden. Die Eiausscheidung begann erneut am 13.09.01 mit 250 EpG und steigerte sich über 450 EpG (27.09.01) zum Höchstwert von 2050 EpG am 11.10.01, woraufhin erneut entwurmt wurde und keine MDS-Eier mehr gezählt werden konnten. Diag. 17: Nematodirus-Eiausscheidung Eier der Gattung Nematodirus kamen in den Alttierproben an 5 Terminen vor (am 07.06.01, 06.07.01. 30.08.01 und 11.10.01 mit 50 EpG, sowie am 13.09.01 mit 100 EpG). Die Jungtierprobe wies am 13. und 27.09.01 50 EpG auf und erreichte am 11.10.01 ihren Höchstwert mit 150 EpG. Diag. 18: Capillaria-Eiausscheidung Dies ist möglicherweise der erste Nachweis dieser Parasitengattung bei der Rappenantilope. Eier der Gattung Capillaria wurden an 4 Terminen bei je einem Alttier (am 10.05.01 und 07.06.01 mit 50 EpG, sowie am 06.07. und 27.09.01 mit 100 EpG) und am 23.05.01 einmalig bei dem Jungtier nachgewiesen. Diag. 19: Trichuris-Eiausscheidung Eier der Gattung Trichuris wurden bei je einem Alttier nur am 01.04.01 und am 03.05.01 mit je 50 EpG nachgewiesen. In Proben des Jungtieres wurden an 4 Terminen positive Befunde Ergebnisse 66 ermittelt mit der höchsten Eizahl pro Gramm (800) am 23.05.01. Nach dem Probenergebnis am 21.06.01 von 300 EpG wurde das Jungtier entwurmt, wies jedoch schon am 19.07.01 wieder 100 EpG auf, um dann bis zum 11.10.01 (mit 200 EpG), keine nachweisbare Trichuris-Eizahl auszuscheiden. Diag. 20: Eimeria-Oozysten-Ausscheidung Hier handelt es sich möglicherweise um den ersten Nachweis von Eimeria-Oozysten bei dieser Tierart. Gelegentliche Befunde mit Eimeria-Oozysten zwischen 50 und dem Höchstwert von 250 EpG traten bei den Alttieren auf, so am 30.10.00, 13.11.00, 13.04.01, 07.06.01, 06.07.01 und am 11.10.01. Pro Termin wurden in höchstens einer Probe Eimeria-Oozysten nachgewiesen. Diag. 21: Mittelwerte absoluter Larvenzahlen der Larvenkulturen Während der Zeit vom 30.10.00 bis zum 02.02.01 entwickelten sich außer 1 bzw. 3 Larven am 30.10.00 bzw. am 27.12.00 keine Larven in den Kotkulturen. Ab dem 02.03.01 bis zum Ende des Probennahmezeitraumes hatten sich in jeweils 1-5 der Proben Larven entwickelt, wobei nur an 6 Terminen (vom 10.05.-06.07.01 und am 13.09.01) in allen Proben 100 Larven ausgezählt werden konnten. Hierbei handelte es sich jeweils um Larven der Gattung Ostertagia, die auch an den anderen Terminen bei weitem vorherrschend waren. Larven der Gattung Trichostrongylus kamen nur an 4 Terminen über das Jahr verteilt mit je einer Larve in nur je einer Probe pro Termin vor. Diag. 22: Quantitative Verteilung des Artenspektrums in % der Larvenkulturen Larven der Gattung Ostertagia machten in den Proben, in denen Larven vorhanden waren, stets den größten Anteil aus (zwischen 66,7 % (am 27.12.00; nur 2 Ostertagia-Larven !) und 100 %). Larven der Gattung Trichostrongylus kamen zu 0 % bis 33,3 % (am 27.12.00; nur 1 Trichostrongylus-Larve !) vor. Ergebnisse 67 Einzelergebnisse: X = Alttier ; □ = Jungtier ; Gruppenmittel: ▬▬ = Alttiere ; 4.2.4 Oryxantilopen Diag. 23 - 29 3000 23.) EpG MDS 2500 2000 1500 1000 500 0 Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov 24.) EpG Nematodirus Nov Okt 350 300 250 200 150 100 50 0 Okt 25.) EpG Capillaria 250 200 150 100 50 0 26.) EpG Eimeria Okt 3000 2500 2000 1500 1000 500 0 Okt 27.) Larvenzahl Dictyocaulus Ergebnisse 68 40 35 30 25 20 15 10 5 0 Jan Feb Mär Apr Mai Mai Jun Jul Aug Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Nov Dez Nov Okt Nov Okt Sep Okt 28.) Mittelwerte der absoluten Larvenzahlen 100 80 60 40 20 Okt Nov Okt Nov Ostertagia Trichostrongylus Sep 80 Sep 100 Strongyloides 60 40 20 0 Aug Jul Trichostrongylus Jun Mai Mai Ostertagia Apr Mär Feb Jan Dez Nov Okt 29.) Larvenzusammensetzung in % 0 Strongyloides Erläuterungen zu den Diagrammen der Oryxantilopengruppe Es wurden jeweils Proben von 3 Alttieren und 1 Jungtier untersucht. Am 02.02.01 war nicht genug Probenmaterial für das Auswanderverfahren und die Larvenkultur vorhanden, so dass nur das Mc-Master-Verfahren zur EpG-Bestimmung durchgeführt werden konnte. Ergebnisse 69 Diag. 23: MDS-Eiausscheidung An allen Probennahmeterminen wurden in mindestens einer Alttierprobe MDS-Eier nachgewiesen, meist in Größenordnungen von mehreren hundert EpG, außer nach der Entwurmung vom 13.11 bis 11.12.00. Das Jungtier wies noch nach der Entwurmung der Gruppe (vom 09.-11.11.00) eine hohe Eiausscheidung auf (1650 EpG MDS) und erhielt eine erneute Wurmkur, woraufhin ab dem 27.12.00 wieder MDS-Eier (100 EpG) gezählt wurden. Der Mittelwert der Alttiere erreichte seinen Höchstwert am 13.04.01 mit 1466,7 EpG. In der Jungtierprobe wurden an 22 von 28 Sammelterminen Eier von MDS gezählt, meist mehrere hundert EpG, gelegentlich über 1000 EpG. Der höchste Jungtier-Einzelbefund erfolgte am 27.09.01 mit 2300 EpG. Diag. 24: Nematodirus-Eiausscheidung Eier der Gattung Nematodirus kamen nur in der Jungtierprobe an 6 Terminen vor. Die höchste Eizahl wurde am 13.11.00 mit 300 EpG gezählt. Am 30.10.00 waren 100 EpG vorhanden. Danach wurden erst wieder im nächsten Herbst 50 EpG am 13.09.01, sowie vom 11.10.01 bis zum 11.11.01 nachgewiesen. -ohne Diagramm: Strongyloides-Eiausscheidung Eier der Gattung Strongyloides wurden bei einem Jungtier am 13.11.00 in Höhe von 100 EpG gezählt. Diag. 25: Capillaria-Eiausscheidung Eier der Gattung Capillaria wurden an 2 Terminen in je einer Alttierprobe festgestellt, am 19.07.01 mit 200 EpG und am 16.08.01 mit 50 EpG. An weiteren zwei Terminen wurden Capillaria-Eier in je einer Jungtierprobe nachgewiesen: 50 EpG am 16.10.00 und 100 EpG am 13.09.01. -ohne Diagramm: Trichuris-Eiausscheidung Am 21.06.01 wurden einmalig bei einem Jungtier 50 EpG der Gattung Trichuris nachgewiesen. Ergebnisse 70 Diag. 26: Eimeria-Oozysten-Ausscheidung Der Mittelwert der Eimeria-Oozysten-Ausscheidung der Alttiere erreichte seinen Höchstwert von 1816,7 EpG am 13.11.00, sank dann wieder ab, um am 01.04.01 noch einmal einen Wert von 250 EpG zu erreichen. Danach erfolgten nur noch 3 Einzelbefunde mit 50 EpG und einer mit 150 EpG. Die höchsten Oozysten-Zahlen in der Jungtierprobe wurden am 13.11.00 und am 11.12.00 mit je 1000 Oozysten gezählt. Danach wurden noch an 13 Terminen Befunde zwischen 50 und 250 EpG erhoben. Diag. 27: Dictyocaulus-Larvenausscheidung Dies ist möglicherweise der erste Nachweis dieser Parasitengattung bei der Oryxantilope in Gehegehaltung. Bis zum 16.02.01 wurden keine Larven der Gattung Dictyocaulus nachgewiesen. Danach wurden bei den Alttieren in 6 Proben je eine Larve gezählt, in 11 Proben konnten die Befunde als geringgradig (2-5 Larven), in 4 Proben als mittelgradig (6-10 Larven), in 6 Proben als hochgradig (11-20 Larven) und in 2 Proben als massenhaft (37 Larven am 13.09.01; 26 Larven am 11.11.01) beurteilt werden. In der Jungtierprobe kam nur einmal am 11.10.01 eine geringgradige Larvenausscheidung (3 Larven) vor. Diag. 28: Mittelwerte absoluter Larvenzahlen der Larvenkulturen Nur am 27.11.00 entwickelten sich in keiner Kultur Larven. Am 13.11.00 (nach der Entwurmung der Gruppe ) waren nur in der Jungtierprobe 100 Larven der Gattung Ostertagia vorhanden (Mittelwert 25) . Auch sonst dominierte diese Gattung mit mittleren Larvenzahlen zwischen 7,5 (am 27.12.00) und 100 (am 30.10.00). Am 27.12.00 wurden nach der routinemäßigen Entwurmung erstmalig wieder MDS-Eier ausgeschieden, daraus entwickelten sich jedoch nur wenige oder keine Larven. In Kulturen von 19 Sammelterminen gab es auch Larven der Gattung Trichostrongylus mit Mittelwerten zwischen 0,5 und 22,75 (20.01.01) Larven. Larven der Gattung Strongyloides wurden nur in einer Alttierprobe (6 Larven; 11.12.00) und in zwei Jungtierproben (1 Larve am 07.06.01 bzw. 7 Larven am 11.11.01) nachgewiesen. Diag. 29: Quantitative Verteilung des Artenspektrums in % der Larvenkulturen In den Proben, in denen sich Larven entwickelten, machte die Gattung Ostertagia an allen Terminen den größten Anteil aus (zwischen 54,5 % (am 20.01.01) und 100 %). Ergebnisse 71 Die Gattung Trichostrongylus erreichte zwischen 0 % und 45,5 % (20.01.01) und die Gattung Strongyloides kam mit Anteilen zwischen 0 % und 6,7 % (11.12.00) vor. 30.) EpG MDS 4.2.5 Ellipsen-Wasserböcke Diag. 30 - 33 Einzelergebnisse: X = Alttier ; □ = Jungtier ; Gruppenmittel: ▬▬ = Alttiere ; 160 140 120 100 80 60 40 20 0 Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov Okt Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov Nov Okt Okt 102000 82000 62000 42000 22000 31.) EpGEimeria 2000 2000 1800 1600 1400 1200 1000 800 600 400 200 0 Ergebnisse 72 32.) Mittelwerte der absoluten Larvenzahlen 100 80 60 40 20 Okt Nov Okt Nov Sep Strongyloides Aug Jul Jun Ostertagia Trichostrongylus Mai Mai Apr Mär Feb Jan 80 Dez Nov 100 Okt Nematodirus 60 40 20 0 Sep Strongyloides Aug Jul Jun Trichostrongylus Mai Mai Apr Mär Ostertagia Feb Jan Dez Nov Okt 33.) Larvenzusammensetzung in % 0 Nematodirus Erläuterungen zu den Diagrammen der Ellipsen-Wasserböcke Es wurden jeweils Proben von 4 Alttieren untersucht. Am 02.03.01 wurde die Probennahme abgebrochen, bevor Proben der Ellipsenwasserböcke gesammelt werden konnten. Ab dem 03.05.01 wurden Proben von dem am 15.02.01 geborenen Jungtier so oft wie möglich zusätzlich genommen. Diag. 30: MDS-Eiausscheidung Zwischen dem 27.11.00 und dem 10.05.01 wurden in 12 von 48 Proben Eier von MDS nachgewiesen (50 bis 150 EpG). Danach waren nur noch in den Proben des Jungtieres an 3 Terminen (07.06., 30.08. und 11.10.01) je 50 MDS-EpG zählbar. Ergebnisse 73 -ohne Diagramm: Nematodirus-Eiausscheidung Hier handelt es sich möglicherweise um den ersten Nachweis dieser Parasitengattung beim Ellipsen-Wasserbock. Eier der Gattung Nematodirus wurden nur an 3 Terminen in der Probe des Jungtieres gezählt: 03.05.01 (100 EpG), 21.06.01 (50 EpG), 19.07.01 (50 EpG). -ohne Diagramm: Capillaria-Eiausscheidung Eier der Gattung Capillaria kamen nur in einer Probe am 01.04.01 mit 50 EpG vor. -ohne Diagramm: Trichuris-Eiausscheidung Eier der Gattung Trichuris wurden nur am 19.07.01 in einer Probe des Jungtieres mit 50 EpG nachgewiesen. Diag. 31: Eimeria-Oozysten-Ausscheidung Außer am 21.06.01 wurden an allen Sammelterminen in mindestens einer Alttierprobe Oozysten der Gattung Eimeria festgestellt, mit Mittelwerten zwischen 25 und dem Höchstwert von 13387,5 Oozysten pro Gramm (am 16.02.01), der v.a. durch ein Probenergebnis von 51700 EpG zustande kam. Vom 16.10.00 bis zum 27.12.00 wurden an 5 von 6 Terminen jeweils in 1 bis 2 Proben Befunde zwischen 2250 und 7150 Oozysten pro Gramm erhoben. In der Jungtierprobe wurde am 07.06.01 die höchste Oozystenzahl von 89650 gezählt. Auch in allen anderen Jungtierproben kamen zwischen 2150 und 17150 Oozysten der Gattung Eimeria vor. Diag. 32: Mittelwerte absoluter Larvenzahlen der Larvenkulturen Nur am 11.12.00 und am 02.08.01 entwickelten sich in keiner Larvenkultur Larven. 100 Larven in jeder der 4 Larvenkulturen waren nur am 16.02.01 und am 01.04.01 auszählbar. Larven der Gattung Ostertagia waren am häufigsten vorherrschend mit Mittelwerten zwischen 0,25 und 97,25. Davon wurden 7 mal Mittelwerte über 30 Larven erreicht. Die Larven der Gattung Trichostrongylus waren seltener in der Überzahl, wobei nur 2 mal Mittelwerte über 30 Larven vorkamen. Möglicherweise ist dies der erste Nachweis von Trichostrongylus sp. bei dieser Tierart in Gehegehaltung. Die Gattung Strongyloides kam an 4 Ergebnisse 74 Terminen vor, zwischen dem 03.05.01 und dem 19.07.01 (meist nur in der Jungtierprobe mit dem Höchstwert von 96 Larven am 03.05.01). Fünf Larven der Gattung Nematodirus kamen nur einmalig am 19.07.01 in der Probe des Jungtieres vor. Diag. 33: Quantitative Verteilung des Artenspektrums in % der Larvenkulturen Die Gattungen Ostertagia, wie auch Trichostrongylus kamen beide mit prozentualen Anteilen zwischen 0 % und 100 % vor. Bei der Gattung Ostertagia wurden häufiger als bei Trichostrongylus mehr als 50 % erreicht. Larven der Gattung Strongyloides kamen nur an 4 Terminen vor und erreichten Anteile bis zu 68,6 % (am 03.05.01). Die Gattung Nematodirus war nur am 19.07.01 mit einem Anteil von 16,7 % vorhanden. 4.2.6 Impala Diag. 34 und 35 34.) Absolute Larvenzahl 60 50 40 30 20 10 Aug Sep Okt Nov Aug Sep Okt Nov Jul Jun Mai Ostertagia Mai Apr 80 Mär Feb Jan Dez Nov 100 Okt Trichostrongylus 60 40 20 0 Jul Jun Mai Ostertagia Mai Apr Mär Feb Jan Dez Nov Okt 35.) Larvenzusammensetzung in % 0 Trichostrongylus Ergebnisse 75 Erläuterungen zu den Diagrammen der Impala-Gruppe In der Regel wurde eine Probe pro Termin genommen. Am 20.01.01 und am 02.02.01 konnte keine Probe aus dem Stall genommen werden, da die Tiere mit Panik reagierten. Im gesamten Untersuchungszeitraum wurden keine Eier mit dem McMaster-Verfahren nachgewiesen. Auch mithilfe des Auswanderverfahrens wurden nie Lungenwürmer gefunden. Diag. 34: Absolute Larvenzahlen der Larvenkulturen Nur in der Larvenkultur vom 16.08.01 wurden 48 Larven der Gattung Ostertagia gezählt. An 6 weiteren Terminen traten nur 1-2 Larven auf, wobei es sich am 27.09.01 um eine Larve der Gattung Trichostrongylus handelte. Bei beiden Parasitengattungen handelt es sich möglicherweise um Erstnachweise bei der Impala in Gehegehaltung. Diag. 35: Quantitative Verteilung des Artenspektrums in % der Larvenkulturen Larven der Gattung Ostertagia kamen an 6 Terminen mit 100 % vor. Die Gattung Trichostrongylus war nur am 27.09.01 mit 100 % vertreten (Dieser Wert beruhte jedoch nur auf einer vorhandenen Larve !). 36.) EpG Eimeria 4.2.7 Nyala Diag. 36-38 Einzelergebnisse: X = Alttier Gruppenmittel: ▬▬ = Alttiere 900 800 700 600 500 400 300 200 100 0 Nov Okt Sep Aug Jul Jun Mai Mai Apr Mär Feb Jan Dez Nov Okt Ergebnisse 76 37.) Mittelwerte der absoluten Larvenzahlen 10 8 6 4 2 Aug Sep Okt Nov Aug Sep Okt Nov Jul Jun Mai Ostertagia Mai Apr 80 Mär Feb Jan Dez Nov 100 Okt 38.) Larvenzusammensetzung in % 0 Trichostrongylus 60 40 20 0 Jul Jun Mai Mai Apr Mär Feb Jan Dez Nov Okt Ostertagia Trichostrongylus Erläuterungen zu den Diagrammen der Nyala-Gruppe Diag. 36: Eimeria-Oozysten-Ausscheidung Zwischen Mitte Juli und Ende Oktober befand sich der längste Zeitraum, in dem keine Oozysten der Gattung Eimeria gezählt werden konnten. Im Rest des Jahres kamen gelegentlich positive Befunde von 50 oder 100 EpG vor. Nur am 16.02.01 erreichte eine Probe den Höchstwert von 800 EpG. Am 08.11.01 waren einmalig alle 3 genommenen Proben positiv ( 100, 250 bzw. 350 EpG). - nicht im Diagramm: am 11.10.01 wurde einmalig eine Probe eines Jungtieres zusätzlich genommen. Der Befund ergab 1750 Eimeria-Oozysten pro Gramm Kot. Diag. 37: Mittelwerte absoluter Larvenzahlen und Diag. 38: Quantitative Verteilung des Artenspektrums in % der Larvenkulturen Nur an zwei Terminen im Mai wurden im Mittel 0,3 (100 %) bzw. 2,7 (34,8 %) OstertagiaLarven gezählt. Trichostrongylus-Larven kamen nur am 03.05.01 mit einem Mittelwert von 5 Larven (65,2 %) vor. Ergebnisse 77 4.2.8. Pferdeantilopen Diag. 39 - 44 Einzelergebnisse: X = Alttier Gruppenmittel: ▬▬ = Alttiere 39.) EpG MDS 250 200 150 100 50 0 Okt Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov Okt Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov Okt Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov Okt Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov 40.) EpG Capillaria 60 50 40 30 20 10 41.) EpG Trichuris 800 700 600 500 400 300 200 100 0 42.) EpG Eimeria 0 800 700 600 500 400 300 200 100 0 Ergebnisse 78 43.) Mittelwerte der absoluten Larvenzahlen 100 80 60 40 20 Nov Okt Sep Aug Cooperia Jul Jun Trichostrongylus Mai Mai Apr Mär Ostertagia Feb Jan 80 Dez Nov 100 Okt Oesophagostomum 60 40 20 0 Nov Okt Sep Aug Cooperia Jul Jun Trichostrongylus Mai Mai Apr Mär Ostertagia Feb Jan Dez Nov Okt 44.) Larvenzusammensetzung in % 0 Oesophagostomum Erläuterungen zu den Diagrammen der Pferdeantilopengruppe Diag. 39: MDS-Eiausscheidung Zwischen dem 27.12.00 und dem 16.08.01 traten an 7 Probennahmeterminen Einzelbefunde von 50 Magen-Darm-Strongyliden-EpG auf. Am 13.4.01 wurden in 2 Proben (50 bzw. 150 EpG) MDS-Eier nachgewiesen. Ab dem 30.08. wurden an jedem Termin zwischen 50 und 200 EpG gezählt. Vom 11.10.01 bis zum Ende des Untersuchungszeitraumes waren in allen 3 Proben MDS-Eier nachweisbar. Der höchste Mittelwert mit 100 EpG wurde am 11.10.01 erreicht. -ohne Diag.: Eier der Gattung Nematodirus wurden nur am 27.12.00 (50 EpG) in einer Probe nachgewiesen. Ergebnisse 79 Diag. 40: Capillaria-Eiausscheidung Eier der Gattung Capillaria konnten an 5 Probennahmeterminen (16.02., 23.05., 07.06.,13.09. und 25.10.01; je 50 EpG) gezählt werden. Am 03.05.01 wurden in 2 der 3 Proben 50 Capillaria-Eier pro Gramm nachgewiesen. Diag. 41: Trichuris-Eiausscheidung Eier der Gattung Trichuris wurden an 6 Terminen (mit 50 und 750 EpG) in insgesamt 9 Proben nachgewiesen. Die höchsten Einzelbefunde (zwischen 400 und 750 EpG) wurden im Mai erreicht. Diag. 42: Eimeria-Oozysten-Ausscheidung Oozysten der Gattung Eimeria wurden an 4 Probennahmeterminen in je einer Probe nachgewiesen, mit einer EpG-Zahl von 50, 200, 300 bzw. dem Höchstwert von 700 (am 30.08.01). Diag. 43: Mittelwerte absoluter Larvenzahlen der Larvenkulturen Nur im Oktober 2000 und am 21.06.01 entwickelten sich keine Larven in den Kulturen. Bis zum 07.06.01 waren meist Larven der Gattung Trichostrongylus vorherrschend, ebenso Ende September, Ende Oktober und am 11.11.01. Die niedrigste mittlere Larvenanzahl dieser Gattung betrug 2,7, die höchste 87,3 Larven. Nach einer Wurmkur am 18./19.06.01 waren Larven der Gattung Ostertagia zwischen dem 06.07. und dem 13.09.01, sowie am 11.10.01 in der Überzahl. Im gesamten Verlauf gab es Mittelwerte zwischen 0,7 und 88,3 Larven. Die Gattung Cooperia war mit Larven an 17 der 28 Probennahmetermine nachweisbar (0,3 bis 29,6 Larven), in nennenswerter Anzahl jedoch nur zwischen dem 20.01. und dem 23.05.01. Larven der Gattung Oesophagostomum (möglicherweise als Erstnachweis dieser Gattung bei dieser Tierart) kamen vom 17.03. bis zum 13.04.01 in den Proben vor mit dem höchsten Mittelwert von 12,3 Larven am 17.03.01. Diag. 44: Quantitative Verteilung des Artenspektrums in % der Larvenkulturen Larven der Gattung Trichostrongylus kamen zu Anteilen zwischen 0 % und 97,3 % (am 27.12.00) vor. Die Gattung Ostertagia schwankte zwischen 0,8 % und 88,3 %. Die höchsten Ergebnisse 80 Anteile wurden von dieser Gattung in den Monaten nach der Entwurmung (18./19.06.01) erreicht. Von Larven der Gattung Cooperia wurden Anteile zwischen 0 % und 36 % (am 23.05.01) ermittelt. Oesophagostomum-Larven erreichten bis zu 12,6 % (am 17.03.01). 4.2.9 Defassa-Wasserböcke Diag. 45 - 49 X = Alttier Einzelergebnisse: Gruppenmittel: ▬▬ = Alttiere 250 45.) EpG MDS 200 150 100 50 0 Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov Okt Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov 46.) EpG Capillaria Okt 60 50 40 30 20 10 0 47.) EpG Eimeria 6000 5000 4000 3000 2000 1000 0 Dez Nov Okt Ergebnisse 81 48.) Mittelwerte der absoluten Larvenzahlen 100 80 60 40 20 Aug Sep Okt Nov Aug Sep Okt Nov Jul Jun Trichostrongylus Mai Mai Apr 80 Mär Feb Jan Dez Nov 100 Okt 49.) Larvenzusammensetzung in % 0 Ostertagia 60 40 20 0 Jul Jun Mai Mai Apr Mär Feb Jan Dez Nov Okt Trichostrongylus Ostertagia Erläuterungen zu den Diagrammen der Defassa-Wasserböcke Am 27.09.01 und am 11.10.01 war keine Probennahme möglich, da sich alle DefassaWasserböcke wegen einer Baustelle auf dem Gelände in einem Auslauf befanden, der nicht betreten werden konnte, ohne Panik auszulösen. Bis zum 01.04.01 wurden 4 Proben von 5 Tieren gesammelt. Am 04.04.01 und am 06.04.01 verendete je ein weibliches Altier, so dass ab dem 13.04.01 noch 3 Proben von 3 Alttieren genommen wurden. Diag. 45: MDS-Eiausscheidung Im Sommer zwischen Ende Mai und Mitte September befand sich der längste Zeitraum, in dem keine MDS-Eier gezählt wurden. In der restlichen Zeit kamen gelegentlich Befunde von Ergebnisse 82 50 oder 100 EpG vor. Die höchsten Probenergebnisse waren 200 EpG am 02.02.01und 150 EpG am 25.10.01. Diag. 46: Capillaria-Eiausscheidung Einzelne Befunde von 50 Capillaria-EpG kamen am 02.02., 23.05, 21.06., 25.10. und am 08.11.01 vor. Nur am 16.02.01 waren in 3 von 4 Proben je 50 EpG der Gattung Capillaria nachweisbar, so dass hier der Mittelwert 37,5 erreicht wurde. Diag. 47: Eimeria-Oozystenausscheidung Die höchsten Ergebnisse wurden am 16.10.00, 01.04.01 und 03.05.01 erreicht (zwischen 2250 und 4900 EpG. In der restlichen Zeit kamen zahlreiche positive Befunde zwischen 50 und 1450 EpG vor. Der Mittelwert schwankte entsprechend zwischen 12,5 und 450 EpG und erreichte seine Höchstwerte am 01.04. und 03.05.01 mit 2600 bzw. 2283,3 EpG. Nur am 13.11.00, vom 23.05 bis 21.06.01 und am 13.09.01 wurden keine Oozysten der Gattung Eimeria nachgewiesen. Diag. 48: Mittelwerte absoluter Larvenzahlen der Kotkulturen Den größten Anteil machten stets Larven der Gattung Trichostrongylus aus mit dem höchsten Mittelwert von 100 am 17.03.01. Dies war zugleich der einzige Termin, an dem in allen 4 Proben 100 Larven ausgezählt werden konnten. Außerdem handelt es sich möglicherweise um den Erstnachweis dieser Gattung bei dieser Tierart. Larven der Gattung Ostertagia kamen selten vor und erreichten als höchsten Mittelwert nur 3 Larven am 30.08.01. Keine Larven entwickelten sich in den Proben vom 16.10.00, 13.11.00 und 06.07.01. Diag. 49: Quantitative Verteilung des Artenspektrums in % der Larvenkulturen Trichostrongylus-Larven kamen in Anteilen zwischen 64,7 % (beruhte nur auf wenigen Larven) und 100 % (an 17 Terminen) vor. Larven der Gattung Ostertagia erreichten bis zu 35,3 % (immer auf geringen Larvenzahlen beruhend). Ergebnisse 83 50.) EpG MDS 4.2.10 Litschi-Moorantilopen Diag. 50 - 54 800 700 600 500 400 300 200 100 0 Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov Okt 60 51.) EpG Capillaria Einzelergebnisse: X = Alttier Gruppenmittel: ▬▬ = Alttiere 50 40 30 20 10 0 Okt 90000 70000 50000 30000 10000 Okt Nov Okt Nov 52.) EpG Eimeria 7000 6000 5000 4000 3000 2000 1000 0 Ergebnisse 84 53.) Mittelwerte der absoluten Larvenzahlen 60 50 40 30 20 10 Aug Sep Okt Nov Aug Sep Okt Nov Jul Jun Trichostrongylus 60 Mai Mai Apr 80 Mär Feb Jan Dez 100 Nov Okt Ostertagia 40 20 0 Jul Jun Trichostrongylus Mai Mai Apr Mär Feb Jan Dez Nov Okt 54.) Larvenzusammensetzung in % 0 Ostertagia Erläuterungen zu den Diagrammen der Litschi-Moorantilopengruppe Je Sammeltermin wurden 6 Proben von 6 Alttieren genommen (außer am 02.03.01 (MKS)). Diag. 50: MDS-Eiausscheidung Zwischen dem 27.12.00 und dem 16.02.01 traten mehrere Befunde zwischen 250 und 700 EpG von Magen-Darm-Strongyliden auf. Im restlichen Zeitraum wurden nur vereinzelt Werte von 50 bzw.100 EpG erreicht (am 30.10.00, 11.12 01, 23.05.01, 02.08.01 und am 16.08.01). Diag. 51: Capillaria-Eiausscheidung Vom 20.01.01 bis zum 16.02. 01 und am 13.09.01, sowie am 08.11.01 war jeweils 1 Probe positiv mit 50 EpG der Gattung Capillaria (möglicherweise als Erstnachweis dieser Gattung bei der Litschi-Moorantilope). Nur am 25.10. wurden in 2 Proben jeweils 50 EpG nachgewiesen. Ergebnisse 85 -ohne Diagramm: Trichuris-Eiausscheidung Nur am 17.03.01 wurden in einer Probe 50 EpG der Gattung Trichuris nachgewiesen. Diag. 52: Eimeria-Oozysten-Ausscheidung In 71,4 % der Proben waren Oozysten der Gattung Eimeria nachweisbar. Der höchste Mittelwert wurde am 20.01.01 erreicht (15066 EpG), kam aber v.a. durch ein einzelnes Probenergebnis von 86.900 Oozysten pro Gramm Kot zustande. Auch die relativ hohen Mittelwerte am 11.12.00 (4558 EpG), am 16.08.01 (2025 EpG) und am 08.11.01 (1175 EpG) wurden jeweils nur durch eine Probe mit besonders hoher Oozystenzahl erreicht. Nur am 27.11.00 befanden sich 5 der 6 genommenen Proben im Bereich zwischen 1450 und 6750 EpG, wodurch der Mittelwert von 3616 erreicht wurde. Diag. 53: Mittelwerte absoluter Larvenzahlen der Larvenkulturen Zwischen dem 17.03.01 und dem 03.05.01 entwickelten sich keine Larven in den Proben. Nie konnten in allen Proben 100 Larven ausgezählt werden. Larven der Gattung Trichostrongylus dominierten mit mittleren Larvenzahlen bis zu 52,7 Larven ( am 02.02.01). Es handelte sich hier möglicherweise um den Erstnachweis dieser Gattung bei dieser Tierart. In wesentlich geringerer Anzahl kamen Larven der Gattung Ostertagia vor mit dem höchsten Mittelwert von 2 Larven am 25.10.01. Diag. 54: Quantitative Verteilung des Artenspektrums in % der Larvenkulturen Larven der Gattung Trichostrongylus kamen mit Anteilen zwischen 33,3 % (beruhte nur auf einer geringen Larvenzahl) und 100 % (an 18 Terminen) vor. Die Gattung Ostertagia war selten mit Anteilen bis zu 66,7 % vertreten, jedoch nur auf Grundlage geringer Larvenzahlen. Ergebnisse 86 4.3 Statistische Auswertung der Kotuntersuchungsergebnisse Aufgrund der geringen Tierzahlen je Tierart war eine statistische Auswertung nur möglich, wenn die Arten zu Gattungsgruppen zusammengefaßt werden. Die Elenantilopen und die Nyalas konnten nur zum Vergleich der Prävalenz von Eimeria sp. als Waldböcke zusammengefaßt werden, da sich hinsichtlich der anderen Endoparasiten zu unterschiedliche Probenbefunde ergaben. Aus dem gesamten Jahresverlauf wurde die durchschnittliche Zahl der pro Termin befallenen bzw. nicht befallenen Tiere ermittelt. Dann wurden der Chi-Quadrat-Homogenitätstest und der bei diesen geringen Tierzahlen genauere Fisher`s Exact Test eingesetzt, um die Gattungsgruppen hinsichtlich der Prävalenz jeweils einer Parasitengattung bzw. -gruppe zu vergleichen. Beide Tests ergeben einen pWert. Ist dieser kleiner als 0,05, so kann man von einem signifikanten Unterschied der Verhältnisse der befallenen und nicht befallenen Tierzahlen zwischen den Antilopengattungsgruppen sprechen (Daten: siehe Tabellenanhang). Diag. 55-58: Vergleich der Gattungsgruppen hinsichtlich der Prävalenz von MagenDarm-Strongyliden, Eimeria sp., Ostertagia sp. und Trichostrongylus sp. Eimeria Magen-Darm-Strongyliden 15 15 10 10 5 5 0 0 Wasserböcke befallen Waldböcke Pferdeböcke befallen nicht befallen Ostertagia Pferdeböcke nicht befallen Trichostrongylus 15 15 10 5 10 5 0 Wasserböcke 0 Wasserböcke befallen Pferdeböcke nicht befallen Wasserböcke befallen Pferdeböcke nicht befallen Ergebnisse 87 Hinsichtlich der Prävalenz von Magen-Darm-Strongyliden, sowie der Gattung Ostertagia waren durchschnittlich pro Termin signifikant mehr Pferdeböcke befallen als Wasserböcke. Keine signifikanten Unterschiede ergaben die Vergleiche hinsichtlich Eimeria sp. und Trichostrongylus sp. Alle weiteren Endoparasitengattungen kamen für sinnvolle Vergleiche zu selten vor. Darüberhinaus erfolgten Vergleiche der Gehege hinsichtlich der Prävalenz einzelner Endoparasitengattungen. Hierfür wurde die durchschnittliche Zahl der pro Untersuchungstermin befallenen bzw. nicht befallenen Tiere des Geheges ermittelt, so dass bei diesem Vergleich in Gehege 1 auch die Giraffen und die Impalas einbezogen wurden. Da im Gehege Afrika 2 nur 3 Proben von Nyalas untersucht wurden, konnte dieses Gehege nicht berücksichtigt werden. Diag. 59-62: Vergleich der Gehege hinsichtlich der Prävalenz von Magen-DarmStrongyliden, Eimeria sp., Ostertagia sp. und Trichostrongylus sp. Magen-Darm-Strongyliden 30 20 Eim eria 30 20 10 10 0 0 Gehege Afrika 1 befallen Gehege Afrika 3 Gehege Afrika 1 nicht befallen befallen Ostertagia nicht befallen Trichostrongylus 30 30 20 20 10 10 0 Gehege Afrika 3 0 Gehege Afrika 1 befallen Gehege Afrika 3 nicht befallen Gehege Afrika 1 befallen Gehege Afrika 3 nicht befallen Hinsichtlich der Prävalenz von Eimeria sp. waren im Gehege Afrika 3 durchschnittlich pro Termin signifikant mehr Tiere befallen als im Gehege Afrika 1. Im letzteren kamen jedoch pro Termin signifikant mehr Proben mit Ostertagia sp. vor als in Gehege Afrika 3. Keine signifikanten Unterschiede zwischen den Gehegen wurden hinsichtlich der Prävalenz von Magen-Darm-Strongyliden, sowie Trichostrongylus sp. nachgewiesen. Ergebnisse 88 4.4 Meteorologische Daten Das Regionale Gutachterbüro Hannover des Deutschen Wetterdienstes stellte die täglich gemessenen Temperaturdaten (Soltau) und Niederschlagswerte (Schwarmstedt) der nächstgelegenen Meßstationen zur Verfügung. Temperatur: Die Höchst- und Tiefstwerte der Lufttemperatur wurden bis zum 31.03.2001 jeweils in der 24-stündigen Meßperiode zwischen dem Vortag 7:30 Uhr (MEZ)und dem betreffenden Tag 7:30 Uhr (MEZ) gemessen. Ab dem 01.04.2001 wurden die Höchst- und Tiefstwerte in der 24-stündigen Meßperiode zwischen dem Vortag 7:00 Uhr (MEZ) und dem betreffenden Tag 7:00 Uhr (MEZ) gemessen. Niederschlag: Die Tageshöhe des Niederschlags wurde im gesamten Zeitraum jeweils in der 24-stündigen Meßperiode zwischen dem Vortag 7:30 Uhr (MEZ) und dem betreffenden Tag 7:30 Uhr (MEZ) gemessen. (MEZ =Mitteleuropäische Zeit) Für die bessere Übersicht in der graphischen Darstellung wurden aus den Tageseinzelwerten die Mittelwerte für jeweils fünf aufeinanderfolgende Tage gebildet. Die Wetterdaten sind im Tabellenanhang aufgeführt (Tab. 47, 48). Ergebnisse 89 Diag. 63: Verlauf der Tageshöchst- und Tiefsttemperaturen vom 06.10.2000 bis 14.11.2001 35 Tageshöchsttemperatur Tagestiefsttemperatur 30 Temperatur in °C 25 20 15 10 5 0 -5 -10 Okt Nov Dez Jan Feb Mär Apr Mai Jun Jul Aug Sep Okt Nov Diag. 64: Verlauf der täglichen Niederschlagsmengen vom 06.10.2000 bis 14.11.2001 Niederschlagsmenge in mm 12 10 Niederschlagsmenge 8 6 4 2 0 Okt Nov Dez Jan Feb Mär Apr Mai Jun Jul Aug Sep Okt Nov Ergebnisse 90 4.5 Darstellung der Warm- und Regenperioden von April bis November 2001 Für das folgende Diagramm wurden aus jeweils 5 aufeinanderfolgenden Tagen nur die für Warm- bzw. Regenperioden (BÜRGER et al., 1983) relevanten Tage zur Berechnung eines Mittelwertes der Niederschlagsmenge bzw. der mittleren Tagestemperatur herangezogen ( siehe auch Methodenteil Kap. 3.2.6 und Tabellenanhang Tab. 49). Diag. 65: Warmperioden und Regenperioden von April bis November 2001 35 mm bzw. °C 30 25 20 15 10 5 0 Nov Okt Sep Aug Jul Jun Mai Apr ■ ■ mittlere Niederschlagsmenge in mm der für Regenperioden relevanten Tage mittlere Tagestemperatur in °C der für Warmperioden relevanten Tage 4.6 Grasprobenuntersuchungergebnisse Tab. 17: Übersicht Pro- Anzahl der Grasproben mit Larven dieser Gattung ben- 2. Zeile: %-Anteil an der Gesamtprobenzahl des Geheges zahl ges. Ostertagia Trichostron- Nematodirus Cooperia gylus Afrika I 21 18 13 14 10 % 85,7 % 61,9 % 66,7 % 47,6 % Afrika II 18 4 1 3 0 % 22,2 % 5,6 % 16,7 % 0 Afrika III 18 4 7 0 0 38,9 % 0 0 % 22,2% gesamt: 57 Gehege Oesophagostomum 1 4,8 % 0 0 0 0 Die Ergebnisse werden in den folgenden Diagrammen graphisch dargestellt und in den jeweils folgenden Texten im Zusammenhang mit den o.g. Warm- und Regenperioden erläutert. Ergebnisse 91 Diag. 66: Gehege Afrika I: Grasprobenergebnisse Gras (Trockenmasse) 6300 5300 4300 3300 2300 1300 Larven / kg 300 250 200 150 100 50 0 Nov Okt Sep Aug Jul Jun Mai Mai Apr Mär Ostertagia ▬▬Nematodirus Feb Jan Dez Nov Okt ---- ▬Trichostrongylus ▬Cooperia ▬Oesophagostomum Im Gehege Afrika I konnten Larven der Gattung Ostertagia vom 17.10.00 bis 11.12.00 mit Larvenzahlen zwischen 505 und der Höchstzahl von 5825 Larven / kg (am 31.10.00) nachgewiesen werden. Larven der Gattung Trichostrongylus traten im Herbst/Winter 2000 3 mal mit Werten zwischen 8 und 164 Larven / kg auf. Larven der Gattung Nematodirus wurden im Herbst/ Winter 2000 4 mal mit Werten zwischen 11 und 95 (am 11.12.00) Larven/ kg gezählt. Larven der Gattung Cooperia kamen mit 14 bis 85 (31.10.00) Larven / kg vom 17.10.00 bis 11.12.00 vor. Die Gattung Oesophagostomum war mit 21 Larven / kg nur am 27.11.00 vertreten. Nach Neubeginn der Grasprobennahmen am 13.04.01 wurden ab dem 10.05.01 nach einer Regenperiode Ende April wieder Ostertagia-Larven (23 L. /kg) gezählt. Einer weiteren Regenperiode Anfang Juni folgten eine Steigerung der Ostertagia-Larvenzahl, sowie ein erstmaliges Auftreten von Trichostrongylus- und Cooperia-Larven. Bis hierher könnte es sich Ergebnisse 92 noch um überwinterte Larven handeln, denn erst Anfang und Ende Juli erfolgten Warmperioden, die die Entwicklung von infektiösen Larven aus ausgeschiedenen Eiern beschleunigten. Anfang August gab es eine weitere Regenperiode. Daraufhin wurden wiederum Trichostrongylus- und Cooperia-Larven nachgewiesen, nachdem vorher an zwei (bei Ostertagia) bzw. vier (bei Cooperia) Probennahmeterminen keine Larven dieser Gattungen im Weidegras nachweisbar waren. Doch erst eine Warmperiode in der zweiten Augusthälfte und längere Regenperioden im September führten zu deutlichen Anstiegen der Larvenzahlen von Ostertagia (Höchstwert: 2450 Larven / kg am 26.10.01) und Trichostrongylus (Höchstwert: 206 Larven / kg am 26.10.01). Auffallend anders als die anderen Gattungen verhielt sich Nematodirus im Gehege Afrika I. Larven dieser Gattung wurden bereits Anfang Mai (schon 69 L./ kg) nachgewiesen. Die höchste Nematodirus-Larvenzahl wurde schon im Juni erreicht (770 L./ kg). Ergebnisse Diag. 67: 93 Gehege Afrika II: Grasprobenergebnisse Larven / kg Gras (TM) 200 150 100 50 0 Nov Okt Sep Aug Jul Jun Mai Mai Apr ▬▬ Nematodirus Mär Feb Jan Dez Nov Okt ▬Ostertagia ▬ Trichostrongylus In den Grasproben aus dem Gehege Afrika II war die Gattung Nematodirus am 17.10.00 mit 38 Larven vertreten. Nachdem Ende Juni / Anfang Juli 2001 eine Warmperiode und in der zweiten Juliwoche eine Regenperiode für optimale Entwicklungsbedingungen gesorgt hatten, wurden ab dem 20.07.01 Larven verschiedener Gattungen gezählt. Ostertagia-Larven traten erstmalig am 20.07.01 und dann an weiteren 3 Terminen mit Werten zwischen 14 und 174 ( 26.10.01) Larven / kg auf. Der Höchstwert von 174 Ostertagia-Larven/ kg wurde also erst am 26.10.01 erreicht und damit recht lange nach der letzten Regenperiode im September. Einzelne Tage mit Niederschlägen zwischen 4 und 8 mm kamen jedoch kurz vor dem 26. Oktober vor (siehe Tabellenanhang). Diese erfüllten zwar nicht die Bedingungen einer Regenperiode, scheinen aber die Translation aufs Weidegras ermöglicht zu haben. Larven der Gattung Trichostrongylus wurden nur am 16.08.01 mit 20 Larven / kg nachgewiesen. Nematodirus-Larven erschienen wieder am 20.07.01 ( 23 Larven / kg) und 02.08.01 (13 Larven / kg) in den Grasproben. Ergebnisse Diag. 68: 94 Gehege Afrika III: Grasprobenergebnisse Larven / kg Gras (TM) 3500 3000 2500 2000 1500 1000 500 0 Nov Okt Sep Aug Jul Jun Mai Mai Apr Mär Feb Jan Dez Nov Okt ▬ Ostertagia ▬ Trichostrongylus In der Sektion Afrika III wurden im Oktober 2000 Larven der Gattung Ostertagia mit 57 bzw. dem Höchstwert von 3200 (31.10.00) Larven / kg nachgewiesen. Larven der Gattung Trichostrongylus wurden am 31.10.00 mit 556 Larven / kg gezählt. Im Jahr danach müssen geringe Niederschläge Anfang April, die nicht die Bedingungen einer Regenperiode erfüllten, ausreichend für eine Translation überwinterter TrichostrongylusLarven auf das Weidegras (81 Larven /kg am 13.04.01) gewesen sein. Ein erneutes Auftreten von Trichostrongylus-Larven am 20.07.01(71 L. /kg) erfolgte (wie im Gehege Afrika II) nach der Warmperiode Ende Juni /Anfang Juli, sowie der Regenperiode in der zweiten Juliwoche. Am 28.09.01 wurden nach einer langen fast den gesamten September andauernden Regenperiode 160 Trichostrongylus-Larven /kg Gras (TM) gezählt. Die jeweiligen Höchstwerte der Gattungen Trichostrongylus (834 L./ kg) und Ostertagia (142 L. /kg ) im Jahr 2001 wurden jedoch erst am 26.10.01 erreicht, nach einigen Tagen mit geringen Niederschlägen, die nicht die Bedingungen einer Regenperiode erfüllten (siehe auch Gehege Afrika II). Ergebnisse 95 4.7 Zusammenfassende Darstellung der Kotproben- und Grasprobenergebnisse der verschiedenen Gehege 6900 4900 2900 900 Okt Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov Okt Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov EpG (Kot) bzw. Larven / kg Gras (TM) Diag. 69: Gehege Afrika I: MDS- Ergebnisse in Kot- und Grasproben 800 600 400 200 0 ------- MDS-Larven / kg Gras (Trockenmasse) in Gehege Afrika I ▬▬ MDS-EpG-Mittelwert der Alttier-Kotproben in Gehege Afrika I ▬▬ MDS-EpG-Mittelwert der Jungtier-Kotproben in Gehege Afrika I Im Gehege Afrika I wurden im Herbst 2000 deutlich höhere MDS-Larvenzahlen am Weidegras erreicht als im darauffolgenden Herbst. Nach der Aufstallung wurden alle Antilopengruppen ab dem 09.11.2000 entwurmt, woraufhin die MDS-EpG-Mittelwerte aller Kotproben einen Tiefpunkt erreichten. Daraufhin erfolgte eine leichte Steigerung. Die niedrigen Werte Anfang März kamen nur durch die geringe Probenzahl aufgrund der abgebrochenen Probennahme (MKS-Risiko) zustande. Danach erreichten die MDS-EpG-Mittelwerte der Alttiere ihren Höchstwert (245 EpG) Mitte April. Später erfolgten nur noch geringe Schwankungen. Im Gegensatz dazu zeigten die MDS-EpGMittelwerte der Jungtiere zwei Anstiege, im Juni, sowie Ende September / Anfang Oktober. Die niedrigen Werte dazwischen wurden nach Entwurmungen der Hauptausscheider ermittelt (siehe Diagr. 73). Die MDS-Larvenzahlen am Weidegras stiegen im Frühjahr und Sommer Ergebnisse 96 2001 je nach Witterung stufenweise geringgradig, dann ab Herbst deutlich schneller an. Ein Zusammenhang mit den Kotprobenergebnissen ist nicht ersichtlich. Diag. 70: Einfluß verschiedener Tierarten und Altersklassen auf den MDS-EpGGesamtmittelwert der Kotproben aus Gehege Afrika I 2500 MDS-EpG 2000 1500 1000 500 0 Nov Okt Sep Aug Jul Jun Mai Mai Apr Mär Feb Jan Dez Nov Okt ■ Oryxantilopen-Alttier □ Oryxantilopen-Jungtier ■ Rappenantilopen-Alttier □ Rappenantilopen-Jungtier ■ Giraffen-Alttier □ Giraffen-Jungtier ■ Elenantilopen-Alttier □ Elenantilopen-Jungtier ■ Ellipsen-Wasserbock-Alttier □ Ellipsen-Wasserbock-Jungtier ▬▬▬ Mittelwert Alttiere ▬▬▬Mittelwert Jungtiere Das Absinken der MDS-EpG-Werte im März kommt v.a. durch die teilweise nicht mögliche Probennahme zustande.Die starken quantitativen Schwankungen der Eiausscheidungen der Jungtiere erfolgen v.a. durch das Oryxantilopen-Jungtier (□)und das RappenantilopenJungtier (□), beide wurden Ende Juni entwurmt, was den plötzlichen Abfall der EpG-Werte im Juli erklärt, ein jahreszeitlicher Zusammenhang mit den Ergebnissen der Grasproben läßt sich so nicht ableiten. Die verschiedenen Tierarten erreichen zu unterschiedlichen Zeiten ihre höchsten EpG-Werte für MDS. Ergebnisse 97 Diag. 71: Gehege Afrika I: Nematodirus-Ergebnisse in Kot- und Grasproben 600 400 Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov Okt Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov 350 Okt EpG bzw. Larven / kg Gras (TM) 800 300 250 200 150 100 50 0 ■ Rappenantilopen-Alttier ■ Giraffen-Alttier ■ Elenantilopen-Alttier □ Rappenantilopen-Jungtier □ Giraffen-Jungtier □ Elenantilopen-Jungtier □ Oryxantilopen-Jungtier □ Ellipsen-Wasserbock-Jungtier ▬▬▬ Mittelwert Alttiere ▬▬▬ Mittelwert Jungtiere ▬▬▬ Gesamtmittelwert ▬▬▬ Nematodirus-Larven / kg Gras Die verschiedenen Tierarten erreichten zu unterschiedlichen Zeiten ihre Höchstwerte der Nematodirus-Eiausscheidung. Ein Schwerpunkt lag im Winter 2000/01 mit EpG-Zahlen bis zu 300. Nach dem nachgewiesenen Höchstwert der Nematodirus-Larvenzahl am Weidegras (770 L. /kg im Juni 2001) kamen zwar auch Nematodirus-Eiausscheider vor, jedoch nur mit EpG-Zahlen bis zu 150. Ergebnisse 98 Diag. 72: Gehege Afrika II: MDS- und Nematodirus-Ergebnisse in Kot- bzw. 180 150 120 90 60 30 Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov Okt Nov Dez Jan Feb Mär Apr Mai Mai Jun Jul Aug Sep Okt Nov 25 Okt Larven / Kotprobe bzw. / kg Gras (TM) Grasproben 20 15 10 5 0 ■ Ostertagia-Larvenzahl einer Nyala-Kotprobe ■ Trichostrongylus-Larvenzahl einer Nyala-Kotprobe ▬▬ Mittelwert der Ostertagia-Larvenzahlen in den Kotproben der Nyalas ▬▬ Mittelwert der Trichostrongylus-Larvenzahlen in den Kotproben der Nyalas ▬■▬ Anzahl der Nematodirus-Larven/ kg Gras (TM) in Gehege Afrika II ▬■▬ Anzahl der Ostertagia- Larven/ kg Gras (TM) in Gehege Afrika II ▬■▬ Anzahl der Trichostrongylus-Larven/ kg Gras (TM) in Gehege Afrika II Da die EpG-Nachweisgrenze in den Kotproben nicht erreicht wurde, wurden die absoluten Larvenzahlen der Larvenkultur für dieses Diagramm herangezogen. Nur im Mai entwickelten sich bis zu 14 Larven in einzelnen Kotproben. Positive Grasprobenbefunde erfolgten jedoch im Jahr 2001 erst ab Juli und erreichten im Oktober bis zu 174 Larven (Ostertagia) pro kg Trockenmasse Gras. Ergebnisse 99 Diag. 73: Gehege Afrika III: MDS- und Nematodirus-Ergebnisse in Kot- bzw. (TM) Grasproben 5000 3000 Jun Jul Aug Sep Okt Nov Jun Jul Aug Sep Okt Nov Mär Mai Mär Feb Mai Feb Jan Mai Jan Dez Mai Dez Nov Apr Nov Okt Apr Okt EpG Kot bzw. Larven/kg Gras 1000 800 600 400 200 0 ■ MDS-EpG Pferdeantilope ■ Nematodirus-EpG Pferdeantilope ■ MDS-EpG Defassa-Wasserbock ■ MDS-EpG Litschi-Moorantilope ▬▬ MDS-Larvenzahl / kg Gras (Trockenmasse) ▬▬ MDS-EpG-Mittelwert der Kotproben aus Gehege Afrika III Die Tierarten des Geheges Afrika III erreichten zu unterschiedlichen Jahreszeiten ihre höchsten MDS-EpG-Ergebnisse. Die Gattung Nematodirus trat nur einmalig in einer Kotprobe (Pferdeantilope im Dezember 2000) auf, nie jedoch in den Grasproben des Geheges. Die höchsten Larvenzahlen am Weidegras wurden jeweils im Herbst erreicht. Diskussion 100 5. Diskussion Die vorliegende Untersuchung wurde zum einen mit der Zielsetzung durchgeführt, durch regelmäßige Kotuntersuchungen über den Zeitraum eines Jahres das Parasitenspektrum und den zeitlichen Verlauf der Ausscheidung von Parasitenstadien, sowie die Effektivität anthelminthischer Behandlungen bei einer Auswahl afrikanischer Wildwiederkäuerarten des Safariparks zu untersuchen. Zum anderen sollte durch die Untersuchung von Grasproben der genutzten Weiden während der Weidesaison ein qualitativer und quantitativer Überblick gewonnen werden über den jahreszeitlichen Verlauf der Weidekontamination mit Parasitenstadien. Es sollten auch Zusammenhänge zwischen der Weideinfestation und dem Infektionsgeschehen bei den Tieren gesucht werden. Letztendlich war das Ziel dieser Untersuchung, Hinweise für eine sinnvolle Parasitenkontrolle bei afrikanischen Wildwiederkäuern des Safariparks zu erhalten. Mit der durchgeführten Untersuchung konnten einige Endoparasitengattungen bei verschiedenen Tierarten nachgewiesen werden, zu denen kein gleichartiger Nachweis aus der Literatur vorliegt (teilweise weder aus dem Freiland, noch aus Zoohaltung, siehe Tab. 2.6), so dass es sich möglicherweise um Erstnachweise handelt: Zur Gattung Eimeria gibt es viel mehr Nachweise aus Zoo- und Gehegehaltung, als aus dem Freiland. Dies ist nicht überraschend, da nach ROMMEL (2000) die Sporulation neben höheren Temperaturen, Feuchtigkeit benötigt und sporulierte Oozysten unter mitteleuropäischen Bedingungen auf der Weide bis zu 1 Jahr lebensfähig bleiben. In hygienisch einwandfreien Ställen treten Eimeriosen kaum auf. Die Haltung in Zoos und Gehegen begünstigt also das Auftreten von Eimeria, im Gegensatz zum oft trockenen und heißen Klima und dem weiträumigeren Lebensraum im Ursprungsland. Mit dem in dieser Untersuchung erfolgten Eimeria-Nachweis bei Rappenantilopen liegen jetzt für alle untersuchten Tierarten Nachweise aus Zoo- und Gehegehaltung vor. Infektionen mit der Gattung Oesophagostomum erfolgen nach SCHNIEDER (2000) meist oral über das Futter vor allem auf der Weide, nur gelegentlich im Stall. Sie benötigt warme, Diskussion 101 feuchte Bedingungen und gehört in der vorliegenden Literatur zu den Gattungen, die nicht überwintern (siehe Kapitel 2.4, Tab. 3, 4, 5). Dies erklärt, warum sie im Ursprungsland viel häufiger nachgewiesen wurde als im Zoo. Es liegen hier nur Nachweise aus Safariparks vor. Ebenso wie dort hat möglicherweise auch im Safaripark Hodenhagen die Weidehaltung das Auftreten bei den Pferdeantilopen begünstigt, allerdings würde aufgrund der Präpatenz der Infektionszeitpunkt in den Zeitraum der winterlichen Stallhaltung fallen, so dass es sich möglicherweise um Adulte handelt, die sich aus hypobiotischen Larven entwickelt haben. EYSKER (1980) und MICHEL (1974) erwähnen ein Auftreten von Hypobiose bei verschiedenen Oesophagostomum sp. . Ein Nachweis der Gattung Ostertagia bei Impalas ergänzte die ansonsten für diese Parasitengattung fast vollständige Nachweisliste. Allerdings gab es für die Rappen- und Pferdeantilopen, sowie für die drei Wasserbockarten nur jeweils einen Nachweis aus dem Safaripark Dvůr Kralové, so dass möglicherweise auch für Ostertagia-Infektionen die Weidehaltung begünstigend wirkt. Dies gilt auch für die Gattung Nematodirus (Erstnachweis beim Ellipsen-Wasserbock), die v.a. in Safariparks und anderen großflächigen Gehegehaltungen nachgewiesen wurde. Die Erstnachweise von Dictyocaulus sp. bei Elen- und Oryxantilopen wurden durch die große, über das ganze Jahr verteilte Probenzahl begünstigt. Die seltenen Nachweise dieser Parasitengattung in der Zootierliteratur könnten durch das häufig zu falsch negativen Ergebnissen führende Untersuchungsverfahren mitverursacht werden. Doch auch die Dictyocaulose ist nach SCHNIEDER (2000) eine typische Weideinfektion. Die aus dem großflächigen Tierpark Berlin und ausnahmslos aus Safariparks (siehe Tabellenanhang Tab. 25, 26) stammenden Befunde deuten darauf hin, dass die Haltungsbedingungen in extensiver Safariparkhaltung, bei der eine Reinigung der Weiden von Kot weitgehend entfällt, aus helminthologischer Sicht eher den Umweltbedingungen im Freiland ähneln, als denen in intensiver Zoohaltung (siehe oben: Nachweise von Ostertagia, Oesophagostomum und Nematodirus sp.). Die Gattung Trichostrongylus wurde in dieser Untersuchung erstmals in Gehegehaltung bei Ellipsen-Wasserböcken sowie bei Impalas nachgewiesen und erstmalig überhaupt bei Defassa-Wasserböcken und Litschi-Moorantilopen. Allerdings liegen zu 3 dieser Tierarten nur jeweils 2 bzw. 3 Literaturnachweise aus Zoo- und Gehegehaltung vor. Zur Gattung Diskussion 102 Trichostrongylus gibt es für die anderen Tierarten jedoch ähnlich viele Nachweise aus intensiver Zoohaltung wie aus weiträumiger Safariparkhaltung. Auch die tägliche Kotentfernung aus Innen- und Außenanlagen verhindert also nicht vollständig das Auftreten von parasitären Infektionen. Nach ROTH (1968) kommen im Zoo im Gegensatz zum Freiland besonders häufig Trichuriden (also Capillaria und Trichuris sp.) vor. Diese Aussage konnte anhand der Literaturübersicht und der vorliegenden Untersuchung bestätigt werden. Eine wichtige Rolle im Safaripark spielte Trichuris vor allem bei Giraffen, Elenantilopen, Rappenantilopen und Pferdeantilopen. Die Befunde kamen in Hodenhagen ohne jahreszeitliche Häufung vor, was sich durch die jahrelange Überlebensfähigkeit der infektiösen Eier (ENIGK u. DEY HAZRA, 1976) erklären läßt. Bei einer Rappenantilope befanden sich nur 23 Tage zwischen der Entwurmung mit Ivermectin (0,2 mg /kg Kgw.) und dem erstmaligen Wiederauftreten von Eiern. Die Präpatenz für z.B. Trichuris ovis beträgt nach SCHNIEDER (2000) jedoch 53 bis 55 Tage, so dass hier keine vollständige Eliminierung der Trichuris sp. erfolgte. Auch LÖSCHER et al. (2002) erwähnen für Ivermectin bei Trichuris sp. nur eine begrenzte Wirksamkeit (bis max. 80 %). Für (Pro-) Benzimidazole ist nach SCHNIEDER (2000) bekannt, dass die für Magen-DarmStrongyliden empfohlene Dosis für Trichuris sp. meist nicht ausreicht. Bei den Pferdeantilopen führte jedoch auch eine normale Dosierung von Febantel dazu, dass keine Trichuris-Eier mehr ausgeschieden wurden. LÖSCHER et al. (2002) erwähnen Benzimidazole als nicht ausreichend wirksam gegen Trichuriden nur beim Rind, nicht jedoch bei kleinen Wiederkäuern und Wild. FLACH et al. (1991) fanden in Edinburgh bei 13 von 17 Litschi-Moorantilopen-Kälbern mithilfe einer Zinksulfat-Flotation Trichuris-Eier (bis 800 EpG). Bei keiner dieser Proben gelang der Nachweis mit der modifizierten McMaster-Technik. In dieser Untersuchung wurden mit dem modifizierten McMaster-Verfahren in vielen Proben Trichuris-Eier nachgewiesen. Möglicherweise wären jedoch mit einer Flotation mit einer Flüssigkeit höherer Dichte noch häufigere und stärkere Infektionen aufgefallen. Diskussion 103 Nach ZUCHOWSKA (1997) ist die Pathogenität von Trichuris bis heute nicht eindeutig einzuschätzen. Jedoch kommen neben symptomlosen Verläufen auch Todesfälle infolge Trichuris ovis-Infektionen vor ( LYON, 1971; ZUCHOWSKA, 1988). Capillaria sp. kamen bei allen Tierarten außer den Impalas und Nyalas vor. Die häufigste und stärkste Capillaria-Eiausscheidung lag bei den Elenantilopen-Jungtieren vor, v.a. in den Sommermonaten. Bei anderen Tierarten waren keine deutlichen jahreszeitlichen Unterschiede festzustellen. Nach SCHNIEDER (2000) soll es bei Capillaria-Infektionen in der Regel nicht zu Symptomen kommen. Für den Nachweis sind Flotationsmedien höherer Dichte erforderlich, so dass mit der hier eingesetzten Kochsalzlösung möglicherweise noch zu niedrige Befunde erhoben wurden. Die Aussage von ROTH (1968), dass Trematoden und Cestoden bei Wildtieren im Freiland nicht nur vielförmiger, sondern auch viel weiter verbreitet sind als in Tiergärten, kann mit den mir vorliegenden zum großen Teil aktuelleren Daten aus Zoos und dem Freiland bestätigt werden. NICKEL und SCHWARZ (1974) betonen außerdem, dass in den zoologischen Gärten Europas Geohelminthen, die in ihrer ektogenen Entwicklung nur von abiotischen Umweltfaktoren abhängig sind, bessere Überlebenschancen haben, als Biohelminthen, deren Zwischenwirte ebenfalls einen passenden Lebensraum vorfinden müssen. Vorliegende Untersuchungsergebnisse bestätigen dies: Es wurden an Trematoden weder Fasciola hepatica noch Dicrocoelium dendriticum nachgewiesen. Auch die Cestodengattung Moniezia kam nicht vor, jedoch in einer zeitgleich im Safaripark an anderen Wiederkäuerarten durchgeführten Untersuchung bei jeweils einem Jungtier der Bisons und der NilgauAntilopen (BIRKMANN, mündliche Mitteilung, 06.07.2005). Die ebenfalls auf Zwischenwirte angewiesenen kleinen Lungenwürmer (Protostrongyliden) traten nicht auf. Große Lungenwürmer (Dictyocaulus sp.) spielten bei Giraffen, Elenantilopen und Oryxantilopen eine Rolle. Diskussion 104 Bei der Gruppe der Oryxantilopen wird deutlich, wie sich die Larvenausscheidung während der Weidesaison zum Herbst hin steigert. Nach SCHNIEDER (2000) ist eine rasche Folge von 3-4 Lungenwurmgenerationen während einer Weidesaison typisch für Dictyocaulus. Den Ursprung im Frühjahr bilden überwinterte Larven oder häufiger Larven von symptomlosen Ausscheidern. Mit jeder folgenden größeren Larven-Generation werden weitere Tiere befallen. Dies führt dazu, dass die meisten Dictyocauloseausbrüche im Herbst beobachtet werden. Auch bei den Elenantilopen traten im Herbst/Winter 2000/01 gehäuft geringgradige bis hochgradige Befunde von Dictyocaulus-Larven besonders bei den Jungtieren auf. Im Gegensatz dazu kamen die höchsten Befunde der Giraffen im Mai bei zwei Alttieren vor. Nach SCHNIEDER (2000) erwerben Kälber mit bestehenden oder vorangegangenen Infektionen mit Ostertagia ostertagi und Cooperia oncophora stärkere DictyocaulusInfektionen und scheiden mehr Lungenwurmlarven aus als nicht infizierte. Dies fiel auch bei den Oryxantilopen auf, die von allen Tierarten im Park die stärkste Eiausscheidung von MDS, v.a. von Ostertagia sp. zeigten. Sie schieden auch viel mehr Dictyocaulus-Larven als die anderen Tierarten aus. Möglicherweise waren deutlich mehr Tiere Larvenausscheider als nachgewiesen wurden: ENIGK und DÜWEL (1962) fanden bei 19 Schlachtrindern weibliche Lungenwürmer, sowie embryonierte Eier und Larven im Bronchialschleim, jedoch nur bei 3 von den 19 Tieren waren in 500 g Kot Larven mithilfe des Auswanderverfahrens nachweisbar. Die latenten Träger scheiden also nur wenige Larven aus und entgehen bei einer Kotuntersuchung leicht der Feststellung. Dies bestätigen auch RODE und JØRGENSEN (1989). In den Gehegen Afrika II und III wurden nie Dictyocaulus-Larven nachgewiesen. Aufgrund des unsicheren Untersuchungsverfahrens können jedoch latente Träger dieser Parasiten dem Nachweis entgangen sein. Eine belastbare Immunität in der Form einer verminderten Ansiedlungsrate wird nach SCHNIEDER (2000) bereits durch eine einmalige Infektion mit etwa 1000 D. viviparusLarven hervorgerufen. Unterbleiben dann jedoch weitere Infektionen, so ist die Immunität nach 12 Monaten verschwunden. Diskussion 105 Eine solche Immunität scheint z.B. bei einem weiblichen Oryxantilopen-Alttier (im Tabellenanhang unterstrichen (Tab. 37)) nicht aufgebaut worden zu sein. Sie schied im Jahresverlauf steigende Larvenzahlen aus. ORTLEPP (1962) beschrieb den Fall einer verendeten Elenantilope aus einem Zoo in Südafrika. Bei ihr wurden massenhaft Lungenwürmer verschiedener Entwicklungsstadien nachgewiesen. Sie muß über einen längeren Zeitraum infektiöse Larven aufgenommen haben, ohne eine Immunität auszubilden. Die Oryxantilopen scheinen v.a. für die Kontamination des Geheges Afrika I mit Dictyocaulus-Larven zu sorgen, so dass alle anderen Wiederkäuerarten sich reinfizieren und ihre Immunität aufrecht erhalten können. Sie selbst erreichten möglicherweise wegen ihrer Belastung durch Ostertagia relativ hohe Larvenausscheidungszahlen, fielen aber weder durch Husten noch Gewichtsabnahme auf. Nach SCHNIEDER (2000) kann die Einstellung nicht immuner Tiere auf stark kontaminierten Flächen innerhalb von 3 Wochen eine schwere Dictyocaulose zur Folge haben. Werden also im Spätsommer aus anderen Zoos übernommene Antilopen in dieses Gehege gelassen, sollten sie ab der 2. Woche intensiv beobachtet und beim ersten Auftreten von Atemwegsproblemen sofort behandelt werden. Larven der Gattung Nematodirus entwickelten sich in den Larvenkulturen im Verhältnis zu den gefundenen Eizahlen nur vereinzelt. Nach BÜRGER und STOYE (1968) benötigt diese Gattung längere Zeit als die anderen zur Larvenentwicklung und ist deshalb nur in älteren Larvenkulturen vorhanden. In den Grasproben des Geheges Afrika I fiel auf, dass Larven der Gattung Nematodirus im Frühjahr bereits Anfang Mai als erste Larvengattung wieder nachgewiesen wurden. Ihre höchste Larvenzahl wurde bereits im Juni erreicht, im Gegensatz zu allen anderen Gattungen, deren höchste Larvenzahlen erst im Herbst vorkamen. Es könnte sich daher teilweise um die Art Nematodirus battus handeln, die sonst v.a. Schafe, aber auch Rinder befällt. Sie benötigt vor dem Schlupf eine Kältephase, der anschließend mittlere Temperaturen von mindestens 10°C folgen müssen (SCHNIEDER, 2000). Im Safaripark Hodenhagen wurden nach dem Winter 2000 /01 erst ab Mai durchgängig diese Temperaturen erreicht. Ab August kamen nur noch vereinzelt geringe Larvenzahlen vor, bei Diskussion 106 denen es sich möglicherweise um andere Arten handelt, wie z.B. N. helvetianus, für den die o.g. Bedingungen nicht nötig sind (ROSE, 1975). Diese und andere Arten schlüpfen 2-3 Monate, nachdem die Eier auf die Vegetation gelangt sind (SCHNIEDER, 2000). Erhöhte Eizahlen von Magen-Darm-Strongyliden traten bei vielen Tieren (in Gehege I: Elenantilopen, Ellipsen-Wasserböcke und Giraffen-Jungtiere; in Gehege III: DefassaWasserböcke und Litschi-Moorantilopen) im Winter bei Stallhaltung auf. Eventuell ermöglicht die für die afrikanischen Tiere nötige relativ hohe Stalltemperatur eine Larvenentwicklung im Stall. Außerdem könnte der im Vergleich zum Sommer beengte Raum dazu beitragen, dass vermehrt Infektionen mit Magen-Darm-Strongyliden, wie auch mit Arten der Gattung Eimeria ermöglicht werden. Denn auch Eimeria-Oozysten kamen vermehrt im Winter bei den Elenantilopen, Oryxantilopen, Ellipsen- und Defassa-Wasserböcken vor. Im Gegensatz dazu wurden bei den Rappen- und den Pferdeantilopen vermehrt im Sommerhalbjahr mit Steigerung zum Herbst hin erhöhte Zahlen von MDS-Eiern wie auch Eimeria-Oozysten nachgewiesen. Es war in vielen Fällen möglich, Zusammenhänge zwischen den Wetterdaten und den Larvenzahlen am Weidegras zu erkennen. Gelegentlich sorgten einige wenige Tage mit geringen Niederschlägen, die nicht die Bedingungen einer Regenperiode nach BÜRGER et al. (1983) erfüllten, für eine Translation größerer Larvenzahlen auf das Weidegras. Ein Zusammenhang zwischen den Gras- und den Kotprobenergebnissen war jedoch nicht nachweisbar. In Gehege Afrika I wurden die Schwankungen der MDS-EpG-Mittelwerte v.a. durch die Jungtiere verursacht und hier wiederum nur durch einige wenige Jungtiere, die zudem während des Untersuchungszeitraumes entwurmt wurden. Die verschiedenen Tierarten erreichten zu unterschiedlichen Jahreszeiten ihre Höchstwerte der MDSEiausscheidung. Möglicherweise hat hier die momentane Kondition und der Immunstatus der Tiergruppe bzw. einzelner Tiere einen größeren Einfluß auf die Höhe der Eiausscheidung als die Menge der vorher mit dem Weidegras aufgenommenen infektiösen Larven. Auch hinsichtlich der Gattung Nematodirus wurden in Gehege Afrika I höhere EpGKotprobenbefunde im Winter bei Stallhaltung erreicht als im Sommer nach dem Erreichen der höchsten Larvenzahlen am Weidegras. Diskussion 107 In Gehege Afrika II wurden zwar deutlich weniger MDS- und Nematodirus-Larven am Weidegras nachgewiesen als in den anderen Gehegen, im Vergleich zu den niedrigen Kotprobenergebnissen, waren die Grasprobenergebnisse jedoch noch verhältnismäßig hoch, obwohl in dem Gehege an weiteren Wiederkäuern nur 2 Bergriedböcke und 2-3 Blessböcke vorhanden waren. Möglicherweise kommt hier auch eine Verbreitung von Parasitenstadien durch den Fahrzeugverkehr aus den anderen Gehegen infrage. Auch in Gehege Afrika III ist kein Zusammenhang zwischen Grasproben- und Kotprobenergebnissen erkennbar. Die verschiedenen Tierarten erreichen zu unterschiedlichen Jahreszeiten ihre höchste Eiausscheidung. Zur Kontamination der Weide mit für Wiederkäuer relevanten Nematodengattungen können neben den Zebras (nur Trichostrongylus axei) außerdem auch die ebenfalls nicht untersuchten Watussirinder beitragen. Bei weitem am häufigsten (78,2% der Proben), sowie mit den höchsten Einzelergebnissen (bis zu 2400 EpG bei einem Alttier) wurden Magen-Darm-Strongyliden bei Oryxantilopen nachgewiesen. Auch nach Entwurmungen wurden schnell wieder hohe Werte erreicht. Ähnliches beobachteten bereits KEYSERLINGK et al. (1997) in Hodenhagen, sowie BOYCE et al. (1991) in San Diego. In einer Studie auf einer Wildfarm in Kenia (WARUIRU et al. 1995) hatten jedoch Oryxantilopen geringere mittlere EpG-Werte als Elenantilopen und sogar Impalas, die in meiner Untersuchung zwar das Gehege mit den Oryxantilopen teilten, jedoch nahezu gar keine Parasitenstadien ausschieden. BOOMKER et al. (2000) wiesen in einem südafrikanischen Nationalpark mit hoher Tierdichte und feuchtem Klima viel höhere Wurmbürden bei Oryxantilopen nach, als in einem trockenen Lebensraum. So könnte die von MIKOLON et al. (1994) zu Gazellen geäußerte Ansicht, dass aus Wüsten stammende Tiere, aufgrund ihres für Parasiten sehr ungeeigneten natürlichen Lebensraumes für entsprechende Infektionen sehr empfänglich sind, auch auf die Oryxantilopen zutreffen, die in der Wildbahn optimal an Trockensavannen und Halbwüsten angepaßt sind. ( BÖER, mündliche Mitteilung, 04.07.2005). Von einer Infektion mit Eimeria sp. waren dagegen insbesondere die Wasserböcke betroffen, gefolgt von den Elenantilopen. Möglicherweise sind diese Tiere besonders häufig von Eimeria befallen, da hierzu auch Nachweise aus dem Freiland vorliegen. Diskussion 108 Bei den Wasserböcken waren pro Termin durchschnittlich ca. 2/3 der Tiere befallen, bei den Wald- und Pferdeböcken nur 1/3. Dies Verhältnis reichte jedoch aufgrund der geringen Tierzahl nicht für einen statistisch abgesicherten signifikanten Unterschied. Die Aussage von ROMMEL (2000), dass Jungtiere stets mehr Oozysten ausscheiden, als die entsprechenden Alttiere galt auch für die meisten betroffenen Tierarten des Safariparks, mit Ausnahme der Oryxantilopen. Auch einzelne Ellipsen-Wasserbock-Alttiere (z.B. der Altbock (*1993); im Tabellenanhang (Tab. 37) fettgedruckt) und Litschi-Moorantilopen-Alttiere erreichten sehr hohe EpG-Werte ohne klinische Symptomatik. Nach anthelminthischen Behandlungen fielen einige Besonderheiten auf: Bei den Oryxantilopen, aber auch bei Elenantilopen, Defassa- und Ellipsen-Wasserböcken wurden mehr als 3 Wochen (also nach Ablauf der Präpatenz von Ostertagia oder Trichostrongylus) nach einer Entwurmung wieder MDS-Eier (bis zu 400 EpG bei einer Oryxantilope) ausgeschieden, aus denen sich gelegentlich jedoch nur sehr wenige oder gar keine Larven entwickelten. Hierfür konnte ich keine Erklärung finden. In den anderen gleichbehandelten Proben der jeweiligen Probennahmetermine entwickelte sich eine der EpGZahl entsprechende Larvenzahl, so dass ein Einfluß aufgrund meiner Probenbearbeitung auszuschließen ist. Ein auffälliger Anstieg bzw. ein erstmaliges Auftreten einer Eimeria-Oozystenausscheidung nach einer Wurmkur gegen Nematoden trat bei den Elenantilopen, bei den Oryxantilopen (auch im Sommer) und bei den Ellipsen-Wasserböcken auf. Die Eliminierung der Helminthenbürde wirkte sich möglicherweise begünstigend auf die Entwicklung von Eimeria aus, was beim Auftreten von Diarrhoe nach anthelminthischen Behandlungen diagnostisch beachtet werden sollte. Trotz der Verabreichung von Wurmkuren während des Untersuchungszeitraumes kam dieses Phänomen nicht bei den Rappenantilopen und den Pferdeantilopen vor. Möglicherweise handelt es sich um Zufälle. Auch hierzu liegen mir keine Literaturinformationen vor. Bei den Pferdeantilopen machten die Ostertagia sp. bis zu einer Entwurmung (Fenbendazol) im Juni 2001 jeweils nur einen geringen Anteil an der Larvengesamtzahl aus. Die Zeit Diskussion 109 zwischen der Wurmkur und dem ersten Ei- (bzw. Larven-) nachweis betrug 17 Tage und liegt damit knapp unter der Präpatenz von 3 Wochen bei Ostertagia. Nach der Entwurmung bildeten bis zum Oktober Ostertagia-Larven den größten Anteil, um dann wieder von den Trichostrongylus-Larven abgelöst zu werden. FORSTNER et al. (1977) beobachteten ebenfalls ein vorzeitiges Auftreten von MDS vor Ablauf der Präpatenz nach Entwurmungen mit Mebendazol und vermuteten, dass es sich um Ostertagia-Larven handeln könnte, die nach der Behandlung aus den schützenden Schleimhautknötchen der Labmagenwand ins Lumen zurückkehren. Auch MIKOLON et al. (1994) beschrieben das gleiche bei Einsatz von Fenbendazol (auch bei Dosisverdoppelung). LÖSCHER et al. (2002) geben für Mebendazol an, dass die Wirkung gegen Ostertagia sp. beim Schaf nur gegen adulte Formen vorhanden ist. Für Fenbendazol und Oxfendazol wird diese Einschränkung jedoch nicht gemacht. In Gehege Afrika I waren pro Termin signifikant mehr Tiere von Ostertagia sp. befallen als in Gehege Afrika III. Hinsichtlich Trichostrongylus konnten so keine signifikanten Unterschiede zwischen diesen Gehegen nachgewiesen werden. Zur statistischen Auswertung konnte jedoch nur die qualitative Aussage herangezogen werden, ob sich in einer Probe TrichostrongylusLarven entwickelten oder nicht. Nicht berücksichtigt werden konnte der quantitative Anteil der Trichostrongylus-Larven an der Gesamtlarvenzahl: In Gehege Afrika III machte diese Art fast immer den größten Anteil aus (Ausnahme: Pferdeantilopen nach Entwurmung => siehe oben). In Gehege Afrika I waren fast immer Ostertagia-Larven in der Überzahl vorhanden, was auch auf die Grasproben zutraf. In Gehege Afrika III waren noch im Vorjahr (2000) viele Ostertagia-Larven aufgefallen, im Folgejahr waren jedoch die Trichostrongylus-Larven vorherrschend. Theoretisch wäre in Gehege III aufgrund der Vergesellschaftung mit den Zebras ein vermehrtes Vorkommen von Trichostrongylus axei denkbar, der nach DRUDGE et al. (1955) neben Wiederkäuern auch Equiden und andere Wirte befällt. Aufgrund nur eines Jahresverlaufs ist jedoch keine sichere Aussage möglich. Problematisch ist außerdem die sichere Unterscheidung von Ostertagia sp. und Trichostrongylus sp. nur aufgrund der mikroskopischen Untersuchung der in der Larvenkultur entwickelten Larven. Nach BÜRGER und STOYE (1968) unterscheiden sich diese beiden Diskussion 110 Gattungen durch folgende Merkmale bei Rind und Schaf: Ostertagia-Larven erreichen eine Körpergröße von 800-850 µm, und haben einen kurzen bis mittellangen Scheidenschwanz mit mindestens 30 µm Länge, Trichostrongylus-Larven sind ca. 700 µm lang, und haben einen kurzen Scheidenschwanz mit bis zu 40 µm Länge. Die anderen Merkmale stimmen weitgehend überein (16 Mitteldarmzellen etc.). Bei den Larven der untersuchten Kotproben waren oft klare Unterschiede in Körpergröße und Scheidenschwanzlänge zu erkennen. In vielen Fällen gab es jedoch fließende Übergänge, was ja auch bei den oben erwähnten sich überlappenden Angaben nicht überrascht, so mußte eine subjektive Grenze gezogen werden. Dies sind jedoch nur die in Europa vorkommenden Parasiten. Wie leicht eine möglicherweise schon vor längerer Zeit importierte Parasitenart unerkannt bleiben könnte, zeigt die von FRANK (1963) veröffentlichte Beschreibung der Larven von Monodontella giraffae, einem Hakenwurm der Gallengänge von Giraffen und Okapis: Mit einer Larvenlänge von 730871µm, einer Scheidenschwanzlänge von 34 -75 µm, sowie 16 Mitteldarmzellen, ist seine Unterscheidung von Ostertagia sp. sehr schwierig. Dieser Parasit wurde von NEUNHOEFFER (1965) bei Giraffen direkt nach einem Import, aber auch noch im Jahr danach nachgewiesen und war Todesursache bei einer Giraffe. CRAIG (1993) betont die leicht mögliche Verwechselung der Adulten von Longistrongylus curvispiculum mit anderen Ostertagiinae. Diese Art wurde bei in England bzw. Amerika geborenen Oryx- und Rappenantilopen nachgewiesen ( GIBBONS u. KHALIL, 1977; CRAIG, 1993). Camelostrongylus mentulatus kam bei einer in Japan geborenen Giraffe vor und wird als stark pathogen beschrieben (FUKUMOTO et al. 1996). Bei diesen Fällen lagen die Importe Generationen zurück. Zahlreiche Autoren (SCHOTT, 1960; LAHDE, 1971; DOLLINGER, 1973)unterstreichen die Notwendigkeit, die Einschleppung solcher Parasiten durch Quarantäne und anthelminthische Behandlungen zu vermeiden. Auch im Safaripark sollte hierauf stärker geachtet werden. Bei einem aus Schweden importierten und nach 3 Wochen abgegebenen Giraffenbullen wurden 18 Tage nach der Ankunft Ostertagia sp. (Präpatenz: 3 Wochen) und Trichuris sp. (Präpatenz: >50 Tage) nachgewiesen, wobei es sich um eine Infektion aus dem Herkunftszoo handeln mußte. Diskussion 111 Oesophagostomum sp. wie auch Cooperia sp. kamen nur bei Pferdeantilopen in nennenswerter Anzahl vor. In den Grasproben wurden beide Gattungen jedoch nie in Gehege Afrika III, sondern nur in Gehege Afrika I nachgewiesen. In den Versuchen von SIEVERSPREKEHR (1973) zur Grasprobenaufbereitung und -untersuchung schwankten die Mittelwerte der wiedergewonnenen Larven aus Grasproben mit bekannten Larvenmengen je nach Grasmenge, Larvenalter oder Bearbeiter zwischen ca. 52 und 72 %, was sich möglicherweise auch auf die vorliegenden Grasprobenuntersuchungen ausgewirkt haben kann, so dass geringe Larvendichten dem Nachweis möglicherweise entgehen könnten. Bei der Parasitenkontrolle sind nach MEISTER et al. (1989) leichtgradig infizierte aber nicht parasitenfreie Tiere das Ziel. Durch eine geringe Wurmbürde wird die Immunität des Wirtes stimuliert. Auf der anderen Seite können subklinische Parasitosen nach ELZE et al. (1976) die Entwicklung der Tiere verzögern und das Manifestwerden anderer Erkrankungen begünstigen, und so bei wertvollen Tieren auch zu großen ökonomischen Schäden führen. Für den Safaripark Hodenhagen muß also diesbezüglich ein Mittelweg gefunden werden. Die Gefahr "parasitenfreier" und damit nichtimmuner Tiere besteht aufgrund einiger auch nach Behandlungen schnell wieder starker Ausscheider nicht (z.B. Oryxantilopen). Die routinemäßige Entwurmung aller Antilopenarten im Herbst zur Aufstallung sollte weiter beibehalten werden, auch um zu verhindern, dass es durch den Stress der Aufstallung und der damit verbundenen Haltungsänderung zu klinischen Parasitosen kommt. Bei den meisten Tierarten wäre auch im Frühjahr eine Entwurmung sinnvoll, auch um die Kontamination der Weide soweit wie möglich hinauszuzögern. Im Jahresverlauf des Untersuchungszeitraumes wurden erst im Herbst kurz vor oder sogar nach der Aufstallung sehr hohe Larvenzahlen am Weidegras nachgewiesen. Dies könnte bei entsprechenden Witterungsbedingungen jedoch in anderen Jahren auch früher der Fall sein. Alternativ zur routinemässigen Entwurmung im Frühjahr vor dem Weideaustrieb könnte eine größere Anzahl Kotproben untersucht werden und nur die Tiergruppen behandelt werden, bei Diskussion 112 denen dies nötig ist. Möglicherweise benötigen v.a. die Impalas und die Nyalas auch in anderen Jahren keine Entwurmung. Auf jeden Fall sollten jedoch die Giraffen mit in die routinemässige Entwurmungen einbezogen werden. Der beste Zeitpunkt für die Frühjahrsentwurmung bzw. -kotuntersuchung ist direkt vor dem Austrieb auf die Weide, v.a. weil hier im Stall noch am ehesten die gleichmässige Aufnahme des Anthelminthikums über das Futter gewährleistet ist, bzw. eine den Tierarten, z.T. Einzeltieren zugeordnete Kotprobennahme ohne großen Zeitaufwand möglich ist. Da die Giraffen und die Rappenantilopen ganzjährig nachts aufgestallt werden, wäre bei diesen Tierarten auch später im Sommer eine Untersuchung von Kotproben sehr leicht möglich und v.a. bei den Rappenantilopen sehr wichtig, da diese Tierart obwohl sie nach der Wurmkur im Herbst sehr lange fast parasitenfrei blieb, im Sommer sehr hohe Befunde aufwies. Die routinemäßigen Behandlungen können am besten wie bisher mit Panacur® -Pellets (Fenbendazol) über das Futter erfolgen. Die übliche Gabe der Dosis an drei aufeinanderfolgenden Tagen ist ebenso sinnvoll, da so die bei Wildwiederkäuern oft unterschiedliche tägliche Aufnahme ausgeglichen und die Wirkung verstärkt wird (ENIGK u. DEY HAZRA, 1978). Sollten während der Weideperiode bei Einzeltieren klinische Symptome oder hohe Befunde bei Kotuntersuchungen auffallen, so ist wie bisher eine Behandlung mit Ivermectin per Teleinjektion sinnvoll, da bei den meisten Tierarten, eine gezielte Fütterung von Einzeltieren an mehreren aufeinanderfolgenden Tagen kaum möglich ist. Im Untersuchungszeitraum wurden keine Maßnahmen gegen Eimeria sp. durchgeführt. Wahrscheinlich wird dies in der Regel auch weiterhin nicht notwendig sein. Nur wenn sich v.a. Tiere der Wasserbockarten in schlechtem Allgemeinzustand befinden sollten, könnte eine zusätzliche Behandlung, der bei diesen Tierarten fast immer vorhandenen Eimeria sp. mit z.B. Baycox® nötig werden. Neue Tiere, sollten nach der Ankunft im Safaripark zunächst getrennt von den schon vorhandenen aufgestallt, koprologisch untersucht, und dann entwurmt werden. COURTNEY Diskussion 113 und KOLLIAS (1985) empfehlen zur gleichen Zeit mehrere nicht verwandte Anthelminthika einzusetzen, um möglichst keine resistenten Parasiten einzuführen. Nachdem sie später zu den anderen auf die Weide gelassen werden, sollten sie noch mehrere Wochen lang besonders intensiv beobachtet werden. Wenn möglich, wäre auch eine Kotuntersuchung sinnvoll. Besonders im Gehege Afrika I ist damit zu rechnen, dass Tiere aus anderen Zoos nicht genügend immun sind, um zusammen mit dem Stress des Umzugs ohne Probleme mit dem starken Infektionsdruck aufgrund hoher Larvendichte am Weidegras zurechtzukommen. Zusammenfassung 114 Susanne Koch: Untersuchungen zum Endoparasitenbefall bei afrikanischen Wildwiederkäuern unter Berücksichtigung der Weideinfestation im Serengeti-Park Hodenhagen Zusammenfassung Im Serengeti-Park Hodenhagen wurden 1130 Kotproben von 10 verschiedenen afrikanischen Wildwiederkäuerarten in 3 verschiedenen Gehegen gesammelt: Gehege Afrika I (7,6 ha) mit Giraffen, Elenantilopen, Oryxantilopen, Ellipsen-Wasserböcken, Rappenantilopen und Impalas, Gehege Afrika II (2,6 ha) mit Nyalas und Gehege Afrika III (11,1ha) mit DefassaWasserböcken, Pferdeantilopen und Litschi-Moorantilopen. Die Untersuchungen mittels Flotationsverfahren nach McMaster, Auswanderverfahren und Larvenkultur brachten folgende Ergebnisse: Giraffe: In 38,4 % der 159 Proben wurden Magen-Darm-Strongyliden-Eier nachgewiesen. Nematodirus-, Trichuris-, und Capillaria-Eier kamen in 5,0 bis 7,5 % der Proben vor. Aus 6,9 % der Proben wanderten Dictyocaulus-Larven aus. In der Larvenkultur kamen Ostertagia sp. mit 91,2 % der Proben am häufigsten vor, gefolgt von Trichostrongylus-Larven mit 37,1 % und Cooperia-, Nematodirus- und Strongyloides-Larven in geringerer Häufigkeit. Elenantilope: Am häufigsten wurden Eimeria-Oozysten nachgewiesen (44,8 % der Proben). MDS-, Nematodirus-, Trichuris- und Capillaria-Eier erreichten zwischen 8,4 und 21,0 %. In den Larvenkulturen wurden am häufigsten Ostertagia-Larven gefunden (62,9% der Proben), Trichostrongylus- und Strongyloides-Larven erreichten 2,1 bzw. 9,1 %. Oryxantilope: Diese Tierart erreichte mit MDS-Eiern in 78,2 % der Proben den höchsten Wert aller untersuchten Tierarten. Eimeria sp. kamen in 25,5 % der Proben vor, Eier der anderen Parasitenarten nur zu 0,9 bis 5,5 %. Dictyocaulus-Larven wanderten aus 28,3 % der Proben aus. In 81,1 % der Larvenkulturen kamen Ostertagia-Larven vor, Trichostrongylusund Strongyloides-Larven erreichten 49,1 % bzw. 1,9 %. Ellipsen-Wasserbock: In 55,7 % der Proben wurden Eimeria-Oozysten nachgewiesen, MDS-Eier dagegen nur in 12,3 % der Proben. Nematodirus, Trichuris und Capillaria sp. erreichten Werte unter 3 %. Ostertagia- und Trichostrongylus-Larven kamen in einer ähnlich großen Zahl von Proben vor. (41,8 % bzw. 42,6 %). Nematodirus- und Strongyloides-Larven erreichten Werte unter 4 %. Rappenantilope: In 36,0 % der Proben kamen MDS-Eier vor. Die anderen Gattungen erreichten Werte unter 6 %. Ostertagia-Larven wurden in 60,4 % der Proben nachgewiesen, Trichostrongylus-Larven jedoch nur in 2,9 %. Zusammenfassung 115 Impala: In 22,2 % der Larvenkulturen kamen Ostertagia-Larven vor, in 3,7 % Trichostrongylus-Larven. Alle anderen Verfahren brachten nur negative Ergebnisse. Nyala: Eimeria-Oozysten kamen in 21,6 % der Proben vor. Eier der anderen Gattungen erreichten keine zählbare Grenze. In 2,3 % bzw. 3,4 % der Larvenkulturen entwickelten sich Trichostrongylus- bzw. Ostertagia-Larven. Defassa-Wasserbock: In 50 % der Proben wurden Eimeria-Oozysten gezählt. MDS- bzw. Capillaria-Eier wurden in 13,3 % bzw. 8,9 % der Proben gezählt. Mit 66,7 % der Larvenkulturen kamen Trichostrongylus-Larven deutlich häufiger vor als Ostertagia-Larven (7,8 % der Proben). Pferdeantilope: MDS-Eier wurden in 26,2 % der Proben gezählt, Eier (bzw. Oozysten) anderer Gattungen in bis zu 10,7 % der Proben. Ostertagia-, Trichostrongylus- bzw. Cooperia-Larven kamen in 75 %, 81 % bzw. 41,7 % der Proben vor, Oesophagostomum sp. nur in 7,1 %. Litschi-Moorantilope: In 71,4 % der Proben kamen Eimeria-Oozysten vor. Eier der Helminthengattungen erreichten nicht mehr als 8,3 % (MDS). Mit 34,5 % der Larvenkulturen waren Trichostrongylus sp. häufiger vorhanden als Ostertagia sp. (5,4 %). Grasproben: Insgesamt wurden 57 Grasproben gesammelt und untersucht. Im Gehege Afrika 1 waren von den insgesamt 21 Grasproben in 18 Proben (=85,7 %) Ostertagia-Larven, in 13 (61,9 %) Trichostrongylus-Larven, in 14 (66,7 %) NematodirusLarven und in 10 (47,6%) Cooperia-Larven vorhanden. Nur in einer (4,8 %) der Proben kamen Oesophagostomum-Larven vor. Im Gehege Afrika 2 wurden in 4 von 18 Proben (22,2%) Ostertagia-Larven gezählt, in einer (5,6 %) Trichostrongylus- und in 3 Proben (16,7 %) Nematodirus-Larven. Im Gehege Afrika 3 waren ebenfalls in 4 von 18 Proben (22,2%) Ostertagia-Larven vorhanden. Trichostrongylus-Larven kamen jedoch in 7 Grasproben (38,9 %) vor. Eine wichtige Rolle spielte die Gattung Trichuris v.a. bei Giraffen, Elen-, Rappen- und Pferdeantilopen (ohne jahreszeitliche Häufung). Bei einer Rappenantilope erfolgte nach einer Ivermectin-Injektion keine vollständige Eliminierung von Trichuris. Zusammenfassung 116 Die Gattung Capillaria kam bei allen Tierarten außer der Impala und der Nyala meist ohne jahreszeitliche Häufung vor. Die Aussage von ROTH (1968), dass im Zoo im Gegensatz zum Freiland mehr Trichuriden, jedoch weniger Trematoden und Cestoden vorkommen, konnte bestätigt werden. Dictyocaulus sp. kamen bei Oryx- und Elenantilopen, wie auch bei Giraffen vor. V.a. bei den Oryxantilopen erfolgte eine für diese Endoparasitengattung typische Steigerung der Larvenausscheidung zum Herbst hin. Ein weibliches Oryxantilopen-Alttier schien keine belastbare Immunität auszubilden. In Grasproben wurde die Gattung Nematodirus deutlich früher als alle anderen Gattungen bereits Anfang Mai nachgewiesen. Es könnte sich daher teilweise um die Art Nematodirus battus handeln, die vor dem Schlupf eine Kältephase benötigt. Bei den meisten Tierarten wurden erhöhte MDS-Eizahlen bzw. Eimeria-Oozysten-Zahlen im Winter bei Stallhaltung festgestellt. Nur bei Rappen- und Pferdeantilopen erfolgte die Steigerung im Sommerhalbjahr. Unter Berücksichtigung der vorliegenden Literatur erfolgten möglicherweise erstmalige Nachweise bestimmter Endoparasiten unter Gehegebedingungen bei Elenantilope (Dictyocaulus sp. ), Oryxantilope (Dictyocaulus sp.), Rappenantilope (Eimeria sp., Capillaria sp.), Pferdeantilope (Oesophagostomum sp.), Ellipsen-Wasserbock (Trichostrongylus sp., Nematodirus sp.), Defassa-Wasserbock (Trichostrongylus sp.), Litschi-Moorantilope (Trichostrongylus sp., Capillaria sp.) und Impala (Trichostrongylus sp., Ostertagia sp.). Das Auftreten der Gattungen Oesophagostomum, Dictyocaulus, Ostertagia und Nematodirus wurde möglicherweise durch die im Safaripark vorhandene Weidehaltung begünstigt. Eine Ausnahme bildete die Gattung Trichostrongylus, die laut Literatur in intensiver Zoohaltung, wie auch in weiträumiger Safariparkhaltung ähnlich häufig vorkam. Auch die tägliche Reinigung der Gehege kann also parasitäre Infektionen und damit eine zur Ausbildung einer Immunität wichtige Wirt-Parasit-Interaktion nicht vollständig verhindern. Zusammenfassung 117 Zusammenhänge zwischen den Klimadaten und den Schwankungen der Larvenmengen im Weidegras waren erkennbar. Die Höhepunkte der Eiausscheidung erfolgten jedoch je nach Tierart (auch innerhalb eines Geheges) zu unterschiedlichen Zeitpunkten. Auch hinsichtlich der Höhe der Eiauscheidung gab es Unterschiede zwischen den Tierarten. Die Oryxantilopen waren die Hauptausscheider von Magen-Darm-Strongyliden-Eiern. Eimeria sp. traten v.a. bei Wasserbockarten auf. Jedoch konnte aufgrund der geringen Tierzahl kein statistisch signifikanter Unterschied zu den anderen Gattungsgruppen nachgewiesen werden. Mehr als 3 Wochen nach anthelminthischen Behandlungen wurden von verschiedenen Tierarten MDS-Eier ausgeschieden, aus denen sich unerklärlicherweise keine Larven entwickelten. Bei anderen Tieren wurden vermehrt Eimeria-Oozysten nachgewiesen. Bei den Pferdeantilopen erfolgte nach einer Entwurmung eine vorübergehende Verschiebung zugunsten von Ostertagia sp., nachdem vorher Trichostrongylus sp. den Hauptanteil der entwickelten Larven ausmachten. Die z.T. problematische Unterscheidung der Parasiten-Gattungen und das damit verbundene Risiko des unbemerkten Imports exotischer Parasitenarten wurden diskutiert mit dem Rat zu verschärfter Quarantäne. Zur Verbesserung der Parasitenkontrolle wurde empfohlen, eine zweite routinemäßige Entwurmung gegen Ende der Stallperiode durchzuführen, um die verstärkte Kontamination der Weiden im Jahresverlauf möglichst weit nach hinten zu verschieben. Zusammenfassung 118 Studies on endoparasites in wild African ruminants in consideration of the infestation of pasture in the Serengeti Wild Animal Park Hodenhagen, by Susanne Koch Summary Faecal and pasture sampling over a period of 13 months were used to estimate the prevalence of endoparasitic infections in wild African ruminants of the Serengeti Wild Animal Park in Hodenhagen in Lower-Saxony, approximately 60 km north of Hannover. 1130 faecal samples of 10 different wild African ruminant species were collected in three different enclosures: Africa I (18,8 acres) with giraffes, elands, gemsboks, common waterbucks, sable antelopes and impalas, Africa II (6,4 acres) with nyalas and Africa III (27,4 acres) with defassa waterbucks, roan antelopes and lechwe. By using McMaster flotation technique, larval migration technique and culture of larvae the following results were found: Giraffe: Strongyle nematode eggs were detected in 38,4% of the 159 faecal samples. Eggs of Nematodirus, Trichuris and Capillaria sp. were found in 5,0 to 7,5% of the samples. From 6,9% of the samples larvae of Dictyocaulus sp. migrated. Ostertagia and Trichostrongylus were found in 91,2 and 37,1% of larval cultures, respectively and larvae of Cooperia, Nematodirus and Strongyloides sp. more rarely. Eland: Eimeria oocysts were found in 44,8% of the samples. Strongyle eggs and eggs of Nematodirus, Trichuris and Capillaria sp. were found in 8,4-21,0% of the samples. In larval cultures, Ostertagia, Strongyloides and Trichostrongylus sp. were found in 62,9, 9,1% and 2,1%, respectively. Gemsbok: With strongyle eggs in 78,2% of the samples, gemsbok had the highest value of this kind of all examined ruminant species. Eimeria oocysts and eggs of other parasites were found in 25,5 and 0,9-5,5% of the samples respectively. Dictyocaulus larvae migrated from 28,3% of the samples. Ostertagia, Trichostrongylus and Strongyloides sp. were found in 81,1, 49,1 and 1,9% of larval cultures, respectively. Common waterbuck: Eimeria oocysts, strongyle eggs and eggs of other nematodes (Nematodirus, Trichuris and Capillaria) were found in 55,7, 12,3 and <3% of the samples, Zusammenfassung 119 respectively. Ostertagia, Trichostrongylus and other nematodes (Nematodirus and Strongyloides) were found in 41,8, 42,6 and <4% of larval cultures, respectively. Sable antelope: Eggs of strongyle and other nematode sp. were found in 36,0 and 6% of the samples, respectively. Ostertagia and Trichostrongylus sp. were found in 60,4 and 2,9% of larval cultures, respectively. Impala: Ostertagia and Trichostrongylus sp. were detected in 22,2 and 3,7% of larval cultures, respectively. All the other examination methods yielded negative results. Nyala: Eimeria oocysts were detected in 21,6% of the samples. Egg numbers of helminth genera were below the detection limit. Ostertagia and Trichostrongylus sp. were found in 3,4 and 2,3% of larval cultures, respectively. Defassa waterbuck: Eimeria oocysts were found in 50% of the samples. Strongyle and Capillaria eggs were found in 13,3 and 8,9% of the samples. Trichostrongylus and Ostertagia sp. were found in 66,7 and 7,8% of larval cultures, respectively. Roan antelope: Eggs of strongyle sp. and other genera were found in 26,2 and up to 10,7% of the samples, respectively. Trichostrongylus, Ostertagia, Cooperia and Oesophagostomum sp. were found in 81, 75, 41,7 and 7,1% of larval cultures, respectively. Lechwe: Eimeria oocysts and eggs of helminth genera were found in 71,4 and up to 8,3% of the samples, respectively. Trichostrongylus and Ostertagia sp. were found 34,5 and 5,4%, respectively, in larval cultures. Pasture samples: In total 57 pasture samples were examined. In enclosure Africa I, larvae of Ostertagia, Trichostrongylus, Nematodirus, Cooperia and Oesophagostomum, respectively, were found in 85,7, 61,9, 66,7, 47,6 and 4,8% of 21 pasture samples. In enclosure Africa II, larvae of Ostertagia, Trichostrongylus and Nematodirus, respectively, were found in 22,2, 5,6 and 16,7% of 18 pasture samples. In enclosure Africa III, larvae of Ostertagia and Trichostrongylus sp., respectively, were found in 22,2 and 38,9% of 18 pasture samples. Zusammenfassung 120 The genus Trichuris was important especially in giraffes, elands, sable antelopes and roan antelopes (without seasonal increase). Ivermectin administration failed to eliminate Trichuris sp. in one sable antelope. The genus Capillaria was found in all examined animal species except impala and nyala. (mostly without seasonal increase). The data confirmed the statement of ROTH (1968) that Trichuridae are more prevalent (and cestodes and trematodes less prevalent) in the zoo than in the original habitats of the animals. Dictyocaulus sp. were detected in gemsboks, elands and giraffes. Gemsboks, especially, showed a typical increase of the larval excretion towards autumn for this parasite genus. An adult female gemsbok seemed unable to form a stable immunity. The genus Nematodirus was found much earlier in the year (in early May) in pasture samples than all other genera. It is possibly partly the species Nematodirus battus, which needs a cold phase before hatching. Higher counts of strongyle nematode eggs and oocysts of Eimeria were detected in most of the examined animal species during the winter housing period. Only in sable and roan antelopes did egg output increase in summer. A literature search suggests that this may be the first report of the following endoparasites under zoo or enclosure conditions: Dictyocaulus sp. in eland and gemsbok, Capillaria sp. in lechwe and sable antelope; Eimeria sp. in sable antelope, Nematodirus sp. in common waterbuck, Oesophagostomum sp. in roan antelope, Ostertagia sp. in impala, and Trichostrongylus sp. in common waterbuck, defassa waterbuck, impala and lechwe. Grazing husbandry in the safari park possibly maintained the incidence of Oesophagostomum, Dictyocaulus, Ostertagia and Nematodirus sp. . The genus Trichostrongylus, which the literature reports as occurring approximately as often in zoos as in spacious safari parks, is an exception. Even daily cleaning of enclosures cannot Zusammenfassung 121 prevent parasitic infections completely and so it also cannot prevent a host-parasiteinteraction, which is important to form immunity. Relations between weather conditions and the changes of larval density on herbage were noticeable. However, depending on the animal species, increases of egg outputs occurred (even within enclosures) at very different times of the year. Also, the animal species showed high differences as regards the extent of egg output. Gemsboks excreted the highest numbers of strongyle nematode eggs. Eimeria oocysts were found especially in the waterbuck samples but the statistical significance of that observation is questionable because of the small number of samples. Some animals excreted strongyle nematode eggs more than three weeks after anthelminthic treatment but no larvae developed. Other animals showed higher counts of oocysts of Eimeria sp. . A change in the larval cultures followed anthelminthic treatment of roan antelopes: Ostertagia sp. temporarily reached a higher percentage than Trichostrongylus sp. . The partly difficult differentiation of the parasites´ genus and the corresponding risk of unnoticed import of exotic parasites were discussed with the advice to organize a strict quarantine. To improve parasite control it was recommended to perform a second routine anthelmintic treatment at the end of the winter housing period, to move the time of increasing pasture contamination with worm eggs to the latest possible time of the year. Literaturverzeichnis 122 Literaturverzeichnis ANDERSON, I. G. (1983): The prevalence of helminths in impala Aepyceros melampus (Lichtenstein, 1812) under game ranching conditions. S. Afr. Tydskr. Natuurnav. 13 (3), 55-70. APFELBACH, R. (1988): Langhals- oder Steppengiraffen in: Grzimeks Enzyklopädie, Säugetiere (4) Kindler Verlag GmbH München, S. 266-277. ARMOUR, J., K. BAIRDEN, R. DALGLEISH, A. M. IBARRA-SILVA u. S. K. SALMAN (1988): Clinical nematodiriasis in calves due to Nematodirus battus infection. Vet. Rec. 123, 230-231. BAERMANN, O. (1917): Eine einfache Methode zur Auffindung von Ankylostomum (Nematoden) - Larven in Erdproben. Geneesk. T. Ned.- Ind. 57, 131-137. BARUTZKI, D., M. A. HASSLINGER, K. SCHMID u. H. WIESNER (1985): Situationsanalyse zum Endoparasitenbefall bei Zootieren. Tierärztl. Umschau 40, 953-961. BARUTZKI, D., G. v. HEGEL u. K. SCHMID (1989): Einsatz von Fenbendazol zur Bekämpfung von Helminthen bei kleinen Zoo-Wiederkäuern. Tierärztl. Prax. 17, 137-143. BENEDEK, L (1943): Untersuchungen auf Leberegeleier durch Sedimentation. Allatorv. Lap. 66, 139-141. BHATT, G. N., V. K. SRIVASTAVA u. G. SUBRAMANIAN (1969): Studies on Bunostomum trigonocephalum (Rudolphi, 1808) VI. Percutaneous invasion in normal hosts. Indian J. Anim. Sci. 39 (6), 536-538. BOAG, B., u. R. J. THOMAS (1977): Epidemiological studies on gastro-intestinal nematode parasites of sheep: the seasonal number of generations and succession of species. Res. Vet. Sci. 22, 62-67. BOCH, J. (1961): Phenothiazin, Piperazin und Bephenium als Anthelminthika bei Zootieren. Verh. Ber. Int. Symp. Erkr. Zootiere 3, 48-52. Literaturverzeichnis 123 BOOMKER, J. (1977): A revision of the genus Impalaia Mönnig, 1924. Onderstepoort J. vet. Res. 44 (3), 131-138. BOOMKER, J. (1986 a): Paracooperia horaki n. sp. (Nematoda: Trichostrongylidae) from the nyala Tragelaphus angasi Gray, 1849. Onderstepoort J. vet. Res. 53, 161-165. BOOMKER, J. (1986 b): Trichostrongylus auriculatus n. sp. (Nematoda: Trichostrongylidae) from the steenbok, Raphicerus campestris (Thunberg, 1811). Onderstepoort J. vet. Res. 53, 213-215. BOOMKER, J. (1991): Parasites of South African wildlife. XI. Description of a new race of Cooperia rotundispiculum Gibbons & Khalil, 1980. Onderstepoort J. vet. Res. 58, 271-273. BOOMKER, J., D. G. BOOYSE, R. WATERMEYER, I. L. DE VILLIERS, I. G. HORAK u. J. R. B. FLAMAND (1996): Parasites of South African wildlife. XIV. Helminths of nyalas (Tragelaphus angasii) in the Mkuzi Game Reserve, KwaZulu-Natal. Onderstepoort J. vet. Res. 63, 265-271. BOOMKER, J., I. G. HORAK u. R. ALVES (1979): Cooperia connochaeti sp. nov. (Nematoda, Trichostrongylidae) from the blue wildebeest, Connochaetes taurinus (Burchell, 1823). Onderstepoort J. vet. Res. 46, 83-86. BOOMKER, J., I. G. HORAK u. V. DE VOS (1986): The helminth parasites of various artiodactylids from some South African nature reserves. Onderstepoort J. vet. Res. 53, 93-102. BOOMKER, J., I. G. HORAK u. J. R. B. FLAMAND (1991): Parasites of South African wildlife. XII. Helminths of nyala, Tragelaphus angasi, in Natal. Onderstepoort J. vet. Res. 58, 275-280. BOOMKER, J., I. G. HORAK, R. WATERMEYER u. D. G. BOOYSE (2000): Parasites of South African wildlife. XVI. Helminths of some antelope species from the Eastern and Western Cape Provinces. Onderstepoort J. vet. Res. 67, 31-41. BOOMKER, J., u. R. K. REINECKE (1989): A nematode parasite Trichostrongylus deflexus n. sp. from several South African antelope species. S. Afr. J. Wildl. Res. 19 (1), 21-25. Literaturverzeichnis BORAY, J. C., u. I. G. PEARSON (1960): The anthelminthic efficiency of tetrachlorodifluoroethane in sheep infested with Fasciola hepatica. Austral. vet. J. 36, 331-337. BOYCE, W., J. ALLEN, C. HIMMELWRIGHT, L. ELLIOT, A. MIKOLON, J. MAZET u. I. GARDNER (1991): Implementation and evaluation of a strategic parasite control program for captive exotic ungulates. J. Am. Vet. Med. Assoc. 198 (No. 11), 1972-1976. BREMNER, K. C., R. K. KEITH u. R. WINKS (1976): Age resistance of cattle to the nodular worm Oesophagostomum radiatum. Res. Vet. Sci. 20, 350-351. BÜRGER, H. J., G. SIEVERS u. C. RATH (1983): Vorhersage des Ansteckungsrisikos für Rinder mit Trichostrongyliden auf Grund von Wetterdaten. Fortschr. Vet. Med. 37, 301-308. BÜRGER, H.-J., u. M. STOYE (1968): Parasitologische Diagnostik. Teil II: Eizählung und Larvendifferenzierung. Therapogen Praxisdienst 3, 1-22. BURTON, M., u. R. BURTON (1994): Nyala; Eland; Sable antelope; Waterbuck in: International Wildlife Encyclopedia, Marshall Cavendish Corporation, USA. S. 737-738; S. 835-836; S. 2124-2125; S. 2672-2673. BWANGAMOI, O. (1968): Helminth parasites of domestic and wild animals in Uganda. Bull. epizoot. Dis. Afr. 16, 429-454. CHAKRABORTY, A. (1992): Trichuris sp. infection in wild captive herbivores. J. Vet. Parasitol. 6 (2), 37-40. CHAUHAN, P. P. S., B. B. BHATIA, G.S. ARORA, R. D. AGRAWAL u. S. S. AHLUWALIA (1973): A prelimiminary survey of parasitic infections among mammals and birds at Lucknow and Delhi zoos. Indian J. Anim. Sci. 43 (2), 163-168. CHURCH, N.W. (1986): Gastrointestinal nematodes in captive roan and sable antelope. Vet. Rec. 119, 406-407. 124 Literaturverzeichnis 125 COURTNEY, C. H., u. G. V. KOLLIAS (1985): Management concepts for control of endoparasitism in exotic ungulates. Avian / Exotic Practice 2 (1), 13-17. CRAIG, T. M. (1986): Epidemiology and control of gastrointestinal nematodes and cestodes in small ruminants. Vet. Clin. North. Am. Food Anim. Pract. 2 (2), 367-372. CRAIG, T. M. (1993): Longistrongylus curvispiculum (Nematoda: Trichostrongyloidea) in free-ranging exotic antelope in Texas. J. Wildl. Dis. 29 (3), 516-517. CROFTON, H. D. (1954): Nematode parasite populations in sheep on lowland farms I. Worm egg counts in ewes. Parasitol. 44, 465-477. CROFTON, H. D. (1958): Nematode parasite populations in sheep on lowland farms V. Further observations on the post-parturient rise and a discussion of its significance. Parasitol. 48, 243-260. DINNIK, J. A., u. R. SACHS (1968): A gigantic Protostrongylus, P. africanus sp. nov., and other lung nematodes of antelopes in the Serengeti, Tanzania. Parasitol. 58, 819-829. DOLLINGER, P. (1973): Zur Wirksamkeit des Anthelminthikums Mebendazol bei Zootieren. Verh. Ber. Int. Symp. Erkr. Zootiere 15, 323-332. DONALD, A. D. (1968): Ecology of the free-living stages of nematode parasites of sheep. Austr. Vet. J. 44, 139-144. DRUDGE, J. H., S. E. LELAND, Z. N. WYANT u. G. W. ELAM (1955): Studies on Trichostrongylus axei (Cobbold, 1879) I. Some experimental host relationships. J. Parasitol. 41, 505-511. DU TOIT, J. (2001): Giraffes and plant defenses in: The encyclopedia of mammals Vol. II: Primates and large herbivores, Andromeda Oxford Ltd., Oxford, S. 527. DÜWEL, D., u. K. SCHMID (1986): Zur Behandlung von Helminthosen bei Tieren in zoologischen Gärten - eine Übersicht. Verh. Ber. Int. Symp. Erkr. Zootiere 28, 347-363. Literaturverzeichnis 126 ECKERT, J. (1960): Die Diagnose des Magen-Darmstrongylidenbefalles des Schafes durch Differenzierung der freilebenden dritten Larven. Zbl. Vet. Med. B 7, 612-630. ECKERT, J. (1963): Versuche zur Anwendung von Thiabendazole als Anthelminthikum bei Zootieren. Kleintier-Prax. 8, 34-40. ECKERT, J., M. ROMMEL u. E. KUTZER (2000): Erreger von Parasitosen: Systematik, Taxonomie und allgemeine Merkmale. in: ROMMEL, M., J. ECKERT, E. KUTZER, W. KÖRTING u. T. SCHNIEDER (Hrsg.): Veterinärmedizinische Parasitologie Parey Buchverlag im Blackwell Wissenschafts-Verlag, Berlin und Wien, 5. Aufl., S. 2 - 39. EID, R. A. A., u. M. A. O. RAWHIA (1996): Some studies on the enteric parasites of giraffes (Camelopardalis angolensis) in Giza zoo, Egypt. Egypt. J. Comp. Pathol. Clin. Pathol. 9 (2), 80-88. ELZE, K., G. DANNER u. E. TAMIM (1976): Zur Metaphylaxe des Helminthenbefalls bei Zootieren mittels Mebendazol. Verh. Ber. Int. Symp. Erkr. Zootiere 18, 219-224. ENIGK, K., u. A. DEY- HAZRA (1976): Die Behandlung des Helminthenbefalles wildlebender Säugetiere und Vögel mit Fenbendazol. Kleintier-Prax. 21, 133-140. ENIGK, K., u. A. DEY- HAZRA (1978): Die Behandlung der Rundwurminfektionen wildlebender Säugetiere und Vögel mit Rintal ®. Veterinärmed. Nachr. 2, 195-203. ENIGK, K., u. D. DÜWEL (1961): Die Lebensdauer der ansteckungsfähigen Larven des Rinderlungenwurmes. Tierärztl. Umsch. 16, 415-418. ENIGK, K., u. D. DÜWEL (1962): Beitrag zur Dictyocaulose des Rindes. Dtsch. tierärztl. Wschr. 69, 72-78. EYSKER, M. (1980): Significance of inhibited development in the epidemiology of Chabertia ovina and Oesophagostomum venulosum infections in sheep. Vet. Parasitol. 6, 369-379. Literaturverzeichnis 127 FLACH, E. J., D. A. BLEWETT u. K. W. ANGUS (1991): Coccidial infections of captive red lechwe (Kobus leche leche) at Edinburgh Zoo, with a note on concurrent Trichuris sp. infections. J. Zoo Wildl. Med. 22 (4), 446-452. FORSTNER, M. J. (1967): Untersuchungen über die jahreszeitlich verschiedenen Ausscheidungsraten von Wurmeiern und -larven bei Zootieren. Verh. ber. Erkr. Zootiere 9, 167-169. FORSTNER, M. J., H. KOPP u. H. WIESNER (1977): Weitere Untersuchungen über die Entwurmung von Zoowiederkäuern mit Mebendazol. Berl. Münch. Tierärztl. Wschr. 90, 180-183. FORSTNER, M. J., H. WIESNER, D. JONAS u. W. KRANEBURG (1976): Versuche zur Entwurmung von Zoowiederkäuern und -equiden mit Mebendazol. Zool. Gart. N. F. Jena 46, 401-416. FOURIE, L. J., S. VRAHIMIS, I. G. HORAK, H. J. TERBLANCHE u. O. B. KOK (1991): Ecto- and endoparasites of introduced gemsbok in the Orange Free State. S. Afr. Tydskr. Natuurnav. 21 (3), 82-87. FRANK, W. (1963): Zur Kenntnis von Monodontella giraffae Yorke und Marplestone 1926 (Nematodes, Ancylostomatidae), einem Parasiten der Gallengänge von Giraffen und Okapis (Mammalia, Giraffidae). 2. Beschreibung der Eier, Larven und Adulten. Z. f. Parasitenkunde 23, 181-196. FUKUMOTO, S., T. UCHIDA, M. OHBAYASHI, Y. IKEBE u. S. SASANO (1996): A new host record of Camelostrongylus mentulatus (Nematoda; Trichostrongyloidea) from abomasum of a giraffe at a zoo in Japan. J. Vet. Med. Sci. 58 (12), 1223-1225. FURSTENBURG, D., u. W. VAN HOVEN (1994): Condensed tannin as anti-defoliate agent against browsing by giraffe (Giraffa camelopardalis) in the Kruger National Park. Comp. Biochem. Physiol. 107 A (2), 425-431. GALLIVAN, G. J. , I. K. BARKER, R. M. R. ALVES, J. CULVERWELL u. R. GIRDWOOD (1989): Observations on the lungworm, Pneumostrongylus calcaratus, in impala (Aepyceros melampus) from Swaziland. J. Wildl. Dis. 25 (1), 76-82. Literaturverzeichnis 128 GALLIVAN, G. J., I. K. BARKER, J. CULVERWELL u. R. GIRDWOOD (1996): Prevalence of hepatic helminths and associated pathology in impala (Aepyceros melampus) in Swaziland. J. Wildl. Dis. 32 (1), 137-141. GEORGI, J. R., u. M. E. GEORGI (1990): Helminths in: Parasitology for veterinarians W. B. Saunders Company, Philadelphia 5. Aufl., S. 103-223. GERAGHTY, V., J. MOONEY u. K. PIKE (1982): A study of parasitic infections in mammals and birds at the Dublin Zoological Gardens. Vet. Res. Commun. 5 (1981/1982), 343-348. GIBBONS, L. M. (1972): Kobusinema banagiense sp. nov. a new trichostrongylid nematode from african game animals. J. Helminthol. 46 (3), 213-218. GIBBONS, L. M. (1973): Bigalkenema curvispiculum sp. nov. (Nematoda, Trichostrongylidae) from east african game animals with a redescription of the female of Kobusinema banagiense Gibbons, 1972. J. Helminthol. 47 (3), 303-310. GIBBONS, L. M. (1974): Recent records of nematodes in east african mammals. Helminthol. Abstr. Series A 43 (8), 641-646. GIBBONS, L. M., u. L. F. KHALIL (1977): Longistrongylus curvispiculum (Gibbons, 1973) (Nematoda: Trichostrongylidae) in Oryx tao in England. J. Helminthol. 51, 209-210. GIBBONS, L. M., u. L. F. KHALIL (1980): Some new trichostrongylid nematodes from east african artiodactylids. Systematic Parasitol. 1 (2), 91-104. GIBBS, H. C. (1986): Hypobiosis and the periparturient rise in sheep. Vet Clin. North Am. Food Anim. Pract. 2 (2), 345-353. GOLDBERG, A. (1968): Development and survival on pasture of gastrointestinal nematode parasites of cattle. J. Parasitol. 54 (5) 856-862. Literaturverzeichnis GOLDBERG, A. (1970): Development, migration and survival on pasture of gastrointestinal nematodes of cattle: Summer contamination. Proc. Helminthol. Soc. Washington 37 (2), 166-169. GÖLTENBOTH, R. (1983): Parasitenbekämpfung bei Zootieren im Zoologischen Garten Berlin. Berl. Münch. Tierärztl. Wschr. 96, 214. GÖLTENBOTH, R., u. H.-G. KLÖS (1970): Klinische Erfahrungen bei der Überwachung und Bekämpfung der Endoparasiten der Zootiere im Zoologischen Garten Berlin. Zool. Gart. 39, 91-100. GORDON, H. L., u. H. V. WHITLOCK (1939): A new technique for counting nematode eggs in sheep faeces. J. Counc. Sci. Industr. Res. Anst. 12, 50-52. GRABER, M., J. EUZEBY, P.M. TRONCY u. J. THAL (1973): Nématodes pulmonaires des antilopes d` Afrique centrale. Rev. Elev. Méd. vét. Pays trop. 26 (3): 313-321. GRABER, M., u. J. THAL (1979 a): Trématodes hépato-biliaires de divers ruminants sauvages d` Afrique centrale. Rev. Elev. Méd. vét. Pays trop. 32 (4), 361-369. GRABER, M., u. J. THAL (1979 b): Anoplocéphalides parasites de l` intestin et des canaux biliaires des herbivores sauvages d` Afrique centrale. Rev. Elev. Méd. vét. Pays trop. 32 (4), 371-378. GRÄFNER, G. (1967): Zur Überwinterungsfähigkeit von Larven wirtschaftlich wichtiger Nematoden. Monatsh. Veterinärmed. 22, 446-449. GREGORY, M. W. (1990): Pathology of coccidial infections. in: LONG, P. L. (Hrsg.): Coccidiosis of man and domestic animals. CRC Press, Boca Raton, Florida, S. 235-258. GRIFFITHS, H. J. (1962): Fascioloidiasis of cattle, sheep and deer in Northern Minnesota. J. Am. Vet. Med. Assoc. 140 (4), 342-347. 129 Literaturverzeichnis 130 GROBLER, J. H. (1981): Parasites and mortality of sable Hippotragus niger niger (Harris, 1838) in the Matopos, Zimbabwe. Koedoe 24, 119-123. GRZIMEK, B. (1968): Die Giraffe in: Grzimeks Tierleben XIII, Säugetiere (4) Kindler Verlag AG Zürich, S. 283-295. GRZIMEK, B. (1988): Waldgiraffen in: Grzimeks Enzyklopädie, Säugetiere (4) Kindler Verlag GmbH München, S. 262-265. HALL, S. J. G., u. R. UNDERWOOD (2001): Wild cattle and spiral-horned antelope species. in: The encyclopedia of mammals Vol. II: Primates and large herbivores Andromeda Oxford Ltd., Oxford, S.537-539. HAMMOND, J. A. (1972): Infections with Fasciola spp. in wildlife in Africa. Trop. Anim. Health Prod. 4, 1-13. HEINICHEN, I. G. (1973): Parasitological studies on impala: preliminary report. Jl. S. Afr. vet. Ass. 44 (3), 265-269. HERD, R. P. (1971): The parasitic life cycle of Chabertia ovina (Fabricius, 1788) in sheep. Int. J. f. Parasitol. 1, 189-199. HERTZBERG, H. (1988): Wettereinflüsse auf Entwicklung und Verbreitung dritter Larven von Ostertagia ostertagi und Cooperia oncophora und ihre Bedeutung für die Epizootiologie der Trichostrongylidose erstsömmriger Weiderinder. Hannover, Tierärztl. Hochschule, Diss. HERTZBERG, H., T. SCHNIEDER, F. J. LÖPMEIER u. M. STOYE (1992): The influence of weather and egg contamination on the development of third-stage larvae of Cooperia oncophora on pasture. Int. J. Parasitol. 22 (6), 719-730. HOFMANN, R. R. (1988): Die Wiederkäuerernährungstypen: Ausdruck evolutionärer morphologischer Anpassung und Orientierung für artgerechte Ernährung von Zootieren. Verhandlungsbericht d. Arbeitstagung d. Zootierärzte im deutschsprachigen Raum 8, 13-18. Literaturverzeichnis 131 HOFMANN, R. R., u. D. R. M. STEWART (1972): Grazer or browser: A classification based on the stomach-structure and feeding habits of east african ruminants. Mammalia 36, 226-240. HORAK, I. G. (1978): Parasites of domestic and wild animals in South Africa. X. Helminths in impala. Onderstepoort J. vet. Res. 45, 221-228. HORAK, I. G. (1980): The control of parasites in antelope in small game reserves. Jl. S. Afr. vet. Ass. 51 (1), 17-19. HORAK, I. G. (1981 a): Host specificity and the distribution of the helminth parasites of sheep, cattle, impala and blesbok according to climate. Jl. S. Afr. vet. Ass. 52 (3), 201-206. HORAK, I. G. (1981 b): The seasonal incidence of the major nematode genera recovered from sheep, cattle, impala and blesbok in the Transvaal. Jl. S. Afr. vet. Ass. 52 (3), 213-223. HORAK, I. G., J. BOOMKER, S. A. KINGSLEY u. V. DE VOS (1983): The efficacy of ivermectin against helminth and arthropod parasites of impala. Jl. S. Afr. vet. Ass. 54 (4), 251-253. IPPEN, R., u. D. HENNE (1988): Auswertung der Obduktionsbefunde bei 2000 Artiodactyla. Verh. ber. Int. Symp. Erkr. Zoo- u. Wildtiere 30, 5-24. ISAZA, R., C. H. COURTNEY u. G. V. KOLLIAS (1990): Survey of parasite control programs used in captive wild ruminants. Zoo Biology 9, 385-392. ISAZA, R., C. H. COURTNEY u. F. C. NEAL (1987): Benzimidazole-resistant Haemonchus contortus in roan antelope (Hippotragus equinus). J. Zoo Anim. Med. 18 (2-3), 96-97. JANSSEN, D. L. (1985): Efficacy of fenbendazole for endoparasite control in large herds of nondomestic ruminants. J. Am. Vet. Med. Assoc. 187 (11), 1189-1190. JARRETT, W. F. H. , W. I. M. McINTYRE, F. W. JENNINGS u. W. MULLIGAN (1957): The natural history of parasitic bronchitis with notes on prophylaxis and treatment. Vet. Rec. 69, 1329-1336. Literaturverzeichnis 132 JAYAWICKRAMA, S. D., u. H. C. GIBBS (1967): Studies on ostertagiasis in sheep. Can. Vet. J. 8 (2), 29-38. JEFFCOATE, I.A., G. FISHWICK, K. BAIRDEN, J. ARMOUR u. P. H. HOLMES (1990): Pathophysiology of the periparturient egg rise in sheep: The role of prolactin. Res. Vet. Sci. 48, 295-300. JOOSTE, R. (1987): Internal parasites of wild-life in Zimbabwe: Impala, Aepyceros melampus (Lichtenstein, 1812). Zimbabwe Vet. J. 18 (3-4), 44-55. JORGE, W., S. BUTLER u. K. BENIRSCHKE (1976): Studies on a male eland x kudu hybrid. J. Reprod. Fertil. 46, 13-16. KARIUKI, D. P., R. INJAIRO, W. L. BOYCE, B. T. WELLDE u. S. NGETHE (1989): Parasite survey of eight wild animals in the Ruma National Park. Ann. Trop. Med. Parasitol. 83 (1), 115-118. KATES, K. C. (1950): Survival on pasture of free-living stages of some common gastrointestinal nematodes of sheep. Proc. Helminthol. Soc. Washington 17 (2), 39-58. KEEP, M. E. (1971): Some parasites and pathology of the nyala Tragelaphus angasi and its potential value as a ranch animal. Lammergeyer 13, 45-54. KEYSERLINGK, M. v., K. H. HILLMANN u. R. WILL (1997): Über die Anwendung von Rintal ® bei Wildtieren und Exoten eines Safariparks im Rahmen eines strategischen Prophylaxeprogrammes zur Vermeidung parasitär bedingter Tierverluste. Tierärztl. Umsch. 52, 91-99. KINGS, M. (1999): Untersuchungen zum Endoparasitenbefall bei Wildequiden unter Berücksichtigung der Weideinfestation im Serengeti-Park Hodenhagen und im Wisentgehege Springe. Hannover, Tierärztl. Hochsch., Diss. KNOTTENBELT, M. K. (1990): Causes of mortality in impala (Aepyceros melampus) on 20 game farms in Zimbabwe. Vet. Rec. 127, 282-285. Literaturverzeichnis 133 KOCK, N. D., G. KAMPAMBA, S. MUKARATIRWA u. J. DU TOIT (2002): Disease investigation into free-ranging Kafue lechwe (Kobus leche kafuensis) on the Kafue Flats in Zambia. Vet. Rec. 151, 482-484. KRECEK, R. C., J. BOOMKER, B. L. PENZHORN u. L. SCHEEPERS (1990): Internal parasites of giraffes (Giraffa camelopardalis angolensis) from Etosha National Park, Namibia. J. Wildl. Dis. 26 (3), 395-397. KREIS, H. A. (1952): Helminthologische Untersuchungen in schweizerischen Tierpärken und bei Haustieren. Schweiz. Arch. Tierheilkd. 94, 499-522. LACHOWICZ, J. (1988): Development of Parafasciolopsis fasciolaemorpha Ejsmont, 1932 from eggs derived from sheep. Acta Parasitol. Polonica 33 (3), 169-175. LAHDE, G. (1971): Parasitologische Untersuchungen in einem Zootierbestand - Routinemäßige Überwachung und prophylaktische Maßnahmen. Verh. Ber. Int. Symp. Erkr. Zootiere 13, 139-145. LEVINE, N. D. (1963): Weather, climate and the bionomics of ruminant nematode larvae. Adv. Vet. Sci. 8, 215-261. LOBSIGER, L. (1987): Magen-Darm-Parasitenbefall bei Huftieren im Tierpark Dählhölzli, Bern: Gezielte Bekämpfung aufgrund der kontinuierlichen Erfassung der Eiausscheidung. Bern, Univ., tierärztl. Fak., Diss. LÖSCHER, W., F. R. UNGEMACH u. R. KROKER (2002): Pharmakotherapie bei Haus- und Nutztieren. Parey Buchverlag im Blackwell Verlag GmbH, Berlin, Wien, 5. Aufl. . LYON, D. G. (1971): A survey of parasitic problems, treatment and control at Chester Zoo. Verh. ber. Int. Symp. Erkr. Zootiere 13, 147-151. LYON, D. G. (1974): Some ruminant diseases encountered at the North of England Zoological Gardens, Chester. Verh. ber. Int. Symp. Erkr. Zootiere 15, 5-13. Literaturverzeichnis 134 MALOIY, G. M. O. (1973): Water metabolism of East African ruminants in arid and semi-arid regions. Z. Tierz. Züchtungsbiol. 90, 219-228. MANZ, D., u. W. DINGELDEIN (1974): Untersuchungen zur anthelminthischen Wirkung des Medikaments Banminth bei europäischen und exotischen Pflanzenfressern. Prakt. Tierarzt 8, 422-425. MARES, R. C., L. AMARAL u. L. C. FACHADA (1984): Helminth parasites of game in Transkei. Jl. S. Afr. vet. Ass. 55 (2), 73-74. MATERN, B., u. G. KLÖPPEL (1995): Giraffe und Okapi in: GÖLTENBOTH, R. u. H. G. KLÖS (Hrsg.): Krankheiten der Zoo- und Wildtiere Blackwell Wissenschafts-Verlag, Berlin, S. 284-299. McKENNA, P.B. (1973): The significance of inhibition in the parasitic development of abomasal nematodes in New Zealand Sheep. N. Z. Vet. J. 21, 98-102. MEESER, M. J. N. (1952): A preliminary survey of the endo- and ectoparasites of the impala - Aepyceros melampus. J. S. Afr. Vet. Med. Assoc. 23 (4), 221-223. MEISTER, V., K. ROBIN, H. KIPFER, L. LOBSIGER, M. HENZI, M. FOLLY u. K. PFISTER (1989): Langzeitkonzept zur Endoparasitenprophylaxe im Tierpark: Ergebnisse einer fünfjährigen Studie bei Huftieren. Verh. Ber. Int. Symp. Erkr. Zootiere 31, 403-408. MEISTER, V., K. ROBIN, M. MÜLLER u. K. PFISTER (1993): Endoparasiten-Prophylaxe bei Huftieren in Gehegehaltung: Erfahrungen mit einem Pilotprojekt im Tierpark Dählhölzli Bern. Schweiz. Arch. Tierheilkd. 135, 165-171. MELBOURNE, C. P. (1978): Observations on the treatment of endoparasites of giraffes at Longleat Safari Park. J. Zoo An. Med. 9, 146-148. MICHEL, J. F. (1974): Arrested development of nematodes and some related phenomena. Adv. Parasitol. 12, 279-366. Literaturverzeichnis 135 MIKOLON, A. B., W. M. BOYCE, J. L. ALLEN, I. A. GARDNER u. L. F. ELLIOT (1994): Epidemiology and control of nematode parasites in a collection of captive exotic ungulates. J. Zoo Wildl. Med. 25 (4), 500-510. MOSKWA, B. (1988): Parasitological and hematological studies on experimental infection of Parafasciolopsis fasciolaemorpha in sheep. Acta Parasitol. Polonica 33 (3), 199-208. MOUCHA, P. (1981): Review of parasites of animals in Zoological Garden of Dvůr Králové nad Labem, 1978-1980. Verh. ber. Erkrg. Zootiere 23, 147-150. MOUCHA, P., u. V. MIKULICA (1982): Dictyocaulus viviparus in Rotschild`s giraffe (Giraffa camelopardalis rotschildi). Verh. ber. XXIV. Int. Symp. Erkr. Zootiere (1984), 353-356. MOULTON, J. E., u. R. SACHS (1970): Verminous pneumonia in east african antelopes. J. Comp. Pathol. 80, 169-173. MURRAY, M. G. (2001): Grazing antelope species in: The encyclopedia of mammals Vol. II: Primates and large herbivores Andromeda Oxford Ltd., Oxford, S.554-555. NEUNHOEFFER, I. (1965): Untersuchungen über den Wurmbefall bei Einhufern und Wiederkäuern der "Wilhelma" in Stuttgart- Bad Cannstatt unter besonderer Berücksichtigung der jahreszeitlichen Schwankungen in der Zahl der ausgeschiedenen Wurmeier und -larven. München, Univ., tierärztl. Fak., Diss. NGATHIA, T. A., P. G. MBUTHIA, R. M. WARUIRU, S. M. NJIRO, P.W. KANYARI, W. K. MUNYUA, H. E. WEDA u. J. W. NGOTHO (1998): Verminous pneumonia and other microscopic lung lesions in wild animals in Kenya. Bull. Anim. Health Prod. Afr. 46, 153-155. NICKEL, S. (1971): Betrachtungen zur Parasitenbekämpfung bei Zootieren. Verh. Ber. Int. Symp. Erkr. Zootiere 13, 133-138. NICKEL, S., u. D. SCHWARZ (1974): Vorschlag für eine planmäßige Helminthenkontrolle am Beispiel des Zoologischen Gartens Rostock. Verh. Ber. Int. Symp. Erkr. Zootiere 15, 317-322. Literaturverzeichnis 136 OAKLEY, G. A. (1979): Survival of Dictyocaulus viviparus infection on pasture. Vet. Rec. 104, 530-531. OCAIDO, M., SIEFERT, L. u. S. K. ARUO (1996): Muellerius capillaris infection in impala (Aepyceros melampus) in Lake Mburo Area in Mbarara District in western Uganda. Bull. Anim. Health Prod. Afr. 44, 259-262. ORTLEPP, R. J. (1962): Lungworms from South African antelopes. Onderstepoort J. vet. Res. 29 (2), 173-181. ORTLEPP, R. J. (1964): Haemonchus krugeri sp. nov. (Nematoda: Trichostrongylidae) from an impala (Aepyceros melampus). Onderstepoort J. vet. Res. 31 (1), 53-58. O`SULLIVAN, B. M., u. A. D. DONALD (1970): A field study of nematode parasite populations in the lactating ewe. Parasitol. 61, 301-315. PELLEW, R. A. (2001): Giraffe and Okapi in: The encyclopedia of mammals Vol. II: Primates and large herbivores Andromeda Oxford Ltd., Oxford, S.520-526. PETZSCH, H., u. R. PIECHOCKI (1992): Giraffen; Antilopen in: Urania Tierreich Leipzig; Jena; Berlin: Urania-Verlag, S.461-463; S.467-487. PITCHFORD, R. J., P. S. VISSER, U. DE V. PIENAAR u. E. YOUNG (1974): Further observations on Schistosoma mattheei, Veglia & Le Roux, 1929, in the Kruger National Park. Jl. S. Afr. vet. Ass. 45 (3), 211-218. PITCHFORD, R. J., P. S. VISSER, J. F. DU TOIT, U. DE V. PIENAAR u. E. YOUNG (1973): Observation on the ecology of Schistosoma mattheei Veglia & Le Roux, 1929, in portion of the Kruger National Park and surrounding area using a new quantitative technique for egg output. Jl. S. Afr. vet. Ass. 44 (4), 405-420. Literaturverzeichnis 137 PLETCHER, J. M. , I. G. HORAK, V. DE VOS u. J. BOOMKER (1988): Hepatic lesions associated with Cooperioides hepaticae (Nematoda: Trichostrongylidea) infection in impala (Aepyceros melampus) of the Kruger National Park. J. Wildl. Dis. 24 (4), 650-655. PRICE, E. W. (1953): The fluke situation in american ruminants. J. Parasitol. 39 (2), 119-134. PULLAN, N. B., M. J. BURRIDGE, H. W. REID, R. W. SUTHERST u. E. B. WAIN (1971): Some helminths of bushbuck, waterbuck, and sitatunga in Busoga District, Uganda. Bull. epizoot. Dis. Afr. 19, 123-125. RAETHEL, H.-S. (1958): Tierverluste in Zoologischen Gärten, ihre Ursachen und Maßnahmen zu ihrer Verhütung. Monatsh. Veterinärmed. 13, 295-300. RATHMANN, E. (1968): Untersuchungen über den Endoparasitenbefall bei Boviden im Tierpark Berlin unter Berücksichtigung der Haltungsbedingungen. Berlin, Humboldt Univ., tierärztl. Fak., Diss. RICCI-BITTI, G., S. PAMPIGLIONE u. M. KABALA (1973): On some coccidia of Kobus defassa Ruppel, 1835, in Zaïre. J. Wildl. Dis. 9, 274-281. ROBERTS, J. A. (1993): Toxocara vitulorum in ruminants. Helminthol. Abstr. 62 (4), 151-174. RODE, B., u. R. J. JØRGENSEN (1989): Baermannization of Dictyocaulus spp. from faeces of cattle, sheep and donkeys. Vet. Parasitol. 30, 205-211. ROMMEL, M. (2000): Protozoeninfektionen der Wiederkäuer - Eimeriose in: ROMMEL, M., J. ECKERT, E. KUTZER, W. KÖRTING u. T. SCHNIEDER (Hrsg.): Veterinärmedizinische Parasitologie Parey Buchverlag im Blackwell Wissenschafts-Verlag, Berlin und Wien, 5. Aufl., S. 133-144. ROSE, J. H. (1956): The bionomics of the free-living larvae of Dictyocaulus viviparus. J. Comp. Pathol. 66, 228-240. Literaturverzeichnis ROSE, J. H. (1975): The significance of Nematodirus helvetianus eggs which have survived on a pasture throughout the winter in the transmission of infection to calves. Res. Vet. Sci. 18, 175-177. ROTH, H. H. (1962): Die parasitologische Überwachung der Zootiere. Kleintierp. 7, 125-130. ROTH, H. H. (1968): Das Helminthenvorkommen in Säugetieren Zoologischer Gärten und seine Abhängigkeit von ökologischen Faktoren. Zool. Beitrag 14, 61-123. RÜEDI, D. (1984): Anwendung von Droncit ® bei Zoo- und Wildtieren. Verh. ber. d. Arbeitstagung d. Zootierärzte i. deutschspr. Raum 4, 92-93. SAAD, M.D., K. A. EL MUBARAK u. K. S. EL BADARI (1983): Endoparasites in wild animals at Khartoum Zoo. Bull. Anim. Hlth. Prod. Afr. (1983) 31, 9-15. SACHS, R., L. M. GIBBONS u. M. F. LWENO (1973): Species of Haemonchus from domestic and wild ruminants in Tanzania, East Africa, including a description of H. dinniki n. sp. Z. Tropenmed. Parasitol. 24, 467-475. SACHS, R., u. C. SACHS (1968): A survey of parasitic infestation of wild herbivores in the Serengeti region in northern Tanzania and the Lake Rukwa region in southern Tanzania. Bull. epizoot. Dis. Afr. 16, 455-472. SALISBURY, J. R., u. J. H. ARUNDEL (1970): The relationship between lactation and post-parturient rise in faecal nematode egg counts of ewes. Austr. Vet. J. 46, 267-271. SAMIZADEH-YAZD, A., u. A. C. TODD (1979): Observations on the pathogenic effects of Nematodirus helvetianus in dairy calves. Am. J. Vet. Res. 40 (1), 48-51. SCHÄTZLE, M. (1964): Koprologische Untersuchungen bei Wiederkäuern im Münchner Tierpark Hellabrunn unter besonderer Berücksichtigung der jahreszeitlichen Schwankungen in der Wurmei- und Wurmlarvenausscheidung. München, Univ., tierärztl. Fak., Diss. 138 Literaturverzeichnis 139 SCHEEL, G. (1967): Ein Beitrag zur Therapie des Endoparasitenbefalles einiger Zoowiederkäuer und -equiden. München, Univ., tierärztl. Fak., Diss. SCHMIDT, U. (1971): Parasitologische Kotuntersuchung durch ein neues Verdünnungsverfahren. Tierärztl. Umsch. 26, 229-230. SCHMITZ, S. (1988): Paarhufer in: Grzimeks Enzyklopädie, Säugetiere (4) Kindler Verlag GmbH München, S. 1-2. SCHNEIDER, G. (1966): Koprologische Untersuchungen auf Endoparasiten bei einer Antilopen- und einer Zebragruppe des Tierparks Berlin zwecks Prüfung der Wirksamkeit durchgeführter prophylaktischer Maßnahmen. Berlin, Humboldt Univ., tierärztl. Fak., Diss. SCHNIEDER, T. (2000): Helminthosen der Wiederkäuer in: ROMMEL, M., J. ECKERT, E. KUTZER, W. KÖRTING u. T. SCHNIEDER (Hrsg.): Veterinärmedizinische Parasitologie Parey Buchverlag im Blackwell Wissenschafts-Verlag, Berlin und Wien, 5. Aufl., S. 192-295. SCHNIEDER, T., A. BELLMER u. F.-J. KAUP (1989): Neuere Erkenntnisse zur Ätiologie, Pathogenese und Bekämpfung der Dictyocaulose. Wien. Tierärztl. Monatsschr. 76, 372-376. SCHOTT, G. (1960): Koprologische Untersuchungen auf Darmnematoden bei Tieren des Zoologischen Gartens Berlin. Berl. Münch. tierärztl. Wochenschr. 73, 165-166. SCHULZE, W. (1956): Tierärztliche Betrachtungen zur Tiergartenhygiene. Dtsch. tierärztl. Wschr. 63, 97-99. SCHUSTER, R. (1998): Epidemiologie der Monieziose des Schafes. Prakt. Tierarzt 79 (4), 357-363. SEWELL, M. M. H. (1966): The pathogenesis of fascioliasis. Vet. Rec. 78 (3), 98-105. Literaturverzeichnis 140 SIEVERS-PREKEHR, G. H. C. (1973): Methode zur Gewinnung von 3. Strongylidenlarven aus dem Weidegras. Hannover, Tierärztl. Hochsch., Diss. SINCLAIR, T., S. HEDGES u. R. A. KOCK (2001): Wild cattle and spiral-horned antelopes. in: The encyclopedia of mammals Vol. II: Primates and large herbivores, Andromeda Oxford Ltd., Oxford, S.530-536. SOSNOWSKI, A., u. E. ZUCHOWSKA (1981): Beitrag zum Nematodenbefall bei Zootieren. Verh. Ber. Int. Symp. Erkr. Zootiere 23, 193-195. STAFFORD, K. J. (1991): A review of diseases of parasites of the Kafue lechwe (Kobus leche kafuensis). J. Wildl. Dis. 27 (4), 661-667. STEGER, G. (1978): Untersuchungsbefunde bei nicht domestizierten Huftieren 1939-1977. Intern. Symp. Diseases Zoo Anim., Dvur Králové, 9-19. STOYE, M. (1965): Untersuchungen über den Infektionsweg von Bunostomum trigonocephalum Rudolphi 1808 (Ancylostomatidae) beim Schaf. Z. f. Parasitenkunde 25, 526-537. SUPPERER, R. (1973): Parasitosen der Kälber. Tierärztl. Prax. 1, 403-412. SUPPERER, R., u. H. PFEIFFER (1965): Untersuchungen über die Gattung Strongyloides V. Die Entwicklungsphase im Freien. Wien. Tierärztl. Monatsschr. 52, 9-16. TAYLOR, C. R. (1968): Hygroscopic food: a source of water for desert antelopes ? Nature 219, 181-182. TAYLOR, M. A., u. J. CATCHPOLE (1994): Coccidiosis in domestic ruminants. Appl. Parasitol. 35, 73-86. THENIUS, E. (1988): Paarhufer - Stammesgeschichte in: Grzimeks Enzyklopädie, Säugetiere (4) Kindler Verlag GmbH München, S. 4-15. Literaturverzeichnis THOMAS, R. J., u. D. A. ALI (1983): The effect of Haemonchus contortus infection on the pregnant and lactating ewe. Int. J. f. Parasitol. 13 (4), 393-398. TRONCY, P. M., u. M. GRABER (1973): Ostertagia thalae n. sp., parasite d` antilopes d` Afrique Centrale. Rév. Elev. Méd. vét. Pays trop. 26 (2), 221-224. TSCHERNER, W. (1973): Kokzidien bei Wiederkäuern im Tierpark Berlin. Verh. ber. Int. Symp. Erkr. Zootiere (1974) 15, 103-111. TSCHERNER, W. (1978): Koprologische Untersuchungen bei Huftieren des Tierparks Berlin. Proc. XX. Internat. Symp. Diseases Zoo Anim., Dvur Králové, 137-143. URQUHART, G. M., J. ARMOUR, J. L. DUNCAN, A. M. DUNN u. F. W. JENNINGS (1987): Veterinary helminthology. in: Veterinary parasitology Longman Scientific & Technical, UK, S. 3 - 136. VARADHARAJAN, A., u. C. PYTHAL (1999): A preliminary investigation on the parasites of wild animals at the zoological garden, Thiruvananthapuram, Kerala. Zoos` Print Journal Vol. I - XIV (Nr. 3-12), 159-164. WALTHER, F. (1968): Die Hornträger in: Grzimeks Tierleben XIII, Säugetiere (4) Kindler Verlag AG Zürich, S. 301-492. WALTHER, F. (1988): Hornträger in: Grzimeks Enzyklopädie, Säugetiere (4) Kindler Verlag GmbH München, S. 290-461. WARUIRU, R. M., P. G. MBUTHIA, S. M. NJIRO, T. A. NGATIA, E. H. WEDA, J. W. NGOTHO, P. N. KANYARI u. W. K. MUNYUA (1995): Prevalence of gastrointestinal parasites and lungworms in wild and domestic ruminants in a game ranching farm in Kenya. Bull. Anim. Health Prod. Afr. 43, 253-259. WESCOTT, R. B., u. W. J. FOREYT (1986): Epidemiology and control of trematodes in small ruminants. Vet. Clin. North Am. Food Anim. Pract. 2 (2), 373-381. WILLIAMS, J.C., u. F. R. BILKOVICH (1971): Development and survival of infective larvae of the cattle nematode Ostertagia ostertagi. J. Parasitol. 57 (2), 327-338. 141 Literaturverzeichnis 142 WILLIAMS, J.C., u. R. L. MAYHEW (1967): Survival of infective larvae of the cattle nematodes Cooperia punctata, Trichostrongylus axei and Oesophagostomum radiatum. Am. J. Vet. Res. 28 (124), 629-640. YOUNG, E., u. P. A. BASSON (1976): Cordophilosis and fatal gastro-intestinal verminosis in eland. Jl. S. Afr. vet. Ass.47 (1), 57. YOUNG, K.E. , J. M. JENSEN, T. M. CRAIG (2000): Evaluation of anthelminthic activity in captive wild ruminants by fecal egg reduction tests and a larval development assay. J. Zoo Wildl. Med. 31 (3), 348-352. ZIEGER, U., J. BOOMKER, A. E. CAULDWELL u. I. G. HORAK (1998): Helminths and bot fly larvae of wild ungulates on a game ranch in Central Province, Zambia. Onderstepoort J. vet. Res. 65, 137-141. ZUCHOWSKA, E. (1988): Helminthosen bei Zoowiederkäuern. Verh. ber. Erkr. Zootiere 30, 171-172. ZUCHOWSKA, E. (1997): Trichurosis bei Säugetieren im Zoo. Verh. Ber. Erkr. Zootiere 38, 367-369. Tabellenanhang 143 8. Tabellenanhang In den folgenden Tabellen werden die wichtigsten Endoparasiten der Wiederkäuer, die mit den verwendeten Verfahren nachweisbar sind, kurz vorgestellt. (L I, II,III, IV bzw. V = Larvenstadien 1 bis 5). Die in den Tabellen hinter den zitierten Informationen angegebenen Zahlen in Klammern entsprechen den Nummern der folgenden Literaturtabelle: Tab. 18: Literaturliste Nr. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 Autor ARMOUR et al. BHATT et al. BREMNER et al. CHAKRABORTY DRUDGE et al. ECKERT et al. EYSKER GEORGI u. GEORGI GREGORY GRIFFITHS HERD JARRETT et al. JAYAWICKRAMA u. GIBBS LACHOWICZ MOSKWA PRICE ROBERTS ROMMEL SAMIZADEH-YAZD u. TODD SCHNIEDER SCHNIEDER et al. SCHUSTER SEWELL STOYE SUPPERER TAYLOR u. CATCHPOLE THOMAS u. ALI URQUHART et al. WESCOTT u. FOREYT ZUCHOWSKA Jahr 1988 1969 1976 1992 1955 2000 1980 1990 1990 1962 1971 1957 1967 1988 1988 1953 1993 2000 1979 2000 1989 1998 1966 1965 1973 1994 1983 1987 1986 1997 Tabellenanhang 144 Tab. 19: Protozoen und Trematoden PROTOZOEN Eimeria spp. - zahlreiche Arten Entwicklung: - Wirt nimmt sporulierte Oozyste auf => je 8 Sporozoiten werden freigesetzt => penetrieren Dünndarmschleimhaut => 1-2 ungeschlechtliche Vermehrungen => aus Schizonten werden Merozoiten freigesetzt => bilden Gamonten (26) => reifen zu ♀ u. ♂ Gameten heran => Befruchtung => Oozysten werden in Außenwelt freigesetzt => sporulieren => 4 Sporozysten mit je 2 Sporozoiten (6) Präpatenz: je nach Art 7- 35 Tage (18); Pathogenese: - befallen je nach Art v.a.Dünndarm oder Dickdarm; Dickdarm wird schneller stärker geschädigt (9) -Resistenzentwicklung infolge aktiver Immunantwort; kann aber durch schädigende Einflüsse auf den Wirt verschlechtert werden (25) Symptome: - je nach Eimeria-Spezies: von unblutigen wenige Tage dauernden Durchfällen bis zu blutigen Durchfällen mit Darmschleimhautverlust, Dehydration, Gewichtsabnahme; Todesfälle möglich (25) -klinische Eimeriosen bei Lämmern meist im Alter von 4 –7 Wochen (18) -bei Rindern in der Regel im Alter bis zu 1,5 Jahre (25) TREMATODEN Fasciola hepatica Entwicklung: adulte Leberegel in Gallengängen => Eier mit Kot in Außenwelt => Mirazidium schlüpft => bewegt sich aktiv / sucht u. dringt in Zwischenwirt: Schnecke (Lymnea sp.) ein =>Sporozyste => Redien => Zerkarien=> aus Schnecke in Außenwelt auf Vegetation => Metazerkarien => infizieren Wirt; (29) Schneckenzyklus dauert 2-3 Monate; => im Wirt: unreife Egel penetrieren Darm => wandern (durch Peritonäalhöhle zur Leber, durch Parenchym zu Gallengängen => reifen und setzen Eier frei (20 /29) Präpatenz: mind. 56 –65 Tage (20) Pathogenese: -Zerstörung von Leberparenchym auf der Wanderung => nach 7 Wochen in Gallengängen Immunantwort des Wirtes => Leberfibrose und Verkalkung der Gallengänge b. Rind => führt zur Abstoßung der Egel (nicht so beim kleinen Wiederkäuer) (16/20/29) Symptome: - (sub)akut (durch Wanderung unreifer Egel): plötzliche Todesfälle möglich; chronisch (durch reife Egel in den Gallengängen): Anämie, Ödeme, Leistungsminderung (20 /29) Fasciola gigantica -kommt vor in Afrika, Asien u. am östlichen Mittelmeer; Entw. /Pathog. ähneln F. hepatica (20 /23) Fascioloides magna - in Amerika und Europa bei Elch und Reh; in diesen relativ ungefährlich(29) -schmarotzt in versch. Organen (20) - führen in Rind, Schaf, Ziege nicht zu patenten Infektionen, aber v.a. bei Schaf u. Ziege zu Todesfällen , da sie ziellos durch das Leberparenchym wandern und dieses zerstören (10 /29) Parafasciolopsis fasciolaemorpha - ursprünglich in Osteuropa, v.a. beim Elch, aber auch b. Schaf u.a. (20) - Zwischenwirt: Posthornschnecke (Planorbarius corneus) (14) Präpatenz: bei Schafen 28-35 Tage; Pathogenese: -schmarotzt im Duodenum und in den Gallengängen, vereinzelt in Gallenblase u. Pankreas (15) Symptome: Apathie, herabgesetzte Vormagentätigkeit, Bauchschmerz, trockener Kot; Todesfälle möglich(20) Dicrocoelium dendriticum Entwicklung: - Eier werden von Landlungenschnecken gefressen=> Entw. bis zu Zerkarien dauert 4 Monate => in Außenwelt von Ameisen gefressen=> Verhaltensänderung: Ameisen beißen sich abends an Gräsern fest u. können von Endwirten aufgenommen werden => wandern vom Darm über d. Ductus choledochus in die Gallengänge; Präpatenz: ca. 7 Wochen (20) Pathogenese: es kann zu nichteitrigen Cholangitiden, Cholangiektasien, später Leberfibrose kommen; lebenslang keine Immunität (16) Symptome: Leistungsminderung, nur bei sehr hohem Befall (>15000 Exemplare)Todesfälle möglich (20) Paramphistomum sp. (weitere Gattungen weltweit: Cotylophoron sp., Calicophoron sp.) Entwicklung: - über Schnecken als Zwischenwirte, z.B. Planorbis sp. o. Lymnea sp.; Entw. i. d. Schnecke: 110 Tage; => nach Freisetzung: Metazerkarien bis 5 Monate lebensfähig => werden von Endwirten aufgenommen =>Jungegel heften sich an Duodenumschleimhaut => wandern in 1,5 Monaten zurück zum Pansen. Präpatenz: 3 – 3,5 Monate Pathogenese: Jungegel verursachen Duodenitis und Abomasitis; Adulte führen zu Veränderungen des Pansenepithels (20) Symptome: nur in der intestinalen Phase bei > 20000 Jungegeln => hgr. Durchfall, gestörte Futteraufnahme, kann zu Abmagerung führen. (16 /20) Schistosoma sp. - v.a. in Afrika, auch am Mittelmeer; Entw.: Zwischenwirt: aquatische Schnecken => Zerkarien dringen aus d. Wasser perkutan in Endwirte ein; leben paarweise in Venen => Eier mit Mirazidien => proteolyt. Enzyme bahnen Weg in Hohlorgan, z.B. Darm Pathog./Sympt.: u.a. hämorrhagische Enteritis => evtl. Todesfälle; o. chron. Leberform =>Anämie, Kachexie (20) Tabellenanhang 145 Tab. 20: Cestoden und Nematoden CESTODEN Moniezia sp. Entwicklung: Zwischenwirt: Moosmilbe nimmt Proglottiden mit Eiern aus Kot auf => in Milbe: nach 3 Monaten: Zystizerkoid (20); hohe Tenazität der Eier / hohe Lebenserwartung d. Milben => Weidekontamination hält bis zu 2 Jahre an (22); => Endwirt nimmt Milbe auf =>in Duodenum werden Finnen frei => nach Präpatenz von 30-52 Tagen => geschlechtsreife Bandwürmer Pathog.: evtl. katarrh. Enteritis, meist wenig Schädigung, Symptome: oft klin. inapparent, evtl. abwechselnd Diarrhöe / Obstipation (20); v.a. Jungtiererkrankung (22) NEMATODEN dungsreaktion => Obstruktion d. Atemwege =>Atelektasen (21); Bronchitiden; Bronchopneumonien => Husten, verschärfte Atmung etc. (7) Dict. viviparus: Adulte leben 1 Monat, => Elimination u. Heilung d. meisten Tiere (20); Verlauf ist von Anzahl der aufgenommenen Larven abhängig (12);ohne Reinfektion Immunität für 1 Jahr;Dict. filaria: Larvenausscheidung kann viele Monate anhalten; Immunität: nur teilweise (nicht gegen patente Inf.), aber langanhaltend (20) Toxocara vitulorum: Entw.: Adulte ♀ leben im Dünndarmlumen => 3-8 Millionen Eier / Tag => Kot => bei 18-20 °C in 30-40 T.=> infekt. LIII im Ei (20) =>hohe Tenazität (17); Eier überleben bis 2 Jahre => orale Aufnahme durch Wirt => führen nur bei Rd. > 6 Monate zur Infektion => Larven schlüpfen im Dünndarm => Leber (=>L II) =>Lunge => gr. Blutkreislauf => versch . Organe => gegen Ende d. Trächtigkeit ins Euter => galaktogene Inf. (17) d. Kälber bis 30.Tag post partum (wahrschl. auch Protostrongyliden pränatal) => im Dünndarm rasch Entw.: Zwischenwirt: terrestrische Nackt- oder Gehäuseschnecken => L I geschlechtsreif (20/25); Präpatenz: Rd. ca. 4 Wochen, gelegentl. nur 12 bohren sich in Schneckenfuß=> 2 Häutungen =>L III (im Sommer inner- Tage (wahrschl. nach pränatal. Inf.); Kalb: höchste Eiausscheidung im 2. halb von 2 Wochen); können in Lebensmonat, ab 6 Monate kaum Schnecke überwintern => orale Aufnoch; Kuh: kann 1x infiziert. über 3 nahme durch Endwirt (z.T. mit Dictyocaulus sp. Laktationen Larven ausscheiden; Schnecke); => Dickdarmbereich => Entw.: Adulte ♀ in Bronchien legen Pathog.: Kalb: Nahrungsentzug / tox. Mesenteriallymphknoten => L IV=> embryonierte Eier => mit WimpernWirkungen=> selten Dünndarmentz., strom zum Larynx => abgeschluckt => Ductus thoracicus =>Herz=> PulmoVerschluß, Perforation (v.a.b. Büffel); nalarterie =>Lunge: in Brutherden L I schlüpft => Kot => Außenwelt: Sympt.: Kümmern, Anämie, letzte Häutung; in 4-6 Wochen GeHäutungen => L III => orale Inf. des wechselnde Verdaungsstörungen (20), schlechtsreife; Patenz kann Jahre Wirtes => Darm => Blut-Lymphweg oft ohne sichtbare Erscheinungen (25) anhalten. => Lungenlymphknoten => LIV => Capillaria sp. Pathog.: Artverschieden in Größe u. Alveolen =>LV => kl. Bronchien => Lokalisation werden sog. Brutherde u. Entw.: Adulte besiedeln DünndarmAdulte in gr. Bronchien; Präpatenz: schleimhaut; Embryonalentw. dauert Wurmknoten v.a. in d. Lunge (von D. viviparus (Rd.): 21-25 Tage; D. Monate => orale Inf. mit larvenhaltiNeostrongylus auch in Darmwand u. filaria (Schf. /Zg.): 26-35 Tage (20); gem Ei; Leber) gebildet; alte Schafe / Ziegen Pathog./ Sympt.: Zilienbesatz geht zur weiteren Entw. / Pathog. wenig stärker befallen als Jungtiere verloren => Schleim / Partikel bekannt Sympt.: meist klin. inapparent (20) verbleiben in Atemwegen / EntzünSymptome: i. d. R. symptomlos (20) Trichuris sp. Entw.: Eier => auf Weide erst nach 34 Monaten infektiöse L I in d. Eihülle; können mehrere Jahre überleben => orale Aufn. => Larven dringen in Zäkum u. Kolon i. d. Schleimhaut=> =>L III=> L IV; nach 50 T. Präadulte Präpatenz: 53-55 Tage (20); Pathog.: (Prä-)adulte sind subepithelial in Bewegung => katarrh. Typhlocolitis , Schleimabsonderung, Blutungen u. Schleimhautablösung (4); Sympt.: Dehydrierung, Aszites, Ödeme, wässrige bis blutige Diarrhöe (20), symptomlose Verläufe, aber auch Todesfälle möglich (30) Strongyloides papillosus Entw.: im Wirt: nur parasitische ♀=> legen embryonierte Eier i. d. Dünndarmschleimhaut => Kot=> b. 20°C in 4 Tagen => Larven; L I / L II freilebend; LIII infektiös; ein kl. Teil d. Eier entwickelt sich stattdessen zu freilebender Generation mit ♀ u. ♂=> legen schon nach 5 Tagen Eier => L I werden ausnahmslos zu inf. L III;max. 4 Mon. lebensfähig; Inf. perkutan o. galaktogen; L III => Lymphe / Blut =>Herz =>Lunge=> Trachea => Larynx =>Duodenum- / Jejunummukosa L IV / V (20); bei älteren immunen Tieren nicht in Lunge, sondern versch. Org. v.a. Muskulatur, um Geburt: in Euter => 7.-33. T. in Milch; Präpatenz: galaktog. : 6; perkutan 9 Tage; Sympt.: selten, nur Jungtiere (25) Husten, Diarrhöe, Hautveränd. (20) Tabellenanhang 146 Tab. 21: Nematoden (Fortsetzung) Chabertia ovina Entw.: Ei => bei 25 °C in 5- 7 T.=> LIII (20); => Wirt => 1 Wo. in Submukosa des Dünndarms => L IV =>Lumen d. kaudalen Dünndarms u. Zäkums => LV=>v.a. craniales Colon, an Schleimhaut geheftet (11) =>Präpatenz: 42-49 T.; eierlegende Adulte entwickeln sich nur bei schwacher Infektion (einige hundert); bei einigen tausend Larven gehen viele (Prä-)Adulte zugrunde => keine Eiausscheidung; Pathog./ Sympt.: LV / Adulte verdauen Schleimhautpfröpfe => Erosionen, erhöhte Schleimproduktion, lokale Blutungen; ab 250-300 C. ovina klinische Ersch. : Durchfall mit Schleim / Blut, Abmagerung, Anämie (20); Erkr. nach Hypobiose evtl. schon im Winter (7) Oesophagostomum sp. Entw.: Ei => b. 25°C in 5-7 T. =>LIII => Wirt => im Pansen entscheidet => bohren sich in Dünn- oder Dickdarmwand => in kl. Knötchen; => L IV => evtl. monatelange Hypobiose (20 / 7) => bohren sich aus Schleimhaut => siedeln an Schleimhaut; Präpatenz: ca. 45 T.; perkutane Inf. möglich (20); ältere Tiere: bessere Resistenz: mehr Knötchen , aber geringere Wurmbürde (3); Pathog.: Knötchen = Reaktion auf Larven; Schleimhautentz. / im Lumen lebende L IV u. V verdauen Schleimhautpfröpfe; Sympt.: selten Erkr. ; v.a. während Präpatenz; akut: Fieber, Diarrhoe; chron.: Anämie (20) Bunostomum sp. Entw.: Adulte leben angesaugt an Dünndarmschleimhaut => Eier => Kot=> bei 20-25°C in 10-16 T. => L III (20); perkutane Inf. erfolgreicher als perorale ( 24); bei beiden: BlutLungen- Wanderung => LIV => Trachea => Pharynx => Labmagen => Duod. / Jej. => LV v.a. an Schleimhaut des Duodenums ; Präpatenz: Lamm: 7 Wo. ; Kalb: 8 Wo. ; (20) Pathog. / Sympt.: perkutane Einwanderung => allergische Reaktion (2); Lungenpassage => Husten; Ortswechsel der (Prä-)Adulten => Nachblutung => Anämie, lokale Duodenitis, Jejunitis, Kehlgangsödem (20) Nematodirus sp. Entw.: bis L III im Ei (mind. 2 Mon.) N. battus benötigt für Schlupf Kältephase (20 / 8)=> die meisten Eier tragen erst im Folgejahr zum Infektionsrisiko bei (20); N. helvetianus in Kälbern bohrt sich in Darmschleimhaut und untertunnelt sie (19); Präpatenz: N. battus: 15 T. ; N. helvetianus 20-26 T.; Pathog./ Sympt.: N. battus: während Entw. zu LV in 10 -12 T. => im Dünndarm Epithelschäden => katarrh. Duodenitis / Jejunitis mit temporärem Durchfall; Immunität nach 4-7 Wochen möglich => Verminderung d. Wurmbürde (20) N. battus als typ. Lämmerparasit führt auch b. Kälbern zu Todesfällen (1); Haemonchus sp. Entw.: Ei => in 5 T. ( b. Kälte in Wo. bis Monaten) => L III=> orale Inf. d. Wirtes=> Pansen => 2 Häutungen => Adulte bewegen sich frei auf Pansenschleimhautoberfl.; Präpatenz: Schaf: 2-3 Wochen (28); Pathog.: jeder Wurm nimmt ca. 0,05 ml Blut täglich auf (20 / 28); akute Hamonchose: Anämie ca. 2 Wochen nach Inf., seltener perakut: bei bis zu 30.000 Würmern: plötzliche Todesfälle infolge hämorrhag. Gastritis; Sympt.: Anämie, Ödeme , Ascites, dunkler Kot, Wollverlust (28); während d. Laktation infizierte Schafe: Gewichtsverlust und geringere Milchmenge (27) Ostertagia sp. Entw.: Ei => 2 Wo. bei opt. Beding. => L III => orale Inf. => Wirt=> Entw. in Labmagendrüsen => Adulte auf d. Schleimhautoberfläche 18 Tage nach Inf. ; Präpatenz: 3 Wo. ; aber oft Hypobiose bis zu 6 Monate in L IV- Stadium (28); bei stärkeren Infekt. Eiprod. herabgesetzt (overcrowding) (13) Pathog.: v.a. wenn Adulte die Drüsen verlassen => Reduktion d. funktionellen Drüsenmasse => pHWert steigt (von 2 auf bis zu 7); Proteinaufn. verringert; erhöhte Permeabilität, verringerter bakteriostat. Effekt d. Labmagens; Sympt.: Gewichtsverlust, Diarrhöe; Typ I (Sommerostertagiose): Jungtiere in der 1. Weidesaison; Typ II: Jährlinge im Trichostrongylus sp. Entw.: Ei => 1-2 Wo. =>LIII => orale Winter / Frühling nach 1. Weidesaison Inf. =>Wirt; Präpatenz: 2-3 Wo.(28); (nach Hypobiose) (20 / 28); Pathog. /Sympt.: T. axei: LarvalentCooperia sp. wicklung in Tunneln über d. Lamina Entw.: z.B. Cooperia oncophora: propria d. Labmagenschleimhaut => Adulte: ragen ins Lumen der Krypten Präpatenz: 17-22 Tage; andere Arten: 11-18 T.; Entwicklungsstadien liegen o. Drüse=> Verlust von Haupt- u. Belegzellen => Störung d. Labmagen- in den Schleimhautkrypten des Dünndarmes; Pathog.: einzelne Adulte funktion; Durchfall; T.colubriformis, T. vitrinus: besiedeln penetrieren in die Lamina propria => Dünndarm der Schafe; Würmer liegen Epithel teilweise abgeschilfert; Zotten in Tunneln i. d. Zotten=> Zottenatro- verkürzt; Proteinverlust in das Darmphie, Erosionen => Proteinverluste => lumen; Sympt.: Diarrhöe, verminderte Gewichtszunahmen; verringerte Gewichtszunahmen; Durchfall (20); T. axei: geringe Wirts- Cooperiose tritt selten allein auf, meist spezifität: neben Pfd. auch Kaninchen als Begleiterscheinung d. Sommerostertagiose (20) u. Meerschweinchen infizierbar (5) Tabellenanhang 147 zu Kapitel 2.6: Nachweise von Endoparasiten bei den untersuchten Wildwiederkäuerarten im Freiland Tab. 22: Literaturliste Nr. Jahr Autor(en) (1) 1952 MEESER (2) 1962 ORTLEPP (3) 1964 ORTLEPP (4) 1968 BWANGAMOI (5) 1968 DINNIK u. SACHS (6) 1968 SACHS u. SACHS (7) 1970 MOULTON u. SACHS (8) 1971 KEEP (9) 1971 PULLAN et al. (10) 1972 GIBBONS (11) 1972 HAMMOND (12) 1973 GIBBONS (13) 1973 GRABER et al. (14) 1973 HEINICHEN (15) 1973 PITCHFORD et al. (16) 1973 RICCI-BITTI et al. (17) 1973 SACHS et al. (18) 1973 TRONCY u. GRABER (19) 1974 GIBBONS (20) 1974 PITCHFORD et al. (21) 1976 YOUNG u. BASSON (22) 1977 BOOMKER (23) 1978 HORAK (24) 1979 BOOMKER et al. (25) 1979a GRABER u. THAL (26) 1979b GRABER u. THAL (27) 1980 GIBBONS u. KHALIL (28) 1980 HORAK (29) 1981 GROBLER (30) 1981a HORAK (31) 1983 ANDERSON (32) 1984 MARES et al. (33) 1986a BOOMKER (34) 1986b BOOMKER Art und Ort der Untersuchung Sektionen (Impalas); Ost-Transvaal, Südafrika Sektionen (Antilopen); Südafrika Sektionen (Impala); Priv. Wildreservat, Südafr. Sektionen (Haus- u. Wildtiere); Uganda Kotproben / Sektionen (Wildwdk.); Tansania Kotproben / Sektionen (Herbivoren); Tansania Sektionen (Antilopen); Tansania Sektionen (Nyalas); Zululand, Südafrika Sektionen (Antilopen); Uganda Sektionen (Antilopen); Tansania u. Kenia Literaturrecherche: Fasciola spp. in Afrika Sektionen (Antilopen); Tansania u. Kenia Sektionen (Antilopen); Zentralafrik. Republik Sektionen u. Literaturrech.(Impala); Südafrika Kotproben (Wildtiere); Krüger-Park, Südafrika Kotproben (Wasserböcke); Nationalpark, Zaire Sektionen (Haus- u. Wildwdk.); Tansania Sektionen (Antilopen); Zentralafrik. Republik Materialrecherche, (Wildwdk.), Ostafrika Kotproben (Wildtiere); Krüger-Park, Südafrika Sektionen (Elen-Ant.); Nationalpark, Südafrika Überarbeitung der Gattung Impalaia, Südafrika Sektionen (Impalas); Nationalpark, Südafrika Sektionen (Antilopen); Botswana u. Südafrika Sektionen (Wildwdk.); Zentralafrik. Republik Sektionen (Wildwdk.); Anoploceph. spp.; Sektionen (Antilopen); Kenia u. Tansania Sektionen (Antilopen); Wildfarm; Südafrika Sektionen (Rappenant.); Nat.-park, Simbabwe Sektionen u. Literaturrech. (Wdk.); Südafrika Sektionen u. Literaturrech.(Impala); Südafrika Sektionen (Wildtiere); Transkei, Südafrika Sektionen (Nyalas); Natal, Südafrika Sektionen (Antilopen), Nationalpark, Südafrika Tabellenanhang (35) (36) (37) (38) 1986 1987 1988 1989 (39) (40) (41) (42) (43) (44) (45) (46) (47) (48) (49) (50) (51) (52) (53) (54) 1989 1989 1990 1990 1991 1991 1991 1991 1995 1996 1996 1996 1998 1998 2000 2002 148 BOOMKER et al. JOOSTE PLETCHER et al. BOOMKER u. REINECKE GALLIVAN et al. KARIUKI et al. KNOTTENBELT KRECEK et al. BOOMKER BOOMKER et al. FOURIE et al. STAFFORD WARUIRU et al. BOOMKER et al. GALLIVAN et al. OCAIDO et al. NGATIA et al. ZIEGER et al. BOOMKER et al. KOCK et al. Sektionen (Antilopen), Nationalparks, Südafr. Sektionen (Impalas); Simbabwe Sektionen (Impalas); Krüger-Park, Südafrika Sektionen (Antilopen); Südafrika Sektionen (Impalas); Nationalpark, Swasiland Kotproben (Antilopen); Nationalpark, Kenia Sektionen (Impalas); Wildfarmen, Simbabwe Sektionen (Giraffen); Etosha-Park, Namibia Sektionsmaterial (Antilopen); Südafrika Sektionen (Nyalas); Natal; Südafrika Sektionen (Oryx gazella); Südafrika Kotprob. u. Lit.-rech.(Kobus leche); Sambia Kotprob./Sektionen (Haus- u.Wildwdk.), Kenia Sektionen (Nyalas), KwaZulu-Natal, Südafrika Sektionen (Impalas), Swasiland Kotproben / Sektionen (Impalas); Uganda Sektionen (Antilopen); Wildfarm, Kenia Sektionen (Zebra / Antilopen);Sambia Sektionen (Antilopen); Südafrika Sektionen / Kotproben (Kobus leche); Sambia Die Nummern in der folgenden Tabelle entsprechen den Nummern dieser Literaturliste. Tabellenanhang 149 Tabelle Nr. 23: Nachweise von Endoparasiten bei den untersuchten Wildwiederkäuerarten im Freiland. Die Nummern in der folgenden Tabelle entsprechen den Nummern der Literaturliste. Die Reihenfolge entspricht der Systematik in Kapitel 2.1 . Giraffe Protozoen: Eimeria congolensis Eimeria katangensis Eimeria kobi Eimeria spp. Trematoden: Schistosoma leiperi Schistosoma margrebowiei Schistosoma mattheei Schistosoma sp. Fasciola gigantica Fasciola hepatica Fasciola sp. Leberegel (keine Artangabe) Paramphistomum cervi Paramphistomum cotylophorum Paramphistomum microbothrium Paramphistomum sp. Calicophoron calicophorum Calicophoron phillerouxi Calicophoron sp. Cotylophoron cotylophorum Cotylophoron fuelleborni Cotylophoron jacksoni Cotylophoron sp. Pansenegel (keine Gattungsang.) Cestoden: Moniezia benedeni Elenantilope Nyala Oryxantilope Rappenantilope Pferdeantilope EllipsenWasserbock 47 2,15 11 20,44 2,15 11 DefassaWasserbock LitschiMoorantilope 16 16 16 16 54 11,25,52 46 46 46 52 46,52 2,15 25 32 Impala 2,3,15,31 31 23,30,31, 36,41,49 11 6 46,54 40 40 4 31 8 44 8 29 35 52 4 8 54 46 52 4 52 46 14,23 3,31,36 36 52 31 48 48 6 26,52 6 48 6 30,31,36, 52 Tabellenanhang 150 Giraffe Elenantilope Nyala Oryxantilope Rappenantilope Pferdeantilope EllipsenWasserbock DefassaWasserbock LitschiMoorantilope Moniezia expansa 1,23,30,31 ,36 Moniezia monardi Moniezia sp. Avitellina buechneri Avitellina centripunctata Avitellina sandgroundi Avitellina sp. Stilesia globipunctata Stilesia hepatica 26 33 26 31,36 32 26 26 35 6 26 26,52 1,3,14,30, 31,36,49, 52 6 31,36 6 48 Strongyloides sp. Oesophagostomum columbianum Agriostomum equidentatum Agriostomum gorgonis 26 45 26 26 Stilesia sp. Thysaniezia giardi Nematoden: Strongyloides papillosus Oesophagostomum lechwei Oesophagostomum sp. Monodontella giraffae Bunostomum cobi Bunostomum dentatum Bunostomum trigonocephalum Bunostomum sp. Gaigeria pachyscelis Impala 35,45 28,30,31, 36 23,31 1,3,23,28, 30,31,36 40 35 9 46 52 44 45 29 6,35 46 9 46 30,36 19,31 1,3,14,30, 31,52 35,45 47 36,47 Tabellenanhang 151 Giraffe Elenantilope Haemonchus bedfordi 17 Haemonchus contortus Haemonchus dinniki Haemonchus krugeri Haemonchus mitchelli Haemonchus placei Haemonchus vegliai Haemonchus sp. Ostertagia angusdunni Ostertagia harrisi Ostertagia ostertagi Ostertagia thalae Ostertagia trifurcata Ostertagia sp. Bigalkenema curvispiculum Longistrongylus curvispiculum Longistrongylus meyeri Longistrongylus sabie Oryxantilope Rappenantilope 32 35,45,47 17 17 4,47,52 32,35,45, 47 17,42 17,47,53 45,47 17 21 27 Nyala 35,44,48 8 EllipsenWasserbock 35 17 29 DefassaWasserbock 17 LitschiMoorantilope 46 17 52 Impala 1,14,17,30 ,31,36,48 1,3,17,31, 36,47,52 17,31 3,31,36 19,31,36 23,28,30, 31 31,36 35 8,44 53 18 8 3,14,31 12 53 35 45 Longistrongylus sp. Kobusinema banagiense Trichostrongylus auriculatus Trichostrongylus axei 19,31 1,3,23,28, 30,31,36 35 10 34 45 Trichostrongylus colubriformis 19,47 Trichostrongylus deflexus Trichostrongylus falculatus 38 Trichostrongylus minor Trichostrongylus pietersei Trichostrongylus rugatus 35,45 Pferdeantilope 10,31 47 44,48 44,48 53 45,53 53 53 38 14,19,23, 28,30,31 1,14,23,28 ,30,31,36 38 23,28,30, 31,36 19,31 Tabellenanhang 152 Giraffe Elenantilope Trichostrongylus thomasi Trichostrongylus sp. Cooperia connochaeti 44 Cooperia curticei Cooperia fuelleborni Cooperia hungi Cooperia neitzi Cooperia pectinata Cooperia punctata Cooperia rotundispiculum Cooperia verrucosa Cooperia yoshidai Cooperia sp. Paracooperia horaki Paracooperia serrata Paracooperia sp. Impalaia nudicollis Impalaia taurotragi Impalaia tuberculata Impalaia sp. Camelostrongylus harrisi Camelostrongylus sp. Gazellostrongylus leroux Cooperioides hamiltoni Cooperioides hepaticae Cooperioides sp. Nyala Oryxantilope Rappenantilope Pferdeantilope EllipsenWasserbock DefassaWasserbock LitschiMoorantilope 53 35 3,31 46 19 19 48 Impala 19,45 19,45 35 35 9 24,28,30, 47 36 3,30,31,36 1,3,23, 28, 30,31,36 45 43,52,53 43,44,48 35 33,44,48 19,22 22 22 47 43 45 35,45 35 35 35,45 19,45 19,35 22 44,48 45 44 48 48 35 47 22 35 36 36 43 19,31 36 22,31 1,3,22,23, 28,30,31, 36,47 35 47 1,3,14,23, 28,30,31, 36,52 1,3,6,23, 28,30,31, 36,37,49, 52 52 Tabellenanhang 153 Giraffe Nematodirus spathiger Dictyocaulus filaria Dictyocaulus viviparus Dictyocaulus sp. Protostrongylus africanus Protostrongylus etoshai Protostrongylus spp. Muellerius capillaris Muellerius sp. Pneumostrongylus calcaratus Pneumostrongylus cornigerus Pneumostrongylus spp. Trichuris barbetonensis Trichuris globulosa Trichuris sp. Elenantilope Nyala 53 Oryxantilope Rappenantilope Pferdeantilope EllipsenWasserbock DefassaWasserbock LitschiMoorantilope Impala 53 46 46 8,44 45 52 50 5,7,13 2 5 5 5 5 38,50,51 13,31 50 1,2,3,5,7, 13,14,30, 31,36,39 5 5 13 5 5 38,51 19,31,36 14,31,36 45 46 In einigen Fällen wurden Angaben zur Zahl der Magen-Darm-Strongyliden-Eier pro Gramm Kot gemacht. Im folgenden werden diese kurz zusammengefaßt. (Autoren: Nummern => siehe Literaturliste) Tab. 24: EpG-Befunde im Freiland Tierart Giraffe Elenantilope Oryxantilope Pferdeantilope Defassa-Wasserbock Litschi-Moorantilope Impala Zahl der untersuchten Tiere 25 32 3 3 12 2 37 22 (davon 7 mit positivem Befund) 76 8 niedrigster Befund (EpG) 0 0 0 0 600 200 0 50 0 0 höchster Befund (EpG) 1500 3133 3600 3300 3300 500 1767 200 7067 2100 Mittelwert (EpG) 203 759 760 330 1583 350 594 keine Angabe 748 813 Autor 6 6 47 47 6 40 6 54 6 47 Tabellenanhang 154 zu Kapitel 2.6: Nachweise von Endoparasiten bei den untersuchten Wildwiederkäuerarten in Zoo- und Gehegehaltung Tabelle Nr. 25: Literaturliste Nr. Jahr Autor(en) (1) 1960 SCHOTT (2) 1963 ECKERT (3) 1964 SCHÄTZLE (4) 1965 NEUNHOEFFER (5) 1966 SCHNEIDER (6) 1967 SCHEEL (7) 1968 ROTH (8) (9) (10) (11) (12) (13) 1971 1973 1973 1974 1974 1976 LYON CHAUHAN et al. TSCHERNER LYON MANZ u. DINGELDEIN ENIGK u. DEY-HAZRA (14) (15) (16) 1977 FORSTNER et al. 1977 GIBBONS u. KHALIL 1978 ENIGK u. DEY-HAZRA (17) (18) (19) (20) (21) (22) (23) (24) (25) (26) 1978 1978 1978 1981 1982 1982 1983 1984 1985 1986 (27) 1987 ISAZA et al. (28) 1988 IPPEN u. HENNE (29) (30) (31) (32) (33) 1988 1991 1991 1992 1993 MELBOURNE STEGER TSCHERNER MOUCHA GERAGHTY et al. MOUCHA u. MIKULICA SAAD et al. RÜEDI BARUTZKI et al. CHURCH ZUCHOWSKA BOYCE et al. FLACH et al. CHAKRABORTY CRAIG Art und Ort der Untersuchung Kotproben; Zoo Berlin Kotproben; Zoo Hannover Kotproben; Münchner Tierpark Hellabrunn Kotproben; „Wilhelma“ Stuttgart Kotproben; Tierpark Berlin Kotproben; Münchner Tierpark Hellabrunn Kotproben; Zoos Berlin, Frankfurt, Gelsenkirchen, Hamburg, Hannover, München, Erfurt Sektionen, Kotproben; Chester Zoo, (GBR) Kotproben; Zoos Delhi und Lucknow, Indien Kotproben; Tierpark Berlin Sektion, Kotproben; Chester Zoo (GBR) Kotproben; Zoo Hannover Kotproben, Sektionen; versch. Zoos /Tierparks Institut für Parasitologie, Hannover Kotproben; Münchner Tierpark Hellabrunn Sektion; Marwell Zoological Park (GBR) Kotproben; verschiedene Zoos im In- u. Ausland Institut für Parasitologie, Hannover Kotproben; Longleat Safari Park (GBR) Sektionen; versch. Zoos; Nürnberger Institut Kotproben; Tierpark Berlin Kotproben; Zoo Dvůr Králové, Tschech. Rep. Kotproben; Dublin Zoological Gardens, Irland Sektion; Zoo Dvůr Králové, Tschechische Rep. Kotproben; Khartoum Zoo, Sudan Kotproben; Zoo Basel, Schweiz Kotproben; Münchner Tierpark Hellabrunn Kotproben; keine Zooangabe, (GBR), große grasbewachsene Gehege Kotproben; keine Zooangabe, Florida, USA, große grasbewachsene Gehege Sektionen; versch. Zoos etc.; Forschungsstelle für Wirbeltierforschung im Tierpark Berlin Sektionen / Kotproben; Zoo Lódz, Polen Kotproben; San Diego Wild Animal Park USA Kotproben / Sektionen; Edinburgh Zoo (GBR) Sektionen; Assam State Zoo, Indien Kotproben / Sektionen; Farmen in Texas, USA Tabellenanhang (34) (35) (36) (37) (38) (39) 1994 1996 1996 1997 1999 MIKOLON et al. EID u. RAWHIA FUKUMOTO et al. KEYSERLINGK et al. VARADHARAJAN u. PYTHAL 2000 YOUNG et al. 155 Kotproben; San Diego Wild Animal Park USA Sektion / Kotproben; Giza Zoo, Ägypten Sektion; Akiyoshidai Safari Land, Japan Kotproben; Safaripark, Niedersachsen Kotproben, Zoo Thiruvananthapuran, Kerala, Indien Kotproben, u.a. Caldwell Zoo, Texas, USA Tabellenanhang 156 Tabelle Nr. 26: Nachweise von Endoparasiten bei den untersuchten Wildwiederkäuerarten in Zoo- und Gehegehaltung Die Nummern in der folgenden Tabelle entsprechen den Nummern der Literaturliste Die Buchstaben in Klammern in der Spalte für Oryxantilopen stehen für: (b)= Oryx beisa; (d)= Oryx dammah; (g)= Oryx gazella. Ungenaue Bezeichnungen für die Endoparasiten wie z.B. „Magenwürmer“ wurden entsprechend in die Tabelle übernommen. Protozoen: Eimeria sp. Giraffe Elenantilope Nyala 35 3;10;19;20 10;19; ;37 20;37 10 Oryxantilope 10(d);20 (g);37(g) Eimeria canna Eimeria macieli Eimeria triffitt Trematoden: Dicrocoelium dendriticum Paramphistomum sp. Cestoden: Moniezia sp. 28 7;20;24 7;20 7 (b); 20 (g) Nematoden: Strongyloides sp. 3;7;18 3;19;20 1 (b); 3; 20 (g); 37 (g) Chabertia sp. Oesophagostomum sp. Bunostomum Monodontella giraffae MDS „Magenwürmer“ „Strongyliden“ „Trichostrongyliden“ Rappenantilope Pferdeantilope EllipsenWasserbock DefassaWasserbock LitschiMoorantilope Impala 20 10;19; 20 20;37 31 20 10 10 28 7 7 (b) 20 7 17;20 20 4;28 14;28 4;21;38 5;16 1 9;37 12 23 20 34 20 2;20 20 20 20 30 (g) 1 (b)/(d) 37 (g) 12 25;31 30 37 2 9 Tabellenanhang Haemonchus sp. Haemonchus contortus Ostertagia sp. 157 Giraffe Elenantilope 17;19;39 7;22 3;6;7;17 19 13 7 7;19;20 Nyala 19 Longistrongylus curvispiculum Trichostrongylus sp. Cooperia sp. 3;6;7;8; 17;18; 19;23 7;18 Camelostrongylus mentulatus Nematodirus sp. 36 37 „Lungenwürmer“ Dictyocaulus viviparus Dictyocaulus filaria Protostrongylidae Askariden Capillaria sp. Trichuris sp. Trichuris giraffae 3;7;13; 19 19 Oryxantilope 13 (b) 7 (b) 7 (b); 13 (b); 20 (g) 15 (d); 33 (b) 3;7 (b) Rappenantilope Pferdeantilope 20 27 20 EllipsenWasserbock 19 DefassaWasserbock LitschiMoorantilope 20 20 20 Impala 33 26 23;26 7;13 3;7 (b); 20 (g) 20 20 3;7;19; 20;37 3; 7 (b); 20 (g) 37 (g) 20;25 20;26; 27 37 19 22 17 19 3;7;18; 19;20;37 4;7;8;11 14;17;18 19;20;22 28;29;35 37 32;35 19;20 12;20; 37 37 20 7 (b);20 (g);37(g) 3; 20 (g); 37 (g) 20;25 20 20 20 20;27 19;20 20 20;31 20 Tabellenanhang 158 Eigene Untersuchungsergebnisse: Tab. 27: Kotuntersuchungsergebnisse der Giraffen: Eizahl pro Gramm (EpG) Giraffen EpG M=MDS N=Nematodirus T=Trichuris C=Capillaria Alttiere Jungtiere Probe 1 Probe 2 Probe 3 Probe 4 Probe 1 Probe 2 Datum M N T M T M C M N C M N T C M N T C 16.10.00 150 0 0 0 0 0 0 0 0 50 0 0 50 0 0 0 0 0 30.10.00 350 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 13.11.00 0 0 0 0 0 150 0 150 0 0 0 200 50 0 0 0 0 0 27.11.00 0 0 0 50 0 0 0 150 0 0 0 150 50 0 50 0 0 0 11.12.00 0 0 0 0 0 0 0 0 0 0 50 150 0 0 200 0 0 0 27.12.00 100 50 0 50 0 100 0 0 0 0 250 0 0 0 50 0 0 0 06.01.01 0 0 0 50 100 0 0 0 0 0 50 0 0 0 0 100 0 0 20.01.01 50 0 0 0 0 100 0 0 0 0 0 50 0 0 50 0 0 0 02.02.01 0 0 0 100 0 50 50 0 0 0 0 0 0 0 300 0 50 0 16.02.01 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 50 02.03.01 MKS 17.03.01 0 0 0 0 0 50 0 0 0 0 150 50 0 0 0 0 0 0 01.04.01 0 0 0 50 0 100 0 0 0 0 0 0 0 0 50 0 0 0 13.04.01 0 0 0 100 0 50 50 0 0 0 0 0 0 0 150 0 0 50 03.05.01 50 0 0 50 0 50 0 50 0 0 0 0 0 0 0 0 0 0 10.05.01 0 0 0 0 0 250 0 0 0 0 0 0 0 0 50 0 0 0 23.05.01 0 0 0 0 0 100 0 0 0 0 0 0 0 0 0 0 0 0 07.06.01 0 0 0 0 0 100 0 0 0 0 0 0 0 0 50 50 0 0 21.06.01 250 0 0 0 0 0 0 50 0 50 0 0 0 0 150 0 0 0 06.07.01 0 0 0 50 0 100 0 0 0 0 50 100 0 0 0 50 0 0 19.07.01 100 0 0 0 0 0 50 0 0 0 0 0 100 0 Bulle aus 02.08.01 0 0 50 0 0 0 0 350 50 100 0 0 0 0 Schweden 16.08.01 0 0 0 0 0 0 0 0 0 0 0 0 0 0 am 06.07.01: 30.08.01 50 0 0 100 0 0 0 50 0 0 0 0 0 0 50 Trichuris-EpG 13.09.01 150 0 0 50 0 50 0 0 0 0 0 0 0 0 27.09.01 150 0 50 0 0 0 0 0 0 0 0 0 0 50 11.10.01 0 0 0 0 0 150 0 0 0 0 0 0 0 0 25.10.01 100 100 0 0 0 200 0 50 0 0 50 0 0 0 08.11.01 0 0 0 150 0 0 0 100 0 0 100 0 0 0 Tabellenanhang 159 Tab. 28: Kotuntersuchungsergebnisse der Giraffen: Eizahl pro Gramm (EpG); Larvenkultur Giraffen EpG Giraffen Larvenkultur M=MDS N=Nematodirus O=Ostertagia T=Trichostrongylus T=Trichuris C=Capillaria C=Cooperia S=Strongyloides Alttiere Jungtiere Alttiere Mittelwert Mittelwert Probe1 Probe 2 Probe 3 Probe 4 Datum M N T C M N T C O T O T C S O T S O T S 16.10.00 37,5 0 0 12,5 0 0 25 0 100 0 100 0 0 0 100 0 0 100 0 0 30.10.00 87,5 0 0 0 0 0 0 0 100 0 40 0 0 0 100 0 0 100 0 0 13.11.00 75 0 0 0 0 100 25 0 0 0 100 0 0 0 100 0 0 38 0 0 27.11.00 50 0 0 0 25 75 25 0 100 0 100 0 0 0 100 0 0 100 0 0 11.12.00 0 0 0 0 125 75 0 0 100 0 100 0 0 0 100 0 0 100 0 0 27.12.00 62,5 12,5 0 0 150 0 0 0 43 0 100 0 0 0 100 0 0 2 0 0 06.01.01 12,5 0 25 0 25 50 0 0 100 0 99 1 0 0 100 0 0 99 1 0 20.01.01 37,5 0 0 0 25 25 0 0 100 0 18 0 0 0 100 0 0 23 0 0 02.02.01 37,5 0 0 12,5 150 0 25 0 0 0 100 0 0 0 94 5 1 100 0 0 16.02.01 0 0 0 0 0 0 0 25 100 0 100 0 0 0 0 0 0 0 0 0 02.03.01 MKS 17.03.01 12,5 0 0 0 75 25 0 0 99 1 93 2 0 5 99 0 1 98 0 2 01.04.01 37,5 0 0 0 25 0 0 0 100 0 100 0 0 0 99 0 1 100 0 0 13.04.01 37,5 0 0 12,5 75 0 0 25 100 0 100 0 0 0 100 0 0 61 0 0 03.05.01 50 0 0 0 0 0 0 0 97 3 20 1 0 0 89 10 1 100 0 0 10.05.01 62,5 0 0 0 25 0 0 0 100 0 100 0 0 0 98 2 0 70 3 0 23.05.01 25 0 0 0 0 0 0 0 99 1 95 4 0 1 93 7 0 82 4 14 07.06.01 25 0 0 0 25 25 0 0 100 0 99 0 0 1 100 0 0 79 3 0 21.06.01 75 0 0 12,5 75 0 0 0 98 2 66 2 0 0 79 3 0 100 0 0 06.07.01 37,5 0 0 0 25 75 0 0 39 0 100 0 0 0 100 0 0 97 3 0 19.07.01 25 0 0 12,5 0 0 100 0 20 0 35 2 0 0 63 0 0 93 5 2 02.08.01 87,5 12,5 12,5 25 0 0 0 0 96 4 43 1 0 0 2 2 0 98 2 0 16.08.01 0 0 0 0 0 0 0 0 88 12 100 0 0 0 98 2 0 42 0 0 30.08.01 50 0 0 0 0 0 0 0 96 4 98 1 1 0 99 1 0 97 3 0 13.09.01 62,5 0 0 0 0 0 0 0 98 2 92 8 0 0 100 0 0 13 8 0 27.09.01 37,5 0 12,5 0 0 0 0 50 100 0 16 6 0 0 100 0 0 99 1 0 11.10.01 37,5 0 0 0 0 0 0 0 96 4 94 6 0 0 100 0 0 23 13 0 25.10.01 87,5 25 0 0 50 0 0 0 89 11 73 27 0 0 97 3 0 95 5 0 08.11.01 62,5 0 0 0 100 0 0 0 87 13 66 34 0 0 79 21 0 80 20 0 Tabellenanhang 160 Tab. 29: Kotuntersuchungsergebnisse der Giraffen: Larvenkultur. Aufgrund der Rundung auf eine Stelle nach dem Komma ergibt die Summe der prozentualen Larvenanteile nicht immer genau 100. Giraffen Larvenkultur O=Ostertagia T=Trichostrongylus C=Cooperia N=Nematodirus S=Strongyloides Jungtiere Alttiere +Jungtiere Probe 1 Probe 2 Mittelwerte der Larvenzusammensetzung absoluten Larvenzahlen in % Datum O T N S O T S O T C N S O T C N S 16.10.00 2 0 0 0 0 0 0 67,0 0,0 0,0 0,0 0,0 100,0 0,0 0,0 0,0 0,0 30.10.00 0 0 0 0 3 0 0 57,2 0,0 0,0 0,0 0,0 100,0 0,0 0,0 0,0 0,0 13.11.00 77 0 0 0 6 0 0 53,5 0,0 0,0 0,0 0,0 100,0 0,0 0,0 0,0 0,0 27.11.00 23 0 0 0 67 0 0 81,7 0,0 0,0 0,0 0,0 100,0 0,0 0,0 0,0 0,0 11.12.00 98 2 0 0 67 0 0 94,2 0,3 0,0 0,0 0,0 99,6 0,4 0,0 0,0 0,0 27.12.00 100 0 0 0 100 0 0 74,2 0,0 0,0 0,0 0,0 100,0 0,0 0,0 0,0 0,0 06.01.01 31 9 0 0 35 0 0 77,3 1,8 0,0 0,0 0,0 97,7 2,3 0,0 0,0 0,0 20.01.01 8 0 0 0 12 0 0 43,5 0,0 0,0 0,0 0,0 100,0 0,0 0,0 0,0 0,0 02.02.01 0 0 0 0 100 0 0 65,7 0,8 0,0 0,0 0,2 98,5 1,3 0,0 0,0 0,3 16.02.01 99 1 0 0 93 7 0 65,3 1,3 0,0 0,0 0,0 98,0 2,0 0,0 0,0 0,0 02.03.01 MKS 17.03.01 0 0 0 0 100 0 0 81,5 0,5 0,0 0,0 1,3 97,8 0,6 0,0 0,0 1,6 01.04.01 2 0 0 0 63 0 1 77,3 0,0 0,0 0,0 0,3 99,6 0,0 0,0 0,0 0,4 13.04.01 100 0 0 0 69 0 0 88,3 0,0 0,0 0,0 0,0 100,0 0,0 0,0 0,0 0,0 03.05.01 81 8 0 0 17 3 1 67,3 4,2 0,0 0,0 0,3 93,7 5,8 0,0 0,0 0,5 10.05.01 18 0 0 0 60 0 0 74,3 0,8 0,0 0,0 0,0 98,9 1,1 0,0 0,0 0,0 23.05.01 0 0 0 0 95 2 3 77,3 3,0 0,0 0,0 3,0 92,8 3,6 0,0 0,0 3,6 07.06.01 72 23 0 0 96 1 3 91,0 4,5 0,0 0,0 0,7 94,6 4,7 0,0 0,0 0,7 21.06.01 96 0 0 4 100 0 0 89,8 1,2 0,0 0,0 0,7 98,0 1,3 0,0 0,0 0,7 06.07.01 84 0 16 0 100 0 0 86,7 0,5 0,0 2,7 0,0 96,5 0,6 0,0 3,0 0,0 19.07.01 0 0 0 0 Bulle aus 42,2 1,4 0,0 0,0 0,4 95,9 3,2 0,0 0,0 0,9 02.08.01 0 0 0 0 Schweden 47,8 1,8 0,0 0,0 0,0 96,4 3,6 0,0 0,0 0,0 16.08.01 0 0 0 0 am 06.07.01: 65,6 2,8 0,0 0,0 0,0 95,9 4,1 0,0 0,0 0,0 30.08.01 0 0 0 0 3 0 5 78,0 1,8 0,2 0,0 0,0 97,5 2,3 0,2 0,0 0,0 13.09.01 0 0 0 0 60,6 3,6 0,0 0,0 0,0 94,4 5,6 0,0 0,0 0,0 27.09.01 98 2 0 0 82,6 1,8 0,0 0,0 0,0 97,9 2,1 0,0 0,0 0,0 11.10.01 76 2 0 0 77,8 5,0 0,0 0,0 0,0 94,0 6,0 0,0 0,0 0,0 25.10.01 92 8 0 0 89,2 10,8 0,0 0,0 0,0 89,2 10,8 0,0 0,0 0,0 08.11.01 89 0 0 0 80,2 17,6 0,0 0,0 0,0 82,0 18,0 0,0 0,0 0,0 Tabellenanhang 161 Tab. 30: Kotuntersuchungsergebnisse der Giraffen (Auswanderverfahren) und der Elenantilopen (Eizahl pro Gramm Kot) Giraffen Auswanderverfahren Elenantilopen EpG D=Dictyocaulus E= Eimeria M=MDS N=Nematodirus A=Alttiere J=Jungtiere T=Trichuris C=Capillaria M=Mittelwert A J A J Alttiere Jungtier Pr.-Nr. 1 2 3 4 1 2 M M Probe 1 Probe 2 Probe 3 Probe 1 Datum D D D D D D D D E M N C M C E M T E M N C 16.10.00 0 0 0 0 0 0 0,0 0 0 0 0 0 0 0 0 0 0 1650 0 0 0 30.10.00 0 0 0 0 0 0 0,0 0 0 0 0 0 50 0 0 0 0 0 0 0 0 13.11.00 0 0 0 0 0 0 0,0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 27.11.00 0 0 0 0 0 0 0,0 0 50 0 0 0 0 50 100 0 0 250 50 0 50 11.12.00 0 0 0 0 0 0 0,0 0 0 0 0 0 0 50 50 0 0 250 0 0 0 27.12.00 0 0 0 0 0 0 0,0 0 100 50 0 0 50 50 50 0 0 500 0 50 50 06.01.01 0 0 0 0 0 0 0,0 0 0 0 0 0 0 0 0 100 50 150 50 0 50 20.01.01 0 0 0 0 0 0 0,0 0 0 0 250 0 0 0 0 0 0 100 50 100 0 02.02.01 0 0 0 0 0 0 0,0 0 0 0 0 0 0 0 0 0 0 300 0 0 0 16.02.01 0 0 0 0 0 0 0,0 0 0 0 0 0 0 50 0 0 0 50 0 0 0 02.03.01 MKS 0 0 50 0 0 MKS 17.03.01 0 0 0 0 0 0 0,0 0 0 0 50 0 0 0 50 50 0 200 0 100 0 01.04.01 0 0 0 0 0 0 0,0 0 0 0 0 0 0 0 300 0 0 250 0 0 50 13.04.01 0 0 0 0 0 0 0,0 0 350 0 0 0 0 0 50 0 0 150 0 0 0 03.05.01 9 0 0 0 0 0 2,3 0 0 0 0 0 50 0 100 0 0 50 0 0 50 10.05.01 0 0 0 0 0 0 0,0 0 0 0 0 0 50 0 0 0 50 0 0 50 0 23.05.01 0 0 0 12 0 0 3,0 0 0 0 0 0 100 0 0 0 0 0 0 0 0 07.06.01 0 0 0 0 1 1 0,0 1 100 0 0 0 0 0 0 0 0 250 0 0 0 21.06.01 0 3 0 0 0 0 0,8 0 0 0 0 0 0 0 100 0 0 100 0 0 0 06.07.01 0 0 2 0 0 0 0,5 0 0 0 0 0 0 0 100 0 0 150 0 0 0 19.07.01 0 0 1 0 0 0,3 0 0 0 0 0 0 0 0 0 0 300 0 0 0 02.08.01 0 0 0 0 0 0,0 0 0 0 0 0 0 0 50 0 0 0 0 0 0 16.08.01 0 0 0 1 0 0,3 0 0 0 0 0 0 0 150 0 0 0 0 0 0 30.08.01 0 0 0 0 0 0,0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 13.09.01 0 0 0 0 0 0,0 0 0 0 0 0 0 0 0 0 0 50 0 0 0 27.09.01 0 0 0 0 1 0,0 1 50 0 0 0 0 0 0 0 0 200 0 0 0 11.10.01 0 0 0 0 0 0,0 0 0 0 0 0 0 0 200 0 0 250 0 0 0 25.10.01 0 0 1 0 0 0,3 0 0 0 0 0 0 0 850 0 0 50 0 0 0 08.11.01 0 0 1 0 0 0,3 0 0 0 0 50 0 0 200 0 0 0 0 0 0 Tabellenanhang 162 Tab. 31: Kotuntersuchungsergebnisse der Elenantilopen: Eizahl pro Gramm Kot Elenantilopen EpG E=Eimeria M=MDS N=Nematodirus T=Trichuris C=Capillaria Jungtier Alttiere Jungtiere Probe 2 Mittelwerte Mittelwerte Datum E M N T C E M N T C E M N T C 16.10.00 0 0 0 0 50 0 0 0 0 0 825 0 0 0 25 30.10.00 0 50 0 0 100 0 17 0 0 0 0 25 0 0 50 13.11.00 700 0 0 0 0 0 0 0 0 0 350 0 0 0 0 27.11.00 1800 100 0 150 100 50 0 0 0 17 1025 75 0 75 75 11.12.00 850 0 50 50 50 17 0 0 0 17 550 0 25 25 25 27.12.00 150 150 0 0 100 50 33 0 0 17 325 75 25 0 75 06.01.01 0 50 50 0 0 0 33 0 17 0 75 50 25 0 25 20.01.01 50 100 50 50 200 0 0 83 0 0 75 75 75 25 100 02.02.01 250 0 0 0 0 0 0 0 0 0 275 0 0 0 0 16.02.01 450 50 0 50 50 0 0 0 0 17 250 25 0 25 25 02.03.01 650 0 50 0 50 25 0 0 0 0 650 0 50 0 50 17.03.01 150 0 0 0 0 17 17 17 0 0 175 0 50 0 0 01.04.01 0 0 0 0 0 100 0 0 0 0 125 0 0 0 25 13.04.01 350 50 100 350 100 133 0 0 0 0 250 25 50 175 50 03.05.01 250 100 0 0 0 33 17 0 0 0 150 50 0 0 25 10.05.01 50 0 50 100 450 0 17 0 17 0 25 0 50 50 225 23.05.01 50 50 0 0 150 0 33 0 0 0 25 25 0 0 75 07.06.01 150 100 0 50 250 33 0 0 0 0 200 50 0 25 125 21.06.01 150 100 0 0 200 33 0 0 0 0 125 50 0 0 100 06.07.01 50 200 0 50 300 33 0 0 0 0 100 100 0 25 150 19.07.01 100 0 0 250 150 0 0 0 0 0 200 0 0 125 75 02.08.01 100 100 0 0 100 17 0 0 0 0 50 50 0 0 50 16.08.01 150 50 0 0 150 50 0 0 0 0 75 25 0 0 75 30.08.01 0 0 0 0 50 0 0 0 0 0 0 0 0 0 25 13.09.01 150 0 0 0 0 0 0 0 0 0 100 0 0 0 0 27.09.01 1100 100 0 200 300 17 0 0 0 0 650 50 0 100 150 11.10.01 50 0 50 0 0 67 0 0 0 0 150 0 25 0 0 25.10.01 300 0 0 0 0 283 0 0 0 0 175 0 0 0 0 08.11.01 450 0 0 0 100 67 0 0 0 17 225 0 0 0 50 Tabellenanhang 163 Tab. 32: Kotuntersuchungsergebnisse der Elenantilopen: Larvenkultur. Aufgrund der Rundung auf eine Stelle nach dem Komma ergibt die Summe der prozentualen Larvenanteile nicht immer genau 100. Elenantilopen Larvenkultur O=Ostertagia T=Trichostrongylus S=Strongyloides Alttiere Jungtiere Alttiere / Jungtiere Pr.1 Probe 2 Probe 3 Probe 1 Probe 2 Mittelwerte %-Anteile Datum O O T O T O T O T S O T S O T S 16.10.00 4 15 0 61 0 21 0 0 0 0 20,2 0,0 0,0 100,0 0,0 0,0 30.10.00 1 4 0 0 0 2 0 75 0 0 16,4 0,0 0,0 100,0 0,0 0,0 13.11.00 3 0 0 0 0 0 0 27 0 0 6,0 0,0 0,0 100,0 0,0 0,0 27.11.00 8 1 0 0 0 0 0 19 0 0 5,6 0,0 0,0 100,0 0,0 0,0 11.12.00 0 0 0 12 0 0 0 4 0 0 3,2 0,0 0,0 100,0 0,0 0,0 27.12.00 100 100 0 4 0 0 0 71 0 29 55,0 0,0 7,3 88,4 0,0 11,6 06.01.01 0 0 0 4 1 0 0 100 0 0 20,8 0,2 0,0 99,0 1,0 0,0 20.01.01 100 9 0 13 0 82 18 70 28 2 54,8 9,2 0,5 85,0 14,3 0,8 02.02.01 0 100 0 64 0 0 0 0 0 0 32,8 0,0 0,0 100,0 0,0 0,0 16.02.01 52 3 0 41 0 0 0 98 2 0 38,8 0,4 0,0 99,0 1,0 0,0 02.03.01 0 0 0 0 MKS 0 0 0 0,0 0,0 0,0 0,0 0,0 0,0 17.03.01 100 2 0 0 0 24 0 100 0 0 45,2 0,0 0,0 100,0 0,0 0,0 01.04.01 10 100 0 3 0 2 0 14 0 0 25,8 0,0 0,0 100,0 0,0 0,0 13.04.01 0 24 0 0 0 0 0 100 0 0 24,8 0,0 0,0 100,0 0,0 0,0 03.05.01 0 81 7 7 0 0 0 49 5 0 27,4 2,4 0,0 91,9 8,1 0,0 10.05.01 1 42 1 16 0 1 0 99 1 0 31,8 0,4 0,0 98,8 1,2 0,0 23.05.01 0 90 10 9 1 0 0 90 8 2 37,8 3,8 0,5 89,8 9,0 1,2 07.06.01 6 37 0 5 0 0 0 100 0 0 29,6 0,0 0,0 100,0 0,0 0,0 21.06.01 4 50 0 0 0 0 0 51 0 0 21,0 0,0 0,0 100,0 0,0 0,0 06.07.01 2 0 0 0 0 0 0 100 0 0 20,4 0,0 0,0 100,0 0,0 0,0 19.07.01 0 2 0 0 0 0 0 100 0 0 20,4 0,0 0,0 100,0 0,0 0,0 02.08.01 1 0 0 0 0 0 0 82 0 0 16,6 0,0 0,0 100,0 0,0 0,0 16.08.01 4 5 1 0 0 0 0 100 0 0 21,8 0,2 0,0 99,1 0,9 0,0 30.08.01 3 0 0 8 0 0 0 94 0 0 21,0 0,0 0,0 100,0 0,0 0,0 13.09.01 22 0 0 8 0 1 0 100 0 0 26,2 0,0 0,0 100,0 0,0 0,0 27.09.01 4 2 0 0 0 0 0 98 2 0 20,8 0,4 0,0 98,1 1,9 0,0 11.10.01 7 1 0 0 0 0 0 100 0 0 21,6 0,0 0,0 100,0 0,0 0,0 25.10.01 22 3 0 0 0 0 0 100 0 0 25,0 0,0 0,0 100,0 0,0 0,0 08.11.01 10 9 0 0 0 1 0 100 0 0 24,0 0,0 0,0 100,0 0,0 0,0 Tabellenanhang 164 Tab. 33: Kotuntersuchungsergebnisse der Elenantilopen (Auswanderverfahren) und der Rappenantilopen (Eizahl pro Gramm Kot). EpG Elenantilopen D=Dictyocaulus Rappenantilopen Auswanderverfahren E=Eimeria M=MDS N=Nematodirus A=Alttiere J=Jungtiere T=Trichuris C=Capillaria M=Mittelwert A J A J Alttiere Pr.-Nr. 1 2 3 1 2 M M Probe 1 Probe 2 P.3 Probe 4 Probe 5 Datum D D D D D D D E M N T C M T M E M C E M C 16.10.00 0 0 0 0 0 0,0 0,0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 30.10.00 0 0 0 0 0 0,0 0,0 0 0 0 0 0 0 0 0 0 0 0 100 0 0 13.11.00 0 0 0 0 1 0,0 0,5 0 0 0 0 0 0 0 0 50 0 0 0 0 0 27.11.00 0 0 0 0 2 0,0 1,0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 11.12.00 0 0 0 2 12 0,0 7,0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 27.12.00 3 7 0 5 1 3,3 3,0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 06.01.01 0 0 0 1 0 0,0 0,5 0 0 0 0 0 0 0 0 0 0 0 0 0 0 20.01.01 0 0 1 9 3 0,3 6,0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 02.02.01 0 0 0 0 0 0,0 0,0 keine Probennahme möglich 16.02.01 0 0 0 0 0 0,0 0,0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 02.03.01 MKS 0 0 0 0 0 0 0 0 keine Pr.-n. 0 0 0 17.03.01 1 0 0 0 0 0,3 0,0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 01.04.01 0 0 0 0 0 0,0 0,0 0 0 0 0 0 100 50 0 0 50 0 0 0 0 13.04.01 0 0 0 3 0 0,0 1,5 0 100 0 0 0 0 0 0 0 0 0 150 0 0 03.05.01 0 0 0 0 0 0,0 0,0 0 400 0 50 0 0 0 0 0 0 0 0 0 0 10.05.01 0 0 0 0 0 0,0 0,0 0 0 0 0 0 0 0 0 0 50 0 0 100 50 23.05.01 0 0 0 0 0 0,0 0,0 0 0 0 0 0 0 0 0 0 0 0 07.06.01 0 0 0 0 0 0,0 0,0 150 300 50 0 50 0 0 0 0 50 0 0 50 0 21.06.01 0 0 1 0 0 0,3 0,0 0 100 0 0 0 100 0 0 50 0 0 50 0 06.07.01 0 0 0 0 0 0,0 0,0 0 400 50 0 100 50 0 50 0 200 0 50 100 0 19.07.01 1 0 0 0 0 0,3 0,0 100 0 0 0 100 0 0 100 0 02.08.01 0 0 0 0 0 0,0 0,0 0 0 0 0 0 0 0 350 0 0 200 0 16.08.01 0 0 0 0 0 0,0 0,0 0 0 0 0 0 250 0 0 50 0 0 200 0 30.08.01 0 0 0 0 0 0,0 0,0 0 150 50 0 0 100 0 350 0 0 0 0 13.09.01 0 0 0 0 0 0,0 0,0 0 600 100 0 0 300 0 200 0 100 0 27.09.01 4 0 0 0 0 1,3 0,0 0 0 0 0 0 150 0 200 0 550 100 11.10.01 3 0 0 0 0 1,0 0,0 250 0 50 0 0 300 0 0 550 0 0 300 0 25.10.01 0 0 0 0 0 0,0 0,0 0 0 0 0 0 150 0 50 0 0 0 08.11.01 0 0 0 0 0 0,0 0,0 0 150 0 0 0 500 0 100 0 0 0 0 300 0 Tabellenanhang 165 Tab. 34: Kotuntersuchungsergebnisse der Rappenantilopen: Eizahl pro Gramm Kot (EpG) und Larvenkultur. Larvenkultur Rappenantilopen EpG E=Eimeria M=MDS N=Nematodirus T=Trichuris C=Capillaria O=Ostertagia T=Trichostrongylus Jungtier Alttiere / Jungtier A=Alttierprobe J=Jungtierprobe Pr.-Nr. Probe 1 Mittelwerte A1 A2 A3 A4 A5 J1 Datum M N T C E M N T C O T O O O T O O 16.10.00 0 0 0 0 0 0 0 0 100 0 0 0 30.10.00 20 0 0 0 0 0 0 0 0 0 0 1 13.11.00 10 0 0 0 0 0 0 0 0 0 0 0 27.11.00 0 0 0 0 0 0 0 0 0 0 0 0 11.12.00 0 0 0 0 0 0 0 0 0 0 0 0 27.12.00 0 0 0 0 0 2 1 0 0 0 0 0 06.01.01 0 0 0 0 0 0 0 0 0 0 0 0 20.01.01 0 0 0 0 0 0 0 0 0 0 0 0 02.02.01 keine Probennahme möglich 16.02.01 0 0 0 0 0 0 0 0 0 0 0 0 02.03.01 0 0 0 0 0 0 0 0 76 0 17.03.01 0 0 0 0 0 100 0 10 98 1 1 2 01.04.01 0 30 0 10 0 11 0 100 19 100 0 100 13.04.01 30 20 0 0 0 100 0 100 42 46 0 1 03.05.01 0 80 0 10 0 100 0 100 100 93 0 100 10.05.01 0 30 0 0 10 100 0 100 100 100 0 100 23.05.01 1000 0 800 50 0 0 0 0 0 100 0 100 100 100 100 07.06.01 30 80 10 0 10 100 0 100 100 100 0 100 21.06.01 850 0 300 0 0 75 0 0 0 100 0 100 100 0 100 100 06.07.01 10 160 10 0 20 100 0 100 100 100 0 100 19.07.01 0 0 100 0 0 75 0 0 0 100 100 100 0 100 0 02.08.01 0 0 0 0 0 138 0 0 0 0 0 100 100 0 100 0 16.08.01 0 0 0 0 0 125 0 0 0 100 0 100 100 0 100 3 30.08.01 0 0 0 0 0 150 12,5 0 0 99 1 100 100 0 100 0 13.09.01 250 50 0 0 0 300 25 0 0 100 0 100 100 100 0 100 27.09.01 450 50 0 0 0 300 0 0 25 0 0 100 100 100 0 100 11.10.01 2050 150 200 0 62,5 288 12,5 0 0 0 0 100 100 0 100 100 25.10.01 0 0 0 0 0 50 0 0 0 17 0 100 100 0 0 0 08.11.01 0 210 0 0 0 99 1 100 100 0 0 100 Tabellenanhang 166 Tab. 35: Kotuntersuchungsergebnisse der Rappenantilopen: Larvenkultur. Aufgrund der Rundung auf eine Stelle nach dem Komma ergibt die Summe der prozentualen Larvenanteile nicht immer genau 100. Kotuntersuchungsergebnisse der Oryxantilopen: Eizahl pro Gramm Kot; Ergebnisse der beiden Muttertiere fett gedruckt bzw. unterstrichen. Rappenantilopen Larvenkultur Oryxantilopen EpG O=Ostertagia M=MDS E=Eimeria C=Capillaria T=Trichostrongylus Alttiere Alttiere Mittelwert %-Anteile Probe 1 Probe 2 Probe 3 Mittelwerte Datum O T O T M E C M E C M E M E C 16.10.00 20,0 0,0 100,0 0,0 550 0 0 300 0 0 200 0 350 0 0 30.10.00 0,2 0,0 100,0 0,0 900 0 0 1000 0 0 500 0 800 0 0 13.11.00 0,0 0,0 0,0 0,0 0 0 0 0 2800 0 0 2650 0 1817 0 27.11.00 0,0 0,0 0,0 0,0 0 200 0 0 800 0 0 350 0 450 0 11.12.00 0,0 0,0 0,0 0,0 0 0 0 0 0 0 150 0 0 450 0 27.12.00 0,4 0,2 66,7 33,3 0 0 0 50 0 150 0 0 0 0 400 06.01.01 0,0 0,0 0,0 0,0 50 0 0 0 0 0 350 100 133 33 0 20.01.01 0,0 0,0 0,0 0,0 0 0 0 0 250 0 0 0 0 0 750 02.02.01 keine Pr.- n. möglich 1100 0 0 50 0 650 0 0 0 0 800 16.02.01 0,0 0,0 0,0 0,0 50 0 0 100 2050 0 733 0 0 0 0 02.03.01 19,0 0,0 100,0 0,0 MKS 17.03.01 42,2 0,2 99,5 0,5 300 0 0 0 0 100 0 0 0 0 0 01.04.01 66,0 0,0 100,0 0,0 50 150 0 150 550 0 150 50 117 250 0 13.04.01 57,8 0,0 100,0 0,0 300 0 0 2400 0 0 1700 0 1467 0 0 03.05.01 98,6 0,0 100,0 0,0 450 0 0 300 0 0 800 0 517 0 0 10.05.01 100,0 0,0 100,0 0,0 750 0 0 300 50 0 900 0 650 17 0 23.05.01 100,0 0,0 100,0 0,0 300 0 0 0 0 0 200 0 167 0 0 07.06.01 100,0 0,0 100,0 0,0 500 0 0 700 0 750 0 0 0 0 1050 21.06.01 100,0 0,0 100,0 0,0 0 0 0 800 0 0 650 0 483 0 0 06.07.01 100,0 0,0 100,0 0,0 0 0 0 200 0 167 0 0 0 0 300 19.07.01 80,0 0,0 100,0 0,0 350 0 200 750 50 0 300 0 467 17 67 02.08.01 60,0 0,0 100,0 0,0 50 0 0 100 0 50 50 17 0 0 0 16.08.01 80,6 0,0 100,0 0,0 150 0 0 550 0 533 0 17 0 50 900 30.08.01 79,8 0,2 99,8 0,3 150 0 0 250 0 233 0 0 0 0 300 13.09.01 100,0 0,0 100,0 0,0 250 0 0 50 0 0 400 0 233 0 0 27.09.01 80,0 0,0 100,0 0,0 350 0 0 250 0 500 0 0 0 0 900 11.10.01 80,0 0,0 100,0 0,0 100 0 0 350 0 217 0 0 0 0 200 25.10.01 43,4 0,0 100,0 0,0 150 0 0 450 150 0 650 0 417 50 0 08.11.01 79,8 0,2 99,8 0,3 950 0 0 200 0 1117 0 0 0 0 2200 Tabellenanhang 167 Tab. 36: Kotuntersuchungsergebnisse der Oryxantilopen: Eizahl pro Gramm Kot (EpG) und Larvenkultur; Ergebnisse der beiden Muttertiere fett gedruckt bzw. unterstrichen. Larvenkultur O=Ostertagia Oryxantilopen EpG M=MDS C=Capillaria N=Nematodirus T=Trichostrongylus S=Strongyloides E=Eimeria S=Strongyloides T=Trichuris Alttiere Jungtier Jungtier Probe 1 Probe 1 Probe 2 Probe 3 Probe 1 Datum M E C N S T O T S O T O T O T S 16.10.00 750 0 50 0 0 0 100 0 0 93 0 100 0 100 0 0 30.10.00 850 0 0 100 0 0 100 0 0 100 0 100 0 100 0 0 13.11.00 1650 1000 0 300 100 0 0 0 0 0 0 0 0 100 0 0 27.11.00 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 11.12.00 0 1000 0 0 0 0 62 0 6 0 0 15 2 0 4 0 27.12.00 100 100 0 0 0 0 0 0 0 18 0 0 12 2 0 6 06.01.01 200 100 0 0 0 0 100 0 0 25 0 0 0 0 64 36 20.01.01 200 50 0 0 0 0 0 0 0 70 30 39 61 0 0 0 02.02.01 150 0 0 0 0 0 zuwenig Material 16.02.01 100 0 0 0 0 0 76 24 0 65 35 67 33 0 0 0 02.03.01 MKS 17.03.01 0 0 0 0 0 0 0 0 0 98 4 0 0 0 2 17 01.04.01 500 100 0 0 0 0 7 0 0 100 0 100 0 100 0 0 13.04.01 750 0 0 0 0 0 81 19 0 93 7 94 6 98 2 0 03.05.01 650 100 0 0 0 0 93 7 0 92 8 81 19 68 32 0 10.05.01 850 0 0 0 0 0 96 4 0 100 3 89 11 0 0 97 23.05.01 850 0 0 0 0 0 1 4 0 19 0 98 2 99 1 0 07.06.01 1750 50 0 0 0 0 100 0 0 100 0 99 0 1 0 100 21.06.01 1600 0 0 0 0 50 0 0 0 100 0 100 0 100 0 0 06.07.01 0 200 0 0 0 0 0 0 0 99 2 0 0 0 1 98 19.07.01 0 250 0 0 0 0 100 0 0 100 0 0 0 0 0 100 02.08.01 150 0 0 0 0 0 100 0 0 98 0 100 0 0 2 100 16.08.01 850 100 0 0 0 0 98 2 0 95 0 97 3 0 5 100 30.08.01 700 100 0 0 0 0 95 5 0 97 1 0 3 78 22 99 13.09.01 750 50 0 50 0 0 72 28 0 91 9 82 18 86 14 0 27.09.01 2300 0 100 0 0 0 78 22 0 86 14 95 5 98 2 0 11.10.01 1450 100 0 50 0 0 100 0 0 97 8 100 0 0 3 92 25.10.01 0 0 0 50 0 0 74 26 0 71 29 98 2 0 0 0 08.11.01 450 100 0 50 0 0 78 22 0 83 17 73 27 88 5 7 Tabellenanhang 168 Tab. 37: Kotuntersuchungsergebnisse der Oryxantilopen: Larvenkultur: Aufgrund der Rundung auf eine Stelle nach dem Komma ergibt die Summe der prozentualen Larvenanteile nicht immer genau 100. Auswanderverfahren: Ergebnisse der beiden Muttertiere fett gedruckt bzw. unterstrichen. Kotuntersuchungsergebnisse der Ellipsen-Wasserböcke: Eizahl pro Gramm Kot (EpG); Ergebnisse des in der Diskussion im Zusammenhang mit Eimeria sp. erwähnten Altbockes fettgedruckt. Oryxantilopen Larvenkultur O=Ostertagia Auswanderverfahren Ellipsen-Wasserböcke T=Trichostrongylus S=Strongyloides D=Dictyocaulus EpG E=Eimeria Mittelwerte %-Anteile A=Alttiere J=Jungtier M=MDS C=Capillaria A1 A2 A3 Ø A J 1 Alttierprobe 1 Altt.-p.2 Datum O T S O T S D D D D D M E C M E 16.10.00 98,3 0,0 0,0 100,0 0,0 0,0 0 0 0 0,0 0,0 0 0 0 0 0 30.10.00 100,0 0,0 0,0 100,0 0,0 0,0 0 0 0 0,0 0,0 0 0 0 0 0 13.11.00 25,0 0,0 0,0 100,0 0,0 0,0 0 0 0 0,0 0,0 0 0 0 0 0 27.11.00 0,0 0,0 0,0 0,0 0,0 0,0 0 0 0 0,0 0,0 0 200 0 0 0 11.12.00 20,3 0,5 1,5 91,0 2,2 6,7 0 0 0 0,0 0,0 0 150 0 0 0 27.12.00 7,5 2,0 0,0 78,9 21,1 0,0 0 0 0 0,0 0,0 0 50 0 0 0 06.01.01 47,3 9,0 0,0 84,0 16,0 0,0 0 0 0 0,0 0,0 100 550 0 100 350 20.01.01 27,3 22,8 0,0 54,5 45,5 0,0 0 0 0 0,0 0,0 0 50 0 0 0 02.02.01 zuwenig Material 0 250 0 0 50 16.02.01 52,0 23,0 0,0 69,3 30,7 0,0 0 0 5 1,7 0,0 0 51700 0 50 450 02.03.01 MKS 17.03.01 28,8 1,5 0,0 95,0 5,0 0,0 0 0 0 0,0 0,0 0 50 0 0 0 01.04.01 76,8 0,0 0,0 100,0 0,0 0,0 0 0 0 0,0 0,0 150 200 50 0 0 13.04.01 91,5 8,5 0,0 91,5 8,5 0,0 0 0 0 0,0 0,0 100 0 0 150 700 03.05.01 83,5 16,5 0,0 83,5 16,5 0,0 10 1 2 4,3 0,0 0 0 0 0 200 10.05.01 95,5 4,5 0,0 95,5 4,5 0,0 0 0 0 0,0 0,0 0 100 0 50 150 23.05.01 54,3 1,8 0,0 96,9 3,1 0,0 2 0 0 0,7 0,0 0 0 0 0 100 07.06.01 99,8 0,0 0,3 99,8 0,0 0,3 7 1 8 5,3 0,0 0 0 0 0 0 21.06.01 75,0 0,0 0,0 100,0 0,0 0,0 0 5 3 2,7 0,0 0 0 0 0 0 06.07.01 49,3 0,8 0,0 98,5 1,5 0,0 0 0 5 1,7 0,0 0 50 0 0 0 19.07.01 75,0 0,0 0,0 100,0 0,0 0,0 0 1 0 0,3 0,0 0 50 0 0 0 02.08.01 99,5 0,5 0,0 99,5 0,5 0,0 0 3 12 5,0 0,0 0 0 0 0 0 16.08.01 97,5 2,5 0,0 97,5 2,5 0,0 0 1 3 1,3 0,0 0 0 0 0 0 30.08.01 92,3 7,8 0,0 92,3 7,8 0,0 0 0 5 1,7 0,0 0 0 0 0 100 13.09.01 82,8 17,3 0,0 82,8 17,3 0,0 0 37 13 16,7 0,0 0 0 0 0 0 27.09.01 89,3 10,8 0,0 89,3 10,8 0,0 1 0 9 3,3 0,0 0 0 0 0 100 11.10.01 97,3 2,8 0,0 97,3 2,8 0,0 18 0 13 10,3 3,0 0 0 0 0 50 25.10.01 60,8 14,3 0,0 81,0 19,0 0,0 12 3 15 10,0 0,0 0 0 0 0 100 08.11.01 80,5 17,8 1,8 80,5 17,8 1,8 1 3 26 10,0 0,0 0 100 0 0 50 Tabellenanhang 169 Tab. 38: Kotuntersuchungsergebnisse der Ellipsen-Wasserböcke: Eizahl pro Gramm Kot (EpG) und Larvenkultur. Ellipsen-Wasserböcke EpG Larvenkultur O=Ostertagia M=MDS E=Eimeria T=Trichostrongylus N=Nematodirus T=Trichuris C=Capillaria S=Strongyloides Alttiere Jungtier Alttiere Probe 3 Probe 4 Mittelwerte Probe 1 Probe 1 Probe 2 Probe 3 Datum M E M E M E C M E N T O T O T O T S 16.10.00 0 0 0 3000 0 750 0 0 0 0 0 0 0 0 30.10.00 0 0 0 4550 0 1138 0 0 0 0 0 0 0 0 13.11.00 0 0 0 7150 0 1788 0 0 0 0 0 0 0 0 27.11.00 0 0 50 0 13 50 0 0 0 0 0 0 0 0 11.12.00 0 5750 0 2600 0 2125 0 0 0 0 0 0 0 0 27.12.00 0 0 0 2250 0 575 0 3 0 2 0 10 13 0 06.01.01 0 250 0 0 50 288 0 34 66 36 53 35 65 0 20.01.01 50 700 0 1400 13 538 0 73 27 100 0 100 0 0 02.02.01 0 0 0 0 0 75 0 19 0 12 2 37 41 0 16.02.01 50 550 150 850 63 13388 0 96 4 38 62 34 66 0 02.03.01 MKS 17.03.01 100 750 0 100 25 225 0 100 0 75 0 93 7 0 01.04.01 0 0 0 0 38 50 13 98 2 97 3 98 2 0 13.04.01 0 0 0 0 63 175 0 97 3 5 5 93 1 0 03.05.01 0 650 0 150 0 250 0 0 2150 100 0 0 0 0 22 2 1 0 10.05.01 0 450 0 350 13 263 0 0 1 0 41 4 6 0 23.05.01 0 0 0 0 0 25 0 0 0 0 4 0 2 0 07.06.01 0 2750 0 0 0 688 0 50 89650 0 0 0 1 1 3 39 0 52 21.06.01 0 0 0 0 0 0 0 0 2650 50 0 0 0 0 1 0 0 0 06.07.01 0 450 0 0 0 125 0 0 0 0 0 0 0 0 19.07.01 0 700 0 100 0 213 0 0 3400 50 50 0 0 0 0 0 0 0 02.08.01 0 450 0 0 0 113 0 0 0 0 0 0 0 0 16.08.01 0 300 0 100 0 100 0 0 9700 0 0 0 0 0 0 0 0 0 30.08.01 0 50 0 0 0 38 0 50 16200 0 0 0 0 0 0 0 0 0 13.09.01 0 400 0 100 0 125 0 0 7900 0 0 0 0 0 0 0 0 0 27.09.01 0 0 0 0 0 25 0 0 17150 0 0 0 0 1 1 0 0 0 11.10.01 0 50 0 50 0 38 0 50 13200 0 0 0 0 0 0 0 0 0 25.10.01 0 150 0 100 0 88 0 0 14250 0 0 0 0 0 0 2 0 0 08.11.01 0 200 0 100 0 113 0 0 0 0 1 0 0 0 Tabellenanhang 170 Tab. 39: Kotuntersuchungsergebnisse der Ellipsen-Wasserböcke: Larvenkultur. Aufgrund der Rundung auf eine Stelle nach dem Komma ergibt die Summe der prozentualen Larvenanteile nicht immer genau 100. Kotuntersuchungsergebnisse der Impalas: Larvenkultur. Impala Larvenkultur O=Ostertagia T=Trichostrongylus S=Strongyloides N=Nematodirus O=Ostertagia Alttier Jungtier Alttiere / Jungtier T=Trichostr. Prob. 4 Probe 1 Mittelwerte %-Anteile Pr. 1 %-Ant. Datum O T O T S N O T S N O T S N O T O T 16.10.00 1 0 0,3 0,0 0,0 0,0 100,0 0,0 0,0 0,0 2 0 100 0 30.10.00 3 0 0,8 0,0 0,0 0,0 100,0 0,0 0,0 0,0 0 0 0 0 13.11.00 0 7 0,0 1,8 0,0 0,0 0,0 100,0 0,0 0,0 1 0 100 0 27.11.00 0 1 0,0 0,3 0,0 0,0 0,0 100,0 0,0 0,0 0 0 0 0 11.12.00 0 0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0 0 0 0 27.12.00 1 7 4,0 5,0 0,0 0,0 44,4 55,6 0,0 0,0 0 0 0 0 06.01.01 37 63 35,5 61,8 0,0 0,0 36,5 63,5 0,0 0,0 0 0 0 0 20.01.01 33 39 76,5 16,5 0,0 0,0 82,3 17,7 0,0 0,0 keine Proben02.02.01 69 32 34,3 18,8 0,0 0,0 64,6 35,4 0,0 0,0 nahme möglich 16.02.01 37 63 51,3 48,8 0,0 0,0 51,3 48,8 0,0 0,0 0 0 0 0 02.03.01 MKS 0 0 0 0 17.03.01 100 0 92,0 1,8 0,0 0,0 98,1 1,9 0,0 0,0 0 0 0 0 01.04.01 96 4 97,3 2,8 0,0 0,0 97,3 2,8 0,0 0,0 0 0 0 0 13.04.01 100 0 73,8 2,3 0,0 0,0 97,0 3,0 0,0 0,0 0 0 0 0 03.05.01 0 15 0 4 96 0 0,4 8,4 19,2 0,0 1,4 30,0 68,6 0,0 2 0 100 0 10.05.01 0 0 1,0 12,0 0,0 0,0 7,7 92,3 0,0 0,0 0 0 0 0 23.05.01 0 46 0,0 13,0 0,0 0,0 0,0 100,0 0,0 0,0 0 0 0 0 07.06.01 0 0 0 12 0 0 8,0 3,2 10,4 0,0 37,0 14,8 48,1 0,0 1 0 100 0 21.06.01 4 4 45 0 55 0 9,8 1,0 11,0 0,0 45,0 4,6 50,5 0,0 0 0 0 0 06.07.01 0 1 0,0 0,3 0,0 0,0 0,0 100,0 0,0 0,0 0 0 0 0 19.07.01 0 7 7 10 1 5 1,4 3,4 0,2 1,0 23,3 56,7 3,3 16,7 0 0 0 0 02.08.01 0 0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0 0 0 0 16.08.01 0 0 5 3 0 0 1,0 0,6 0,0 0,0 62,5 37,5 0,0 0,0 48 0 100 0 30.08.01 0 0 97 3 0 0 19,4 0,6 0,0 0,0 97,0 3,0 0,0 0,0 0 0 0 0 13.09.01 2 6 80 0 0 0 16,4 1,2 0,0 0,0 93,2 6,8 0,0 0,0 0 0 0 0 27.09.01 1 2 54 4 0 0 11,2 1,4 0,0 0,0 88,9 11,1 0,0 0,0 0 1 0 100 11.10.01 0 0 37 0 0 0 7,4 0,0 0,0 0,0 100,0 0,0 0,0 0,0 2 0 100 0 25.10.01 0 3 6 62 0 0 1,6 13,0 0,0 0,0 11,0 89,0 0,0 0,0 0 0 0 0 08.11.01 0 0 0,0 0,3 0,0 0,0 0,0 100,0 0,0 0,0 0 0 0 0 Ellipsen-Wasserböcke Larvenkultur Tabellenanhang 171 Tab. 40: Kotuntersuchungsergebnisse der Nyalas: Eizahl pro Gramm Kot (EpG) und Larvenkultur. EpG E =Eimeria Larvenkultur O=Ostertagia T=Trichostrongylus Alttiere Mit- Jung- Alttiere Pr. 1 Pr. 2 Pr. 3 telw. tier Probe 1 Probe 2 Probe 3 Mittelwert %-Anteile Datum E E E E E O T O T O T O T O T 16.10.00 0 0 0 0 0 0 0 0 0 0 0,0 0,0 0,0 0,0 30.10.00 0 0 0 0 0 0 0 0 0 0 0,0 0,0 0,0 0,0 13.11.00 0 0 0 0 0 0 0 0 0 0 0,0 0,0 0,0 0,0 27.11.00 100 0 100 67 0 0 0 0 0 0 0,0 0,0 0,0 0,0 11.12.00 0 0 0 0 0 0 0 0 0 0 0,0 0,0 0,0 0,0 27.12.00 0 0 0 0 0 0 0 0 0 0 0,0 0,0 0,0 0,0 06.01.01 0 50 50 33 0 0 0 0 0 0 0,0 0,0 0,0 0,0 20.01.01 0 50 0 17 0 0 0 0 0 0 0,0 0,0 0,0 0,0 02.02.01 0 0 0 0 0 0 0 0 0 0 0,0 0,0 0,0 0,0 16.02.01 0 100 800 300 0 0 0 0 0 0 0,0 0,0 0,0 0,0 02.03.01 0 0 50 17 0 0 0 0 0 0 0,0 0,0 0,0 0,0 17.03.01 0 0 0 0 0 0 0 0 0 0 0,0 0,0 0,0 0,0 01.04.01 0 0 0 0 0 0 0 0 0 0 0,0 0,0 0,0 0,0 13.04.01 0 0 0 0 0 0 0 0 0 0 0,0 0,0 0,0 0,0 03.05.01 50 0 0 17 4 14 0 0 4 1 2,7 5,0 34,8 65,2 10.05.01 0 0 0 0 0 0 0 0 0 0 0,0 0,0 0,0 0,0 23.05.01 0 0 0 0 0 0 1 0 0 0 0,3 0,0 100,0 0,0 07.06.01 50 0 50 33 0 0 0 0 0 0 0,0 0,0 0,0 0,0 21.06.01 50 50 0 33 0 0 0 0 0 0 0,0 0,0 0,0 0,0 06.07.01 100 0 50 50 0 0 0 0 0 0 0,0 0,0 0,0 0,0 19.07.01 0 0 0 0 0 0 0 0 0 0 0,0 0,0 0,0 0,0 02.08.01 0 0 0 0 0 0 0 0 0 0 0,0 0,0 0,0 0,0 16.08.01 0 0 0 0 0 0 0 0 0 0 0,0 0,0 0,0 0,0 30.08.01 0 0 0 0 0 0 0 0 0 0 0,0 0,0 0,0 0,0 13.09.01 0 0 0 0 0 0 0 0 0 0 0,0 0,0 0,0 0,0 27.09.01 0 0 0 0 0 0 0 0 0 0 0,0 0,0 0,0 0,0 11.10.01 0 0 0 0 1750 0 0 0 0 0 0 0,0 0,0 0,0 0,0 25.10.01 0 0 0 0 0 0 0 0 0 0 0,0 0,0 0,0 0,0 08.11.01 100 350 250 233 0 0 0 0 0 0 0,0 0,0 0,0 0,0 Nyala Tabellenanhang 172 Tab. 41: Kotuntersuchungsergebnisse der Pferdeantilopen: Eizahl pro Gramm Kot (EpG). Pferdeantilopen EpG M=MDS C=Capillaria T=Trichuris N=Nematodirus E=Eimeria Probe 1 Probe 2 Probe 3 Mittelwerte Datum M C T N E M C T N E M C T N E M C T N E 16.10.00 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 30.10.00 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 13.11.00 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 27.11.00 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 11.12.00 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 27.12.00 0 0 0 0 0 0 0 0 50 0 50 0 0 0 0 17 0 0 17 0 06.01.01 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 20.01.01 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 02.02.01 0 0 0 0 0 0 0 0 0 0 50 0 0 0 0 17 0 0 0 0 16.02.01 0 0 0 0 0 0 0 0 0 0 50 50 50 0 0 17 17 17 0 0 02.03.01 MKS 17.03.01 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 01.04.01 0 0 0 0 0 0 0 50 0 0 0 0 50 0 0 0 0 33 0 0 13.04.01 50 0 0 0 0 0 0 0 0 0 150 0 0 0 0 67 0 0 0 0 Tier 1 Tier 2 Tier 3 Mittelwerte M C T N E M C T N E M C T N E M C T N E 03.05.01 0 0 0 0 0 0 50 400 0 0 50 50 750 0 0 17 33 383 0 0 10.05.01 0 0 0 0 0 0 0 500 0 0 0 0 750 0 0 0 0 417 0 0 23.05.01 50 0 0 0 0 0 0 0 0 0 0 50 50 0 0 17 17 17 0 0 07.06.01 0 0 0 0 0 0 50 0 0 0 0 0 50 0 200 0 17 17 0 67 21.06.01 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 06.07.01 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 19.07.01 0 0 0 0 0 0 0 0 0 0 50 0 0 0 0 17 0 0 0 0 02.08.01 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 16.08.01 50 0 0 0 0 0 0 0 0 0 0 0 0 0 300 17 0 0 0 100 30.08.01 200 0 0 0 0 0 0 0 0 0 0 0 0 0 700 67 0 0 0 233 13.09.01 100 0 0 0 0 0 50 0 0 50 0 0 0 0 0 33 17 0 0 17 27.09.01 100 0 0 0 0 0 0 0 0 0 50 0 0 0 0 50 0 0 0 0 Probe 1 Probe 2 Probe 3 Mittelwerte M C T N E M C T N E M C T N E M C T N E 11.10.01 150 0 0 0 0 50 0 0 0 0 100 0 0 0 0 100 0 0 0 0 25.10.01 100 0 0 0 0 50 0 0 0 0 100 50 0 0 0 83 17 0 0 0 08.11.01 150 0 0 0 0 50 0 0 0 0 50 0 0 0 0 83 0 0 0 0 Tabellenanhang 173 Tab. 42: Kotuntersuchungsergebnisse der Pferdeantilopen: Larvenkultur. Aufgrund der Rundung auf eine Stelle nach dem Komma ergibt die Summe der prozentualen Larvenanteile nicht immer genau 100. Pferdeantilopen Larvenkultur O=Ostertagia T=Trichostrongylus C=Cooperia Oe= Oesophagostomum Probe 1 Probe 2 Probe 3 Mittelwerte %-Anteile Datum O T C Oe O T C Oe O T C Oe O T C Oe O T C Oe 16.10.00 0 0 0 0 0 0 0 0 0 0 0 0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 30.10.00 0 0 0 0 0 0 0 0 0 0 0 0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 13.11.00 2 2 0 0 2 7 0 0 0 0 0 0 1,3 3,0 0,0 0,0 30,8 69,2 0,0 0,0 27.11.00 20 7 0 0 0 12 2 0 0 1 0 0 6,7 6,7 0,7 0,0 47,6 47,6 4,8 0,0 11.12.00 6 1 0 0 27 73 0 0 15 8 0 0 16,0 27,3 0,0 0,0 36,9 63,1 0,0 0,0 27.12.00 0 3 0 0 0 99 1 0 2 8 0 0 0,7 36,7 0,3 0,0 1,8 97,3 0,9 0,0 06.01.01 6 7 0 0 0 0 0 0 2 1 0 0 2,7 2,7 0,0 0,0 50,0 50,0 0,0 0,0 20.01.01 5 34 7 0 1 2 0 0 0 58 10 0 2,0 31,3 5,7 0,0 5,1 80,3 14,5 0,0 02.02.01 4 30 1 0 4 2 0 0 0 16 1 0 2,7 16,0 0,7 0,0 13,8 82,8 3,4 0,0 16.02.01 1 28 13 0 1 78 21 0 0 81 19 0 0,7 62,3 17,7 0,0 0,8 77,3 21,9 0,0 02.03.01 MKS 17.03.01 1 62 35 2 31 24 3 35 0 49 51 0 10,7 45,0 29,7 12,3 10,9 46,1 30,4 12,6 01.04.01 0 76 23 1 5 16 0 4 12 61 8 19 5,7 51,0 10,3 8,0 7,6 68,0 13,8 10,7 13.04.01 9 72 19 0 6 61 33 0 28 52 15 5 14,3 61,7 22,3 1,7 14,3 61,7 22,3 1,7 Tier1 Tier 2 Tier 3 Mittelwerte %-Anteile O T C Oe O T C Oe O T C Oe O T C Oe O T C Oe 03.05.01 2 79 19 0 8 35 0 0 3 83 14 0 4,3 65,7 11,0 0,0 5,3 81,1 13,6 0,0 10.05.01 6 14 8 0 5 30 1 0 1 67 32 0 4,0 37,0 13,7 0,0 7,3 67,7 25,0 0,0 23.05.01 4 55 41 0 4 21 14 0 1 68 31 0 3,0 48,0 28,7 0,0 3,8 60,3 36,0 0,0 07.06.01 4 62 35 0 25 59 16 0 0 55 45 0 9,7 58,7 32,0 0,0 9,6 58,5 31,9 0,0 21.06.01 0 0 0 0 0 0 0 0 0 0 0 0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 06.07.01 2 0 0 0 1 0 0 0 1 0 1 0 1,3 0,0 0,3 0,0 80,0 0,0 20,0 0,0 19.07.01 3 0 0 0 6 0 0 0 19 15 0 0 9,3 5,0 0,0 0,0 65,1 34,9 0,0 0,0 02.08.01 38 18 0 0 64 28 0 0 66 10 0 0 56,0 18,7 0,0 0,0 75,0 25,0 0,0 0,0 16.08.01 83 17 0 0 92 8 0 0 79 21 0 0 84,7 15,3 0,0 0,0 84,7 15,3 0,0 0,0 30.08.01 87 13 0 0 92 8 0 0 86 14 0 0 88,3 11,7 0,0 0,0 88,3 11,7 0,0 0,0 13.09.01 90 10 0 0 86 13 1 0 71 28 1 0 82,3 17,0 0,7 0,0 82,3 17,0 0,7 0,0 27.09.01 34 66 0 0 51 49 0 0 31 69 0 0 38,7 61,3 0,0 0,0 38,7 61,3 0,0 0,0 Probe 1 Probe 2 Probe 3 Mittelwerte %-Anteile O T C Oe O T C Oe O T C Oe O T C Oe O T C Oe 11.10.01 84 16 0 0 52 48 0 0 93 6 1 0 76,3 23,3 0,3 0,0 76,3 23,3 0,3 0,0 25.10.01 6 93 1 0 4 96 0 0 40 59 1 0 16,7 82,7 0,7 0,0 16,7 82,7 0,7 0,0 11.11.01 24 76 0 0 9 91 0 0 4 95 1 0 12,3 87,3 0,3 0,0 12,3 87,3 0,3 0,0 Tabellenanhang 174 Tab. 43: Kotuntersuchungsergebnisse der Defassa-Wasserböcke: Eizahl pro Gramm Kot (EpG) und Larvenkultur. Defassa-Wasserböcke EpG Larvenkultur T=Trichostrongylus E=Eimeria M=MDS C=Capillaria O=Ostertagia Probe 1 Probe 2 Probe 3 Prob.4 Mittelwerte Prob.1 Prob.2 Prob.3 P.4 Datum E M E M C E M C E C E M C T O T O T O T 16.10.00 250 0 4150 0 0 100 0 0 0 0 1125 0 0 0 0 0 0 0 0 0 30.10.00 200 0 0 100 0 0 0 0 0 0 50 25 0 0 0 100 0 0 0 0 13.11.00 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 27.11.00 250 0 200 50 0 100 0 0 50 0 150 13 0 0 0 7 6 0 0 4 11.12.00 50 0 650 0 0 0 0 0 0 0 175 0 0 100 0 14 0 1 0 0 27.12.00 1450 0 0 0 0 150 0 0 200 0 450 0 0 2 0 10 0 2 0 3 06.01.01 600 0 0 0 0 0 0 0 100 0 175 0 0 92 0 100 0 0 0 30 20.01.01 1300 0 0 0 0 350 0 0 0 0 413 0 0 100 0 100 0 35 0 1 02.02.01 0 200 0 50 0 1150 0 50 100 0 313 63 13 100 0 100 0 19 0 64 16.02.01 450 0 0 100 50 500 0 50 350 50 325 25 38 100 0 100 0 0 0 19 02.03.01 MKS 17.03.01 0 50 0 50 0 50 0 0 0 0 13 25 0 100 0 100 0 100 0 100 01.04.01 4900 50 350 50 0 4800 0 0 350 0 2600 25 0 100 0 100 0 83 0 100 13.04.01 150 0 300 0 0 0 0 0 150 0 0 0 0 0 0 100 0 03.05.01 2250 0 4600 0 0 0 0 0 2283 0 0 100 0 36 0 88 0 10.05.01 700 50 0 0 0 0 0 0 233 17 0 70 0 31 0 81 0 23.05.01 0 0 0 0 0 0 0 50 0 0 17 34 0 31 0 23 0 07.06.01 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 52 0 21.06.01 0 0 0 0 0 0 0 50 0 0 17 3 0 1 0 71 0 06.07.01 150 0 550 0 0 0 0 0 233 0 0 0 0 0 0 0 0 19.07.01 50 0 50 0 0 0 0 0 33 0 0 0 0 0 0 1 0 02.08.01 200 0 400 0 0 0 0 0 200 0 0 5 2 0 0 23 5 16.08.01 300 0 150 0 0 50 0 0 167 0 0 0 0 0 0 10 0 30.08.01 0 0 250 0 0 0 0 0 83 0 0 2 0 0 0 35 9 13.09.01 0 0 0 0 0 0 0 0 0 0 0 60 2 4 0 2 0 27.09.01 keine Probennahme möglich 11.10.01 keine Probennahme möglich 25.10.01 600 0 200 0 0 0 150 50 267 50 17 5 0 0 0 98 2 08.11.01 0 0 400 0 50 0 50 0 133 17 17 8 0 5 0 95 5 Tabellenanhang 175 Tab. 44: Kotuntersuchungsergebnisse der Defassa-Wasserböcke: Larvenkultur. Kotuntersuchungsergebnisse der Litschi-Moorantilopen: Eizahl pro Gramm Kot (EpG). Litschi-Moorantilopen EpG Defassa-Wasserböcke Larvenkultur O=Ostertagia E=Eimeria M=MDS C=Capillaria T=Trichostrongylus Mittelw. %-Anteile Probe 1 Probe 2 Probe 3 Pr. 4 Probe 5 Probe 6 Datum T O T O E M E M E M C E E ME M C T 16.10.00 0,0 0,0 0,0 0,0 750 0 100 0 500 0 0 600 0 0 2450 0 0 0 30.10.00 25,0 0,0 100,0 0,0 400 0 100 0 1600 50 0 500 450 0 900 0 0 0 13.11.00 0,0 0,0 0,0 0,0 150 0 0 0 300 0 0 0 1500 0 650 0 0 0 27.11.00 2,8 1,5 64,7 35,3 1450 0 4500 0 6750 0 0 5450 500 0 3050 0 0 0 11.12.00 28,8 0,0 100,0 0,0 200 0 0 0 1300 100 0 25300 400 0 150 0 0 0 27.12.00 4,3 0,0 100,0 0,0 500 650 250 250 550 0 0 200 300 0 0 0 0 0 06.01.01 55,5 0,0 100,0 0,0 550 0 1950 0 0 250 0 0 200 0 0 0 0 0 20.01.01 59,0 0,0 100,0 0,0 100 0 86900 350 250 0 50 2450 0 0 700 0 0 0 02.02.01 70,8 0,0 100,0 0,0 600 200 100 0 150 0 50 0 0 50 100 700 0 0 16.02.01 54,8 0,0 100,0 0,0 350 300 0 0 150 0 50 0 50 0 50 0 0 0 02.03.01 MKS 17.03.01 100,0 0,0 100,0 0,0 150 0 0 0 4750 0 0 0 150 0 650 0 0 50 01.04.01 95,8 0,0 100,0 0,0 150 0 0 0 2050 0 0 500 150 0 50 0 0 0 13.04.01 33,3 0,0 100,0 0,0 0 0 2950 0 150 0 0 150 0 0 250 0 0 0 03.05.01 74,7 0,0 100,0 0,0 350 0 200 0 300 0 0 0 350 0 600 0 0 0 10.05.01 60,7 0,0 100,0 0,0 100 0 0 0 0 0 0 0 50 0 0 0 0 0 23.05.01 29,3 0,0 100,0 0,0 250 0 0 0 0 0 0 0 100 50 0 0 0 0 07.06.01 17,3 0,0 100,0 0,0 350 0 0 0 150 0 0 0 0 0 0 0 0 0 21.06.01 25,0 0,0 100,0 0,0 350 0 450 0 50 0 0 250 50 0 50 0 0 0 06.07.01 0,0 0,0 0,0 0,0 100 0 100 0 200 0 0 300 50 0 0 0 0 0 19.07.01 0,3 0,0 100,0 0,0 0 0 100 0 100 0 0 50 300 0 50 0 0 0 02.08.01 9,3 2,3 80,0 20,0 0 0 250 50 50 0 0 0 50 0 50 50 0 0 16.08.01 3,3 0,0 100,0 0,0 150 0 11900 100 50 0 0 50 0 0 0 0 0 0 30.08.01 12,3 3,0 80,4 19,6 150 0 950 0 100 0 0 500 300 0 50 0 0 0 13.09.01 22,0 0,7 97,1 2,9 0 0 50 0 50 0 50 200 50 0 0 0 0 0 27.09.01 keine Probennahme 0 0 0 0 50 0 0 0 50 0 0 0 0 0 11.10.01 möglich 0 0 1600 0 50 0 0 100 0 0 350 0 0 0 25.10.01 34,3 0,7 98,1 1,9 900 0 0 0 900 0 50 100 350 0 150 0 50 0 08.11.01 36,0 1,7 95,6 4,4 500 0 5050 0 0 0 0 250 0 0 1250 0 50 0 Tabellenanhang 176 Tab. 45: Kotuntersuchungsergebnisse der Litschi-Moorantilopen: Eizahl pro Gramm Kot (EpG) und Larvenkultur. Larvenkultur Litschi-Moorantilopen EpG E=Eimeria M=MDS T=Trichostrongylus O=Ostertagia C=Capillaria T=Trichuris Mittelwerte Probe1 Probe2 Probe3 Probe4 P.5 Probe 6 Mittelw. %-Anteile Datum E M C T T O T O T O T O T T O T O T O 16.10.00 733 0 0 0 0 0 0 0 0 0 0 0 23 0 0 3,8 0,0 100,0 0,0 30.10.00 658 8 0 0 0 0 0 0 0 0 0 0 4 0 0 0,7 0,0 100,0 0,0 13.11.00 433 0 0 0 0 0 0 0 0 0 0 0 0 4 0 0,7 0,0 100,0 0,0 27.11.00 3617 0 0 0 0 0 0 0 0 2 0 0 0 2 2 0,3 0,7 33,3 66,7 11.12.00 4558 17 0 0 0 0 0 0 0 0 0 0 100 0 0 16,7 0,0 100,0 0,0 27.12.00 300 150 0 0 100 0 2 0 100 0 0 0 0 0 0 33,7 0,0 100,0 0,0 06.01.01 450 42 0 0 14 0 0 0 9 0 15 0 100 0 0 23,0 0,0 100,0 0,0 20.01.01 15067 58 8 0 0 0 100 0 100 0 0 0 0 0 0 33,3 0,0 100,0 0,0 02.02.01 158 158 8 0 100 0 6 0 8 0 100 0 2 100 0 52,7 0,0 100,0 0,0 16.02.01 100 50 8 0 100 0 0 0 0 0 0 0 5 0 0 17,5 0,0 100,0 0,0 02.03.01 MKS 17.03.01 950 0 0 8 0 0 0 0 0 0 0 0 0 0 0 0,0 0,0 0,0 0,0 01.04.01 483 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0,0 0,0 0,0 0,0 13.04.01 583 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0,0 0,0 0,0 0,0 03.05.01 300 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0,0 0,0 0,0 0,0 10.05.01 25 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0,2 0,0 100,0 0,0 23.05.01 58 8 0 0 7 1 3 0 0 0 4 0 0 0 0 2,3 0,2 93,3 6,7 07.06.01 83 0 0 0 15 0 2 0 0 0 0 0 1 0 0 3,0 0,0 100,0 0,0 21.06.01 200 0 0 0 80 1 0 0 5 3 0 0 1 0 0 14,3 0,7 95,6 4,4 06.07.01 125 0 0 0 3 0 0 0 2 0 9 0 42 0 0 9,3 0,0 100,0 0,0 19.07.01 100 0 0 0 4 0 0 0 0 0 0 0 0 1 0 0,8 0,0 100,0 0,0 02.08.01 67 17 0 0 0 0 0 0 8 4 4 1 0 3 0 2,5 0,8 75,0 25,0 16.08.01 2025 17 0 0 18 0 0 0 100 0 0 0 12 2 0 22,0 0,0 100,0 0,0 30.08.01 342 0 0 0 0 0 0 0 27 0 0 0 0 1 0 4,7 0,0 100,0 0,0 13.09.01 58 0 8 0 0 0 2 0 0 0 0 0 0 3 0 0,8 0,0 100,0 0,0 27.09.01 17 0 0 0 0 0 8 0 1 0 6 0 0 2 0 2,8 0,0 100,0 0,0 11.10.01 350 0 0 0 4 0 0 0 0 0 6 0 0 0 0 1,7 0,0 100,0 0,0 25.10.01 400 0 17 0 0 0 43 12 0 0 0 0 0 0 0 7,2 2,0 78,2 21,8 08.11.01 1175 0 8 0 19 0 0 0 0 0 0 0 0 9 3 4,7 0,5 90,3 9,7 Tabellenanhang 177 Tab. 46: Ergebnisse der Grasprobenuntersuchungen Grasproben Larvenanzahl pro Kilogramm Trockenmasse Gras O=Ostertagia T=Trichostronglyus N=Nematodirus C=Cooperia Oe=Oesophagostomum Gehege Gehege Afrika 1 Gehege Afrika 2 Gehege Afrika3 Datum O T N C Oe O T N O T 17.10.00 1063 0 0 68 0 0 0 38 57 0 31.10.00 5825 8 11 85 0 0 0 0 3200 556 14.11.00 1237 108 17 84 0 27.11.00 1214 0 13 41 21 11.12.00 505 164 95 14 0 27.12.00 06.01.01 20.01.01 02.02.01 16.02.01 02.03.01 17.03.01 01.04.01 13.04.01 0 0 0 0 0 0 0 0 0 81 03.05.01 0 0 69 0 0 0 0 0 0 0 10.05.01 23 0 34 0 0 0 0 0 0 0 23.05.01 0 0 29 0 0 0 0 0 0 0 08.06.01 27 12 770 15 0 0 0 0 0 0 22.06.01 73 11 346 0 0 0 0 0 0 0 05.07.01 51 17 72 0 0 0 0 0 0 0 20.07.01 79 0 62 0 0 18 0 23 0 71 02.08.01 71 0 0 0 0 0 0 13 0 0 16.08.01 69 5 5 11 0 0 20 0 0 16 31.08.01 86 42 0 21 0 22 0 0 0 0 13.09.01 152 13 0 14 0 0 0 0 0 0 28.09.01 956 27 0 27 0 14 0 0 0 160 12.10.01 460 110 16 0 0 0 0 0 0 0 26.10.01 2480 206 0 0 0 174 0 0 142 834 09.11.01 598 58 19 0 0 0 0 0 135 135 Tabellenanhang 178 Tab. 47: Meteorologische Daten vom 01. Oktober 2000 bis 14. November 2001: Tageshöchsttemperaturen und Tagestiefsttemperaturen mit den jeweiligen Mittelwerten (Ø) aus fünf aufeinanderfolgenden Tagen Datum 01.-05. 06.-10. 11.-15. 16.-20. 21.-25. 26.-30. 31.-04. 05.-09. 10.-14. 15.-19. 20.-24. 25.-29. 30.-04. 05.-09. 10.-14. 15.-19. 20.-24. 25.-29. 30.-03. 04.-08. 09.-13. 14.-18. 19.-23 24.-28. 29.-02. 03.-07. 08.-12. 13.-17. 18.-22. 23.-27. 28.-04. 05.-09. 10.-14. 15.-19. 20.-24. 25.-29. 30.-03. 04.-08. 09.-13. Tageshöchsttemperaturen in °C Ø Tagestiefsttemperaturen in °C Ø Tag 1 Tag 2 Tag 3 Tag 4 Tag 5 T.1-5 Tag 1 Tag 2 Tag 3 Tag 4 Tag 5 T.1-5 Okt 19,5 18,4 15,9 19,6 16,9 18,1 7,8 10 7,4 5,7 7,2 7,6 13,6 10,5 14,7 12,7 12,4 12,8 6,6 5,5 2,2 6,1 5,6 5,2 14,3 16,5 17,1 17 12,6 15,5 5,2 5,9 7,2 4,6 7,3 6 19,4 13,5 14,8 10,1 13,3 14,2 10,8 5,6 2,1 3,4 10 6,4 16 19,3 18,8 13,8 12,4 16,1 8 7,7 7,4 10,8 9,5 8,7 12,4 11,5 12,6 13,6 13,9 12,8 7,2 6,5 9,7 7,5 7,9 7,8 Nov 11,1 11,9 11,3 10,3 10,9 11,1 7,3 6,4 3,4 5,2 2,8 5 10 6,6 11,7 12 10 10,1 2,7 2,2 5,5 4,9 7,4 4,5 8,5 9,1 10,7 10 9,9 9,6 6,2 5 4,4 8,1 6,2 6 8,9 9,5 6,6 5,5 8,8 7,9 1 4,2 4 3,3 4,1 3,3 9,2 8,7 9,5 8 8,6 8,8 3,7 0,1 1,5 1,4 4,4 2,2 7,8 9,3 7,4 12,2 12,6 9,9 -0,7 1,5 2,6 2,3 7 2,5 Dez 12,6 11,8 11,5 10,2 8,5 10,9 3,5 5,1 6,4 6,7 1 4,5 10,6 9,6 11,2 13 11,7 11,2 4,6 5,9 5,6 6,8 5,7 5,7 9,2 11,7 12,9 12,3 9,5 11,1 5,5 7,6 10,6 8,4 4,9 7,4 6,4 4,5 4,2 3,7 1,3 4,0 3 0,9 2 0,2 -4 0,4 1,4 -1,1 -2 -0,9 -0,5 -0,6 -1,8 -4,1 -7,3 -12 -9 -6,8 -0,7 -1,7 -0,5 0,7 1,7 -0,1 -3,5 -11 -2,7 -0,5 -1,3 -3,8 Jan 0,9 2 1,4 5,7 6,4 3,3 -2,5 -3,2 -4 1,4 0,6 -1,5 5,3 7,4 8,1 8,3 5,1 6,8 -0,5 3,8 4,3 2,4 1,7 2,3 5,2 3,8 3 -0,7 -2,7 1,7 3,8 0,7 -5,1 -3,9 -4,5 -1,8 -1,1 -2 -0,4 -2,6 -0,9 -1,4 -5,8 -4,1 -5,5 -6,5 -7,3 -5,8 -1,2 -1,4 -0,2 0,3 5,8 0,7 -3,4 -4 -2,4 -1,7 -0,1 -2,3 10,7 8,5 7 3,9 2,3 6,5 4,1 1,3 1,7 -0,3 0,3 1,4 Feb 3,3 2,4 3,3 1,3 -1 1,9 -0,8 0,4 -0,4 -2,3 -5,3 -1,7 -3,4 -3,7 5,6 10,1 12,2 4,2 -8,9 -5,2 -5 4,9 6,4 -1,6 13,8 8,1 4,8 11 13,5 10,2 6,3 -1,6 -5 -0,4 5,5 1 7,2 7,7 9,1 9,4 4,8 7,6 3,3 0,5 -3,6 -3,6 0,7 -0,5 7,3 4,5 7,2 7,7 5,5 6,4 0,4 1,1 2,7 3,7 1 1,8 2,1 -0,3 2,5 2,5 4,3 2,2 -4,8 -11 -2,5 -1,6 -4,2 -4,8 Mär 7 1,6 1,3 0,5 0,8 2,2 -2,3 -2,5 -1,6 -2 -2,4 -2,2 4,4 6 5,5 10,6 13,5 8,0 -3,6 -6,2 -3,1 2,7 6,9 -0,7 12,1 13,7 12,2 10,3 7,6 11,2 7,8 9,1 3,1 -0,1 2,4 4,5 9 9,4 4,4 2,3 5,8 6,2 3 1,3 -0,5 0,3 -2,3 0,4 3,6 3,9 1 2,3 1,9 2,5 -4,9 -5 -0,5 -0,6 0,6 -2,1 1,8 6 4,1 4 11,3 5,4 0,1 -0,7 -3,6 -3,4 0,9 -1,3 Apr 11,3 13,7 15,3 21,4 15,7 15,5 0,3 3,8 6,1 5,6 5,1 4,2 17,5 11,9 12,1 12,7 12,9 13,4 5 5,2 5,2 4,4 0,1 4 12,9 12,1 8,7 7 6,2 9,4 -0,2 7,1 3,3 -0,5 -2,6 1,4 Tabellenanhang 179 Tageshöchsttemperaturen in °C Ø Tagestiefsttemperaturen in °C Ø Datum Tag 1 Tag 2 Tag 3 Tag 4 Tag 5 T.1-5 Tag 1 Tag 2 Tag 3 Tag 4 Tag 5 T.1-5 14.-18. Apr 5,8 8,3 6,5 6,6 5,9 6,6 -3,5 -0,3 4,1 3,1 0,7 0,8 19.-23 8,4 8,3 11,1 12,3 13,9 10,8 0,3 -0,3 -0,8 -1,8 -1,7 -0,9 24.-28. 16,7 11,7 14,6 12,4 13 13,7 -0,9 8,4 5,3 4,2 2,6 3,9 29.-03. Mai 18,1 21,7 20,6 20,8 27,1 21,7 3,9 10,8 7,9 4,8 11 7,7 04.-08. 12,7 13,7 15,2 15,5 20,9 15,6 6,2 5,3 5,6 4,3 4,6 5,2 09.-13. 23 25 23,2 23,2 23,7 23,6 5,6 9,6 6,9 6,1 6,2 6,9 14.-18. 25,3 18,9 20,9 20,3 14 19,9 8,7 7,9 6,8 8,5 5,4 7,5 19.-23 15,6 15,5 16,1 18,8 23,3 17,9 4,3 3,6 5,5 4,6 3,6 4,3 24.-28. 23,5 21,2 23,5 22,4 16,5 21,4 6,5 5,4 5,3 9,8 14,3 8,3 29.-02. Jun 20,1 18,8 17,4 16,4 14,5 17,4 10,1 8,5 6,8 7,6 6,5 7,9 03.-07. 11 11,3 17,1 20,2 15,6 15,0 6 7,5 8,6 8,5 9 7,9 08.-12. 15,8 16,4 15 15,9 16,3 15,9 5,9 4,6 4,7 3,3 4,7 4,6 13.-17. 18,9 19,1 23,8 22,7 20,4 21,0 2,1 8,2 6,6 12 12,5 8,3 18.-22. 19 14,9 21,5 19,5 15,2 18,0 11,4 5,5 3,4 10,3 9,9 8,1 23.-27. 17,9 19 19,9 25,5 29,1 22,3 11,1 9,8 8,6 9,3 14,9 11 28.-02. Jul 23,3 24,5 26 20,9 21,4 23,2 13,4 12,4 13 12,2 12 13 03.-07. 24,7 27 29,8 30,5 29,3 28,3 10,3 12 16,8 16,2 18,4 15 08.-12. 20,8 20,8 24,4 21,5 21,2 21,7 16 15,4 12,8 12,6 12,7 14 13.-17. 20,6 20,7 19,1 14,6 21,6 19,3 11,5 12,6 11,9 9,8 8,6 11 18.-22. 22,7 22,8 21,2 22,4 27 23,2 10,8 12,6 12 12,7 13,9 12 23.-27. 27,1 27,5 25,8 27,3 29,6 27,5 16,7 16,3 15,2 13,5 13,2 15 28.-01. Aug 28,5 25,9 26,8 23,2 21,4 25,2 16,8 15 14,9 13,5 10,3 14 02.-06. 25,2 25,8 23,3 19 21,1 22,9 8,8 13,7 11,9 11,9 9,8 11 07.-11. 20,3 21,4 19,5 17,6 19,3 19,6 15 13,9 13,1 9,7 9,5 12 12.-16. 19,8 18,3 28 33,9 28,5 25,7 12,6 14,6 17,4 17,1 17,4 16 17.-21. 24,5 25,1 26,6 23,4 25,9 25,1 12,7 12,5 17,7 14,2 14,2 14 22.-26. 26,9 27,7 29,9 31,8 32,9 29,8 12,3 14,6 19 16 17,4 16 27.-31. 19,9 18,8 21 23 21,3 20,8 11,6 10,3 9 10,1 10,9 10 01.-05. Sep 19,7 17,2 17,8 17,9 20,2 18,6 9,6 9,3 12,4 11,8 9,4 11 06.-10. 13,3 16,6 14 12,8 14,2 14,2 8 10,6 7,9 8 10,7 9 11.-15. 12,4 17,1 17,6 17,4 14,5 15,8 9,9 10,1 7,8 7,5 8 8,7 16.-20. 14,3 15,5 15 16,9 13,2 15,0 7,2 4,8 2,5 8,2 10,1 6,6 21.-25. 13,8 14,4 15,3 17 16,1 15,3 11 9,1 9,6 8,3 7,3 9,1 26.-30. 16,8 13 14 20,7 16,8 16,3 7,8 8,2 10,5 9,9 9,7 9,2 01.-05. Okt 18,1 19,6 16,9 16,4 17,7 17,7 10,2 14 11,8 11,3 8,4 11 06.-10. 19,9 17,6 17,3 17,3 16,1 17,6 7,3 11,1 9 9,3 11,7 9,7 11.-15. 14,6 20,4 21,6 23,5 20,9 20,2 12,2 8,2 7,3 10,7 10 9,7 16.-20. 18,2 14,6 16,8 18,4 14,9 16,6 5,7 3,2 9,5 9 7,3 6,9 21.-25. 11,3 15,2 11,9 9,5 13,7 12,3 8 11 9,5 7,5 8,1 8,8 26.-30. 15,6 13,9 14,3 11,5 18,1 14,7 8,6 8,4 9,1 8,5 11,4 9,2 31.-04. Nov 16,2 9,7 12,8 11,4 10,1 12,0 6,7 5,7 7,3 9,5 8 7,4 05.-09. 9,6 9,9 8,4 6,8 4,8 7,9 4 5 5,3 -0,4 -3,3 2,1 10.-14. 5,1 5,5 9 6,9 6,1 6,5 -5,1 2,2 2,1 -2 -2,3 -1 Tabellenanhang 180 Tab. 48: Meteorologische Daten vom 01. Oktober 2000 bis 14. November 2001: Tagesniederschlagsmengen in mm mit den Mittelwerten aus fünf aufeinanderfolgenden Tagen Datum 01.-05. 06.-10. 11.-15. 16.-20. 21.-25. 26.-30. 31.-04. 05.-09. 10.-14. 15.-19. 20.-24. 25.-29. 30.-04. 05.-09. 10.-14. 15.-19. 20.-24. 25.-29. 30.-03. 04.-08. 09.-13. 14.-18. 19.-23 24.-28. 29.-02. 03.-07. 08.-12. 13.-17. 18.-22. 23.-27. 28.-04. 05.-09. 10.-14. 15.-19. 20.-24. 25.-29. 30.-03. 04.-08. 09.-13. 14.-18. 19.-23 Tag Tag Tag Tag Tag T.1-5 Datum 1 2 3 4 5 Ø Okt 4,4 0 0 0 2,7 1,4 24.-28. 3,2 0 2,2 1,6 1,2 1,6 29.-03. 0,7 1,3 0,1 0 0,2 0,5 04.-08. 0 0,3 0 1 0 0,3 09.-13. 0 0 4,1 1,3 0,1 1,1 14.-18. 0,7 4,6 0,2 0,8 1,1 1,5 19.-23 Nov 0,1 1,9 0,4 0,7 0,4 0,7 24.-28. 0 6,9 0 0 0 1,4 29.-02. 0 0 1,9 1 0,1 0,6 03.-07. 0,3 0 2,9 0 0,3 0,7 08.-12. 0 1,6 3,9 2,3 0 1,6 13.-17. 0,2 0,2 2,1 5,6 0,1 1,6 18.-22. Dez 0 3,2 0 0 0,6 0,8 23.-27. 0,1 0,2 2,9 0,2 0,5 0,8 28.-02. 2,7 4,8 2,8 1,9 0 2,4 03.-07. 14 0,7 1 0 0 3 08.-12. 0 0 0 0 8 1,6 13.-17. 0,5 0,8 1,2 0,6 3,1 1,2 18.-22. Jan 1,1 0 8,3 0 0,8 2 23.-27. 1,7 19,5 0,3 0 0,5 4,4 28.-01. 0,8 0 0 0 0 0,2 02.-06. 0 0 0 0 0 0 07.-11. 0 2,5 2,8 2,4 2,1 2 12.-16. 0,8 4,4 1,1 9,8 3 3,8 17.-21. Feb 0,9 1 1,1 0,4 1,3 0,9 22.-26. 2,5 17,2 3,1 2,2 1,3 5,3 27.-31. 1,6 0,4 0 0 2,4 0,9 01.-05. 0 0 0 5 0 1 06.-10. 0 0,6 0,8 1 3,1 1,1 11.-15. 0 0 1 0 0 0,2 16.-20. Mär 0 6,4 0 0,1 0,4 1,4 21.-25. 0 0 0 0,1 3 0,6 26.-30. 5,4 1,2 0 5,2 1,7 2,7 01.-05. 0,5 0,5 3,8 7,7 2,4 3 06.-10. 0 1,4 0,3 20 0 4,3 11.-15. 0,1 0 0 4,4 1,4 1,2 16.-20. Apr 0,4 0,1 0 0 0 0,1 21.-25. 1,1 4,4 3,7 0,4 0,6 2 26.-30. 0 1,2 0 1 0 0,4 31.-04. 5,5 8,5 0,5 2,3 7,1 4,8 05.-09. Apr 0,6 0,9 0 0 0 0,3 10.-14. Tag Tag Tag Tag Tag T.1-5 1 2 3 4 5 Ø Apr 1,1 14,8 2,3 3,8 1 4,6 Mai 3 0,9 0 0 2,1 1,2 0 0 0 0 0 0 0 0 0 0 0 0 0 0 7,1 0,2 0,4 1,5 0 0 0 0 0 0 0 0 0 2,4 0,5 0,6 Jun 0 0 15,4 5 8 5,7 11,5 1,5 0 7,8 2,6 4,7 3,3 0,3 0,3 0,3 2,4 1,3 0 0 3,8 2,9 21,3 5,6 1,5 0 0 2,8 3,2 1,5 0 0 0 0 0,7 0,1 Jul 0 0 20,2 0 0 4 0 0 0 0 11,6 2,3 1,3 1 3,7 1,5 0,8 1,7 1,5 6,1 3,4 4,4 0 3,1 2 6 0 0 0 1,6 17,8 0 0 0 0 3,6 Aug 0 0 0 0 0 0 1,8 0 3,9 13,6 3,9 4,6 7,7 0,5 1,3 1,9 0 2,3 8,7 1,4 0 0 0 2 0 0 0 0,5 0 0,1 0 0 0 0 10,6 2,1 12 0 0 1,6 0 2,7 Sep 0 3 10,4 2,3 0,3 3,2 0,5 14,2 5 19,6 8,6 9,6 7,1 3,1 1,6 0,2 0,8 2,6 0,7 0,3 0,9 4,1 4,5 2,1 10 7,1 0,4 1 0 3,7 0,2 21,3 1,6 6,1 0,8 6 Okt 1,5 5,3 2 0 0 1,8 0 0 0 0 0,6 0,1 0,1 0 0 0 0 0 0 0 0 0 0 0 8 4,6 0 4 0 3,3 0 3,5 0 2,4 0 1,2 Nov 2,1 0,7 0 0 1 0,8 0,8 2,6 2,3 6,5 0 2,4 0 0,7 2,4 0 0 0,6 Tabellenanhang 181 Tab. 49: Warm- /Regenperioden: Die mittlere Tagestemperatur wurde als Mittelwert aus Höchst- und Tiefsttemperatur berechnet. Für den Durchschnitt (ø) des 5 Tage-Zeitraumes bei Temperatur bzw. Niederschlag wurde nur der Mittelwert der nach dem Schema von BÜRGER et al. (1983) für Warm- bzw. Regenperioden relevanten Tage (fettgedruckt) berechnet. Warmperiode: 7-10 Tage lang >18 oder 20 °C; Regenperiode: mind. 4 aufeinanderfolgende Tage mit Niederschlägen (Summe im Sommer > 20mm). Am 26./ 27. August wurden ausnahmsweise die Niederschläge von nur 2 Tagen mit einbezogen. Mittlere Temperatur in °C ø Niederschläge in mm ø Zeitraum 09.-13. 14.-18. 19.-23 24.-28. 29.-03. 04.-08. 09.-13. 14.-18. 19.-23 24.-28. 29.-02. 03.-07. 08.-12. 13.-17. 18.-22. 23.-27. 28.-02. 03.-07. 08.-12. 13.-17. 18.-22. 23.-27. 28.-01. 02.-06. 07.-11. 12.-16. 17.-21. 22.-26. 27.-31. 01.-05. 06.-10. 11.-15. 16.-20. 21.-25. 26.-30. 01.-05. 06.-10. 11.-15. 16.-20. 21.-25. 26.-30. 31.-04. 05.-09. Apr Mai Jun Jul Aug Sep Okt Nov Tag 1 6,4 1,2 4,4 7,9 11 9,5 14 17 10 15 15 8,5 11 11 15 0 18 18 18 16 17 22 23 17 18 16 19 20 16 15 11 11 11 12 12 14 14 13 12 9,7 12 11 6,8 2 9,6 4 4 10,1 16,3 9,5 17,3 13,4 9,55 13,3 13,7 9,4 10,5 13,7 10,2 0 18,5 19,5 18,1 16,7 17,7 21,9 20,5 19,8 17,7 16,5 18,8 21,2 14,6 13,3 13,6 13,6 10,2 11,8 10,6 16,8 14,4 14,3 8,9 13,1 11,2 7,7 7,45 3 6 5,3 5,2 10 14 10 15 14 11 14 12 13 9,9 15 12 0 20 23 19 16 17 21 21 18 16 23 22 24 15 15 11 13 8,8 12 12 14 13 14 13 11 12 10 6,9 4 3,25 4,85 5,25 8,3 12,8 9,9 14,7 14,4 11,7 16,1 12 14,4 9,6 17,4 14,9 0 16,6 23,4 17,1 12,2 17,6 20,4 18,4 15,5 13,7 25,5 18,8 23,9 16,6 14,9 10,4 12,5 12,6 12,7 15,3 13,9 13,3 17,1 13,7 8,5 10 10,5 3,2 5 1,8 3,3 6,1 7,8 19,1 12,8 15 9,7 13,5 15,4 10,5 12,3 10,5 16,5 12,6 22 16,7 23,9 17 15,1 20,5 21,4 15,9 15,5 14,4 23 20,1 25,2 16,1 14,8 12,5 11,3 11,7 11,7 13,3 13,1 13,9 15,5 11,1 10,9 14,8 9,05 0,75 22,5 18,4 20,5 21,2 20,6 23,7 19,7 22,9 Tag 1 0 5,5 0,6 1,1 3 0 0 0 0 0 0 11,5 3,3 0 1,5 0 0 0 1,3 1,5 2 17,8 0 1,8 7,7 8,7 0 0 12 0 0,5 7,1 0,7 10 0,2 1,5 0 0,1 0 8 0 2,1 0,8 2 1,2 8,5 0,9 14,8 0,9 0 0 0 0 0 0 1,5 0,3 0 0 0 0 0 1 6,1 6 0 0 0 0,5 1,4 0 0 0 3 14,2 3,1 0,3 7,1 21,3 5,3 0 0 0 4,6 3,5 0,7 2,6 3 0 0,5 0 2,3 0 0 0 7,1 0 0 15,4 0 0,3 3,8 0 0 20,2 0 3,7 3,4 0 0 0 3,9 1,3 0 0 0 0 10,4 5 1,6 0,9 0,4 1,6 2 0 0 0 0 0 0 2,3 4 1 2,3 0 3,8 0 0 0 0,2 0 2,4 5 7,8 0,3 2,9 2,8 0 0 0 1,5 4,4 0 0 0 13,6 1,9 0 0,5 0 1,6 2,3 19,6 0,2 4,1 1 6,1 0 0 0 0 4 2,4 0 6,5 5 0 7,1 4,8 0 0,8 1 4,6 2,1 2 0 0 0,4 0 0,5 8 9,5 2,6 6,5 2,4 21 9,3 3,2 1,5 0,7 0 12 12 0,8 1,7 0 3,9 0 0 0 3,9 7,1 0 2,9 0 0 10,6 0 11,3 0,3 4 8,6 9,6 0,8 2,6 4,5 2,1 0 4,6 0,8 6 0 2,9 0,6 0 0 0 0 1 0 Tabellenanhang 182 Tab. 50: Zusätzliche Daten zum Kapitel 4.7 Zusammenfassende Darstellung der Kot- und Grasprobenergebnisse der verschiedenen Gehege Gehege Afrika 1 Gehege Gehege Afrika 2 Afrika 3 MDS Nematodirus Larven MDS Mittelwerte Summe Mittelwerte Mittelwerte Mit- SumKotproben (EpG) Gras- Kotproben (EpG) Kotproben tel- me wert proben geAlt- Jung- Larven ge- Alt- Jung- Oster- Tri- Kot- Grassamt tiere tiere samt tiere tiere tagia cho- pro- prostr. ben ben 16.10.00 Okt 78 60 150 1131 0 0 0 0 0 0 57 30.10.00 148 140 180 5918 4 0 20 0 0 11,5 3756 13.11.00 Nov 78 15 330 1429 20 0 100 0 0 0 27.11.00 18 12,5 40 1276 6 0 30 0 0 3,9 11.12.00 Dez 10 0 50 683 8 0 40 0 0 7,7 27.12.00 54 40 110 4 2,5 10 0 0 73,1 06.01.01 Jan 44 37,5 70 6 0 30 0 0 19,2 20.01.01 56,3 50 80 18,8 13 40 0 0 26,9 02.02.01 Feb 134,2 150 90 0 0 0 0 0 96,2 16.02.01 104 122,5 30 0 0 0 0 0 34,6 02.03.01 Mär 0 0 0 6,3 0 50 0 0 17.03.01 26 25 30 8 2,5 30 0 0 7,7 01.04.01 Apr 54 40 110 0 0 0 0 0 7,7 13.04.01 234 245 190 0 4 0 20 0 0 16,7 81 03.05.01 Mai 113,5 110 125 0 3,9 0 17 2,7 5 4,2 0 10.05.01 134 122,5 180 23 4 0 20 0 0 4,2 0 23.05.01 Mai 104 36,8 317 0 0 0 0 0,3 0 8,3 0 07.06.01 180,8 137,5 325 54 3,9 2,5 8,3 0 0 0 0 21.06.01 Jun 182,7 107,9 386 84 1,9 0 7,1 0 0 0 0 06.07.01 68 72,5 50 68 8 2,5 30 0 0 0 0 19.07.01 Jul 72 94,7 0 79 2 0 8,3 0 0 4,2 71 02.08.01 54,2 55,3 50 71 2,1 2,6 0 0 0 8,3 0 16.08.01 Aug 120 110,5 150 85 0 0 0 0 0 12,5 16 30.08.01 90 79 125 149 1,9 2,5 0 0 0 16,7 0 13.09.01 Sep 126 113,2 167 179 8 5,3 17 0 0 8,3 0 27.09.01 216 134,2 475 1010 2 0 8,3 0 0 16,7 160 11.10.01 Okt 220 102,6 592 570 12 2,6 42 0 0 33,3 0 25.10.01 74 94,7 8,3 2686 6 5,3 8,3 0 0 33,3 976 08.11.01 Nov 216,7 232,5 138 656 2,1 0 13 0 0 25 270 Danksagung 183 Danksagung Herrn Prof. Dr. Michael Böer danke ich für die Überlassung des interessanten Arbeitsthemas, die Betreuung bei der schriftlichen Ausarbeitung, die vielen freundlichen Ratschläge und Problemlösungen und ganz besonders für die Aufrechterhaltung der Probennahme im März /April 2001, als aufgrund der MKS-Epidemie in den Niederlanden Außenstehenden der Zutritt zum Serengeti-Park nicht ermöglicht werden konnte. Mein Dank gilt außerdem Herrn Dr. Christian Epe, sowie allen Mitarbeitern und Doktoranden des Institutes für Parasitologie der Tierärztlichen Hochschule Hannover für die Ermöglichung der Laborarbeit, die Bereitstellung der benötigten Materialien und Geräte, sowie für die jederzeit gern gegebenen Hilfestellungen und Ratschläge. Bei der Familie Sepe möchte ich mich für die Ermöglichung der Arbeit mit den afrikanischen Wildwiederkäuern im Serengeti-Park Hodenhagen bedanken. Mein besonderer Dank gilt auch den Tierpflegern für die jederzeit gern geleistete Hilfe bei der Probennahme und die freundliche Aufnahme im Serengeti-Park. Frau Giffei und Herrn Beyerbach danke ich für die Beratung und Betreuung bei der statistischen Auswertung. Weiterhin möchte ich mich besonders bei Martin bedanken für seine hilfreiche Unterstützung bei Computerfragen. Herrn Phil Rogers aus Dublin bin ich dankbar für seine Hilfe bei der Formulierung der englischen Zusammenfassung. Meinen Eltern, Heike, Antonia und Eckard sei ein ganz besonderer Dank ausgesprochen für jede Form ihrer Unterstützung, Anregung und Motivierung.