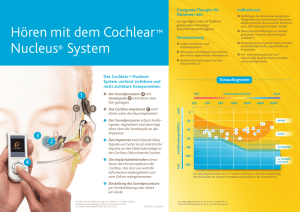
Promotion - Deutsche Digitale Bibliothek
Werbung

Aus der Neurochirurgischen Universitätsklinik der Albert-Ludwigs-Universität Freiburg i.Br. Ausdehnung, Lage und Form des menschlichen Nucleus cochlearis INAUGURAL – DISSERTATION zur Erlangung des Medizinischen Doktorgrades der Medizinischen Fakultät der Albert-Ludwigs-Universität Freiburg i.Br. vorgelegt 2008 von Sybille Rosahl geboren in Dessau Dekan: Prof. Dr. Christoph Peters 1. Gutachter: Prof. Dr. med. Dr. h.c. Roland Laszig 2. Gutachter: Professor Dr. med. Dr. h.c. Bodo Christ Jahr der Promotion: 2008 2 Ausdehnung, Lage und Form des menschlichen Nucleus cochlearis Inhalt: 1. Einleitung................................................................................................. 5 2. Stand der Forschung ................................................................................ 7 2.1. Lokalisation und Aufbau des Nucleus cochlearis ....................................................... 7 2.1.1. Interspezies-Vergleich ........................................................................................................ 7 2.1.2. Daten zu Lage und Ausdehnung des menschlichen Hörkerns .......................................... 7 2.1.3. Ventrales und dorsales Kerngebiet .................................................................................. 10 2.1.4. Zytoarchitektur .................................................................................................................. 10 2.2. Funktionelle Charakteristika der Nuclei cochleares.................................................. 12 2.2.1. Einbindung in die Hörbahn ............................................................................................... 12 2.2.2. Innere funktionelle Organisation und Tonotopie............................................................... 14 2.2.3. Degenerative Veränderungen im Bereich des Nucleus cochlearis .................................. 19 2.3. Auditorische Hirnstammimplantate - ABI und PABI.................................................. 20 2.3.1. Historische Entwicklung der elektrischen Stimulation der Hörbahn ................................. 20 2.3.2. Auditorische Hirnstammimplantate ................................................................................... 21 2.3.3. Penetrierende ABI-Elektroden .......................................................................................... 25 3. Ziele und Fragestellung.......................................................................... 30 4. Material und Methoden .......................................................................... 31 4.1. Hirnstämme ............................................................................................................. 31 4.2. Histomorphometrie des menschlichen Hirnstamms ................................................. 32 4.2.1. Präparate .......................................................................................................................... 32 4.2.2. Histologische Fixierungen und Färbungen ....................................................................... 32 4.2.3. Variablen und Messwerte ................................................................................................. 33 4.2.4. Schrumpfungskorrektur .................................................................................................... 37 4.3. Statistik.................................................................................................................... 38 4.4. Modellierung des Nucleus cochlearis....................................................................... 40 5. Ergebnisse ............................................................................................. 40 5.1. Abgrenzbarkeit des Kerns und seiner Teilgebiete.................................................... 40 3 5.2. Form und räumliche Orientierung ............................................................................ 41 5.3. Ausdehnung des Kernkomplexes ............................................................................ 45 5.3.1. Mittlere Länge und Breite.................................................................................................. 46 5.3.2. Mittlere Höhe .................................................................................................................... 48 5.3.3. Extremwerte bezüglich der dreidimensionalen Ausdehnung ........................................... 48 5.4. Lagebeziehungen zu äußeren Bezugspunkten und zum N. facialis ......................... 50 5.4.1. Bezug zur Hirnstammoberfläche ...................................................................................... 50 5.4.2. Bezug zum Nervus facialis ............................................................................................... 51 5.4.3. Bezug zur Mittellinie des Hirnstamms .............................................................................. 52 5.4.4. Abstand des Mittelpunktes der Nuclei zum lateralen Scheitelpunkt des Hirnstamms ..... 53 5.5. Korrelationen der Maße untereinander und zu anderen Variablen........................... 55 5.5.1. Alter................................................................................................................................... 55 5.5.2. Geschlecht ........................................................................................................................ 55 5.5.3. Hirngewicht ....................................................................................................................... 55 5.5.4. Seitenvergleich ................................................................................................................. 56 5.5.5. Korrelationen zwischen den Messwerten ......................................................................... 56 5.6. Maße in Bezug zu derzeit gebräuchlichen Hirnstammimplantaten........................... 56 6. Diskussion der Ergebnisse ..................................................................... 59 6.1. Ausdehnung, Form, räumliche Lage und Rotation der Nuclei cochleares ................ 59 6.2. Relevanz der Anatomie des Nucleus cochlearis für auditorische Neuroprothesen... 66 7. Schlussfolgerungen für das Design von ABI- und PABI-Elektroden ....... 72 8. Zusammenfassung ................................................................................. 75 9. Danksagung ........................................................................................... 76 10. Literaturverzeichnis ............................................................................... 77 4 1. Einleitung Der Nucleus cochlearis ist die zweite Schaltstelle der sogenannten „Hörbahn“ – einem neuronalen System welches sich von der Hörschnecke (Cochlea) im Innenohr bis zum auditorischen Kortex ausdehnt. Besonders in seinem ventralen Anteil finden sich Neurone, deren afferente Zuflüsse direkt über die Fasern des Hörnerven (Nervus cochlearis) aus dem Ganglion spirale der Cochlea eintreffen. Durch Quervernetzung der Neurone erfolgt hier eine erste Signalverarbeitung. Das Kerngebiet hat in den letzten Jahren klinische Bedeutung bei der Rehabilitation ertaubter Patienten erlangt. Solche Patienten, bei denen die Cochlea und/oder der Hörnerv beidseits zerstört wurden, verlieren das Hören als Sinnesempfindung vollständig. Mit elektronischen Geräten, den so genannten auditorischen Hirnstammimplantaten (engl.: Auditory Brainstem Implant, ABI), die erstmals 1979 in Los Angeles eingesetzt wurden, können diese Patienten wieder Geräusche aus ihrer Umgebung wahrnehmen. Damit gelingt oft eine bessere soziale Reintegration, weil das Lippenablesen und die Orientierung im Alltag verbessert werden [Edgerton et al. 1982; Laszig et al. 1991; Brackmann et al. 1993; Shannon et al. 1993; Laszig et al. 1995a; Matthies et al. 2000; Rosahl et al. 2004; Shepherd und McCreery 2006]. Mit den Implantaten werden akustische Reize aus der Umwelt über ein Mikrophon in einen programmierbaren Stimulator eingespeist, der daraus eine elektrische Impulsfolge erzeugt, welche über Elektroden direkt auf den Hirnstamm im Bereich des Hörkerns übertragen wird. Das damit zu erreichende Sprachverständnis ist allerdings noch unbefriedigend. Im Gegensatz zum Cochlear Implant können mit dem ABI z.B. nur weniger als 10% der Patienten einzelne kurze Sätze über Telefon verstehen. Die Ursachen dafür sind vielfältig. Vier funktionell-anatomisch Faktoren spielen dabei mit Sicherheit eine Rolle: Erstens erfolgt die elektrische Stimulation im Gegensatz zu den bezüglich des erreichbaren Höreindrucks erfolgreicheren Cochlea-Implantaten [Clark et al. 1981; Parkin et al. 1985; Blamey et al. 1992; Fishman et al. 1997; Illg et al. 1999; Laszig und Aschendorff 1999; Shepherd und McCreery 2006] nicht auf Rezeptorebene mit einer annähernden Punkt-zu-Punkt-Anordnung der einzelnen Frequenzbänder. Die elektrische Stimulation am Nucleus cochlearis trifft im Gegenteil auf eine Region, in der bereits eine umfassende parallele und serielle Signalverarbeitung stattfindet. Zweitens werden mit den derzeit eingesetzten Oberflächenimplantaten wahrscheinlich nur bestimmte Anteile des ventralen und auch des dorsalen Nucleus cochlearis stimuliert. Welche das sind, hängt von der Lage der Elektroden bei dem individuellen Patienten und damit von der chirurgischen Implantation, aber auch von der Lage der Nuclei cochleares im Hirnstamm ab. Es ist schon bekannt, dass der dorsale Kernanteil im Recessus lateralis des vierten Hirnventrikels am dichtesten unter der ependymalen Oberfläche des Hirnstamms gelegen ist. Die primären synaptischen Verbindungen der Axone des Hörnervs liegen beim Menschen jedoch überwiegend im ventralen Hörkern [Moore 1986]. Drittens breiten sich die Stimulationsströme longitudinal über die kapazitiven Schichten der Pia mater entlang des Hirnstamms aus [Ranck, Jr. 1975]. Dadurch kann es zu Ladungsverlusten und einem sogenannten „Übersprechen“, einer Vermischung der Reizströme zwischen einzelnen Kanälen des Implantates kommen. 5 Viertens ist es mit Oberflächenelektroden allenfalls durch eine Variation der Stärke und Dauer der Reizströme möglich, die innerhalb des Nucleus cochlearis des Menschen vorhandene perpendikuläre Tonotopie in längs zur Oberfläche des Hirnstamms verlaufenden frequenzspezifischen (tonotopen) Zellbändern [Bourk et al. 1981; Wickesberg und Oertel 1988; Kelly 1991; McCreery et al. 1998] zu aktivieren. Eine gezielte, selektive Stimulation ist auf diese Art und Weise aber nicht denkbar, da die elektrischen Felder unter einem Elektrodenkontakt immer alle im Radius der Reizschwelle aktivierbaren Neurone erreichen. Dies waren auch im Wesentlichen die Gründe, warum man nadelförmige Elektroden entwickelt hat, welche direkt in den Hirnstamm implantiert werden können [McCreery et al. 1992; Rosahl et al. 2001; Fayad et al. 2006]. Seit 2004 befinden sich solche Implantate in klinischen Tests. Sie werden jedoch weiterhin mit Oberflächenelektroden kombiniert, vor allem deshalb, weil man Lage, Größe und Orientierung der Nuclei cochlearis weder generell noch individuell exakt ermitteln kann. Für das Einstechen der Elektroden ist man daher auf äußere Landmarken angewiesen, welche zwar eine relative Zuordnung des Eintrittspunktes, aber kaum eine genaue Trajektorie oder sichere Tiefenzuordnung der Elektroden zulassen. Das ist schon deshalb unmöglich, weil es für die anatomische Ausdehnung der Nuclei cochleares bisher weder Normwerte noch überhaupt systematische histomorphometrische Messungen gibt. Auch die interindividuelle Variabilität der Lage und Größe des Hörkernkomplexes ist weitgehend unbekannt, ebenso wie seine räumlichen Beziehungen zu Nachbarstrukturen und zur Oberfläche des Hirnstamms. Damit fehlen letztlich wichtige prognostische Kriterien für die Effektivität und für das mögliche Risiko von Fehlstimulationen und damit verbundenen Nebenwirkungen einer Stimulation mit Tiefenelektroden. Die in der Literatur bisher verfügbaren Daten zur Lage, Form und Ausdehnung des Hörkernkomplexes stammen entweder aus Einzelfalluntersuchungen oder sie beziehen sich auf Gesamtvolumen und Querschnitt einzelner Bereiche des Nucleus cochlearis [Konigsmark und Murphy 1972; Gandolfi et al. 1981; Seldon und Clark 1991; Nara et al. 1993; Wagenaar et al. 1999; Chao et al. 2002; Demanez und Demanez 2003; Abe und Rhoton, Jr. 2006] bzw. auf Messungen, die an der Oberfläche des Hirnstamms durchgeführt wurden [Luxon 1981; Terr et al. 1987; Sinha et al. 1987; Terr et al. 1990; Quester und Schroder 1999; Klose und Sollmann 2000; Abe und Rhoton, Jr. 2006]. Die Studienlage in Bezug auf die exakte histologische Lokalisation, Tiefe, Dimension und Orientierung des Hörkerns innerhalb des menschlichen Hirnstamms erscheint also äußerst unbefriedigend. Die vorliegende Studie wurde konzipiert, um diesen Fragen in einer morphometrischen Analyse auf der Basis histologischer Untersuchungen systematisch nachzugehen. 6 2. Stand der Forschung 2.1. Lokalisation und Aufbau des Nucleus cochlearis Am besten untersucht bei Säugetieren ist der Nucleus cochlearis der Katze. Leider lassen sich die Untersuchungen in Bezug auf die morphometrischen Fragestellungen der vorliegenden Arbeit nur sehr bedingt auf den Menschen übertragen. Dennoch gibt es einige Parallelen, die an dieser Stelle erwähnt werden sollen. 2.1.1. Interspezies-Vergleich Auch bei der Katze kann der Nucleus cochlearis im Wesentlichen in ein ventrales und ein dorsales Gebiet unterteilt werden [Osen 1969a; Osen 1969b; Moore 1987b; McCreery et al. 1998]. Insbesondere im Nucleus cochlearis ventralis finden sich ähnliche Zellklassen wie beim Menschen, an denen die primären Afferenzen von der Cochlea terminieren [Osen 1969a]. Neurone und deren Axone sind im Nucleus cochlearis dorsalis der Katze noch schichtförmig (laminar) angeordnet, während sie sich beim Menschen in einem annähernd homogenen Plexus verteilen [Moore 1987b]. Die wesentlichsten Unterschiede zwischen den Hörkernen der beiden Spezies bestehen aber in der Lage, der Form und der Dimension dieser anatomischen Struktur. Der dorsale Kern verdeckt bei der Katze seitlich den ventralen Kern zum größten Teil - beim Menschen überlappt er nur einen Teil des hinteren Pols des NCV - und wird nicht wie beim Menschen noch von Fasern des Hörnervs durchzogen. Gleichzeitig liegt der ventrale Kern der Katze relativ frei zugänglich unter der ventralen Oberfläche des Hirnstamms, während er beim Menschen zu einem größeren Teil in der Tiefe verborgen ist. Während das gesamte Kerngebiet beim Menschen lang gestreckt um den Pedunculus cerebelli inferior verläuft, ist es bei der Katze kompakter, obwohl auch hier die Längsachse etwas größer ist als die Querachse. Wenn man also davon ausgeht, dass Breite und Höhe des gesamten Kernkomplexes bei Katze und Mensch etwa vergleichbar sind, dann wäre die Längsausdehnung beim Menschen etwa doppelt so lang wie bei der Katze [Moore 1987b]. 2.1.2. Daten zu Lage und Ausdehnung des menschlichen Hörkerns Der menschliche Hörkernkomplex befindet sich in der Rautengrube genau im Bereich des pontomedullären Überganges [Moore und Osen 1979; Voss und Herrlinger 1981]. Seine Form ist bislang nicht eindeutig definiert, aber die Literatur geht davon aus, dass seine Längsachse nach lateral rotiert ist, so dass zur rostro-kaudalen Achse des Hirnstamms ein Winkel von etwa 75° entsteht [Moore 1987a; Moore 1987b]. Damit liegt der hintere Anteil nahezu parallel zur dorsalen Hirnstammoberfläche im Boden des 4. Ventrikels, während der vordere Anteil erst in der Tiefe des Hirnstammes liegt und sich dann mit weiterer Ausdehnung nach kaudal der lateralen Hirnstammoberfläche nähert (Abb. 2.1, 2.2). Obwohl exakte Varianz-Studien bislang fehlten, geht man nach den vorliegenden Daten der Literatur davon aus, dass das gesamte Kerngebiet beim Menschen etwa einen Bereich von 10 x 8 x 3 mm 7 (Länge x Höhe x Breite) einnimmt [Terr und Edgerton 1985b; Moore 1987b; Jacob et al. 1991; Seldon und Clark 1991; Quester und Schroder 1999; Rosahl et al. 2000]. Nach einer 1972 von Konigsmark und Murphy veröffentlichten Studie an 23 neurologisch unauffälligen Patienten scheint es, dass das Volumen des Nucleus cochlearis von der Geburt (4,8 mm³) etwa bis zum fünfzigsten Lebensjahr (12,1 mm³) zu- und danach wieder abnimmt (8,2 mm³ bei einem 90-Jährigen) [Konigsmark und Murphy 1972]. Interessanterweise fanden Seldon und Clark 1991 bei 11 Autopsien ein im Mittel signifikant größeres Volumen sowohl der Somata der Neurone als auch des gesamten Nucleus cochlearis der rechten Seite gegenüber der linken [Seldon und Clark 1991]. Sie führten diesen Befund auf eine zuvor von mehreren Autoren postulierte Bevorzugung des rechten Ohres bei Rechtshändern zurück [Kimura 1967; Geffen 1978; Sidtis 1982]. Die Tatsache, dass die Neurone im Hörkortex der linken, dominanten Hemisphäre ebenfalls größer sind als die der rechten wäre aufgrund der Kreuzung des überwiegenden Teils der Hörbahn mit diesem Befund gut vereinbar [Seldon 1985]. Von der Hirnstammoberfläche betrachtet, bedeckt der Nucleus cochlearis seitlich und dorsal den Pedunculus cerebelli inferior, die rostrale Verlängerung des Hinterstranges der Medulla oblongata. Die dadurch auf der Oberfläche sich abzeichnende, graue Vorwölbung wurde durch Schwalbe (1881) als „Tuberculum acusticum“ bezeichnet [Schwalbe 1881]. Noch ältere Bezeichnungen dieser Oberflächenstruktur, die von den nicht zum auditorischen System gehörenden Striae medullares überzogen wird, sind die in der Mitte des 19. Jahrhunderts durch Henle und die Gebrüder Wenzel geprägten Termini „Taeniola cinerea“ und „Colliculus cinereus“ [Ziehen 1913]. Abb. 2.1 Schema der menschlichen Hirnstamm - Kleinhirnregion. Die dreidimensional komplex ineinander verdrehten Kleinhirnschenkel stehen in unmittelbarer Lagebeziehung zu den Nuclei cochleares. (modifiziert nach [Oberson www.cid.ch] 2001) Beim Menschen liegt, im Gegensatz zur Katze, nur ein kleiner Teil des Nucleus cochlearis ventralis (NCV) oberflächlich. Der Pedunculus cerebellaris medius, der wegen seiner starken Verbindungen 8 zum Pons so genannte „Brückenarm“ [Voss und Herrlinger 1981] grenzt seitlich an den am weitesten ventral gelegenen Teil des Hörkerns und bedeckt diesen zum Teil [Moore und Osen 1979; Moore 1987b]. Lateral steht der NCV in Lagebeziehung zum Pedunculus floccularis. Schwach myelinisierte Fasern vom Corpus pontobulbare, einer Relaisstelle am kaudalen Pol der grauen Substanz des Pons mit efferenten Verbindungen zu den visuellen und auditorischen Regionen des Zerebellum und Afferenzen von Rückenmark, Nucleus ruber, der Gesichtsregion des sensorimotorischen Kortex und des Zerebellum [Martin et al. 1977; Moore und Osen 1979; Terr et al. 1987; Terr und Sinha 1987; Terr und House 1988], welches sich von kaudal dem NCD und medioventral dem NCV unmittelbar anlegt, ziehen sich über die ventrolaterale Oberfläche des vorderen Kernanteils und über Teile der lateralen Oberfläche des NCD. Sie bilden mit versprengten Zellclustern im Wesentlichen die sogenannte „periphere astrozytäre Grenzzone“ (peripheral astrocytic border, glial zone) [Moore und Osen 1979]. Abb. 2.2 Topographisch-anatomische Lokalisation der Nuclei cochlearis in einer axialen Schnittebene in Höhe der Eintrittszone des Nervus vestibulocochlearis (Einsatz rechts unten). Legende: Tp Tractus pyramidalis ncd Nucleus cochlearis dorsalis Cpp Corpus pontobulbare ol Olive Tr. Trig. Tractus trigeminalis lm Lemniscus medialis ncl.vest. Nucleus cochlearis ventralis N.VIII Nervus cochlearis Ventr. IV IV. Ventrikel pci Pedunculus cerebelli inferior 9 2.1.3. Ventrales und dorsales Kerngebiet Aufgrund histomorphologischer Kriterien unterschied der Cajal-Schüler und spanisch-amerikanische Neurowissenschaftler Lorente de No bereits lange vor der späteren exakten zellulären Subklassifizierung einen kompakten, ventralen Kern von einem länglich ausgezogenen dorsalen Kern [Lorente de No 1933]. Untersuchungen zur Zytoarchitektur haben diese Unterteilung erhärtet [Bacsik und Strominger 1973; Brawer et al. 1974; Kane 1974; Moore und Osen 1979; Gandolfi et al. 1981; Luxon 1981; Moore 1986; Moore 1987b; Mobley et al. 1995]. Der Nervus cochlearis, dessen vom ersten Neuron der Hörbahn (Ganglion spirale) am Hirnstamm eintreffende Pars cochlearis zwischen 32 – 41.000 fast ausschließlich myelinisierte Fasern mit einem Axon-Durchmesser von 2-3 µm enthält [Spoendlin und Schrott 1989], erreicht den ventralen Hörkern an seiner ventromedialen Oberfläche. Innerhalb der Nervenwurzel im Hirnstamm teilt sich jedes Axon in eine aszendierende und eine deszendierende Faser [Moore 1986]. Die aszendierenden Fasern ziehen nach dorsolateral in den Nucleus cochlearis ventralis. Die deszendierenden Fasern verlaufen relativ gerade durch den Nucleus cochlearis ventralis nach kaudal und dorsal. An der hinteren Begrenzung des NCV divergieren diese Fasern und die meisten – bei der Katze ca. 85% [Fekete et al. 1984] - ziehen weiter zum Nucleus cochlearis dorsalis. Im Gegensatz zu anderen Säugern wird der Nucleus cochlearis dorsalis des Menschen nicht nur bis zur Mitte, sondern vollständig rostrokaudal von deszendierenden Axonen des Hörnerven durchzogen [Moore 1986]. Die Fasern formen einen relativ homogenen Plexus, in den sich die Neurone einordnen. Der NCD hat daher beim Menschen, im Gegensatz zur Katze keinen schichtförmigen (laminaren) Aufbau [Moore 1987b]. Der intramedulläre Anteil des N. vestibulocochlearis durchzieht das ventrale Kerngebiet, woraus die anatomisch-deskriptive Unterteilung in Nucleus cochlearis ventralis superior (NCVS) et inferior (NCVI) resultiert [Lorente de No 1981; Dublin 1982; Terr und Edgerton 1985b; Terr et al. 1987]. Hier ist eine Nomenklaturfrage von Bedeutung: Bei Untersuchungen am Tier werden, resultierend aus der mehr horizontalen räumlichen Orientierung des Hirnstamms, an Stelle der Begriffe „superior“ und „inferior“ die Termini „anterior“ und „posterior“ verwendet. Die in histologischen Studien aufgrund des zellulären Besatzes und des Innervationsmusters (aszendierende versus deszendierende Fasern) bei Säugetieren deutliche Untergliederung in eine „Pars anteroventralis“ und „Pars posteroventralis“ ist beim Menschen durch den gekrümmten Verlauf der Axone des Nervus cochlearis im Hirnstamm schwer zu erkennen, so dass eine weitere histomorphologische Unterteilung des ventralen Hörkerns hier meist nicht erfolgt [Moore und Osen 1979]. 2.1.4. Zytoarchitektur Der gesamte Nucleus cochlearis des Menschen enthält weniger als 100.000 Zellen. Bezüglich des NCV sind die Angaben dazu weitgehend einheitlich (63.200 - 70.000 Zellen), während für den NCD in zwei wesentlichen Studien erstaunlich differente Zahlen angegeben werden (7370 – 26 000 Zellen) [Hall 1965; Konigsmark und Murphy 1972]. Die Ursache dafür dürfte in der schwierigen histologischen Abgrenzbarkeit der beiden Kernanteile liegen. 10 Die Korrelation zwischen Volumen und Zellzahl ist offenbar nicht signifikant [Hall 1965; Konigsmark und Murphy 1972], weil das für das Gesamtvolumen des Kerngebietes entscheidende Zellvolumen individuell erheblich schwankt [Hall 1965; Seldon und Clark 1991]. Die Literaturbefunde zur Zytoarchitektur sind umfangreich, aber ebenfalls nicht einheitlich. Detaillierte Subklassifizierungen verwenden zum Teil unterschiedliche Nomenklaturen für gleiche Zelltypen [Olszewski und Baxter 1954; Konigsmark und Murphy 1972; Bacsik und Strominger 1973; Dublin 1974; Moore und Osen 1979; Dublin 1982; Terr und Edgerton 1985a; Adams 1986; Moore 1987a; Terr et al. 1990]. Das hat dazu geführt, dass solche Subklassifizierungen auch von renommierten Autoren angezweifelt wurden [Seldon und Clark 1991]. Eine Erklärung für die unterschiedliche Benennung liegt möglicherweise darin, dass die verschiedenen Zelltypen in Form und Größe sehr heterogen auftreten können [Tolbert und Morest 1982]. Bei den zumeist angewendeten NisslFärbungen entsteht daher ein relativ großer, subjektiver Spielraum bei der Klassifizierung. Im Nucleus cochlearis dorsalis finden sich ganz überwiegend bipolare und trianguläre Zellen mit einem Durchmesser von 15-30µm [Moore 1987b]. Eine derart große Variabilität der Zellgröße ist in keinem anderen Bereich des Nucleus cochlearis zu beobachten [Moore und Osen 1979]. Drei weitere Zelltypen (kleine Sternzellen, Riesenzellen und Körnerzellen) spielen eine untergeordnete Rolle und finden sich auch im NCV. Nach dem Zellbild lässt sich im Bereich des Nucleus cochlearis ventralis ein unterer, großzelliger Anteil von einem oberen kleinzelligen Gebiet differenzieren. Eine auffällige Zellgruppe im unterhalb der Eintrittszone des Hörnerven gelegenen Bereich sind die so genannten „Oktopus-Zellen“ mit einem Durchmesser von ca. 30µm. Oberhalb und ventral dieser Region dominieren multipolare Sternzellen mit einem Durchmesser von ca. 30-35µm und ovaläre Zellen, die den in Golgi-Färbungen sicher zu klassifizierenden globulären Zellen entsprechen [Bacsik und Strominger 1973; Moore und Osen 1979; Adams 1986; Moore 1987b]. In dem oberen, kleinzelligen Gebiet finden sich ebenfalls vorwiegend multipolare Sternzellen, hier allerdings mit einem geringeren Zelldurchmesser (ca. 25µm). Weiterhin sind hier sphärische oder Rundzellen angeordnet, die beim Menschen häufig auch ovaläre Form annehmen können und bei sensorineuralem Hörverlust ein charakteristische Degenerationsmuster aufweisen [Dublin 1976]. In der lateralen Flanke des VCN liegen die sogenannten „cap cells“, eine flache Schicht einheitlich kleiner, spindelförmiger Zellen [Moore und Osen 1979; Moore 1987b]. Offenbar nimmt die Größe der Neurone im Nucleus cochlearis generell von kaudal nach rostral ab [Seldon und Clark 1991]. Im Rahmen dieser Arbeit erscheinen die exakte Subklassifizierung der Zellen und ihr Besatz mit Neurotransmittern von untergeordneter Bedeutung, so dass hier nicht weiter darauf eingegangen werden soll. 11 2.2. Funktionelle Charakteristika der Nuclei cochleares 2.2.1. Einbindung in die Hörbahn Das Kerngebiet des Nucleus cochlearis enthält die zweiten Neurone der Hörbahn, die gleichzeitig die der ersten Umschaltstelle im Bereich des Hirnstammes repräsentieren. Abb. 2.3 Vereinfachtes Schema der Hörbahn zur Veranschaulichung der Kreuzung der wesentlichen Afferenzen im auditorischen System des Hirnstamms auf die Gegenseite. Im Bereich der hier nicht berücksichtigen Olive erfolgt parallel auch eine ipsilaterale Aufschaltung (s. unter 2.1.3.). Deutlich wird in der Abbildung auch das Prinzip der tonotopen Frequenz-abbildung: Im Bereich der Cochlea ist jeder Frequenz ein relativ präziser Punkt zugeordnet. Diese Präzision dieser Zuordnung nimmt im Verlauf der Hörbahn nach zentral ab. (modifiziert nach Oberson, 2001)[Oberson www.cid.ch] Seine afferente Innervation erhält das Kerngebiet durch die Pars cochlearis des Nervus vestibulocochlearis, die ihren Ursprung von den Ganglienzellen des Ganglion spirale hat (s. Abb.2.3). Nur 2-4 % der Fasern des Hörnervs sind nicht myelinisiert. Abzüglich der Myelinscheide beträgt der mittlere Durchmesser der etwa 30.000 Fasern weniger als einen Mikrometer [Spoendlin und Schrott 1989]. Im Bereich der Nervenwurzel teilen sich die Fasern, woraus ihre anatomisch deskriptive Unterscheidung in aufsteigende und absteigende Fasern resultiert (s.a. 2.1.3.) [Voss und Herrlinger 1981]. 12 Afferenzen vom ventralen Hörkern verlaufen in der Medulla oblongata zur Olive, wo durch komplexe Verschaltung bereits eine Raumorientierung unter anderem durch reflektorische Blickwendungen realisiert werden kann. Hier erfolgt auch eine Verteilung auf ipsi- und kontralaterale Bahnsysteme [Irvine 1986; Schmidt und Thews 1996]. Der weit überwiegende Anteil der Fasern kreuzt auf die Gegenseite und durchzieht dabei in der Mittelinie von Pons und Medulla das Corpus trapezoideum. Von dort verlaufen die Fasern im Lemniscus lateralis zum Colliculus inferior. Afferenzen vom dorsalen Kern verlaufen als Striae acustici (Monakov) zur Mittellinie, kreuzen ebenfalls und verlaufen im Lemniscus lateralis der Gegenseite zum Colliculus inferior. Über das Corpus geniculatum laterale werden bereits, ohne nochmalige Kreuzung der Bahnsysteme, die primären auditorischen Hörfelder im Temporallappen („Heschl’scher Cortex“) innerviert. Die meisten corticalen Neurone werden daher vom kontralateralen Ohr aktiviert [Irvine 1986; Schmidt und Thews 1996]. Bei einer zentralen, unilateralen Läsion der Hörbahn leidet der Betroffene folglich unter Schwierigkeiten bei der Lokalisation von Schallquellen sowie beim Erkennen zeitlicher Muster des Schallreizes und daraus resultierenden Störungen des Sprachverständnisses, unter Umständen auch bei Schädigung im Bereich der nicht dominanten Hemisphäre. Die Neurone des ventralen Nucleus cochlearis verhalten sich funktionell noch ähnlich wie die Fasern des Hörnervs. Reine Töne führen dort, falls sie überschwellig sind, fast immer zu einer Aktivierung. Die Tuningkurven (d.h. der Frequenzbereich, innerhalb derer sich ein auditorisches Neuron aktivieren lässt) sind scharf, die Latenzen sind kurz [Evans 1975; Webster und Aitkin 1975; Irvine 1986]. Im dorsalen Nucleus cochlearis ergibt sich ein grundlegend anderes Bild. Obwohl auch hier die Neurone meist noch durch die Präsentation reiner Töne über das Ohr erregbar sind, ist das Antwortmuster auf diese Stimulation jedoch sehr unterschiedlich. Einige Neurone des dorsalen Kerns können durch Beschallung generell gehemmt werden, andere wieder werden durch bestimmte Frequenzen erregt, durch Nachbarfrequenzen aber gehemmt. Wiederum andere Neurone lassen sich besonders leicht durch Töne erregen, deren Frequenz sich ändert (so genannte frequenzmodulierte Töne [Whitfield 1967; Evans 1975; Goldberg 1975; Britt und Starr 1976; Manis und Brownell 1983; Moore 1987a]. Die anatomische Grundlage für dieses Verhalten bilden kollaterale Verschaltungen, die teils exzitatorisch, teils inhibitorisch wirken. Die funktionelle Bedeutung liegt offenbar darin, dass die Neurone auf bestimmte Eigenschaften des Schallreizes besonders reagieren, d.h. bereits hier Beiträge zur Mustererkennung geliefert werden. Dieses Verhalten wird in zentraleren Anteilen der Hörbahn immer deutlicher. Je weiter zentral sich ein Neuron in der Hörbahn befindet, desto komplexere Schallmuster muss man verwenden, um die Neurone aktivieren zu können [Pickles 1988]. Viele cochlea-fern gelegene Zellen reagieren überhaupt nicht mehr auf reine Töne. Zum Beispiel gibt es im Colliculus inferior Zellen, die nur durch frequenzmodulierte Töne erregbar sind, wobei häufig Richtung und Grad der Modulation von Bedeutung sind. Andere Zellen in diesem Gebiet reagieren zwar auf einen reinen Ton, aber nur, wenn er amplitudenmoduliert ist. 13 Betrachtet man die mit Cochlea-Implantaten erreichbaren Hörergebnisse, dann erscheint es sicher erstrebenswert, die Elektroden auditorischer Hirnstammimplantate ebenso tonotop anzuordnen wie das in der Cochlea möglich ist. Aufgrund der nach zentral zunehmenden Komplexität der Verschaltung im Bereich der Hörbahn muss man annehmen, dass die primäre Schaltstelle im Hirnstamm, der Nucleus cochlearis ventralis, dafür ein sehr geeigneter Zielort wäre. Würde man seine Größe und Lage kennen und könnte diese auch während der Implantation zuordnen, dann sollte ein tonotopes „Andocken“ mit einem Hirnstammimplantat prinzipiell möglich sein, solange der funktionelle Aufbau des Kerngebietes berücksichtigt wird. Diese funktionelle Organisation soll im Folgenden daher noch näher betrachtet werden. 2.2.2. Innere funktionelle Organisation und Tonotopie Bereits im Bereich der Nuclei cochleares werden einzelne frequenzspezifische Kanäle in ein vielkanaliges sensorisches System integriert [Moore 1986]. Phylogenetisch zeigt sich allerdings mit zunehmender Enzephalisation des auditorischen Systems ein Trend zur Abnahme der Integration im Bereich dieses Kerngebietes im Hirnstamm, was zum Beispiel im Abbau der externen Granularzellschicht (Interneurone) im Verlauf der postnatalen Entwicklung, in der relativen Verkleinerung des Nucleus cochlearis dorsalis bei Primaten, in der vollständigen Durchsetzung auch dieses hinteren Kernanteils mit Fasern aus dem Nervus cochlearis, in reduzierten Populationen von Riesenzellen sowie im Verlust perpendikulären Anordnung der Pyramidenzellen im NCD beim Menschen im Vergleich zur Katze zum Ausdruck kommt [Moore und Osen 1979; Heiman-Patterson und Strominger 1985; Pickles 1988]. Damit ist die funktionelle Organisation des Nucleus cochlearis beim Menschen eigentlich eher klarer und weniger komplex als bei niederen Säugetieren. Nach seiner Teilung im Bereich der Wurzeleintrittszone kontaktiert jedes der etwa 30.000 primären Axone des Hörnervs über synaptische Verbindungen jeweils einige Hundert Neurone im Hörkernkomplex [Lorente de No 1933; Whitfield 1967; Luxon 1981; Quester und Schroder 1997]. An den Neuronen des ventralen Kerns bilden die Fasern große und komplexe neurochemische Strukturen, die sogenannten Held’schen Endkolben [Lorente de No 1981]. Wie unter 2.2.1. beschrieben sind es die Neurone des ventralen Nucleus, welche funktionelle Charakteristika aufweisen, die denen der Fasern des Hörnerven ähneln. Die Zellen des Nucleus cochlearis dorsalis zeigen ein wesentlich komplexeres Verhalten. Etwa die Hälfte der im NCD der Katze gelegenen Zellen sind Interneurone und werden nicht direkt durch Fasern des Hörnerven innerviert [Whitfield 1967; Moore 1986]. Die Axone der Neurone des Nucleus cochlearis dorsalis ziehen zudem an der nächsten Schaltstelle der Hörbahn, der oberen Olive, nur vorbei ohne dort umgeschaltet zu werden und kreuzen vollständig zum lateralen Lemniscus der Gegenseite [Whitfield 1967; Pickles 1988]. Die Spontanaktivität der Neurone des NCD der Katze wird kaum durch cochleäre Afferenzen direkt beeinflusst, so dass man annehmen kann, dass hier andere Zuflüsse dominieren [Koerber et al. 1966]. 14 Das für die Entwicklung von Tiefenelektroden für die elektrische Stimulation interessanteste Prinzip in der funktionellen Topographie des Hörkerngebietes ist die tonotope Organisation seiner Zellen und Fasersysteme, das heißt die Ausrichtung der anatomischen Strukturen nach funktionellen Prinzipien der Frequenzzuordnung. Primäre auditorische Axone von der Basis der Cochlea (hohe Frequenzen) penetrieren tief in den Nucleus hinein, bevor sie in seinen Unterabschnitten terminieren. Primäre Axone vom Apex der Cochlea (tiefe Frequenzen) terminieren in oberflächlicheren Schichten und Fasern aus den mittleren Regionen erreichen Schichten, die zwischen diesen beiden Extremen angeordnet sind [Moore und Osen 1979; Dublin 1982; Moore 1986; Kelly 1991]. Im Bereich des Nucleus cochlearis dorsalis zeigt sich neben der im Gegensatz zu anderen Spezies vollständigen Penetration durch deszendierende Axone des Hörnerven [Moore 1986] noch eine weitere, wichtige Besonderheit: Die cochleotope Sequenz ist hier im Gegensatz zu Katze und Meerschwein so angelegt, dass basale Fasern rostral und apikale Fasern kaudal in den hinteren Teil des Hörkerns einstrahlen [Moore und Osen 1979; Moore 1986]. Abb. 2.4 Abbildung aus der ersten Originalpublikation über Messungen zur tonotopen Abbildung der Frequenzen im anterioren NCV nach akustischer Stimulation. Entlang des Penetrationskanals einer Mikroelektrode durch den Hirnstamm der Katze wurden Summenpotenziale als Antwort auf akustische Stimulation mit unterschiedlichen Tonhöhen abgeleitet. Interessanterweise zeigt sich in den drei Kerngebieten des Hörkerns der Katze jeweils eine eigenständige Tonotopie. (nach [Rose et al. 1959]) 15 Erwartungsgemäß finden diese anatomischen Beobachtungen ihre funktionelle Widerspiegelung in einer tonotopen Tiefenanordnung charakteristischer Frequenzen (Abb.2.4) [Rose et al. 1959; Whitfield 1967; Osen 1970; Evans 1975; Lorente de No 1981; Luxon 1981; Irvine 1986; Pickles 1988; Kahle 1991]. Eine schichtförmige, oberflächenparallele Frequenz-Anordnung gibt es bei der Katze nur im anterioren NCV. Hier besteht eine klare Punkt-zu-Schicht (oder Punkt-zu-Ebene) Zuordnung charakteristischer cochleärer Frequenzen bzw. Frequenzbänder. Diese Schichten konstanter charakteristischer Frequenzen (Isofrequenzschichten) sind annähernd planar, parallel und von lateral nach medial sowie von rostral nach kaudal jeweils ca. 45° geneigt [Bourk et al. 1981; Irvine 1986]. Eine solche Punkt-zuSchicht-Repräsentation somatosensorischen erfordert System Transformationen [Merzenich et al. höherer 1977; Ordnung Bourk als et al. im visuellen 1981]. und Welche Stimuluseigenschaften an welchen Punkten der Isofrequenzschichten repräsentiert werden ist noch ungeklärt. Die schichtförmige Frequenz-Zuordnung im anterioren Nucleus cochlearis ventralis der Katze gilt nicht mehr im posterioren NCV, wo es mehrere tonotope Gradienten gibt und Neurone mit sehr unterschiedlichen charakteristischen Frequenzen einander benachbart sein können [Bourk et al. 1981]. Gleichzeitig lässt sich bei Änderung der Penetrationsrichtung der Messelektroden im Nucleus cochlearis ventralis der Katze auch eine von dorsal nach ventral gerichtete Abnahme der charakteristischen Frequenz nachweisen [Rose et al. 1960; Evans und Nelson 1973; Goldberg 1975; Luxon 1981]. Das Neuropil der Zentralregion des NCD setzt sich offenbar zu einem großen Teil aus nicht primären Axonen und Synapsen zusammen [Osen 1969a; Osen 1969b; Osen 1970; Moore und Osen 1979; Moore 1987b]. Degenerationsstudien stützen diese Befunde (s. unter 2.1.5). Eine tonotope Anordnung findet sich aber auch im hinteren Hörkern [Rose et al. 1959; Rose et al. 1960; Irvine 1986]. Offenbar ist dort jedoch die Tiefenanordnung komplexer, so dass lineare Tonotopie-Modelle für dieses Kerngebiet bei der Katze bisher nicht bestätigt werden konnten [Irvine 1986]. Im Tierexperiment lassen sich intranukleäre Verbindungen zwischen korrespondierenden, tonotopen Regionen des NCV und NCD nachweisen [Snyder und Leake 1988; Wickesberg und Oertel 1988]. Aufgrund der beschriebenen, plexusartigen Aufzweigung der Afferenzen im dorsalen Hörkern des Menschen dürfte eine systematische Frequenzzuordnung hier noch weniger gelingen. McCreery et al. nutzten in einer 1998 veröffentlichten Studie den bekannten tonotopen, dorsolateralnach-ventromedialen Aufbau des Nucleus centralis des Colliculus inferior bei Katzen um nachzuweisen, dass man mit Stromstärken, die in früheren Experimenten bei chronischer Stimulation als unschädlich befunden wurden [McCreery et al. 1992; McCreery et al. 1994; McCreery et al. 1997], die Isofrequenzschichten des Nucleus cochlearis ventralis mit penetrierenden Tiefenelektroden separat stimulieren kann [McCreery et al. 1998]. Durch die gleichzeitige Implantation von Elektroden im Colliculus inferior konnte die räumliche Verteilung evozierter Feldpotenziale (multi unit activity) nach Reizung an verschiedenen Punkten auf 16 einer dorso-ventral durch den Nucleus cochlearis ventralis liegenden Achse ermittelt werden. Es zeigten sich gegeneinander abgrenzbare Regionen im Colliculus inferior, die offenbar die charakteristischen Frequenzen im NCV repräsentieren (Abb. 2.5). In gewisser Weise waren diese Untersuchungen die unmittelbare Fortsetzung der Studien von Rose und Galambos zur Tiefentonotopie des Nucleus cochlearis [Rose et al. 1959; Rose et al. 1960] und der tierexperimentelle Beweis, dass eine Ausnutzung der tonotopen Gradienten des Kerngebietes durch penetrierende Hirnstammimplantate auch durch elektrische Stimulation praktisch realisierbar ist. Abb. 2.5 Links: Summenfeldpotenziale im Colliculus inferior nach Stimulation mit einer Stromstärke von 24µA über Mikroelektroden in der Tiefe des Nucleus cochlearis ventralis der Katze. Rechts: Mittlere Anzahl von neuronalen Summenpotenzialen, welche eine definierte Schwelle überschritten, als Funktion der Tiefe der Ableitelektroden im Colliculus inferior und der Position der Stimulationselektroden im NCV. Es wird deutlich, dass die Stimulation in unterschiedlicher Tiefe entlang der dorso-ventralen Achse des Kerns maximale Antworten an unterschiedlichen Orten der tonotopen Karte des CI auslöst. Daraus lässt sich schließen, dass eine frequenzspezifische Reizung im Nucleus cochlearis ventralis mit dauerhaft tolerablen Amplituden bei der Katze möglich ist. (aus [McCreery et al. 1998]) Eine direkte Kartierung der Repräsentation akustischer Reizfrequenzen im auditorischen Hirnstammsystem des Menschen ist noch nicht möglich. Dublins’s Versuch eines „kochleären Nukleogramms“ [Dublin 1974; Dublin 1976; Dublin 1982] ist bisher die einzige brauchbare Methode, die Tiefentonotopie abzuschätzen. Wie zuvor schon aus dem histologischen Zustand der Haarzellen, der Stria vascularis und der Spiralganglionneurone ein „Audiohistogramm“ erstellt wurde, bestimmte Dublin aus dem Verlust der sphärischer Zellen im Nucleus cochlearis, dem zu erwartenden Audiogramm bei sensorineuralem Hörverlust und dem Untergang von Spiralganglienzellen eine näherungsweise („best fit“) Frequenzkarte. Er ermittelte dabei einen Gradienten, innerhalb dessen tiefe Frequenzen ventral und hohe Frequenzen dorsal repräsentiert werden (Abb. 2.6). Diese Befunde stehen mit den oben zitierten histologischen Untersuchungen im Einklang [Moore und Osen 1979; Moore 1986]. 17 Abb. 2.6 Abbildung niedriger und hoher Frequenzen im Bereich der unteren Hörbahn (Cochlea, Nucleus cochlearis, Colliculus inferior). Die Abbildung hoher Frequenzen soll auch beim Menschen primär und überwiegend im NCV erfolgen [McCreery et al. 2005]. Eine Form Kartierung ist, allerdings nur über den Umweg einer elektrischen Stimulation der Tonotopie- und Abfrage der Tonhöhen-Wahrnehmung, auch bei Patienten mit mehrkanaligen auditorischen Hirnstammimplantaten durch ein so genanntes „pitch ranking“ möglich [Moore und Osen 1979; Moore 1986; Laszig et al. 1995b; Laszig 1997; Sollmann et al. 1998; Marangos et al. 2000]. Auch hier zeichnet sich eine ähnliche Tendenz ab: niedrige Frequenzen werden medial (tiefer im Recessus lateralis) und kaudal, höhere Frequenzen lateral und kranial abgebildet [Marangos et al. 2000]. Da die lateralen Elektroden die Grenze zwischen dorsalem und ventralem Nucleus überschreiten und die Elektrodenlage individuell variiert ist die Aussagekraft dieser Untersuchungen allerdings eingeschränkt. Darüber hinaus muss man berücksichtigen, dass bei Oberflächenimplantaten in vivo die Feldverteilung unter den Elektroden uneinheitlich ist und man in der klinischen Praxis bisher nicht vorhersagen kann, in welcher Tiefe Neurone unter einer bestimmten Elektrode gerade noch erreicht werden. Die durch Stimulation an einem bestimmten Elektrodenkontakt durch den Patienten empfundene Tonhöhe kann daher durchaus auch eine Funktion der erreichten Eindringtiefe des elektrischen Feldes an dieser Stelle sein [Klinke et al. 1996]. An einem physikalisch-mathematischen Modell, mit dem die Stromverteilung in Gewebe und Flüssigkeit vorhergesagt werden kann, wird derzeit an der University of Michigan gearbeitet [McCreery et al. 2005]. Damit soll es möglich werden, den Abstand zwischen Elektroden und (auditorischen) Neuronen abzuschätzen. Als neurophysiologische Basis für die elektrische Stimulation zum Hörersatz kann man nach den vorliegenden Befunden auch beim Menschen dreidimensionale Tonotopie-Gradienten in den Nuclei cochleares annehmen, deren Ausnutzung durch Oberflächenelektroden derzeit nur ansatzweise möglich ist. Nach einer Hypothese von Young (1984) [Young 1984] bilden die in den Nuclei cochleares zum Teil abgrenzbaren Gruppen unterschiedlicher Zellformen separate, parallele Systeme zur Weitergabe der auditorischen Information. Ein Teil des Qualitätsverlustes des ABI gegenüber dem Cochlear-Implant resultiert also möglicherweise daraus, dass aufgrund der Entfernung der Elektroden zu den primären auditorischen Neuronen nur sekundäre funktionelle Subsysteme angeregt werden können und dies nicht komplex und konzertiert genug [Liu et al. 1998]. Auch hier wäre eine bessere Kontaktierung (Interfacing) primärer auditorischer Afferenzen mit Tiefenelektroden ein möglicher Lösungsansatz. 18 2.2.3. Degenerative Veränderungen im Bereich des Nucleus cochlearis Entscheidend für die dauerhafte Funktionsfähigkeit von Implantaten, welche die primären auditorischen Zentren des Hirnstamms elektrisch stimulieren, ist die Überlebensfähigkeit der Nervenzellen im Nucleus cochlearis. Auch bei vollständig biokompatibler, elektrischer Dauerreizung ohne unmittelbar zellschädigende Effekte würde eine teilweise und fortschreitende Degeneration der Neurone einen schleichenden Funktionsverlust der Implantate mit sich bringen. Das ist auch für die vorliegende Untersuchung bezüglich der Altersverteilung von Bedeutung. Außerdem ist ungeklärt, ob sich durch Degeneration die anatomischen Dimensionen des Nucleus cochlearis verändern. Degenerationsstudien nach Zerstörung der Cochlea oder des Hörnerven erlauben prinzipiell Rückschlüsse nicht nur auf das Ausmaß des Zellverlustes im Bereich des 2. Neurons der Hörbahn. Aufgrund der trophischen Funktion der afferenten Axone des Nervus cochlearis lassen diese Untersuchungen darüber hinaus Aussagen über das Innervationsmuster und Rückschlüsse auf die Tonotopie der Nuclei cochleares zu. Es ist zu erwarten, dass Neurone, die ihren afferenten Zustrom unmittelbar über Axone des Hörnerven, also vom Ganglion spirale und nicht von Zwischenneuronen erhalten, nach sensorineuraler Destruktion am deutlichsten degenerieren. Aus der nur geringgradigen Degeneration des Neuropils des Nucleus cochlearis dorsalis nach kompletter cochleärer Destruktion kann geschlossen werden, dass in diesem Teil des Hörkerns Axone und Synapsen überwiegen, die nicht primär aus dem Hörnerven gespeist werden [Moore 1986; Seldon und Clark 1991]. Der NCD ist also bezüglich Dichte und Ausmaß der Innervation weit weniger durch den Hörnerv dominiert als der Nucleus cochlearis ventralis. Tatsächlich tritt eine Degeneration nach Cochlealäsionen offenbar überwiegend im Bereich des Nucleus cochlearis ventralis ein [Dublin 1976; Moore und Osen 1979; Dublin 1982; Moore 1986; Moore 1987a]. Dabei kommt es kaum zu Zellverlusten, sondern vor allem zu einer Verringerung von Zellgröße und –volumen. Seldon and Clark (1991) [Seldon und Clark 1991] fanden bei 11 postlingual ertaubten Patienten eine Verringerung der Zellgröße und des Volumens des Nucleus cochlearis im Vergleich zu einer Kontrollgruppe. Beide Veränderungen erwiesen sich jedoch, trotz der großen Gesamtzahl von 81.007 gezählten Neuronen, als nicht statistisch signifikant. Selbst 40 Jahre nach Ertaubung hatte die Zellgröße in einem Fall dieser Studie nur minimal abgenommen. Erfahrungen mit Patienten, die gute Sprachdiskrimination erlangten, obwohl ihnen erst mehr als 30 Jahre nach Ertaubung ein Cochlea Implantat eingesetzt wurde, werden damit interpretierbar [Blamey et al. 1992]. Jean Moore et al. fanden in einer Untersuchung an 7 sensorineural ertaubten Patienten 1997 eine Verringerung der Zellgröße in der Größenordnung von 20-30% im vorderen Anteil des Nucleus cochlearis [Moore et al. 1997]. Interessanterweise wiesen die Autoren diese Schrumpfung in ähnlicher Ausprägung auch in übergeordneten Zentren der Hörbahn nach, nämlich in der Olive und im Colliculus inferior. Die gleiche Größenabnahme fand sich auch bei einem Patienten mit Cochlea Implantat, woraus sich schlussfolgern lässt, dass die elektrische Stimulation des Hörnerven allein den offenbar durch transmitter-assoziierte Substanzen vermittelten trophischen Effekt nicht ersetzen kann. 19 Bei einem Patientin mit Neurofibromatose Typ II in der gleichen Studie zeigten auch 10 Jahre nach unilateraler und 6 Jahre nach bilateraler Ertaubung mehr als 70% der Zellen keine Degenerationszeichen. Selbst im Nucleus cochlearis eines seit fast 30 Jahren ertaubten Patienten war die Mehrzahl der Neurone morphologisch unverändert im Vergleich zur Norm. Das beschriebene Degenerationsmuster mit Volumenreduktion bei gleichbleibender Zellzahl tritt offenbar bei Mensch und Katze in durchaus vergleichbarer Weise ein [Shepherd und Hardie 2001]. Hardie und Shephard berichteten 1999 über eine an 13 kochleär vertaubten Katzen durchgeführte Untersuchung mit Implantation bipolarer Elektroden in der Scala tympani. 12 der Tiere waren seit weniger als 2½ Jahren taub. Die Spiralgangliendichte hatte im Mittel auf 17% abgenommen. Das Volumen des Nucleus cochlearis war um 46% vermindert, die Neuronendichte um 37% gegenüber der Norm erhöht. Bei einem längerfristig (8 Jahre) ertaubten Tier trat die Schrumpfungsdegeneration in deutlich stärkerem Maße ein (60% Volumenminderung, 44% erhöhte Neuronendichte). Wiederum war die absolute Zahl der Zellen nicht wesentlich reduziert. Dennoch ist die Volumenverringerung des gesamten Kerngebietes nach Deafferenzierung im Rahmen der Versorgung von längerfristig ertaubten Patienten mit Implantaten aufgrund der möglichen, topographisch-anatomischen Veränderungen ein nicht zu unterschätzender Faktor. Histomorphometrische Messungen, die an Hirnstämmen nicht ertaubter Menschen durchgeführt werden, müssten demnach in der Tendenz Überschätzung der Ausdehnung des Nucleus cochlearis befunden werden. Darauf soll in der Diskussion der Ergebnisse der vorliegenden Arbeit zurückgekommen werden. 2.3. Auditorische Hirnstammimplantate - ABI und PABI 2.3.1. Historische Entwicklung der elektrischen Stimulation der Hörbahn Zu Beginn des 19. Jahrhunderts bemerkte Alessandro Volta bei elektrischer Stimulation mit der ersten Batterie, der berühmten Volta’schen Säule, an seinen mit leitfähiger Kochsalzlösung gefüllten äußeren Gehörgängen Höreindrücke [Volta 1800]. 1925 wurde der Effekt durch amerikanische Radioingenieure als „elektrophones Hören“ quasi wiederentdeckt, indem sie Stimulationselektroden in der Nähe des Ohres platzierten [Steven und Jones 1939]. Wever und Bray entdeckten 1930 per Zufall mit auf dem Hörnerv von Katzen platzierten Elektroden Potenziale, die den Eigenschaften des Schallreizes nahezu analog folgten [Wever und Bray 1930]. Die erste wissenschaftliche Publikation über eine elektrische Stimulation des Hörnervs mit dem Ziel der Wiederherstellung des Hörvermögens entstand 1957. Der Otologe Djourno und der Physiker Eyries hatten in Paris bei einem Patienten über eine retrocochleär am Hörnerv gelegene Elektrode auditorische Sensationen auslösen können [Djourno und Eyries 1957]. Durch die elektrische Stimulation über einen primitiven Sprachstimulator konnten die französischen Forscher auditorische Sensationen auslösen, welche der Patient als Geräusche beschrieb, wie sie beim Drehen eines Roulettes entstehen. Nach einer Übungsphase verstand er sogar einzelne Wörter. Interessant ist, dass er das mit einem perkutanen Stecker 20 versehene und in situ belassene Implantat über mehr als ein Jahr benutzte und das Ausschalten als „Rückfall in unerträgliche Stille“ beschrieb [Lehnhardt 1998]. Die Arbeit von Djourno und Eyries griffen die US-Amerikaner James Doyle und sein Schüler William House auf. 1961 entwickelten die HNO-Spezialisten die ersten klinisch eingesetzten EinkanalImplantate zur elektrischen Stimulation der Cochlea [Doyle et al. 1964]. Die implantierten Patienten konnten Umgebungsgeräusche hören und den Rhythmus von Musik und Sprache erkennen. In Europa wurde durch den Otologen Fritz Zöllner in Freiburg und den Physiologen Wolf Dieter Keidel Pionierarbeit geleistet. Während Djourno’s Gruppe in Frankreich weiterhin eine Platzierung der Elektroden auf dem Hörnervstumpf favorisierte, implantierten die Deutschen, wie William House in Los Angeles, über das runde Fenster direkt in die Scala tympani. Zöllner und Keidel entwarfen bereits 1963 ein mehrkanaliges Cochlea-Implantat [Zöllner und Keidel 1963]. 1964 stimulierte F. Blair Simmons nach der Entfernung eines rezidivierten Kleinhirntumors den Hörnerv elektrisch intraoperativ. Am Tag zuvor hatte er dem Patienten Tonfolgen vorgespielt, die während der Wachoperation am nächsten Tag in ähnlicher Form als elektrische Reizfolgen appliziert wurden. Der Patient berichtete während der elektrischen Stimulation bei der Operation, dass er tatsächlich ähnliche Geräusche wahrnähme wie tags zuvor beim akustischen Training [Simmons et al. 1964]. 1966 implantierte die gleiche Arbeitsgruppe an der Stanford Universität eine Elektrode in den Modiolus der Cochlea eines kongenital tauben Patienten [Simmons 1966]. 1981 berichteten sowohl Michelson und Schindler als auch Clark et al. (Melbourne) unabhängig voneinander zum ersten Mal über Patienten, die durch cochleäre Implantate ein Sprachverständnis erlangt hatten [Clark et al. 1981; Michelson und Schindler 1981]. 2.3.2. Auditorische Hirnstammimplantate Ermutigt durch die Erfolge bei ertaubten Patienten, deren Hörnerv noch intakt war und ausgehend von der Überlegung, dass es auch möglich sein müsste, durch elektrische Stimulation an anderen Stellen der Hörbahn akustische Wahrnehmungen auszulösen, implantierten der HNO-Chirurg William House und der Neurochirurg William Hitselberger am 24. Mai 1979 zwei kugelförmige Platin-Elektroden (Durchmesser 0,5 mm, Elektrodenabstand 1,5 mm, Abb. 2.7 ) in den Hirnstamm einer Patientin, bei der durch Typ-II-Neurofibromatose beide Hörnerven durch Akustikusneurinome zerstört waren [Edgerton et al. 1982]. 21 Abb. 2.7 Historische ABI-Elektroden [Brackmann et al. 1993] Ganz oben: erstes (penetrierendes) Einkanal-ABI 1979 Darunter: mehrere Generationen Oberflächen-ABI Rechts: Beispiel des implantierten Anteils eines aktuellen ABI mit 21 aktiven Elektroden und einer kugelförmigen Referenzelektrode (Nucleus24, Abb. Press Kit der Fa. Cochlear Ltd.) Damit war das erste auditorische Hirnstammimplantat (ABI … Auditory Brainstem Implant) geschaffen – kurioserweise als penetrierendes Implantat (PABI … Penetrating Auditory Brainstem Implant). Zwei Jahre später wurden diese penetrierenden Elektroden gegen eine Oberflächenelektrode (Dakronnetz mit zwei Platin-Kontakten) ersetzt. Penetrierende Implantate wurden erst 2004, also 25 Jahre nach dem ersten ABI erneut eingesetzt. Bis 1989 waren 16 Oberflächen-ABI implantiert worden. Der Recessus lateralis des 4.Ventrikels erwies sich für Oberflächenelektroden als der am besten geeignete Implantationsort (Abb. 2.8). 22 Abb. 2.8 Cochlea Implant (CI) rechts und zwei Typen von Elektroden eines auditorischen Hirnstammimplantates (ABI). Die eine Elektrode liegt als Oberflächenelektrode im rechten Recessus lateralis des vierten Ventrikels dem Nucleus cohlearis an. Die auf dem zweiten ABI-Elektrodenträger montierten Nadelelektroden penetrieren der NCV (PABI) (Quelle: PABI Press Kit; House Ear Institute, Los Angeles, Zeichnung von Cochlear Corporation/ Cochlear Limited, http://www.hei.org/news/presskits/pabi/pabiimages.htm) Durch die Einführung einer intraoperativen, elektrophysiologischen Ableittechnik für elektrisch evozierte Potenziale des Hirnstamms (Potenziale mit einer Latenz von weniger als 4ms, so genannte „Electrically Evoked Auditory Brainstem Response“, EABR) durch Michael Waring am HEI in Los Angeles 1992 [Waring 1995a; Waring 1995b] wurde eine exaktere Platzierung der Elektrode über dem Nucleus cochlearis möglich, die Implantate blieben aber zunächst einkanalig. Erst nachdem Luetje et al. (Kansas City, Missouri) im Februar 1990 bei einer ertaubten Patientin nach Entfernung eines Vestibularisschwannoms die Elektrode eines der zu diesem Zeitpunkt kommerziell verfügbaren mehrkanaligen Cochlea-Implantate über das Foramen Luschkae in den Recessus lateralis eingesetzt hatten und mit vier Elektroden davon bereits am sechsten postoperativen Tag das auditorische System aktivieren konnten [Luetje et al. 1992], begann die systematische klinische Erprobung von Mehrkanalimplantaten auch für den Nucleus cochlearis. 1991 wurden am HEI in Los Angeles erstmals 3-Kanal- Implantate – damals noch mit rechteckigem Elektrodenquerschnitt – bei fünf Patienten eingesetzt. Das erste klinisch eingesetzte Multikanalimplantat wurde durch den HNOChirurgen Roland Laszig und den Neurochirurgen Wolf Peter Sollmann in Hannover konzipiert und durch die australische Firma Nucleus technisch umgesetzt [Laszig et al. 1991]. 1992 wurden die ersten Patienten in Hannover und in Los Angeles über einen translabyrinthären Zugang mit 23 Multikanal-Arrays versorgt [Laszig et al. 1995a; Otto et al. 1997]. Neben der Weiterentwicklung der Sprachprozessortechnik, die Impulse durch den weltweiten Erfolg des Cochlear-Implantats erhielt, wurde die Elektrodenentwicklung vorangetrieben. Das europäische Konzept hatte von Beginn an gezielt auf die Verwendung von Multikanal-Arrays gesetzt, um die vorhandene Prozessortechnologie und gegebenenfalls auch die mögliche Tonotopie entlang der Oberfläche des Nucleus cochlearis auszunutzen [Laszig 1997; Laszig et al. 1997; Sollmann et al. 1998; Sollmann et al. 2000; Lenarz et al. 2001]. In der Praxis konnte dann auch tatsächlich ein Tonhöhenabfall von medial nach lateral an den in den Recessus lateralis eingebrachten Elektroden beobachtet werden [Laszig et al. 1995b]. Obwohl die Qualität des Sprachverständnisses theoretisch bei mehr als acht frequenzspezifischen Kanälen nur noch geringfügig ansteigt [Shannon et al. 1995; Fishman et al. 1997; Dorman et al. 1997] hat sich in der Praxis letztlich das deutsche, beziehungsweise europäische Konzept eines mit 21 aktiven Kanälen bestückten Implantates gegenüber dem 8-Kanal Konkurrenten aus Los Angeles (HEI) durchgesetzt. Inzwischen wurden weltweit mehr als 600 Patienten mit ähnlichen Implantaten versorgt [http://www.cdc.gov/ncbddd/ehdi/documents/ABI_Biernath%2007-2007%20(2).pdf]. Nachdem anfangs nur der translabyrinthäre Zugang zur Implantation genutzt wurde, werden ABI seit längerem auch über einen lateral subokzipitalen Zugang eingesetzt [Matthies et al. 2000; Sollmann et al. 2000]. Obwohl zeitliche Reizauflösung, Dynamik und Lautstärkecharakteristik dem CochleaImplantat sehr ähnlich sind [Shannon 1989; Shannon und Otto 1990], blieben die klinischen Ergebnisse mit dem ABI trotz ausgefeilter Sprachprozessortechnik und Einbindung multipler Elektroden in die Implantate hinter den Erwartungen und insbesondere hinter den Erfolgen mit den CI zurück [Shannon et al. 1993; Shannon 1993; Laszig et al. 1995a; Laszig et al. 1995b; Briggs et al. 2000; Ebinger et al. 2000; Matthies et al. 2000; Marangos et al. 2000; Sollmann et al. 2000; Lenarz et al. 2001]. Charakteristisch ist die hohe individuelle Varianz bezüglich der Effektivität der elektrischen Implantate. Wie beim Cochlea Implantat müssen Elektrodenkonfiguration und Reizparameter jeweils individuell postoperativ angepasst werden. Die Prozessorstrategie, also die Art der Umsetzung von akustischen Signalen in elektrische Reizfolgen und das Muster der Ansteuerung der einzelnen Elektroden ist dabei ebenfalls bedeutungsvoll. Die Ergebnisse der einzelnen Arbeitsgruppen, die zum Teil sehr unterschiedliche Sprachprozessorstrategien einsetzen, sind daher auch nur bedingt vergleichbar. Im Durchschnitt entspricht die Qualität des durch ein ABI erreichbaren Höreindrucks mit wenigen Ausnahmen [Colletti und Shannon 2005] derzeit noch immer nur dem eines einkanaligen Cochlea Implantates [Laszig und Aschendorff 1999; Rauschecker und Shannon 2002]. Das Lippenlesen wird für mehr als die Hälfte der ABI-Patienten bereits in den ersten Wochen nach Implantation deutlich leichter. Dieser Effekt nimmt später noch weiter zu, sodass die meisten Patienten ihr Implantat permanent einsetzen. Umgebungsgeräusche (z.B. Klingel, Autohupen) können gehört, von Sprache unterschieden und oft richtig eingeordnet werden. Männer-, Frauen und Kinderstimmen können ebenso differenziert werden und manche Patienten können weiter in ihrem Beruf arbeiten [Lenarz et al. 2002; Nevison et al. 2002]. Zur Wahrnehmung eindeutiger Höreindrücke ist für Patienten mit den heutigen ABI eine geräuscharme Umgebung Voraussetzung. Längere Worte können aufgrund von Nachhall- und Echo-Effekten meist nicht verstanden werden. Ein echtes Sprachverständnis („open set speech recognition“) erhalten nur wenige Patienten allein durch die 24 elektro-auditorische Stimulation mit dem ABI [Lesinski-Schiedat et al. 2000; Jackson et al. 2002]. Zu den Nebenwirkungen zählen Schwindel und Dysästhesien im Bereich der Zunge, des Kopfes und des Beines. Die sensorische Fehlstimulation betrifft oft auch das 2. Neuron der somatosensiblen Bahnen (Druckempfindung, Vibrationsempfinden, Raumsinnempfindung, Berührungssensibilität). [Lenarz et al. 2001] Seltener wird der Nervus facialis mitgereizt [Brackmann et al. 1993; Shannon et al. 1993], was sich aus dem Verlauf des Nerven im Hirnstamm und seiner Nachbarschaft zum Nucleus cochlearis erklärt. Auch Nebenwirkungen durch Reizung der caudalen Hirnnerven (Nervi glossopharyngeus, vagus, accessorius), deren Kerngebiete in der mittleren Medulla oblongata unweit des darüber liegenden Zielgebietes der ABI-Elektroden lokalisiert sind. Motorische Fehlstimulation der unteren Extremitäten durch Elektrodenmigration wurden episodisch beschrieben [Edgerton et al. 1982]. Bei Fehlstimulation und Elektrodenverlagerung ist eine Replatzierung des Implantates möglich; auch tierexperimentell zeigten sich durch das Oberflächenimplantat selbst keine Schädigungen des Hörkerns [Liu et al. 1997; Manrique et al. 2000; Rosahl et al. 2001; Manrique et al. 2008]. Wie oben beschrieben (s. Kapitel 2.1.3) liegt auch der oberflächliche dorsale Kern noch geschützt unter der Pia und einzelnen Nervenfaserzügen. 2.3.3. Penetrierende ABI-Elektroden Weil nur wenige ABI-Träger ein offenes Sprachverständnis wiedererlangen und weil durch die erfolgreicheren Cochlea Implantate bekannt ist, dass ein Sprachverständnis davon abhängt, die Wahrnehmung möglichst vieler unterschiedliche Tonhöhen durch elektrische Stimulation an unterschiedlichen Orten auslösen zu können, vermutet man, dass die Oberflächenelektroden des ABI, im Gegensatz zu den annähernd tonotop platzierten Elektroden des Cochlea Implantates, zu wenig direkte räumliche Beziehung zu tonhöhenspezifischen Arealen des Hörkerns haben. Man vermutet weiterhin, dass dieser Nachteil durch penetrierende Elektroden (PABI, Abb. 2.9) teilweise ausgeglichen werden kann, so dass ein Sprachverständnis resultiert, welches dem durch MultikanalCochlear-Implantate näher kommt (http://www.hei.org/news/facts/pabifact.htm). 25 A B C Abb. 2.9 Im Katzenexeperiment am Huntington Research Institute in Pasadena eingesetzten PABI-Elektroden. In jeden der in A und B dargestellten 4 Silikonschäfte waren mehrere Elektrodenkontakte integriert. Der EpoxyTrägersockel (C) hatte einen Durchmesser von 2,4 mm und war damit genau so dimensioniert, wie der Elektrodenträger für die erste Generation penetrierender Elektroden im Patienteneinsatz. Dabei kamen allerdings Einzelelektroden unterschiedlicher Länge aus Iridium zum Einsatz [McCreery et al. 2005]. Die Elektroden wurden während der Operation mit einem speziellen pneumatischen Insertions-Werkzeug implantiert. Die in der Cochlea longitudinal angeordneten, charakteristischen Frequenzen sind im Nucleus cochlearis zum Teil vertikal zur Hirnstammoberfläche repräsentiert (dreidimensionale Tonotopie, Tiefentonotopie, s. Kapitel 2.2.2) [Rose et al. 1959; Moore und Osen 1979; Moore 1986; McCreery et al. 2000]. Große Anteile des Nucleus cochlearis ventralis werden durch Oberflächenimplantate nicht erreicht. Dieser Teil des Kerngebietes erhält aber den weitaus größeren Anteil der primären auditorischen Afferenzen. Seine Neurone weisen ähnliche Antwortcharakteristiken wie die primären sensorischen Neurone des Ganglion spirale auf. Sie exprimieren überwiegend exzitatorische Transmitter. Der Grad ihrer Vernetzung untereinander ist noch nicht so komplex wie im Nucleus cochlearis dorsalis. Die Zahl der in Richtung des Colliculus inferior abgehenden Fasern aus dem Nucleus cochlearis ventralis ist etwa um den Faktor 10 größer als im Nucleus cochlearis dorsalis [Evans 1975]. Die Stimulation des vorderen Kernanteils führt simultan zu einer Aktivierung zugehöriger tonotoper Areale im Nucleus cochlearis dorsalis [Moore 1987b]. 26 Mit penetrierenden Elektroden lassen sich außerdem experimentell, offenbar aufgrund einer besseren Ankopplung der Stimulation an auditorische Neurone zweiter Ordnung, niedrigere elektrische Reizschwellen erzielen [Evans 1975; Niparko et al. 1989; Shore et al. 1990; El-Kashlan et al. 1991; McCreery et al. 1992; Liu et al. 1997; McCreery et al. 1998; McCreery et al. 2000; Rosahl et al. 2001]. Penetrierende Elektroden haben im Experiment kaum neuronale Schäden im Bereich der Implantationsstelle hervorgerufen (Abb. 2.10) [McCreery et al. 1992; Liu et al. 1997; McCreery et al. 2000; Rosahl et al. 2001]. Abb. 2.10 Längsschnitt des Stichkanals einer Insertionselektrode mit quadratischem Querschnitt und einer Kantenlänge von 180 Man sieht eine glatte Penetration des Gewebes und eine Verdichtung von Glia vor allem um die meisselförmige Spitze der Elektrode, aber keine signifikanten Veränderungen der Zahl oder Form der Neuroneum Schaft und Spitze. (Trichrom-Färbung [Rosahl et al. 2004]). Theoretisch sind durch penetrierende Elektroden in Kombination mit konventionellen Oberflächenelektroden (s. Abb. 2.11) also signifikante Vorteile bezüglich der Qualität der auditorischen Wahrnehmung zu erwarten. 27 Abb. 2.11 Schematische Darstellung der Komponenten eines ABI mit einer Kombination von Oberflächen- und Tiefenelektroden für die elektrische Stimulation des Nucleus cochlearis zur partiellen Wiederherstellung des Hörvermögens nach beidseitigem Funktionsverlust der Hörnerven (grün: PABI-Träger, blau: Träger für Oberflächenelektroden; modifizert nach [Rauschecker und Shannon 2002]). In praxi haben sich diese Erwartungen in ersten klinischen Fallstudien, die seit 2003 am HEI in Los Angeles mit nach anatomischen Untersuchungen am menschlichen Nucleus cochlearis von Jean Moore [Moore und Osen 1979; Moore 1986] konzipierten kombinierten Elektrodenarrays (anfangs 14 Oberflächen- und 8 Tiefenelektroden, derzeit 11 Oberflächen- und 10 Tiefenelektroden) durchgeführt wurden, bisher offenbar nicht erfüllt [McCreery et al. 2005; Fayad et al. 2006]. Nachdem fünf Neurofibromatose-Patienten mit einem kombinierten PABI der Fa. Cochlear Ltd./Cochlear Corporation versorgt waren (sie konnten jeweils drei verschiedene Sprachprozessoren, einen für die ausschließliche Nutzung der 14 Oberflächenelektroden, einen für die ausschließliche Nutzung der 8 penetrierenden Mikroelektroden und einen für die Kombination beider Elektrodentypen einsetzen), ergaben sich folgende Ergebnisse: 28 Ein Patient (#3) hatte kontralateral bei der Routine-Nachuntersuchung im zweiten Quartal 2005 noch normales Hören, obwohl auf dieser Seite ein Akustikusneurinom mit einem Durchmesser von 2cm gewachsen war. An vier der penetrierenden Elektroden dieses Patienten konnten auditorische Sensationen ausgelöst werden, die maximale Komfortlautstärke (MCL) wurde aber bis zum Ladungslimit von 3nC an keiner dieser Elektroden erreicht. Der Patient nutzte das PABI zu diesem Zeitpunkt nur für kurze Phasen am Tag, zu denen er den Audio-Ausgang des Fernsehers direkt mit dem Sprachprozessor verband und den Ton des Fernsehers ausstellt. Nur drei Patienten empfanden überhaupt nach Stimulation an penetrierenden Elektroden Höreindrücke. Alle drei setzten am meisten den kombinierten Sprachprozessor ein. PABI-Patientin #2 hatte die besten Sprachdiskriminations-Scores, zwischen den anderen 4 Patienten gab es bezüglich der Spracherkennung keine Unterschiede. Patientin #2 konnte Phoneme mit dem kombinierten Prozessor und dem Prozessor für das Oberflächenimplantat gleich gut wahrnehmen, Sätze aber deutlich besser mit dem Kombinationsprozessor diskriminieren (Abb. 2.12). Abb. 2.12 Ergebnisse der Spracherkennung der fünf am House Ear Institute mit einem kombinierten PABI implantierten Patienten. Auf der Abszisse sind die Monate seit Beginn der Tests aufgetragen [McCreery et al. 2005]. Zusammenfassend zeigten alle PABI-Patienten auch ein Jahr nach Implantation ein enttäuschend geringes offenes Satzverständnis (open set sentence recognition) von unter 20%. Eine der Ursachen sahen die kalifornischen Wissenschaftler in dem geringen von der FDA genehmigten Ladungslimit pro Stimulation und Elektrode (3nC). Von den Patienten, die überhaupt über penetrierende Elektroden etwas hören konnten, hörte keiner wirklich ausreichend laute Geräusche bei Stimulation dieser Elektroden, so dass die penetrierenden Elektroden in dieser Form funktionell ohne Bedeutung waren. Die multidisziplinäre Arbeitsgruppe am HEI in Los Angeles, am Huntington Research Institute in Pasadena und an der University of Michigan hat daher bereits 2005 bei der FDA eine weitere klinische 29 Studie mit 10 Patienten zum Einsatz einer zweiten PABI-Generation beantragt. In dem neuen Implantat wurden zwei weitere penetrierende Elektrodenkontakte untergebracht. Dafür reduzierte man die Anzahl der Oberflächenelektroden auf 11. Die Oberfläche der penetrierenden Mikroelektroden sollte vergrößert, das Ladungslimit von 3 auf 8 nC erhöht werden. Die Ergebnisse dieser neuen Untersuchungen sind zum jetzigen Zeitpunkt noch unveröffentlicht. Die vorliegende Studie soll auch dazu beitragen, mögliche Ursachen für die bisher unbefriedigende Situation bezüglich der Qualität der Sprachwahrnehmung mit dem PABI zu finden. An dieser Stelle sei erwähnt, dass inzwischen auch andere Stationen der Hörbahn klinisch mit entsprechend angepassten Elektroden stimuliert werden, um ertaubten Patienten mit zerstörten Hörnerven wieder einen Höreindruck zu vermitteln. Der Colliculus inferior bietet sich dafür durch seine klare Tonotopie und seine nicht durch Tumore (Akustikusneurinome) veränderte Anatomie an [Lenarz et al. 2006a; Lenarz et al. 2006b; Lim et al. 2007; Lenarz et al. 2007; Lim und Anderson 2007]. Die ersten mit Implantaten im Mittelhirn (Lemniscus lateralis, Colliculus inferior) versorgten Patienten gaben gute Hörwahrnehmungen an, zum Teil vergleichbar denen, die mit den besten Oberflächen-ABI erreicht werden. Allerdings werden dabei starke Schwankungen der Lautstärkeadaptation sowie geringere Lautstärkesummationseffekte für höherfrequente Stimulation und stärkere Stromverluste bei Stimuli längerer Phasendauer als bei kochleären Neuronen berichtet [Schwartz et al. 2008; Lim et al. 2008a; Lim et al. 2008b]. 3. Ziele und Fragestellung Die in 2.3.3. skizzierten klinischen Studien zur Implantation von Tiefenelektroden in den Nucleus cochlearis zur Restitution des Hörvermögens bei durch Neurofibromatose gehörlos gewordenen Patienten haben diese Arbeit inspiriert. Es sollte eine möglichst exakte Beschreibung der durchschnittlichen Größe, Tiefe und räumlichen Orientierung des Hörkernkomplexes (NCK) im normalen menschlichen Hirnstamm versucht werden. Darüber hinaus sollte die interindividuelle Variabilität dieser Maße berechnet werden. Schließlich sollten Lagebeziehungen des Nucleus zu Nachbarstrukturen (wie dem Hirnstammeintritt des N. facialis) und zu äußeren Bezugspunkten (Scheitelpunkt des Hirnstamms, Oberfläche des Hirnstamms, Mitte des Hirnstamms) systematisch untersucht werden. Daraus ergaben sich zwei wesentliche Fragekomplexe – mit anatomischer und klinischneuroprothetischer Orientierung: Welche Form, welche Orientierung, welche Ausdehnung, welche Tiefe und welchen Abstand zum Nervus facialis, zur Medianebene und zum seitlichen Scheitelpunkt des Hirnstamms haben die beiden Anteile des Nucleus cochlearis? 30 Welche Dimensionen müsste ein Elektrodenarray aufweisen, welches alle Teile des Nucleus cochlearis direkt kontaktieren soll und welches ist bezüglich der Hirnstammoberfläche und des Austritts des Nervus facialis der am besten geeignete Implantationsort für ein penetrierendes Elektrodenarray? 4. Material und Methoden 4.1. Hirnstämme In dieser Arbeit wurden 20 menschliche Hirnstämme und daran 33 Nuclei cochleares untersucht. Die Hirnstämme wurden im Rahmen von Routine-Obduktionen bei 11 Männern und 9 Frauen entnommen. Dabei vergingen zwischen Eintritt des Todes und Fixierung in 4%iger TRISgepufferter Formalinlösung durchschnittlich 49,6 Stunden. Minimal betrug die Zeit 8 Stunden und maximal 168 Stunden. Bei keinem der in die Untersuchung einbezogenen Patienten wurde eine Schwerhörigkeit angegeben. 25% der Patienten waren auf Grund allgemeiner kardiorespiratorischer Erkrankungen verstorben, 40% kamen durch Linksherzversagen ad exitum, bei 10% war Rechtsherzversagen die pathologisch gesicherte Todesursache, 20% erlagen einem toxischen und 5% einem respiratorischen Kreislaufversagen. Tab. 4.1. Geschlechtsverteilung, Alter, Gehirngewicht und Dauer der Formalinfixierung der verwendeten Präparate Fallnr. Geschlecht Alter Gehirngewicht Zeit in Formalin [Jahre] [g] [Tage] I W 48 1330 42 X M 60 1470 76 XII W 75 1300 142 XIV W 53 1250 144 XVI M 50 1330 85 XVII M 44 1530 76 XX M 60 1400 190 XXI W 83 1400 189 XXIII W 69 1100 239 XXIV W 45 1450 183 XXVI W 64 1260 152 XXXI M 61 1320 164 XXXII M 41 1600 91 XXXIII W 50 1200 135 XXXIV M 83 1330 457 31 XXXV M 37 1450 79 XXXVI M 32 1360 556 XXXVII W 81 1260 574 XXXVIII M 62 1590 572 XXXIX M 52 1320 588 Das durchschnittliche Alter der Verstorbenen lag bei 57,5 (48-83) Jahren (Tab. 4.1). Das Gehirnfrischgewicht lag zwischen 1100g und 1600g (Mittelwert 1362,4). Die histologischen Hirnpräparate zeigten keine pathologischen Veränderungen oder Autolysezeichen. Die durchschnittliche Zeit der Formalinfixierung betrug 236,7 (42 - 588) Tage. 4.2. Histomorphometrie des menschlichen Hirnstamms 4.2.1. Präparate Die ausgewählten Hirnstämme wurden zunächst orthogonal zur Längsachse so in Blöcken zugeschnitten, dass der Komplex des Hörkerns beidseits eingeschlossen war. Als äußere Landmarken dienten die Hirnnerven V und IX/X. Die Präparate wurden danach für mindestens 6 Wochen in 4%iger Formalinlösung belassen, da erst nach diesem Zeitpunkt die Vorgänge der Schwellung und Schrumpfung annähernd konstant sind [Treff und Kraus 1960b; Fischer et al. 1973; Kuroki und Moller 1995]. 4.2.2. Histologische Fixierungen und Färbungen In einer aufsteigenden Alkoholreihe erfolgte anschließend die Entwässerung der Präparate über drei Tage bis zur Einbettung in Paraffin. Mit dem Mikrotom wurden aus den Paraffinblöcken anschließend axiale Schnitte mit einer Schichtdicke von 8µm hergestellt. Jeder zweite Schnitt wurde auf Objektträger aufgezogen, die mit Poly-L-Lysin beschichtet waren. Vor der Färbung lagerten die Schnitte im Trockenschrank. Gefärbt wurde jeder 20. Schnitt, so dass der Abstand zwischen zwei ausgewerteten Schnitten 320µm betrug. War ein gefärbter Schnitt zerrissen oder umgeschlagen, dann wurde der nächste, 16µm weiter kaudal oder rostral gelegene Schnitt nachgefärbt. Die Kolorierung der getrockneten Schnitte erfolgte durch eine Trichromfärbung (Masson). Dazu wurde zunächst mit Xylol für 10min, anschließend mit Xylol und 100% Methylhydroxid (1:1) entparaffiniert. Danach wurden die Schnitte noch einmal mit 90% Methylhydroxid und zweimal mit 70% Methylhydroxid behandelt. 32 Anschließend erfolgte die Anwendung einer Eisen-Hämatoxylin-Färbung nach Weigert. Die erste Stammlösung wurde aus 10g kristallinem Hämatoxil auf 1000ml 96%igem Ethanol hergestellt, um anschließend vier Wochen zu reifen. Die zweite Stammlösung bestand aus 11,6g Eisen-(III)chloridhexahydrat auf 980ml Aqua bidest unter Zugabe von 10 ml 25%iger Salzsäure. Beide Stammlösungen wurden im Verhältnis 1:1 gemischt und filtriert. Mit diesen Lösungen erfolgte das Bläuen der Schnitte in warmem Wasser für zwei Mal 5 Minuten, mit einer Zwischeneinlage in 0,5%iger Essigsäure für eine Minute. Es schloss sich eine Fuchsinfärbung (Stammlösung A, 50ml : 10g Säurefuchsin + 5ml Eisessig + 1000ml Aqua bidest; Stammlösung B, 150 ml: 10g Panceau de Xylidine + 10ml Eisessig + 1000ml Aqua bidest) über einen Zeitraum von 5 Minuten an. Anschließend wurden die Schnitte für zwei Sekunden durch destilliertes Wasser gezogen, danach für 10 Minuten in 1%iger Wolframsäure eingelegt. Nach erneutem kurzem Spülen in 0,5%iger Essigsäure erfolgte eine Anilinblaufärbung (5,5g Anilinblaulösung + 5,5ml Eisessig auf 250ml Aqua bidest) für eine Minute. Nach weiteren 10 Minuten in Essigsäure wurden die Schnitte kurz in Wasser gespült und anschließend in einer aufsteigenden Alkoholreihe endfixiert. Das Eindecken der fertig gefärbten Präparate erfolgte mit Corbit. 4.2.3. Variablen und Messwerte Als natürlicher Bezugspunkt (Landmarke) für die Lagebestimmung und Ausdehnung des Hörkernkomplexes wurde, neben der äußeren Begrenzung (Oberfläche) des Hirnstamms, die Eintrittsstelle des Nervus facialis in den Hirnstamm gewählt. Diese ist für den Chirurgen auch nach Entfernung von Tumoren aus dem Bereich des Hirnstamms meistens abgrenzbar und muss ohnehin dargestellt werden, um Irritationen durch zu implantierende Elekroden zu vermeiden. Zur exakten Einstufung der rostrokaudalen Höhe wurde der rostralste (kranialste) Anschnitt des Eintritts des Nervus facialis (Schicht 0) gewählt. Für die Untersuchungen sicher und vollständig auswertbar waren 17 rechtsseitige und 16 linksseitige Nuclei cochleares. Die Bestimmung der Dimensionen und Distanzen erfolgte unter dem Mikroskop (Leica) bei 2,5facher Vergrößerung mit Hilfe eines Messokulars, welches mit einer Zählkammer nach Neubauer (Kammertiefe 0,1mm) geeicht war. Die kleinste Unterteilung der Skala (Auflösung und Messgenauigkeit) lag bei 4µm. Die Messungen bezogen sich vor allem auf die Tiefe des Kerngebietes unter der Oberfläche des Hirnstamms, die dreidimensionale Ausdehnung der beiden Nuclei cochleares und deren Lage in Bezug auf die Eintrittsstelle des Nervus facialis in den Hirnstamm. Tabelle 4.2 und Abbildung 4.1 geben eine Übersicht über die Variablen, die jeweils für den Nucleus cochlearis ventralis und den Nucleus cochlearis dorsalis sowie für jede Seite getrennt gemessen wurden. Aufgrund der komplexen räumlichen Lage der Nuclei cochleares ist es nicht sinnvoll, die Messungen auf das einfache Koordinatensystem mit den Dimensionen medial, lateral, rostral , kaudal, dorsal und ventral beziehen. Die Messwerte müssen sich vielmehr direkt an der vermessenen Struktur orientieren 33 (Länge x Breite x Höhe). Für den Nucleus cochlearis dorsalis bedeutet „Länge“ die Ausdehnung in mediolateraler Richtung, für den Nucleus cochlearis ventralis aber die Ausdehnung in ventrodorsaler Richtung. Mit „Breite“ wird bei beiden Kerngebieten die Ausdehnung in die Tiefe des Hirnstamms bezeichnet. Die „Höhe“ ist die rostrokaudale Ausdehnung gemeint. Tab. 4.2 Zur Charakterisierung der Nuclei cochleares bestimmte Variablen (s.a. die folgenden Abbildungen) BEZEICHNUNG VARIABLE größte Länge K geringste Tiefe D Tiefe am ventralen Pol G Tiefe im ventralen Drittel i1 Tiefe in der Mitte des Kerns E Tiefe im dorsalen Drittel h1 Tiefe am dorsalen Pol B größte Breite ->gesamter Kern N ->ventrales Drittel I ->im Mittelpunkt des Kerns F ->dorsales Drittel H Abstand von der Mittellinie (Sulcus medianus) des Hirnstamms A auf der Hirnstammoberfläche Abstand des Mittelpunktes zum seitlichen Scheitelpunkt des O Hirnstamms Abstand NCV – NCD M (m_000s) Abstand NCV – Mitte N. facialis P Höhe über rostralstem Anschnitt des Fazialis vvü Gesamthöhe des dorsalen Kerns vd Gesamthöhe des ventralen Kerns vv Gesamthöhe NCV + NCD vg Alle Variablen wurden in jedem gefärbten Schnitt, d.h. in einem Abstand von jeweils 320µm Schicht für Schicht sowohl auf der rechten als auch auf der linken Seite bestimmt und individuell vermessen. 34 N. cochlearis Flocculus NCV k(v) o pci IV. Ventrikel k(d) a Abb. 4.1 Skizzen zur Bestimmung der Variablen aus Tab. 4.2. [a] Transversalschnitt des Hirnstamms in Höhe der Eintrittszone des Nervus vestibulocochlearis (pci…Pedunculus cerebelli inferior, NCV…Nucleus cochlearis ventralis) 35 n e (i, f, h) (d,g, i1,h1,b) h1, b) k m NCD [b] Vergrößerte Darstellung der beiden Teilgebiete des Hörkerns, die sich seitlich dem Pedunculus cerebelli inferior anlegen (NCD…Nucleus cochlearis dorsalis) 36 vvu vv vg vd [c] Koronarer Schnitt durch den Hirnstamm in Höhe der Nuclei cochlearis zur Illustration der vorgenommenen Höhenbestimmungen und Maße aus Tabelle 4.2 4.2.4. Schrumpfungskorrektur Die aufgrund der Fixierung, Dehydratation und Paraffineinbettung eintretende Schrumpfung des Hirnstammgewebes wurde, unter Berücksichtigung der wesentlichen Literaturbefunde [Konigsmark und Murphy 1972; Moore 1987a; Quester und Schroder 1997] mit 12% in transversaler und 17% in longitudinaler Richtung (Umrechnungsfaktoren 1,13 und 1,21; Tab. 4.3) angenommen. Die aus den mikroskopischen Messungen ermittelten, linearen Dimensionen wurden daher mit dem Faktor 1,13 für transversale Messungen und mit dem Faktor 1,21 für longitudinale Maße multipliziert, um die Verhältnisse in vivo zu approximieren und die Ergebnisse mit denen von Quester und Schröder (1997) durch äußere Messungen am menschlichen Hirnstamm gewonnenen vergleichen zu können, obwohl sich in der Literatur für den longitudinalen Faktor auch geringere Werte finden [Konigsmark und Murphy 1972; Schaltenbrand und Wahren 1977; Moore 1987a]. Tab. 4.3 Schrumpfung des Hirnstammgewebes im Bereich der Medulla oblongata (n=33) durch verschiedene histologische Bearbeitungsschritte nach Quester und Schröder (1997)[Quester und Schroder 1997] Formalinfixierung (4%) Dehydratation + transversal longitudinal transversal longitudinal Formalinfixierung + Dehydratation + Paraffineinbettung transversal longitudinal 0 8,3 12 17 13 Paraffineinbettung % 17 37 Für die hier ausgemessenen histologischen Schichten von 288 µm kranial bis 448 µm kaudal des rostralsten Fazialisanschnitts ergeben sich nach Schrumpfungskorrektur (Faktor 1,21) die in Tabelle 4.4 angegebenen Werte. Tab. 4.4 Lage der histologischen Schnitte in Bezug auf den rostralsten Anschnitt des Nervus facialis Ausgangswert (Schnitttiefe) Nach Schrumpfungskorrektur [µm] (x 1,21) [µm] -2880 -3480 -2560 -3100 -2240 -2710 -1920 -2320 -1600 -1940 -1280 -1550 -960 -1160 -640 -770 -320 -390 ±0 ±0 +320 +390 +640 +770 +960 +1160 +1280 +1550 +1600 +1940 +1920 +2320 +2240 +2710 +2560 +3100 +2880 +3480 +3200 +3870 +3520 +4260 +3840 +4650 +4160 +5030 +4480 +5420 4.3. Statistik Die Messergebnisse wurden mit dem Statistikprogramm SPSS PC+ bearbeitet. Die Eingabe und Analyse erfolgten sowohl seitengetrennt als auch kombiniert. Zur Anwendung kamen im Wesentlichen deskriptive Statistiken zur Bestimmung des Mittelwertes, der Varianz, der Standardabweichung und des Standardfehlers. 38 Bezüglich der Messung der Längen- und Breitenausdehnung des Kerngebietes muss man sich darüber im Klaren sein, dass minimale und maximale Ausdehnung in den verschiedenen Ebenen nicht für jedes Kerngebiet an der gleichen Stelle bzw. im gleichen histologischen Schnitt auftreten. Außerdem war nicht damit zu rechnen, dass ein Kerngebiet in allen Dimensionen das kleinste oder das größte sein würde. Um einerseits eine Vorstellung von der Schwankungsbreite der Werte zu vermitteln, andererseits eine gute Einschätzung der mittleren Ausdehnung der Anteile des Kernkomplexes zu erhalten, werden hier drei verschiedene Werte je Seite und Kerngebiet angegeben: a) Mittelwerte für Länge und Breite in dem histologischen Schnitt, in dem der Kern im Mittel am breitesten bzw. am längsten war b) Mittelwerte für Länge und Breite in dem Fall, in dem im Mittel die kleinste Breite und kürzeste Länge des Kerns gemessen wurde c) Mittelwerte für Länge und Breite in dem Fall, in dem im Mittel die kleinste Breite und kürzeste Länge des Kerns gemessen wurde Damit stellt a) eine Mittelwertbildung über alle Fälle in einem histologischen Schnitt dar (listenweise Auswertung), während die Mittelwerte in b) und c) über alle histologischen Schnitte in einem Fall ermittelt wurden (fallweise Auswertung nach Flip-Kommando zum Tausch von Variablen und Fällen in der SPSS-Datenbank). Während a) also einen guten Wert für die mittlere Ausdehnung des Kerngebietes liefert, sind b) und c) als Extremwerte zu betrachten, bei denen Breite und Länge nicht von ein und demselben Kerngebiet stammen müssen. Daher werden die so erhaltenen Extremwerte im Folgenden auch als „virtuell“ kleinste und „virtuell“ größte Ausdehnung bezeichnet, die aber gerade beim Einsatz von Tiefenelektroden entscheidende Anhaltspunkte liefern, weil man sich hier schon aus Sicherheitsgründen auf Extremwerte einstellen muß. Die gemessenen Höhen (rostro-kaudale Ausdehnung der einzelnen Kerngebiete in der Sagittalebene) wurden durch die Anzahl der histologischen Schnitte bestimmt, in denen der jeweilige Kern noch nachweisbar war. Sie beinhalten daher methodisch bedingt einen systematischen Fehler von maximal ±320µm. Ein Seitenvergleich der Mittelwerte wurde zur Prüfung der Signifikanz einer univariaten Varianzanalyse (ANOVA) unterzogen. Für einige Messwertpaare (z.B. Längsdurchmesser verglichen mit Querdurchmesser der Nuclei) wurden Korrelationskoeffizienten nach Pearson und deren Signifikanzniveau bestimmt. Der angewendete Chi-Quadrat-Test bei großer Anzahl der Werte und der Kolmogorov-Smirnov-Test für eine kleine Anzahl von Werten zeigten keine signifikanten Abweichungen der Messwerte von einer Normalverteilung. 39 4.4. Modellierung des Nucleus cochlearis Zur Veranschaulichung der komplexen Form des Kerngebietes wurde nach den Messwerten ein Modell aus Knetmasse hergestellt. Berücksichtigt wurden die Größenverhältnisse der beiden Kerngebiete untereinander, deren Überlappung und die Achsenkrümmungen des gesamten Kernkomplexes. Fotos dieses Modells in verschiedenen Ansichten wurden mit einem Grafikprogramm so bearbeitet, dass die Oberflächen glatt erschienen. Für die Abbildungen in dieser Arbeit wurden diese Ansichten noch zum Teil räumlich rotiert. 5. Ergebnisse Aus den vorliegenden Ergebnissen wird deutlich, dass räumliche Orientierung, Tiefe und Ausdehnung des Komplexes der Hörnervenkerne interindividuell u.a. in Abhängigkeit vom gesamten Hirngewicht beträchtlich variieren, im Seitenvergleich individuell aber eher konstant sind. Außerdem ließ sich erstmals eine Form dieses Hirnnervengebietes abstrahieren, welche für alle ausgemessenen Präparate ähnlich war. 5.1. Abgrenzbarkeit des Kerns und seiner Teilgebiete Die Außengrenzen des gesamten Nucleus-cochlearis-Gebietes, d.h. die Grenzen zu den anliegenden Bahnsystemen, Hirnnerven und Kerngebieten (Nucleus vestibularis, Pedunculus cerebelli inferior, Pedunculus floccularis, Zerebellum, Nervus facialis, Nervus vestibulocochlearis, Corpus pontobulbare, Nervus glossopharyngeus, Tractus rubrospinalis, Tractus Tectospinalis, Tractus bulbothalamicus) ließen sich lichtmikroskopisch gut differenzieren (Abb. 5.1). Die Beziehung zu den äußeren Landmarken und zu am Hirnstamm von außen her sichtbaren Strukturen war nicht immer eindeutig. Abb. 5.1. zeigt in einem repräsentativen Axialschnitt neben den Grenzen des Hörkerngebietes auch die mediale Begrenzung des zuvor markierten „Tuberculum auditivum“, welches als äußere Landmarke zur Vermessung und Lokalisierung des Kerngebietes gilt. Man sieht hier bereits trotz der in diesem Fall relativ guten räumlichen Kongruenz eine Differenz zwischen der Messung anhand äußerer Merkmale und der Messung in histologischen Schnitten (intrinsische Messung). Die intrinsische Messung ergibt in diesem Fall schon am medialen Rand eine um fast 200µm geringere Ausdehnung des NCD. Die sichere Abgrenzung des ventralen vom dorsalen Kerngebiet aufgrund klassisch-histologischer Kriterien ist weniger eindeutig. Sie gelang in der vorliegenden Studie oft nur durch Hinzuziehen zytoarchitektonischer Kriterien unter stärkerer Vergrößerung. So konnten bipolare und trianguläre 40 Zellen im hinteren, länglich ausgezogenen Kerngebiet von ovalären und sphäroiden Zellen im vorderen, kompakteren Teil differenziert werden. Abb. 5.1 Histologische Schnitte auf der Ebene der Eintrittszone des Nervus vestibulocochlearis (links), des Recessus lateralis (Mitte) und des Nervus facialis (rechts). Die Definition der zum Teil überlappenden Grenzzone zwischen dem Nucleus cochlearis ventralis (NCV) und dem Nucleus cochlearis dorsalis (NCD) gelingt oft nur mit Hilfe zytoarchitektonischer Merkmale. Die Markierung mit grüner Tinte bezieht sich auf die makroskopische Begrenzung des sogenannten „Tuberculum auditivum“. ICP … Pedunculus cerebelli inferior, IVth v. … 4. Ventrikel, cb … cerebellum, fp … Pedunculus floccularis, gr.p. … Griseum pontis Dennoch zeigte sich, dass die histologische Abgrenzung zwischen ventralem und dorsalem Kerngebiet nicht immer und nicht in allen Schnitten eindeutig war. Darüber hinaus fiel eine bisher nicht explizit beschriebene Überlappung der beiden Nuclei in der Sagittalebene auf. 5.2. Form und räumliche Orientierung Die Form des Kerngebietes der Nuclei cochleares ist relativ komplex. Sie ähnelt in der Sagittalebene einem deformierten „X“, dreidimensional einem vorn (d.h. am medialen gelegenen Teil des DCN) spitz zulaufenden Stiefel mit kurzem, breitem Schaft. Zur besseren Einordnung und zum leichteren Verständnis der weiteren Ergebnisse ist in Abb. 5.3 ein schematisches 3D-Modell des Kernkomplexes wiedergegeben. Abb. 5.4 zeigt dieses Modell eingepasst in eine schematische Abbildung des menschlichen Hirnstamms. In Abb. 5.5 ist der gesamte Kernkomplex in verschiedenen Ansichten dargestellt. 41 Für die Beschreibung der Form und räumlichen Orientierung betrachten wir zunächst den ventralen und dorsalen Anteil separat. Der Nucleus cochlearis ventralis ist in seinem rostralen Anteil kompakt mit einem stumpfen Ende. Er verändert seine Ausdehnung allmählich von rostral nach kaudal und läuft schmal abgerundet aus. Dabei nähert er sich aus der Tiefe des Hirnstammes kommend der lateralen Hirnstammoberfläche an (Abb. 5.2). mm 88 77 66 55 44 33 22 11 00 - 1160 0 390 1550 3480 µm Abb. 5.2 Tiefe des NCV bezogen auf die laterale Grenze des Hirnstamms in axialen Schichten bezogen auf den rostralsten Anschnitt des Nervus facialis (Schicht 0). Etwa einen Millimeter rostral dieser Schicht liegt der NCV mehr als 7mm tief, während er 3 mm weiter kaudal fast ebenso oberflächlich wie der dorsale Kern nur etwa 0,5 mm von der Oberfläche des Hirnstamms entfernt ist. 42 NCV rostral lateral caudal NCD Abb. 5.3 Schema der räumlichen Anordnung der beiden Anteile des rechtsseitigen Nucleus cochlearis von dorsal gesehen. NCV … Nucleus cochlearis ventralis NCD … Nucleus cochlearis dorsalis Der Nucleus cochlearis dorsalis überlappt den dorsokaudalen Anteil des NCV zum Teil. Er ist graziler, liegt parallel zur Hirnstammoberfläche und ist daher nach außen konvex gekrümmt. 43 Abb. 5.4 Lagebeziehungen des Kerngebietes der Nuclei cochleares (NCV = gelb, NCD = rot) in den Hirnstamm kaudal des Pedunculus cerebelli inferior und rostroventral des Recessus lateralis auf der rechten Seite. Auch hier sieht man die „Einwärtsrotation“ des NCV, welche durch die Zunahme der Tiefe bezogen auf die Hirnstammoberfläche charakterisiert ist (s. Tab. 5.1). 2,32 mm kaudal vom rostralsten Fazialisanschnitt erreichte der dorsale Kern seinen größten Querdurchmesser (Breite) von durchschnittlich 0,68 mm (0,45 – 1,08 mm, SD = 0,20) und auch seine größte Länge von 3,42 mm (0,90-5,42 mm, SD = 1,21). Die größte Breite des VCN fand sich 0,39 mm kaudal des rostralsten Fazialisanschnittes mit 1,53 mm (0,68 – 2,71 mm, SD = 0,64), während die größte Länge 1,94 mm kaudal dieser histologischen Landmarke mit 4,59 mm (3,34 - 6,78 mm, SD = 0,98) gemessen wurde. 44 [a] von ventral [b] von kranial [c] von dorsal [d] von kaudal [e] von lateral [f] von medial Abb. 5.5 Ansichten eines 3D-Modells des Nucleus cochlearis dexter aus verschiedenen Betrachtungswinkeln 5.3. Ausdehnung des Kernkomplexes Im Folgenden werden die in den histologischen Schnitten im Schichtabstand von 320µm gemessenen Längen und Breiten, korrigiert mit den in Kapitel 4.2.4. beschriebenen Schrumpfungsfaktoren gruppiert nach den methodischen Überlegungen in Kapitel 4.2.5. wiedergegeben. Die Werte für die rostrokaudale Ausdehnung (Höhe) wurden durch die Anzahl der Schnitte bestimmt, in welchen 45 Anschnitte der Nuclei noch sichtbar waren (s. Kapitel 4.2.5). Die Gesamthöhen sind wegen der Überlappung der Kernanteile nicht identisch mit den additiven Werten von NCV und NCD. 5.3.1. Mittlere Länge und Breite Für die Betrachtung der Gesamtlänge des Kerngebietes (NCV + NCD) ist es wichtig zu vermerken, dass NCV und NCD natürlich nicht in allen histologischen Schichten direkt aneinander grenzten. Allerdings ist der gemessene Abstand der beiden Kerne in den mittleren, für die Bestimmung der maximalen Länge entscheidenden Schichten zu vernachlässigen gewesen. In den weiter kaudal gelegenen Ebenen driften der dorsale und der ventrale Kern auseinander, so dass der Abstand zwischen beiden u.U. mehr als 5mm betragen kann. Der gesamte Kernkomplex hatte eine mittlere maximale Ausdehnung von 8,15 ± 1,92 x 1,53 ± 0,64 mm (Mittelwert MW + Standardabweichung SD; Länge x Breite oder anteroposteriore x mediolaterale Ausdehnung). Der NCD war im Mittel rechts 2,80 mm lang und 0,67 mm breit und links 4,14 mm lang und 0,68 mm breit. Der NCV war dagegen rechts 4,50 mm lang und 1,48 mm breit und links 4,70 mm lang und 1,57 mm breit. Die Werte für Länge und Breite des dorsalen Kerns wurden in Schicht 192, d.h. nach Schrumpfungskorrektur 2,32 mm unterhalb des kranialsten Fazialisanschnittes bestimmt. Die angegebene mittlere Länge des ventralen Kerns bezieht sich auf Schicht 160, die Breite auf Schicht 32, d.h. die Messung erfolgte hier 1,93 mm bzw. 0,39 mm unterhalb des Fazialis-Bezugspunktes. Tabelle 5.1 zeigt die Mittelwerte von maximaler Länge und Breite (= maximaler Durchmesser) beider Kernanteile zusätzlich im Seitenvergleich. Die Rechts-Links-Unterschiede der Mittelwerte zeigten sich, abgesehen von der Länge des DCN (ANOVA, F=5,525; df=11; p=0,38) statistisch nicht signifikant (p>0.05). Tabelle 5.1 Mittelwerte und Standardabweichung von Länge und Breite der Kernanteile und des gesamten Kerngebietes (Nucleus-Cochlearis-Komplex = NCK) im Seitenvergleich. Weil der NCV der breitere Kernanteil ist, entspricht die Gesamtbreite des NCK der des NCV. NCD NCV NCK Länge Breite anteroposterior mediolateral links 4,14±0,92 0,68±0,16 rechts 2,80±1,12 0,67±0,25 links 4,70±1,31 1,57±0,63 rechts 4,50±0,71 1,48±0,66 links 9,38±1,68 1,57±0,63 rechts 7,27±1,65 1,48±0,66 46 Für den NCD waren die Mittelwerte für Breite und Länge in der gleichen Schicht maximal, nämlich 232 µm kaudal des Fazialisanschnitts. Der NCV war im Mittel weiter kaudal (194 µm kaudal Fazialisanschnitt) länger, aber weiter rostral (39 µm kaudal Fazialisanschnitt) breiter. Abb. 5.6 zeigt die Änderungen der maximalen Durchmesser (Breite) der beiden Kernanteile in rostrokaudaler Richtung. Man erkennt leicht, dass der NCV im Bereich um den rostralsten Fazialisanschnitt und damit im Bereich seiner größten Tiefe (Abb. 5.2, Kapitel 5.2) am breitesten ist und dass die Breite des NCD nur wenig über seine gesamte rostrokaudale Ausdehnung variiert. Außerdem sieht man, wie das ventrale Kerngebiet sich über das dorsale nach rostral ausdehnt. Breite mm 1,75 1,50 1,25 1,00 0,75 0,50 0,25 -1550 - 770 0 770 1550 2320 3100 3870 3650 µm Schichttiefe Abb. 5.6 Änderungen der maximalen Durchmesser (Breite) der beiden Kernanteile in rostrokaudaler Richtung (Mittelwerte ± Standardfehler, gleitende [Spline-]Interpolation) Die interindividuelle Variabilität in den Daten war relativ groß und illustriert sich am besten in den in Kapitel 5.3.3. angegeben Extremwerten, die einen Faktor von 3 zwischen Minima und Maxima ausweisen. 47 5.3.2. Mittlere Höhe Die mittlere Gesamthöhe (rostrokaudale Ausdehnung) des Kerngebietes betrug 3,76±0,89 mm (MW+SD). Die Rechts-Links-Differenzen für das Gesamtkerngebiet und die beiden Anteile (NCV, NCD) sind in Tabelle 5.2 dargestellt. Statistisch relevante Seitendifferenzen ergaben sich aus den vorliegenden Daten nicht. Noch einmal sei auf die kraniokaudale Überlappung der Kerngebiete und die daraus resultierende geringere Gesamthöhe hingewiesen. Tabelle 5.2 Mittelwerte und Standardabweichung der Höhe der Kernanteile und des gesamten Kerngebietes (Nucleus-Cochlearis-Komplex = NCK) im Seitenvergleich Höhe rostrokaudal NCD NCV NCK links 1,59±0,59 rechts 2,21±060 links 3,06±0,81 rechts 3,30±0,60 links 3,48±0,88 rechts 4,05±0,87 5.3.3. Extremwerte bezüglich der dreidimensionalen Ausdehnung Zwischen den Dimensionen des „virtuell“ kleinsten und „virtuell“ größten Kerngebietes (s. Methodik Kapitel 4.2.5.) ergaben sich Größenunterschiede im Bereich des Faktors 2-3. Tabelle 5.3 zeigt die exakten Werte für die ermittelten Extremfälle. Die Höhenangaben beinhalten jeweils pro Fall nur einen Wert (ermittelt aus der Anzahl der Schichten, s. Kapitel 5.2.5.), daher können hier keine Varianzbreiten angegeben werden. Tabelle 5.3 Extremwerte für die Ausdehnung des Nucleus cochlearis (Mittelwerte und Standardabweichungen) a. dorsales Kerngebiet NCD Länge Breite Höhe (ventrodorsal) (mediolateral) (rostrocaudal) kleinster 1,46 ± 1,00 0.29 ± 0,19 0,77 größter 4,24 ± 1,67 0.81 ± 0,19 3,10 48 b. ventrales Kerngebiet NCV Länge Breite Höhe (ventrodorsal) (mediolateral) (rostrocaudal) kleinster 1,92 ± 1,11 0.78 ± 0,31 2,32 größter 5,42 ± 1,75 2.10 ± 0,91 4,26 Breite Höhe (ventrodorsal) (mediolateral) (rostrocaudal) kleinster 3,38 ± 1,05 1,07 ± 0,50 2,32 größter 9,66 ± 3,42 2.91 ± 0,55 7,36 c. gesamter Kernkomplex NCK Länge Minimal wurden für den gesamten Kernkomplex 3,38 x 1,07 x 2,32 mm (ventrodorsal x mediolateral x rostrokaudal), maximal 9,66 x 2,91 x 7,36 mm gemessen. In Tabelle 5.4 sind die Extremwerte für die Kernanteile seitengetrennt angegeben. Tabelle 5.4 Extremwerte für die „virtuell“ kleinsten und größten Kerngebiete im Seitenvergleich a. Virtuell kleinster und größter NCD (Mittelwerte ± Standardabweichungen) NCD links rechts Länge Breite Höhe kds ± SD(Fallnr.) nds ± SD (Fallnr.) vds (Fallnr.) kleinster 2.04 ± 0.37 (12) 0.29 ± 0.19 (26) 0.77 (12) größter 4.24 ± 1.67 (32) 0.78 ± 0.40 (21) 2.32 (24) kleinster 1.46 ± 1.00 (16) 0.41 ± 0.12 (17) 1.55 (14) größter 3.73 ± 1.12 (23) 0.81 ± 0.19 (23) 3.10 (33) b. Virtuell kleinster und größter NCV (Mittelwerte ± Standardabweichungen) NCV links rechts Länge Breite Höhe kvs ± SD(Fallnr.) nvs ± SD (Fallnr.) vvs (Fallnr.) kleinster 1.92 ± 1.11 (26) 0.78 ± 0.31 (21) 2.32 (12) größter 5.42 ± 1.75 (1) 2.10 ± 0.91 (1) 4.26 (16) kleinster 2.88 ± 0.73 (31) 0.95 ± 0.66 (39) 2.71 (14) größter 4.94 ± 1.46 (37) 1.92 ± 0.35 (38) 4.26 (24) Während generell die Seitendifferenzen gering ausgeprägt waren, zeigte sich eine deutliche interindividuelle Variabilität bezüglich der Dimensionen sowohl der ventralen als auch der dorsalen Kerngebiete (s.a. Abb. 5.6). 49 5.4. Lagebeziehungen zu äußeren Bezugspunkten und zum N. facialis 5.4.1. Bezug zur Hirnstammoberfläche Die geringste Tiefe, d.h. den kleinsten Abstand von der seitlichen Oberfläche des Hirnstamms erreichte der ventrale Kern im Mittel etwa 0,3 mm ab der Schnittebene 2710 µm kaudal des rostralsten Fazialisanschnittes. Wie in Abb. 5.1 gezeigt, neigt sich die Achse des ventralen Kerns dann gegen die Hirnstammachse in die Tiefe, so dass die Außenfläche des Kerns 1160 µm kranial des ersten Fazialisanschnittes im Mittel 7,02 (SD±1,63) mm tief liegt. Der NCD ist nicht so stark gegen die Hirnstammoberfläche geneigt gelegen. Seine Außenfläche erreicht 3870 µm kaudal des Fazialisanschnittes 0,2 mm und 370 µm kranial dieser Landmarke 0,94 (SD±1,71) mm Tiefe (Abb. 5.7). 8 mm 77 66 55 44 33 22 11 00 0 390 1550 3480 4650 µm Abb. 5.7 Abstand der Außenfläche des NCD zur Hirnstammoberfläche (mittlere minimale Tiefe ± Standardfehler) Bestimmt man den mittleren minimalen Abstand (minimale Tiefe) jeweils über alle histologischen Schnitte der einzelnen Fälle, dann erhält man die in Tabellen 5.5 gezeigten Extrema für die beiden 50 Kerngebiete. Man sieht wieder, dass der ventrale Kernanteil sehr tief in den Hirnstamm abtaucht, während der dorsale Anteil auch im Extremfall nicht wesentlich tiefer als 2 mm unter der Oberfläche liegt. Tabelle 5.5 Extrema der minimalen Tiefe (Abstand der Außenflächen der Nuclei gegenüber der lateralen Hirnstammoberfläche) im Seitenvergleich a. Minimale Tiefe des Nucleus cochlearis dorsalis NCD Minimale Tiefe MW± SD (Fallnr.) links geringste 0.09 ± 0.03 (24) größte 1.94 ± 2.49 (35) geringste 0.09 ± 0.00 (12) größte 1.35 ± 1.74 (17) rechts a. Minimale Tiefe des Nucleus cochlearis ventralis NCV Minimale Tiefe MW± SD (Fallnr.) links geringste 0.62 ± 0.96 (21) größte 6.85 ± 2.32 (23) geringste 0.97 ± 1.66 (17) größte 6.67 ± 2.08 (38) rechts Von der Hirnstammoberfläche waren beide Kerne stets durch eine feine Schicht myelinisierter Fasern getrennt. 5.4.2. Bezug zum Nervus facialis Mit dem ersten histologischen Anschnitt des Nucleus cochlearis ventralis war nach vorliegenden äußeren Messungen am Hirnstamm [Jacob et al. 1991; Quester und Schroder 1999] auf beiden Seiten schon 1,55 mm über dem rostralsten Anschnitt des Nervus facialis zu rechnen. Deshalb wurden die histologischen Schnitte auch bis zu diesen Grenzen hin analysiert. Durchschnittlich fand sich der erste Anschnitt der ventralen Kernanteile rechts jedoch erst 0,7 mm rostral des Nerven. Der kaudalste Anschnitt war in den meisten Fällen 2,6 mm unter dem ersten Fazialisanschnitt zu finden. Hier zeigte sich wiederum eine große interindividuelle Varianz: der rechte NCV endete z.T. erst 4,1 mm kaudal des ersten Facialisanschnittes. Der linke NCV dehnte sich von durchschnittlich 0,6 mm über dem Nerven bis in die 2,4 mm unter dem ersten Fazialisanschnitt erhaltene Schicht aus. Manche Kerne endeten hier jedoch erst 3,5 mm unter dem ersten Nervenanschnitt. Wie in Kapitel 5.3.2. beschrieben, erreichte der ventrale Kernanteil rechts im Mittel eine größere Höhenausdehnung als links (3,3 mm vs. 3,05 mm; n.s.) 51 Der dorsale Nucleus cochlearis wurde auf Höhe des ersten Facialisanschnittes nur sehr selten angeschnitten. Er begann rechts im Mittel erst 1,07 mm kaudal des ersten Fazialisanschnittes und dehnte sich bis durchschnittlich 3,3 mm kaudal des Fazialisanschnittes aus. Der NCD rechts ließ sich allerdings von 0,79 mm rostral bis 5,65 mm kaudal des N.facialis finden. Damit hatte auch der NCD rechts eine etwas größere Höhenvarianz als links: links begann der NCD im Mittel erst 1,06 mm unter dem Nervenanschnitt und dehnte sich bis in Schichten 2,7 mm unterhalb dieser Landmarke aus. Maximal erreichte er Ausdehnungen von 0,39 mm rostral bis 3,87 mm kaudal des Nervenanschnittes. Der Nucleus cochlearis wölbte sich nach lateral über den Eintritt des Nervus facialis vor. Von dessen Mittellinie war der NC rechts in der Eintrittsebene durchschnittlich 3,04 mm entfernt (Minimum: 1,13 mm; Maximum: 5,42 mm). Auf der linken Seite waren diese Werte wenig höher: Mittelwert 3,97 mm (Minimum: 1,81 mm; Maximum: 5,70 mm). Die Seitendifferenz war statistisch nicht signifikant. Die Pars cochlearis des Nervus vestibulocochlearis trat – soweit in den histologischen Präparaten nachweisbar – regelmäßig in den mittleren Anteil des NCV von ventral her ein. 5.4.3. Bezug zur Mittellinie des Hirnstamms Um eine Orientierung von dorsal zu ermöglichen, wurden die Abstände des dorsalen Pols zur Mittellinie des Hirnstammes auf der Oberfläche ausgemessen (Tab.5.6). Tabelle 5.6 Mittlerer Abstand der medialen Kernoberfläche von der Mittellinie des Hirnstamms a. Nucleus cochlearis ventralis Schnittebene in Bezug auf den rostralsten Fazialisanschnitt [µm] Abstand von der Mittellinie des Hirnstamms [mm] Standardabweichung -1550 15,71 3,36 -1160 14,70 1,69 -770 14,98 1,47 -390 15,14 1,27 ±0 15,27 1,35 +390 14,80 1,64 +770 14,83 1,60 +1160 14,96 1,20 +1550 14,76 1,46 +1940 14,74 2,27 +2320 14,02 1,17 +2710 13,63 1,89 +3100 14,51 1,67 +3480 14,99 0,67 +3870 14,06 0,25 52 b. Nucleus cochlearis dorsalis Schnittebene in Bezug auf den rostralsten Fazialisanschnitt [µm] Abstand von der Mittellinie des Hirnstamms [mm] Standardabweichung -390 8,16 2,27 ±0 10,19 2,09 +390 9,90 1,86 +770 9,25 0,84 +1160 10,82 1,79 +1550 10,97 1,72 +1940 9,69 2,57 +2320 10,30 1,82 +2710 10,10 2,37 +3100 10,93 1,58 +3480 10,57 2,23 +3870 10,68 2,87 +4260 10,24 1,75 +4650 11,13 1,68 +5030 10,70 0,26 In den rostralen Ebenen, in denen der Hirnstamm in den Pedunculus cerebelli inferior übergeht und der Recessus lateralis nicht mehr ausgeformt ist, konnten diese Messungen nicht durchgeführt werden. In der Ebene des Fazialis-Eintritts war der hintere Pol des NCV sowohl rechts als auch links durchschnittlich etwa 15 mm von der Hirnstammmittellinie entfernt. Es zeigte sich eine geringe Schwankungsbreite dieses Wertes über alle Schnittebenen (Tab. 5.6 a.). In verschiedenen Höhen des NCV fielen sie relativ gering aus. Die individuellen Unterschiede waren wiederum nicht unerheblich. So konnten die minimalen Werte zwischen den einzelnen ventralen Nuclei in der gleichen Ebene zwischen 9.72 mm und 17,94 mm schwanken. Der mediale Pol des NCD reichte generell näher an die Mittellinie des Hirnstamms heran. Die mittleren Werte bewegten sich um 10 mm (Tab. 5.6 b.), in einzelnen Schichten konnten minimal 5,42 mm und maximal 16,77 mm gemessen werden. Signifikante Seitendifferenzen zeigten sich nicht. 5.4.4. Abstand des Mittelpunktes der Nuclei zum lateralen Scheitelpunkt des Hirnstamms Die Erhebung dieses Messwertes (s. Abb. 4.1, Tab. 4.2 in Kapitel 4.3.2.) war erst kaudal des ersten Facialisanschnittes möglich, da in den weiter rostral gelegenen Ebenen der Hirnstamm in den Pedunculus cerebelli nach lateral übergeht und damit keine direkte Beziehung zum seitlichen Hirnstamm mehr gegeben war. 53 Bei der Auswertung des Abstandes der Kerne zum lateralen Scheitelpunkt des Hirnstammes zeigte sich eine interindividuelle Varianz der Lage: so lag der Mittelpunkt des NCV in der gleichen Schnittebene in einem Fall 2,31mm dorsal des lateralen Scheitelpunktes, in einem anderen 0,05mm links ventral des lateralen Scheitelpunktes. Generell pendelte der Mittelpunkt des ventralen Kerns aber ziemlich genau um den lateralen Scheitelpunkt es Hirnstamms (Abb. 5.8). Abstand [mm] 4 NCV 2 o pci 0 -2 µm -4 390 1550 2710 3870 Schichttiefe [µm] Abb. 5.8 Abstand des Mittelpunktes des VCN vom lateralen Scheitelpunkt des Hirnstamms (Variable o, Mittelwerte und Standardfehler) Der Mittelpunkt des NCD lag im Durchschnitt 3mm entfernt vom lateralen Scheitelpunkt des Hirnstamms (Tab. 5.7). Die interindividuelle Varianz war auch bei dieser Variable deutlich, allerdings lag der Mittelpunkt des Kerns nie vor dem Scheitelpunkt des Hirnstamms und damit auch regelmäßig dorsal des Mittelpunktes des NCV. 54 Tabelle 5.7 Mittlerer Abstand des Mittelpunktes des NCD vom lateralen Scheitelpunkt des Hirnstamms Schnittebene in Bezug auf den rostralsten Fazialisanschnitt [µm] Abstand des Kernmittelpunktes vom lateralen Scheitelpunkt des Hirnstamms [mm] Standardabweichung +390 3,05 0,23 +770 2,77 0,64 +1160 2,71 1,99 +1550 2,81 1,81 +1940 3,34 0,92 +2320 3,27 1,09 +2710 3,20 1,53 +3100 1,90 1,19 +3480 2,36 1,34 +3870 2,52 0,46 +4260 3,09 1,04 +4650 1,54 0,91 +5030 2,08 0,63 5.5. Korrelationen der Maße untereinander und zu anderen Variablen 5.5.1. Alter Die Gesamthöhe korrelierte signifikant reziprok mit dem Alter (r= -0,54, p<0,05), d.h. je älter der Verstorbene war, desto geringer war die Höhe des Kerngebietes in der Sagittalebene. Weder zu den Höhen des NCV und NCD noch zu Breite und Länge der Kernanteile oder des Gesamtkomplexes ergaben sich weitere signifikante Korrelationen. Auch zwischen Hirngewicht und Alter gab es in dieser Studie keinen signifikanten Zusammenhang. 5.5.2. Geschlecht Außer einer hochsignifikanten Korrelation von Hirngewicht zu Geschlecht (0,60; p<0,01) – das Hirngewicht war bei Frauen in dieser Studie deutlich geringer (Männer 1437 ± 110,4 g; Frauen: 1283 ± 101 g) – ergaben sich keine statistisch signifikanten Zusammenhänge zu weiteren der untersuchten Variablen. 5.5.3. Hirngewicht Zwischen Hirngewicht und Höhe des ventralen Nucleus cochlearis gab es eine schwache positive Korrelation (r = 0,55, P<0,05). Außerdem gab es eine inverse Korrelation von Hirngewicht zu Tiefe des NCV an seiner flachsten Stelle: 2710 µm kaudal des Fazialisanschnittes (r=-0,60, p<0,05), d.h. je niedriger das Hirngewicht desto tiefer lag die Oberfläche des NCV unter der Hirnstammoberfläche. 55 Weitere statistisch signifikante Zusammenhänge mit dem Hirngewicht konnten, abgesehen von der oben erwähnten Geschlechtsspezifität, mit keiner der untersuchten Variablen gefunden werden. 5.5.4. Seitenvergleich Einzig die mittlere maximale Länge des NCD zeigte im Seitenvergleich einen stärkeren Unterschied (links: 4,14 vs. rechts: 2,80; s. Kapitel 5.3.1.). Dadurch zeigte sich für diese Variable auch eine reziproke Korrelation zur Hirnstammseite (r = -0,58, p<0,05). Ansonsten gab es keine signifikanten Korrelationen zu den anderen gemessenen Werten. 5.5.5. Korrelationen zwischen den Messwerten Etliche der schrumpfungskorrigierten Messwerte korrelierten wie erwartet positiv miteinander – auch zwischen den beiden Kernanteilen (Tab. 5.8). Allerdings gab es auch drei inverse Korrelationen, nämlich zwischen der (mittleren maximalen) Breite des NCD und der Gesamthöhe des Nucleus-cochlearis-Komplexes (r=-0,685; p<0,05), zwischen der Länge des NCV und der Höhe des NCD (r=-0,82; p<0,01) und zwischen Höhe des NCD und Gesamtlänge des Kerngebietes (r=-0,79; p<0,01), also immer zwischen Höhenmaßen und Messwerten zur Beschreibung der axialen Ausdehnung. Signifikante Korrelationen zwischen Tiefe in Bezug zur Hirnstammoberfläche und dreidimensionaler Ausdehnung der Kerngebiete fanden sich nicht. Tabelle 5.8 Positive Korrelationen zwischen schrumpfungskorrigierten Werten Variable 1 Variable 2 Pearson-Koeffizient r Signifikanz p von r Länge NCV Gesamtlänge NCK 0,79 0,01 Länge NCD Gesamtlänge NCK 0,84 0,01 Länge NCV Gesamtlänge NCK 0,79 0,01 Höhe NCD Gesamthöhe NCK 0,59 0,05 Höhe VCN Gesamthöhe NCK 0,78 0,01 Höhe NCV Höhe NCD 0,79 0,01 5.6. Maße in Bezug zu derzeit gebräuchlichen Hirnstammimplantaten Die Implantation von Oberflächenelektroden orientiert sich am Recessus lateralis des 4. Hirnventrikels (Abb. 5.9.). Eine Leitschiene zum Aufsuchen des Eingangs des Recessus ist der Nervus glossopharyngeus. 56 Abb. 5.9 Ansicht des rechten NCK von dorsolateral Das Kerngebiet des Nucleus cochlearis so gedreht, dass es in Implantationsrichtung für Oberflächenelektroden für den Recessus lateralis ausgerichtet ist. ® Das derzeit gebräuchlichste ABI, Nucleus 24 der Firma Cochlear Ltd., ist ein Array mit 21 aktiven Elektroden, montiert auf einem Silikonträger mit den Maßen 8 x 3,5 mm. Abb. 5.10 kombiniert ein Schema dieses Elektrodenträgers mit den in den Kapiteln 5.3.1. und 5.3.2. angegeben Messwerten. Länge und Höhe des Trägers entsprechen sehr gut den mittleren Werten für die anteroposteriore (8,15 mm) und die rostrokaudale (3,76 mm; s. Kapitel 5.3.1 und 5.3.2) Ausdehnung. Wenn man die Krümmung der Oberfläche der Medulla oblongata in diesem Bereich vernachlässigt und einmal annimmt, das Implantat würde exakt bis zum medialen Rand des NCK in den Recessus eingeschoben sein und auch kranial mit der oberen Kernbegrenzung abschließen, dann würden Oberflächenelektroden und Kerngebiet sich in einer Aufsicht nahezu vollständig übereinander darstellen. Abbildung 5.10 b berücksichtigt in der Ansicht von kranial die Rotation des NCV um die beiden Längsachse und vor allem die anteroposteriore Querachse des Hirnstamms und zeigt, dass trotz der passenden Größenrelationen das Interfacing der Neuroprothese nicht optimal ist. Schon die (rostrokaudale) Mitte des NCV liegt dadurch in einer mittleren Tiefe von 2 mm und sein rostralster Anteil ist 7 mm von der Oberfläche des Hirnstamms entfernt (s.a. Abb. 5.2, Kapitel 5.2). 57 a b Abb. 5.10 Interfacing des Hörkerngebietes mit Oberflächenelektroden (hier Typ Nucleus 24, Fa. Cochlear Ltd., Sydney, Australien) [a] Ansicht des rechten Kerngebietes von dorsolateral in der intrinischen Längsebene Hier zeigt sich eine scheinbar gute Kontaktierung der Außenfläche des NKC durch die Nucleus 24 Elektrode NKC: 8,15 x 3,76 mm Elektrodenträger: 8,00 x 3,50 mm [b] Ansicht der kranialen Kernanteile von kranial Durch das Abdrehen des NCV (Rotation gleichzeitig über die a.p.-Querachse und die Längsachse der Medualla oblongata) in die Tiefe des Hirnstamms vergrößert sich der Abstand zwischen Elektrode und NCV bis auf im Mittel 7mm im rostralsten Kernanteil. Die Implantation von Patienten mit penetrierenden Elektroden am House Ear Institute erfolgte mit dem Ziel, die kranialen Anteile des NCV zu kontaktieren. In der Literatur gibt es bisher keine genauen Angaben, in welcher anatomischen Region die bisher implantierten Tiefenelektroden des PABI liegen. Auch die exakte Dimensionierung der beiden Generationen des Tiefenarrays wurde bisher nicht veröffentlicht, das Array wird auch noch nicht frei vertrieben. Eine exakte Korrelation zu den hier dargestellten histomorphometrischen Ergebnissen ist daher nicht möglich (zu Details der möglichen Interaktion PABI-NCK s. Kapitel 2.3.3 und Diskussion). 58 6. Diskussion der Ergebnisse Die folgende Diskussion wird sich an den beiden wesentlichen Zielstellungen der Arbeit orientieren und ist daher auch zweiteilig strukturiert. 6.1. Ausdehnung, Form, räumliche Lage und Rotation der Nuclei cochleares Sieht man von den nicht signifikanten Seitendifferenzen einmal ab, dann betrug die Gesamtausdehnung des NCK in der vorliegenden Untersuchung 8,15 x 1,53 x 3,76mm, wobei der NCV mit 4,60 x 1,52 x 3,18 mm gegenüber dem NCD mit 3,74 x 0,67 x 1,9mm den größeren Anteil einnahm. In der Literatur findet sich bisher keine einzige andere Studie, die sich mit der systematischen 3 histomorphometrischen Vermessung der Ausdehnung des vom Volumen her nur etwa 10mm großen Kerngebietes [Konigsmark und Murphy 1972; Seldon und Clark 1991; Mobley et al. 1995; Glendenning und Masterton 1998] des Nucleus cochlearis im menschlichen Hirnstamm beschäftigt. Lediglich Jacob et al. haben 1991 an 7 Nissl-gefärbten Schnittserien ähnliche Messungen wie in die vorliegende Studie durchgeführt und die Größe des ventralen Kerns (Länge x Breite x Höhe) mit 4,5 x 2,4 x 3,8 mm, die des dorsalen Kerns mit 4,5 x 0,7 x 2,8 mm angegeben, allerdings ohne auf Schrumpfung zu korrigieren und ohne ein Streuungsmaße zu erwähnen [Jacob et al. 1991]. Die Tiefe des unteren NCV in Bezug auf die Hirnstammoberfläche beschrieben die Autoren mit 0,3 – 0,6 mm, die des oberen NCV mit 1,4 – 3,2 mm. Die Oberfläche des DCN sei von einer Zellschicht bedeckt gewesen, die als „pontobulbar body“ bezeichnet würde [Moore und Osen 1979], zu den „pontozerebellären Bahnen“ gehöre und etwa 0,5 mm dick gewesen sei. Ausgehend von den Befunden von Terr und Edgerton (1985) [Terr und Edgerton 1985b; Terr und Edgerton 1985c] und McElveen et al. (1987) [McElveen, Jr. et al. 1987], dass NCD und NCV einen Teil der medialen Wand des Recessus lateralis des 4. Ventrikels bilden und v.a. die Rückfläche des Nucleus cochlearis dorsalis fast vollständig im Recessus lateralis liegt (mit Ausnahme eines sehr kleinen, kaudal des Recessus liegenden Anteils), vermaßen die Jacob et al. die im Recessus lateralis zugängliche Fläche des NCK mit 7,5 x 2,5 mm. McElveen et al. schreiben in der Diskussion ihrer histopathologischen Studie über die chirurgische Zugänglichkeit des Nucleus cochlearis, dass in den von Ihnen untersuchten 10 Hirnstämmen 8 x 3 mm der (im Recessus lateralis) freiliegenden Oberfläche des Kernkomplexes ohne Destruktion neuraler oder vaskulärer Strukturen erreicht werden konnten, ohne diese Maßangabe in den Ergebnissen überhaupt zu erwähnen [McElveen, Jr. et al. 1987]. Am House Ear Institute (HEI) Los Angeles haben Terr und Edgerton 1985 versucht, den Kernkomplex des gesamten Nucleus cochlearis zwei- und dreidimensional zu analysieren und mit auf fotografierten histologischen Schnitten basierenden Acrylschichtmodellen zu rekonstruieren [Terr und Edgerton 1985b; Terr und Edgerton 1985c]. Die Autoren fotografierten von einem einzigen Hirnstamm im Bereich des Nucleus cochlearis jede 6. histologische Schicht und vergrößerten die Fotos mit einer Vergrößerung von 8,4, bevor sie diese Fotos auf Acrylplatten mit einer Dicke von 1,4mm übertrugen 59 (28µm x 6 x 8,4 = 1,4 mm). Nachdem man die relevanten anatomischen Strukturen (Hirnstamm, NCK, Nervus vestibulocochlearis) ausgeschnitten hatte, wurden diese Acrylplättchen dann verklebt und dienten als Modell zur Anfertigung von Gussschalen, die mit Polyesterharz gefüllt wurden. Die resultierenden Polyestermodelle hat man poliert und nachträglich die Anhaftungsstelle des unteren Velum medullare angezeichnet (Abb. 6.1). Abb. 6.1 Laterale Ansicht eines 3D-Modells des Hirnstamms in Höhe des Nucleus cochlearis von Terr und Edgerton [Terr und Edgerton 1985b]. Die weisse, mit Pfeilen markierte Linie zeigt die Anheftungsstelle des Velum medullare inferior am Hirnstamm. DCN…Nucleus cochlearis dorsalis, VCN…Nucleus cochlearis ventralis, ol…Oliva Streuungsmasse sind natürlich bei einer solchen Fallstudie nicht zu erhalten, wahrscheinlich haben die Autoren deshalb auch bewusst darauf verzichtet, genaue Maße für die Dimensionen des Nucleus cochlearis anzugeben. Darüber hinaus sind die Grenzen des NCK in der Tiefe des Hirnstamms so nicht darstellbar. Dennoch dürften diese Modelle für die Dimensionierung der Oberflächenimplantate Pate gestanden haben. Auf Anfrage teilte Prof. Michael Waring aus dem House Ear Institute in Los Angeles mit, dass diese Modelle kommerziell nicht erhältlich sind, sonst hätte eine farbige Originalansicht diese Diskussion bereichert. Quester und Schröder [Quester und Schroder 1999]) haben die auf der Oberfläche des Hirnstamms durch den Nucleus cochlearis gebildeten Aufwölbungen, den „Torus“ („nuclear torus“), welcher zu der gesamten Ausdehnung der lateralen Begrenzung des NCK von der medialen Grenze im Recessus lateralis bis zur Wurzeleintrittszone des Nervus cochlearis korrelieren soll, und das so genannte „Tuberculum auditivum“ („auditory tubercle“), einer im Recessus lateralis gelegenen Erhebung über dem lateralen Anteil des Nucleus vestibularis, dem Nucleus cochlearis dorsalis und der Pars 60 cochlearis des Nervus vestibulocochlearis [Martinez et al. 2000; Abe und Rhoton, Jr. 2006], makroskopisch mit einem Messschieber bzw. einer Fadenmethode beidseits vermessen. Insgesamt hatten die Autoren 28 formalin-fixierte Präparate und ein Frischpräparat untersucht. Die Messwerte wurden mit einem Schrumpfungsfaktor von 1,02 für longitudinale Maße korrigiert. Gemessen wurden in dieser Studie unter anderem: 1. Die Distanz von der medialen Grenze des Tuberculum auditivum zum Sulcus medianus des Hirnstamms mit 0,65 cm rechts und 0,69 cm links (jeweils n=12). 2. Die mittlere maximale Länge des Tuberculum auditivum (diagonale Distanz zwischen medialer und lateraler Grenze des Tuberculum) mit 0,6 cm (0,35 – 0,9) rechts (n=17) und 0,62 cm (0,31-0,86) links (n=16). 3. Die rostrokaudale Ausdehnung (Höhe) des Tuberculum auditivum mit 0,21 cm (0,12-0,29) rechts und mit 0,22 cm (0,15-0,3) links (jeweils n=10) 4. Die mittlere Gesamtlänge des „Torus“, d.h. die um die Hirnstammkrümmung mit der Fadenmethode gemessene Distanz zwischen medialer Grenze des Tuberculum auditivum und der Eintrittszone des Hörnerven mit 1,28 cm (rechts: 1,37 cm, links: 1,2 cm). 5. An 6 Präparaten wurde in histologischen Schnitten die Höhe des Foramen Luschkae mit 0,2 bis 0,25 cm vermessen. Die Autoren selbst vermuten aber, dass die Weite des Foramens noch größer sein müsse, da für diese Maße keine Schrumpfungskorrektur vorgenommen wurde. Ein weiteres Ergebnis der Untersuchung, nämlich dass die mediale Grenze des Tuberculum auditivum nur wenig lateral der Mitte zwischen Foramen Luschkae und Sulcus medianus des Hirnstamms liegt, führte zu der wesentlichen Schlussfolgerung der Autoren, dass eine Platzierung von Elektroden für auditorische Hirnstammimplantate besser von medial über den 4. Ventrikels als von lateral über den Recessus lateralis möglich sein müsse, da man hier auf reguläre, nicht durch Tumore alterierte Anatomie träfe. Obwohl diese Untersuchung im Gegensatz zu allen anderen Studien zur Ausdehnung des Hörkerns erstmals die interindividuelle Variabilität des NCK berücksichtigt und Streumaße (Varianz, teilweise Standardabweichung) einführt, gibt es methodisch zumindest drei Kritikpunkte: Erstens entspricht das Tuberculum als Oberflächenerhebung histologisch nicht dem NCD und wahrscheinlich auch nicht dem NCD plus des Anteils des NCV im Recessus lateralis. Zweitens grenzt gerade in den lateralen, der Hirnstammoberfläche nahen Anteilen der NCD nicht direkt an den NCV, so dass an der Oberfläche keine Struktur bestehen kann, die man als seitliche Gesamtausdehnung des NCK zu Messungen heranziehen könnte. Drittens tritt der Nervus cochlearis nicht am ventralen Rand sondern in der Mitte des NCV in diesen ein. Er kann daher nicht die Begrenzung des Kerngebietes nach ventral markieren. Darüber hinaus ist der Hörnerv selbst mehr als 3 mm breit [Lang 1995]. So erklärt sich die Differenz zu den Maßen in der vorliegenden Untersuchung. Die Längendifferenz (8,15mm versus 12,8mm bei Quester und Schröder) ist dabei die augenfälligste Abweichung. Die weiteren, in der Literatur angegebenen Messwerte stammen sämtlich aus histologischen Studien, bei denen weder eine Schrumpfungskorrektur durchgeführt wurde noch eine statistische Auswertung 61 erfolgte. Sehr oft stammen die Maße aus Messungen an einzelnen Hirnstämmen. Bacsik und Strominger ermittelten 1973 für die rostrokaudale Ausdehnung (Höhe) des anteroventralen Nucleus cochlearis 2,3mm [Bacsik und Strominger 1973]. Die Messungen erfolgten an 4 Gefrierschnitten und 2 in Zelloidin eingebetteten Präparaten. Dublin gab diesen Wert für den unteren und oberen Anteil des NCV mit 4 – 4,5mm, für den DCN mit 2,5 – 3mm bei insgesamt neun, teils parasagittal teils transversal geschnittenen Hirnstämmen an [Dublin 1982]. Bei einem Einzelfall bestimmten Mobley et al. diese Höhe mit 3,3mm [Mobley et al. 1995]. Auch Seldon und Clark gaben 1991 die Höhe der beiden Anteile des NCK an, den ventralen mit 3-4,5mm und den dorsalen mit 2-3mm. Die Höhenmasse fielen auch in dieser Studie sozusagen als „Nebenprodukt“ an, weil man durch das Produkt von Anzahl der untersuchten histologischen Schnitte und Schichtdicke leicht darauf Zugriff hatte. Systematische statistische Angaben finden sich aber auch in dieser Untersuchung nicht. In einem „Atlas of the human brainstem“ mit aus einem Einzelfall gewonnenen Daten geben Paxinos und Huang die Ausdehnung des VCN mit 6,0 x 2,3 x 3,0mm (Länge x Breite x Höhe) an [Paxinos und Huang 1995]. Der DCN ist in diesem Atlas mit 4,3 x 0,9mm (ohne Höhenangabe) abgebildet. Die Lage des NCK in diesem Atlas korreliert sehr gut mit der in der vorliegenden Untersuchung gefundenen, abgesehen von der Atlas-Abbildung 27, in der die Autoren einen großen NCD bezeichnen, obwohl an gleicher Stelle in Abbildung 26 noch der „Pontobulbar Nucleus“ beschriftet wird. In einer kernspintomographischen Studie (175 Patienten, bilaterale Darstellung der Kerngebiete) vermaßen Gebarski et al. die Länge des NCK in der Kanthomeatalebene mit 8mm, die Breite mit 3mm. Monsell et al. geben als Längenausdehnung des NCK 7mm an [Monsell et al. 1987]. Klose und Sollmann untersuchten und dissezierten 100 Kleinhirnbrückenwinkel-Präparate unter einem Operationsmikroskop [Klose und Sollmann 2000]. Sie beschrieben die „sichtbare Fläche des Nucleus cochlearis“ am Hirnstamm mit einer Ausdehnung von 11,7 ± 2,7 x 3,1 ± 0,7 mm. Einige weitere Befunde aus dieser Arbeit sind hier bemerkenswert. Die Autoren fanden in 68% der Fälle einen Ast der Vena pontis lateralis vor dem Recessus lateralis. Die Taenia des Plexus choroideus verlegte das Foramen in 92% und musste in 53% durchtrennt werden, um Zugang zum Recessus zu erhalten. Das Foramen Luschkae wird von den Autoren mit einer Weite von 3,5 x 2mm angegeben, also etwa mit ähnlichen Werten wie bei Quester und Schröder (auch hier ohne Schrumpfungskorrektur). Das Foramen selbst sei in 24% der Fälle ohne weiteres offen gewesen, in 53% habe man die Arachnoidea inzidiert, um es zu öffnen. In 18% ließ es sich nur mit „exzessiver Dissektion“ öffnen und in 5% war es gänzlich anatomisch verschlossen. Diese Befunde sind natürlich vor allem im Hinblick auf die Versuche einer Abgrenzung des Nucleus cochlearis über äußere Landmarken aufschlussreich. Eine sehr umfassende Arbeit zur Anatomie des menschlichen Nucleus cochlearis haben Jean Moore und Kirsten Osen beigetragen [Moore und Osen 1979]. Die Autoren untersuchten insgesamt 11 mit unterschiedlichen Fixierungen und in unterschiedliche Einbettungen gefasste NCK-Blöcke. Auch die histologische Schnittführung variierte (teils horizontal, teils frontal, teils sagittal). Dadurch konnten Moore und Osen sehr gute Rückschlüsse auf die räumliche Rotation des Kernkomplexes ziehen. So beschrieben sie einen Winkel von 30-35% zwischen der rostrokaudalen Achse des NCK und der Neuraxis. Das aus ihren Untersuchungen abgeleitete Diagramm des Kernkomplexes mit der 62 Eintrittsstelle des Nervus cochlearis (Abbildung 7 der Originalarbeit, s.a. Abb. 6.2) beschreibt recht gut die äußere Form des NCK und wurde später in mehreren Arbeiten übernommen [Rauschecker und Shannon 2002; Rosahl et al. 2004; Nevison 2006]. Die Abbildung ist dennoch leicht trügerisch (s. Kapitel 6.2 und Abb. 6.3), insbesondere weil sie suggeriert, dass die gesamte laterale Wand des NCV dem Hirnstamm anliegt und damit die Einwärtsrotation der kraniokaudalen Achse des NCK und die daraus resultierende tiefe Lage des oberen NCV in der Medulla oblongata, die schon Leonid Terr beschrieb [Terr und Edgerton 1985c] vernachlässigt. Bezüglich einer systematischen quantitativen Beschreibung der Ausdehnung des NCK ist die Arbeit ebenfalls problematisch: Maße lassen sich nur aus Abbildungen eines einzigen Falles, dem eines 4 ½-jährigen Kindes rekonstruieren. Eine Schrumpfungskorrektur wurde auch hier nicht vorgenommen. In dem besagten Fall hat der VCN eine maximale Ausdehnung von 4,4 x 2,5 x 3,1mm, der DCN misst 4,9 x 1,2 x 2,0mm. Diese Werte korrelieren recht gut mit den Messergebnissen der vorliegenden Studie. Es wurde mehrfach erwähnt, dass in den meisten Arbeiten keine Schrumpfungskorrektur von Messwerten in histologischen Schnitten erfolgte. Dieser methodisch wichtige Aspekt muss hier unbedingt erläutert und diskutiert werden. Wie in Kapitel 4.2.4 erläutert, wurde die präparationsbedingte Schrumpfung des Hirnstammgewebes rechnerisch ausgeglichen, indem die Werte für longitudinale Messungen mit einem Faktor von 1,21 und für transversale Messungen mit einem Faktor von 1,13 multipliziert wurden. Die unter dem Mikroskop bestimmten Messwerte für die Ausdehnung, Tiefe und Variabilität des Nucleus cochlearis wurden an fixierten, paraffinierten und gefärbten Hirnstammpräparaten gewonnen. Damit sind sie einem systematischen Fehler infolge von Schrumpfung- und Schwellungsvorgängen im Gewebe durch die histologische Aufarbeitung unterworfen [Berg 1907; Treff und Kraus 1960a]. Einzelne Teilschritte führen dabei zu unterschiedlichen Veränderungen, die später in den globalen Korrekturfaktor einfließen. Um methodisch bedingte Volumendifferenzen zwischen den einzelnen Präparaten einzuschränken, wurden die verwendeten Präparate zunächst für mindestens 6 Wochen in 4%igem Formaldehyd fixiert. Erst nach drei bis vier Wochen bleiben nämlich Gewicht und Volumen der Gehirne konstant, nachdem zuvor eine Phase der Schwellung (umgekehrt proportional zur Formalinkonzentration) und der Schrumpfung durchlaufen wurden [Lagerlöf und Torgersruud 1934; Treff und Kraus 1960a; Fischer et al. 1973]. Mouritzen Dam berichtete 1979, dass bei Fixierung in 4% phosphat-gepufferter Formalinlösung („Lillie’s fluid“) die initiale, lineare Schwellung und die darauf folgende Schrumpfung im Bereich des cerebralen Cortex in manchen Präparaten sich gegenseitig nahezu vollständig aufheben [Mouritzen Dam 1978]. Die meisten Studien zur Änderung von Gewicht, Volumen und Dimensionen des Gehirns durch die Vorgänge der Fixation, Dehydratation und Paraffineinbettung wurden an Groß- und Kleinhirnpräparaten gewonnen. Neben starken individuellen Differenzen fand man deutliche 63 Unterschiede auch für Volumenveränderungen zwischen grauer (51%) und weißer Substanz (42%) [Kretschmann et al. 1982] sowie für unterschiedliche Hirnregionen (Thalamus: 41%)1. Vergleichbare Untersuchungen am Hirnstamm gibt es wenige. Jean Moore gab 1987 eine Schrumpfung der mediolateralen und dorsoventralen Dimensionen von 12% bei dehydratisierten, paraffineingebetteten und gefärbten transversalen Schnitten im Vergleich zu dem gleichen Gewebe nach reiner Formalinfixierung an. Die Veränderungen in longitudinaler Richtung wurden in dieser Studie offenbar nicht systematisch untersucht. Die Autorin bemerkte dazu, dass die Ergebnisse nicht als exakte Messungen sondern eher als annähernd korrekte Schätzungen verstanden werden sollten [Moore 1987b]. Quester und Schröder (1997) argumentieren in diesem Punkt ähnlich, indem sie auf die große individuelle und topographische Variabilität solcher Messungen hinweisen [Quester und Schroder 1997]. Die am Hirnstamm aufgrund der 4%igen Formalinfixierung eintretende Änderung der linearen Dimensionen ist nach ihren Befunden nach mehr als 4 Wochen in den transversalen Messungen (Breite der Olive) vernachlässigbar klein. Für longitudinale Maße im Bereich des Hirnstamms ergab sich eher eine Schrumpfung, die in den zitierten Befunden an 14 Hirnstämmen 8,3% betrug. Auch der histologische Bearbeitungsvorgang des Hirnstamms insgesamt (Formalinfixierung + Dehydratation + Einbettung) führte offenbar in den Untersuchungen dieser Autoren zu einer deutlicheren Schrumpfung in longitudinaler Richtung (17%, Korrekturfaktor 1,21; n=3) als in transversaler (13%, Korrekturfaktor 1,15; n=9). Wegen der großen interindividuellen Variabilität insbesondere bei den Längenmessungen in kraniokaudaler Richtung, die auf die Hauptfaserorientierung im Hirnstamm zurückgeführt wurden, konnten die Autoren eine statistische Signifikanz dieser Unterschiede jedoch nicht sichern. In dieser Untersuchung ergab sich auch keine Korrelation des Ausmaßes der Schrumpfung zu Alter, Hirngewicht sowie dem zeitlichen Abstand zwischen Tod und Autopsie. Konigsmark und Murphy (1972) fanden dagegen in einer größeren Studie (n=143) nach Paraffineinbettung eine stärkere lineare Schrumpfung des Hirnstamms im Bereich des Nucleus cochlearis in der Alterskohorte von 0-20 Jahren [Konigsmark und Murphy 1972]. Etwas über dem Durchschnitt lagen die Werte auch ab einem Alter von 65 Jahren. Zwischen diesen beiden Gruppen wurden fast durchgängig Korrekturfaktoren um 1,12 bestimmt, was einer linearen Schrumpfung von etwa 12% entsprach. Zu einem ähnlichen Ergebnis kamen Schaltenbrand und Wahren, die für den Hirnstamms nach Paraffineinbettung etwa 10-15%, im Mittel aber 12% (n=111) Schrumpfung fanden (Großhirnhemisphäre circa 30%) [Schaltenbrand und Wahren 1977]. Aus diesen Angaben wurden die für die vorliegende Untersuchung als optimal anzunehmende Korrekturfaktoren ausgewählt. Ein weiterer Diskussionspunkt bei der exakten Bestimmung linearer Maße in histologischen Schnitten sind Distanzverkürzungen durch den Schneidevorgang. Diese treten offenbar bei Schichtstärken unter 1 Anm.: Eine 50%igen Volumenschrumpfung übersetzt sich in eine etwa 20%ige Verringerung in den linearer Längen- und Distanzmessungen. Umgekehrt entspricht eine Verkürzung der linearen Dimensionen um 12% einer Volumenreduktion von 33%.(Moore, 1987) 64 10µm nicht mehr auf [Quester und Schroder 1997], so dass bei den hier angefertigten 8µmPräparaten diese mögliche Fehlerquelle vernachlässigt werden kann. Zusammenfassend unterscheidet sich die vorliegende Untersuchung mit ihrem quantitativ histomorphometrischem Ansatz methodisch grundlegend von den bisher in der Literatur verfügbaren Studien, bei denen entweder die chirurgische Zugänglichkeit des NCK (meist ohne histologische Schnitte anhand äußerer Landmarken), Untersuchungen zur Zytoarchitektur und funktionellen Organisation des NCK oder ontogenetische und degenerative Aspekte im Vordergrund standen. Im Gegensatz zu anatomischen Atlanten und anderen Untersuchungen an Einzelfällen erfolgten hier eine Mittelwertbildung und die Abschätzung der Variabilität der Messwerte durch Streuungsmaße. Zudem wurde Veränderungen berücksichtigt, so des dass Gewebes eine durch annähernd Schrumpfungsvorgänge realistische Abschätzung bei der der Präparation Ausdehnung des Hörkerngebietes resultiert. Eines der wesentlichen Ergebnisse dieser Arbeit ist die Beschreibung der Tiefenausdehnung des ventralen Kernanteils (Kapitel 5.2). Die Tatsache, dass die Oberfläche des VCN teilweise erst in einer Tiefe von bis zu 7mm unter der Hirnstammoberfläche zu erreichen ist, war so bisher nicht bekannt. Zwar wusste man, dass Anteile des Kerngebietes in der Tiefe des Hirnstamms gelegen sind, quantitative Angaben existierten aber nicht. Es wird dadurch jetzt klarer, dass das Kerngebiet nicht nur eine komplexe Form (spitz zulaufender Stiefel mit kurzem, breiten Schaft, s. Kapitel 5.2) sondern auch eine komplexe räumliche Abweichung seiner Hauptachsen zu den Achsen des Hirnstamms aufweist. So zeigte sich eine Rotation nicht nur der Längsachse zur Neuraxis (ca. 30-36°, [Moore und Osen 1979]), sondern auch der rostrokaudalen Achse vor allem des NCV zur Sagittalebene. Ausgerechnet an einer Stelle, wo die Oberfläche des VCN schon 3mm in der Tiefe liegt, ist dieser Kernanteil am breitesten. Diese Stelle liegt nur 0,4 mm kaudal der Eintrittszone des Nervus facialis in den Hirnstamm. Aus diesen Fakten ergeben sich Konsequenzen für die Erreichbarkeit mit Tiefenelektroden, die unter 6.2. noch diskutiert werden. Die Höhe des NCK, d.h. die Ausdehnung des Kerngebietes in der Sagittalebene nahm in der vorliegenden Untersuchung mit zunehmendem Alter ab. Das könnte ein Hinweis auf Zusammenhänge im Sinne des in der Literatur beschriebenen Degenerationsmusters mit Volumenreduktion bei gleichbleibender Zellzahl sein [Shepherd und Hardie 2001]. Allerdings ergab sich keine Korrelation zwischen Alter und Höhenmaßen für die beiden Kernanteile. Außerdem standen Hirngewicht und Alter hier in keinem eindeutigen Zusammenhang und es fand sich sogar eine schwach positive Korrelation der Höhe des NCV zum Hirngewicht. Im Seitenvergleich zeigte sich, dass der NCD links deutlich länger war als rechts. Da sich sonst keine weiteren Seitendifferenzen ergaben, soll man diesem Befund keine größere funktionelle Bedeutung beimessen, zumal Seldon und Clark im Gegenteil ein größeres Volumen – korreliert zu größeren Zellsomata - zumindest für den NCV auf der rechten Seite fanden. Der Längenunterschiede war auch statistisch nicht so stark, dass er für einen Korrelationskoeffizienten über 0,6 gesorgt hätte. Hier können nur entsprechend gezielte Untersuchungen weiterhelfen. 65 Eine interessante Frage ist, ob der relativ starke, reziproke Zusammenhang zwischen Höhe des NCD und Länge des NCK bzw. NCV auf eine clusterförmige Variabilität der Form des Kernkomplexes hindeutet. Die Literatur gibt hierzu keine Hinweise. 6.2. Relevanz der Anatomie des Nucleus cochlearis für auditorische Neuroprothesen Der Nucleus cochlearis ist aufgrund seiner Lokalisation im Bereich des Hirnstamms eine geeignete Zielstruktur für die elektrische Stimulation zur partiellen Wiederherstellung der Hörfunktion nach vollständigem Funktionsverlust beider Hörnerven [Hitselberger et al. 1984; McElveen, Jr. et al. 1987; Terr et al. 1989; Terr et al. 1990; Brackmann et al. 1993; Abe und Rhoton, Jr. 2006]. In einer aktuellen anatomischen Studie, die mit einem Operationsmikroskop durchgeführt wurde, schrieben Abe et al. noch einmal, dass der an der Rückfläche des Pedunculus cerebellaris inferior gelegene Nucleus cochlearis dorsalis am Boden des Recessus lateralis das Tuberculum auditivum bildet und als solches bei der Platzierung einer ABI-Elektrode sichtbar ist [Abe und Rhoton, Jr. 2006]. Unter 6.1. wurde bereits dargelegt, dass der NCD sehr wahrscheinlich nur einen Teil des Tuberculum auditivum, nämlich den lateralen Anteil, bildet. Daher ist diese „Landmarke“ auch bei intakter Anatomie im Recessus lateralis nicht gleichzusetzen mit einer genauen Zielmarkierung für eine Oberflächenelektrode. Problematisch für die Ausnutzung der oberflächlichen Struktur wirkt sich auch aus, dass diese nicht immer ausgebildet ist [Quester und Schroder 1999] und zudem die Oberfläche des Hirnstamms auch durch einen großen Tumor verändert sein kann. Wir haben daher in der vorliegenden Studie einige Messungen in Bezug auf den Eintritt des Nervus fazialis vorgenommen, da dieser in vielen Fällen auch bei Neurofibromatose-Patienten noch gut sichtbar ist. Dass Tuberculum auditivum und NCD nicht gleichzusetzen sind, zeigt schon die Differenz der Abstände zwischen den medialen Grenzen der beiden Strukturen zum Sulcus medianus. Für das Tuberculum auditivum geben Quester und Schröder hier 6,5 mm rechts und 6,9 mm links an [Quester und Schroder 1999]. Die vorliegende Studie fand aber für den NCD einen mittleren Abstand von etwa 10 mm, also 3-4 mm mehr (Tab 5.6 Kapitel 5.4.3.). Da medial des NCD der Nucleus vestibularis gelegen ist, ist dieses Kerngebiet sehr wahrscheinlich an der Bildung des Tuberculum auditivum beteilgt. Außerdem beteiligen sich daran myelinisierte Fasern pontozerebellärer Bahnen [Moore und Osen 1979; Terr und Edgerton 1985b; Terr und Edgerton 1985c] und das Ependym des vierten Ventrikels. Der von Quester und Schröder ausgemessene Wulst des Tuberculum auditivum ist also länger und weiter medial gelegen als der DCN. Damit liegt der NCD auch nicht, wie von Quester und Schröder vermutet, in der Mitte der Distanz zwischen Sulcus medianus und lateraler Hirnstammoberfläche, sondern deutlich weiter lateral. Der von den Autoren vorgeschlagene Zugang zum NCD von medial zur ABI-Elektrodenplatzierung relativiert sich daher, zumal diese Untersuchung gezeigt hat, dass der Mittelpunkt des NCD nur 3mm dorsomedial des lateralen Scheitelpunktes des Hirnstamms gelegen ist. Die Mitte des NCV liegt sogar genau auf Höhe dieses lateralen Scheitelpunktes. Damit bietet sich auch aus anatomischen Gründen weiterhin der auch bisher bevorzugte laterale Zugang über den Kleinhirnbrückenwinkel an. 66 Abe et al. bemerken außerdem korrekt, dass der NCV oft bis an den Vorderrand des Foramen Luschkae heranreicht und am Hirnstamm eine wesentlich geringere Erhebung erzeugt. Betrachtet man die Daten der vorliegenden Studie, dann wird klar, dass diese Erhebung allenfalls durch den dorsalen Anteil des NCV bedingt sein kann, weil das Kerngebiet weiter ventral viel zu tief gelegen ist, um noch ein Oberflächenrelief zu bilden. Es erscheint allerdings sehr fraglich, ob man an der Oberfläche überhaupt eine Grenze zwischen DCN und VCN feststellen kann. Viel eher ist hier mit einem fließenden Übergang zu rechnen, der selbst in histologischen Schnitten nicht immer einfach abzugrenzen ist. Die bisher bei Patienten eingesetzten Oberflächen-Elektroden erreichen den Nucleus cochlearis an seinem kaudalen Rand im Recessus lateralis. Direkt stimuliert werden damit nach den vorliegenden anatomischen Daten dieser Studie und nach den wesentlichen Litraturbefunden v.a. der Nucleus cochlearis dorsalis und der untere Teil des Nucleus cochlearis ventralis (s.a. Abb. 6.3), deren dorsale und laterale Begrenzungen nahezu vollständig in der ventralen und lateralen Wand des Recessus lateralis des 4. Ventrikels liegen [Terr und Edgerton 1985a; Terr und Edgerton 1985b; McElveen, Jr. et al. 1987]. Damit werden etwa ein bis zwei Drittel der auf den Hirnstamm projizierten lateralen Fläche des gesamten Kernkomplexes von den derzeit gebräuchlichen Elektroden überlappt [Terr und Edgerton 1985b; McElveen, Jr. et al. 1987; Rosahl et al. 1998; Quester und Schroder 1999]. Nur für diese Anteile des Kerngebietes sind Oberflächenelektroden auch sinnvoll, da z.B. der im Mittel nur 0,8mm dünne Kernanteil hier sehr gleichmäßig flach (etwa 0,5mm) unter der Hirnstammoberfläche liegt. Lediglich die kapazitären Eigenschaften der Pia erweisen sich hier als Hindernis für eine punktuelle, präzise Stimulation [Ranck, Jr. 1975]. Die primären auditorischen Afferenzen im tiefer gelegenen Nucleus cochlearis ventralis lassen sich durch Elektrodenkontakte im Recessus lateralis nicht errreichen [Moore 1986; McCreery et al. 1998; Rauschecker und Shannon 2002]. Während für Oberflächenelektroden z.B. mit dem Nervus glossopharyngeus und dem Recessus lateralis klare Leitstrukturen etabliert sind, fehlen diese für penetrierende Elektroden. In Kapitel 2.3.3. wurde bereits dargestellt, warum man überhaupt penetrierende ABI (PABI) in Betracht gezogen hat und welche Vorteile man durch direkten Zugriff auf die Tonotopie v.a. des VCN erwartet. Hier soll daher nur noch der Bezug zwischen den Daten der vorliegenden Untersuchung und der Tonotopie der ersten Schaltstation der Hörbahn hergestellt werden. Mit Oberflächenelektroden ist zwar ebenfalls durch Variation der Stärke, Dauer und Lokalisation der Stimulation und damit des elektrischen Feldes eine eingeschränkte tonhöhenspezifische (tonotope) Reizung des NCK möglich [Laszig 1997]. Man hat auch an der Oberfläche des Hirnstamms so eine Tonotopie-Kartierung bei Patienten mit mehrkanaligen auditorischen Hirnstammimplantaten durch ein so genanntes „pitch ranking“ durchgeführt [Laszig et al. 1995a; Sollmann et al. 1998; Marangos et al. 2000]. Niedrige Frequenzen wurden dabei medial (tiefer im Recessus lateralis) und kaudal, höhere Frequenzen lateral und kranial abgebildet [Marangos et al. 2000]. Da die lateralen Elektroden die 67 Grenze zwischen dorsalem und ventralem Nucleus überschreiten und Elektrodenlage sowie Reizparameter individuell variierten, bleibt eine reale Oberflächentonotopie aber fraglich. In jedem Fall ist nicht erst seit dieser Untersuchung klar, dass der überwiegende Teil des Nucleus cochlearis ventralis von Oberflächenelektroden aufgrund seiner Lage gar nicht erreicht werden kann ([Terr und Edgerton 1985c], s. auch Kapitel 2.1.2.). Für ein Sprachverständnis von der Qualität eines CI ist die mit Oberflächenelektroden im Recessus lateralis erreichbare Frequenzspezifität nicht ausreichend. Der Zugriff auf die Tiefentonotopie des ventralen Kerngebietes mit Insertionselektroden (s. Abb 6.2 und Kapitel 2.2.2.) wird als valide Alternative betrachtet [Liu et al. 1997; McCreery et al. 1998; Rauschecker und Shannon 2002; Fayad et al. 2006], wirft aber gleichzeitig im Zusammenhang mit den jetzt erhobenen Messdaten eine Reihe von Fragen auf. Abb. 6.2 Schematische Darstellung der Tonhöhenrepresentation (Tonotopie) im Nucleus cochlearis. Oberflächenelektroden (rechts) können Tonhöhenunterschiede nur durch die variable Ausprägung des elektrischen Feldes erzeugen. Mit Insertionselektroden (INSEL, links) können Regionen innerhalb des Nucleus cochlearis, die unterschiedliche Frequenzen repräsentieren, direkt stimuliert werden. (modifiziert mit Genehmigung nach Rauschecker & Shannon, 2002 [Rauschecker und Shannon 2002]) Diese beziehen sich vor allem auf: - die Tiefe der kranialen Anteile des VCN, - den schmalen Durchmesser und die sehr oberflächliche Lage des DCN, - den Verlauf des Nervus fazialis in Bezug auf den NCV, - die Variabilität der Ausdehnung und Lage des NCK, auch in Bezug zu Nachbarstrukturen. Literaturbefunde zu quantitativen Messungen der Tiefe des Nucleus cochlearis ventralis im Hirnstamm finden sich ausschließlich in der schon zitierten Studie von Jacob et al. (1991), die das obere ventrale Kerngebiet in einer Tiefe von 1,4-3,2 mm und das untere ventrale Kerngebiet in 0,3-0,6 mm lokalisierten. Korrigiert man diese Daten nachträglich mit dem Schrumpfungsfaktor 1,12, dann ergibt 68 sich von kranial nach kaudal eine von 3,58mm auf 0,34mm abnehmende Tiefe und damit ein deutlich geringerer Gradient als in der vorliegenden Studie (7,02mm auf 0,28mm). Die Ursachen dürften, abgesehen von der Variabilität des NCK (Streumaße wie Standardabweichung oder Standardfehler wurden von Jacob et al. nicht angegeben) vor allem auf methodischem Gebiet zu suchen sein. So hat die vorliegende Studie systematisch alle histologischen Schichten einbezogen, auf denen Anschnitte des NCV sichtbar waren. Durch das „Abdrehen“ des NCV, eine Rotation gleichzeitig über die a.p.Querachse und die Längsachse der Medualla oblongata in die Tiefe des Hirnstamms vergrößert sich der Abstand zwischen Elektrode und NCV bis auf im Mittel 7mm im rostralsten Kernanteil. Das dürfte auch für Tiefenelektroden problematisch sein. Zum einen müssten diese sehr lang sein, um diesen Kernanteil noch direkt stimulieren zu können. Zum anderen muss die Trajektorie zwischen Eintrittspunkt und Zielpunkt exakt stimmen, weil mit zunehmender Tiefe auch bei geringer Winkelabweichung ein Zielfehler von mehreren Millimetern möglich ist. Der NCD und der kaudale Anteil des NCV andererseits liegen sehr flach unter der Oberfläche und haben in diesem Bereich einen Durchmesser von etwa einem halben Millimeter. Penetrierende Elektroden für diesen Anteil könnten allenfalls als „Spikes“ geformt sein, um den Übergangswiderstand durch die kapazitiven Schichten des Ependyms zu verringern. Längere Elektroden sind in dieser Region wenig sinnvoll, weil sie den NCD und Teile des NCV durchstoßen würden und damit ein Trauma herbeiführen ohne einen Gewinn bezüglich der Tonotopie zu bringen. Dem hat man auch bei den klinischen PABI-Untersuchungen in Los Angeles Rechnung getragen, indem man die penetrierenden Elektroden immer mit Oberflächenelektroden kombiniert. ABI-Oberflächenelektroden stimulieren den Nucleus cochlearis (überwiegend den dorsalen Kernteil und kaudale Anteile des NCV) an seinem Unterrand im Recessus lateralis des IV. Ventrikels. Das ist knapp oberhalb der Eintrittszone des Glossopharyngeus (CN9), der nach Lang (1995)[Lang 1995] im Mittel 4,5mm (2,5-6,5mm), nach Klose und Sollmann (2000)[Klose und Sollmann 1998] 5,5mm (48mm) kaudal des N. fazialis liegt. Eine Insertionselektrode für den Nucleus cochlearis ventralis muss daher kranial des Recessus an der Seite – etwa im Scheitelpunkt der lateralen Oberfläche - des Hirnstamms penetrieren (s. a. Kapitel 7.). Sie dürfte aber nicht in Höhe der Eintrittsstelle des N. fazialis ansetzen, um diesen Nerven nicht zu gefährden, obwohl darunter auch noch Anteile des NCV zu finden sind. Die Verlaufsrichtung der PABI-Elektroden muss daher schräg von kaudal nach rostral gewählt sein Warum sind nun die mit dem PABI bisher publizierten Ergebnisse nicht signifikant besser als die mit Oberflächenelektroden erreichten (Kapitel 2.3.3.)? Wahrscheinlich gibt es dafür viele Gründe (s. Kapitel 1.). Hier sollen nur Erklärungsmöglichkeiten aufgezeigt werden, die sich aus den Daten der vorliegenden Studie ergeben. Der Nucleus cochlearis ist kein interindividuell konstantes Gebilde, sondern seine Form, Ausdehnung und Lage variieren. Die Dimensionen für den kleinsten NCK waren 3,4 x 1,1 x 2,3 mm, der (virtuell, s. 5.3.3.) größte rangierte bei 9,7 x 2,9 x 7,4 mm. Das sind Größenunterschiede, die im Bereich der Faktoren 2-3 liegen – ein erhebliches Problem für die Dimensionierung von Elektroden. Eine ähnliche anatomische Variabilität wurde aber auch schon für Oberflächenstrukturen („Landmarks“) in dieser 69 Region dokumentiert [Quester und Schroder 1997]. Die Aufgabe, ein optimal angepasstes Elektrodendesign zu entwerfen, wird dadurch nicht vereinfacht. Intelligent wäre eine individuelle Anpassung, aber dazu müsste eine genaue kernspintomographische Vermessung des Kerngebietes möglich sein. Gebarski et al. haben zwar bereits 1993 behauptet, dass sich der NCK verlässlich mittel MRT abgrenzen liesse, aber trotz der weiteren Verbesserung der Kernspintechnologie wurde diese Aussage bisher nicht bestätigt. Weitere systematische Untersuchungen sind daher auf diesem Gebiet gefragt. Zwei weitere Ursachen für die bisher nicht signifikant bessere Qualität der Sprachperzeption mit dem PABI gegenüber dem Oberflächen-ABI könnten in einer abweichenden Antizipation von Form und Lage bei der Entwicklung des Elektrodendesigns liegen. Wie bereits erwähnt, wurden die bisherigen Modelle des Nucleus cochlearis aufgrund von Fallstudien erstellt [Dublin 1982; Terr und Edgerton 1985b; Terr und Edgerton 1985c]. Ebenso gab es keine systematischen Studien zur räumlichen Orientierung des NCK außer fallweisen Beobachtungen [Moore und Osen 1979]. Das hat dazu geführt, dass man bisher annahm, der NCK wäre ein relativ kompaktes Gebilde, welches zumindest in allen Anteilen dicht unter der Oberfläche des Hirnstamms beginnen würde. Man dachte, dass der rostrale Anteil des NCV (AVCN, s. Abb. 6.3) lediglich deshalb soweit in die Tiefe des Hirnstamms reichte, weil der kaudale Anteil zwischen jenem und der Hirnstammoberfläche lag. Eine penetrierende Elektrode würde in einem solchen Modell in jedem Fall auf Anteile des ventralen Nucleus treffen. Die Abbildung 6.3. illustriert diese Situation. Die komplexe „Stiefel“-Form des Nucleus cochlearis ist auch in anderen Studien (wie hier bei Nevison [Nevison 2006] schon sehr gut anerkannt worden. Nevison überschätzte aber die Breite des Kerngebietes im Vergleich zu den Dimensionen des Elektrodenträgers und deutete die deutliche Einwärtsrotation des NCV gegen die Medianebene des Hirnstamms nur durch Pfeile an. Der Eintritt des Nervus cochlearis in den NCV ist in seiner Arbeit korrekt in der Mitte des Kernanteils wiedergegeben. Insbesondere bei Katzen markiert diese Eintrittsstelle auch die Trennung von anteroventralem und posteroventralem Kerngebiet. Beim Menschen ist die Unterteilung zytoarchitektonisch weniger auffällig (s. Kapitel 2.1.1.). Streckt man das Modell von Nevinsons auf die jetzt ermittelten Dimensionen, dann sieht man, wie gut die Form dieses Modells mit den Ergebnissen dieser Studie harmoniert (Abb. 6.3B). Der räumliche Abstand zwischen NCV und Hirnstammoberfläche ist jedoch im Mittel bedeutend größer als in Nevinsons Zeichnung (Abb. 6.3C), so dass eine penetrierende Elektrode, die kürzer als 7mm ist, den rostralsten Anteil des NCV gar nicht erreichen kann, selbst wenn die Penetrationsrichtung exakt ist. VCN und DCN liegen außerdem, bedingt durch die Krümmung und Form des Kern-Komplexes, nicht in jeder Tiefe (nicht in jeder histologischen Schicht) morphologisch aneinander an. 70 A B aus Nevison, B.: A guide to the positioning of brainstem implants using intraoperative electrical auditory brainstem responses, Adv.Otorhinolaryngol. 64 (2006): 154-166 C VCN DCN Abb. 6.3 Vergleich der bisher angenommenen und der realen anatomischen Verhältnisse im Bereich des Nucleus cochlearis zu Oberflächen-ABI-Elektroden (s.a. Abb. 5.5 & 5.10) A Originale Abbildung aus [Nevison 2006] B Dehnung und Stauchung der originalen Abbildung aus A, so dass die Länge des Elektrodenträgers mit dem in C skizzierten übereinstimmt und gleichzeitig die Breite der Kerngebiete anhand der Daten der vorliegenden Studie korrigiert wird. C Schematische Respräsentation des Elektrodenträgers im Vergleich zu der durch die vorliegende Studie ermittelten Ausdehnung und räumlichen Orientierung der kranialen Hälfte des Kerngebietes. Eine „Freihand“-Implantation des PABI - mit oder ohne Platzierungshilfe – bleibt aus Sicht dieser Untersuchung also problematisch. Oberflächenstrukturen sind schon bei normaler, nicht durch Tumoren veränderter Anatomie ohne Formalinfixierung schwer zu identifizieren. Dazu kommen tumorbedingte anatomische Veränderungen, unter Umständen sogar tumorbedingte Zerstörungen am Nucleus cochlearis. Pessimistisch betrachtet bliebe daher für das PABI als einziger Vorteil die Verringerung der Reizschwelle durch das Durchbrechen der kapazitiven Schicht über dem NCK, wenn eine individuell exakte Platzierung an den Zielstrukturen nicht doch möglich wird. Ob Midbrain-Implantate als Alternative (s. Kapitel 2.3.3) die Sprachperzeption verbessern werden, wird die Zukunft zeigen. Je weiter zentral sich ein Neuron in der Hörbahn befindet, desto komplexere Schallmuster muss man verwenden, um die Neurone aktivieren zu können [Pickles 1988]. Viele 71 cochlea-fern gelegene Zellen reagieren überhaupt nicht mehr auf reine Töne. Zum Beispiel gibt es im Colliculus inferior Zellen, die nur durch frequenzmodulierte Töne erregbar sind, wobei häufig Richtung und Grad der Modulation von Bedeutung sind. Andere Zellen in diesem Gebiet reagieren zwar auf einen reinen Ton, aber nur, wenn er amplitudenmoduliert ist. Dies ist jedoch abgelegen von der Thematik der vorliegenden Untersuchung. Schließlich soll noch eine weitere Problematik erwähnt werden, die eine Rolle bei der Implantation vor allem von penetrierenden Elektroden spielen könnte. Obwohl diese Untersuchung keine signifikante Korrelation zwischen Alter und Ausdehnung des NCK nachweisen konnte, bestand doch zumindest ein Zusammenhang zwischen Hirngewicht und Höhe des Kernkomplexes. Außerdem lag der NCV bei geringerem Hirngewicht tiefer unter der Oberfläche des Hirnstamms. Degenerative Veränderungen im Bereich des Nucleus cochlearis nach Deafferenzierung wurden in tierexperimentellen Untersuchungen beschrieben [Campos-Torres et al. 2005]. Beim Menschen tritt eine Degeneration nach Cochlealäsionen überwiegend im Bereich des Nucleus cochlearis ventralis ein [Dublin 1976; Moore und Osen 1979; Dublin 1982; Moore 1986; Moore et al. 1994]. Dabei kommt es allerdings kaum zu Zellverlusten, sondern vor allem zu einer Verringerung von Zellgröße und Zellvolumen. Seldon and Clark (1991) fanden bei 11 postlinguistisch ertaubten Patienten eine Verringerung der Zellgröße und des Volumens des Nucleus cochlearis im Vergleich zu einer Kontrollgruppe [Seldon und Clark 1991]. Beide Veränderungen erwiesen sich jedoch, trotz der großen Anzahl von 81.007 gezählten Neuronen, als nicht statistisch signifikant. Selbst 40 Jahre nach Ertaubung hatte die Zellgröße in einem Fall dieser Studie nur minimal abgenommen. Erfahrungen mit Patienten, die gute Sprachdiskrimination erlangten, obwohl ihnen erst mehr als 30 Jahre nach Ertaubung ein Cochlea Implantat eingesetzt wurde, werden damit interpretierbar [Blamey et al. 1992]. Hardie und Shephard berichteten 1999 über eine an 13 kochleär vertaubten Katzen durchgeführte Untersuchung mit Implantation bipolarer Elektroden in der Scala tympani [Hardie und Shepherd 1999]. 12 der Tiere waren seit weniger als 2 ½ Jahren taub. Die Spiralgangliendichte hatte im Mittel auf 17% abgenommen. Das Volumen des Nucleus cochlearis war um 46% vermindert, die Neuronendichte um 37% gegenüber der Norm erhöht. Bei einem längerfristig (8 Jahre) ertaubten Tier trat die Schrumpfungsdegeneration in deutlich stärkerem Maße ein (60% Volumenminderung, 44% erhöhte Neuronendichte). Wiederum war die absolute Zahl der Zellen nicht wesentlich reduziert. Dennoch erscheint die Volumenverringerung des gesamten Kerngebietes nach Deafferenzierung im Rahmen der Versorgung von längerfristig ertaubten Patienten mit Implantaten aufgrund der möglichen, topographisch-anatomischen Veränderungen ein nicht zu unterschätzender Faktor. 7. Schlussfolgerungen für das Design von ABI- und PABI-Elektroden Die vorliegenden anatomischen Ergebnisse bestätigen, dass der dorsale Hörkern trotz der Variabilität seiner Ausdehnung immer flach genug unter der Hirnstammoberfläche im Bereich des Recessus 72 lateralis liegt, um direkt durch die Oberflächen-Elektroden der derzeit klinisch eingesetzten auditorischen Hirnstammimplantate stimuliert zu werden. Die darüber liegenden, dünnen Ependymund Faserschichten können allerdings durch die Ausbreitung oberflächlicher Kriechströme zu höheren Reizschwellen für Oberflächenimplantate führen [Ranck, Jr. 1975]. Auch der dorsokaudale Anteil (etwa 1/3 der Länge) des NCV, der hier in histologischen Schnitten auch teilweise den NCD überlappt, ist durch Oberflächenelektroden stimulierbar. Da sich der an seiner breitesten Stelle im Mittel nur maximal 1,5 mm starke, trapezoide ventrale Kern nach rostral hin weiter von der Oberfläche der Hirnstamms entfernt, ist er hier sicher nicht mehr durch Oberflächenelektroden mit den üblichen Stromstärken und Impulsbreiten zu aktivieren. Geschätzt bleibt für die Oberflächenstimulation also eine maximal erreichbare Stimulationsfläche von 1 2 3,42 mm + ( /3 x 4,6 mm) x 3,76 mm = 4,95 mm x 3,76 mm. Auf einer aktuellen (Nucleus24)-Elektrode verteilen sich über eine Fläche von ca. 7 x 3 mm 21 3 Kontakte (3 Reihen á 7 Kontakte) . Reizstärke, Impulsdauer und Verteilung des elektrischen Feldes werden also über die zu erreichende Tonotopie (Frequenzverteilung) bestimmen, weniger die direkte anatomische Lage und Zuordnung zum Nucleus cochlearis. Die Elektrode wird in den meisten Fällen über den unter der Oberfläche stimulierbaren Anteil des NCK nach medial oder lateral hinaus ragen und kann – schon wegen ihrer Positionierbarkeit im Recessus, welche eine größere Höhe nicht erlaubt - nicht die gesamte Höhe des Kerngebietes erreichen. Der obere und vordere Anteil des Nucleus cochlearis ventralis sind zwar aufgrund ihrer tiefen Lokalisation im Hirnstamm für Oberflächenelektroden nicht zugänglich, ein Teil dieses funktionell primären, d.h. noch stärker vom Hörnerv dominierten Kerngebietes mit seiner charakteristischen Tiefentonotopie (Kapitel 2.2.2. und 6.2.) lässt sich aber mit Insertionselektroden erreichen. Die Platzierung von Elektroden direkt in dem zu stimulierenden Zielgebiet führt theoretisch zu niedrigeren Reizschwellen und weniger Nebenstimulation nicht auditorischer Zentren. Weil dafür sehr kleine Elektrodenkontakte verwendet werden müssen, um eine stärkere Zerstörung des Gewebes zu vermeiden, sind die Übergangswiderstände dennoch sehr hoch – offenbar ein weiterer Grund für die bisher eingeschränkte Funktionalität des PABI [McCreery et al. 2005; Fayad et al. 2006]. Die folgenden Überlegungen zu einem optimal angepassten Array penetrierender Elektroden für den Nucleus cochlearis basieren zwar auf exakten Messwerten, abstrahiert aber von der individuellen Variabilität des Kernkomplexes. Wie unter 6.2. beschrieben ist die Effektivität des PABI außerdem von anderen Faktoren abhängig, z.B. ob es gelingen kann, mit einer Positionierhilfe die exakte Trajektorie für penetrierende Elektroden überhaupt einzuhalten. Unter diesen Einschränkungen wäre ein optimal anatomisch angepasstes Tiefenimplantat so konfiguriert: 2 Länge des dorsalen Kerns [kd] + (1/3 x Länge des ventralen Kerns [kv]) x Gesamthöhe [vg] des Kernkomplexes 3 Der Silikonträger ist mit 8 x 3,5mm noch etwas größer. 73 Die Elektrodentiefe müsste von kaudal - in Höhe des Recessus lateralis bzw. des Foramen Luschkae beginnend - nach kranial über eine Distanz von ca. 3 mm von 0,5 auf 7 mm zunehmen. Da der ventrale Kernanteil in Höhe des Austritts des Nervus fazialis aus dem Hirnstamm am tiefsten gelegen ist und dort gleichzeitig seine größte Breite aufweist, müssten die längsten Nadelelektroden des Arrays kranial diesen Bereich erreichen, die kürzesten würden knapp oberhalb des Foramen Luschkae des Recessus lateralis liegen. Die einzelnen Mikronadeln würden auf dem Elektrodenträger so eng wie möglich aneinander gesetzt werden und – bei maximaler effektiver Elektrodenkontaktfläche einen möglichst geringen Durchmesser aufweisen. Praktisch vorstellbar wäre ein Array mit 1, 3, 5 und 7 mm langen Nadeln im Abstand von je 0,75 mm, nach Möglichkeit mit multiplen Kontakten je Nadel. In ventrodorsaler Richtung könnte das Array bei einer Länge von knapp 4mm mehr als 2/3 des „Norm“-NCV und damit den nicht durch Oberflächenelektroden erreichbaren Anteil gut abdecken. Da die Fazialis-Eintrittszone das Array wegen der Gefahr der Nebenstimulation und der Fazialisverletzung nach kranial limitiert, kann der Abstand von der obersten bis zur untersten Elektrode auch bei schrägem Eintritt der Nadeln in den Hirnstamm wohl nicht mehr als 2,5 mm betragen (Gesamthöhe des Kerngebietes 3,7mm minus Kernanteil kranial des Fazialisaustritts minus Kernanteil im Recessus lateralis). Kraniokaudal sollte die Platzierung des Arrays also zwischen Recessus lateralis und Fazialisaustrittszone erfolgen. In der zweiten Ebene (ventrodorsal) sollten der Mittelpunkt des Arrays und der seitliche Scheitelpunkt des Hirnstammes in Höhe des pontomesencephalen Übergangs und damit dem Mittelpunkt des Nucleus cochlearis ventralis übereinstimmen. Aufgrund der auch in den histologischen Schnitten nachgewiesenen Lagebeziehungen sind Fehlstimulationen dieser Kerngebiete und Fasersysteme durch Tiefenelektroden wie auch bei der Oberflächenstimulation [Edgerton et al. 1982; Shannon et al. 1993; Matthies et al. 2000; Sollmann et al. 2000] nicht sicher auszuschließen: kranial: Nervus facialis (Gesicht: Sekretion, Sensibilität, Sensorik, Mototik) medial, ventral: Tractus rubrospinalis und Tractus tectospinalis (unwillkürliche Motorik, Stellreflexe, rhythmische Motorik, Gleichgewichtsregulation) ventral, lateral: Corpus pontobulbare (Efferenzen zu visuellen und auditorischen Regionen des Zerebellum und Afferenzen von Rückenmark, Nucleus ruber, Gesichtsregion des sensorimotorischen Kortex) medial: Tractus trigeminus (Kauen, Sensibilität, sympathische und parasympathische Anteile) medial zweites Neuron der langen, somatosensiblen Bahnen (Druckempfindung, Vibration, Raumsinn) medial, kranial: mittlerer und unterer Kleinhirnschenkel (z.B. Tiefensensibilität) medial, dorsal Nucleus vestibularis (Gleichgewicht) kaudal Nervus glossopharyngeus (Sensibilität Zunge, Gaumen, Motorik Pharynxmuskulatur, Parasympathikus: Speicheldrüse) 74 8. Zusammenfassung Die vorliegende erste quantitative Untersuchung an 20 Hirnstämmen mit insgesamt 33 Hörkernen bestätigt, dass sich der Nucleus cochlearis lichtmikroskopisch in einen ventralen und einen dorsalen Kern differenzieren lässt. Die Form des gesamten Kerngebietes ist komplex und ähnelt einem flachen Stiefel mit breitem Schaft. In der Sagittalebene ergibt sich eine annähernd X-förmige Silhouette, zur Längsachse des Hirnstamms ist das Kerngebiet nach lateral rotiert. Erstmals konnte in einer histologisch aufgearbeiten Serie von Hirnstammpräparaten gezeigt werden, dass der NCK auch zur antero-posterioren Querachse kranial einwärts rotiert gelegen ist. Außerdem besteht eine medial konvexe Krümmung, die in etwa der Kurvatur der lateralen Oberfläche der Medulla oblongata folgt. Die an der Hirnstammoberfläche gebildete Erhebung des Tuberculum auditivum ist nach Lage und Größe nicht mit dem Nucleus cochlearis deckungsgleich. Der dorsale Kern ist mit einer mittleren maximalen Breite von 675 µm schmal und in allen Dimensionen im Mittel etwa 1mm kleiner als der ventrale Kern. Er liegt flach - im Mittel 0,30mm tief und ziemlich parallel zur Hirnstammoberfläche im Bereich des Recessus lateralis. Daraus erklärt sich seine gute Stimulierbarkeit mit Oberflächenelektroden. Das gleiche trifft auch für das dorsokaudale Drittel des NCV zu, der hier in histologischen Schnitten mit dem NCD überlappen kann. Da sich der an seiner breitesten Stelle im Mittel 1550 µm starke ventrale Kern nach rostrokranial im Mittel bis auf 7mm von der Oberfläche der Hirnstamms entfernt, ist er hier nicht mehr durch Oberflächenelektroden mit den üblichen Stromstärken und Impulsbreiten zu aktivieren. Die mittlere maximale Gesamtausdehnung des Nucleus-Cochlearis-Komplexes (Länge x Breite x Höhe) betrug in der vorliegenden Studie 8,15 ± 1,92 x 1,53 ± 0,64 x 3,76 ± 0,89 mm (Mittelwert ± Standardabweichung; NCV 4,60 x 1,52 x 3,18 mm; NCD mit 3,74 x 0,67 x 1,9mm). Zwischen den ermittelten Extrema, d.h. den kleinsten und größten gemessenen Dimensionen individueller Kerne liegt ein Faktor von 2-3. Die interindividuelle Variabilität der Ausdehnung des Nucleus cochlearis und der Abstand der rostralen Anteile des NCV von der Oberfläche des Hirnstamms erschweren die exakte Platzierung penetrierender Elektrodenarrays. Ein penetrierendes Elektrodenarray (ventrodorsal x rostrokaudal = 4 x 2,5mm) mit Mikronadellängen von 1, 3, 5 und 7mm im rostrokaudalen Abstand von 0,75mm wäre bei korrekter Platzierung im Nucleus cochlearis ventralis sicher geeignet, die Hörbahn zu aktivieren. Der Eintrittspunkt des mittig über dem seitlichen Scheitel des Hirnstamms zu platzierenden penetrierenden Arrays sollte zwischen dem Dach des Recessus lateralis und der Fazialisaustrittszone liegen. 75 9. Danksagung Der visionären Perspektive von Prof. Dr. med.Dr.h.c.mult.M.Samii (Präsident des INI Hannover) verdankt auch diese Arbeit die Idee ihrer Entstehung. Den Professoren Dr. med. C. Matthies (leitende Oberärztin der Klinik für Neurochirurgie der Universität Würzburg), Dr. Dr.h.c. Laszig (Ärztlicher Direktor der Universitätsklinik für Hals-, Nasenund Ohrenheilkunde Freiburg) und Dr. med. T. Lenarz (Direktor der Klinik für Hals-NasenOhrenheikunde der Medizinischen Hochschule Hannover) und ihren Arbeiten zur Implantation von Hörprothesen verdanke ich wichtige Anregungen. Für die große Unterstützung bei der Durchführung dieser Arbeit möchte ich mich beim Team des damaligen Instituts für Neuropathologie der Medizinischen Hochschule Hannover bedanken. Herr Prof. Dr.med. G. Walther hat dafür gesorgt, dass ich die Möglichkeiten seines Institutes effektiv für die Präparation der Hirnstämme nutzen konnte. Frau Dr. A. Brandis hat mich mit viel Erfahrung bei der Auswahl geeigneter Hirnstämme unterstützt. Insbesondere die MTA Ewa Sikorra, aber auch Natascha Heidrich und Uwe Preis haben mir mit großer Ausdauer geholfen, die histologischen Präparate herzustellen. Ohne die stete sowohl wissenschaftliche wie auch moralische Unterstützung meines Mannes, Steffen Rosahl, wäre es wohl nie zum Abschluss dieser Arbeit gekommen. Ich danke ihm für die immer wieder neue Motivation, unendliche Geduld und unzählige fachliche Anregungen. Mein Dank gilt ebenso meinen Eltern Ingeborg und Klaus Koch, die mir auf meinem Weg in die Medizin Vorbilder waren und diesen dann auch intensiv begleitet haben. Meine Kinder Sophie und Richard können jetzt (oder später) nachlesen, warum sie etliche Stunden bei Großeltern und Tagesmüttern verbracht haben… Ich hoffe sie werden mich verstehen. 76 10. Literaturverzeichnis 1. Abe H., Rhoton A.L., Jr. (2006) Microsurgical anatomy of the cochlear nuclei. Neurosurgery 58: 728-739 2. Adams J.C. (1986) Neuronal morphology in the human cochlear nucleus. Arch Otolaryngol Head Neck Surg 112: 1253-1261 3. Bacsik R.D., Strominger N.L. (1973) The cytoarchitecture of the human anteroventral cochlear nucleus. J Comp Neurol 147: 281-289 4. Berg W. (1907) Die Veränderungen des Volumens und Gewichtes des Gewebes bei der histologischen Fixation, dem Auswässern, der Härtung un der Paraffineinbettung. Anat Anzeiger 31: 252-268 5. Blamey P.J., Pyman B.C., Gordon M., Clark G.M., Brown A.M., Dowell R.C., Hollow R.D. (1992) Factors predicting postoperative sentence scores in postlinguistically deaf adult cochlear implant patients. Ann Otol Rhinol Laryngol 101: 342-348 6. Bourk T.R., Mielcarz J.P., Norris B.E. (1981) Tonotopic organization of the anteroventral cochlear nucleus of the cat. Hear Res 4: 215-241 7. Brackmann D.E., Hitselberger W.E., Nelson R.A., Moore J., Waring M.D., Portillo F., Shannon R.V., Telischi F.F. (1993) Auditory brainstem implant: I. Issues in surgical implantation. Otolaryngol Head Neck Surg 108: 624-633 8. Brawer J.R., Morest D.K., Kane E.C. (1974) The neuronal architecture of the cochlear nucleus of the cat. J Comp Neurol 155: 251-300 9. Briggs R.J.S., Fagan P., Atlas M., Kaye A.H., Sheehy J., Hollow R., Shaw S., Clark G.M. (2000) Multichannel auditory brainstem implantation: the Australian experience. J Laryngol Otol 114: 46-50 10. Britt R., Starr A. (1976) Synaptic events and discharge patterns of cochlear nucleus cells. II. Frequency-modulated tones. J Neurophysiol 39: 179-194 11. Campos-Torres A., Touret M., Vidal P.P., Barnum S., de Waele C. (2005) The differential response of astrocytes within the vestibular and cochlear nuclei following unilateral labyrinthectomy or vestibular afferent activity blockade by transtympanic tetrodotoxin injection in the rat. Neuroscience 130: 853-865 12. Chao T.K., Burgess B.J., Eddington D.K., Nadol J.B., Jr. (2002) Morphometric changes in the cochlear nucleus in patients who had undergone cochlear implantation for bilateral profound deafness. Hear Res 174: 196-205 13. Clark G.M., Tong Y.C., Martin L.F. (1981) A multiple channel cochlear implant: an evaluation using open-set CID sentences. Laryngoscope 91: 628-634 14. Colletti V., Shannon R.V. (2005) Open set speech perception with auditory brainstem implant? Laryngoscope 115: 1974-1978 15. Demanez J.P., Demanez L. (2003) Anatomophysiology of the central auditory nervous system: basic concepts. Acta Otorhinolaryngol Belg 57: 227-236 16. Djourno A., Eyries C. (1957) Prothèse auditive par excitation électrique à distance du nerf sensoriel à l'aide d'un bobinage inclus à demeure. Presse Méd 35: 1417-1423 77 17. Dorman M.F., Loizou P.C., Rainey D. (1997) Speech intelligibility as a function of the number of channels of stimulation for signal processors using sine-wave and noise-band outputs. J Acoust Soc Am 102: 2403-2411 18. Doyle J.H., Doyle J.B., Turnbull F.M.Jr. (1964) Electrical stimulation of the eighth cranial nerve. Arch Otolaryngol 80: 388-391 19. Dublin W.B. (1974) Cytoarchitecture of the cochlear nuclei. Report of an illustrative case of erythroblastosis. Arch Otolaryngol 100: 355-359 20. Dublin W.B. (1976) The combined correlated audiohistogram. Incorporation of the superior ventral cochlear nucleus. Ann Otol Rhinol Laryngol 85: 813-819 21. Dublin W.B. (1982) The cochlear nuclei revisited. Otolaryngol Head Neck Surg 90: 744-760 22. Ebinger K., Otto S., Arcaroli J., Staller S., Arndt P. (2000) Multichannle auditory brainstem implant: US clinical trial results. J Laryngol Otol 114: 50-54 23. Edgerton B.J., House W.F., Hitselberger W. (1982) Hearing by cochlear nucleus stimulation in humans. Ann Otol Rhinol Laryngol Suppl 91: 117-124 24. El-Kashlan H.K., Niparko J.K., Altschuler R.A., Miller J.M. (1991) Direct electrical stimulation of the cochlear nucleus: surface vs. penetrating stimulation. Otolaryngol Head Neck Surg 105: 533-543 25. Evans E.F. 1975 Cochlear nerve and cochlear nucleus. In: Keidel W.D., Neff W.D. (Eds.) Handbook of sensory physiology. Springer Berlin, Heidelberg, New York. 26. Evans E.F., Nelson P.G. (1973) The responses of single neurones in the cochlear nucleus of the cat as a function of their location and the anaesthetic state. Exp Brain Res 17: 402-427 27. Fayad J.N., Otto S.R., Brackmann D.E. (2006) Auditory brainstem implants: surgical aspects. Adv Otorhinolaryngol 64: 144-153 28. Fekete D.M., Rouiller E.M., Liberman M.C., Ryugo D.K. (1984) The central projections of intracellularly labeled auditory nerve fibers in cats. J Comp Neurol 229: 432-450 29. Fischer G., Köhler C., Röthig W., Rojewski H. (1973) Die Gewichtsveränderungen von Gehirnen während einer 4wöchigen Formalinfixierung in Abhängigkeit von Alter, Geschlecht und Liegezeit post mortem. Zbl allg Path 117: 400-407 30. Fishman K.E., Shannon R.V., Slattery W.H. (1997) Speech recognition as a function of the number of electrodes used in the SPEAK cochlear implant speech processor. J Speech Lang Hear Res 40: 1201-1215 31. Gandolfi A., Horoupian D.S., De Teresa R.M. (1981) Quantitative and cytometric analysis of the ventral cochlear nucleus in man. J Neurol Sci 50: 443-455 32. Geffen G. (1978) The development of the right ear advantage in dichotic listening with focused attention. Cortex 14: 169-177 33. Glendenning K.K., Masterton R.B. (1998) Comparative morphometry of mammalian central auditory systems: variation in nuclei and form of the ascending system. Brain Behav Evol 51: 59-89 34. Goldberg J.M. 1975 Physiological studies of auditory buclei of the pons. In: Keidel W.D., Neff W.D. (Eds.) Handbook of sensory physiology. Springer Berlin, Heidelberg, New York, S. pp 108-144. 35. Hall J.G. (1965) The cochlea and cochlear nuclei in neonatal asphyxia. Universitets Forlaget, Oslo 78 36. Hardie N.A., Shepherd R.K. (1999) Sensorineural hearing loss during development: morphological and physiological response of the cochlea and auditory brainstem. Hear Res 128: 147-165 37. Heiman-Patterson T.D., Strominger N.L. (1985) Morphological changes in the cochlear nuclear complex in primate phylogeny and development. J Morphol 186: 289-306 38. Hitselberger W.E., House W.F., Edgerton B.J., Whitaker S. (1984) Cochlear nucleus implants. Otolaryngol Head Neck Surg 92: 52-54 39. Illg A., von der Haar-Heise S., Goldring J.E., Lesinski-Schiedat A., Battmer R.D., Lenarz T. (1999) Speech perception results for children implanted with the CLARION cochlear implant at the Medical University of Hannover. Ann Otol Rhinol Laryngol Suppl 177: 93-98 40. Irvine D.R.F. (1986) The auditory brainstem. Springer, Berlin, Heidelberg, Tokyo 41. Jackson K.B., Mark G., Helms J., Mueller J., Behr R. (2002) An auditory brainstem implant system. Am J Audiol 11: 128-133 42. Jacob U., Mrosack B., Gerhardt H., Staudt J. (1991) Der chirurgische Zugang zum KochlearisKerngebiet. Anat Anz Jena 173: 93-100 43. Kahle W. (1991) Taschenatlas der Anatomie. Band 3: Nervensystem und Sinnesorgane. Thieme, Stuttgart, New York 44. Kane E.C. (1974) Patterns of degeneration in the caudal cochlear nucleus of the cat after cochlear ablation. Anat Rec 179: 67-91 45. Kelly J.P. 1991 Hearing. In: Kandel E.C., Schwartz J.H., Jessell T.M. (Eds.) Principles of neural science. 3 Elsevier New York, Amsterdam, London, Tokyo, S. pp 481-498. 46. Kimura D. (1967) Functional asymmetry of the brain in dichotic listening. Cortex 3: 163-178 47. Klinke R., Hartmann R., Tillein J., Tönder N. (1996) Grundlagen für eine dritte Generation von Cochlea-Implantaten: die Erfordernisse von Seiten des Nervensystems und die biotechnischen Voraussetzungen. Physiologisches Institut III, J.W.Goethe-Universität, BMBFReport 01 VJ 9002, Frankfurt 48. Klose A.K., Sollmann W.P. (1998) Landmarks for implantation at the cochlear nucleus - a microanatomical study. Zentralbl Neurochir (Suppl.): 61 49. Klose A.K., Sollmann W.P. (2000) Anatomical variations of landmarks for implantation at the cochlear nucleus. J Laryngol Otol (Suppl.): 8-10 50. Koerber K.C., Pfeiffer R.R., Warr W.B., Kiang N.Y. (1966) Spontaneous spike discharges from single units in the cochlear nucleus after destruction of the cochlea. Exp Neurol 16: 119-130 51. Konigsmark B.W., Murphy E.A. (1972) Volume of the ventral cochlear nucleus in man: its relationship to neuronal population and age. J Neuropathol Exp Neurol 31: 304-316 52. Kretschmann H.-J., Tafesse U., Herrmann A. (1982) Different volume changes of cerebral cortex and white matter during histological preparation. Microscopica Acta 86: 13-24 53. Kuroki A., Moller A.R. (1995) Microsurgical anatomy around the foramen of Luschka in relation to intraoperative recording of auditory evoked potentials from the cochlear nuclei. J Neurosurg 82: 933-939 54. Lagerlöf H., Torgersruud T. (1934) Zur Kenntnis der Gewichts- und Volumenveränderungen bei Formalinfixation von Gehirngewebe und der Einwirkung von NaCl-Zusatz darauf. J Psychol Neurol 46: 178-188 79 55. Lang J. (1995) Skull base and related structures. Schattauer, Stuttgart, New York 56. Laszig R. (1997) European auditory brain stem prosthesis. Ann Otol Rhinol Laryngol 106: 884885 57. Laszig R., Aschendorff A. (1999) Cochlear implants and electrical brainstem stimulation in sensorineural hearing loss. Curr Opin Neurol 12: 41-44 58. Laszig R., Kuzma J., Seifert V., Lehnhardt E. (1991) The Hannover auditory brainstem implant: a multiple-electrode prosthesis. Eur Arch Otorhinolaryngol 248: 420-421 59. Laszig R., Marangos N., Sollmann P., Ramsden R., Fraysse B., Lenarz T., Rask-Andersen H., Bredberg G., Sterkers O., Manrique M., Nevison B. (1997) Initial results from the clinical trial of the nucleus 21-channel auditory brain stem implant. Am J Otol 18: S160 60. Laszig R., Sollmann W.P., Marangos N. (1995a) The restoration of hearing in neurofibromatosis type 2. J Laryngol Otol 109: 385-389 61. Laszig R., Sollmann W.P., Marangos N., Charachon R., Ramsden R. (1995b) Nucleus 20channel and 21-channel auditory brain stem implants: first European experiences. Ann Otol Rhinol Laryngol Suppl 166: 28-30 62. Lehnhardt E. 1998 Entwicklung des Cochlea-Implantats und das Cochlea-Implant-Projekt in Hannover. In: Lenarz T. (Ed.) Cochlea-Implantat. Springer Berlin, Heidelberg, New York, S. pp 1-8. 63. Lenarz M., Lim H.H., Lenarz T., Reich U., Marquardt N., Klingberg M.N., Paasche G., Reuter G., Stan A.C. (2007) Auditory midbrain implant: histomorphologic effects of long-term implantation and electric stimulation of a new deep brain stimulation array. Otol Neurotol 28: 1045-1052 64. Lenarz M., Lim H.H., Patrick J.F., Anderson D.J., Lenarz T. (2006a) Electrophysiological validation of a human prototype auditory midbrain implant in a guinea pig model. J Assoc Res Otolaryngol 7: 383-398 65. Lenarz M., Matthies C., Lesinski-Schiedat A., Frohne C., Rost U., Illg A., Battmer R.D., Samii M., Lenarz T. (2002) Auditory brainstem implant part II: subjective assessment of functional outcome. Otol Neurotol 23: 694-697 66. Lenarz T., Lim H.H., Reuter G., Patrick J.F., Lenarz M. (2006b) The auditory midbrain implant: a new auditory prosthesis for neural deafness-concept and device description. Otol Neurotol 27: 838-843 67. Lenarz T., Moshrefi M., Matthies C., Frohne C., Lesinski-Schiedat A., Illg A., Rost U., Battmer R.D., Samii M. (2001) Auditory brainstem implant: part I. Auditory performance and its evolution over time. Otol Neurotol 22: 823-833 68. Lesinski-Schiedat A., Frohne C., Illg A., Rost U., Matthies C., Battmer R.D., Samii M., Lenarz T. (2000) Auditory brainstem implant in auditory rehabilitation of patients with neurofibromatosis type 2: Hannover programme. J Laryngol Otol (Suppl.): 15-17 69. Lim H.H., Anderson D.J. (2007) Spatially distinct functional output regions within the central nucleus of the inferior colliculus: implications for an auditory midbrain implant. J Neurosci 27: 8733-8743 70. Lim H.H., Lenarz T., Anderson D.J., Lenarz M. (2008a) The auditory midbrain implant: Effects of electrode location. Hear Res 80 71. Lim H.H., Lenarz T., Joseph G., Battmer R.D., Patrick J.F., Lenarz M. (2008b) Effects of phase duration and pulse rate on loudness and pitch percepts in the first auditory midbrain implant patients: Comparison to cochlear implant and auditory brainstem implant results. Neuroscience 154: 370-380 72. Lim H.H., Lenarz T., Joseph G., Battmer R.D., Samii A., Samii M., Patrick J.F., Lenarz M. (2007) Electrical stimulation of the midbrain for hearing restoration: insight into the functional organization of the human central auditory system. J Neurosci 27: 13541-13551 73. Liu X., McPhee G., Seldon H.L., Clark G.M. (1997) Histological and physiological effects of the central auditory prosthesis: surface versus penetrating electrodes. Hear Res 114: 264-274 74. Liu X., Seldon H.L., Clark G.M. (1998) Chronic study on the neuronal excitability of the cochlear nuclei of the cat following electrical stimulation. Acta Otolaryngol 118: 524-529 75. Lorente de No R. (1933) Anatomy of the eighth nerve. III. General plan of the primary cochlear nuclei. Laryngoscope 43: 327-350 76. Lorente de No R. (1981) The primary acoustic nuclei. Raven Press, New York 77. Luetje C.M., Whittaker C.K., Geier L., Mediavilla S.J., Shallop J.K. (1992) Feasibility of multichannel human cochlear nucleus stimulation. Laryngoscope 102: 23-25 78. Luxon L.M. (1981) The anatomy and pathology of the central auditory pathways. Br J Audiol 15: 31-40 79. Manis P.B., Brownell W.E. (1983) Synaptic organization of eighth nerve afferents to cat dorsal cochlear nucleus. J Neurophysiol 50: 1156-1181 80. Manrique M., Cervera-Paz F.J., Insausti A.M., Nevison B. (2008) Effects of cochlear nuclei electrical stimulation with surface brain stem implants in nonhuman primates. Ann Otol Rhinol Laryngol 117: 212-220 81. Manrique M., Jauregui I., Insausti A., Insausti R., Cervera-Paz F.J., Perez N., Vanaclocha V. (2000) Experimental study following inactive implantation of an auditory brain stem implant in nonhuman primates. Ann Otol Rhinol Laryngol 109: 163-169 82. Marangos N., Stecker M., Sollmann W.P., Laszig R. (2000) Stimulation of the cochlear nucleus with multichannel auditory brainstem implants and long-term results: Freiburg patients. J Laryngol Otol (Suppl.): 27-31 83. Martin G.F., Linauts M., Walker J.M. (1977) The nucleus corporis pontobulbaris of the North American opossum. J Comp Neurol 175: 345-372 84. Martinez J., de Oliveira E., Tedeschi H., Tzu Wen H., Rhoton A. (2000) Microsurgical anatomy of the brain stem. Operative Techniques in Neurosurgery 3: 80-86 85. Matthies C., Thomas S., Moshrefi M., Lesinski-Schiedat A., Frohne C., Battmer R.-D., Lenarz T., Samii M. (2000) Auditory brainstem implants: current neurosurgical experiences and perspective. J Laryngol Otol 114: 32-37 86. McCreery D., Bullara L.A., Lossinsky A.S., Shannon R.V., Otto S., Waring M. (2005) A cochlear nucleus auditory prosthesis based on microstimulation, Progress Report #4. Huntington Medical Research Institutes, Neural Engineering Laboratory & House Ear Institute, Pasadena, Los Angeles 87. McCreery D.B., Shannon R.V., Moore J.K., Chatterjee M. (1998) Accessing the tonotopic organization of the ventral cochlear nucleus by intranuclear microstimulation. IEEE Trans Rehabil Eng 6: 391-399 81 88. McCreery D.B., Yuen T.G., Agnew W.F., Bullara L.A. (1992) Stimulation with chronically implanted microelectrodes in the cochlear nucleus of the cat: histologic and physiologic effects. Hear Res 62: 42-56 89. McCreery D.B., Yuen T.G., Agnew W.F., Bullara L.A. (1994) Stimulus parameters affecting tissue injury during microstimulation in the cochlear nucleus of the cat. Hear Res 77: 105-115 90. McCreery D.B., Yuen T.G., Agnew W.F., Bullara L.A. (1997) A characterization of the effects on neuronal excitability due to prolonged microstimulation with chronically implanted microelectrodes. IEEE Trans Biomed Eng 44: 931-939 91. McCreery D.B., Yuen T.G., Bullara L.A. (2000) Chronic microstimulation in the feline ventral cochlear nucleus: physiologic and histologic effects. Hear Res 149: 223-238 92. McElveen J.T., Jr., Hitselberger W.E., House W.F. (1987) Surgical accessibility of the cochlear nuclear complex in man: surgical landmarks. Otolaryngol Head Neck Surg 96: 135-140 93. Merzenich M.M., White M.W., Leake P.A., Schindler R.A., Michelson R.P. (1977) Further progress in the development of multichannel cochlear implants. Trans Am Acad Ophthalmol Otolaryngol 84: 181-182 94. Michelson R.P., Schindler R.A. (1981) Multichanel cochlear implant: preliminary results in man. Laryngoscope 91: 38-42 95. Mobley J.P., Huang J., Moore J.K., McCreery D.B. (1995) Three-dimensional modeling of human brain stem structures for an auditory brain stem implant. Ann Otol Rhinol Laryngol Suppl 166: 30-31 96. Monsell E.M., McElveen J.T., Jr., Hitselberger W.E., House W.F. (1987) Surgical approaches to the human cochlear nuclear complex. Am J Otol 8: 450-455 97. Moore J.K. 1986 Cochlear nuclei: relationship to the auditory nerve. In: Altschuler R.A., Hoffmann D.W., Bobbin R.P. (Eds.) Neurobiology of hearing: The cochlea. Raven Press New York, S. pp 283-301. 98. Moore J.K. (1987a) The human auditory brain stem as a generator of auditory evoked potentials. Hear Res 29: 33-43 99. Moore J.K. (1987b) The human auditory brain stem: a comparative view. Hear Res 29: 1-32 100. Moore J.K., Niparko J.K., Miller M.R., Linthicum F.H. (1994) Effect of profound hearing loss on a central auditory nucleus. Am J Otol 15: 588-595 101. Moore J.K., Niparko J.K., Perazzo L.M., Miller M.R., Linthicum F.H. (1997) Effect of adultonset deafness on the human central auditory system. Ann Otol Rhinol Laryngol 106: 385-390 102. Moore J.K., Osen K.K. (1979) The cochlear nuclei in man. Am J Anat 154: 393-418 103. Mouritzen Dam A. (1978) Shrinkage of the brain during histological procedures with fixation in formaldehyde solutions of diferent concentrations. ? 104. Nara T., Goto N., Nakae Y., Okada A. (1993) Morphometric development of the human auditory system: ventral cochlear nucleus. Early Hum Dev 32: 93-102 105. Nevison B. (2006) A guide to the positioning of brainstem implants using intraoperative electrical auditory brainstem responses. Adv Otorhinolaryngol 64: 154-166 106. Nevison B., Laszig R., Sollmann W.P., Lenarz T., Sterkers O., Ramsden R., Fraysse B., Manrique M., Rask-Andersen H., Garcia-Ibanez E., Colletti V., von Wallenberg E. (2002) Results from a European clinical investigation of the Nucleus multichannel auditory brainstem implant. Ear Hear 23: 170-183 82 107. Niparko J.K., Altschuler R.A., Evans D.A., Xue X.L., Farraye J., Anderson D.J. (1989) Auditory brainstem prosthesis: biocompatibility of stimulation. Otolaryngol Head Neck Surg 101: 344352 108. Oberson, J. C. www.cid.ch 109. Olszewski J., Baxter D. (1954) Cytoarchitecture of the human brain stem. Karger, Basel 110. Osen K.K. (1969a) Cytoarchitecture of the cochlear nuclei in the cat. J Comp Neurol 136: 453484 111. Osen K.K. (1969b) The intrinsic organization of the cochlear nuclei. Acta Otolaryngol 67: 352359 112. Osen K.K. (1970) Course and termination of the primary afferents in the cochlear nuclei of the cat. An experimental anatomical study. Arch Ital Biol 108: 21-51 113. Otto S.R., Brackmann D.E., Staller S., Menapace C.M. (1997) The multichannel auditory brainstem implant: 6-month coinvestigator results. Adv Otorhinolaryngol 52: 1-7 114. Parkin J.L., Eddington D.K., Orth J.L., Brackmann D.E. (1985) Speech recognition experience with multichannel cochlear implants. Otolaryngol Head Neck Surg 93: 639-645 115. Paxinos G., Huang X. (1995) Atlas of the Human Brainstem. Academic Press, San Diego 116. Pickles J.O. (1988) An introduction to the physiology of hearing. Academic Press, London 117. Quester R., Schroder R. (1997) The shrinkage of the human brain stem during formalin fixation and embedding in paraffin. J Neurosci Methods 75: 81-89 118. Quester R., Schroder R. (1999) Topographic anatomy of the cochlear nuclear region at the floor of the fourth ventricle in humans. J Neurosurg 91: 466-476 119. Ranck J.B., Jr. (1975) Which elements are excited in electrical stimulation of mammalian central nervous system: a review. Brain Res 98: 417-440 120. Rauschecker J.P., Shannon R.V. (2002) Sending sound to the brain. Science 295: 1025-1029 121. Rosahl S., Rosahl S.K., Samii M., Walter G.F. (1998) Extension, shape and orientation of the human cochlear nucleus complex in axial sections of the brainstem. Zentralbl Neurochir (Suppl.): 39-40 122. Rosahl S.K., Lenarz T., Matthies C., Samii M., Sollmann W.P., Laszig R. (2004) Hirnstammimplantate zur Wiederherstellung des Hörvermögens. Dt Aerzteblatt 101: 180-188 123. Rosahl S.K., Mark G., Herzog M., Pantazis C., Gharabaghi F., Matthies C., Brinker T., Samii M. (2001) Far-field responses to stimulation of the cochlear nucleus with microsurgically placed penetrating and surface electrodes in the cat. J Neurosurg 95: 845-852 124. Rosahl S.K., Rosahl S., Walter G.F., Hussein S., Matthies C., Samii M. (2000) Cochlear region of the brainstem. J Neurosurg 93: 724-729 125. Rose J.E., Galambos R., Hughes J.R. (1959) Microelectrode studies of the cochlear nuclei of the cat. Johns Hopkins Hosp Bull 104: 211-251 126. Rose J.E., Galambos R., Hughes J.R. 1960 Organization of frequency sensitive neurons in the cochlear nuclear complex of the cat. In: Rasmussen G.L., Windle W.F. (Eds.) Neural mechanisms of the auditory and vestibular systems. (Chap. 9). Thomas Springfield, S. pp 116136. 127. Schaltenbrand G., Wahren W. (1977) Atlas for Stereotaxy of the human Brain. 83 128. Schmidt, Thews (1996) Physiologie des Menschen. Springer, 129. Schwalbe G. (1881) Lehrbuch der Neurologie. Gustav Fischer, Jena 130. Schwartz M.S., Otto S.R., Shannon R.V., Hitselberger W.E., Brackmann D.E. (2008) Auditory brainstem implants. Neurotherapeutics 5: 128-136 131. Seldon H.L. 1985 The anatomy of speech perception: human auditory cortex. In: Peters A., Jones E.G. (Eds.) Cerebral cortex. Plenum New York, S. pp 273-324. 132. Seldon H.L., Clark G.M. (1991) Human cochlear nucleus: comparison of Nissl-stained neurons from deaf and hearing patients. Brain Res 551: 185-194 133. Shannon R.V. (1989) Threshold functions for electrical stimulation of the human cochlear nucleus. Hear Res 40: 173-177 134. Shannon R.V. (1993) Quantitative comparison of electrically and acoustically evoked auditory perception: implications for the location of perceptual mechanisms. Prog Brain Res 97: 261269 135. Shannon R.V., Fayad J., Moore J., Lo W.W., Otto S., Nelson R.A., M O.L. (1993) Auditory brainstem implant: II. Postsurgical issues and performance. Otolaryngol Head Neck Surg 108: 634-642 136. Shannon R.V., Otto S.R. (1990) Psychophysical measures from electrical stimulation of the human cochlear nucleus. Hear Res 47: 159-168 137. Shannon R.V., Zeng F.G., Kamath V., Wygonski J., Ekelid M. (1995) Speech recognition with primarily temporal cues. Science 270: 303-304 138. Shepherd R.K., Hardie N.A. (2001) Deafness-induced changes in the auditory pathway: implications for cochlear implants. Audiol Neurootol 6: 305-318 139. Shepherd R.K., McCreery D.B. (2006) Basis of electrical stimulation of the cochlea and the cochlear nucleus. Adv Otorhinolaryngol 64: 186-205 140. Shore S.E., Wiler J.A., Anderson D.J. (1990) Evoked vertex and inferior colliculus responses to electrical stimulation of the cochlear nucleus. Ann Otol Rhinol Laryngol 99: 571-576 141. Sidtis J.J. (1982) Predicting brain organization from dichotic listening performance: cortical and subcortical functional asymmetries contribute to perceptual asymmetries. Brain Lang 17: 287-300 142. Simmons F.B. (1966) Electrical stimulation of the auditory nerve in man. Arch Otolaryngol 84: 2-54 143. Simmons F.B., Mongeon C.J., Lewis W.R., Huntington D.A. (1964) Electrical stimulation of the acoustical nerve and inferior colliculus (results in man). Arch Otolaryngol 79: 559-567 144. Sinha U.K., Terr L.I., Galey F.R., Linthicum F.H., Jr. (1987) Computer-aided three-dimensional reconstruction of the cochlear nerve root. Arch Otolaryngol Head Neck Surg 113: 651-655 145. Snyder R.L., Leake P.A. (1988) Intrinsic connections within and between cochlear nucleus subdivisions in cat. J Comp Neurol 278: 209-225 146. Sollmann W.P., Laszig R., Marangos N. (2000) Surgical experiences in 58 cases using the Nucleus 22 multichannel auditory brainstem implant. J Laryngol Otol (Suppl.): 23-26 147. Sollmann W.P., Laszig R., Samii M. (1998) Electrical stimulation of the cochlear nucleus in NF2 - report of 27 cases. Zentralbl Neurochir (Suppl.): 61 84 148. Spoendlin H., Schrott A. (1989) Analysis of the human auditory nerve. Hear Res 43: 25-38 149. Steven S.S., Jones R.C. (1939) The mechanisms of hearing by electrical stimulation. J Acoust Soc Am 10: 261-269 150. Terr L.I., Edgerton B.J. (1985a) Physical effects of the choroid plexus on the cochlear nuclei in man. Acta Otolaryngol 100: 210-217 151. Terr L.I., Edgerton B.J. (1985b) Surface topography of the cochlear nuclei in humans: twoand three-dimensional analysis. Hear Res 17: 51-59 152. Terr L.I., Edgerton B.J. (1985c) Three-dimensional reconstruction of the cochlear nuclear complex in humans. Arch Otolaryngol 111: 495-501 153. Terr L.I., Fayad J., Hitselberger W.E., Zakhary R. (1990) Cochlear nucleus anatomy related to central electroauditory prosthesis implantation. Otolaryngol Head Neck Surg 102: 717-721 154. Terr L.I., House W.F. (1988) Neurons of the inferior medullary velum in the cerebellopontine angle. Ann Otol Rhinol Laryngol 97: 52-54 155. Terr L.I., Mobley J.P., House W.F. (1989) Biocompatibility of the central electroauditory prosthesis and the human cochlear nuclei. Am J Otol 10: 339-342 156. Terr L.I., Sinha U.K. (1987) Three-dimensional computer-aided reconstruction of the pontobulbar body. Am J Otol 8: 432-435 157. Terr L.I., Sinha U.K., House W.F. (1987) Anatomical relationships of the cochlear nuclei and the pontobulbar body: possible significance for neuroprosthesis placement. Laryngoscope 97: 1009-1011 158. Tolbert L.P., Morest D.K. (1982) The neuronal architecture of the anteroventral cochlear nucleus of the cat in the region of the cochlear nerve root: Golgi and Nissl methods. Neuroscience 7: 3013-3030 159. Treff M., Kraus C. (1960a) Zur Formalinfixierung des Gehirns. Psychiat Neurol Neurochir 63: 116-124 160. Treff W.M., Kraus C. (1960b) Formalinfixierung des Gehirns. Psychiatr Neurol Neurochir 63: 116-124 161. Volta A. (1800) On the electricity excited by mere contact of conducting substances of different kinds. Trans R Soc Phil 90: 403-431 162. Voss H., Herrlinger R. (1981) Taschenbuch der Anatomie. Gustav Fischer, Jena 163. Wagenaar M., Draaijer P., Meek H., ten Donkelaar H.J., Wesseling P., Kimberling W., Cremers C. (1999) The cochlear nuclei in two patients with Usher syndrome type I. Int J Pediatr Otorhinolaryngol 50: 185-195 164. Waring M.D. (1995a) Auditory brain-stem responses evoked by electrical stimulation of the cochlear nucleus in human subjects. Electroencephalogr Clin Neurophysiol 96: 338-347 165. Waring M.D. (1995b) Intraoperative electrophysiologic monitoring to assist placement of auditory brainstem implant. Ann Otol Rhinol Laryngol Suppl 104: 33-36 166. Webster W.R., Aitkin L.M. 1975 Central auditory processing. In: Gazzaniga M.S., Blakemore C. (Eds.) Handbook of Psychobiology. Academic Press New York, S. p 325. 167. Wever E.G., Bray C.W. (1930) The nature of the acoustic response: the relation between sound frequency and frequency of impulses in the auditory nerve. J Exp Psychol 13: 373-387 85 168. Whitfield I.C. (1967) The auditory pathway. Edward Arnold Ltd, London 169. Wickesberg R.E., Oertel D. (1988) Tonotopic projection from the dorsal to the anteroventral cochlear nucleus of mice. J Comp Neurol 268: 389-399 170. Young E.D. 1984 Response characteristics of neurons of the cochlear nuclei. In: Berlin C.I. (Ed.) Hearing Science. College Hill Press San Diego, S. pp 423-460. 171. Ziehen Th. 1913 Anatomie des Centralnervensystems. 2. Abteilung: Mikroskopische Anatmoie des Gehirns. In: von Bradeleben K. (Ed.) Handbuch der Anatomie des Menschen. Gustav Fischer Jena. 172. Zöllner F., Keidel W.D. (1963) Gehörvermittlung durch elektrische Erregung des Nervus acusticus. Arch klin exp Ohr Nas Kehlk Heilk 181: 216-223 86