Sektion für klinische und molekulare Neurogenetik
Werbung
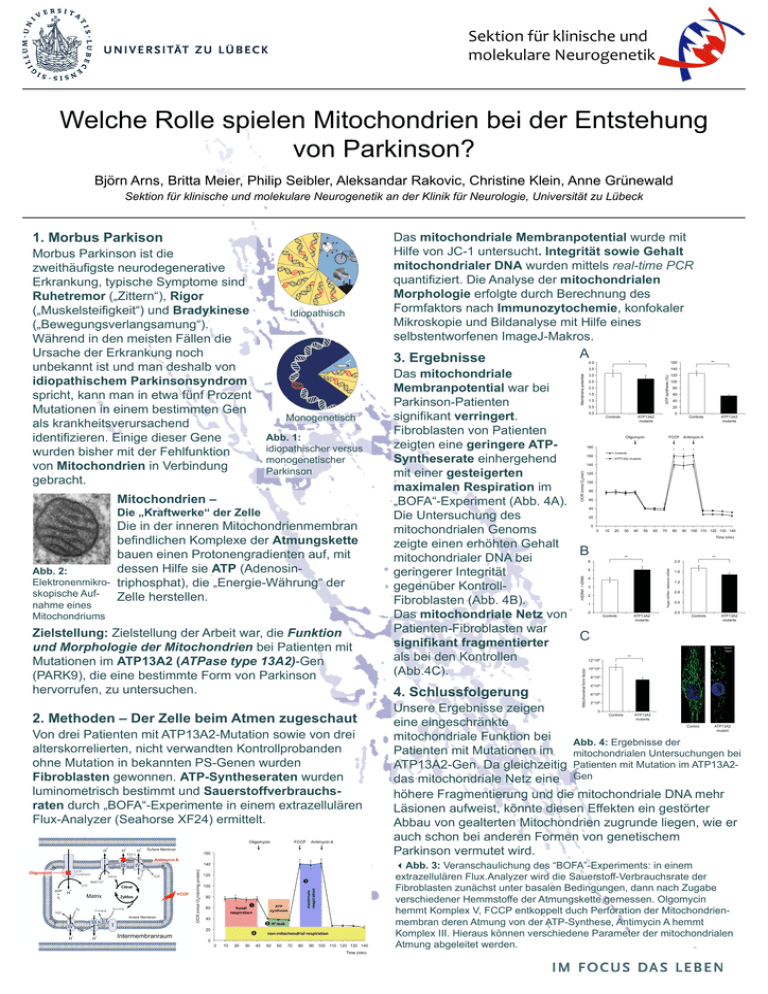
Sektion für klinische und molekulare Neurogenetik Welche Rolle spielen Mitochondrien bei der Entstehung von Parkinson? Björn Arns, Britta Meier, Philip Seibler, Aleksandar Rakovic, Christine Klein, Anne Grünewald Sektion für klinische und molekulare Neurogenetik an der Klinik für Neurologie, Universität zu Lübeck 1. Morbus Parkison Morbus Parkinson ist die zweithäufigste neurodegenerative Erkrankung, typische Symptome sind Ruhetremor („Zittern“), Rigor („Muskelsteifigkeit“) und Bradykinese („Bewegungsverlangsamung“). Während in den meisten Fällen die Ursache der Erkrankung noch unbekannt ist und man deshalb von idiopathischem Parkinsonsyndrom spricht, kann man in etwa fünf Prozent Mutationen in einem bestimmten Gen als krankheitsverursachend identifizieren. Einige dieser Gene wurden bisher mit der Fehlfunktion von Mitochondrien in Verbindung gebracht. Idiopathisch 3. Ergebnisse Monogenetisch Abb. 1: idiopathischer versus monogenetischer Parkinson Mitochondrien – Die „Kraftwerke“ der Zelle Abb. 2: Elektronenmikroskopische Aufnahme eines Mitochondriums Das mitochondriale Membranpotential wurde mit Hilfe von JC-1 untersucht. Integrität sowie Gehalt mitochondrialer DNA wurden mittels real-time PCR quantifiziert. Die Analyse der mitochondrialen Morphologie erfolgte durch Berechnung des Formfaktors nach Immunozytochemie, konfokaler Mikroskopie und Bildanalyse mit Hilfe eines selbstentworfenen ImageJ-Makros. Die in der inneren Mitochondrienmembran befindlichen Komplexe der Atmungskette bauen einen Protonengradienten auf, mit dessen Hilfe sie ATP (Adenosintriphosphat), die „Energie-Währung“ der Zelle herstellen. Zielstellung: Zielstellung der Arbeit war, die Funktion und Morphologie der Mitochondrien bei Patienten mit Mutationen im ATP13A2 (ATPase type 13A2)-Gen (PARK9), die eine bestimmte Form von Parkinson hervorrufen, zu untersuchen. 2. Methoden – Der Zelle beim Atmen zugeschaut Von drei Patienten mit ATP13A2-Mutation sowie von drei alterskorrelierten, nicht verwandten Kontrollprobanden ohne Mutation in bekannten PS-Genen wurden Fibroblasten gewonnen. ATP-Syntheseraten wurden luminometrisch bestimmt und Sauerstoffverbrauchsraten durch „BOFA“-Experimente in einem extrazellulären Flux-Analyzer (Seahorse XF24) ermittelt. A Das mitochondriale Membranpotential war bei Parkinson-Patienten signifikant verringert. Fibroblasten von Patienten zeigten eine geringere ATPSyntheserate einhergehend mit einer gesteigerten maximalen Respiration im „BOFA“-Experiment (Abb. 4A). Die Untersuchung des mitochondrialen Genoms zeigte einen erhöhten Gehalt B mitochondrialer DNA bei geringerer Integrität gegenüber KontrollFibroblasten (Abb. 4B). Das mitochondriale Netz von Patienten-Fibroblasten war C signifikant fragmentierter als bei den Kontrollen (Abb.4C). 4. Schlussfolgerung Unsere Ergebnisse zeigen eine eingeschränkte mitochondriale Funktion bei Abb. 4: Ergebnisse der Patienten mit Mutationen im mitochondrialen Untersuchungen bei ATP13A2-Gen. Da gleichzeitig Patienten mit Mutation im ATP13A2das mitochondriale Netz eine Gen höhere Fragmentierung und die mitochondriale DNA mehr Läsionen aufweist, könnte diesen Effekten ein gestörter Abbau von gealterten Mitochondrien zugrunde liegen, wie er auch schon bei anderen Formen von genetischem Parkinson vermutet wird. Abb. 3: Veranschaulichung des “BOFA”-Experiments: in einem extrazellulären Flux.Analyzer wird die Sauerstoff-Verbrauchsrate der Fibroblasten zunächst unter basalen Bedingungen, dann nach Zugabe verschiedener Hemmstoffe der Atmungskette gemessen. Olgomycin hemmt Komplex V, FCCP entkoppelt duch Perforation der Mitochondrienmembran deren Atmung von der ATP-Synthese, Antimycin A hemmt Komplex III. Hieraus können verschiedene Parameter der mitochondrialen Atmung abgeleitet werden.