Versuch7_Bestimmung des Phagentiters
Werbung

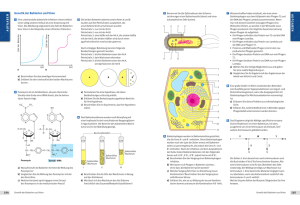
Versuch 7: Bestimmung des Phagentiters Bestimmung des Phagentiters 1. Einleitung Bakteriophagen befallen lebende Zellen und vermehren sich in diesen. Sie haben sich auf eine Bakterienart spezialisiert (Indikatorbakterien). Die Spezialisierung beruht auf der Fähigkeit sich an der Oberfläche der Wirtszelle an einer Rezeptorsubstanz zu binden. Zur Anheftung an ein Bakterium dienen die Schwanzfibrillen. Neben diesen ist der komplexe Phage in zwei Großbereiche gegliedert (siehe Abbildung 1). Abb. 1: Phage T4 als Beispiel eines komplexen Phagen Der Kopf beinhaltet die lineare, doppelsträngige Pagen-DNA, die von Capsiden umhüllt ist. Durch den so genannten Kragen ist der Kopf- von dem Schwanzbereich getrennt. Der Schwanzbereich besteht aus einer kontraktilen Scheide (Phage T4) oder einer nicht kontraktilen Scheide (Phage Lambda). Die Scheide wird nach unten von der Basalplatte abgegrenzt, die sich durch ihre Haken bei der Injektion der DNA in die Wirtszelle in der Membran verankert. Durch den Stift, der durch die Membran dringt, wird die DNA in die Zelle injiziert. Neben den komplexen Phagen gibt es einfache Phagen, die nur einen Kopf besitzen, in dem die Erbinformationen in Form von DNA oder RNA gespeichert sind. Die Formen dieser Phagen sind in Abbildung 2 aufgezeigt. Seite 1 von 4 Versuch 7: Bestimmung des Phagentiters A: Fadenform B: Komplexe Form mit Kopf und kontraktiler Scheide (T4) C: Kopf mit flexiblen Schwanz und nichtkontraktiler Scheide D: Kopf mit kurzem Schwanz E: Oktaeder (Kopfform) F: Eikosaeder (Kopfform) Abb. 2: Verschiedene Kopfformen von Bakteriophagen (nach Schlegel) Die Wirtszelle dient den Phagen zur Bildung von Proteinen und zur Replikation der Phagen-DNA. Ohne die Wirtszelle ist ein Überleben der Phagen ausgeschlossen, da die Phagen über keinen eigenständigen Stoffwechsel verfügen. Es gibt Phagen, die für die Wirtszelle virulent sind. Nach der Adsorption auf der Oberfläche wird die Phagen-DNA in die Zelle injiziert. Der Injektion schließt sich die Latenz-Periode in der Bakterienzelle an, die durch die Replikation der Phagen DNA, sowie durch die Bildung von Phagenproteinen gekennzeichnet ist. Danach erfolgt die Reifung, bei der die DNA in Capside verpackt wird. Danach vereinigen sich der Kopfund Schwanzbereiches der Phagen. Abschließend kommt es zu einer Lyse der Bakterienwand durch Phagenlysozym. Die Phagen gelangen ins Medium und sind in der Lage weitere Bakterien zu befallen. Man spricht von einem lytischen Lebenszyklus (Beispiel für Phage T4). Temperente Bakteriophagen (Bsp. Phage Lambda) adsorbieren an der Zelloberfläche der Bakterien und injizieren ihre DNA. Es kommt jedoch nicht zur Lyse der Zellen, sondern zu einem Einbau der Phagen DNA in das ringförmige Bakterienchromosom. Bevor diese Integration (Insertion) der DNA erfolgen kann, muss die lineare doppelsträngige DNA der Phagen zu einem Ring geschlossen werden. Die lineare DNA besitzt so genannte ´sticky ends´, die eine komplementäre DNA-Sequenz aufweisen. Ein Ringschluss ist somit vereinfacht, wird jedoch zusätzlich durch ein Bakterienenzym, der Polynukleotidligase, katalysiert. Die Bakterien replizieren bei jeder Teilung auch die DNA-Bereiche des Phagen, der nun als Prophage bezeichnet wird. Dieser vermehrt sich somit bei jeder Teilung der Bakterienzelle. In diesem Fall spricht man von einem lysogenen Lebenszyklus (Beispiel: Lambda Phage). Jedoch kann es durch äußere Einflüsse (z.B. UV-Licht) in seltenen Fällen zur Excision (Ausgliederung) der Phagen DNA kommen. Dies liegt daran, dass die durch die UV-Strahlung ausgelöste SOS-Antwort die Bildung des Seite 2 von 4 Versuch 7: Bestimmung des Phagentiters cycloplasmatischen Repressorproteins verhindert. Der Repressor verhindert die Vermehrung vegetativer Phagen und somit ihren lytischen Lebenszyklus. Die Phagen sind nun jedoch für die Bakterienzelle virulent. Bei diesem Versuch wird der Phagentiter des Phagen T4-1Ly bestimmt. Voraus geht eine Inkubation des Bakteriums E. coli B 519 mit dem Phagen. Man geht davon aus, dass ein Plaque von je einem freien Phagen ausgeht. Ein Plaque kennzeichnet sich durch einen Hof im Bakterienrasen, der durch die Lyse der Bakterien entstanden ist. Unter Berücksichtigung des Verdünnungsfaktors und des eingesetzten Volumens des Phagenlysats kann der Phagentiter, also die Anzahl der Phagen pro Volumeneinheit berechnet werden. 2. Material und Methoden Der Versuch wurde wie im Skript beschrieben durchgeführt. Abweichungen von den im Skript angegebenen Materialien sind hier kurz aufgeführt: Der Ausgangstiter liegt bei 5 x 108. Die Verdünnungsreihe des Phagenlysats mit Phagenpuffer wurde bis zu einer Verdünnung von 10-8 durchgeführt. Wie im Skript beschrieben werden die letzten vier Verdünnungen für den Versuch verwendet. Allerdings werden Doppelbestimmungen der Verdünnungsstufe 10-6 und 10-7 durchgeführt. 3. Ergebnisse Tab. 1: Anzahl der gebildeten Plaques bei verschiedenen Verdünnungsstufen Verdünnungsstufe der Anzahl der Plaques pro Platte Phagenausgangslösung 10-5 294 10 -6 28 10 -6 61 10 -7 8 10 -7 6 10 -8 0 Kontrolle (Bakterien und Puffer ohne Phagen) 0 Berechnung des Phagentiters: Anzahl der Plaques x Verdünnungsfaktor Phagen ml Probe Phagenlysat Anzahl der Phagen / ml PhagenlysatSeite [pfu/ml] 3 von 4 Versuch 7: Bestimmung des Phagentiters Berechnung: Verdünnungsfaktor 105: 294 x 105 / 0,1ml = 2,94 x 108 pfu/ml Verdünnungsfaktor 106: [(28+61)/2] x 106 / 0,1ml = 4,45 x 108 pfu/ml Verdünnungsfaktor 107: [(8+6)/2] x 107 / 0,1ml = 7 x 108 pfu/ml Mittelwert: (7 x 108 + 4,45 x 108 + 2,94 x 108) / 3 = 4,797 x 108 pfu/ml 4. Diskussion Die Ergebnisse zeigen, dass bei einer geringeren Verdünnung mehr Plaques entstehen. Geht man davon aus das jedes Plaque aus einem freien Phagen entstanden ist, ist es nicht verwunderlich, wenn bei einer geringeren Verdünnung mehr Plaques entstehen, da mehr Phagen in dem Lysat vorliegen. Der berechnete Phagentiter liegt bei 4,794 x 108 pfu/ml. Dieser Wert entspricht nahezu dem der eingesetzten Konzentration von 5 x 108 pfu/ml. Dies lässt darauf schließen, dass in der Phagenausgangslösung fast alle Phagen funktionstüchtig waren und die Zellen befallen haben. 5. Literatur Madigan, M.: Brock. Biology of Mikroorganisms, Heidelberg, 2001 Schlegel, Hans G.: „Allgemeine Mikrobiologie“, 7. überarbeitete Auflage, Thieme Verlag, Stuttgart, 1992 Skript „Übungen in Mikrobiologie F1-Teil2a“ Seite 4 von 4