Neurospora crassaals Modellorganismus im
Werbung

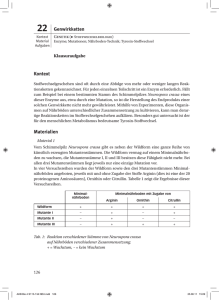
697_729_BIOsp_0707.qxd:697_729 708 07.11.2007 14:14 Uhr Seite 708 WISSENSCHAFT Functional Genomics MINOU NOWROUSIAN LEHRSTUHL FÜR ALLGEMEINE UND MOLEKUL ARE BOTANIK, RUHR-UNIVERSITÄT BOCHUM Neurospora crassa ist der erste Hyphenpilz, dessen Genom vollständig sequenziert wurde. Zurzeit werden Deletionsmutanten von allen 10.000 vorhergesagten Genen hergestellt; außerdem wurden GesamtgenomMikroarrays etabliert. Damit ist N. crassa ein vielseitiges Modellsystem für die molekulare Analyse genetischer Regulationsmechanismen in Eukaryoten. ó Pilze (Eumycota, „echte Pilze“) stellen eine artenreiche Gruppe von Eukaryoten dar, deren Vertreter in nahezu allen Ökosystemen anzutreffen sind. Neben ein- oder wenigzelligen Arten gibt es eine große Anzahl vielzelliger Pilze, die Hyphenpilze. Ihre Zellen wachsen in Form von lang gestreckten Fäden (Hyphen), welche durch Verzweigung und Fusion netzartige Myzelien ausbilden können. Zusätzlich können sich Hyphenpilze meist durch sexuelle oder asexuelle Sporen vermehren. Eine Reihe von Hyphenpilzen aus der Gruppe der Ascomyceten ist saprophytisch, also in der Lage, auf totem organischen Substrat zu wachsen. Sie lassen sich daher meist leicht im Labor kultivieren, sodass sie bereits seit Jahrzehnten als Modellorganismen für die Untersuchung verschiedener biochemischer, genetischer und molekularbiologischer Fragestellungen verwendet werden. Hierzu zählt neben Aspergillus nidulans besonders Neurospora crassa (im weiteren Verlauf nur Neurospora genannt), der in den letzten Jahren eine Vorreiterrolle bei der Etablierung von Genomics- und Functional Genomics-Techniken bei Hyphenpilzen gespielt hat. Neurospora: ein Pilz für alle Fälle Neurospora ist ein haploider, saprophytischer Ascomycet, der sich sowohl sexuell als auch vegetativ vermehren kann (Abb. 1). Neurospora hat eine lange Tradition als Modellsystem[1]. Bereits in der ersten Hälfte des letzten Jahrhunderts wurde dieser Pilz von Ber- nard Dodge für klassisch-genetische Studien genutzt, und in den 40er Jahren konnten George Beadle und Edward Tatum durch die Analyse von auxotrophen Neurospora-Mutanten die Ein-Gen-ein-Enzym-Theorie aufstellen (Nobelpreis 1958). Seit den 70er Jahren wurden molekulargenetische Methoden für Neurospora etabliert, sodass dieser Pilz ein wichtiger Modellorganismus für die Untersuchung der Lichtrezeption und der circadianen Rhythmik sowie für die Analyse von Differenzierungsprozessen bei Hyphenpilzen wurde[2]. Weiterhin war Neurospora einer der ersten Organismen, bei denen Faktoren identifiziert wurden, die essenziell für RNAi sind, das hier zuerst unter dem Begriff „Quelling“ beschrieben wurde[3]. Zusätzlichen Auftrieb als Modellsystem erhielt Neurospora dadurch, dass das Genom als erstes Hyphenpilzgenom sequenziert und öffentlich zugänglich gemacht wurde[4]. Das Neurospora-Genom-Projekt Das Neurospora-Genom hat eine Größe von etwa 40 Mb und kodiert für etwa 10.000 Gene. Ausgehend von der Genomsequenz wurde im Jahr 2004 das Neurospora-Genom-Projekt begonnen, bei dem im Rahmen von vier Teilprojekten eine Reihe von Functional-Genomics-Ressourcen für Neurospora etabliert werden (Abb. 2). Hierzu zählt die Erzeugung von Deletionsmutanten für alle der rund 10.000 vorhergesagten offenen Leserahmen (ORFs) sowie die Herstellung von GesamtgenomMikroarrays. Weiterhin sollen EST(expressed sequence tag)- sowie SNP(single nucleotide polymorphism)-Datenbanken angelegt werden, die zur verbesserten Annotation des Genoms sowie zur Kartierung von Mutationen genutzt werden können. Außerdem wird die manuelle Annotation des Genoms durch die Neurospora-Community vorangetrieben, um experimentelle Ergebnisse mit den Genomdaten zu verknüpfen. Hierzu zählen beispielsweise Expressionsdaten oder Mutantenphänotypen für einzelne Gene, die in die Genomdatenbank integriert werden. Das Neurospora-Genom-Projekt wird von verschiedenen Labors in den USA koordiniert, es sind aber auch Kooperationspartner aus anderen Ländern beteiligt[5]. So wurde ein Teil der Sequenzierung sowie der Annotation am MIPS (Munich Information Center for Protein Sequences) durchgeführt[6]. Sämtliche Ergebnisse und Ressourcen wie Deletionsmutanten und Mikroarrays sind vollständig öffentlich und stehen allen interessierten Forschern zur Verfügung. Im Folgenden werden das Deletionsmutanten- sowie das Mikroarray-Projekt genauer vorgestellt, da beide bereits weit fortgeschritten sind und die daraus hervorgehenden Ressourcen von einer breiten Gruppe von Anwendern genutzt werden können. Gesamtgenom-Mikroarrays Die Mikroarray-Technologie ist eine Hochdurchsatz-Anwendung, welche die gleichzeitige Hybridisierung von hunderten bis tausenden Träger-gebundenen DNA-Sonden ermöglicht. Mikroarrays werden besonders für Expressionsanalysen verwendet. Dabei werden die DNA-Sonden auf dem Trägermaterial mit revers transkribierter RNA, dem Target, hybridisiert. Mikroarray-Expressionsanalysen können beispielsweise dazu genutzt werden, Mutanten oder bestimmte physiologische Zustände zu charakterisieren sowie bisher nicht-charakterisierte Gene in funktionelle Gruppen einzuordnen. Die Vorhersage von rund 10.000 ORFs im Neurospora-Genom erlaubte die Herstellung von Mikroarrays, die jeweils ein Oligonukleotid für BIOspektrum | 07.07 | 13. Jahrgang © 2007 Thermo Fisher Scientific Inc. All rights reserved. Neurospora crassa als Modellorganismus im „postgenomischen“ Zeitalter 697_729_BIOsp_0707.qxd:697_729 710 07.11.2007 14:14 Uhr Seite 710 WISSENSCHAFT Die Oligonukleotide werden auf Glas-Objektträger aufgebracht („gespottet“); die Arrays sind über das Fungal Genetics Stock Center (FGSC) zu beziehen. Die GesamtgenomMikroarrays wurden bereits dazu verwendet, um Transkriptionsprofile für die Keimung der Makrokonidiosporen zu erstellen; weiterhin wurde die transkriptionelle Regulation der Aminosäurebiosynthese, die cross pathway control, auf Gesamtgenomebene untersucht[7, 8]. Diese Untersuchungen sind Teil eines umfassenden Projekts, bei dem das Basis-Transkriptom von Neurospora erstellt werden soll. Ziel ist es hierbei, Transkriptionsprofile für eine Reihe von unterschiedlichen Wachstumsbedingungen sowie verschiedenen Entwicklungsstadien (Abb. 1) zu ermitteln, die als Grundlage für nachfolgende Analysen dienen können. Zusätzlich können die Arrays auch für die Analyse von Mutanten verwendet werden, und sie lassen sich auch für Hybridisierungen mit Targets aus anderen Hyphenpilzen einsetzen (s. u.). ˚ Abb. 1: Lebenszyklus von Neurospora crassa. Das vegetative Myzel von Neurospora ist in der Lage, zwei verschiedene Formen von asexuellen Sporen zu bilden, nämlich die meist mehrkernigen, orange gefärbten Makrokonidien sowie die kleineren, oft einkernigen Mikrokonidien. Im Verlauf der sexuellen Entwicklung bilden sich am vegetativen Myzel Ascogone (weibliche Gametangien). Vom Ascogon geht eine Trichogyne (Empfängnishyphe) aus, die mit einem Konidium oder auch dem vegetativen Myzel eines Neurospora-Stamms vom entgegengesetzten Kreuzungstyp verschmelzen kann. Bei Neurospora gibt es zwei Kreuzungstypen (A und a), und nur Stämme mit verschiedenen Kreuzungstypen können sich gegenseitig befruchten (heterothallischer Lebenszyklus). Nach der Befruchtung werden vom Ascogon die ascogenen Hyphen ausgebildet, die jeweils zwei Kerne mit verschiedenen Kreuzungstypen (gelb und rot) enthalten. Die Ascogone werden von sterilen Hyphen umschlossen, welche die Fruchtkörperhülle bilden und zuerst einen Vorfruchtkörper (Protoperithezium) und später das Perithezium bilden. Im Inneren des Fruchtkörpers entwickeln sich die ascogenen Hyphen zu Asci, dabei kommt es zu Karyogamie (K), Meiose (M) und postmeiotischer Mitose (PM), sodass acht Ascosporen pro Ascus entstehen. Die reifen Asci werden aus dem Perithezium ausgeschleudert. jeden ORF tragen, sodass alle vorhergesagten Gene auf den Mikroarrays repräsentiert sind. Bei den Oligonukleotiden handelt es sich um 70mere, die so ausgewählt wurden, dass sie wenig interne Sequenzwiederholungen enthalten, einen relativ einheitlichen GCGehalt aufweisen und bevorzugt in der 3’Region des jeweiligen Leserahmens liegen[7]. Ein weiterer Teil des Neurospora-Genom-Projekts ist die Erzeugung von Deletionsmutanten für alle vorhergesagten ORFs[9]. Hierzu werden Gendisruptionskassetten erstellt, bei denen das hph-Gen, das Resistenz gegen das Antibiotikum Hygromycin vermittelt, von DNA-Fragmenten flankiert wird, die Bereichen stromauf- und stromabwärts des zu deletierenden Gens entsprechen. Die flankierenden Neurospora-DNA-Fragmente haben eine Länge von 1,0–1,3 kb. Diese Fragmente sowie ein das hph-Gen enthaltendes Fragment werden in Saccharomyces cerevisiae transformiert, wo sie durch homologe Rekombination über kurze, überlappende Enden zur Disruptionskassette assembliert werden. Die gesamte Kassette kann dann durch PCR amplifiziert und zur Transformation von Neurospora eingesetzt werden, um das Wildtyp-Allel des Gens durch homologe Rekombination innerhalb der flankierenden Bereiche durch das hph-Gen zu ersetzen[9]. Bei Neurospora wie auch bei den meisten anderen Hyphenpilzen integriert transformierte DNA allerdings meist an beliebiger Stelle (ektopisch) ins Genom. Die Rate der homologen Integration liegt oft deutlich unter fünf Prozent, was für ein Hochdurchsatz-Projekt zur Erzeugung von Transformanten mit homologer Rekombination sehr nachteilig ist. Abhilfe schaffte hier die Verwendung spezieller Rezipientenstämme, die Mutationen in den Genen ku70 (mus51) oder ku80 (mus-52) tragen. Diese Gene BIOspektrum | 07.07 | 13. Jahrgang 07.005 sign-berlin.de Ein Knock-out-Stamm für jedes Gen 712 07.11.2007 14:14 Uhr Seite 712 S&F 697_729_BIOsp_0707.qxd:697_729 WISSENSCHAFT ¯ Abb. 2: Das NeurosporaGenom-Projekt. Die Genomsequenz sowie Annotationsdaten sind öffentlich zugänglich, Deletionsmutanten sowie Mikroarrays sind über das FGSC erhältlich. sind für die Verbindung nicht-homologer DNA-Stränge essenziell und damit auch für die ektopische Integration. Mutationen in einem der Gene führen daher zu einer drastisch verringerten Rate der nicht-homologen Integration[10]. Infolgedessen haben nahezu alle erhaltenen Transformanten die Disruptionskassette durch homologe Rekombination am gewünschten Genort integriert und stellen somit Knock-out-Mutanten dar. Bisher sind mehr als 3.000 Knock-out-Stämme erzeugt worden, die über das FGSC bestellt werden können. Die Reihenfolge der Erzeugung der Mutanten richtet sich nach der Nachfrage durch Neurospora-Forscher. Wunsch-Mutanten können per E-Mail bestellt werden ([email protected]). Zukünftig sollen für ausgewählte Knock-out-Mutanten Transkriptionsprofile mithilfe der Gesamtgenom-Arrays erzeugt werden, um so die Funktion einzelner Gene im Gesamtorganismus besser verstehen zu können. Neurospora-Ressourcen als Werkzeuge für die Erforschung anderer Organismen Die Functional-Genomics-Ressourcen für Neurospora können zum Teil auch für die Arbeit mit anderen Pilzen genutzt werden. So ist es möglich, cross species-Mikroarray-Hybridisierungen durchzuführen, bei denen Targets aus der RNA eines anderen Hyphenpilzes mit den Neurospora-Gesamtgenom-Arrays hybridisiert werden. Voraussetzung hierfür ist, dass die zweite Art genügend Sequenzidentität zu Neurospora aufweist. Dies ist beispielsweise bei dem Ascomyceten Sordaria macrospora der Fall, für den gezeigt werden konnte, dass die Nukleinsäure-Identität zu Neurospora innerhalb von kodierenden Regionen fast 90 Prozent beträgt[11]. Cross speciesHybridisierungen mit S. macrospora-Targets auf den Neurospora-Gesamtgenom-Arrays verliefen erfolgreich und konnten genutzt werden, um den Einfluss zweier Entwicklungsgene auf die Fruchtkörperdifferenzierung in S. macrospora zu untersuchen[12]. Auch das Deletionsmutanten-Projekt hat große Vorteile für die Arbeit mit anderen Organismen, nicht nur für Pilze, sondern auch für andere Gruppen, da nun NeurosporaMutanten einfach bestellt und für vergleichende Analysen herangezogen werden können. So kann beispielsweise festgestellt werden, ob die Deletion eines bestimmten Gens in Neurospora dieselbe Wirkung auf zellulärer oder organismischer Ebene hat wie die Deletion des orthologen Gens bei anderen Organismen. Hierdurch ist es viel einfacher, Faktoren zu identifizieren, deren Wirkung im Lauf der Evolution konserviert ist oder die eine Änderung ihrer zellulären Funktion erfahren haben. Für Spezies, bei denen die Herstellung von Deletionsmutanten schwierig ist, kann der Phänotyp der Neurospora-Mutante oftmals als erster Anhaltspunkt für die mögliche Funktion eines Gens dienen. Die Kombination des sequenzierten Genoms mit Gesamtgenom-Mikroarrays und einer genomweiten Kollektion von Knock-outMutanten macht Neurospora zu einem einzigartigen Modellorganismus im Bereich der vielzelligen Eukaryoten. Derartige konzertierte Anstrengungen gibt es bei Pilzen bisher nur für die einzellige Hefe S. cerevisiae, und es ist zu erwarten, dass Neurospora hierdurch auch weiterhin einer der wichtigsten Modellorganismen für die allgemeine Zellbiologie sowie für die Erforschung pilzspezifischer Fragestellungen sein wird. Danksagung Ich möchte Prof. Dr. Ulrich Kück für seine Unterstützung, Dr. Birgit Hoff und Ines Engh für die kritische Durchsicht des Manuskripts und der Deutschen Forschungsgemeinschaft für die Förderung danken. ó Literatur [1] Davis, R. H. (2000): Neurospora: contributions of a model organism. Oxford University Press, Oxford, New York. [2] Borkovich, K. A. et al. (2004): Lessons from the genome sequence of Neurospora crassa: tracing the path from genomic blueprint to multicellular organism. Microbiol. Mol. Biol. Rev. 68: 1–108. [3] Cogoni, C., Macino, G. (2000): Post-transcriptional gene silencing across kingdoms. Curr. Opin. Genet. Dev. 10: 638– 643. [4] Galagan, J. E. et al. (2003): The genome sequence of the filamentous fungus Neurospora crassa. Nature 422: 859–868. [5] Dunlap, J. C. et al. (2007): Enabling a community to dissect an organism: overview of the Neurospora functional genomics project. Adv. Genet. 57: 49–96. [6] Mewes, H. W., Amid, C., Arnold, R., Frishman, D., Güldener, U., Mannhaupt, G., Münsterkötter, M., Pagel, P., Strack, N., Stümpflen, V., Warfsmann, J. J., Ruepp, A. (2004): MIPS: analysis and annotation of proteins from whole genomes. Nucleic Acids Res. 32: D41–44. [7] Kasuga, T., Townsend, J. P., Tian, C., Gilbert, L. B., Mannhaupt, G., Taylor, J. W., Glass, N. L. (2005): Long-oligomer microarray profiling in Neurospora crassa reveals the transcriptional program underlying biochemical and physiological events of conidial germination. Nucleic Acids Res. 33: 6469–6485. [8] Tian, C., Kasuga, T., Sachs, M. S., Glass, N. L. (2007): Transcriptional profiling of cross pathway control in Neurospora crassa and comparative analysis of the Gcn4 and CPC1 regulons. Eukaryot. Cell 6: 1018–1029. [9] Colot, H. V., Park, G., Turner, G. E., Ringelberg, C., Crew, C. M., Litvinkova, L., Weiss, R. L., Borkovich, K. A., Dunlap, J. C. (2006): A high-throughput gene knockout procedure for Neurospora reveals functions for multiple transcription factors. Proc. Natl. Acad. Sci. USA 103: 10352–10357. [10] Ninomiya, Y., Suzuki, K., Ishii, C., Inoue, H. (2004): Highly efficient gene replacements in Neurospora strains deficient for nonhomologous end-joining. Proc. Natl. Acad. Sci. USA 101: 12248–12253. [11] Nowrousian, M., Würtz, C., Pöggeler, S., Kück, U. (2004): Comparative sequence analysis of Sordaria macrospora and Neurospora crassa as a means to improve genome annotation. Fungal Genet. Biol. 41: 285–292. [12] Nowrousian, M., Frank, S., Koers, S., Strauch, P., Weitner, T., Ringelberg, C., Dunlap, J. C., Loros, J. J., Kück, U. (2007): The novel ER membrane protein PRO41 is essential for sexual development in the filamentous fungus Sordaria macrospora. Mol. Microbiol. 64: 923–937. Korrespondenzadresse: Dr. Minou Nowrousian Lehrstuhl für Allgemeine und Molekulare Botanik Fakultät für Biologie und Biotechnologie Ruhr-Universität Bochum Universitätsstraße 150 D-44801 Bochum Tel.: 0234-3224588 Fax: 0234-3214184 [email protected] D W E M u W m u C AUTORIN Minou Nowrousian Jahrgang 1971. 1991–1996 Biologiestudium an der Ruhr-Universität Bochum. 1996–1998 Promotion bei Prof. Dr. Ulrich Kück am Lehrstuhl für Allgemeine und Molekulare Botanik in Bochum. 1999–2001 Postdoc bei Prof. Dr. Jay Dunlap und Prof. Dr. Jennifer Loros am Department of Genetics, Dartmouth Medical School (Hanover, USA). Seit 2002 Postdoc/Projektleiterin am Lehrstuhl für Allgemeine und Molekulare Botanik, Ruhr-Universität Bochum. BIOspektrum | 07.07 | 13. Jahrgang 210x29