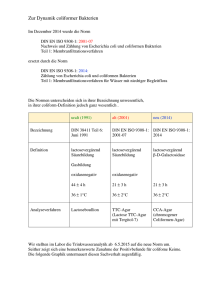
Gesamte Arbeit lesen
Werbung

Experimentelle Prüfung verschiedener Methoden der quantitativen Bestimmung gesamtcoliformer und fäkalcoliformer Bakterien (E. coli) für die qualitative Bewertung von Wasserproben Diplomarbeit im Studiengang Biotechnologie vorgelegt von Dzevrije Sabani Serani Hamburg am 21.02.20006 Gutachter: Prof. Dr. Birger Anspach Dr. Klaus Roch Fachhochschule Hamburg Fachamt für Umweltuntersuchungen, Umweltbehörde Hamburg Die Diplomarbeit wurde betreut und erstellt im Fachamt für Umweltuntersuchungen Hamburg, Marckmannstr. 129 b, 20539 Hamburg Danksagungen Diese Arbeit wurde erstellt mit freundlicher Unterstützung der Mitarbeiter im Fachamt für Umweltuntersuchungen Hamburg. Ein ganz besonderer Danke gilt dabei Frau Keitel für ihre tatkräftige Unterstützung bei den praktischen Arbeiten im Labor. Für die freundliche Unterstützung bei der paktischen und theoretischen Arbeit möchte ich mich herzlich bei Herrn Dr. Roch bedanken. Für die umfassende Betreuung der Diplomarbeit danke ich Herrn Prof. Dr. Anspach. Inhaltsverzeichnis 1. Einleitung 1 1.1 Bakteriologische Wasseruntersuchung 2. Material und Methoden 1 2 2.1 Definition coliformer und fäkalcoliformer Bakterien 2 2.2 Plattenmethoden 2 2.2.1 Allgemeines 2 2.2.2 Unterscheidung der Ausstriche bei den Plattenmethoden 3 2.2.3 Selektiv-Nährböden zur Bestimmung von coliformen und fäkalcoliformen Bakterien (E. coli) 4 2.2.3.1 Gerätschaften und Materialien 5 2.2.3.2 Oberflächenausstrich 8 2.2.3.3 Einmischverfahren (Plattengussverfahren) 9 2.2.3.4 Membranfiltration 9 2.2.3.5 Weitere Differenzierungen von coliformen und fäkalcoliformen Bakterien 10 2.3 MPN-Verfahren (Mehrfachansatz) 2.3.1 Allgemeines 11 11 2.3.2 Bestimmung von coliformen Bakterien und fäkalcoliformen Bakterien (E. coli) 13 2.3.2.1 Durchführung der Untersuchungen 13 2.3.3 MPN-Verfahren mit Miniaturverfahren zur Erfassung von E. coli 14 2.3.3.1 Allgemeines 14 2.3.3.2 Durchführung der Untersuchungen 15 2.3.4 Colilert-18®/Quanti-Tray®-Verfahren 17 2.3.4.1 Allgemeines 17 2.3.4.2 Durchführung der Untersuchungen 17 2.3.4.3 Prüfung biochemischer Merkmale von Mikroorganismen durch die Lange Bunte Reihe 2.3.5 Membranfiltationsverfahren 20 29 2.3.5.1 Allgemeines 29 2.3.5.2 Durchführung der Untersuchungen 32 2.3.6 Zusammenfassung der unterschiedlichen Nährböden 2.4 Mikrobiologische Referenzmaterialien 34 35 2.4.1 Durchführung der Kultivierung von Kontrollstämme 35 2.4.2 Einsatz der Gebrauchskulturen 35 2.5 Statistische Prüfverfahren 36 2.5.1 Statistik für die Qualitätssicherung in der Wassermikrobiologie 36 2.5.2 Grundberechnungen 36 2.5.2.1 Arithmetisches Mittel 36 2.5.2.2 Varianz, Standardabeichung und Variationskoeffizienten 37 3. Ergebnisse 38 3.1 Vergleich verschiedener Untersuchungsverfahren 38 3.1.1 Durchführung der Plattenmethoden 38 3.1.2 Durchführung der MPN-Verfahren 39 3.1.3 Ergebnisse der Untersuchungen auf coliformen Bakterien mit den Plattenmethoden 39 3.1.3.1 Differenzierungen der coliformen Bakterien von ChromocultColiformen-Agar, Endo-C-Agar und Desoxycholat-Agar 40 3.1.4 Ergebnisse der Untersuchungen coliformen Bakterien mit den MPN-Verfahren und Colilert®-18-Verfahren 43 3.1.4.1 Differenzierung der Colilert®-18-Verfahren mit der Langen Bunten Reihe 46 3.2 Ergebnisse der Untersuchungen auf Escherichia coli mit den Plattenmethoden 48 3.2.1 Differenzierung der Escherichia coli von Chromocult-ColiformenAgar, Endo-C-Agar und Desoxycholat-Agar 49 3.2.2 Ergebnisse der Untersuchungen auf Escherichia coli mit den MPN-Verfahren und Coliler®-18-Verfahren 51 3.3 Ergebnisse der Untersuchungen auf Escherichia coli und coliformen Bakterien mit dem Membranfiltrationsverfahren 53 3.4 Miniaturverfahren zur Zählung von Escherichia coli 55 3.5 Ergebnisse der quantitativen Erfassung von coliformen Bakterien mit den einzelnen Verfahren 57 3.5.1 Chromocult-Coliformen-Agar 57 3.5.1.2 Endo-C-Agar 57 3.5.1.3 Desoxycholat-Agar 58 3.5.1.4 MPN-Verfahren und Colilert®-18-Verfahren 59 3.5.2 Ergebnisse der quantitativen Erfassung von Escherichia coli mit den einzelnen Verfahren 60 3.5.2.1 Desoxycholat-Agar 60 3.5.2.2 Endo-C-Agar 61 3.5.2.3 Fluorocult-ECD-Agar 61 3.5.2.4 Chromocult-Coliformen-Agar 61 3.5.2.5 MPN-Verfahren und Colilert®-18-Verfahren 62 3.5.2.6 Membranfiltrationsverfahren zur quantitativen Erfassung von Escherichia coli und coliformen Bakterien 3.5.2.7 Miniaturverfahren zur Zählung von Escherichia coli 3.6 Statistische Prüfverfahren zur quantitativen Erfassung der Ergebnisse 62 63 64 3.6.1 Anwendung statistischer Prüfverfahren auf die Ergebnisse der Untersuchungen mit coliformen Bakterien 3.6.2 Ergebnisse der E. coli mit den statistischen Prüfverfahren 64 65 3.7 Untersuchungen von Umweltproben 66 3.8 Vergleich von Ergebnissen der Alster- und Elbeproben 67 3.8.1 Vergleich der Alsterproben mit den MPN-Verfahren 67 3.8.2 Vergleich der Elbeproben mit verschiedene Verfahren 68 3.8.2.1 Vergleich der Elbeproben aus der Kleine Elbe 68 3.8.2.2 Vergleich der Elbeproben aus der Großen Elbe 69 4. Schlussfolgerungen 4.1 Analytische Qualitätssicherung für coliforme Bakterien 70 70 4.2 Analytische Qualitätssicherung für fäkalcoliforme Bakterien (E. coli) 71 4.3 Bewertung der Bestimmungsmethoden 72 4.4 Zusammenfassung 74 4.5 Literaturverzeichnis 76 Kapitel 1: Einleitung 1.Einleitung 1.1 Bakteriologische Wasseruntersuchung Die bakteriologische Untersuchung hat den Zweck, festzustellen, wie viele Bakterien einer Wasserprobe auf einem Nährboden bestimmter Zusammensetzung zur Vermehrung zu bringen sind. Zur Erhaltung einer bestimmten Gewässerqualität sind nationale Gesetze und Verordnungen sowie internationale Richtlinien erlassen worden. Die EG-Richtlinien enthalten Qualitäts- bzw. Gewässergüteziele, die aquatische Schutzgüter sichern, wenn die Grenzwerte eingehalten werden. In der EG-Richtlinie 76/160/EWG vom 08.12.1975 über die Qualität der Badegewässer werden z. B. für die Nutzung von natürlichen Gewässern als Badegewässer bakteriologisch-hygienische Anforderungen gestellt (Tab. 1.1). In Deutschland gilt auf der gesamtstaatlichen Ebene das Wasserhaushaltsgesetz (WHG). Das WHG dient als Rahmengesetz, durch das der Bund einen Regelungsrahmen vorgibt, den die Länder durch eigene Gesetze (Landeswassergesetze) auszufüllen haben. In den einzelnen Bundesländern führte dies z. B. zum Erlass von Badegewässerverordnungen. Die Überwachung des Wasserrechtes obliegt den zuständigen Behörden. [1] Tabelle 1.1: Leit- und Grenzwerte der EG-Richtlinie über die Qualität der Badegewässer vom 08.12.1975 bei denen die Werte nicht überschritten werden dürfen. Parameter Volumen Leitwert Grenzwert Coliforme 100 ml 500 (80) 10 000 (95)1 Fäkalcoliforme 100 ml 100 (80) 2000 (95) Zur qualitativen und quantitativen Bestimmung von coliformen und fäkalcoliforme Bakterien Escherichia coli wurden daher verschieden bewährte und neuartige Verfahren eingesetzt. Neben verschiedenen Palettenverfahren wie zum Beispiel Desoxycholat-Agar-Verfahren, Chromocult-Coliformen-Agar, Endo-C-Agar, Fluorocult-ECD-Agar wurde die „MostProbable-Number“-Methode (MPN) als Dreifachansatz angewendet. Darüber hinaus wurde ein „MPN“-Miniaturverfahren der Firma BIO RAD, bei dem die Probe mit sogenannten Mikrotiterplatten untersucht wird, eingesetzt. Ein weiteres Verfahren ist der Membranfiltrationsverfahren, die als Alternativverfahren für das Colilert-18-Verfahren zugelassen ist. Die Zielsetzung dieser Arbeit umfasst somit nicht nur auf die Einführung einer anerkannten qualitätssichernden Maßnahmen für den Bereich der bakteriologischen Wasseruntersuchung, sonder auch den Vergleich verschiedener Methoden mit dem Ziel, die optimale Bestimmungsmethode zu finden. 1 Probenzahlen in % 1 Kapitel 2: Material und Methoden 2. Methoden zur Bestimmung von coliformen und fäkalcoliformen Bakterien 2.1. Definition coliformer und fäkalcoliformer Bakterien Der direkte Nachweis von Krankheitserregern ist aufgrund der Vielzahl der Organismen und ihrer meist geringen Dichte zeitlich und arbeitstechnisch sehr aufwendig und in den meisten Fällen nicht durchführbar. Deshalb führt man bei der bakteriologischen Gewässerüberwachung in der Regel nicht unmittelbar den direkten Nachweis von potentiell pathogenen Organismen durch, sondern den von leichter erfassbaren Indikatorkeimen. Es handelt sich dabei um Bakterien, die aus dem Darm von Menschen und warmblütigen Tieren stammen und mit den Fäkalien bzw. dem gereinigten Abwasser in die Gewässer gelangen. Als Fäkalindikatoren werden die coliformen Bakterien (Enterobacter, Klebsiella, Citrobacter, Escherichia) und insbesondere fäkalcoliforme Bakterien der Art Escherichia coli herangezogen. Das Vorkommen von coliformen Bakterien kann jedoch nur als Hinweis auf eine fäkale Verunreinigung dienen, da Vertreter dieser Gruppe auch im Boden und im Oberflächenwasser leben und damit nicht zwangsläufig fäkalen Ursprungs sein müssen. Eine eindeutige Aussage kann somit nur über den Nachweis des obligaten Darmbewohners Escherichia coli als Indikator einer fäkalen Verunreinigung gemacht werden. [1] Escherichia coli und coliforme Bakterien gehören zur Familie der Enterobacteriaceae. Sie sind sporenlose gramnegative Stäbchen, die Glucose und andere Kohlenhydrate unter Säureund Gasbildung metabolisieren. Die fakultativen Anaerobier sind auf den üblichen Nährmedien leicht anzüchtbar. [4] Die Verunreinigung von Gewässern durch Fäkalien und damit einhergehend mit Krankheitserregern kann zu einer weitgehenden Einschränkung der Nutzung führen. Betroffen sind dabei unter anderem die Trinkwassergewinnung oder die Landwirtschaft sowie Freizeit und Erholung des Menschen. 2.2 Plattenmethoden Bei der Plattenmethoden werden verschiedene Nährböden auf coliforme und fäkalcoliforme Bakterien untersucht. 2.2.1 Allgemeines Unter der Plattenmethode ist die Kultivierung von Bakterien in einem festen Nährmedium zu verstehen. Dieses feste Medium besteht aus Gelatine, Agar-Gel oder Natriumsilikat, das Nährstoffe und weitere selektive Substanzen enthält. Je nach Untersuchungsziel werden die Bakterien auf verschiedenen Nährböden unterschiedlich kultiviert. Man unterscheidet hauptsächlich folgende Medien: 2 Kapitel 2: Material und Methoden Selektivmedien, die das Wachstum einer bestimmten Gattung fördern und möglichst alle andere Arten hemmen, aber auch Anreicherungsmedien, mit denen das Wachstum einer Bakterienart in einer Mischprobe gegenüber anderen Keimen beschleunigt wird. Differenzierungsmedien zur Bestimmung mehrer Bakterienarten nebeneinander durch Bildung charakteristischer Unterschiede im Koloniewachstum. In der bakteriologischen Wasseruntersuchung sind vor allem selektive Nährböden von Bedeutung, deren Inhaltsstoffe und Zusammensetzung das Wachstum des nachzuweisenden Organismus fördern und gleichzeitig unerwünschte Begleitorganismen hemmen. Das Festmedium wird üblicherweise in einer sterilen Petri-Schale angewendet. Es wird mit einer geringen Menge an Probematerial beimpft und anschließend im Brutschrank bei einer konstanten Temperatur bebrütet. Nach einer bestimmten Inkubationszeit entwickeln sich durch die Vermehrung der Bakterien Kolonien. Jedes Bakterium braucht neben verschiedenen, oft spezifischen Nährstoffen eine bestimmte Temperatur zum optimalen Wachstum. Durch die Temperatur lassen sich bereits bestimmte Bakterien qualitativ differenzieren. So wird bei einer Methode zur Gewässeruntersuchung beispielsweise zur Bestimmung der coliformen Bakterien der Desoxycholat-Agar bei 37°C bebrütet, zur Bestimmung der fäkalcoliforme Bakterien wird die Temperatur auf 44°C erhöht. Somit wird die Tatsache genutzt, dass fäkalcoliforme Bakterien eine größere Thermotoleranz besitzen. Die eindeutige Identifizierung eines Bakteriums erfolgt durch Form, Größe und Farbe der Kolonien. Je nach Spezies können typische Kolonienformen entstehen. Durch den Zusatz von chromogenen Substanzen kann ein weiteres Erkennungsmerkmal geschaffen werden, da diese durch spezifische Stoffwechselprodukte der Bakterien in Farbkomplexe umgesetzt werden und die Kolonien anfärben. 2.2.2 Unterscheidung der Ausstriche bei den Plattenmethoden Bei der Plattenmethode läßt sich eine Vielzahl von unterschiedlichen Verfahren zur Beimpfung unterscheiden. Oberflächenausstrich Beim Ausplattieren wird das Inokulum (0,1-0,5 ml) mit einer Impfschlinge auf dem festen Nährboden ausgestrichen. Somit wachsen die Bakterien nur auf der Oberfläche des Nährbodens. Diese Methode wird immer dann eingesetzt, wenn es sich um einen Indikator-Agar handelt, bei dem eine eindeutige Farbreaktion mit den Kolonien stattfinden muss. Abweichende Färbungen entstehen vor allem bei eingemischten Kolonien, da beispielsweise unter der Oberfläche andere Sauerstoffverhältnisse herrschen können. Verdünnungsausstrich (fraktionierter Ausstrich) Benötigt man einzelne, gut isolierte Kolonien, die aus einer Probe mit hoher Keimdichte entstehen sollen, wird das Inokulum schrittweise „verdünnt“, so dass in einigen Zonen der Platte einzelne Kolonien zurückbleiben. 3 Kapitel 2: Material und Methoden Einmischverfahren Die Kolonien wachsen besser, wenn man zunächst das Inokulum in die leere Petri-Schale pipettiert und anschließend mit zuvor verflüssigtem Nährboden übergießt. Dieses Einmischverfahren ist vor allem bei beweglichen Bakterien anzuwenden, da diese sonst an der Oberfläche schwärmen und einzelne Kolonien schwer zu erkennen sind. Auch bei hoher Keimdichte der Proben bietet sich dieses Verfahren an, da die eingeschlossenen Keime wesentlich kleinere und kompaktere Kolonien bilden als auf der Oberfläche. Dadurch können viele Kolonien deutlich erkennbar nebeneinander wachsen, ohne dass diese zusammentreffen und zu größeren Einheiten zusammenwachsen. Membranfiltration Bei der bakteriologische Untersuchungen wird das Inokulum durch einen bakterienundurchlässigen Membranfilter (Porengröße 0,45 µm, ∅ 50mm) mittels eines Filtrationsgerätes filtriert. Das Filter wird auf einen geeigneten Agar gelegt und inkubiert. Aus dem Nährboden diffundieren die Nährstoffe durch die Porenstruktur des Filters, so dass sich einzelne Organismen vermehren können. Das Auszählen der Kolonien wird durch eine entsprechende Farbe des Filters und durch das eingedruckte Gitternetz erleichtert. Zur quantitativen Bestimmung der Keimzahl werden die Kolonien unter einem Keimzählgerät mit 6-8facher Vergrößerung ausgezählt. Das Ergebnis der Koloniezählung wird in „Koloniebildenden Einheiten pro Milliliter“ (KBE/ml) angegeben. Die Zahl der Kolonien pro Platte sollte zwischen 30 und 300 liegen. Bei hoher Keimdichte zählt man nur einige zufällig ausgewählte Quadrate im Sichtfeld und bestimmt mit dem Mittelwert dieser Einzelzählungen die Gesamtzahl pro Platte. Das Fachamt für Umweltuntersuchungen Hamburg gibt zur Auswertung der Koloniezahl vor, dass bei starkem Bewuchs der Platte fünf zufällig ausgewählte Quadrate (á 1 cm2) ausgezählt werden. Der aus diesen fünf Einzelzählungen gebildete Mittelwert wird dann mit einem Faktor multipliziert, so dass man die Gesamtkoloniezahl erhält. Ist die Keimdichte auf der Platte zu hoch (>>300/Platte) muss der Ansatz mit höheren Verdünnungen wiederholt werden. Die Verdünnung erfolgt in der Regel in Zehnerpotenzen. 2.2.3 Selektiv-Nährböden zur Bestimmung von coliformen und fäkalcoliformen Bakterien (E.coli) Es werden bestimmte Selektiv-Nährböden wie Desoxycholat-Agar, Endo-C-Agar, Chromocult-Coliformen-Agar und Fluorocult-ECD-Agar für die Bestimmung von coliformen und fäkalcoliformen Bakterien angewendet. 4 Kapitel 2: Material und Methoden 2.2.3.1 Gerätschaften und Materialien Zur Durchführung der verschiedenen Plattenmethoden und für die Zubereitung der Nährboden werden folgende Materialien und Geräte benötigt: Sterile Petri-Schalen (BIOPUR, Art-Nr. 391K3660) Elektrische Heizplatte Wasserbad Brutschränke Memmert, thermostatisiert, 37°C und 44°C Eppendorf-Pipette 1 ml, 100 µl, 10 µl Sterile Pipettenspitzen 10-1000 µl (z. B. EPPENDORF BIOPUR) Einmal-Impfösen, steril, Standard 10 µl (VWR, Art. Nr.: 631Q2211) Membranfilter 0,45µm ( ME 25/21, SCLEICHER & SCHUELL) Vakuumpumpe (VACU USOG, Firma GERHARDT) Einmalbecher Waage (SARTORIUS BP 8100) Kolonienzählgerät mit Lupe (Keimzählgerät WTW BZG 28) Oxidase-Teststreifen, MERCK (Art. Nr.: 1.13300) Kovac´s Reagenz für Indol-Test, MERCK Art. Nr.: 109293 Desoxycholat-Agar Dieser spezielle Desoxycholat-Citrat-Nährboden der Firma OXOID (Art. Nr.: CM 163) ist zur Isolierung und Keimzählung von coliformen und fäkalcoliformen Bakterien (Escherichia coli) in Milch, Speiseeis und Wasser entwickelt. Er wird im Fachamt für Umweltuntersuchungen Hamburg zum routinemäßigen Nachweis von coliformen und fäkalcoliformem Bakterien (E. coli) in Oberflächengewässern verwendet. Zusammensetzung der Bestandteile des Nährbodens in g je Liter: Pepton 10,0 Laktose 10,0 Natriumdesoxycholat 1,0 Natriumchlorid 5,0 di-kaliumhydrogenphosphat 2,0 Eisen(III)-Citrat 1,0 Natriumcitrat 1,0 Neutralrot 0,3 Technischer Agar 15,0 5 Kapitel 2: Material und Methoden Die Laktose dient den coliformen Bakterien als fermentierbare Kohlenstoffquelle. Der Abbau von Laktose zu Säure wird durch einen Farbumschlag des pH-Indikators Neutralrot nach rosa und durch einen gleichzeitigen Präzipitalhof von Gallensäure angezeigt. Die Kolonien von Escherichia coli erscheinen somit rot und haben einen Präzipitalhof. Die Selektivität des Agars wird durch Desoxycholat und Citrat erhöht, wodurch die grampositive Begleitflora gehemmt wird. Die Selektivität wird bei anderen Desoxycholat-Nährböden mit größeren Anteilen an Natriumdesoxycholat noch gesteigert. Endo-C-Agar Es handelt sich um einen Selektivnährboden nach ENDO(1904) zum Nachweis von coliformen und fäkalcoliforme Bakterien (Escherichia coli) in den verschiedensten Materialien. Der Endo-C-Agar von MERCK (Art. Nr.: 1.10684.0500) hat folgende Zusammensetzung in g je Liter: Pepton 10,0 Laktose 10,0 di-kaliumhydrogenphosphat 2,5 Natriumsulfit, wasserfrei 3,3 Pararosanilin (Fuchsin) 0,3 Agar-Agar 12,5 Natriumsulfit und Fuchsin hemmen grampositive Bakterien. E. coli und Coliforme verwerten Laktose unter Bildung von Aldehyd und Säure. Aldehyd setzt Fuchsin aus der Fuchsin-SulfidVerbindung frei, welches dann die Kolonien rot anfärbt. Bei E. coli ist diese Reaktion so intensiv, dass das Fuchsin auskristallisiert und dadurch den Kolonien einen grünschimmernden, beständigen Metallglanz (Fuchsinglanz) verleiht. Die Coliformen zeigen keinen Fuchsinglanz. Fuchsin gilt als potenziell krebserzeugend. Deshalb darf man Farbstoff und Nährboden nicht mit der Haut in Berührung bringen. Durch Sauerstoffeinwirkung wird der aufgegossene Nährboden infolge der Oxidation des Sulfits allmählich rot und damit unbrauchbar. Selbst in Dunkelheit und bei Kühlschranktemperaturen ist er nur wenige Tage haltbar. Chromocult-Coliformen-Agar Der von MERCK entwickelte Coliformen-Agar (Art. Nr.: 1.10426.0100/0500) gehört zur Produktgruppe der Chromocult-Trockennährböden. Die Bestimmung von Bakterien durch diese speziellen Nährböden erfolgt mittels chromogener Substrate. Sie ermöglichen eine schnelle Identifizierung von Bakterien durch den Nachweis charakteristischer Enzyme. Beim Chromocult-Coliformen-Agar handelt es sich um einen Selektivagar zum gleichzeitigen Nachweis von coliformen und fäkalcoliformen Bakterien (E. coli) bei der bakteriologischen 6 Kapitel 2: Material und Methoden Untersuchung von Wasser und Lebensmitteln. Der Coliformen-Agar setzt sich wie folgt zusammen in g je Liter: Pepton 3,0 Natriumchlorid 5,0 di-Natriumhydrogenphosphat 2,7 Natriumpyruvat 1,0 Natrium-di-hydrogenphosphat 2,2 Tryptophan 1,0 Agar-Agar 10,0 Sorbit 1,0 Tergitol-7 0,15 Chromogenmischung 0,4 (Enthält u.a. Salmon-GAL und X-Glucuronid) Durch die Kombination von geeigneten Peptonen, Pyruvat, Sorbit und Phosphatpuffer wird ein schnelles Anwachsen auch von subletal geschädigten coliformen Bakterien gewährleistet. Der Gehalt an Tergitol-7 hemmt weitgehend das Wachstum grampositiver und einiger gramnegativer Bakterien, ohne Einflüsse auf das Wachstum der Coliformen zu haben. Der simultane Nachweis von Coliformen und E.coli wird durch die neue Kombination von zwei chromogenen Substanzen möglich. Das Substrat Salmon-GAL wird durch die Coliforme charakteristische ß-D-Galactosidase gespalten und bewirkt eine rosa-rote Färbung der Coliformen-Kolonien. Der Nachweis der für E. coli charakteristischen ß-D-Glucuronidase erfolgt über das Substrat X-Glucuronid, das eine Blaufärbung der positiven Kolonien bewirkt. Da E. coli sowohl Salmon-GAL als auch X-Glucuronid spaltet, färben sie sich dunkelblauviolett. Somit sind sie leicht von den übrigen, rosaroten coliformen Bakterien zu differenzieren. Fluorocult-ECD-Agar Der von MERCK für den Nachweis von E. coli entwickelte Fluorocult-ECD-Agar (Art.Nr. 1.04038.0100/0500) gehört zur Produktgruppe der Fluorocult-Trockennährböden. Der Nährboden wird in der üblichen Weise mittels Oberflächenausstrich beimpft. Der Nährboden besteht aus (Angaben in g/l): Pepton aus Casein 20,0 Laktose 5,0 Natriumchlorid 5,0 7 Kapitel 2: Material und Methoden Gallesalzmischung 1,5 di-Kaliumhydrogenphosphat 4,0 Kaliumdihydrogenphosphat 1,5 Agar-Agar 15,0 Tryptophan 1,0 4-Methylumbelliferyl-ß-D-glucuronid 0,07 Die Gallesalzmischung diese E. coli-Direkt-Agars hemmt weitgehend die nicht obligat im Darm vorkommende Begleitflora. Die Kolonien, die durch Spaltung des 4Methylumbelliferyl-ß-D-glucuronids) hellblau fluoreszieren, werden mittels einer UV-Lampe abgelesen. Zusätzlich wird durch eine positiven Indolprobe, die eine Rotfärbung hervorruft, die Anwesenheit von E.coli bestätigt. Der Fluorocult-ECD-Agar wurde als Trockensubstanz geliefert und im Labor angesetzt. Es werden 53,1 g des Pulvers eingewogen und in einem Liter destillierten Wasser gelöst. Die Lösung wird mit Hilfe eines pH-Meters auf pH 7,0 eingestellt und 15 Minuten bei 121°C autoklaviert. Nach dem Abkühlen (ca. 45-50°C) der Lösung im Wasserbad wird die Lösung in sterilen Petri-Schalen gegossen. Bei den vier verwendeten Nährböden wurden zwei unterschiedliche Beimpfungsmethoden angewendet. Die jeweilige Methode ergibt sich aus den in der Literatur empfohlenen Anwendungsverfahren. Bei Nährböden, für die mehrere Beimpfungsmethoden in Betracht kommen, wurde entweder die im Labor bereits bewährte Methode übernommen oder in Vorversuchen das geeignetste Verfahren ermittelt. 2.2.3.2 Oberflächenausstrich Im Oberflächenausstrich wurden folgende Nährböden beimpft: Endo-C-Agar (coliforme Bakterien bei 37°C, E. coli bei 44°C) Chromocult-Coliformen-Agar (coliforme Bakterien und E. coli bei 37°C) Fluorocult-ECD-Agar (E. coli bei 44°C) Die fertigen Platten mit dem festen Nährboden für Endo-C-Agar und ChromocultColiformen-Agar werden gekühlt vorrätig gehalten. Vor der Benutzung werden die Nährböden mit geöffnetem Deckel im Brutschrank bei 37°C für ca. 15 Minuten vorgewärmt. Dadurch wird eventuell in den Schalen vorhandenes Kondenswasser entfernt und der Nährboden eignet sich anschließend besser zum Ausstreichen der Keime. Die vorgewärmten Platten werden mit einem bestimmten Volumen der Probe befüllt. Die geeignetste Probenmenge wurde bei den Vorversuchen ermittelt. Bei der Endo-CAgarplatte konnte kein großes Volumen gewählt werden, da der Nährboden für größere Volumen sich nicht als „saugfähig“ festgestellt hat. Aber bei der Fluorocult-ECD-Agarplatte 8 Kapitel 2: Material und Methoden war wiederum ein kleines Volumen als „nicht geeignet“ gefunden. Da bei den Vorversuchen kaum Kolonien abzulesen waren. Für den Chromocult-Coliformen-Agar haben sich beide Probenmengen als geeignet herausgestellt. Direkt im Anschluss werden die vorgewärmten Platten mit der flüssigen Probe beimpft und mit Hilfe eines Spatels ein gleichmäßiger Ausstrich durchgeführt. Durch Drehen der Platte im Licht kann man die Verteilung der Flüssigkeit auf der Platte beobachten. Nachdem die ausgestrichenen Platten getrocknet sind, werden sie mit dem Deckel nach unten in Brutschränke für 37°C (Endo-C-Agar, ChromocultColiformen-Agar) und 44°C (Endo-C-Agar, Fluorocult-ECD-Agar) gestellt. 2.2.3.3 Einmischverfahren (Plattengussverfahren) Das Einmischverfahren wurde nur bei Desoxycholat-Agar für coliforme Bakterien bei 37°C und fäkalcoliforme Bakterien bei 44°C angewendet. Um die Ergebnisse besser zu präsentieren und eine Grundlage für einen Vergleich zu bilden wurden bei diesem Verfahren Parallelansätze durchgeführt, d. h. mit eine beliebige Probe A wurde das Einmischverfahren mit Desoxycholat-Agar, 4x als Parallelansatz durchgeführt. Der Nährboden ist in Kulturröhrchen abgefüllt und wird kühl gelagert. Für jede Platte werden zwei Kulturröhrchen in einem Emaillebecher auf einer elektrischen Heizplatte solange aufgekocht, bis sich der gesamte Inhalt verflüssigt hat. Anschließend wird das Röhrchen im Wasserbad auf 45-48°C abgekühlt. Von der gut homogenisierten, geschüttelten Probe wird ein definiertes Volumen in eine sterile Petri-Schale gegeben. Der flüssige, auf 45-48°C abgekühlte Agar eines Kulturröhrchens wird nun in die Petri-Schale gegossen. Durch Bewegen der Schale wird der Agar mit der Probe sorgfältig vermischt. Nach Erstarren dieser Mischung wird die Petri-Schale mit dem zweiten verflüssigtem Agar aufgegossen. Nach Erstarren dieser Schicht wird die Petri-Schale mit dem Deckel nach unten gerichtet in die Brutschränken gegeben. 2.2.3.4 Membranfiltration Die Membranfiltration wurde beim Tergitol-7-Agar angewendet. Bei der Membranfiltrationsverfahren werden die steril gelieferten Membranfilter auf die Filtrationsanlage gelegt. Es ist darauf zu achten, dass zwischen den einzelnen Arbeitsgängen die Filtrationsanlage per Flammensterilisation entkeimt wird. Das Inokulationsvolumen von 0,1 ml Referenzsuspension wird mit sterilem Wasser auf 100 ml gefüllt. Dieser Vorgang wird in einem sterilen Erlenmeyerkolben vorbereitet. Nach der Filtration wird das Filter mit einer sterilen Pinzette auf den Agar gelegt. Die Platten werden ebenfalls mit dem Deckel nach unten gerichtet in den Brutschrank bei 37°C gestellt (siehe Kapitel 2.3.5.2). 9 Kapitel 2: Material und Methoden 2.2.3.5 Weitere Differenzierung von coliformen und fäkalcoliformen Bakterien Eine weitere Bearbeitung und Bewertung der relativ schwach selektiven Desoxycholat-Platten erfolgt durch die Identifizierung der Kolonien mit einer kleinen „Bunte Reihe“. Während der experimentellen Tätigkeiten ist die Koloniezahl eine von den höchsten Werten, die eine Vermutung auf falsch-positive Ergebnisse liefert. Deshalb wird für die weiteren Proben eine Auswertung mit biochemischen Reaktionen „Bunte Reihe“ beschlossen. Diese sind bei allen 4 Parallelansätzen durchzuführen. Die Bunte Reihe setzt sich aus Glucose-Röhrchen, Laktose-Röhrchen, Indol-Röhrchen und Citrat-Röhrchen zusammen. Nach der Bebrütungszeit der Desoxycholat-Agarplatten werden die Kolonien mit einen Keimzählgerät ausgewertet und dokumentiert. Dann werden die einzelnen Kolonien (neutralrot-rot) mit ausgeglühter Impfnadel in einem Indol-Röhrchen (Tryphtophan-Bouillon) suspendiert und 3-6 h2 bei 36°C bebrütet. Von dieser Flüssigkeitskultur werden die zur weiteren biochemischen Identifizierung dienenden Nährböden und Nährlösungen beimpft. Das Glucose-Röhrchen wird bei 44°C, die anderen drei Röhrchen bei 36°C für 24 h bebrütet. Glucose-Röhrchen Positiv: Gasbildung und Gelbfärbung des grünen Agars, sonst negativ. Laktose-Röhrchen Positiv: Gasbildung und Gelbfärbung, sonst negativ. Indol-Röhrchen Positiv: Abbau des Tryptophans. Die farblose Lösung wird ca. 0,2 ml Kovacs-Reagenz überschichtet. Das zugefügte Reagenz färbt rot, sonst negativ. Citrat-Röhrchen Positiv: Blaufärbung des grünen Agars, sonst negativ. Oxidase-Reaktion Mit eine sterilen Impföse wird eine kleine Menge der verdächtigen Kolonien (rot-rosa) auf der markierten Stelle des Oxidasen-Teststreifens verrieben. Wird an der Stelle das Teststäbchen blau bis blau-violett, ist die Reaktion positiv, sonst ist sie negativ. Dieser Oxidase-Test wurde auch bei der Endo-C-Agarülatte durchgeführt und die Ergebnisse dokumentiert. 2 Stunden 10 Kapitel 2: Material und Methoden Die Zusammensetzungen der Nährböden und Nährlösung werden in 2.3.4.3 dokumentiert. Dort folgt eine „Lange Bunte Reihe“ mit 36 Komponenten. 2.3 MPN-Verfahren (Mehrfachansatz) 2.3.1 Allgemeines Das Most-Probable-Number-Verfahren (MPN) ist eine Methode zur Keimzahlbestimmung in Flüssigmedium, bei der das Bakterienwachstum im Mehrfachansatz bei verschiedenen Verdünnungen Rückschlüsse über die vermeintlich in der Probe enthaltene Keimzahl zulässt. Die Grundlage des Verfahrens ist ein flüssiges Selektivnährmedium, in dem durch bestimmte Substrate bei Anwesenheit eines Bakteriums eine spezifische enzymatische Reaktion stattfindet, die zu einem optischen Erkennungsmerkmal führt. Dies kann zum Beispiel ein Farbumschlag der Nährlösung nach entsprechender Inkubationszeit oder ein fluoreszierendes Reaktionsprodukt sein. Zur Bestimmung der wahrscheinlichsten Keimzahl werden parallele Verdünnungsreihen von einer Probe erstellt. Bei der Auswertung werden die jeweils positiven Röhrchen in den einzelnen Verdünnungsstufen gezählt und die MPN-Kennzahl aufgestellt. Mit Hilfe einer Statistiktabelle kann man aufgrund der vorliegenden Röhrchenkombination die wahrscheinlichste Keimzahl ablesen. Beim MPN-Verfahren wird demnach nicht direkt die sichtbare Koloniezahl bestimmt, sondern die wahrscheinlichste Keimzahl statistisch ermittelt. Die statistische Sicherheit der Ergebnisse nimmt mit der Anzahl der Parallelansätze zu. Je mehr Parallelansätze verwendet werden, desto höher ist die Genauigkeit der Tabellenwerte. Die Anwendung der MPN-Methode kann in verschiedenen Fällen von Vorteil sein. Einerseits gibt es Bakterien, die nicht auf festen Medien kultiviert werden können und somit nur mit Flüssigmedien nachgewiesen werden können. Andererseits wird das Verfahren bevorzugt, wenn die Kinetik des Wachstums verschiedener Bakterien in der Probe stark variiert. Wenn zum Beispiel einige Keime sofort anfangen zu wachsen, sich ausbreiten und schließlich große Kolonien bilden, können dabei die Kolonien der Bakterien, die von Interesse sind und die sich erst später ausbilden, verdeckt werden. MPN-Verfahren mit 3er- Ansatz Bei z. B. 3 Parallelen führt ein Unterschied von einem positiven Röhrchen in der Kennzahl (3-3-0 und 3-3-1) bereits zu einer Verdopplung der Keimzahl (24 und 46 KBE/ml). Damit können Keimzahldifferenzen von weniger als 50% nicht quantitativ bestimmt werden. Dagegen ist z. B. bei 10 Parallelen die Differenz der Tabellenwerte zweier aufeinanderfolgender Kennzahlen wesentlich kleiner, es können Unterschiede von ca. 10% bestimmt werden. Die Auswertung der Ergebnisse erfolgt anhand der MPN-Statistiktabellen nach MC CRADY(siehe Anhang), die für Auswertungen von 3er- und 5er-MPN verwendet werden. Bei diesen mathematischen Ansätzen wird die Wahrscheinlichkeit berechnet, mit einer Anzahl 11 Kapitel 2: Material und Methoden bestimmter Volumina in verschiedenen Verdünnungsstufen eine gewisse Kombination an positiven und negativen Röhrchen zu erhalten. Die Tabelle von MC CRADY wird zur Auswertung der routinemäßigen Untersuchung der Oberflächengewässer mittels MPNMethode im Fachamt für Umweltuntersuchungen Hamburg verwendet. Die Anwendung der Tabelle von MC CRADY beinhaltet genaue Vorgaben in bezug auf die Verdünnungsstufen und Parallelansätze. Die Volumina, durch die bei gleichem Volumen der Nährlösung die einzelnen Verdünnungen erreicht werden, sind bei MC CRADY festgelegt. Die Tabelle gilt nur dann, wenn die erste Verdünnung (10-1) mit 1 ml, die zweite (10-2) mit 0,1 ml und die dritte(10-3) mit 0,01 ml angesetzt wird. Auch die Zahl der Parallelansätze ist nicht frei wählbar, sondern mit 3 oder 5 ebenfalls vorgegeben. Die Wahrscheinlichkeit für das Vorkommen einzelner Röhrchenkombinationen ist in Kategorie zwischen 1 (am wahrscheinlichsten) und 3 (wenig wahrscheinlich) angegeben. Im Einzelnen bedeuten die Kategorien folgendes: Kategorie 1: Am wahrscheinlichsten vorkommende Röhrchenkombinationen. Andere Kombinationen werden mit einer Wahrscheinlichkeit von höchstens 5% erhalten. Kategorie 2: Weniger wahrscheinlich als in Kategorie 1 vorkommende Röhrchenkombinationen. Andere Kombinationen als in Kategorie 1 und 2 werden mit einer Wahrscheinlichkeit vom höchsten 1 % erhalten. Kategorie 3: noch weniger wahrscheinlich als in Kategorie 2 vorkommende Röhrchenkombinationen. Andere Kombinationen als in Kategorie 1 bis 3 werden mit einer Wahrscheinlichkeit von höchstens 0,1 % erhalten. Beispiel: Oberflächengewässer für eine beliebige Probe A Bei einem Oberflächengewässer und einem MPN-Ansatz mit 3 Parallelansätzen d.h. 9 Kulturröhrchen, hat sich für beliebige Probe A folgendes Schema ergeben: Tabelle 2.1: Ermittlung der MPN-Kennzahl • = positive Röhrchen Impfvolumen[ml] Verdünnungen 1 1:10 0,1 1:100 0,01 1:1000 1 • • • Parallelansätze 2 3 • • • • - Positive 3 3 1 Um die MPN-Kennzahl zu ermitteln, wird diejenige Verdünnungsreihe für die letzte Ziffer der Kennzahl ausgewählt, in der noch positive Röhrchen zu finden sind. Das wäre in diesem Fall ein MPN-Kennzahl von 3-3-1 (Tab.: 2.1). In der Statistiktabelle von MC CRADY für 3 Parallelansätze findet man die entsprechend dieser speziellen Zahlenkombination wahrscheinlichste Keimzahl. In diesem Beispiel würde sich aus der entsprechende Tabelle ein Wert von 4600 Keimen pro 100 ml, beziehungsweise 1 ml der Probe entsprechen 46 Keime. 12 Kapitel 2: Material und Methoden 2.3.2 Bestimmung von coliformen Bakterien und fäkalcoliformen Bakterien (E. coli) Zur quantitativen Bestimmung der Keimzahl von Escherichia coli mit Hilfe der MPNMethode wurde Fluorocult-Laurylsulfat-Bouillon verwendet. Der Nährboden von MERCK (Art.-Nr.: 1.12587.0100/0500) entspricht der DIN-Norm 10110 zur Untersuchung von Milch, den Vorschriften nach § 35 LMBG (06.00/36) zur Untersuchung von Lebensmitteln und dem ISO Standard 6391 (1996) zur Untersuchung von Milch und Milchprodukten. Weiterhin wird die MUG-Laurylsulfat-Bouillon als geeignete Methode von Gesamtcoliformen und Fäkalcoliformen nach der Badegewässerrichtlinie 76/160/EWG empfohlen. Zur Differenzierung der Gesamtcoliformen und der Fäkalcoliformen wird ein fluoreszenzoptischer Test durchgeführt. Das 4-Methylumbelliferyl-ß-D-Glucuronid wird nur von den Fäkalcoliformen (E. coli) gespalten und das Spaltprodukt Methylumbelliferon entsteht. Diese Substanz erzeugt Fluoreszenz im UV-Licht bei 366 nm. Die MUGLaurylsulfat-Bouillon wird insbesondere für die Most-Probable-Number-Methode (MPN) eingesetzt. Der Nährboden enthält folgende Bestandteile in g/l: Tryptose 20,0 Laktose 5,0 Dikaliumhydrogenphosphat 2,75 Laurylsulfat-Natriumsalz 0,1 L-Tryptophan 1,0 4-Methylumbelliferyl-ß-D-Glucuronid(MUG) 0,1 Der Gehalt an Laurylsulfat hemmt weitgehend das Wachstum von Begleitorganismen, insbesondere Pseudomonaden. Zum Nachweis der Gesamtcoliformen werden die Kulturröhrchen mit Gärröhrchen nach DURHAM versehen. Nach einer Inkubationszeit von 48 h bei 37° C führt die Laktosegärung der Gesamtcoliformen zur Gasbildung im DURHAMRöhrchen. 2.3.2.1 Durchführung der Untersuchungen Bei der Durchführung der MPN-Methode wurden folgende Materialien und Geräte benötigt: Brutschränke 37°C Eppendorf-Pipetten 1 ml, 100µl, 10µl Sterile Pipettenspitzen 1 ml, 100 µl (EPPENDOEF BIOPUR) Sterile Pipettenspitzen 10µl (EPPENDORF EUROTIPS) Reagenzständer UV-Lampe 366 nm 13 Kapitel 2: Material und Methoden Für das Most-Probable-Number-Verahren wurden die Kulturröhrchen für die Proben A 4x als Parallelansatz vorbereitet, d.h. für Probe A wurde jeweils 36 Röhrchen mit der flüssigen Bouillon in drei Verdünnungsreihen zu je 3 Röhrchen im Reagenzständer aufgestellt. Die drei Verdünnungen wurden mit 1:10, 1:100 und 1:1000 festgelegt, dementsprechend Probenvolumina von 1 ml, 0,1 ml und 0,01 ml pipettiert. Die Suspension wurde den drei Verdünnungsreihen entsprechend mit drei verschiedenen Pipetten zugegeben. Für jede Reihe wurde eine Pipettenspitze benutzt, mit deren Spitze man in die Bouillon eintaucht und die Flüssigkeit ausdrückt. Vor jedem Pipettiervorgang muss die Probe geschüttelt werden. Nach der Bebrütungszeit werden die Kulturröhrchen nach Gasbildung für coliforme Bakterien und Fluoreszenz für Escherichia coli untersucht. Die Auswertung erfolgt durch die Ermittlung der MPN-Kennzahl und das Ablesen des Ergebnisses aus der Statistiktabelle von MC CRADY. Dann wird von den einzelnen Parallelansätzen der Mittelwert gebildet. 2.3.3 MPN-Verfahren mit Miniaturverfahren zur Erfassung von E. coli 2.3.3.1 Allgemeines Diese miniaturisierte Methode zur Keimzahlbestimmung in Wasserproben beruht auf demselben Prinzip zur Ermittlung der wahrscheinlichsten Anzahl wie das herkömmliche MPN-Verfahren. Die Mikrotiterplatte besteht aus 96 Vertiefungen, in denen sich das Nährmedium in Form von Trockensubstrat befindet. Die Aufteilung der Vertiefungen auf der Platte ergibt sich zu 12 Reihen mit jeweils 8 Vertiefungen. Jede einzelne Vertiefung ist aufgrund eines auf der Platte eingravierten Planquadrates gekennzeichnet, so dass man die Einteilung in verschiedene Verdünnungsstufen problemlos vornehmen kann. Je nach der zu erwartenden Keimzahl werden die 96 Vertiefungen in 2, 4 oder 6 Verdünnungsstufen unterteilt. Die Wahl der geeigneten Probenverdünnung lässt sich anhand der Probenherkunft in drei Kategorien einteilen (Tab.: 2.2). Tabelle 2.2: Verdünnungsstufen in Abhängigkeit der Keimzahl bei Verwendung von Mikrotiterplatten Art der Probe Anzahl der Verdünnungsstufen Badegewässer 2 Oberflächengewässer 4 Abwässer 6 Anzahl der Vertiefungen je Verdünnungen 64 für 1:2 32 für 1:20 Jeweils 24 für 1:2, 1:20, 1:200 und 1:2000 Jeweils 16 für 1:2 bis 1:200 000 14 Messbereich [Keimzahl/ml] 15∗10-2 – 3,5∗102 40∗10-2 – 3,2∗104 60∗10-2 – 6,7∗106 Kapitel 2: Material und Methoden Zur Bestimmung der wahrscheinlichsten Keimzahl in der Probe werden Statistiktabellen für die einzelnen Anwendungsbereiche vom Hersteller BIO RAD mitgeliefert. Dabei wird zu jeder Kennzahl zusätzlich das 95%-Intervall als Vertrauensbereich angegeben. Die Anzahl positiver Reaktionen je Verdünnungsstufe ergibt die Kennzahl. Bei mehr als drei Verdünnungsstufen sollte die dreistellige Kennzahl, wenn möglich in der dritten Verdünnung keine Positiven mehr haben, also auf null enden. Beispiel: Oberflächengewässer für eine beliebige Probe A Bei Oberflächengewässer werden zwei Verdünnungsstufen angewendet, da dass sich jeweils eine zweistellige Kennzahl ergibt. Zum Beispiel erhält man folgende Werte: Verdünnung 1:2: 25 positive Vertiefungen von 64 Verdünnung 1:200: 3 positive Vertiefungen von 32 Es ergibt sich daraus die Kennzahl 25/3. Aus der Statistiktabelle für zwei Verdünnungen lassen sich folgende Werte ablesen: Tabelle 2.3: Darstellung der charakteristischen Zahl mit den unteren- und oberen Grenzwerten Charakteristische Zahl Statistische Tabellenwert Untere Grenzwert Obere Grenzwert 25/64 524 360 763 3/32 In diesem Beispiel erhält die Probe A 524 Keime/100 ml (95%-Vertrauensberiech: 360-763). Der Nachweis der Fäkalindikatoren (E.coli) erfolgt durch eine enzymatische Reaktion der Bakterien mit dem Substrat, das durch die Zugabe von Probe und Probenverdünnungspuffer rekonstituiert wird. Bei positiver Reaktion wird eine fluoreszierende Substanz freigesetzt. Der Nährboden wird als Trockensubstrat in den sterilen, gebrauchsfertigen Mikrotiterplatte der Firma BIO RAD GmbH (Art.-Nr.: 3553785) geliefert. Bei dem Trockensubstrat in den 96 Vertiefungen der Mikrotiterplatte handelt es sich um einen Nährboden, der MUG (4Methylumbelliferyl-ß-D-Glucuronid) enthält. Das Verfahren basiert auf demselben fluoreszenzoptischen Nachweis von E. coli, der bereits bei der MPN-Methode erläutert wurde (Kapitel 2.3.2). 2.3.3.2 Durchführung der Untersuchungen Für die Anwendung der Mikrotiterplatten wurden folgende Materialien verwendet: Mikrotiterplatte E.coli (Art.-Nr.: 3553785) der Firma BIO RAD GmbH Spezial-Probenverdünnungspuffer SDP (BIO RAD GmbH, Art.-Nr.3554280) Abdeckfolien (Zubehör Mikrotiterplatten) Sterile Röhrchen Vollpipette, 10 ml 15 Kapitel 2: Material und Methoden Eppendorf-Pipette, 1 ml Mehrkanal- (8er)- Pipette Sterile Pipettenspitzen 100 µl Reagenz-Reservoirs für Mehrkanalpipetten (V-Form, 60 ml, WILKE und WITZEL, Art.Nr.: 9510027) UV-Lampe 366 nm Zur Bestimmung der Keimzahl in Proben aus Oberflächengewässern ist ein Ansatz mit zwei Verdünnungsstufen ausreichend, da die zu erwartende Keimzahl im unteren Drittel des Messbereiches für zwei Verdünnungen liegt. Die Probe A, die zu einem besseren Vergleich der Verfahren dienen sollte, war kaum belastet, dass diese Probe beim Mikrotiterverfahren in Parallelansätzen nicht durchgeführt werden konnte. Deshalb sind andere beliebige Proben, die eine höhere Keimzahlwachstum haben untersucht. Sie werden wie folgt durchgeführt: Für jede Mikrotiterplatte werden bei zwei Verdünnungsstufen je zwei Röhrchen à 9 ml Probenverdünnungspuffer (SDP) benötigt. Dieser Verdünnungspuffer wird fertig geliefert und musste nicht selbst hergestellt werden. In das erste Röhrchen werden 9 ml der Probe gegeben. Die Vermischung der Flüssigkeiten im Röhrchen erfolgt durch mehrmaliges Aufziehen mit der Vollpipette. Von dieser ersten Verdünnungsstufe (1:2) wird 1 ml mit der EppendorfPipette entnommen und in das zweite SDP-Röhrchen gegeben (Verdünnung 1:20) Mit diesen Verdünnungen wird die Mikrotiterplatte beimpft. Mit der Acht-Kanal-Pipette werden z.B. die ersten 64 (8∗8) Vertiefungen mit je 200 µl der ersten Verdünnung befüllt, die letzten 32 (4∗8) Vertiefungen mit der zweiten Verdünnung. Anschließend wird die Platte mit einer Abdeckfolie überklebt und in den Brutschrank für 48 h bei 44°C gestellt. Ausgehend von 10 ml Probensuspension werden 9 ml mit 9 ml SDP vermischt und ergeben damit die erste Verdünnungsstufe für die Mikrotiterplatten (Verdünnung 1:2, 64 Vertiefungen). Von dieser ersten Verdünnung ausgehend wird 1 ml erneut mit 9 ml Probenverdünnungspuffer vermischt und es ergeben sich 10 ml der Verdünnung 1:20 für die zweite Verdünnungsstufe (32 Vertiefungen). Die Aufteilung der Proben in die Mikrotiterplatte mit der Mehrkanalpipette bereitet keine Schwierigkeiten, da die speziellen Reagenz-Reservoirs eine V-Form besitzen und dadurch selbst bei kleinen Flüssigkeitsmengen einen ausreichend hohen Flüssigkeitsspiegel gewährleisten. Tabelle 2.4: Vergleich von vorhandenem und benötigtem Suspensionsvolumen zur Beimpfung der Mikrotiterplatten Mikrotiterplatten: Vorhandenes Volumen Benötigtes Volumen 9 ml Suspension + 9 ml SDP 64∗0,2 ml = 18 ml 1. Verdünnung = 12,8 ml -1 ml für die 2. Verdünnung = 17 ml 1 ml Suspension (aus der 32∗0,2 ml 1.Verdünnung) + 9 ml SDP 2. Verdünnung = 6,4 ml = 10 ml 16 Kapitel 2: Material und Methoden 2.3.4 Colilert-18®/Quanti-Tray®-Verfahren 2.3.4.1 Allgemeines Der Colilert 18/Quanti-Tray-Verfahren ist ein Schnellverfahren für Wasserproben. Das Verfahren ermöglicht den endgültigen Nachweis von coliformen Bakterien und Escherichia coli in einem einzigen Anreicherungsschritt innerhalb von 18 Stunden. Die qualitative als auch die quantitative Auswertung erfolgt über die Beurteilung der Gelbfärbungen bzw. der Fluoreszenz. Verfahrensprinzip: Coliforme Bakterien metabolisieren innerhalb von 18 Stunden bei 36°C das farblose orthoNitrophenol-ß-D-Galaktopyranosid (ONPG), einen Indikatornährstoff, unter Abspaltung des gelben ortho-Nitrophenols. Escherichia coli ist zusätzlich in der Lage, 4-Methyl-Umbelliferyl-ß-D-Glukuronid (MUG), einen weiteren Indikatornährstoff, unter Abspaltung des fluoreszierenden 4-MethylUmbelliferons zu metabolisieren. Bei Anwesenheit von E. coli wird durch die Aktivität der ßGlucuronidase aus dem Substrat Methyl-umbelliferyl-ß-D-Glukuronid (MUG) das fluoreszierende 4-Methylumbelliferon freigesetzt. Die Fluoreszenz wird mittels einer UVLampe sichtbar gemacht. 2.3.4.2 Durchführung der Untersuchungen Für die Anwendung der Colilert-18/Quanti-Tray-Verfahren wurden folgende Materialien verwendet: IDEXX-Geräte, -Nährböden und –Testreagenzien Reaktionsgefäß mit Antifoam IDEXX-Bestellnr. 98 06160 00 Quanti-Tray-Sealer IDEXX-Bestellnr. 98 10896 00 Quanti-Tray-Einwegtrays IDEXX- Bestellnr. 98 21378 00 Quanti-Tray-2000 Einwegtrays (MPN=2419) IDEXX-Bestellnr. 98 21675 00 UV-Sichtkasten der Fa. IDEXX-Bestellnr. 98 21322 00 Gummimatte Quanti Tray IDEXX- Bestellnr. 98 21322 00 Gummimatte Quanti Tray 2000 IDEXX-Bestellnr. 98 09226 00 Quanti-Tray-/2000 Comperator IDEXX-Bestellnr. 98 09227 00 Colilert 18/200 Blisterpacks für 100 ml Wasserprobe Bestellnr. 98 21373 00 Einmal-Impfösen, steril, Standard 10 µl (VWR, Art. Nr.: 631Q2211) Steriles demineralisiertes Wasser, falls Verdünnungen erforderlich 17 Kapitel 2: Material und Methoden Brutschrank Memmert, thermostatisiert, (36±1)°C Kühlschrank Wasserfester Stift Die 100 ml Wasserprobe wird unter sterilen Bedingungen in das versehene 100 ml-ColilertKulturgefäß überführt. Unter dem Abzug wird der Inhalt einer Packung Colilert-18 (Pulver) vorsichtig dazugegeben. Nach Auflösen des Pulvers (ca. 15 Min.) wird der Ansatz in einen leeren, sterilen Quanti-Tray-Behälter überführt. Hierbei wird der Quant-Tray mit einer Hand angefasst und senkrecht gehalten, wobei die Seite mit den Vertiefungen zur Handfläche zeigen soll. Der obere Teil des Trays wird zusammengedrückt, so dass sich der Träger zur Handfläche hinbiegt. Der Tray wird geöffnet, indem die Folienlasche von der Seite mit den Vertiefungen abgezogen wird. Die vorbereitet Mischung aus Probe und Reagenzien wird direkt in den Tray gegossen, dabei ist eine Berührung der Folienlasche unbedingt zu vermeiden. Somit wird die Sterilität gesichert. Die mit der Probe gefüllten Tray wird auf die Gummi-Trägerunterlage das Quanti-TrayVersiegelungsgerät gestellt. Die Seite mit den Vertiefungen muss dabei nach unten weisen, damit sie in die Unterlage passt. Die Trägerunterlage wird in das Versiegelungsgerät geschoben bis es vom Transportmechanismus erfasst und ins Gerät gezogen wird. Innerhalb von 15 Sekunden wird der Tray versiegelt und auf der Rückseite des Gerätes ausgeworfen. Der Tray wird aus der Trägerunterlage entnommen und 18 h im Brutschrank bei 36 ± 1 °C inkubiert. Hauptsächlich wurde die Verdünnung von 1:10 gewählt. Nur für die Abwasserproben war die Verdünnungsstufe 1:100 sinnvoller. Die Verdünnungen wurden mit sterilem Wasser durchgeführt. Auswertung: Die Proben müssen exakt nach 18 Stunden ausgewertet werden. Nach Ablauf von 18 Stunden können andere heterotrophe Keime das Hemmsystem von Colilert-18 überwinden. Wenn dann eine Gelbfärbung bzw. Gelbfärbung und Fluoreszenz beobachtet wird, gilt dies nicht als positives Ergebnis. Um positive Reaktionen eindeutig von negativen unterscheiden zu können, wird als Referenz die Komparator-Lösung mit dem Ansatz verglichen. Falls bei einem Ansatz ohne Gelbfärbung eine Fluoreszenz auftreten sollte, ist dieser Ansatz als negativ zu betrachten, es handelt sich auf keinen Fall um Escherichia coli. Für Keimzahlen bis zu 200 wird ein Tray mit 51 großen Vertiefungen verwendet, für Keimzahlen bis 2000 ein Tray mit 97 Vertiefung (Quanti-Tray-2000). Die Quanit-Tray-2000 enthält 49 große Vertiefungen und 48 kleine Vertiefungen. Bei einer hohen Keimbelastung wird die Probe, vor der Zugabe des Pulvers, verdünnt. Nach der Bebrütungszeit wird die Keimzahl anhand der Anzahl gelber bzw. fluoreszenter Vertiefungen ermittelt. 18 Kapitel 2: Material und Methoden Tabelle 2.5: Qualitativer Nachweis von coliformen und fäkalcoliforme Bakterien (E. coli) Eigenschaften des Ansatzes Ergebnis Farblos oder leichte Verfärbung (geringer Escherichia coli: n.n.3 als Komparator-Lösung) Coliforme Bakterien: n.n. Gelbfärbung gleich oder intensiver als die Escherichia coli: n.n. Komparator-Lösung, ohne Fluoreszenz Coliforme Bakterien: pos. Gelbfärbung gleich oder intensiver als die Escherichia coli: pos. Komparator-Lösung, mit Fluoreszenz Coliforme Bakterien: pos. Die gelben, positiven Vertiefungen werden für die Coliforme und zusätzlich den fluoreszierenden Vertiefungen für E. coli entsprechend gezählt. Die aus der Anzahl der positiven Reaktionen in den Wells4 sich ergebende wahrscheinliche Zahl (MPN) wird in der „MPN-Tabelle für Quanti-Tray mit 51 Vertiefungen“(siehe Anhang) abgelesen. Die erste Spalte beinhaltet die positiven Vertiefungen bei einer 100 ml Probe. Man sucht die Zeile der positiven Vertiefungen und liest den dazugehörigen Wert in der zweiten Spalte ab. Die MPNTabelle weist eine obere und untere Vertrauensgrenze von 95% auf. Für die Auswertung des Quanti-Tray 2000 benutzt man die „Quanti-Tray 2000 MPN-Tabelle“ (siehe Anhang). In der ersten Spalte waagerecht sucht man den Zahlenwert der positiven großen Vertiefungen und in der ersten horizontalen Spalte den Wert der positiven kleinen Taschen. Dort wo sich die Spalten treffen, kann die wahrscheinliche Zahl (MPN) abgelesen werden. Falls der Ansatz davor verdünnt wurde, muss der Verdünnungsfaktor mit eingerechnet werden. Beispiel: Oberflächengewässer für eine beliebige Probe A Tabelle 2.6: Darstellung der charakteristischen Zahl für Colilert-18 Positiven großen Positiven kleinen Charakteristische Vertiefungen Vertiefungen Zahl 49 44 49/44 Statistische Tabellenwert 1553,1 In diesem Beispiel lautet der statistische Tabellenwert 1553,1/100 ml Wasserprobe. Da in diesem Beispiel eine Verdünnung von 1:10 vorgenommen wurde, ist das Ergebnis 15531/100 ml Wasserprobe oder 1 ml der Probe entsprechen 155,31 Keime. Absicherung der Befunde: Eine weitere Untersuchung der Colilert-18 zur Identifizierung von coliformen und fäkalcoliformen Bakterien ist die Weiterbearbeitung der Anreicherungsflüssigkeit nach der Bebrütungszeit der Colilert-18. Die leichte Verfärbung der Vertiefungen, die nicht geringer sind als der Komparator-Lösung, sollen unter sterilen Bedingungen auf Endo-C-Agar-Platten ausgestrichen werden. 3 4 Nicht Nachweisbar Vertiefungen 19 Kapitel 2: Material und Methoden Die Unterseite der versiegelten Trays wird mit Desinfektionsmittel gereinigt und mit sterilen Impfnadeln gestochen. Die hellgelbe Anreicherungsflüssigkeit wird mit Hilfe einer sterilen Impföse auf Endo-C-Agar-Platte ausgestrichen und bei 37°C bebrütet. Die fluoreszierende Anreicherungsflüssigkeit auch ausgestrichen aber bei 44°C bebrütet. Es war bei früheren Untersuchungen der Verdacht aufgetaucht, dass das Verfahren Colilert-18 falsch-positive Ergebnisse liefert. Die Ergebnisse der Endo-C-Agar-Platten waren negativ. Dieses Ergebnis stellt die These auf, dass das Colilert-18-Verfahren falsch-positive Ergebnisse liefert. Um diese These zu bestätigen, wird eine „Lange Bunte Reihe“ durchgeführt. 2.3.4.3 Prüfungen biochemischer Merkmale von Mikroorganismen durch die Lange Bunte Reihe Die „Lange Bunte Reihe“ ist die Prüfung biochemischer Merkmale von Mikroorganismen. Sie besteht aus 36 Komponenten wie zum Beispiel Malonat-Test, Nitrat-Test, Citrat-Test etc. und dient zur Identifizierung der einzelnen Kolonien anhand der positiven bzw. negativen Reaktionen der einzelnen Nährböden. Die Auswertung der „Lange Bunte Reihe“erfolgt anhand der „Table of Biochemical reaction“(Biochemical reaction of the nemed species, biogroups, and Enteric Groups of the family Enterobacteriaceae). Indolbildung Gewisse Bakterien haben die Fähigkeit, aus dem Tryptophan abgebauter Eiweiße, Indol zu bilden. Diese Substanz lässt sich im Medium mit einer Testlösung nachweisen. Hierfür verwendete Reagenz ist das KOVACS´Reagens. Dieses Reagenz ist z. B. von „Merck“ erhältlich. Das tryptophanreiche Nährmedium wird von der Nährbodenküche geliefert. Technik: Nach Beimpfung wird das Röhrchen 24-48 h bei 36 °C bebrütet. Dann setzt man einige Tropfen (ca. 1 ml) KOVACS´Reagenz zu. Bewertung: Positiv: Das zugesetzte Reagenz verfärbt sich an der Oberfläche rot. Negativ: Keine Verfärbung des zugesetzten Reagenzes. Nachweis der Kohlenhydrate Die beim Abbau von Kohlenhydrate entstehende Säure wird durch den Umschlag eines dem Testsubstrat zugesetzten Indikators sichtbar. Der meist hierfür benutzte Farbstoff Bromthymolblau schlägt dabei von blaugrün nach gelb um; Alkalisierung führt zum Umschlag nach blau. Die Reaktion kann nach 24 h Bebrütung abgelesen werden, wenn auch die Säurebildung eingetreten ist. 20 Kapitel 2: Material und Methoden Reagenzien und Testsubstrat: Bromthymolblau-Lösung (2%ig Fertiglösung z. B. OXOID) Grundsubstrat: Fleischextrakt (OXOID) 5,0 g Pepton 10,0 g NaCL 3,0 g Na2HPO4 2,0 g Aqua dest. 1000,0 ml Monosaccharide sowie gewisse Alkohole, sind z. B. Dextrose, Mannit, Inosit, Maltose, Sorbit, Adonit, Salicin, Arabinose und Dulcit. Sie können dem Grundsubstrat in eine Konzentration von 0,5 – 2,0 % vor der Sterilisation zugesetzt werden. Die Nährmedien werden von der Nährbodenküche geliefert. Technik: Kohlenhydratmedien mit geringer Mengen Kulturmaterial 20 h bei 37°C bebrüten. Bewertung: Positiv (Säurebildung):Farbumschlag nach gelb (Bromthymolblau), unter diffuser Trübung des Substrates. Negativ: Kein Indikatorumschlag; Trübung des Nährbodens. Nachweis der Gasbildung: Der Abbau der Kohlenhydrate kann mit oder ohne Bildung von Gas vor sich gehen. Die Gasbildung wird mittels kleiner, in die kohlenhydrathaltigen Röhrchen eingebrachter Gärröhrchen nach Durham nachgewiesen. Außerdem kann die Gasbildung wie bei KliglerAgar durch das Auftreten von Gasblasen, Rissen in der Agarsäule oder Zersprengen des Nährbodens erkannt werden (siehe Kligler-Zweizucker-Eisen-Agar). Oxidase-Reaktion Oxidasen sind Enzyme, die Oxidationsvorgänge im Bakterienstoffwechsel katalysieren. Sie finden sich vor allem bei obligaten Aeroben wie Pseudomonas. Zum Nachweis der Oxidasen bedient sich gewisser Redox-Farbstoffe z.B. N,N-Dimethyl-p-phenylendiaminhydrochlorid. Durch Einwirkung der Bakterien-Oxidase nehmen diese im reduzierten Zustand farblosen Reagenzien eine schwarzbraune bzw. blauviolette Farbe an. Technik: Heutzutage verwendet man Teststreifen, die mit Oxidase-Reagenz getränkt sind. Die zu prüfende Kolonie wird mit einer Platinöse auf dem Teststreifen eingerieben. 21 Kapitel 2: Material und Methoden Bewertung: Oxidase-positiv: Teststreifen verfärbt sich in blauviolett, z. B. Pseudomonas, Aeromonas, Neisserien. Oxidase-negativ: Teststreifen verfärbt sich in gelb bzw. farblos, z. B. E. coli, coliforme Bakterien. ß-Galaktosidase-Test (ONPG-Test) Das Enzym ß-Galaktosidase spaltet Laktose, in Dextrose und Galaktose. Bei verzögertem Laktoseabbau kann der Nachweis der ß-Galaktosidase die Diagnostik beschleunigen. Das Ferment muss jedoch zunächst durch Tuluol aus dem Zellinneren der Bakterien freigesetzt werden, bevor es mit o-Nitrophenyl-ß-Galaktopyranosid (ONPG) nachgewiesen werden kann. ONPG wird dabei in Galaktose und o-Nitrophenol, das eine kräftige gelbe Farbe besitzt, gespalten. Die beiden Lösungen: Lösung 1(Pufferlösung, pH 7,0): NaH2PO4 ∗2H2O 6,9 g Aqua dest. 45,0 ml pH-Wert mit konz. NaOH auf 7 einstellen und auf 50,0 ml Aqua dest. auffüllen. Lösung 2(ONPG-Lösung): o-Nitrophenyl-ß-Galaktopyranosid 0,08 g Aqua dest. 15,0 ml Technik: Die Pufferlösung (Lösung 1) vorher einige Minuten im Brutschrank zur Lösung der Phosphatkristalle anwärmen. Beide Lösungen werden zu gleichen Teilen gemischt. Das Röhrchen nach beimpfen 18 h, bei 37°C bebrüten. Die Anreicherungskultur in 0,25 ml NaClLösung aufschwemmen und 1 Tropfen Toluol zusetzen. Dann 10 Min. in den Brutschrank (37°C) stellen. Anschließend 0,25 ml Reagenzlösung 2 zufügen. Bewertung: Ablesung nach 20 Minuten. Positiv: Gelbfärbung (z. B. Hafnia, meiste Colistämme). Negativ: Keine Farbänderung. 22 Kapitel 2: Material und Methoden Methylrot-Reaktion Bei Spaltung von Dextrose wird unter geeigneten Bedingungen auf etwa 4,5 erniedrigter pHWert (Umschlagspunkt des Methyl-Rot-Indikators) durch bestimmte Mikroorganismen ein längerer Zeitraum aufrechterhalten. Der Nachweis erfolgt durch Zugabe weniger Tropfen Methyrotindikatorlösung zum Testssubstrat. Reagenz: Methylrotlösung (0,1 g Methylrot in 300 ml 96%igem Äthylalkohol lösen, dann 200 ml Aqua. dest. zusetzen). Testsubstrat ( z. B. OXOID): Pepton 7,0 g K2HPO4 5,0 g Glukose 5,0 g Aqua dest. 1000,0 ml Technik: Nährboden nach Beimpfung 48 h bei 36 °C bebrüten, dann 5 Tropfen Reagenz zusetzen und kurz schütteln. Bewertung: Positiv: Rotfärbung des Mediums nach Zugabe der Indikatorlösung. Negativ: Gelbfärbung. Voges-Proskauer-Reaktion Während einigen Bakterien (z. B. E. coli) aus kohlenhydrathaltigen Medien Säuren bilden (Methylrot-Reaktion: pos.), kommt es durch Einwirkung anderer Keime (z.B. Enterobacteriaceae) zur Bildung von Acetylmethylcarbinol, einem Zwischenprodukt des Kohlenhydratstoffwechsels. Reagenzien: (Barrit-Methode) 1. 5%ige Lösung von α-Naphthol in absolutem Äthylalkohol 2. 40%ige wässrige Lösung von KOH. Testsubstrat: Wie bei Methylrotreaktion. Technik: 1 ml einer mindestens 2 Tage bebrüteten Bouillonkultur werden zunächst 0,6 ml α-NaphholLösung (5%ig in absolutem Alkohol) und 0,2 ml einer 40%igen KOH-Lösung zugefügt. Das Gemisch wird geschüttelt und über der Flamme leicht erwärmt. 23 Kapitel 2: Material und Methoden Bewertung: Positive Reaktion: Rote Farbe (in wenigen Minuten). Negative Reaktion: Gelblich-bräunliche-Farbe bzw. Niederschlag. Phenylalanindeaminase-(PAD)-Test Phenylalanindeaminase, ein bei Bakterien der Proteus-Providencia-Gruppe vorkommendes Ferment, spaltet Phenylalanin unter Bildung von Phenylbrenztraubensäure. Diese reagiert mit Eisen III-Salzen, wobei Grünfärbung entsteht. Reagenz: 10%ige FeCl3-Lösung Testsubstrat: Hefeextrakt 3,0 g DL-Phenylalanin 1,0 g Na2HPO4 1,0 g NaCl 5,0 g Agar Oxoid Nr.3 12,0 g Aqua. dest 1000,0 ml Technik: Schrägfläche des Nähbodens kräftig beimpfen, 24 h bei 36°C bebrütet, dann einige Tropfen 10%ige FeCl3-Lösung auftropfen und über die Schrägfläche laufen lassen. Bewertung: Positiv: Grüne Verfärbung der aufgetropften Flüssigkeit und zum Teil auch des Nährbodens. Negativ: Keine Verfärbung. Lysin- und Ornithindecarboxylase-, Arginindihydrolase-Test Durch das Fermentsystem bestimmter Bakterien werden unter anaeroben Bedingungen (Versuchsröhrchen mit Paraffin abdichten) die Aminosäure L-Lysin und L-Ornithin decarboxyliert, wobei die entsprechenden Amine und CO2 entstehen. Durch die Arginindihydrolase von gewissen Bakterien wird Arginin zu CO2 und NH3 abgebaut. Die Folge ist ein Anstieg des pH-Wertes. Dieser Vorgang wird jedoch erst durch einen erniedrigten pH-Wert ausgelöst. Das heißt, zunächst muss die im Nährboden vorhandene Dextrose abgebaut werden; durch die sauren Abbauprodukte erniedrigt sicht der pH-Wert: es kommt zum Farbumschlag nach gelb. Erst jetzt setzt die Decarboxylierung ein und es erfolgt (oft erst nach 2-4 Tagen der Farb(rück) Umschlag nach violett. Ein stets mitzuführender Kontrollröhrchen ohne Aminosäurezusatz bleibt in diesem Fall gelb. Die Röhrchen werden von der Nährbodenküche fertig geliefert, die mit Paraffin beschichtet sind. 24 Kapitel 2: Material und Methoden Testsubstrate: Fleischextrakt 5,0 g Pepton 5,0 g Pyridoxal 0,005 g Dextrose 0,5 g Bromkresolpurpurlösung 2,5 ml Aqua dest. 1000,0 ml Technik: Die Kulturröhrchen und ein Kontrollröhrchen werden mittels Platinnadel durch die Paraffinschicht hindurch geimpft. Sie werden 4 Tage bei 37°C bebrütet; (täglich auf Indikatorumschlag prüfen). Bewertung: Positiv: Farbumschlag nach violett. Negativ: Gelbe Farbe bleibt bestehen. Das Kontrollröhrchen (ohne Aminosäure-Zusatz) soll die gelbe Farbe behalten. Schwefelwasserstoff-Bildung/Kligler-(Zweizucker-)Eisen-Agar Durch den Gehalt an Glukose, Laktose und im Dreizucker-Agar zusätzlich Saccharose sowie Phenolrot und Eisen-II-Sulfat ermöglicht dieser Test die gleichzeitige Erkennung mehrer biochemischer Leistungen. H2S-Bildung kann aus Eiweißkörpern bzw. den beim Abbau entstehenden schwefelhaltigen Aminosäuren erfolgen. Die Intensität der H2S-bildung ist von der Menge der vorhandenen Schwefelverbindungen und von der untersuchten Bakterienart abhängig. Testsubstrate: Hefeextrakt-Cystein-Basalmedium 1000,0 ml FeSO4 ∗ 7H2O 0,2 g Na2SO3 0,3 g Na2S2O3 5H2O (Na-Thiosulfat) 0,1 g Substrat in Röhrchen (12/13x100) bis zu 5 ml abfüllen und mit Schrägschicht erstarren lassen, so dass ein etwa gleich langer Hoch- und Schrägschichtteil entsteht. Sie werden fertig von der Nährbodenküche geliefert. Technik: Material mit Nadel auf Schrägschicht deponieren, dann in den Hochschichtteil einstechen und anschließend das deponierte Material auf der Schrägfläche verteilen, 18 h bei 36 ° bebrüten. 25 Kapitel 2: Material und Methoden Bewertung: Schrägfläche rot, Hochschicht gelb; Abbau von Glukose. Schrägfläche gelb, Hochschicht gelb: Abbau von Glukose und Laktose(und/oder Saccharose beim Dreizuckeragar). Schrägfläche rot, Hochschicht rot: keine fermentativer Glukose-, Laktose- und Saccharoseabbau. Schwarzfärbung der Hochschicht: Bildung von H2S. Blasen- und Rissbildung: Gasbildung beim Glukoseabbau. Beweglichkeitsprüfung Es handelt sich um halbfeste Medien, denen nur eine geringe Menge Agar-Agar zur Gliederung beigesetzt wurde. Begeißelte Mikroorganismen können sich sichtbar in den Agar hineinbewegen (Trübung des Agars von Stichkanal ausgehen = Stichagar). Eine von vielen Nährmedien ist der SIM-Nährboden. SIM-Nährboden Testsubstrat: Im Handel erhältlich (z. B. von Merck) Technik: Den in Hochschicht erstarrten Nährboden mit Platinnadel beimpfen und 18-24 h bei 37°C bebrüten. Bewertung: Positiv: Diffuse Trübung des Mediums. Negativ: Wachstum nur entlang dem Stichkanal. Nitratreduktionstest Bei Vorhandensein des Enzyms Nitratreduktase und Anwesenheit eines geeigneten Wasserstoffdonators wird Nitrat zu Nitrit und ggf. weiter zu Ammoniak oder molekularen Stickstoff reduziert. Testsubstrat: KNO3 (nitritfrei) 0,2 g Pepton 5,0 g Aqua dest. 1000,0 ml 26 Kapitel 2: Material und Methoden Technik: Nach Beimpfung bis 4 Tage bei Optimaltemepatur bebrüten, dann 0,1 ml einer Mischung aus beiden Teilen folgender Lösung zusetzen (Griess-Iiosvay-Reagenz zu Nachweis von Nitrit): Lösung A: Sulfanilsäure 1,0 g 5 M Essigsäure 125,0 ml Lösung B: α-Naphthylamin 1,0 g 5 M Essigsäure 200,0 ml Bewertung: Positiv: Rotfärbung (Nitritnachweis). Negativ: Keine Rotfärbung nach Zugabe von Lösung A und B. Gelatinasetest Das Enzym Gelatinase bewirkt einen hydrolytischen Abbau der Gelatine. Durch Gelatine zur Erstarrung gebrachtes Substrat wird dabei verflüssigt. Testsubstrat: Fleischextrakt 7,5 g Pepton 25,0 g NaCl 5,0 g Aqua dest. 1000,0 ml Gelatine 80,0 g Nähragar 1000,0 ml Technik: Die verdächtige Einzelkolonie strichförmig auf der Platte ausimpfen unter Mitführung eines positiven und eines negativen Kontrollstammes, 48 h bei 36°C bebrüten. Anschließend die strichförmig gewachsenen Kulturen mit einem HgCl2-Lösung getränkten Tupfer abwischen und die Platte mit HgCl2-Lösung übergießen (HgCl2-Lösung: 15 g HgCl2 in 20 ml konz. HCL mit 100 ml Aqua dest. lösen). Bewertung: Positiv: Substrat im Bereich des Impfstriches klar durchscheinende (unveränderte Gelatine wird durch die Lösung getrübt). Negativ: Nährboden im Strichbereich unverändert. 27 Kapitel 2: Material und Methoden Tartrat-, Mukat- und Zitrat - Test Ähnlich der Zuckerspaltung können gewisse Bakterien auch die organischen Säuren Tartrat, Mukat und Zitrat abbauen, wobei saure Abbauprodukte entstehen, die mit einem Indikator wie Bromthymolblau nachgewiesen werden können. Die Verdeutlichung der Tartratreaktion kann noch mit gesättigter Bleiacetatlösung erfolgen. Reagenz: Bleiacetat, 50%ige wässrige Lösung, kräftig schütteln. Vor Gebrauch 30 Min. absetzen lassen. Testsubstrat: Bacto-Pepton (z. B. Difco) 10,0 g M/10 NaOH-Lösung 8,5 ml Aqua. dest 1000,0 ml Bromthymolblaulösung, 0,2% 12,0 ml Organische Säuren: d-Tartrat, Zitrat und Mukat werden in 1%iger Konzentration dem Substrat zugefügt. Technik: Je 2 Röhrchen werden die Röhrchen beimpft und 48 h bei 36 °C bebrütet. Bewertung: Positiv: Farbumschlag über grüngelb nach weiß, dann zum Teil wieder zurück nach blau. Die Ablesung erfolgt beim Tartrat nach Zugabe von 0,5 ml gesättigter Bleiazetatlösung und beim Mukatsubstrat wird nur die Farbreaktion beurteilt. Positiv: Farbumschlag über grüngelb nach weiß, dann zum Teil wieder zurück nach blau. Negativ: Keine Färbung. Präzipitatbildung nach Bleiazetatzusatz (bei Tartrat und Zitrat zu prüfen): Positiv: Der bei Zugabe des Reagenz entsehende Niederschlag sinkt innerhalb 30 Min. auf eine sehr geringe Menge ab. Negativ: Der entstehende, kräftige Niederschlag bleibt im Röhrchen weitgehend bestehen und nimmt nach 24 h noch mehr als die Hälfte der Flüssigkeit ein. Malonat-Test Na-Malonat wird von verschiedenen Bakterienarten unter Bildung alkalischer Stoffwechselprodukte verwertet. Die Alkalisierung führt zum Umschlag dem dem Testsubstrat zugesetzten Bromthymolblau nach blau. Testsubstrat: Hefeextrakt 1,0 g 28 Kapitel 2: Material und Methoden (NH4)2 SO4 2,0 g K2HPO4 0,6 g KH2PO4 0,4 g NaCl 2,0 g Na-Malonat 3,0 g Glukose 0,25 g Bromthymolblau-Lösung 12,5 ml Aqua dest. 1000,0 ml Technik: Substrat mit Material von einer Einzelkolonie beimpfen, 24-48 h bebrüten bei 36 °C. Bewertung: Positiv: Farbumschlag von grün nach blau. Negativ: Keine Farbänderung. Harnstoff-(Urease-)Reaktion nach Christensen Durch das in verschiedenen Bakterienarten vorkommende Ferment Urease wird sie hydrolysiert unter Bildung von Ammoniak und CO2. Wobei sich der pH-Wert zur alkalischen Seite verschiebt. Die pH-Änderung wird durch den Indikator Phenolrot angezeigt. Außer der sehr intensiven Alkalibildung aus Harnstoff tritt noch eine weitere Alkalisierung infolge Eiweiß- bzw. Peptonabbaus auf. Um dies zu neutralisieren, setzt man Glucose hinzu, aus deren Spaltung Säure hervorgeht. Wird im Medium nur Eiweiß gespalten, so überwiegt bei glukosepositiven Keimen die Säurefermentation. Es wird zusätzlich Harnstoff abgebaut und die Reaktion ist alkalisch. Testsubstrat: (z. B. Oxoid) Pepton 1,0 g NaCl 5,0 g Glukose 1,0 g KH2PO4 2,0 g Phenolrot (0,2%Lösung in 50%Äthylalkohol) 6,0 ml Agar (Oxoid) 15,0 g Aqua dest. 1000,0 ml 29 Kapitel 2: Material und Methoden Technik: Schrägfläche mit steriler Impföse beimpfen, 1-4 Tage bei 36 °C bebrüten. Bewertung: Positiv: deutliche rotviolette Färbung des ganzen Mediums. Negativ: keine Farbänderung. Kaliumcyanid (KCN)-Test Bei einem KCN-Gehalt des Nährbodens von 0,0075% können die meisten Bakterien nicht mehr wachsen, wohl aber Keime der Klebsiellagruppe und Citrobactergruppe. Testsubstrat: Pepton 10,0 g NaCl 5,0 g KH2PO4 225,0 mg Na2HPO4 ∗ H2O 5,64 g Aqua dest. 1000,0 ml Technik: Röhrchen mit einer Impföse beimpfen, 2 Tage bei 36 °C bebrüten unter Mitführung eines in gleicher Weise beimpften Röhrchens mit Basissubstrat (ohne KCN Zusatz). Bewertung: Positiv: Wachstum (Trübung) im KCN-haltigen und im KCN-freien Substrat. Negativ: Kein Wachstum im KCN-hatigen aber Wachstum im KCN-freien Substrat. 2.3.5 Membranfiltrationsverfahren (Verfahren nach ISO 9308) 2.3.5.1 Allgemeines Die Membranfiltrationsverfahren dienen zur Nachweis und Zählung von Escherichia coli und coliformen Bakterien. Sie wird mit Hilfe einer Vakuumfiltrationsanlage durchgeführt. Dieses Verfahren beinhaltet mehrer Arbeitsschritte, um den Nachweis von coliforme und fäkalcoliforme Bakterien zu bestätigen. Hier werden 100 ml Probe über ein Membranfilter mit 0,45 µm Porengröße filtriert. Das Filter wird auf Laktose-TTC-Agar mit Tergitol-7 gelegt und bei 36°C bebrütet. Laktoseverwertende Bakterien, zu denen die coliformen Bakterien zählen, wachsen auf diesem Medium als gelbe bis gelb-orange Kolonien, erzeugen eine entsprechende Verfärbung des Mediums uns sind coliformverdächtig. Weisen diese im Oxidase-Test eine negative Reaktion auf, gelten sie als coliforme Bakterien. Sind die verdächtigen Kolonien in der Lage 30 Kapitel 2: Material und Methoden zusätzlich auf Tryptophan bei 44 °C Indol zu bilden, gilt der Nachweis für E. coli als erbracht. Das Colilert-Verfahren ist eine alternative zur Membranfiltrationsverfahren. Das Membranfiltrationsverfahren ist besonders für Trinkwasser und technische Bäder geeignet, die eine niedrige Keimzahlbelastung aufweisen. Für die Oberflächengewässer muss die Probe unbedingt verdünnt werden. Hierfür gibt es keine konkreten Anweisungen aus der Standardarbeitsanweisung des Fachamts für Umweltuntersuchungen Hamburg. Es wird durch Durchführung mehrer Proben, der richtige Verdünnungsfaktor bestimmt. Beispiel: Oberflächengewässer für eine beliebige Probe A Zuerst erfolgt die Bebrütung bei der Laktose-TTC-Agar mit Tergitol 7. Dann werden die gewachsenen Kolonien auf Oxidase und Indolbildung geprüft. Das Ergebnis der coliformen und fäkalcoliformen Bakterien setzt sich auf mehreren Schritten zusammen. Als Beispiel wird eine beliebige Probe A bei folgender Koloniezahl ermittelt: Es wird der Gesamtzahl der gewachsenen Kolonien, die Zahl der verdächtigen Kolonien, die Zahl der gelb-orange Kolonien dokumentiert. Wichtig sind die Ergebnisse der Oxidase-Test und IndolTest. Als coliformen Bakterien werden Laktose-positiven Kolonien mit negativer OxidaseReaktion gezählt. Die E. coli gelten als Laktose-positiven Kolonien mit negativer OxidaseReaktion und positivem Indol-Test. Diese Parameter bilden ein gesamtes Ergebnis der coliformen und fäkalcoliformen Bakterien. Bei einer Anzahl verdächtiger Kolonien auf dem Membranfilter müssen mindestens ca. 10 Kolonien auf Oxidase und Indolbildung geprüft werden. Das Ergebnis der 10 verdächtigen Kolonien) Untersuchungen wird auf die Gesamtheit der Anfangs gezählten, verdächtigen Kolonien hochgerechnet. Tabelle 2.7: Beispiel für Rechnung der verdächtigen Kolonien Anzahl der verkeine Coliforme Coliforme dächtiger Kolonien auf Bakterien Bakterien dem Membranfilter: 140 Kolonien 2 Kolonien 6 Kolonien E. coli 2 Kolonien Gesamtkolonienzahl / 10 verdächtige Kolonien = Umrechnungswert d. h. 140/10 = 14 Kolonien Insgesamt Kolonienzahl: Nicht identisierbar 6∗14=84 2∗14=28 Somit enthält die Probe A, 84 Kolonien für coliforme Bakterien und 28 Kolonien für E. coli. Diese Probe wurde am Anfang der Membranfiltration mit einer Verdünnung (1:1000) verdünnt, d. h. die Probe A enthält 840 Coliformen Keime pro 100 ml Wasserprobe. 31 Kapitel 2: Material und Methoden 2.3.5.2 Durchführung der Untersuchungen Die Zusammensetzung der Nährböden und Nährlösungen: Laktose-TTC-Agar mit Tergitol-7 (OXOID CM 793, hergestellt in der Nährbodenküche) in g/l: Laktose 20,0 Pepton 10,0 Hefeextrakt 6,0 Fleischextrakt 5,0 Bromthymolblau 0,05 Agar 15,0 Zusätzlich wird ein Gemisch aus 2,3,5-Triphenyl-Tetrazoliumchlorid 0,05 g/100ml und Natriumheptadecylsulfat 0,2g/100ml, je 5 ml, als Grundmedium zugegeben. Tryptose-Soja-Agar(TSA) (nichtselektiver Nähragar für Oxidase-Test, DIFCO 236950, hergestellt in der Nährbodenküche) in g/l: Casein 15,0 Sojapepton 5,0 Natriumchlorid 5,0 Agar 15,0 Tryptophan-Bouillon (Trypton-Wasser, DIFCO 264410, hergestellt in der Nährbodenküche) in g/l: Pepton aus Casein 10,0 Natriumchlorid 5,0 Die Durchführung der Membranfiltration erfordert folgende Materialien: Laktose-TTC-Agar mit Tergitol®7 Tryptose-Soja-Agar (TSA) Röhrchen mit Tryptophanbouillon Kovac´s Reagenz für Indol-Test MERCK Art. Nr.: 109293 Oxidase-Teststäbchen MERCK Art. Nr.: 1.13300 Membranfiltrationsgerät mit sterilen Einwegtrichtern (MBSI System mit Trichterspender; Schleicher & Schüll, 37568 Dassel) Membranpumpe ME 4R (Vacuubrand GmbH, 97866 Wertheim) 32 Kapitel 2: Material und Methoden Membranfilter (ME2521 STL, Porengröße 0,45 Ø 50 mm) Demineralisiertes Wasser Brutschrank Memmert, thermostatisiert, (36 ±2)°C und (44 ±0,5)°C Einmal-Impfösen, steril, 10 µl, Art. Nr.: 631Q2211 Pinzetten Bunsenbrenner Die Wasserproben werden durch ein steriles Membranfilter filtriert. Das Membranfilter wird mit einer sterilen Pinzette blasenfrei auf den Laktose-TTC-Tergitol-7-Agar in einer Petrischale gelegt und bis zu (21±3) °C aerob bebrütet. Die Keimbelastung der Wasserproben, die bearbeitet wurden, war sehr hoch. Die Abbildung 2.1 zeigt eine Probe mit hohe Keimbelastung, indem eine Keimzählung nicht möglich ist. Deshalb mussten sehr hohe Verdünnungsstufen angesetzt werden. Abbildung 2.1: Bebrütete Laktose-TTC-Tergitol-7-Agar Die meist angesetzte Verdünnungsstufen waren: Tabelle 2.8: Die Verdünnungsstufen für verschiedene Gewässern Gewässer Oberflächengewässer Elbe Abwasser Verdünnungsstufen 1:500 1:1000 bzw. 1:500 1:10 000 Nach Abschluss der Bebrütungszeit werden die verdächtigen Kolonien gezählt. Als verdächtige Kolonien gelten, ungeachtet ihrer Größe, gelbe bzw. gelb-orange Kolonien, die unter dem Membranfilter im Agar einen gelben Hof aufweisen. Diese Kolonien zählen als Laktose-positive Bakterien. Die Ergebnisse der auf dem Laktose-TTC-Agar gewachsenen verdächtigen Kolonien und die Zahl der auf TSA-Agar ausgestrichenen Kolonien werden dokumentiert. Die Koloniezahl wird auf 100 ml des untersuchten Wassers bezogen. Bei Verdünnungen wurde der Verdünnungsfaktor berücksichtigt. Differenzierung/Absicherung Für Oxidase-Test und der Indol-Test wird die repräsentative Anzahl von Kolonien auf nichtselektiven TSA Agar, fraktioniert ausgestrichen und in Tryptophan-Bouillon angelegt. Der Oxidase-Test und die Indolprüfung werden wie in Kapitel 2.2.4.3 „Lange Bunte Reihe“ durchgeführt. 33 Kapitel 2: Material und Methoden 2.3.6 Zusammenfassung der unterschiedlichen Nährböden In diesem Abschnitt sind alle Nährböden, die verwendet wurden, zusammengefasst. Tabelle 2.9: Zusammenfassung der unterschiedlichen Nährböden Gesamtcoliforme Bakterien Anwendung Zubereitung Bebrütung Einmischverfahren Oberflächenausstrich Oberflächenausstrich Geliefert in Kulturröhrchen: Hygieneinstitut Gelieferte Platten; Hygieneinstitut Gelieferte Platten; Hygieneinstitut 24 h bei 37°C 24 h bei 37°C 24 h bei 37°C Merck MPN-Verfahren Gelieferte Kulturröhrchen;Hygieneinstitut 44 h bei 37°C Idexx MPN-Verfahren 18 h bei 37°C Laktose-TTCAgar mit Tergitol®7 Oxoid Cm 793 MembranFiltration Gelieferte Pulver (Nährboden) mit Probe vermischen und in eine Quanti-Tray luftblasenfrei geben. Zum Schluss mit eine Quanti-Tray Sealer verließen Gelieferte Platten; Hygieneinstitut Colilert 18Testkitt Idexx MPN-Verfahren Gelieferte Pulver mit Probe vermischen und in eine QuantiTray luftblasenfrei geben. Zum Schluss mit eine Quanti-Tray Sealer verließen. 18 h bei 37°C Laktose-TTCAgar mit Tergitol®7 Tryptose-SojaAgar TryptophanBouillon Oxoid Cm 793 MembranFiltration Gelieferte Platten; Hygieneinstitut 21 h bei 37°C Gelbfärbung und Fluoreszenz;der Ver-tiefunge; Kennzahl zur Auswertung Gelbe bzw. gelborange Kolonien Gelieferte Platten; Hygieneinstitut Gelieferte Kulturröhrchen; Hygieneinstitut 21 h bei 37°C 21 h bei 44°C Auf Oxidase überprüfen Auf Indolbildung untersuchen Nährboden Desoxycholat-Agar Endo-CAgar ChromocultColiformenAgar MPN-Methode LaurylsulfatBouillon Colilert 18Testkit Hersteller Oxoid Merck Merck Auswertung Rote Kolonien mit Präzipitalhof Rote Kolonien Rosa-rote Kolonien Gasbildung;Kenn zahl zur Auswertung Gelbfärbung der Ver-tiefungen; Kennzahl zur Auswertung 21 h bei 37°C Gelbe bzw. gelborange Kolonien→ weitere Bearbeitung mit TSA-Agar Difco Gelieferte Platten; 21 h bei Tryptose-SojaAuf Oxidase Hygieneinstitut 37°C Agar (TSA) überprüfen Difco Gelieferte 21 h bei TryptophanAuf Indolbildung Kulturröhrchen; Hygieneinstitut 44°C Bouillon untersuchen Auswertung der Membranfiltration: Coliforme Bakterien: Oxidase-negativ und Indol-negativ Escherichia coli Nährboden Hersteller Anwendung Zubereitung Bebrütung Auswertung Oxoid EinmischGeliefert in 24 h bei DesoxyRote Kolonien verfahren Kulturröhrchen; Hygieneinstitut 44°C cholat-Agar mit Präzipitalhof Merck OberflächenGelieferte Platten; 24 h bei Endo-CRote Kolonien ausstrich Hygieneinstitut 44°C Agar Merck OberflächenGelieferte Platten; 24 h bei ChromocultDunkelblauausstrich Hygieneinstitut 44°C Coliformenviolette Kolonien Agar Merck MPN-Verfahren Gelieferte 44 h bei MPN-Methode Gasbildung und Kulturröhrchen; Hygieneinstitut 37°C LaurylsulfatFluoreszenz; Bouillon Kennzahl zur Auswertung Difco Difco Auswertung der Membranfiltration: E. coli: Oxidase-negativ und Indol-positiv 34 Kapitel 2: Material und Methoden 2.4 Mikrobiologische Referenzmaterialien 2.4.1 Durchführung der Kultivierung von Kontrollstämme Vom Kontrollstamm aus der Kulturensammlung (DSMZ-Referenzstamm5) wird eine Mehrfachkonserve (Stammkultur, Subkultur des Kontrollstammes) für das Labor hergestellt. Von dieser Stammkultur des Kontrollstammes werden nach Bedarf eine oder mehrere Gebrauchskulturen (weitere Subkulturen) für den einmaligen Einsatz bei der Qualitätsprüfung angelegt. Die Gebrauchkulturen waren frisch aus den gefriergetrockneten Kontrollstämme angesetzt und konnten somit für die Prüfung der Verfahren verwendet werden. 2.4.2 Einsatz der Gebrauchskulturen Von der Gebrauchskultur wird Material des Kontrollstammes auf bzw. in das bei dem jeweiligen Untersuchungsverfahren angewendete erste Anreicherungs- bzw. Nachweismedium eingebracht. Danach werden der jeweiligen SOP entsprechend sukzessive alle weiteren Selektions-, Differenzierungs- und Nachweisprozeduren bis zum Endergebnis vorgenommen. Dies gilt in gleicher Weise für die Kontrollstämme der nachzuweisenden Bakterien (Positiv-Kontrolle) wie auch für die Kontrollstämme der Negativ-Kontrolle. Die Plattenmethode beinhaltet folgende Nährböden: Desoxycholat-Agar Chromocult-Coliformen-Agar Endo-C-Agar Fluorocult-ECD-Agar Für den Nachweis der thermophilen fäkalcoliforme Bakterien bei allen Nährböden wurde Escherichia coli (DSMZ 30083) als Positivkontrolle verwendet. Die durchgeführten Untersuchungsverfahren wie zum Beispiel Membranfiltrationsverfahren, Colilert-18Verfahren werden in Tabelle 2.10 mit den entsprechenden Referenzstämmen dokumentiert. Tabelle 2.10: Einsatz von verschiedenen Gebrauchskulturen Coliforme Bakterien Untersuchungsverfahren: MPN-Verfahren Fäkalcoliforme Bakterien Positivkontrolle Negativkontrolle Positivkontrolle Negativkontrolle Miniaturverfahren E. coli Pseudomonas aeruginosa Aeromonas hydrophila Aeromonas hydrophila Aeromonas hydrophila E. coli Colilert-18-Verfahren Citrobacter freundii E. coli Citrobacter freundii Aeromonas hydrophila Aeromonas hydrophila Citrobacter freundii Membranfiltrationsverfahren E. coli 5 Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH 35 E. coli E. coli E. coli Kapitel 2: Material und Methoden Die qualitative Bestimmung der Referenzstämme mit Positiv-, wie auch Negativkontrollen, wurde bei diesen Untersuchungsverfahren erfolgreich durchgeführt. 2.5 Statistische Prüfverfahren 2.5.1 Statistik für die Qualitätssicherung in der Wassermikrobiologie Die Validierung mikrobiologischer Methoden und die Interpretation ihrer Ergebnisse sind insofern kompliziert, als sie einen gewissen Grund an Variabilität aufweisen. Diese Variabilität kann gleichermaßen systematischen Effekten aber auch der Zufallsvariation bei der Probenentnahme und der Durchführung von analytischen Verfahren zugeschrieben werden. Um diese zu berücksichtigen, ist es notwendig, vielseitige Informationen zu sammeln. Das erreicht man durch wiederholtes Zählen, paralleles Ausplattieren und mehrfache Verfahren. In solchen Fällen können die einzelnen Ergebnisse zu einer Auswertung zusammengefasst werden, die die Hauptmerkmale der Analyse bereibt und den Einfluss der Zufallsvariabilität verringert. Dazu wurden wichtige statistische Methoden mit folgender Zielsetzung entwickelt: Zusammenfassung der Hauptmerkmale von Mehrfachproben und Schätzung des Einflusses der Zufallsvariation Verallgemeinerung der Probenergebnisse für die Gesamtheit oder die Umwelt, auf der sie entnommen wurden Vergleich der Resultate von verschiedenen Methoden unter Berücksichtigung der Zufallsvariation, sodass sich systematische und zufallsbedingte Abweichungen unterscheiden lassen 2.5.2 Grundberechnungen Zwei Hauptmerkmale bei einer Serie von Beobachtungen zum Beispiel bei einer Reihe von Parallelplattenzählungen sind ihre Lage und ihre Streuung. Im Fall von quantitativen Bestimmungen wird in der Statistik das arithmetische Mittel zur Beschreibung der Lage verwendet und die Varianz, die Standardabweichung oder der Variationskoeffizient als Maße der Dispersion. 2.5.2.1 Arithmetisches Mittel Das arithmetische Mittel oder der Durchschnitt x wird definiert als die Summe aller Einzelmessungen xi, geteilt durch die Anzahl der Werte n. 1 n x = ∑ xi n i =1 36 Kapitel 2: Material und Methoden Diese statistische Kenngröße bezüglich der Lage vermittelt jedoch nur dann den richtigen Eindruck der Datenreihe, wenn die Einzelwerte symmetrisch um den Mittelwert verteilt sind, weil jede Messung denselben Beitrag zum Durchschnitt leistet. Bei schiefen asymmetrischen Verteilungen würde der Einfluss der höchsten bzw. niedrigsten Werte Durchschnitte ergeben, die außerhalb der Mehrheit der Beobachtungen liegen. 2.5.2.2 Varianz, Standardabweichung und Variationskoeffizient Das entsprechende Maß der Dispersion ist die Varianz s2, die aus den Differenzen der Einzelmessungen xi und deren Durchschnitt x errechnet wird. Diese Differenzen werden quadriert, um die Richtung der Abweichung auszuschalten, zusammengezählt und dann deren Summe durch die Anzahl der Messungen minus eins dividiert. 1 n s = ( xi − x ) 2 ∑ n − 1 i =1 2 Ein Nachteil beim Beschreiben der Variation innerhalb einer Datenreihe als Varianz besteht jedoch darin, dass dieser Wert wegen der quadrierten Abweichungen, die in der Berechnung verwendet werden, nicht so einfach zu interpretieren ist. Daher wird die Standardabweichung s angeführt. 2 1 n s= s = ( x − x ) ∑ i n −1 i=1 2 Ein Vergleich der Variation in zwei oder mehr Messreihen mit unterschiedlichen Mittelwerten muss auf einer dritten statischen Größe für die Abweichung basieren, die man durch Division der Standardabweichung durch den Mittelwert erhält. Diese nennt man den relativen Standardabweichung v = s / x. Sie stellt die Variation der Messungen im Verhältnis zu deren Mittelwert dar. Die Standardabweichung, Varianz und der Variationskoeffizient werden in den Parallelansätzen der Plattenmethode für die coliformen und fäkalcoliformen Bakterien durchgeführt. 37 Kapitel 3: Ergebnisse 3. Ergebnisse 3.1 Vergleich verschiedener Untersuchungsverfahren Die experimentelle Bestimmung der E. coli und coliformen Bakterien erfolgte mit Proben von Oberflächengewässern und Abwasser. Insgesamt wurden an vier Proben unterschiedlicher Herkunft intensiv untersucht. Es ging darum, aufzuzeigen inwieweit das Ergebnis von den gewählten Methoden abhängt. Die Verfahren wurden nach Anleitung von der SOP Standardarbeitsanweisung durchgeführt. Bei den einzelnen Verfahren sollte vier Proben, die drei, vier und fünf Parallelansätze pro Versuchsreihe enthalten durchgeführt werden, und der sich daraus ergebende Mittelwert für die Auswertung herangezogen werden. Die Proben wurden mit folgenden Parallelansätzen durchgeführt: Oberflächengewässer; Regensiel: 3 Parallelansätze Oberflächengewässer; Alster-Haselknick: 4 Parallelansätze Oberflächengewässer; Alster-Wulksfelde: 5 Parallelansätze Kläranlage; Dradenau: 4 Parallelansätze Die Ergebnisse der Keimzahlbestimmung für E. coli und coliforme Bakterien werden im Folgenden mit der Einheit KBE/ml als Mittelwerte angegeben. Die Wahl der Probenvolumen bzw. Verdünnungsreihen wurde mit Vorversuchen bestimmt. 3.1.1 Durchführung der Plattenmethode Bei der Plattenmethoden wurden mit folgenden Nährböden gearbeitet: Desoxycholat-Agar Chromocult®-Coliformen-Agar Fluorcult®-ECD-Agar Endo-C-Agar Bei den Untersuchungen mit Desoxycholat-Agar und Chromocult-Coliformen-Agar wurden zum Teil sehr hohe Werte erzielt. Deshalb wurde bei den Proben Regensiel, Haselknick und Dradenau eine weitere Untersuchung zur Differenzierung der Bakterien vorgenommen (z. B. Bunten Reihe für Desoxycholat-Agar und ein Oxidase-Test für Chromocult-Coliformen-Agar und Endo-C-Agar durchgeführt). Das Membranfiltrationsverfahren gehört zwar auch zu den Plattenmethoden wird aber separat mit der Bestimmung von E. coli und coliformen Bakterien bearbeitet (siehe Kapitel 3.3). 38 Kapitel 3: Ergebnisse 3.1.2 Durchführung der MPN-Verfahren Bei dem MPN-Ansatz wurde nur eine 3er MPN, in drei Parallelansätzen mit drei Verdünnungsreihen 0,1 ml, 0,01 ml und 0,001 ml, wie auch bei der Untersuchungen von Badegewässern üblich ist, durchgeführt. Alle vier Proben wurden mit diesem Verdünnungsreihen bearbeitet. Andere Verfahren, die auf dem MPN-Verfahren beruhen, sind Colilert-18 und Miniaturverfahren. Das Colilert-18-Verfahren wurde bei allen Proben durchgeführt. Aber das Miniaturverfahren wurde nur bei der ersten Probe (Regensiel) angewendet. Hier konnte kein Ergebnis erzielt werden, da die Keimzahlbelastung der E. coli bei dieser Probe nicht hoch genug war. Das Miniaturverfahren konnte bei den Paralleluntersuchungen nicht durchgeführt werden, weil die Keimzahlbelastung der E. coli sehr gering waren. 3.1.3 Ergebnisse der Untersuchungen auf coliformen Bakterien mit den Plattenmethoden Bei der Plattenmethode wurden das Einmischverfahren bei der Desoxycholat-Agar und der Oberflächenausstrich bei Chromocult-Coliformen-Agar und Endo-C-Agar verwendet. Tabelle 3.1: Coliformenzahlen der Regensielprobe Plattenmethode Desoxycholat-Agar Chromocult-Agar Endo-C-Agar Probe Regensiel Regensiel Regensiel Keimzahl in KBE/ml 1.Platte 2.Platte 111 103 500 400 135 130 Tabelle 3.2: Coliformenzahlen der Haselknickprobe Probe Plattenmethode Keimzahl in KBE/ml 1.Platte 2.Platte 3.Platte Desoxycholat-Agar Haselknick 65 102 111 Chromocult-Agar Haselknick 205 300 295 Endo-C-Agar Haselknick 40 45 25 3.Platte 74 490 110 4.Platte 54 255 45 Mittelwert 96 463 125 Mittelwert 83 264 39 Tabelle 3.3: Coliformenzahlen der Wulksfeldeprobe Probe Plattenmethode Keimzahl in KBE/ml 1.Platte 2.Platte 3.Platte 4.Platte 5.Platte Mittelwert Desoxycholat-Agar Wulksfelde 504 470 460 426 336 439 Chromocult-Agar Wulksfelde 420 305 340 290 320 355 Endo-C-Agar Wulksfelde 25 20 20 40 50 31 Tabelle 3.4: Coliformenzahlen der Dradenauprobe Probe Plattenmethode Keimzahl in KBE/ml 1.Platte 2.Platte 3.Platte Desoxycholat-Agar Dradenau 55 45 50 Chromocult-Agar Dradenau 30 20 75 Endo-C-Agar Dradenau 20 25 55 39 4.Platte 35 105 20 Mittelwert 46 58 30 Kapitel 3: Ergebnisse Im Labor wurde die Information erteilt, dass die Desoxycholat-Agar-Methode erhöhte Keimzahlbelastungen zeigt. Bei den experimentellen Untersuchungen wurden alle Parallelverfahren auch den Chromocult-Coliformen-Agar eingesetzt. Dabei zeigte das Desoxycholat-Agar die zweithöchste Keimbelastung. Die Proben Regensiel, Haselknick und Dradenau (Tab. 3.1, 3.2 und 3.4) beim ChromocultColiformen-Agar waren am meisten belastet. Die Ergebnisse deuten auf ein schnelles Anwachsen von Coliformen hin, auch wenn sie möglicherweise subletal geschädigt waren. Der Nährboden wurden bei den Vorversuchen auf die Empfindlichkeit der Temperatur geprüft, d.h. mit eine beliebige Probe A wurde Platten ausgestrichen, die davor im Brutschrank bei 37°C erwärmt wurden, aber auch Platten, die direkt aus dem Kühlschrank entnommen wurden. Daraus ergab sich, dass die Keimzahl der beiden Platten identisch war. Da keine weitere Fehlerquelle entdeckt wurde, ist anzunehmen, dass das Anwachsen der subletal geschädigten Coliformen eine hohe Keimzahlbelastung hervorruft. In der Probe Wulksfelde (Tab. 3.3) zeigte Chromocult-Coliformen-Agar einen niedrigeren Mittelwert, als der Desoxycholat-Agar. Es könnte sein, dass Fehler während der Vorbereitung des Nährbodens gemacht wurden. Der niedrige Mittelwert der Proben Regensiel, Haselknick und Dradenau ließen vermuten, dass der größte Teil der Bakterien durch eine zu hohe Temperatur des flüssigen Agars abgetötet wurden. Diese These kann nicht bestätigt werden, weil der Nährboden nach dem Aufkochen über mehrere Stunden im Wasserbad temperiert wurde. Darauf wurde sehr geachtet, da im Labor diese Vorinformation über diesen Verfahren bekannt war. In der Abbildung 3.1 sind die Ergebnisse der coliformen Bakterien übersichtlich dargestellt. 3.1.3.1 Differenzierungen der coliformen Bakterien von Chromocult-Coliformen-Agar, Endo-C-Agar und Desoxycholat-Agar Die experimentelle Untersuchung mit dem Nährboden Chromocult-Coliformen-Agar zeigte die höchsten Ergebnisse. Deshalb wurde anschließend bei allen Proben ein Oxidase-Test durchgeführt. Durch den Oxidase-Test wurden die coliforme Bakterien differenziert. Sie sind Oxidase-negativ. (Oxidase-Reaktion: Kapitel. 2.3.4.3). Die höchste Keimzahl zeigte die Probe Regensiel. Sie hatte einen Mittelwert von 463 Kolonien pro ml, davon sind 315 Kolonien (Tab. 3.5) keine coliforme Bakterien. Bei der Probe Haselknick waren von 264 Kolonien, 209 Kolonien (Tab. 3.5) keine coliformen Bakterien. Prozentual gesehen, besteht eine 79%ig niedrigere Keimzahlbelastung, als angegeben. Die Probe Wulksfelde hatte 330 Kolonien, die nicht zu den coliformen Bakterien gehörten, d.h. 93% weniger Wachstum, als beim Mittelwert. Auch die Kläranlage Dradenau zeigte auch ein niedrigeres Koloniewachstum, als der ermittelte Wert. Hier wurden 58 Kolonien ermittelt, wobei der Oxidase-Test 48 Kolonien weniger anzeigte und damit eine Abweichung von 83% ergab. 40 Kapitel 3: Ergebnisse Tabelle 3.5: Differenzierung der coliformen Bakterien nach Chromocult-Agar mit Oxidase-Test Coliforme Bakterien Chromocult-Agar (KBE/ml) ∑ der untersuchten Kolonien Oxidase-positiv (KBE/ml) Oxidase-negativ (KBE/ml) falsch-positive Abweichung (%) Tatsächlicher Wert (KBE/ml) Regensiel 463 25 17 8 68 148 Haselknick 264 14 11 3 79 55 Wulksfelde 355 27 25 2 93 25 Dradenau 58 18 15 3 83 10 Der Endo-C-Agar lieferte bei der Plattenmethode den niedrigsten Wert. Da hier mit den gewachsenen rosa-roten Kolonien ein Oxidase-Test durchgeführt wurde, reduzierten sich auch hier die Mittelwerte. Bei genaueren Nachforschungen stellte sich heraus, dass der Endo-C-Agar möglicherweise zu lange gelagert worden war, denn der Agar gilt als sehr empfindlich und wenige Tage haltbar. Dadurch konnten die Ergebnisse beeinflusst worden sein. Im weiteren Verlauf der Arbeit wurde versucht möglichst frischen Nährboden zu verwenden. Aber es konnte aus technischen Gründen der Nährbodenküche leider nicht immer berücksichtigt werden. Der Agar wurde im Dunkeln aufbewahrt. Die Proben Haselknick, Wulksfelde und Dradenau lagen zwischen 11 – 16 Kolonien pro ml. Damit zeigte der Oxidase-Test Falsch-positive im Bereich von 52 – 63 %. Bei der Probe Regensiel wurde frisch gegossenes Agar direkt zum Einsatz gebracht. Deshalb waren die Ergebnisse am höchsten. Der Mittelwert lag bei 125 Kolonien pro ml, die durch einen Oxidase-Test einen Wert von 31 Kolonien pro ml enthielt (Tab. 3.6). Tabelle 3.6: Differenzierung der coliformen Bakterien nach Endo-Agar mit Oxidase-Test Coliforme Bakterien Regensiel Haselknick Wulksfelde Dradenau 125 39 31 30 Endo-C-Agar (KBE/ml) 20 15 19 21 ∑ der untersuchten Kolonien 15 9 10 13 Oxidase-positiv (KBE/ml) 5 6 9 8 Oxidase-negativ (KBE/ml) 75 60 52 63 Falsch-positive Abweichung (%) Tatsächlicher Wert (KBE/ml) 31 16 15 11 Im Gegensatz zum Endo-C-Agar wurde bei den Proben der Desoxycholat-Agar-Verfahren zur Differenzierung der coliformen Bakterien eine kleine Bunte Reihe durchgeführt. Die Röhrchen mit D-Glucose-, Laktose-Pepton-Bouillou, Indol- und Citrat-Agar wurden mit den dunkelroten Kolonien, die auf dem Desoxycholat-Agar gewachsen waren, beimpft. Daraus ergab sich, dass die tatsächlichen coliformen Bakterien der Probe Regensiel und Haselknick um 33%, und die Probe Wulksfelde um 40% geringer war, als mit dem Desoxycholat-Agar erschien. Bei der Probe Dradenau betrug die prozentuale Abweichung 46%. 41 Kapitel 3: Ergebnisse Tabelle 3.7: Differenzierung der coliformen Bakterien nach Desoxycholat-Agar durch die Bunte Reihe Coliforme Bakterien Regensiel Haselknick Wulksfelde Dradenau 96 83 439 46 Desoxycholat-Agar (KBE/ml) 15 12 15 13 ∑ der untersuchten Kolonien 10 8 9 7 Bunte Reihe: positiv (KBE/ml) 33 33 40 46 Falsch-positive Abweichung (%) Tatsächlicher Wert (KBE/ml) 64 56 263 25 Die Differenzierung ergab, dass die tatsächliche Anzahl der coliformen Bakterien erheblich geringer war, als mit den verschieden Agarplatten festgestellt wurde. Die Abbildungen 3.1 und 3.2 stellt ein Vergleich zwischen den ermittelten Anzahlen der coliformen Bakterien mit und ohne die Differenzierung dar. Abbildung 3.1: Ermittelte Anzahl der coliformen Bakterien nach der Differenzierung 500 KBE/ml 400 300 263 200 100 148 64 31 56 55 25 16 25 15 10 0 Regensiel Haselknick Wulksfelde Desoxycholat-Agar Chromocult-Agar 11 Dradenau Endo-Agar Abbildung 3.2: Ermittelte Anzahl der coliformen Bakterien ohne die Differenzierung 500 463 439 KBE/ml 400 355 264 300 200 100 96 125 83 39 31 46 58 30 0 Regensiel Haselknick Desoxycholat-Agar Wulksfelde Chromocult-Agar 42 Endo-Agar Dradenau Kapitel 3: Ergebnisse 3.1.4 Ergebnisse der Untersuchungen auf coliformen Bakterien mit den MPN-Verfahren und Colilert®18-Verfahren Die Mittelwerte des Colilert-18 (Tab. 3.8 - 3.15) liegen eindeutig über dem Mittelwerte der MPN-Verfahren. Für Colilert-18 wurde die Probe mit sterilem Leitungswasser (1:10), verdünnt. Tabelle 3.8: MPN-Verfahren für Coliformenzahlen in der Regensielprobe Positive Röhrchen Charakteristische Statistischer MPN Volumen Probe: Nr. Regensiel 1 2 3 1:10 3 3 3 1:100 3 3 3 1:1000 0 1 1 Zahl Tabellenwert (KBE/100ml) 3/3/0 3/3/1 3/3/1 2400 4600 4600 Mittelwert (KBE/ml) 39 Bei den MPN-Verfahren ergab sich eine Koloniezahl von 39 KBE/ml (Tab. 3.8). Hier wurde die Vorverdünnung mit berücksichtigt. Im Gegensatz dazu lagen die Ergebnisse des Colilert-18 (Tab. 3.9) weit über den MPNKeimzahlen. Dies ist auch bei den anderen Proben (Tab. 3.11-3.15) zu beobachten. Tabelle 3.9: Colilert-Verfahren für Coliformenzahlen in der Regensielprobe Große Kleine Statistischer Verdünnung Mittelwert Colilert-18 Wells Wells Charakteristische Tabellenwert (KBE/ml) Zahl (KBE/100ml) Nr. Positive Reaktion 1:10 Probe: 1 49 46 49/46 1986,3 1:10 Regensiel 2 170 49 44 49/44 1553,1 1:10 3 49 44 49/44 1553,1 Tabelle 3.10: MPN-Verfahren für Coliformenzahlen in der Haselknickprobe Positive Röhrchen Charakteristische Statistischer MPN Volumen Probe: Haselknick Nr. 1 2 3 4 1:10 3 2 2 1 1:100 0 0 0 0 1:1000 0 0 0 0 Zahl Tabellenwert (KBE/100ml) 3/0/0 2/0/0 2/0/0 1/0/0 230 90 90 40 Mittelwert (KBE/ml) 1 Die Probe Haselknick zeigte eine Keimzahl von 1 Kolonie pro ml und beim Colilert®18 – Verfahren war die Keimzahl 9 Kolonien pro ml (Tab. 3.11). Dies zeigt eine 9-fache Erhöhung der Keimzahl. 43 Kapitel 3: Ergebnisse Tabelle 3.11: Colilert-Verfahren für Coliformenzahlen in der Haselknickprobe Große Kleine Statistischer Colilert-18 Wells Probe: Haselknick Nr. 1 2 3 4 Wells Positive Reaktion 41 1 36 4 45 2 40 9 Charakteristische Zahl Tabellenwert (KBE/100ml) Verdünnung 41/1 36/4 45/2 40/9 80,5 67,7 105,8 95,9 1:10 1:10 1:10 1:10 Mittelwert (KBE/ml) 9 Bei der Probe Wulksfelde wurden fünf Paralleluntersuchungen durchgeführt. Hier war der Vergleich zwischen MPN-Verfahren und Colilert-18-Verfahren übereinstimmend (Tab. 3.12 und 3.13) mit den vorherigen Untersuchungen. Tabelle 3.12: MPN-Verfahren für Coliformenzahlen in der Wulksfeldeprobe Positive Röhrchen Charakteristische Statistischer MPN Volumen Probe: Wulksfelde Nr. 1 2 3 4 5 1:10 3 3 3 3 3 1:100 3 3 2 3 2 1:1000 0 0 1 2 1 Zahl Tabellenwert (KBE/100ml) 3/3/0 3/3/0 3/2/1 3/3/2 3/2/1 2400 2400 1500 11000 1500 38 Tabelle 3.13: Colilert-Verfahren für Coliformenzahlen in der Wulksfeldeprobe Große Kleine Statistischer Colilert-18 Wells Probe: Wulksfelde Nr. 1 2 3 4 5 Wells Positive Reaktion 49 43 49 41 49 39 48 42 49 48 Mittelwert (KBE/ml) Charakteristische Zahl Tabellenwert (KBE/100ml) Verdünnung Mittelwert (KBE/ml) 49/43 49/41 49/39 48/42 48/49 1413,6 1203,3 1046,2 755,5 691 1:10 1:10 1:10 1:10 1:10 102 Bei der Probe Dradenau, war die Keimzahlbelastung sehr niedrig (Tab. 3.14 - 3.15). Trotzdem waren hier die Ergebnisse der Colilert-18 höher als beim MPN-Verfahren. Diese Probe ist eine Abwasserprobe und müsste eigentlich höhere Ergebnisse liefern. Diese Ergebnisse wurden mit den jährlichen Untersuchungsergebnissen verglichen. Es stellte sich heraus, dass die jährlichen Untersuchungsergebnisse der Kläranlage deutlich über den ermittelten Wert lagen. Dies war darauf zurückzuführen, dass die Probe Dradenau erst nach vier Wochen untersucht wurde. 44 Kapitel 3: Ergebnisse Tabelle 3.14: MPN-Verfahren für Coliformenzahlen in der Dradenauprobe6 Positive Röhrchen Volumen MPN Probe: Nr. Dradenau 1 2 3 4 1:10 3 3 3 3 Charakteristische Zahl Statistischer Tabellenwert (KBE/100ml) 3/2/1 3/1/0 3/2/0 3/1/0 1500 430 930 430 1:100 1:1000 2 1 1 0 2 0 1 0 Mittelwert (KBE/ml) 8 Tabelle 3.15: Colilert-Verfahren für Coliformenzahlen in der Dradenauprobe Große Kleine Statistischer Colilert-18 Probe: Dradenau Nr. 1 2 3 4 Wells Wells Charakteristische Zahl Positive Reaktion 44 44 43 47 3 4 7 10 44/3 44/4 43/7 47/10 Tabellenwert (KBE/100 ml) Verdünnung 102,0 105,4 108,1 160,7 1:10 1:10 1:10 1:10 Mittelwert (KBE/ml) 12 Bei allen Proben war zu beobachten, dass das Colilert-18-Verfahren höhere Werte als das MPN-Verfahren lieferte. Die Proben Regensiel und Wulksfelde zeigten die höchsten Keimzahlbelastungen mit 170 – 102 KBE/ml. Die anderen Proben Haselknick und Dradenau hatten eine recht niedrige Keimbelastung von 12 - 9 KBE/ml, die aber auch über den Ergebnissen mit dem MPN-Verfahren lagen. Abbildung 3.3: MPN-Verfahren und Colilert-18-Verfahren für coliforme Bakterien 200 170 KBE/ml 150 102 100 50 39 38 9 8 1 0 Regensiel Haselknick Wulksfelde MPN-Verfahren 6 abgestandene Probe 45 Colilert 18 12 Dradenau Kapitel 3: Ergebnisse Durch erhöhte Werte der Colilert-18-Verfahren sollte eine Differenzierung mit dem Endo-CAgar und eine Identifizierung der Bakterien mit der „Langen Bunten Reihe“ durchgeführt werden. Beim Colilert-18 wurden die gelben und die fluoreszierenden Vertiefungen, unter sterilen Bedingungen, entnommen und auf Endo-C-Agar ausgestrichen. Die qualitative Differenzierung der coliformen Bakterien wurde bei 37°C und E. coli bei 44°C, bei einer Bebrütungszeit von 24 h, durchgeführt. Als Ergebnis lieferte Endo-C-Agar Kolonien, die nicht rosa-rot bzw. kein grünschimmernden, beständigen Metallglanz (Fuchsinglanz) hatten, die in der Abbildung 3.4 zu beobachten ist. Abbildung 3.4: Beimpfte Endo-C-Agarplatte mit Colilert-18-Flüssigkultur. Aufgrund dieses Ergebnisses wurde die These aufgestellt, dass das Colilert-18-Verfahren falsch-positive Coliforme oder E. coli Ergebnisse liefern kann. 3.1.4.1 Differenzierung der Colilert®18-Verfahren mit der Langen Bunte Reihe Die Lange Bunte Reihe prüft die Stoffwechselleistungen der Bakterien. Sie wurde mit 36 Komponenten wie zum Beispiel Voges Proskauer-Reaktion, Malonat-, Methylrot-, Gelatinase-Test etc. (Kapitel 2.2.4.4) durchgeführt. Diese Komponenten zeigen die biochemischen Merkmale von Mikroorganismen, die der weiteren Identifizierung dienen. Zuerst wurden neue Endo-C-Agar-Platten fraktioniert ausgestrichen. Somit bestand die Möglichkeit, die Lange Bunte Reihe mit einzeln gewachsenen Kolonien durchzuführen. Bei der Durchführung der Differenzierung wurden folgende Proben untersucht: Oberflächengewässer; Bille 61 Oberflächengewässer; Bille 4 Oberflächengewässer; Alster-Haselknick Die einzeln gewachsenen Kolonien wurden mit Hilfe einer sterilen Impföse auf die entsprechenden Nährböden ausgestrichen und die Nährboulliouns wurden beimpft. Nach einer Bebrütungszeit von 24 – 48 h wurden die Röhrchen nach positiven bzw. negativen Reaktionen ausgewertet. Hierzu ergab sich aus den 36 Komponenten eine Liste (Ablaufprotokoll) mit positiven und negativen Reaktionen. Danach wurde diese Liste mit der 46 Kapitel 3: Ergebnisse Identifizierungstabelle (Biochemical reactions of the named species, biogroups, and Enteric Groups of the familiy Enterobacteriaceae, siehe Anhang) verglichen. Dieser Identifizierungsbogen für Enterobacteriaceae enthält 31 Gruppen der Organismen wie Citrobacter, Cedecea, Enterobacter, Salmonella, Escherichiae, Hafnia etc. und deren Untergruppen, wie zum Beispiel, Escherichiae mit der Untergruppe von E. coli inaktiv, E. blattae. Außerdem enthält die Identifizierungstabelle Angaben über prozentuelle Anteile positiver und negativer Reaktionen. Die Wahrscheinlichkeit der Organismen hängt von der Zusammenstellung der ausgewerteten Liste (Ablaufprotokoll; siehe Anhang), die von einer fraktioniert ausgestrichenen Kolonie bearbeitet wurde. Als Beispiel wird die Billeprobe 61 aufgeführt. Diese Probe hatte beim Colilert-18-Verfahren, gelbe Vertiefungen, die als coliforme Bakterien zu beurteilen waren. Vom positiven (gelben) Wells wurde Flüssigkeit auf Endo-C-Agar ausgestrichen. Die Ergebnisse der Endo-C-Agar schienen atypisch zu sein, d.h. es wuchsen keine rot-rosa Kolonien bzw. war kein grünschimmernder Metallganz zu sehen. Um sicher zu gehen wurden einzeln gewachsenen Kolonien erneut auf eine neue Endo-C-Platte ausgestrichen und mit einzeln gewachsene Kolonien die Nährböden und Nährbouillons der Langen Bunten Reihe beimpft. Nach der Bebrütungszeit wurden sie ausgewertet und die positiven, sowie auch die negativen Reaktionen dokumentiert. Somit war eine Liste erstellt, die mit der Identifizierungstabelle verglichen wurde. Die Identifizierungstabelle enthält prozentuelle Werte, wie zum Beispiel 100%, 80%, 50% ect., die als positive und negative Reaktion zugeordnet werden. Bei der Billeprobe 61 wurde eine Liste zusammengestellt, wo zum Beispiel die D-Glucose als positiv bewertet wurde und dementsprechend ein 100%iger Anteil auf der Identifizierungstabelle abzulesen war. Diese Vorgehensweise wurde bei allen 36 Komponenten durchgeführt. Bei der Tabelle 3.16 werden die Mikroorganismen dargestellt, die durch die Differenzierung mit der Langen Bunten Reihe ermittelt wurden. Tabelle 3.16: Differenzierung durch die Lange Bunte Reihe Proben Probenbezeichnung Lange Bunte Reihe Mikroorganismen 1. Probe 2. Probe 3. Probe Oberflächengewässer; Bille 61 Oberflächengewässer; Bille 4 Oberflächengewässer; Alster-Haselknick E. coli inaktiv Enterobacter eloacae Klebsiella pneumoniae Bei der Differenzierung wurde festgestellt, dass die Billeprobe 61 mit E. coli, inaktiv belastet war. Außerdem war bei der Billeprobe 4 Organismen wie Enterobacter eloacae zu identifizieren. Die letzte Probe war die Alster-Haselknick, die mit dem Organismen Klebsiella pneumoniae belastet war. Die Differenzierung durch die Lange Bunte Reihe bewies, dass das Colilert 18-Verfahren kein falsch-positive Ergebnis geliefert hat. Denn alle untersuchten Wells ergaben bei der Langen Bunten Reihe einen positiven Coliformen-Befund. 47 Kapitel 3: Ergebnisse 3.2 Ergebnisse der Untersuchungen auf Escherichia coli mit den Plattenmethoden Die Untersuchungen auf Escherichia coli werden in der gleichen Reihenfolge wie die der coliformen Bakterien gezeigt, d. h. zuerst wird die Plattenmethode mit allen Proben und dann das MPN-Verfahren vorgestellt. Zusätzlich wird das Fluorocult-ECD-Agar-Verfahren, das nur als fluoreszenzoptischer Nachweis von E. coli dient, aufgenommen. Tabelle 3.17: Plattenmethoden für E. coli-Keimzahlen der Regensielprobe Plattenmethode Desoxycholat-Agar Chromocult-Agar Endo-C-Agar Fluorocult-ECD-Agar Probe Regensiel Regensiel Regensiel Regensiel 1.Platte 20 10 5 5 Keimzahl in KBE/ml 2.Platte 3.Platte 25 25 0 0 5 5 5 5 Mittelwert 23 3 5 5 Bei der Plattenmethode hatte der Desoxycholat-Agar die höchsten E. coli-Zahlen bei den Proben Regensiel und Dradenau. Regensiel hatte 23 Kolonien pro ml (Tab. 3.17) und Dradenau mit 21 Kolonien pro ml (Tab. 3.18). Tabelle 3.18: Plattenmethoden für E. coli-Keimzahlen der Haselknickprobe Plattenmethode Desoxycholat-Agar Chromocult-Agar Endo-C-Agar Fluorocult-ECD-Agar Probe Haselknick Haselknick Haselknick Haselknick 1.Platte 11 0 20 10 Keimzahl in KBE/ml 2.Platte 3.Platte 4.Platte 15 8 7 0 5 0 25 5 10 0 5 0 Mittelwert 10 1 15 4 Bei der Probe Haselknick wurde die größte E. coli-Zahlen der Endo-C-Agar mit 15 Kolonien pro ml beobachtet (Tab. 3.18). Dann folgte die Probe Wulksfelde mit 10 Kolonien pro ml (Tab. 3.19). Die Probe Haselknick wurde mit frisch gegossener Endo-C-Agar durchgeführt. Deshalb war nur hier der höchste E. coli-Zahl zu ermitteln. Bei den anderen Proben konnte aus technischen Gründen kein frisch gegossener Endo-C-Agar aus der Nährbodenküche geliefert werden. Deshalb konnten sie nicht sofort durchgeführt werden. Tabelle 3.19: Plattenmethoden für E. coli-Keimzahlen der Wulksfeldeprobe Plattenmethode Probe Desoxycholat-Agar Chromocult-Agar Endo-C-Agar Fluorocult-Agar Wulksfelde Wulksfelde Wulksfelde Wulksfelde Keimzahl in KBE/ml 1.Platte 2.Platte 3.Platte 4.Platte 5.Platte Mittelwert 5 15 10 15 5 10 0 0 10 0 0 2 6 7 6 6 4 6 5 10 5 0 5 5 Das Fluorocult-ECD-Agar hatte bei allen Probe fast gleiche E. coli-Zahlen. Die Ergebnisse waren übereinstimmend, d. h. sie lagen zwischen 4 – 5 Kolonien pro ml. Dies ist darauf zurückzuführen, dass der Fluorocult-ECD-Agar ein Selektivagar ist. 48 Kapitel 3: Ergebnisse Zusätzlich zur Bestätigung des Befundes wurden die fluoreszierenden Kolonien auf Indolbildung geprüft. Außerdem wurde das Volumen der Proben bei den Vorversuchen bestimmt. Es zeigte sich, dass ein kleines Volumen, wie z. B. 10 - 100 µl für den FluorocultAgar zu niedrig war. Es wuchsen nur vereinzelte Kolonien, die jedoch im UV-Licht nicht sichtbar waren. Deshalb wurde bei den weiteren Untersuchungen ein Volumen von 200 µl gewählt und bei der Auswertung die Verdünnung berücksichtigt. Tabelle 3.20: Plattenmethoden für E. coli-Keimzahlen der Dradenauprobe Probe Keimzahl in KBE/ml Plattenmethode 1.Platte 2.Platte 3.Platte 4.Platte Desoxycholat-Agar Dradenau 25 20 10 30 Chromocult -Agar Dradenau 5 0 5 5 Endo-C-Agar Dradenau 5 0 0 0 Fluorocult-ECD-Agar Dradenau 5 5 0 5 Mittelwert 21 4 1 4 Der Chromocult-Coliformen-Agar hatte bei allen Proben die niedrigsten Mittelwerte. Hier lagen die Keimbelastungen zwischen 1 – 4 Kolonien pro ml. Die dunkelblau-violett gefärbten Kolonien auf dem hellen Chromocult-Agar waren sehr gut zu identifizieren. 3.2.1 Differenzierung der Escherichia coli von Chromocult-Coliformen-Agar, Endo-CAgar und Desoxycholat-Agar Die Differenzierung der E. coli für Chromocult-Agar mit einem Oxidase-Test bewies, dass alle dunkelblau-violett gewachsenen Kolonien coliforme Kolonien waren. Da die getesteten Kolonien die Reaktion Oxidase-negativ zeigten (Tab. 3.21). Tabelle 3.21: Differenzierung der E. coli für Chromocult-Agar mit Oxidase-Test E. coli Regensiel Haselknick Wulksfelde Dradenau 3 1 2 4 Chromocult-Agar (KBE/ml) 3 1 2 4 ∑ der untersuchten Kolonien 0 0 0 0 Oxidase-positiv (KBE/ml) 3 1 2 4 Oxidase-negativ (KBE/ml) 0 0 0 0 Falsch-positive Abweichung (%) Tatsächliche Wert (KBE/ml) 3 1 2 4 Bei der Differenzierung für Endo-C-Agar durch einen Oxidase-Test zeigten sich keine großen prozentuellen Abweichungen, da die untersuchten Kolonien Oxidase-negativ waren. Die Probe Haselknick enthielt eine Abweichung von 20% und die Dradenauprobe zeigte eine 100% Abweichung. Bei der Probe Dradenau konnte aber nur eine Kolonie auf Oxidase untersucht werden. Somit ist die Wahrscheinlichkeit zu gering, um eine Aussage treffen zu können (Tab. 3.23). 49 Kapitel 3: Ergebnisse Tabelle 3.23: Differenzierung der E. coli für Endo-Agar mit dem Oxidase-Test Escherichia coli Regensiel Haselknick Wulksfelde 5 15 6 Endo-C-Agar (KBE/ml) 0 3 0 Oxidase-positiv (KBE/ml) 5 12 6 Oxidase-negativ (KBE/ml) 0 20 0 Prozentuale Abweichung (%) Tatsächliche Wert (KBE/ml) 5 12 6 Dradenau 1 1 0 100 0 Bei der Überprüfung des Desoxycholat-Agars wurde die Differenzierung der E. coli mit den Bunten Reihen durchgeführt. Das Desoxycholat-Agar-Verfahren zeigten die höchsten Keimzahlen, weil der Nährböden die thermotoleranten Bakterien wachsen lassen. Bei der Probe Haselknick und Wulksfelde lagen die Keimbelastungen zwischen 80 – 83 % (Tab. 3.22) weniger als mit der Bestimmung von Desoxycholat-Agar. Der Mittelwert der E. coli bei der Probe Dradenau war zu 71% weniger vorhanden, als in der Tat die Probe enthielt. Die geringste prozentuale Abweichung zeigte die Probe Regensiel mit 65%. Tabelle 3.22:Differenzierung der E. coli-Zahlen nach Desoxycholat-Agar durch die Bunte Reihe Escherichia coli Regensiel Haselknick Wulksfelde Dradenau 23 10 6 21 Desoxycholat-Agar (KBE/ml) 8 5 6 7 ∑ der untersuchten Kolonien 3 1 1 2 Bunte Reihe: positiv (KBE/ml) 63 80 83 71 Falsch-positive Abweichung (%) Tatsächliche Wert (KBE/ml) 8 2 1 6 Die Abbildungen 3.5 und 3.6 stellt ein Vergleich zwischen den ermittelten Anzahlen der Escherichia coli mit und ohne die Differenzierung dar. Abbildung 3.5: Ermittelte Anzahl der E. coli nach der Differenzierung 25 KBE/ml 20 15 12 10 5 8 5 3 6 5 4 2 6 5 1 1 4 4 2 0 0 Regensiel Haselknick Desoxycholat-Agar Wulksfelde Chromocult-Agar 50 Endo-Agar Dradenau Fluorocult-Agar Kapitel 3: Ergebnisse Abbildung 3.6: Ermittelte Anzahl der E. coli ohne die Differenzierung 25 23 21 20 KBE/ml 15 15 10 10 10 5 5 6 5 4 3 5 4 2 1 4 1 0 Regensiel Haselknick Desoxycholat-Agar Wulksfelde Chromocult-Agar Dradenau Endo-Agar Fluorocult-Agar 3.2.2 Ergebnisse der Untersuchungen auf Escherichia coli mit den MPN-Verfahren und Colilert®18-Verfahren Die Ergebnisse der MPN-Verfahren und der Colilert-18-Verfahren waren übereinstimmend. Die Probe Regensiel hatte bei dem MPN-Verfahren weniger als 0,3 Kolonien pro ml (Tab. 3.24) und mit dem Colilert-18-Verfahren lag die Koloniezahl bei 0,3 Kolonien pro ml (Tab. 3.25). Tabelle 3.24: Ergebnisse der Probe Regensiel mit MPN-Verfahren Positive Röhrchen Charakteristische Statistischer MPN Volumen Probe: Nr. Regensiel 1 2 3 1:10 0 0 0 1:100 0 0 0 1:1000 0 0 0 Zahl Tabellenwert (KBE/100ml) 0/0/0 0/0/0 0/0/0 <30 <30 <30 Tabelle 3.25: Ergebnisse der Probe Regensiel mit Colilert-18 Große Kleine Statistischer Colilert-18 Wells Probe: Regensiel Nr. 1 2 3 Wells Positive Reaktion 3 1 3 0 3 0 Mittelwert (KBE/ml) <0,30 Charakteristische Zahl Tabellenwert (KBE/100 ml) Verdünnung Mittelwert (KBE/ml) 3/1 3/0 3/0 4,1 3,1 3,1 1:10 1:10 1:10 0,30 Die Probe Haselknick (Tab. 3.26 und 3.27) zeigte bei beiden Verfahren die gleiche Keimzahlbelastung. Hier wurden 0,5 Kolonien pro ml ermittelt. 51 Kapitel 3: Ergebnisse Tabelle 3.26: Ergebnisse der Probe Haselknick mit MPN-Verfahren Positive Röhrchen Charakteristische Statistischer MPN Volumen Probe: Haselknick Nr. 1 2 3 4 1:10 2 1 0 0 1:100 0 0 0 1 1:1000 0 0 0 0 Zahl Tabellenwert (KBE/100ml) 2/0/0 1/0/0 0/0/0 0/1/0 90 40 <30 30 Tabelle 3.27: Ergebnisse der Probe Haselknick mit Colilert-18 Große Kleine Charakteristische Statistischer Colilert-18 Wells Probe: Haselknick Nr. 1 2 3 4 Wells Positive Reaktion 2 0 7 0 5 0 3 1 Zahl Tabellenwert (KBE/100ml) 2/0 7/0 5/0 3/1 2,0 7,4 5,2 4,1 Mittelwert (KBE/ml) 0,50 Verdünnung 1:10 1:10 1:10 1:10 Mittelwert (KBE/ml) 0,50 Die Probe Wulksfelde zeigte einen Unterschied beim MPN-Verfahren. Sie zeigte eine Keimzahl von 13 Kolonien pro ml (Tab. 3.28) und bei Colilert-18 lag sie bei 2 Kolonien pro ml. Tabelle 3.28: Ergebnisse der Probe Wulksfelde mit MPN-Verfahren Positive Röhrchen Charakteristische Statistischer MPN Volumen Probe: Wulksfelde Nr. 1 2 3 4 5 1:10 3 3 3 3 3 1:100 3 2 2 1 1 1:1000 0 1 0 1 1 Zahl Tabellenwert (KBE/100ml) 3/3/0 3/2/1 3/2/0 3/1/1 3/1/1 2400 1500 930 750 750 Tabelle 3.29: Ergebnisse der Probe Wulksfelde mit Colilert-18 Große Kleine Statistischer Colilert-18 Wells Probe: Wulksfelde Nr. 1 2 3 4 5 Wells Positive Reaktion 11 5 12 6 10 4 15 4 11 4 Mittelwert (KBE/ml) 13 Charakteristische Zahl Tabellenwert (KBE/100ml) Verdünnung Mittelwert (KBE/ml) 11/5 12/6 10/4 15/4 11/4 17,9 20,4 15,5 22,3 16,8 1:10 1:10 1:10 1:10 1:10 2 Der Wert der E. coli-Zahlen bei der Probe Dradenau enthielt bei beiden Verfahren die gleiche Keimzahlbelastung. Sie lag bei 1 Kolonie pro ml (Tab. 3.30 und 3.31). 52 Kapitel 3: Ergebnisse Tabelle 3.30: Ergebnisse der Probe Dradenau mit MPN-Verfahren Positive Röhrchen Charakteristische Statistischer MPN Volumen Probe: Dradenau Nr. 1 2 3 4 1:10 2 1 2 2 1:100 0 0 0 1 1:1000 0 0 0 0 Zahl Tabellenwert (KBE/100ml) 2/0/0 1/0/0 2/0/0 2/1/0 90 40 90 150 Tabelle 3.31: Ergebnisse der Probe Dradenau mit Colilert-18 Große Kleine Charakteristische Statistischer Colilert-18 Wells Probe: Dradenau Nr. 1 2 3 4 Wells Positive Reaktion 8 0 7 1 11 0 12 0 Zahl Tabellenwert (KBE/100ml) 8/0 7/1 11/0 12/0 8,6 8,5 12,2 13,5 Mittelwert (KBE/ml) 1 Verdünnung Mittelwert (KBE/ml) 1:10 1:10 1:10 1:10 1 3.3 Ergebnisse der Untersuchungen auf Escherichia coli und coliformen Bakterien mit dem Membranfiltrationsverfahren Das Membranfiltrationsverfahren wird mit E. coli und coliformen Bakterien gemeinsam präsentiert. Von den verdächtigen Kolonien auf dem Membranfilter wurden bis zu 10 Kolonien weiter untersucht und der Befund auf das Endergebnis hochgerechnet. Das Membranfiltrationsverfahren wurde mit sehr großen Verdünnungen vorbereitet. Die Standardarbeitsanweisung des Umweltamtes Hamburg beschreibt, dass dieses Verfahren mit einem Volumen von 100 ml durchgeführt werden soll. Während den Vorversuchen wurde festgestellt, dass die Durchführung des Verfahrens mit 100 ml Wasserprobe, ohne Verdünnung, zu keinen Ergebnissen führt. Dann wurden Verdünnungen von 1:100 gewählt. Die Identifizierung und Differenzierung der gelben bzw. gelb-orange Kolonien auf dem Membranfilter konnte kaum ausgewertet werden, da die Kolonien meist aufeinander gewachsen waren. Dies wurde nach 18 h Bebrütung bei 37°C beobachtet. Bei den ersten drei Paralleluntersuchungen wurde eine Verdünnung von 1:1000 gewählt und die Abwasserprobe wurde mit einer Verdünnung von 1:10000 durchgeführt. Erst mit diesen Verdünnungen konnten Ergebnisse erzielt werden. Die coliformen Bakterien waren bei der Probe Regensiel zu 90 Kolonien pro ml vorhanden. Dies ist die meist belastete Probe beim Membranfiltrationsverfahren. Die fäkalcoliforme Bakterien waren nicht vorhanden (Tab. 3.32). 53 Kapitel 3: Ergebnisse Tabelle 3.32:Membranfiltrationsverfahren für E. coli und Coliformenzahlen der Regensielprobe Membran- Verdächtige UmrechnugsKolonien auf wert filtration Membranfilter Nr. 28/47=7 Probe: 1 28 Regen20/4=5 2 20 siel 28/4=7 3 28 Coliforme der untersuchten Kolonien Coliforme Bakterien E. coli 3 1 0 21 5 28 0 0 0 Mittelwert (KBE/ml) Coliforme: 90 E. coli: 0 Der Mittelwert der Probe Haselknick lag bei 53 Kolonien pro ml. Hier konnten auch keine fäkalcoliforme Bakterien ermittelt werden (Tab. 3.33). Tabelle 3.33:Membranfiltrationsverfahren für E. coli und Coliformenzahlen der Haselknickprobe Membranfiltration Nr. Probe: 1 Hasel2 knick 3 4 Verdächtige Kolonien auf Membranfilter Umrechnugswert 45 41 34 22 45/6=7,5 41/6=6,83 34/6=5,6 22/6=3,6 Coliforme der untersuchten Kolonien Coliforme Bakterien E. coli 2 1 3 1 15 6,83 17 3,6 0 0 0 0 Mittelwert (KBE/ml) Coliforme: 53 E. coli: 0 Die Probe Wulksfelde hatte die zweithöchste Keimzahlbelastung mit 73 Kolonien pro ml. Der Mittelwert der E. coli lag bei 5 Kolonien pro ml (Tab. 3.34). Tabelle 3.34:Membranfiltrationsverfahren für E. coli und Coliformenzahlen der Wulksfeldeprobe Membranfiltration Nr. Probe: 1 2 Wulks3 felde 4 5 Verdächtige Kolonien auf Membranfilter Umrechnugswert 28 30 35 48 82 28/6=4,6 30/6=5 35/6=5,8 48/6=8 82/6=13,6 Coliforme der untersuchten Kolonien Coliforme Bakterien E. coli 4 1 2 3 1 18,6 5 12 24 13,6 4,6 0 0 0 0 Mittelwert (KBE/ml) Coliforme: 73 E. coli: 5 Die Probe Dradenau hatte einen Mittelwert von 49 Kolonien und die E. coli-Keimzahl lag bei 5 Kolonien pro ml (Tab. 3.35). 7 Anzahl der untersuchten Kolonien 54 Kapitel 3: Ergebnisse Tabelle 3.35:Membranfiltrationsverfahren für E. coli und Coliformenzahlen der Dradenauprobe Membran- Verdächtige UmrechnugsKolonien auf wert filtration Membranfilter Nr. 11/7=1,57 Probe: 1 11 Dra13/6=2,16 2 13 denau 11/7=1,57 3 11 12/6=2 4 12 Coliforme der untersuchten Kolonien Coliforme Bakterien E. coli 3 1 3 4 4,71 2,16 4,71 8 0 0 0 2 Mittelwert (KBE/ml) Coliforme:49 E. coli:5 Alle coliformen Bakterien lagen zwischen 50 – 90 Kolonien pro ml und bei den E. coli lies sich ein Mittelwert von 0 - 5 Kolonien pro ml feststellen. Diese Proben enthielten große Verdünnungen. 3.4 Miniaturverfahren zur Zählung von Escherichia coli Es konnten keine Ergebnisse für die Proben Regensiel, Haselknick, Wulksfelde und Dradenau bestimmt werden. Da diese Proben für ein Miniaturverfahren zu geringe E. coli-Keimzahlen hatten. Deshalb wurde beschlossen Proben mit höheren E. coli-Keimzahlen für dieses Verfahren einzusetzen. Es wurden noch 7 zusätzliche Proben genommen. Diese Proben wurden sowohl mit dem Miniaturverfahren (Mikrotiterplatten) als auch mit den anderen Verfahren untersucht. Tabelle 3. 36: Miniaturverfahren und Colilert-18-Verfahren für E. coli Escherichia coli: in KBE/ml Nr. Proben: Datum: Colilert-18 Miniaturverfahren 19.10.05 1 Schlemmer Bach, Billstedt 2 3 19.10.05 2 AS Billstedt 5 6 25.10.05 2 3 Winterhuder Brücke, Alster 17 25.10.05 3 4 Ammersbek, Bürgkamp 65 07.11.05 5 Moorfleet, Autobahn 24 3 4 07.11.05 6 Waltershof Autobahn 12 22 14.11.05 7 Georgswerder Bogen 2 3 Mittelwert in (KBE/ml) 15 6 Der Vergleich bei den Einzelwerten dieser 7 Proben, zwischen dem Colilert-18 und dem Miniaturverfahren ergab, dass das Colilert-18 in 3 von 7 Fällen drastisch unterschiedliche Ergebnisse liefert. Der Mittelwert für das Verfahren Colilert-18 für 7 Proben betrug 15 Kolonien pro ml. Im Gegensatz dazu erhielt das Miniaturverfahren einen Mittelwert von 7 Kolonien pro ml. Damit zeigte das Colilert-18 mehr als 2-fachen Belastungen der E. coli. 55 Kapitel 3: Ergebnisse Die Plattenmethoden für E. coli werden in Kolonienbildende Einheiten pro ml angegeben. Damit eine bessere Übersicht entsteht, ist das Desoxycholat-Agar-Verfahren, die höchsten Zahlen lieferte. Tabelle 3. 37: Zusammenfassung der Plattenmethoden für E. coli Plattenmethoden: KBE/ml bei Escherichia coli DesoxycholatEndo-C- Chromocult- FluorocultNr. Proben: 1 2 3 4 5 6 7 Georgsweder Bogen Schlemmer Bach, Billstedt AS Billstedt Moorfleet, Autobahn 24 Waltersdorf Autobahn Winterhuder Brücke, Alster Ammersbek, Bürgkamp Mittelwert in KBE/ml Agar Agar Agar Agar 75 10 35 15 40 40 70 41 15 8 25 20 20 25 50 23 5 5 10 10 30 45 40 21 5 5 7 5 5 10 15 7 Mit dem Desoxycholat-Agar wurden höhere Belastungen festgestellt als mit den anderen Nährböden. In nur 1 von 7 Fällen zeigte der Desoxycholat-Agar einen niedrigeren Wert (Tab. 3.37). Der Endo-C-Agar liefert geringe Anzahl der E. coli, als der Chromocult-Agar. Bei der Fluorocult-ECD-Agar wuchsen die wenigsten Keimzahlen. Im Zusammenhang mit Miniaturverfahren waren die Ergebnisse der Plattenmethode erheblich höher, als der des Miniaturverfahrens. Bei sechs Verfahren, die in diesem Abschnitt behandelt wurden, lag das Miniaturverfahren an der letzten Stelle mit den Keimzahlen (Abb. 3.6). Abbildung 3.7: Ermittelte Anzahl der Escherichia coli 50 41 KBE/ml 40 30 23 21 20 15 7 10 6 0 Desoxycholat-Agar Colilert-18Verfahren Endo-C-Agar Fluorocult-Agar Chromocult-Agar Miniaturverfahren Insgesamt betrachtet ist die Reihenfolge der Einzelwerte dieser Proben ähnlich der Reihenfolge der Ergebnisse der Parallelansätze, die im Kapitel 3.2 ermittelt wurden. Außer einige Werte, die man als Ausreißer bezeichnen könnte. 56 Kapitel 3: Ergebnisse 3.5 Ergebnisse der quantitativen Erfassung von coliformen Bakterien mit den einzelnen Verfahren Beim Vergleich der Verfahren mit den Plattenmethoden werden die Endergebnisse, die durch die Differenzierung und ohne die Differenzierung ermittelt wurden, dargestellt. Anschließend folgt der Vergleich zwischen MPN-Verfahren und Colilert-18-Verfahren. 3.5.1 Chromocult-Coliformen-Agar Mit diesem Agar wurde die höchste Keimzahl nach der Differenzierung mit der Oxidase-Text erreicht. Insgesamt waren 225 Kolonien pro ml, die durch einen Oxidase-Test als falschpositive Bakterien ermittelt wurden. Dies entspricht einen prozentualen Anteil von 81% (siehe Tab. 3.5). Zur Identifizierung der Kolonien bietet der Coliformen–Agar von allen verwendeten Nährböden eindeutig den besten Farbkontrast (Abb. 3.8). Auf dem hellen, transparenten Nährboden sind die rosa-roten Coliformen deutlich zu erkennen. Die Aufnahme der Volumen von dem Nährboden ist einwandfrei, da das Aufsaugen der Probe mit kleinen und großen Volumen mit dem Oberflächenausstrich problemlos war. Abbildung 3.8: Kolonien von coliformen Bakterien auf Chromocult-Coliformen-Agar 3.5.1.2 Endo-C-Agar Mit dem Endo-C-Agar war im Verlauf der Untersuchungen ein durchgehend geringes Koloniewachstum, mit Ausnahme einer Probe, festzustellen. In nur 1 von 4 Fällen wuchsen auf Endo-C-Agar mehr Kolonien als bei den anderen Plattenmethoden. Mit dem Oxidase-Test wurde ein Anteil von 63% an falsch positiven Nachweisen festgestellt (siehe Tab. 3.6). Das Ausplattieren und Auszählen der Kolonien auf dem Endo-C-Agar erwies sich als problematisch. Beim Ausplattieren mit dem Oberflächenausstrich durfte kein großes Volumen eingesetzt werden. Die Flüssigkeit wurde schlecht von den Nährböden aufgesaugt. Auf dem hellroten Nährboden wachsen die Kolonien in einem roten Farbton, so dass sie sehr schlecht zu erkennen sind. Teilweise waren die Nährboden, die aus der Nährbodenküche geliefert wurden, eher rot bis dunkelrot. Somit wurde die Identifizierung der Kolonien noch schwieriger. Deshalb wurde eine Lampe zu Hilfe genommen, um die roten Kolonien und den 57 Kapitel 3: Ergebnisse grünschimmernden Metallglanz besser überprüfen zu können. Ein beständiger, grünschimmernder Metallglanz (Fuchsinglanz) der Kolonien war bei einigen Parallelansätzen meist nicht zu erkennen (Abb. 3.9). Abbildung 3.9: Kolonien von coliformen Bakterien auf Endo-C-Agar 3.5.1.3 Desoxycholat-Agar Während der experimentellen Untersuchungen, ohne die Differenzierung, hatte das Desoxycholat-Agar-Verfahren die zweithöchste Keimzahl. In der Abbildung 3.10 sind zwei Ansätze für die Bunte Reihe aufgestellt. Der linke Ansatz ist eine bearbeitete Bunte Reihe und zeigt die Gasbildung bei den Laktose und Glucose Röhrchen. Die Indolbildung ist durch die violette Färbung zu erkennen und der Citrat-Röhrchen ist positiv. Der rechte Ansatz ist unbehandelt und macht den Unterschied deutlich. Abbildung 3.10: Die Bunte Reihe mit einem behandelten und unbehandelten Ansatz Insgesamt war durch die Differenzierung mit einer Bunten Reihe ein Anteil von 38% an falsch-positiven Bakterien (siehe Tab. 3.7). Dies ist darauf zuführen, dass der DesoxycholatAgar ein Nährboden ist, die thermotoleranten Bakterien wachsen lässt. Trotzdem zeigten die Platten eine gute Aufteilung der Kolonien, die auf eine richtige Durchmischung der Flüssigkeit mit Nährboden hindeutet. 58 Kapitel 3: Ergebnisse Der helle Nährboden ermöglicht eine problemlose Identifizierung der dunkelroten Kolonien mit dem Keimzählgerät (Abb. 3.11). Abbildung 3.11: Kolonien von coliformen Bakterien auf Desoxycholat-Agar 3.5.1.4 MPN-Verfahren und Colilert®18-Verfahren Die Ergebnisse der Keimzahlen von MPN-Ansätzen lagen deutlich unter den der Colilert-18Verfahren. In zwei Fällen wurde mit Colilert-18 sogar das 9 - 4fache als beim MPNVerfahren beobachtetBei dem MPN-Verfahren wurde keine weitere Differenzierung vorgenommen und beim Colilert-18 wurde die Identifizierung der Bakterien durchgeführt. Die Durchführung der MPN-Verfahren ist problemlos. Die Durchführung nimmt nicht viel Zeit in Anspruch. Aber die Bebrütungszeit ist im Gegensatz zu Colilert-18 doppelt so lang. Um ein schnelles Ergebnis zu erzielen ist der Colilert-18 vorteilhafter. Bei Colilert-18-Verfahren ist die Bebrütungszeit 18 Stunden und der Test muss exakt nach 18 Stunden ausgewertet werden. Nach Ablauf von 18 Stunden können andere heterotrophe Keime das Hemmsystem von Colilert-18 überwinden und könnten zu falsche Ergebnisse führen (Abb. 3.12). Abbildung 3.12: Colilert-18-Verfahren für coliforme Bakterien 59 Kapitel 3: Ergebnisse Die Auswertung der MPN-Röhrchen und der Colilert-18-Trays ist eindeutig. Die Gasbildung in den Durham-Röhrchen ist klar zu erkennen. Die Beurteilung der gelben Vertiefungen beim Colilert-18-Verfahren bereitet auch keine Probleme. Hierfür wird als Referenz die Komparator-Lösung mit dem Ansatz verglichen. Abbildung 3.13: MPN-Röhrchen für coliforme Bakterien 3.5.2 Ergebnisse der quantitativen Erfassung von Escherichia coli mit den einzelnen Verfahren Beim Vergleich der Verfahren mit den Plattenmethoden werden die Endergebnisse, die durch die Differenzierung ermittelt wurden, dargestellt. Zusätzlich wird noch der Fluorocult-ECDAgar eingesetzt, der nur für die Bestimmung von E. coli dient. Anschließend folgt der Vergleich zwischen MPN-Verfahren und Colilert-18-Verfahren. 3.5.2.1 Desoxycholat-Agar Mit diesem Agar hatten 3 Proben die höchsten Keimzahlen. Somit hatte der DesoxycholatAgar die höchsten Keimzahlen vor der Differenzierung mit der Bunten Reihe. Durch die Differenzierung wurde festgestellt, dass darunter die meisten falsch-positive Keime waren. Das Desoxycholat-Agar-Verfahren zeigte ein Anteil von 74% (siehe Tab. 3.22). In der Abbildung 3.14 sind die E. coli Bakterien auf den hellen Nährboden zu erkennen. Abbildung 3.14: Kolonien von E. coli auf dem Desoxycholat-Agar 60 Kapitel 3: Ergebnisse 3.5.2.2 Endo-C-Agar Die Koloniezahlen, die mit Endo-C-Agar durch die Differenzierung erreicht wurde, liegen an zweiter Stelle. In nur 1 von 4 Fällen wuchsen auf Endo-C-Agar mehr Kolonien als auf Desoxycholat-Agar. Der Anteil an falsch-positiven Keimen bei dem Endo-C-Agar liegt bei 30% (siehe Tab. 3.23) 3.5.2.3 Fluorocult-ECD-Agar Beim Fluorocult-Agar wurde die Differenzierung durch die Indolprüfung durchgeführt. Dieser Agar zeigt den nächstkleinsten Keimzahlen. Die E. coli-Keimzahlen blieben selbst durch die Indolprüfung unverändert (siehe Tab. 3.17-3.20). Die Saugfähigkeit der Fluorocult-Agar war begrenzt. Im Gegensatz dazu erwies sich nur ein Ansatz mit geringem Probenvolumen, als ungenügend. Deshalb müsste das gewählte Volumen lange mit dem Spatel gerieben werden. Zusätzlich wurde der Agar, bei 37°C ca. 5 Minuten erwärmt und sofort behandelt. Als vorteilhaft ist der helle Nährboden (Abb. 3.15) für die Identifizierung der hellblau fluoreszierenden Kolonien sehr geeignet. Abbildung 3.15: Fluorocult-ECD-Agar ohne Fluoroszenz 61 Kapitel 3: Ergebnisse 3.5.2.4 Chromocult-Coliformen-Agar Der Chromocult-Coliformen-Agar zeigte die niedrigsten E. coli-Keimzahlen vor der Differenzierung an. Hier ergaben sich bei allen 4 Untersuchungen geringe Keimzahlen außer bei einer Probe. Da der Chromocult-Coliformen-Agar ein Selektiv-Nährboden ist, waren bei der Differenzierung mit dem Oxisase-Test keine Unterschiede zu beobachten. Hier wurden keine falsch-positiven Ergebnisse ermittelt (siehe Tab. 3.21). Aufgrund der geringen Keimzahldichte auf den Platten hatten die Kolonien generell optimalen Wachstumsraum und es kam nicht zu Anhäufungen von mehreren Kolonien. Hier besteht kein Bedarf für die Nutzung eines Keimzählgerätes Dies zeigt auch die Abbildung 3.16. Abbildung 3.16: Kolonien von E. coli auf Chromocult-Coliformen-Agar 3.5.2.5 MPN-Verfahren und Colilert®18-Verfahren Die ermittelten Keimzahlen mit dem MPN-Verfahren und dem Colilert-18-Verfahren für E. coli waren übereinstimmend. In nur 1 von 4 Fällen lag das Ergebnis mit dem MPN-Verfahren höher als das Colilert-18-Verfahren. Bei den anderen 3 Untersuchungen waren die Ergebnisse der Keimzahlen identisch. Bei diesen Ergebnissen wurde keine Differenzierung vorgenommen. Die Auswertung der MPN-Röhrchen und der Colilert-18-Trays mit Hilfe einer UV-Lampe zeigte eindeutig gut unterscheidbare positive und negative Reaktionen (Abb. 3.17). 62 Kapitel 3: Ergebnisse Abbildung 3.17: MPN-Röhrchen mit Fluoreszenz 3.5.2.6 Membranfiltrationsverfahren zur quantitativen Erfassung von Escherichia coli und coliformen Bakterien Bei dem Membranfiltrationsverfahren wurden nur die laut DIN vorgeschriebenen Differenzierungen durchgeführt. Die Keimzahlbestimmung bei den coliformen Bakterien sowie der E. coli-Keimzahlen durch dieses Verfahren ist niedrig. Die Durchführung des Verfahrens ist einwandfrei. Aber es ist ein Verfahren, das erst nach 48 Stunden Ergebnis liefert. Außerdem müssen sehr große Verdünnungen gewählt werden. Bei der Abbildung 3.18 ist eine Membranfiltrationsanlage dargestellt. Abbildung 3.18: Membranfiltrationsanlage 3.5.2.7 Miniaturverfahren zur Zählung von Escherichia coli Das Miniaturverfahren wurde mit 7 verschiedenen Proben durchgeführt. Das Verfahren ergab sehr niedrige E. coli-Keimzahlen. Der Nachweis von E. coli durch Fluoreszenz im UV-Licht war eindeutig und die Durchführung des Miniaturverfahrens lief einwandfrei. Das Pipettieren mit der 8-Mehrkanal-Pipette wurde vor der Durchführung der Proben auf ihre Volumen geprüft. Somit wurde diese Fehlerquelle von Anfang an ausgeschlossen. Bei dem Miniaturverfahren sollten Proben gewählt werden, die höhere E. coliKeimzahlbelastung besitzen. Durch den Einsatz kleiner Probenvolumina ist dieses Verfahren 63 Kapitel 3: Ergebnisse insbesondere für die Untersuchung von Abwasser- und Oberflächengewässern geeignet. Bei der Abbildung 3.19 ist eine Mikrotiterplatte dargestellt. Abbildung 3.19: Mikrotiterplatte für ein Miniaturverfahren 3.6. Statischtische Prüfverfahren zur quantitativen Erfassung der Ergebnisse In diesem Abschnitt werden die Plattenmethoden für die coliformen und fäkalcoliformen Bakterien mit dem statischen Prüfverfahren untersucht. Es wurden die Mittelwerte der Verfahren ohne die Differenzierung d.h. die Gesamt-Keimzahlen inklusive falsch-positiven Ergebnisse betrachtet. Die Anzahl falsch-positiver Kolonien wurde auf die Gesamtheit der Koloniezahlen aller Platten bezogen. Damit ist die Bestimmung der Koloniezahl falschpositiver Kolonien der einzelnen Platten nicht gewährleistet. Aufgrund der Vielfalt der Bestimmungsmethoden wurde beschlossen nur die Ergebnisse der Plattenmethoden mit statistischen Prüfverfahren zu analysieren. 3.6.1 Anwendung statistischer Prüfverfahren auf die Ergebnisse der Untersuchungen mit coliformen Bakterien Bei der quantitativen Analyse der Plattenmethoden beobachtet man eine Variabilität und damit eine Streuung der Ergebnisse. Insgesamt wurden vier Proben mit verschiedenen Parallelansätzen durchgeführt und das sich daraus ergebende arithmetische Mittel bzw. der Mittelwert wurde für die Auswertung der Parallelansätze herangezogen. Die Tabelle 3.38 ermöglicht eine besseren Übersicht über die Plattenmethoden und den jeweiligen statistischen Größen. Die statistischen Größen setzen sich aus arithmetischem 64 Kapitel 3: Ergebnisse Mittelwert, Varianz, Standardabweichung und Variationskoeffizienten zusammen. Die Formeln für diese Größen sind im Kapitel 2.5.2.1 dargestellt. Tabelle 3.38: Coliformenzahlen mit dem statischen Prüfverfahren x Plattenmethoden Proben s2 s DesoxycholatAgar ChromocultAgar Endo-C-Agar Regensiel Haselknick Wulksfelde Dradenau Regensiel Haselknick Wulksfelde Dradenau Regensiel Haselknick Wulksfelde Dradenau 96 83 439 46 463 264 355 58 125 39 31 30 379 770 4084 73 3033 1940 3100 1575 175 89,67 180 150 19,46 27,75 63,90 8,54 55,07 44,04 55,67 39,69 13,23 9,47 13,42 12,25 v 0,20 0,33 0,15 0,19 0,12 0,17 0,16 0,68 0,11 0,24 0,43 0,40 V*100% 20 33 15 19 12 17 16 68 11 24 43 40 Der Variationskoeffizient ist eine Kenngröße für das Ausmaß der zufälligen Fehler und damit ein Maß für die Ungenauigkeit der verwendeten Bestimmungsmethode. Durch die Bestimmung der Standardabweichung konnten die Variationskoeffizienten berechnet werden. In 7 von 12 Fällen ist der Variationskoeffizient unter 20%. Je kleiner der Zahlenwert der Variationskoeffizienten, desto größer ist die Präzision der Bestimmungsmethode. In 7 Fällen ist die Genauigkeit der Bestimmungsmethode noch zu akzeptieren. Die größeren Abweichungen über 20% hängen mit der Streuung der Einzelwerte um ihren Mittelwert zusammen. In 5 Fällen sind diese Streuungen zu beobachten, in denen der Variationskoeffizient in einem Bereich von 33 bis 63% liegt. Die Einzelwerte der Plattenmethoden sind im Kapitel 3.2.3 nachzusehen. 3.6.2 Ergebnisse der E. coli mit dem statistischen Prüfverfahren Bei den Ergebnissen der E. coli wurden auch arithmetischer Mittelwert, Varianz, Standardabweichung und Variationskoeffizienten berechnet. Tabelle 3.39: E. coli-Keimzahlen mit dem statischen Prüfverfahren x Plattenmethoden Proben s2 s DesoxycholatAgar ChromocultAgar Regensiel Haselknick Wulksfelde Dradenau Regensiel Haselknick Wulksfelde Dradenau 23 10 10 21 3 1 2 4 8,5 13 25 73 33,5 6,33 20 6,3 65 2,91 3,61 5 8,54 5,79 2,51 4,47 2,51 v V*100% 0,13 0,36 0,50 0,40 1,93 2,51 2,23 0,63 13 36 50 40 193 251 223 63 Kapitel 3: Ergebnisse Endo-C-Agar Fluorocult-Agar Regensiel Haselknick Wulksfelde Dradenau Regensiel Haselknick Wulksfelde Dradenau 5 15 6 1 5 4 5 4 -8 58,3 1,25 6,3 23 12,5 6,3 7,64 1,12 2,51 4,79 3,5 2,51 0,50 0,18 2,51 1,19 0,70 0,63 50 18 251 119 70 63 Die Ergebnisse der Variationskoeffizienten zeigen, dass nur die Bestimmungsmethode in nur 2 von 15 Fällen präzise ist mit einem Variationskoeffizient unter 20%. Bei den anderen Fällen wurden sehr große Ungenauigkeiten ermittelt, obwohl die Streuung der Einzelwerte um ihren Mittelwert teilweise gering war. Aber der arithmetische Mittelwert ist bei den E. coliKeimzahlen sehr gering und dementsprechend die einzelne Kolonienzahl der Platten. Dies könnte ein Grund für die höheren Variationskoeffizienten sein. Ein weiterer Grund dafür ist die geringe Anzahl der Proben. Diese Faktoren beeinflussen die Ermittlung der Variationskoeffizienten für die E. coli-Keimzahlen. Durch diese Vorgehensweise ist festzuhalten, dass die Standardabweichung, Varianz und der Variationskoeffizienten mit geringer Anzahl der Kolonien und der Proben nicht zu bewerten ist. In der Tabelle sind Bemerkungen wie „keine“ angeführt. Hier konnte die Variationskoeffizienten nicht ermittelt werden, da die Streuung der Einzelwerte gleich dem arithmetischen Mittelwert war. Somit ist ein statisches Prüfverfahren nicht durchführbar. 3.7 Untersuchungen von Umweltproben Zusätzlich zu den Hauptuntersuchungen mit den Parallelansätzen (4 Proben) wurden Untersuchungen mit verschiedenen Wasserproben durchgeführt. Insgesamt wurden 107 Proben aus der Bille, Elbe, Alster, einige Sonderproben und dem Ablauf der Kläranlage Dradenau, untersucht. Die Proben wurden parallel vom Amt für Umweltuntersuchungen mit den routinemäßigen Methoden analysiert. Coliforme Bakterien und Escherichia coli Bei der Untersuchung natürlicher Umweltproben tritt beim Endo-C-Agar, im Vergleich zu den Paralleluntersuchungen, zum Teil ein wesentlich stärkerer Bewuchs der Platten auf. Hier wurde möglichtst frische Nährböden verwendet. Das Auszählen der Kolonien von coliformen Bakterien und E. coli auf Endo-C-Agar wird dadurch erschwert. Obwohl eine Lampe zur Identifizierung der Kolonien genommen wurde, könnten viele Kolonien nicht eindeutig als coliforme Bakterien bzw. E. coli identifiziert werden. Zur Sicherheit wurde ein Oxidase-Test durchgeführt. Durch die Oxidation von Sulfit wird der Nährboden rot gefärbt. Da die Kolonien von coliformen Bakterien und E. coli jedoch durch 8 nicht berechenbar 66 Kapitel 3: Ergebnisse eine Rotfärbung identifiziert werden, ist der Farbkontrast zwischen Kolonien und Nährboden gering. Zudem bilden Begleitorganismen zum Teil farblich ähnliche Kolonien. Der theoretisch grünschimmernde Fuchsinglanz bei Kolonien von E. coli war nicht immer festzustellen. Der Chromocult-Coliformen-Agar ermöglicht den simultanen Nachweis von coliformen Bakterien und E. coli. Die Kolonien coliformer Bakterien sind theoretisch rosa-rot gefärbt, die von E. coli dunkelblau-violett. Bei der Untersuchung der Gewässerproben war dieser Farbunterschied nicht in allen Fällen deutlich zu erkennen. Einige Kolonien waren weder eindeutig rosa-rot noch eindeutig dunkelblau-violett gefärbt. Zur Identifizierung der Kolonien wurde auch ein Oxidase-Test vorgenommen. Das Auszählen der Kolonien auf Desoxycholat-Agar sowie die Auswertung der MPNVerfahren und Colilert-18-Verfahren ergab dagegen keine gravierenden Unterschiede zu den Parallelansätzen. Im Anhang (CD-Rom) sind die Ergebnisse der quantitativen Bestimmung von coliformen Bakterien und E. coli der verschiedenen Gewässerproben dargestellt. Die Ergebnisse aller Proben zeigen eine sehr gute Übereinstimmung mit den Werten, die vom Fachamt für Umweltuntersuchungen ermittelt wurden. Zudem liegen die Werte dicht zusammen, es gibt keine signifikanten Abweichungen. Insgesamt sind die Keimzahlen der Plattenmethoden vor allem Chromocult-Coliformen-Agar und Desoxycholat-Agar deutlich über denen der MPN-Verfahren. Auffallend sind die Minimalwerte beim Miniaturverfahren. Die Ergebnisse dieser Proben sind im Anhang (CD-Rom) zu entnehmen. 3.8 Vergleich von Ergebnisse der Alster- und Elbeproben In der Hygiene Institut Hamburg wird der Alster und die Elbe regelmäßig auf bestimmte Parameter wie zum Beispiel E. coli, Coliforme Bakterien, Salmonellen, etc. untersucht. Hier werden die Proben vom 2003 bis 2005 mit den Bestimmungsmethoden Desoxycholat-AgarVerfahren und Colilert-18-Verfahren ausgewertet. 3.8.1 Vergleich der Alsterproben mit den MPN-Verfahren In diesem Abschnitt werden Vergleiche von den alten Proben aus Alster und Elbe vorgenommen. Zuerst werden die Proben aus der Alster 2003 – 2005 verglichen. Insgesamt werden 273 Proben, die während der Jahre 2003-2005 im Hygiene Institut Hamburg untersucht wurden, behandelt. Im Jahr 2003 wurden 44 Proben mit den MPN-Verfahren und dem Colilert-18-Verfahren durchgeführt. Beim Vergleich zwischen den beiden Verfahren stellte sich heraus, dass das Colilert-18-Verfahren bei den coliformen Bakterien geringfügigen Wert lieferte als das MPN67 Kapitel 3: Ergebnisse Verfahren. Das Colilert-18-Verfahren zeigte einen Mittelwert von 3 KBE/ml und das MPNVerfahren einen Mittelwert von 2 KBE/ml. Bei den fäkalcoliformen Bakterien lieferten beide Verfahren Ergebnisse unter 1 KBE/ml. Diese Proben hatten keine Richtwertüberschreitungen gem. EG-Badegewässerrichtlinie. Es wurden Informationen aus der Wetterdienststelle9 zur Wetterbeobachtung für das Jahr 2003 beschafft. Hier wurden die Wetterdaten vom April bis September ausgewertet. Auffallend sind die Ergebnisse bei den Wettereigenschaften wie Regen und erhöhte Temperaturen. Es ist festzuhalten, dass erhöhte Werte bei diesen Parametern häufiger auftraten. Da beide Verfahren gleichzeitig durchgeführt wurden, sind die Ergebnisse der MPN-Verfahren und Colilert-18-Verfahren kaum zu unterscheiden. Im Jahr 2004 und 2005 wurde nur das MPN-Verfahren durchgeführt. Insgesamt waren, im Jahr 2004, 149 Proben und im Jahr 2005, 80 Proben bearbeitet worden. Die Ergebnisse von 2004 bei den coliformen Bakterien zeigten einen Mittelwert von 15 KBE/ml und bei den fäkalcoliformen Bakterien von 3 KBE/ml. In diesem Jahr sind die Ergebnisse deutlich höher als im Jahr 2003. Der Grund dafür ist, dass im Jahr 2004 sehr hohe Temperaturen zwischen den Monaten Juni bis Mitte September zu beobachten waren. Die Temperaturen lagen teilweise über 30°C, was die starke Vermehrung der Bakterien erklären könnte. Außerdem waren häufig auftretende Regenfälle ein Grund für die Grenzwertüberschreitungen gem. EGBadegewässerrichtlinien, die während 2004 zu verfolgen waren. Im Gegensatz dazu waren die Ergebnisse im Jahr 2005 niedriger. Die coliformen Bakterien lagen mit einem Mittelwert von 7 KBE/ml und die fäkalcoliformen Bakterien waren unter einer Kolonie pro ml. Der Vergleich bei den Alsterproben von 2003 bis 2005 beim MPN-Verfahren macht deutlich, dass im Jahr 2004 die höchsten Werte an Koloniebildenden Einheiten zu finden sind. Wenn andere Bestimmungsmethoden parallel zu den MPN-Verfahren durchgeführt worden wären, würde man bessere und sichere Aussagen über die erhöhten Ergebnisse machen können. 3.8.2 Vergleich der Elbeproben mit verschiedenen Verfahren Die Elbeproben werden in zwei Bereiche unterteilt. Der erste Bereich ist die „Kleine Elbe“ und der zweite die „Große Elbe“. Die „Kleine Elbe“ besteht aus den Probenahmestellen Zollenspieker und Seemannshöft und die „Große Elbe“ aus 36 Probenahmestellen wie zum Beispiel Cuxhaven Kugelbake, Hallerwettern, Glückstadt Nebenelbe etc. 3.8.2.1 Vergleich der Elbeproben aus der „Kleine Elbe“ Bei der Probenahmestellen Zollenspieker und Seemannshöft wurde das MPN-Verfahren und das Desoxycholat-Agar-Verfahren durchgeführt. 9 Quelle: www.wetteronline.de 68 Kapitel 3: Ergebnisse Im Jahr 2003 wurden insgesamt 9 Untersuchungen auf coliforme und fäkalcoliforme Bakterien mit den beiden Bestimmungsmethoden für die Probe Zollenspieker vorgenommen. Das Desoxycholat-Agar-Verfahren für diese Probestelle bei den coliformen Bakterien hatte einen Mittelwert von 71 KBE/ml und bei den fäkalcoliformen Bakterien von 5 KBE/ml geliefert. An der Probenahmestelle Seemannshöft wurden im Jahr 2003 insgesamt 11 Proben entnommen. Davon wurden 9 Proben auf coliforme und fäkalcoliforme Bakterien und 2 Proben nur auf fäkalcoliforme Bakterien untersucht. Der Anzahl der coliformer Bakterien liegt beim Desoxycholat-Agar-Verfahren bei 39 KBE/ml und bei der Anzahl fäkalcoliformer bei 6 KBE/ml. Mit dem MPN-Verfahren wurden Mittelwerte von 25 KBE/ml und bei den fäkalcoliformen von 4 KBE/ml ermittelt. Hier ist festzustellen, dass der Desoxycholat-Agar die höchsten Ergebnisse liefert.Bei der Auswertung der Wetterdaten für 2003 wurde festgestellt, dass die Temperaturen zwischen Juni bis September recht hoch waren. Sie lagen zwischen 20 – 35°C. Die Proben, die im Jahr 2004 und 2005 untersucht wurden, zeigen die gleiche Rangordnung der Verfahren. Das Desoxycholat-Agar-Verfahren zeigte immer die höheren Mittelwerte. Teilweise sind die Mittelwerte der Desoxycholat-Agar-Verfahren 5-7fach höher als die der MPN-Verfahren. Der Grund dafür ist, dass auf Desoxycholat-Agar auch weitere thermotolerante Bakterien wachsen. Bei diesen Proben wurde auch beobachtet, dass bei Regenwetter höhere Keimzahlen zu ermitteln waren. Der Regen verursacht eine zusätzliche Nährquelle für Bakterien, die diese Nährstoffe in ihrem Stoffwechsel aufnehmen. Die Temperaturen im Jahr 2004 und 2005 lagen zwischen 20 – 32°C, die auch eine Begünstigung für die Vermehrung der coliformen Bakterien darstellt. Teilweise wurde sogar in einigen Tagen die Erhöhung der Temperaturen über 30°C beobachtet, die sich bei den Ergebnissen der Desoxycholat-Agar-Verfahren widerspiegeln. Allgemein betrachtet liegen die coliformen sowie auch die fäkalcoliformen Bakterien unter den Leit- und Grenzwerten der EG-Richtlinien. 3.8.2.2 Vergleich der Elbeproben aus der „Große Elbe“ Im Jahr 2004 wurden vier Untersuchungen10 und 2005 wurden fünf Untersuchungen der „Große Elbe“ mit 36 Proben durchgeführt. Diese Untersuchungen wurden mit dem Colilert-18-Verfahren bearbeitet. Bei diesen Proben werden für 2004 und 2005 vier Untersuchungen aus den Stellen von Vogelsand Norderelbe bis zur Oberhalb Elbstorf, Geesthacht Proben ausgewertet. Die Keimzahlen der coliformen und fäkalcoliformen Bakterien sind in diesen Jahren sehr gering. Deshalb wird die Koloniebildende Einheiten in 100 ml Wasserprobe angegeben. 10 Summe der bearbeitende Proben 69 Kapitel 3: Ergebnisse Die Ergebnisse im Jahr 2004 liefern im Vergleich zu 2005 höhere Mittelwerte. Im Jahr 2004 liegen beim Colilert-18-Verfahren die coliformen Bakterien bei 2314 KBE pro 100 ml und die fäkalcoliformen Bakterien bei 42 KBE pro 100 ml. Der Mittelwert der coliformen Bakterien ist erheblich höher als der von fäkalcoliformen Bakterien. Der Sommer 2004 hatte hohe Temperaturen von 25-35 °C, die optimale Bedingungen für die Vermehrung der coliformen Bakterien hindeutet. Die fäkalcoliformen Bakterien hatten nicht dieselben Bedingungen wie von den coliformen Bakterien. Deshalb könnte keine Vermehrung stattfinden. Die Ergebnisse im Jahr 2005 waren niedriger als im Jahr 2004. Aber die fäkalcoliformen Bakterien waren im Gegensatz zu den Fäkalcoliformen im Jahr 2004 sehr hoch. Der Mittelwert der fäkalcoliformen Bakterien beträgt 104 KBE pro 100 ml und der von coliformen Bakterien 1392 pro 100 ml. Allgemein betrachtet liegen die Ergebnisse der coliformen und fäkalcoliformen Bakterien unter den Leit- und Grenzwerten der EG-Richtlinien. 70 Kapitel 4: Schlussfolgerungen 4. Schlussfolgerungen 4.1 Analytische Qualitätssicherung für coliforme Bakterien Bei der quantitativen Analytik von biologischen Parametern sind bislang nur wenige Maßnahmen zur analytischen Qualitätssicherung im Einsatz. Als grundlegendes Element der statistischen Datenkontrolle quantitativer Bestimmungen gelten Kontrollkarten. Die Verwendung der Kontrollkarten zur analytischen Qualitätssicherung mit Hilfe von Referenzmaterial, führt zu einer übersichtlichen Darstellung der Ergebnisse. Während der experimentellen Untersuchungen wurden nur Referenzmaterial für die qualitative Bestimmung der Verfahren verwendet. Aufgrund dessen konnte keine Anwendung der Kontrollkarten stattfinden. Zur qualitativen und quantitativen Bestimmung von coliformen und fäkalcoliformen Bakterien wurden daher verschiedene bewährte Verfahren eingesetzt. Es wurden SelektivNährböden, wie zum Beispiel Desoxycholat-Agar, Chromocult-Coliformen-Agar, Endo-CAgar und Fluorocult-ECD-Agar angewendet. Zusätzlich wurde das MPN-Verfahren als Dreifachansatz, MPN-Miniaturverfahren, Colilert-18-Verfahren und das Membranfiltrationsverfahren eingesetzt. Die Vorgehensweise dieser experimentellen Untersuchung beruht auf statistischen Verfahren. Die einzelnen Verfahren werden mit vier Proben, die drei, vier und fünf Parallelansätze pro Versuchsreihe enthalten, durchgeführt. Die sich daraus ergebenden Mittelwerte, Varianzen, Standardabweichungen, sowie Variationskoeffizienten werden für die Auswertung herangezogen. Aufgrund der auftretenden Streuung und damit einer oft beträchtlichen Variabilität, finden die statistischen Verfahren bei den quantitativen Untersuchungen eine Anwendung. Es ist zu bemerken, dass aus der Vielfalt der Bestimmungsmethoden nur bei den Plattenmethoden eine statistische Auswertung durchgeführt wird. Insgesamt betrachtet ist der Chromocult-Coliformen-Agar der Nährboden, der das höchste Koloniewachstum zeigt. Als zweites kommt das Desoxycholat-Agar für die coliformen Bakterien. Das Colilert-18-Verfahren zeigt die nächstkleinste Keimzahlbelastung. Dann folgt das Membranfiltrationsverfahren mit den coliformen Bakterien. Anschließend kommt das Endo-C-Agar und zum Schluss das MPN-Verfahren. Die Ermittlung der Varianzkoeffizienten bei den einzelnen Proben zeigt, dass das Desoxycholat-Agar-Verfahren die geringsten zufälligen Fehler hervorruft. Hier ist die Streuung der Einzelwerte um ihren Mittelwert gering und damit ist die Präzision der Bestimmungsmethode bedeutend. Dies spiegelt sich bei den Ergebnissen nach der Differenzierung der Plattenmethoden wieder. Hier zeigt das Desoxycholat-Agar-Verfahren prozentual die niedrigsten falsch-positiven Anteile, im Gegensatz zu dem ChromocultColiformen-Agar und dem Endo-C-Agar. Der Desoxycholat-Agar steht an erster Stelle mit einem Anteil von 38% (Tab. 3.7). Die Differenzierung der coliformen Bakterien wird durch einen Oxidase-Test, für Endo-C-Agar sowie Chromocult-Coliformen-Agar, und eine Bunte Reihe für Desoxycholat-Agar durchgeführt. Bei der Differenzierung mit dem Oxidase-Test 70 Kapitel 4: Schlussfolgerungen steht der Endo-C-Agar an zweiter Stelle. Er zeigt einen falsch-positiven Anteil an coliformen Bakterien von 63% (Tab. 3.6). Der Chromocult-Coliformen-Agar ist ein Nährboden, der die höchsten falsch-positiven Ergebnisse mit einem Anteil von 81 % anzeigt. Die prozentualen Anteile sind als Mittelwert der einzelnen Verfahren zusammengefasst. 4.2 Analytische Qualitätssicherung für fäkalcoliforme Bakterien (E. coli) Die E. coli-Keimzahlen unterscheiden sich von den Keimzahlen der coliformen Bakterien. Der Desoxycholat-Agar zeigt das höchste Koloniewachstum von allen Verfahren. Die zweithöchste Keimzahl liefert der Endo-C-Agar. Dann folgt der Fluorocult-ECD-Agar, der nur für die Bestimmung von E. coli dient. Als nächstes folgt das MPN-Verfahren, dem der Chromocult-Coliformen-Agar und das Membranfiltrationsverfahren, mit den gleichen KBE/ml, folgen. Das Colilert-18-Verfahren zeigt die kleinste Keimzahlbelastung von E. coli an. Die Validierung der Plattenmethoden mit statistischen Prüfverfahren und die Interpretation ihrer Ergebnisse sind kompliziert, da sie bei den fäkalcoliformen Bakterien einen erheblichen Grund an Variabilität aufweisen. Hier ist nur das Desoxycholat-Agar-Verfahren, das einen prozentuellen Mittelwert der Variationskoeffizienten von 35% liefert. Bei den anderen Plattenmethoden sind sehr große Abweichungen, die teilweise bis zu 100% erreichen, zu beobachten. Der Grund für große Abweichung ist die geringe Anzahl der Proben sowie auch der vorhandenen Kolonien auf den Nährböden. Daraus ergibt sich, dass ein statistisches Prüfverfahren nur mit höherer Anzahl von Proben durchzuführen ist. Der Chromocult-Coliformen-Agar zeigt kein Unterschied durch die Differenzierung mit einem Oxidase-Test. Dies macht deutlich, dass der Chromocult-Agar bei den fäkalcoliformen Bakterien keine falsch-positiven Ergebnisse liefert. Bei der Differenzierung der Endo-C-Agar mit dem Oxidase-Test liefert das Verfahren einen Anteil von 30% (Tab. 3.23). Der Desoxycholat-Agar zeigt durch die Differenzierung einen Anteil an falsch-positiven Kolonien von 74% (Tab. 3.22). Das Miniaturverfahren wird gesondert in 7 Wasserproben mit dem Colilert-18-Verfahren und den verschiedenen Plattenmethoden verglichen. Der Vergleich zwischen Colilert-18Verfahren und Miniaturverfahren macht deutlich, dass der Colilert-18 höhere Ergebnisse liefert. Hier ist eine Verdopplung der festgestellten E. coli-Keimzahlen zu beobachten (Tab. 3.36). Bei den Plattenmethoden ist der Desoxycholat-Agar an erster Stelle mit den E. coliKeimzahlen (Tab. 3.37). Die Reihenfolge der Plattenmethoden, bei den 7 Wasserproben, haben die gleiche Reihenfolge der E. coli-Keimzahlen der Hauptuntersuchung11. Insgesamt liefert das Miniaturverfahren niedrigere E. coli-Keimzahlen. Es liegt an letzter Stelle bei allen Verfahren. 11 Parallelansätze von 4 Proben 71 Kapitel 4: Schlussfolgerungen 4.3 Bewertung der Bestimmungsmethoden Die Ergebnisse der Keimzahlbestimmung mit den Parallelansätzen bei coliformen Bakterien und anschließend die statistische Auswertung (Kapitel 3.5 3) führen zu der Erkenntnis, dass die Anwendung des Desoxycholat-Agar-Verfahrens von Oxoid bei den Plattenmethoden die zuverlässigste Methode darstellt. Die Durchführung sowie die Auswertung auf dem hellroten Nährboden sind einwandfrei. Im Vergleich dazu kann der Chromocult-Coliformen-Agar für coliforme Bakterien nicht empfohlen werden. Dieses Verfahren liefert keine ausreichend präzisen Ergebnisse, wie durch die Differenzierung mit einem Oxidase-Test und die statistische Auswertung ermittelt wurde. Im Gegensatz dazu zeigte das ChromocultColiformen-Agar bei den fäkalcoliformen Bakterien präzise Ergebnisse, die durch die Differenzierung bestätigt wurde. Die Durchführung sowie die Auswertung der Ergebnisse auf dem hellen Nährboden erfolgten dagegen problemlos. Der Fluorocult-ECD-Agar bewies, dass sie zuverlässige Ergebnisse liefert. Die E. coliKeimzahlen blieben selbst durch die Indolprüfung unverändert. Als vorteilhaft ist der helle Nährboden für die Identifizierung der hellblau fluoreszierenden Kolonien sehr gut geeignet. Im Gegensatz dazu ist die Saugfähigkeit der Fluorocult-Agar begrenzt und somit besitzt das Verfahren einen erheblich großen Arbeitsaufwand sowie auch Materialaufwand. Die Verwendung von Endo-C-Agar kann aufgrund der unbefriedigenden Ergebnisse, die sich auch während der ersten Differenzierung der Colilert-18-Verfahren bewiesen hat, sowie der Schwierigkeit beim Auszählen der Kolonien nicht empfohlen werden. Generell sollte dieser Nährboden wegen seiner gesundheitlich bedenklichen Wirkstoffe nicht für den täglichen Gebrauch eingesetzt werden. Bei den Colilert-18-Verfahren, MPN-Verfahren, Miniaturverfahren und Membranfiltrationsverfahren wurden keine statistischen Prüfverfahren angewendet. Die Ergebnisse der Keimzahlbestimmung mit den Parallelansätzen führen zu der Erkenntnis, dass die Anwendung des Colilert-18-Verfahrens von Idexx die zuverlässigste Methode darstellt. Bei der Auswertung der Ergebnisse des Colilert-18 ist ein Verdacht auf falschpositive Ergebnisse entstanden. Durch die zweite Differenzierung mit der „Langen Bunten Reihe“ wurde bestätigt, dass die untersuchten Kolonien coliforme und auch fäkalcoliforme Bakterien sind. Das Verfahren ermöglicht den endgültigen Nachweis der coliformen und fäkalcoliforme Bakterien in einem Anreicherungsschritt innerhalb von 18 Stunden. Die Durchführung sowie die Auswertung der MPN-Verfahren (Mehrfachansatz) mit 3 Parallelansätzen können nicht empfohlen werden. Dieses Verfahren liefert keine ausreichend präzisen Ergebnisse. Hinzu kommt der erheblich höhere Arbeits- und Materialaufwand. Für das miniaturisierte MPN-Verfahren mit Mikrotiterplatten hingegen ist eine ausreichende statistische Sicherheit durch die hohe Zahl an Parallelansätzen gewährleistet. Die Beimpfung der Mikrotiterplatten mit Hilfe des speziellen Zubehörs lässt sich wesentlich schneller und übersichtlicher als das Pipettieren bei einem MPN-Mehrfachansatz durchführen. Die optische Auswertung der bebrüteten Mikrotiterplatten ist problemlos. Dieses Verfahren zeigt bei allen Untersuchungsverfahren die niedrigste E. coli-Keimzahlen. Deshalb ist das Verfahren für 72 Kapitel 4: Schlussfolgerungen Proben mit Vorinformation auf die Keimbelastung bzw. für die Untersuchung von Abwasserproben geeignet. Die Verwendung der Membranfiltrationsverfahren kann nur für Proben mit Vorinformation empfohlen werden. Die Durchführung ohne den geeigneten Verdünnungsfaktor liefert keine Ergebnisse aufgrund des massenhaften Koloniewachstums. Hierzu kommt noch der erheblich größere Zeitaufwand des Verfahrens. Die Tabelle 4.1 zeigt eine Übersicht über den Materialaufwand für die einzelnen Verfahren. Tabelle 4.1: Materialkosten der unterschiedlichen Flüssig- und Festnährböden Methode Plattenverfahren: Desoxychoalt-Agar Chromocult-Coliformen-Agar Endo-C-Agar Fluorocult-ECD-Agar MPN-3er Ansatz Colilert-18-Verfahren Miniaturverfahren mit Mikrotiterplatten Membranfiltrationsverfahren Materialkosten in € für einen Bestimmungstest (1 Platte) 0,72 0,35 0,35 1,19 5,4 (9 Röhrchen) 5,65 11,12 (1 Platte) 1,15 Beim Vergleich aller Verfahren zur Bestimmung von Coliformen lässt sich feststellen, dass das Einmischverfahren mit Desoxycholat-Agar nach der Differenzierung mit der Bunten Reihe, und der Colilert-18-Verfahren die besten Resultate liefert. Beim Vergleich der Verfahren zur Bestimmung von E. coli lässt sich feststellen, dass der Oberflächenausstrich mit Fluorcult-ECD-Agar, Chromocult-Coliformen-Agar, Colilert-18Verfahren und das Miniaturverfahren die präzisen Ergebnisse liefern. Die Tabelle 4.2 und 4.3 zeigen eine Zusammenfassung über die Bewertung der einzelnen Verfahren. Tabelle 4.2 Zusammenfassung über die Bewertung der Bestimmungsmethoden für coliforme Bakterien Bestimmungsmethoden für coliformen Bakterien BestimmungsDurchführung Oxidase- Bunte Bebrütungs- MaterialMethoden: Test Reihe zeit aufwand 12 Chromocult-Agar ++ x ++ ++ Desoxycholat-Agar + x ++ + Endo-C-Agar -x ++ ++ MPN-Verfahren Colilert-18-Verfahren + x ++ Membranfiltationsx -+ verfahren Zuverlässigkeit -+ -++ 0 Bewertungsmerkmale: sehr schlecht:“ -- „ schlecht:“ - „ trifft nicht zu:“ 0 „ gut:“ + „ sehr gut:“++ „ 12 durchgefüht 73 Kapitel 4: Schlussfolgerungen Tabelle 4.3 Zusammenfassung über die Bewertung der Bestimmungsmethoden für fäkalcoliforme Bakterien Bestimmungsmethoden für fäkalcoliforme Bakterien BestimmungsDurchführung Oxidase- Bunte Bebrütungs- MaterialMethoden: Test Reihe zeit aufwand Chromocult-Agar ++ x ++ ++ Desoxycholat-Agar + x ++ + Endo-C-Agar -x ++ ++ Fluorocult-ECD-Agar ++ + MPN-Verfahren Colilert-18-Verfahren + x ++ Miniaturverfahren ++ -Membranfiltationsx -+ verfahren Zuverlässigkeit ++ -++ ++ ++ 0 Bewertungsmerkmale: sehr schlecht:“ -- „ schlecht:“ - „ trifft nicht zu:“ 0 „ gut:“ + „ sehr gut:“++ „ 74 Kapitel 4: Zusammenfassung Hochschule für Angewandte Wissenschaften Hamburg Fachbereich Naturwissenschaftliche Technik Sabani Serani, Dzevrije Studiengang: Biotechnologie Zusammenfassung der Diplomarbeit Thema: „Experimentelle Prüfung verschiedener Methoden der quantitativen Bestimmung gesamtcoliformer und fäkalcoliformer Bakterien (E. coli) für die qualitative Bewertung von Wasserproben“. Zur Optimierung der analytischen Qualitätssicherung bei der quantitativen Bestimmung von gesamtcoliformen und fäkalcoliformen Bakterien in Wasserproben, wurden im Hygieneinstitut Hamburg, Untersuchungen mit mehreren Bestimmungsmethoden durchgeführt. Neben verschiedenen Plattenmethoden wurde das MPN-Verfahren als Dreifachansatz, MPN-Miniaturverfahren mit Mikrotiterplatten, Colilert-18-Verfahren und das Membranfiltrationsverfahren eingesetzt. Die einzelnen Verfahren wurden mit vier Proben, die drei, vier und fünf Parallelansätze pro Versuchsreihe (Hauptuntersuchung) enthielten, durchgeführt. Die Auswertung der Ergebnisse der Plattenmethode erfolgte mit Hilfe von weiteren Differenzierungen und von statistischen Prüfverfahren. Die Differenzierung wurde durch ein Oxidase-Test, für Endo-C-Agar sowie Chromocult-Coliformen-Agar und einer Bunte Reihe für Desoxycholat-Agar durchgeführt. Eine weitere Differenzierung wurde bei dem Colilert18-Verfahren mit der Langen Bunten Reihe vorgenommen. Bei der statistischen Prüfverfahren wurden die arithmetischen Mittelwerte, Varianzen, Standardabweichungen, sowie Variationskoeffizienten zur Auswertung der Ergebnisse herangezogen. Es ist zu bemerken, dass aus der Vielfalt der Bestimmungsmethoden nur bei den Plattenmethoden eine statistische Auswertung durchgeführt wurde. Es stellt sich heraus, dass ein statistisches Prüfverfahren mit geringer Anzahl von Proben in der bakteriologischen Wasseruntersuchung nicht zu empfehlen ist. Deshalb sind die Differenzierungen der experimentellen Untersuchungen von Bedeutung. Die quantitative Bestimmung von coliformen Bakterien ergibt, dass das Desoxycholat-AgarVerfahren der Firma Oxoid und das Colilert-18-Verfahren der Firma Merck die quantitativ besten Ergebnisse liefern. Für den Nachweis von E. coli eignet sich vor allem der FluorocultECD-Agar, Chromocult-Coliformen-Agar, sowie Colilert-18-Verfahren der Firma Merck. Das Miniaturverfahren der Firma Bio Rad GmbH ist ebenfalls geeignet. Der Vergleich zwischen realen Umweltproben und Parallelansätzen der Hauptuntersuchung stimmen überein. Diese Feststellung bestätigt, dass die empfohlenen Bestimmungsmethoden die optimalen Verfahren zur quantitativen Bestimmung der gesamtcoliformen und fäkalcoliformen Bakterien sind. 75 Literaturverzeichnis [1] Gunkel, G. : Bioindikation in aquatischen Ökosystemen, Jena, G. Fischer Verlag, 1994, 175-177; 440-459 [2] CEN – Europäisches Komitee für Normung: Wasserbeschaffenheit – Nachweis und Zählung von Escherichia coli und coliformen Bakterien (Entwurf prEN ISO 9308-1), Brüssel, 1998 [3] Fachamt für Umweltuntersuchungen, Umweltbehörde Hamburg: Nachweis von fäkalcoliforme (Escherichia coli) und gesamtcoliforme Bakterien in Oberflächengewässern (limnologische Routineuntersuchungen), QualitätsManagement-Handbuch, 2001 [4] Hütter, L. A.: Wasser und Wasseruntersuchung, 6, Frankfurt a. M., Otto Salle Verlag, 1994, 408 [5] Länderarbeitsgemeinschaft Wasser (LAWA): AQS – Analytische Qualitätssicherung – Rahmenempfehlung der LAWA für Wasser-, Abwasser- und Schlammuntersuchungen, Berlin, Erich Schmidt Verlag, 1989 [6] Lightfood N. F., Maier E. A.: Mikrobiologische Analysen: Richtlinien zur Qualitätssicherung, Berlin, Springer Verlag, 2003, 231-234 [7] Hallmann L., Burkhardt F.: Klinische Mikrobiologie, 4 Auflage, Stuttgart, Thieme Verlag, 1974, 555-567 [8] Balows A., Hausler JR W., Hermann K., Isenberg H., Shadomy H.: Manual of Clinical Microbiology, 5th Edition 1991, USA, 360-364 [9] Singleton, P. (aus dem Engl. übertragen von F. Mertens und R. Löscher): Einführung in die Bakteriologie, 2. engl. Auflage, Quelle und Meyer, Wiesbaden, 1995, 52-54; 207-222 [10] American Sociaty For Microbiology: Manual of methods for general bacteriology, Washington DC, USA, University Microfilms International, 1981, 185-189 [11] American Public Health Association: Standard methods for the examination of water and wastewater, 18th Edition 1992, USA, 9/33-9/34 [12] Halvarson, H. O. & Ziegler, N.R. : Application of statistics to problems in bacteriology, Department of Bacteriology and Immunolgy, University of Minnesota, 1932, 101-118 [13] BioRAD SDP GmbH (ehemals SANOFI DIAGNOSTICS PASTEUR): Miniaturized method für determining Escherichis coli counts in surface waters – MU/EC methos, Marnes-La-Coquette, 1991 Anhang: FREIE UND HANSESTADT HAMBURG Behörde für Umwelt und Gesundheit Hygiene Institut Hamburg Abteilung Mikrobiologischer Verbraucherschutz- Nationales Referenzzentrum Probenaufbereitung: Ablaufprotokoll EDV-Dateneingabe: keine Proben-Bearbeitung: Sabani Serani Probenaufkleber: Oberflächengewässer; Billeprobe 4 Salmonella/Enterobateriaceae Indol negativ Lactose positiv Glucose/Gas positiv/ positiv Saccharose positiv Harnstoff negativ Adonit negativ Salicin positiv Arabinose positiv Dulcit negativ Inosit positiv Rhamnose positiv Trehalose positiv Xylose positiv Maltose positiv Mannit positiv Sorbit positiv Kligler/H2S negativ/negativ Beweglichkeit negativ Citrat positiv Voges Proskauer positiv Methylrot negativ LDC negativ ODC positiv ADH positiv L(+) d-Tartrat negativ Mucat positiv Malonat positiv ONPG positiv KCN positiv Gelatinase positiv PAD negativ Nitrat positiv Oxidase negativ Cellobiose positiv Melibiose positiv Raffinose positiv Ergebnis: Enterobacter eloacae 77 Datum: 26.10.2005