Werbung

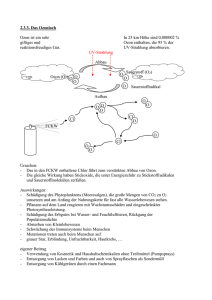
Spezialgbiet Chemie Schadstoffe in der Luft El-Batawy Magda WkRg 8.B Schadstoffe Einleitung 1 a) Saurer Regen 1 Ursache Wirkung Vermeidung 2 2 2-3 b) Treibhauseffekt 3 Ursachen Der anthropogene Treibhauseffekt Folgen Vorbeugung 3 3 4 4 c) Ozon Ozon in der Stratosphäre Bodennahes Ozon Wirkung der FCKWs auf die Ozonschicht 5 5 5 6 d) Smog 7 Photochemischer Sommersmog 7 e) Kohlenmonoxid CO 8 f) Stickstoff NOx 8 Wirkung auf den Menschen Wirkung auf Pflanze Vorbeugung 8 8 9 g) Staubförmige Verunreinigungen (Aerosole) 9 h) Schwermetalle 10 Wirkung auf den Menschen i) Rauchinhaltss chlorierte KWS halogenierte KWS j) Quellenverzeichnis 10 11 11 11 12 Einleitung Emission: sind in die Außenluft entweichende flüssige, feste oder gasförmige Schadstoffe, die während des Transportes in der Atmosphäre, um so verdünnter werden, um so höher die Emissionsquelle liegt. Immission: luftverunreinigende Stoffe in Bodennähe MIK (=maximale Immissionskonzentration): gibt die maximale Konzentration eines Stoffes an bis zu dem keine gesundheitlichen Schäden entstehen. MAK (=maximale Arbeitsplatz-Konzentration): gibt den Grenzwert für Luftverunreinigungen am Arbeitsplatz während acht Stunden an. Diese ganzen Werte werden alle in ppm. (=parts per million = 1 mg/1 kg) oder in ppb. (=parts per billion = 1 mg/1000 kg) angegeben. a) Saurer Regen Ursache Abgase aus Industrie, Haushalt und Straßenverkehr steigen in die Atmosphäre auf. Vor allem SO2, das bei Verbrennung von Kohle und Holz entsteht (Erdölprodukte sind entschwefelt) und Stickoxide, die bei der Verbrennung aus Luftstickstoff N2 mit hoher Temperatur entstehen, bilden mit Wasser Säuren. Schwefeldioxid + SO2 Schwefelige Säure H2SO3 + Wasser Schwefelige Säure H2O H2SO3 Sauerstoff Schwefelsäure 0.5O2 H2SO4 1 Im sauren Regen ist auch Salzsäure HCl enthalten, die bei der Verbrennung von PVC (Polyvinylchlorid) entsteht. Wirkung Der saure Regen wäscht von den Nadeln die Wachsschicht herunter und zerstört das Chlorophyll (für Photosynthese wichtig: 6CO2 + 6H2O 6O2 + C6H12O6). Saurer Regen bewirkt auch das Auswaschen von Nährstoffen im Boden. Diese Ursachen sind für das Waldsterben verantwortlich. Der saure Regen zerstört Sandsteinbauten/Kalksteinbauten. (da Gips gebildet wird und dieser wasserlöslich ist). Kalk + CaCO3 Schwefelsäure Gips H2SO4 CaSO4 + Kohlensäure H2CO3 Gebiete, in denen silicathaltige Gesteine wie Granit oder Felsspat den Untergrund bilden, haben besonders weiche Oberflächengewässer, weil die Gesteinsarten nur wenig verwittern und Ionen an die Gewässer abgeben. Daher können diese Gewässer Zusätze von Säuren oder Laugen nur unvollkommen neutralisieren. Wenn also saurer Regen auf Gebiete mit silicatreichem Untergrund fällt, werden auch Flüsse und Seen sauer. Organisches Material zersetzt sich in sauren Gewässern langsamer, da Bakterien, die besonders stark zum Abbau organischer Stoffe beitragen in saurer Umgebung gewöhnlich weniger leistungsfähig sind. Der saure Regen verstärkt die Korrosionsbildung (Rostung). Vermeidung: Der Autokatalysator wird auch als 3- Wege Katalysator bezeichnet, da er 3 Funktionen hat. 1.) Wandelt Kohlenmonoxid in Kohlendioxid um 2.) Stickoxide in Stickstoff und 3.) verbrennt auch nicht verbranntes Benzin. Kohlenmonoxid 2CO + Stickoxid 2NO Stickstoff N2 + Kohlendioxid 2CO2 Autokatalysator (ist ein Keramikgitter, das mit Platin beschichtet ist) Der Katalysator verringert den Anteil der Stickoxide. Saurer Regen kann auch durch die Entschwefelung von Rauchgasen in der Industrie vermieden werden. (= Entschwefelung) 2 Entschwefelung O + ½O2 Calciumhydroxid + + Ca(OH)2 + SO2 Gips + Wasser SO2 CaSO4 + H2O Saurer Regen kann auch durch Entfernung der Stickoxide vermieden werden. (= Entstickung) Entstickung Stickoxide + 6NO Ammoniak → Stickstoff 4NH3 5N2 + Wasser 6H2O b) Treibhauseffekt: Ursachen: Sonnenstrahlen werden auf der Erde in Wärmestrahlen umgewandelt und diese in die Atmosphäre abgestoßen. An Kohlendioxidmolekülen werden sie wieder zur Erde zurück reflektiert und es entsteht eine Erwärmung. Dieser natürliche Treibhauseffekt bewirkt das Anheben der Temperatur um 30 Grad; sonst würde auf der Erde Dauerfrost herrschen. Der anthropogene Treibhauseffekt (= vom Menschen hervorgerufen) wird durch Verbrennung von Kohle, Erdöl und Erdgasen ausgelöst wodurch, die Kohlendioxidkonzentration erhöht wird. Durch zunehmende Industrialisierung stieg die CO2-Konzentration von 280 ppm (=parts per million) im Jahre 1750 auf 330-340 ppm. In Österreich sind seit Mitte des vorherigen Jahrhunderts die Durchschnittstemperaturen um 1,80 C gestiegen. Die CO2-Konzentration unterliegt jahreszeitlichen Schwankungen. Im Sommer ist sie geringer durch verstärkte Photosynthese, im Winter höher durch Freisetzung beim Heizen. Aber auch Methan CH4, das zwar in kleineren Mengen vorhanden ist, dafür aber wesentlich effizienter Infrarotstrahlung absorbiert als Kohlendioxid, und FCKWs tragen zu einem verstärktem Treibhauseffekt bei. Es kommt zu weiterer Erwärmung 3 Folgen: - Abschmelzen des Polareises und des Gletschers Anstieg des Meeresspiegels um 30 bis 90 cm Großräumiges Waldsterben Ausbreitung der Wüsten Beeinträchtigung der Wasserressourcen vieler Gebiete Für Österreich würde das laut Österreichischer Akademie der Wissenschaften folgendes bedeuten: - Temperaturanstieg mit Schwerpunkt im Winter mehr Niederschläge im Winter (allerdings häufiger in Form von Regen) weniger Niederschläge im Sommer geringere Bodenfeuchte im Sommer weniger Tage mit Schneedecke, vor allem im Flachland Vorbeugung: - Ersatz von fossilen Brennstoffen Methan statt Heizöl Einsatz von CO2 –neutraler Energie (Biomasse, nachwachsende Rohstoffe) Vorteil: während ihres Wachstums nehmen sie CO2 auf, diese sie dann bei der Verbrennung abgeben (Baumrottung) Solarenergie – Sonnenenergie elektrischer Strom Wasserstoff als Antrieb in der Brennstoffzelle zerlegt H2O in H und O2 durch Solarenergie Energie sparen und Nutzung der Fernwärme 4 c) Ozon Ozon (griech. ozein: ,,das Duftende") ist ein blassblaues, hochgiftiges Gas mit durchdringenden Geruch. Es besteht aus drei Sauerstoffatomen, weshalb die Formel O3 ist. Ozon gehört zu den atmosphärischen Spurengasen, welches in der Troposphäre und in der Atmosphäre verschiedene Rollen spielt. 90% des atmosphärischen Ozons befindet sich in der Stratosphäre, dort bildet es die lebensnotwendige Ozonschicht. Diese Absorbiert die harte UV-Strahlung. In der Troposphäre initiiert Ozon die Oxidation von andern Spurengasen, welche in der Atmosphäre emittiert werden. Die Ozonschicht in einer Höhe von 30 bis 40 km über dem Erdboden schirmt die Erdoberfläche vor energiereichen, kurzwelligen Sonnenstrahlen ab, die unter anderem Krebs erregend wirken. Ozon entsteht in dieser Höhe durch Einwirkung von UV-Strahlung auf die obere Atmosphäre. Der Bestand der Ozonschicht wird vorwiegend durch das Entweichen von FCKWs und Stickoxiden in der Atmosphäre gefährdet. Diese Gase steigen, ohne zerstört zu werden, bis in die Höhe der Ozonschicht auf und gehen dort chemische Reaktionen ein. Dabei wird mehr Ozon abgebaut, als durch die UVStrahlung neu gebildet wird. 1) Ozon in der Stratosphäre Ozon wird aus Sauerstoff gebildet und absorbiert die UV-Strahlen. UV-Strahlung besteht aus UVA, UVB und UVC (energiereichsten). O2 UVC → O + O → O3 O2 + O Es ist wenig stabil und zerfällt leicht wieder O3 UVB → O2 + O 2) bodennahes Ozon Wird aus Stickoxiden gebildet, indem UVC- Strahlen Stickoxide in Stickstoff und Sauerstoff spalten und der Sauerstoff mit einem O2 Molekül zu Ozon O3 reagiert. Schon eine geringe Konzentration schädigt die Pflanzen. O3 wird durch Einwirkung v. UV – Strahlen auf Stickoxide NOx (Vorläufer des O3 ) gebildet „Ozonvorläufersubstanz“ NO2 NO + O O + O2 Ozon (O3) NO + O3 NO2 + O2 5 Kommt O3 in bodennahen Schichten vor, zählt es zu den Schadstoffen. - schädigt die Schleimhäute - Reizungen an den Augen, Nasen und Hals - Beeinträchtigt die Lungenfunktion 3) Wirkung der FCKWs auf die Ozonschicht FCKW (Fluor-Chlor-Kohlenwasserstoff) wird als Treibgas in Spraydosen, als Kühlmittel, zum Aufschäumen von Kunststoffen und als Feuerlöscher verwendet. FCKWs sind sehr stabile Verbindungen. Sie verweilen bis zu 30-50 Jahre in niedrigen Luftschichten. In der Nähe des Äquators gelangen die FCKWs in höhere Luftschichten, wo sie mit UV-Strahlen reagieren und Chlor freigesetzt wird. Chlor reagiert mit Ozon unter Bildung von Chlormonoxid und Sauerstoff. Chlormonoxid kann mit Sauerstoffatomen reagieren, wobei sich Chlor und O2 bildet. Dieses entstandene Chlor spaltet wieder Ozon zu Chlormonoxid und O2. Cl + O3 → ClO + O2 ClO + O → Cl + O2 Cl + O3 → ClO + O2 Kommt Chlor mit Wasserstoff oder Stickstoff in Berührung wird es gebunden. Ein Chlormolekül kann bis zu 1000 Ozonmoleküle zerstören. Warum ist das Ozonloch über der Antarktis so groß und erreicht seine maximale Ausdehnung im Frühling? Obwohl die Antarktis weit von Industrieländern entfernt ist, werden FCKWs aufgrund von Windwirbeln dort konzentriert. Die tiefen Temperaturen bewirken eine Kristallbildung der Verbindungen, wobei Chlor abgespalten wird. Bei der Erwärmung der Atmosphäre im Frühling schmelzen die Kristalle und sehr viel Chlor wird freigesetzt, so dass die Ozonmenge rasch sinkt. 6 d) Smog Der Ausdruck Smog setzt sich aus den englischen Bezeichnungen für Rauch (smoke) und Nebel (fog) zusammen. Besonders ungünstige Ausbreitungsbedingungen herrschen bei geringer Luftbewegung. Wird der horizontale und vertikale Luftaustausch durch Windstille und Temperaturumkehr (Inversion) behindert, kann es zu einer gesundheitsbedrohenden Anreicherung von Luftschadstoffen kommen, zu Smog. Begünstigt wird die Entstehung von Smog durch eine ungünstige geographische Lage, wie zum Beispiel die Beckenlage von Linz oder Graz, oder durch meteorologische Besonderheiten wie hohe Luftfeuchtigkeit (Nebelbildung). Auswirkungen sind zum Beispiel eine Überreizung der Schleimhäute, und auch Herz und Kreislauf sind gefährdet. Smog bezeichnet starke Anreicherungen von Luftverunreinigungen in Ballungsgebieten. Smog kann entstehen, wenn die in der Luft enthaltenen Verunreinigungen aufgrund austauscharmer Wetterlagen, Inversionswetterlagen, (Luft unten kälter als oben) nicht mehr in die höheren Luftschichten entweichen können. Je nach Jahreszeit und Art der emittierten Stoffe kann es zu unterschiedlichen Smogtypen kommen: Hohe Konzentration von Schwefeldioxid und Staub führen hauptsächlich im Winter zum sogenannten Londontyp, während es im Sommer zum Los-Angeles-Typ (photochemischer Smog) kommt. Photochemischer Sommersmog O3 kann mit unverbrannten Kohlenwasserstoffen zu schädlichen Verbindungen reagieren, weil O3 ein starkes Oxidationsmittel ist. 7 e) Kohlenmonoxid CO Kohlenmonoxid bildet sich durch unvollständige Verbrennung (zuwenig O2 ) bei kohlenstoffhältigen Verbindungen. Dies geschieht sowohl bei der Verfeuerung fossiler Brennstoffe, also Erdöl und Erdgas, aber auch beim Abbrennen tropischer Regenwälder und Savannen. C + ½ O2 2C + O2 CO oder 2CO CO ist ein geruchloses, farbloses und giftiges Gas, das zu Kopfschmerzen, Übelkeit und bei 0,03% zu Bewusstlosigkeit führt. Es verbindet sich mit dem Hämoglobin (Farbstoff der roten Blutzellen) und wird statt O2 zu den Zellen transportiert innere Erstickung Dieser Vorgang ist reversibel (= umkehrbar), d.h., durch sportliche Betätigung kann CO wieder in O2 ausgetauscht werden. CO ist gefährlich am Ort der Entstehung, wird aber meist bei Abkühlung in CO2 Umgewandelt. f) Stickstoff Nox Entsteht dort, wo N2 und O2 bei hoher Temperatur zusammentreffen (Gewitter) Mit Luftfeuchtigkeit reagieren sie weiter zu HNO3 (siehe „Saurer Regen“) Wirkung auf Menschen • NO reizt die Atemwege • NO bewirkt im Hämoglobin die Oxidation von Fe2+ zu Fe3+, es bildet sich Metthämoglobin, das O2 nicht mehr binden kann • NO regiert in den Atemwegen zu NO2, das mit Feuchtigkeit zu Säuren reagiert => Lungenverätzung Wirkung auf Pflanzen • saurer Regen • Ozon zerstört Chlorophyll 8 Vorbeugung - Autoabgasreinigung durch KAT 2NO 2CO + O2 2NO + 2CO2 (KAT) N2 + O2 2CO2 2CO2+ N2 Aus den Schadstoffen entstehen N2, O2, CO2 nur dann, wenn der Motor richtig eingestellt ist. Bei zuwenig O2 kann CO nicht oxidiert werden; bei zuviel O2 Werden die Stickoxide nicht zerlegt. - DENOX – Anlage bei Wärmekraftwerken Mit Hilfe eines KAT werden Stickoxide mit Hilfe von Ammoniak in N2 und H2O – Dampf zerlegt g) Staubförmige Verunreinigungen (=Aerosole) Staub ist ein natürlicher Bestandteil der Luft; durch anthropogene Aktivitäten wird die Staubbelastung der Atmosphäre direkt und indirekt erhöht. Unter direkter Emission wird hierbei die Emission staubhaltiger Abluft verstanden. Daneben gibt es noch indirekte anthropogene Staubemissionen - oft als sekundäre Staubquellen bezeichnet - wie z. B. • Staubaufwirbelungen vom Boden (Kraftfahrzeugverkehr, Baustellen etc.) • verstärkte Staubemissionen durch geänderte Landnutzung (Landwirtschaft) In der Nähe von großen Industriezentren oder Ballungszentren mit starkem Autoverkehr steigen die Immissionswerte sprunghaft an (z.B. Wien: 140g Staub/Jahr/m²). Wenn diese Aerosole Metalloxide enthalten kann es zu basischem Regen kommen. Außerdem bilden diese Staubteilchen Kondensationskeime, die zu verstärkter Wolken- und Dunstbildung führen. In der Industrie lässt sich die Staubabgabe durch elektrostatische Filter um 99,5 % reduzieren. In Österreich sank der Wert durch bessere Entstaubungsanlagen in der Industrie und durch die Verdrängung von Kohle zur Wohnraumheizung. 9 h) Schwermetalle Schwermetalle sind Metalle mit einer höheren Dichte als 5g/cm3 (z.B. Eisen, Zink, Kupfer, Mangan, Zinn, Chrom, Cadmium, Blei, Quecksilber u.a.). Einige Schwermetalle sind in geringen Mengen (Spurenelementen) lebensnotwendig (z.B. Eisen, Kupfer, Zink). Viele Schwermetalle haben jedoch bei den Stoffwechselprozessen keine erkennbar lebensnotwendige Funktion, sondern wirken giftig auf Menschen, Tier und Pflanze (z.B. Quecksilber, Cadmium), daher werden unter dem Begriff Schwermetall meist toxische Schwermetalle verstanden. Schwermetalle werden in vielfältiger Weise industriell genutzt und gelangen dabei über den Abfall und Verbrennungsprozesse (Kraftwerke, Abfallverbrennungsanlagen), in die Umwelt. Schwermetalle können sich über die Nahrungskette in Organismen anreichern. Einige Schwermetalle können sich in Fischen in größeren Konzentrationen anreichern. Toxische Schwermetalle sind: • Antimon Sb • Arsen As • Blei Pb • Cadmium Cd • Quecksilber Hg Wirkung auf den Menschen: Antimon (Kunststoffindustrie) Staublunge, Herz-Kreislauf-System, Darmreiz Arsen (Konservierungsmittel, Rattengift) Blei (Treibstoffe, Akkus) Cadmium (Akkus) Cd Übelkeit, Lungenödem, Koma, Tod im Blut beeinträchtigt es die Hämoglobinbildung wird statt Ca im Knochen eingelagert => Skelettschrumpfung Quecksilber (Thermometer, Zahnfüllungen, Verätzung, Schock, Nierenversagen, etc.. 10 Fungizide) Lungenödem, i) Rauchinhaltsstoffe (z.B. Zigarette) Kohlenwasserstoffe Chlorierte Kohlenwasserstoffe Diese Bezeichnung fasst organisch-chemische Verbindungen, die außer Kohlenstoff und Wasserstoff auch Chlor enthalten, zusammen. Sie werden in Industrie und Haushalt (z.B. in Pflanzenschutz- und Reinigungsmitteln) als Lösungsmittel eingesetzt und u.a. als TRI (Trichlorethylen), PER (Perchlorethylen), 1,1,1 (Trichlorethan) bezeichnet. Diese CKW weisen Eigenschaften wie beispielsweise ein gutes Fettlösevermögen, kurze Trocknungszeiten und schwere Entflammbarkeiten aus. Die weite Verbreitung und die hohe Stabilität der CKWs tragen dazu bei, dass sie heute überall in der Umwelt, in Trinkwasser und Nahrung, vorkommen. Spuren von CKW wurden auch schon in einigen Mineralwässern gefunden. Durch ihr Fettlösevermögen werden CKWs auch leicht in tierisches und menschliches Fettgewebe aufgenommen und gespeichert - und tragen so zum Krebsrisiko bei. Auch bei geringer akuter Giftigkeit bewirken sie infolge von Anreicherungen in Gehirn, Leber, Nieren, Herz und Keimdrüsen chronische Schäden. Halogenierte Kohlenwasserstoffe Halogenierte Kohlenwasserstoffe finden im Hausgebrauch hauptsächlich als Lösungsmittel Verwendung. Aufgrund der Lösungsmittelverordnung sind halogenierte Lösungsmittel in den meisten Haushaltsprodukten wegen ihren Auswirkungen auf die Umwelt verboten. In alten Produkten können sie jedoch noch enthalten sein. Zu den halogenierten Kohlenwasserstoffen gehören flüssige organische Verbindungen, die die Halogene Fluor, Chlor, Brom oder Jod als Bestandteil enthalten. Halogenierte Kohlenwasserstoffe sind meist giftig und oft krebserregend. Daher sollte jeder direkte Kontakt mit der Haut oder über die Atmung vermieden werden. Der Rauch einer Zigarette enthält: Methan Ethen Benzol Ethan Propen Naphtalin Propan Benzpyren Terpene Wirkung: Carzinogen Benzpyren, Benzol blutschädigend; Leukämie 11 u.v.a Blausäure HCN Cyanide (Cyankali) zählen zu den bekanntesten Giften. Viele Morde wurden mit Cyaniden begangen. Die „friedliche“ Nutzung der Cyanide findet bei der Gewinnung von Edelmetallen, der Cyanid – Laugerei. Die Vergiftung mit Blausäure, deren bittermandelähnlicher Geruch nicht von allen Menschen wahrgenommen wird, führt zu Schwindel, Kopfschmerz und Erregungszuständen. Nach wenigen Minuten tritt der Tod durch Atemlähmung ein. HCN im Tabakrauch Im Rauch einer Zigarette sind 100 – 400 µg² des Giftes enthalten. Der Filter senkt diesen Gehalt um ca. 14%. Nach der Trinkwasser – Verordnung von 1975 darf in einem Liter Wasser nicht mehr als 50 µg HCN enthalten sein. Wirkung: - Beeinträchtigung des Flusses des Lungenschleimes durch Lähmung der Flimmerhärchen Lungenkrebs Lähmung des Atemzentrums im Gehirn Rhodanid SCN¯ Rhodanid ist die Verknüpfung von Schwefel, Kohlenstoff und Stickstoff. SCN¯ im Tabakrauch Bis zu ca. 720 µg/100 ml Blut konnte bei Rauchern nachgewiesen werden. Rhodanid ist im rauch nicht nachweisbar; denn der Körper bildet diese chemische Verbindung selbst. Die eigentliche Quelle des Rhodanids ist die Blausäure. In eine Stoffwechselprozess wird aus dem Cyanid durch Schwefelanlagerung Rhodanid: CN¯ + S = SCN¯ Es ist um viel weniger giftig als Cyanid. Wirkung - Vergrößerung der Schilddrüse Schädigung des Knochenmarks Störung des Zentralen Nervensystems 12 Amine Sie sind chemisch gesehen Abkömmlinge des Ammoniaks NH3. Ammoniak selbst kommt im Tabakrauch mit einem Gehalt von bis zu mehreren mg vor. Sowohl die Bildung des NH3, als auch die Entstehung der Amine hängt auf das engste vom Nitratgehalt des Tabaks ab, weil diese Verbindung durch die Reduktion der Nitrate in der Glut gebildet werden. Werden die Wasserstoffatome ganz oder teilweise durch Kohlenstoffreste ersetzt, etwa beim Übergang von NH3 zu CH3-NH2, dem Methylamin, so erhält man die Amine. Darüber hinaus besitzen einige Amine selbst eine carzinogene Wirkung. Gefährlich ist v.a. das Naphtylamin Blasenkrebs Bsp.: Methylamin Ethylamin Trimethylamin Isobutylamin Isoamylamin Amylamin Anilin Naphtylamin Nitrosamine Die Amine sind in der Natur weit verbreitet. Die Reaktionspartner, die diese Nitrosamine überführen, sind Nitrit NO¯2 und Stickoxid (NO). Nitrit und Stickoxid sind ebenfalls weit verbreitet. Beispielsweise führt die starke Düngung in der Landwirtschaft (Nitratdüngung) zu einer Nitratanreicherung im Trinkwasser. Dieses Nitrat ist jedoch noch nicht dazu in der Lage Nitrosamine zu bilden. Doch die Mikroorganismen, die im Darm jedes Menschen lebenswichtige Stoffe (Vitamine) herstellen, sind dazu fähig, aus Nitrat NO¯3 das Nitrit NO¯2 zu machen, welche mit Aminen dann zu den krebsauslösenden Nitrosaminen reagieren. Nitrosamingehalt im Tabakrauch Nitrosamin in Nahrungsmittel Tabak Gehalt 0,01 - 0,1 µg/g 1,9 - 88,6 µg/g Etwa 6 % des Nitroso – Nornicotins gehen beim Rauchen in den Rauchstrom über. Nitrosaminbelastung des Rauchers Ein Raucher nimmt mit dem Hauptstromrauch aus einer Zigarette ca. 300 – 800 ng Nitrosamine auf, das sind 0,3 –0,8 µg/Zig. Nitrosamin selbst ist kein Krebsauslöser, sondern es wird durch einen Stoffwechselprozess innerhalb des Organismus erst dazu gemacht. Die entscheidende Reaktion der Nitrosamine ist die chem. Veränderung der Erbsubstanz, der DNS: Nitrosamine methylieren (Anlagerung von CH3) die Kernbase Guanin. Dadurch wir die Teilung der Zelle gestört, die Tochterzellen unterscheiden sich von der Mutterzelle durch wucherndes, d.h. unkontrolliertes Wachstum, welches Krebs heißt. 13 j) Quellenverzeichnis „Von der Chemie 1“ „Der Blaue Dunst“ „Kaffe Käse und Karies“ „dtv – Lexikon“ „ Microsoft Encarta Encyclopädie 97“ www.hausarbeiten.de www.garmisch-partenkirchen.com/gesundheitsamt/alle/umwelt/lex/index.htm www.bmu.gv.at www.chemie-online.de 14