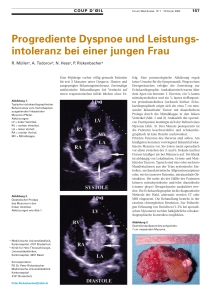
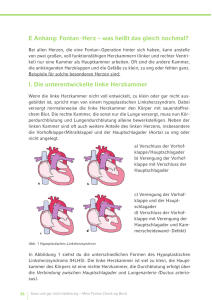
Langzeitverlauf von univentrikulären Herzfehlern nach
Werbung

Diplomarbeit Langzeitverlauf von univentrikulären Herzfehlern nach Fontanoperation eingereicht von Nadine Zimmermann Mat.Nr.: 0533713 zur Erlangung des akademischen Grades Doktor(in) der gesamten Heilkunde (Dr. med. univ.) an der Medizinischen Universität Graz ausgeführt am Institut / Klinik für Kinder- und Jugendheilkunde Klinische Abteilung für Pädiatrische Kardiologie unter der Anleitung von Univ. Prof. Dr. A. Gamillscheg Graz, 13.07.2011 Eidesstattliche Erklärung Ich erkläre ehrenwörtlich, dass ich die vorliegende Arbeit selbstständig und ohne fremde Hilfe verfasst habe, andere als die angegebenen Quellen nicht verwendet habe und die den benutzten Quellen wörtlich oder inhaltlich entnommenen Stellen als solche kenntlich gemacht habe. Graz, 13.07.2011 i Danksagungen Als erstes möchte mich vor allem bei Herrn Univ.-Prof. Dr. med. Andreas Gamillscheg bedanken, dass er es mir ermöglicht hat, diese Arbeit an der Klinischen Abteilung für Pädiatrische Kardiologie zu schreiben. Durch die kompetente Betreuung konnte ich viel von ihm lernen. Ich weiß es sehr zu schätzen, dass er so viel Zeit in diese Arbeit investiert hat. Ein besonderer Dank gilt Dr. Thomas Rehak, der sich immer Zeit für meine Fragen genommen und dadurch einen wesentlichen Beitrag zur Erstellung der Arbeit geleistet hat. Für die statistische Auswertung und Hilfe danke ich Univ.-Prof. Dr. Peter Rehak. Bei meinem Freund Robert Kreysing möchte ich mich sowohl für die Hilfe bei den graphischen Darstellungen und das zahlreiche Korrekturlesen als auch für jegliche Ablenkung und Motivation bedanken. Von ganzem Herzen möchte ich mich bei meinen Eltern und meinem Bruder bedanken, die mich während des gesamten Studiums unterstützt haben und immer für mich da sind. Vielen Dank! ii Zusammenfassung Einleitung: Bei univentrikulären Herzfehlern ist die Fontanoperation die einzige Möglichkeit der Trennung des System- und Pulmonalkreislaufs. Im Langzeitverlauf können verschiedene Komplikationen bis zum Versagen des Fontankreislaufes auftreten. Ziel der Studie war die Analyse des Langzeitverlaufes. Methoden: Für diese retrospektive Studie wurden die Krankenakten mit Echokardiographie-, Herzkatheter- und EKG-Befunden von 79 Fontan-Patienten, die von 1989 bis 2010 an der Medizinischen Universität Graz betreut wurden, analysiert. Als Endpunkte wurden die letzte Kontrolle, eine Herztransplantation und ein tödlicher Verlauf definiert. Ergebnisse: Die Fontanoperation erfolgte im mittleren Alter von 4,8 3,9 Jahren bei 53 Patienten als Totale Cavopulmonale Konnektion (TCPC) und bei 26 Patienten ab 1999 mittels Extrakardialer Fontanoperation (ECFO). Bei 63 Patienten lag ein links-, bei 15 Patienten ein rechtsmorphologischer und bei 1 Patienten ein indifferenter Systemventrikel (SV) vor. Die perioperative Mortalität, inkl. Fontan-take-down-Patienten, betrug 15,2%. Perioperativ verstorbene bzw. take-down-Patienten hatten mehr präoperative Risikofaktoren (RF) als primär Überlebende (2,1±0,9 vs. 0,8±0,81; p<0,05). Die 15-Jahres Überlebensrate betrug bei 59 Patienten 97%. Bei 1 Patienten erfolgte eine Herztransplantation, 2 Patienten verstarben nach 0,3 bzw. 1,1 Jahren. In einer Nachbeobachtungszeit von 11,5 5,2 Jahren traten bei 14 von 56 Patienten Spätkomplikationen auf, wobei Herzrhythmusstörungen mit 80% am häufigsten waren. Alle Patienten waren im NYHA-Stadium I oder II, 28,6% der Patienten benötigten eine kardiale Medikation. Eine höhere Anzahl präoperativer RF beeinflusste die Ejektionsfraktion des SV im Langzeitverlauf negativ (p=0,0018). Die TCPC führte häufiger zu therapiepflichtigen Rhythmusstörungen (p=0,0324). Ein rechtsmorphologischer SV war tendenziell mit einem schlechteren Langzeit-Outcome assoziiert. Konklusion: Die überwiegende Mehrzahl der Fontan-Patienten zeigt einen zufriedenstellenden Langzeitverlauf. Allerdings bedingt die palliative Natur der Fontanoperation wegen der möglichen Komplikationen eine lebenslange Betreuung dieser Patienten, insbesondere von Herzrhythmusstörungen. Schlüsselwörter: univentrikuläre Herzfehler, Fontanoperation, Totale- Cavopulmonale-Konnektion, Extrakardiale Fontanoperation, Spätkomplikationen iii Abstract Introduction: The Fontan operation offers the only possibility of treatment for patients with single ventricle morphology. However, various complications including late failure of the Fontan circulation may occur in the long-term. The purpose of this study was to analyse the long-term outcome after Fontan surgery. Methods: In this retrospective study we reviewed all medical records including echocardiographic and cardiac catheterization data as well as electrocardiograms of 79 patients treated at the Medical University of Graz from 1989 to 2010. Last follow-up, heart transplantation and death over the years were defined as endpoints. Results: At a mean age of 4,8 3,9 years the Fontan operation was accomplished in 53 patients as total cavopulmonary connection (TCPC) and in 26 patients as extracardiac Fontan operation (ECFO). The morphological assessment revealed a systemic left ventricle in 63 patients, a right ventricle in 15 patients and an indifferent systemic ventricle in 1 patient. Perioperative mortality, including patients with Fontan take down, was 15,2%. Non survivors and patients with Fontan take down had more preoperative risk factors than survivors (2,1±0,9 vs. 0,8±0,81; p<0,05). Of 60 patients available to follow up 1 patient underwent heart transplantation and 2 patients died after 0,3 and 1,1 years, respectively, resulting in a 15-year survival of 97%. Current follow-up information was available in 56 patients with a mean follow-up of 11,5 5,2 years. Late-complications occurred in 14/56 patients, most frequent complications were cardiac arrhythmias (80%). All patients were in NYHA class I or II, 28% needed cardiac medication. The number of preoperative risk factors had a negative impact on the systolic function of the systemic ventricle (p=0,0018). The incidence of relevant cardiac arrhythmias was higher after TCPC than after ECFO (p=0,0324). A right morphology of the systemic ventricle appeared to result in a worse long-term-outcome. Conclusion: The Fontan operation provides overall good results in the majority of Fontan patients. However, due to the palliative nature of this operation long term surveillance is mandatory because of potential late complications, in particular of arrhythmias. Keywords: univentricular heart, Fontan operation, Total Cavopulmonary Connection, Extracardiac Fontan operation, late complications iv Inhaltsverzeichnis Danksagungen ........................................................................................................ ii Zusammenfassung ................................................................................................. iii Abstract .................................................................................................................. iv Inhaltsverzeichnis .................................................................................................... v Glossar und Abkürzungen ..................................................................................... vii Abbildungsverzeichnis ............................................................................................ ix Tabellenverzeichnis ................................................................................................ xi 1 Einleitung ...................................................................................................... 1 1.1 Funktionell univentrikuläre Herzen ................................................................ 1 1.1.1 Definition ............................................................................................. 1 1.1.2 Pathologische Anatomie ...................................................................... 2 1.1.2.1 Trikuspidalatresie ....................................................................... 2 1.1.2.2 Double-Inlet-Left-Ventricle ......................................................... 3 1.1.2.3 Double-Outlet-Right-Ventricle .................................................... 4 1.1.2.4 Mitralatresie und Hypoplastisches-Linksherz-Syndrom ............. 5 1.1.2.5 Atrioventrikulärer Septumdefekt mit hypoplastischem rechten Ventrikel ..................................................................................... 6 1.1.2.6 Pulmonalatresie mit intaktem Ventrikelseptum .......................... 7 1.1.3 Hämodynamik und Klinik ..................................................................... 8 1.1.4 Diagnostik............................................................................................ 9 1.1.4.1 Klinische Untersuchung ............................................................. 9 1.1.4.2 Elektrokardiogramm ................................................................... 9 1.1.4.3 Echokardiographie und Magnetresonanztomographie .............. 9 1.1.4.4 Herzkatheter ............................................................................ 10 1.1.5 Prognose des univentrikulären Herzfehlers ohne Operation ............. 11 1.2 Fontanoperation .......................................................................................... 12 1.2.1 Das Fontan-Prinzip............................................................................ 12 1.2.2 Entwicklung und Modifikationen ........................................................ 12 1.2.3 Physiologie der Fontanoperation ....................................................... 16 1.2.4 Postoperative intensivmedizinische Probleme .................................. 17 1.2.5 Selektionskriterien ............................................................................. 18 1.2.6 Fenestration des Fontan-Tunnels...................................................... 20 1.2.7 Palliativeingriffe vor Fontanoperation ................................................ 21 1.2.8 Prognose nach Fontanoperation ....................................................... 22 1.3 Fragestellung .............................................................................................. 23 2 Methodik ..................................................................................................... 24 2.1 Patientenkollektiv/Studiendesign ................................................................ 24 v 2.2 Datenerhebung und statistische Auswertung .............................................. 24 3 Ergebnisse – Resultate ............................................................................... 25 3.1 Gesamtes Patientenkollektiv- demographische Daten und Diagnosen ....... 26 3.2 Palliativeingriffe vor Fontanoperation .......................................................... 27 3.2.1 Bidirektionale Glenn-Anastomose und Hemi-Fontanoperation .......... 28 3.3 Fontanoperation .......................................................................................... 28 3.3.1 Präoperative Parameter .................................................................... 29 3.3.2 Präoperative Risikofaktoren und Einfluss auf das perioperative Outcome nach Fontanoperation ........................................................ 29 3.3.3 Modifikation der Fontanoperation (TCPC und ECFO) ....................... 31 3.4 Frühpostoperativer Verlauf nach Fontanoperation (< 30 Tage) .................. 32 3.4.1 Komplikationen .................................................................................. 32 3.4.2 Fontan-take-down ............................................................................. 33 3.4.3 Operative Mortalität ........................................................................... 33 3.5 Langzeitverlauf............................................................................................ 34 3.5.1 Spätmortalität .................................................................................... 34 3.5.2 Re-Operation und Herztransplantation .............................................. 35 3.5.3 Spätkomplikationen ........................................................................... 36 3.5.4 Postoperative Hämodynamik bei Herzkatheteruntersuchung ............ 37 3.5.5 Klinischer Status bei letzter Kontrolle ................................................ 39 3.5.6 Einfluss präoperativer Risikofaktoren auf den Langzeitverlauf .......... 40 3.5.7 Vergleich TCPC versus ECFO .......................................................... 43 3.5.8 Vergleich linker versus rechter Ventrikel als Systemventrikel............ 45 4 Diskussion .................................................................................................. 48 4.1 Frühpostoperative Phase ............................................................................ 48 4.2 Langzeitverlauf............................................................................................ 49 4.2.1 Spätmortalität und Langzeitüberleben ............................................... 49 4.2.2 Langzeitkomplikationen ..................................................................... 50 4.2.3 Klinischer Status bei letzter Kontrolle ................................................ 57 4.3 Limitationen der Studie ............................................................................... 60 4.4 Konklusion .................................................................................................. 61 5 Literaturverzeichnis ..................................................................................... 62 6 Curriculum Vitae ......................................................................................... 70 Anhang – Datenerhebungsbogen......................................................................... 72 vi Glossar und Abkürzungen ASD Atriumseptumdefekt AV atrioventrikulär AV-Klappen Atrioventrikularklappen AVSD Atrioventrikulärer Septumdefekt BDGA bidirektionale Glenn-Anastomose DILV Double-Inlet-Left-Ventricle DORV Double-Outlet-Right-Ventricle ECFO Extrakardiale Fontanoperation EDP Enddiastolischer Druck EF Ejektionsfraktion EKG Elektrokardiogramm HLHS Hypoplastisches-Linksherz-Syndrom HTX Herztransplantation LA Linker Vorhof LAD Linksatrialer Druck LPA Linke Pulmonalarterie LV Linker Ventrikel MA Mitralatresie PA Pulmonalatresie PAB Pulmonalarterien-Banding PDA Persistierender Ductus arteriosus Botalli PFO Persistierendes Foramen ovale ProBNP Pro-Brain-Natriuretisches-Peptid PS Pulmonalstenose RF Risikofaktor RPI Pulmonary-Resistance-Index (pulmonaler Gefäßwiderstand) RPA Rechte Pulmonalarterie RA Rechtes Atrium (rechter Vorhof) RV Rechter Ventrikel SV Systemventrikel TA Trikuspidalatresie TCPC Totale Cavopulmonale Konnektion UVH Univentrikuläre Herzfehler vii VCI Vena cava inferior VCS Vena cava superior VSD Ventrikelseptumdefekt ZVD Zentralvenöser Druck viii Abbildungsverzeichnis Abbildung 1-1 Trikuspidalatresie ............................................................................ 3 Abbildung 1-2 Atrioventrikuläre Verbindung bei Double-Inlet-Left-Ventricle ........... 3 Abbildung 1-3 Double-Inlet-Left-Ventricle ............................................................... 4 Abbildung 1-4 Darstellung eines Double-Outlet-Right-Ventricle ............................. 5 Abbildung 1-5 Mitralatresie mit Hypoplastischem-Linksherz-Syndrom ................... 6 Abbildung 1-6 Dysbalancierter Atrioventrikulärer Septumdefekt ............................ 6 Abbildung 1-7 Pulmonalatresie mit intaktem Ventrikelseptum ................................ 7 Abbildung 1-8 2-d-Echokardiographie eines Hypoplastischen Linksherzsyndroms mit Tunnel und Fenestration ....................................................................... 10 Abbildung 1-9 Angiographische Lungenarterien Darstellung des Tunnels, der beiden und der Vena cava superior nach Verschluss einer Fenestration mit einem Amplatzer Septal Occluder .................................... 11 Abbildung 1-10 Atriopulmonale Anastomose ........................................................ 14 Abbildung 1-11 Totale Cavopulmonale Konnektion.............................................. 14 Abbildung 1-12 Extrakardiale Fontanoperation bei Trikuspidalatresie .................. 15 Abbildung 1-13 Fontankreislauf ............................................................................ 16 Abbildung 1-14 Darstellung der Druckverhältnisse im normalen Kreislauf und bei der Fontan-Zirkulation ................................................................................. 17 Abbildung 1-15 Fenestration eines lateralen Tunnels bei einer TCPC ................. 20 Abbildung 1-16 Funktion der Fenestrierung als Überlaufventil ............................. 20 Abbildung 3-1 Übersicht über die Studienpopulation ............................................ 25 Abbildung 3-2 Häufigkeiten der einzelnen Diagnosen .......................................... 26 Abbildung 3-3 Boxplots der Risikofaktoren in den 3 Gruppen .............................. 30 Abbildung 3-4 Kaplan-Meier-Kurve der Überlebenswahrscheinlichkeit frühpostoperativ überlebender Fontan-Patienten ........................................ 35 Abbildung 3-5 Vergleich Herzrhythmusstörungen zwischen Patienten mit TCPC und ECFO ................................................................................................... 37 Abbildung 3-6 Vergleich NYHA-Stadium und Ability-Index zwischen Patienten mit keinem oder 1 Risikofaktor und Patienten mit 2 oder mehr Risikofaktoren . 41 Abbildung 3-7 Vergleich Rhythmus zwischen Patienten mit keinem oder 1 Risikofaktor und Patienten mit 2 oder mehr Risikofaktoren ........................ 42 ix Abbildung 3-8 Vergleich Ejektionsfraktion und der AV-Klappenfunktion zwischen Patienten mit keinem oder 1 Risikofaktor und Patienten mit 2 oder mehr Risikofaktoren ............................................................................................. 42 Abbildung 3-9 Vergleich NYHA-Stadium und Ability-Index zwischen Patienten mit TCPC bzw. ECFO ....................................................................................... 43 Abbildung 3-10 Vergleich des Rhythmus zwischen Patienten mit TCPC bzw. ECFO .......................................................................................................... 44 Abbildung 3-11 Vergleich Ejektionsfraktion und Ability-Index zwischen Patienten mit TCPC bzw. ECFO ................................................................................. 45 Abbildung 3-12 Vergleich NYHA-Stadium und Ability-Index zwischen Patienten mit linkem bzw. rechtem Systemventrikel. ........................................................ 46 Abbildung 3-13 Vergleich Rhythmus zwischen Patienten mit linkem bzw. rechtem Ventrikel. ..................................................................................................... 46 Abbildung 3-14 Vergleich der Ejektionsfraktion und AV-Klappenfunktion zwischen Patienten mit rechtem bzw. linkem Ventrikel .............................................. 47 x Tabellenverzeichnis Tabelle 1-1 Selektionskriterien ............................................................................. 19 Tabelle 3-1 Zusätzliche kardiale Fehlbildungen bei 23 Patienten ......................... 27 Tabelle 3-2 Palliativoperationen und Korrektur zusätzlicher Fehlbildungen bei 68 Patienten ..................................................................................................... 27 Tabelle 3-3 Präoperative Parameter vor Bidirektionaler Glenn-Anastomose bzw. Hemi-Fontan ............................................................................................... 28 Tabelle 3-4 Präoperative Daten vor Fontanoperation ........................................... 29 Tabelle 3-5 Anzahl Risikofaktoren vor Fontanoperation ....................................... 30 Tabelle 3-6 Anzahl an Risikofaktoren bei den verschiedenen Patientengruppen . 31 Tabelle 3-7 Chirurgische Begleiteingriffe während Fontanoperation .................... 32 Tabelle 3-8 Frühpostoperative Komplikationen bei 38 Patienten ......................... 32 Tabelle 3-9 Komplikationen im Langzeitverlauf bei 14 Patienten ......................... 36 Tabelle 3-10 Ergebnisse der Herzkatheteruntersuchung nach Fontanoperation.. 38 Tabelle 3-11 Patientencharakteristika bei der letzten Kontrolle ............................ 39 xi 1 Einleitung 1.1 Funktionell univentrikuläre Herzen 1.1.1 Definition Nach Autopsieergebnissen entsprechen 1-3 % aller kongenitalen Herzfehler einem funktionell univentrikulären Herzen/singulärem Ventrikel (UVH) (1). Unter diesem Begriff fasst man eine Reihe komplexer und heterogener Herzfehler zusammen, bei denen eine biventrikuläre Korrektur aus anatomischen Gründen nicht durchführbar ist. Aufgrund der Vielzahl der Fehlbildungen, die zu einem solchen funktionell singulären Ventrikel führen, gestaltete es sich in der Vergangenheit schwierig eine einheitliche Klassifikation zu finden (2,3). Unter Berücksichtigung von Van Praaghs Segmentanalyse (4), Andersons „sequential segmental approach“ (5) und anderen Klassifikationen, bei denen die atrioventrikuläre (AV) Verbindung im Zentrum steht, fassen Jacobs et al. (4) alle kongenitalen Herzfehler, bei denen beide Vorhöfe vollständig, oder beinahe vollständig mit einem Ventrikel in Verbindung stehen, unter dem Begriff des UVH zusammen. Demzufolge zählen die folgenden Herzfehler zum Fehlbildungskomplex des funktionell singulären Herzen: - Herzen mit „Double-inlet“ AV-Verbindung - Herzen mit nur einer AV-Verbindung - Herzen mit einer gemeinsamen AV-Verbindung, aber nur einem normal entwickelten Ventrikel - Ein normal entwickelter Ventrikel in Verbindung mit Heterotaxie Syndrom - Seltene Herzfehler, die nicht nach obigem Schema klassifiziert werden können (4) Charakteristisch ist das Vorhandensein eines dominanten Ventrikels mit rechtsventrikulärer, linksventrikulärer oder unbestimmbarer Morphologie (1). Zusätzlich existiert häufig eine zweite rudimentäre oder hypoplastische Kammer, die den Begriff „funktionell singulärer Ventrikel“ rechtfertigt und mit der „Hauptkammer“ über einen Ventrikelseptumdefekt (VSD) in Verbindung steht. In den seltensten Fällen besteht tatsächlich ein einzelner Ventrikel (1). 1 Zusätzliche Fehlbildungen, wie eine Pulmonalstenose (PS) oder -atresie (PA), ein persistierender Ductus arteriosus Botalli (PDA), eine Aortenisthmusstenose oder Anomalien der Hohl- und Pulmonalvenen führen zur Komplexität und Heterogenität des UVH. In 90% besteht bei UVH ein atrialer Situs solitus. Eine bilaterale Links- beziehungsweise Rechtsisomerie mit Asplenie bzw. Polysplenie oder ein Situs inversus sind selten. Die Lage der großen Arterien betreffend kann eine ventrikuloarterielle Konkordanz oder Diskonkordanz (Transpositionsstellung der großen Arterien) vorliegen (1). 1.1.2 Pathologische Anatomie In den folgenden Abschnitten wird beispielhaft für Herzfehler mit univentrikulärer Physiologie die Anatomie der Trikuspidalatresie (TA), des Double-Inlet-LeftVentricle (DILV), des Double-Outlet-Right-Ventricle (DORV), der Mitralatresie (MA) mit hypoplastischem Linksherzsyndrom (HLHS), der Pulmonalatresie (PA) und des dysbalancierten atrioventrikulären Septumdefektes (AVSD) dargestellt. 1.1.2.1 Trikuspidalatresie Die Inzidenz der TA liegt bei 1-3 % (6,7) aller angeborenen Herzfehler. Infolge der Atresie beziehungsweise Aplasie der Trikuspidalklappe kommt es zu einer vollständigen Unterbrechung der Verbindung zwischen rechtem Atrium (RA) und rechtem Ventrikel (RV). Das systemvenöse Blut aus dem RA kann lediglich über einen bestehenden Atriumseptumdefekt (ASD) oder ein Persistierendes Foramen Ovale (PFO) in das linke Atrium (LA) fließen. Der dominante linke Ventrikel (LV) enthält somit das gesamte pulmonal- und systemvenöse Blut. Die notwendige Kommunikation zwischen systemischer und pulmonaler Zirkulation besteht gewöhnlich über einen VSD. Als Folge der Minderdurchblutung des RV ist dieser hypoplastisch (6). 2 Abbildung 1-1 Trikuspidalatresie aus Epstein (8). Links: Ventrikuloarterielle Konkordanz. Rechts: D-Transposition der großen Gefäße. In beiden Abbildungen besteht jeweils ein großer Atriumseptum- und Ventrikelseptumdefekt. Ao, Aorta; LV, linker Ventrikel; PA, Pulmonalarterie; RA, rechter Vorhof; RV, rechter Ventrikel Anhand der ventrikuloarteriellen Konkordanz/Diskordanz unterscheidet man nach Edwards und Burchell (9) (Abbildung 1-1) zwei Typen der TA mit jeweils drei Subgruppen hinsichtlich des Ausmaßes der Lungendurchblutung. Diese Einteilung kann durch Differenzierung der Transpositionsstellung erweitert werden (6–8). Assoziierte kardiale Fehlbildungen liegen bei 20 % der Patienten mit TA vor. Familiäres Vorkommen und extrakardiale Fehlbildungen sind selten (6). 1.1.2.2 Double-Inlet-Left-Ventricle Definitionsgemäß stehen beim DILV über 50 % beider Vorhöfe (Abbildung 1-2) mit dem dominanten LV in Verbindung (10,11). Abbildung 1-2 Atrioventrikuläre Verbindung bei Double-Inlet-Left-Ventricle aus Hagler & Edwards (10). Dominante RA-LV-Verbindung im Sinne eines DILV. LV, linker Ventrikel; RA, rechter Vorhof; RV, rechter Ventrikel Entweder existieren zwei AV-Klappen, wobei eine undurchlässig sein kann, oder es findet sich eine gemeinsame AV-Klappe. Eine Mischung des systemvenösen mit dem pulmonalvenösen Blut findet im LV statt (Abbildung 1-3). Es werden drei Haupttypen des DILV unterschieden: DILV mit normaler Beziehung der großen Arterien, DILV mit rechtsseitiger subaortaler rechtsventrikulärer Auslasskammer 3 und d-Transpositionsstellung der großen Arterien und DILV mit linksseitiger subaortaler rechtsventrikulärer Auslasskammer mit l-Transpositionsstellung der großen Arterien. Die weitere Hämodynamik ist bestimmt durch das Vorhandensein assoziierter kardialer Fehlbildungen, wie zum Beispiel einer gemeinsamen Auslasskammer oder einem VSD. In den meisten Fällen ist zusätzlich ein rudimentärer RV vorhanden. Es besteht in der Regel ein Situs solitus (10,11). Abbildung 1-3 Double-Inlet-Left-Ventricle aus Hagler & Edwards (10). LA, linker Vorhof; LV, linker Ventrikel; RA, rechter Vorhof; RV, rechter Ventrikel 1.1.2.3 Double-Outlet-Right-Ventricle Entspringen beide großen Arterien vollständig, oder zu einem größeren Teil aus dem RV, liegt ein DORV vor (Abbildung 1-4) (12,13). Ein VSD ist lebensnotwendig, da er die einzige Ausflussmöglichkeit für das oxygenierte Blut aus dem LV darstellt. Aus dem RV gelangt das system- und pulmonalvenöse Blut zum einen über die Pulmonalarterie in die Lunge und zum anderen über die Aorta in den Systemkreislauf. Eine Einteilung dieses Herzfehlers erfolgt sowohl über die Lokalisation des VSD in Bezug zu den großen Arterien als auch anhand der Beziehung der großen Arterien zueinander. Von diesen beiden Kriterien hängt auch die Physiologie dieses Herzfehlers ab, die darüber hinaus durch weitere kardiale Fehlbildungen, wie einer PS, Obstruktionen im pulmonalen Gefäßbett, einem ASD, einem gemeinsamen Vorhof, einer Subaortenstenose und Defekten der AV-Klappe bestimmt wird (12,13). 4 Abbildung 1-4 Darstellung eines Double-Outlet-Right-Ventricle aus Schmaltz (14). Ao, Aorta; LA, linker Vorhof; LV, linker Ventrikel; PA, Pulmonalarterie; RA, rechter Vorhof; RV, rechter Ventrikel 1.1.2.4 Mitralatresie und Hypoplastisches-Linksherz-Syndrom Bei der MA existiert eine univentrikuläre atrioventrikuläre Verbindung zu einem dominanten RV, der LV ist rudimentär (Abbildung 1-5). Auch dieser Herzfehler weist eine morphologische Heterogenität auf, welche die Hämodynamik in unterschiedlichem Ausmaß beeinflusst. Existieren zusätzlich zu einer MA eine Atresie der Aorta und ein intaktes Ventrikelseptum, ist sie Teil des Hypoplastischen-Linksherz-Syndrom (HLHS) (7). Extrakardiale Fehlbildungen und Syndrome sind beim HLHS mit 15 – 30% häufig (15). Verschiedenste kardiale Malformationen, charakterisiert durch unterschiedliche Grade einer Unterentwicklung des LV, zählen zum HLHS. Im Allgemeinen schließt dieser Herzfehler alle Fehlbildungen ein, die einen dominanten RV und eine systemische Ausflussbahnobstruktion vorweisen (15). 5 Abbildung 1-5 Mitralatresie mit Hypoplastischem-Linksherz-Syndrom aus Apitz (16). Ao, Aorta; AP, Arteria pulmonalis; LA, linker Vorhof; LV, linker Ventrikel; RA, rechter Vorhof; RV, rechter Ventrikel 1.1.2.5 Atrioventrikulärer Septumdefekt mit hypoplastischem rechten Ventrikel Ein kompletter AVSD ist durch das völlige Fehlen der AV-klappennahen Anteile des atrialen und ventrikulären Septums, sowie dem Vorliegen einer gemeinsamen AV-Klappe charakterisiert. In über 40% ist dieser Herzfehler mit der Trisomie 21 vergesellschaftet. In den überwiegenden Fällen bestehen balancierte Formen mit weitgehend normal entwickelten RV und LV. Steht die gemeinsame AV-Klappe überwiegend mit dem LV in Verbindung und der RV ist hypoplastisch, spricht man von einem dysbalancierten AVSD mit hypoplastischem RV (Abbildung 1-6). In diesen Fällen ist keine biventrikuläre Korrektur möglich (17). Abbildung 1-6 Dysbalancierter Atrioventrikulärer Septumdefekt modifiziert nach Kaulitz & Hofbeck (18). LV, linker Ventrikel; RA, rechter Vorhof; RV, rechter Ventrikel 6 1.1.2.6 Pulmonalatresie mit intaktem Ventrikelseptum Kennzeichen dieses Herzfehlers ist der Verschluss des rechten Ausflusstraktes in Verbindung mit einem intakten Ventrikelseptum. Die Morphologie ist auch hier heterogen, mit unterschiedlichen Graden der rechtsventrikulären und Trikuspidalklappen- Hypoplasie. Patienten präsentieren sich normalerweise mit Lävokardie, normaler Vorhofbeziehung, konkordanter AV-Konnektion und konkordanter ventrikuloarterieller Verbindung. Der pulmonale Blutfluss erfolgt über einen PDA (Abbildung 1-7) (19,20). Abbildung 1-7 Pulmonalatresie mit intaktem Ventrikelseptum aus Vogt (20). LV, linker Ventrikel; RV, rechter Ventrikel Basierend auf der Morphologie des RV und dem Durchmesser des Trikuspidalklappenringes erfolgt nach Bull et al. (21) eine Einteilung der Patienten mit PA und intaktem Ventrikelseptum in folgende drei Gruppen: - Patienten mit tripartidem RV, bei denen sowohl der trabekuläre, der infundibuläre als auch der „inlet“ Anteil des RV vorhanden ist - Patienten ohne trabekulären Anteil - Patienten, die weder einen trabekulären, noch einen infundibulären Anteil besitzen Anatomische Kriterien, zum Beispiel der Grad der Trikuspidalklappen- oder die RV Hypoplasie, erlauben die Zuweisung zur Fontanpalliation bzw. biventrikulären Korrektur. Besteht die Möglichkeit einer biventrikulären Operation, erfolgt die Dekompression des rechten Ventrikels und eventuell die Anlage eines systemischpulmonalen Shunt (22). 7 1.1.3 Hämodynamik und Klinik Die Gemeinsamkeit all dieser Herzfehler liegt in der Physiologie eines funktionell singulären Ventrikels. Pulmonal- und Systemkreislauf sind, im Gegensatz zu einem normalen kardiovaskulären System, parallel geschaltet. Dies bedeutet, dass der singuläre Ventrikel den systemischen und pulmonalen Kreislauf aufrechterhalten muss. Eine solche Zirkulation führt zu zwei wesentlichen Problemen: arterielle Sauerstoffuntersättigung und chronische Volumenbelastung des singulären Ventrikels (23). Hämodynamisch wichtige Voraussetzungen für eine optimale Physiologie einer solchen Kreislaufsituation sind eine gute Ventrikel- und AV-Klappenfunktion, eine interatriale Verbindung in Form eines ASD oder eines weiten PFO und ein ausgeglichener systemischer und pulmonaler Blutfluss. So ist zum Beispiel bei schwerer Obstruktion im Ausflusstrakt des Systemventrikels ein Rechts-LinksShunt über einen PDA für eine adäquate Aufrechterhaltung des kardialen Auswurfes bzw. für die Systemzirkulation notwendig. Dagegen kann der pulmonale Blutfluss bei schwerer Obstruktion im pulmonalen Ausflusstrakt nur durch einen Links-Rechts-Shunt über den PDA aufrecht erhalten werden. Obstruktionen im pulmonalvenösem Rückfluss können in weiterer Folge zu einer schweren pulmonalen Hypertonie führen (1,3). Das klinische Erscheinungsbild ist im großen Ausmaß abhängig von der Präsenz einer pulmonalen Ausflussbahnobstruktion und sehr variabel (1,3). Liegt eine schwere PS oder PA vor, sind typische Symptome eine Hypoxämie und eine ausgeprägte zentrale Zyanose. Ein gewisser Grad einer PS ist hämodynamisch jedoch wünschenswert, um einen übermäßig hohen pulmonalen Blutfluss und in weiterer Folge eine pulmonale Hypertonie zu vermeiden (1,3). Besteht keine zusätzliche PS, resultiert dadurch eine vermehrte Lungendurchblutung mit pulmonalem Hypertonus. Dies führt zu typischen Symptomen eines großen Li-Re-Shunts. Innerhalb der ersten Lebensmonate zeigen sich Zeichen der chronischen Herzinsuffizienz mit pulmonaler Hyperperfusion wie Trinkschwäche, Tachypnoe, Schwitzen, Gewichtsstillstand und rezidivierende pulmonale Infektionen (1,3). 8 1.1.4 Diagnostik 1.1.4.1 Klinische Untersuchung Bei der klinischen Untersuchung präsentieren sich die Patienten mit einer unterschiedlich ausgeprägten Zyanose oder den Folgen einer Herzinsuffizienz (siehe Kapitel 1.1.3). Die Palpation der Pulse ist normalerweise unauffällig. Pulsdifferenzen können jedoch Hinweise auf das Vorliegen einer Aortenisthmusstenose sein (1). Die Auskultationsbefunde des Herzens lassen keine direkte Diagnose des zugrundeliegenden Herzfehlers zu und sind abhängig von zusätzlich vorhandenen Fehlbildungen, wie z.B. einer PS oder einem VSD. Der erste Herzton ist meist leise, bei Transpositionsstellung der großen Gefäße kann der zweite Herzton singulär und betont sein. Ein dritter Herzton und ein mesodiastolisches Mitralströmungsgeräusch über der Herzspitze sind bei vermehrter Lungendurchblutung auskultierbar (1). 1.1.4.2 Elektrokardiogramm Bedeutung erlangt das Elektrokardiogramm (EKG) in der präoperativen Diagnostik zum Nachweis eines bestehenden Sinusrhythmus (Kapitel 1.2.5). Im Allgemeinen sind die Befunde bei UVH sehr variabel. In ca. 50% der Fälle besteht der Hinweis auf ein abnormal verlaufendes Reizleitungssystem, insbesondere bei Herzen mit AV-Diskordanz und AV-Kanal-Defekten. Im Falle eines DILV sieht man zum Beispiel häufig eine Verlängerung des PR-Intervalls und höhergradige AVBlockierungen. Ebenfalls fehlen bei diesem Herzfehler über den links präkordialen Ableitungen die Q-Zacken, in den rechts präkordialen Ableitungen können sie vorhanden sein. Bei Patienten mit TA ist das PR-Intervall normal, mit hoher und breiter p-Welle und es besteht eine Abweichung der Herzachse nach links (Linkstyp oder überdrehter Linkstyp) (1,3). 1.1.4.3 Echokardiographie und Magnetresonanztomographie Mittels Echokardiographie kann die Diagnose des UVH und der zugrunde liegende morphologische Subtyp bereits genau charakterisiert werden. Besonderes Augenmerk sollte auf die Vorhofsituation, die AV-Beziehung, die ventrikuloarterielle Verbindung und auf die Größe der Pulmonalarterien gelegt werden. Zur umfassenden hämodynamischen Beurteilung, insbesondere der Funktion der Ventrikel und der AV-Klappen und des Blutflusses über den VSD, 9 muss eine farbkodierte Doppleruntersuchung durchgeführt werden. Eventuell vorhandene Ausflussbahnobstruktionen können durch Farb- und CW-Doppler erfasst werden (3,10). Abbildung 1-8 2-d-Echokardiographie eines Hypoplastischen Linksherzsyndroms mit Tunnel und Fenestration. (Klinische Abteilung für Pädiatrische Kardiologie, Medizinische Universität Graz) Eine weitere nicht invasive Methode ist die Magnetresonanztomographie, die eine genauere Abschätzung der Ventrikelmasse, des Ventrikelvolumens und der Funktion ermöglicht. Außerdem können system- und pulmonalvenöse Anomalien, Malformationen des Aortenbogens und proximale Läsionen der Pulmonalarterien besser diagnostiziert werden (3,10). 1.1.4.4 Herzkatheter Die Herzkatheteruntersuchung dient einerseits zur Absicherung der meist echokardiographisch bereits gestellten Diagnose und zur Erfassung morphologisch wichtiger Nebenbefunde, die echokardiographisch nur schwer oder gar nicht zu erkennen sind, wie z.B. system- oder pulmonalvenöse Anomalien, systemarterielle-pulmonale Kollateralen oder Distorsionen bzw. Stenosen der peripheren Pulmonalarterien (1,10). Andererseits ist die Herzkatheteruntersuchung für die präoperative hämodynamische Evaluation von entscheidender Bedeutung, wie z.B. die Messung des Pulmonalarteriendruckes, die Bestimmung des pulmonalen Gefäßwiderstandes und der Höhe des enddiastolischen Blutdruckes des Systemventrikels (siehe Kapitel 1.2.5). Diese sind für die Planung des therapeutischen Managements von enormer Bedeutung. 10 Nach einer initialen Palliation (siehe Kapitel 1.2.7), wie z.B. nach einem Pulmonalarterienbanding Shuntimplantation bei bei pulmonaler verminderter Hyperperfusion Lungendurchblutung, oder müssen nach der Pulmonalarteriendruck bzw. der pulmonale Gefäßwiderstand (RPI) erneut bewertet werden. Während dieser Evaluierung können eventuelle Komplikationen, wie z.B. Shunt-Stenosen, periphere Pulmonalstenosen und pulmonal- arteriovenöse Fisteln, nach dem primären Palliativeingriff frühzeitig aufgedeckt und behoben werden (24). Abbildung 1-9 Angiographische Darstellung des Tunnels, der beiden Lungenarterien und der Vena cava superior nach Verschluss einer Fenestration mit einem Amplatzer Septal Occluder. (Klinische Abeilung für Pädiatrische Kardiologie, Medizinische Universität Graz) 1.1.5 Prognose des univentrikulären Herzfehlers ohne Operation Der natürliche Verlauf bei UVH hat im Allgemeinen eine schlechte Prognose. So betrug die 15-Jahres Überlebensrate betroffener Kinder vor der Einführung der operativen Korrektur ca. 50% (25). In einer Studie von Moodie et al. (26) verstarben 70% der Patienten mit gut entwickeltem singulären LV vor dem 16. Lebensjahr. Die 4-Jahres Überlebenswahrscheinlichkeit nach Diagnosestellung für Patienten mit rechtsventrikulärer Morphologie des Systemventrikels lag bei 50% (26). Die häufigsten Ursachen der Mortalität waren Herzrhythmusstörungen, Herzinsuffizienz und plötzlicher Herztod. Abgesehen von dieser Mortalität leiden 11 unoperierte Patienten an chronischer Zyanose mit konsekutiven hämatologischen Folgen wie Erythrozytose, Eisen-Mangel, Thrombembolien und Blutungen. Die Symptome einer Hyperviskosität sind unter anderem Müdigkeit, Kopfschmerzen, Parästhesien oder mentale Veränderungen (3). Im Allgemeinen ist die Lebenserwartung günstiger bei mäßiggradiger PS mit normalen Druck- und Widerstandsverhältnissen und gleichzeitigem Fehlen einer subaortalen Obstruktion. Bei ausgeprägter PS oder bei vermehrter Lungendurchblutung durch das Fehlen einer geringgradigen PS ist die Prognose durch die resultierende Hypoxie beziehungsweise entstehende Herzinsuffizienz und den pulmonalen Hypertonus infaust (1). 1.2 Fontanoperation 1.2.1 Das Fontan-Prinzip Bei den Operationen nach dem Fontan-Prinzip handelt es sich um den letzten Schritt eines mehrstufigen operativen Vorgehens für alle Kinder mit UVH, die keiner anatomischen biventrikulären Korrektur zugeführt werden können. Ziel der Fontanoperation und ihrer Modifikationen im Sinne einer sogenannten „definitiven Palliation“ ist die vollständige Trennung von system- und pulmonalvenösem Kreislauf, um den singulären Ventrikel zu entlasten und eine normale arterielle Sauerstoffsättigung zu erreichen (23). 1.2.2 Entwicklung und Modifikationen Bereits 1628 postulierte Harvey den Einfluss der In- und Exspiration auf die pulmonale Zirkulation (27). Diese Beziehung zwischen Atmung und pulmonalen Blutfluss konnte im 19. und 20. Jahrhundert von verschiedenen Forschern bestätigt werden. Dadurch entstand im Laufe der Zeit die Überlegung, dass unter bestimmten Voraussetzungen ein adäquater pulmonaler Blutfluss ohne präpulmonalen Ventrikel möglich sein muss. Basierend auf diesen Entdeckungen wurden verschiedene tierexperimentelle Prozeduren, hinsichtlich der Möglichkeit den RV partiell oder komplett aus dem Herzkreislaufsystem auszuschalten, getestet (28–31). Die erste erfolgreiche klinische Anwendung einer cavopulmonalen Verbindung durch Anastomose der Vena cava superior (VCS) mit der rechten Pulmonalarterie 12 (RPA) gelang Meshalkin im Jahr 1956 (31). Glenn et al. (32) berichteten 1958 über die erste Palliation in Form einer End-zu-End-Anastomose der VCS mit der RPA (Klassische Glenn-Anastomose). All diese Erfahrungen bildeten schließlich die Grundlage für die von F. Fontan und E. Baudet (33) im Jahre 1968 erstmals durchgeführte komplette Trennung der Kreisläufe bei Patienten mit TA. Das von Fontan und Baudet (33) entwickelte Verfahren bestand aus einer End-zu-End-Anastomose zwischen der VCS und dem distalen Ende der durchtrennten RPA im Sinne einer Glenn-Anastomose und einer Verbindung des proximalen Endes der RPA mit dem RA. Auf diese Weise konnte, nach Verschluss des ASD, das Blut aus der Vena cava inferior (VCI) der linken Pulmonalarterie (LPA) zugeführt werden. Der Hauptstamm der Pulmonalarterie wurde ligiert. Die Funktion des RA wurde durch Implantation von zwei homologen Aorten- oder Pulmonalklappen unterstützt. Eine lag im Übergang der VCI zum RA, die andere wurde als Anastomose zwischen dem rechten Herzohr und dem proximalen Ende der RPA eingesetzt (33). Nach Einführung dieses neuen Operationsverfahrens zur Behandlung der TA wurde die Fontanoperation in den folgenden Jahrzehnten in zahlreichen Schritten modifiziert und wird heute bei jeder Form eines UVH angewendet (25). Mit Beginn der „Fontanära“ konnte die Prognose dieser angeborenen Herzfehler elementar verbessert werden (siehe Kapitel 1.2.8). Einige der bedeutendsten Veränderungen waren zum Beispiel der Verzicht auf den Einsatz von Homografts und die direkte Verbindung zwischen rechtem Herzohr und patienteneigener Pulmonalklappe, die atriopulmonale Anastomose (Abbildung 1-10) (34,35), oder die Einbeziehung des rudimentären RV in den Kreislauf (36). Wesentliche Meilensteine in der weiteren Entwicklung der Fontanoperation waren die Einführung der totalen cavopulmonalen Konnektion (TCPC) (37,38), sowie die extrakardiale Fontanoperation (ECFO) (39–41). 13 Abbildung 1-10 Atriopulmonale Anastomose aus Khairy et al. (3) Bei der 1988 von de Leval et al. (38) erstmals beschriebenen TCPC (Abbildung 111) wird zum einen eine bidirektionale Glenn-Anastomose (BDGA) angelegt. Diese ist eine Weiterentwicklung der klassischen Glenn-Anastomose durch Hopkins et al. (42), bei der die VCS durchtrennt und End-zu-Seit mit der RPA anastomosiert wird. Eine etwaige Verbindung des Pulmonalarteriensystems zum singulären Ventrikel wird durch Ligatur des Trunkus pulmonalis unterbunden. Die Anbindung der VCI zum Pulmonalarteriensystem wird durch einen intraatrialen Tunnel hergestellt. Dieser entsteht durch Implantation eines Goretexpatches zwischen den beiden Holvenenmündungen und der lateralen rechtsatrialen Wand, und Anastomose des distalen Stumpfes der VCS an die RPA. Nach Atrioseptektomie wird jener Teil des RA, der außerhalb dieses Tunnels liegt, funktionell zum LA. Abbildung 1-11 Totale Cavopulmonale Konnektion aus Khairy et al. (3) 14 Ein weiterer Entwicklungsschritt war die erstmalig im Jahre 1990 von Marcelletti et al. (39) beschriebene ECFO (Abbildung 1-12). Nach einer BDGA wird hierbei die VCI vom RA abgesetzt und ein Goretexrohr mit einem Durchmesser von 2 cm zwischen der VCI und der RPA außerhalb des RA interponiert. Dadurch wird nun der gesamte systemvenöse Rückfluss direkt unter Ausschaltung eines pumpenden Ventrikels in das Pulmonalarteriensystem geleitet, während das oxygenisierte Blut ausschließlich in den Systemventrikel gelangt. Somit ist eine funktionelle Trennung des kleinen und großen Kreislaufs eingetreten. Abbildung 1-12 Extrakardiale Fontanoperation bei Trikuspidalatresie aus Gamillscheg et al. (43) Eine weitere entscheidende Verbesserung der letzten Jahre, die zu einer signifikanten Senkung der Mortalitäts- und Morbiditätsrate geführt hat, ist das heutzutage am häufigsten durchgeführte zweistufige Verfahren nach Norwood et al. (44). Unmittelbar nach der Geburt sind der RPI physiologisch noch erhöht, und die Pulmonalarterien zu klein, weshalb eine Fontanoperation in diesem Alter noch nicht möglich ist. Im frühen Säuglingsalter (4-12 Monaten), sobald der RPI dies zu lässt, erfolgt als erster Schritt die Anlage einer oberen cavopulmonalen Anastomose. Für diese vorangehende Operation haben sich zwei Techniken bewährt: Die oben beschriebene BDGA (45) oder die Hemi-Fontan-Operation (44,46). Die Hemi-Fontan-Operation unterscheidet sich in der technischen Durchführung der Anastomosierung, führt aber zu einer gleichen Physiologie. Dieses zweistufige Vorgehen erlaubt dem Körper eine schrittweise Anpassung an die völlig veränderte Hämodynamik, da vorerst nur das systemvenöse Blut aus der 15 oberen Körperhälfte direkt in die Pulmonalarterien geleitet wird. Häufig wird zusätzlich eine Atrioseptektomie durchgeführt. Außerdem besteht während dieser Operation die Möglichkeit, assoziierte Fehlbildungen, wie eine Subaortenstenose, AV-Klappen-Insuffizienzen oder pulmonale Hauptstammstenosen zu korrigieren (2). Der zweite Schritt zur Fontankomplettierung, die Verbindung der VCI mit der RPA, sollte in einem Alter zwischen 18 Monaten und 4 Jahren erfolgen (3). Die in der Literatur beschriebenen Altersgrenzen variieren (18,23,47) und sind abhängig vom Wachstum der Pulmonalarterien und von dem Grad der bestehenden Zyanose (23). Für diese Verbindung wird heute fast ausschließlich die bereits beschriebene ECFO gewählt. Die Vorteile dieser Variante gegenüber der TCPC liegen insbesondere in der Verringerung des Risikos einer postoperativen Arrhythmie durch geringere Manipulationen und Nähte am Vorhof. Des Weiteren kann diese Operation ohne kardiopulmonalen Bypass durchgeführt werden (40). 1.2.3 Physiologie der Fontanoperation In einer Fontanzirkulation sind der System- und Lungenkreislauf (Abbildung 1-13) in Serie geschaltet (43). Abbildung 1-13 Fontankreislauf modifiziert nach Gamillscheg et al. (43). FT, Fontan-Tunnel; RPI, pulmonaler Gefäßwiderstand; SV, singulärer Ventrikel Durch die direkte Anbindung der Hohlvenen an das Pulmonalarteriensystem kommt es zu einer Angleichung des zentralvenösen Druckes (ZVD) an den Pulmonalarteriendruck (Abbildung 1-14) bei gleichzeitigem Verlust eines pulsatilen Flusses in den Pulmonalarterien. In den Hohlvenen, dem Fontan-Tunnel und den Pulmonalarterien besteht nun ein gewisser Grad einer venösen Hypertension (48). Daraus resultiert bei normalem Druck im linken Vorhof (LAD) ein transpulmonaler Gradient (Transpulmonaler Gradient = ZVD-LAD), welcher die Energie für die 16 pulmonale Perfusion liefert. Auf diese Weise kann die Perfusion der Pulmonalarterien, welche zusätzlich durch die diastolische Saugkraft des Systemventrikels und den intrapulmonalen Sog während der Inspiration unterstützt wird, ohne prä-pulmonalen Ventrikel bewerkstelligt werden (43). Abbildung 1-14 Darstellung der Druckverhältnisse im normalen Kreislauf und bei der FontanZirkulation, modifiziert nach Gewillig et al. (48). Links: normale kardiovaskuläre Zirkulation; Rechts: Fontan-Zirkulation. Ao, Aorta; FT, Fontan-Tunnel; LA, linker Vorhof; LV, linker Ventrikel; P, pulmonale Zirkulation; S, systemische Zirkulation; PA, Pulmonalarterie; RA; rechter Vorhof; RV, rechter Ventrikel; V, singulärer Ventrikel Die Mechanismen hinsichtlich der Kontrolle der kardialen Auswurfleistung sind bis heute noch nicht vollständig geklärt. Die Regulation bei Patienten nach Fontan Operation unterscheidet sich jedoch deutlich von der Physiologie eines normalen Herz-Kreislaufsystems. Es konnte gezeigt werden, dass der RPI den bedeutendsten Faktor in der Bestimmung der Vorlast des Systemventrikels und somit in der Regulation des Herzzeitvolumens darstellt (48,49). 1.2.4 Postoperative intensivmedizinische Probleme In der frühen Phase nach Operationen mit Einsatz einer Herz-Lungen-Maschine kann eine passagere endotheliale Dysfunktion der Pulmonalarterien zu einem reaktiven Anstieg des RPI führen (50). Dieser Anstieg kann nach einer Fontanoperation einerseits zu einer systemvenösen Hypertonie mit der Entwicklung von Ödemen, Aszites und Ergüssen führen (43), andererseits kann eine verminderte pulmonale Perfusion eine deutliche Reduktion der Vorlast des Systemventrikels, eine verminderte Oxygenierung und Hyperkapnie verursachen. Eine Hypoxämie und Hyperkapnie können wiederum einen weiteren Anstieg des RPI induzieren. Die pulmonale Perfusion wird durch eine mechanische Beatmung 17 zusätzlich negativ beeinflusst (48,49), sodass nach Fontanoperationen prinzipiell eine frühe Extubation, so fern von hämodynamischer Seite her möglich, anzustreben ist. Als Folge der verringerten Vorlast und einer hypoxämisch bedingten Dysfunktion des Systemventrikels kann sich ein therapieresistenten Low-Cardiac-OutputSyndrom mit konsekutivem Multiorganversagen entwickeln (43). In diesen Fällen kann eine Reduktion des erhöhten RPI durch den Einsatz von inhalativem Stickstoffmonoxid (NO) erreicht werden. Der selektive pulmonale Vasodilatator verbessert die pulmonale Perfusion ohne wesentlichen Einfluss auf den peripheren Gefäßwiderstand. In weiterer Folge treten eine Besserung der Oxygenierung und der Vorlast bzw. der Funktion des Systemventrikels ein (51). Ein eventuelles Reboundphänomen (pulmonale Vasokonstriktion und Reduktion der Oxygenierung) nach Absetzen des inhalativen NO kann durch eine Kombinationstherapie mit intravenösem Prostacyklin (Epoprostenol) verhindert werden (52). Eine postoperativen weitere Therapiemöglichkeit Oxygenierung und zur Verbesserung Hämodynamik ist der der Phosphodiesterasehemmer Sildenafil (43). Weitere postoperative Probleme können durch tachykarde Rhythmusstörungen auftreten, die zu einer Verschlechterung der Funktion des Systemventrikels mit konsekutiv schlechtem Auswurf und/oder pulmonalvenöser Stauung mit Anstieg des RPI führen können (53). Auch jede höhergradige AV-Klappeninsuffizienz des Systemventrikels kann zu einem Anstieg des LAD und somit zu einem pulmonalvenösen Rückstau führen (53). 1.2.5 Selektionskriterien Damit eine passive pulmonale Perfusion überhaupt möglich ist, sind gewisse hämodynamische Voraussetzungen erforderlich. Bereits 1978 publizierten Choussat et al. (54) 10 präoperative Selektionskriterien, die für ein gutes Outcome nach einer Fontan-Operation erfüllt sein sollten. Manche dieser Selektionskriterien haben heute ihre Bedeutung verloren oder wurden neu bewertet, des Weiteren wurden verschiedene Faktoren ergänzt. Es ergaben sich zum Beispiel Änderungen hinsichtlich des Operationsalters (55,56) und der zwingenden Notwendigkeit eines präoperativ bestehenden Sinusrhythmus (57). Als 18 zuverlässige Prognoseparameter für das postoperative Ergebnis können heutzutage die in Tabelle 1-1 zusammengefassten Selektionskriterien erachtet werden. Tabelle 1-1 Selektionskriterien Selektionskriterien für Fontanoperation Pulmonalarterieller Mitteldruck < 15 mmHg (24,58–60) RPI < 2 Wood Units x m² Körperoberfläche (59,61) Ausreichendes Pumonalarterienkaliber (McGoon-Ratio, Nakata-Index) (62,63) Keine Pulmonalarteriendistorsionen/ -stenosen (59,60) OP-Alter nicht < 2 Jahre (24,58,60) Kompetente AV-Klappe (24,58,59) Normale systolische Funktion des SV (59,61): EF (%) > 50 (64) Normale diastolische Funktion des SV: EDP (mmHg) < 12 (59) Keine Hypertrophie des SV (64) Kein rechter Ventrikel als SV (65) Keine komplexe Anatomie (24,58,59) Kein Heterotaxiesyndrom (58,60) Keine Obstruktion des Ausflusstraktes des SV (59,64) Weniger Voroperationen (24) Keine Schrittmacher – Indikation vor Fontanoperation (60) AV-Klappe, Atrioventrikularklappe; SV, Systemventrikel; EF, Ejektionsfraktion; EDP, Enddiastolischer Druck des SV; RPI, pulmonaler Gefäßwiderstand. Zur besseren Quantifizierung der Gefäßgröße der Pulmonalarterien haben sich der Nakata-Index [(LPA-Fläche + RPA-Fläche)/Körperoberfläche] (63) und die McGoon-Ratio [(LPA-Durchmesser + RPA-Durchmesser)/Durchmesser der Aorta auf Höhe des Diaphragmas] (62) bewährt. Ein Nakata Index < 250 mm²/m² (Referenzwert 330±30 mm²/m²) oder eine McGoon-Ratio < 1,8 (Normalwert 2) gehen mit einem erhöhten postoperativen Risiko einher. 19 1.2.6 Fenestration des Fontan-Tunnels Nicht alle Fontankandidaten erfüllen die im vorigen Kapitel angeführten Selektionskriterien. Bei Risikopatienten (siehe Kapitel 1.2.5) wird daher eine Fenestration (Abbildung 1-15) des intraatrialen bzw. extrakardialen Tunnels als „Überlaufventil“ durchgeführt (59,66,67). Abbildung 1-15 Fenestration eines lateralen Tunnels bei einer TCPC aus Kopf et al. (68). IVC, Vena cava inferior; PA, Pulmonalarterien; SCV, Vena cava superior. Postoperativ kann bei einem vorübergehenden Anstieg des RPI das systemvenöse Blut durch den Rechts-Links-Shunt zwischen Tunnel und LA in den Systemkreislauf „ausweichen“ (Abbildung 1-16) und damit eine adäquate Vorlast und kardiale Auswurfleistung des Systemventrikels, unter in Kaufnahme einer mäßigen Zyanose, aufrechterhalten werden. Gleichzeitig werden durch dieses „Ventil“ ein exzessiv gesteigerter ZVD und damit eine venöse Stauung vermindert (59,66,67). Abbildung 1-16 Funktion der Fenestration als Überlaufventil aus Kopf et al. (68). LA, linker Vorhof; RA, rechter Vorhof. 20 Durch die Implementierung dieses Prinzips der Fenestration des intra- oder extrakardialen Fontan-Tunnels konnte die postoperative Mortalität und Morbidität, insbesondere bei Risikopatienten, gesenkt werden (59,66,67). In machen Zentren wird eine Fenestration bei jeder Fontanoperation durchgeführt, unabhängig von vorhanden Risikofaktoren (69). Nach Adaptation an die veränderte Hämodynamik sollte diese Fenestration interventionell verschlossen werden, um eine relevante Zyanose oder die Gefahr einer paradoxen Embolie möglichst gering zu halten (70). Gelegentlich kommt es jedoch bereits vorzeitig zu einem spontanen Verschluss der Fenestration (71). 1.2.7 Palliativeingriffe vor Fontanoperation Die meisten Patienten mit funktionell singulärem Ventrikel sind hämodynamisch nicht balanciert. Um dennoch günstige Voraussetzungen (siehe Kapitel 1.2.5) für eine spätere Fontanisierung zu schaffen, sind bei diesen Patienten in den ersten Lebensmonaten bereits initiale Palliationen notwendig (18). Von enormer Bedeutung ist ein ausgeglichen limitierter Fluss durch die Lungen (3). Zum einen muss bei Vorliegen eines reduzierten Lungenflusses, der meist auch mit hypoplastischen Pulmonalarterien verbunden ist, und der damit einhergehenden meist schweren Zyanose, eine adäquate Lungendurchblutung mittels Anlage eines systemisch-pulmonalarteriellen Shunts hergestellt werden, damit die Pulmonalarterien wachsen können. In der Regel wird hierfür ein modifizierter Blalock-Taussig-Shunt verwendet, bei welchem mit Hilfe einer Goretexrohrprothese eine Verbindung zwischen Arteria subclavia und der LPA oder RPA angelegt wird. Bei zu hypoplastischen peripheren Pulmonalarterien muss ein zentraler Shunt zwischen der Aorta und der Pulmonalarterienbifurkation implantiert werden (3,18). Zum anderen ist bei vermehrter Lungendurchblutung mit der Gefahr der Entwicklung einer pulmonalen Hypertonie bzw. einer pulmonalen Gefäßerkrankung ein frühes Pulmonalarterien-Banding (PAB) zum Schutz der Lungengefäße entscheidend (2). Des Weiteren ist auf einen ungehinderten systemarteriellen Ausfluss zu achten. Bei bestehenden Obstruktionen im Ausflusstrakt des Systemventrikels im Sinne einer Subaortenstenose kann eine Damus-Kaye-Stansel Operation (1) oder beim 21 HLHS die Norwood I Palliation indiziert sein (1,3). Mittels einer „Rashkind balloon septostomy“ kann bei einem restriktiven ASD ein ausreichender Blutrückfluss zum Ventrikel interventionell sichergestellt werden (23). 1.2.8 Prognose nach Fontanoperation Durch eine bessere Patientenselektion, die Weiterentwicklung der ursprünglichen Fontanoperation bis zur ECFO, dem Staging der Fontanpalliation, durch Fortschritte des kardiochirurgischen Managements einschließlich der perioperativen Intensivmedizin sowie schließlich auch mit der verbesserten Nachsorge konnte eine deutliche Reduktion der postoperativen Mortalität und Morbidität als auch der Langzeitergebnisse erzielt werden. Das initiale operative Überleben konnte von 80-85% auf 95 % verbessert werden (72). Laut Mair et al. (73) liegt das operative Risiko für Patienten mit TA und guten Voraussetzungen (entsprechend den Selektionskriterien) bei lediglich 2%. Bei Patienten mit TCPC beträgt das Überleben 10 Jahre nach Operation (inklusive perioperativ Verstorbener) 91 % (65). Trotz des signifikanten Beitrages der Fontan-Operation zur Therapie der Patienten mit UVH stellt sie eine Palliation dar. Nach der Fontan-Operation besteht bei allen Patienten, auch nach exzellenten frühpostoperativen Ergebnissen, im Langzeitverlauf das Risiko für folgende Komplikationen, bis hin zu einem „LateFontan-Failure“ (47,74): - Herzrhythmusstörungen - Chronische systemvenöse Stauung - Leberfunktionsstörungen als Folge des erhöhten ZVD - Entwicklung veno-venöser Kollateralen mit eventuell späterer Desaturierung und Auftreten einer Zyanose - Eiweißverlustenteropathie - Plastische Bronchitis - Thrombose- und Embolierisiko durch Auffälligkeiten im Gerinnungssystem - Progressive Dysfunktion des Systemventrikels Low – Cardiac – Output – Syndrom - Multiorgan- (Nieren-) versagen 22 1.3 Fragestellung Durch die vorhin erwähnten Fortschritte konnte die initiale postoperative Überlebensrate nach Fontan-Operation und deren Modifikationen zwar enorm gesteigert werden, jedoch zeigt sich mit dieser Entwicklung im Langzeit-Follow-Up auch eine erhöhte Anzahl an Patienten mit Versagen des Fontan-Kreislaufes (Late-Fontan-Failure) durch die oben genannten Komplikationen. Diese Problematik stellt Herausforderungen an die Therapie und an das gesamte Management der Patienten nach Fontan-Operation. Anhand der bisher an der Medizinischen Universität Graz betreuten FontanPatienten steht im Zentrum dieser Diplomarbeit neben der allgemeinen Analyse der Patientencharakteristika die Klärung folgender Fragestellungen bezüglich des Langzeitverlaufes von Patienten nach der Fontanoperation: - Welche Komplikationen treten im Langzeitverlauf nach Fontan-Operation gehäuft auf und benötigen eine entsprechende Therapie oder Intervention? Zusätzlich soll die Häufigkeit einer Therapie, Katheterintervention oder ReOperation dargestellt werden. - Welchen Einfluss haben die präoperativen Selektionskriterien auf die postoperative Mortalität und auf den Langzeitverlauf? - Welche Modifikation zeigt bessere Langzeitergebnisse: TCPC oder ECFO? - Welche zugrundeliegende Ventrikelmorphologie zeigt im Langzeitverlauf die bessere Prognose: ein linker bzw. rechter Systemventrikel? 23 2 Methodik 2.1 Patientenkollektiv/Studiendesign Die vorliegende retrospektive Single-Center-Studie stellt eine Analyse der Daten aller Patient/-innen nach Fontanoperation dar, die an der Klinischen Abteilung für Pädiatrische Kardiologie der Medizinischen Universität Graz betreut werden. Die Operationen wurden bei den Patienten/-innen von 03/1989 bis 02/2010 an der Klinischen Abteilung für Herzchirurgie der Universitätsklinik für Chirurgie durchgeführt. Ausgeschlossen wurden jene Patienten, die nach der Fontanoperation in einer anderen Klinik betreut wurden. Ansonsten wurden keine weiteren Ausschlusskriterien definiert. Abbildung 3-1 gibt einen Überblick über die in dieser Studie erfasste Patientenpopulation. Als Endpunkte der Studie wurden definiert: die letzte Kontrolle, eine Herztransplantation und der Tod. Das Studiendesign wurde im Vorfeld von der Ethikkommission der Medizinischen Universität Graz geprüft und genehmigt. 2.2 Datenerhebung und statistische Auswertung Die Akten aller bisher an den Klinischen Abteilungen für Herzchirurgie und für Pädiatrische Kardiologie der Medizinischen Universität Graz operierten und betreuten Fontan-Patienten wurden von 04/2010 bis 10/2010 hinsichtlich demographischer, präoperativer, operativer und postoperativer Parameter ausgewertet. Hierfür wurden neben den ambulanten Krankenakten auch prä- und postoperative Echokardiographie-, Herzkatheter- und EKG-Befunde der Patienten herangezogen. Die gesamten Auswertungsparameter zeigt der Datenerhebungsbogen im Anhang. Alle genannten Daten wurden anonymisiert zur weiteren statistischen Verarbeitung in einer Excel-Tabelle erfasst. Die statistische Auswertung erfolgte mit Hilfe des Programms NCSS 2007 (Hintze, J. (2007); NCSS, LLC. Kaysville, Utah, USA). Es wurde eine deskriptive Statistik mit Erfassung von Häufigkeiten, Mittelwerten, Standardabweichungen sowie Minimum und Maximum durchgeführt. Zur Überlebenszeitanalyse wurde die Kaplan-Meier Methode herangezogen. Folgende statistische Analysen kamen zur Anwendung: Fisher´s exact test, Chi-²-Test, Mann-Whitney U Test und der Kruskal-Wallis Test. Ein p-Wert < 0,05 wurde als signifikant angesehen. 24 3 Ergebnisse – Resultate Von 1989 bis 2010 wurden insgesamt 79 Patienten mit einem univentrikulären Herzfehler mittels einer Fontanoperation behandelt. Abbildung 3-1 gibt einen Überblick über den Verlauf nach Fontanoperation aller Patienten dieser Studie. Abbildung 3-1 Übersicht über die Studienpopulation. HTX, Herztransplantation; n, Anzahl der Patienten 25 3.1 Gesamtes Patientenkollektiv- demographische Daten und Diagnosen Von den 79 Patienten waren 53 (67,1%) männlich und 26 (32,9%) weiblich. Die häufigsten Grunddiagnosen waren der DILV (32%, 25 Patienten) und die TA (30%, 24 Patienten). Abbildung 3-2 gibt die Häufigkeiten aller zugrundeliegenden Diagnosen wieder. Abbildung 3-2 Häufigkeiten der einzelnen Diagnosen. DILV, Double-Inlet-Left-Ventricle; DORV, Double-Outlet-Right-Ventricle; HLHS, Hypoplastisches Linksherz Syndrom; MA, Mitralatresie; TA, Trikuspidalatresie Als Systemventrikel lag bei 63 Patienten (79,7%) ein morphologisch LV, bei 15 Patienten (19%) ein morphologisch RV und bei 1 Patienten (1,3%) ein Ventrikel unbestimmten Typs vor. Von den 79 erfassten Patienten wiesen 23 (29,1%) 30 zusätzliche kardiale Fehlbildungen, wie System- und Pulmonalvenenanomalien, Lageanomalien und Obstruktionen im systemischen Ausflusstrakt auf (Tabelle 3-1). 26 Tabelle 3-1 Zusätzliche kardiale Fehlbildungen bei 23 Patienten Anomalien Venenanomalien (n = 12) Systemvenenanomalien 6 Pulmonalvenenanomalien 2 System- und Pulmonalvenenanomalien 4 Lageanomalien 7 Obstruktionen im systemischen Ausflusstrakt (n = 11) Aortenisthmusstenose 8 Subaortenstenose 3 Gesamt 30 3.2 Palliativeingriffe vor Fontanoperation Bei 68 Patienten (86,1%) waren insgesamt 109 Palliativeingriffe bzw. korrigierende Operationen vor der Fontanoperation notwendig. Tabelle 3-2 präsentiert die Art und die Häufigkeit der jeweils durchgeführten Eingriffe. Bei 38 Patienten war nur ein einzelner Eingriff, bei 30 Patienten 2 oder mehr Eingriffe vor Fontanoperation erforderlich. Tabelle 3-2 Palliativoperationen und Korrektur zusätzlicher Fehlbildungen bei 68 Patienten Art der durchgeführten Operation BAS 20 Shunt 43 PAB 30 Korrektur Aortenisthmusstenose/unterbrochenen AoBo 8 Korrektur einer Totalen Lungenvenenfehlbildung 2 Patchplastik der Pulmonalarterien 1 DKS 1 Valvulotomie Pulmonalklappe 1 Ligatur system-pulmonaler Kollateralen 1 Patcherweiterung Arteria subclavia 1 Stentimplantation in LPA nach BDGA 1 Gesamt 109 BAS, Ballonatrioseptostomie; BDGA, bidirektionale Glenn-Anastomose; DKS, Damus-KayeStanzel-Anastomose; LPA, linke Pulmonalarterie; PAB, Pulmonalarterienbanding. 27 3.2.1 Bidirektionale Glenn-Anastomose und Hemi-Fontanoperation Insgesamt wurde bei 44 Patienten (55,7%) die Fontanoperation zweizeitig durchgeführt, wobei die ECFO (ab 1998) prinzipiell zweizeitig erfolgte. Die BDGA (90,9%, 40 Patienten) bzw. die Hemi-Fontanoperation (9,1%, 4 Patienten) wurde im Durchschnitt in einem Alter von 2,1 3,0 Jahren (0,4-18,3) durchgeführt. Die präoperativen Parameter sind in Tabelle 3-3 zusammengefasst. Tabelle 3-3 Präoperative Parameter vor Bidirektionaler Glenn-Anastomose bzw. Hemi-Fontan Parameter Mittelwert (Min-Max) Größe (cm) 81,1 (60-169) (33 von 44 Patienten) Gewicht (kg) 10,4 (4,2-43) (34 von 44 Patienten) SaO2 (%) 77 (68-95) (36 von 44 Patienten) pulmonalarterieller Mitteldruck (mmHg) 13 (8-22) (32 von 44 Patienten) RPI (Wood Units) 1,54 (0,50-4,70) (30 von 44 Patienten) RPI, pulmonaler Gefäßwiderstand; SaO2, arterielle Sauerstoffsättigung Bei 16/44 Patienten (36,4%) wurde bei der BDGA bzw. Hemi-Fontanoperation der Pulmonalarterienhauptstamm primär nicht abgesetzt, bei 12 Patienten (27,3%) erfolgte eine Erweiterung der peripheren Pumonalarterien mittels einer Patchplastik und bei 3 Patienten (6,8%) wurde wegen einer persistierenden linken VCS eine bilaterale BDGA angelegt. Korrektureingriffe zusätzlicher Fehlbildungen erfolgten bei 4/44 Patienten (9,1%). Bei 2/4 Patienten wurde eine Damus-Kaye-Stansel Operation durchgeführt, bei 1/4 Patienten erfolgte die Korrektur einer partiellen Lungenvenenfehlmündung rechts und bei einem weiteren Patienten wurde die Trikuspidalklappe mittels eines Patches verschlossen. 3.3 Fontanoperation Die Fontanoperation wurde im mittleren Alter von 4,8 3,9 (0,8-21,3) Jahren durchgeführt, die TCPC im mittleren Alter von 4,5±3,6 (0,8-19,8) Jahren, die ECFO im mittleren Alter von 5,4±4,5 (2,4-21,3) Jahren (p= 0,234). 28 3.3.1 Präoperative Parameter Präoperativ hatten alle Patienten einen SR. Von 78 Patienten konnten Informationen über die Ejektionsfraktion (EF), AV-Klappenfunktion und Kollateralkreisläufe erhoben werden. Von diesen wiesen 75 Patienten (96,2%) eine normale EF (> 50%) auf. Hämodynamisch relevante AV- Klappeninsuffizienzen bestanden bei 9/78 Patienten (11,5%) und veno-venöse bzw. system-venöse Kollateralen bei 5/78 Patienten (6,4%; veno-venöse n = 1, system-venöse n = 3, beide n = 1). Pulmonalarterienstenosen hatten 21/79 Patienten (26,6%). Die Mittelwerte der restlichen präoperativen demographischen und hämodynamischen Parameter sind in Tabelle 3-4 zusammengefasst. Tabelle 3-4 Präoperative Daten vor Fontanoperation Parameter Mittelwert (Min-Max) Größe (cm) 102,4 (70-169) Gewicht (kg) 16,5 (7,5-50,0) SaO2 (%) 82 (64-95) EDP-SV (mmHg) 7,6 (2-18) pulmonalarterieller Mitteldruck (mmHg) 2 RPI (Wood Units x m Körperoberfläche) Nakata Index McGoon-Ratio 11,2 (6-18) 1,44 (0,50-5,20) 298 (100-715) 2,10 (1,14-3,70) EDP-SV, Enddiastolischer Druck im Systemventrikel; RPI, pulmonaler Gefäßwiderstand; SaO 2, arterielle Sauerstoffsättigung; SV, Systemventrikel 3.3.2 Präoperative Risikofaktoren und Einfluss auf das perioperative Outcome nach Fontanoperation Als präoperative Risikofaktoren wurden definiert (siehe Kapitel 1.2.5): Alter unter 2 Jahre, kein Sinusrhythmus, zusätzliche System- und Pulmonalvenenanomalien, Obstruktionen im systemischen Ausflusstrakt, eine EF < 50%, relevante Insuffizienz der systemischen AV-Klappe, ein enddiastolischer Druck (EDP) des Systemventrikels > 12 mmHg, ein Mitteldruck der Pulmonalarterien > 15 mmHg, RPI > 2 Wood Units x m2 Körperoberfläche und Stenosen der peripheren Pulmonalarterien. All diese Faktoren wurden als gleichwertig erachtet und für jeden Patienten addiert. Tabelle 3-5 zeigt die Anzahl der Patienten mit der entsprechenden Anzahl an Risikofaktoren. 29 Tabelle 3-5 Anzahl Risikofaktoren vor Fontanoperation Einfluss Risikofaktoren- Anzahl der Anzahl Patienten 0 26 1 28 2 18 3 6 4 1 präoperativer Risikofaktoren auf das Outcome nach Fontanoperation Um einen möglichen Einfluss präoperativer Risikofaktoren auf das perioperative Outcome nach Fontanoperation festzustellen, wurden die folgenden 3 Gruppen hinsichtlich der Risikofaktorenanzahl verglichen: Überlebende nach Fontanoperation ohne postoperative Komplikationen (n = 30), Überlebende nach Fontanoperation mit postoperativen Komplikationen (n = 37) und perioperativ Verstorbene nach Fontanoperation bzw. Patienten mit Fontan-take-down (n=12). Abbildung 3-3 zeigt die Verteilung der Risikofaktoren in den verschiedenen Gruppen. Abbildung 3-3 Boxplots der Risikofaktoren in den 3 Gruppen. 0, Überlebende nach Fontanoperation ohne postoperative Komplikationen; 1, Überlebende nach Fontanoperation mit Komplikationen; 2, Verstorbene nach Fontanoperation bzw. Patienten mit Fontan-take-down. Tabelle 3-6 fasst die Anzahl an Risikofaktoren bei den verschiedenen Patientengruppen zusammen. 30 Alle Patienten, die perioperativ verstarben bzw. bei denen ein Fontan-take-down notwendig war, hatten mindestens 1 oder mehr präoperative Risikofaktoren, während von der Gruppe der Überlebenden der größte Teil keinen oder nur 1 Risikofaktor zeigten. Patienten ohne postoperative Komplikationen hatten im Mittel 0,8 Risikofaktoren, während die Gruppe mit postoperativen Komplikationen im Mittel 1,0 und die Gruppe der Verstorbenen bzw. Patienten mit Fontan-take-down 2,1 Risikofaktoren hatten. Die Gruppen unterschieden sich signifikant hinsichtlich der Anzahl an präoperativen Risikofaktoren (p=0,001). Die Gruppe der postoperativ Verstorbenen bzw. Patienten mit Fontan-take-down hatte deutlich mehr präoperative Risikofaktoren als die beiden anderen Gruppen. Tabelle 3-6 Anzahl an Risikofaktoren bei den verschiedenen Patientengruppen Risikofaktorenanzahl Gruppe 0 (n=30) Gruppe 1 (n=37) Gruppe 2 (n=12) 0 1 2 3 4 12 13 4 1 0 14 12 8 3 0 0 3 6 2 1 Gruppe 0, Überlebende nach Fontanoperation ohne postoperative Komplikationen; Gruppe 1, Überlebende nach Fontanoperation mit Komplikationen; Gruppe 2, Verstorbene nach Fontanoperation bzw. Fontan-take-down. 3.3.3 Modifikation der Fontanoperation (TCPC und ECFO) Bis zum Jahre 1998 wurde bei den ersten 53/79 Patienten (67,1%) die TCPC angewandt, anschließend erfolgte ausschließlich die ECFO bei 26/79 Patienten (32,9%). Bei 29/79 Patienten (36,7%) wurde wegen des Vorliegens von mehr als 2 Risikofaktoren eine Fenestration des Fontan-Tunnels durchgeführt. Bei allen Patienten, bei denen zuvor noch keine Anlage einer BDGA bzw. eine HemiFontan-Operation durchgeführt wurde, erfolgte dies während der Fontanoperation im Sinne eines einzeitigen Verfahrens. Eine bilaterale BDGA aufgrund einer persistierenden SVC war bei 3 Patienten notwendig. Die insgesamt 34 Begleitprozeduren, welche während der Fontanoperation bei 32 Patienten (40,5%) zur Korrektur zusätzlicher Fehlbildungen durchgeführt wurden, sind in Tabelle 3-7 zusammengefasst. 31 Tabelle 3-7 Chirurgische Begleiteingriffe während Fontanoperation bei 32 Patienten Begleiteingriffe Bilaterale BDGA 3 Patchplastik der Pulmonalarterien 24 DKS/Korrektur Subaortenstenose 4 Korrektur einer Venenanomalie 2 AV-Klappen-Rekonstruktion 1 Gesamt 34 AV-Klappen, Atrioventrikularklappen; BDGA, bidirektionale Glenn-Anastomose; DKS, Damus-KayStanzel-Anastomose 3.4 Frühpostoperativer Verlauf nach Fontanoperation (< 30 Tage) 3.4.1 Komplikationen Ein unkomplizierter frühpostoperativer Verlauf konnte bei 31/79 Patienten (39,2%) beobachtet werden. Bei 38/79 Patienten (48,1%) traten 58 Komplikationen auf (Tabelle 3-8). Tabelle 3-8 Frühpostoperative Komplikationen bei 38 Patienten Komplikationen Die Anzahl Prolongierte Ergüsse/Aszites 27 Herzrhythmusstörungen 11 Low-Cardiac-Output-Syndrom 9 Neurologisches Durchgangssyndrom 4 Zwerchfellparese 4 Nachblutung 2 Thrombus/Pulmonalarterienembolie 1 Gesamt 58 häufigsten postoperativen Komplikationen waren drainage- bzw. punktionsbedürftige Pleuraergüsse (postoperative Drainagedauer > 1 Woche), gefolgt von therapiepflichtigen Rhythmusstörungen. Bei einer 2 ½ -jährigen Patientin wurde wegen protrahierten Ergüssen und massiver Hepatosplenomegalie 2 Wochen postoperativ eine sekundäre Fensterung des extrakardialen Fontan-Tunnels durchgeführt. Eine 3-jährige Patientin erlitt 3 Wochen nach Fontanoperation (TCPC) eine fulminante Pulmonalarterienembolie. Sie konnte erfolgreich mit einer medikamentösen 32 Thrombolyse behandelt werden (75). Bei einem 2 jährigen Patienten erfolgte 22 Tage postoperativ nach Fontanoperation (TCPC) eine endoskopische Zwerchfellraffung wegen einer Zwerchfellparese. 3.4.2 Fontan-take-down Ein Rückbau der Fontanoperation, ein sogenannter Fontan-take-down, musste bei 3/79 (3,8%) Patienten durchgeführt werden. Bei einem 2½-jährigen Patienten mit Criss-cross-heart erfolgte noch intraoperativ nach Abgang von der Herz-Lungen-Maschine wegen eines Low-Cardiac-OutputSyndroms der Fontan-take-down bei TCPC. Vor der Fontanoperation war eine Korrektur einer Aortenisthmusstenose und ein PAB notwendig gewesen. Als weiteren extrakardialen Risikofaktor war er wegen einer Tracheobronchomalazie auf eine Langzeitatemunterstützung angewiesen. Er verstarb 14 Jahre postoperativ an den Folgen einer massiven Lungenblutung. Eine 2-jährige Patientin mit DILV erlitt nach einer TCPC ein schweres LowCardiac-Output-Syndrom. Am 1. postoperativen Tag erfolgte bei ihr der Fontantake-down, 3 Stunden postoperativ verstarb sie an einem therapieresistenten LowCardiac-Output-Syndrom. Bei einem 2-jährigen Patienten mit DILV erfolgte am ersten postoperativen Tag nach Durchführung einer TCPC wegen eines Low-Cardiac-Output-Syndroms der Fontan-take-down. Bei ihm wurde der Hemi-Fontankreislauf belassen. Eine Aortenisthmusstenose war während der Anlage eines PAB als Palliativeingriff korrigiert worden. 7 ½ Jahre nach Fontan-take-down wurde erfolgreich eine ECFO angelegt. Dieser Patient wurde in die Auswertung des Langzeitverlaufes nach Fontanoperation in dieser Studie mit eingeschlossen. 3.4.3 Operative Mortalität In der operativen/frühen postoperativen Phase verstarben 10 Patienten (12,7%) einschließlich des einen Patienten nach Fontan-take-down (siehe Kapitel 3.4.2). Alle postoperativen Todesfälle waren in den ersten Jahren nach Einführung der Fontanoperation zu verzeichnen. Ab dem Jahr 1999 verstarb kein Patient mehr in der frühen postoperativen Phase bzw. kein Patient verstarb nach Einführung der ECFO. 33 Die Todesursachen waren therapieresistentes Low-Cardiac-Output-Syndrom (n = 6) mit den Folgen eines Multiorganversagen oder cerebrale Ursachen (n = 3). Eine Patientin verstarb nach Fontan-take-down an einem Low-Cardiac-Output Syndrom (siehe Kapitel 3.4.2). 3.5 Langzeitverlauf Von den 67 überlebenden Patienten, welche die Fontanoperation primär überlebten, wurden 8 Patienten von anderen Kliniken weiter betreut. Der Patient, welcher nach primärem Fontan-take-down im zweiten Versuch erfolgreich Fontan operiert werden konnten, wurde in die Auswertung des Langzeitverlaufes mit einbezogen. Letztendlich konnte so ein Follow-Up des Langzeitverlaufes von 60/79 Patienten (75,9%) erfasst werden, davon waren 39 Patienten nach TCPC und 21 Patienten nach ECFO. Bei einem dieser 60 Patienten wurde erfolgreich eine Herztransplantation (siehe Kapitel 3.5.2) durchgeführt und 2 weitere Patienten verstarben im Langzeitverlauf (siehe Kapitel 3.5.1). Des Weiteren konnten von einem Patienten nicht alle Daten vollständig erhoben werden, sodass die Auswertungen der aufgetretenen Spätkomplikationen und der letzten Kontrolle anhand der Daten von 56 Patienten mit erhaltenem Fontankreislauf erfolgten. Endpunkte dieser Studie waren die letzte Kontrolle, eine Herztransplantation oder der Tod. 3.5.1 Spätmortalität Im Langzeitverlauf verstarben 2/60 Patienten (3,3%). Eine fast 3-jährige Patientin mit TA verstarb 1,1 Jahre nach einer TCPC. Postoperativ bestand eine rechtsseitige Zwerchfellparese und eine Pleuraschwarte rechts. Ein halbes Jahr nach der Fontanoperation Patcherweiterung der erfolgte eine Pulmonalarterien. sekundäre Fenestration Aufgrund des und reduzierten Lungenvolumens und erhöhten pulmonalen Gefäßwiderstands erfolgte nach 1,1 Jahren eine Dekortikation der Pleuraschwarte. 7 Tage nach dieser Operation verstarb die Patientin an einem Multiorganversagen. Ein 7½ -jähriger Patient mit DILV verstarb 0,3 Jahre postoperativ nach einer TCPC an einer cerebralen Embolie nach interventionellem Verschluss einer Fenestration. 34 Die Kaplan-Meier Überlebenswahrscheinlichkeit (Abbildung 3-4) für die frühpostoperativ Überlebenden, ohne den einen Patienten mit Herztransplantation (siehe Kapitel 3.5.2), war 96,6% nach 15 Jahren. Abbildung 3-4 Kaplan-Meier-Kurve der Überlebenswahrscheinlichkeit frühpostoperativ überlebender Fontan-Patienten (n=59) 3.5.2 Re-Operation und Herztransplantation Bei einem Patienten mit TA musste 7½ Monate nach zweizeitiger Fontanoperation und nach postoperativer Stentimplantation bei einer LPA-Stenose sowie zweimaliger AV-Klappenrekonstruktion eine Herztransplantation wegen kardialer Dekompensation durchgeführt werden. Als präoperative Risikofaktoren waren bei ihm eine Anomalie der Systemvenen (persistierende linke VCS), eine Mitralklappeninsuffizienz II° und Stenose der Pulmonalarterien vorhanden. Als Palliativeingriff war vor der Fontanoperation ein PAB erfolgt. Die Anlage der bilateralen BDGA war Fontankomplettierung in (ECFO einem mit Alter von Fenestration ca. 1 und Jahr erfolgt, Patchplastik die der Pulmonalarterien) in einem Alter von 8,7 Jahren. Bei einem weiteren Patienten mit TA musste 1,2 Jahre nach Fontanoperation ein neuerlicher linksseitiger Blalock-Taussig-Shunt wegen Obliteration des Abganges der linken Pulmonalarterie und Hypoplasie derselben angelegt werden. Als Risikofaktoren hatte er vor Fontanoperation eine Stenose der Pulmonalarterien und einen erhöhten RPI. Die Anlage eines Shunts als Palliativeingriff war im 35 frühen Säuglingsalter erfolgt, gefolgt von einer BDGA im Alter von 1,2 Jahren. Die ECFO mit Fenestration und Patchplastik der Pulmonalarterien wurde im Alter von 2,6 Jahren durchgeführt. Der postoperative Verlauf gestaltete sich zunächst komplikationslos. 3.5.3 Spätkomplikationen Bei 14/56 Patienten (25%) traten im Langzeitverlauf 15 relevante Komplikationen auf (Tabelle 3-9). Tabelle 3-9 Komplikationen im Langzeitverlauf bei 14 Patienten Art der Komplikation Herzrhythmusstörungen 12 Eiweißverlustenteropathie 2 Thrombus 1 Gesamt 15 Die mit Abstand häufigsten Komplikationen im Langzeitverlauf waren mit 80% (12/15) Herzrhythmusstörungen. Diese traten häufiger bei Patienten nach TCPC auf (Abbildung 3-5). Von den 37 überlebenden Patienten nach TCPC entwickelten 11 Patienten im Langzeitverlauf relevante Herzrhythmusstörungen, während es unter den 19 Patienten nach ECFO lediglich einer war (p=0,0324). Die Herzrhythmusstörungen wurden bei 3 Patienten medikamentös behandelt, bei 7 Patienten bestand die Indikation zu einer Schrittmacherimplantation. Unter den Patienten mit Schrittmacherindikation waren 6 Patienten mit TCPC sowie der eine Patient mit ECFO. Bei einem Patienten nach TCPC mit Wolff-Parkinson-WhiteSyndrom und einer Patientin nach TCPC mit asymptomatischen AV-Block II°-III° musste bisher keine Therapie eingeleitet werden. 36 Abbildung 3-5 Vergleich relevante Herzrhythmusstörungen zwischen Patienten mit TCPC und ECFO. TCPC, Totale Cavopulmonale Konnektion; ECFO, Extrakardiale Fontanoperation. Eine Patientin mit Eiweißverlustenteropathie hatte einen nicht näher bezeichneten funktionell UVH mit großem VSD und zusätzlich eine milde PS. Bei dieser Patientin bestand präoperativ ein erhöhter RPI. Die andere Patientin hatte einen nicht weiter klassifizierten UVH mit großem VSD, Transpositionsstellung der großen Arterien und einer PS. Die Eiweißverlustenteropathie wurde bei beiden Patienten mit Diuretika, Nachlastsenkern sowie mit pulmonalen Vasodilatatoren (Sildenafil bzw. Bosentan) behandelt. Bei einer Patientin kam es unter dieser Therapie zu einem Verschwinden der Eiweißverlustenteropathie, bei der anderen Patientin zu einer deutlichen klinischen Verbesserung. Bei letztgenannter Patientin erfolgte des Weiteren noch eine Stentimplantation in das extrakardiale Conduit am Übergang zur VCI. Nur bei einer Patientin wurde bei einer routinemäßigen Herzkatheteruntersuchung bzw. in einer transösophagealen Echokardiographie ein asymptomatischer Thrombus im pulmonalvenösen Atrium entdeckt. Eine Therapie, bis auf eine Antikoagulation mit Sintrom, wurde diesbezüglich nicht durchgeführt. Bei dem einzigen Patienten mit terminaler Herzinsuffizienz konnte erfolgreich eine Herztransplantation durchgeführt werden (siehe Kapitel 3.5.2). 3.5.4 Postoperative Hämodynamik bei Herzkatheteruntersuchung Bei 54/57 Patienten wurde im Mittel 5,7 Jahre (3 Wochen-18,9 Jahre) nach Fontanoperation eine Herzkatheteruntersuchung durchgeführt. Die hämodynamischen Parameter sind in Tabelle 3-10 zusammengefasst. 37 Tabelle 3-10 Ergebnisse der Herzkatheteruntersuchung nach Fontanoperation Parameter Mittelwert (Min-Max) Mitteldruck Tunnel (mmHg) 10,9 (6-19) Mitteldruck VCS (mmHg) 11,0 (6-18) Mitteldruck VCI (mmHg) 10,9 (6-18) Mitteldruck LPA (mmHg) 10,5 (6-19) Mitteldruck RPA (mmHg) 10,6 (6-19) EDP-SV (mmHg) 7,1 (2-14) SaO2 in % 92,2 (80,0-98,0) EDP-SV, enddiastolischer Druck im Systemventrikel; LPA, linke Pulmonalarterie; RPA, rechte Pulmonalarterie; SaO2, arterielle Sauerstoffsättigung; VCI, Vena Cava Inferior; VCS, Vena Cava superior. Bei 11 Patienten wurde eine noch offene Fenestration interventionell mit einem Schirm oder mit Coils verschlossen. Bei 23/54 Patienten (42,6%) wurden venovenöse Kollateralen gefunden, welche bei 4 Patienten mit Coils embolisiert wurden. Schließlich wurden bei 5/54 Patienten nach TCPC Restdefekte zwischen der Vorhofwand und dem Patch mit Coils verschlossen. Die SaO2 stieg nach Verschluss von im Mittel 86,3% (68-95%) auf 91,1% (74-98%) an, während sich die Druckverhältnisse im Fontankreislauf nicht signifikant änderten. 38 3.5.5 Klinischer Status bei letzter Kontrolle Die Nachbeobachtungszeit bis zur letzten Kontrolle bzw. Herztransplantation oder Tod betrug im Mittel 10,9 5,6 (0,3-19) Jahre. Tabelle 3-11 fasst die Untersuchungsergebnisse aller Patienten (n = 56) bei der letzten Kontrolle zusammen. Tabelle 3-11 Patientencharakteristika bei der letzten Kontrolle Mittelwert Anzahl Patienten (Min-Max) NYHA-Stadium Stadium I 45 (80,4%) Stadium II 11 (19,6%) Stadium III + IV 0 Ability-Index 1 48 (85,7%) 2 7 (12,5%) 3 1 (1,8%) 4 0 SpO2 (%) 93,8 (84-98) >= 95 27 (48,2%) < 95 29 (51,8%) ProBNP (pg/ml) 154 (17-488) Rhythmus SR 36 (64,3%) SM 7 (12,5%) AV-Knotenrhythmus 13 (23,2%) Normal (> 50%) 50 (89,3%) Erniedrigt (< 50%) 6 (10,7%) EF AV-Klappeninsuffizienz 10 (17,9%) Medikamente 16 (28,6%) EF, Ejektionsfraktion; ProBNP, Pro-Brain-Natriuretisches-Peptid; SM, Schrittmacher; SpO2, pulsoxymetrische Sauerstoffsättigung; SR, Sinusrhythmus Die meisten Patienten waren im NYHA-Stadium I und zeigten einen Ability-Index (76) von I. Bei knapp der Hälfte der Patienten lag die pulsoxymetrische Sauerstoffsättigung (SpO2) bei >95%. Lediglich von 33 Patienten wurden ProBNPWerte (Pro-Brain-Natriuretisches-Peptid) erfasst. Der durchschnittliche Wert lag 39 mit 154 pg/ml nur knapp über der Norm (150 pg/ml). Die überwiegende Mehrzahl der Patienten zeigte echokardiographisch eine zufriedenstellende systolische Ventrikelfunktion und kompetente AV-Klappen. Die meisten Patienten zeigten einen Sinusrhythmus (64%) bzw. AV-Knotenrhythmus (23%), 13% hatten einen Schrittmacher. Alle Patienten wurden ein Jahr lang postoperativ bzw. bis zum interventionellem Verschluss einer Fenestration oder eines Restdefektes oral antikoaguliert, anschließend erfolgte in der Regel eine Thromboseprophylaxe mit Acetysalicylsäure. Nur bei 13 Patienten bestand zum Zeitpunkt der letzten Kontrolle eine orale Antikoagulation. Zum Zeitpunkt der letzten Kontrolle hatten 41 Patienten (71,9%) keine kardiale Medikation. Bei 44/56 Patienten (78,6%) konnten zusätzlich noch Informationen über die soziale Integration ermittelt werden. Von diesen Patienten waren 42 altersentsprechend entwickelt und besuchten einen normalen Kindergarten, eine normale Schule oder konnten uneingeschränkt einem Beruf nachgehen. 3.5.6 Einfluss präoperativer Risikofaktoren auf den Langzeitverlauf Da bei einem Patienten eine vollständige Erfassung der Parameter nicht möglich war, wurden die nachfolgenden Berechnungen nur anhand von 56 Patienten durchgeführt. Die Auswirkungen der präoperativen Risikofaktoren auf den Langzeitverlauf wurden anhand des NYHA-Stadiums, des Ability-Indexes, des Rhythmus, der EF des Systemventrikels, der AV-Klappenfunktion sowie der Medikamenteneinnahme der Patienten bei der letzten Kontrolle analysiert. Es wurde eine Patientengruppe mit keinem oder nur 1 präoperativen Risikofaktor mit einer Patientengruppe mit 2 oder mehr Risikofaktoren verglichen. Von den insgesamt 56 Patienten zählten 43 Personen (76,8%) zu der Gruppe mit keinem oder nur 1 Risikofaktor (Gruppe 1). 13 Personen (23,2%) hatten 2 oder mehr Risikofaktoren (Gruppe 2). 40 NYHA-Stadium und Ability-Index (Abb. 3-6) In der Gruppe 1 waren 34/43 Patienten (79,1%) im NYHA-Stadium I bzw. 36/43 Patienten (83,7%) hatten einen Ability-Index von I. In der Gruppe 2 waren 11/13 Patienten (84,6%) im NYHA-Stadium I bzw. hatten 12/13 Patienten (92,3%) einen Ability-Index I, (p>0,05). Abbildung 3-6 Vergleich NYHA-Stadium und Ability-Index zwischen Patienten mit keinem oder 1 Risikofaktor und Patienten mit 2 oder mehr Risikofaktoren. RF, Risikofaktor Rhythmus (Abb. 3-7) Von der Gruppe 1 hatten 27/43 Patienten (62,8%) und von der Gruppe 2 9/13 Patienten (69,2%) bei der letzten Kontrolle einen Sinusrhythmus. Von den 43 Patienten der Gruppe 1 hatten 6 Patienten (14%) bzw. von den 13 Patienten der Gruppe 2 hatte 1 Patient (7,7%) einen Schrittmacher. Die beschriebenen Unterschiede waren nicht signifikant (p= 0,827). 41 Abbildung 3-7 Vergleich Rhythmus zwischen Patienten mit keinem oder 1 Risikofaktor und Patienten mit 2 oder mehr Risikofaktoren. AR, AV-Knotenrhythmus; RF, Risikofaktor; SM, Schrittmacher; SR, Sinusrhythmus Ejektionsfraktion und AV-Klappeninsuffizienz (Abb. 3-8) Eine normale EF (EF > 50%) hatten 42/43 Patienten (97,7%) in der Gruppe 1, dagegen zeigten in Gruppe 2 nur 8/13 Patienten (61,5%) eine normale EF (p=0,0018). Bezüglich der AV-Klappenfunktion zeigte sich kein Unterschied zwischen den beiden Gruppen (35/43 vs. 11/13 Patienten, p>0,05). Abbildung 3-8 Vergleich Ejektionsfraktion und der AV-Klappenfunktion zwischen Patienten mit keinem oder 1 Risikofaktor und Patienten mit 2 oder mehr Risikofaktoren. EF, Ejektionsfraktion; RF, Risikofaktor 42 Medikamente Auch bezüglich der kardialen Medikation zeigte sich kein Unterschied zwischen der Gruppe 1 und Gruppe 2 (12/43 vs. 3/13 Patienten, p>0,05). 3.5.7 Vergleich TCPC versus ECFO Von den 56 Patienten, bei denen alle Daten im Langzeitverlauf kontrolliert wurden, waren 37 Patienten (66,1%) nach einer TCPC und 19 Patienten (33,9%) nach einer ECFO. Die Nachbeobachtungszeit bei den Patienten mit TCPC betrug 14,1±4,2 (2,5-19) Jahre, bei den Patienten mit ECFO 6,7±3,3 (0,3-11,8) Jahre (p<0,05). NYHA-Stadium und Ability-Index (Abb. 3-9) In der Gruppe mit TCPC hatten 6/37 Patienten (16,2%) ein NYHA-Stadium II, in der Gruppe mit ECFO waren es 5/19 Patienten (26,3%) (p > 0,05). Ähnlich den NYHA-Stadien verhält sich auch die Verteilung auf die verschiedenen AbilityIndices. Aus der TCPC-Gruppe hatten 4/37 Patienten (10,8%), aus der ECFOGruppe 3/19 Patienten (15,8%) einen Ability-Index II. Nur ein Patient (TCPC) hatte einen Ability-Index III. Es zeigten sich keine signifikanten Unterschiede (p = 0,68). Abbildung 3-9 Vergleich NYHA-Stadium und Ability-Index zwischen Patienten mit TCPC bzw. ECFO. ECFO, Extrakardiale Fontanoperation; TCPC, Totale Cavopulmonale Konnektion. 43 Rhythmus (Abb. 3-10) In der Gruppe mit TCPC hatten bei der letzten Kontrolle 26/37 Patienten (70,3%) einen Sinusrhythmus, 6/37 (16,2%) einen Schrittmacher, 5/37 Patienten (13,5%) einen AV-Knotenrhythmus. Bei den Patienten mit ECFO waren es 10/19 Patienten (52,6%) mit Sinusrhythmus, einer (5,3%) mit SM und 8/19 Patienten (42,1%) mit einem AV-Knotenrhythmus. Die Unterschiede waren signifikant (p = 0,044). Abbildung 3-10 Vergleich des Rhythmus zwischen Patienten mit TCPC bzw. ECFO. AR, AVKnotenrhythmus; SM, Schrittmacher; SR, Sinusrhythmus; ECFO, Extrakardiale Fontanoperation; TCPC, Totale Cavopulmonale Konnektion. Ejektionsfraktion und AV-Klappenfunktion (Abb. 3-11) In beiden Gruppen hatten nahezu 90% der Patienten eine normale EF, also 33/37 Patienten mit TCPC und 17/19 mit ECFO (p = 1,000). Bei 30/37 Patienten mit TCPC (81,1%) und 16/19 Patienten mit ECFO (84,2%) konnte eine normale Funktion der AV-Klappen festgestellt werden (p = 1,000). 44 Abbildung 3-11 Vergleich Ejektionsfraktion und AV-Klappeninsuffizienz zwischen Patienten mit TCPC bzw. ECFO. ECFO, Extrakardiale Fontanoperation; EF, Ejektionsfraktion; TCPC, Totale Cavopulmonale Konnektion. Kardiale Medikation In der TCPC-Gruppe benötigten 27/37 Patienten (73%) und in der ECFO -Gruppe 14/19 Patienten (73,7%) keine Medikamente (p = 1,000). 3.5.8 Vergleich linker versus rechter Ventrikel als Systemventrikel Von den bei der letzten Kontrolle vollständig erfassten 56 Patienten hatte 1 Patient einen unbestimmbaren Systemventrikel. Dieser Patient wird in die folgenden Berechungen nicht mit einbezogen. Einen morphologisch linken Systemventrikel hatten 42/55 Patienten (76,4%), während 13/55 Patienten (23,6%) einen morphologisch rechten Systemventrikel hatten. NYHA-Stadium und Ability-Index (Abb. 3-12) In beiden Gruppen hatten die Mehrzahl der Patienten ein NYHA-Stadium I. Im NYHA-Stadium II befanden sich 6/42 Patienten (14,3%) mit linkem und 5/13 Patienten (38,5%) mit rechtem Systemventrikel. Der Anteil der Patienten mit rechtem Systemventrikel im NYHA-Stadium II war zwar deutlich größer als bei den Patienten mit linkem Ventrikel, jedoch zeigte sich wegen der geringen Fallzahl kein signifikanter Unterschied (p=0,106). In der Gruppe mit rechtem Systemventrikel hatten 10/13 (76,9%) einen Ability-Index von I und 3/13 Patienten (23,1%) eine Ability-Index II. In der Gruppe mit linkem Systemventrikel hatten 37/42 Patienten (88,1%) einen Ability-Index von I, 4/42 Patienten (9,5%) einen 45 Ability-Index von II, und ein Patient einen Index von III. In der Gruppe mit rechtsmorphologischem Systemventrikel war der relative Anteil der Patienten mit Ability-Index II zwar höher, jedoch zeigte sich auch hier kein statistisch signifikanter Unterschied (p = 0,389). Abbildung 3-12 Vergleich NYHA-Stadium und Ability-Index zwischen Patienten mit linkem bzw. rechtem Systemventrikel. Rhythmus (Abb. 3-13) Einen Sinusrhythmus hatten im Patientenkollektiv mit rechtem Systemventrikel 8/13 Patienten (61,5%), bei den Patienten mit linkem Systemventrikel 27/42 (64,3%). Es zeigten sich keine signifikanten Unterschiede (p = 0,7). Abbildung 3-13 Vergleich Rhythmus zwischen Patienten mit linkem bzw. rechtem Ventrikel. AR, AV-Knotenrhythmus; SM, Schrittmacher; SR, Sinusrhythmus. 46 Ejektionsfraktion und AV-Klappen-Insuffizienz (Abb. 3-14) Nur 2/13 Patienten (15,4%) mit rechtsmorphologischem Systemventrikel und 3/42 Patienten (7,1%) mit linksmorphologischem Systemventrikel hatten eine erniedrigte EF (p = 0,58). Nur 2/13 Patienten (15,4%) mit rechtem Systemventrikel und 8/42 (19%) mit linkem Systemventrikel zeigten eine hämodynamisch relevante Insuffizienz der AV-Klappe (p=1,000). Abbildung 3-14 Vergleich der Ejektionsfraktion und AV-Klappenfunktion zwischen Patienten mit rechtem bzw. linkem Ventrikel. EF, Ejektionsfraktion. Kardiale Medikation Die Indikation von mindestens einer kardialen Medikation bestand bei 4/13 Patienten (30,8%) mit rechtem Systemventrikel und bei 11/42 Patienten (26,2%) mit linkem Systemventrikel (p = 0,734). 47 4 Diskussion Die vorliegende retrospektive Studie befasste sich mit 79 Patienten nach Fontanoperation, die bisher in den Klinischen Abteilungen für Herzchirurgie und Pädiatrische Kardiologie der Medizinischen Universität Graz über einen Zeitraum von 21 Jahren operiert und betreut wurden. Hierbei stand der Langzeitverlauf nach Fontanoperation im Mittelpunkt der Analysen. Bei der statistischen Auswertung wurde insbesondere nach Unterschieden im Langzeit-Outcome bezüglich präoperativer Risikofaktoren, der zugrundeliegenden Ventrikelmorphologie und der durchgeführten Fontan-Modifikation gesucht. 4.1 Frühpostoperative Phase Perioperative Mortalität Von den gesamten 13/79 Todesfällen waren 10 intra- bzw. perioperativ, was zeigt, dass die Fontanoperation selbst das größte Risiko für den Tod darstellt. In dieser Studie lag die perioperative Mortalität bei 12,7% (10/79) Patienten. In anderen Studien variieren die Angaben von 5,4-16,9% (65,77,78). Alle 10 perioperativ verstorbenen Patienten wurden in der ersten Hälfte des Untersuchungszeitraums operiert. Ab dem Jahr 1999 verstarb kein Patient mehr in der frühen postoperativen Phase bzw. kein Patient verstarb nach Einführung der ECFO, die zu diesem Zeitpunkt erfolgte. Dieses Ergebnis deckt sich mit der Studie von Khairy et al. (78), bei welcher die perioperative Mortalität mit der Zeit von 36,7% (vor 1982 operiert) auf 15,7% (zwischen 1982 und 1989 operiert) und schließlich auf 1,9% (nach 1990 operiert) sank. Auch laut Driscoll (72) ist sowohl die frühe als auch die späte Mortalität höher bei Patienten, die in den frühen Jahren nach Einführung der Fontanoperation operiert wurden. In einer Studie von Gentles et al. (60) sank das frühpostoperative Auftreten eines Fontan-Failures von 27,1% im ersten Viertel ihrer Untersuchung auf 7,5% im letzten Viertel. Diese Ergebnisse zeigen, dass durch die Entwicklung der verschiedenen Modifikationen, die zunehmende chirurgische und postoperativ-intensivmedizinische Erfahrung sowie eine genauere präoperative Selektion der Patienten die akuten Ergebnisse der Fontanoperation drastisch verbessert werden konnten. Als häufigste Ursache der perioperativen Mortalität gaben Stamm et al. (65) in ihrer Studie eine ventrikuläre Dysfunktion bei 9/12 Patienten an. In einer Studie 48 von D´Udekem et al. (79) war die häufigste perioperative Mortalität von insgesamt 10 perioperativ verstorbenen Patienten ein Low-Cardiac-Output-Syndrom (n = 4), gefolgt von jeweils 2 Todesfällen nach Fontan-take-down bzw. einem septischen Schock. In unserer Studie verstarben ebenfalls die meisten Patienten an einem Low-Cardiac-Output-Syndrom (n = 6). Eine Patientin verstarb nach einem Fontantake-down, die 3 anderen Patienten an einer cerebralen Ursache. Beziehung zu präoperativen Risikofaktoren Ursprünglich wurden von Choussat et al. (54) 10 Selektionskriterien für eine erfolgreiche Fontanoperation aufgestellt. Im Laufe der Zeit kristallisierten sich insbesondere die Größe der Pulmonalarterien, der RPI und die präoperative Funktion des Systemventrikels als besonders bedeutende Faktoren für das Gelingen einer Fontanoperation heraus (73). Diese Risikofaktoren scheinen sich vor allem auf das frühpostoperative Überleben zu beziehen. Zum Beispiel konnten Gentles et al. (60) einige Faktoren, wie ein junges Alter zum Zeitpunkt der Fontanoperation, eine Trikuspidalklappe als dominante AV-Klappe oder einen erhöhten RPI, für ein erhöhtes frühpostoperatives Risiko verantwortlich machen. Ebenso führten bei Gaynor et al. (80) eine gemeinsame AV-Klappe und ein erhöhter RPI zu einer erhöhten perioperativen Mortalität. Wir konnten in unserer Studie zeigen, dass mit der Anzahl der Risikofaktoren die perioperative Mortalität signifikant steigt, und dass man daher durch penible präoperative Patientenselektion die Ergebnisse verbessern kann. 4.2 Langzeitverlauf Nachdem die perioperative Mortalität der Fontanoperation und deren Modifikationen deutlich gesenkt werden konnte, steht in der heutigen Zeit die Langzeit-Morbidität sowie die Lebensqualität der Fontan-Patienten im Vordergrund. 4.2.1 Spätmortalität und Langzeitüberleben In unserer Studie zeigte sich eine Überlebenswahrscheinlichkeit von 96,6% nach 15 Jahren. In der internationalen Literatur variiert die 15 Jahresüberlebenswahrscheinlichkeit zwischen 50-80% (72). Ähnliche Ergebnisse bezüglich des Langzeitüberlebens, wie wir sie beobachteten, registrierten Stamm et al. (65) in einer Studie mit 220 Patienten nach TCPC. Sie konnten ein 10-jahres 49 Überleben ihrer Patienten (ohne perioperativ verstorbener) von 98% nachweisen. Khairy et al. (78) verzeichneten in einer Studie mit 261 Patienten nach Fontanoperation ein 10-jahres Überleben ihrer Patienten (inklusive perioperativ Verstorbener) von 75%. In der Studie von Stamm et al. (65) konnten von 196/220 Patienten Informationen über den Langzeitverlauf erhoben werden. Von diesen 196 Patienten verstarben 7 während einer mittleren Follow-Up-Dauer von 10,2 Jahren. Die häufigste Todesursache war die ventrikuläre Dysfunktion bei 3 der 7 Patienten. In anderen Studien über das Langzeit-Outcome nach Fontanoperation waren die häufigsten Todesursachen der plötzliche Herztod bzw. das Herzversagen (73,78,79). Die beiden Patienten in unserer Studie verstarben während des Langzeitverlaufes an einem Low-Cardiac-Output-Syndrom bzw. an einer cerebralen Embolie nach interventionellem Verschluss einer Fenestration. 4.2.2 Langzeitkomplikationen Die spezielle Hämodynamik in einer Fontanzirkulation kann zahlreiche typische Komplikationen im Langzeitverlauf ergeben, wie Arrhythmien, Thrombembolien, hepatische Dysfunktion, Eiweißverlustenteropathie oder eine zunehmende Zyanose auf Grund der Entwicklung von veno-venösen Kollateralen (3). Auch bei 25% der Patienten in unserer Studienpopulation konnten typische Postfontan-Komplikationen beobachtet werden. Mair et al. (73) fanden in ihrem Kollektiv nur 11% Patienten mit relevanten Komplikationen in einer mittleren Zeit von 8 Jahren nach Fontanoperation. Dieser Unterschied lässt sich vielleicht dadurch erklären, dass in der Studienpopulation von Mair et al. nur Patienten mit einer Trikuspidalatresie waren. Unsere Patienten jedoch hatten die unterschiedlichsten Grunddiagnosen mit zum Teil sehr komplexen Herzfehlern. Bereits in verschiedenen Studien (24,58–60) konnte belegt werden, dass komplexere Herzfehler mit einem höheren Risiko im Langzeitverlauf einhergehen. Herzrhythmusstörungen In der vorliegenden Studie traten relevante Herzrhythmusstörungen bei 21% der Patienten auf und waren die mit Abstand häufigste Komplikation während des Beobachtungszeitraums von durchschnittlich 11,5 Jahren. 50 Herzrhythmusstörungen, Bradyarrhythmien wie sowie Dysfunktionen supraventrikuläre des Sinusknotens Tachykardien, sind mit häufige Komplikationen im Langzeitverlauf nach Fontanoperation. Generell ist die Inzidenz spät postoperativ auftretender Arrhythmien nach Fontanoperation hoch (47). Die Angaben bezüglich der Häufigkeiten variieren jedoch in der internationalen Literatur. In einer Studie von Cohen et al. (81) hatten nach einem Follow-Up nach > 4 Jahren 44% der Patienten eine Dysfunktion des Sinusknotens. Die Inzidenz atrialer Tachykardien wurde von Fishberger bzw. Durongpisitkul mit 16-17% (82,83) 5 Jahre nach der Fontanoperation angegeben. Stamm et al. (65) konnten in ihrem Patientengut mit ausschließlicher TCPC sogar bei 98% des Patientenkollektives eine arrhythmiefreie (Supraventrikuläre Tachykardie) Zeit von 5 Jahren, sowie ein freies Intervall von postoperativ neu aufgetretenen Bradyarrhythmien von 88% über 5 Jahre registrieren. Für das Auftreten einer Arrhythmie nach Fontanoperation, besonders nach der TCPC, wird sowohl eine chronische Erhöhung des Druckes im Fontan-Tunnel (84) und damit eines Teiles der rechtsatrialen Wand als auch ein chirurgisch geschaffenes Narbengewebe, eine intraoperative Schädigung des Sinusknoten oder deren vaskulärer Versorgung angesehen (81,85). Hierdurch erklären sich auch die theoretischen Vorteile einer ECFO. Durch geringere Manipulationen im Bereich des Sinusknotens und einer Minimierung der Nähte am Vorhof sollen postoperative atriale Arrhythmien bzw. Dysfunktionen des Sinusknotens reduziert werden (40). Dass Limitationen von Nähten im Vorhof bei der ECFO das Auftreten einer Tachykardie verringern, wird durch Deal et al. (86) beschrieben. Amodeo (87) konnte in einer Studie ein arrhythmiefreies 5-jahres Intervall bei 92% der ECFOPatienten feststellen. Azakie et al. (77) konnten nachweisen, dass die ECFO das Risiko für frühe und später auftretende Arrhythmien im Vergleich zur TCPC reduziert. Die Inzidenz atrialer Arrhythmien war in ihrer Studie bei Patienten mit TCPC (23%) signifikant höher als bei Patienten mit ECFO (7%). Im Gegensatz zu diesen Feststellungen konnten Cohen et al. (81) keinen Unterschied in der Inzidenz einer frühpostoperativen Sinusknotendysfunktion zwischen Patienten mit TCPC und ECFO finden. 51 Im Gegensatz zu den meisten anderen Studien zeigte sich in dieser Arbeit bezüglich des Erhalts eines SR kein Vorteil der ECFO gegenüber der TCPC. Eine mögliche Erklärung könnte darauf beruhen, dass in unserer Studie im Gegensatz zu anderen Studien ausschließlich 24-h-EKG-Befunde als Basis für die Bewertung herangezogen wurden, welches die Genauigkeit der Rhythmusdiagnostik im Vergleich zu einem routinemäßigen Oberflächen EKG deutlich erhöht. Obwohl der Anteil der Patienten mit SR in der Gruppe mit TCPC sogar größer war als bei den Patienten nach ECFO, traten relevante, therapiepflichtige Herzrhythmusstörungen im Langzeitverlauf häufiger bei Patienten mit TCPC auf als bei Patienten nach ECFO auf. Dies zeigte sich insbesondere in der Inzidenz einer Schrittmachertherapie. Allerdings ist bei der Interpretation dieser Ergebnisse zu beachten, dass die Follow-Up-Dauer bei Patienten mit ECFO naturgemäß signifikant kürzer war als in der Gruppe mit TCPC. Eiweißverlustenteropathie Die Eiweißverlustenteropathie, der Verlust von Serumproteinen über den Gastrointestinaltrakt, ist eine seltene, aber prognostisch sehr ungünstige, Komplikation nach Fontanoperation, die sich mit peripheren Ödemen, Aszites, chronischen Diarrhöen, sowie einem erhöhten Alpha-1-Antitrypsin-Level im Stuhl manifestiert (3). Die Häufigkeit wird mit 4-13% angegeben (88,89). In unserer Studie hatten 2/60 Patienten (3,3%) eine Eiweißverlustenteropathie. Die Mortalität der Eiweißverlustenteropathie ist mit bis zu 50% innerhalb von 5 Jahren nach Diagnosestellung sehr hoch (69,73,79). In unserer Studienpopulation war bisher kein Tod als Folge dieser Komplikation zu verzeichnen. Der genaue Pathomechanismus ist immer noch unbekannt. Eine chronische Erhöhung des Systemvenösen Druckes mit konsekutiver Verschlechterung der lymphatischen Zirkulation wird als eine der möglichen hämodynamischen Ursachen angenommen (89,90). Als weitere Ursachen werden die Folgen eines Low-Cardiac-Outputs mit einer resultierenden Erhöhung des Widerstandes in den Mesenterialgefäßen (91), als auch ein entzündliches Geschehen diskutiert (92). Feldt et el. (89) konnten in ihrer Studie mit 427 Patienten zeigen, dass ein präoperativ erhöhter RPI, ein erhöhter enddiastolischer Druck des 52 Systemventrikels, kein linksmorphologischer Systemventrikel und eine andere Fehlbildung als eine TA Risikofaktoren für das Auftreten einer Eiweißverlustenteropathie darstellen. Auch die beiden Patienten in unserer Studie hatten keine TA als Grunddiagnose. Bei einer der beiden Patienten bestand präoperativ ein erhöhter RPI. Beide Patienten jedoch wiesen einen linksmorphologischen Systemventrikel auf ohne erhöhten enddiastolischen Druck. Die Behandlung der Eiweißverlustenteropathie erfolgte bei beiden Patienten in unserer Studie mit Diuretika, Nachlastsenkern sowie pulmonalen Vasodilatatoren. Bei einer der beiden Patienten erfolgte eine Stentimplantation wegen einer Stenose in das extrakardiale Conduit am Übergang zu VCI, weil es zu einer erneuten Verschlechterung der Symptome gekommen war. In der Literatur werden verschiedenste beschrieben, Behandlungsmodalitäten was darauf hindeutet, für dass die kein Eiweißverlustenteropathie einheitliches definitives Management existiert. Die Eiweißverlustenteropathie bleibt deshalb eine der größten Herausforderungen im Management der Patienten nach Fontanoperation (69). Neben der oben angeführten medikamentösen Therapie (23,74,93) werden zusätzlich eine kalorien- und proteinreiche Diät, und Infusionen mit Albumin und Immunglobulinen angegeben (3). Auch Therapien mit hochmolekularem Heparin, welches einen membranstabilisierenden Effekt besitzt, und Kortikosteroiden sind beschrieben (3,74,92,94,95). Interventionen, wie eine Fenestration des Tunnels bei erhöhtem Druck im Fontankreislauf, Schrittmacherimplantation bzw. eine konsequente medikamentöse Therapie bei Rhythmusstörungen oder operative bzw. interventionelle Korrekturen vorhandener Obstruktionen können helfen, den systemvenösen Druck zu reduzieren (23). Untersuchungen von Vyas et al. (96) zeigen aber, dass eine „transkatheter Fontan Fenestration“ nur eine überbrückende Maßnahme bis zu einer definitiven Prozedur darstellt, da alle Patienten während ihrer Untersuchung, auch nach vorerst erfolgreicher Fenestration, erneut Symptome einer Eiweißverlustenteropathie aufwiesen. Als letzte Option besteht für Patienten mit Verschlechterung der hämodynamischen Parameter und schlechtem Ansprechen auf die übrigen Therapiemöglichkeiten die Herztransplantation (23). 53 Veno-venöse Kollateralen In Abwesenheit einer Fenestration liegt die Sauerstoffsättigung bei FontanPatienten normalerweise um 94%. Diese leichte Desaturierung beruht bei den meisten Fontan-Patienten darauf, dass der Koronarsinus in das LA mündet und auf diese Weise eine moderate Untersättigung von Eine zunehmende Hypoxämie und damit 2% verursacht (3,23,74). einhergehende Zyanose kann unterschiedliche Ursachen haben. Eine noch offene Tunnelfenestration oder eine residuelle interatriale Verbindung zwischen Tunnel und LA können zu einem signifikanten Rechts-Links-Shunt führen. Eine Kompression der Pulmonalvenen durch einen großen Vorhof, die Entwicklung von intrapulmonalen arteriovenösen Fisteln, eine Imbalance von Ventilation und Perfusion in der Lunge oder auch schließlich systemvenöse Kollateralen sind weitere mögliche Ursachen einer progredienten Zyanose (3,23,74). Veno-venöse Kollateralen sind Ausdruck eines chronisch erhöhten ZVD bzw. eines erhöhten RPI (97). Die Kollateralen führen zu einer arteriellen Untersättigung, wenn sie einen Anschluss in das LA oder in die pulmonalvenöse Zirkulation finden (3,23,74). Im Falle einer schweren Zyanose sollte eine Katheterembolisation dieser veno-venösen Kollateralen in Betracht gezogen werden (23,74). Andrews et al. (98) registrierten in ihrer Kohorte mit Patienten (HLHS) nach einer Hemi-Fontan-Operation bei 39% system-venöse Kollateralen, Weber et al. (99) bei 43% nach Fontankomplettierung. In unserer Studie beobachteten wir bei 23 Patienten (38,3%) Kollateralen zwischen system- und pulmonalvenösem Stromgebiet. Die arterielle Sauerstoffsättigung stieg durch die Intervention von im Mittel 88,8% (88-90%) auf im Durchschnitt 91,3% (91-92%) an. McElhinney et al. (97) konnten bei Patienten nach BDGA sogar einen Anstieg der Sauerstoffsättigung von 9-20% nach Embolisation verzeichnen. Thrombose- und Embolierisiko Thrombembolische Komplikationen sind eine bekannte Ursache für die LangzeitMortalität nach Fontanoperation. Khairy et al. (78) fanden die Thrombembolie als eine der drei häufigsten Todesursachen in ihrer Studie. In unserer Studie verstarb kein Patient an den Folgen eines thrombembolischen Ereignisses. Nur bei einer Patientin wurde während einer Routineuntersuchung ein Thrombus im pulmonalvenösen Atrium nachgewiesen. Balling et al. (100) fanden bei einer 54 Untersuchung von 52 asymptomatischen Patienten bei 33% eine intrakardiale Thrombusformation. Das Auftreten dieser Komplikation ist in der vorliegenden Untersuchung im Vergleich mit anderen Studien sehr gering. Während die Inzidenz in unserer Studie bei lediglich 1,6% lag, hatten in einer Untersuchung von Kaulitz et al. (101) 7% von 142 Patienten nach einem Follow-Up von 91,1 43,9 Monaten nach TCPC bzw. ECFO einen Thrombus. Rosenthal (102) berichtete sogar von 20% nach 5,2±4,7 Jahren. Ursachen thrombotischer Komplikationen nach einer Fontanoperation inkludieren den langsamen Fluss durch den cavopulmonalen Kreislauf, die Hyperkoagulabilität, Rhythmusstörungen, Nähte und Verletzungen im Bereich der Vorhöfe (74). Bei Abwesenheit atrialer Rhythmusstörungen ist die Rolle einer antithrombotischen Langzeitprophylaxe mit Thrombozytenaggregationsinhibitoren oder mit einer oralen Antikoagulation noch nicht wirklich geklärt (3). Einige retrospektive Studien unterstützen die Wirksamkeit einer Prophylaxe mit Thrombozytenaggregratationshemmern, andere Autoren sind der Meinung, dass eine Anitkoagulationstherapie effektiver ist, während wieder andere eine RoutineAntikoagulation ablehnen (3). Mahnke et al. (103) zeigten zum Beispiel, dass spät aufgetretene cerebrovaskuläre Ereignisse nicht mit einer fehlenden antikoagulativen Therapie korrelieren. Nach Coon et al. (104) traten Thromben auch bei Patienten auf, die eine Therapie mit Aspirin bzw. Warfarin hatten. Auf der anderen Seiten meinen Khairy et al. (78), dass die Abwesenheit einer Therapie mit Aspirin oder Warfarin ein Risiko für die Langzeitmortalität durch Thrombembolie darstellt. Alle Patienten in unserer Studie wurden 1 Jahr lang bzw. bis zum interventionellen Verschluss eines hämodynamisch relevanten Rechts-Links-Shunts postoperativ oral antikoaguliert, danach wurde die Thromboseprophylaxe auf Acetylsalicylsäure umgestellt. Zusätzlich wurden jene Patienten mit erhöhtem Risiko nach individueller Einschätzung weiter oral antikoaguliert. Auch die oben genannte Patientin hatte zum Zeitpunkt der letzten Kontrolle noch eine perorale Antikoagulation. 55 Progressive Dysfunktion des Systemventrikels mit chronischem LowCardiac-Output Eine systolische Dysfunktion des Systemventrikels ist durch eine verminderte Kontraktilität und eine Ejektionsfraktion von <50% gekennzeichnet. Eine diastolische Dysfunktion liegt bei erhöhtem enddiastolischen Druck im Systemventrikel vor (74). Während der ersten Lebensmonate unterliegt der singuläre Ventrikel bei Patienten mit einem UVH einer Volumenbelastung. Diese führt zu einer Dilatation, Hypertrophie und zunächst zu einer Hyperkontraktilität des Systemventrikels (23). Idealerweise kann eine Volumenentlastung des Ventrikels durch ein mehrstufiges Verfahren die Hypertrophie und Dilatation des Systemventrikels reduzieren und so die ventrikuläre Performance verbessern (74). Systemisch-pulmonalarterielle Shunts, ein PAB, Klappeninsuffizienzen oder eine Obstruktion des systemischen Ausflusstrakts können eine zusätzliche Druck- bzw. Volumenbelastung des Systemventrikels noch begünstigen. Diese Faktoren sind demnach Determinanten für ein mögliches Versagen des zukünftigen Systemventrikels (94). Auch kann die zugrundeliegende kongenitale Malformation selbst, sowie die Morphologie des Systemventrikels zu einer später auftretenden progressiven Dysfunktion des Ventrikels entscheidend beitragen (23). Schließlich können auch therapierefraktäre Rhythmusstörungen als Folge der gestörten Synchronisation zwischen LA und dem Systemventrikel zu einer Herzinsuffizienz führen (81,86). Prinzipiell ist nach einer Fontanoperation die Vorlast des Systemventrikels in Relation zur Ventrikelgröße um 25-70% reduziert (23). Durch die niedrige Vorlast findet ein Remodelling statt. Eine verminderte Compliance mit beeinträchtigter diastolischer Ventrikelfüllung und ein verminderter kardialer Auswurf sind die Folgen (23). Daraus kann im Langzeitverlauf eine ventrikuläre Dysfunktion und nachfolgend ein Late-Fontan-Failure resultieren (74). Die Exploration eines Late-Fontan-Failures sollte grundsätzlich mit einer Suche nach anatomischen Abnormalitäten oder Arrhythmien beginnen, die einer eventuellen chirurgischen Klappeninsuffizienzen, oder pulmonalvenöse interventionellen Obstruktionen, Korrektur Stenosen (AVder 56 Pulmonalarterien, Obstruktionen im Tunnel oder im Ausflusstrakt) bzw. medikamentösen Therapie zugänglich sind (74). Die Herztransplantation stellt die letzte Möglichkeit der Therapieoption bei Patienten mit Fontan-Late-Failure dar. In unserer Studie entwickelte nur ein Patient mit TA im Langzeitverlauf aufgrund einer progredienten Mitralklappeninsuffizienz trotz AV-Klappenrekonstruktion eine therapieresistente Herzinsuffizienz, die schließlich eine Herztransplantation notwendig machte. Die Prognose nach Herztransplantation bei Fontan-Patienten ist im Allgemeinen schlechter als bei Patienten mit anderer Grunderkrankung (105). 4.2.3 Klinischer Status bei letzter Kontrolle Generell ist die Belastbarkeit der Patienten nach Fontanoperation im Vergleich zur Normalbevölkerung signifikant reduziert (49). In verschiedenen Studien werden dennoch bei der Mehrzahl der Patienten gute NYHA-Stadien verzeichnet. In der Studie von Stamm et al. (65) lagen von 183/196 Patienten Informationen bezüglich des NYHA-Stadiums vor. Von diesen Patienten erreichten 94% ein NYHA-Stadium I oder II, ein NYHA-Stadium IV wurde bei keinem Patienten beobachtet. Ebenfalls benötigte die Mehrzahl der Patienten zum Zeitpunkt des letzten Follow-Up keine kardialen Medikamente. In dem Patientenkollektiv von d´Udekem et al. (79) mit 215 überlebenden Patienten mit Fontankreislauf (Atriopulmonale Anastomose, TCPC und ECFO) hatten 97% ein NYHA-Stadium I oder II, kein Patient hatte ein NYHA-Stadium IV. Mair et al. (73) berichteten über 167 überlebende Patienten mit TA (Atriopulmonale Anastomose, TCPC und ECFO), von denen 89% ein NYHAStadium I oder II hatten. Auch in dieser Studie waren alle Patienten im NYHA-Stadium I bzw. II mit einem dementsprechend guten Ability-Index. Bei einem Großteil der Patienten (71,4%) bestand bei der letzten Kontrolle keine Indikation zu einer kardialen Medikation. Bei 44 Patienten konnten wir weitere Informationen über die „soziale Integration“ erhalten. Von 44 Patienten führten 42 ein ihrem Alter entsprechendes Leben mit Besuch einer normalen Schule oder der Ausübung eines Berufes. Lediglich 2 Patienten mit geistiger Retardierung waren bei der letzten Kontrolle zu verzeichnen. In einigen Studien wurde ein niedrigerer Intelligenzquotient bei Fontan-Patienten als in der Normalbevölkerung nachgewiesen (106,107), welches in einer anderen Studie nicht belegt werden konnte (108). 57 Auswirkungen präoperativer Risikofaktoren auf den Langzeitverlauf Gentles et al. (60) konnten die präoperative Notwendigkeit einer Schrittmacherimplantation sowie eine komplexere Anatomie (Heterotaxie Syndrom oder HLHS) als Risikofaktoren für einen schlechteren Langzeitverlauf finden. Stamm et al. (65) konnten jedoch auch andere präoperative Risikofaktoren, wie AV-Klappeninsuffizienzen oder eine vorangegangene Korrektur einer Aortenisthmusstenose mit einem Late-Fontan-Failure in Verbindung bringen. In unserer Studie konnte gezeigt werden, dass Patienten mit mehr als einem präoperativen Risikofaktor signifikant häufiger eine erniedrigte Ejektionsfraktion des Systemventrikels bei der letzten Kontrolle hatten als Patienten mit maximal einem präoperativen Risikofaktor. Bei den restlichen untersuchten Parametern konnten wir jedoch keinen Einfluss feststellen. Einfluss der durchgeführten Fontan-Modifikation Neben dem allgemeinen Erfahrungszuwachs konnten durch die Modifikationen der ursprünglichen Fontanoperation die frühpostoperativen als auch die Langzeitergebnisse deutlich gebessert werden (47). Gegenwärtig werden weltweit nur die ECFO und die TCPC zur Fontankomplettierung angewandt (77). Mögliche Vorteile der ECFO liegen einerseits in einer Optimierung eines laminaren Blutflusses im Fontan-Tunnel, andererseits operationstechnisch in der deutlich geringeren Manipulation im Bereich des Sinusknotens. Ein möglicher weiterer Vorteil besteht in der Minimierung oder gar Vermeidung eines Kardio-PulmonalenBypass bzw. einer Kardioplegie (40,77). Der Nachteil einer ECFO ist, dass das Conduit nicht mitwachsen kann und ein eventuell höheres Risiko für ein späteres thrombembolisches Ereignis besteht (77). In unserer Studie ist ein direkter Vergleich zwischen den TCPC und ECFOPatienten auf Grund der naturgemäß deutlich unterschiedlichen Länge der Nachbeobachtungszeit nur bedingt möglich. Hinsichtlich des NYHA-Stadiums bzw. dem Ability-Index, sowie der Indikation einer kardialen Medikation, der Ejektionsfraktion und AV-Klappenfunktion konnte kein Unterschied zwischen den Patientengruppen festgestellt werden. Dies könnte unter anderem daran liegen, dass die Therapie von Rhythmusstörungen bei unseren Patienten sehr frühzeitig begonnen wurde und so bis jetzt noch keine negativen hämodynamischen 58 Auswirkungen auftreten therapiepflichtige konnten. Der Einfluss Rhythmusstörungen der wurde Modifikation bereits im auf Kapitel Herzrhythmusstörungen diskutiert. Auswirkungen der Morphologie des Systemventrikels Ein rechtsmorphologischer Systemventrikel scheint für die lebenslange Aufrechterhaltung einer adäquaten systemischen Zirkulation nicht in gleicher Weise in der Lage zu sein wie ein morphologisch LV (94). Auch eine Trikuspidalklappe oder eine gemeinsame AV-Klappe tolerieren die einstige Volumenbelastung und die anschließend bestehende systemische Nachlast schlecht (23). In mehreren Studien konnte gezeigt werden, dass ein rechtsmorphologischer Systemventrikel mit einem schlechteren Outcome sowohl früh postoperativ als auch im Langzeitverlauf nach Fontanoperation verbunden ist (65,78,109,110,111). Fontan-Patienten mit einem rechtsmorphologischen Systemventrikel weisen zudem eine schlechtere Belastungskapazität im Vergleich zu Patienten mit einem linksmorphologischen Systemventrikel auf (112). In unserer Studie zeigte sich aufgrund der niedrigen Patientenanzahl mit rechtsmorphologischem Systemventrikel lediglich tendenziell, dass ein rechtsmorphologischer Systemventrikel mit einem schlechteren Langzeit-Outcome in Verbindung gebracht werden kann. Diese tendenziellen Unterschiede konnten hinsichtlich des NYHA-Stadiums, des Ability-Indexes, der Ejektionsfraktion und der Medikamentenindikation festgestellt werden. Bei der Funktion der AV-Klappen ergab sich kein Unterschied zwischen den beiden morphologischen Ventrikeltypen. Eine Studie von Anderson et al. (113) zeigte jedoch, dass ein rechter Ventrikel häufiger mit einer schlechteren Ventrikelfunktion als auch mit einer schlechteren AV-Klappenfunktion einhergeht. 59 4.3 Limitationen der Studie Die Aussagekraft dieser Studie wird insbesondere durch das retrospektive Design limitiert. Die Datenerhebung erfolgte ausschließlich mittels Studium der Krankenakten der Patienten, wobei eine vollständige Datenerfassung bei allen Patienten nicht immer möglich war. Durch die geringe Anzahl der Patienten ist ein statistischer Vergleich zwischen verschiedenen Patientenuntergruppen nur bedingt möglich. Die Heterogenität von assoziierten kardialen Fehlbildungen macht einen statistischen Vergleich noch schwerer. Aufgrund des langen Zeitraums, den diese Studie umfasst, ist eine „Learning Curve“ sowohl hinsichtlich der operativen Erfahrung als auch in Bezug auf das postoperativ- intensivmedizinische Management sowie schließlich auch in der Langzeitbetreuung sicherlich zu berücksichtigen. Die beiden Modifikationen der Fontanoperation, TCPC und ECFO, wurden auch nicht parallel eingesetzt, sondern die ECFO wurde als Weiterentwicklung der TCPC, wie international üblich, erst ab etwa der ersten Hälfte der Studiendauer als ausschließliche Methode angewandt. Dadurch hat diese Patientengruppe besonders durch die vorherigen Erfahrungen profitiert. Als weitere Folge zeigt sich in dieser Studie naturgemäß ein unterschiedlich langes Follow-Up, wodurch ein direkter Vergleich der Patienten mit ECFO bzw. TCPC auch eingeschränkt ist. 60 4.4 Konklusion Bei Patienten mit funktionell singulärem Ventrikel bietet die Fontanoperation die einzige Möglichkeit der Trennung des System- und Lungenkreislaufs. Durch die Fortschritte der Herzchirurgie, der postoperativen Intensivmedizin sowie durch die Einführung neuer Modifikationen bis hin zu der heutzutage fast ausschließlich angewendeten ECFO konnten die postoperativen Ergebnisse in den letzten Jahren deutlich gebessert werden. Auch im Langzeitverlauf zeigen sich in der Mehrzahl der Patienten zufriedenstellende Ergebnisse. In dieser Studie konnte gezeigt werden, dass die Anzahl von präoperativen Risikofaktoren, die angewandte Modifikation und auch die Morphologie des Systemventrikels sich nicht nur auf das perioperative Outcome, sondern auch auf den Langzeitverlauf der Patienten auswirkt. Im Langzeitverlauf wird die systolische Funktion des Systemventrikels durch eine höhere Anzahl präoperativer Risikofaktoren negativ beeinflusst, die TCPC führt häufiger zu therapiepflichtigen Rhythmusstörungen im Vergleich zur ECFO, und ein rechtsmorphologischer SV ist tendenziell mit einem schlechteren Langzeit-Outcome assoziiert. Die möglichen schwerwiegenden Komplikationen im Langzeitverlauf, wie Herzrhythmusstörungen, Thrombembolien, Eiweißverlustenteropathie oder die Entstehung von venösen Kollateralen, unterstreichen die Notwendigkeit regelmäßiger, lebenslanger Kontrollen. Da die relativ kleine Studienpopulation die Aussagekraft unserer Studie limitiert, wäre eine größere österreichweite Multicenter-Studie empfehlenswert, um den Einfluss der Fontanmodifikationen und der präoperativen Risikofaktoren auf den Langzeitverlauf besser zu erfassen. 61 5 Literaturverzeichnis 1. Schumacher G. Univentrikuläres Herz bzw. singulärer Ventrikel. In: Schumacher G, Hess J, Bühlmeyer K. Klinische Kinderkardiologie: Diagnostik und Therapie der angeborenen Herzfehler. 3rd ed. Berlin: Springer; 2001. p.431-444. 2. Lange R, Hörer J. Funktionell singulärer Ventrikel und Fontan-Operation. In: Ziemer G, Haverich A. Herzchirurgie: Die Eingriffe am Herzen und den herznahen Gefäßen. 3rd ed. Berlin, Heidelberg: Springer; 2010. p.331-358. 3. Khairy P, Poirier N, Mercier L. Univentricular heart. Circulation 2007; 115(6):800–12. 4. Jacobs ML, Mayer JE. Congenital Heart Surgery Nomenclature and Database Project: single ventricle. Ann Thorac Surg 2000; 69(4 Suppl):197-204. 5. Anderson RH, Becker AE, Freedom RM, Macartney FJ, Quero-Jimenez M, Shinebourne EA et al. Sequential segmental analysis of congenital heart disease. Pediatr Cardiol 1984; 5(4):281–7. 6. Schumacher G. Trikuspidalatresie. In: Schumacher G, Hess J, Bühlmeyer K. Klinische Kinderkardiologie: Diagnostik und Therapie der angeborenen Herzfehler. 3rd ed. Berlin: Springer; 2001. p.222-238. 7. Thorne, S. Atrioventricular valve atresia. In: Gatzoulis MA, Webb GD, Daubeny PEF. Diagnosis and management of adult congenital heart disease. Edinburgh: Churchill Livingstone; 2004. p.405-412. 8. Epstein, ML. Tricuspid atresia. In: Allen HD, Moss AJ, Adams FH. Moss and Adams' heart disease in infants, children, and adolescents: Including the fetus and young adult. 7th ed. Philadelphia, Pa: Lippincott Williams & Wilkins; 2008. p.817834. 9. Edwards JE, Burchell HB. Congenital tricuspid atresia; a classification. Med. Clin. North Am 1949; 33:1177–96. 10. Hagler DJ, Edwards WD. Univentricular atrioventricular connection. In: Allen HD, Moss AJ, Adams FH. Moss and Adams´heart disease in infants, children, and adolescents. Including the fetus and young adult. 7th ed. Philadelphia, Pa: Lippincott Williams & Wilkins; 2008. p.1128-1148. 11. Poirir NC, Gatzoulis MA. Double-inlet ventricle. In: Gatzoulis MA, Webb GD, Daubeny PEF. Diagnosis and management of adult congenital heart disease. Edinburgh: Churchill Livingstone; 2004. p.399-404. 12. Hagler DJ. Double-outlet right ventricle and double-outlet left ventricle. In: Allen HD, Moss AJ, Adams FH. Moss and Adams´heart disease in infants, children, and adolescents. Including the fetus and young adult. 7th ed. Philadelphia, Pa: Lippincott Williams & Wilkins; 2008. p.1100-1127. 13. Arsdell GS. Double-outlet right ventricle. In: Gatzoulis MA, Webb GD, Daubeny PEF. Diagnosis and management of adult congenital heart disease. Edinburgh: Churchill Livingstone; 2004. p.389-398. 14. Schmaltz, AA. Zustand nach Fontan-Operation. In: Schmaltz AA. Erwachsene mit angeborenen Herzfehlern. Steinkopff; 2008. p. 143-150. 62 15. Tweddell JS, Hoffman GM, Ghanayem NS, Frommelt MA, Mussatto KA, Berger S. Hypoplastic left heart syndrome. In: Allen HD, Moss AJ, Adams FH. Moss and Adams´heart disease in infants, children, and young adults.Including the fetus and young adults. 7th ed. Philadelphia, Pa: Lippincott Williams & Wilkins; 2008. p. 1005-1037. 16. Apitz J. Hypoplastisches Linksherzsyndrom mit Aorten- und/oder Mitralatresie. In: Apitz J. Pädiatrische Kardiologie: Erkrankungen des Herzens bei Neugeborenen, Säuglingen, Kindern und Heranwachsenden. 2. ed. Darmstadt: Steinkopff; 2002. p. 459-472. 17. Singer H, Hofbeck, M. Endokardkissendefekte - AV-Septumdefekte. In: Apitz J. Pädiatrische Kardiologie: Erkrankungen des Herzens bei Neugeborenen, Säuglingen, Kindern und Heranwachsenden. 2. ed. Darmstadt: Steinkopff; 2002. p. 365-380. 18. Kaulitz R, Hofbeck M. Current treatment and prognosis in children with functionally univentricular hearts. Arch Dis Child 2005; 90(7):757–62. 19. Nykanen DG. Pulmonary atresia and intact ventricular septum. In: Allen HD, Moss AJ, Adams FH. Moss and Adams´heart disease in infants, children, and young adults. Including the fetus and young adults. 7th ed. Philadelphia, Pa: Lippincott Williams & Wilkins; 2008. p.859-877. 20. Vogt J. Pulmonalatresie mit intaktem Ventrikelseptum. In: Apitz J. Pädiatrische Kardiologie: Erkrankungen des Herzens bei Neugeborenen, Säuglingen, Kindern und Heranwachsenden. 2. ed. Darmstadt: Steinkopff; 2002. p.448-451. 21. Bull C, Leval MR de, Mercanti C, Macartney FJ, Anderson RH. Pulmonary atresia and intact ventricular septum: a revised classification. Circulation 1982; 66(2):266–72. 22. Yoshimura N, Yamaguchi M. Surgical strategy for pulmonary atresia with intact ventricular septum: initial management and definitive surgery. Gen Thorac Cardiovasc Surg 2009; 57(7):338–46. 23. Gewillig M. The Fontan circulation. Heart 2005; 91(6):839–46. 24. Knott-Craig CJ, Danielson GK, Schaff HV, Puga FJ, Weaver AL, Driscoll DD. The modified Fontan operation. An analysis of risk factors for early postoperative death or takedown in 702 consecutive patients from one institution. J Thorac Cardiovasc Surg 1995; 109(6):1237–43. 25. Kuroczynski W. Entwicklung der Fontan-Prozedur als Behandlungskonzept für Kinder mit angeborenen komplexen Herzfehlern. Herz 2007; (32):241–7. 26. Moodie DS, Ritter DG, Tajik AJ, O'Fallon WM. Long-term follow-up in the unoperated univentricular heart. Am J Cardiol 1984; 53(8):1124–8. 27. Harvey W. Exercitatio Anatomica De Motu Cordis Et Sanguinis in Animalibus. An English translation with Annotations by Leake CD. Springfield, Ill., C.C. Thomas; 1958. 28. Rodbard S, Wagner D. By-passing the right ventricle. Proc Soc Exp Biol Med 1949; 71(1):69. 29. Warden HE, Wall RA de, Varco RL. Use of the right auricle as a pump for the pulmonary circuit. Surg Forum 1955; 5:16–22. 63 30. Rose JC, Cosimano SJ, Hufnagel CA, Massullo EA. The effects of exclusion of the right ventricle from the circulation in dogs. J Clin Invest 1955; 34(11):1625–31. 31. Robicsek F, Watts LT. A prelude to Fontan. Pediatr Cardiol 2007; 28(6):422–5. 32. Glenn WW, Ordway NK, Talner NS, Call EP. Circulatory Bypass Of The Right Side Of The Heart. VI. Shunt Between Suoerior Vena Cava And Distal Right Pulmonary Artery; Report Of Clinical Application In Thirty-Eight Cases. Circulation 1965; 31:172–89. 33. Fontan F, Baudet E. Surgical repair of tricuspid atresia. Thorax 1971; 26(3):240–8. 34. Kreutzer G, Galíndez E, Bono H, Palma C de, Laura JP. An operation for the correction of tricuspid atresia. J Thorac Cardiovasc Surg 1973; 66(4):613–21. 35. Kreutzer GO, Vargas FJ, Schlichter AJ, Laura JP, Suarez JC, Coronel AR et al. Atriopulmonary anastomosis. J Thorac Cardiovasc Surg 1982; 83(3):427–36. 36. Björk VO, Olin CL, Bjarke BB, Thorén CA. Right atrial-right ventricular anastomosis for correction of tricuspid atresia. J Thorac Cardiovasc Surg 1979; 77(3):452–8. 37. Jonas RA, Castaneda AR. Modified Fontan procedure: atrial baffle and systemic venous to pulmonary artery anastomotic techniques. J Card Surg 1988; 3(2):91–6. 38. Leval MR de, Kilner P, Gewillig M, Bull C. Total cavopulmonary connection: a logical alternative to atriopulmonary connection for complex Fontan operations. Experimental studies and early clinical experience. J Thorac Cardiovasc Surg 1988; 96(5):682–95. 39. Marcelletti C, Corno A, Giannico S, Marino B. Inferior vena cava-pulmonary artery extracardiac conduit. A new form of right heart bypass. J Thorac Cardiovasc Surg 1990; 100(2):228–32. 40. Giannico S, Corno A, Marino B, Cicini MP, Gagliardi MG, Amodeo A et al. Total extracardiac right heart bypass. Circulation 1992; 86(5 Suppl):II110-7. 41. Laschinger JC, Ringel RE, Brenner JI, McLaughlin JS. The extracardiac total cavopulmonary connection for definitive conversion to the Fontan circulation: summary of early experience and results. J Card Surg 1993; 8(5):524–33. 42. Hopkins RA, Armstrong BE, Serwer GA, Peterson RJ, Oldham HN. Physiological rationale for a bidirectional cavopulmonary shunt. A versatile complement to the Fontan principle. J Thorac Cardiovasc Surg 1985; 90(3):391–8. 43. Gamillscheg A, Nagel B, Heinzl B, Köstenberger M, Zobel G, Knez I. Fallbericht und Overview: Fontanzirkulation und pulmonaler Gefäßwiderstand. J Kardiol 2010; 17 (11-12):419–22. 44. Norwood WI, Jacobs ML. Fontan's procedure in two stages. Am J Surg 1993; 166(5):548–51. 45. Bridges ND, Jonas RA, Mayer JE, Flanagan MF, Keane JF, Castaneda AR. Bidirectional cavopulmonary anastomosis as interim palliation for high-risk Fontan candidates. Early results. Circulation 1990; 82(5 Suppl):IV170-6. 64 46. Jacobs ML, Rychik J, Rome JJ, Apostolopoulou S, Pizarro C, Murphy JD et al. Early reduction of the volume work of the single ventricle: the hemi-Fontan operation. Ann Thorac Surg 1996; 62(2):456-61. 47. Marino BS. Outcomes after the Fontan procedure. Curr Opin Pediatr 2002; 14(5):620–6. 48. Gewillig M, Brown SC, Eyskens B, Heying R, Ganame J, Budts W et al. The Fontan circulation: who controls cardiac output? Interact Cardiovasc Thorac Surg 2010; 10(3):428–33. 49. La Gerche A, Gewillig M. What Limits Cardiac Performance during Exercise in Normal Subjects and in Healthy Fontan Patients? Int J Pediatr 2010; Volume 2010. 50. Wessel DL, Adatia I, Giglia TM, Thompson JE, Kulik TJ. Use of inhaled nitric oxide and acetylcholine in the evaluation of pulmonary hypertension and endothelial function after cardiopulmonary bypass. Circulation 1993; 88(5 Pt 1):2128–38. 51. Gamillscheg A, Zobel G, Urlesberger B, Berger J, Dacar D, Stein JI et al. Inhaled nitric oxide in patients with critical pulmonary perfusion after Fontan-type procedures and bidirectional Glenn anastomosis. J Thorac Cardiovasc Surg 1997; 113(3):435–42. 52. Miyaji K, Nagata N, Miyamoto T, Kitahori K. Combined therapy with inhaled nitric oxide and intravenous epoprostenol (prostacyclin) for critical pulmonary perfusion after the Fontan procedure. J Thorac Cardiovasc Surg 2003; 125(2):437–9. 53. Peters NS, Somerville J. Arrhythmias after the Fontan procedure. Br Heart J 1992; 68(2):199–204. 54. Choussat A, Fontan F, Besse P, Vallot F, Chauve A, Bricaud H. Selection criteria for Fontan's procedure. In: Anderson RH, Shinebourne EA. Paediatric Cardiology. Churchill Livingstone, Edinburgh, 1978; 559-566. 55. Pearl JM, Laks H, Drinkwater DC, Capouya ER, George BL, Williams RG. Modified Fontan procedure in patients less than 4 years of age. Circulation 1992; 86(5 Suppl):II100-5. 56. Weber HS, Gleason MM, Myers JL, Waldhausen JA, Cyran SE, Baylen BG. The Fontan operation in infants less than 2 years of age. J Am Coll Cardiol 1992; 19(4):828–33. 57. Alboliras ET, Porter CB, Danielson GK, Puga FJ, Schaff HV, Rice MJ et al. Results of the modified Fontan operation for congenital heart lesions in patients without preoperative sinus rhythm. J Am Coll Cardiol 1985; 6(1):228–33. 58. Driscoll DJ, Offord KP, Feldt RH, Schaff HV, Puga FJ, Danielson GK. Five- to fifteen-year follow-up after Fontan operation. Circulation 1992; 85(2):469–96. 59. Bridges ND, Lock JE, Castaneda AR. Baffle fenestration with subsequent transcatheter closure. Modification of the Fontan operation for patients at increased risk. Circulation 1990; 82(5):1681–9. 60. Gentles TL, Mayer JE, Gauvreau K, Newburger JW, Lock JE, Kupferschmid JP et al. Fontan operation in five hundred consecutive patients: factors influencing early and late outcome. J Thorac Cardiovasc Surg 1997; 114(3):376–91. 65 61. Mair DD, Hagler DJ, Puga FJ, Schaff HV, Danielson GK. Fontan operation in 176 patients with tricuspid atresia. Results and a proposed new index for patient selection. Circulation 1990; 82(5 Suppl):IV164-9. 62. Fontan F, Fernandez G, Costa F, Naftel DC, Tritto F, Blackstone EH et al. The size of the pulmonary arteries and the results of the Fontan operation. J Thorac Cardiovasc Surg 1989; 98(5 Pt 1):711-9. 63. Nakata S, Imai Y, Takanashi Y, Kurosawa H, Tezuka K, Nakazawa M et al. A new method for the quantitative standardization of cross-sectional areas of the pulmonary arteries in congenital heart diseases with decreased pulmonary blood flow. J Thorac Cardiovasc Surg 1984; 88(4):610–9. 64. Graham TP, Johns JA. Pre-operative assessment of ventricular function in patients considered for Fontan procedure. Herz 1992; 17(4):213–9. 65. Stamm C, Friehs I, Mayer JE, Zurakowski D, Triedman JK, Moran AM et al. Long-term results of the lateral tunnel Fontan operation. J Thorac Cardiovasc Surg 2001; 121(1):28–41. 66. Bridges ND, Mayer JE, Lock JE, Jonas RA, Hanley FL, Keane JF et al. Effect of baffle fenestration on outcome of the modified Fontan operation. Circulation 1992; 86(6):1762–9. 67. Black MD, van Son JA, Haas GS. Extracardiac Fontan operation with adjustable communication. Ann Thorac Surg 1995; 60(3):716–8. 68. Kopf GS, Kleinman CS, Hijazi ZM, Fahey JT, Dewar ML, Hellenbrand WE. Fenestrated Fontan operation with delayed transcatheter closure of atrial septal defect. Improved results in high-risk patients. J Thorac Cardiovasc Surg 1992; 103(6):1039-47. 69. Gersony WM. Fontan operation after 3 decades: what we have learned. Circulation 2008; 117(1):13–5. 70. Gamillscheg A, Beitzke A, Stein JI, Zobel G, Rödl S, Zartner P. Interventioneller Verschluss von interatrialen Verbindungen nach modifizierter Fontanoperation. Z Kardiol 2002; 91(4):304–11. 71. Pearl JM, Laks H, Barthell S, Drinkwater DC, Capouya ER, Chang PA. Spontaneous closure of fenestrations in an interatrial Gore-Tex patch: application to the Fontan procedure. Ann Thorac Surg 1994; 57(3):611–4. 72. Driscoll DJ. Long-term results of the Fontan operation. Pediatr Cardio 2007; 28(6):438–42. 73. Mair DD, Puga FJ, Danielson GK. The Fontan procedure for tricuspid atresia: early and late results of a 25-year experience with 216 patients. J Am Coll Cardiol 2001; 37(3):933–9. 74. Ghanayem NS, Berger S, Tweddell JS. Medical management of the failing Fontan. Pediatr Cardiol 2007; 28(6):465–71. 75. Beitzke A, Zobel G, Zenz W, Gamillscheg A, Stein JI. Catheter-directed thrombolysis with recombinant tissue plasminogen activator for acute pulmonary embolism after fontan operation. Pediatr Cardiol 1996; 17(6):410–2. 76. Warnes CA, Somerville J. Tricuspid atresia in adolescents and adults: current state and late complications. Br Heart J 1986; 56(6):535–43. 66 77. Azakie A, McCrindle BW, van Arsdell G, Benson LN, Coles J, Hamilton R et al. Extracardiac conduit versus lateral tunnel cavopulmonary connections at a single institution: impact on outcomes. J Thorac Cardiovasc Surg 2001; 122(6):1219–28. 78. Khairy P, Fernandes SM, Mayer JE, Triedman JK, Walsh EP, Lock JE et al. Long-term survival, modes of death, and predictors of mortality in patients with Fontan surgery. Circulation 2008; 117(1):85–92. 79. d'Udekem Y, Iyengar AJ, Cochrane AD, Grigg LE, Ramsay JM, Wheaton GR et al. The Fontan procedure: contemporary techniques have improved long-term outcomes. Circulation 2007; 116(11 Suppl):I157-64. 80. Gaynor JW, Bridges ND, Cohen MI, Mahle WT, Decampli WM, Steven JM et al. Predictors of outcome after the Fontan operation: is hypoplastic left heart syndrome still a risk factor? J Thorac Cardiovasc Surg 2002; 123(2):237–45. 81. Cohen MI, Wernovsky G, Vetter VL, Wieand TS, Gaynor JW, Jacobs ML et al. Sinus node function after a systematically staged Fontan procedure. Circulation 1998; 98(19 Suppl):II352-8. 82. Fishberger SB, Wernovsky G, Gentles TL, Gauvreau K, Burnett J, Mayer JE et al. Factors that influence the development of atrial flutter after the Fontan operation. J Thorac Cardiovasc Surg 1997; 113(1):80–6. 83. Durongpisitkul K, Porter CJ, Cetta F, Offord KP, Slezak JM, Puga FJ et al. Predictors of early- and late-onset supraventricular tachyarrhythmias after Fontan operation. Circulation 1998; 98(11):1099–107. 84. Gewillig M, Wyse RK, Leval MR de, Deanfield JE. Early and late arrhythmias after the Fontan operation: predisposing factors and clinical consequences. Br Heart J 1992; 67(1):72–9. 85. Gandhi SK, Bromberg BI, Rodefeld MD, Schuessler RB, Boineau JP, Cox JL et al. Lateral tunnel suture line variation reduces atrial flutter after the modified Fontan operation. Ann Thorac Surg 1996; 61(5):1299–309. 86. Deal BJ, Mavroudis C, Backer CL. Arrhythmia management in the Fontan patient. Pediatr Cardiol 2007; 28(6):448–56. 87. Amodeo A, Galletti L, Marianeschi S, Picardo S, Giannico S, Di Renzi P et al. Extracardiac Fontan operation for complex cardiac anomalies: seven years' experience. J Thorac Cardiovasc Surg 1997; 114(6):1020-30. 88. Mertens L, Hagler DJ, Sauer U, Somerville J, Gewillig M. Protein-losing enteropathy after the Fontan operation: an international multicenter study. PLE study group. J Thorac Cardiovasc Surg 1998; 115(5):1063–73. 89. Feldt RH, Driscoll DJ, Offord KP, Cha RH, Perrault J, Schaff HV et al. Proteinlosing enteropathy after the Fontan operation. J Thorac Cardiovasc Surg 1996; 112(3):672–80. 90. Silvilairat S, Cabalka AK, Cetta F, Grogan M, Hagler DJ, O'Leary PW. Proteinlosing enteropathy after the Fontan operation: associations and predictors of clinical outcome. Congenit Heart Dis 2008; 3(4):262–8. 91. Rychik J, Gui-Yang S. Relation of mesenteric vascular resistance after Fontan operation and protein-losing enteropathy. Am J Cardiol 2002; 90(6):672–4. 67 92. Thacker D, Patel A, Dodds K, Goldberg DJ, Semeao E, Rychik J. Use of oral budesonide in the management of protein-losing enteropathy after the Fontan operation. Ann Thorac Surg 2010; 89(3):837–42. 93. Khambadkone S, Li J, Leval MR de, Cullen S, Deanfield JE, Redington AN. Basal pulmonary vascular resistance and nitric oxide responsiveness late after Fontan-type operation. Circulation 2003; 107(25):3204–8. 94. Khambadkone S. The Fontan pathway: What's down the road? Ann Pediatr Cardiol 2008; 1(2):83–92. 95. Kelly AM, Feldt RH, Driscoll DJ, Danielson GK. Use of heparin in the treatment of protein-losing enteropathy after fontan operation for complex congenital heart disease. Mayo Clin Proc 1998; 73(8):777–9. 96. Vyas H, Driscoll DJ, Cabalka AK, Cetta F, Hagler DJ. Results of transcatheter Fontan fenestration to treat protein losing enteropathy. Catheter Cardiovasc Interv 2007; 69(4):584–9. 97. McElhinney DB, Reddy VM, Hanley FL, Moore P. Systemic venous collateral channels causing desaturation after bidirectional cavopulmonary anastomosis: evaluation and management. J Am Coll Cardiol 1997; 30(3):817–24. 98. Andrews RE, Tulloh RMR, Anderson DR. Coil occlusion of systemic venous collaterals in hypoplastic left heart syndrome. Heart 2002; 88(2):167–9. 99. Weber HS. Incidence and predictors for the development of significant supradiaphragmatic decompressing venous collateral channels following creation of Fontan physiology. Cardiol Young 2001; 11(3):289–94. 100. Balling G, Vogt M, Kaemmerer H, Eicken A, Meisner H, Hess J. Intracardiac thrombus formation after the Fontan operation. J Thorac Cardiovasc Surg 2000; 119(4 Pt 1):745–52. 101. Kaulitz R, Ziemer G, Rauch R, Girisch M, Bertram H, Wessel A et al. Prophylaxis of thromboembolic complications after the Fontan operation (total cavopulmonary anastomosis). J Thorac Cardiovasc Surg 2005; 129(3):569–75. 102. Rosenthal DN, Friedman AH, Kleinman CS, Kopf GS, Rosenfeld LE, Hellenbrand WE. Thromboembolic complications after Fontan operations. Circulation 1995; 92(9 Suppl):II287-93. 103. Mahnke CB, Boyle GJ, Janosky JE, Siewers RD, Pigula FA. Anticoagulation and incidence of late cerebrovascular accidents following the Fontan procedure. Pediatr Cardiol 2005; 26(1):56–61. 104. Coon PD, Rychik J, Novello RT, Ro PS, Gaynor JW, Spray TL. Thrombus formation after the Fontan operation. Ann Thorac Surg 2001; 71(6):1990–4. 105. Lamour JM, Kanter KR, Naftel DC, Chrisant MR, Morrow WR, Clemson BS et al. The effect of age, diagnosis, and previous surgery in children and adults undergoing heart transplantation for congenital heart disease. J Am Coll Cardiol 2009; 54(2):160–5. 106. Wernovsky G, Stiles KM, Gauvreau K, Gentles TL, duPlessis AJ, Bellinger DC et al. Cognitive development after the Fontan operation. Circulation 2000; 102(8):883–9. 68 107. Mahle WT, Clancy RR, Moss EM, Gerdes M, Jobes DR, Wernovsky G. Neurodevelopmental outcome and lifestyle assessment in school-aged and adolescent children with hypoplastic left heart syndrome. Pediatrics 2000; 105(5):1082–9. 108. Goldberg CS, Schwartz EM, Brunberg JA, Mosca RS, Bove EL, Schork MA et al. Neurodevelopmental outcome of patients after the fontan operation: A comparison between children with hypoplastic left heart syndrome and other functional single ventricle lesions. J Pediatr 2000; 137(5):646–52. 109. Julsrud PR, Weigel TJ, van Son JA, Edwards WD, Mair DD, Driscoll DJ et al. Influence of ventricular morphology on outcome after the Fontan procedure. Am J Cardiol 2000; 86(3):319–23. 110. McGuirk SP, Winlaw DS, Langley SM, Stumper OF, Giovanni JV de, Wright JG et al. The impact of ventricular morphology on midterm outcome following completion total cavopulmonary connection. Eur J Cardiothorac Surg 2003; 24(1):37–46. 111. Piran S, Veldtman G, Siu S, Webb GD, Liu PP. Heart failure and ventricular dysfunction in patients with single or systemic right ventricles. Circulation 2002; 105(10):1189–94. 112. Ohuchi H, Yasuda K, Hasegawa S, Miyazaki A, Takamuro M, Yamada O et al. Influence of ventricular morphology on aerobic exercise capacity in patients after the Fontan operation. J Am Coll Cardiol 2001; 37(7):1967–74. 113. Anderson PAW, Sleeper LA, Mahony L, Colan SD, Atz AM, Breitbart RE et al. Contemporary outcomes after the Fontan procedure: a Pediatric Heart Network multicenter study. J Am Coll Cardiol 2008; 52(2):85–98. 69 6 Curriculum Vitae Persönliche Daten Nadine Zimmermann Geburtsdatum: 07.01.1985 Neusser Str. 16 a Geburtsort: Mechernich 53909 Zülpich Familienstand: ledig 0049 (0)151/27148783 [email protected] Hochschulstudium Seit Okt 2005 asdff Studium der Humanmedizin an der Medizinischen Universität Graz Jun 2006 1. Diplomprüfung Sep 2010 2. Diplomprüfung Famulaturen und Praktika Jun - Sep 2005 Kreiskrankenhaus Mechernich Pflegepraktikum Jul/Aug 2007 Krankenhaus Merheim Kardiologie (5 Wochen) Jul/Aug 2008 Universitätsklinik Köln Pulmologie (5 Wochen) Jul 2009 Universitätsklinik Köln Orthopädie (3 Wochen) Aug/Sep 2009 St. Elisabeth-Krankenhaus, Köln Gynäkologie (4 Wochen) Feb 2011 Ruppiner Kliniken, Neuruppin Kinder- und Jugendheilkunde (3 Wochen) Klinische Erfahrungen im 6. Studienjahr asdf asdf Okt 2010 Allgemeinmedizin-Praxis Dr. med. univ. Helga Grablowitz in Judendorf-Straßengel bei Graz (5 Wochen) Nov - Dez 2010 Universitätsklinik für Kinder- und Jugendheilkunde, Graz Klinische Abteilung für Pädiatrische Hämatologie und Onkologie (Ableistung der 3. Fächergruppe) 70 Dez 2010 - Mär 2011 Universitätsklinik für Kinder- und Jugendchirurgie, Graz (Ableistung der 1. Fächergruppe) Apr 2011 - Mai 2011 Klinikum Passau, Abteilung für Innere Medizin (Ableistung der 2. Fächergruppe) Weitere berufliche Erfahrungen Okt 2004 - Sep 2005 Aushilfskraft Lebenshilfe Bürvenich 2005 Beginn der Rettungssanitäterausbildung DRK (bis Studienbeginn) Schullaufbahn asdf 1991 - 1995 Katholische Grundschule Zülpich 1995 - 2004 Franken Gymnasium Zülpich Abschluss: Allgemeine Hochschulreife Fremdsprachen asdf Englisch (fließend) Französisch (Grundkenntnisse) 71 Anhang – Datenerhebungsbogen Präoperative Daten Demographische Daten Geburtsdatum Geschlecht Weiblich Männlich Morphologie Diagnose TA DILV MA HLHS DORV Andere Linker SV Rechter SV Unbestimmt System-/Pulmonalvenenanomalien Situsanomalien, Asplenie-/Polysplenie-Syndrom Aortenisthmusstenose, Subaortenstenose Ventrikelmorphologie Zusätzliche Anomalien Vorausgegangene Eingriffe Palliativeingriffe BAS Shunt PAB Einfach Bilateral PA-Patch Korrektur einer Aortenisthmusstenose Korrektur einer Subaortenstenose (DKS) KG KL SaO2 (%) Pulmonalarterieller Mitteldruck (mmHg) RPI BDGA Zusätzliche Korrektureingriffe Präoperative Parameter Hämodynamik vor Fontanoperation Sinusrhythmus Ja Nein Normal (> 50 %) Erniedrigt (< 50 %) Höhergradige Insuffizienz Keine Insuffizienz EF AV-Klappen-Funktion EDP-SV (mmHg) SaO2 (%) Pulmonalarterieller Mitteldruck (mmHg) RPI (Wood Units) PA-Stenose Nakata-Index Mc-Goon-Ration Kollateralen Zusätzliche RF Datum Alter zum Zeitpunkt der Operation KG (kg) KL (cm) Modifikation Fenestration Zusätzliche Eingriffe Ja Nein Ja Nein Ja Nein Operative Parameter TCPC Ja/Nein Ja/Nein ECFO 72 Outcome nach Fontanoperation Postoperativer Verlauf Unkompliziert Kompliziert Tod Langzeitverlauf Verstorben Re-Operation Katheterintervention Verschluss von Kol. Verschluss Fenestr. Stent Aorta Stent Pulmonalarterie Komplikationen Herzrhythmusstörungen Low-Cardiac-Output-Syndrom Protrahierte Ergüsse NDGS Nachblutung Zwerchfellparese SaO2 vor Verschluss SaO2 nach Verschluss SaO2 vor Verschluss SaO2 nach Verschluss Herzrhythmusstörungen PLE Thrombembolisches Ereignis Therapie der Kompl. Letzte HerzkatheterUntersuchung Zeit nach Operation Mitteldruck (mmHg) Tunnel VCS VCI RPA LPA EDP SV SaO2 Kollateralen Ja Nein Letzte ambulante Kontrolle Zeit nach Operation NYHA-Stadium Ability-Index nach Warnes et Somerville (76) I normales Leben; voll schul- bzw. arbeitsfähig II leicht eingeschränktes Leben durch Symptome III Arbeitsunfähigkeit; bedeutende Einschränkungen IV schwerste Einschränkungen; keine Selbstständigkeit Soziale Integration SpO2 (%) ProBNP Rhythmus SR AV-Knotenrhythmus SM EF Normal (> 50 %) Erniedrigt (< 50 %) AV-Klappen-Funktion Höhergradige Insuffizienz Keine Insuffizienz Medikamente 73