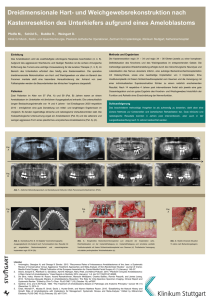
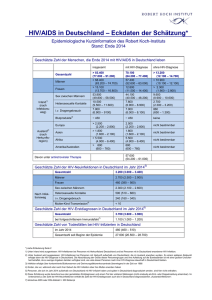
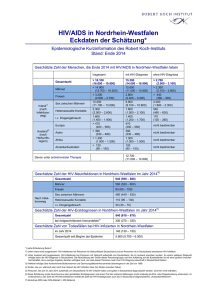
Analyse der Morbidität und Letalität sowie des Langzeitüberlebens
Werbung

Aus der Klinik für Chirurgie am Marienhospital Herne - Universitätsklinik der Ruhr-Universität Bochum Direktor: Prof. Dr. med. A. Sendler Analyse der Morbidität und Letalität sowie des Langzeitüberlebens nach Duodenohemipankreatektomie bei Adenokarzinomen des Pankreaskopfes und der periampullären Region eine unizentrische, prospektive Studie Inaugural-Dissertation zur Erlangung des Doktorgrades der Medizin einer Hohen Medizinischen Fakultät der Ruhr-Universität Bochum vorgelegt von Johannes Kormann aus Wolfratshausen 2008 Dekan: Prof. Dr. med. G. Muhr Referent: Prof. Dr. med. A. Sendler Koreferent: PD Dr.med. A. Reinacher-Schick Tag der mündlichen Prüfung: 16.06.2009 Inhaltsverzeichnis Verzeichnis der Abkürzungen………………………………………………………… 5 1. Einleitung…………………………………………………………………………… 6 2. Methodik……………………………………………………………………………. 9 2.1. Datenerhebung…………………………………………………………………… 9 2.2. Patientenkollektiv………………………………………………………………… 2.2.1. Alter……………………………………………………………………………… 2.2.2. Geschlecht……………………………………………………………………… 2.2.3.Tumorlokalisation………………………………………………………………. 2.2.4. Histologie……………………………………………………………………….. 2.2.5. TNM/G/R-Klassifikation……………………………………………………….. 10 10 11 11 11 12 2.3. Operationen………………………………………………………………………. 15 2.3.1. Art und Anzahl…………………………………………………………………. 15 2.3.2. Operateur………………………………………………………………………. 18 2.4. Somatostatin- und Octreotidtherapie………………………………………….. 20 2.5. Komplikationen…………………………………………………………………… 2.5.1. Pankreasfistel………………………………………………………………….. 2.5.2. Insuffizienz der Hepatikojejunostomie………………………………………. 2.5.3. Intraabdominale Infektion.……………………………………………………. 2.5.4. Intraabdominale Blutung.……………………………………………............. 2.5.5. Magenentleerungsstörung.…………………………………………………… 2.5.6. Pulmonale Komplikation….…………………………………………………... 21 22 24 24 25 25 26 2.6. Reoperationen………………………………………..………………………….. 26 2.7. Bluttransfusionen………………………………………………………………… 26 2.8. Verlaufsbeobachtung der Patienten…………………………………………… 27 2.9. Statistik……………………………………………………………………………. 27 3. Ergebnisse…………………………………………………………………………. 28 3.1. Postoperative Morbidität………………………………………………………… 28 3.1.1. Pankreasfistel………………………………………………………………….. 28 3 3.1.2. Insuffizienz der Hepatikojejunostomie………………………………………. 3.1.3. Intraabdominale Infektion…………………………………………………….. 3.1.4. Intraabdominale Blutung……………………………………………………… 3.1.5. Magenentleerungsstörung……………………………………………………. 3.1.6. Pulmonale Komplikation……………………………………………………… 3.1.7. Gesamtmorbidität……………………………………………………………… 29 30 31 31 32 33 3.2. Reoperationen…………………………………………………………………… 33 3.3. Bluttransfusionen……………………………………………………………….. 35 3.3.1. Erythrozytenkonzentrate……………………………………………………… 35 3.3.2. Fresh Frozen Plasma………………………………………………………… 35 3.4. Perioperative Letalität………………………………………………………….. 36 3.5. Überleben………………………………………………………………………… 3.5.1. Übersicht Gesamtüberleben…………………………………………………. 3.5.2. Alter und Geschlecht………………………………………………………….. 3.5.3. Histologische Klassifikation…………………………………………………… 3.5.4. Operationsart…………………………………………………………………… 3.5.5. Operateur………………………………………………………………………. 3.5.6. Somatostatin- und Octreotidtherapie……………………………………….. 3.5.7. Komplikationen………………………………………………………………… 3.5.8. Reoperationen…………………………………………………………………. 3.5.9. Transfusionen………………………………………………………………….. 3.5.10. Regressionsanalyse der Einflussfaktoren………………………….……… 37 37 38 38 44 45 45 45 47 47 50 4. Diskussion………………………………………………………………………… 52 4.1. Postoperative Morbidität……………………………………………………….. 52 4.2. Perioperative Letalität………………………………………………………….. 62 4.3. Langzeitüberleben……………………………………………………………… 64 5. Zusammenfassung……………………………………………………………… 69 6. Literaturverzeichnis…………………………………………………………….. 71 7. Anhang…………………………………………………………………………….. 81 4 Verzeichnis der Abkürzungen Die folgenden Abkürzungen (in alphabetischer Reihenfolge) werden im Text verwendet: Abb. = Abbildung EK = Erythrozytenkonzentrat FFP = Fresh Frozen Plasma HJS = Hepatikojejunostomie IAB = Intraabdominale Blutung IAI = Intraabdominale Infektion IHJS = Insuffizienz der Hepatikojejunostomie LZÜ = Langzeitüberleben(de) MES = Magenentleerungsstörung OP = Operation PBV = Pankreasblindverschluß PPPD = Pyloruserhaltende Pankreatoduodenektomie (engl.: „pylorus preserving pancreatoduodenectomy“) PF = Pankreasfistel PK = Pulmonale Komplikation RR = Relatives Risiko Tab. = Tabelle ÜLZ = Überlebenszeit WOP = (klassische) Whipple´sche Operation (Duodenohemipankreatektomie mit distaler Magenresektion) 5 1. Einleitung Die partielle Duodenohemipankreatektomie (auch: Pankreatoduodenektomie) oder „Whipple´sche Operation“ stellt nach wie vor eine große technische Herausforderung in der Viszeralchirurgie dar. Sie verlangt einerseits wegen der Lage des Pankreas im Retroperitoneum mit seinen komplexen Nachbarschaftsbeziehungen genaue anatomische und (patho-)physiologische Kenntnisse bei der operativen Präparation und Resektion, andererseits aber auch ein hohes Maß an Sorgfalt und Erfahrung des Operateurs bei der Rekonstruktion. Das Pankreas birgt per se als Produzent aggressiver Verdauungsenzyme ein besonders hohes Komplikationspotenzial. In engem Zusammenhang mit den beträchtlichen Operationsrisiken steht auch die immer noch relativ hohe Operationsletalität. Zudem sind beim Pankreaskarzinom die Langzeitergebnisse nach Resektion nach wie vor enttäuschend. Dennoch bietet die chirurgische Entfernung bei Malignomen des Pankreas derzeit die einzige Möglichkeit einer Prognoseverbesserung und in einzelnen Fällen auch einer Heilung. Die Indikation zur Whipple´schen Operation oder ihrer pyloruserhaltenden Rekonstruktionsform nach Traverso-Longmire ist sowohl bei benignen als auch bei malignen Erkrankungen im Pankreaskopfbereich gegeben. Bei den gutartigen Erkrankungen steht die chronisch-rezidivierende Pankreatitis mit den durch sie verursachten strukturellen Veränderungen im Vordergrund. Bei starken anhaltenden oder wiederkehrenden Schmerzzuständen, Verschlussikterus oder Magenausgangsstenose ebenso wie bei rezidivierenden Pseudozystenbildungen als Folge entzündlicher Veränderungen und deren Komplikationen kann die chirurgische Therapie in Form der partiellen Pankreatoduodenektomie eine dauerhafte Therapie darstellen. Eine andere Therapieform ist die duodenumerhaltende Pankreaskopfresektion (Operation nach Beger). Neben der chronischen Pankreatitis kann auch bei Adenomen oder gutartigen endokrinen Tumoren bei entsprechender Symptomatik eine Pankreaskopfresektion notwendig sein. Oft ist trotz ausgedehnter präoperativer Diagnostik die Dignität nicht eindeutig, so dass schließlich nur die operative Exploration zur Klärung bleibt. 6 Unter den Malignomen rangiert an erster Stelle das duktale Adenokarzinom des Pankreas. Daneben gibt es (abgesehen von seltenen anderen malignen Tumoren dieser Region) insbesondere die periampullären Tumore, die vom distalen Ductus choledochus, der Papilla Vateri oder dem Duodenum ausgehen. In seltenen Fällen kann eine Whipple´sche Operation auch bei Tumoren des angrenzenden Magens, Kolons oder der Gallenblase indiziert sein. Die Symptomatik von Tumoren im Pankreaskopfbereich, die zur Diagnostik und letztendlich zur Operationsindikation führt, kann je nach Lokalisation unterschiedlich sein. Oft werden unspezifische Oberbauchbeschwerden angegeben. Ein typisches klinisches Zeichen ist, insbesondere bei malignen Erkrankungen, der schmerzlose Ikterus. Rückenschmerzen können auf einen bereits fortgeschrittenen, retroperitoneal die Mesenterialwurzel ummauernden bzw. metastasierten Tumor hinweisen. Langfristiges Ziel der Operation ist bei den malignen Pankreastumoren wie bei allen soliden Malignomen die onkologisch vollständige Entfernung. Mit der Durchführung der ersten Pankreaskopfresektionen zeigten sich jedoch auch die schwierige Problematik der Operationstechnik und der postoperativen Komplikationen und mit zunehmender Anwendung der Operation bei Malignomen außerdem die ernüchternden Langzeitergebnisse. Bei der Operation selbst wie bei der Behandlung der Komplikationen konnten durch Fortschritte im Bereich der chirurgischen Technik und Materialien, der Intensivmedizin und auch der medikamentösen Versorgung die Morbiditäts- und Letalitätsraten deutlich gesenkt werden. Dennoch ist die Operation auch heute noch mit erheblichen, mitunter lebensbedrohlichen Risiken verbunden. Daher hat die präoperative Einschätzung der für eine solche Operation geeigneten Patienten, insbesondere auch hinsichtlich der Prognose, in der letzten Zeit zunehmend an Bedeutung gewonnen. In dieser Arbeit sollen Morbidität und Letalität im postoperativen Verlauf bei der Whipple´schen Operation bzw. pyloruserhaltenden Pankreatoduodenektomie analysiert werden. Untersucht wurden Alter und Geschlecht der Patienten, Tumorlokalisation und -histologie, die TNM-Kategorie, das Grading und Resektionsergebnis, die Operationsart, die „Erfahrung des Operateurs“ und die Therapie mit Somatostatin bzw. dem Analogon Octreotid. Dargestellt werden Art und Häufigkeit der 7 Komplikationen sowie Reoperationen und die Häufigkeit der Transfusion von Blutpräparaten. Im Zusammenhang damit wird auf die postoperative Letalität (Krankenhausletalität) und insbesondere das Langzeitüberleben der Patienten eingegangen. Von Interesse war zudem die Frage, ob oder inwieweit die oben genannten Faktoren und die Morbidität Einfluss auf die Langzeitprognose hatten. Zugunsten eines möglichst einheitlichen Kollektivs wurden nur Patienten mit malignen Tumoren des Pankreaskopfbereichs ausgewählt. Die Auswahlkriterien sind im Methodikteil definiert. Die Operationen der betrachteten Patienten erfolgten zwischen Februar 1983 und Oktober 1997 in der Chirurgischen Klinik des Klinikums rechts der Isar der Technischen Universität München. Die Daten der Patienten wurden prospektiv in einer Datenbank erfasst, die Überlebenszeiten zuletzt 2006 erhoben. 8 2. Methodik 2.1. Datenerhebung Die Daten der Patienten wurden einer prospektiv geführten Datenbank entnommen. Zur Datenerhebung dienten die Patientenakten der zwischen Februar 1983 und Oktober 1997 nach Whipple oder der Modifikation nach Traverso-Longmire in der Chirurgischen Klinik des Klinikums rechts der Isar der Technischen Universität München operierten Patienten. In diesem Zeitraum wurden 345 solcher Operationen durchgeführt und klinikintern prospektiv dokumentiert. Folgende Angaben bzw. Daten wurden erfasst und analysiert: - OP-Datum - Alter bei OP - Geschlecht - Tumorlokalisation - Tumorhistologie mit TNM-Kategorie/ R-Klassifikation und Grading - Auftreten einer Pankreasfistel - Auftreten einer Insuffizienz der Hepatikojejunostomie - Postoperative intraabdominale Infektion - Postoperative intraabdominale Blutung - Magenentleerungsstörung - Pulmonale Komplikation - Reoperation - Zahl der perioperativen Transfusionen (Erythrozytenkonzentrate und Fresh Frozen Plasma während und nach der OP) - Art der OP (WOP oder PPPD) - Operateur - Somatostatin- oder Octreotidtherapie - Überlebenszeit ab dem Zeitpunkt der OP In die Untersuchung gingen die Daten von 212 der 345 Patienten ein. 91 der 345 Patienten wurden wegen benignem histologischen Befund oder fehlender oder 9 nicht vollständiger Verfügbarkeit der Daten von der Untersuchung ausgeschlossen. Um zwischen den verbleibenden 254 Patienten mit malignem histologischen Befund eine Vereinheitlichung und damit eine bessere Vergleichbarkeit zu erreichen, wurde nochmals bezüglich Lokalisation, Entstehungsort und Histologie des Tumors unterschieden. So wurden nur Patienten mit einer Tumorlokalisation im Pankreaskopfbereich einbezogen, wobei dazu Primärtumoren des Pankreaskopfes (Parenchymbereich/ duktales Pankreaskarzinom), der Papilla Vateri oder des distalen Ductus choledochus gezählt wurden und die Tumorlokalisation dem Entstehungsort des Tumors in dem jeweiligen Bereich entsprach. Patienten mit Tumoreinbrüchen anderer Malignome (z.B. des Magens oder Kolons) oder Metastasen im Pankreaskopfbereich wurden ausgeschlossen. Von histologischer Seite wurden nur Adenokarzinome bzw. muzinöse Adenokarzinome einbezogen. Seltenere histologische Formen wie Zystadenokarzinome, Siegelringzellkarzinome, Azinuszellkarzinome oder maligne endokrine Pankreastumore wurden ausgeschlossen. Nach diesen Kriterien ergab sich das Kollektiv von 212 Patienten, welches nachfolgend genauer charakterisiert wird. 2.2. Patientenkollektiv 2.2.1. Alter Das mittlere Alter der Patienten zum Operationszeitpunkt lag bei 60,7 Jahren, der Median bei 61,5. Der jüngste Patient war 25 Jahre, der älteste 83 Jahre alt. Die Altersspanne betrug somit 58 Jahre. Der Altersgipfel lag zwischen dem 50. und 69. Lebensjahr (66,1% der Patienten, siehe Tab. 2.2.1.1.). 10 Tab. 2.2.1.1.: Altersverteilung der Patienten zum OP-Zeitpunkt Alter der Patienten Anzahl / n Prozent / % (Lebensjahrzehnt) 20 - 29 Jahre 3 1,4 30 - 39 2 0,9 40 - 49 24 11,3 50 - 59 61 28,8 60 - 69 79 37,3 70 - 79 42 19,8 80 - 89 1 0,5 212 100,0 Gesamt 2.2.2. Geschlecht Von den 212 Patienten waren 59,4 % (n=126) männlichen und 40,6 % (n=86) weiblichen Geschlechts. Dies entspricht einem Verhältnis m:w von etwa 3:2. 2.2.3. Tumorlokalisation Entstehungsort der Tumore waren in 101 Fällen (47,6%) der Pankreaskopf (Parenchym des Pankreaskopfes), in 65 Fällen (30,7%) der distale Ductus choledochus und in 46 Fällen (21,7%) die Papilla Vateri, d.h. 53,3% der Patienten hatten periampulläre Tumore. 2.2.4. Histologie Bei der pathohistologischen Untersuchung der 212 Operationspräparate fanden sich 163 (76,9%) duktale, d.h. vom Gangepithel ausgehende Adenokarzinome und (als Sonderform davon) 49 (23,1%) muzinöse Adenokarzinome. 11 2.2.5. TNM-/ R-Klassifikation und Grading Mit der TNM-Klassifikation werden die malignen Tumore eines Organs international einheitlich histopathologisch eingeteilt. Dabei bezieht sich „T“ (von „Tumor“) auf die Ausdehnung des Primärtumors, „N“ (von „Nodi“) auf den Befall regionaler Lymphknoten und „M“ (von „Metastasen“) auf das Vorhandensein von Fernmetastasen. In der vorliegenden Arbeit wurde die bei Abschluss der Datenerhebung aktuelle TNM-Klassifikation von 1997 [37] zitiert (siehe Tab. 2.2.5.1. - 2.2.5.3.). Für alle Karzinome gilt: Tx: Primärtumor kann nicht beurteilt werden T0: kein Anhalt für Primärtumor Tis: Carcinoma in situ Nx: regionale Lymphknoten können nicht beurteilt werden N0: keine regionalen Lymphknotenmetastasen Mx: Fernmetastasen können nicht beurteilt werden M0: keine Fernmetastasen Tab. 2.2.5.1.: Einteilung des Pankreaskarzinoms (UICC 1997): T1 Tumor auf das Pankreas beschränkt, 2 cm oder weniger in der größten Ausdehnung T2 Tumor auf das Pankreas beschränkt, mehr als 2 cm in der größten Ausdehnung T3 Tumor infiltriert direkt Duodenum, Gallengang oder peripankreatisches Gewebe T4 Tumor infiltriert direkt Magen, Milz, Kolon oder anliegende große Gefäße N1 regionale Lymphknotenmetastasen N1a: Metastase in singulärem regionalen Lymphknoten N1b: Metastasen in multiplen regionären Lymphknoten M1 Fernmetastasen Anmerkung: Peripankreatisches Gewebe beinhaltet retroperitoneales Weichgewebe bzw. Fett, einschließlich Mesenterium, Mesocolon, Omentum majus et minus und Peritoneum. Direkte Infiltration von Gallengängen und Duodenum beinhaltet auch die Ampulla Vateri. Anliegende große Gefäße sind die Vena portae, der Truncus coeliacus sowie die Arteria mesenterica superior und Arteria hepatica communis (nicht die Milzgefäße). 12 Tab. 2.2.5.2.: Einteilung des Karzinoms der Ampulla Vateri (UICC 1997): T1 Tumor auf Ampulla Vateri oder Sphincter Oddi beschränkt T2 Tumor infiltriert Duodenalwand T3 Tumor infiltriert 2 cm oder weniger in das Pankreas T4 Tumor infiltriert mehr als 2 cm in das Pankreas und/ oder anliegende Organe N1 regionale Lymphknotenmetastasen (im Bereich des Pankreaskopfs) M1 Fernmetastasen (einschließlich Milzlymphknoten und Lymphknoten entlang des Pankreasschwanzes) Tab. 2.2.5.3.: Einteilung des Karzinoms des Ductus choledochus bzw. der extrahepatischen Gallenwege (UICC 1997): T1 Tumor infiltriert subepitheliales Bindegewebe oder fibromuskuläre Schicht T1a: Tumor infiltriert subepitheliales Bindegewebe T1b: Tumor infiltriert fibromuskuläre Schicht T2 Tumor infiltriert perifibromuskuläres Bindegewebe T3 Tumor infiltriert anliegende Strukturen: Pankreas, Duodenum, Gallenblase, Colon, Magen N1 Metastasen im Ductus cysticus, pericholedocheal, und/ oder Hiluslymphknoten (z.B. im Ligamentum hepatoduodenale) N2 Metastasen in peripankreatischen (nur Kopf), periduodenalen, coeliacalen, superior mesentericalen und/ oder posterior peripancreatoduodenalen Lymphknoten M1 Fernmetastasen Maligne Tumore werden auch nach dem Differenzierungsgrad ihrer Tumorzellen beurteilt. Diese Einteilung wird mit dem englischen Ausdruck „Grading“, abgekürzt „G“, beschrieben. Vier Stufen der Differenzierung eines Tumors werden üblicherweise unterschieden: G1: gut differenziert G2: mäßig (=mittelgradig) differenziert G3: schlecht differenziert G4: nicht differenziert (=anaplastisch) 13 Für die Prognose eines wegen eines bösartigen Tumors operierten Patienten ist außerdem von Interesse, wie vollständig der Tumor entfernt werden konnte. „R“ steht für „Residualtumor“. R0: mikroskopisch tumorfreie Resektionsränder des Operationspräparates (Resektion im Gesunden) R1: mikroskopisch Tumor bis zum Abtragungsrand des Operationspräparates reichend (Resektion nicht im Gesunden) R2: makroskopisch Tumor am Abtragungsrand (Resektion nicht im Gesunden) Bei den 212 Histologien bestand folgende Verteilung im TNM/R-System (siehe Tab. 2.2.5.4.): Tab. 2.2.5.4.: Verteilung der Histologien nach TNM-System, R-Klassifikation und Grading T-Stadium Anzahl / n Prozent / % T1 26 12,3 T2 114 53,8 T3 69 32,9 T4 3 1,4 Gesamt 212 100,0 N-Stadium Anzahl / n Prozent / % N0 99 46,7 N1 113 53,3 N2 0 0,0 Gesamt 212 100,0 M-Stadium Anzahl / n Prozent / % M0 208 98,1 M1 4 1,9 212 100,0 Gesamt 14 G / Grading Anzahl / n Prozent / % G1 37 17,4 G2 96 45,3 G3 79 37,3 Gesamt 212 100,0 R / Residualtumor Anzahl / n Prozent / % R0 147 69,3 R1 52 24,5 R2 13 6,1 212 100,0 Gesamt 2.3. Operationen 2.3.1. Art und Anzahl Bei dem als „klassische“ Whipple´sche Operation bezeichneten Eingriff werden nach heutigen Standards folgende Strukturen entfernt: - Pankreaskopf - Duodenum - distaler Hauptgallengang - Gallenblase - distaler Magen - regionale Lymphknoten. Die Rekonstruktion erfolgt mit ein oder zwei Jejunumschlingen, an die das Restpankreas (Pankreatojejunostomie), der proximale Gallengang (Hepatikojejunostomie) sowie der Restmagen (Gastrojejunostomie) angeschlossen werden. Die Anastomose des Magens mit dem Jejunum kann durch eine nach Roux ausgeschaltete Schlinge erfolgen (Roux-Y Rekonstruktion). Bereits 1909 beschrieb W. Kausch ein zweizeitiges Verfahren zur Entfernung von Papillenkarzinomen bzw. Tumoren im Pankreaskopfbereich [42]. A.O. Whipple führte bei seinem erstmals 1935 veröffentlichten Verfahren zunächst ebenfalls 15 noch ein zweizeitiges Verfahren mit anderer operativer Rekonstruktion und erst später die einzeitige Operation („one stage procedure“) durch [87, 88]. Insbesondere mit seinem Namen wird die Operation heute weltweit verbunden. Inzwischen existieren zahlreiche technische Varianten zur Wiederherstellung der Passage. Wichtig ist in diesem Zusammenhang die Erwähnung der Pylorus erhaltenden Pankreatoduodenektomie (engl.: „pylorus preserving pancreatoduodenectomy“, PPPD), die im Jahr 1978 (erstmalig wieder) von Traverso und Longmire beschrieben wurde [79]. Diese Rekonstruktion soll eine physiologischere Nahrungspassage ermöglichen. Die Abbildung 2.3.1.1. verdeutlicht eine typische, mögliche Rekonstruktion nach Pylorus erhaltender Resektion. 16 Abb. 2.3.1.1.: Resektionsausmaß (A) und Rekonstruktion (B) bei PPPD: hier Pankreatojejunostomie end-zu-end, Hepatikojejunostomie und postpylorische Duodenojejunostomie in eine Darmschlinge; aus [64] Bei den untersuchten Patienten erfolgte entweder die (klassische) partielle Pankreatoduodenektomie nach Whipple (WOP) mit distaler Magenresektion (Rekonstruktion nach Child) oder die Rekonstruktion mit Erhalt des Pylorus nach Traverso-Longmire. Die Tabelle 2.3.1.1. gibt die Anzahl der durchgeführten WOP und PPPD pro Jahr bei den 212 betrachteten Patienten an: 17 Tab. 2.3.1.1.: Anzahl und Verteilung der Operationsarten im Betrachtungszeitraum OP-Jahr Anzahl WOP Anzahl PPPD 2 - 12 / 1983 6 0 1 - 12 / 1984 6 0 1 - 12 / 1985 9 1 1 - 12 / 1986 10 0 1 - 12 / 1987 8 4 1 - 12 / 1988 5 17 1 - 12 / 1989 5 8 1 - 12 / 1990 7 12 1 - 12 / 1991 10 5 1 - 12 / 1992 18 0 1 - 12 / 1993 14 3 1 - 12 / 1994 9 2 1 - 12 / 1995 13 2 1 - 12 / 1996 15 8 1 - 10 / 1997 11 4 146 66 Gesamt 2.3.2. Operateur Die Eingriffe wurden von insgesamt 14 Operateuren vorgenommen. In Tab. 2.3.2.1. sind die Operateure mit Zahlen von 1 bis 14 kodiert. Weiterhin ist die Anzahl der Operationen angegeben, die jeder einzelne Operateur in dem Betrachtungszeitraum durchführte (Anzahl OP) und wie viele dies vom Gesamtvolumen der Operationen waren (Prozent OP). Zu jedem Operateur ist auch die Zeitspanne in Jahren aufgeführt, in der die von ihm durchgeführten Operationen stattfanden (Zeitraum (J)) und wie viele Eingriffe es durchschnittlich pro Jahr bei dem jeweiligen Operateur waren (OP/ Jahr). 18 Tab. 2.3.2.1.: Verteilung der Operationen / Operateur im Betrachtungszeitraum Operateur Anzahl OP Prozent OP Zeitraum (J) OP / Jahr 1 55 25,9 15 3,7 2 33 15,5 11 3,0 8 28 13,2 4 7,0 4 25 11,7 4 6,3 5 20 9,4 9 2,2 6 11 5,2 6 1,8 3 10 4,7 5 2,0 7 6 2,8 5 1,2 11 6 2,8 2 3,0 10 6 2,8 3 2,0 14 5 2,4 1 5,0 12 4 1,8 2 2,0 9 2 0.9 3 0,7 13 1 0,9 2 0,5 212 100,0 15 14,1 Gesamt Folgende Faktoren für eine Unterscheidung bzgl. der Erfahrung des Operateurs wurden herangezogen: - Gesamtzahl der WOP/PPPD eines Operateurs im Betrachtungszeitraum, - Anzahl der Jahre im Betrachtungszeitraum, in denen ein Operateur diese Operationen durchführte, - Anzahl der Operationen eines Operateurs/ Jahr in dem Zeitraum, in denen er sie durchführte. Die Gruppe der Operateure mit „mehr Erfahrung“ wurde definiert durch - entweder mindestens 25 Duodenopankreatektomien/ Operateur im Betrachtungszeitraum - und/ oder Durchführung der WOP über mindestens fünf Jahre innerhalb des Betrachtungszeitraumes - und/ oder mindestens fünf Operationen dieser Art pro Jahr. Mindestens zwei der drei vorgenannten Kriterien sollten dabei von einem „erfahrenen“ Operateur erfüllt werden. Darunter fielen die Operateure mit den Nummern 1, 19 2, 4 und 8. Die Operateure mit den Nummern 3, 5, 6, 7 und 9 bis 14 wurden zu der Gruppe mit „weniger Erfahrung“ gerechnet. 2.4. Somatostatin- und Octreotidtherapie Somatostatin ist ein Tetradecapeptidhormon mit einer kurzen Halbwertzeit von zwei bis drei Minuten und sowohl parakriner als auch direkter Wirkung an der intestinalen Mukosa. Am Pankreas inhibiert es die Sekretion durch Senkung der Permeabilität von Calciumionen an Azinuszellen. Dadurch verringert es die Menge an ausgeschütteten Enzymen und Bicarbonaten, also die exokrine Aktivität der Bauchspeicheldrüse [19, 28]. Da dies bei Bestehen einer Pankreasfistel als wichtige Voraussetzung für eine Ausheilung angesehen wird, erfolgt seit längerem die Anwendung von Somatostatin bei postoperativ aufgetretenen Pankreasfisteln bzw. wird Somatostatin perioperativ zur Vorbeugung einer Pankreasfistel ab dem Operationstag gegeben. Aufgrund der sehr kurzen Halbwertzeit von Somatostatin muß die Substanz allerdings kontinuierlich intravenös verabreicht werden, um einen ausreichend hohen Wirkstoffspiegel zu erreichen. Octreotid, ein Somatostatinanalogon, ist in seiner Wirkung dem Somatostatin vergleichbar, führt also ebenso zu der gewünschten Unterdrückung der Bauchspeicheldrüsensekretion. Es bietet jedoch den Vorteil, daß es wegen seiner langen Halbwertzeit von etwa 120 Minuten durch subkutane Injektion (z.B. alle 4-8 Stunden) einfacher zu applizieren ist [12, 49]. Tab. 2.4.1. gibt die Häufigkeit der propylaktischen Anwendungen von Somatostatin oder Octreotid in der perioperativen Phase bei den 212 Patienten innerhalb des Betrachtungszeitraumes an. 20 Tab. 2.4.1.: Frequenz der Somatostatin-/ Octreotidprophylaxe im Betrachtungszeitraum OP-Jahr Prophylaxe mit Soma- Keine Prophylaxe Gesamt tostatin oder Octreotid (Anzahl) (Anzahl) (Anzahl) 1983 0 6 6 1984 0 6 6 1985 0 10 10 1986 3 7 10 1987 1 11 12 1988 0 22 22 1989 6 7 13 1990 11 8 19 1991 5 10 15 1992 3 15 18 1993 5 12 17 1994 3 8 11 1995 13 2 15 1996 23 0 23 1997 15 0 15 Gesamt n / % 88 / 41,5 124 / 58,5 212 / 100,0 Bei knapp 58,5% der Patienten (n=124) wurde keine prophylaktische Therapie mit Somatostatin oder Octreotid durchgeführt. Die übrigen 88 Patienten (41,5%) erhielten Somatostatin oder Octreotid im Sinne einer Fistelprophylaxe ab dem Operationstag. 2.5. Komplikationen Betrachtet wurden folgende chirurgische bzw. eingriffsspezifische Komplikationen: - Pankreasfistel (Insuffizienz der Pankreat(ik)ojejunostomie) - Insuffizienz der Hepatikojejunostomie - Intraabdominale Infektion 21 - Intraabdominale Blutung - Magenentleerungsstörung Außerdem wurde die Rolle von pulmonalen Komplikationen als nicht eingriffsspezifische postoperative Komplikation untersucht. Dagegen wurden die folgenden Komplikationen wegen ihres bei den untersuchten Patienten fehlenden oder insgesamt sehr seltenen Auftretens (außer bei der Gesamtmorbidität) nicht weiter in die statistische Auswertung bezüglich eines allgemein signifikanten Einflusses auf den postoperativen Verlauf miteinbezogen: - Insuffizienz der Gastrojejunostomie (0%) - Postoperativer Ileus (0%) - Isolierte kardiale Dekompensation / Myokardinfarkt (0%) - Dialysepflichtige Niereninsuffizienz (0%) - Beinvenenthrombose (0,47% bzw. 1 / 212 Patienten) - Intrazerebrale Blutung (0,47% bzw. 1 / 212 Patienten) - Leberausfallkoma bei Sepsis (0,94% bzw. 2 / 212 Patienten) Nicht berücksichtigt bei der Auswertung der postoperativen Morbidität wurden außerdem nosokomiale Harnwegsinfekte. 2.5.1. Pankreasfistel Prinzipiell handelt es sich bei einer Pankreasfistel (PF) nach einer resezierenden Operation um die nicht gewollte Verbindung eines Teils des Pankreas mit der freien Bauchhöhle, verbunden mit dem Austritt von Pankreassekret. Für die betrachteten Operationen bedeutet dies in der Regel eine Anastomoseninsuffizienz bzw. Leckage zwischen Pankreasrest und abführender Jejunumschlinge, so dass das Pankreassekret nicht vollständig in den Darm, sondern teilweise in die Peritonealhöhle gelangt. Bei einer Fistel des blind verschlossenem Pankreasrestes ist die Naht des Restpankreas an der Absetzungsstelle bzw. der geblockte Pankreasgang undicht. 22 Selten auftretende Formen von PF sind Verbindungen zur Hautoberfläche, zum Beispiel nach Entfernung einer lange Zeit gelegenen Drainage, oder Verbindungen zu einer angrenzenden Organstruktur wie Magen oder Darm. Zur Diagnostik einer Insuffizienz kommen verschiedene Methoden zur Anwendung. Im Sinne eines Screening können aus dem Sekret der an der Anastomose gelegenen Abdominaldrainage die Höhe der Amylase- oder Lipasewerte einen Hinweis auf eine Fistel geben. Dabei gibt es sowohl, was den Zeitpunkt der Bestimmung, als auch, was die Menge des Sekrets und die Höhe des jeweiligen Enzymwertes betrifft, in der Literatur verschiedene Angaben bzw. Definitionen. Auch Aussehen und Geruch des Drainagesekretes können hinweisend auf eine PF sein. Eine andere Methode ist die radiologische Darstellung der Anastomose durch Kontrastmittelgabe (z.B. über eine im Ductus hepaticus liegende Drainage). Zudem kann bei einer Reoperation auch makroskopisch die Diagnose einer PF gestellt werden. Büchler et al. beschrieben als laborchemisches Zeichen einer PF eine Konzentration von Amylase oder Lipase im Drainagesekret, welche die Serumkonzentration an mehr als drei postoperativen Tagen mindestens um das Dreifache überstieg, bei einem gleichzeitigen Sekretvolumen von mindestens 10 ml pro Tag. Gemessen wurden die jeweiligen Werte an den postoperativen Tagen 1,3,4,5 und 7 und danach zweimal pro Woche [21]. Miedema et al. rechneten mit einem „Anastomosenleck“ der Pankreatikojejunostomie, wenn aus der Flüssigkeit der peripankreatischen Drainagen ein Amylasegehalt von mindestens dem Fünfachen des Serumnormalwertes zu bestimmen oder eine Leckage röntgenologisch zu sichern war [56]. Die gleiche Definition verwendeten Cullen et al. [29]. In der vorliegenden Untersuchung zählte als postoperative PF bzw. Insuffizienz der Pankreatojejunostomie, wenn ab dem fünften postoperativen Tag die Amylaseoder Lipasekonzentration in der Drainage mindestens einmal mindestens das Fünffache der Plasmakonzentration bei mindestens 10 ml Sekret in der Drainage/ Tag betrug oder eine Insuffizienz der Pankreatojejunostomie oder des Pankreasblindverschlusses im postoperativen Verlauf radiologisch oder durch Reoperation nachgewiesen wurde. 23 2.5.2. Insuffizienz der Hepatikojejunostomie Bei der Whipple´schen OP (wie auch bei der PPPD) wird der distale Anteil des Ductus hepaticus bzw. choledochus entfernt. Eine Hepatikojejunostomie (HJS) ist die Anastomose des nach Resektion verbleibenden proximalen Hauptgallengangsstumpfes mit dem Jejunum in End-zu-Seit-Technik (sog. biliodigestive Anastomose). Wird diese Verbindung undicht und tritt Galleflüssigkeit in die freie Bauchhöhle aus, so steigt das Risiko einer intraabdominalen Infektion (gallige Peritonitis). Eine Insuffizienz der biliodigestiven Anastomose kann durch gallehaltiges Drainagesekret, radiologisch durch eine Kontrastmitteldarstellung, eventuell endoskopisch oder auch direkt bei einer Revisionsoperation festgestellt werden. 2.5.3. Intraabdominale Infektion Unter intraabdominaler Infektion wurden in der Untersuchung alle Formen von durch Bakterien (oder selten auch Pilze) verursachten postoperativen Infektionen des Bauchraumes zusammengefasst. Darunter fielen sowohl lokale infizierte Flüssigkeitsansammlungen, also Flüssigkeitsverhalte, z.B. bei Anastomoseninsuffizienzen, infizierte Hämatome oder Abszessbildungen, aber auch alle Formen einer postoperativen Peritonitis. In erster Linie führen klinische Parameter wie Fieber, Bauchschmerzen oder Allgemeinzustandsverschlechterung und laborchemische Parameter (Anstieg der Entzündungswerte) oder auffällige Befunde in bildgebenden Untersuchungen zur Diagnose. Abnorme Flüssigkeitsansammlungen können z.B. durch Sonographie oder Computertomographie lokalisiert werden. Infektionen können zumeist nach Materialgewinnung durch Punktion oder intraoperativen Abstrich mikrobiologisch gesichert werden. 24 2.5.4. Intraabdominale Blutung Eine postoperative intraabdominale Blutung kann durch eine primär nicht ausreichend Blutstillung des Wundgebietes entstehen, aber auch als Arrosionsblutung bei Entzündungsvorgängen. Hierbei können intraabdominale Flüssigkeitsansammlungen durch Fisteln nach Whipple´scher OP in besonderem Maße eine Blutung provozieren, wenn sie Pankreas- und/oder Galleflüssigkeit enthalten, da diese durch ihre chemische Zusammensetzung arrosiv wirken. Die typischen Blutungshinweise sind Kreislaufdepression und Hb-Abfall oder auch sichtbare blutige Sekretion über Ablaufdrainagen. Je nach Blutungsquelle (-lokalisation), -quantität und Zustand des Patienten können Blutungen durch Erythrozytensubstitution (und ggf. Plasma-/Thrombozytensubstitution), endoskopische Blutstillung, interventionelle Radiologie (Stent, coiling) oder chirurgische Revision behandelt werden, wobei die akute Blutstillung selbstverständlich prinzipiell vorrangig ist. In der eigenen Arbeit wurde als postoperative Blutung gewertet, wenn entweder eine notfallmäßige Reoperation wegen (akuter) Nachblutung erfolgte oder während des stationären Krankenhausaufenthalts ein perioperatives Transfusionsvolumen von mindestens zehn Einheiten von Erythrozytenkonzentraten gegeben wurde. 2.5.5. Magenentleerungsstörung Die Magenentleerungsstörung (MES) ist eine häufig beobachtete und beschriebene Komplikation nach Whipple´scher OP oder PPPD. Klinisch äußert sie sich durch Appetitlosigkeit und Völlegefühl, Übelkeit oder Erbrechen. Unterschiedliche Faktoren werden als Ursachen diskutiert. Sie sind letztlich nicht vollständig geklärt. Als Maß für das Vorhandensein einer MES wird üblicherweise die andauernde Notwendigkeit einer Magensonde zur Sekretableitung bei rezidivierendem Erbrechen nach einer bestimmten Zeit genommen. Van Berge Henegouwen et al. definierten als MES, wenn eine nasogastrale Sonde für 10 oder mehr Tage notwendig war oder sich der reguläre Kostaufbau bis über den 14. postoperativen Tag hinaus verzögerte [82]. 25 In der vorliegenden Arbeit wurde von einer postoperativen MES ausgegangen, wenn die Magensonde entweder über den 10. postoperativen Tag hinaus liegen blieb oder nach geplanter Entfernung erneut gelegt werden musste und sich damit der Kostaubau entsprechend verlängerte. 2.5.6. Pulmonale Komplikationen Von den als „allgemeine“ oder „nicht chirurgisch“ zu bezeichnenden Komplikationen traten pulmonale Komplikationen am häufigsten auf. Diese wurden deshalb bezüglich der sie möglicherweise mit bedingenden Einflussfaktoren bzw. ihrer Auswirkungen auf Morbidität und Letalität bei ihrem Auftreten untersucht. Unter pulmonale Komplikationen fielen respiratorische Insuffizienzen, Pneumonien, punktionspflichtige Pleuraergüsse, Pleuraempyeme und Lungenembolien. 2.6. Reoperationen Eine Reoperation erfolgte vor allem bei größeren Nachblutungen, bei konservativ nicht beherrschbaren intraabdominalen Infektionen oder bei Auftreten konservativ nicht therapierbarer Anastomoseninsuffizienzen. Ziele einer Reoperation waren demnach meist Blutstillung, Infektionsbehandlung und Revision/ Drainage oder Neuanlage einer Anastomose zur Fisteltherapie. Auch größere Nachresektionen (z.B. Restpankreatektomie) wurden in Einzelfällen notwendig. 2.7. Bluttransfusionen Die während und nach der Operation gegebenen Erythrozytenkonzentrate (EK) und Fresh-Frozen-Plasma-Einheiten (FFP) wurden in der Untersuchung als perioperative Transfusionen definiert. Dabei wurde bei der EK-Gabe der Median von 5 26 und bei der FFP-Gabe der Median von 6 Transfusionseinheiten als „cut off“ für die Aufteilung in jeweils zwei Gruppen gewählt. 2.8. Verlaufsbeobachtung der Patienten Im Rahmen des „follow up“ wurden bis März 2006 telefonische Konsultationen der nachbetreuenden Hausärzte oder der Patienten selbst durchgeführt, in der nach dem Überleben und nach Tumorrezidiven gefragt wurde. Patienten, zu denen keine aktuellen Daten mehr eruiert werden konnten, erscheinen in der Statistik als „verstorben“ ab dem Zeitpunkt der letzten sicheren „Lebend“-Dokumentation. Die Todesursachen konnten in acht Fällen nicht erhoben werden. 2.9. Statistik Für die statistische Auswertung der Ergebnisse wurde das Programm SPSS (Statistical Package for the Social Sciences) verwendet. Mit dieser Software sind gruppenspezifische Auswertungen möglich. Für stetige Messwerte wurden die Spannweite sowie Mittelwert und Median berechnet. Signifikanzen wurden mit Hilfe des Chi-Quadrat-Tests ermittelt, wobei Unterschiede, für die p≤0,05 errechnet wurde, als signifikant gewertet wurden. Die p-Werte wurden als absolute Zahlen angegeben. Mit dem Kaplan-Meier-Verfahren und der Cox´schen Regressionsanalyse wurden die Überlebenszeiten in Abhängigkeit einzelner oder mehrerer Einflussfaktoren berechnet und dargestellt [22]. 27 3. Ergebnisse 3.1. Postoperative Morbidität 3.1.1. Pankreasfistel Eine Pankreasfistel (PF) trat postoperativ bei 62 der 212 Patienten (29,2%) auf. Dabei führte bei 59 Patienten eine erhöhte Amylase oder Lipase im Drainagesekret zur Diagnose Bei drei Patienten wurde eine PF radiologisch mittels Kontrastmitteldarstellung diagnostiziert. In 39 Fällen (66,1%) führte das protrahierte Belassen der intraoperativ gelegten Zieldrainagen (Penrose/ Easy flow/ Robinson), evtl. kombiniert mit spezieller medikamentöser Therapie (Somatostatin oder Octreotid), zu einer Ausheilung der Fistel. Allerdings wurden auch bei 21 Patienten radiologisch-interventionell CT-gestützt neue Drainagen zur Ableitung des Sekrets gelegt. Nur bei zwei Patienten (0,94% aller Pat.) erfolgte eine Reoperation primär wegen einer PF. Bei den Pat. unter 50 Jahren fanden sich deutlich weniger PF (10,3%) als bei denen zwischen 50 und 69 bzw. ab 70 Jahren (32,9% bzw. 30,2%, p=0,052). Im Vergleich von unter 70-jährigen und 70 Jahre und älteren Patienten zeigte sich eine annähernd gleiche Fistelhäufigkeit (29,0% zu 30,2%, p=0,873). Bei weiblichen Patienten waren tendenziell weniger Fisteln als bei männlichen zu verzeichnen (24,4% zu 32,5%, p=0,202), ebenso bei Patienten mit muzinösen Adenokarzinomen im Vergleich zu den übrigen Adenokarzinomen (20,4% zu 31,9%, p=0,121). Diese Unterschiede waren jedoch nicht signifikant. Patienten mit einem pT1- oder T3-Tumor bildeten wesentlich häufiger Fisteln aus als Patienten mit pT2-Tumoren (p=0,030). Betrachtet man T1- und T2-Patienten in einer Gruppe (25,7% PF) gegenüber einer Gruppe von T3/4-Patienten (36,1% PF), so findet sich kein signifikanter Unterschied (p=0,115). Fast ebenso viele Patienten ohne Lymphknotenbefall (29,3%) wie mit Befall (29,2%) hatten postoperativ eine PF. Alle vier Patienten mit Fernmetastasierung hatten keine postoperative PF (aufgrund mangelnder Vergleichbarkeit bei nur vier Patienten mit M1-Stadium keine statistische Aussage28 kraft). Patienten mit schlecht differenzierten Tumoren (G3) hatten signifikant seltener PF (17,7%) als Patienten mit guter oder mäßiger Differenzierung des Tumors (G1 27,0% und G2 37,3%, p=0,006). Auch bei Darstellung des Zusammenhangs in zwei Gruppen (G1/2 36,1%, G3 17,7%) bleibt der signifikanter Unterschied erhalten (p=0,005). R1-resezierte Patienten zeigten deutlich weniger PF (11,5%) als R0- bzw. R2-Patienten (34,7% bzw. 38,5%, p=0,005). Fasst man R1- und R2Patienten zu einer Gruppe zusammen (PF 16,9%), ist der Unterschied zu R0Patienten signifikant (p=0,0087). Patienten mit WOP hatten tendenziell weniger postoperative PF (26,0%) als Patienten mit PPPD (36,4%, p=0,1255). Patienten mit Pankreasblindverschluss (PBV) hatten deutlich mehr PF (39,6%) als Patienten mit Pankreasanastomose (25,8%, p=0,0551). Patienten mit WOP zeigten mit PBV wesentlich mehr Fisteln als mit Pankreasanastomose (42,9% gegenüber 24,2%). Nach PPPD fielen Fisteln bei PBV in 38,5% und bei abgeleitetem Restpankreas in 33,3% der Fälle auf. Die Patientengruppe, welche von Operateuren mit mehr Erfahrung nach o.g. Einteilung operiert wurde, hatte weniger PF als diejenige, welche von Operateuren mit weniger Erfahrung operiert wurden (28,2% gegenüber 37,5%, p=0,345, nicht signifikant). PF traten bei 25,0% der Patienten ohne prophylaktische Applikation von Somatostatin oder Octreotid und bei 35,2% mit prophylaktischer Gabe auf (p=0,1067, nicht signifikant). Betrachtet man nur die Patientengruppe ohne Rekonstruktion mit PBV, so ist die Fistelhäufigkeit unter prophylaktischer Gabe von Som. oder Oct. mit 32,4% gegenüber 20,5% bei Patienten ohne prophylaktische Gabe deutlich, allerdings nicht signifikant höher (p=0,087). 3.1.2. Insuffizienz der Hepatikojejunostomie Eine Insuffizienz der Hepatikojejunostomie (HJS) trat postoperativ bei 11 (5,2%) der 212 Patienten auf. Bei Patienten ab 70 Jahren wurden signifikant mehr Insuffizienzen (16,3%) diagnostiziert als bei Patienten mit einem Operationsalter von weniger als 70 Jahren (2,4%, p=0,00024). Bei den unter 50-jährigen Patienten wurden keine Insuffizienzen der HJS beobachtet. Signifikante Unterschiede bezüglich Geschlecht 29 (p=0,735), Histologie (p=0,737), T-Kategorie (p=0,863), N-Kategorie (p=0,592), MKategorie (p=0,637 (bei nur vier Patienten mit Metastasen nicht statistisch aussagekräftig)), Grading (p=0,949) und R-Klassifikation (p=0,357) waren nicht zu verzeichnen. Die Rekonstruktion nach distaler Magenresektion (4,1% Insuffizienzen der HJS) oder pyloruserhaltend (7,6% Insuffizienzen der HJS) bzw. mit oder ohne Pankreasblindverschluss hatte auf die Entstehung einer Insuffizienz der HJS keinen signifikanten Einfluss. In der Gruppe der Operateure mit mehr Erfahrung wurden signifikant weniger Insuffizienzen der HJS beobachtet (3,7% gegenüber 16,7%, p=0,007). 3.1.3. Intraabdominale Infektion Eine intraabdominale Infektion (IAI) trat bei 54 (25,5%) der 212 Patienten auf. Dabei handelte es sich bei 42 Patienten um einen oder mehrere lokale Abszesse, zumeist im Oberbauch. Bei vier Patienten wurde eine diffuse Peritonitis beschrieben. Siebenmal wurde eine bakterielle Cholangitis diagnostiziert und in einem Fall wurde ein Leberabszess festgestellt. In der Patientengruppe <50 Jahre fanden sich zwar deutlich weniger (10,3%) IAI im Vergleich zu den Patienten über 50 bzw. über 70 Jahre (jeweils 27,9%), dieser Unterschied war jedoch nicht signifikant. Frauen waren signifikant seltener von IAI betroffen als Männer (14% gegenüber 33,3%, p=0,002). Bezüglich der Tumorhistologie (p=0,737) und Tumorlokalisation (p=0,895) ließ sich jeweils kein signifikanter Zusammenhang erkennen. Weder in der T-Kategorie (p=0,060), N-Kategorie (p=0,701), M-Kategorie (p=0,256, bei nur vier Patienten mit Metastasen keine statistische Aussagekräftigkeit)) noch innerhalb der Grading-Gruppen (p=0,206) bzw. R-Klassifikation (p=0,382) zeigten sich signifikante Unterschiede in der Häufigkeit von IAI. Bei Patienten mit klassischer WOP traten IAI nur bei 21,9% auf, bei PPPD mit 33,3% tendenziell häufiger (Unterschied nicht signifikant). Rekonstruktionen mit Pankreasblindverschluss zogen signifikant häufiger IAI nach sich als solche mit Anastomose (37,7% gegenüber 21,4%, p=0,018). Die Erfahrung des Operateurs (p=0,348) und Gabe von Somatostatin oder Octreotid (p=0,252) führten jeweils 30 nicht zu signifikanten Unterschieden in der Frequenz des Auftretens von IAI. Eine signifikante Abhängigkeit ließ sich zwischen dem Auftreten von Pankreasfistel und IAI (ohne PF 17,3% IAI, mit PF 45,2% IAI, p<0,001) und von Insuffizienzen der HJS und IAI (ohne Insuffizienz der HJS 23,4% IAI, mit Insuffizienz der HJS 63,6% IAI, p=0,003) feststellen. 3.1.4. Intraabdominale Blutung Eine intraabdominale Blutung (IAB) trat postoperativ bei 37 (17,5%) der 212 Patienten auf. 18 Patienten wurden deshalb reoperiert, 19 konservativ bzw. interventionell-angiographisch behandelt. Bei der Verteilung der IAB auf Alter (p=0,776), Geschlecht (p=0,092), Tumorhistologie (p=0,330), Tumorlokalisation (p=0,811), T-Kategorie (p=0,069), N-Kategorie (p=0,284), M-Kategorie (p=0,577), R-Klassifikation (p=0,3529) und Grading (p=0,139) ließen sich keine signifikanten Unterschiede erkennen. Bei Patienten mit WOP ergaben sich signifikant mehr IAB (9,6%) als mit PPPD (1,5%, p=0,034). Bezüglich Erfahrung des Operateurs (p=0,799) und prophylaktischer Therapie mit Somatostatin oder Octreotid (p=0,902) zeigten sich keine signifikanten Unterschiede. Signifikant höher war die Rate von IAB bei Patienten mit einer Pankreasfistel (mit 16,1%, ohne 3,3%, p=0,001) und einer IAI (mit 14,8%, ohne 4,4%, p=0,010), nicht jedoch bei Patienten mit einer Insuffizienz der HJS (mit 9,1%, ohne 7,0%, p=0,7889). 3.1.5. Magenentleerungsstörungen Magenentleerungsstörungen (MES) traten bei 28 (13,2%) der 212 Patienten auf. In der Gruppe unter 70 Jahre hatten nur 10,6% eine MES (davon nur ein Patient < 50 Jahre), in der Gruppe der Patienten ab 70 Jahre konnte bei 23,3% eine MES festgestellt werden (p=0,029). In Bezug auf Geschlechtsverteilung (p=0,882), Tumorhistologie (p=0,462), Tumorlokalisation (p=0,094), T-Kategorie (p=0,135), NKategorie (p=0,399), Grading (p=0,511) und R-Klassifikation (p=0,010) sowie Operationsart (p=0,901), Erfahrung des Operateurs (p=0,241) und Somatostatin31 /Octreotidprophylaxe (p=0,571) ließen sich keine signifikanten Unterschiede erkennen. Eine MES trat signifikant häufiger bei Patienten mit einer Pankreasfistel (mit 29,0%, ohne 6,7%, p<0,001), einer Insuffizienz der Hepatikojejunostomie (mit 36,4%, ohne 11,9%, p=0,0198), einer intraabdominalen Infektion (mit 35,2%, ohne 5,7%, p<0,001), einer intraabdominalen Blutung (mit 46,7%, ohne 10,7%, p<0,001) und einer pulmonalen Komplikation (mit 42,9%, ohne 9,9%, p<0,001) auf. 3.1.6. Pulmonale Komplikationen Folgende pulmonale Komplikationen (PK) waren bei 21 (9,9%) von 212 Patienten zu verzeichnen (siehe Tab. 3.1.6.1.): Tab. 3.1.6.1.: Art und Häufigkeit pulmonaler Komplikationen Art der Komplikation Anzahl (%) Pneumonie 10 (4,7) Pleuraerguß (punktionspflichtig) 5 (2,4) Respiratorische Insuffizienz 4 (1,9) Lungenembolie 1 (0,5) Pleuraempyem 1 (0,5) Anzahl PK gesamt (%) 21 (9,9) In Bezug auf Alter (p=0,803), Geschlecht (p=0,808), Tumorhistologie (p=0,522) und -lokalisation (p=0,094), T-Kategorie (p=0,135), N-Kategorie (p=0,141), MKategorie (p=0,503), R-Klassifikation (p=0,8949), Grading (p=0,131), Operationsart (p=0,790), Erfahrung des Operateurs (p=0,784), Fistelprophylaxe mit Somatostatin oder Octreotid (p=0,895) und dem Auftreten einer Pankreasfistel (p=0,149) ergaben sich keine signifikanten Unterschiede. Signifikant häufiger waren PK im Zusammenhang mit intraabdominalen Infektionen (p=0,003) und Blutungen (p<0,001) und bei Magenentleerungsstörungen (p<0,001). 32 3.1.7. Gesamtmorbidität Insgesamt hatten 100 von 212 Patienten (47,2%) mindestens eine Komplikation. Von diesen wiederum hatten 52 (52,0%) zwei oder mehr Komplikationen (darunter auch ein Patient mit einer beidseitigen Beinvenenthrombose, ein Patient mit einer großen intrazerebralen Blutung und zwei Patienten mit einem Leberausfallkoma im Rahmen einer Sepsis). 3.2. Reoperationen Von den 212 Patienten mußten 23 (10,9%) reoperiert werden. Von diesen wurde ein Patient zweimal und weitere sechs Patienten dreimal reoperiert. Bezüglich der Einflussfaktoren Alter, Geschlecht, TNM/R-Klassifikation, Grading, Operationsart, Erfahrung des Operateurs und prophylaktischer Somatostatin/Octreotidgabe fanden sich jeweils keine signifikanten Unterschiede in der Reoperationsfrequenz. Signifikant häufiger waren Reoperationen bei Patienten mit Pankreasfistel (p=0,011), Insuffizienz der Hepatikojejunostomie (p<0,001), intraabdominaler Infektion (p<0,001) und intraabdominaler Blutung (p<0,001) sowie Magenentleerungsstörung (p<0,001) und pulmonaler Komplikation (p<0,001) (siehe Tab.3.2.1. und Anhang 7.2.). Tab. 3.2.1.: Zusammenfassung der Reoperationsfrequenz bezogen auf die einzelnen Komplikationsarten Komplikationsart Anzahl Reoperationen Pankreasfistel (PF) 12/62 mit PF (19,4%) Insuffizienz der HJS (IHJS) Intraabdominale Infektion (IAI) Intraabdominale Blutung (IAB) 5/11 mit IHJS (45,5%) 14/54 mit IAI (25,5%) 8/15 mit IAB (53,3%) Magenentleerungsstörung(MES) 15/28 mit MES (53,6%) Pulmonale Komplikationen (PK) 11/21 mit PK (52,4%) 33 11/150 ohne PF (7,3%) 18/201 ohne IHJS (9,0%) 9/158 ohne IAI (5,7%) 15/197 ohne IAB (7,6%) 8/184 ohne MES (4,3%) 12/191 ohne PK (6,3%) Von den 23 Reoperationspatienten hatten 15 eine intraabdominale Blutung, 14 eine intraabdominale Infektion, 13 eine Pankreasfistel und fünf eine Insuffizienz der Hepatikojejunostomie. Dabei hatten 16 Patienten eine Kombination von mindestens zwei der vorgenannten Komplikationen. 15 Patienten zeigten eine Magenentleerungsstörung. 11 Patienten entwickelten im Verlauf eine pulmonale Komplikation. 18 Patienten erhielten mindestens zehn EK und ebenfalls 18 mindestens zehn FFP perioperativ. Zehn Patienten mit Reoperation verstarben innerhalb von zwei Monaten postoperativ, fünf überlebten über fünf Jahre (siehe Tab. 3.2.2). Tab. 3.2.2.: Einzelzuordnung Reoperation mit OP-Jahr und Komplikationen sowie Überlebenszeiten (ÜLZ) Reop. An- Pan- Insuffizienz Intraabd. Intraabd. Magenent- Pulmo- Anzahl ÜLZ/ nach zahl kreas- Hepatiko- Infektion Blutung leerungs- nale EK/FFP Mo- OP-Jahr Re- fistel jejuno- störung Kom- periop. nate OP stomie plikation 1/1983 3 ja ja ja nein ja nein 18/33 <2 2/1984 1 ja nein ja ja ja nein 47/94 <2 3/1985 1 nein ja nein nein nein nein 4/19 17 4/1985 3 ja ja ja ja ja ja 63/107 147 5/1986 1 nein nein nein ja ja ja 50/80 <2 6/1988 1 ja nein nein ja ja nein 24/33 8 7/1989 1 nein nein nein nein nein ja 5/26 1 8/1990 1 nein nein ja ja ja nein 44/75 1 9/1990 1 nein nein nein nein ja nein 6/9 8 10/1990 2 ja nein ja nein nein nein 2/16 8 11/1990 1 ja nein ja ja ja nein 18/22 8 12/1990 3 ja nein ja ja ja ja 28/33 6 13/1991 1 nein nein ja nein nein ja 6/42 6 14/1992 1 nein nein ja ja ja ja 8/5 <1 15/1992 1 nein nein nein ja nein nein 15/22 8 16/1992 1 ja nein ja Ja ja ja 44/34 119 17/1993 3 ja ja nein ja ja ja 34/32 <1 18/1993 2 ja nein nein ja ja ja 35/65 <2 19/1994 3 ja nein ja ja nein ja 58/8 <1 20/1995 1 nein nein nein ja nein nein 14/6 79 21/1996 1 ja ja ja nein nein nein 10/14 114 22/1996 1 ja nein ja nein Ja nein 2/0 99 23/1996 3 nein nein ja ja ja ja 46/132 <1 34 3.3. Transfusion von Blutpräparaten 3.3.1. Erythrozytenkonzentrate Insgesamt wurden bei den 212 betrachteten Patienten 1613 Erythrozytenkonzentrate (EK) perioperativ transfundiert. Der Mittelwert lag bei 7,6 und der Median bei 5. Fünf Patienten erhielten keine EK, 35 Patienten ein bis zwei EK, 53 Patienten drei bis vier EK, 51 Patienten fünf bis sechs EK, 28 Patienten sieben bis acht EK, 12 Patienten neun bis zehn EK, 16 Patienten 11 bis 20 EK und 12 Patienten mehr als 20 EK (max. 63 EK). Signifikante Zusammenhänge zwischen Anzahl der gegebenen EK und Alter (p=0,761), Geschlecht (p=0,058, tendenziell mehr EK bei Männern), M-Kategorie (p=0,954), R-Klassifikation (p=0,863), Operationsart (WOP/ PPPD) (p=0,133), Erfahrung des Operateurs (p=0,345) und prophylaktischer Somatostatin-/ Octreotidgabe (p=0,285) ließen sich nicht feststellen (siehe Anhang 7.3.1.). Innerhalb der Gruppe der Langzeitüberlebenden (LZÜ) bekamen 26 Patienten (68,4%) bis zu fünf EK und 12 Patienten (31,6%) mehr als fünf EK (14 bzw. vier Patienten bei den über zehn Jahre LZÜ). 3.3.2. Fresh Frozen Plasma Insgesamt wurden bei den 212 betrachteten Patienten 2392 Einheiten Fresh Frozen Plasma (FFP) perioperativ transfundiert. Der Mittelwert lag bei 11,3 und der Median bei 6. 20 Patienten erhielten keine FFP, 27 Patienten ein bis zwei FFP, 36 Patienten drei bis vier FFP, 28 Patienten fünf bis sechs FFP, 16 Patienten sieben bis acht FFP, 13 Patienten neun bis zehn FFP, 44 Patienten 11 bis 20 FFP und 26 Patienten mehr als 20 FFP (max. 132 FFP). Signifikante Zusammenhänge zwischen Anzahl der gegebenen FFP und Alter (p=0,978), Geschlecht (p=0,084, tendenziell mehr FFP bei Männern), T-Kategorie (p=0,118), N-Kategorie (p=0,243), M-Kategorie (p=0,059), Grading (p=0,975), RKlassifikation (p=0,276), Operationsart (WOP/ PPPD) (p=0,152) und Erfahrung des Operateurs (p=0,099) ließen sich nicht feststellen. Für die prophylaktische 35 Somatostatin-/ Octreotidgabe fand sich ein signifikanter Unterschied bezüglich der Anzahl der verabreichten FFP (p<0,001): Patienten ohne Prophylaxe wurden wesentlich häufiger mehr als sechs FFP gegeben als Patienten mit Prophylaxe (siehe Anhang 7.3.2.). Innerhalb der Gruppe der LZÜ erhielten 25 Patienten (65,8%) bis zu sechs FFP und 13 Patienten (34,2%) mehr als sechs FFP (zwölf bzw. sechs Patienten bei den über zehn Jahre LZÜ). 3.4. Perioperative Letalität 21 der 212 Patienten (9,9%) verstarben innerhalb von 90 Tagen, 13 (6,1%) von diesen innerhalb von 30 Tagen nach Operation. 191 Patienten (90,1%) lebten 90 Tage oder länger (Langzeitüberlebende). Keinen signifikanten Einfluss auf die 90-Tage-Letalität hatten bei der univariaten Betrachtung Alter (p=0,672), Geschlecht (p=0,822), T-Kategorie (p=0,674), NKategorie (p=0,582), M-Kategorie (p=0,308), Grading (p=0,436) sowie Operationsart (p=0,208) und Erfahrung des Operateurs (p=0,239). Dagegen fanden sich innerhalb der Gruppe der bis 90 Tage postoperativ verstorbenen Patienten jeweils signifikant mehr Komplikationen (Pankreasfistel: p=0,051, Insuffizienz der Hepatikojejunostomie: p=0,003, intraabdominale Infektion: p=0,014, intraabdominale Blutung: p<0,001, Magenentleerungsstörung: p<0,001, pulmonale Komplikation: p<0,001; siehe auch Anhang 7.4.). Signifikant mehr Patienten aus der R2-resezierten Gruppe im Vergleich zu R0/1 verstarben innerhalb von 90 Tagen postoperativ (p=0,033). Dieser Unterschied ist bei Zusammenfassung von R1 und R2 zu einer Gruppe (gegenüber R0) nicht mehr signifikant (p=0,436). 36 3.5. Überleben 3.5.1. Übersicht Gesamtüberleben Die mediane Überlebenszeit des Gesamtkollektivs betrug 16 Monate. Von den 212 Patienten fielen 21 (9,9%) in die Gruppe der postoperativen 90-TageLetalität. Insgesamt 78 Patienten (36,8%) verstarben innerhalb von 12 Monaten postoperativ. Insgesamt 144 Patienten (67,9%) verstarben innerhalb eines Zeitraums von 24 Monaten postoperativ. 38 Patienten (17,9%; 21 weiblich, 17 männlich, 30 Pat. bis 69 Jahre, acht Pat. älter als 69 Jahre) überlebten fünf Jahre oder länger, davon 18 (8,5%) 10 Jahre oder länger (siehe Tab. 3.5.1.1.). Die längste nachprüfbare Überlebenszeit war knapp 20 Jahre (235 Monate) im März 2006. Zehn Langzeitüberlebende (LZÜ) starben im sechsten bis zwölften Jahr postoperativ, davon einer im sechsten Jahr an einem Rezidiv. Alle über sieben Jahre LZÜ waren bezüglich des ehemaligen Karzinoms im Pankreaskopfbereich rezidivfrei. Bei drei über fünf Jahre LZÜ konnte der weitere Verlauf nicht mehr eruiert werden. Bei vier Patienten der LZÜ wurden im Verlauf Zweitkarzinome bekannt. Eine Patientin wurde wegen eines Zervixkarzinoms operiert (bis März 2006 diesbezüglich rezidivfrei). Ein Patient wurde wegen eines Harnblasenkarzinoms operiert (bis März 2006 diesbezüglich rezidivfrei). Eine Patientin starb 106 Monate postoperativ an einem metastasierten Ovarialkarzinom und ein Patient 154 Monate postoperativ an einem Bronchialkarzinom. Ein weiterer Patient erlag 101 Monate postoperativ den Folgen einer (am ehesten transfusionsbedingten) Hepatitis-C-Infektion. Tab. 3.5.1.1. Zusammenfassung Gesamtüberleben Überlebenszeit postoperativ Anzahl Pat. n=212 (%) 3 Monate 191/212 (91,1) 12 Monate 134/212 (63,2) 24 Monate 68/212 (32,1) 60 Monate 38/212 (17,9) 120 Monate 18/212 (8,5) 37 1,0 ,9 ,8 ,7 ,6 ,5 ,4 ,3 ,2 n=212 ,1 0,0 0 24 12 48 36 72 60 96 84 120 108 144 132 168 156 192 180 216 204 240 228 Überlebenszeit nach OP / Monate Abb. 3.5.1.1.: Gesamtüberleben n=212 (Kaplan-Meier-Diagramm) 3.5.2. Alter und Geschlecht Es zeigten sich keine signifikanten Unterschiede bezüglich Alters- (p=0,896) und Geschlechtsverteilung (p=0,563) der Langzeitüberlebenden (siehe auch Anhang 7.5.). 3.5.3. Histologische Klassifikation Signifikant weniger Patienten unter den über fünf Jahre Überlebenden hatten ein muzinöses Adenokarzinom (p=0,014), signifikant mehr dieser Patienten hatten ein Papillenkarzinom (63,2%, p<0,001, siehe Tab. 3.5.3.1.). Unter den 111 periampullären Tumoren wurden 65 (58,6%) dem Papillenbereich und 46 (41,4%) dem distalen Ductus choledochus zugeordnet (siehe Tab. 3.5.3.1.). 38 Tab. 3.5.3.1.: Tumortyp und -lokalisation und 5-Jahresüberleben Histologischer Typ alle Pat. LZÜ - 59 Mon. LZÜ > 59 Mon. Anzahl(%) Anzahl (%) Anzahl (%) von n=212 von n=174 von n=38 163 (76,9) 128 (73,6) 35 (92,1) 49 (23,1) 46 (26,4) 3 (7,9) Pankreaskopf 101 (47,6) 96 (55,2) 5 (13,2) Papilla Vateri 65 (30,7) 41 (23,6) 24 (63,2) Dist. Ductus chol. 46 (21,7) 37 (21,3) 9 (23,7) Adeno-Ca muzinös. Adeno-Ca Tumorlokalisation Signifikant mehr Patienten in der Gruppe der mindestens fünf Jahre LZÜ hatten ein T1-und N0-Stadium. Keiner der Patienten der LZÜ hatte Fernmetastasen. Unter den 5-Jahresüberlebenden befanden sich keine R2-resezierten Patienten. Bezüglich des Gradings ergaben sich keine Unterschiede im Gruppenvergleich. Bei 36 von 38 Patienten (94,7%) wurde histologisch eine R0-Resektion und bei zwei (5,3%) eine R1-Resektion diagnostiziert. Außerdem zeigten sich bei den LZÜ bei 35 von 38 Patienten (92,1%) histologisch nicht-muzinöse Adenokarzinome und bei 33 von 38 Patienten (86,8%) eine Tumorlokalisation im periampullären Bereich. Die 5-Jahresüberlebensrate von Patienten mit periampullären Tumoren war 29,7% (33/111 Pat.), die von Patienten mit duktalem Adenokarzinom des Pankreaskopfes 5,0% (5/101 Pat.). Beim histologischen Typ und der Tumorlokalisation bestanden damit jeweils signifikante Unterschiede zwischen 5- Jahresüberlebenden und Gesamtkollektiv bzw. Patienten mit periampullären Tumoren und Patienten mit duktalem Adenokarzinom. Die folgenden Tabellen fassen die histologischen Ergebnisse im Gruppenvergleich zusammen. 39 Tab. 3.5.3.2.: TNM/G/R-Klassifikation und 5-Jahresüberleben Tumor- alle Pat. ÜLZ - 59 Mon. ÜLZ > 59 Mon. klassifikation Anzahl (%) Anzahl (%) Anzahl (%) von n=212 von n=174 von n=38 T1 26 (12,3) 12 (6,9) 14 (36,8) T2 114 (53,8) 97 (55,8) 17 (44,7) T3 69 (33,9) 62 (35,6) 7 (18,4) T4 3 (1,7) 0 (0,0) 0 (0,0) N0 99 (46,7) 70 (40,2) 29 (76,3) N1 113 (53,3) 104 (59,8) 9 (23,7) M0 208 (98,1) 170 (97,7) 38 (100,0) M1 4 (1,9) 4 (2,3) 0 (0,0) G1 79 (37,3) 26 (14,9) 11 (28,9) G2 96 (45,3) 79 (45,4) 17 (44,7) G3 37 (17,5) 69 (39,7) 10 (26,3) R0 147 (69,3) 111 (63,8) 36 (94,7) R1 52 (24,5) 50 (28,7) 2 (5,3) R2 13 (6,1) 13 (7,5) 0 (0,0) T-Kategorie N-Kategorie M-Kategorie Grading R-Klassifikation Patienten mit T1-Karzinomen hatten eine signifikant höhere Überlebenswahrscheinlichkeit als T2-, T3- bzw. T4-Patienten. Die hier mit einbezogenen Patienten mit T4-Tumoren verstarben im vierten, fünften bzw. siebten Monat nach der Operation (siehe Tab. 3.5.3.3. und Abb. 3.5.3.1.). 40 Tab. 3.5.3.3.: T-Kategorie und 5-Jahresüberleben T-Kategorie Überleben / Anzahl (%) Pat. - 59 Mon. Gesamtzahl (%) Pat. > 59 Mon. T1 15 (65,2) 8 (34,8) T2 94 (90,4) 10 (9,6) 104 (54,5) T3 57 (93,4) 4 (6,6) 61 (31,9) 0 (0,0) 3 (1,6) 22 (11,5) 191 (100,0) 3 (100,0) T4 169 (88,5) Gesamtzahl(%) 23 (12,0) p=0,002 1,0 ,9 ,8 T-Stadium ,7 T4 ,6 ,5 T3 ,4 ,3 T2 ,2 ,1 T1 0,0 0 12 24 36 48 60 72 84 96 108 120 Überlebenszeit nach OP / Monate (log rank Test p< 0,001) Abb. 3.5.3.1.: T-Kategorie und Überlebensrate (Kaplan-Meier-Diagramm) Unter den bis fünf Jahre Überlebenden hatten signifikant mehr Patienten Lymphknotenmetastasen als unter den mehr als 60 Monate LZÜ (siehe Tab 3.5.3.4. und Abb. 3.5.3.2.). 41 Tab. 3.5.3.4.: N-Kategorie und 5-Jahresüberleben N-Kategorie Langzeitüberlebende / Anzahl (%) Gesamtzahl Pat. - 59 Mon. (%) Pat. > 59 Mon. N0 70 (40,2) 29 (76,4) 99 (46,7) N1 104 (59,8) 9 (23,7) 113 (53,9) Gesamtzahl (%) 174 (82,1) 38 (17,9) 212 (100,0) p<0,001 1,0 ,9 ,8 ,7 ,6 ,5 ,4 N-Status ,3 ,2 N1 ,1 0,0 N0 0 12 24 36 48 60 72 84 96 108 120 Überlebenszeit nach OP / Monate ( log rank Test p< 0,001) Abb. 3.5.3.2.: N-Kategorie und Überlebensrate (Kaplan-Meier-Diagramm) Keiner der mehr als 60 Monate überlebenden Patienten hatte (zum Operationszeitpunkt) Fernmetastasen. Drei Patienten mit Fernmetastasen überlebten 11, 15 bzw. 24 Monate. Die mehr als 60 Monate überlebenden Patienten hatten tendenziell mehr gut und mittelhoch differenzierte Tumore, der Unterschied ist jedoch nicht signifikant (siehe Tab. 3.5.3.5.). 42 Tab. 3.5.3.5.: Differenzierungsgrad und 5-Jahresüberleben Differenzierungs- Langzeitüberlebende / Anzahl (%) Grad Pat. - 59 Mon. Gesamtzahl (%) Pat. > 59 Mon. G1 26 (14,9) 11 (28,9) 37 (17,5) G2 79 (45,4) 17 (44,7) 96 (45,3) G3 69 (39,7) 10 (26,3) 79 (37,3) 174 (82,1) 38 (17,9) 212 (100,0) Gesamtzahl (%) p=0,082 Alle bis auf zwei Patienten (diese R1-klassifiziert) der Gruppe der 60 Monate und länger überlebenden Patienten wurden R0-reseziert. Dagegen gab es unter den übrigen Langzeitüberlebenden insgesamt etwa ein Drittel mit mikroskopischem oder makroskopischem Resttumor (R1/R2-klassifizierte Patienten: 35,9%). Der Unterschied ist signifikant (siehe Tab. 3.5.3.6. und Abb.3.5.3.3.). Tab. 3.5.3.6.: Residualtumor und 5-Jahresüberleben Residualtumor Langzeitüberlebende / Anzahl (%) Pat. - 59 Mon. R0 R1/2 Gesamtzahl (%) Gesamtzahl (%) Pat. > 59 Mon. 111 (63,8) 36 (94,7) 147 (69,3) 63 (36,2) 2 (5,2) 65 (30,7) 174 (82,1) 38 (17,9) 212 (100,0) p<0,001 43 1,0 ,9 ,8 ,7 ,6 ,5 ,4 R-Klassifikation ,3 ,2 R1/2 ,1 0,0 R0 0 12 24 36 48 60 72 84 96 108 120 Überlebenszeit nach OP / Monate (log rank Test p<0,001) Abb: 3.5.3.3.: Langzeitüberleben und R-Klassifikation im Kaplan-Meier-Diagramm Bezüglich des Einflusses der ausgewählten allgemeinen Faktoren und der postoperativ aufgetretenen Komplikationen auf die Langzeitprognose wurden die 38 mindestens fünf Jahre überlebenden Patienten dem Gesamtkollektiv gegenübergestellt. 3.5.4. Operationsart Die Verteilung der Operationsarten bei allen Patienten bzw. den 5-Jahresüberlebenden zeigt die nachstehende Tabelle 3.5.4.1. (kein signifikanter Unterschied). 44 Tab. 3.5.4.1: Operationsart und 5-Jahresüberleben Operationsart alle Pat. 5-Jahresüberlebende Anzahl (%) vonn=212 Anzahl (%) von n=38 WOP 146/212 (68,9%) 22/38 (57,9%) PPPD 66/212 (31,1%) 16/38 (42,1%) PBV 53/212 (25,0%) 7/38 (18,4%) 3.5.5. Operateur In den Überlebenszeiten ist nach Zuordnung der Patienten in die jeweilige Gruppe der Operateure kein signifikanter Unterschied festzustellen (p=0,462; siehe Anhang Tab. 7.5.10) 3.5.6. Prophylaktische Somatostatin- bzw. Octreotidtherapie Die prophylaktische Gabe von Somatostatin oder Octreotid ab dem OP-Tag hatte auf die Langzeitprognose keinen signifikanten Einfluß (p=0,656, siehe Anhang Tab. 7.5.11.). 3.5.7. Komplikationen Zwischen den Häufigkeiten der betrachteten Komplikationen bei den 5Jahresüberlebenden im Vergleich zur Gesamtzahl der Patienten zeigten sich keine signifikanten Unterschiede (siehe Tab. 3.5.7.1.). 45 Tab. 3.5.7.1.: Perioperative Komplikationen und 5-Jahresüberleben Komplikation alle Pat. 5-Jahresüberlebende Anzahl (%) von n=212 Anzahl (%) von n=38 Pankreasfistel 62/212 (29,2%) 16/38 (42,1%) Insuffizienz der HJS 11/212 (5,2%) 2/38 (5,2%) Intraabdominale Infektion 54/212 (25,5%) 11/38 (28,9%) Intraabdominale Blutung 15/212 (7,1%) 3/38 (7,9%) Magenentleerungsstörung 28/212 (13,2%) 4/38 (10,5%) Pulmonale Komplikationen 21/212 (9,9%) 3/38 (7,9%) Pankreasfistel In die Gruppe der 5-Jahresüberlebenden fielen tendenziell mehr Patienten mit einer postoperativen Pankreasfistel (p=0,054, siehe Anhang Tab. A 7.5.12.). Insuffizienz der Hepatikojejunostomie Ihr Auftreten hat keinen signifikanten Einfluss auf die Langzeitprognose (p=0,558, siehe Anhang Tab. A 7.5.13.). Intraabdominale Infektion Patienten, bei denen postoperativ eine intraabdominale Infektion auftrat, hatten allein durch dieses Ereignis keine verringerte Langzeitüberlebenswahrscheinlichkeit (p=0,334). In der Gruppe der über fünf Jahre LZÜ waren relativ mehr Patienten mit postoperativer intraabdominaler Infektion (siehe Anhang Tab. A 7.5.14.). 46 Intraabdominale Blutung Ein signifikant ungünstiger Einfluss einer postoperativ durchgemachten intraabdominalen Blutung auf die Langzeitprognose konnte nicht festgestellt werden (p=0,301, siehe Anhang Tab A 7.5.15.). Magenentleerungsstörung Falls postoperativ eine MES zu beobachten war, so hatte diese keinen signifikanten Einfluss auf das Langzeitüberleben (p=0,894, siehe Anhang Tab. A 7.5.16.). Pulmonale Komplikationen Patienten mit pulmonalen Komplikationen im postoperativen Verlauf hatten keine signifikant veränderte Langzeitüberlebenswahrscheinlichkeit (p=0,203, siehe Anhang Tab. A 7.5.17.). 3.5.8. Reoperationen Reoperationen führten zu keiner signifikanten Abnahme des Langzeitüberlebens. In der Gruppe der mindestens 60 Monate überlebenden Patienten waren etwas mehr Reoperationen im Vergleich zum Gesamtkollektiv festzustellen (5/38 Pat. (13,2%) gegenüber 23/212 Pat. (10,8%);.p=0,051, siehe Anhang Tab. A 7.5.18.). 3.5.9. Transfusionen Unter den 5-Jahresüberlebenden fanden sich deutlich mehr Patienten mit einem (bis auf den jeweiligen Median) begrenzten Transfusionsbedarf an EK und FFP (siehe Tab. 3.5.9.1.). 47 Tab. 3.5.9.1.: Transfusionen und 5-Jahresüberleben Transfusionen alle Pat. 5-Jahresüberlebende Anzahl (%) von n=212 Anzahl (%) von n=38 - 5 EK 109/212 (51,4%) 26/38 (68,4%) - 6 FFP 113/212 (53,3%) 25/38 (65,8%) Erythrozytenkonzentrate Die Anzahl der Erythrozytenkonzentrate, die perioperativ verabreicht wurden, machte sich signifikant zwischen den beiden Überlebensgruppen bemerkbar (siehe Tab 3.5.9.2.). Tab. 3.5.9.2: Erythrozytentransfusion und 5-Jahresüberleben EK periop. Überlebende / Anzahl (%) Pat. - 59 Mon. Gesamtzahl (%) Pat. > 59 Mon. Pat. mit - 5 EK 83 (47,7) 26 (68,4) 109 (51,4) Pat. mit > 5 EK 91 (52,3) 12 (31,6) 103 (48,6) Gesamtzahl (%) 174 (82,1) 38 (17,9) 212 (100,0) p=0,021 In Abb. 3.5.9.1. ist die 5- bzw. 10-Jahres-Überlebensrate für Patienten, die nicht mehr als 5 EK postoperativ bekamen, nach 60 Monaten signifikant höher als die für Patienten, die mehr als 5 EK erhielten. 48 1,0 ,9 ,8 ,7 ,6 ,5 ,4 EK periop ,3 ,2 > 5 EK ,1 0,0 - 5 EK 0 10 20 30 40 50 60 70 80 90 100 110 120 Überlebenszeit nach OP / Monate (log rank Test p=0,004) Abb. 3.5.9.1.: Langzeitüberleben und Erythrozytensubstitution im Kaplan-MeierDiagramm Fresh Frozen Plasma Bei der perioperativen Gabe von FFP ließ sich bei einem cut off von 6 (Median) kein signifikanter Unterschied bezüglich des Langzeitüberlebens feststellen (siehe Tab. 3.5.9.3.). Tab. 3.5.9.3.: Plasmatransfusion und 5-Jahresüberleben FFP periop. Überlebende / Anzahl (%) Gesamtzahl Pat. - 59 Mon. (%) Pat. > 59 Mon. Pat. mit - 6 FFP 88 (50,6) 25 (65,8) 113 (53,3) Pat. mit > 6 FFP 86 (49,4) 13 (34,2) 99 (46,7) Gesamtzahl (%) 174 (82,1) 38 (17,9) 212 (100,0) p=0,089 49 3.5.10. Regressionsanalyse der Einflussfaktoren Bei univariater Betrachtung der oben aufgeführten Einflussgrößen auf den Langzeitverlauf zeigten die Tumorlokalisation, die Histologie, die Tumorgröße, der Lymphknotenstatus, der Status der Fernmetastasierung sowie der Residualtumor und die Gabe von Erythrozytenkonzentraten einen signifikanten Einfluss auf die Langzeitüberlebensrate (bis 59 oder länger als 59 Monate). Dagegen führte das Auftreten postoperativer Komplikationen (Pankreasfistel, Insuffizienz der Hepatikojejunostomie, intraabdominale Infektion, intraabdominale Blutung, Magenentleerungsstörung, pulmonale Komplikation oder die Notwendigkeit einer Reoperation) nicht zu signifikanten Unterschieden. Ebensowenig zeigten sich signifikante Unterschiede bei der Betrachtung von Alter und Geschlecht, dem Differenzierungsgrad des Tumors, der Operationsart, der Anzahl von Transfusionen von FFP sowie der prophylaktischen Somatostatin- bzw. Octreotidgabe. Eine Cox´sche Regressionsanalyse wurde zur Darstellung des Sterberisikos im postoperativen Verlauf in Abhängigkeit der unter 3.5. genannten Variablen mit signifikantem Einfluss in der univariaten Betrachtung durchgeführt (siehe Tab. 3.5.10.1.). Tab. 3.5.10.1.: Testung der in der univariaten Analyse signifikanten Variablen im Cox´schen Regressionsmodell (stepwise forward / backward) Variable Exp (B) Sign. 95% CI Tumorgröße 1,960 <0,001 1,352 - 2,840 Lymphknotenstatus - 0,489 - Residualtumor 2,183 <0,001 1,491 - 3,196 Tumorlokalisation 0,581 0,007 0,391 - 0,861 Histologie - 0,350 - EK-Gabe 1,745 0,001 1,242 - 2,453 -2 Log Likelihood: 1272,69; Significance: <0,001; Exp (B) = hazard ratio = odd´s ratio; Sign. = Signifikanz; CI = Konfidenzintervall 50 Für die odd´s ratio bzw. hazard ratio (Exp (B)) waren Tumorgröße, Tumorlokalisation, R-Situation und Erythrozytentransfusion in dieser Analyse von signifikantem Einfluss. Für Lymphknotenstatus und Histologie wurde jeweils keine statistische Signifikanz bei der Regression nach Cox errechnet. 51 4. Diskussion 4.1. Postoperative Morbidität Gesamtkomplikationsraten nach onkologischen Pankreasresektionen von 20% bis über 50% werden auch aus spezialisierten Zentren heutzutage noch berichtet (z.B. 29,9% von Richter et al. [67], 41% von Yeo et al. [93], 42% von Adam et al.[1], 43% von Bakkevold et al. und Schmidt et al. [3, 75], 44,1% von Wagner [85] und 20-70% von Schäfer in einem Review über den Zeitraum von 1990 bis 2001 [74]). Als häufigste Komplikationen nach Whipple´scher Operation werden Pankreasfisteln, intraabdominale Infektionen und Blutungen sowie eine verzögerte Magenentleerung beschrieben. Dies kann mit der vorliegenden Untersuchung bestätigt werden. Sind dabei Reoperationen erforderlich, steigt das Letalitätsrisiko [35]. Eine erweiterte („extended“) Lymphadenektomie scheint nicht mit erhöhter Morbidität und Mortalität einher zu gehen, allerdings hat die erweiterte Lymphadenektomie keinen Einfluss auf das Langzeitüberleben [32, 58, 92, 94]. Alter Daß auch ältere Patienten mit Pankreasmalignomen von Pankreasresektionen profitieren können, wurde inzwischen mehrfach in Studien gezeigt. DiCarlo et al. [30] sahen bei 33 über 70-jährigen Patienten im Vergleich zu 85 jüngeren Patienten keine signifikant unterschiedliche Gesamtmorbidität und Mortalität. Auch Blair und Schwarz [18] fanden in einer retrospektiven Betrachtung unter Verweis auf ähnliche Komplikations- und Sterbezahlen bei Patienten unter 70 und über 70 Jahren keinen Grund dafür, allein wegen fortgeschrittenen Alters auf eine größere abdominale Operation zu verzichten. Nicht alle Autoren berichten allerdings über vergleichbare Morbiditäts- und Letalitätsraten. Richter et al. [68] fanden im eigenen Kollektiv eine eindeutig erhöhte Morbiditäts- und Letalitätsrate bei Patienten über 70 Jahre, wenngleich sie das Alter allein (im Hinblick auf die zu erwartende bessere Lebensqualität nach Tumorresektion im Vergleich zu palliativer Bahandlung al52 lein) nicht als limitierenden Faktor für einen resezierenden Eingriff sahen. Eindeutig kritisch beurteilt wird die Operationsindikation bei älteren Patienten z.B. von Finlayson und Birkmeyer, Bathe et al., Böttger et al. oder Lightner et al., welche jeweils auf häufig schlechtere funktionelle Ergebnisse bzw. erhöhte Komplikationsraten und Sterblichkeit hinwiesen [11, 20, 33, 51]. Ab wann ein Patient als letztlich „älter“ eingestuft wird, ist schwierig zu beurteilen, zumal die allgemeine Lebenserwartung weiterhin steigt. Eine feste Grenze in Zahlen läßt sich nicht angeben und wird auch in der Literatur entsprechend unterschiedlich (meist zwischen 65 und 75 Jahren) gezogen. In der eigenen Untersuchung zeigten sich in der univariaten Analyse signifikant mehr Insuffizienzen der Hepatikojejunostomie (Alter unter 50 Jahre: 0%, 50 bis 69 Jahre: 2,4%, größer 69 Jahre: 16,3%) und signifikant mehr Magenentleerungsstörungen (Alter unter 50 Jahre: 3,4%, 50 bis 69 Jahre: 10,6%, größer 69 Jahre: 23,3%). Eine deutliche Tendenz bestand außerdem für die Entstehung von Pankreasfisteln (unter 50 Jahre: 10,3%, 50 bis 69 Jahre: 29,0%, größer 69 Jahre: 30,2%) und von intraabdominalen Infektionen (unter 50 Jahre: 10,3%, 50 bis 69 Jahre: 24,9%, größer 69 Jahre: 27,9%) mit zunehmendem Alter. Die Ursachen werden vorwiegend in dem meist schlechteren Allgemeinzustand bzw. Immunstatus älterer Patienten bei erhöhter Komorbidität liegen. Keine wesentlichen Differenzen innerhalb der Altersgruppen fanden sich hingegen bei der Zahl intraabdominaler Blutungen, pulmonaler Komplikationen und Reoperationen. Die Beobachtungen eines gesteigerten Komplikationsrisikos bei älteren Patienten entsprechen der allgemeinen chirurgischen Erfahrung und sollten in den Überlegungen zur Operationsindikation bei älteren Patienten besonders berücksichtigt werden [8]. Pankreasfistel Postoperative Pankreasfisteln (PF) treten nach Literaturangaben in 0 bis 46% nach Pankreaskopfresektionen auf. Berichtet wurden z.B. 2% von Berdah et al. [14], 3,2% von Büchler et al. [22], 10,4% von Halloran et al. [35], 12,6% von Kazanjian et al. [43] und 16% von Yamaguchi et al. [89]. Die Ursachen sind nicht definitiv geklärt. Sowohl die individuelle Anatomie des Patienten und Konsistenz des 53 Pankreas als auch die operative Anastomosentechnik, über welche angesichts vieler beschriebener Varianten weltweit offensichtlich noch keine Einigkeit besteht, scheinen eine Rolle scheinen zu spielen. Das Management richtet sich nach dem Verlauf, ist aber in der Mehrzahl der Fälle konservativ [43, 69]. Ablaufdrainagen können, wenn nötig, auch über mehrere Wochen in situ verbleiben und das aggressive, enzymhaltige Pankreassekret so nach außen leiten. Durch Bilanzierung der täglichen Sekretmengen und Bestimmungen der Enzymaktivitäten im Drainagesekret, unterstützt durch regelmäßige sonographische Kontrollen, ist eine ausreichende Kontrolle und schließlich ein Verschluß der Fistel in der überwiegenden Mehrzahl der Fälle möglich (so auch bei 39 bzw. zwei Drittel der eigenen Patienten). Reoperationen sind meist nur bei durch Infektionen oder Blutungen komplizierten Fisteln nötig. Die früher häufiger durchgeführte Restpankreatektomie sollte nur im Notfall erfolgen, da sie zu einer deutlichen Erhöhung der Morbiditäts- (insbesondere der schwer einstellbare pankreoprive Diabetes mellitus) und Letalitätsraten führt [22]. Die Zahl von 29,2% PF bei den eigenen Patienten liegt im Literaturvergleich hoch. Dabei muss allerdings beachtet werden, dass die Definition der Pankreasfistel nicht einheitlich ist [9, 52]. Eine unkomplizierte PF, die konservativ mittels Drainage nach außen behandelt werden kann, stellt für sich allein eigentlich noch keine größere, allzu belastende Komplikation für den Patienten dar, wenngleich sie immer einen erhöhten Pflege- und Diagnostikaufwand und damit auch Kosten- und Zeitaufwand bedingt. Von klinischer Relevanz ist die PF allerdings immer wegen ihrer potentiellen Folgen. Sie kann weitere Komplikationen bedingen und dann zu lebensgefährlichen Verläufen führen. PF bestanden immerhin bei 28 von 54 (also mehr als der Hälfte) der Patienten mit intraabdominalen Infektionen und bei 10 von 15 (also zwei Drittel) der Patienten mit intraabdominalen Blutungen. Unter den Patienten mit letalem postoperativen Krankheitsverlauf hatte knapp die Hälfte (10 von 21) eine PF. 54 Insuffizienz der Hepatikojejunostomie Die Rate von 5,2% Insuffizienzen der Hepatikojejunostomien (IHJS) bei den selbst untersuchten Patienten liegt im Bereich der (dazu eher selteneren) Angaben in der Literatur (z.B. 4,7% bei Yamaguchi et al. [89]). Auffällig war das signifikant höhere Auftreten bei Operateuren mit „weniger Erfahrung“, was die Bedeutung der Anastomosentechnik und die Forderung nach „high volume“ Chirurgie für diese Operation unterstreichen würde. Das eindeutig häufigere Vorkommen bei älteren Patienten kann für ein allgemein höheres Morbiditätsrisiko bei dieser Patientengruppe sprechen, welches wiederum durch eine besonders kritische Indikationsstellung der OP berücksichtigt werden sollte, war doch eine IHJS mit einer signifikant erhöhten perioperativen Letalität von 36,4% verbunden. Intraabdominale Infektionen Intraabdominale Infektionen (IAI) werden nach WOP/PPPD mit einer Frequenz von bis zu 15% beschrieben (Yeo et al. 10% [93], Yamaguchi et al.14% [89]). Die Rate von 25,5% IAI bei den eigenen Patienten liegt im Vergleich dazu deutlich höher. Möglicherweise war allerdings die eigene Definition dabei relativ großzügig, da auch z.B. Cholangitiden (bei Yamaguchi et al. z.B. mit 8,9% extra angeführt [89]) oder mikrobiologisch positive Bauchhöhlenabstriche hier mit einbezogen wurden. Wichtig erscheint insbesondere, dass IAI signifikant mit dem gleichzeitigen Bestehen von Pankreasfisteln (45,2%) und Insuffizienzen der Hepatikojejunostomie (63,6%) korreliert haben, was in der Literatur bestätigt wird [89]. Dies wiederum zeigt die entscheidende Bedeutung von Anastomoseninsuffizienzen für die Gesamtmorbidität (mit hoher Reoperationsfrequenz: 25,9% bei IAI) und Letalität (18,5% bei IAI). Intraabdominale Blutungen In der Literatur wird die postoperative intraabdominale Blutung (IAB) fast regelmäßig als Komplikation aufgeführt. Allerdings finden sich nur wenige explizite De55 finitionen einer IAB, insbesondere bezüglich der Quantität bzw. des Transfusionsvolumens [6, 75]. Immerhin 103 der eigenen Patienten (48,6%), also nahezu die Hälfte, benötigten mehr als fünf EK, 51 (24,1%) mehr als sieben und 35 (16,5%) mehr als neun EK perioperativ. 18 Patienten (8,5%) wurden wegen einer Blutung mindestens einmal reoperiert. Der Gesamtanteil von Patienten mit IAB von 17,5% (37 von 212 Patienten) nach der im Methodikteil genannten Definition im selbst untersuchten Kollektiv erscheint im Literaturvergleich relativ hoch (vgl. z.B. Yamaguchi et al.: 3,5% IAB [89], Rumstadt et al.: 7,5% [72], Balladur et al.: 9% [6]). Der Grund dürfte einerseits in der doch sehr ausgedehnten Operation, die eine große Wundfläche bedingt, und andererseits in der nicht selten vorbestehenden Anämie liegen. Beides machte Bluttransfusionen intra- und postoperativ in der deutlichen Mehrzahl der Fälle notwendig. Sicherlich haben in den letzten Jahren außerdem modernere Techniken der intraoperativen Blutstillung wie z.B. die Ultraschalldissektion zur weiteren Senkung des perioperativen Transfusionsbedarfs geführt. Auch ein Rückgang an peptischen Ulzera als Ursache von IAB durch neuere, potentere Medikamente zur Säureblockade des Magens hat möglicherweise zur Reduzierung der Gesamtrate von Blutungskomplikationen nach Whipple´scher OP/PPPD beigetragen. Magenentleerungsstörung Die Magenentleerungsstörung (MES) wird stets ähnlich als Zustand mit deutlich verzögerter oraler Nahrungsaufnahme (mehr als 10 bis 14 Tage), Notwendigkeit des Belassens bzw. Neulegens einer Magensonde und der (zusätzlichen) parenteralen Ernährung definiert [7, 41, 83]. Sie wird in einigen Studien, insbesondere frühpostoperativ, deutlich häufiger nach PPPD als nach klassischer Whipple´scher OP mit distaler Magenresektion (Balcom et al.: 17% vs. 6,1% [5], Jimenez et al.: 33% vs. 12% [41], Patel et al.: 61% vs. 41% [62]), in anderen jedoch auch als ähnlich hoch oder sogar niedriger angegeben [38, 95]. Die Angaben zur Inzidenz reichen von 5 bis 70% und somit schwer evaluierbar. Definitiv zählen MES aber zu den häufigen Komplikationen nach Pankreatoduodenektomien, die als unabhängige Komplikationen in einer Reihe mit Pankreasfisteln, intraabdominalen Infektio56 nen oder Blutungen genannt werden [5, 41]. Bemerkenswert ist dabei, dass sich MES, insbesondere auch nach PPPD, meist nach einigen Tagen bis wenigen Wochen, fast immer jedoch nach sechs bis zwölf Monaten postoperativ zurückbilden [7, 60], es sich also nahezu ausnahmslos um vorübergehende Phänomene handelt. Die Beobachtung, dass eine MES allein aufgrund einer pyloruserhaltenden Operationstechnik wesentlich häufiger als bei der klassischen WOP auftritt, kann durch die eigenen Daten nicht bestätigt werden. Insgesamt 28 von 212 Patienten, d.h. 13,2% zeigten eine postoperative MES nach der eigenen Definition, entsprechend der Mehrzahl der Literaturangaben (Büchler et al.: 14% [22], Jimenez et al.: 12%/33% [41], Horstmann et al.: 12/21% [38]). Dabei waren die in der vorliegenden Betrachtung aufgetretenen Fälle signifikant mit anderen abdominalen Komplikationen assoziiert. Patienten mit einer Pankreasfistel, Insuffizienz der Hepatikojejunostomie, intraabdominaler Infektion, Blutung oder pulmonaler Komplikation hatten jeweils deutlich häufiger eine MES als Patienten ohne diese Komplikationen (mit PF 29% (ohne 6,7%), mit Insuffizienz der HJS 36,4% (ohne 11,9%), mit IAI 35,2% (ohne 5,%), mit IAB 46,7% (ohne 10,7%), mit PK 42,9% (ohne 9,9%)). Insofern scheint eine MES eher als Begleiterscheinung bei Auftreten von schwerwiegenderen abdominalen (oder auch pulmonalen) Komplikationen gewertet werden zu müssen als als Folge eines speziellen Operationsverfahrens. Diese Deutung findet sich auch in der Literatur. So kamen van Berge-Henegouwen et al. nach einer Untersuchung von 200 Patienten zu dem Schluß, dass intraabdominale Komplikationen einen gewichtigen Risikofaktor für das Auftreten einer MES darstellen [83]. Bar-Natan et al. sahen bei 75 von 99 Patienten mit einer MES einen postoperativen „contributing factor“ wie Anastomosenödem/-insuffizienz, Ileus, Pankreatitis, Sepsis oder Multiorganversagen. Gleichzeitig erwähnten sie prädisponierende Faktoren wie Diabetes mellitus, Malnutrition und maligne Grunderkrankung [7]. Auch Horstmann et al. verwiesen auf das nahezu ausschließlich mit anderen postoperativen Komplikationen verbundene Auftreten von MES [38]. Ob man der MES (im Umkehrschluss) sogar einen prädiktiven Wert für das Auftreten von anderen Komplikationen zuschreiben darf oder ob sie als selbständige Komplikation zu betrachten ist, bleibt letztlich fraglich. Eine verlängerte gastrale 57 Atonie dürfte allerdings (als Begleitreaktion) immer kritisch als ein gewisser Indikator (wohl meist im Zusammenhang mit einer dann ebenso bestehenden Darmatonie) für andere postoperative intraabdominale Funktionsstörungen gewertet werden. Insofern ist neben der symptomatischen Behandlung (Entlastung durch Magensonde, medikamentöse Behandlung mit Propulsiva) immer auch die adäquate Therapie der möglicherweise zugrunde liegenden intraabdominalen Funktionsstörung wichtig (z.B. Fokussanierung bei intraabdominaler Infektion, Ileusbehandlung). Die o.g. Risikofaktoren für eine postoperative MES sollten in die präoperative Risikokalkulation miteinbezogen werden. Art der Operation Die von Kausch und Whipple beschriebene Operationstechnik unter Mitentfernung des distalen Magens wurde 1978 durch Traverso und Longmire in Form der pyloruserhaltenden Pankreatoduodenektomie (PPPD) modifiziert [79]. Wesentliche Argumente für die PPPD sind die Vermeidung von Komplikationen in Bezug auf die Magenteilresektion wie Anastomosenulzera und Gallereflux, Diarrhoe und Dumping und der meist bessere postoperative Ernährungsstatus der Patienten, außerdem kürzere Operationszeiten und ein geringerer Blutverlust. Kritiker der Pylorus erhaltenden Methode führen vor allem gehäufte Magenentleerungsstörungen („delayed gastric emptying“) und eine möglicherweise eingeschränkte Radikalität der Operation bei (größeren) Karzinomen aufgrund unzureichender peripylorischer und perigastrischer Lymphadenektomie an, welche in möglicherweise geringeren Überlebenszeiten der Patienten resultieren könnten [62, 71]. Bei der Betrachtung ausgewählter Literatur kann man zusammenfassen: Bis auf die Magenentleerungsstörung, deren Häufigkeit in Abhängigkeit von der Operationsmethode auch in der jüngsten Zeit noch kontrovers diskutiert wird, scheint weitgehende Einigkeit zu bestehen, dass die PPPD keine erhöhte postoperative Morbidität und Letalität nach sich zieht. Aber auch die Langzeitergebnisse bei onkologischen Resektionen durch PPPD sind nicht schlechter als bei der „klassischen“ WOP [63, 65, 76, 78, 81, 95]. 58 Die eigenen Ergebnisse zeigen ebenfalls keine signifikant erhöhte Morbidität, insbesondere keine signifikant häufigeren MES, und auch das Langzeitüberleben war bei den Patienten mit PPPD nicht verringert. Aufgrund der wahrscheinlich günstigeren ernährungsphysiologischen Ergebnisse sollte die PPPD daher gegenüber der WOP bevorzugt werden [60], sofern dabei eine R0-Resektion gewährleistet ist. Inwieweit die Reihenfolge der Anastomosierung von Pankreasstumpf, Ductus hepaticus und postpylorischem Duodenum respektive Magenstumpf mit einer oder mehreren Jejunumschlingen für die postoperative Morbidität (insbesondere für MES) wichtig ist, kann aufgrund der dazu nur relativ spärlich existierenden Daten nicht genauer beurteilt werden. Ebenso scheint es bislang keine definitive, evidenzbasierte Empfehlung zur Technik der Pankreasanastomose zu geben [9, 54]. Einfluss des Operateurs Der Operateur als Einfluss- und Prognosefaktor wird in der chirurgischen Literatur allgemein immer wieder diskutiert („surgeon volume“). Daher wurde auch in der eigenen Arbeit eine Einteilung der Operateure im Sinne der „Erfahrung“ des Operateurs versucht. Die Kriterien, wann ein Operateur als „mehr erfahren“ und wann als „weniger erfahren“ gelten kann, wie dies auch in der Literatur bisweilen vorgenommen wurde, lassen sich nur schwer festlegen. Zunächst erscheint es logisch zu behaupten, dass „erfahrenere“ Operateure die besseren Ergebnisse haben. Bei dem Versuch, die bei den untersuchten Patienten beteiligten Hauptoperateure in zwei Gruppen, nämlich „erfahren“ und „weniger erfahren“, einzuteilen, lässt sich die oben genannte Behauptung allerdings nicht bestätigen. Für die Annahme, die Einteilung wäre zutreffend, erscheint z.B. die höhere Rate an Insuffizienzen der Hepatikojejunostomie bei den weniger erfahrenen Operateuren in der eigenen Untersuchung nachvollziehbar. Die als eindeutig schwieriger geltende Anastomose zwischen Pankreasstumpf und Jejunum würde allerdings ein ähnliches Ergebnis erwarten lassen. Hier ergab sich, bei tendenziell weniger Insuffizienzen bei den „erfahreneren“ Operateuren, jedoch kein signifikanter Unterschied in der postoperativen Fistelhäufigkeit. Auch bezüglich des Auftretens von Magenentleerungsstörungen oder intraabdominalen Infektionen und Blutungen konnten keine signifikan59 ten Zusammenhänge nachgewiesen werden. Diese Ergebnisse zeigen, daß die Definition der Operationsqualität durch die Erfahrung des Operateurs schwierig bleibt, jedenfalls vorsichtig bewertet werden muss, und sicherlich durch eine Vielzahl von Faktoren bestimmt wird. Auch Saettler und Temple verwiesen darauf, dass allein die Anzahl der von einem Chirurgen operierten Patienten die Mortalität bei Pankreasresektionen nicht unabhängig beeinflussen würde, vielmehr müssten andere Kriterien, wie z.Β. das spezielle Training einer Operation, genauer untersucht werden [73]. Lieberman et al. sahen signifikant niedrigere perioperative Letalitätsraten in Krankenhäusern mit großen Patientenzahlen, jedoch keine signifikante Relation der Sterblichkeit zur Erfahrung des Operateurs [50]. Gegen eine Überbewertung personenbezogener Operationsergebnisse spricht auch ein Erfahrungsbericht von Hoshal et al. über Whipple´sche OP und PPPD bei 134 Patienten an einem kommunalen Krankenhaus ohne überdurchschnittlich hohe Morbiditätsund Letalitätsraten [39]. Allerdings konnten Birkmeyer et al. anhand umfangreicher US-amerikanischer Daten (National Medicare claims data base) für das „hospital volume“ (abhängig von der Operation) und insbesondere auch für das „surgeon volume“ (unabhängig von der Operation) eindeutige Zusammenhänge im Sinne einer inversen Relation zwischen Patienten- bzw. Operationsanzahl und Krankenhaus- bzw. 30-Tage-Letalität feststellen. Bei onkologischen Pankreasresektionen lag die operationsbezogene Sterblichkeit in „high volume“ Krankenhäusern und bei „high volume“ Chirurgen jeweils signifikant niedriger als in „low volume“ Einrichtungen bzw. bei „low volume“ Chirurgen [16, 17]. Bedeutung der Gabe von Somatostatin oder Octreotid zur Prophylaxe von Pankreasfisteln Der inhibitorische Effekt von Somatostatin und Octreotid auf die exokrine Pankreassekretion (und die Enzymproduktion) ist unzweifelhaft, wobei unterschiedliche Meinungen über die optimale Dosis bzw. zeitliche Applikation von Octreotid bestehen [19, 21, 40]. Der Einsatz der Substanzen zur Behandlung bzw. Vorbeugung von Pankreasfisteln ist daher nahe liegend. 60 Ein beschleunigter Verschluss bzw. die Prophylaxe von Pankreasfisteln durch eine Therapie mit Somatostatin oder Octreotid im Vergleich zu Kontrollgruppen (konservative Fistelbehandlung ohne Gabe von Somatostatin/Octreotid) wurde mehrfach in (randomisiert-kontrollierten) Studien dargelegt, von vielen Autoren als erwiesen angesehen und entsprechend propagiert [13, 21, 35, 69]. Andere hingegen sahen den positiven Einfluss der prophylaktischen Gabe, aber auch der Anwendung bei bereits existenten Fisteln unterschiedlich bzw. kritisch oder als nicht bewiesen an [40, 53, 91]. Außerdem wird immer wieder auf die Spontanheilungen bzw. allgemeinen konservativen Behandlungsmöglichkeiten verwiesen. Unterschiedliche Angaben finden sich zudem zur Definition einer Pankreasfistel (siehe auch 2.5.1. und 4.1.), zur (optimalen) Dosierung von Octreotid sowie zu Beginn und Dauer der Behandlung. Die Sekretmengen von Pankreasfisteln sollen meist deutlich sinken. Ob Verschlussraten, Heilungszeiten und Gesamtkomplikationsraten reduziert werden, bleibt offen. Nach wie vor werden weitere Studien zur genaueren Einschätzung des Effekts dieser Substanzen bzw. zur Indikation (Prophylaxe/ postoperative Therapie bei manifester Fistel) gefordert [52]. Bis heute scheint der eindeutige Nutzen der Prophylaxe nicht bewiesen. Die eigenen Daten können den Vorteil einer Prophylaxe mit Somatostatin oder Octreotid ebenfalls nicht untermauern. Tendenziell bildeten sogar mehr Patienten mit Somatostatin-/Octreotidprophylaxe Pankreasfisteln aus (35 von 88 Pat. (35,2%) mit Prophylaxe im Gegensatz zu 35 von 124 Pat. (25,0%) ohne prophylaktische Gabe). Reoperationen Reoperationen werden allgemein zumeist wegen Infektions- oder Blutungskomplikationen und postoperativem Ileus notwendig. Die Häufigkeit bei der Whipple´schen OP bzw. PPPD variiert nach Literaturangaben etwa zwischen 1 und 18% [3, 39], wobei die Letalitätsraten im Vergleich zur Primäroperation steigen (23 bis 67%) und Reoperationen einen signifikanten Faktor für die postoperative Letalität darstellen sollen [35]. 61 Von den eigenen 212 Patienten wurden 23 (10,8%) kurzfristig reoperiert, davon verstarben 11, also fast die Hälfte der Patienten innerhalb von 90 Tagen postoperativ. Von den 189 nicht reoperierten Patienten verstarben dagegen nur 10 (5,3%) in den ersten 90 Tagen. Dieser Unterschied ist signifikant (p<0,001) und bestätigt die o.g. Aussagen über die prinzipielle Prognoseverschlechterung bezüglich der Krankenhausletalität bei Reoperation. Von den 38 5-Jahresüberlebenden allerdings wurden fünf (entsprechend 13,2%) frühpostoperativ reoperiert, also relativ sogar mehr als reoperierte Patienten innerhalb von 90 Tagen verstorben waren. Dies spricht gegen einen negativen Einfluss auf das Langzeitüberleben. 4.2. Perioperative Letalität Die perioperative Letalität oder Krankenhausletalität wird in der Literatur mit bis etwa 6% in Zentren, jedoch bis 20% und mehr in nicht spezialisierten Einrichtungen angegeben [2, 3, 35, 39, 47, 67, 74, 75, 85, 89, 92]. Mehrere Autoren verweisen auf sinkende Letalitätsraten in den letzten Jahr(zehnt)en [46, 64, 80], die auf die zunehmende Spezialisierung bzw. Zentralisierung zurückgeführt werden, die deshalb auch immer mehr gefordert werden. Der Begriff „perioperative Letalität“ wird oft nicht genauer definiert. Meist wird diese mit der „Krankenhausletalität“ oder 30-Tage-Letalität gleichgesetzt (entsprechend der Anzahl von Patienten, die innerhalb des postoperativen Krankenhausaufenthaltes an den Komplikationen einer Operation verstirbt). Innerhalb von 30 Tagen postoperativ verstarben von den in der eigenen Studie untersuchten 212 Patienten acht, entsprechend 3,8%. Dieser Prozentsatz liegt im Rahmen der o.g. Angaben von 1-6% perioperativer Letalität. Innerhalb von 60 Tagen verstarben 17 Patienten (8,0%) und innerhalb von 90 Tagen 21 Patienten (9,9%). Die Todesursachen der Patienten, die innerhalb von 90 Tagen postoperativ verstarben, waren jedoch zumeist ebenfalls mit postoperativen Komplikationen assoziiert. Einen Zeitraum von 90 Tagen als „perioperativ“ zu definieren, erscheint daher der operationsbezo62 genen Letalität gerechter zu werden als lediglich eine 30-Tage-Letalität zu betrachten [20]. Es wurde untersucht, ob die Einflussfaktoren, die in Bezug auf die postoperative Morbidität analysiert wurden, auch für die postoperative Sterblichkeit eine Rolle spielten und ob eine höhere Morbidität bzw. größere Anzahl an postoperativen Komplikationen zu einer höheren 90-Tage-Sterblichkeit führte. Entscheidende Ursachen postoperativer Letalität bei den eigenen Patienten waren meist größere chirurgische Komplikationen, vor allem Anastomoseninsuffizienzen (Pankreasfistel, Insuffizienz der Hepatikojejunostomie), intraabdominale Infektionen und Blutungen, R2-Resektionen und Magenentleerungsstörungen, daneben aber insbesondere pulmonale Komplikationen. Andere, nicht chirurgische („systemische“), größere Komplikationen (kardiale, renale, hepatische Insuffizienzen) wurden aufgrund des relativ seltenen Auftretens nicht weiter untersucht. Einzelne Autoren sind allerdings der Meinung, dass diese mit zunehmender Erfahrung und Kompetenz in der Beherrschbarkeit der chirurgischen Komplikationen zukünftig eine größere Rolle spielen werden [22]. Intraabdominale Infektionen und Blutungen scheinen eng assoziiert mit Anastomoseninsuffizienzen (siehe unter 3.1. Morbidität). Ob eine Magenentleerungsstörung als eigene Ursache zu werten ist oder als Folge einer Anastomoseninsuffizienz oder Infektion, bleibt fraglich. Pulmonale Komplikationen stellen bekanntermaßen (auch bei anderen großen abdominalen Eingriffen) immer eine ernste Komplikation dar, wobei auch hier die signifikante Häufung bei Patienten mit intraabdominalen Infektionen und Blutungen bemerkenswert ist. Daraus könnte gefolgert werden, dass pulmonale Komplikationen in der Mehrzahl der Fälle Folge von abdominalen Komplikationen sind. Die genannten Beobachtungen werden in der Literatur bestätigt. So fanden Kim et al. einen signifikanten Einfluss vaskulärer Komplikationen auf die postoperative Letalität, ähnlich wie Böttger et al. [20, 45]. Interessant ist die ungünstige Auswirkung von R2-Resektionen auf den Heilungsverlauf, während die Art der Operation (WOP oder PPPD) und die Erfahrung des Operateurs (hier nur Tendenz ersichtlich) bezüglich der Operationsletalität keine signifikante Rolle spielten. Alter, Geschlecht, Tumorgröße und -differenzierungsgrad, Lymphknotenbefall oder Fernmetastasierung waren ebenso ohne wesentliche Bedeutung. 63 Entscheidend für die Senkung der perioperativen Letalität ist demnach die Vermeidung des intraabdominalen Komplikationenkomplexes Infektion und Blutung, welche zumeist mit einer Anastomoseninsuffizienz in Zusammenhang stehen. 4.3. Langzeitüberleben Tumorbezogene Faktoren Die 5-Jahresüberlebensraten nach Resektionen von Pankreasmalignomen werden weltweit etwa zwischen 5% und 46% angegeben, wobei in diesen Studien unterschiedlich homogene Patientenkollektive betrachtet worden sind [2, 15, 27, 47, 55, 57, 59, 61, 65, 66, 81]. Auch hier wird, wie bei der perioperativen Letalität, auf verbesserte Langzeitergebnisse in den letzten Jahrzehnten [24] und die Wichtigkeit der Spezialisierung bzw. Zentralisierung [4, 16, 17] bei der operativen Behandlung von Pankreaskarzinomen hingewiesen. Im selbst untersuchten Patientengut überlebten 17,8% (38 von 212 resezierten Patienten) fünf Jahre oder länger und 8,5% (18 von 212) zehn Jahre oder länger. Unter den 153 länger als drei Monate und bis fünf Jahre überlebenden Patienten allerdings verstarben fast zwei Drittel (63,9%) innerhalb von zwei Jahren nach der Operation, die große Mehrzahl davon an einem Tumorrezidiv oder -progress. Insbesondere fünf tumorbezogene Faktoren wirkten sich bei univariater Analyse in der eigenen Untersuchung statistisch signifikant auf das Langzeitüberleben aus: 1. Die Tumorlokalisation: Nach dem histologischen Befund gingen die Tumore bei 33 von 38 Patienten (86,9%) von der Papille oder vom distalen Ductus choledochus aus. Die Lokalisation an einem Hauptausführungsgang führt anscheinend häufig zu frühzeitigeren Symptomen und dadurch letztlich zur frühzeitigeren Operation, so dass diese Tumore in einem früheren Stadium therapiert werden konnten. 2. Die Tumorhistologie: Langzeitüberlebende (ÜLZ > fünf Jahre) hatten signifikant seltener muzinöse Adenokarzinome als bis fünf Jahre überlebende Patienten (92,1 64 Adenokarzinome vs. 7,9% muzinöse Adenokarzinome). Dies spricht für ein aggressiveres Verhalten von muzinösen im Vergleich zu nicht muzinösen Tumoren. 3. Die Tumorausdehnung (T-Kategorie): 31 der 38 (81,6%) der Patienten, die fünf Jahre oder länger überlebten, hatten T1- oder T2-Tumore, bei den 174 bis fünf Jahre Überlebenden fanden sich immerhin 35,6% T3-Tumore. Kein Patient mit einem T4-Tumor überlebte fünf Jahre. 4. Der Lymphknotenstatus (N-Kategorie): Bei Patienten, die fünf Jahre oder länger überlebten, zeigten sich signifikant häufiger histologisch tumorfreie Lymphknoten im Präparat (bei 29 von 38 Patienten bzw. 76,4% N0) als bei den übrigen 174 Patienten (40,2% N0). 5. Die Resektionsradikalität (R-Klassifikation): Bei 36 von 38 (94,7%) Patienten, die fünf Jahre oder länger überlebten, wurde der Tumor als histologisch im Gesunden, also mikroskopisch eindeutig ohne Residualtumor reseziert, beschrieben. Hingegen fanden sich nur 63,8% R0-Resektionen bei den übrigen 174 Patienten Die infauste Prognose bei Fernmetastasierung ist hinlänglich bekannt. Immerhin überlebten jedoch drei Patienten mit Fernmetastasen 11, 15 und 24 Monate (Tumorklassifikationen dieser Patienten: T3 N1 M1 G2 R2 bzw. T2 N1 M1 G3 R1 bzw. T2 N1 M1 G2 R1). Dabei könnte hierbei der palliativen Resektion ein positiver Effekt im Sinne einer Reduktion der Tumormasse zugekommen sein (nicht resezierte Patienten mit fortgeschrittenem bzw. metastasiertem Pankreaskarzinom erreichen selten Überlebenszeiten von mehr als sechs Monaten ab dem Zeitpunkt der Diagnose). Die Wichtigkeit tumorabhängiger (histopathologischer) Kriterien für die Langzeitprognose wird in der Literatur immer wieder herausgestellt. Kuhlmann et al. fanden in einer multivariaten Analyse als unabhängige Faktoren für das Überleben Tumorgröße, tumorpositive Lymphknoten sowie nicht-radikale Resektionen (R1/2) und schlechte Tumordifferenzierung, also jeweils tumorbezogene Einflussvariablen [48]. Als unabhängige Faktoren für ein 5-Jahresüberleben nannten ebenso Cleary et al. bei multivariater Betrachtung das Tumorstadium und die Tumordifferenzierung [26]. Dagegen stellten Richter et al. [67] in ihrer multivariaten Analyse (n=194) Patienten nach Whipple´scher Operation einzig die R0-Resektion als signifikant mit einer guten Prognose assoziiert fest. Darüber hinaus war innerhalb dieser 65 Gruppe wiederum der Lymphknotenstatus von prognostischer Relevanz (5-JahresÜberlebensrate von 25,4%, 7-JÜR bzw. 10-JÜR 12,3 bzw. 8,2%). Auf die entscheidende Bedeutung des Tumorsitzes/-ausgangspunktes für die Langzeitprognose, nämlich Ampulla Vateri bzw. intrapankreatischer Ductus choledochus bzw. Duodenum einerseits im Gegensatz zu duktalem Pankreaskopfkarzinom andererseits, verwiesen bereits 1962 Warren et al. [86]. Dies wurde zwischenzeitlich von mehreren Untersuchern bestätigt. Bessere Langzeitprognosen bei periampullären Karzinomen hängen demnach damit zusammen, dass sich diese Tumore oft in einem früheren Tumorstadium aufgrund früherer Symptomatik (Lage an Hauptausführungsgang) präsentieren, daher offensichtlich hohe R0-Resektionsraten erreicht werden können und möglicherweise auch das Lymphabstromgebiet operationstechnisch besser erfasst werden kann [47, 65, 70]. Zahlreiche weitere Autoren berichten über die Bedeutung von Tumorausdehnung, Lymphknotenstatus (bzw. Lymphgefässstatus) sowie R0-Resektion und Grading für ein Langzeitüberleben bei Pankreaskopfmalignomen [10, 15, 27, 44, 55, 57, 85, 93, 94]. Interessant ist allerdings, dass sich bei den Patienten der eigenen Untersuchung, welche fünf oder sogar zehn Jahre überlebten, dennoch kein homogenes Bild ergibt, was die für das Langzeitüberleben allgemein als entscheidend angesehenen tumorbezogenen Prognosefaktoren betrifft. Immerhin hatten acht von 18 Patienten mit zehn Jahren Überlebenszeit einen T2- und zwei weitere einen T3-Tumor, d.h. mehr als die Hälfte in dieser Gruppe hatten Tumore >T1. Weiterhin wurden drei der 18 Patienten positive Lymphknoten, außerdem bei sieben eine nur mäßige und bei vier eine schlechte Tumordifferenzierung konstatiert. Längst nicht bei allen Langzeitüberlebenden trafen also die o.g. prognostisch so wichtigen Faktoren der histopathologischen Klassifikation zu. Diesen Widerspruch diskutierten auch Cooperman [27] und Han et al. [36] anhand von Studienergebnissen. Dass auch Patienten mit fortgeschrittenen Tumorstadien (fehlende Fernmetastasierung vorausgesetzt) und schlechter Differenzierung (T2/3, N+, G3) so lange überlebten, könnte einerseits die entscheidende Wichtigkeit der R0-Resektion unterstreichen, die z.B. von Richter et al., Wagner et al. oder Millikan et al. in jeweils multivariaten Analysen prognosebestimmender Faktoren als einziger bzw. wichtigster Faktor statistische Signifikanz zeigte [57, 67, 85]. Die zwei bei den selbst betrachteten 66 Patienten aufgeführten R1-Resektionen (36 von 38 R0 bei den 5-Jahresüberlebenden, 17 von 18 R0 bei den 10-Jahresüberlebenden) zeigen außerdem, dass die R1-Klassifikation mitunter kritisch zu bewerten ist (bei diesen beiden Tumorresektionen verblieb trotz des definitionsgemäß mikroskopischen Heranreichens des Tumors an den Resektionsrand höchstwahrscheinlich kein Resttumor in situ). Andererseits zeigt sich auch bei dieser Analyse, dass neben der TNM- und R-Klassifikation und dem Grading des Tumors die individuelle und derzeit nicht fassbare Tumorbiologie einen mit entscheidenden Einfluss auf das Langzeitüberleben hat. Operationsbezogene Faktoren Bezüglich der Auswirkung von postoperativen Komplikationen auf das Langzeitüberleben nach den eigenen Daten kann zusammengefasst werden: Wenn Patienten eine Komplikation oder eine Kombination von Komplikationen überlebt haben, waren die jeweiligen Komplikationsereignisse anscheinend im weiteren Verlauf nicht von signifikanter Bedeutung für die Überlebenszeit. Dies berichteten auch Bassi et al. über Patienten, die innerhalb der ESPAC-1 Studie beobachtet wurden [10]. Die Verteilung der Komplikationsereignisse innerhalb der beiden Gruppen langzeitüberlebender Patienten (fünf oder zehn Jahre) war jeweils ähnlich. Im Übrigen waren Alter und Geschlecht sowie die Art der Operation ohne signifikanten Einfluss auf das Langzeitüberleben (vergleiche auch [10, 76]). Von Bedeutung für die Langzeitprognose dürfte hingegen die Gabe von Fremdblutprodukten sein. Seit den 1980er Jahren wird der Einfluss von perioperativen Bluttransfusionen kontrovers diskutiert. Die Hypothese einer negativen Immunmodulation nach onkologischen Operationen wird seitdem zunehmend durch Studienergebnisse untermauert. Neben vielen anderen immunsuppressiven Faktoren, die insbesondere in der perioperativen Stressphase auf (onkologische) Patienten einwirken, stellen anscheinend auch Bluttransfusionen einen solchen Faktor (Mediator) dar, der möglichst vermieden werden sollte [82]. Bezüglich gastrointestinaler Malignome kamen Chung et al. in einem Review von 20 Studien zwischen 1982 und 1990 zu dem Schluss, dass perioperative Bluttransfusionen mit einem erhöh67 ten Rezidivrisiko bei kolorektalen Karzinomen assoziiert sind [25]. Dresner et al. betonten, dass in ihrer multivariaten Analyse von 222 Patienten (nach Ausschluss der perioperativen Mortalität) die Gabe von mehr als vier Transfusionseinheiten neben dem Lymphknotenstatus ein unabhängiger Prognosefaktor für ein signifikant verkürztes Überleben nach radikaler Ösophagusresektion war [31]. Speziell hinsichtlich Pankreastumoren beschrieben Van Geenen et al. in einer univariaten Analyse u.a. eine Verringerung der Überlebenszeit bei Substitution von mehr als vier Einheiten Erythrozytenkonzentraten nach Pankreatoduodenektomien [84]. Als unabhängige Variable für das Überleben nach Pankreasresektionen wird die Anzahl von Bluttransfusionen auch von Sperti et al. genannt [77]. Ebenso als signifikanten unabhängigen Faktor, der die Überlebenszeit verbessert, nannten Millikan et al. und Allema et al. die fehlende Notwendigkeit („absence of intraoperative blood transfusion“) [57] bzw. die „Begrenzung“ perioperativer Transfusionen [2]. Ein vollständiger Verzicht auf perioperative Transfusionen war offensichtlich, auch mit verbesserten Operationstechniken, bei einer so umfangreichen Operation wie der Whipple´schen OP bzw. PPPD, bis zum Ende des Beobachtungszeitraumes 1997 nur in wenigen Fällen möglich. Ein Median von fünf EK und sechs FFP pro Operation bei den selbst untersuchten Patientenverläufen darf wohl als durchaus üblich angenommen werden. Genauere Durchschnittswerte für Bluttransfusionen bei WOP lassen sich aus der Literatur kaum eruieren. Die Anzahl der verabreichten Transfusionseinheiten variierte bei den selbst betrachteten Patienten erheblich. 97,6% bzw. 91,4% der Operierten erhielten mindestens ein EK bzw. FFP. Immerhin fast einem Drittel (68 Pat.) bzw. fast der Hälfte (99 Pat.) wurden sieben oder mehr EK bzw. FFP gegeben, davon wiederum 28 Patienten (13,2%) zehn oder mehr EK bzw. 75 Patienten (35,4%) zehn oder mehr FFP. Die eigenen Ergebnisse deuten ebenso wie die Literaturergebnisse auf ungünstigere Langzeitverlaufe bei Verabreichung größerer Mengen von EK oder FFP perioperativ hin (p=0,021 bei >5EK bzw. p=0,089 bei>6FFP). Diese Ergebnisse unterstreichen die Forderung nach einer möglichst blutungsarmen Operationstechnik. 68 5. Zusammenfassung Die radikale operative Therapie von malignen Tumoren des Pankreaskopfbereichs ist immer noch mit einer hohen postoperativen Morbidität und Letalität verbunden. Von den in dieser Arbeit betrachteten Patienten verstarben 3,8% innerhalb von 30 Tagen bzw. 9,9% innerhalb von 90 Tagen nach der Operation. Die Hauptursachen der Sterblichkeit im Krankenhaus waren vor allem intraabdominale Infektionen (25,5%) und Blutungskomplikationen (17,5%) in Verbindung mit Pankreasfisteln (29,2%), aber auch pulmonale Komplikationen (9,9%). Magenentleerungsstörungen (13,2%) fanden sich signifikant häufiger in Kombination mit anderen Komplikationen, insbesondere bei älteren Patienten. Eine vermehrtes Auftreten bei pyloruserhaltender Operationstechnik, wie in der Literatur immer wieder beschrieben, ließ sich bei den hier untersuchten Patienten nicht finden. Die prophylaktische Gabe von Somatostatin oder Octreotid, die in einigen Studien als protektiv gewertet wird, führte in der eigenen Untersuchung nicht zur Senkung von postoperativen Pankreasfisteln. Die postoperative Morbidität (Gesamtmorbidität 47,2%) hatte keinen signifikanten negativen Einfluß auf die Langzeitprognose der Patienten. Allerdings wurde die perioperative Transfusion von mehr als fünf Erythrozytenkonzentraten im Cox´schen Regressionsmodell als signifikanter negativer Einflussfaktor auf das Überleben gewertet. Das Langzeitüberleben - mindestens fünf bzw. zehn Jahre überlebten 17,9% bzw. 8,5% aller operierten Patienten - wurde im Wesentlichen von tumorbezogenen Faktoren (Tumorgröße und -lokalisation, Lymphknotenstatus, Histologie) und insbesondere von der Resektionsradikalität (R0-Resektion) bestimmt. Patienten mit periampullären Tumoren hatten eine wesentlich bessere Langzeitprognose als Patienten mit duktalen Adenokarzinomen des Pankreaskopfes (29,7% vs. 5,0% 5Jahresüberleben). Dabei ist bemerkenswert, dass sich bei den über fünf Jahre überlebenden Patienten eine relativ inhomogene Verteilung zwischen den T- und NKategorien fand, was vermuten lässt, dass die individuelle Tumorbiologie für das Überleben ebenfalls eine wichtige Rolle spielt. Unvollständige Tumorresektionen (R1/R2) bzw. auch palliative Operationen metastasierter Stadien können in Einzel69 fällen Überlebensverlängerungen im Vergleich zu nicht operierten Patienten bringen. Alter und Geschlecht waren jeweils nicht von signifikanter Bedeutung für die postoperative Morbidität und Letalität und das Langzeitüberleben der betrachteten Patienten. Die Pylorus erhaltende Variante nach Traverso-Longmire zeigte im Vergleich mit der klassischen Operation nach Kausch-Whipple mit Entfernung des distalen Magens bezüglich Komplikationen und Langzeitüberleben ähnliche bzw. gleichwertige Resultate. In Zusammenschau der hier gezeigten Ergebnisse ist zur Verringerung der postoperativen Morbidität und Letalität auch in Zukunft der sorgfältigen Operationstechnik, vor allem einer optimal durchgeführten Pankreasanastomose, größte Aufmerksamkeit zu schenken, um die Entstehung einer Pankreasfistel mit den möglicherweise schwerwiegenden Folgekomplikationen zu verhindern. Die Gabe von Fremdblutprodukten sollte wegen des ungünstigen Einflusses auf die Langzeitprognose so gering wie möglich gehalten werden. Nach wie vor muss eine verbesserte Diagnostik in asymptomatischen bzw. frühen Tumorstadien gefordert werden, um die Prognose der Patienten nachhaltig zu verbessern. 70 6. Literaturverzeichnis [ 1] Adam, U., Makowiec, F., Riediger, H., Scharek, W.D., Benz, S., Hopt, U.T. (2004). Risk factors for complications after pancreatic head resection. Am J Surg 187, 201-208 [ 2] Allema, J.H., Reinders, M.E., van Gulik, T.M., Koelemay, M.J., van Leeuwen, D.J., de Wit, L.T., Gouma, D.J., Obertop H. (1995). Prognostic factors for survival after pancreaticoduodenectomy for patients with carcinoma of the pancreatic head region. Cancer 75, 2069-2076 [ 3] Bakkevold, K.E., Kambestad, B. (1993). Morbidity and mortality after radical and palliative pancreatic cancer surgery. Risk factors influencing the short-term results. Ann Surg 217, 356-368 [ 4] Bachmann, M.O., Alderson, D., Peters, T.J., Bedford, C., Edwards, D., Wotton, S., Harvey, I.M. (2003). Influence of specialization on the management and outcome of patients with pancreatic cancer. Br J Surg 90, 171-177 [ 5] Balcom, J.H., Rattner, D.W., Warshaw, A.L., Chang, Y., Fernandez del Castillo, C. (2001). Ten-year experience with 733 pancreatic resections: chan-ging indications, older patients, and decreasing length of hospitalization. Arch Surg 136, 391-398 [ 6] Balladur, P., Christophe, M., Tiret, E., Parc, R. (1996). Bleeding of the pancreatic stump following pancreatoduodenectomy for cancer. HepatoGastroenterol 43, 268-270 [ 7] Bar-Natan, M., Larson, G.M., Stephens, G., Massey, T. (1996). Delayed gastric emptying after gastric surgery. Am J Surg 172, 24-28 [ 8] Bartels, H. (2006). Präoperative Risikoabschätzung und Operationsvorbereitung in der onkologischen Chirurgie. In J.R. Siewert (Bandherausgeber): Praxis der Viszeralchirurgie. Onkologische Chirurgie. (2. Auflage) Springer Medizin Verlag Heidelberg, 333-339 [ 9] Bartoli, F.G., Arnone, G.B., Ravera, G., Bachi, V. (1991). Pancreatic fistula and relative mortality in malignant disease after pancreaticoduodenectomy. Review and statistical meta-analysis regarding 15 years of literature. Anticancer Research 11, 1831-1848 71 [10] Bassi, C., Stocken, D.D., Olah, A., Friess, H., Buckels, J., Hickey, H., Derveni, C., Dunn, J.A., Deakin, M., Carter, R., Ghaneh, P., Neoptolemos, J.P., Büchler, M.W. (2005). Influence of surgical resection and postoperative complications on survival following adjuvant treatment for pancreatic cancer in the ESPAC-1 randomized controlled trial. Dig Surg 22, 353-363 [11] Bathe, O.F., Caldera, H., Hamilton, K.L., Franceschi, D., Sleeman, D., Livingstone, A.S., Levi, J.U. (2001). Diminished benefit from resection of cancer of the head of the pancreas in patients of advanced age. J Surg Oncol 77, 115-122 [12] Bauer, W., Briner, U., Doepfner, W. (1982). SMS 201-995: A very potent and selective octapeptide analogue of somatostatin with prolonged action. Life Sci 31, 1133-1140 [13] Berberat, P.O., Friess, H., Uhl, W., Büchler, M.W. (1999). The role of octreotide in the prevention of complications following pancreatic resection. Digestion 60 (suppl 2), 15-22 [14] Berdah, S., Panis, Y., Gleizes, V., Sastre, B., Valleur, P. (1997). Reappraisal of pancreaticojejunostomy after Pancreaticoduodenectomy: a report of 86 cases with particular reference to the rate of pancreatic fistulation. Eur J Surg 163, 365-369 [15] Birk, D., Fortnagel, G., Formentini, A., Beger, H.G. (1998). Small carcinoma of the pancreas. Factors of prognostic relevance. J Hepatobiliary Pancreat Surg 5, 450-454 [16] Birkmeyer, J.D., Siewers, A.E., Finlayson, E.V., Stukel, T.A., Lucas, F.L., Batista, I., Welch, H.G., Wennberg, D.E. (2002). Hospital volume and surgical mortality in the United States. N Engl J Med 346, 1128-1137 [17] Birkmeyer, J.D., Stukel, T.A., Siewers, A.E., Finlayson, E.V., Goodney, P.P., Wennberg, D.E., Lucas, F.L. (2003). Surgeon volume and operative mortality in the United States. N Engl J Med 349, 2117-2127 [18] Blair, S.L., Schwarz, R.E. (2001). Advanced age does not contribute to increased risks or poor outcome after major abdominal operations. Am Surg 67, 1123-1127 [19] Boden, G., Sivitz, M.C., Owen, O.E., Essa-Koumar, N., Landor, J.H. (1975). Somatostatin suppresses secretin and pancreatic exocrine secretion. Science 190, 163-165 72 [20] Böttger, Th.C., Engelmann, R., Junginger, T. (1999). Is age a risk factor for major pancreatic surgery? - An analysis of 300 resections. HepatoGastroenterol 46, 2589-2598 [21] Büchler, M., Friess, H., Klempa, I., Hermanek, P., Sulkowski, U., Becker, H., Schafmeyer, A., Baca, I., Lorenz, D., Meister, R., Kremer, B., Wagner, P., Witte, J., Zurmeyer, E.L., Saeger, H.-D., Rieck, B., Dollinger, P., Glaser, K., Teichmann, R., Konradt, J., Gaus, W., Dennler, H.-J., Welzel, D., Beger, H.G. (1992). Role of octreotide in the prevention of postoperative complications following pancratic resection. Am J Surg 163, 125-13 [22] Büchler, M.W., Wagner, M., Schmied, B.M., Uhl, W., Friess, H., Z´graggen, K. (2003). Changes in morbidity after pancreatic resection: toward the end of completion pancreatectomy. Arch Surg 138, 1310-1314 [23] Bühl, A., Zöfel, P. (1995). SPSS für Windows Version 6.1. Praxisorientierte Einführung in die moderne Datenanalyse. 2. Auflage. Addison-Wesley Verlag, 63, 215-237 und 422-431 [24] Cameron, J.L. (1995). Long-term survival following pancreaticoduodenectomy for adenocarcinoma of the head of the pancreas. Surg Clin N Am 75, 939-951 [25] Chung, M., Steinmetz, O.K., Gordon, P.H. (1993). Perioperative blood transfusion and outcome after resection for colorectal carcinoma. Br J Surg 80, 427-432 [26] Cleary, S.P., Gryfe, R., Guindi, M., Greig, P., Smith, L., Mackenzie, R., Strasberg, S., Hanna, S., Taylor, B., Langer, B., Gallinger, S. (2004). Prognostic factors in resected pancreatic adenocarcinoma: analysis of actual 5-year survivors. J Am Coll Surg 198, 722-731 [27] Cooperman, A.M. (2001). Pancreatic cancer: the bigger picture. Surg Clin North Am 81, 557-571 [28] Creutzfeld, W., Lankisch, P.G., Fölsch, U.R. (1975). Hemmung der Sekretin- und Cholecystikinin-Pankreatin-induzierten Saft- und Enzymsekretion des Pankreas und der Gallenblasenkontraktion bei Menschen durch Somatostatin. Dtsch Med Wochenschr 100, 1135-1138 [29] Cullen, J.J., Sarr, M.G., Ilstrup, D.M. (1994). Pancreatic anastomotic leak after pancreaticoduodenectomy: Incidence, significance, and management. Am J Surg 168, 295-298 [30] DiCarlo, V., Balzano, G., Zerbi, A., Villa, E. (1998). Pancreatic cancer resection in elderly patients. Br J Surg 85, 607-610 73 [31] Dresner, S.M., Lamb, P.J., Shenfine, J., Hayes, N., Griffin, S.M. (2000). Prognostic significance of perioperative blood transfusion following radical resection for esophageal carcinoma. Eur J Surg Oncol 26, 492-497 [32] Farnell, M.B., Pearson, R.K., Sarr, M.G., DiMagno, E.P., Burgart, L.J., Dahl, T.R., Foster, N., Sargent, D.J. (2005). A prospective randomized trial comparing standard pancreatoduodenectmy with pancreatoduodenectomy with extended lymphadenectomy in resectable pancreatic head adenocarcinoma. Surgery 138, 618-628 [33] Finlayson, E.V., Birkmeyer, J.D. (2001). Operative mortality with elective surgery in older adults. Eff Clin Pract 4, 172-177 [34] Gerdes, B., Ramaswamy, A., Bartsch, D., Rothmund, M. (2005). Peripyloric lymph node metastasis is a rare condition in carcinoma of the pancreatic head. Pancreas 31, 88-92 [35] Halloran, C.M., Ghaneh, P., Bosonnet, L., Hartley, M.N,., Sutton, R., Neoptolemos, J.P. (2002). Complications of pancreatic cancer resection. Dig Surg 19, 138-146 [36] Han, S.S., Jang, J.Y., Kim, S.W., Kim, W.H., Lee, K.U., Park, Y.H. (2006). Analysis of long-term survivors after surgical resection for pancreatic cancer. Pancreas 32, 271-275 [37] Hermanek, P., Hutter, R.V.P., Sobin, L.H., Wagner, G., Wittekind, Ch. th (Eds.) (1997). TNM Atlas of the UICC. 4 Edition. Springer Verlag Berlin Heidelberg New York, 131-152 [38] Horstmann, O., Markus, P.M., Ghadimi, M.B., Becker, H. (2004). Pylorus preservation has no impact on delayed gastric emptying after pancreatic head resection. Pancreas 28, 69-74 [39] Hoshal, V.L. Jr, Benedict, M.B., David, L.R., Kulick, J. (2004). Personal experience with the Whipple operation: outcomes and lessons learned. Am Surg 70, 121-126 [40] Jenkins, S.A., Nott, D.M., Baxter, J.N. (1995). Fluctuations in the secretion of pancreatic enzymes between consecutive doses of octreotide: implications for the management of fistulae. Eur J Gastroenterol Hepatol 7, 255258 [41] Jimenez, R.E., Fernandez del Castillo, C., Rattner, D.W., Chang, Y, Warshaw, A.L. (2000). Outcome of pancreaticoduodenectomy with pylorus preservation or with antrectomy in the treatment of chronic pancreatitis. Ann Surg 231, 293-300 74 [42] Kausch, W. (1912). Das Carcinom der Papilla duodeni und seine radikale Entfernung. Beitr Klin Chir 78, 439-486 [43] Kazanjian, K.K., Hines, O.J., Eible, G., Reber, H.A. (2005). Management of pancreatic fistulas after pancreaticoduodenectomy: results in 437 consecutive patients. Arch Surg 140, 849-856 [44] Kedra, B., Popiela, T., Sierzega, M., Precht, A. (2001). Prognostic factors of long-term survival after resective procedures for pancreatic cancer. Hepatogastroenterology 48, 1762-1766 [45] Kim, A.W., McCarthy, W.J. 3 , Maxhimer, J.B., Quiros, R.M., Hollinger, E.F., Doolas, A., Millikan, K.W., Deziel, D.J., Godelas, C.V., Prinz, R.A. (2002). Vascular complications associated with pancreatoduodenectomy adversely effect clinical outcome. Surgery 132, 738-747 [46] Klempnauer, J., Ridder, G.J., Bektas, H., Pichlmayr, R. (1995). Multivariate analysis of prognostic factors after resection of ductal pancreatic carcinomas. Langenbecks Arch Chir 380, 133-138 [47] Klempnauer, J., Ridder, G.J., Pichlmayr, R. (1995). Prognostic factors after resection of ampullary carcinoma: multivariate survival analysis in comparison with ductal cancer of the pancreatic head. Br J Surg 82, 16861691 [48] Kuhlmann, K.F., de Castro, S.M., Wesseling, J.G., ten Kate, F.J., Offerhaus, G.J., Busch, o.R., van Gulik, T.M., Obertop, H., Gouma, D.J. (2004). Surgical treatment of pancreatic adenocarcinoma; actual survival and prognostic factors in 343 patients. Eur J Cancer 40, 549-558 [49] Lembcke, B., Creutzfeld, W., Schleser, S., Ebert, R., Shaw, C., Koop, I. (1987). Effect of somatostatin analogon sandostatin (SMS 201-995) on gastrointestinal, pancreatic and biliary function and hormone release in normal men. Digestion 36, 108-124 [50] Lieberman, M.D., Kilburn, H., Lindsay, M., Brennan, M.F. (1995). Relation of perioperative deaths to hospital volume among patients undergoing pancreatic resection for malignancy. Ann Surg 222, 638-645 [51] Lightner, A.M., Glasgow, R.E., Jordan, T.H., Krassner, A.D., Way, L.W., Mulvihill, S.J., Kirkwood, K.S. (2004). Pancreatic resection in the elderly. J Am Coll Surg 198, 697-706 [52] Li-Ling, J., Irving, M. (2001). Somatostatin and octreotide in the prevention of postoperative pancreatic complications and the treatment of entero- rd 75 cutaneous pancreatic fistulas: a systematic review of randomized controlled trials. Br J Surg 88, 190-199 [53] Lowy, A.M., Lee, J.E., Pisters, P.W.T., Davidson, B.S., Fenoglio, C.J., Stanford, P., Jinnah, R., Evans, D.B. (1997). Prospective, randomized trial of octreotide to prevent pancreatic fistula after pancreaticoduodenectomy for malignant disease. Ann Surg 226, 632-641 [54] Marcus, S.G., Cohen, H., Ranson, J.H.C. (1995). Optimal management of the pancreatic remnant after pancreaticoduodenectomy. Ann Surg 221, 635-648 [55] Meyer, W., Jurowich, C., Reichel, M., Steinhauser, B., Wunsch, P.H., Gebhardt, C. (2000). Pathomorphological and histological prognostic factors in curatively resected ductal adenocarcinoma of the pancreas. Surg Today 30, 582-587 [56] Miedema, B.W., Sarr, M.G., van Heerden, J.A., Nagorney, D.M., McIlrath, D.C., Ilstrup, D. (1992). Complications following pancreaticoduodenectomy: Current management. Arch Surg 127, 945-950 [57] Millikan, K.W., Deziel, D.J., Silverstein, J.C., Kanjo, T.M., Christein, J.D., Doolas, A., Prinz, R.A. (1999). Prognostic factors associated with resectable adenocarcinoma of the head of the pancreas. Am Surg 65, 618623 [58] Nguyen, T.C., Sohn, T.A., Cameron, J.L., Lillemoe, K.D., Campbell, K.A., Coleman, J., Sauter, P.K., Abrams, R.A., Hruban, R.H., Yeo, C.J. (2003). Standard vs. radical pancreaticoduodenectomy for periampullary adenocarcinoma: a prospective, randomized trial evaluating quality of life in pancreaticoduodenectomy survivors. J Gastrointest Surg 7, 1-11 [59] Ni, Q.X., Zhang, Q.H., Fu, D.L., Cao, G.H., Yao, Q.Y., Jin, C., Yu, X.J., Zhang, N., Zhang, Y.L. (2002). Curative resection of pancreatic head carcinoma in recent 30 years: report of 377 cases. Hepatobiliary Pancreat Dis Int 1, 126-128 [60] Ogata, Y., Hishinuma, S. (2002). The impact of pylorus-preserving pancrea-toduodenectomy on surgical treatment for cancer of the pancreatic head. J Hepatobiliary Pancreat Surg 9, 223-232 [61] Ozaki, H., Hiraoka, T., Mizumoto, R., Matsuno, S., Matsumoto, Y., Nakayama, T., Tsunoda, T., Suzuki, T., Monden, M., Saitoh, Y., Yamauchi, H., Ogata, Y. (1999). The prognostic significance of lymph node metastasis and intrapancreatic perineural invasion in pancreatic cancer after curative resection. Surg Today 29, 16-22 76 [62] Patel, A.G., Toyama, M.T., Kusske, A.M., Alexander, P., Ashley, S.W., Reber, H.A. (1995). Pylorus-preserving Whipple resection for pancreatic cancer. Is it any better? Arch Surg 130, 838-843 [63] Pirro, N., Sielezneff, I., Cesari, J., Consentino, B., Gregoire, R., Brunet, C., Sastre, B. (2002). Cephalic pancreaticoduodenectomy for adenocarcinoma of the head of the pancreas: does pylorus preservation change morbidity and prognosis? Ann Chir 127, 95-100 [64] Pitt H.A. (1995). Curative treatment for pancreatic neoplasms. Standard resection. Surg Clin N Am 75, 891-904 [65] Qiao, Q.L., Zhao, Y.G., Ye, M.L., Yang, Y.M., Zhao, J.X., Huang, Y.T., Wan, Y.L. (2007). Carcinoma of the ampulla of Vater: factors influencing long-term survival of 127 patients with resection. World J Surg 31, 137-143 [66] Riall, T.S., Cameron, J.L., Lillemoe, K.D., Winter, J.M., Campbell, K.A., Hruban, R.H., Chang, D., Yeo, C.J. (2006). Resected periampullary adenocarcinoma: 5-year survivors and their 6- to 10-year follow-up. Surgery 140, 764-772 [67] Richter, A., Niedergethmann, M., Sturm, J.W., Lorenz, D., Post, S., Trede, M. (2003). Long-term results of partial pancreaticoduodenectomy for ductal adenocarcinoma of the pancreatic head: 25-year experience. World J Surg 27, 324-329 [68] Richter, A., Schwab, M., Lorenz, D., Rumstadt, B., Trede M. (1996). Operative Therapie des Pankreaskarzinoms beim älteren Patienten über 70 Jahre. Langenbecks Arch Chir Suppl II (Kongreßbericht), 492-494 [69] Ridgeway, M.G., Stabile, B.E. (1996). Surgical management and treatment of pancreatic fistulas. Surg Clin N Am 76, 1159-1173 [70] Roder, J.D., Schneider, P.M., Stein, H.J., Siewert, J.R. (1995). Number of lymph node metastases is significantly associated with survival in patients with radically resected carcinoma of the ampulla of Vater. Br J Surg 82, 1693-1696 [71] Roder, J.D., Stein, H.J., Hüttl, W., Siewert, J.R. (1992). Pylorus-preserving versus standard pancreatico-duodenectomy: an analysis of 110 pancreatic and periampullary carcinomas. Br J Surg 79, 152-155 [72] Rumstadt, B., Schwab, M., Korth, P., Samman, M., Trede M. (1998). Hemorrhage after Pancreatoduodenectomy. Ann Surg 227, 236-241 [73] Saettler, E.B., Temple, W.J. (2000). The surgeon as a prognostic factor in the management of pancreatic cancer. Surg Oncol Clin N Am 9, 133-142 77 [74] Schäfer, M., Mullhaupt, B., Clavien, P.A. (2002). Evidence-based pancreatic head resection for pancreatic cancer and chronic pancreatitis. Ann Surg 236, 137-148 [75] Schmidt, C.M., Powell, E.S., Yiannoutsos, C.T., Howard, T.J., Wiebke, E.A., Wiesenauer, C.A., Baumgardner, J.A., Cummings, O.W., Jacobson, L.E., Broadie, T.A., Canal, D.F., Goulet, R.J. Jr, Curie, E.A., Cardenes, H., Watkins, J.M., Loehrer, P.J., Lillemoe, K D., Madura, J.A. (2004). Pancreaticoduodenectomy: a 20-year experience in 516 patients. Arch Surg 139, 718-727 [76] Schoenberg, M.H., Gansauge, F., Kunz, R. (1997). Die Wertigkeit der pyloruserhaltenden partiellen Duodenopankreatektomie beim duktalen Pankreascarcinom. Chirurg 68, 1262-1267 [77] Sperti, C., Pasquali, C., Piccoli, A., Pedrazzoli, S. (1996). Survival after resection for ductal adenocarcinoma of the pancreas. Br J Surg 83, 625631 [78] Takada, T., Yasuda, H., Amano, H., Yoshida, M., Ando, H. (1997). Results of pylorus-preserving pancreatoduodenectomy for pancreatic cancer: A com-parison with results of the Whipple procedure. Hepato-Gastroenterol 44, 1536-1540 [79] Traverso, L.W., Longmire, W.P. (1978). Preservation of the pylorus in pancreaticoduodenectomy. Surg Gynecol Obstet 146, 959-962 [80] Trede, M., Schwall, G., Saeger, H.D. (1990). Survival after pancreatoduodenectomy. 118 consecutive resections without an operative mortality. Ann Surg 211, 447-458 [81] Tsao, J.I., Rossi, R.L., Lowell, J.A. (1994). Pylorus-preserving pancreatoduodenectomy. Is it an adequate cancer operation? Arch Surg 129, 405412 [82] Vallejo, R., Hord, E.D., Barna, S.A., Santiago-Palma, J., Ahmed, S. (2003). Perioperative immunosupression in cancer patients. J Environ Pathol Toxicol Oncol 22, 139-146 [83] van Berge Henegouwen, M.I., van Gulik, T.M., DeWit, L.Th., Allema, J.H., Rauws, E.A.J., Obertop, H., Gouma, D.J. (1997). Delayed gastric emptying after standard pancreaticoduodenectomy versus pylorus-preserving pancreaticoduodenectomy: An analysis of 200 consecutive patients. J Am Coll Surg 185, 373-379 78 [84] van Geenen, R.C., van Gulik, T.M., Offerhaus, G.J., de Wit, L.T., Busch, O.R., Obertop, H., Gouma, D.J. (2001). Survival after pancreatoduodenectomy for periampullary adenocarcinoma: an update. Eur J Surg Oncol 27, 549-557 [85] Wagner, M., Redaelli, C., Lietz, M., Seiler, C.A., Friess, H., Büchler, M.W. (2004). Curative resection is the single most important factor determining outcome in patients with pancreatic adenocarcinoma. Br J Surg 91, 586594 [86] Warren, K.W., Cattell, R.B., Blackburn, J.P., Nora, P.F. (1962). A longterm appraisal of pancreaticoduodenal resection for peri-ampullary carcinoma. Ann Surg 155, 653-662 [87] Whipple, A.O. (1942). Present day surgery of the pancreas. New Engl J Med 226, 515-526 [88] Whipple, A.O., Parsons, W.B., Mullins, C.R. (1935). Treatment of carcinoma of the ampulla of Vater. Ann Surg 102, 763-779 [89] Yamaguchi, K., Tanaka, M., Chijiiwa, K., Nagakawa, T., Imamura, M., Takada, T. (1999). Early and late complications of pylorus-preserving pancrea-toduodenectomy in Japan 1998. Hepatobiliary Pancreat Surg 6, 303311 [90] Yeo, C.D. (1995). Management of complications following pancreaticoduodenectomy. Surg Clin N Am 75, 913-924 [91] Yeo, C.J., Cameron, J.L., Lillemoe, K.D., Sauter, P.K., Coleman, J., Sohn, T. A., Campbell, K.A., Choti, M.A. (2000). Does prophylactic octreotide decrease the rates of pancreatic fistula and other complications after pancreaticoduodenectomy? Results of a prospective randomized placebocontrolled trial. Ann Surg 232, 419-429 [92] Yeo, C.J., Cameron, J.L., Lillemoe, K.D., Sohn, T.A., Campbell, K.A., Sauter, P.K., Coleman, J., Abrams, R.A., Hruban, R.H. (2002). Pancreaticoduoden-ectomy with or without distal gastrectomy and extended retroperitoneal lymphadenectomy for periampullary adenocarcinoma, part 2: randomized controlled trial evaluating survival, morbidity and mortality. Ann Surg 236, 355-368 [93] Yeo, C.J., Cameron, J.L., Sohn, T.A., Lillemoe, K.D., Pitt, H.A., Talamini, M.A., Hruban, R.H., Ord, S.E., Sauter, P.K., Coleman, J., Zahurak, M.L., Grochow, L.B., Abrams, R.A. (1997). Six hundred fifty consecutive pancreaticoduo-denectomies in the 1990s: pathology, complications, and outcomes. Ann Surg 226, 248-257 79 [94] Yoshida, T., Matsumoto, T., Sasaki, A., Morii, Y., Aramaki, M., Kitano, S. (2002). Prognostic factors after pancreatoduodenectomy with extended lymphadenectomy for distal bile duct cancer. Arch Surg 137, 69-73 [95] Zerbi, A., Balzano, G., Patuzzo, R., Calori, G., Braga, M., Di Carlo, V. (1995). Comparison between pylorus-preserving and Whipple pancreatoduodenectomy. Br J Surg 82, 975-979 80 7. Anhang 7.1. Postoperative Morbidität 7.1.1. Pankreasfistel (PF) Tab. A 7.1.1.1.a.: PF und Alter bei OP (drei Altersgruppen) Altersgruppe Pankreasfistel / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit <50 Jahre 26 (89,7) 3 (10,3) 29 (13,7) 50-69 Jahre 94 (67,1) 46 (32,9) 140 (66,0) >69 Jahre 30 (69,8) 13 (30,2) 43 (20,3) 150 (70,8) 62 (29,2) 212 (100,0) Gesamtzahl (%) p=0,052 Tab. A 7.1.1.1.b.: PF und Alter bei OP (zwei Altersgruppen) Altersgruppe Pankreasfistel / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit - 69 Jahre 120 (71,0) 49 (29,0) 169 (79,7) >69 Jahre 30 (69,8) 13 (30,2) 43 (20,3) 150 (70,8) 62 (29,2) 212 (100,0) Gesamtzahl (%) p=0,873 Tab. A 7.1.1.2.: PF und Geschlecht Geschlecht Pankreasfistel / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit männlich 85 (67,5) 41 (32,5) 126 (59,4) Weiblich 65 (75,6) 21 (24,4) 86 (40,6) 150 (70,8) 62 (29,2) 212 (100,0) Gesamtzahl (%) p=0,202 81 Tab. A 7.1.1.3.: PF und Histologie Histologie Pankreasfistel / Anzahl (%) Pat. ohne Adeno-Ca Muzinöses Adeno-Ca Gesamtzahl (%) Gesamtzahl (%) Pat. mit 111 (68,1) 52 (31,9) 163 (76,9) 39 (79,6) 10 (20,4) 49 (23,1) 150 (70,8) 62 (29,2) 212 (100,0) p=0,121 Tab. A 7.1.1.4.: PF und Tumorlokalisation Tumorlokalisation Pankreasfistel / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit Pankreaskopf 86 (85,1) 15 (14,9) 101 (47,6) Papilla Vateri 33 (50,8) 32 (49,2) 65 (30,7) Dist. Ductus choledochus 31 (67,4) 15 (32,6) 46 (21,7) 150 (70,8) 62 (29,2) 212 (100,0) Gesamtzahl (%) P<0,001 Tab. A 7.1.1.5.a.: Pankreasfistel und T-Kategorie (vier T-Gruppen) T-Kategorie Pankreasfistel / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit T1 14 (53,8) 12 (46,2) 26 (12,3) T2 90 (78,9) 24 (21,1) 114 (53,8) T3 44 (63,8) 25 (36,2) 69 (32,5) T4 2 (66,7) 1 (33,3) 3 (1,4) 150 (70,8) 62 (29,2) 212 (100,0) Gesamtzahl (%) p=0,030 Tab. A 7.1.1.5.b.: Pankreasfistel und T-Kategorie (zwei T-Gruppen) T-Kategorie Pankreasfistel / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit T1/2 104 (74,3) 36 (25,7) 140 (66,0) T3/4 46 (63,9) 26 (36,1) 72 (34,0) 150 (70,8) 62 (29,2) 212 (100,0) Gesamtzahl (%) p=0,115 82 Tab. A 7.1.1.6.: Pankreasfistel und N-Kategorie N-Stadium Pankreasfistel / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit N0 70 (70,7) 29 (29,3) 99 (46,7) N1 80 (70,8) 33 (29,2) 113 (53,3) 150 (70,8) 62 (29,2) 212 (100,0) Gesamtzahl (%) p=0,989 Tab. A 7.1.1.7.: Pankreasfistel und M-Kategorie M-Stadium Pankreasfistel / Anzahl (%) Pat. ohne M0 M1 Gesamtzahl (%) Gesamtzahl (%) Pat. mit 146 (70,2) 62 (29,8) 4 (100,0) 0 (0) 150 (70,8) 62 (29,2) 208 (98,1) 4 (1,9) 212 (100,0) p=0,194 Tab. A 7.1.1.8.a.: Pankreasfistel und Grading (drei G-Gruppen) Grading Pankreasfistel / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit G1 27 (73,0) 10 (27,0) 37 (17,5) G2 58 (60,4) 38 (39,6) 96 (45,3) G3 65 (82,3) 14 (17,7) 79 (37,3) 150 (70,8) 62 (29,2) 212 (100,0) Gesamtzahl (%) p=0,006 Tab. A 7.1.1.8.b.: Pankreasfistel und Grading (zwei G-Gruppen) Grading Pankreasfistel / Anzahl (% Pat. ohne Gesamtzahl (%) Pat. mit G1/2 85 (63,9) 48 (36,1) 133 (62,7) G3 65 (82,3) 14 (17,7) 79 (37,3) 150 (70,8) 62 (29,2) 212 (100,0) Gesamtzahl (%) M: p=0,005 83 Tab. A 7.1.1.9.a.: Pankreasfistel und R-Klassifikation (drei R-Gruppen) Residualtumor Pankreasfistel / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit R0 96 (65,3) 51 (34,7) 147 (69,3) R1 46 (88,5) 6 (11,5) 52 (24,5) R2 8 (61,5) 5 (38,5) 13 (6,1) 150 (70,8) 62 (29,2) 212 (100,0) Gesamtzahl (%) p=0,005 Tab. A 7.1.1.9.b.: Pankreasfistel und R-Klassifikation (zwei R-Gruppen) Residualtumor Pankreasfistel / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit R0 96 (65,3) 51 (34,7) 147 (69,3) R1/2 54 (83,1) 11 (16,9) 65 (30,7) 150 (70,8) 62 (29,2) 212 (100,0) Gesamtzahl (%) p=0,009 Tab. A 7.1.1.10.a.: Pankreasfistel und Operationsart (WOP/PPPD) Operationsart Pankreasfistel / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit WOP 108 (74,0) 38 (26,0) 146 (68,9) PPPD 42 (63,6) 24 (36,4) 66 (31,1) 150 (70,8) 62 (29,2) 212 (100,0) Gesamtzahl (%) p=0,126 Tab. A 7.1.1.10.b.: Pankreasfistel und Operationsart (ohne/mit PBV) Pankreas- Pankreasfistel / Anzahl (%) Blindverschluß Pat. ohne Pat. ohne 118 (74,2) 41 (25,8) 159 (75,0) 32 (60,4) 21 (39,6) 53 (25,0) 150 (70,8) 62 (29,2) 212 (100,0) Pat. mit Gesamtzahl (%) Gesamtzahl (%) Pat. mit p=0,055 84 Tab. A 7.1.1.10.c.: Pankreasfistel und Operationsart (WOP/PPPD/PBV) Operationsart Pankreasfistel / Anzahl (%) Pat. ohne Whipple ohne PBV Gesamtzahl (%) Pat. mit 100 (75,8) 32 (24,2) 132 (73,6) Whipple mit PBV 8 (57,1) 6 (42,9) 14 (26,4) Whipple gesamt 108 (74,0) 38 (26,0) 146 (68,9) PPPD ohne PBV 18 (66,7) 9 (33,3) 27 (26,4) PPPD mit PBV 24 (61,5) 15 (38,5) 39 (73,6) PPPD gesamt 42 (63,6) 24 (36,4) 66 (31,1) 150 (70,8) 62 (29,2) 212 (100,0) Gesamtzahl (%) p=0,126 Tab. A 7.1.1.11.: Pankreasfistel und Erfahrung des Operateurs Operateur Pankreasfistel / Anzahl (%) Pat. ohne mehr Erfahrung Pat. mit 135 (71,8) 53 (28,2) 188 (88,7) 15 (62,5) 9 (37,5) 94 (31,8) 150 (70,8) 62 (29,2) 212 (100,0) Weniger Erfahrung Gesamtzahl (%) Gesamtzahl (%) p=0,345 Tab. A 7.1.1.12.a.: Pankreasfistel und Somatostatin-/Octreotidgabe Somatostatin-/ Pankreasfistel / Anzahl (%) Octreotidgabe Pat. ohne Gesamtzahl (%) Pat. mit Pat. ohne 93 (75,0) 31 (25,0) 124 (58,5) Pat. mit 57 (64,8) 31 (35,2) 88 (41,5) 150 (70,8) 62 (29,2) 212 (100,0) Gesamtzahl (%) p=0,107 Tab. A 7.1.1.12.b.: Pankreasfistel und Somatostatin-/Octreotidgabe (ohne Pat. mit PBV) Somatostatin-/ Octreotid- Pankreasfistel / Anzahl (%) gabe (ohne Pat. mit PBV) Pat. ohne Gesamtzahl (%) Pat. mit Pat. ohne 70 (79,5) 18 (20,5) 88 (55,3) Pat. mit 48 (67,6) 23 (32,4) 71 (44,7) 118 (74,2) 41 (25,8) 159 (100,0) Gesamtzahl (%) p=0,087 85 7.1.2. Insuffizienz der Hepatikojejunostomie (IHJS) Tab. A 7.1.2.1.a.: IHJS und Alter bei OP (drei Altersgruppen) Insuffizienz der HJS / Anzahl (%) Altersgruppe 0-49 Jahre Pat. ohne Gesamtzahl (%) Pat. mit 29 (100,0) 0 (0) 29 (13,7) 50-69 Jahre 136 (97,1) 4 (2,9) 140 (66,0) >69 Jahre 36 (83,7) 7 (16,3) 43 (20,3) Gesamtzahl (%) 201 (94,8) 11 (5,2) 212 (100,0) p=0,001 Tab. A 7.1.2.1.b.: IHJS und Alter bei OP (zwei Altersgruppen) Altersgruppe Insuffizienz der HJS / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit - 69 Jahre 165 (97,6) 4 (2,4) 169 (79,7) >69 Jahre 36 (83,7) 7 (16,3) 43 (20,3) 150 (70,8) 62 (29,2) 212 (100,0) Gesamtzahl (%) p=0,002 Tab. A 7.1.2.2.: IHJS und Geschlecht Geschlecht Insuffizienz der HJS / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit Männlich 120 (95,2) 6 (4,8) 126 (59,4) Weiblich 81 (94,2) 5 (5,8) 86 (40,6) 201 (94,8) 11 (5,2) 212 (100,0) Gesamtzahl (%) p=0,735 Tab. A 7.1.2.3.: IHJS und Histologie Histologie Insuffizienz der HJS / Anzahl (%) Pat. ohne Adeno-Ca Muzinöses Adeno-Ca Gesamtzahl (%) Gesamtzahl (%) Pat. mit 155 (95,1) 8 (4,9) 163 (76,9) 46 (93,9) 3 (6,1) 49 (23,1) 201 (94,8) 11 (5,2) 212 (100,0) p=0,737 86 Tab. A 7.1.2.4.: IHJS und Tumorlokalisation Tumorlokalisation Insuffizienz der HJS / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit Pankreaskopf 96 (95,0) 5 (5,0) 101 (47,6) Papilla Vateri 62 (95,4) 3 (4,6) 65 (30,7) Dist. Ductus choledochus 43 (93,5) 3 (6,5) 46 (21,7) 201 (94,8) 11 (5,2) 212 (100,0) Gesamtzahl (%) p=0,895 Tab. A 7.1.2.5.a.: IHJS und T-Kategorie (vier T-Gruppen) T-Kategorie Insuffizienz der HJS / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit T1 24 (92,3) 2 (7,7) 26 (12,3) T2 109 (95,6) 5 (4,4) 114 (53,8) T3 65 (94,2) 4 (5,8) 69 (32,5) T4 Gesamtzahl (%) 3 (100,0) 201 (94,8) 0 (0) 3 (1,4) 11 (5,2) 212 (100,0) p=0,874 Tab. A 7.1.2.5.b.: IHJS und T-Kategorie (zwei T-Gruppen) T-Kategorie Insuffizienz der HJS / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit T1/2 133 (95,0) 7 (5,0) 140 (66,0) T3/4 68 (94,4) 4 (5,6) 72 (34,0) 201 (94,8) 11 (5,2) 212 (100,0) Gesamtzahl (%) p=0,863 Tab. A 7.1.2.6.: IHJS und N-Kategorie N-Katetorie Insuffizienz der HJS / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit N0 93 (93,9) 6 (6,1) 99 (46,7) N1 108 (95,6) 5 (4,4) 113 (53,3) Gesamtzahl (%) 201 (94,8) 11 (5,2) 212 (100,0) p=0,592 87 Tab. A 7.1.2.7.: IHJS und M-Kategorie M-Kategorie M0 M1 Gesamtzahl (%) Insuffizienz der HJS / Anzahl (%) Gesamtzahl (%) Pat. ohne Pat. mit 197 (94,7) 11 (5,3) 208 (98,1) 0 (0) 4 (1,9) 11 (5,2) 212 (100,0) 4 (100,0) 201 (94,8) p=0,637 Tab. A 7.1.2.8.a: IHJS und Grading (drei G-Gruppen) Grading Insuffizienz der HJS / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit G1 36 (97,3) 1 (2,7) 37 (17,5) G2 90 (93,8) 6 (6,2) 96 (45,3) G3 75 (94,9) 4 (5,1) 79 (37,3) 201 (94,8) 11 (5,2) 212 (100,0) Gesamtzahl (%) p=0,709 Tab. A 7.1.2.8.b.: IHJS und Grading (zwei G-Gruppen) Grading Insuffizienz der HJS / Anzahl (% Pat. ohne G1/2 G3 Gesamtzahl (%) Gesamtzahl (%) Pat. mit 126 (94,7) 7 (5,3) 133 (62,7) 75 (94,9) 4 (5,1) 79 (37,3) 201 (94,8) 11 (5,2) 212 (100,0) p=0,949 Tab. A 7.1.2.9.a.: IHJS und R-Klassifikation (drei R-Gruppen) Residualtumor Insuffizienz der HJS / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit R0 138 (93,9) 9 (6,1) 147 (69,3) R1 51 (98,1) 1 (1,9) 52 (24,5) R2 12 (92,3) 1 (7,7) 13 (6,1) 201 (94,8) 11 (5,2) Gesamtzahl (%) p=0,460 88 212 (100,0) Tab. A 7.1.2.9.b.: IHJS und R-Klassifikation (zwei R-Gruppen) Residualtumor Insuffizienz der HJS / Anzahl (%) Pat. ohne R0 R1/2 Gesamtzahl (%) Gesamtzahl (%) Pat. mit 138 (93,9) 9 (6,1) 147 (69,3) 63 (96,9) 2 (3,1) 65 (30,7) 201 (94,8) 11 (5,2) 212 (100,0) p=0,357 Tab. A 7.1.2.10.a.: IHJS und Operationsart (WOP/PPPD) Operationsart Insuffizienz der HJS / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit WOP 140 (95,9) 6 (4,1) 146 (68,9) PPPD 61 (92,4) 5 (7,6) 66 (31,1) 201 (94,8) 11 (5,2) 212 (100,0) Gesamtzahl (%) p=0,292 Tab. A 7.1.2.10.b.: IHJS und Operationsart (ohne/mit PBV) Pankreas- Insuffizienz der HJS / Anzahl (%) Blindverschluß Pat. ohne Pat. ohne 152 (95,6) 7 (4,4) 159 (75,0) 49 (92,5) 4 (7,5) 53 (25,0) 201 (94,8) 11 (5,2) 212 (100,0) Pat. mit Gesamtzahl (%) Gesamtzahl (%) Pat. mit p=0,371 Tab. A 7.1.2.10.c.: IHJS und Operationsart (WOP/PPPD/PBV) Operationsart Insuffizienz der HJS / Anzahl (%) Pat. ohne Whipple ohne PBV Whipple mit PBV Gesamtzahl (%) Pat. mit 126 (95,5) 6 (4,5) 14 (100,0) 0 (0) 132 (73,6) 14 (26,4) Whipple gesamt 140 (95,9) 6 (4,1) 146 (68,9) PPPD ohne PBV 26 (96,3) 1 (3,7) 27 (26,4) PPPD mit PBV 35 (89,7) 4 (10,3) 39 (73,6) PPPD gesamt 61 (92,4) 5 (7,6) 66 (31,1) 201 (94,8) 11 (5,2) 212 (100,0) Gesamtzahl (%) p=0,292 89 Tab. A 7.1.2.11.: IHJS und Erfahrung des Operateurs Operateur / Gruppe Insuffizienz der HJS / Anzahl (%) Pat. ohne mehr Erfahrung Pat. mit 181 (96,3) 7 (3,7) 188 (88,7) 20 (83,3) 4 (16,7) 24 (11,3) Weniger Erfahrung Gesamtzahl (%) Gesamtzahl (%) 201 (94,8) 11 (5,2) 212 (100,0) p=0,007 Tab. A 7.1.2.12.a.: IHJS und Somatostatin-/Octreotidgabe Octreotid- oder Soma- Insuffizienz der HJS / Anzahl (%) tostatinprophylaxe Pat. ohne Pat. ohne 115 (92,7) 9 (7,3) 124 (58,5) 86 (97,7) 2 (2,3) 88 (41,5) 201 (94,8) 11 (5,2) 212 (100,0) Pat. mit Gesamtzahl (%) Gesamtzahl (%) Pat. mit p=0,107 Tab. A 7.1.2.12.b.: IHJS und Somatostatin-/Octreotidgabe (ohne Pat. mit PBV) Somatostatin-/ Octreotid- Insuffizienz der HJS / Anzahl (%) gabe (ohne Pat. mit PBV) Pat. ohne Gesamtzahl (%) Pat. mit Pat. ohne 83 (94,3) 5 (5,7) 88 (55,3) Pat. mit 69 (97,2) 2 (2,8) 71 (44,7) 152 (95,6) 7 (4,4) 159 (100,0) Gesamtzahl (%) p=0,381 7.1.3. Intraabdominale Infektion (IAI) Tab. A 7.1.3.1.a.: IAI und Alter bei OP (drei Altersgruppen) Altersgruppe Intraabdominale Infektion / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit >50 Jahre 26 (89,7) 3 (10,3) 29 (13,7) 50-69 Jahre 101 (72,1) 39 (27,9) 140 (66,0) >69 Jahre 31 (72,1) 13 (27,9) 43 (20,3) 158 (74,5) 54 (25,5) 212 (100,0) Gesamtzahl (%) p=0,132 90 Tab. A 7.1.3.1.b.: IAI und Alter bei OP (zwei Altersgruppen) Altersgruppe Intraabdominale Infektion / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit - 69 Jahre 127 (75,1) 42 (24,9) 169 (79,7) >69 Jahre 31 (72,1) 13 (27,9) 43 (20,3) 158 (74,5) 54 (25,5) 212 (100,0) Gesamtzahl (%) p=0,681 Tab. A 7.1.3.2: IAI und Geschlecht Geschlecht Intraabdominale Infektion / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit Männlich 84 (66,7) 42 (33,3) 126 (59,4) Weiblich 74 (86,0) 12 (14,0) 86 (40,6) 158 (74,5) 54 (25,5) 212 (100,0) Gesamtzahl (%) p=0,002 Tab. A 7.1.3.3.: IAI und Histologie Histologie Intraabdominale Infektion / Anzahl (%) Pat. ohne Adeno-Ca Muzinöses Adeno-Ca Gesamtzahl (%) Gesamtzahl (%) Pat. mit 119 (73,0) 44 (27,0) 163 (76,9) 39 (79,6) 10 (20,4) 49 (23,1) 158 (74,5) 54 (25,5) 212 (100,0) p=0,354 Tab. A 7.1.3.4.: IAI und Tumorlokalisation Tumorlokalisation Intraabdominale Infektion / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit Pankreaskopf 82 (81,2) 19 (18,8) 101 (47,6) Papilla Vateri 41 (63,1) 24 (36,9) 65 (30,7) Dist. Ductus choledochus 35 (76,1) 11 (23,9) 46 (21,7) 158 (74,5) 54 (25,5) 212 (100,0) Gesamtzahl (%) p=0,032 91 Tab. A 7.1.3.5.a.: IAI und T-Kategorie (vier T-Gruppen) T-Kategorie Intraabdominale Infektion / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit T1 20 (76,9) 6 (23,1) 26 (12,3) T2 90 (78,9) 24 (21,1) 114 (53,8) T3 46 (66,7) 23 (33,3) 69 (32,5) T4 2 (66,7) 1 (33,3) 3 (1,4) 158 (74,5) 54 (25,5) 212 (100,0) Gesamtzahl (%) p=0,309 Tab. A 7.1.3.5.b.: IAI und T-Kategorie (zwei T-Gruppen) T-Kategorie Intraabdominale Infektion / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit T1/2 110 (78,6) 30 (21,4) 140 (66,0) T3/4 48 (66,7) 24 (33,3) 72 (34,0) 158 (74,5) 54 (25,5) 212 (100,0) Gesamtzahl (%) p=0,060 Tab. A 7.1.3.6.: IAI und N-Kategorie N-Kategorie Intraabdominale Infektion / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit N0 75 (75,8) 24 (24,2) 99 (46,7) N1 83 (73,5) 30 (26,5) 113 (53,3) 158 (74,5) 54 (25,5) 212 (100,0) Gesamtzahl (%) p=0,701 Tab. A 7.1.3.7.: IAI und M-Kategorie M-Kategorie Intraabdominale Infektion / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit M0 156 (75,0) 52 (25,0) 208 (98,1) M1 2 (50,0) 2 (50,0) 4 (1,9) 158 (75,1) 54 (25,5) 212 (100,0) Gesamtzahl (%) p=0,256 92 Tab. A 7.1.3.8.a: IAI und Grading (drei G-Gruppen) Grading Intraabdominale Infektion / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit G1 32 (86,5) 5 (13,5) 37 (17,5) G2 71 (74,0) 25 (26,0) 96 (45,3) G3 55 (69,6) 24 (30,4) 79 (37,3) 158 (74,5) 54 (25,5) 212 (100,0) Gesamtzahl (%) p=0,149 Tab. A 7.1.3.8.b: IAI und Grading (zwei G-Gruppen) Grading Intraabdominale Infektion / Anzahl (%) Pat. ohne G1/2 G3 Gesamtzahl (%) Gesamtzahl (%) Pat. mit 103 (77,4) 30 (22,6) 133 (62,7) 55 (69,6) 24 (30,4) 79 (37,3) 158 (74,5) 54 (25,5) 212 (100,0) p=0,206 Tab. A 7.1.3.9.a.: IAI und R-Klassifikation (drei R-Gruppen) Residualtumor Intraabdominale Infektion / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit R0 107 (72,8) 40 (27,2) 147 (69,3) R1 39 (75,0) 13 (25,0) 52 (24,5) R2 12 (92,3) 1 (7,7) 13 (6,1) 158 (74,5) 54 (25,5) 212 (100,0) Gesamtzahl (%) p=0,300 Tab. A 7.1.3.9.b.: IAI und R-Klassifikation (zwei R-Gruppen) Residualtumor Intraabdominale Infektion / Anzahl (%) Pat. ohne R0 R1/2 Gesamtzahl (%) Gesamtzahl (%) Pat. mit 107 (72,8) 40 (27,2) 147 (69,3) 51 (78,5) 14 (21,5) 65 (30,7) 158 (74,5) 54 (25,5) 212 (100,0) p=0,382 93 Tab. A 7.1.3.10.a.: IAI und Operationsart (WOP/PPPD) Operationsart Intraabdominale Infektion / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit WOP 114 (78,1) 32 (21,9) 146 (68,9) PPPD 44 (66,7) 22 (33,3) 66 (31,1) 158 (74,5) 54 (25,5) 212 (100,0) Gesamtzahl (%) p=0,077 Tab. A 7.1.3.10.b.: IAI und Operationsart (ohne/mit PBV) Pankreas- Intraabdominale Infektion / Anzahl (%) Blindverschluß Pat. ohne Pat. Ohne 125 (78,6) 34 (21,4) 159 (75,0) 33 (62,3) 20 (37,7) 53 (25,0) 158 (74,5) 54 (25,5) 212 (100,0) Pat. Mit Gesamtzahl (%) Gesamtzahl (%) Pat. mit p=0,018 Tab. A 7.1.3.10.c.: IAI und Operationsart (WOP/PPPD/PBV) Operationsart Intraabdominale Infektion / Anzahl (%) Pat. ohne Whipple ohne PBV Gesamtzahl (%) Pat. mit 105 (79,5) 27 (20,5) 132 (73,6) Whipple mit PBV 9 (64,3) 5 (35,7) 14 (26,4) Whipple gesamt 114 (78,1) 32 (21,9) 146 (68,9) PPPD ohne PBV 20 (70,1) 7 (29,9) 27 (26,4) PPPD mit PBV 24 (61,5) 15 (38,5) 39 (73,6) PPPD gesamt 44 (66,7) 22 (33,3) 66 (31,1) 158 (74,5) 54 (25,5) 212 (100,0) Gesamtzahl (%) p=0,077 Tab. A 7.1.3.11.: IAI und Erfahrung des Operateurs Operateur / Gruppe Intraabdominale Infektion / Anzahl (%) Pat. ohne mehr Erfahrung Weniger Erfahrung Gesamtzahl (%) Gesamtzahl (%) Pat. mit 142 (75,5) 46 (24,5) 188 (88,7) 16 (66,6) 8 (33,3) 24 (11,3) 158 (74,5) 54 (25,5) 212 (100,0) p=0,348 94 Tab. A 7.1.3.12.a: IAI und Somatostatin-/Octreotidgabe Somatostatin-/ Intraabdominale Infektion / Anzahl (%) Octreotidgabe Pat. ohne Gesamtzahl (%) Pat. mit Pat. ohne 96 (77,7) 28 (22,6) 124 (58,5) Pat. mit 62 (70,5) 26 (29,5) 88 (41,5) 158 (74,5) 54 (25,5) 212 (100,0) Gesamtzahl (%) p=0,252 Tab. A 7.1.3.12.b.: IAI und Somatostatin-/Octreotidgabe (Pat. ohne/mit PBV) Somatostatin-/ Octreotid- Intraabdominale Infektion / Anzahl (%) gabe (ohne Pat. mit PBV) Pat. ohne Gesamtzahl (%) Pat. mit Pat. ohne 83 (94,3) 5 (5,7) 88 (55,3) Pat. mit 69 (97,2) 2 (2,8) 71 (44,7) 152 (95,6) 7 (4,4) 159 (100,0) Gesamtzahl (%) p=0,381 Tab. A 7.1.3.13.: IAI und Pankreasfistel Pankreasfistel Intraabdominale Infektion / Anzahl (%) Pat. ohne Pat. ohne Pat. mit Gesamtzahl (%) Gesamtzahl (%) Pat. mit 124 (82,7) 26 (17,3) 150 (70,8) 34 (54,8) 28 (45,2) 62 (29,2) 158 (74,5) 54 (25,5) 212 (100,0) P<0,001 Tab. A 7.1.3.14.: IAI und Insuffizienz der Hepatikojejunostomie Insuffizienz der HJS Intraabdominale Infektion / Anzahl (%) Pat. ohne Pat. ohne Pat. mit Gesamtzahl (%) Gesamtzahl (%) Pat. mit 154 (76,6) 47 (23,4) 201 (94,8) 4 (36,4) 7 (63,6) 11 (5,2) 158 (74,5) 54 (25,5) 212 (100,0) p=0,003 95 7.1.4. Intraabdominale Blutung (IAB) Tab. A 7.1.4.1.a.: IAB und Alter bei OP (drei Altersgruppen) Altersgruppe Intraabdominale Blutung / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit >50 Jahre 27 (93,1) 2 (6,9) 29 (13,7) 50-69 Jahre 129 (92,1) 11 (7,9) 140 (66,0) >69 Jahre 41 (95,3) 2 (4,7) 43 (20,3) 158 (74,5) 54 (25,5) 212 (100,0) Gesamtzahl (%) p=0,773 Tab. A 7.1.4.1.b.: IAB und Alter bei OP (zwei Altersgruppen) Altersgruppe Intraabdominale Blutung / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit - 69 Jahre 129 (92,1) 11 (7,9) 140 (66,0) >69 Jahre 41 (95,3) 2 (4,7) 43 (20,3) 158 (74,5) 54 (25,5) 212 (100,0) Gesamtzahl (%) p=0,773 Tab. A 7.1.4.2.: IAB und Geschlecht Geschlecht Intraabdominale Blutung / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit Männlich 114 (90,5) 12 (9,5) 126 (59,4) Weiblich 83 (96,5) 3 (3,5) 86 (40,6) 197 (92,9) 15 (7,1) 212 (100,0) Gesamtzahl (%) p=0,092 Tab. A 7.1.4.3.: IAB und Histologie Histologie Intraabdominale Blutung / Anzahl (%) Pat. ohne Adeno-Ca Muzinöses Adeno-Ca Gesamtzahl (%) Gesamtzahl (%) Pat. mit 153 (93,9) 10 (6,1) 44 (89,8) 5 (10,2) 197 (92,9) 15 (7,1) p=0,330 96 163 (76,9) 49 (23,1) 212 (100,0) Tab. A 7.1.4.4.: IAB und Tumorlokalisation Tumorlokalisation Intraabdominale Blutung / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit Pankreaskopf 95 (94,1) 6 (5,9) 101 (47,6) Papilla Vateri 60 (92,3) 5 (7,7) 65 (30,7) Dist. Ductus choledochus 42 (91,3) 4 (8,7) 46 (21,7) 197 (92,9) 15 (7,1) 212 (100,0) Gesamtzahl (%) p=0,811 Tab. A 7.1.4.5.a.: IAB und T-Kategorie (vier T-Gruppen) T-Kategorie Intraabdominale Blutung / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit T1 25 (96,2) 1 (3,8) 26 (12,3) T2 106 (93,0) 8 (7,0) 114 (53,8) T3 63 (91,3) 6 (8,7) 69 (32,5) T4 Gesamtzahl (%) 3 (100,0) 197 (92,9) 0 (0) 3 (1,4) 15 (7,1) 212 (100,0) p=0,821 Tab. A 7.1.4.5.b.: IAB und T-Kategorie (zwei T-Gruppen) T-Kategorie Intraabdominale Blutung / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit T1/2 131 (93,6) 9 (6,4) 140 (66,0) T3/4 66 (91,7) 6 (8,3) 72 (34,0) 197 (92,9) 15 (7,1) 212 (100,0) Gesamtzahl (%) p=0,609 Tab. A 7.1.4.6.: IAB und N-Kategorie N-Kategorie Intraabdominale Blutung / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit N0 90 (90,9) 9 (9,1) 99 (46,7) N1 107 (94,7) 6 (5,3) 113 (53,3) Gesamtzahl (%) 197 (92,9) 15 (7,1) 212 (100,0) p=0,284 97 Tab. A 7.1.4.7.: IAB und M-Kategorie M-Kategorie Intraabdominale Blutung / Anzahl (%) Pat. ohne M0 M1 Gesamtzahl (%) Gesamtzahl (%) Pat. mit 193 (92,8) 4 (100,0) 197 (92,9) 15 (7,2) 208 (98,1) 0 (0) 4 (1,9) 15 (7,1) 212 (100,0) p=0,577 Tab. A 7.1.4.8.a.: IAB und Grading (drei G-Gruppen) Grading Intraabdominale Blutung / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit G1 37 (100,0) 0 (0) 37 (17,5) G2 89 (92,7) 7 (7,3) 96 (45,3) G3 71 (89,9) 8 (10,1) 79 (37,3) Gesamtzahl (%) 197 (92,9) 15 (7,1) 212 (100,0) p=0,139 Tab. A 7.1.4.8.b.: IAB und Grading (zwei G-Gruppen) Grading Intraabdominale Blutung / Anzahl (%) Pat. ohne G1/2 G3 Gesamtzahl (%) Gesamtzahl (%) Pat. mit 126 (94,7) 7 (5,3) 133 (62,7) 71 (89,9) 8 (10,1) 79 (37,3) 197 (92,9) 15 (7,1) 212 (100,0) p=0,182 Tab. A 7.1.4.9.a.: IAB und R-Klassifikation (drei R-Gruppen) Residualtumor Intraabdominale Blutung / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit R0 135 (91,8) 12 (8,2) 147 (69,3) R1 51 (98,1) 1 (1,9) 52 (24,5) R2 11 (84,6) 2 (15,4) 13 (6,1) Gesamtzahl (%) 197 (92,9) 15 (7,1) p=0,155 98 212 (100,0) Tab. A 7.1.4.9.b.: IAB und R-Klassifikation (zwei R-Gruppen) Residualtumor Intraabdominale Blutung / Anzahl (%) Pat. ohne R0 R1/2 Gesamtzahl (%) Gesamtzahl (%) Pat. mit 135 (91,8) 12 (8,2) 147 (69,3) 62 (95,4) 3 (4,6) 65 (30,7) 197 (92,9) 15 (7,1) 212 (100,0) p=0,353 Tab. A 7.1.4.10.a.: IAB und Operationsart (WOP/PPPD) Operationsart Intraabdominale Blutung / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit WOP 132 (90,4) 14 (9,6) 146 (68,9) PPPD 65 (98,5) 1 (1,5) 66 (31,1) 197 (92,9) 15 (7,1) 212 (100,0) Gesamtzahl (%) p=0,034 Tab. A 7.1.4.10.b.: IAB und Operationsart (ohne/mit PBV) Pankreas- Intraabdominale Blutung / Anzahl (%) Blindverschluß Pat. ohne Pat. ohne 145 (91,2) 14 (8,8) 159 (75,0) 52 (98,1) 1 (1,9) 53 (25,0) 197 (92,9) 15 (7,1) 212 (100,0) Pat. mit Gesamtzahl (%) Gesamtzahl (%) Pat. mit p=0,089 Tab. A 7.1.4.10.c.: IAB und Operationsart (WOP/PPPD/PBV) Operationsart Intraabdominale Blutung / Anzahl (%) Pat. ohne Whipple ohne PBV Gesamtzahl (%) Pat. mit 119 (90,2) 13 (9,8) 132 (73,6) Whipple mit PBV 13 (92,9) 1 (7,1) 14 (26,4) Whipple gesamt 132 (90,4) 14 (9,6) 146 (68,9) PPPD ohne PBV 26 (96,3) 1 (3,7) 27 (26,4) PPPD mit PBV 39 (100,0) 0 (0) 39 (73,6) PPPD gesamt 65 (98,5) 1 (1,5) 66 (31,1) 197 (92,9) 15 (7,1) 212 (100,0) Gesamtzahl (%) p=0,034 99 Tab. A 7.1.4.11.: IAB und Erfahrung des Operateurs Operateur / Gruppe Intraabdominale Blutung / Anzahl (%) Pat. ohne mehr Erfahrung Weniger Erfahrung Gesamtzahl (%) Gesamtzahl (%) Pat. mit 175 (93,1) 13 (6,9) 188 (88,7) 22 (91,7) 2 (8,3) 24 (11,3) 158 (74,5) 54 (25,5) 212 (100,0) p=0,799 Tab. A 7.1.4.12.a.: IAB und Somatostatin-/Octreotidgabe Somatostatin-/ Insuffizienz der HJS / Anzahl (%) Octreotidgabe Pat. ohne Pat. ohne 115 (92,7) 9 (7,3) 124 (58,5) 82 (93,2) 6 (6,8) 88 (41,5) 197 (92,9) 15 (7,1) 212 (100,0) Pat. mit Gesamtzahl (%) Gesamtzahl (%) Pat. mit p=0,902 Tab. A 7.1.4.12.b.: IAB und Somatostatin-/Octreotidgabe (ohne Pat. mit PBV) Somatostatin-/ Insuffizienz der HJS / Anzahl (%) Octreotidgabe Pat. ohne Gesamtzahl (%) Pat. mit Pat. ohne 80 (90,9) 8 (9,1) 88 (55,3) Pat. mit 65 (91,5) 6 (8,5) 71 (44,7) 145 (91,2) 14 (8,8) 159 (100,0) Gesamtzahl (%) p=0,887 Tab. A 7.1.4.13.: IAB und Pankreasfistel Pankreasfistel Intraabdominale Blutung / Anzahl (%) Pat. ohne Pat. ohne Pat. mit Gesamtzahl (%) Gesamtzahl (%) Pat. mit 145 (96,7) 5 (3,3) 150 (70,8) 52 (83,9) 10 (16,1) 62 (29,2) 197 (92,9) 15 (7,1) 212 (100,0) p=0,001 100 Tab. A 7.1.4.14.: IAB und Insuffizienz der HJS Insuffizienz der HJS Intraabdominale Blutung / Anzahl (%) Pat. ohne Pat. ohne Pat. mit Gesamtzahl (%) Gesamtzahl (%) Pat. mit 187 (93,0) 14 (7,0) 201 (94,8) 10 (90,9) 1 (9,1) 1 (5,2) 197 (92,9) 15 (7,1) 212 (100,0) p=0,789 Tab. A 7.1.4.15.: IAB und intraabdominale Infektion Intraabdominale Infektion Intraabdominale Blutung / Anzahl (%) Pat. ohne Pat. ohne Pat. mit Gesamtzahl (%) Gesamtzahl (%) Pat. mit 151 (95,6) 7 (4,4) 158 (74,5) 46 (85,2) 8 (14,8) 54 (25,5) 197 (92,9) 15 (7,1) 212 (100,0) p=0,010 7.1.5. Magenentleerungsstörungen (MES) Tab. A 7.1.5.1.a: MES und Alter bei OP (drei Altersgruppen) Altersgruppe Magenentleerungsstörung / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit >50 Jahre 28 (96,6) 1 (3,4) 29 (13,7) 50-69 Jahre 123 (87,9) 17 (12,1) 140 (66,0) >69 Jahre 33 (76,7) 10 (23,3) 43 (20,3) 184 (86,8) 28 (13,2) 212 (100,0) Gesamtzahl (%) p=0,042 Tab. A 7.1.5.1.b.: MES und Alter bei OP (zwei Altersgruppen) Altersgruppe Magenentleerungsstörung / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit - 69 Jahre 151 (89,4) 18 (10,6) 169 (79,7) >69 Jahre 33 (76,7) 10 (23,3) 43 (20,3) 158 (74,5) 54 (25,5) 212 (100,0) Gesamtzahl (%) p=0,029 101 Tab. A 7.1.5.2.: MES und Geschlecht Geschlecht Magenentleerungsstörung / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit Männlich 109 (86,5) 17 (13,5) 126 (59,4) Weiblich 75 (87,2) 11 (12,8) 86 (40,6) 184 (86,8) 28 (13,2) 212 (100,0) Gesamtzahl (%) p=0,882 Tab. A 7.1.5.3.: MES und Histologie Histologie Magenentleerungstörung / Anzahl (%) Pat. ohne Adeno-Ca Muzinöses Adeno-Ca Gesamtzahl (%) Gesamtzahl (%) Pat. mit 143 (87,7) 20 (12,3) 163 (76,9) 41 (83,7) 8 (16,3) 49 (23,1) 184 (86,8) 28 (13,2) 212 (100,0) p=0,462 Tab. A 7.1.5.4.: MES und Tumorlokalisation Tumorlokalisation Magenentleerungsstörung / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit Pankreaskopf 93 (92,1) 8 (7,9) 101 (47,6) Papilla Vateri 53 (81,5) 12 (18,5) 65 (30,7) Dist. Ductus choledochus 38 (82,6) 8 (17,4) 46 (21,7) 184 (86,8) 28 (13,2) 212 (100,0) Gesamtzahl (%) p=0,094 Tab. A 7.1.5.5.a.: MES und T-Kategorie (vier T-Gruppen) T-Kategorie Magenentleerungsstörung / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit T1 21 (80,8) T2 104 (91,2) 10 (8,8) 114 (53,8) T3 58 (84,1) 11 (15,9) 69 (32,5) T4 1 (33,3) 2 (66,7) 3 (1,4) 184 (86,8) 28 (13,2) 212 (100,0) Gesamtzahl (%) 5 (19,2) p=0,013 102 26 (12,3) Tab. A 7.1.5.5.b.: MES und T-Kategorie (zwei T-Gruppen) T-Kategorie Magenentleerungsstörung / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit T1/2 125 (89,3) 15 (10,7) 140 (66,0) T3/4 59 (32,1) 13 (18,1) 72 (34,0) 184 (86,6) 28 (7,1) 212 (100,0) Gesamtzahl (%) p=0,135 Tab. A 7.1.5.6.: MES und N-Kategorie N-Kategorie Magenentleerungsstörung / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit N0 88 (88,9) 11 (11,1) 99 (46,7) N1 96 (85,0) 17 (15,0) 113 (53,3) 184 (86,6) 28 (13,2) 212 (100,0) Gesamtzahl (%) p=0,399 Tab. A 7.1.5.7.: MES und M-Kategorie M-Kategorie Magenentleerungsstörung / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit M0 181 (87,0) 27 (13,0) 208 (98,1) M1 3 (75,0) 1 (25,0) 4 (1,9) 184 (86,8) 28 (13,2) 212 (100,0) Gesamtzahl(%) p=0,482 Tab. A 7.1.5.8.a: MES und G-Kategorie (drei G-Gruppen) Grading Magenentleerungsstörung / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit G1 33 (89,2) 4 (10,8) 37 (17,5) G2 84 (87,5) 12 (12,5) 96 (45,3) G3 67 (84,8) 12 (15,2) 79 (37,3) 184 (86,8) 28 (13,2) 212 (100,0) Gesamtzahl (%) p=0,780 103 Tab. A 7.1.5.8.b.: MES und Grading (zwei G-Gruppen) Grading Magenentleerungsstörung / Anzahl (%) Pat. ohne G1/2 G3 Gesamtzahl (%) Gesamtzahl (%) Pat. mit 117 (87,9) 16 (12,1) 133 (62,7) 67 (84,8) 12 (15,2) 79 (37,3) 197 (92,9) 15 (7,1) 212 (100,0) p=0,511 Tab. A 7.1.5.9.a.: MES und R-Klassifikation (drei Gruppen) Residualtumor Magenentleerungsstörung / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit R0 123 (83,7) 24 (16,3) 147 (69,3) R1 48 (92,3) 4 (7,7) 52 (24,5) R2 13 (100,0) 0 (0) 13 (6,1) Gesamtzahl (%) 184 (86,8) 28 (13,2) 212 (100,0) p=0,010 Tab. A 7.1.5.9.b.: MES und R-Klassifikation (zwei R-Gruppen) Residualtumor Magenentleerungsstörung / Anzahl (%) Pat. ohne R0 R1/2 Gesamtzahl (%) Gesamtzahl (%) Pat. mit 123 (83,7) 24 (16,3) 147 (69,3) 61 (93,8) 4 (6,2) 65 (30,7) 184 (86,8) 15 (7,1) 212 (100,0) p=0,044 Tab. A 7.1.5.10.a.: MES und Operationsart (WOP/PPPD) Operationsart Magenentleerungsstörung / Anzahl (%) Pat. ohne Whipple gesamt PPPD gesamt Gesamtzahl (%) Gesamtzahl (%) Pat. mit 127 (87,0) 19 (13,0) 146 (68,9) 57 (86,4) 9 (13,6) 66 (31,1) 184 (86,8) 28 (13,2) 212 (100,0) p=0,901 104 Tab. A 7.1.5.10.b.: MES und Operationsart (ohne/mit PBV) Pankreas- Magenentleerungsstörung / Anzahl (%) Blindverschluß Pat. ohne Pat. Ohne 139 (87,4) 20 (12,6) 159 (75,0) 45 (84,9) 8 (15,1) 53 (25,0) 184 (86,8) 28 (13,2) 212 (100,0) Pat. Mit Gesamtzahl (%) Gesamtzahl (%) Pat. mit p=0,640 Tab. A 7.1.5.10.c.: MES und Operationsart (WOP/PPPD/PBV) Operationsart Magenentleerungsstörung / Anzahl (%) Pat. ohne Whipple ohne PBV Gesamtzahl (%) Pat. mit 115 (87,1) 17 (12,9) 132 (73,6) Whipple mit PBV 12 (85,7) 2 (14,3) 14 (26,4) Whipple gesamt 127 (87,0) 19 (13,0) 146 (68,9) PPPD ohne PBV 24 (88,9) 3 (11,1) 27 (26,4) PPPD mit PBV 33 (84,6) 6 (15,4) 39 (73,6) PPPD gesamt 57 (86,4) 9 (13,6) 66 (31,1) 184 (86,8) 28 (13,2) 212 (100,0) Gesamtzahl (%) p=0,901 Tab. A 7.1.5.11.: MES und Erfahrung des Operateurs Operateur / Gruppe Magenentleerungsstörung / Anzahl (%) Pat. ohne mehr Erfahrung Weniger Erfahrung Gesamtzahl (%) Gesamtzahl (%) Pat. mit 165 (87,8) 23 (12,2) 188 (88,7) 19 (79,2) 5 (20,8) 24 (11,3) 184 (86,8) 28 (13,2) 212 (100,0) p=0,241 Tab. A 7.1.5.12.a.: MES und Somatostatin-/Octreotidgabe Somatostatin-/ Magenentleerungsstörung / Anzahl (%) Octreotidgabe Pat. ohne Pat. Ohne 109 (87,9) 15 (12,1) 124 (58,5) 75 (85,2) 13 (14,8) 88 (41,5) 184 (86,8) 28 (13,2) 212 (100,0) Pat. Mit Gesamtzahl (%) Gesamtzahl (%) Pat. mit p=0,571 105 Tab. A 7.1.5.12.b.: MES und Somatostatin-/Octreotidgabe (ohne Pat. mit PBV) Somatostatin-/ Magenentleerungsstörung / Anzahl (%) Octreotidgabe Pat. ohne Gesamtzahl (%) Pat. mit Pat. Ohne 76 (86,4) 12 (13,6) 88 (55,3) Pat. Mit 63 (88,7) 8 (11,3) 71 (44,7) 139 (87,4) 20 (12,6) 159 (100,0) Gesamtzahl (%) p=0,654 Tab. A 7.1.5.13.: MES und Pankreasfistel Pankreasfistel Magenentleerungsstörung / Anzahl (%) Pat. ohne Pat. Ohne Pat. Mit Gesamtzahl (%) Gesamtzahl (%) Pat. mit 140 (93,3) 10 (6,7) 150 (70,8) 44 (71,0) 18 (29,0) 62 (29,2) 184 (86,8) 28 (13,2) 212 (100,0) P<0,001 Tab. A 7.1.5.14.: MES und Insuffizienz der HJS Insuffizienz der Magenentleerungsstörung / Anzahl (%) Hepatikojejunostomie Pat. ohne Pat. Ohne 177 (88,1) 24 (11,9) 201 (94,8) 7 (63,6) 4 (36,4) 11 (5,2) 184 (86,8) 28 (13,2) 212 (100,0) Pat. Mit Gesamtzahl (%) Gesamtzahl (%) Pat. mit p=0,010 Tab. A 7.1.5.15.: MES und intraabdominale Infektion Intraabdominale Infektion Magenentleerungsstörung / Anzahl (%) Pat. ohne Pat. Ohne Pat. Mit Gesamtzahl (%) Gesamtzahl (%) Pat. mit 149 (94,3) 9 (5,7) 158 (74,5) 35 (64,8) 19 (35,2) 54 (25,5) 184 (86,8) 28 (13,2) 212 (100,0) P<0,001 106 Tab. A 7.1.5.16.: MES und intraabdominale Blutung Intraabdominale Blutung Magenentleerungsstörung / Anzahl (%) Pat. ohne Pat. Ohne Pat. Mit Gesamtzahl (%) Gesamtzahl (%) Pat. mit 176 (89,3) 21 (10,7) 197 (92,9) 8 (53,3) 7 (46,7) 15 (7,2) 184 (86,8) 28 (13,2) 212 (100,0) P<0,001 Tab. A 7.1.5.17.: MES und pulmonale Komplikationen Pulmonale Magenentleerungsstörung / Anzahl (%) Komplikationen Pat. ohne Pat. Ohne 172 (90,1) Pat. Mit Gesamtzahl (%) Gesamtzahl (%) Pat. mit 19 (9,9) 191 (90,1) 12 (57,1) 9 (42,9) 21 (9,9) 184 (86,8) 28 (13,2) 212 (100,0) P<0,001 7.1.6. Pulmonale Komplikationen (PK) Tab. A 7.1.6.1.a.: PK und Alter bei OP (drei Altersgruppen) Altersgruppe Pulmonale Komplikation / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit >50 Jahre 27 (93,1) 2 (6,9) 29 (13,7) 50-69 Jahre 126 (90,0) 14 (10,0) 140 (66,0) >69 Jahre 38 (88,4) 5 (11,6) 43 (20,3) Gesamtzahl (%) 191 (90,1) 21 (9,9) 212 (100,0) p=0,803 Tab. A 7.1.6.1.b.: PK und Alter bei OP (zwei Altersgruppen) Altersgruppe Pulmonale Komplikation / Anzahl (%) Pat. ohne - 69 Jahre 153 (90,5) >69 Jahre 38 (88,4) Gesamtzahl (%) Gesamtzahl (%) Pat. mit 16 (9,5) 5 (11,6) 191 (90,1) 21 (9,9) p=0,672 107 169 (79,7) 43 (20,3) 212 (100,0) Tab. A 7.1.6.2.: PK und Geschlecht Geschlecht Pulmonale Komplikation / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit Männlich 113 (89,7) 13 (10,3) 126 (59,4) Weiblich 78 (90,7) 8 (9,3) 86 (40,6) 191 (90,1) 21 (9,9) 212 (100,0) Gesamtzahl (%) p=0,808 Tab. A 7.1.6.3.: PK und Histologie Histologie Adeno-Ca Muzinöses Adeno-Ca Gesamtzahl (%) Pulmonale Komplikation / Anzahl (%) Pat. ohne Pat. mit 148 (90,8) 15 (9,2) 43 (87,8) 6 (12,2) 191 (90,1) 21 (9,9) Gesamtzahl (%) 163 (76,9) 49 (23,1) 212 (100,0) p=0,532 Tab. A 7.1.6.4.: PK und Tumorlokalisation Tumorlokalisation Pulmonale Komplikation / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit Pankreaskopf 95 (94,1) 6 (5,9) 101 (47,6) Papilla Vateri 58 (89,2) 7 (10,8) 65 (30,7) Dist. Ductus choledochus 38 (82,6) 8 (17,4) 46 (21,7) Gesamtzahl (%) 191 (90,1) 21 (9,9) 212 (100,0) p=0,094 Tab. A 7.1.6.5.a.: PK und T-Kategorie (vier Gruppen) T-Kategorie Pulmonale Komplikation / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit T1 22 (84,6) 4 (15,4) 26 (12,3) T2 107 (93,9) 7 (6,1) 114 (53,8) T3 59 (85,5) 10 (14,5) 69 (32,5) T4 Gesamtzahl (%) 3 (100,0) 191 (90,1) p=0,200 108 0 (0) 3 (1,4) 21 (9,1) 212 (100,0) Tab. A 7.1.6.5.b.: PK und T-Kategorie (zwei T-Gruppen) T-Kategorie Pulmonale Komplikation / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit T1/2 129 (92,1) 11 (7,9) 140 (66,0) T3/4 62 (86,1) 10 (13,9) 72 (34,0) 191 (90,1) 21 (9,9) 212 (100,0) Gesamtzahl (%) p=0,135 Tab. A 7.1.6.6.: PK und N-Kategorie N-Kategorie Pulmonale Komplikation / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit N0 86 (86,9) 13 (13,1) 99 (46,7) N1 105 (92,9) 8 (7,1) 113 (53,3) Gesamtzahl (%) 191 (90,1) 21 (9,9) 212 (100,0) p=0,141 Tab. A 7.1.6.7.: PK und M-Kategorie M-Kategorie Pulmonale Komplikation / Anzahl (%) Pat. ohne M0 M1 Gesamtzahl(%) Gesamtzahl (%) Pat. mit 187 (89,9) 21 (10,1) 4 (100,0) 191 (90,1) 208 (98,1) 0 (0) 4 (1,9) 21 (9,9) 225 (100,0) p=0,503 Tab. A 7.1.6.8.a.: PK und Grading (drei G-Gruppen) Grading Pulmonale Komplikation / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit G1 34 (91,9) 3 (8,1) 37 (17,5) G2 89 (92,7) 7 (7,3) 96 (45,3) G3 68 (86,1) 11 (13,9) 79 (37,3) 191 (90,1) 21 (9,9) 212 (100,0) Gesamtzahl (%) p=0,317 109 Tab. A 7.1.6.8.b.: PK und Grading (zwei G-Gruppen) Grading Pulmonale Komplikation / Anzahl (%) Pat. ohne G1/2 G3 Gesamtzahl (%) Gesamtzahl (%) Pat. mit 123 (92,5) 10 (7,5) 133 (62,7) 68 (86,1) 11 (13,9) 79 (37,3) 191 (90,1) 21 (9,9) 212 (100,0) p=0,131 Tab. A 7.1.6.9.a.: PK und R-Klassifikation (drei R-Gruppen) Residualtumor Pulmonale Komplikation / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit R0 132 (89,8) 15 (10,2) 147 (69,3) R1 49 (94,2) 3 (5,8) 52 (24,5) R2 10 (76,9) 3 (23,1) 13 (6,2) Gesamtzahl (%) 191 (90,1) 21 (9,9) 212 (100,0) p=0,170 Tab. A 7.1.6.9.b.: PK und R-Klassifikation (zwei R-Gruppen) Residualtumor Magenentleerungsstörung / Anzahl (%) Pat. ohne R0 R1/2 Gesamtzahl (%) Gesamtzahl (%) Pat. mit 132 (89,8) 15 (10,2) 147 (69,3) 59 (90,8) 6 (9,2) 65 (30,7) 191 (90,1) 21 (9,9) 212 (100,0) p=0,827 Tab. A 7.1.6.10.a.: PK und Operationsart (WOP/PPPD) Operationsart Pulmonale Komplikation / Anzahl (%) Pat. ohne Whipple gesamt PPPD gesamt Gesamtzahl (%) Gesamtzahl (%) Pat. mit 131 (89,7) 15 (10,3) 146 (68,9) 60 (90,9) 6 (9,1) 66 (31,1) 191 (90,1) 21 (9,9) 212 (100,0) p=0,790 110 Tab. A 7.1.6.10.b.: PK und Operationsart (ohne/mit PBV) Pankreas- Pulmonale Komplikation / Anzahl (%) Blindverschluß Pat. ohne Pat. ohne 146 (91,8) Pat. Mit Gesamtzahl (%) Gesamtzahl (%) Pat. mit 13 (8,2) 45 (84,9) 8 (15,1) 191 (90,1) 21 (9,9) 159 (75,0) 53 (25,0) 212 (100,0) p=0,144 Tab. A 7.1.6.10.c.: PK und Operationsart (WOP/PPPD/PBV) Operationsart Pulmonale Komplikation / Anzahl (%) Pat. ohne Whipple ohne PBV Gesamtzahl (%) Pat. mit 121 (91,7) 11 (8,3) 132 (73,6) Whipple mit PBV 10 (71,4) 4 (28,6) 14 (26,4) Whipple gesamt 131 (89,7) 15 (10,3) 146 (68,9) PPPD ohne PBV 25 (92,6) 2 (7,4) 27 (26,4) PPPD mit PBV 35 (89,7) 4 (10,3) 39 (73,6) PPPD gesamt 60 (90,9) 6 (9,1) 66 (31,1) 191 (90,1) 21 (9,9) 212 (100,0) Gesamtzahl (%) p=0,790 Tab. A 7.1.6.11.: PK und Erfahrung des Operateurs Operateur / Gruppe Pulmonale Komplikation / Anzahl (%) Pat. ohne mehr Erfahrung Weniger Erfahrung Gesamtzahl (%) Gesamtzahl (%) Pat. mit 169 (89,9) 19 (10,1) 188 (88,7) 22 (91,7) 2 (8,3) 24 (11,3) 191 (90,1) 21 (9,9) 212 (100,0) p=0,784 Tab. A 7.1.6.12.a.: PK und Somatostatin-/Octreotidgabe Somatostatin-/ Pulmonale Komplikation / Anzahl (%) Octreotidgabe Pat. ohne Pat. ohne 112 (90,3) Pat. Mit Gesamtzahl (%) Gesamtzahl (%) Pat. mit 12 (9,7) 79 (89,8) 9 (10,2) 191 (90,1) 21 (9,9) p=0,895 111 124 (58,5) 88 (41,5) 212 (100,0) Tab. A 7.1.6.12.b.: PK und Somatostatin-/Octreotidgabe (ohne Pat. mit PBV) Somatostatin-/ Pulmonale Komplikation / Anzahl (%) Octreotidgabe Pat. ohne Gesamtzahl (%) Pat. mit Pat. ohne 81 (92,0) 7 (8,0) 88 (55,3) Pat. Mit 65 (91,5) 6 (8,5) 71 (44,7) 146 (91,8) 13 (8,2) 159 (100,0) Gesamtzahl (%) p=0,910 Tab. A 7.1.6.13.: PK und Pankreasfistel Pankreasfistel Pat. ohne Pat. Mit Gesamtzahl (%) Pulmonale Komplikation / Anzahl (%) Pat. ohne Pat. mit 138 (92,0) 12 (8,0) 53 (85,5) 9 (14,5) 191 (90,9) 21 (9,9) Gesamtzahl (%) 150 (70,8) 62 (29,2) 212 (100,0) p=0,149 Tab. A 7.1.6.14.: PK und intraabdominale Infektion Intraabdominale Infektion Pulmonale Komplikation / Anzahl (%) Pat. ohne Pat. ohne Pat. Mit Gesamtzahl (%) Gesamtzahl (%) Pat. mit 148 (93,7) 10 (6,3) 158 (74,5) 43 (79,6) 11 (20,4) 54 (25,5) 191 (90,1) 21 (9,9) 212 (100,0) p=0,003 Tab. A 7.1.6.15.: PK und intraabdominale Blutung Intraabdominale Blutung Pulmonale Komplikation / Anzahl (%) Pat. ohne Pat. ohne Pat. Mit Gesamtzahl (%) Gesamtzahl (%) Pat. mit 172 (93,5) 12 (6,5) 19 (67,9) 9 (32,1) 191 (90,1) 21 (9,9) p<0,001 112 184 (86.8) 28 (13,2) 212 (100,0) Tab. A 7.1.6.16.: PK und Magenentleerungsstörung Magenentleerungs- Pulmonale Komplikation / Anzahl (%) störung Pat. ohne Pat. ohne 183 (92,9) Pat. mit Gesamtzahl (%) Gesamtzahl (%) Pat. mit 14 (7,1) 8 (53,3) 7 (46,7) 191 (90,1) 21 (9,9) 197 (92,9) 15 (7,1) 212 (100,0) p<0,001 7.2. Reoperation (ReOP) Tab. A 7.2.1.a.: Reoperationsfrequenz und Patientenalter bei OP (drei Altersgruppen) Altersgruppe Reoperation / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit >50 Jahre 26 (89,7) 3 (10,3) 29 (13,7) 50-69 Jahre 25 (89,3) 15 (10,7) 140 (66,0) >69 Jahre 38 (88,4) 5 (11,6) 43 (20,3) 189 (89,2) 23 (10,8) 212 (100,0) Gesamtzahl (%) p=0,982 Tab. A 7.2.1.b.: Reoperationsfrequenz und Patientenalter bei OP (zwei Altersgruppen) Altersgruppe Reoperation / Anzahl (%) Gesamtzahl (%) Pat. ohne Pat. mit - 69 Jahre 151 (89,3) 18 (10,7) 169 (79,7) >69 Jahre 38 (88,4) 5 (11,6) 43 (20,3) 189 (89,2) 23 (10,8) 212 (100,0) Gesamtzahl (%) p=0,854 113 Tab. A 7.2.2.: Reoperationsfrequenz und Geschlecht Geschlecht Reoperation / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit Männlich 111 (88,1) 15 (11,9) 126 (59,4) Weiblich 78 (90,7) 8 (9,3) 86 (40,6) 189 (89,2) 23 (10,8) 212 (100,0) Gesamtzahl (%) p=0,550 Tab. A 7.2.3.: Reoperationsfrequenz und Histologie Histologie Reoperation / Anzahl (%) Pat. ohne Adeno-Ca Muzinöses Adeno-Ca Gesamtzahl (%) Gesamtzahl (%) Pat. mit 146 (89,6) 17 (10,4) 163 (76,9) 43 (87,8) 6 (12,2) 49 (23,1) 189 (89,2) 23 (10,8) 212 (100,0) p=0,720 Tab. A 7.2.4.: Reoperationsfrequenz und Tumorlokalisation Tumorlokalisation Reoperation / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit Pankreaskopf 92 (91,1) 9 (8,9) 101 (47,6) Papilla Vateri 59 (90,8) 6 (9,2) 65 (30,7) Dist. Ductus choledochus 38 (82,6) 8 (17,4) 46 (21,7) 189 (89,2) 23 (10,8) 212 (100,0) Gesamtzahl (%) p=0,272 Tab. A 7.2.5.a.: Reoperationsfrequenz und T-Kategorie (vier T-Gruppen) T-Kategorie Reoperation / Anzahl (%) Pat. ohne T1 22 (84,6) T2 103 (90,4) T3 61 (88,4) T4 Gesamtzahl (%) Gesamtzahl (%) Pat. mit 4 (15,4) 11 (9,6) 8 (11,6) 3 (100,0) 0 (0) 189 (89,2) 23 (10,8) p=0,771 114 26 (12,3) 114 (53,8) 69 (32,5) 3 (1,4) 212 (100,0) Tab. A 7.2.5.b.: Reoperationsfrequenz und T-Kategorie (zwei T-Gruppen) T-Kategorie Magenentleerungsstörung / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit T1/2 125 (89,3) 15 (10,7) 140 (66,0) T3/4 64 (88,9) 8 (11,1) 72 (34,0) 189 (89,2) 23 (10,8) 212 (100,0) Gesamtzahl (%) p=0,930 Tab. A 7.2.6.: Reoperationsfrequenz und N-Kategorie N-Kategorie Reoperation / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit N0 88 (88,9) 11 (11,1) 99 (46,7) N1 101 (89,4) 12 (10,6) 113 (53,3) Gesamtzahl (%) 189 (89,8) 23 (10,8) 212 (100,0) p=0,909 Tab. A 7.2.7.: Reoperationsfrequenz und M-Kategorie M-Kategorie Reoperation / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit M0 186 (89,4) 22 (10,6) 208 (98,1) M1 3 (75,0) 1 (25,0) 4 (1,9) 189 (89,2) 23 (10,8) 212 (100,0) Gesamtzahl (%) p=0,358 Tab. A 7.2.8.a.: Reoperationsfrequenz und Grading (drei G-Gruppen) Grading Reoperation / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit G1 35 (94,6) 2 (5,4) 37 (17,5) G2 85 (88,5) 11 (11,5) 96 (45,3) G3 69 (87,3) 10 (12,7) 79 (37,3) 189 (89,2) 23 (10,8) 212 (100,0) Gesamtzahl (%) p=0,487 115 Tab. A 7.2.8.b.: Reoperationsfrequenz und Grading (zwei G-Gruppen) Grading Reoperation / Anzahl (%) Pat. ohne G1/2 G3 Gesamtzahl (%) Gesamtzahl (%) Pat. mit 120 (90,2) 13 (9,8) 133 (62,7) 69 (87,3) 10 (12,7) 79 (37,3) 189 (89,2) 23 (10,8) 212 (100,0) p=0,514 Tab. A 7.2.9.a.: Reoperationsfrequenz und R-Klassifikation (drei R-Gruppen) Residualtumor Reoperation / Anzahl (%) Pat. ohne Gesamtzahl (%) Pat. mit R0 127 (86,4) 20 (13,6) 147 (69,3) R1 49 (94,2) 3 (5,8) 52 (24,5) R2 13 (100,0) 0 (0) 13 (6,2) Gesamtzahl (%) 189 (89,2) 23 (10,8) 212 (100,0) p=0,127 Tab. A 7.2.9.b.: Reoperationsfrequenz und R-Klassifikation (zwei R-Gruppen) Residualtumor Reoperation / Anzahl (%) Pat. ohne G1/2 G3 Gesamtzahl (%) Gesamtzahl (%) Pat. mit 127 (86,4) 20 (13,6) 147 (69,3) 62 (95,4) 3 (4,6) 65 (30,7) 189 (89,2) 23 (10,8) 212 (100,0) p=0,052 Tab. A 7.2.10.a.: Reoperationsfrequenz und Operationsart (WOP/PPPD) Operationsart Reoperation / Anzahl (%) Pat. ohne Whipple gesamt PPPD gesamt Gesamtzahl (%) Gesamtzahl (%) Pat. mit 129 (88,4) 17 (11,6) 146 (68,9) 60 (90,9) 6 (9,1) 66 (31,1) 189 (89,2) 23 (10,8) 212 (100,0) p=0,580 116 Tab. A 7.2.10.b.: Reoperationsfrequenz und Operationsart (ohne/mit PBV) Pankreas- Reoperation / Anzahl (%) blindverschluß Pat. ohne Pat. ohne 141 (88,7) 18 (11,3) 159 (75,0) 48 (90,6) 5 (9,4) 53 (25,0) 189 (89,2) 23 (10,8) 212 (100,0) Pat. Mit Gesamtzahl (%) Gesamtzahl (%) Pat. mit p=0,702 Tab. A 7.2.10.c.: Reoperationsfrequenz und Operationsart (WOP/PPPD/PBV) Operationsart Reoperation / Anzahl (%) Pat. ohne Whipple ohne PBV Gesamtzahl (%) Pat. mit 117 (88,6) 15 (11,4) 132 (73,6) Whipple mit PBV 12 (85,7) 2 (14,3) 14 (26,4) Whipple gesamt 129 (88,4) 17 (11,6) 146 (68,9) PPPD ohne PBV 24 (88,9) 3 (11,1) 27 (26,4) PPPD mit PBV 36 (92,3) 3 (7,7) 39 (73,6) PPPD gesamt 60 (90,9) 6 (9,1) 66 (31,1) 189 (89,2) 23 (10,8) 212 (100,0) Gesamtzahl (%) p=0,571 Tab. A 7.2.11.: Reoperationsfrequenz und Erfahrung des Operateurs Operateur / Gruppe Reoperation / Anzahl (%) Pat. ohne mehr Erfahrung Weniger Erfahrung Gesamtzahl (%) Gesamtzahl (%) Pat. mit 128 (67,7) 13 (56,5) 141 (66,5) 61 (32,3) 10 (43,5) 71 (33,5) 189 (89,2) 23 (10,8) 212 (100,0) p=0,782 Tab. A 7.2.12.: Reoperationsfrequenz und Somatostatin-/Octreotidgabe Somatostatin-/ Reoperation / Anzahl (%) Octreotidgabe Pat. ohne Pat. mit Pat. ohne 111 (89,5) 13 (10,5) 124 (58,5) 78 (88,6) 10 (11,4) 88 (41,5) 189 (89,2) 23 (10,8) 212 (100,0) Pat. Mit Gesamtzahl (%) p=0,839 117 Gesamtzahl (%) Tab. A 7.2.13.: Reoperationsfrequenz und Pankreasfistel Pankreasfistel Pat. ohne Pat. Mit Gesamtzahl (%) Reoperation / Anzahl (%) Gesamtzahl (%) Pat. ohne Pat. mit 139 (92,7) 11 (7,3) 150 (70,8) 50 (80,6) 12 (19,4) 62 (29,2) 189 (89,2) 23 (10,8) 212 (100,0) p=0,011 Tab. A 7.2.14.: Reoperationsfrequenz und Insuffizienz der HJS Insuffizienz der Reoperation / Anzahl (%) Hepatikojejunostomie Pat. ohne Pat. mit Pat. ohne 183 (91,0) 18 (9,0) Pat. Mit Gesamtzahl (%) Gesamtzahl (%) 201 (94,8) 6 (54,4) 5 (45,5) 11 (5,2) 189 (89,2) 23 (10,8) 212 (100,0) P<0,001 Tab. A 7.2.15.: Reoperationsfrequenz und intraabdominale Infektion Intraabdominale Infektion Reoperation / Anzahl (%) Pat. ohne Pat. ohne Pat. Mit Gesamtzahl (%) Gesamtzahl (%) Pat. mit 149 (94,3) 9 (5,7) 158 (74,5) 40 (74,1) 14 (25,9) 54 (25,5) 189 (89,2) 23 (10,8) 212 (100,0) p<0,001 Tab. A 7.2.16.: Reoperationsfrequenz und intraabdominale Blutung Intraabdominale Blutung Pat. ohne Pat. mit Gesamtzahl (%) Reoperation / Anzahl (%) Gesamtzahl (%) Pat. ohne Pat. mit 182 (92,4) 15 (7,6) 197 (92,9) 7 (46,7) 8 (53,3) 15 (7,1) 189 (89,2) 23 (10,8) 212 (100,0) p<0,001 118 Tab. A 7.2.17.: Reoperationsfrequenz und Magenentleerungsstörung Magenentleerungs- Reoperation / Anzahl (%) störung Pat. ohne Pat. ohne 176 (95,7) 8 (4,3) 184 (86,8) 13 (46,4) 15 (53,6) 28 (13,2) 189 (89,2) 23 (10,8) 212 (100,0) Pat. mit Gesamtzahl (%) Gesamtzahl (%) Pat. mit p<0,001 Tab. A 7.2.18.: Reoperationsfrequenz und pulmonale Komplikationen Pulmonale Reoperation / Anzahl (%) Komplikationen Pat. ohne Pat. ohne 179 (93,7) 12 (6,3) 191 (90,1) 10 (47,6) 11 (52,4) 21 (9,9) 189 (89,2) 23 (10,8) 212 (100,0) Pat. Mit Gesamtzahl (%) Gesamtzahl (%) Pat. mit p<0,001 7.3. Transfusion von Blutpräparaten 7.3.1. Erythrozytenkonzentrate (EK) Tab. A 7.3.1.1.a.: Erythrozytensubstitution und Alter bei OP (drei Altersgruppen) Altersgruppe Erythrozytenkonzentrate / Anzahl (%) Pat. mit - 5 EK Gesamtzahl (%) Pat. mit > 5 EK >50 Jahre 20 (69,0) 9 (31,0) 29 (13,7) 50-69 Jahre 66 (47,1) 74 (52,9) 140 (66,0) >69 Jahre 23 (53,5) 20 (46,5) 43 (20,3) 189 (89,2) 23 (10,8) 212 (100,0) Gesamtzahl (%) p=0,097 119 Tab. A 7.3.1.1.b.: Erythrozytensubstitution und Alter bei OP (zwei Altersgruppen) Altersgruppe Erythrozytenkonzentrate / Anzahl (%) Pat. mit - 5 EK Gesamtzahl (%) Pat. mit > 5 EK - 69 Jahre 86 (50,9) 83 (49,1) 169 (79,7) >69 Jahre 23 (53,5) 20 (46,5) 43 (20,3) 109 (51,4) 103 (48,6) 212 (100,0) Gesamtzahl (%) p=0,761 Tab. A 7.3.1.2.: Erythrozytensubstitution und Geschlecht Geschlecht Erythrozytenkonzentrate / Anzahl (%) Pat. mit - 5 EK Gesamtzahl (%) Pat. mit > 5 EK Männlich 58 (46,0) 68 (54,0) 126 (59,4) Weiblich 51 (59,3) 35 (40,7) 86 (40,6) 109 (51,4) 103 (48,6) 212 (100,0) Gesamtzahl (%) p=0,058 Tab. A 7.3.1.3.: Erythrozytensubstitution und Histologie Histologie Erythrotzytenkonzentrate / Anzahl (%) Pat. mit - 5 EK Gesamtzahl (%) Pat. mit > 5 EK Adeno-Ca 88 (54,0) 75 (46,0) 163 (76,9) Muzinöses Adeno-Ca 21 (42,9) 28 (57,1) 49 (23,1) 109 (51,4) 103 (48,6) 212 (100,0) Gesamtzahl (%) p=0,177 Tab. A 7.3.1.4.: Erythrozytensubstitution und Tumorlokalisation Tumorlokalisation Erythrozytenkonzentrate / Anzahl (%) Pat. mit - 5 EK Gesamtzahl (%) Pat. mit > 5 EK Pankreaskopf 53 (52,5) 48 (47,5) 101 (47,6) Papilla Vateri 38 (58,5) 27 (41,5) 65 (30,7) Dist. Ductus choledochus 18 (39,1) 28 (60,9) 46 (21,7) 109 (51,4) 103 (48,6) 212 (100,0) Gesamtzahl (%) p=0,128 120 Tab. A 7.3.1.5.a.: Erythrozytensubstitution und T-Kategorie (vier T-Gruppen) T-Kategorie Erythrozytenkonzentrate / Anzahl (%) Pat. mit - 5 EK Gesamtzahl (%) Pat. mit > 5 EK T1 18 (69,2) 8 (30,8) 26 (12,3) T2 63 (55,3) 51 (44,7) 114 (53,8) T3 26 (37,7) 43 (62,3) 69 (32,5) T4 2 (66,7) 1 (33,3) 3 (1,4) 109 (51,4) 103 (48,6) Gesamtzahl (%) 212 (100,0) p=0,023 Tab. A 7.3.1.5.b.: Erythrozytensubstitution und T-Kategorie (zwei T-Gruppen) T-Kategorie Erythrozytenkonzentrate / Anzahl (%) Pat. mit - 5 EK Gesamtzahl (%) Pat. mit > 5 EK T1/2 81 (57,9) 59 (42,1) 140 (66,0) T3/4 28 (38,9) 44 (61,1) 72 (34,0) 109 (51,4) 103 (48,6) 212 (100,0) Gesamtzahl (%) p=0,009 Tab. A 7.3.1.6.: Erythrozytensubstitution und N-Kategorie N-Kategorie Erythrozytenkonzentrate / Anzahl (%) Pat. mit - 5 EK Gesamtzahl (%) Pat. mit > 5 EK N0 58 (58,6) 41 (41,4) 99 (46,7) N1 51 (45,1) 62 (54,9) 113 (53,3) 109 (51,4) 103 (48,6) 212 (100,0) Gesamtzahl (%) p=0,051 Tab. A 7.3.1.7.: Erythrozytensubstitution und M-Kategorie M-Stadium Erythrozytenkonzentrate / Anzahl (%) Pat. mit - 5 EK Pat. mit > 5 EK M0 107 (51,4) 101 (48,6) M1 2 (50,0) 2 (50,0) 109 (51,4) 103 (48,6) Gesamtzahl (%) p=0,954 121 Gesamtzahl (%) 208 (98,1) 4 (1,9) 212 (100,0) Tab. A 7.3.1.8.a.: Erythrozytensubstitution und Grading (drei G-Gruppen) Grading Erythrozytenkonzentrate / Anzahl (%) Pat. mit - 5 EK Gesamtzahl (%) Pat. mit > 5 EK G1 24 (64,9) 13 (35,1) 37 (17,5) G2 53 (55,2) 43 (44,8) 96 (45,3) G3 32 (40,5) 47 (59,5) 79 (37,3) 109 (51,4) 103 (48,6) 212 (100,0) Gesamtzahl (%) p=0,030 Tab. A 7.3.1.8.b.: Erythrozytensubstitution und Grading (zwei G-Gruppen) Grading7 Erythrozytenkonzentrate / Anzahl (%) Pat. mit - 5 EK Gesamtzahl (%) Pat. mit > 5 EK G1/2 77 (57,9) 56 (42,1) 133 (62,7) G3 32 (40,5) 47 (59,5) 79 (37,3) 109 (51,4) 103 (48,6) 212 (100,0) Gesamtzahl (%) p=0,014 Tab. A 7.3.1.9.a.: Erythrozytensubstitution und R-Klassifikation (drei R-Gruppen) Residualtumor Erythrozytenkonzentrate / Anzahl (%) Pat. mit - 5 EK Gesamtzahl (%) Pat. mit > 5 EK R0 75 (51,0) 72 (49,0) 147 (69,3) R1 29 (55,8) 23 (44,2) 52 (24,5) R2 5 (38,5) 8 (61,5) 13 (6,2) 109 (51,4) 103 (48,6) Gesamtzahl (%) 212 (100,0) p=0,528 Tab. A 7.3.1.9.b.: Erythrozytensubstitution und R-Klassifikation (zwei R-Gruppen) Residualtumor Erythrozytenkonzentrate / Anzahl (%) Pat. mit - 5 EK Gesamtzahl (%) Pat. mit > 5 EK R0 75 (51,0) 72 (49,0) 147 (69,3) R1/2 34 (52,3) 31 (47,7) 65 (30,7) 109 (51,4) 103 (48,6) 212 (100,0) Gesamtzahl (%) p=0,863 122 Tab. A 7.3.1.10.a.: Erythrozytensubstitution und Operationsart (WOP/PPPD) Operationsart Erythrozytenkonzentrate / Anzahl (%) Pat. mit - 5 EK Gesamtzahl (%) Pat. mit > 5 EK WOP gesamt 70 (47,9) 76 (52,1) 146 (68,9) PPPD gesamt 39 (59,1) 27 (40,9) 66 (31,1) 109 (51,4) 103 (48,6) 212 (100,0) Gesamtzahl (%) p=0,133 Tab. A 7.3.1.10.b.: Erythrozytensubstitution und Operationsart (ohne/mit PBV) Pankreas- Erythrozytenkonzentrate / Anzahl (%) Blindverschluß Pat. ohne Gesamtzahl (%) Pat. mit Pat. ohne 81 (50,9) 78 (49,1) 159 (75,0) Pat. Mit 28 (52,8) 25 (47,2) 53 (25,0) 109 (51,4) 103 (48,6) 212 (100,0) Gesamtzahl (%) p=0,144 Tab. A 7.3.1.10.c.: Erythrozytensubstitution und Operationsart (WOP/PPPD/PBV) Operationsart Erythrozytenkonzentrate / Anzahl (%) Pat. mit - 5 EK WOP ohne PBV Gesamtzahl (%) Pat. mit > 5 EK 62 (47,0) 70 (53,0) 132 (73,6) WOP mit PBV 8 (57,1) 6 (42,9) 14 (26,4) WOP gesamt 70 (47,9) 76 (52,1) 146 (68,9) PPPD ohne PBV 19 (70,4) 8 (29,6) 27 (26,4) PPPD mit PBV 20 (51,3) 19 (48,7) 39 (73,6) PPPD gesamt 39 (59,1) 27 (40,9) 66 (31,1) 109 (51,4) 103 (48,6) 212 (100,0) Gesamtzahl (%) p=0,133 Tab. A 7.3.1.11.: Erythrozytensubstitution und Erfahrung des Operateurs Operateur / Gruppe Erythrozytenkonzentrate / Anzahl (%) Pat. mit - 5 EK Gesamtzahl (%) Pat. mit > 5 EK mehr Erfahrung 98 (52,1) 90 (47,9) 188 (88,7) Weniger Erfahrung 11 (45,8) 13 (54,2) 94 (11,3) 109 (51,4) 103 (48,6) 212 (100,0) Gesamtzahl (%) p=0,345 123 Tab. A 7.3.1.12.: Erythrozytensubstitution und Somatostatin-/Octreotidgabe Somatostatin-/ Erythrozytenkonzentrate / Anzahl (%) Octreotidgabe Pat. mit - 5 EK Gesamtzahl (%) Pat. mit > 5 EK Pat. Ohne 60 (55,0) 64 (51,6) 124 (58,5) Pat. Mit 49 (55,7) 39 (44,3) 88 (41,5) 109 (51,4) 103 (48,6) 212 (100,0) Gesamtzahl (%) p=0,295 7.3.2. Fresh Frozen Plasma (FFP) Tab. A 7.3.2.1.a.: Plasmasubstitution und Alter bei OP (drei Altersgruppen) Altersgruppe Fresh Frozen Plasma / Anzahl (%) Pat. mit - 6 FFP Gesamtzahl (%) Pat. mit > 6 FFP >50 Jahre 21 (72,4) 8 (27,6) 29 (13,7) 50-69 Jahre 69 (49,3) 71 (50,7) 140 (66,0) >69 Jahre 23 (53,5) 20 (46,5) 43 (20,3) 113 (53,3) 99 (46,7) 212 (100,0) Gesamtzahl (%) p=0,076 Tab. A 7.3.2.1.b.: Plasmasubstitution und Alter bei OP (zwei Altersgruppen) Altersgruppe Fresh Frozen Plasma / Anzahl (%) Pat. mit - 6 FFP Gesamtzahl (%) Pat. mit > 6 FFP - 69 Jahre 90 (53,3) 79 (46,7) 169 (79,7) >69 Jahre 23 (53,5) 20 (46,5) 43 (20,3) 113 (53,3) 99 (46,7) 212 (100,0) Gesamtzahl (%) p=0,978 Tab. A 7.3.2.2.: Plasmasubstitution und Geschlecht Geschlecht Fresh Frozen Plasma / Anzahl (%) Pat. mit - 6 FFP Gesamtzahl (%) Pat. mit > 6 FFP Männlich 61 (48,4) 65 (51,6) 126 (59,4) Weiblich 52 (60,5) 34 (39,5) 86 (40,6) 113 (53,3) 99 (46,7) 212 (100,0) Gesamtzahl (%) p=0,084 124 Tab. A 7.3.2.3.: Plasmasubstitution und Histologie Histologie Fresh Frozen Plasma / Anzahl (%) Pat. mit - 6 FFP Gesamtzahl (%) Pat. mit > 6 FFP Adeno-Ca 97 (59,5) 66 (4,50) 163 (76,9) Muzinöses Adeno-Ca 16 (32,7) 33 (67,3) 49 (23,1) 113 (53,3) 99 (46,7) 212 (100,0) Gesamtzahl (%) p=0,001 Tab. A 7.3.2.4.: Plasmasubstitution und Tumorlokalisation Tumorlokalisation Fesh Frozen Plasma / Anzahl (%) Pat. mit - 6 FFP Gesamtzahl (%) Pat. mit > 6 FFP Pankreaskopf 54 (53,5) 47 (46,5) 101 (47,6) Papilla Vateri 40 (61,5) 25 (38,5) 65 (30,7) Dist. Ductus choledochus 19 (41,3) 27 (58,7) 46 (21,7) 113 (53,3) 99 (46,7) 212 (100,0) Gesamtzahl (%) p=0,109 Tab. A 7.3.2.5.a.: Plasmasubstitution und T-Kategorie (vier T-Gruppen) T-Kategorie Fresh Frozen Plasma / Anzahl (%) Pat. mit - 6 FFP Gesamtzahl (%) Pat. mit > 6 FFP T1 20 (76,9) 6 (23,1) 26 (12,3) T2 60 (52,6) 54 (47,7) 114 (53,8) T3 31 (44,9) 38 (55,1) 69 (32,5) T4 2 (66,7) 1 (33,3) 3 (1,4) 113 (53,3) 99 (46,7) 212 (100,0) Gesamtzahl (%) p=0,046 Tab. A 7.3.2.5.b.: Plasmasubstitution und T-Kategorie (zwei T-Gruppen) T-Kategorie Fresh Frozen Plasma / Anzahl (%) Pat. mit - 6 FFP Gesamtzahl (%) Pat. mit > 6 FFP T1/2 80 (57,1) 60 (42,9) 140 (66,0) T3/4 33 (45,8) 39 (54,2) 72 (34,0) 113 (53,3) 99 (46,7) 212 (100,0) Gesamtzahl (%) p=0,118 125 Tab. A 7.3.2.6.: Plasmasubstitution und N-Kategorie N-Kategorie Fresh Frozen Plasma / Anzahl (%) Pat. mit - 6 FFP Gesamtzahl (%) Pat. mit > 6 FFP N0 57 (57,6) 42 (42,4) 99 (46,7) N1 56 (49,6) 57 (50,4) 113 (53,3) 113 (53,3) 99 (46,7) 212 (100,0) Gesamtzahl (%) p=0,243 Tab. A 7.3.2.7.: Plasmasubstitution und M-Kategorie M-Kategorie Fresh Frozen Plasma / Anzahl (%) Pat. mit - 6 FFP M0 M1 Gesamtzahl (%) Gesamtzahl (%) Pat. mit > 6 FFP 109 (52,4) 99 (47,6) 4 (100,0) 0 (0) 113 (53,3) 99 (46,7) 208 (98,1) 4 (1,9) 212 (100,0) p=0,059 Tab. A 7.3.2.8.a.: Plasmasubstitution und Grading (drei G-Gruppen) Grading Fresh Frozen Plasma / Anzahl (%) Pat. mit - 6 FFP Gesamtzahl (%) Pat. mit > 6 FFP G1 17 (45,9) 20 (54,1) 37 (17,5) G2 54 (56,3) 42 (43,7) 96 (45,3) G3 42 (53,2) 37 (46,8) 79 (37,3) 113 (53,3) 99 (46,7) 212 (100,0) Gesamtzahl (%) p=0,566 Tab. A 7.3.2.8.b.: Plasmasubstitution und Grading (zwei G-Gruppen) Grading Fresh Frozen Plasma / Anzahl (%) Pat. mit - 6 FFP Gesamtzahl (%) Pat. mit > 6 FFP G1/2 71 (53,4) 62 (46,6) 133 (62,7) G3 42 (53,2) 37 (46,8) 79 (37,3) 113 (53,3) 99 (46,7) 212 (100,0) Gesamtzahl (%) p=0,975 126 Tab. A 7.3.2.9.a.: Plasmasubstitution und R-Klassifikation (drei R-Gruppen) Residualtumor Fresh Frozen Plasma / Anzahl (%) Pat. mit - 6 FFP Gesamtzahl (%) Pat. mit > 6 FFP R0 82 (55,6) 65 (44,2) 147 (69,3) R1 27 (51,9) 25 (48,1) 52 (24,5) R2 4 (30,8) 9 (69,2) 13 (6,1) 113 (53,3) 99 (46,7) 212 (100,0) Gesamtzahl (%) p=0,217 Tab. A 7.3.2.9.b.: Plasmasubstitution und R-Klassifikation (zwei R-Gruppen) Residualtumor Fresh Frozen Plasma / Anzahl (%) Pat. mit - 6 FFP Gesamtzahl (%) Pat. mit > 6 FFP R0 82 (55,6) 65 (44,2) 147 (69,3) R1/2 31 (47,7) 34 (52,3) 65 (30,7) 113 (53,3) 99 (46,7) 212 (100,0) Gesamtzahl (%) p=0,276 Tab. A 7.3.2.10.a.: Plasmasubstitution und Operationsart (WOP/PPPD) Operationsart Fresh Frozen Plasma / Anzahl (%) Pat. mit - 6 FFP Gesamtzahl (%) Pat. mit > 6 FFP WOP 73 (50,0) 73 (50,0) 146 (68,9) PPPD 40 (60,6) 26 (39,4) 66 (31,1) 113 (53,3) 99 (46,7) 212 (100,0) Gesamtzahl (%) p=0,152 Tab. A 7.3.1.10.b.: Plasmasubstitution und Operationsart (ohne/mit PBV) Pankreas- Fresh Frozen Plasma / Anzahl (%) blindverschluß Pat. - 6 FFP Gesamtzahl (%) Pat. mit > 6 FFP Pat. Ohne 86 (54,1) 73 (45,9) 159 (75,0) Pat. Mit 27 (50,9) 26 (49,1) 53 (25,0) 113 (53,3) 99 (4,76) 212 (100,0) Gesamtzahl (%) p=0,691 127 Tab. A 7.3.2.10.c.: Operationsart und Plasmasubstitution (WOP/PPPD/PBV) Operationsart Fresh Frozen Plasma / Anzahl (%) Pat. mit - 6 FFP Whipple ohne PBV Gesamtzahl (%) Pat. mit > 6 FFP 65 (49,2) 67 (50,8) 132 (73,6) Whipple mit PBV 8 (57,1) 6 (42,9) 14 (26,4) Whipple gesamt 73 (50,0) 73 (50,0) 146 (68,9) PPPD ohne PBV 21 (77,8) 6 (22,2) 27 (26,4) PPPD mit PBV 19 (48,7) 20 (51,3) 39 (73,6) PPPD gesamt 40 (60,6) 26 (39,4) 66 (31,1) 113 (53,3) 99 (46,7) 212 (100,0) Gesamtzahl (%) p=0,152 Tab. A 7.3.2.11.: Plasmasubstitution und Erfahrung des Operateurs Operateur / Gruppe Fresh Frozen Plasma / Anzahl (%) Pat. mit - 6 FFP mehr Erfahrung Weniger Erfahrung Gesamtzahl (%) Gesamtzahl (%) Pat. mit > 6 FFP 104 (55,3) 84 (44,7) 188 (88,7) 9 (37,5) 15 (62,5) 24 (11,3) 113 (53,3) 99 (46,7) 212 (100,0) p=0,099 Tab. A 7.3.2.12.: Plasmasubstitution und prophylaktische Somatostatin-/Octreotidgabe Somatostatin- Frash Frozen Plasma / Anzahl (%) /Octreotidgabe Pat. mit - 6 FFP Gesamtzahl (%) Pat. mit > 6 FFP Pat. Ohne 54 (43,5) 70 (56,5) 124 (58,5) Pat. Mit 59 (67,0) 29 (33,0) 88 (41,5) 113 (53,3) 99 (46,7) 212 (100,0) Gesamtzahl (%) p<0,001 128 7.4. Perioperative Letalität Tab. A 7.4.1.a.: 90-Tage-Letalität und Alter bei OP (drei Altersgruppen) Altersgruppe Überlebenszeiten / Anzahl (%) Gesamtzahl (%) - 90 Tage > 90 Tage 2 (6,9) 27 (93,1) 29 (13,7) 50-69 Jahre 14 (10,0) 126 (90,0) 140 (66,0) >69 Jahre 5 (11,6) 38 (88,4) 43 (20,3) 191 (90,1) 212 (100,0) >50 Jahre Gesamtzahl (%) 21 (9,9) p=0,803 Tab. A 7.4.1.b.: 90-Tage-Letalität und Alter bei OP (zwei Altersgruppen) Altersgruppe - 69 Jahre >69 Jahre Gesamtzahl (%) Überlebenszeiten / Anzahl (%) Gesamtzahl (%) - 90 Tage > 90 Tage 16 (9,5) 153 (90,5) 169 (79,7) 38 (88,4) 43 (20,3) 191 (90,1) 212 (100,0) 5 (11,6) 21 (9,9) p=0,672 Tab. A 7.4.2.: 90-Tage-Letalität und Geschlecht Geschlecht Männlich Weiblich Gesamtzahl (%) Überlebenszeiten / Anzahl (%) Gesamtzahl (%) - 90 Tage > 90 Tage 12 (9,5) 111 (90,5) 126 (59,4) 77 (89,5) 86 (40,6) 191 (90,1) 212 (100,0) 9 (10,5) 21 (9,9) p=0,822 Tab. A 7.4.3.: 90-Tage-Letalität und Histologie Histologie Adeno-Ca Muzinöses Adeno-Ca Gesamtzahl (%) Überlebenszeiten / Anzahl (%) Gesamtzahl (%) - 90 Tage > 90 Tage 14 (8,6) 149 (91,4) 163 (76,9) 42 (85,7) 49 (23,1) 191 (90,1) 212 (100,0) 7 (14,3) 21 (9,9) p=0,242 129 Tab. A 7.4.4.: 90-Tage-Letalität und Tumorlokalisation Histologie Überlebenszeiten / Anzahl (%) Gesamtzahl (%) - 90 Tage > 90 Tage Pankreaskopf 8 (7,9) 93 (92,1) 101 (47,6) Papilla Vateri 4 (6,2) 61 (93,8) 65 (30,7) Dist. Ductus choledochus 9 (19,6) 37 (80,4) 46 (21,7) 191 (90,1) 212 (100,0) Gesamtzahl (%) 21 (9,9) p=0,043 Tab. A 7.4.5.a.: 90-Tage-Letalität und T-Kategorie (vier T-Gruppen) T-Kategorie Überlebenszeiten / Anzahl (%) - 90 Tage T1 Gesamtzahl (%) > 90 Tage 3 (11,5) 23 (88,5) 26 (12,3) T2 10 (8,8) 104 (91,2) 114 (53,8) T3 11 (15,9) 61 (88,4) 69 (32,5) T4 Gesamtzahl (%) 0 (0) 3 (100,0) 21 (9,9) 191 (90,1) 3 (1,4) 212 (100,0) p=0,851 Tab. A 7.4.5.b.: 90-Tage-Letalität und T-Kategorie (zwei T-Gruppen) T-Kategorie T1/2 T3/4 Gesamtzahl (%) Überlebenszeiten / Anzahl (%) Gesamtzahl (%) - 90 Tage > 90 Tage 13 (9,3) 127 (90,7) 140 (66,0) 64 (88,9) 72 (34,0) 191 (90,1) 212 (100,0) 8 (11,1) 21 (9,9) p=0,674 Tab. A 7.4.6.: 90-Tage-Letalität und N-Kategorie N-Kategorie Überlebenszeiten / Anzahl (%) - 90 Tage Gesamtzahl (%) > 90 Tage N0 11 (11,1) 88 (88,9) 99 (46,7) N1 10 (8,8) 103 (91,1) 113 (53,3) Gesamtzahl (%) 21 (9,9) 191 (90,1) 212 (100,0) p= 0,582 130 Tab. A 7.4.7.: 90-Tage-Letalität und M-Kategorie M-Kategorie Überlebenszeiten / Anzahl (%) - 90 Tage M0 M1 Gesamtzahl (%) Gesamtzahl (%) > 90 Tage 20 (9,6) 188 (90,4) 1 (25,0) 3 (75,0) 21 (13,7) 191 (90,1) 208 (98,1) 4 (1,9) 212 (100,0) p= 0,308 Tab. A 7.4.8.a.: 90-Tage-Letalität und Grading (drei G-Gruppen) Grading Überlebenszeiten / Anzahl (%) - 90 Tage Gesamtzahl (%) > 90 Tage G1 2 (5,4) 35 (94,6) 37 (17,5) G2 12 (12,5) 84 (87,5) 96 (45,3) G3 7 (8,9) 72 (91,1) 69 (32,5) 21 (13,7) 191 (90,1) 212 (100,0) Gesamtzahl (%) p=0,436 Tab. A 7.4.8.b.: 90-Tage-Letalität und Grading (zwei G-Gruppen) Grading Überlebenszeiten / Anzahl (%) - 90 Tage G1/2 G3 Gesamtzahl (%) Gesamtzahl (%) > 90 Tage 14 (10,5) 119 (89,5) 133 (62,7) 7 (8,9) 72 (91,1) 79 (37,3) 21 (13,7) 191 (90,1) 212 (100,0) p=0,695 Tab. A 7.4.9.a.: 90-Tage-Letalität und R-Klassifikation (drei R-Gruppen) Residualtumor Überlebenszeiten / Anzahl (%) Gesamtzahl (%) - 90 Tage > 90 Tage R0 13 (8,8) 134 (91,2) 147 (69,3) R1 4 (7,7) 48 (92,3) 52 (24,5) R2 4 (30,8) 9 (69,2) 13 (6,1) Gesamtzahl (%) 21 (9,9) 191 (90,1) p=0,033 131 212 (100,0) Tab. A 7.4.9.b.: 90-Tage-Letalität und R-Klassifikation (zwei R-Gruppen) Residualtumor R0 R1/2 Gesamtzahl (%) Überlebenszeiten / Anzahl (%) Gesamtzahl (%) - 90 Tage > 90 Tage 13 (8,8) 134 (91,2) 147 (69,3) 57 (87,7) 65 (30,7) 191 (90,1) 212 (100,0) 8 (12,3) 21 (9,9) p=0,436 Tab. A 7.4.10.: 90-Tage-Letalität und Pankreasfistel Pankreasfistel Überlebenszeiten / Anzahl (%) Gesamtzahl (%) - 90 Tage > 90 Tage Pat. Ohne 11 (7,3) 139 (92,7) 150 (70,8) Pat. Mit 10 (16,1) 52 (83,9) 62 (29,2) Gesamtzahl (%) 21 (9,9) 191 (90,1) 212 (100,0) p=0,051 Tab. A 7.4.11.: 90-Tage-Letalität und Insuffizienz der Hepatikojejunostomie Insuffizienz der HJS Pat. Ohne Pat. Mit Gesamtzahl (%) Überlebenszeiten / Anzahl (%) - 90 Tage > 90 Tage 17 (8,5) 184 (91,5) 4 (36,4) 7 (63,6) 21 (9,9) 191 (90,1) Gesamtzahl (%) 201 (94,8) 11 (5,2) 212 (100,0) p=0,003 Tab. A 7.4.12.: 90-Tage-Letalität und intraabdominale Infektion Intraabdominale Überlebenszeiten / Anzahl (%) Infektion - 90 Tage > 90 Tage Pat. Ohne 11 (7,0) 147 (93,0) 158 (74,5) Pat. Mit 10 (18,5) 44 (81,5) 54 (25,5) Gesamtzahl (%) 21 (9,9) 191 (90,1) 212 (100,0) p=0,014 132 Gesamtzahl (%) Tab. A 7.4.13.: 90-Tage-Letalität und intraabdominale Blutung Intraabdominale Überlebenszeiten / Anzahl (%) Blutung - 90 Tage > 90 Tage 15 (7,6) 182 (92,4) Pat. Ohne Pat. Mit Gesamtzahl (%) 6 (40,0) 9 (60,0) 21 (9,9) 191 (90,1) Gesamtzahl (%) 197 (92,9) 15 (7,1) 212 (100,0) p<0,001 Tab. A 7.4.14.: 90-Tage-Letalität und Magenentleerungsstörung Magenentleerungs- Überlebenszeiten / Anzahl (%) Gesamtzahl (%) Störung - 90 Tage > 90 Tage Pat. Ohne 11 (6,0) 172 (94,0) 183 (86,3) Pat. Mit 10 (34,5) 19 (65,5) 29 (13,7) Gesamtzahl (%) 21 (9,9) 191 (90,1) 212 (100,0) p<0,001 Tab. A 7.4.15.: 90-Tage-Letalität und pulmonale Komplikationen Pulmonale Überlebenszeiten / Anzahl (%) Komplikationen - 90 Tage > 90 Tage 8 (4,2) 183 (95,8) Pat. Ohne Pat. Mit 13 (61,9) Gesamtzahl (%) 21 (9,9) 8 (38,1) 191 (90,1) Gesamtzahl (%) 191 (90,1) 21 (9,9) 212 (100,0) p<0,001 Tab. A 7.4.16.a.: 90-Tage-Letalität und Operationsart (WOP/PPPD) Operationsart Überlebenszeiten / Anzahl (%) - 90 Tage Gesamtzahl (%) > 90 Tage WOP gesamt 17 (11,6) 129 (88,4) 146 (68,9) PPPD gesamt 4 (6,1) 62 (93,9) 66 (31,1) 21 (9,9) 191 (90,1) 212 (100,0) Gesamtzahl (%) p=0,208 133 Tab. A 7.4.16.b.: 90-Tage-Letalität und Operationsart (ohne/mit PBV) Pankreas- Überlebenszeiten / Anzahl (%) blindverschluß -90 Tage Pat. Ohne Pat. Mit Gesamtzahl (%) Gesamtzahl (%) > 90 Tage 16 (10,1) 143 (89,9) 159 (75,0) 5 (9,4) 48 (90,6) 53 (25,0) 21 (9,9) 191 (90,1) 212 (100,0) p=0,894 Tab. A 7.4.16.c.: 90-Tage-Letalität und Operationsart (WOP/PPPD/PBV) Operationsart Überlebenszeiten / Anzahl (%) - 90 Tage Whipple ohne PBV Gesamtzahl (%) > 90 Tage 15 (11,4) 117 (88,6) 132 (73,6) Whipple mit PBV 2 (14,3) 12 (85,7) 14 (26,4) Whipple gesamt 17 (11,6) 129 (88,4) 146 (68,9) PPPD ohne PBV 3 (11,1) 24 (88,9) 27 (26,4) PPPD mit PBV 1 (7,7) 38 (92,3) 39 (73,6) PPPD gesamt 4 (6,1) 62 (93,9) 66 (31,1) 21 (9,9) 191 (90,1) 212 (100,0) Gesamtzahl (%) p=0,208 Tab. A 7.4.17.: 90-Tage-Letalität und Erfahrung des Operateurs Operateur / Gruppe mehr Erfahrung Weniger Erfahrung Gesamtzahl (%) Überlebenszeiten / Anzahl (%) Gesamtzahl (%) - 90 Tage > 90 Tage 17 (9,0) 171 (91,0) 188 (88,7) 20 (83,1) 24 (11,3) 191 (90,1) 212 (100,0) 4 (16,9) 21 (9,9) p=0,239 Tab. A 7.4.18.: 90-Tage-Letalität und Somatostatin-/Octreotidgabe Somatostatin-/ Überlebenszeiten / Anzahl (%) Octreotidgabe - 90 Tage Pat. Ohne Pat. Mit Gesamtzahl (%) Gesamtzahl (%) > 90 Tage 14 (11,3) 110 (88,7) 124 (58,5) 7 (8,0) 81 (92,0) 88 (41,5) 21 (9,9) 121 (90,1) 212 (100,0) p=0,423 134 7.5. Überleben Tab. A 7.5.1.a.: Langzeitüberleben und Alter bei OP (drei Altersgruppen) Altersgruppe Langzeitüberleben / Anzahl (%) Pat. - 59 Mon. Gesamtzahl (%) Pat. > 59 Mon. >50 Jahre 21 (12,1) 8 (21,1) 29 (13,7) 50-69 Jahre 118 (67,8) 22 (57,8) 140 (66,0) >69 Jahre 35 (20,1) 8 (21,1) 43 (20,3) 174 (82,1) 38 (19,9) 212 (100,0) Gesamtzahl (%) p=0,314 Tab. A 7.5.1.b.: Langzeitüberleben und Alter bei OP (zwei Altersgruppen) Altersgruppe Langzeitüberlebende / Anzahl (%) Pat. -59 Mon. Gesamtzahl (%) Pat. > 59 Mon. - 69 Jahre 139 (79,9) 30 (78,9) 169 (79,7) >69 Jahre 35 (20,1) 8 (21,1) 43 (20,3) 174 (82,1) 38 (17,9) 212 (100,0) Gesamtzahl (%) p=0,896 Tab. A 7.5.2.: Langzeitüberleben und Geschlecht Geschlecht Langzeitüberleben / Anzahl (%) Pat. - 59 Mon. Gesamtzahl (%) Pat. > 59 Mon. Männlich 105 (60,3) 21 (55,3) 126 (59,4) Weiblich 69 (39,7) 17 (44,7) 86 (40,6) 174 (82,1) 38 (17,9) 212 (100,0) Gesamtzahl (%) p=0,563 Tab. A 7.5.3.: Langzeitüberleben und Histologie Histologie Langzeitüberleben / Anzahl (%) Pat. - 59 Mon. Adeno-Ca Muzinöses Adeno-Ca Gesamtzahl (%) Gesamtzahl (%) Pat. > 59 Mon. 128 (73,6) 35 (92,1) 163 (76,9) 46 (26,4) 3 (7,9) 49 (23,1) 174 (82,1) 38 (17,9) 212 (100,0) p=0,014 135 1,0 ,9 ,8 ,7 ,6 ,5 ,4 Histologie ,3 Muzinös. Adeno-Ca ,2 ,1 Adeno-Ca 0,0 0 12 24 36 48 60 72 84 96 108 120 Überlebenszeit nach OP / Monate (log rank Test<0,001) Abb. A 7.5.1.: Langzeitüberleben und Histologie im Kaplan-Meier-Diagramm Tab. A 7.5.4.: Langzeitüberleben und Tumorlokalisation Tumorlokalisation Langzeitüberleben / Anzahl (%) Pat. - 59 Mon. Gesamtzahl (%) Pat. > 59 Mon. Pankreaskopf 96 (55,2) 5 (13,2) 101 (47,6) Papilla Vateri 41 (23,6) 24 (63,2) 65 (30,7) Distaler Ductus chol. 37 (21,3) 9 (23,7) 46 (21,7) 174 (82,1) 38 (17,9) 212 (100,0) Gesamtzahl (%) p<0,001 136 1,0 ,9 ,8 ,7 ,6 Tumorlokalisation ,5 Papille ,4 ,3 Dist. Duct. chol. ,2 ,1 Kopf 0,0 0 12 24 36 48 60 72 84 96 108 120 Überlebenszeit nach OP / Monate (log rank Test p<0,001) Abb. A 7.5.2.: Langzeitüberleben und Tumorlokalisation (Kaplan-Meier) Tab. A 7.5.5.a.: Langzeitüberleben und T-Kategorie (vier T-Gruppen) T-Kategorie Langzeitüberleben / Anzahl (%) Pat. - 59 Mon. Gesamtzahl (%) Pat. > 59 Mon. T1 12 (6,9) 14 (36,8) 26 (12,3) T2 97 (55,7) 17 (44,7) 114 (53,8) T3 62 (35,6) 7 (18,4) 69 (32,5) T4 3 (1,7) 0 (0,0) 3 (1,4) 174 (82,1) 38 (17,9) 212 (100,0) Gesamtzahl (%) p<0,001 137 1,0 ,9 ,8 T-Stadium ,7 T4 ,6 ,5 T3 ,4 ,3 T2 ,2 ,1 T1 0,0 0 12 24 36 48 60 72 84 96 108 120 Überlebenszeit nach OP / Monate (log rank Test p=0,006) Abb. A 7.5.3.: Langzeitüberleben und T-Kategorie im Kaplan-Meier-Diagramm Tab. A 7.5.5.b.: Langzeitüberleben und T-Kategorie (zwei T-Gruppen) T-Stadium Langzeitüberleben / Anzahl (%) Pat. - 59 Mon. Gesamtzahl (%) Pat. > 59 Mon. T1/2 109 (62,6) 31 (81,6) 140 (66,0) T3/4 65 (37,4) 7 (18,4) 72 (34,0) 174 (82,1) 38 (17,9) 212 (100,0) Gesamtzahl (%) p=0,028 Tab. A 7.5.6.: Langzeitüberleben und N-Kategorie N-Kategorie Langzeitüberlebende / Anzahl (%) Pat. - 59 Mon. Gesamtzahl (%) Pat. > 59 Mon. N0 70 (40,2) 29 (76,4) 99 (46,7) N1 104 (59,8) 9 (23,7) 113 (53,9) Gesamtzahl (%) 174 (82,1) 38 (17,9) 212 (100,0) P<0,001 138 1,0 ,9 ,8 ,7 ,6 ,5 ,4 N-Status ,3 ,2 N1 ,1 0,0 N0 0 12 24 36 48 60 72 84 96 108 120 Überlebenszeit nach OP / Monate (log rank Test p<0,001) Abb. A 7.5.4.: Langzeitüberleben und N-Kategorie im Kaplan-Meier-Diagramm Tab. A 7.5.7.a.: Langzeitüberleben und Grading (drei G-Gruppen) Differenzierungsgrad Langzeitüberlebende / Anzahl (%) Pat. - 59 Mon. Gesamtzahl (%) Pat. > 59 Mon. G1 26 (14,9) 11 (28,9) 37 (17,5) G2 79 (45,4) 17 (44,7) 96 (45,3) G3 69 (39,7) 10 (26,3) 79 (37,3) 174 (82,1) 38 (17,9) 212 (100,0) Gesamtzahl (%) p=0,082 Tab. A 7.5.7.b.: Langzeitüberleben und G-Klassifikation (zwei G-Gruppen) Grading Langzeitüberlebende / Anzahl (%) Pat. - 59 Mon. G1/2 G3 Gesamtzahl (%) Gesamtzahl (%) Pat. > 59 Mon. 105 (60,3) 28 (73,7) 133 (62,7) 69 (39,7) 10 (26,3) 79 (37,3) 174 (82,1) 38 (17,9) 212 (100,0) p=0,123 139 Tab. A 7.5.8.a.: Langzeitüberleben und R-Klassifikation (drei R-Gruppen) Residualtumor Langzeitüberlebende / Anzahl (%) Gesamtzahl (%) Pat. - 59 Mon. Pat. > 59 Mon. R0 111 (63,8) 36 (24,5) 147 (69,3) R1 50 (28,7) 2 (5,3) 52 (24,5) R2 13 (7,5) 0 (0) 13 (6,2) Gesamtzahl (%) 174 (82,1) 38 (17,9) 212 (100,0) p<0,001 Tab. A 7.5.8.b.: Langzeitüberleben und R-Klassifikation (zwei R-Gruppen) Residualtumor Langzeitüberlebende / Anzahl (%) Pat. - 59 Mon. R0 R1/2 Gesamtzahl (%) Gesamtzahl (%) Pat. > 59 Mon. 111 (63,8) 36 (94,7) 147 (69,3) 63 (36,2) 2 (5,2) 65 (30,7) 174 (82,1) 38 (17,9) 212 (100,0) p<0,001 1,0 ,9 ,8 ,7 ,6 ,5 ,4 R-Klassifikation ,3 ,2 R1/2 ,1 0,0 R0 0 12 24 36 48 60 72 84 96 108 120 Überlebenszeit nach OP / Monate (log rank Test p<0,001) Abb. A 7.5.5.: Langzeitüberleben und R-Klassifikation im Kaplan-Meier-Diagramm 140 Tab. A 7.5.9.a.: Langzeitüberleben und Operationsart (WOP/PPPD) Operationsart Whipple gesamt PPPD gesamt Gesamtzahl (%) Langzeitüberlebende / Anzahl (%) Gesamtzahl (%) Pat. - 59 Mon. Pat. > 59 Mon. 124 (71,3) 22 (57,9) 146 (68,9) 50 (28,7) 16 (42,1) 66 (31,1) 174 (82,1) 38 (17,9) 212 (100,0) p=0,107 Tab. A 7.5.9.b.: Langzeitüberleben und Operationsart (ohne/mit PBV) Pankreas- Langzeitüberlebende / Anzahl (%) blindverschluß Pat. - 59 Mon. Pat. Ohne 128 (73,6) 31 (81,6) 159 (75,0) 46 (26,4) 7 (18,4) 53 (25,3) 174 (82,1) 38 (17,9) 212 (100,0) Pat. Mit Gesamtzahl (%) Gesamtzahl (%) Pat. > 59 Mon. p=0,301 Tab. A 7.5.10.: Langzeitüberleben und Erfahrung des Operateurs Operateur / Gruppe mehr Erfahrung weniger Erfahrung Gesamtzahl (%) Langzeitüberlebende / Anzahl (%) Gesamtzahl (%) Pat. - 59 Mon. Pat. > 59 Mon. 153 (87,9) 35 (92,1) 171 (89,5) 21 (12,1) 3 (7,9) 20 (10,5) 174 (82,1) 38 (17,9) 212 (100,0) p=0,462 Tab. A 7.5.11.: Langzeitüberleben und Somatostatin/-Octreotidgabe Somatostatin-/ Langzeitüberlebende / Anzahl (%) Octreotidgabe Pat. - 59 Mon. Pat. > 59 Mon. Pat. Ohne 103 (59,2) 21 (55,3) 124 (58,5) 71 (40,8) 17 (44,7) 88 (41,5) 174 (82,1) 38 (17,9) 212 (100,0) Pat. Mit Gesamtzahl (%) p=0,656 141 Gesamtzahl (%) Tab. A 7.5.12.: Langzeitüberleben und Pankreasfistel Pankreasfistel Pat. Ohne Pat. Mit Gesamtzahl (%) Langzeitüberlebende / Anzahl (%) Gesamtzahl (%) Pat. - 59 Mon. Pat. > 59 Mon. 128 (73,6) 22 (57,9) 150 (70,8) 46 (26,4) 16 (42,1) 62 (29,2) 174 (82,1) 38 (17,9) 212 (100,0) p=0,054 Tab. A 7.5.13.: Langzeitüberleben und Insuffizienz der HJS Insuffizienz der Langzeitüberlebende / Anzahl (%) Hepatikojejunostomie Pat. - 59 Mon. Pat. > 59 Mon. Pat. ohne 165 (94,8) 36 (94,7) 201 (94,8) 9 (5,2) 2 (5,3) 11 (5,2) 174 (82,1) 38 (17,9) 212 (100,0) Pat. Mit Gesamtzahl (%) Gesamtzahl (%) p=0,982 Tab. A 7.5.14: Langzeitüberleben und IAI Intraabdominale Langzeitüberlebende / Anzahl (%) Infektion Pat. - 59 Mon. Pat. > 59 Mon. Pat. Ohne 120 (81,6) 27 (18,4) 147 (77,0) 33 (75,0) 11 (25,0) 44 (23,0) 153 (80,1) 38 (19,9) 191 (100,0) Pat. Mit Gesamtzahl (%) Gesamtzahl (%) p=0,334 Tab. A 7.5.15.: Langzeitüberleben und IAB Intraabdominale Langzeitüberlebende / Anzahl (%) Blutung Pat. - 59 Mon. Pat. > 59 Mon. Pat. Ohne 147 (80,8) 35 (19,2) 182 (95,3) 6 (66,7) 3 (33,3) 9 (4,7) 153 (80,1) 38 (19,9) 191 (100,0) Pat. Mit Gesamtzahl (%) p=0,301 142 Gesamtzahl (%) Tab. A 7.5.16.: Langzeitüberleben und MES Magenentleerungs- Langzeitüberlebende / Anzahl (%) Störung Pat. - 59 Mon. Pat. > 59 Mon. Pat. Ohne 138 (0,2) 34 (19,8) 172 (90,1) 15 (78,9) 4 (21,1) 19 (9,9) 153 (80,1) 38 (19,9) 191 (100,0) Pat. Mit Gesamtzahl (%) Gesamtzahl (%) p=0,894 Tab. A 7.5.17.: Langzeitüberleben und pulmonale Komplikationen Pulmonale Langzeitüberlebende / Anzahl (%) Komplikationen Pat. - 59 Mon. Pat. > 59 Mon. Pat. Ohne 148 (80,9) 35 (19,1) 183 (95,8) 5 (62,5) 3 (37,5) 8 (4,2) 153 (80,1) 38 (19,9) 191 (100,0) Pat. Mit Gesamtzahl (%) Gesamtzahl (%) p=0,203 Tab. A 7.5.18: Langzeitüberleben und Reoperation Reoperation Pat. Ohne Pat. Mit Gesamtzahl (%) Langzeitüberlebende / Anzahl (%) Gesamtzahl (%) Pat. - 59 Mon. Pat. > 59 Mon. 146 (81,6) 33 (18,4) 179 (93,7) 7 (58,3) 5 (41,7) 12 (6,3) 153 (80,1) 38 (19,9) 191 (100,0) p=0,051 Tab. A 7.5.19.: Langzeitüberleben und Erythrozytensubstitution Erythrozyten- Langzeitüberlebende / Anzahl (%) Konzentrate periop. Pat. - 59 Mon. Gesamtzahl (%) Pat. > 59 Mon. Pat. mit - 5 EK 77 (74,8) 26 (25,2) 103 (53,9) Pat. mit > 5 EK 76 (49,7) 12 (31,6) 88 (46,1) Gesamtzahl (%) 153 (80,1) 38 (19,9) 191 (100,0) p=0,045 143 1,0 ,9 ,8 ,7 ,6 ,5 ,4 EK periop ,3 ,2 > 5 EK ,1 0,0 - 5 EK 0 10 20 30 40 50 60 70 80 90 100 110 120 Überlebenszeit nach OP / Monate (log rank Test p=0,004) Abb. A 7.5.6.: Langzeitüberleben und Erythrozytensubstitution (Kaplan-Meier) Tab. A 7.5.20.: Langzeitüberleben und Plasmasubstitution Fresh frozen plasma- Langzeitüberlebende / Anzahl (%) Konzentrate periop. Pat. - 59 Mon. Gesamtzahl (%) Pat. > 59 Mon. Pat. mit – 6 FFP 84 (54,9) 25 (65,8) 109 (57,1) Pat. mit > 6 FFP 69 (45,1) 13 (34,2) 82 (42,9) Gesamtzahl (%) 153 (80,1) 38 (19,9) 191 (100,0) p=0,225 144 1,0 ,9 ,8 ,7 ,6 ,5 FFP periop. ,4 ,3 >6 ,2 ,1 0,0 -6 0 12 24 36 48 60 72 84 96 108 120 Überlebenszeit nach OP / Monate (log rank Test p=0,224) Abb. A 7.5.7.: Langzeitüberleben und Plasmasubstitution (Kaplan-Meier) 145 Danksagung Mein besonderer Dank gilt Herrn Prof. Dr.med. Andreas Sendler für die jederzeit sehr hilfreiche und zuverlässige Betreuung der Arbeit und meiner Familie für ihre große Geduld und Unterstützung. Lebenslauf Name Johannes Martin Kormann Geburtsdatum 02.12.1970 Geburtsort Wolfratshausen i.Obb. Familienstand Verheiratet Nationalität Deutsch Schulbildung 1977-1981 Grundschule Rotbuchenstraße München 1981-1982 Theodolinden-Gymnasium München 1982-1990 Christoph-Probst-Gymnasium Gilching 06 / 1990 Abitur Studium 1991-1997 Studium der Humanmedizin an der Technischen Universität München, 11 / 1997 Abschluss mit 3. Staatsexamen Beruflicher Werdegang 04 / 1998 - 08 / 2001 Arzt im Praktikum sowie Assistenzarzt an der Klinik und Poliklinik für Viszeral-, Thorax- und Gefäßchirurgie des Universitätsklinikums Carl Gustav Carus an der Technischen Universität Dresden, Direktor: Prof. Dr.med. H.D. Saeger 09 / 2001 - 12 / 2003 Assistenzarzt in der Abteilung für Viszeral-, Thorax- und Gefäßchirurgie des Klinikums Konstanz, Chefarzt: Prof. Dr.med. M. Nagel 12 / 2003 Facharztprüfung für Chirurgie, Freiburg i. Br. Seit 02 / 2004 als Facharzt in der Abteilung für Viszeralchirurgie und Proktologie am Diakonissenkrankenhaus Dresden, Chefarzt: Dr.med. Th. Jacobi Seit 03 / 2007 Zusatzbezeichnung Proktologie Seit 11 / 2008 Facharzt für Viszeralchirurgie Medizinische Zusatzqualifikationen Sonografie (DEGUM) Endoskopie