HMGB1
Werbung
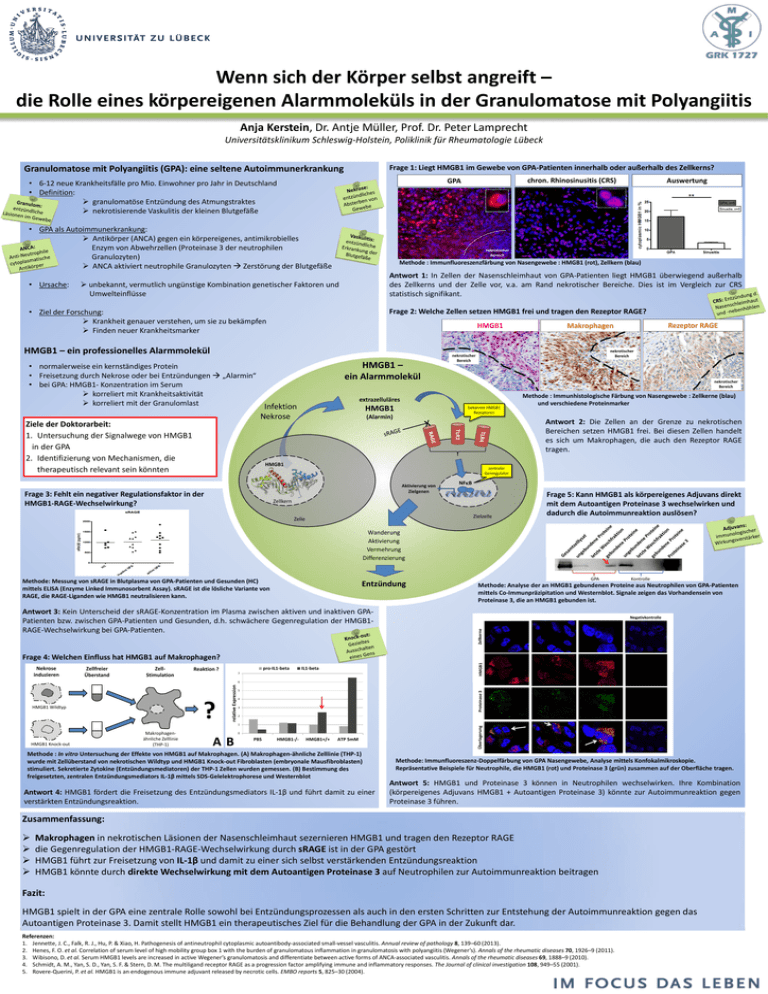
Wenn sich der Körper selbst angreift – die Rolle eines körpereigenen Alarmmoleküls in der Granulomatose mit Polyangiitis Anja Kerstein, Dr. Antje Müller, Prof. Dr. Peter Lamprecht Universitätsklinikum Schleswig-Holstein, Poliklinik für Rheumatologie Lübeck Frage 1: Liegt HMGB1 im Gewebe von GPA-Patienten innerhalb oder außerhalb des Zellkerns? Granulomatose mit Polyangiitis (GPA): eine seltene Autoimmunerkrankung • GPA als Autoimmunerkrankung: Antikörper (ANCA) gegen ein körpereigenes, antimikrobielles Enzym von Abwehrzellen (Proteinase 3 der neutrophilen Granulozyten) ANCA aktiviert neutrophile Granulozyten Zerstörung der Blutgefäße • Ursache: Methode : Immunfluoreszenzfärbung von Nasengewebe : HMGB1 (rot), Zellkern (blau) Antwort 1: In Zellen der Nasenschleimhaut von GPA-Patienten liegt HMGB1 überwiegend außerhalb des Zellkerns und der Zelle vor, v.a. am Rand nekrotischer Bereiche. Dies ist im Vergleich zur CRS statistisch signifikant. • Ziel der Forschung: Krankheit genauer verstehen, um sie zu bekämpfen Finden neuer Krankheitsmarker Frage 2: Welche Zellen setzen HMGB1 frei und tragen den Rezeptor RAGE? HMGB1 HMGB1 – ein professionelles Alarmmolekül HMGB1 – ein Alarmmolekül • normalerweise ein kernständiges Protein • Freisetzung durch Nekrose oder bei Entzündungen „Alarmin“ • bei GPA: HMGB1- Konzentration im Serum korreliert mit Krankheitsaktivität korreliert mit der Granulomlast Infektion Rezeptor RAGE Makrophagen nekrotischer Bereich nekrotischer Bereich nekrotischer Bereich extrazelluläres HMGB1 Nekrose bekannte HMGB1 Rezeptoren (Alarmin) Methode : Immunhistologische Färbung von Nasengewebe : Zellkerne (blau) und verschiedene Proteinmarker TLR2 Antwort 2: Die Zellen an der Grenze zu nekrotischen Bereichen setzen HMGB1 frei. Bei diesen Zellen handelt es sich um Makrophagen, die auch den Rezeptor RAGE tragen. HMGB1 zentraler Genregulator Aktivierung von Zielgenen Frage 3: Fehlt ein negativer Regulationsfaktor in der HMGB1-RAGE-Wechselwirkung? Auswertung nekrotischer Bereich unbekannt, vermutlich ungünstige Kombination genetischer Faktoren und Umwelteinflüsse Ziele der Doktorarbeit: 1. Untersuchung der Signalwege von HMGB1 in der GPA 2. Identifizierung von Mechanismen, die therapeutisch relevant sein könnten chron. Rhinosinusitis (CRS) GPA • 6-12 neue Krankheitsfälle pro Mio. Einwohner pro Jahr in Deutschland • Definition: granulomatöse Entzündung des Atmungstraktes nekrotisierende Vaskulitis der kleinen Blutgefäße NFB Zellkern Zielzelle Zelle Frage 5: Kann HMGB1 als körpereigenes Adjuvans direkt mit dem Autoantigen Proteinase 3 wechselwirken und dadurch die Autoimmunreaktion auslösen? Wanderung Aktivierung Vermehrung Differenzierung Methode: Messung von sRAGE in Blutplasma von GPA-Patienten und Gesunden (HC) mittels ELISA (Enzyme Linked Immunosorbent Assay). sRAGE ist die lösliche Variante von RAGE, die RAGE-Liganden wie HMGB1 neutralisieren kann. Entzündung Kontrolle Methode: Analyse der an HMGB1 gebundenen Proteine aus Neutrophilen von GPA-Patienten mittels Co-Immunpräzipitation und Westernblot. Signale zeigen das Vorhandensein von Proteinase 3, die an HMGB1 gebunden ist. Negativkontrolle Zellkerne Antwort 3: Kein Unterscheid der sRAGE-Konzentration im Plasma zwischen aktiven und inaktiven GPAPatienten bzw. zwischen GPA-Patienten und Gesunden, d.h. schwächere Gegenregulation der HMGB1RAGE-Wechselwirkung bei GPA-Patienten. GPA Nekrose induzieren Zellfreier Überstand ZellStimulation pro-IL1-beta Reaktion ? HMGB1 Frage 4: Welchen Einfluss hat HMGB1 auf Makrophagen? IL1-beta 7 HMGB1 Knock-out Makrophagenähnliche Zelllinie (THP-1) Proteinase 3 5 4 3 2 1 0 AB PBS HMGB1-/- HMGB1+/+ ATP 5mM Methode : In vitro Untersuchung der Effekte von HMGB1 auf Makrophagen. (A) Makrophagen-ähnliche Zelllinie (THP-1) wurde mit Zellüberstand von nekrotischen Wildtyp und HMGB1 Knock-out Fibroblasten (embryonale Mausfibroblasten) stimuliert. Sekretierte Zytokine (Entzündungsmediatoren) der THP-1 Zellen wurden gemessen. (B) Bestimmung des freigesetzten, zentralen Entzündungsmediators IL-1β mittels SDS-Gelelektrophorese und Westernblot Antwort 4: HMGB1 fördert die Freisetzung des Entzündungsmediators IL-1β und führt damit zu einer verstärkten Entzündungsreaktion. Überlagerung ? HMGB1 Wildtyp relative Expression 6 Methode: Immunfluoreszenz-Doppelfärbung von GPA Nasengewebe, Analyse mittels Konfokalmikroskopie. Repräsentative Beispiele für Neutrophile, die HMGB1 (rot) und Proteinase 3 (grün) zusammen auf der Oberfläche tragen. Antwort 5: HMGB1 und Proteinase 3 können in Neutrophilen wechselwirken. Ihre Kombination (körpereigenes Adjuvans HMGB1 + Autoantigen Proteinase 3) könnte zur Autoimmunreaktion gegen Proteinase 3 führen. Zusammenfassung: Makrophagen in nekrotischen Läsionen der Nasenschleimhaut sezernieren HMGB1 und tragen den Rezeptor RAGE die Gegenregulation der HMGB1-RAGE-Wechselwirkung durch sRAGE ist in der GPA gestört HMGB1 führt zur Freisetzung von IL-1β und damit zu einer sich selbst verstärkenden Entzündungsreaktion HMGB1 könnte durch direkte Wechselwirkung mit dem Autoantigen Proteinase 3 auf Neutrophilen zur Autoimmunreaktion beitragen Fazit: HMGB1 spielt in der GPA eine zentrale Rolle sowohl bei Entzündungsprozessen als auch in den ersten Schritten zur Entstehung der Autoimmunreaktion gegen das Autoantigen Proteinase 3. Damit stellt HMGB1 ein therapeutisches Ziel für die Behandlung der GPA in der Zukunft dar. Referenzen: 1. Jennette, J. C., Falk, R. J., Hu, P. & Xiao, H. Pathogenesis of antineutrophil cytoplasmic autoantibody-associated small-vessel vasculitis. Annual review of pathology 8, 139–60 (2013). 2. Henes, F. O. et al. Correlation of serum level of high mobility group box 1 with the burden of granulomatous inflammation in granulomatosis with polyangiitis (Wegener’s). Annals of the rheumatic diseases 70, 1926–9 (2011). 3. Wibisono, D. et al. Serum HMGB1 levels are increased in active Wegener’s granulomatosis and differentiate between active forms of ANCA-associated vasculitis. Annals of the rheumatic diseases 69, 1888–9 (2010). 4. Schmidt, A. M., Yan, S. D., Yan, S. F. & Stern, D. M. The multiligand receptor RAGE as a progression factor amplifying immune and inflammatory responses. The Journal of clinical investigation 108, 949–55 (2001). 5. Rovere-Querini, P. et al. HMGB1 is an endogenous immune adjuvant released by necrotic cells. EMBO reports 5, 825–30 (2004).











