Auswirkungen der aktuellen Empfehlungen auf die HIV
Werbung

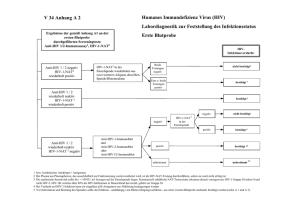
Dr. Andreas Lucht, MPH, MSc FA für Laboratoriumsmedizin FA für Mikrobiologie, Virologie und Infektionsepidemiologie Labor Krone, Bad Salzuflen Konsiliarlabor für Treponemeninfektionen HIV-Workshop des LZG NRW, Münster, 23.09.2015 Auswirkungen auf die Zielrichtung der Diagnostik Auswirkungen des vorgeschlagenen Algorithmus auf die Labordiagnostik Auswirkungen auf die Kommentierung PCR-Diagnostik (NAT-Nukleinsäureamplifikationstests) negative Screeningtests - „ soll dazu dienen, eine HIV-Infektion bereits aus der primär gewonnenen Probe“ … - „ und auch möglichst früh nach Infektion sicher nachzuweisen, so dass der Infizierte möglichst schnell einer Therapie bzw. medizinischen Versorgung zugeführt werden kann“ Stellungnahme der Gemeinsamen Diagnostikkommission der Deutschen Vereinigung zur Bekämpfung von Viruskrankheiten e.V. (DVV e.V.) …, Bundesgesundheitsblatt 7/2015 HIV-Screeningtest (CMIA: p24, HIV-1-Ak, HIV-2-Ak) reaktiv nicht reaktiv Anamnese, Klinik Exposition vor >6 Wochen <6 o.B. V.a. akute Infektion HIV-negativ Immunoblot (HIV-1 Ak, HIV-2 Ak) IB fraglich oder negativ IB reaktiv HIV-1-PCR neg. Kontrolle in 1-3 Wochen pos. HIV-positiv bei reaktivem Suchtest, negativer oder fraglichem Immunblot und negativer HIV-1-PCR, sollte eine (qualitative) HIV-2-PCR durchgeführt werden bei wiederholt isolierter Reaktivität einzelner Banden im Immunblot (HIV-1 oder HIV-2), sollte neben einer HIV-1PCR auch eine HIV-2-PCR durchgeführt werden kommerzielle, qualitative HIV-2-PCRs nur in der Blutspende zugelassen, in-house-Methoden am NRZ „notwendige“ HIV-2-NAT-Untersuchungen im Rückblick: 2013: 15; 2014: 22 , 1. Hj. 2015: 17 (ca. 100 Euro pro PCR, NRZ günstiger für LZG.NRW?? ) geschätzte Zahl der HIV-2-Antigen-Positiven mit reaktivem Suchtest 0,01 pro Jahr (Berechnung später) geschätzte Kosten ca. 2000-3000 Euro pro Jahr Stellungnahme: „bei begründetem Verdacht auf eine kürzlich erworbene Infektion (letzte potentielle Exposition liegt kürzer als 6 Wochen zurück) und noch fehlender Antikörperbildung (negativer Screeningtest) sollte eine HIV-1 NAT durchgeführt werden“ erfolgt nicht automatisch durch das Labor, sondern muss vom Gesundheitsamt/Klienten angefordert (und bezahlt) werden, kann aus der vorhandenen Probe durchgeführt werden bei geschätzt ca. 4-5% der Klienten mit Exposition innerhalb der letzten 6 Wochen: - ca. 500 Untersuchungen im Jahr á 40 Euro - ca. zusätzliche 3-5 Infektionen (Fiebig I, 12.-16.Tag) - geschätzte Kosten: ca. 20.000 € pro Jahr Wenn dass Labor diesem Algorithmus folgt, können bei „Verdacht auf akute Infektion“ und „Risiko in den letzten 6 Wochen“ bei negativem Screeningtest erhebliche Kosten entstehen (HIV-1-PCR, evtl. HIV-2-PCR, Immunoblot) Vorabsprache des Vorgehens mit dem Labor, dass kein spezifischer Laborablauf in Gang gesetzt wird (kein Automatismus) Negativer Suchtest ist ohnehin nie ganz sicher -> Verlaufskontrolle nach 1-3 Wochen Schafberger, HIVreport.de 03/2015 2014 European Guideline on HIV testing*: bei klinischen Symptomen oder high-risk exposure innerhalb der letzten 6 Wochen, erneuter Test 6 Wochen nach dem Expositionszeitpunkt „englisches“ Vorgehen gemäß Empfehlung der British Association for Sexual Health and HIV**: „great majority“ 4 Wochen nach Exposition detektiert, Test „highly likely to exclude HIV infection“ Testung auch bereits früher als 4 Wochen durchführen um frühe Infektionen zu erkennen, nicht verweigern Wiederholung 8 Wochen post exposure nur bei Patienten mit hohem Risiko * Gökengin et al., Int J STD & AIDS 2014 ** BASHH: Statement on HIV window period NAT (Nukleinsäureamplifikationstest)/PCR als gleichwertiger Bestätigungstest Sensitivitätsverlust bei NAT aus Serum 6-Wochen-Frist bei negativen Screeningtests Stellungnahme spricht von „Gleichwertigkeit von immunologischen Bestätigungstests und Nukleinsäureamplifikationstesten (NAT) im Rahmen der HIV-Stufendiagnostik“ NAT können das serologische HIV-Screening im Rahmen der Stufendiagnostik zum Erstnachweis einer HIV-Infektion nicht ersetzen Bei Vorliegen eines grenzwertigen oder reaktiven Ergebnisses im HIV-Screeningtest können beide Verfahren gleichwertig angewendet werden, Immunblot und PCR sind austauschbar in der Bestätigungsdiagnostik Akkreditierte Labore verwenden im Rahmen der Routinediagnostik CE-zertifizierte Tests und akkreditierte Testverfahren (keine in-house-Methoden). Die kommerziellen Immunblots sind für die HIVBestätigungsdiagnostik vorgesehen und zugelassen. Die kommerziellen HIV-1-NAT-Systeme sind von den Herstellern nur für den Einsatz im Kontext einer HIVTherapie zugelassen (Therapiemonitoring). „Die Anwendung von HIV-NAT-Systemen im Rahmen einer Stufendiagnostik ist möglich, …sollte jedoch im Befund kommentiert werden“ Die verwendete HIV-NAT ist vom Hersteller für die Verlaufsdiagnostik bei bekannter HIVInfektion, aber nicht für den Erstnachweis einer HIV-Infektion vorgesehen. Der Einsatz der HIV-NAT im Rahmen der Stufendiagnostik entspricht jedoch den aktuellen Empfehlungen zur HIV-Bestätigungsdiagnostik. prinzipiell serologische und NAT-Diagnostik aus einem einzigen Röhrchen gewünscht (aber welches?) Architect HIV Ag/Ab Combo (CMIA) kann wie die Mehrzahl der anderen Screeningtests theoretisch sowohl Serum als auch Plasma als Probenmaterial verwenden* aber für Screeningtests bei Großgeräteeinsatz im akkreditierten Labor besser nur ein Probenmaterial (allgemein Serum für CMIA); Arztpraxen, Krankenhäuser schicken grundsätzlich Serum zur Antikörperdiagnostik falls Bestätigungsdiagnostik grundsätzlich mittels NAT durchgeführt wird, wäre evtl. Plasma besser * http://www.fda.gov/downloads/BiologicsBloodVaccines/UCM216309.p Stellungnahme: Steht als primär gewonnene Probe Serum zur Verfügung, ist zu beachten, dass die HIVPCR aus Serum ggf. zu einer reduzierten Sensitivität führt und abweichend von den Herstellerangaben als „off-label use“* durchgeführt wird. *allgemein: Zulassungsüberschreitung eines AM *Definition des G-BA: Unter „Off-Label-Use“ versteht man die Anwendung eines zugelassenen Arzneimittels außerhalb der von den nationalen und europäischen Zulassungsbehörden genehmigten Anwendungsgebiete (Indikationen)“. persönliche, umfassende, gründliche Aufklärung zu möglichem Nutzen und möglichem Risiko ausführliche, lückenlose Dokumentation Zustimmung des Patienten „in jedem Fall unerlässlich“ (Einwilligungserklärung) alleinige (haftungsrechtliche) Verantwortung beim veranlassenden Arzt Gefährdungshaftung des pharmazeutischen Unternehmens nur bei zulassungs- bzw. bestimmungsgemäßem Einsatz https://www.g-ba.de/institution/themenschwerpunkte/arzneimittel/off-label-use/hintergrund/ im Serum vor allem bei längerem Stehen lassen und bei Transport von Vollblut (nicht zentrifugiert) laut Untersuchungen im eigenen Labor ca. 5-10% Reduktion der gemessenen Viruslast laut NRZ bis maximal 20% Verlust Viruslasten bei positiven PCRs aus Serum der Gesundheitsämter NRW 2014-2015: 1,4 Mio., 7,5 Mio., 150.000, 4,2 Mio., 1,2 Mio., 1,3 Mio., >10 Mio., >30 Mio. VÄ/ml laut Stellungnahme NAT „nicht eindeutig“ bei </= 1000 Kopien/ml Für die verwendete HIV-NAT-Bestimmung ist vom Hersteller Plasma als Untersuchungsmaterial vorgesehen. In diesem Fall war jedoch nur Serum für die Untersuchung vorhanden. Damit ist eine geringfügige Einschränkung der Sensitivität im Vergleich zur Verwendung von Plasma gegeben. Dem wird durch die Empfehlung einer Verlaufskontrolle Rechnung getragen. Stufendiagnostik ist Grundlage für die gesicherte Diagnose einer HIV-Infektion (und damit Basis für die Mitteilung an den betroffenen Patienten bereits beim virusdiagnostischen Erstnachweis (anders als alte Empfehlung von 1992) Die Untersuchung einer zweiten, unabhängig gewonnen Blutprobe zum Ausschluss einer Probenverwechslung oder Probenkontamination ist dringend angeraten. nur für 4. Generations-Labortests (HIV-1-Ak, HIV-2-Ak, p24-Antigen), nicht 3. Generation Ausschluss „mit hoher Sicherheit“ (nicht wie bereits im Januar von AIDS-Hilfe vorab auf Website verkündet: „sicher ausgeschlossen“) bei Schnelltests (auch mit Ag-Nachweis) weiterhin Aussschluss einer HIV-Infektion mit hoher Sicherheit, wenn Exposition kürzer als 12 Wochen zurückliegt (Alere Schnelltest hat nicht die erforderliche Sensitivität für den Antigennachweis) Das negative Ergebnis im HIV-Antigen/Antikörper-Screeningtest schließt eine HIVInfektion mit hoher Wahrscheinlichkeit aus, wenn die letzte potenzielle HIV-Exposition länger als 6 Wochen zurückliegt. Bei weiterbestehendem Verdacht auf eine HIVInfektion wird eine Verlaufskontrolle empfohlen. „eine Infektion mit einer seltenen HIV-Variante vorliegt z.B. HIV-1-Gruppe O oder HIV-2, …, da der (sensitive) Nachweis von HIV-Antigen nicht in jedem Fall gesichert ist“ ein/e präexistierende/r Immunsuppression/Immundefekt mit Antikörperbildungsstörung (zeitlich verzögerter Nachweis von HIV-Antikörpern) eine antiretrovirale Postexpositionsprophylaxe (PEP) durchgeführt wird (Zeitfenster beginnt 6 Wochen nach Absetzen der PEP) Stellungnahme der Gemeinsamen Diagnostikkommission der Deutschen Vereinigung zur Bekämpfung von Viruskrankheiten e.V. (DVV e.V.) …, Bundesgesundheitsblatt 7/2015 Ausnahmen sind für die AIDS-Hilfe in der Praxis „kaum relevant“* - da es sich um in der Regel schwerkranke Patienten handelt (bekannte Erkrankung und Medikation) und sie daher nicht im Gesundheitsamt/Testprojekt zu erwarten sind* - seltene HIV-1-Varianten und HIV-2 sind in Deutschland extrem selten und haben im Durchschnitt auch nach 22 Tagen Antikörper, damit ist man mit den 6 Wochen auch bei „durchschnittlichen“ seltenen HIV-1-Varianten und HIV-2 Patienten auf der sicheren Seite* ??? aber kein genauer Zeitverlauf von HIV-2 bekannt; unauffällige Antikörperbefunde schliessen eine akute oder frühe HIV-2-Infektion nicht aus (<60 Tage seit Zeitpunkt der Exposition)** * Schafberger, HIVreport.de 03/2015 ** http://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/61785 Stellungnahme: … da der (sensitive) Nachweis von HIV-1 Gruppe O- und HIV-2-Antigen nicht in jedem Fall gesichert ist AIDS-Hilfe: „die Stellungnahme … liest sich etwas sperrig, weil natürlich Ausnahmesituationen und Einschränkungen ausführlich erläutert werden“ aber „schwammige Formulierungen“ der Hersteller und der Stellungnahme verschleiern, dass HIV-Tests zum Nachweis von p24-Antigen (HIV-1) konzipiert sind und nicht zum Nachweis von p26/p27 (HIV-2) unterschiedliche Situation: HIV-1 Gruppe O und HIV-2 seltene HIV-1-Variante (Outlier) Vorkommen vor allem in West-Zentralafrika (Kamerun, Äquatorialguinea, Gabun) in Deutschland etwa 0,6% der HIV-Infektionen manche Tests haben Schwierigkeiten Gruppe O zu erkennen (sowohl Screeningtests, als auch Immunoblot und PCR) der von uns verwendete CMIA hat hohe Agund Ak-Sensitivität für HIV-1 Gruppe O, der verwendete Inno-Lia Blot ist ebenfalls explizit zugelassen für HIV-1, HIV-2 und HIV-1 Gr. O endemisch in Westafrika (Senegal, Gambia, Elfenbeinküste, Kap Verde, Guinea-Bissau, Mauretanien) relativ häufig in Ländern mit entsprechender kolonialer Vergangenheit (Portugal, Spanien, Frankreich) und Ländern mit engen Verbindungen nach Westafrika (Brasilien, Indien) weltweit geschätzt 1-2 Millionen Infizierte in Deutschland sehr selten, 2013 u. 2014: 0,3% laut RKI* längere asymptomatische Phase niedrige Viruslast, häufig unbehandelt PCR negativ intrinsische Resistenz für Nicht-nukleosidische Reverse Transkriptase Inhibitoren (NNRTI) häufig schlechtes Ansprechen auf Therapie * Epidemiologisches Bulletin Nr. 27, 7/2015 • Originated in or have traveled to an HIV-2-endemic area – West African countries (Guinea-Bissau, Cape Verde, Ivory Coast, Gambia, Mali, Mauritania, Nigeria, Sierra Leone, Benin, Burkina Faso, Ghana, Guinea, Liberia, Niger, Sao Tome, Senegal, and Togo), Angola, Mozambique, and India • Received medical care, injections, immunizations, phlebotomy, surgery, or blood products or participated in vaccine trials in an HIV-2-endemic area • Had sexual or needle-sharing contact with persons who are infected with HIV-2 or are from an HIV-2-endemic area • Born to a mother with known HIV-2 infection • Had opportunistic infections or other clinical symptoms of HIV/AIDS but tested negative or indeterminate for HIV-1 • Had multiple HIV-1 indeterminate antibody test results • Had a confirmed diagnosis of HIV-1 but an undetectable viral load that is incompatible with the clinical status http://www.mayomedicallaboratories.com/it-mmfiles/HIV-2_Testing_Algorithm_Screening__Nonsymptomatic__Diagnostic__Symptomatic_.pdf Vergleich der Antigenkomponente verschiedener HIVAntigen-/Antikörpertests HIV-1-Varianten - 3 von 10 Tests erkennen keine Typ O Isolate - 6 von 10 Tests erkennen keine Typ P Isolate - 5 von 10 Tests erkennen nicht alle Typ M non-BIsolate HIV-2 (Kreuzreaktivität) - 3 von 10 Tests waren in der Lage auch HIV-2 zu erkennen (in 2-10 von 30 Proben) Architect-CMIA erkennt HIV-1 Gruppen gut, HIV-2 nicht Testung der Antigensensitivität von 5 p24Antigen-Tests und 11 Ag/Ak-Combotests Testung mit VLPs mit p24 von HIV-1 Subtypen A-H und CRFs (circulating recombinant forms) nur 3/11 Combo-Tests erkennen alle Subtypen mit ausreichender Sensitivität (Abbott Architect 97,7%, Siemens 93%, Roche 89,9%) Von den 4. Generationstests (Combo) haben viele Sensitivitätsprobleme vor allem bei nonB-Subtypen (weltweit Subtyp C und A häufig) 2014 ca. 12.000 Untersuchungen, davon 170 Erstbefunde, davon 7 akute HIV-Infektionen zu erwartende Anzahl von frühen (Antikörpernegativen oder –fraglichen) HIV-1 Gruppe OInfektionen: 0,6%, d.h. 0,04 Fälle/Jahr zu erwartende Anzahl von frühen (Antikörpernegativen oder –fraglichen ) HIV-2-Infektionen: 0,3%, d.h. 0,02 Fälle pro Jahr d.h. alle 25 Jahre ein Fall von akuter HIV-1 Gr.O und alle 50 Jahre ein Fall akuter HIV-2 Infektion zu erwarten im ÖGD NRW Stufendiagnostik im ÖGD NRW entspricht weitestgehend dem neuen Algorithmus 6-Wochen-Frist für Labordiagnostik unter Berücksichtigung der (für den ÖGD fraglich relevanten) Ausnahmen, insbesondere HIV-2 weiterhin 12-Wochen-Frist für alle Schnelltests NAT „gleichwertig“ nur in der Bestätigungsdiagnostik mit entsprechendem Hinweis in der Kommentierung Diagnostik aus einer Primärprobe: NAT aus Serum ist „off-label use“ mit geringem Sensitivitätsverlust