Projektkennblatt Deutschen Bundesstiftung Umwelt 13037 32
Werbung

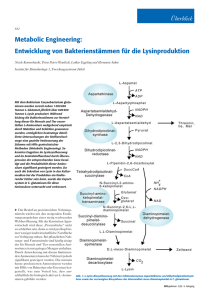
06/02 Projektkennblatt der Deutschen Bundesstiftung Umwelt Az 13037 Referat 32 Fördersumme 604.523,40 € Antragstitel Förderschwerpunkt Biotechnologie: Entwicklung eines biotechnologischen Verfahrens zur fermentativen Gewinnung der Aminosäure L-Serin unter besonderer Berücksichtigung von Aspekten der Ökobilanzierung Stichworte Schwerpunkt-Biotechnologie, Verfahren Laufzeit 4 Jahre und 11 Monate Projektbeginn 21.09.1998 Ökonomie, Mikrobiologie, Projektende 04.09.2003 Förderbereich 1991 – 1998 II.4.Umweltvorsorge, angewandte Umweltforschung Umweltvorsorge, angewandte Umweltforschung Bewilligungsempfänger Forschungszentrum Jülich GmbH Institut für Biotechnologie I Postfach Kooperationspartner Umweltchemikalien, Projektphase(n) 1 Umweltforschung Tel 02461/61-3294 Fax 02461/61-2710 Projektleitung Herr Prof. Dr. Hermann Sahm Bearbeiter 52425 Jülich Frau Dr. Peters-Wendisch AMINO GmbH 38373 Frellstedt Universität Hannover, Lehrstuhl für Ordnungs- und Prozesspolitik Hannover Zielsetzung und Anlaß des Vorhabens Der steigende Bedarf an der Aminosäure L-Serin für die Pharma- und Ernährungsmittelindustrie erfordert die Etablierung einer Alternative zur energieaufwändigen und emissionsträchtigen klassischen sauren Hydrolyse proteinogener Rohstoffe. Ziel des Projekts ist daher die Entwicklung eines hocheffizienten biotechnologischen Verfahrens zur gezielten Herstellung der Aminosäure L-Serin aus Glukose mittels rekombinanter Bakterienstämme, bei der lediglich kompostierbare Biomasse als Reststoff neben dem L-Serin anfällt. Das herkömmliche und das fermentative Verfahren werden dann in neuartiger Weise mittels Ökobilanzierung verglichen. Darstellung der Arbeitsschritte und der angewandten Methoden Ziel war die gezielte Entwicklung eines Bakterienstamms, mit dem die Produktion der Aminosäure L-Serin möglich ist. Durch genetische und molekulare Arbeiten wird die normalerweise gedrosselt ablaufende L-Serin-Synthese in dem Bakterium Corynebacterium glutamicum erhöht. Dadurch kommt es zu erhöhter intrazellulärer Synthese von L-Serin und letztlich zu dessen Ausscheidung in das umgebende Medium, aus dem L-Serin isoliert werden kann. Zunächst wurden hierzu die verantwortlichen L-SerinBiosynthesegene aus C. glutamicum isoliert, durch Mutation dereguliert und mittels geeigneter Vektoren in C. glutamicum überexprimiert. Des Weiteren wurde der Abbau von L-Serin durch Deletion oder Reduktion der Expression der entsprechenden Gene verhindert. Nach jedem Teilschritt wurde der entsprechende Stamm auf seine Fähigkeit L-Serin ins Medium auszuscheiden getestet. Die besten Stämme wurden im Labormaßstab bei der Amino GmbH überprüft. Parallel erstellte der Lehrstuhl Ordnungs- und Prozesspolitik eine Ökobilanzierung und Wirtschaftlichkeitsanalyse der Referenzprozesse Gewinnung von L-Serin durch "Saure Hydrolyse" bzw. "Fermentation". Dieses beinhaltete folgende Teilschritte: Festlegung von Zieldefinition und Untersuchungsrahmen, Bilanzierung der mit dem L-Serin herstellenden Verfahren verknüpften Inputs und Outputs (Sachbilanz), Beurteilung der Sachbilanzergebnisse bezüglich ihrer Umweltwirkungen (Wirkungsbilanz) sowie eine Gesamtbewertung von Sach- und Wirkungsbilanz. Für die Erhebung der Basisdaten gab es eine enge Zusammenarbeit mit verschiedenen Abteilungen der Amino GmbH. Deutsche Bundesstiftung Umwelt } An der Bornau 2 } 49090 Osnabrück } Tel 0541/9633-0 } Fax 0541/9633-190 } http://www.dbu.de Ergebnisse und Diskussion Zur gezielten Konstruktion eines L-Serin-Produktionsstamms wurde das Bakterium C. glutamicum verwendet, das bezüglich seiner Fähigkeit andere Aminosäuren, wie L-Lysin und L-Glutamat in großen Mengen zu bilden gut untersucht ist. Zunächst wurde die L-Serin-Biosynthese untersucht. Die drei verantwortlichen Gene serA, serC und serB wurden aus C. glutamicum kloniert. Die Regulation der L-SerinBiosynthese erfolgt auf Enzymaktivitätsebene durch Hemmung des ersten Enzyms des Biosynthesewegs, der 3-Phosphoglycerat-Dehydrogenase (PGDH, serA) durch L-Serin. Durch die Konstruktion von mutierten Allelen des serA-Gens von C. glutamicum mittels PCR wurden gezielt PGDH-Muteine erzeugt, die sich nicht mehr durch L-Serin hemmen lassen. Die alleinige Überexpression des deregulierten serAGens führte nicht zu einer gesteigerten L-Serin-Bildung, wie dies z. B. für die L-Lysin-Bildung bekannt ist. Auch die Überexpression aller drei Biosynthesegene im Wildtyp führte zu keiner signifikanten Steigerung der L-Serin-Bildung. Dies deutet darauf hin, dass neben der Hemmung auf Aktivitätsebene weitere, bisher unbekannte Regulationsmechanismen des L-Serin-Biosynthesewegs vorhanden sind. Neben der L-Serin-Biosynthese wurde auch der Abbau von L-Serin untersucht. L-Serin dient als Vorstufe zur Synthese zahlreicher anderer zellulärer Metabolite. Es konnte gezeigt werden, dass vor allem die Umsetzung von L-Serin zu Pyruvat, katalysiert durch das Enzym L-Serin-Dehydratase, sowie die Bildung von Glycin und C1-Kohlenstoffeinheiten aus L-Serin durch das Enzym Serinhydroxymethyltransferase eine große Bedeutung haben. Das Ausschalten bzw. die Reduktion dieser Reaktionen führte bei gleichzeitiger Überexpression der L-Serin-Biosynthesegene zu einer signifikanten Steigerung der L-Serin-Bildung, jedoch überstieg die Ausbeute bezogen auf das eingesetzte Substrat nie 0,05 %. Die L-SerinBiosynthese erfolgt ausgehend von dem Glykolyseintermediat 3-Phosphoglycerat. Um eine mögliche Limitation in der Bereitstellung dieser Vorstufe für die L-Serin-Bildung auszuschalten wurden durch gengerichtete Mutagenese Mutanten hergestellt, die einen Block in der Glykolyse unterhalb der Abzweigung zum L-Serin aufweisen, bzw. Glykolyseintermediate anstauen. Die Kombination dieser Mutationen mit der Überexpression der L-Serin-Biosynthesegene und einer Reduktion des L-Serin-Abbaus führte letztlich zu einer Steigerung der L-Serin-Ausbeute um das 140-fache, auf bis zu 7,5 % mit einer Produktausbeute von 2,5 g/l. Als Zielparameter für die industrielle Produktion wurde in der Modellbildung für die Ökobilanz und die Wirtschaftlichkeitsanalyse für das fermentative Verfahren von 30 g/l Produktausbeute (Anteil des L-Serins im zellfreien Fermentermedium) und 47 % Aufarbeitungsausbeute (Ausbeute im Aufreinigungsverfahren nach der Fermentation) ausgegangen. Unter diesen Rahmenbedingungen zeigen sich signifikante ökologische Vorteile des neuartigen fermentativen Verfahrens gegenüber dem etablierten Referenzverfahren der sauren Hydrolyse. Bei fast allen ökologisch relevanten Input- und Outputgrößen liegen bei der Fermentation z. T. deutlich günstigere Mengenverhältnisse im Vergleich zur sauren Hydrolyse vor. Insbesondere in den zentralen ökologischen Bereichen Energiebedarf, Wasserverbrauch und Salzfrachten ist das fermentative Verfahren der sauren Hydrolyse überlegen. Aus ökonomischer Sicht bietet die Fermentation bei diesen Zielparametern relativ zur sauren Hydrolyse und unter den Rahmenbedingungen des deutschen Produktionsstandortes zwar Kostenvorteile, um im internationalen Wettbewerb dauerhaft bestehen zu können und insbesondere um angesichts des in den letzten Jahren herrschenden Preisdrucks auf dem Markt für Aminosäuren auch in ungünstigen Marktphasen mit ausreichenden Deckungsbeiträgen produzieren zu können, ist jedoch eine weitere Erhöhung der Ausbeuten erforderlich. Da die Verbesserung der Aufarbeitungsausbeute nur verfahrenstechnischen Kriterien unterliegt und von der Stammentwicklung unabhängig ist, existiert somit ein zusätzliches Optimierungspotenzial des Verfahrens über den Kern der Forschungsarbeiten hinaus. Öffentlichkeitsarbeit und Präsentation 1. Patentanmeldung 100 09 799.5 (25.02.2000): Peters-Wendisch, P. G., Eggeling, L. und Sahm, H.: „Nukleotidsequenzen kodierend für Proteine beteiligt an der Biosynthese von L-Serin und Verfahren zu dessen Herstellung". 2. [Zusatzanmeldung (06.09.2000): Peters-Wendisch, P. G., Simic, P., Eggeling, L. und Sahm, H.: „Verbessertes Verfahren zur mikrobiellen Herstellung von L-Serin sowie ein dazu geeigneter genetisch veränderter Mikroorganismus“] 3. Patentanmeldung 102 31 297.4 (10.07.2002): Peters-Wendisch, P., Netzer, R., Eggeling, L., Faurie, R., Klaßen, B., Sahm, H.: „Gezielte Deregulation der 3-Phosphoglycerat-Dehydrogenase aus C. glutamicum“. 4. Patentanmeldung (März 2003): Peters-Wendisch, P., Netzer, R., Eggeling, L., Sahm, H.: „Verfahren zur Produktion von L-Serin durch Ausschaltung von L-Serin-Dehydratase Aktivität in Bakterien, am Beispiel Corynebacterium glutamicum“. Deutsche Bundesstiftung Umwelt } An der Bornau 2 } 49090 Osnabrück } Tel 0541/9633-0 } Fax 0541/9633-190 } http://www.dbu.de 5. Peters-Wendisch, P., Eggeling, L., Netzer, R., Sahm, H., Serger, H., Müller, U., Willke, B. und Faurie, R. (2001): Mikrobielle L-Serinproduktion unter besonderer Berücksichtigung der Ökobilanzierung. In: Erb, R. & Heiden, S. (Hrsg.) (2001): Biokatalyse, Sonderausgabe BIOSpektrum: 65-69. 6. Faltblatt für die BioTechnica 2001: Mikrobielle L-Serin-Produktion. 7. Peters-Wendisch, P., Netzer, R., Eggeling, L., Sahm, H. (2002): 3-Phosphoglycerate dehydrogenase from Corynebacterium glutamicum: the C-terminal domain is not essential for activity but is required for inhibition by L-serine. Appl Microbiol Biotechnol. 60(4):437-441. 8. Peters-Wendisch, P., Netzer, R., Eggeling, L., Sahm, H.: L-Serine biosynthesis in Corynebacterium glutamicum. Poster, VAAM-Tagung 2003, Berlin. 9. Netzer, R., Peters-Wendisch, P., Etterich, H., Eggeling, L., Sahm, H.: The role of L-serine dehydratase for growth and L-serine production of Corynebacterium glutamicum. Vortrag KI001, VAAMTagung 2003, Berlin. 10. Netzer, R., Peters-Wendisch, P., Lange, C., Wendisch, V. F., Eggeling, L.: Role of 3phosphoglycertate mutase and pyruvate kinase in Corynebacterium glutamicum for growth and Lserine production. Vortrag KD011, VAAM-Tagung 2002, Göttingen. 11. Netzer, R., Peters-Wendisch, P., Lange, C., Wendisch, V. F., Eggeling, L., Sahm, H.: „Investigations of the glycolysis and L-serine biosynthesis in Corynebacterium glutamicum“ Poster VAAM Workshop: Biologie bakterieller Naturstoffproduzenten Nov. 2001, Berlin. 12. Dock, Ch. (1999): "Isolation von Corynebacterium glutamicum-Mutanten, die keine FeedbackHemmung der Phosphoglycerat-Dehydrogenase besitzen" Studienarbeit der Universität Braunschweig, durchgeführt bei der Amino GmbH. 13. Netzer, R. (in Vorbereitung): „Untersuchungen zur Regulation der Glykolyse und zur L-Serinbildung mit Corynebacterium glutamicum“. Promotionsarbeit der Universität Düsseldorf, durchgeführt am Institut für Biotechnologie 1 des Forschungszentrums Jülich. 14. Stolz, M. (in Vorbereitung): „Einfluss der Serinhydroxymethyltransferase (glyA) auf die Serin-Bildung mit Corynebacterium glutamicum“. Diplomarbeit der Fachhochschule Aachen, Abt. Jülich, durchgeführt am Institut für Biotechnologie 1 des Forschungszentrums Jülich. Fazit Durch gezieltes „Metabolic Engineering“ des Stoffwechsels von C. glutamicum konnte ein Stamm entwickelt werden, mit dem L-Serin mit einer 0,25 %-igen Produktausbeute produziert werden kann. Damit wurde eine außerordentliche Steigerung der L-Serin-Bildung gegenüber der Ausgangssituation erreicht. Es wurde gezeigt, dass am Abbau von L-Serin in vivo ein bisher noch wenig untersuchtes Enzym beteiligt ist. Darüber hinaus sind vermutlich eine Reihe weiterer Reaktionen am Abbau beteiligt, die durch den Ansatz des gezielten Metabolic Engineering nicht erfasst werden können. Die Arbeiten haben gezeigt, dass es ein großes Potenzial gibt, L-Serin fermentativ aus Glukose, und damit umwelt- und ressourcenschonend zu produzieren, dass es jedoch eine Vielzahl bisher unbekannter Faktoren in der Zelle gibt, die die L-Serin-Bildung beeinflussen. Die bisherige Produktivität reicht noch nicht aus, um L-Serin wirtschaftlich zu produzieren. Aufgrund des Wissens, das in diesem Projekt erarbeitet wurde, ist es nun möglich in zukünftigen Arbeiten die erforderlichen Hochleistungsproduktionsstämme zu gewinnen. Durch die Realisierung dieses Ziels kann in Zukunft L-Serin auf ökologisch wesentlich verträglichere Weise und unter Gewährleistung der internationalen Wettbewerbsfähigkeit des beteiligten mittelständischen Produzenten hergestellt werden. Deutsche Bundesstiftung Umwelt } An der Bornau 2 } 49090 Osnabrück } Tel 0541/9633-0 } Fax 0541/9633-190 } http://www.dbu.de