Steigerung der Lysinprodutkion mit Corynebacterium glutamicum
Werbung

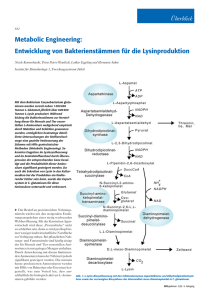
Steigerung der Lysinprodutkion mit Corynebacterium glutamicum durch Manipulation der Lysinsynthesewege Einleitung 1 Lysin ist eine essentielle Aminosäure für Säugetiere. Daher wird Lysin in der Nahrungsmittelindustrie eingesetzt. Neben dem Hinzufügen von Lysin zu Nahrungsmitteln, wird diese Aminosäure auch in der Tiermast verwendet. Lysin wird dabei als Additiv dem Futter zugegeben. Lysin hat aktuell ein Marktvolumen von 2 *106 t pro Jahr. Diese Menge wird biotechnologisch mit klassisch optimierten Stämmen produziert. Der Produktionsstamm 1,2 Als Produktionsstamm für die Lysin Produktion wird in meiner Masterarbeit das gram+ Bodenbakterium Corynebacterium glutamicum verwendet. Dieses Bakterium, dessen Namen sich von seiner Keulenform (Coryne (gr.)=Keule) ableitet, dient schon seit über 60 Jahren für die Produktion von Stoffen und Stoffgemischen in der Biotechnologie. Es wird für die Produktion einer ganzen Bandbreite von Biomolekülen eingesetzt. Das Corynebacterium glutamicum ist auf Grund der bestehenden Methoden zur gentechnischen Manipulation und dem Vorhandensein von Gen-Vektoren für die Erstellung von Produktionsstämmen von hohem Interesse. Diese Tools erlauben es, Corynebacterium glutamicum im Zusammenhang mit Bioreffinerie-Konzepten zu betrachten. Der Lysin-Syntheseweg 2 Lysin wird aus der Aminosäure Aspartat gebildet, welche wiederum die aminierte Form des Oxalacetat (einem Intermediat des TCA-Zyklus) ist. Die Synthese von Lysin in Corynebacterium glutamicum folgt dem Diaminopimelin-Säure-Weg. Im Allgemeinen lässt sich die in Formel 1 wiedergegeben Reaktionsgleichung für die Lysinbiosynthese aufstellen. 2 NH4+ + Oxalacetat + 4NADPH + Pyruvat +ATP Lysin + 4NADP+ + ADP + CO2 (1) Der erste Schritt der Lysinsynthese ist die ATP abhängige Phosphorylierung des Aspartat durch das Enzym Aspartokinase. Dieses ist auch gleichzeitig das Schrittmacher Enzym für den gesamten Syntheseweg von Lysin und Threonin. Der Threonin Biosyntheseweg zweigt von dem Lysinsyntheseweg auf der Höhe des Intermediates Aspartatsemialdehyd ab. Da die Aspartokinase das Schrittmacherenzym für die Synthesewege von Threonin und Lysin ist, sind beide Stoffe als Endprodukte Inhibitoren der Aspartokinase (Feedbackinhibierung). Klassische Stammoptimierung vs. rationales Design 1 Die klassisch eingesetzten Stämme wurden durch random mutagenesis Erzeugt. Das heißt, dass Stämme gezielt mutagenen Strahlungen oder Chemikalien ausgesetzt wurden, um Mutationen zu erzeugen. Auf diese Weise konnte zum Beispiel eine feedbackresistente Aspartokinase-Mutante erzeugt werden. Der Nachteil dieser Methode ist das erzeugen von Mutationen in Genbereichen, in denen keine Veränderung vorgenommen werden wollten. Es kann sich auf diese Weise eine Vielzahl nachteiliger Mutationen im Genom eines Stammes anhäufen, die dazu führen, dass der Stamm in seinem Wachstum beschränkt ist. Beim rationalen Design werden gezielt genetische Veränderungen vorgenommen, um, wie in diesem Fall, die Lysinprodutkion zu steigern. Dabei liegen vor allem die globale Neuregelung von Flüssen und das einfügen neuer Synthesewege im Hauptfokus. Der Nachteil dieser Methode ist jedoch, dass für die Identifizierung von möglichen Zielen riesige Datensetze analysiert und ausgewertet werden müssen, da es sich bei metabolischen Netzwerken um Komplex ineinander greifende Reaktionen handelt. Aus den Datensätzen werden Modelle erstellt, um mögliche Ziele zu identifizieren. Bisherige Manipulationen an Corynebacterium glutamicum 2,3 Um einen Produktionsstamm für Lysin zu erzeugen, der sowohl hohen Produkttiter als auch gute Ausbeuten besitzt, wurde eine Reihe von Manipulationen an Corynebacterium glutamicum vorgenommen. Zu nächst wurde eine feedbackresistente Aspartokinase in den Stamm eingebracht. Somit liegt ein entkoppelter Syntheseweg vor. Desweiteren wurde der Flux der PhosphoenolCarboxykinase verringert, um die Oxalacetatmenge (Lysinvorstufe) zu erhöhen. Eine weitere Steigergun der Oxalacetatmenge erbrachte die Überexpression der Pyruvat-Carboxykinase. Um den Gesamtflux des TCA-Zyklus herunter zu regulieren, wurde das Startcodon der Isocitratdehydrogenase ausgetauscht, wodurch eine Atenuation der Translation dieses Enzyms erreicht wurde. Im Falle des Lysinsynthesewegs wurde der Fluss hin zum Threonin verringert. Eine Deletion der Threoninsynthese hätte einen Stamm zur Folge gehabt, der auf die Supplementierung von Threonin und den aus dieser Aminosäure gebildeten weiteren Aminosäuren angewiesen wäre. Zur Erhöhung der Bereitstellung von Redutkiontäquivalenten in Form von NADPH wurde der Kohlenstoffflux durch den Pentose-Phosphat-Weg (PPP) erhöht. Dazu wurden die Promotoren der ersten beiden NADPH regenerierenden Enzyme gegen stärkere ausgetauscht. Desweiteren wurde das Expressionslevel der Transketolase und Transaldolase erhöht, um den Rückfluss der intermediär entstehenden Pentosen und Triosen in die Glykolyse zu ermöglichen. Ansatzpunkte und Zielsetzung der Masterarbeit 4–7 Ziel der Meisterarbeit ist es, einen bestehenden Produktionsstamm dahingehend zu verbessern, dass mehr Lysin pro Zeiteinheit und bessere Produkt ausbeuten erzielt werden. Das Hauptaugenmerk dabei liegt auf dem Austausch des Sod Promotors vor dem Aspartokinasegens gegen einen EftuPromotor, welcher des Transkirptionslevel um ein Vielfaches anhebt. Nach der erfolgreichen Manipulation des Promotors soll validiert werden, in welchem Ausmaß der Promotoraustausch zu einer höheren Ausbeute an Lysin führt. Außerdem soll untersucht werden, ob und wie weit der Promotoraustausch die Aspartokinaseaktivität eines Rohextraktes erhöht. Dazu müssen Methoden etabliert werden. Ein Beispiel ist ein fotometrischer Test, der auf Eisen(III)Komplexen und Hydroxamsäuren beruht. Ein weiterer Aspekt bei der Veränderung von Flüssen durch einen Syntheseweg und den damit verbundenen Veränderungen im Kohlenstoff- und Reduktionsäquivalentbedarf ist die Erfassung der globalen Konsequenzen für den Stoffwechsel des Organismus. Daher ist naheliegend, dass eine Flussanalyse durchgeführt werden kann, um diese Veränderungen zu quantifizieren. Lysinbiosynthese als Ausgangspunkt für Biopolymere 8 In der Petrochemier wird eine Vielzahl von Aminogruppen haltigen Stoffen zur Produktion von Polymeren genommen. Das wichtigste dieser Moleküle ist Diaminohexan, welches das Monomer der Polyamide ist. Diaminohexan kann jedoch nicht fermentativ gewonnen werden. Dieses Trifft jedoch nicht für Diaminopentan und Diaminobutan zu. Diaminopentan ist ein Natürliches Abbauprodukt von Lysin. Eschrichia coli besitzt ein Gen für die Lysindecarboxylase (ldcC). Dieses Enzym decarboxyliert Lysin zu Diaminopentan. Es ist daher naheliegend, die Lysinsynthese mit diesem Enzym in C. glutamicum zu kombinieren, um statt Lysin direkt Diaminopentan zu erzeugen. Ein Nachteil dieser Synthesemethode ist jedoch, dass ein Kohlenstoffatom in Form von CO2 verloren geht. References 1. Becker, J. Lange, A. Fabarius, J. & Wittmann, C. Top value platform chemicals. Bio-based production of organic acids. Current Opinion in Biotechnology 36, 168–175 (2015). 2. Becker, J. Zelder, O. Häfner, S. Schröder, H. & Wittmann, C. From zero to hero—Design-based systems metabolic engineering of Corynebacterium glutamicum for l-lysine production. Metabolic Engineering 13, 159–168 (2011). 3. Becker, J. et al. Metabolic flux engineering of l-lysine production in Corynebacterium glutamicum—over expression and modification of G6P dehydrogenase. Journal of Biotechnology 132, 99–109 (2007). 4. Cahyanto, M. N. Regulation of aspartokinase, aspartate semialdehyde dehydrogenase, dihydrodipicolinate synthase and dihydrodipicolinate reductase in Lactobacillus plantarum. Microbiology 152, 105–112 (2006). 5. BLACK, S. & WRIGHT, N. G. beta-Aspartokinase and beta-aspartyl phosphate. The Journal of biological chemistry 213, 27–38 (1955). 6. MAXIMILLIAN T. FOLLETTIE,t OLIVER P. PEOPLES,* CATHERINE AGOROPOULOU. Gene Structure and Expression of the Corynebacteriumflavum N13 ask-asd Operon. JOURNAL OF BACTERIOLOGY 1993, 4096–4103. 7. Becker, J. Klopprogge, C. Zelder, O. Heinzle, E. & Wittmann, C. Amplified Expression of Fructose 1,6-Bisphosphatase in Corynebacterium glutamicum Increases In Vivo Flux through the Pentose Phosphate Pathway and Lysine Production on Different Carbon Sources. Applied and Environmental Microbiology 71, 8587–8596 (2005). 8. Kind, S. Jeong, W. K. Schröder, H. & Wittmann, C.