Kohlenhydrate (Saccharide)
Werbung

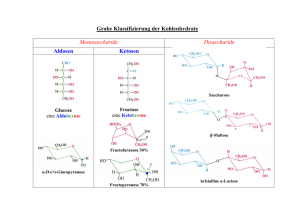
Kohlenhydrate (Saccharide) Kohlenhydrate sind aus drei Elementen aufgebaut, Kohlenstoff (C), Wasserstoff (H) und Sauerstoff (O) Summenformel: (C•H2O)n mit n ≥ 3 Kohlenhydrate existieren als einfache Zucker, sogenannte Monosaccharide, oder als aus einfachen Zuckern aufgebaute Polysaccharide. Kohlenhydrate spielen eine Rolle als: Energiequellen (Glukose, Glykogen, Stärke) Bau- und Strukturmaterial (Cellulose, Chitin) Bestandteil von: Glykoproteinen Glycolipiden Peptidoglycan (in bakteriellen Zellwänden) Monosaccharide Monosaccharide: Carbonylderivate (Aldehyde oder Ketone) von unverzweigten Polyhydroxyalkoholen. Aldehydmonosaccharide: Aldosen H C Ketonmonosaccharide: Ketosen O (H C OH) n CH2OH Aldosen CH2OH C O (H C OH) n H Ketosen Monosaccharide enthalten drei oder mehr C-Atome und werden demnach als: Triosen, Tetrose, Pentosen, Hexosen, Heptosen etc. bezeichnet. Schreibweise und Nomenklatur von Monosacchariden Monosaccharide sind chirale Moleküle. Je nach Anordnung der chiralen Zentren sind viele Stereoisomere möglich. Daher muss eine Nomenklatur festgelegt werden. Fischerprojektion: 1. 2. 3. 4. 5. 2-dimensionale Molekülprojektion der Tetraeder um C-Atome nach E. Fischer (1891) Kohlenstoffkette senkrecht anordnen höchstoxidiertes C-Atom nach oben in rechtem Winkel rechts und links die Substituenten schreiben C-C Bindungen zeigen nach hinten, Substituenten nach vorne steht ein Substituent in dieser Projektion rechts („dexter“) so ist er in DKonfiguration, steht er links („levis“) so ist er in L-Konfiguration Monosaccharide werden nach D- und L-Formen klassifiziert. Dazu betrachtet man das von der Carbonylgruppe am weitesten entfernte, aber immer noch chirale C-Atom. Steht in der Fischerprojektion die OH-Gruppe an diesem C-Atom rechts, so handelt es sich um D-Aldosen oder D-Ketosen, steht die OH-Gruppe links, um L-Aldosen oder LKetosen. H C O (H C OH) n H C OH H C O (H C OH)n HO C H CH2OH CH2OH C O C O (H C OH)n H C OH (H C OH)n HO C H CH2OH CH2OH CH2OH CH2OH D-Aldosen L-Aldosen D-Ketosen L-Ketosen D-Zucker kommen in der Natur viel häufiger vor. Zucker haben je nach ihrer Gesamtzahl von C-Atomen mehrere Asymmetriezentren. Aldosen haben (Gesamtzahl der C-Atome – 2) Asymmetriezentren. Ketosen haben (Gesamtzahl der C-Atome – 3) Asymmetriezentren. Man muss daher weitere Stereoisomere unterscheiden. Für die biologisch wichtigsten Monosaccharide gibt es Eigennamen. Ribose, ist zum Beispiel der Zuckerbestandteil der Ribonukleinsäure, RNA. Ribose findet sich in den Nukleotiden. Es ist damit natürlich auch Bestandteil von ATP (wichtig für Energiehaushalt). Ketten- und Ringform von Monosacchariden Pentosen und Hexosen existieren im Gleichgewicht zwischen Ring- und Kettenform, weil die Carbonylgruppe mit der OH-Gruppe an C4 oder C5 ein intramolekulares Hemiazetal oder Hemiketal bildet. H H C O + R' OH R' R R Hemiazetal Alkohol Aldehyd R C O + R R'' OH R' Keton O C OH Alkohol R'' O C OH R' Hemiketal Es entstehen hierbei 5-gliedrige (Furanosen) oder 6-gliedrige (Pyranosen) Zuckerringe. Aldopentosen können entweder Furanosen oder Pyranosen bilden (siehe Abbildung), Ketopentosen können nur Furanosen bilden. Sowohl Aldo- als auch Ketohexosen bilden Furanosen und Pyranosen. Die Carbonylgruppe wird zu einer OH-Gruppe und das C-Atom wird zu einem neuen Asymmetriezentrum. Die beiden möglichen Anordnungen der OH-Gruppe werden mit αund β-Position bezeichnet und die resultierenden Ringstrukturen sind zueinander anomer. Die Kettenform und die anomeren Ringformen liegen immer im Gleichgewicht vor. Die Kettenform bildet meist weniger als 1% des Gleichgewichtes. Haworthprojektion Zuckerringe können auf mehrere vereinfachende Weisen geschrieben werden. Die üblichste Art ist die Haworthprojektion. In dieser Projektion wird der Ring als planar dargestellt und die Gruppen, die in der Fischerprojektion rechts stehen befinden sich unterhalb der gezeichneten Ringebene, die links stehen, oberhalb. Die CH2OH Gruppen, die nicht am Ring teilnehmen (wie z.B. bei Glukose) liegen bei D-Zuckern immer oberhalb der Ebene. Tatsächlich sind Zuckerringe natürlich nicht planar. Pyranosen können wie Cyclohexan Sessel- oder Wannenkonformation einnehmen. Die Sesselkonformation ist für die meisten Pyranosen günstiger. Zuckerderivate Aldonsäuren Die Aldehydgruppe der Aldosen kann zur Carboxylgruppe oxidiert werden. So entsteht z.B. aus Glukose, Glukonsäure. Alduronsäuren Durch Oxidation der primären OH-Gruppe zur Carboxylgruppe entstehen Alduronsäruen, z.B. Glukuronsäure. Alditole Durch Reduktion der Aldehydgruppe zur OH-Gruppe entstehen azyklische Polyhydroxyalkohole, Alditole. Aus Glukose entsteht so Glucitol, auch als Sorbitol bekannt. Aminozucker Wenn eine oder mehrere OH-Gruppen durch NH2-Gruppen ersetzt werden, entstehen Aminozucker. Sie werden durch die Endung –amin gekennzeichnet, z.B. Glukosamin oder Galaktosamin. Oftmals werden diese NH2-Gruppen auch acetyliert. Somit entsteht dann N-acetyl Glukosamin. Reduzierte Zucker Wird eine OH-Gruppe durch ein H ersetzt, so entstehen Desoxyzucker. Der biologisch wichtigste dieser Zucker ist β-D-2-Desoxyribose, die Zuckerkomponente der Zuckerphosphatkette in DNA. Phosphorylderivate Die Zucker OH-Gruppen können mit Phosphatgruppen Ester bilden (z.B. DGlyceraldehyd-3-phosphat). Glykoside Die anomere Gruppe eines Zuckers kann mit einem anderen Alkohol oder einer NH2Gruppe kondensieren (Abspaltung von H2O). Es entstehen so N-glykosidische oder Oglykosidische Bindungen. D-Ribose und Purine oder Pyrimidine in Nukleinsäuren bilden z.B. N-glykosidische Bindungen. Abkürzungen für Monosaccharide und Derivate: Disaccharide Monosaccharide können über ihre anomere Gruppe mit anderen OH-Gruppen glykosidische Bindungen eingehen. Stammt diese andere OH-Gruppe ebenfalls aus einem Monosaccharid, so bilden sich Disaccharide. Je nachdem welche C-Atome über die glykosidische Bindung verknüpft werden, spricht man z.B. von einer 1Æ2 glykosidischen, oder einer1Æ4 glykosidischen Bindung. Es können zwei Arten von Disacchariden entstehen: 1. Reduzierende Disaccharide Die anomere Gruppe des einen Zuckers reagiert mit einer OH-Gruppe des anderen Zuckers, die nicht am anomeren C-Atom in diesem Zucker ist. Somit ist die anomere Gruppe noch unreagiert in diesem Zucker. 2. Nichtreduzierende Disaccharide Die anomere Gruppe des einen Zuckers reagiert mit der OH-Gruppe des anderen Zuckers, die am anomeren C-Atom sitzt. Beispiele: Die Art der glykosidischen Bindung wird beschrieben, indem man die C-Atome benennt, die verbunden werden, und die Konfiguration an den anomeren C-Atomen, die an der Bindung teilnehmen, z.B. α(1Æ2)β in Sucrose oder β(1Æ4) in Maltose. Vier Eigenschaften unterscheiden also Disaccharide voneinander: 1. Die beiden Monosaccharide. 2. Die C-Atome, die an der Verknüpfung teilnehmen. 3. Die Reihenfolge der Monosaccharide, wenn sie unterschiedlich sind. 4. Die Konfiguration der OH-Gruppe an anomeren C-Atomen, die an der Bindung beteiligt sind. Polysaccharide Polysaccharide sind aus Monosacchariden aufgebaut, die über glykosidische Bindungen miteinander verbunden sind. Im Gegensatz zu Proteinen oder Nukleinsäuren bilden Polysaccharide nicht nur lineare Polymere, sondern auch verzweigte Polymere. Der Grund ist, dass glykosidische Bindungen zu jeder beliebigen OH-Gruppe eingegangen werden können. Die meisten Polysaccharide sind Homopolysaccharide, aber es gibt auch Heteropolysaccharide. Struktur-bildende Polysaccharide Zellulose Zellulose ist die struktur-bildende Hauptkomponente von Pflanzenzellwänden. Zellulose bildet ein lineares Polymer mit bis zu 15 000 D-Glukoseeinheiten. Die Bindung ist β(1Æ4) glykosidisch. Zellulose bildet planare Ketten, wobei jeder Glukoserest 180° gegenüber dem benachbarten Glukoserest gedreht ist. Die einzelnen Ketten können sich so aneinander lagern und ein Netzwerk von H-Brücken ausbilden. Chitin Chitin ist die Hauptkomponente des Exoskeletts von Schalentieren. Chitin ist ein Homopolymer von β(1Æ4)-verbundenen N-acetyl-D-Glukosaminen. Es hat eine ähnliche Struktur wie Zellulose. Glykosaminoglycane Glykosaminoglycane sind unverzweigte Heteropolysaccharide, die aus abwechselnden Uronsäure- und Hexosaminresten aufgebaut sind. Die folgende Abbildung zeigt Beispiele von Glykosaminoglycanen. Sie bilden die extrazelluläre gelartige Matrix im Bindegewebe wie z.B. Knorpel, Sehnen, Haut etc. . Speicher Polysaccharide Stärke Stärke ist eine Mischung aus Glykanen (aus Glukose aufgebaute Homopolymere), der α-Amylose und dem Amylopektin. Stärke ist das Speicherpolysaccharid der Pflanzen. Es wird abgebaut durch Amylasen und Glukosidasen. In α-Amylose sind mehrere tausend Glukoseeinheiten α(1Æ4) glykosidisch verknüpft. Im Gegensatz zu der β(1Æ4) Verknüfpung von Zellulose, führt diese Art der Verknüpfung zur Ausbildung einer helikalen Struktur. Amylopektin Amylopektin besteht ebenfalls haupsächlich aus α(1Æ4) glykosidisch verknüpften Glukoseeinheiten, hat aber auch α(1Æ6) glykosidische Verzweigungen alle 25-30 Reste. Amylopektin enthält bis zu 1 Mio Glukosereste. Glykogen Glyokogen ist ebenfalls ein Glykan aus α(1Æ4) verknüpften Glukoseeinheiten. Alle 7-12 Reste gibt es eine α(1Æ6) Verzweigung. Glykogen ist das Speicherpolysaccharid der Tiere und ist in allen Zellen, vor allem aber Muskel und Leberzellen, vorhanden. Durch seine verzweigte Struktur kann es sehr schnell abgebaut werden (es gibt viele nicht reduzierende Enden, von denen aus abgebaut werden kann durch Glykogenphosphorylase) und Glukose kann somit schnell mobilisiert werden. Glykoproteine Viele Proteine gehen kovalente Bindungen mit Sacchariden ein. Die Proteine werden wie üblich von DNA Vorlagen transkribiert und dann translatiert, d.h. sie sind genetisch kodiert. Die Kohlenhydratanteile werden aber enzymatisch hergestellt und mit den Proteinen verbunden. Glykoroteine haben daher oft heterogene Zusammensetzung. Proteoglykane Proteoglykane sind wichtig für die Organisation von Gewebe. Proteoglykane bestehen aus einem Rückgrat (meist aus Hyaluronsäurefilamenten (4000 – 40000 A lang)), an die kleine „Bürsten“ (bis zu 100) nichtkovalent gebunden sind. Diese „Bürsten“ bestehen aus einer Polypeptidkette an die kovalent bis zu 150 Glykosaminoglykane (meist Keratansulfat oder Chondroitinsulfat) über die OH-Gruppen von Ser or Thr Resten gebunden sind. Zusätzlich sind noch kleinere Oligosaccharide an Asn Reste der Polypeptidkette gebunden. Knorpelgewebe z.B. enthält ein Netzwerk aus Kollagen, das von Proteoglycan umgeben ist. Proteoglycan ist sehr stark hydriert (Anionen aus Sulfatgruppen in Keratan und Chondroitinsulfat). Peptidoglycan in Bakterienzellwänden Im Gegensatz zu Eukaryonten haben Bakterien zusätzlich zur Zellmembran noch eine Zellwand. Bakterienzellwände bestehen aus kovalent verbundenen Polysacchariden und Polypeptiden, die gemeinsam ein grosses Makromolekül bilden, das die Zelle wie ein Beutel vollkommen umschliesst und so Festigkeit und Struktur verleiht. Das Polysaccharid β(1Æ4)-verknüpft abwechselnd N-Acetylglukosamin und NAcetylmuraminsäure. Die Milchsäuregruppe in N-Acetylmuraminsäure bildet eine Amidbindung mit einem Tetrapeptid, das D-Aminosäuren enthält. Die Tetrapeptide der verschiedenen Peptidoglycanketten sind miteinander entweder direkt (gram-negative Bakterien) über Peptidlinker (gram-positive Bakterien) verbunden. Glykosilierte Proteine Fast alle sekretierten und membran-assoziierten Proteine in Eukaryonten sind glykosyliert. Die Glycosilierung findet im ER und im Golgi-Apparat statt. Proteine, die sekretiert oder in Membranen eingebaut werden sollen, werden von Ribosomen translatiert, die an das rER gebunden sind (blaue Punkte). Cotranslational werden sie in das ER Lumen oder in die Membran eingebracht und während dieses Vorgangs findet die erste Glycosylierung statt. Im ER Lumen und später im GolgiApparat werden die Saccharidkomponenten weiter modifiziert und danach die fertigen Glycoproteine in die entsprechenden Membranen gebracht oder sekretiert. Die Glykosilierung findet entweder über eine N-glykosidische oder eine O-glykosidische Bindung statt. N-Glykosylierung Bei der N-Glykosilierung ist immer ein N-acetyl Glucosamin β-verknüpft mit dem Amid N-Atom eines Asn Restes in der Sequenz Asn-X-Ser/Thr. N-Glykosilierung findet cotranslational folgendermassen statt: 1. Heptasaccharid wird an einen Membrananker (Dolichol) synthetisiert, der ins Zytosol zeigt. Nach Synthese des Heptasaccharids klappt der Anker um ins ER Lumen. Dort werden nochmals ein paar Mannose-Einheiten drangehängt. 2. Ribosom ist an die ER-Membran gebunden und synthetisiert Polypeptid. Das Oligosaccharid, das nun aus 9 Mannose, 3 Glukose und 2 GlcNAc Resten besteht, wird von dem Membrananker auf die entstehende, noch Ribosomgebundene Kette übertragen. Die Bindung erfolgt N-glykosidsisch an ein Asn. 3. Im ER Lumen wird nun das Polypeptid-gebundene Oligosaccharid weiter verändert, Zucker werden entfernt und hinzugefügt. Dies wird von Glukosidasen und Mannasen und von Glykosyltransferasen bewerkstelligt. 4. Im Golgi finden weitere Veränderungen statt und Ser/Thr-Reste werden Oglykosiliert. O-Glykosilierung O-Glykosilierung findet im Golgi Apparat an komplett synthetisierten Proteinen statt. Meist wird ein Galaktosyl-N-acetyl-Glukosaminrest an eine Ser oder Thr Seitenkette gebunden. Die Sekundär- und Tertiärstruktur des Proteins bestimmt hierbei wo die Glykosilierung stattfindet, nicht die Sequenz. Glykosyltransferasen fügen dann schrittweise Zucker zur bestehenden Zuckerkette hinzu. Bei den endgültigen Glykoproteinen unterscheidet man nach Oligosaccharid drei Klassen. All drei haben ein „Kernpentasaccharid“ gemeinsam. Man unterscheidet: 1. Oligosaccharide mit hohem Mannose-Anteil. 2. Komplexe Oligosaccharide, die GlcNAc Reste enthalten und zusätzlich noch Sialinsäure- und Fukose-Reste. 3. Hybride Oligosaccharide, die Elemente von sowohl 1. als auch 2. enthalten.