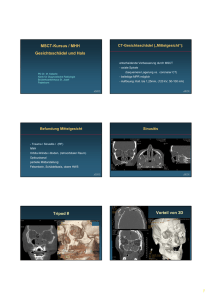
Handbuch diagnostische Radiologie
Werbung

Handbuch diagnostische Radiologie Herausgeber: Jürgen Freyschmidt, Bremen D. Hahn (Hrsg.) Handbuch diagnostische Radiologie Kardiovaskuläres System Mit Beiträgen von: D. Hahn, M. Heinrich, W. Kenn, T.D. Kirchhoff, M. Köhler, P. Kovacs, P. Landwehr, G. Luska, O. Mohrs , Th. Pabst, P. Reimer, H. Rosenthal, J. Sandstede, K. Schürmann, J.-P. Staub, M. Strotzer, M. Uder, Th.Voigtländer, M. Völk, D.Vorwerk, R.Vosshenrich, G. Wittenberg, N. Zorger Mit 328 Abbildungen in 808 Einzeldarstellungen 123 Professor Dr. med. D. Hahn Institut für Röntgendiagnostik Universität Würzburg Josef-Schneider-Straße 2 97080 Würzburg ISBN 978-3-540-41420-9 Springer Berlin Heidelberg New York Bibliografische Information Der Deutschen Bibliothek Die Deutsche Bibliothek verzeichnet diese Publikation in der Deutschen Nationalbibliografie; detaillierte bibliografische Daten sind im Internet über <http://dnb.ddb.de> abrufbar Dieses Werk ist urheberrechtlich geschützt. Die dadurch begründeten Rechte, insbesondere die der Übersetzung, des Nachdrucks, des Vortrags, der Entnahme von Abbildungen und Tabellen, der Funksendung, der Mikroverfilmung oder der Vervielfältigung auf anderen Wegen und der Speicherung in Datenverarbeitungsanlagen, bleiben, auch bei nur auszugsweiser Verwertung, vorbehalten. Eine Vervielfältigung dieses Werkes oder von Teilen dieses Werkes ist auch im Einzelfall nur in den Grenzen der gesetzlichen Bestimmungen des Urheberrechtsgesetzes der Bundesrepublik Deutschland vom 9. September 1965 in der jeweils geltenden Fassung zulässig. Sie ist grundsätzlich vergütungspflichtig. Zuwiderhandlungen unterliegen den Strafbestimmungen des Urheberrechtsgesetzes. Springer ist ein Unternehmen von Springer Science+Business Media springer.de © Springer-Verlag Berlin Heidelberg 2007 Die Wiedergabe von Gebrauchsnamen, Handelsnamen, Warenbezeichnungen usw. in diesem Werk berechtigt auch ohne besondere Kennzeichnung nicht zu der Annahme, dass solche Namen im Sinne der Warenzeichen- und MarkenschutzGesetzgebung als frei zu betrachten wären und daher von jedermann benutzt werden dürften. Produkthaftung: Für Angaben über Dosierungsanweisungen und Applikationsformen kann vom Verlag keine Gewähr übernommen werden. Derartige Angaben müssen vom jeweiligen Anwender im Einzelfall anhand anderer Literaturstellen auf ihre Richtigkeit überprüft werden. Planung: Dr. U. Heilmann, Heidelberg Redaktion: D. Mennecke-Bühler, Heidelberg Herstellung: LE-TeX Jelonek, Schmidt & Vöckler GbR, Leipzig Umschlaggestaltung: Frido Steinen-Broo, eStudio Calamar, Spanien Satz und Reproduktion: am-productions GmbH, Wiesloch 21/3180 YL – 5 4 3 2 1 0 Gedruckt auf säurefreiem Papier Vorwort Eine fortlaufende Optimierung der bildlichen Darstellung krankhafter Organveränderungen erfordert ein sich ständig verbreiterndes medizinisches Wissen. Ein Handbuch ist der Definition nach ein zusammenfassendes, in der Regel mehrbändiges Werk über eine Wissenschaft oder ein spezielles wissenschaftliches Gebiet. Kann ein solches Werk noch Bestand haben in einer Zeit, in der sich wissenschaftliche Erkenntnisse mit nahezu unvorstellbarer Geschwindigkeit entwickeln und wandeln? Die Herausgeber und Autoren dieses Handbuchs bejahen diese Frage; sie halten es geradezu für notwendig, eine fundierte Standortbestimmung über die diagnostische Radiologie in einem Rahmen abzugeben, der für die praktischen Belange dieses – neben der klinischen Pathologie – wichtigsten diagnostischen Schlüsselfachs prinzipiell einen Wertbestand von etwa 8–10 Jahren besitzen soll. Dieser Zeitraum bezieht sich selbstverständlich nur auf die einzelnen Bände, deren jeweiliges Erscheinen sich zwar durch die verschiedensten Umstände seit dem Start des Gesamtprojektes verzögert hat, die sich aber zum Zeitpunkt ihrer Fertigstellung jeweils auf dem aktuellen Erkenntnisstand befanden bzw. befinden. Bei der Erstellung der einzelnen organbezogenen Bände wurde bedacht, dass sich im oben angegebenen Zeitraum zwar untersuchungstechnische Modalitäten, wie z. B. Sequenzen in der MRT, durchaus ändern werden, dass aber das Prinzip der Darstellungsmöglichkeiten von krankhaften Veränderungen bestimmter Organe oder Organsysteme weitgehend unverändert bleibt; denn die den Krankheiten zugrunde liegenden pathologischanatomischen Veränderungen selbst ändern sich ja kaum! Die rasche Entwicklung und den Wandel von ätiologischen, pathogenetischen und therapeutischen Erkenntnissen kann und muss man in wissenschaftlichen Zeitschriften und ggf. aktuellen Monographien verfolgen; doch wird man das Neue nur dann verstehen und nutzen können, wenn man durch einen soliden Wissensfundus darauf vorbereitet ist. Dazu soll dieses Handbuch mit seinem besonderen Konzept der Wissensvermittlung beitragen. Es orientiert sich an Organen oder Organsystemen mit ihren Erkrankungen, die jeweils bestimmte radiologische Untersuchungsstrategien erfordern (z. B. mit Hilfe der Projektionsradiographie, CT, MRT, Ultraschall, ggf. Szintigraphie). In den jeweiligen Hauptkapiteln findet sich zunächst eine Darstellung der Normalanatomie und ihrer wesentlichen Varianten – bezogen auf die einzelnen Darstellungsmodalitäten; dann folgt ein Kapitel über die systematische Bildanalyse. Die Kapitel über die einzelnen Krankheitsentitäten (Fehlbildungen, traumatische und entzündliche Veränderungen, Tumoren und sonstige Störungen) sind einheitlich nach folgenden Themen aufgebaut: – pathologisch-anatomische Grundlagen (zum Verständnis der radiologischen Befunde), – klinische Symptomatik, – charakteristische radiologische Symptome und ihre Differentialdiagnose. – Jedes Kapitel schließt mit Empfehlungen zur Untersuchungsstrategie und zusammenfassenden Merksätzen. Der rote Faden, der sich durch das gesamte Werk zieht, ist die synoptische Betrachtungsweise von klinischen und mit Hilfe der Radiologie erkennbaren pathologisch-anatomischen und funktionellen Veränderungen. Eine dem Patienten nützliche Diagnostik kann im Übrigen nur aus der Fusion von technischer Entwicklung und einem angepassten medizinischen Wissen um das Wesen und die Vielfalt von Krankheiten gelingen. Frau Dr. U. Heilmann vom Springer-Verlag danken wir für die Anregung zu diesem Handbuchprojekt. Ein ganz besonderer Dank gilt Frau D. MenneckeBühler, ohne deren gekonntes Management dieses neunbändige Werk sicherlich nicht zum Abschluss gekommen wäre. Im Frühjahr 2007 Für die Herausgeber und Autoren J. Freyschmidt, Bremen Vorwort Kardiovaskuläre Erkrankungen stellen trotz aller medizinischen Fortschritte die häufigste Todesursache in der westlichen Welt dar. Die kardiale und vaskuläre Diagnostik haben in den vergangenen Jahren eine völlig unterschiedliche Entwicklung genommen. Während die invasive Gefäßdiagnostik und die sich daraus entwickelnde interventionelle radiologische Therapie, vor allem nach Einführung der digitalen Subtraktionsangiographie (DSA), ständig an Bedeutung gewonnen haben, hat die kardiale radiologische Bildgebung ständig an Bedeutung verloren. Zugleich kam es zu einem Aufschwung der invasiven Herzdiagnostik, vor allem der invasiven Koronarangiographie, und der Einführung nuklearmedizinischer Untersuchungsverfahren zur Herzfunktionsdiagnostik. Bis zur Einführung von Computertomographie (CT) und Magnetresonanztomographie (MRT) war die kardiale radiologische Diagnostik auf Thoraxübersichtsaufnahmen und konventionelle Schichtaufnahmen beschränkt. Trotz der neuen Möglichkeiten, Herz und große Gefäße mit CT und MRT nichtinvasiv darzustellen, war der klinische Einsatz über viele Jahre auf spezielle Fragestellungen begrenzt. Erst mit der Einführung der Spiral-CT und der funktionellen MR-Herzbildgebung mit sehr schnellen Sequenzen begann eine erfolgversprechende Renaissance der nichtinvasiven Herz- und Gefäßdiagnostik. Die rasante technische Weiterentwicklung sowohl der Mehrzeilen-CT (MSCT) als auch der MRT hat zu einem fruchtbaren Wettstreit zwischen diesen beiden Verfahren um die Bedeutung für die Herzdiagnostik geführt. Beide Verfahren haben mittlerweile auch eine lebhafte Diskussion über Indikationen für die invasive Koronarangiographie und nuklearmedizinische Herzdiagnostik ausgelöst. Die funktionelle MR-Herzdiagnostik stellt aufgrund der hohen zeitlichen Auflösung heute den Goldstandard für die Berechnung der Herzfunktionsparameter dar und hat darin Echokardiographie, Linksherzkatheter und Nuklearmedizin abgelöst. Wegen der exzellenten Darstellung der Koronararterien mit der MSCT eröff- nen sich nun neue Indikationen zur nichtinvasiven Diagnostik der koronaren Herzkrankheit, die langfristig sicherlich zu einer Reduktion der invasiven Koronarangiographie führen werden. Ein weites Feld der modernen Herzdiagnostik, das bisher nur experimentell eingesetzt wird, stellt die metabolische Bildgebung mit der MR-Spektroskopie (MRS) dar. Hier steht die MRS in Konkurrenz zu neuen nuklearmedizinischen Techniken. Durch die schnelle technische Weiterentwicklung von CT und MRT, aber auch der farbkodierten Duplexsonographie, hat die nichtinvasive Gefäßdiagnostik deutlich an Bedeutung gewonnen. Bis auf spezielle Fragestellungen wird die invasive Gefäßdiagnostik heute überwiegend nur noch bei interventionellen Behandlungen eingesetzt. Die Weiterentwicklung der minimal-invasiven radiologischen Therapie hat durch neue Gefäßprothesen und andere Techniken in den letzten Jahren ihr Indikationsspektrum ebenfalls massiv erweitert. Die Kombination von nichtinvasiver Gefäßdiagnostik und anschließender minimal invasiver interventioneller radiologischer Therapie ist ein erfolgreiches Konzept, das beispielhaft für die Innovation in der Radiologie steht. Die rasante Weiterentwicklung der nichtinvasiven Herz- und Gefäßdiagnostik stellt eine große Herausforderung und Chance zugleich dar, neue Untersuchungsstrategien und Leitlinien für die Herz- und Gefäßdiagnostik zu entwickeln. Es wurden bewusst die Untersuchungstechniken des kardiovaskulären Systems mit der MSCT und MRT in den Mittelpunkt gestellt. Hauptanliegen war es, die modernen Möglichkeiten der morphologischen Darstellung, funktionelle Untersuchungsverfahren und die interventionelle Radiologie in einem klinischen Kontext möglichst umfassend darzustellen. Würzburg im Mai 2007 Prof. Dr. D. Hahn Inhalt 1 Gefäßsystem 1.3.2 1 Herz J. Sandstede, Th. Voigtländer, Th. Pabst Untersuchungstechnik 3 J. Sandstede, Th. Pabst, Th. Voigtländer Konventionelle Röntgendiagnostik 3 Computertomographie 4 Technische Voraussetzungen 4 Durchführung der Untersuchungen und Auswertung 5 Magnetresonanztomographie 15 Technische Voraussetzungen 15 Sequenzbeschreibung 18 Durchführung der Untersuchungen 33 Echokardiographie 49 Zweidimensionale und M-Mode-Echokardiographie 49 Dopplerechokardiographie 49 Farbdopplerechokardiographie 50 Transösophageale Echokardiographie 50 Nuklearmedizin 50 Radionuklidventrikulographie 50 Single-PhotonenEmissionscomputertomographie 50 Positronenemissionstomographie 51 Herzkatheteruntersuchung 52 Normalanatomie und wesentliche Varianten 52 J. Sandstede, Th. Voigtländer Anatomie des Herzens und der Koronararterien 52 Konventionelle Röntgendiagnostik 53 Herzschatten 53 Herznahe Gefäße und pulmonale Gefäßzeichnung 54 Computertomographie und Magnetresonanztomographie 54 Echokardiographie 54 Systematische Bildanalyse und Auswertung 58 J. Sandstede Konventionelle Röntgendiagnostik 58 1.4 1.1 1.1.1 1.1.2 1.1.2.1 1.1.2.2 1.1.3 1.1.3.1 1.1.3.2 1.1.3.3 1.1.4 1.1.4.1 1.1.4.2 1.1.4.3 1.1.4.4 1.1.5 1.1.5.1 1.1.5.2 1.1.5.3 1.1.6 1.2 1.2.1 1.2.2 1.2.2.1 1.2.2.2 1.2.3 1.2.4 1.3 1.3.1 1.4.1 1.4.1.1 1.4.1.2 1.4.1.3 1.4.2 1.4.2.1 1.4.2.2 1.4.2.3 1.4.3 1.4.4 1.4.4.1 1.4.4.2 1.4.5 1.4.6 1.4.6.1 1.4.6.2 1.4.6.3 1.4.6.4 1.4.7 1.4.7.1 1.4.7.2 1.4.7.3 1.4.7.4 Computertomographie und Magnetresonanztomographie 59 Erkrankungen des Herzens 60 Th. Voigtländer, J. Sandstede, O. Mohrs Koronare Herzkrankheit 60 Primärdiagnostik der koronaren Herzerkrankung (chronische KHK) 61 Akutes Koronarsyndrom 64 Komplexe koronare Herzkrankheit 65 Kardiomyopathie 71 Hypertrophe Kardiomyopathie 71 Dilatative Kardiomyopathie 72 Arrhythmogene rechtsventrikuläre Kardiomyopathie 73 Myokarditis 75 Perikarditis 78 Akute Perikarditis 78 Pericarditis constrictiva 78 Erworbene Herzklappenerkrankungen 80 Angeborene Herzfehler 86 Gefäß- und Klappenanomalien 88 Kongenitale Aortenklappenstenose 88 Aortenisthmusstenose 88 Pulmonalstenose 89 Shuntvitien 90 Vorhofseptumdefekt 90 Ventrikelseptumdefekt 91 Ductus arteriosus Botalli 92 Komplexe angeborene Vitien 92 Fallot-Tetralogie 92 Kongenitale Transpositionen 93 Koronaranomalien 94 Kardiale Raumforderungen 95 Anatomische Varianten 97 Nichttumoröse Raumforderungen 97 Gutartige Neubildungen 98 Bösartige Neubildungen 100 Literatur 101 X Inhalt 2 2.1 2.1.1 2.1.2 2.1.3 2.1.4 2.1.4.1 2.1.4.2 2.1.4.3 2.1.4.4 2.1.4.5 2.1.4.6 2.1.4.7 2.2 2.2.1 2.2.2 2.2.3 2.2.4 2.2.4.1 2.2.4.2 2.2.4.3 2.2.4.4 2.2.4.5 3 3.1 3.1.1 3.1.2 3.1.3 3.1.4 3.2 3.2.1 3.2.2 3.2.3 3.2.4 3.2.5 3.2.6 3.2.7 3.3 3.4 3.4.1 3.4.1.1 3.4.1.2 3.4.1.3 3.4.1.4 3.4.1.5 Thorakale Aorta und pulmonale Gefäße W. Kenn Aorta 105 Radiologische Untersuchungstechnik 105 Normalanatomie und wesentliche Varianten 107 Systematische Bildanalyse 110 Krankheitsbilder 114 Aortenisthmusstenose (Coarctatio aortae) 114 Traumatische Veränderungen 117 Entzündliche Veränderungen 122 Mykotische (infektiöse) Aortitiden 126 Tumoren 127 Aortenbogensyndrom 129 Chronische thorakale Aneurysmen 138 Pulmonale Gefäße 146 Radiologische Untersuchungstechnik 146 Normalanatomie und wesentliche Varianten 147 Systematische Bildanalyse 147 Krankheitsbilder 148 Kongenitale Anomalien 148 Traumatische Veränderungen 156 Entzündliche Veränderungen 157 Tumoren 160 Andere Erkrankungen 161 Literatur 172 Gefäße im Abdomen M. Völk, J.-P. Staub, M. Strotzer Radiologische Untersuchungstechniken 177 Ultraschalldiagnostik 178 CT-Angiographie 179 MR-Angiographie 180 Digitale Subtraktionsangiographie 181 Normalanatomie und wesentliche Varianten 181 Aorta abdominalis 181 Arteriae lumbales 183 Arteriae suprarenales und renales 183 Arteria mesenterica superior und inferior 184 Vena cava inferior 187 Venae renales 190 Vena mesenterica superior und inferior 190 Systematische Bildanalyse 190 Erkrankungen der abdominellen Gefäße 192 Abdominelle Aorta 192 Abdominelles Aortenaneurysma 192 Stenose und Verschluss der abdominellen Aorta 200 Aortendissektion 201 Penetrierendes Aortenulkus 204 Intramurales Hämatom 206 3.4.1.6 Inflammatorisches Bauchaortenaneurysma 206 3.4.1.7 Infiziertes Bauchaortenaneurysma 207 3.4.1.8 Vaskulitis 207 3.4.1.9 Posttraumatische Veränderungen der abdominellen Aorta 208 3.4.1.10 Tumoren der Aorta 208 3.4.2 Truncus coeliacus 208 3.4.2.1 Ligamentum-arcuatum-medianumSyndrom 208 3.4.3 Mesenterialgefäße 211 3.4.3.1 Mesenteriale Ischämie 211 Arterielle Mesenterialembolie 212 Arterielle Mesenterialthrombose 214 Nichtokklusive mesenteriale Ischämie 215 Mesenterialvenenthrombose 216 Chronische Mesenterialischämie 217 3.4.3.2 Fibromuskuläre Dysplasie 219 3.4.3.3 Dissektion der Mesenterialarterien 220 3.4.3.4 Traumatische mesenteriale Blutung 221 3.4.3.5 Untere gastrointestinale Blutung 223 3.4.3.6 Vaskulitiden 225 Riesenzellarteriitis (Arteriitis temporalis) 26 Takayasu-Arteriitis 227 Thrombangiitis obliterans 228 Polyarteriitis nodosa 228 Wegener-Granulomatose 230 Lupus-erythematodes-Vaskulitis 231 Behçet-Syndrom 232 Andere Vaskulitiden der kleinen Gefäße 233 3.4.3.7 Retroperitoneale Fibrose 233 3.4.4 Nierengefäße 235 3.4.4.1 Arteriosklerotische Nierenarterienstenose 235 3.4.4.2 Fibromuskuläre Dysplasie 239 3.4.4.3 Nierenarterienembolie 240 3.4.4.4 Nierenarterienaneurysma 242 3.4.4.5 Arteriovenöse Malformationen der Nierenarterien 243 3.4.4.6 Nierenvenenthrombose 244 3.4.4.7 Vaskulitiden 245 Takayasu-Arteriitis 246 Polyarteriitis nodosa 247 Lupus-erythematodes-Vaskulitis 248 Literatur 249 4 4.1 4.2 4.2.1 4.3 Peripheres Gefäßsystem P. Reimer, R. Vosshenrich, P. Landwehr Radiologische Untersuchungstechnik 253 Normalanatomie und wesentliche Varianten, Radiometrie 269 Anomalien und Varianten 272 Systematische Bildanalyse 274 Inhalt 4.4 4.4.1 4.4.2 4.4.3 4.4.4 4.4.5 4.4.6 4.4.7 4.4.8 4.4.9 4.4.10 4.4.11 5 5.1 5.2 5.3 5.4 5.4.1 5.4.2 5.4.3 2 6 6.1 6.2 6.3 6.4 6.5 6.6 7 7.1 7.2 7.3 Erkrankungen der peripheren Gefäße 282 Arteriosklerose 282 Aneurysmen 289 Diabetische Angiopathie 292 Vaskulitiden 293 Thrombangiitis obliterans 296 Morbus Raynaud und sekundäres Raynaud-Phänomen 298 Fibromuskuläre Dysplasie 300 Zystische Erkrankung der Adventitia 301 Popliteales arterielles EntrapmentSyndrom 302 Thoracic-outlet-Syndrom 305 Trauma 307 Literatur 311 Venen P. Kovacs Radiologische Untersuchungstechnik 315 Normalanatomie 322 Systematische Bildanalyse 324 Fehlbildungen und Erkrankungen des Venensystems 326 Veränderungen im Hohlvenensystem 326 Veränderungen der Armvenen 332 Veränderungen der Beinvenen 335 Literatur 346 Interventionen am Gefäßsystem Supraaortale Gefäße N. Zorger Allgemeine periinterventionelle Maßnahmen 351 Arteria subclavia 352 Truncus brachiocephalicus 354 Arteria vertebralis 355 Arteria carotis 356 Intrakranielle Gefäße 360 Literatur 361 Thorakale und abdominale Aorta G. Luska Thorakale Aorta 363 Abdominale Aorta 371 Ausblick 377 Literatur 378 8 8.1 8.1.1 8.1.2 8.2 8.2.1 8.2.2 9 9.1 9.1.1 9.1.2 9.1.3 9.1.4 9.2 9.3 9.3.1 9.4 9.4.1 9.4.2 10 10.1 10.2 11 11.1 11.1.1 11.1.2 11.1.3 11.2 11.2.1 11.2.2 11.2.3 11.2.4 11.2.5 11.2.6 Abdominelle Gefäße M. Uder, M. Heinrich, M. Köhler Nierenarterien 379 M. Uder, M. Heinrich Behandlung der Nierenarterienstenose 379 Zentraler und peripherer Verschluss von Nierenarterien 386 Literatur 392 Mesenterialgefäße 393 M. Köhler Behandlung der mesenterialen Ischämie 393 Behandlung der gastrointestinalen Blutung 399 Literatur 403 Beckengefäße K. Schürmann, D. Vorwerk Behandlung der peripheren arteriellen Verschlusskrankheit der Beckenarterien 405 Beckenarterienstenosen 408 Beckenarterienverschlüsse 411 Behandlung von Restenosen 413 Perinterventionelle Behandlung 415 Behandlung von TransplantatNierenarterienstenosen 417 Embolisationsbehandlung im Becken 417 Uterusmyomembolisation 419 Venöse Interventionen 422 Beckenvenenthrombose 422 Beckenvenenstenosen 424 Literatur 426 Periphere Arterien D. Vorwerk Gefäßeröffnende Verfahren bei chronischen Veränderungen Gefäßeröffnende Verfahren bei akuten Verschlüssen 440 Literatur 443 429 Hämodialyseshunt G. Wittenberg Diagnostik 446 Farbkodierte Duplexsonographie 446 Arterielle Shuntangiographie 448 Venöse Shuntangiographie 449 Interventionen 449 Indikationen zur Therapie 449 Kontraindikationen zur Therapie 450 Therapie der Shuntstenose 450 Therapie des Shuntverschlusses 455 Therapie der zentralvenösen Stenose 457 Schlussfolgerung 458 Literatur 459 XI XII Inhalt 12 12.1 12.1.1 12.1.2 12.1.3 12.1.4 12.1.5 12.1.6 12.1.7 12.2 12.2.1 12.2.2 Transjugulärer portosystemischer Shunt (TIPS) T. Kirchhoff, H. Rosenthal Indikationen zur TIPS-Anlage 461 Rezidivierende Varizenblutung 461 Therapierefraktärer Aszites 462 Therapierefraktärer Hydrothorax 462 Hepatorenales Syndrom 462 Hepatopulmonales Syndrom 462 Budd-Chiari-Syndrom 462 Venookklusive Erkrankung 463 Methodik der TIPS-Anlage 463 Hämodynamische Veränderungen nach TIPS-Anlage 466 Primäre und sekundäre Offenheit 466 12.3 12.4 12.4.1 12.4.2 12.5 Komplikationen 466 Verlaufskontrollen 467 Sonographische und angiographische Verlaufskontrollen Angiographische Portographie zur TIPS-Kontrolle und Shuntrevision 468 TIPS als Brücke zur Transplantation 468 Literatur 469 Sachverzeichnis 471 Autorenverzeichnis Hahn, D., Prof. Dr. med. Institut für Röntgendiagnostik Universität Würzburg Josef-Schneider-Straße 2 97080 Würzburg Heinrich, Marc, Dr. med. Institut für Diagnostische Radiologie der Universität Erlangen-Nürnberg Maximiliansplatz 1 91054 Erlangen Kenn, Werner, Dr. med. Institut für Röntgendiagnostik Universität Würzburg Josef-Schneider-Straße 2 97080 Würzburg Kirchhoff, Timm D., Dr. med. Abteilung Diagnostische Radiologie OE 8220 Medizinische Hochschule Hannover Carl-Neuberg-Straße 1 30625 Hannover Köhler, Michael, Dr. med. Universitätsklinikum Münster Institut für Klinische Radiologie Albert-Schweitzer-Straße 33 48149 Münster Kovacs, Peter, Dr. med. Klinische Abteilung für Radiodiagnostik I Universitäts-Klinik für Radiodiagnostik Medizinische Universität Innsbruck Anichstraße 35 6020 Innsbruck Österreich Landwehr, Peter, Priv.-Doz. Dr. med. Klinik für Diagnostische und Interventionelle Radiologie KH Henriettenstift Marienstraße 72–90 30171 Hannover Luska, Günter, Prof. em. Dr. med. Hindenburgstraße 12 31319 Sehnde Mohrs, Oliver K., Dr. med. Radiologie Darmstadt Abteilung für Kardiovaskuläre Bildgebung am Alice-Hospital Dieburger Straße 29 – 31 64287 Darmstadt Pabst, Thomas, Dr. rer. nat. Institut für Röntgendiagnostik Universität Würzburg Josef-Schneider-Straße 2 97080 Würzburg Reimer, Peter, Prof. Dr. med. Zentralinstitut für bildgebende Diagnostik Städtisches Klinikum Moltkestraße 90 76133 Karlsruhe Rosenthal, Herbert, Dr. med. Abteilung Diagnostische Radiologie OE 8220 Medizinische Hochschule Hannover Carl-Neuberg-Straße 1 30625 Hannover Sandstede, Jörn, Priv.-Doz. Dr. med. Röntgenzentrum Schäferkampsallee Schäferkampsallee 5–7 20357 Hamburg XIV Autorenverzeichnis Schürmann, Karl, Prof. Dr. med. Institut für Diagnostische und Interventionelle Radiologie St.-Johannes-Hospital Johannesstraße 9–17 44137 Dortmund Staub, Jens-Peter, Dr. med. FA für Innere Medizin und Diagnostische Radiologie Abteilung VIII (Radiologie) Bundeswehrkrankenhaus Oberer Eselsberg 40 89081 Ulm Strotzer, Michael, Prof. Dr. med. Abteilung Radiologie Chefarzt-Klinik Hohe Warte Hohe Warte 8 95445 Bayreuth Uder, Michael, Prof. Dr. med. Institut für Diagnostische Radiologie Universität Erlangen-Nürnberg Maximiliansplatz 1 91054 Erlangen Voigtländer, Thomas, Priv.-Doz. Dr. med.. Cardioangiologisches Centrum Bethanien Im Prüfling 23 60389 Frankfurt Völk, Markus, Priv.-Doz. Dr. med. Ärztlicher Leiter MVZ Theresientor Stadtgraben 10 94315 Straubing Vorwerk, Dierk, Prof. Dr. med. Institut für Diagnostische und Interventionelle Radiologie Klinikum Ingolstadt GmbH Krumenauerstraße 25 85049 Ingolstadt Vosshenrich, R., Prof. Dr. med. Radiologen-Gemeinschaftspraxis Magnetresonanztherapie im Friederikenstift Humboldtstraße 5 30169 Hannover Wittenberg, G., Priv.-Doz. Dr. med. Institut für Röntgendiagnostik Universität Würzburg Josef-Schneider-Straße 2 97080 Würzburg Zorger, Niels, Priv.-Doz. Dr. med. Institut für Röntgendiagnostik Universität Regensburg Franz-Josef-Strauß-Allee 11 93042 Regensburg 1 Gefäßsystem Herz 1 J. Sandstede, Th. Voigtländer, Th. Pabst, O. Mohrs 1.1 1.1.1 1.1.2 1.1.2.1 1.1.2.2 1.1.3 1.1.3.1 1.1.3.2 1.1.3.3 1.1.4 1.1.4.1 1.1.4.2 1.1.4.3 1.1.4.4 1.1.5 1.1.5.1 1.1.5.2 1.1.5.3 1.1.6 1.4.5 Erworbene Herzklappenerkrankungen 80 1.4.6 Angeborene Herzfehler 86 1.4.6.1 Gefäß- und Klappenanomalien 88 Kongenitale Aortenklappenstenose 88 Aortenisthmusstenose 88 Pulmonalstenose 89 1.4.6.2 Shuntvitien 90 Vorhofseptumdefekt 90 Ventrikelseptumdefekt 91 Ductus arteriosus Botalli 92 1.4.6.3 Komplexe angeborene Vitien 92 Fallot-Tetralogie 92 Kongenitale Transpositionen 93 1.4.6.4 Koronaranomalien 94 1.4.7 Kardiale Raumforderungen 95 1.4.7.1 Anatomische Varianten 97 1.4.7.2 Nichttumoröse Raumforderungen 97 1.4.7.3 Gutartige Neubildungen 98 1.4.7.4 Bösartige Neubildungen 100 Untersuchungstechnik 3 J. Sandstede, Th. Pabst, Th. Voigtländer Konventionelle Röntgendiagnostik 3 Computertomographie 4 Technische Voraussetzungen 4 Durchführung der Untersuchungen und Auswertung 5 Magnetresonanztomographie 15 Technische Voraussetzungen 15 Sequenzbeschreibung 18 Durchführung der Untersuchungen 33 Echokardiographie 49 Zweidimensionale und M-Mode-Echokardiographie 49 Dopplerechokardiographie 49 Farbdopplerechokardiographie 50 Transösophageale Echokardiographie 50 Nuklearmedizin 50 Radionuklidventrikulographie 50 Single-PhotonenEmissionscomputertomographie 50 Positronenemissionstomographie 51 Herzkatheteruntersuchung 52 Literatur 1.2 Normalanatomie und wesentliche Varianten 52 J. Sandstede, Th. Voigtländer 1.2.1 Anatomie des Herzens und der Koronararterien 52 1.2.2 Konventionelle Röntgendiagnostik 53 1.2.2.1 Herzschatten 53 1.2.2.2 Herznahe Gefäße und pulmonale Gefäßzeichnung 54 1.2.3 Computertomographie und Magnetresonanztomographie 54 1.2.4 Echokardiographie 54 1.3 1.3.1 1.3.2 1.3.3 1.4 1.4.1 1.4.1.1 1.4.1.2 1.4.1.3 1.4.2 1.4.2.1 1.4.2.2 1.4.2.3 1.4.3 1.4.4 1.4.4.1 1.4.4.2 Systematische Bildanalyse und Auswertung J. Sandstede Konventionelle Röntgendiagnostik 58 Computertomographie und Magnetresonanztomographie 59 Echokardiographie 59 101 1.1 Untersuchungstechnik J. Sandstede, Th. Pabst, Th. Voigtländer 1.1.1 Konventionelle Röntgendiagnostik 58 Erkrankungen des Herzens 60 Th. Voigtländer, J. Sandstede, O. Mohrs Koronare Herzkrankheit 60 Primärdiagnostik der koronaren Herzerkrankung (chronische KHK) 61 Akutes Koronarsyndrom 64 Komplexe koronare Herzkrankheit 65 Kardiomyopathie 71 Hypertrophe Kardiomyopathie 71 Dilatative Kardiomyopathie 72 Arrhythmogene rechtsventrikuläre Kardiomyopathie 73 Myokarditis 75 Perikarditis 78 Akute Perikarditis 78 Pericarditis constrictiva 78 Die konventionelle radiologische Herzdiagnostik besteht aus der Darstellung des Herzens im posterior-anterioren (p.-a.) Strahlengang und links anliegend im seitlichen Strahlengang. Die technische Durchführung entspricht der üblichen Anfertigung einer Thoraxübersichtsaufnahme. In Ausnahmefällen kann bei Vergrößerung des linken Vorhofs und/oder Ventrikels und bei Lageanomalien der Aorta und/oder Abgangsanomalien der supraaortalen Gefäße die Kontrastierung des Ösophagus mittels Ösophagusbreischluck sinnvoll sein. Zusätzliche Aufnahmen in rechter und linker vorderer Schrägstellung werden im klinischen Alltag nicht mehr durchgeführt.Wenn der klinische Zustand des Patienten eine Untersuchung im Stehen nicht zulässt, kann alternativ die Thoraxübersichtsaufnahme im Liegen in Rückenlage angefertigt werden. Eine Thoraxdurch- 4 Kapitel 1 Herz leuchtung mit einem Bildverstärkerfernsehsystem wird nur noch zur Lokalisation sowie Beweglichkeitsprüfung von röntgendichten Herzklappenprothesen und Herzschrittmachersonden durchgeführt. Völlig verlassen wurden die Kymographie und die konventionelle Tomographie des Herzens. 1.1.2 Computertomographie 1.1.2.1 Technische Voraussetzungen Eine spezielle computertomographische Herzuntersuchung stellt aufgrund der schnellen und komplexen Eigenbewegung des Herzens hohe Anforderungen an die Gerätetechnik. Im Rahmen der üblichen CT-Diagnostik des Thorax ist nur eine orientierende Beurteilung des Herzens möglich. ! Für eine spezielle Herzdiagnostik sind Merke eine EKG-Triggerung und eine zeitliche Auflösung der Datenakquisition ≤250 ms notwendig. Daher sollte eine dedizierte CT-Herzuntersuchung nicht mit einer Inkremental-CT und auch nicht mit einer Einzelschicht-Spiral-CT durchgeführt werden, sondern ausschließlich entweder mit der Elektronenstrahl-CT oder der Mehrschicht-CT. Elektronenstrahl-CT Die Elektronenstrahl-CT (EBT, „electron beam CT“) zeichnet sich im Vergleich zur herkömmlichen CT durch seine hohe zeitliche Auflösung von 50–100 ms Datenakquisitionszeit aus. Dies wird durch seine spezielle Technik ermöglicht, die auf bewegte Teile verzichtet. Im Gegensatz zur üblichen Rotation der Röntgenröhre um den Patienten, deren Geschwindigkeit letztendlich durch die entstehenden Fliehkräfte begrenzt ist, entsteht bei der EBT die Röntgenstrahlung in semizirkulär um den Patienten angeordneten „Wolfram-Targets“ durch Rotation eines Elektronenstrahls. Hierzu werden Elektronen mit einer Elektronenkanone zunächst beschleunigt, dann fokussiert und auf die Target-Ringe ausgelenkt. Grundsätzlich werden alle Untersuchungen mit einer prospektiven EKG-Triggerung durchgeführt. Für den Einsatz in der kardialen Diagnostik stehen 2 Aufnahmemodi mit unterschiedlicher zeitlicher und räumlicher Auflösung zur Verfügung. ∑ Im Einzelschichtmodus werden Aufnahmen mit einer zeitlichen Auflösung von 100 ms und einer Matrix von 512×512 akquiriert. Diese Technik wird für den Nachweis von Koronarkalk, die CTKoronarangiographie und die morphologische Darstellung des Herzens eingesetzt. ∑ Im Cine-Modus zur Funktionsdiagnostik wird eine höhere zeitliche Auflösung von 50 ms bei einer Matrix von 256×256 erzielt. Im Gegensatz zur konventionellen CT, bei der sowohl die Scan-Dauer als auch die Spannung und der Röhrenstrom zur Einstellung der Röntgendosis reguliert werden können, wird bei der EBT die Quantität der Röntgenstrahlung und damit die Qualität des CT-Bildes ausschließlich durch die Expositionszeit reguliert. Die Elektronenkanone arbeitet konstant bei 130 kV und 630 mA (Becker et al. 1998 a). Dadurch sinkt die Bildqualität bei adipösen Patienten aufgrund des geringeren Signal-zu-Rausch-Verhältnisses deutlich ab. Nachteile des EBT sind die hohen Kosten bei geringer Verfügbarkeit aufgrund der fehlenden Anwendbarkeit in der Routinediagnostik anderer Körperbereiche. Mehrschicht-CT Die Einführung der Mehrschicht-CT (MSCT) hat die computertomographische Herzdiagnostik revolutioniert. Im Vergleich zur EBT lässt sich eine bessere Bildqualität erzielen. Außerdem findet die Methode aufgrund ihrer vielseitigen Einsetzbarkeit eine deutlich größere Verbreitung. Der Hauptunterschied zur üblichen Spiral-CT ist neben der kürzeren Röhrenrotationszeit das Vorhandensein von mehr als einer Detektorzeile, wodurch sich mit einer Röhrenrotation mehrere Schichten gleichzeitig akquirieren lassen. Die ersten MSCT-Geräte waren so genannte 4-ZeilenComputertomographen, d. h. es wurden gleichzeitig 4 Schichten akquiriert. Derzeit sind 16-Zeilen-Geräte am weitesten verbreitet. In der Herzdiagnostik werden überwiegend schon 40- und 64-Zeilen-Geräte eingesetzt. Ein Ende der technischen Weiterentwicklung ist noch nicht absehbar. Wie bei der Einzelschicht-Spiral-CT lassen sich Datenakquisition und Datenrekonstruktion durch 4 Parameter (Kollimation, Tischvorschub, Schicht– dicke, Inkrement) beschreiben. Die Kollimation gibt die röhrenseitig eingestellte minimale Dicke einer Einzelschicht an. Diese kann bei der Rekonstruktion nicht unterschritten werden. Die Angabe erfolgt als Kollimation einer Einzelschicht, multipliziert mit der Schichtanzahl (z. B. 4×2,5 mm). Zusammen mit dem Tischvorschub pro Umlauf ergibt sich der „Pitch-Faktor“, der entweder auf die Einzel- oder Gesamtkollimation bezogen werden kann. Beispielsweise ergibt eine Kollimation von 4×2,5 mm bei einem Tischvorschub von 15 mm einen Pitch-Faktor von 1,5 bzw. 6. Mittlerweile hat sich die Angabe des Pitch-Faktors bezogen auf die Gesamtkollimation durchgesetzt. Im Gegensatz zur Einzelschicht-Spiral-CT hat der PitchFaktor jedoch bei Beibehaltung der gerätetechnischen Einstellungen keinen Einfluss auf die resultie- 1.1 Untersuchungstechnik rende Strahlenexposition, da bei höherem Pitch der Röhrenstrom automatisch erhöht wird, um eine konstante Bildqualität zu erreichen. Ein hoher Pitch dient daher hauptsächlich der schnellen Volumenabdeckung. In der Herzdiagnostik wird dagegen ein Pitch <1 verwendet, da die überlappende Datenakquisition die Bildqualität verbessert. Die Schichtdicke gibt die Dicke der berechneten Einzelschicht an, das Inkrement den Schichtabstand. Aufgrund der Rekonstruktionen in anderen Ebenen empfiehlt sich eine überlappende Rekonstruktion mit einem Inkrement von 20–50% der Schichtdicke. Wie auch bei der EBT werden alle Herzuntersuchungen EKG-getriggert durchgeführt. Allerdings ist nicht nur eine prospektive Triggerung (EKG-gesteuerte Scan-Auslösung) sondern auch ein retrospektives Gating (EKG-korrelierte Bilddatenberechnung) möglich. Während bei der prospektiven Triggerung nur ein fester Zeitpunkt der Datenakquisition vor der Untersuchung wählbar ist, können beim retrospektiven Gating die Rohdaten zu unterschiedlichen Zeitpunkten im Herzzyklus rekonstruiert werden. Grundsätzlich lässt sich der Rekonstruktionszeitpunkt auf 3 verschiedene Arten angeben: 1. als relative Verzögerung in Prozent des Herzzyklus nach der vorausgegangenen R-Zacke, 2. als absolute Verzögerung in Millisekunden nach der vorausgegangenen R-Zacke, 3. als reverse Verzögerung in Millisekunden in einem definierten Abstand vor der nachfolgenden R-Zacke. Im klinischen Alltag hat sich bei gleichmäßigem Herzrhythmus die relative Verzögerung in Prozent des Herzzyklus durchgesetzt, bei Arrhythmien wird jedoch vermehrt die absolute Verzögerung in Millisekunden eingesetzt. Die ersten 4-Zeilen-Geräte hatten eine Rotationszeit von 500 ms. In Abhängigkeit von Hersteller und Gerätegeneration liegt die Rotationsgeschwindigkeiten derzeit zwischen 330 und 500 ms. Mit einem auf dem Halfscan-Verfahren beruhenden Rekonstruktionsalgorithmus muss die Röhre für die Aufnahme eines Bildes eine halbe Rotation beschreiben. Damit wird die effektive zeitliche Auflösung auf die Hälfte der Rotationszeit erhöht. Somit können mittlerweile zeitliche Auflösungen zwischen 165 und 250 ms erzielt werden. Dies gilt sowohl für die prospektive Triggerung als auch für das retrospektive Gating. Eine höhere zeitliche Auflösung lässt sich auf 3 Wegen erreichen: 1. Schnellere Röhrenrotationszeiten: Hier besteht eine physikalische Grenze durch die Fliehkräfte, die bei immer schnellerer Rotation exponentiell zunehmen. 2. Rekonstruktion der Bilddaten aus mehreren Herzzyklen (Multisegmentrekonstruktion; Flohr u. Ohnesorge 2001). Hierdurch kommt es zu einer besseren zeitlichen Auflösung, die direkt proportional zur Anzahl der verwendeten Herzzyklen (Segmente) ist. So kann durch die Rekonstruktion von Bildern aus 2 Segmenten die zeitliche Auflösung z. B. verdoppelt werden. Heute werden bis zu 4 Segmente verwendet. Allerdings kann es bei Arrhythmien oder Frequenzschwankungen zu Artefakten kommen. 3. Einsatz von je 2 Röntgenröhren und Detektoren („Dual-source-“ oder „Zwei-Röhren-CT“): Durch die Anordnung von 2 Röhren-Detektor-Paaren, die um 90° versetzt sind, kann die effektive zeitliche Auflösung der Aufnahme einer vollständigen Schicht auf ein Viertel der Rotationszeit erhöht werden (Johnson et al. 2006). Damit wird die zeitliche Auflösung verdoppelt. Die erste derartige CT erreicht so bei einer Röhrenrotationszeit von 330 ms eine zeitliche Auflösung von 83 ms. Beim retrospektiven Gating kann die Strahlenexposition durch den Einsatz einer EKG-gesteuerten Reduktion des Röhrenstroms vermindert werden. Grundlage des Dosismodulation ist, dass bei der CTKoronarangiographie für die Bildrekonstruktion nur die während einer bestimmten Herzphase akquirierten Daten verwendet werden, während die zu anderen Zeitpunkten im Herzzyklus akquirierten Daten verworfen oder nur für die Funktionsanalyse verwendet werden (s. unten,Abschn.„CT-Koronarangiographie“). Hierfür ist eine reduzierte Bildqualität bei reduziertem Röhrenstrom ausreichend. Deshalb kann der Röhrenstrom während der Herzphase reduziert werden, die nicht zur Rekonstruktion der koronarangiographischen Daten verwendet wird, ohne dass dadurch die Bildqualität der CT-Koronarangiographie abnimmt. Zumeist findet die Datenrekonstruktion in der Diastole (etwa 55–75% des Herzzyklus) statt, weshalb der Röhrenstrom in der Systole vermindert wird. Bei schnelleren Herzfrequenzen kann jedoch der optimale Rekonstruktionszeitpunkt sowohl in der Systole (bei etwa 30%) als auch in der Diastole liegen, weshalb dann der Röhrenstrom nicht zwischen 30-75% des RR-Intervalls, sondern nur in den übrigen Abschnitten der Herzzyklus reduziert wird. Die Dosisreduktion kann bis zu etwa 50% betragen. 1.1.2.2 Durchführung der Untersuchungen und Auswertung Für die Mehrzahl der kardialen CT-Untersuchungen umfasst das Untersuchungsvolumen das gesamte Herz von der Trachealbifurkation bzw. dem Unterrand der linken Pulmonalarterie bis zur Herzspitze 5 6 Kapitel 1 Herz bzw. dem inneren Zwerchfellwinkel. Mit Ausnahme der Koronarkalkdetektion werden CT-Herzuntersuchungen unter Gabe eines jodhaltigen Kontrastmittels durchgeführt. Hierfür ist ein automatischer Injektor notwendig, der Flussgeschwindigkeiten >3 ml/s ermöglicht. Wenn möglich sollte bei doppelläufigem Injektor ein NaCl-Bolus zur Reduktion der Kontrastmittelmenge angeschlossen werden. Der Zeitpunkt der Kontrastmittelinjektion sollte durch eine Testbolusmessung oder durch automatische Boluserkennung optimiert werden. Der Patient wird in Rückenlage wie für eine Thorax-CT positioniert. Die EKG-Elektroden werden bilateral infraklavikulär und an der linkslateralen Thoraxwand außerhalb des Scan-Volumens platziert. Die Untersuchungen finden in Inspiration statt. Die Untersuchung wird meist in kraniokaudaler Richtung zur sicheren Erfassung der Koronararterienabgänge durchgeführt, kann aber abhängig von der Fragestellung auch kaudokranial geplant werden. Morphologie Zur Darstellung der Morphologie ist eine zeitliche Auflösung von ≤250 ms notwendig, die Datenakquisition wird in die Diastole gelegt. Bei höheren Herzfrequenzen können Bewegungsartefakte entstehen, eine Auswertung ist jedoch zumeist möglich. Die Untersuchung erfolgt analog zur CT-Koronarangiographie. Funktion Die Funktionsdiagnostik des Herzens ist sowohl mit der EBT als auch der MSCT möglich. Die Auswertung der CT-Funktionsanalyse erfolgt analog der Auswertung der Cine-MRT. CT-spezifische Normalwerte sind aufgrund der Strahlenexposition für gesunde Probanden nicht bestimmt worden. In der Literatur konnten für alle Parameter signifikante Korrelationen zwischen MRT und EBT sowie etwas ungenauer auch zwischen MRT und MSCT gezeigt werden, sodass sich die CT bei bestehenden Kontraindikationen als Alternativmethode für den Goldstandard MRT anbietet (Kivelitz et al. 2000). Allerdings sollten wegen der vorhandenen systematischen Unterschiede Verlaufskontrollen unter Therapie nur mit einer Untersuchungstechnik durchgeführt werden. Bei der EBT wird durch Auslenkung des Untersuchungstisches nach rechts (25°) und nach unten (19° Neigung) annähernd eine Darstellung in der kurzen Herzachse erreicht. Eine Auslenkung nach links (21°) und unten versucht, den links- bzw. rechtsventrikulären Zweikammerblick darzustellen. Da die Herzachse bei jedem Patienten anatomisch unterschiedlich ist und die Freiheitsgrade des Untersuchungstisches begrenzt sind, gelingt die Einstellung von definierten Herzachsen jedoch nur in beschränktem Umfang (Becker et al. 1998 a). Das Herz wird im Cine-Modus in einer Atemanhaltephase in 12 Schichten mit einer Schichtdicke von 8 mm untersucht. Dabei werden maximal 13 Scans pro Schicht und Herzzyklus aufgezeichnet. Die Akquisitionszeit der Einzelschichten und damit die zeitliche Auflösung betragen 50 ms. Nach Bestimmung der Kontrastmitteltransitzeit mit einem Testbolus werden 90–100 ml Kontrastmittel mit einer Flussgeschwindigkeit von 3 ml/s injiziert. Der Bildausschnitt der rekonstruierten Bilder beträgt 18 bzw. 21 cm, die Matrix 256×256. Daraus resultiert eine Pixelgröße von 0,49 bzw. 0,67 mm2. Mit der MSCT können die im Rahmen der CT-Koronarangiographie mit retrospektivem Gating gewonnenen Daten entlang der kurzen Herzachse über den Herzzyklus multiplanar reformatiert werden. Hierbei stellt sich jedoch die Frage, ob die zeitliche Auflösung der CT des Herzens für eine valide Funktionsanalyse ausreichend ist. In Abhängigkeit von Hersteller und Gerätegeneration liegt die Rotationsgeschwindigkeit zwischen 330–500 ms. Mit einem auf dem Halfscan-Verfahren beruhenden Rekonstruktionsalgorithmus können bei Ein-Röhren-Geräten somit zeitliche Auflösungen von 165–250 ms erzielt werden. Ein anderer Ansatz zur Verbesserung der zeitlichen Auflösung ist der Einsatz eines MultisegmentRekonstruktionsalgorithmus. Hierbei können aufgrund des „Oversamplings“ bei der Datenakquisition für die Rekonstruktion einer Schicht Daten aus mehreren Herzphasen verwendet werden. Hierdurch kommt es zu einer besseren zeitlichen Auflösung auf Kosten einer gewissen Unschärfe, wenn nicht jeder Herzschlag exakt gleich ist. Dies erscheint jedoch für die Funktionsanalyse nicht von so großer Bedeutung wie für die Koronarangiographie, da die MRT auch über mehrere Herzschläge mittelt. Allerdings konnte für die MRT gezeigt werden, dass für eine valide Funktionsanalyse eine zeitliche Auflösung ≤ 50 ms pro Herzphase notwendig ist, da bei schlechterer zeitlicher Auflösung mit konsekutiv schlechterer Abgrenzbarkeit der Endsystole das endsystolische Volumen überschätzt und die Ejektionsfraktion unterschätzt werden. Trotz dieser methodischen Problematik wurden jedoch immer wieder gute Ergebnisse der CT-Funktionsanalyse publiziert (Heuschmid et al. 2005; Hundt et al. 2005; Yamamuro et al. 2005). Somit können die im Rahmen der CT-Koronarangiographie erhobenen Daten für die globale Funktionsanalyse ausgewertet werden mit klinisch einsetzbaren Ergebnissen. Hierbei ist der Multisegment-Rekonstruktionsalgorithmus aufgrund der höheren, wenn auch gemittelten zeitlichen Auflösung dem Halfscan-Verfahren überlegen. Ein Einsatz der MSCT zur Funktionsanalyse allein ist weiterhin kaum als sinnvoll an- 1.1 Untersuchungstechnik zusehen, zumal bisher noch nicht gezeigt werden konnte, dass eine regionale Funktionsanalyse mit der CT zuverlässig möglich ist. Koronarkalkbestimmung Mittlere und größere Verkalkungen der Koronararterien lassen sich auch in der konventionellen Durchleuchtung nachweisen. Allerdings lassen sich die Läsionen nicht quantifizieren. Kleinere Läsionen entgehen dem Nachweis, und die Methode ist deutlich von der Erfahrung des Untersuchers abhängig (Becker et al. 1998 b). Auch mit der konventionellen CT kann Koronarkalk detektiert werden. Probleme der konventionellen CT basieren jedoch auf der langen Akquisitionszeit. Es resultieren Bewegungsartefakte, Partialvolumeneffekte, Fehlmessungen durch Atemverschieblichkeit und folglich eine niedrige Reproduzierbarkeit und geringe Sensitivität im Nachweis kleiner Läsionen (Stanford u. Thompson 1999). Die im Vergleich zum Herzschlag lange Akquisitionszeit ist auch der Nachteil der Einzelschicht-Spiral-CT. Die Einführung von EKG-getriggerten SubsekundenScannern ermöglichte zwar eine der EBT vergleichbare Koronarkalkquantifizierung, die Verbreitung der MSCT hat jedoch diese Entwicklung überholt. Für eine valide Koronarkalkquantifizierung ist aufgrund der Bewegung der Koronararterien eine zeitliche Auflösung ≤ 250 ms zu fordern. 쐍 EBT. Für den Nachweis von Koronarverkalkungen wird das gesamte Herz mit etwa 40 kontinuierlichen Schichten mit einer Schichtdicke und einem Tischvorschub von jeweils 3 mm bei 130 kV und 630 mA im Einzelschichtmodus abgebildet. Hierfür sind abhängig von der Gerätegeneration ein oder 2 Atemanhaltephasen notwendig. Die Aufnahmen werden prospektiv EKG-getriggert. Die Datenakquisition erfolgt in der Diastole mit einem Abstand von 80% des RRIntervalls zur vorangehenden R-Zacke. Die Expositionszeit beträgt 100 ms. Im Gegensatz zu den meis- ten anderen Anwendungen der CT in der kardialen Diagnostik erfolgt diese Untersuchung ohne Verabreichung von Kontrastmittel. Die Strahlenexposition liegt zwischen 0,5–0,8 mSv (Becker et al. 1999). 쐍 MSCT. Die Koronarkalkbestimmung mit der MSCT kann entweder mit prospektiver Triggerung wie bei der EBT oder mit retrospektivem Gating wie bei der CT-Koronarangiographie durchgeführt werden. Bei der prospektiven Triggerung werden im Inkrementalmodus gleichzeitig mehrere Schichten akquiriert, dann erfolgt der aus Schichtanzahl und Schichtdicke resultierende Tischvorschub. Bei der 4-Zeilen-CT sind dies 4×2,5 mm dicke Schichten mit 10 mm-Tischvorschub. Die Triggerung wurde zunächst analog zur EBT bei 80% des RR-Intervalls durchgeführt, mittlerweile hat sich 60% als die durchschnittliche beste Herzphase für die CT-Koronarkalkmessung herausgestellt. Die Strahlenexposition liegt bei 1–3 mSv. Nachteil der 4-Zeilen-Technik ist, dass aufgrund der Detektorkonfiguration nur Schichtdicken von 2,5 mm und nicht wie für die EBT standardisiert von 3 mm gemessen werden können. Bei CT-Geräten mit mehr – und damit auch dünneren – Schichten dagegen können die Detektoren so zusammen geschaltet werden, dass wieder die zur EBT identische Schichtdicke von 3 mm gemessen wird (Tabelle 1.1). Die Koronarkalkmessung mit retrospektivem Gating wird analog zur CT-Koronarangiographie durchgeführt, allerdings mit niedrigerem Röhrenstrom und höherer Schichtkollimation (Tabelle 1.2). Die Datenrekonstruktion kann analog zur EBT mit einer Schichtdicke von 3 mm bei einem Inkrement von 3 mm erfolgen. Sinnvoller ist aber die überlappende Rekonstruktion mit einem Inkrement von 1,5 mm, die zu einer Verringerung der Variabilität und damit einer verbesserten Reproduzierbarkeit führt. Ursache hierfür ist die Verminderung von Partialvolumeneffekten. Bei einer Schichtdicke von 3 mm und Tabelle 1.1. Durchführung CT-Koronarkalkmessung mit prospektiver Triggerung Gerätetechnik 4-Zeiler 16-Zeiler 64-Zeiler Dual-source-64-Zeiler 32×0,6 mm Kollimation 4×2,5 mm 16×0,75 mm 32×0,6 mm Tischvorschub 10 mm 18 mm 18 mm 18 mm Schichtdicke 2,5 mm 3 mm 3 mm 3 mm Inkrement 2, 5 mm 3 mm 3 mm 3 mm Röhrenspannung 120 kV 120 kV 120 kV 120 kV Röhrenstrom 100 mAs 100 mAs 100 mAs 76 mAs EKG-Triggerung Prospektiv Prospektiv Prospektiv Prospektiv Kontrastmittel Nein Nein Nein Nein 7 8 Kapitel 1 Herz Tabelle 1.2. Durchführung CT-Koronarkalkmessung mit retrospektivem Gating Gerätetechnik 4-Zeiler 16-Zeiler 64-Zeiler Dual-source-64-Zeiler Kollimation 4×2,5 mm 16×1,5 mm 24×1,2 mm 24×1,2 mm Tischvorschub 3,8 mm 5,5 mm 5,7 mm 5,7 mm Schichtdicke 3 mm 3 mm 3 mm 3 mm Inkrement 1,5 mm 1,5 mm 1,5 mm 1,5 mm Röhrenspannung 120 kV 120 kV 120 kV 120 kV Röhrenstrom 40 mAs (100 mAs eff.) 30 mAs (100 mAs eff.) 20 mAs (100 mAs eff.) 40 mAs/Rotation (100 mAs eff.) EKG-Triggerung Retrospektiv + Röhrenstrommodulation Retrospektiv + Röhrenstrommodulation Retrospektiv + Röhrenstrommodulation Retrospektiv + Röhrenstrommodulation Kontrastmittel Nein Nein Nein Nein Bei einer Schichtdicke von 3 mm und einer Akquisition Schicht-bei-Schicht kann ein Kalkplaque mit einem kraniokaudalen Durchmesser von 3 mm exakt in der Schicht lokalisiert und damit gut detektierbar sein. Im schlechtesten Fall dagegen liegt der Plaque genau zwischen 2 Schichten und wird nicht detektiert aufgrund von Partialvolumeneffekten, die durch überlappende Rekonstruktion vermindert werden. Ein weiterer Vorteil ist die Möglichkeit der Datenrekonstruktion zu verschiedenen Zeitpunkten aus demselben Rohdatensatz. Nachteil ist die im Vergleich zur prospektiven Triggerung mit 1–3,5 mSv (Männer) bzw. 1,4–4,1 mSv (Frauen) deutlich höhere Strahlenexposition (Jakobs et al. 2002; Mahnken et al. 2001). 쐍 Auswertung. Die am häufigsten eingesetzte Methode der Koronarkalkquantifizierung ist die Bestimmung des Agatston-Scores. Hierfür werden alle 4 Koronararterienhauptäste in ihrem Verlauf manuell mit groben Konturen segmentiert. Das Auswerteprogramm detektiert innerhalb der Markierung alle Strukturen mit Dichtewerten ≥130 HE. Alternativ kann die Software auch erst alle Pixel ≥130 HE detektieren, die dann vom Untersucher manuell den einzelnen Koronararterien zugeordnet werden (Abb. 1.1). Mehrere „Pitfalls“ können zu einer falschhohen Bestimmung des Koronarkalk-Scores führen. Dies sind Verkalkungen des Anulus fibrosus mitralis und der Aortenwurzel, die bei der manuellen Segmentierung ausgeschlossen werden müssen. Die Einbeziehung von Stents kann durch die spezielle Morphologie und eine sorgfältige Anamnese verhindert werden. Probleme können auch Bewegungsartefakte vor allem der rechten Kranzarterie bereiten. Allerdings sollten die Artefakte mit gemessen werden. Hierdurch wird der Score zwar verfälscht, die Interobserver-Variabilität aber verringert. Zur Berechnung wird zunächst für jeden Kalkplaque die verkalkte Fläche nebeneinander liegender Pixel mit einem Wichtungsfaktor zwischen 1 und 4 abhängig von der maximalem CT-Dichte der Läsion multipliziert (131–200 HE=1, 201–300 HE=2, 301– 400 HE=3, ≥ 401 HE=4). Merke ! Der Grenzwert, ab dem eine Läsion als verkalkt angesehen wird, liegt bei 130 HE. Dieser Wert ist empirisch gewählt, da keine spezifische CT-Dichte existiert, ab der eine Läsion eindeutig verkalkt ist. Da die CT-Dichte von Weichteilgewebe jedoch im Mittel 50 HE beträgt, kann ab einer Dichte von 130 HE mit ausreichender Sicherheit davon ausgegangen werden, dass eine Läsion Kalzium enthält. Der Wichtungsfaktor berücksichtigt die Menge des vorhandenen Kalziums zur Errechnung des Scores. Als Mindestgröße einer Läsion wird 1 mm2 Fläche gefordert, typischerweise 2 Pixeln entsprechend. Dadurch wird erreicht, dass eine Läsion sicher einer verkalkten Plaque entspricht und vom Bildrauschen differenziert werden kann. Der Gesamt-Score entspricht dann der Summe aller Einzel-Scores der nachgewiesenen Läsionen. Insgesamt besteht zwischen EBT und MSCT eine gute Korrelation. Allerdings ergibt die MSCT jedoch systematisch höhere Werte für Agatston-Score und Anzahl der Läsionen aufgrund des höheren Signalzu-Rausch-Verhältnisses und der geringeren Schichtdicke (Becker et al. 2001). Die Vergleichbarkeit in der Größenordung – wenn auch nicht im exakten Messwert – ist jedoch für den klinischen Einsatz ausreichend. Andere Quantifizierungsmöglichkeiten für die MSCT sind das Volumen (Fläche×Inkrement) und vor allem die Masse in Milligramm. Diese wird berechnet aus Fläche×Inkrement×mittlere Dichte× 1.1 Untersuchungstechnik Abb. 1.1. Koronarkalkmessung. 3 repräsentative transversale Schichten von kranial nach kaudal. LM linker Hauptstamm, LAD R. interventricularis anterior, RCX R. circumflexus, RCA rechte Koronararterie Kalibrierungsfaktor. Vorteil ist die Vergleichbarkeit der Messwerte unterschiedlicher CT-Geräte, weshalb diese Messmethode für Verlaufskontrollen eingesetzt werden sollte. Leider gibt es derzeit noch keine altersund geschlechtsangepassten Vergleichskollektive zur Abschätzung des kardiovaskulären Risikos mittels Kalkmasse analog zum Agatston-Score. Deshalb sollten derzeit beide Parameter der Kalklast angegeben werden. Eine gemeinsame Durchführung von Koronarkalkmessung und CT-Koronarangiographie in einer Untersuchung ist nicht möglich. CT-Koronarangiographie 쐍 EBT. Bei der CT-Koronarangiographie wird das gesamte Herz mit 30–40 überlappenden Schichten mit einer Schichtdicke von 3 mm und einem Tischvorschub von 2 mm bei 130 kV und 630 mA im Einzelschichtmodus abgebildet. Die Aufnahmen werden prospektiv EKG-getriggert. Die Datenakquisition erfolgt in der Diastole mit einem Abstand von 80% des RR-Intervalls zur vorangehenden R-Zacke. Die Expositionszeit beträgt 100 ms. Nach Bestimmung der Kontrastmitteltransitzeit mit einem Testbolus von 10 ml werden 120–160 ml Kontrastmittel mit einer Flussgeschwindigkeit von 3–4 ml/s injiziert. Abhängig von der Herzfrequenz des Patienten beträgt die Messdauer etwa 30–50 s, wobei die Akquisition von einem Bild pro Herzschlag bis zu einer Frequenz von 120/min möglich ist. Der Bildausschnitt der rekonstruierten Bilder beträgt 15 cm, die Matrix 512×512. Daraus resultiert eine Pixelgröße von 0,29×0,29 mm2. Die Strahlenexposition beträgt etwa 10 mSv (Achenbach et al. 1998). 쐍 MSCT. In der CT-Koronarangiographie in Multischichttechnik wird das gesamte Herz nach i. v. Kontrastmittelgabe in transversaler Schichtführung mit der geringsten Schichtkollimation untersucht (Tabel- le 1.3). Die Datenakquisition erfolgt unter kontinuierlicher EKG-Registrierung mit retrospektivem Gating. Die Untersuchung beginnt an der Aortenwurzel in Höhe der Trachealbifurkation und endet unterhalb des Herzens, die Scan-Richtung ist also kraniokaudal.Wurde zuvor eine Koronarkalkmessung durchgeführt, kann sich das Akquisitionsvolumen an der am weitesten kranialen bzw. kaudalen Abbildung der Koronararterien mit einem Sicherheitsabstand von etwa 1 cm orientieren. Die Atemanhaltezeit beträgt etwa 30–40 s für den 4-Zeiler, etwa 20 s für den 16-Zeiler und zwischen 5–10 s für 40- und 64-Zeiler. Das Kontrastmittel wird mit einer automatischen Pumpe injiziert, die Injektionsgeschwindigkeit beträgt mindestens 3 ml/s, besser aber 5 ml/s. Die Startverzögerung nach Beginn der Kontrastmittelinjektion kann entweder mittels Testbolus oder Bolustriggerung bestimmt werden. Bei der Testbolusmethode werden zunächst 10–20 ml mit der gleichen Injektionsgeschwindigkeit wie zur eigentlichen CT-Koronarangiographie injiziert mit Messung in der Aorta ascendens alle 2 s über 30 s. Die Startverzögerung ergibt sich aus der Zeitverzögerung der Spitze des Testbolus (höchste Dichte) plus einer zusätzlichen Startverzögerung von meist 5 s. Bei der Bolustriggerung wird während der Injektion der gesamten Kontrastmittelmenge die Dichte in der Aorta ascendens kontinuierlich gemessen. Die CT-Koronarangiographie wird dann mit einer zusätzlichen Startverzögerung von ebenfalls meist 5 s nach Erreichen der Triggerschwelle (100–200 HE) gestartet. Die Kontrastmittelmenge orientiert sich an der Scan-Dauer einschließlich zusätzlichen Startverzögerung nach Triggerung/Spitze des Testbolus und der Injektionsgeschwindigkeit: Kontrastmittelmenge (ml) = [Scan-Dauer (s) + StartverzögerungTrigger/Testbolus (s)]× Injektionsgeschwindigkeit (ml/s). 9 10 Kapitel 1 Herz Tabelle 1.3. Durchführung CT-Koronarangiographie Gerätetechnik 4-Zeiler 16-Zeiler 64-Zeiler Dual-source-64-Zeiler Kollimation 4×1 mm 16×0,75 mm (2×) 32×0,6 mm (2×) 32×0,6 mm Tischvorschub 1,5 mm 2,8 mm 3,8 mm 3,8 mm Schichtdicke 1,25 mm 1 mm 0,6 mm 0,6 mm Inkrement 0,6 mm 0,5 mm 0,4 mm 0,4 mm Röhrenspannung 120 kV 120 kV 120 kV 120 kV Röhrenstrom 300–400 mAs 500 mAs 850 mAs 360 mAs/Rotation EKG-Triggerung Retrospektiv + Röhrenstrommodulation Retrospektiv + Röhrenstrommodulation Retrospektiv + Röhrenstrommodulation Retrospektiv + Röhrenstrommodulation Kontrastmittel Ja Ja Ja Ja Testbolus 10–20 ml + 30 ml NaCl 10–20 ml + 30 ml NaCl 10–20 ml + 30 ml NaCl 10–20 ml + 30 ml NaCl KM-Dosis 140 ml + 30 ml NaCl 90 ml + 30 ml NaCl 80–100 ml + 30 ml NaCl 80–100 ml + 30 ml NaCl Delay nach KM Testbolus Testbolus +5 s Testbolus +5 s Testbolus +5 s Flussrate 3–5 ml/s 3–5 ml/s (3–)5 ml/s (3–)5 ml/s Die Kontrastmittelkonzentration sollte mindestens 300 mg Jod/ml betragen. Letztlich ist der Gefäßkontrast jedoch nicht von der Kontrastmittelkonzentration alleine, sondern von der Jodapplikationsrate pro Zeiteinheit (Jodflux) abhängig. Daher bieten sich höhere Jodkonzentrationen von 350–400 mg Jod/ml für die CT-Koronarangiographie an, die bei einer klinische vertretbaren Injektionsgeschwindigkeit von bis zu 5 ml/s zu einem verbesserten Jodflux führen. Hierbei ist jedoch die erhöhte Viskosität zu beachten, weshalb die höher konzentrierten Kontrastmittel auf jeden Fall angewärmt werden sollten. Kontraindikationen und Vorsichtsmaßnahmen für die Kontrastmittelgabe sind identisch zu allen anderen CT-Untersuchungen mit Kontrastmittel und werden daher hier nicht aufgeführt. ! Zu beachten ist jedoch für kardiologische Patienten, dass es durch das applizierte Volumen von bis zu 150 ml bei eingeschränkter linksventrikulärer Pumpfunktion (<30– 40%) aufgrund der Volumenbelastung zu einem akuten Linksherzversagen kommen kann. CAVE Daher sollte bei Verdacht auf bzw. manifester Herzinsuffizienz vor der CT-Koronarangiographie eine kardiologische Abklärung erfolgen mit der Frage, ob die Volumenbelastung für den Patienten tolerabel ist. Bei Zustand nach Bypass-Operation muss das Untersuchungsvolumen entsprechend angepasst werden. Idealerweise sollten vor der Untersuchung Art, Anzahl und Verlauf der Bypass-Gefäße bekannt sein, um die Untersuchung entsprechend planen zu kön- nen. Ist dies jedoch nicht der Fall, muss das Akquisitionsvolumen den Abgang der A. thoracica (mammaria) interna aus der A. subclavia einbeziehen, da dieses Gefäß am häufigsten als arterielles Bypass-Gefäß verwendet wird (s. unten, Abschn. „Klappenöffnungsfläche“). Dies bedeutet, dass die Untersuchung etwa 1 cm oberhalb der linken Lungenspitze beginnen muss. Ist zumindest bekannt, dass nur aortokoronare Bypass-Gefäße implantiert wurden, so kann das Akquisitionsvolumen kranial auf den Oberrand des Arcus aortae begrenzt werden. Kaudal wird wie bei der CT-Koronarangiographie stets der untere Herzrand abgebildet. Die Atemanhaltezeit erhöht sich entsprechend. Das Vorhandensein von Stents hat auf die Untersuchungsdurchführung keinen Einfluss. Von entscheidender Bedeutung für den technischen Erfolg und die Beurteilbarkeit einer CT-Koronarangiographie sind die Herzfrequenz des Patienten, der Zeitpunkt der Datenrekonstruktion und die Ausprägung der Koronarverkalkungen. 쐍 Herzfrequenz. Die relative Länge des Datenakquisitionsfensters im Herzzyklus bestimmt aufgrund der hohen Eigenbewegung der Koronararterien die Bildqualität. Da die Rotationszeit nicht verändert werden kann, sinkt bei höheren Herzfrequenzen und damit geringerer Dauer des Herzzyklus die Bildqualität. Deshalb sollte die Herzfrequenz immer möglichst niedrig liegen, auch wenn die neuesten CT-Geräte mit einer zeitlichen Auflösung <100 ms auch bei Herzfrequenzen >75/min eine ausreichende Bildqualität erzielen. 1.1 Untersuchungstechnik Merke ! Die beste Beurteilbarkeit ist stets bei Herzfrequenzen <65/min gegeben. Dies ist durch Gabe eines Betablockers zu erreichen, der auf 3 Arten appliziert werden kann: 1. orale Gabe von Metoprolol 100 mg (z. B. Lopresor) eine Stunde vor Untersuchungsbeginn, 2. I. v.-Injektion eines kurzfristig wirksamen Betablockers (z. B. Brevibloc) unmittelbar vor Untersuchungsbeginn, 3. I. v.-Injektion von 5–20 mg Metoprolol (z. B. Beloc) fraktioniert unmittelbar vor Untersuchungsbeginn. Wichtig ist die Beachtung der Kontraindikationen arteriovenöser Block und chronisch-obstruktive Lungenerkrankungen. Als zusätzliche Medikamentengabe vor Durchführung der CT-Koronarangiographie hat sich mittlerweile die orale Gabe von Nitroglyzerinspray durchgesetzt. Dies führt zu einer signifikanten Weitstellung der Koronararterien und damit zu einer besseren Beurteilbarkeit (Dewey et al. 2006). Die Applikation sollte nicht unmittelbar, sondern etwa 5 min vor der Aufnahme erfolgen, um eine maximale Wirkung zu erzielen.Als Nebenwirkungen können ein Blutdruckabfall und – vor allem bei jüngeren Patienten – Kopfschmerzen auftreten. a b Abb. 1.2 a, b. Rekonstruktionszeitpunkt CT-Koronarangiographie. a Multiphasenrekonstruktion des R. interventricularis anterior über den gesamten Herzzyklus (RR-Intervall) in 5%Schritten bei einer mittleren Herzfrequenz von 91/min. b Die beste Bildqualität findet sich bei 35% des RR-Intervalls (Volume-Rendering-Technik) 쐍 Zeitpunkt der Datenrekonstruktion. Ein großer Vorteil der CT-Koronarangiographie – z. B. auch im Gegensatz zur MR-Koronarangiographie – ist, dass durch den Einsatz des retrospektiven Gatings die Rohdaten zu verschiedenen Zeitpunkten des Herzzyklus rekonstruiert werden können. Dadurch ist es möglich, für jeden Patienten individuell den Zeitpunkt der besten Abbildung der Koronararterien im Herzzyklus zu bestimmen. Dies geschieht zunächst durch Proberekonstruktionen in 5%-Schritten des RR-Intervalls. Bei langsamen Herzfrequenzen (bis 70/min) liegt der optimale Rekonstruktionszeitpunkt meist in der Diastole bei 60 oder 65%, weshalb hier die Proberekonstruktion zwischen 55 und 75% des RR-Intervalls meist ausreichend ist. Bei schnelleren Herzfrequenzen verlagert sich der Zeitpunkt des optimalen Rekonstruktionsintervalls weiter nach vorne in die Systole. Daher sollte bei Herzfrequenzen >70/min das optimale Rekonstruktionsintervall durch Proberekonstruktionen im Bereich zwischen 25–80% des Herzzyklus und nicht nur in der Diastole gesucht werden (Abb. 1.2 a, b). Wenn sich hierdurch immer noch keine ausreichende Bildqualität erzielen lässt oder wenn der Patient einen unregelmäßigen Herzschlag – z. B. auch bei Vorhofflimmern – hat, bietet sich die Rekonstruktion als absolute Ver- zögerung in Millisekunden nach der vorausgegangenen R-Zacke an. In 50 ms-Schritten ist oftmals in der Systole ein für den Patienten optimales und insgesamt auch beurteilbares Rekonstruktionsintervall zu finden. 쐍 Ausmaß der Koronarverkalkungen. Die CT-Koronarangiographie kann im selben Untersuchungsgang, jedoch bei getrennten Aufnahmen, mit der Koronarkalkmessung kombiniert werden. Dies führt bei Durchführung beider Untersuchungen unmittelbar nacheinander insgesamt zu einer höheren Strahlenexposition. Dieser Nachteil wird jedoch z. T. durch die exaktere Anpassung des Untersuchungsvolumens der CT-Koronarangiographie an die tatsächliche Position der Koronararterien wieder ausgeglichen. Darüber hinaus wird diskutiert, ob ab einem bestimmten Grenzwert für den Agatston-Score die Durchführung einer CT-Koronargangiographie noch sinnvoll ist, da aufgrund der Kalkplaques eine valide Stenosendetektion erschwert ist. Zudem steigt mit dem Ausmaß der Verkalkungen auch die Anzahl der falsch-positiven Befunde. Allerdings ist weniger die Kalkgesamtmasse als vielmehr die Kalkplaquemorphologie entscheidend 11 12 Kapitel 1 Herz für die Beurteilbarkeit.Während diffuse wandständige Verkalkungen oder auch umschriebene wandständige Kalkplaques mit modernen CT-Geräten eindeutig als wandständig und nicht signifikant stenosierend erkannt werden können, sind zirkuläre Verkalkungen weiterhin nicht beurteilbar. Dies lässt sich jedoch aus der Koronarkalkmessung nicht unterscheiden. Somit erscheint die zusätzliche Durchführung der Koronarkalkmessung nur zur Indikationsstellung für die CT-Koronarangiographie nicht sinnvoll, zur Abschätzung des kardiovaskulären Risikos kann sie jedoch gut eingesetzt werden. 쐍 Stenosendiagnostik. Die Diagnosestellung erfolgt auf den transversalen Schichten und zweidimensionalen Rekonstruktionen. Hier haben sich vor allem dünne Maximum-Intensity-Projektionen (MIP) mit einer Schichtdicke von 3–5 mm bei einem Schichtabstand von 1,5–2,5 mm bewährt. Zusätzlich sind noch zum Gefäßverlauf orthogonale Projektionen möglich, die eine Planimetrie der Stenose und des normalen Gefäßdurchmessers ermöglichen. Eine Stenose muss immer in 2 Ebenen dargestellt werden. Ob die Angabe eines Stenosegrads in Prozent tatsächlich derzeit schon valide ist, kann noch nicht eindeutig gesagt werden – auf jeden Fall sollte eine Unterscheidung von gering-, mäßig-, und hochgradigen Stenosen sowie Okklusionen erfolgen. Abb. 1.3. CT-Koronarangiographie. LAO-Projektion (RIVA R. interventricularis anterior) Rekonstruktionen Für Rekonstruktionen aus CT-Datensätzen ist eine 20–50% überlappende Rekonstruktion der Rohdaten notwendig, d. h. das Inkrement beträgt 50–80% der Schichtdicke. Dies führt vor allem zu einer Vermeidung von Stufenartefakten am Bildrand. Mittlerweile sind MIP- und multiplanare Rekonstruktionen (MPR) auch direkt aus den Rohdaten möglich, ohne dass zunächst die überlappende Rekonstruktion der transversalen Schichten erfolgen muss.Alle beschriebenen Rekonstruktionsverfahren sind analog natürlich auch mit der MRT einsetzbar. a 쐍 Projektionen. Analog zur Herzkatheteruntersu- b chung werden in der MIP- und der MPR-Darstellung zunächst Standardprojektionen angefertigt. Dies sind die LAO- („left antorior oblique-“)Projektion zur Darstellung von rechter Koronararterie (RCA) und R. circumflexus (RCX), die RAO- („right anterior oblique-“)Projektion zur Darstellung des R. interventricularis anterior (RIVA) und die Projektion entlang der langen Herzachse zur Aufsicht auf linken Hauptstamm, R. interventricularis anterior und R. circumflexus sowie der distalen rechten Koronararterie. Zur Erstellung der LAO-Projektion wird zunächst in einer transversalen Ebene der Abgang der rechten Abb. 1.4 a, b. CT-Koronarangiographie: RAO-Projektion. a Rechte Koronararterie (RCA). b Linker Hauptstamm (LM) und R. circumflexus (RCX) 1.1 Untersuchungstechnik einer Videosequenz aus mehreren Projektionen vermittelt dann einen räumlichen Eindruck.Vorteile des Verfahrens sind die Unabhängigkeit von Schwellenwerten und das hohe Signal-zu-Rausch-Verhältnis. Nachteilig ist, dass umliegende Strukturen hoher Signalintensität wie z. B. die Thoraxwand manuell segmentiert werden müssen, um Überlagerungen zu vermeiden. 쐍 VRT. Die Volume-Rendering-Technik (VRT) ergibt Abb. 1.5. CT-Koronarangiographie. Lange Herzachse R. interventricularis anterior (RIVA) und R. circumflexus (RCX) Koronararterie aufgesucht. Die Kippung der Schichtebene erfolgt dann von rechts ventral nach links dorsal mit möglichst langstreckiger Darstellung des RCA-Verlaufs. In dieser Darstellung kommen auch der linke Hauptstamm und die R. circumflexus gut zur Darstellung (Abb. 1.3). Für die RAO-Projektion wird in einer transversalen Ebene der Verlauf des R. interventricularis anterior aufgesucht, anhand dessen erfolgt die Kippung der Schichtebene von rechts ventral nach links dorsal (Abb. 1.4 a, b). Die Projektion in der langen Herzachse wird orthogonal zur RAO-Projektion entlang des Verlaufs des R. interventricularis anterior geplant (Abb. 1.5). So kommen linker Hauptstamm, R. interventricularis anterior und Diagonaläste sowie die distale rechte Koronararterie einschließlich Crux cordis und Aufteilung in R. posterolateralis sinster und R. interventricularis posterior zur Darstellung. Bei nicht ausreichender Darstellung aller Koronararteriensegmente werden zusätzliche, individuell anhand des Verlaufs des betreffenden Koronararteriensegments geplante Ebenen erstellt. 쐍 MIP. Bei der MIP werden in einem virtuellen Strahlengang aus jeder Schicht nur die Voxel mit der höchsten Signalintensität als Pixel auf einer Ebene (2D) abgebildet. Primär besteht kein räumlicher Effekt in der Betrachtungsebene. Das Projektionsradiogramm wird jedoch in verschiedenen Ebenen bzw. Betrachtungswinkeln berechnet. Die Kombination zu ein dreidimensionales Bild (Abb. 1.6 a, b). Im Gegensatz zur MIP-Technik ist auch die Darstellung von überlagernden Gefäßen möglich, da die einzelnen Objekte mit unterschiedlicher Opazität, d. h. Transparenz dargestellt werden. Den darzustellenden Gefäß-, Weichteil- und Knochenstrukturen werden die für die Rekonstruktion zu verwendenden CT-Intensitätswerte und Opazitätswerte zugeordnet, aus denen ein frei rotierbares Projektionsbild errechnet wird. Eine Variante ist die Surface-Rendering-Technik, die die alleinige Darstellung eines Gefäßsystems ermöglicht. Hierfür werden z. B. die Koronararterien auf jeder Einzelschicht manuell segmentiert. 쐍 SSD. Die Oberflächendarstellung („shaded-surface-display“, SSD) ist ebenfalls eine Variante der VRT. Hier wird ein einziges Intervall festgelegt mit maximaler Opazität, sodass nur eine dreidimensionale Oberflächenrekonstruktion ohne Durchscheineffekt erzeugt wird. 쐍 MPR. Bei der MPR entsteht ein zweidimensionales Bild durch die Festlegung einer Schnittebene durch den gesamten Schichtstapel. Die Schnittebene kann entweder eine Gerade sein oder eine gekrümmte Linie. Vor allem letzteres Rekonstruktionsverfahren ist deutlich untersucherabhängig. Der Zeitaufwand ist jedoch relativ gering. 쐍 Virtuelle Koronaroskopie. Bei der virtuellen Koronaroskopie werden Bilder erzeugt, die den Blickwinkel endoskopischer Verfahren simulieren. Hierdurch wird mit Hilfe einer Zentralprojektion nach Vorgabe eines Schwellenwerts ein „Flug“ durch das Koronararterienlumen mit der Möglichkeit zur Betrachtung der Wandstrukturen erzeugt. Hierbei handelt es sich um ein aufwändiges Nachverarbeitungsverfahren, dessen diagnostischer Stellenwert eher gering erscheint. 13 14 Kapitel 1 Herz Abb. 1.6 a, b. CT-Koronarangiographie: Volume-Rendering-Technik (VRT) mit korrespondierender gekurvter multiplanarer Rekonstruktion (MPR). (RCA rechte Koronararterie, RIVA R. interventricularis anterior, RCX R. circumflexus) a b 1.1 Untersuchungstechnik 1.1.3 Magnetresonanztomographie 1.1.3.1 Technische Voraussetzungen Technische Weiterentwicklungen der letzten Jahre führten zu einer Generation von Magnetresonanztomographen, die sich durch einen hohen Patientenkomfort, vor allem in Bezug auf die Länge der Magnetfeldröhre, und eine sehr gute Bedienerfreundlichkeit auszeichnen. Für kardiovaskuläre Anwendungen wurden spezielle Empfangsspulen und Messtechniken mit dazugehöriger Auswertesoftware entwickelt. Der Magnetresonanztomograph besteht aus einem Magneten mit Shim-System, einem Magnetfeldgradientensystem, einem Hochfrequenzsystem inklusive Sende- und Empfangsspulen, der Patientenlagerungseinheit und einem Steuer- und Bildrechner mit der dazugehörigen Software. Die einzelnen Komponenten müssen den klinischen Anforderung an die Bildqualität zur Darstellung des kardiovaskulären Systems gerecht werden. Diese wird primär durch das Signal-zu-Rausch-Verhältnis und die zeitliche und räumliche Auflösung beschrieben. ! Eine Magnetfeldstärke von mindestens 1,0 Tesla (T) ist aufgrund des benötigten Signal-zu-Rausch-Verhältnisses zwingend erforderlich. Merke Spezielle kardiovaskuläre Untersuchungen wie die Perfusionsmessung und die Koronarangiographie benötigen eine Magnetfeldstärke von 1,5 T. Die Verwendung einer Magnetfeldstärke von 3,0 T bietet vor allem den Vorteil eines deutlich höheren Signal-zuRausch-Verhältnisses als bei 1,5 T, aber auch deutliche Nachteile, wie z. B. eine stark erhöhte spezifische Absorptionsrate, ausgeprägtere Suszeptibilitätsartefakte oder die Beeinflussung der Form des PatientenEKGs. Die kardiovaskulären Anwendungen profitieren vor allem vom Signalgewinn, der u. a. in eine Reduktion der Untersuchungsdauer umgesetzt werden kann. Das Shim-System des Magneten muss in der Lage sein, in einer kurzen Zeitspanne von etwa 1 min die Magnetfeldhomogenität im Untersuchungsvolumen selbstständig zu optimieren. Die Leistungsmerkmale des Gradientensystems ergeben sich aus den geforderten Messbedingungen (Signal-zuRausch-Verhältnis, zeitliche und räumliche Auflösung, Akquisitionszeit) der klinischen Fragestellungen. Die Verwendung eines zielvolumenadaptierten Oberflächenspulensystems, bestehend aus mehreren Elementen auf der Vorder- und Hinterwand des Tho- rax, ist aufgrund des besseren Signal-zu-Rausch-Verhältnisses obligatorisch. Das Hochfrequenzsystem sollte über mehrere getrennt arbeitende Hochfrequenzkanäle verfügen, damit im Zusammenhang mit dem Oberflächenspulensystem die Verfahren der parallelen Bildgebung angewendet werden können. Die EKG-Triggerung des Magnetresonanztomographen muss weitgehend unabhängig von Störungen durch das Hauptmagnetfeld und das Schalten der Magnetfeldgradienten sein. Die Software für die verschiedenen kardiovaskulären Messtechniken wird ebenso benötigt, wie eine Auswertesoftware für die quantitative Bestimmung der Herzfunktionsparameter, der Perfusions- und der Flussmessungen. Für die Durchführung und Reproduzierbarkeit der kontrastmittelverstärkten Magnetresonanzangiographie (MRA) und der Perfusionsuntersuchung ist ein magnetresonanzkompatibler Kontrastmittelinjektor obligatorisch. Während der Untersuchung sollte eine Überwachung des Patienten sowohl optisch als auch über das EKG erfolgen. Zusätzliche Überwachungsmaßnahmen sind bei Untersuchungen unter pharmakologischem Stress indiziert. Akquisitionsparameter und Akronyme In der MRT wird eine große Anzahl von unterschiedlichen Akquisitionstechniken für verschiedene medizinische Fragestellungen eingesetzt. Die für die MRTUntersuchung des Herzens relevanten Akquisitionstechniken mit den wichtigsten Messparametern wie Wichtung, zeitliche und räumliche Auflösung werden im weiteren Verlauf des Kapitels vorgestellt. Die sehr stark geräte- und herstellerspezifischen Parameter wie Repetitionszeit, Echozeit, Flip-Winkel oder Abstand der Echos werden nicht aufgeführt. Grundlegende Kenntnisse der MRT-Messparameter und deren Zusammenhänge hinsichtlich des räumlichen und zeitlichen Auflösungsvermögens, der Akquisitionszeit und des Signal-zu-Rausch-Verhältnisses werden dabei vorausgesetzt. MRT-Akquisitionstechniken werden üblicherweise durch Akronyme beschrieben, wobei je nach Hersteller unterschiedliche Akronyme für gleiche oder ähnliche MRT-Techniken verwendet werden. In Tabelle 1.4 wird ein Überblick über die am weitesten verbreiteten Akronyme und MRT-Techniken gegeben, da diese ebenfalls im weiteren Verlauf benutzt werden sollen. Die Tabelle erhebt keinen Anspruch auf Vollständigkeit sondern soll nur eine Orientierungshilfe darstellen. Herz- und Atembewegung: Triggerverfahren 쐍 EKG-Triggerung. Üblicherweise erfolgen MRT-Aufnahmen des Herzens mit EKG-Triggerung, um Bildartefakte durch die Bewegung des Herzens zu minimieren oder um Bilder zu bestimmten Zeiten des 15 16 Kapitel 1 Herz Tabelle 1.4. Akronyme der Hersteller GE, Philips und Siemens Akronym Voller Name Beschreibung Hersteller SE TSE Spin-Echo Basis SE-Sequenz GE, Philips, Siemens Turbo Spin-Echo SE-Sequenz mit mehreren, unterschiedlich phasenkodierten 180°-HF-Pulsen Siemens, Philips FSE Fast Spin-Echo SE-Sequenz mit mehreren, unterschiedlich phasenkodierten 180°-HF-Pulsen GE HASTE „Half Fourier single shot Turbo Spin-Echo“ Kombination aus RARE und Half Fourier Siemens GRE, GE Gradientenecho Basis GRE-Sequenz GE, Siemens FFE „Fast field echo“ Basis GRE-Sequenz Philips FLASH „Fast low angle shot“ GRE mit Magnetisierungsspoiler Siemens T1-FFE „Contrast enhanced fast field echo“ FFE mit Magnetisierungsspoiler Philips SPGR „Spoiled grass“ GRE mit Magnetisierungsspoiler GE FISP „Fast imaging with steady state precession“ GRE mit teilweiser Rephasierung der Gradienten Siemens GRASS „Gradient recalled acquisition in steady state“ GRE mit teilweiser Rephasierung der Gradienten GE T2-FFE „Contrast enhanced fast field echo“ FFE mit teilweiser Rephasierung der Gradienten Philips SSFP „Steady state free precession“ GRE mit teilweiser Rephasierung der Gradienten GE PSIF „Reverse FISP“ GRE mit teilweiser Rephasierung der Gradienten Siemens TrueFISP „FISP with heavy T2 weighting“ GRE mit Rephasierung der Gradienten in allen 3 Richtungen Siemens FIESTA „Fast imaging employing steady state acquisition“ GRE mit Rephasierung der Gradienten in allen 3 Richtungen GE BFFE „Balanced FFE“ GRE mit Rephasierung der Gradienten in allen 3 Richtungen Philips Turbo FLASH „Turbo FLASH“ Sehr schnelle magnetisierungspräparierte FLASH-Sequenz Siemens TFE „Turbo field-echo“ Sehr schnelle magnetisierungspräparierte FFE-Sequenz Philips FSPGR „Fast SPGR“ Sehr schnelle magnetisierungspräparierte SPGR-Sequenz GE EPI „Echo planar imaging“ GRE-Sequenz mit mehreren, unterschiedlich phasenkodierten Gradientenechos Philips, Siemens, GE PSIR „Phase sensitive inversion recovery“ Spezielle Bildaufnahme und Bildrekonstruktion für die Spätaufnahmetechnik Philips, Siemens, GE Herzzyklus aufzuzeichnen. Die meisten Sequenztechniken benötigen hierzu eine Datenaufnahme in mehreren Herzzyklen. Durch die EKG-Triggerung wird sichergestellt, dass alle Messdaten zur gleichen Zeit im Herzzyklus aufgezeichnet werden, wodurch Artefakte durch die Herzbewegung weitgehend vermieden werden können. Spezielle, nicht-ferromagnetische EKG-Elektroden erlauben die Ableitung eines EKG-Signals vom Patienten in einem Magnetfeld zur Triggerung einer MRT-Aufnahme. Das vom Patienten abgeleitete EKG- Signal wird durch das Hauptmagnetfeld gestört (magnetohydrodynamischer Effekt), d. h. die physiologische Form kann verändert werden. Weitere Störungen des EKGs können durch das Schalten der Magnetfeldgradienten während einer Messung erfolgen, wodurch die Triggerung aber nicht beeinflusst werden sollte. Die Triggerung funktioniert im Allgemeinen trotz der Störungen zuverlässig, solange der Magnetresonanztomograph im EKG-Signal einen wiederkehrenden Peak registriert, der in Korrelation zur R-Zacke steht. 1.1 Untersuchungstechnik a b Abb. 1.7 a, b. EKG-Triggerung. Bei der prospektiven Triggerung (a) erfolgt nach der R-Zacke der Beginn der Datenaufnahme, die in der Abbildung durch die grauen Rechtecke dargestellt werden soll. Ein Rechteck soll z. B. im Fall einer GRESequenz die Aufnahme einer k-Raum-Linie symbolisieren, d. h. es werden 9 k-Raum-Linien einer Schicht pro RR-Intervall aufgezeichnet. Bedingt durch normale Schwankungen des Herzzyklus können nur etwa 90% der mittleren RR-Zeit für die Datenaufnahme verwendet werden. Dadurch ist gewähr- leistet, dass in jedem Herzzyklus eine Datenaufnahme erfolgt und keiner übersprungen wird. Aufnahmen in der späten Diastole werden dadurch im Gegensatz zur retrospektiven Triggerung (b) nicht möglich. Bei der retrospektiven Triggerung erfolgt die Aufnahme von k-Raum-Linien kontinuierlich (EKGunabhängig) bei einer gleichzeitigen EKG-Registrierung. Nach der Messung erfolgt vor der Bildrekonstruktion eine Korrelation der k-Raum-Linien mit ihrem Aufnahmezeitpunkt im Herzzyklus 왔 EKG-Triggerung bedeutet, dass die Zeitpunkten des Herzschlags zugeordnet, wodurch eine Rekonstruktion von Bildern für verschiedene Herzphasen möglich ist (vgl. Abb. 1.7 b). Ein Vorteil der retrospektiven gegenüber der prospektiven Methode besteht in der Möglichkeit, Aufnahmen in der späten diastolischen Phase zu erhalten. Dies wird durch die kontinuierliche, EKG-unabhängige Rohdatenaufnahme ermöglicht, während im Vergleich dazu bei der prospektiven Triggerung nur etwa während der ersten 90% des Herzzyklus eine Datenaufnahme erfolgt und dann der Tomograph auf die nächste R-Zacke wartet. Es entsteht folglich eine Totzeit von etwa 10% in der späten Diastole. Die ultraschnelle Bildgebung des Herzens kann auch ohne EKG-Triggerung eingesetzt werden, da durch die hohe Datenaufnahmegeschwindigkeit die Bewegung des Herzens gewissermaßen „eingefroren“ wird. Die räumliche Auflösung bei diesen Techniken ist im Vergleich zu EKG-getriggerten Techniken deutlich verringert. Definition Datenaufnahme mit dem EKG des Patienten synchronisiert wird. Grundsätzlich stehen dafür 2 Methoden zur Verfügung: die prospektive und die retrospektive EKG-Triggerung (Abb. 1.7 a, b). Die prinzipielle Funktionsweise der prospektiven Triggerung, d. h. der Triggerung der Datenaufnahme auf die R-Zacke des EKGs, kann in 3 Schritten zusammengefasst werden (vgl. Abb. 1.7 a): 1. der Tomograph wartet auf eine R-Zacke, 2. nach der R-Zacke und einer evtl. eingestellten Wartezeit (Trigger-Delay) erfolgt die Datenakquisition und 3. nach Ende der Messung wartet der Tomograph auf die nächste R-Zacke für eine weitere Datenakquisition. Diese Methode kann bei allen Sequenztechniken eingesetzt werden. Im Fall der retrospektiven Triggerung erfolgt eine kontinuierliche Aufnahme von Rohdaten ohne EKG-Triggerung bei gleichzeitiger unabhängiger Registrierung des EKGs. Nach der Datenaufnahme werden die Rohdaten den verschiedenen 쐍 Kompensation der Atmung. Bildartefakte durch die Atmung müssen bei der Herzbildgebung weitgehend minimiert oder gänzlich beseitigt werden, da sie die diagnostische Aussagekraft stark beeinträchtigen 17 18 Kapitel 1 Herz können. Ein großer Teil der Artefakte entsteht durch das helle Fettsignal der vorderen (anterioren) Thoraxwand. Dieses Artefakt wird durch die Verwendung der obligatorischen Oberflächenspulen noch verstärkt. Für die Reduktion der Atemartefakte stehen grundsätzlich 3 Methoden zur Verfügung: ∑ die Datenaufnahme in Atemanhaltetechnik, ∑ die Triggerung auf die Atembewegung oder ∑ eine Datenaufnahme mit einer entsprechende Anzahl von Signalmittelungen. Die Atemanhaltetechnik liefert bei einem kooperativen Patienten sehr gute Resultate. Sie ist mit nahezu allen Bildgebungsmethoden kombinierbar, da die Messzeiten aller Methoden in der Größenordnung von etwa 15–25 s liegen. Für die Atemtriggerung ist eine Detektion der Atembewegung erforderlich, wie sie z. B. mit einem Atemgürtel erfolgen kann. Eine modernere Methode ist die so genannte Navigatortechnik, die mit Hilfe von meist eindimensionalen MRT-Bildern die Bewegung des Herzens direkt oder über die Diaphragmabewegung aufzeichnet. Mit dieser Technik kann z. B. eine Atemtriggerung der EKGgetriggerten Aufnahme in der bewegungsarmen endexspiratorischen Atmungsphase erfolgen. Ein wesentlicher Nachteil dieses Verfahrens ist die erhebliche Verlängerung der Messzeit. Die Methode der Signalmittelungen scheidet bei den meisten Anwendungen durch die sehr lange Untersuchungszeit bei einer nur mäßigen Bildqualität aus. 1.1.3.2 Sequenzbeschreibung Morphologie Für die kardiovaskuläre MRT-Bildgebung steht eine fast unendliche große Anzahl von Sequenztechniken zur Verfügung, die sich primär durch einen unterschiedlichen Bildkontrast, die Länge der Bildaufnahmezeit und die räumliche und zeitliche Auflösung unterscheiden. Alle Sequenztechniken lassen sich aber grundsätzlich auf 2 Basissequenzen, die SpinEcho- (SE-)Sequenz und die Gradientenecho- (GRE-) Sequenz zurückführen. In diesem Abschnitt sollen die Funktionsweisen dieser Basissequenzen beschrieben und ihr grundsätzlich unterschiedlicher Bildkontrast bei der kardiovaskulären Bildgebung insbesondere in der morphologischen Darstellung erläutert werden. Variationen und Kombinationen dieser Sequenzen werden im weiteren Verlauf unter dem Aspekt einer speziellen Anwendung im kardiovaskulären Bereich (z. B. der Perfusionsuntersuchung) vorgestellt. Einige wichtige Messparameter, die bei der morphologischen Untersuchung zu beachten sind, sind in Tabelle 1.5 aufgeführt. Tabelle 1.5. Messparameter Morphologie Sequenzen SE, TSE, TIRM, HASTE, FSE, RARE, ... Wichtung T1, T2, IR Pixelgröße ≤1,5 mm×2,1 mm Matrix ≥256×180 FoV ≤380 mm Schichtdicke 5–8 mm 쐍 Spin-Echo. Die SE-Pulssequenz ist die am häufigsten benutzte Pulssequenz in der MRT (Stark u. Bradley 1992). Die Ursache dafür ist sicherlich zum einen der einfache Zusammenhang zwischen den Messparametern (TR, TE) und dem entstehenden Bildkontrast und zum anderen die Verfügbarkeit auf allen Magnetresonanztomographen. Die SE-Sequenz besteht aus 2 Hochfrequenzpulsen, einem 90°-Puls gefolgt von einem 180°-Puls im zeitlichen Abstand der halben Echozeit (TE). Auf den 180°-Puls folgt nach nochmaligem Ablauf der gleichen Zeitspanne (TE/2) ein MRT-Signal in der Empfangsspule, das Echosignal. Dieses Echosignal hat den Vorteil, nicht mehr von externen Magnetfeldinhomogenitäten abzuhängen. Die Sequenz, bestehend aus 90°-Puls, 180°-Puls und Echosignal wird mit der Reptitionszeit TR für unterschiedliche Phasenkodiergradienten wiederholt, um die für die Bildrekonstruktion benötigten Rohdaten zu akquirieren. Bei der SE-Sequenz kann sehr einfach durch die Wahl der Messparameter Repetitionszeit (TR) und Echozeit (TE) eine T1-, T2- oder Protonendichte(PD-)gewichtete Aufnahme erzeugt werden: ∑ TR kurz (200–800 ms), TE kurz (<20 ms) ergibt ein T1-Bild, ∑ TR lang (2000–6000 ms), TE kurz (<20 ms) ein PD-Bild und ∑ TR lang (2000–6000 ms) und TE lang (>80 ms) eine T2-gewichtete Aufnahme. Die Parameterkombination TR kurz (200–800 ms), TE lang (>20 ms) liefert einen Mischkontrast aus T1, T2- und PD-Wichtung, der in der Diagnostik nicht verwendet wird. MRT-Aufnahmen des Herzens erfolgen in der Regel mit EKG-Triggerung. Die EKG-Triggerung erfolgt auf die R-Zacke, wodurch ein neuer SE-Pulszyklus (90-180-Echosignal) ausgelöst wird (Abb. 1.8). Demzufolge wird die Repetitionszeit durch die Herzfrequenz bestimmt, woraus die Abhängigkeit des Bildkontrasts und der Gesamtmesszeit von der Herzfrequenz resultiert (vgl. Abb. 1.8). Zur Erzeugung einer T1-gewichteten SE-Aufnahme erfolgt die Triggerung auf jede R-Zacke des Herzzyklus, wodurch sich eine Repetitionszeit von etwa 600–1000 ms ergibt. Um die 1.1 Untersuchungstechnik aus der Schicht geflossen sind, so liefern sie einen Signalbeitrag, der bei einer Messung mit 2 aufeinanderfolgenden Echos (Doppelecho) unterschiedlich sein kann: Beim ersten (ungeraden) Echo tritt eine Dephasierung, also Signalabschwächung der bewegten Spins auf, wogegen beim zweiten (geraden) Echo eine Rephasierung („even echo rephasing“) mit einem stärkeren Signal entsteht (Waluch u. Bradley 1984). Abb. 1.8. SE-Schema mit EKG. Schematischer Ablauf der EKGgetriggerten SE-Sequenz: Direkt nach der R-Zacke erfolgt das Schalten eines Blutunterdrückungspulses („dark blood“, db). Nach Ablauf einer einstellbaren Wartezeit (TD) wird der 90°Hochfrequenzpuls und nach der einstellbaren Echozeit TE/2 der 180°-Hochfrequenzpuls gesendet. Das Echosignal wird nach der Echozeit TE aufgenommen. Die EKG-getriggerte TSESequenz unterscheidet sich von der EKG-gertiggerten SE-Sequenz nur dadurch, dass in einem Herzzyklus statt einem Echosignal mehrere Echosignale mit unterschiedlichen Phasenkodierungen erzeugt und gemessen werden. Der Unterschied zwischen nicht-EKG-getriggerter und EKG-getriggerter SE- oder TSE- Sequenz liegt darin, dass der Bildkontrast durch die so genannte effektive Repetitionszeit TReff bestimmt wird. Diese entspricht dem RR-Intervall, wodurch der Bildkontrast vom Herzschlag des Patienten abhängig ist für eine T2-gewichtete Aufnahme benötigte längere Repetitionszeit zu erhalten, erfolgt die Triggerung auf jede zweite R-Zacke. Die Wahl einer langen Echozeit (60–90 ms) ergibt durch den T2-Zerfall im Vergleich zu einer kurzen Echozeit (<20 ms) ein deutlich schlechteres Signal- zu Rausch-Verhältnis und eine deutliche T2-Wichtung. Für Myokard liegen die T1Relaxationszeiten etwa zwischen 550 und 600 ms, die T2-Relaxationszeiten betragen etwa 30–45 ms. Aus den in etwa gleichen Werten der T1-Relaxationszeiten und den verwendeten Repetitionszeiten und den T2-Relaxationszeiten mit den Echozeiten resultiert der sehr gute Weichteilkontrast im Herzen (Stark u. Bradley 1992). Signalverluste durch Flussphänomene sind eine charakteristische Eigenschaft der SE-Sequenz. Ist die Flussgeschwindigkeit von Blut so hoch, dass die mit dem 90°-Puls angeregten Blut-Spins in der Zeit bis zum 180°-Puls aus der Schicht geflossen sind, so entsteht ein Signalverlust bis hin zur vollständigen Auslöschung des Blutsignals (Auswascheffekt, „dark blood“ oder „flow void“). Dies führt zu einem sehr guten Kontrast zwischen Lumen und Herzwand. Der Auswascheffekt ist umso größer, je dünner die Schicht ist, je länger die Echozeit ist und je schneller das Blut fließt. Ist die Geschwindigkeit des Blutes derart gering, dass die Spins beim 180°-Puls noch nicht ! Die SE-Technik wird im Gegensatz zur GRE-Technik durch die geringere Empfindlichkeit für Bildartefakte durch Magnetfeldinhomogenitäten bei Patienten mit Metall im Bereich des Herzens (z. B. durch künstliche Herzklappen mit Metallanteilen oder operationsbedingten Metallklammern) vorrangig eingesetzt. Merke Für die morphologische Bildgebung des Herzens mit SE-Sequenzen finden 2 Magnetisierungspräparationen Verwendung: ∑ Die „Dark-blood-Technik“ stellt Blut dunkel dar und dient zur flussartefaktfreien Abgrenzung von Herzwand und Lumen (Abb. 1.9 a–c). Sie wird insbesondere bei T1- und T2-gewichteten Aufnahmen in Atemanhaltetechnik eingesetzt. Das Prinzip (Abb. 1.9 a–c) der Dark-blood-Technik beruht auf einem nicht-schichtselektiven 180°-Inversionspuls, gefolgt von einem schichtselektiven 180°Inversionspuls, der die Magnetisierung in der zu untersuchenden Schicht wieder in den Ausgangszustand zurückführt, während sie außerhalb invertiert bleibt. Die eigentliche Aufnahme der Schicht erfolgt nach einer Wartezeit, die derart eingestellt wird, dass das Blut in der Schicht durch invertiertes und gesättigtes Blut von außerhalb ersetzt worden ist (Haacke et al. 1995). ∑ Die zweite Magnetisierungspräparation ist die „Inversion-recovery- (IR-)Technik“. Bei diesem Verfahren wird die Magnetisierung durch einen 180°-Inversionspuls invertiert. Die Aufnahme der Schicht erfolgt nach einer Wartezeit (Inversionszeit TI), wobei durch deren Wahl das Signal unterdrückt wird, dessen Magnetisierung gerade zu diesem Zeitpunkt den Wert Null besitzt. So kann durch Variation der Inversionszeit TI eine Unterdrückung unterschiedlicher Gewebe erreicht werden. Die IR-Technik kann auch in Kombination mit der Dark-blood-Technik eingesetzt werden, um z. B. neben Blut auch Fett zu unterdrücken. Definition 왔 Die Turbo-Spin-Echo- (TSE-)Technik oder Fast-Spin-Echo- (FSE-)Technik ist eine schnelle Variante der SE-Technik bei einem annähernd identischen Gewebekontrast. 19 20 Kapitel 1 Herz a b c Abb. 1.9 a–c. Prinzip Dark-blood. a Bei der Dark-blood-Magnetisierungspräparation erfolgt als erstes eine Invertierung der Magnetisierung des gesamten Untersuchungsvolumens durch einen nicht-schichtselektiven 180°-HF-Puls. b Die Magnetisierung der Untersuchungsschicht wird direkt danach durch einen zweiten, diesmal schichtselektiven 180°-HF-Puls zurückinvertiert. c Wartet man nun solange, bis invertiertes Blut in die Untersuchungsschicht eingeflossen ist und dessen Magnetisierung durch Null geht, so kann ein Bild gemessen werden, in dem Blut kein Signal liefert Die TSE-Technik beruht auf einer Multi-Echo-SE-Sequenz, bei der nach einem 90°-Puls mehrfach ein 180°-Puls geschaltet wird, um einen Zug aus Echos zu erhalten. Der Phasenkodiergradient wird von Echo zu Echo variiert, wodurch in einem Echozug mehrere k-Raum-Linien pro Repetitionszeit gemessen werden. Die Echozuglänge (Turbofaktor) gibt die Zahl der gemessenen Echos, bzw. k-Raum-Linien pro Repetitionszeit an und ist ein Maß für den Geschwindigkeitsgewinn gegenüber der Standard SE-Technik. Obwohl alle Echos in einem Zug zu unterschiedlichen Echozeiten gemessen werden, kann eine effektive, den Bildkontrast beschreibende Echozeit TEeff angegeben werden. Die effektive Echozeit ist diejenige Echozeit, bei der die zentralen k-Raum-Linien akquiriert werden. Die RARE- (Hennig et al. 1986),„Single-shot-FSE-“ oder HASTE- („Half-acquisition-with-TSE-“) Technik sind die schnellsten Varianten der TSE-Technik. Hier kann pro Repetitionszeit TR z. B. die Auslesung aller für eine Schicht benötigten Echos bzw. Phasenkodierzeilen erfolgen. In Kombination mit dem HalfFourier-Verfahren kann die Akquisitionszeit zusätzlich reduziert werden. Die schnellen Varianten der SE-Technik ermöglichen die Aufnahme von einer (TSE) bzw. mehrerer (HASTE) Schichten in einer Atemanhaltezeit. So ist z. B. bei einer Auflösung von 150 2D-Phasenkodierschritten mit einer TSE-Sequenz bei einem Turbofaktor 10 nur eine Messzeit von etwa 15 s (bzw. 15 TR oder 15 RR Intervallen) für die Aufnahme einer Schicht erforderlich. Die HASTE-Technik ermöglicht sogar die Akquisition von einer kompletten Schicht in einer Repetitionszeit, d. h innerhalb eines Herzschlags. Die TSE- und HASTE-Technik wird am Herzen üblicherweise mit einer Dark-blood-Präparation eingesetzt. Das primäre Einsatzgebiet liegt in der Darstellung der Morphologie. 쐍 Gradientenecho. Die GRE-Pulssequenz basiert auf dem Effekt der Dephasierung und Rephasierung der Spins durch einen Magnetfeldgradienten (Edelstein et al. 1980). Nach der Anregung des Spin-Systems durch einen Hochfrequenzpuls erfolgt eine schnelle Dephasierung des MRT-Signals durch das Anlegen eines Magnetfeldgradienten. Die Rephasierung der Spins wird durch einen Magnetfeldgradienten umgekehrter Polarität, aber mit gleichem Produkt aus Amplitude und Anschaltzeit bewirkt. In der Empfangsspule entsteht das so genannte GRE-Signal. Als Echozeit wird die Zeit zwischen der Anregung des SpinSystems und dem Auftreten des Echosignals bezeichnet. Durch das Fehlen des 180°-Refokussierungspulses im Vergleich zur SE-Sequenz ist die Signalamplitude des Echosignals nicht nur von der T2Relaxation, sondern auch vom Signalzerfall durch Magnetfeldinhomogenitäten abhängig. Der kombinierte, schnellere Signalzerfall wird durch die T2*Relaxationszeit beschrieben. Die GRE-Sequenz kann mit einer sehr viel kleineren Repetitionszeit TR als die SE-Sequenz wiederholt werden, da u. a. der 180°Hochfrequenz- (HF-)Puls fehlt und ein anderer Kontrastaufbau stattfindet. Aus der kleinen Repetitionszeit resultiert der große Vorteil einer erheblich verkürzten Messzeit gegenüber der SE-Sequenz. Der Weichteilkontrast ist bei der GRE-Sequenz grundsätzlich geringer ausgeprägt als bei der SE-Sequenz. Er entspricht einem PD-Kontrast mit leichter T1-Wichtung (Stark u. Bradley 1992). Den Bildkontrast der GRE-Sequenz bestimmt nicht nur die Repetitionszeit TR und die Echozeit TE, sondern auch der HF-Anregungswinkel (Flip-Winkel). Typische Messparameter für eine EKG-getriggerte GRE-Aufnahme mit der Akquisition von einer Rohdatenzeile (kRaum-Zeile) pro Herzschlag sind z. B. TR=13 ms, TE=6 ms und Flip-Winkel-α=40°. Durch die im Vergleich zur SE-Sequenz und der T1-Relaxationszeit im menschlichen Körper sehr kurzen Repetitionszeit TR bei der GRE-Sequenz baut sich bei der wiederholten