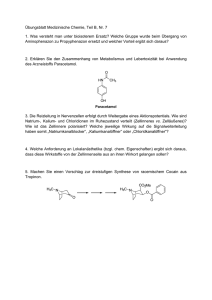
nicht-opioide und opioide analgetika in der zahnheilkundlichen
Werbung

Diplomarbeit NICHT-OPIOIDE UND OPIOIDE ANALGETIKA IN DER ZAHNHEILKUNDLICHEN SCHMERZTHERAPIE eingereicht von Alexandra Tromayer Mat.Nr.: 9302381 zur Erlangung des akademischen Grades Doktor(in) der Zahnheilkunde (Dr. med. dent.) an der Medizinischen Universität Graz ausgeführt am Institut für Experimentelle und Klinische Pharmakologie unter der Anleitung von Ao Univ. Prof. Dr. Josef Donnerer Ort, Datum ………………………….. (Unterschrift) Eidesstattliche Erklärung Ich erkläre ehrenwörtlich, dass ich die vorliegende Arbeit selbstständig und ohne fremde Hilfe verfasst habe, andere als die angegebenen Quellen nicht verwendet habe und die den benutzten Quellen wörtlich oder inhaltlich entnommenen Stellen als solche kenntlich gemacht habe. Graz, am …… Unterschrift 2 Danksagung Mein Dank gilt an dieser Stelle Herrn Prof. Dr. Josef Donnerer vom Institut für experimentelle und klinische Pharmakologie, der mir die Erstellung dieser Arbeit ermöglicht hat. Des weiteren bedanke ich mich bei meinen Eltern für die finanzielle und mentale Unterstützung während des gesamten Studiums. Zuletzt gilt mein Dank meinem Ehemann Jürgen, der mir bei der Erstellung dieser Arbeit stets tatkräftig zur Seite stand. 3 Zusammenfassung Analgetika stellen in der Zahnheilkunde insbesondere zur symptomatischen Schmerztherapie unverzichtbare Arzneimittel dar. Aufgrund ihrer guten entzündungshemmenden Eigenschaften werden dabei Nicht-Opioid- Analgetika bevorzugt eingesetzt. Obwohl diese im allgemeinen als gut verträglich gelten, können sie dennoch bei unsachgemäßer Anwendung eine Reihe von unerwünschten Nebenwirkungen herbeiführen. Eine genaue Kenntnis der einzelnen Präparate hinsichtlich ihrer Wirkungsweise, ihres Nebenwirkungsprofils und ihrer Kontraindikationen ermöglicht deren sicheren Einsatz im zahnärztlichen Alltag. Anhand einer Literaturrecherche wurden ausgewählte, in der Zahnheilkunde häufig eingesetzte Analgetika wie NSAR, selektive COX-2 Hemmer, aber auch einige Opioid-Analgetika, hinsichtlich ihrer pharmakologischen Eigenschaften, ihrer Wirkungsweise, ihrer Nebenwirkungen und auch ihrer praktischen Anwendung dargestellt und miteinander verglichen. Vor allem NSAR sind in der Zahnheilkunde bevorzugt verwendete Arzneimittel, da sie, wie auch in der „Oxford League Table“, einer Rangliste von Analgetika zur Behandlung akuter Schmerzen ersichtlich, gerade in der Therapie akuter postoperativer Schmerzen äußerst effektiv wirksam sind. Das ursprünglich zur Behandlung von Tumorschmerzen entwickelte Stufenschema der WHO findet auch im zahnärztlichen Alltag Anwendung, insofern, daß im Falle einer unzureichenden Analgesie durch ein NSAR, eine Kombination mit einem schwach wirksamen Opioid indiziert ist. Untersuchungen haben diesbezüglich gezeigt, daß solche Kombinationen zum Teil wirksamer sind, als die einzelnen Substanzen alleine. Dies gilt zum Teil auch für Kombinationen von Nicht-Opioid-Analgetika untereinander, wie beispielsweise Paracetamol und NSAR. Obwohl bislang keine eindeutige Meinung hinsichtlich des Nutzen-RisikoVerhältnisses von zum Teil rezeptfrei erhältlichen Kombinationspräparaten, sog. „over-the-counter“ Präparaten, vorherrschend scheint, so empfiehlt sich dennoch in erster Linie eine Verschreibung von Monopräparaten zur Schmerzbehandlung in der Zahnheilkunde. 4 Abstract The prescription of analgesics is very common for the symptomatic treatment of pain in dentistry. Because of their anti-inflammatory properties, non-opioid analgesics are chosen primarily. Although they are generally considered to be quite save, very high dosages or extended use can lead to a number of unwanted side effects. Therefore the knowledge of the mechanisms of action, the proper dosages, side effects and contraindications is a prerequisite for their save use in dentists’ daily routine. Based on a literature search, some of the most common analgesics in dentistry, such as NSAIDs, selective COX-2 inhibitors and specific opioid analgesics are described. A comparison is made concerning their pharmacological effects, side effects, contraindications and applications in patients. Especially NSAIDs are used quite often, because they are known to be very effective in the treatment of acute postoperative pain, as it can also be deduced from the „Oxford League Table“, which was established for analgesics to grade their efficacy in relieving acute pain. The WHO analgesic ladder, which was originally developed for the treatment of cancer pain, also applies in dentistry. At the point where non-opioid analgesics alone are not sufficient for pain relief, the combination with a weak opioid analgesic should be considered. As several studies have shown, the combination of an opioid analgesic with a non-opioid analgesic is sometimes more effective than either alone. This principle also applies to combinations among nonopioids themselves, e.g. the combination of paracetamol and a NSAID. Although the benefit-risk profile of combination products, several of them sold without a prescreption as so called „over-the-counter“ drugs, is not yet clearly established, single drug products should be preferred in dentistry. 5 Inhaltsverzeichnis Glossar ------------------------------------------------------------------------------------- 7 1 Einleitung ----------------------------------------------------------------------------- 8 2 Schmerz ------------------------------------------------------------------------------- 9 2.1 Pathophysiologie des Schmerzes ------------------------------------------------ 9 2.2 Schmerzentstehung -------------------------------------------------------------- 10 2.3 Schmerzmessung ----------------------------------------------------------------- 11 2.4 Geschlechterunterschiede ------------------------------------------------------- 12 3 Einteilung der Analgetika ---------------------------------------------------------- 13 4 Opioid-Analgetika ------------------------------------------------------------------ 16 4.1 Wirkmechanismen der Opioid-Analgetika ------------------------------------- 17 4.2 Indikationen für Opioid-Analgetika -------------------------------------------- 18 4.3 Applikationsformen und Dosierung -------------------------------------------- 19 4.4 Stark wirksame Opioid-Analgetika --------------------------------------------- 20 Morphin ------------------------------------------------------------------------------------- 20 Buprenorphin ------------------------------------------------------------------------------- 22 4.5 Schwach wirksame Opioid-Analgetika ----------------------------------------- 23 Tramadol ------------------------------------------------------------------------------------ 23 5 Nicht-Opioid-Analgetika ----------------------------------------------------------- 27 5.1 Einteilung der Nicht-Opioid-Analgetika --------------------------------------- 27 5.2 Wirkmechanismen der Nicht-Opioid-Analgetika ------------------------------ 27 5.3 Indikationen der Nicht-Opioid-Analgetika ------------------------------------ 29 5.4 Anwendung und Dosierung ------------------------------------------------------ 29 5.5 NSAR (nicht steroidale Antirheumatika) --------------------------------------- 30 5.5.1 Saure, antiphlogistisch-antipyretische Analgetika ------------------------ 30 Acetylsalicylsäure (ASS) ----------------------------------------------------------------- 30 Diclofenac ---------------------------------------------------------------------------------- 34 Dexibuprofen ------------------------------------------------------------------------------- 36 Naproxen ------------------------------------------------------------------------------------ 38 5.5.2 5.6 Selektive COX-2 Hemmer ---------------------------------------------------- 39 Nicht-saure antipyretische Analgetika ----------------------------------------- 40 Paracetamol --------------------------------------------------------------------------------- 41 Metamizol ---------------------------------------------------------------------------------- 43 6 Diskussion ---------------------------------------------------------------------------- 46 7 Literaturverzeichnis ---------------------------------------------------------------- 51 8 Abbildungsverzeichnis ------------------------------------------------------------- 56 6 Glossar AM-404 Arachidonoylaminphenol ASS Acetylsalicylsäure COX Cyclooxygenase FAAH Fettsäureamidhydrolase GIT Gastrointestinaltrakt HWZ Halbwertszeit IL-1β Interleukin-1 beta MAO Monoaminooxidase NGF Nerve Growth Factor NNT number needed to treet NRS Numerische Rating-Skala NSAID non-steroidal anti-inflammatory drugs NSAR Nicht-Steroidale Antirheumatika PG Prostaglandin TNF α Tumor-Nekrose-Faktor alpha VAS Visuelle Analog-Skala VRS Verbale Rating-Skala WHO World Health Organisation ZNS Zentrales Nervensystem 7 1 Einleitung Der Einsatz von Analgetika stellt ein Standardprozedere im zahnärztlichen Alltag dar. Schmerzen, mit denen sich der Zahnarzt in der Praxis häufig konfrontiert sieht, sind zumeist entzündlicher Genese bzw. die Folge oralchirurgischer Eingriffe wie Zahnextraktionen oder die operative Entfernung retinierter Weisheitszähne. Gerade in Hinblick auf ihre entzündungshemmenden Eigenschaften, haben sich dabei Analgetika, die der Gruppe der Cyclooxygenasehemmstoffe zugeordnet sind, als Medikamentengruppe der 1.Wahl in der symptomatischen Schmerzbehandlung etabliert. Während NSAR früher allgemein rezeptpflichtig waren, sind einige heute als sog. „over-the-counter“ Medikamente, sowohl als Mono- als auch Kombinationspräparate, frei im Handel erhältlich. Möglicherweise mit ein Grund, warum die Zahl der Mißbrauchsfälle in den letzten Jahren angestiegen ist. Insbesondere der langfristige (mißbräuchliche) Einsatz der Nicht-Opioid- Analgetika kann jedoch mit einer Reihe von Nebenwirkungen einhergehen, deren Folgen nicht bzw. nur sehr schwer abschätzbar sind. Der Umstand, daß die Einnahme von Opioid-Analgetika, im Gegensatz zu den Nicht-Opioid-Analgetika, langfristig mit keinerlei Organschädigung einhergeht, hat deren Einsatz gerade auch in der Zahnmedizin in ein anderes Licht gerückt. So stellen diese gerade bei insuffizienter Schmerzlinderung durch Nichtopioide oder allenfalls vorliegenden Kontraindikationen ein durchaus geeignetes Reservemittel dar. Letztlich liegt es im Ermessen des Zahnarztes, die Verschreibung von Schmerzmedikamenten in Bezug auf ihr Nutzen-Risiko-Verhältnis den individuellen Bedürfnissen seiner Patienten entsprechend anzupassen, was eine genaue Kenntnis der einzelnen Präparate, insbesondere ihrer Wirkungen und Nebenwirkungen unumgänglich macht. 8 2 Schmerz 2.1 Pathophysiologie des Schmerzes Schmerz wird für die meisten Menschen als unangenehmes Gefühl wahrgenommen und veranlasst viele dazu, einen Arzt aufzusuchen. Zum einen stellt er für den Betroffenen ein Warnsignal dar, zum anderen dient er dem behandelnden Arzt als wesentliches Symptom hinsichtlich der Diagnosefindung (1). Schmerzen können akut auftreten, beispielsweise in Folge einer Verletzung, wobei sich deren Dauer im Wesentlichen auf Stunden bzw. Tage beschränkt. Diese sind im Gegensatz zu einem chronischen, allmählich einsetzenden Schmerzverlauf (über Monate bis Jahre) meistens rasch und gut behandelbar (1). Neben dieser Einteilung in akut und chronisch lassen sich hinsichtlich der zugrundeliegenden Mechanismen drei Schmerztypen (2) unterscheiden. Der physiologische Nozizeptorschmerz ensteht durch die Einwirkung thermischer, mechanischer oder chemischer Reize auf gesundes Gewebe und führt meist zu einer sofortigen Reflexreaktion, um eine dauerhafte Schädigung zu vermeiden. Der pathologische Nozizeptorschmerz entsteht im Rahmen von Entzündungen und wird deshalb auch Entzündungsschmerz genannt. Dabei spielen Sensibilisierungsvorgänge sowohl im zentralen als auch peripheren Nervensystem eine wesentliche Rolle. Neuropathische Schmerzen entstehen durch Schädigung peripherer Nerven z.B durch Verletzungen, Quetschung, Entzündung oder metabolische Störungen wie Diabetes mellitus. Auch der sogenannte Phantomschmerz wird zu dieser Gruppe gezählt. Eine weitere Einteilung der Schmerzarten lässt sich hinsichtlich des Entstehungsortes treffen. Der somatische Schmerz kann von der Haut, den Muskeln, den Gelenken und Knochen, sowie vom Bindegewebe ausgehen. Dementspre9 chend wird jener Schmerz, der von der Haut ausgeht als Oberflächenschmerz, jener der von den darunterliegenden Geweben ausgeht, als Tiefenschmerz bezeichnet. Schmerzen, die ihren Ursprung im Bereich der inneren Organe haben, werden als viszerale Schmerzen bzw. Eingeweideschmerzen bezeichnet (2). 2.2 Schmerzentstehung Durch die Gewebsschädigung kommt es zur Freisetzung sog. Schmerzmediatoren, die ihrerseits zur Sensibilisierung des nozizeptiven Systems führen. Eine wesentliche Rolle spielen dabei Zytokine wie Tumor-Nekrose-Faktor alpha (TNF-α) oder Interleukin 1 beta (IL 1β). Von neutrophilen Granulozyten gebildet, binden diese an die entsprechenden Rezeptoren von Entzündungszellen wie beispielsweise Makrophagen und aktivieren so innerhalb des Zellkerns die Transkription entzündlicher Gene. Eines der wichtigsten Genprodukte stellt dabei die Cyclooxygenase-2 (COX-2) dar. Sie katalysiert die Umwandlung von Arachidonsäure in Prostaglandine. Neben Prostaglandinen (vorwiegend PG E 2 ) tragen auch Zytokine sowie der sog. Nerve growth factor (NGF), der von Mastzellen, neutrophilen Granulozyten sowie Makrophagen freigesetzt wird zur Entstehung des Entzündungsschmerzes bei. Die sensibilisierten Nozizeptoren setzen ihrerseits weitere Entzündungsmediatoren wie beispielsweise das Neuropeptid Substanz P frei. Die von den Nozizeptoren ausgehenden Nervenimpulse werden über das Rückenmark zum Thalamus und in weiterer Folge zur Großhirnrinde weitergeleitet, die für die bewusste Schmerzempfindung verantwortlich ist (2). 10 Abb. 1: Übersicht der nozizeptiven Reizleitung zum Gehirn (Quelle: Schmidt, Thews: "Physiolog ie des Menschen“) 2.3 Schmerzmessung Da Schmerz ein subjektives Phänomen darstellt, ist eine Einschätzung des Schmerzgeschehens seitens des Patienten sowohl für die Therapiewahl als auch für deren erfolgreiches Gelingen von entscheidender Bedeutung. Dies kann einerseits durch Fragebögen erfolgen, in denen der Patient Angaben über die Art des Schmerzes, dessen Lokalisation, Dauer, etc. macht oder anhand einfacher Skalen. Hierfür stehen verschiedene Möglichkeiten zur Verfügung 11 (siehe Abb.2). Bei der Verbalen Rating- Skala (VRS) erfolgt die subjektive Einstufung des Schmerzempfindens anhand von Wörtern (kein Schmerz, mäßiger Schmerz, etc.), bei der visuellen Analog- Skala (VAS) anhand einer Linie, deren Endpunkte jeweils Extreme darstellen (kein Schmerz – stärkster vorstellbarer Schmerz) und bei der Numerischen Rating-Skala (NRS) anhand von Zahlen (von 1 bis 10). Speziell bei Kindern ab dem 3. Lebensjahr erweisen sich sog. Smiley Skalen als sehr hilfreich (1). Abb. 2: Skalen zur Schmerz messung (Beubler) 2.4 Geschlechterunterschiede Hinsichtlich des Schmerzempfindens zeigen sich deutliche Unterschiede zwischen dem männlichen und dem weiblichen Geschlecht. So leiden Frauen häufiger unter chronischen Schmerzen als Männer. Untersuchungen zufolge liegt die Schmerzschwelle bei Frauen niedriger und sie weisen ein höheres Schmerzempfinden auf (3-6). Dem zugrundeliegend hat man herausgefunden, dass möglicherweise anatomische Unterschiede in bestimmten Gehirnstrukturen und -funktionen dafür verantwortlich sein könnten (6). Neben diesen anatomischen Gegebenheiten spielen auch genetische Unterschiede eine zentrale Rolle. So scheint es Gene zu geben, die Frauen schmerzempfindlicher machen als Männer, was auch mit ein Grund dafür sein 12 könnte, warum manche Schmerzmittel bei den Geschlechtern unterschiedliche Wirksamkeit aufweisen (4). Studien haben gezeigt, dass es auch einen Zusammenhang zwischen dem Hormonspiegel gegenüber bei Männern Frauen gibt. und So der nimmt höheren Schmerzempfindlichkeit beispielsweise die Häufigkeit schmerzhafter Erkrankungen nach der Menopause deutlich ab (4,7). Einen weiteren wichtigen Aspekt stellt auch der emotionale Umgang mit Schmerzen dar. Während Männer primär dazu neigen, Schmerzen eher zu ignorieren, suchen Frauen vielmehr Kontakt zu ihrem sozialen Umfeld. Angstzustände und Depressionen sind unter Frauen weiter verbreitet als unter Männern, was mit ein Grund dafür sein könnte, dass Frauen häufiger unter Schmerzerkrankungen leiden. Dennoch scheint es, dass Frauen eher in der Lage sind, mit Schmerzen umzugehen, indem sie negative Gefühle durch den Schmerz begrenzen (4,8). 3 Einteilung der Analgetika Die Einteilung der Analgetika erfolgt in zwei Hauptgruppen. Die OpioidAnalgetika, die ihrerseits in zwei Subgruppen unterteilt werden, nämlich in schwach- und stark wirksame Opioide und die sog. Nicht- Opioid- Analgetika. Als Richtlinie zur medikamentösen Schmerztherapie hat sich das sog. Stufenschema der World Health Organisation (WHO) von 1986, welches ursprünglich zur Therapie von Tumorschmerzen entwickelt wurde, bis heute als sehr hilfreich und effektiv erwiesen (siehe Abb.3). 13 Abb. 3: WHO Stufensche ma (http://www.medizinfo.de/schmerz) Dabei wird in Stufe 1 ein Nicht-Opioid-Analgetikum (z.B.: Acetylsalicylsäure (ASS), Nichtsteroidale Antirheumatika (NSAR), etc.) entweder allein oder in Kombination mit einem Adjuvans eingesetzt. Sollte sich dadurch nicht der gewünschte Effekt einstellen, muß auf ein Arzneimittel der Stufe 2 zurückgegriffen werden. Dabei kommt ein schwach wirksames Opioid (z.B.: Tramadol, Tilidin,etc.) alleine oder in Kombination mit einem Nicht-Opioid- Analgetikum u/o Adjuvans zum Einsatz. Eine weitere Steigerung stellen Arzneimittel der 3. Stufe dar. Hierbei wird ein starkes Opioid (z.B.: Morphin,etc.) allein oder wiederum in Kombination mit einem Nicht-Opioid-Analgetikum u/o Adjuvans verabreicht (2). Insbesondere bei akuten postoperativen Schmerzen kann das Stufenschema auch in entgegengesetzter Richtung durchlaufen werden, dh. in Abhängigkeit von der Schmerzintensität beginnt man zunächst mit einem Opioid- Analgetikum, um möglichst rasch eine Schmerzlinderung zu erzielen, und steigt dann, mit zunehmend schwächer werdenden Schmerzen, auf ein NichtOpioid-Analgetikum um, solange bis eine Schmerzfreiheit erreicht ist (9). Bei den Adjuvantien handelt es sich um Pharmaka, die selbst nicht analgetisch wirken, aber die Wirkung von Schmerzmitteln verstärken bzw. die mit Schmerzen verbundenen Symptome lindern können. Dazu zählen u.a. Antidepressiva, Antikonvulsiva, Neuroleptika und Glucocorticoide (1). In Anlehnung an das WHO Dokument gibt es einfache Empfehlungen in Hinblick auf die richtige Verwendung von Analgetika für eine erfolgreiche Be- 14 handlung. Grundsätzlich sollten Analgetika wenn möglich oral und in regelmäßigen Intervallen eingenommen werden. Des weiteren sollten sie in Abhängigkeit einer zuvor durchgeführten Schmerzmessung der Schmerzintensität entsprechend verschrieben werden und nicht zuletzt sollte die Dosierung individuell angepasst sein (9). 15 4 Opioid-Analgetika Nicht zuletzt aufgrund von Unwissenheit und Angst vor einer möglichen Abhängigkeit, sowie vor unangenehmen Nebenwirkungen, wie Übelkeit, Atemdepression, Obstipation, etc. werden Opioid-Analgetika europaweit immer noch selten verschrieben. Tatsächlich ist jedoch die Gefahr, bei ordnungsgemäßer Anwendung, insbesondere bei oraler Einnahme, eine psychische und physische Abhängigkeit zu entwickeln, äußerst gering (10). Eine Studie von Porter et.al (11) aus dem Jahr 1980 zeigte eine Abhängigkeitsrate von nur rund 0,03% unter 12.000 Patienten. Neueren Untersuchungen zufolge besteht lediglich bei langfristiger Einnahme von Opioid-Analgetika insbesondere zur Behandlung chronischer Schmerzen eine höhere Gefahr einer Abhängigkeitsentwicklung (12). Eine Abhängigkeit entwickelt sich primär aufgrund der euphorisierenden Wirkung und der Entzugserscheinungen, die mit dem Absetzten dieser Medikamente verbunden sind. Dem wirken heutzutage sog. Retardpräparate weitestgehend entgegen, indem sie langsam an- bzw. abfluten. Zum einen werden durch die langsamere Anflutung Plasmaspitzen (und damit die euphorisierende Wirkung) vermieden, zum anderen werden Entzugserscheinungen durch das langsame Abfluten reduziert (2). Abhängigkeit stellt in erster Linie ein psychisches Problem, nicht aber eine pharmakodynamische Eigenschaft dar. Demensprechend vorsichtig sollte man bei Patienten, die ein entsprechendes Suchtpotential aufweisen, bei der Verordnung von Opioiden sein (13). Im richtigen Intervall und der richtigen Dosis appliziert, stellen Opioide nach wie vor für viele Schmerzzustände die besten Analgetika dar. Die Tatsache, daß sie dem Suchtmittelgesetz unterliegen, schreckt nach wie vor viele Behandler davon ab, diese Arzneimittel zu verordnen (1). 16 4.1 Wirkmechanismen der Opioid-Analgetika Die analgetische Wirkung der Opioide beruht auf einer agonistischen Bindung an den Opioidrezeptoren (µ-, κ- und δ-Rezeptoren). Diese sind sowohl in zentralnervösen Strukturen wie Hirnstamm, Rückenmark oder limbischem System, als auch in peripheren Geweben in großer Anzahl vertreten. Demnach werden zentrale und periphere Wirkungen unterschieden. Abb. 4: Wir kmecha nis mus von Opioiden auf Rückenmar kse bene (Mutschler) Eine der wichtigsten zentralen Wirkungen stellt die Analgesie dar. Durch die Gabe von Opioiden wird das absteigende schmerzhemmende System aktiviert, nozizeptive Impulse auf spinaler Ebene werden unterdrückt und auch das Schmerzerlebnis im limbischen System ändert sich dahingehend, daß Schmerz zwar wahrgenommen, aber nicht mehr als so bedrohlich empfunden wird (1). 17 Nebenbei wirken Opioide im Bereich des ZNS u.a.: • sedierend, dh. Aufmerksamkeit und Konzentration nehmen ab • angstlösend • euphorisierend • hustendämpfend • miotisch, dh. es kommt zu einer Verengung der Pupillen • emetisch, v.a. zu Beginn der Anwendung, später eher antiemetisch • atemdepressiv • antidiuretisch Zu den wichtigsten peripheren Wirkungen gehören u.a.: • Analgesie • Verzögerte Magenentleerung • Obstipation • Kontraktion der Gallengänge • Histaminfreisetzung und damit verbundener Juckreiz Die therapeutische Bedeutung der Opioide besteht in erster Linie in der analgetischen Wirkung. Um unerwünschte Wirkungen wie Übelkeit, Erbrechen oder Obstipation möglichst gering zu halten, sollten Opioide vor allem zu Beginn der Therapie immer in Kombination mit Antiemetika, bei längerfristiger Behandlung in Kombination mit Laxantien verordnet werden (1). Durch die Gabe von Retardformen lassen sich insbesondere Nebenwirkungen wie Atemdepression und Euphorie weitestgehend reduzieren. 4.2 Indikationen für Opioid-Analgetika Starke Schmerzen, insbesondere akute Schmerzen nach Trauma bzw. Operation, sowie chronische Schmerzen stellen die Hauptindikation für den Einsatz von Opioiden dar. Auf Opioide wird in der Regel dann zurückgegriffen, wenn 18 eine Therapie mit Nicht-Opioid-Analgetika (v.a. NSAR) trotz Dosissteigerung nicht den gewünschten schmerzlindernden Effekt bringt. 4.3 Applikationsformen und Dosierung Grundsätzlich kann man zwischen nicht-invasiver und invasiver OpioidApplikation unterscheiden, wobei in der Zahnmedizin in erster Linie die nicht-invasiven Verfahren zum Einsatz kommen. Dazu zählen die perorale, die sublinguale, transdermale und parenterale Applikation. Insbesondere bei Verwendung schwach wirksamer Opioidanalgetika (z.B.: Tramadol, Dihydrocodein) wird die orale Applikation in Form von Filmtabletten oder Lösungen bevorzugt eingesetzt. Die Dosierung muß der jeweiligen Schmerzsituation (Stärke, Dauer,etc.) individuell angepaßt werden und hat nach einem fixen Zeitplan zu erfolgen. Besonders bei langfristiger Therapie ist u.U. aufgrund einer Toleranzentwicklung eine Dosissteigerung notwendig (2). Der Vorteil der Opioid-Analgetika besteht darin, daß es selbst bei langfristiger Therapie zu keinerlei Organschäden kommt und es daher hinsichtlich der Dosis nach oben hin praktisch keine Grenzen gibt (1). Da bei Verwendung oraler Retardformen die volle Wirkung erst nach einigen Stunden zu tragen kommt, ist es vor allem zu Therapiebeginn wichtig, rasch wirksame Tabletten einzunehmen, und erst dann auf Retardpräparate umzusteigen, um eine möglichst rasche Schmerzlinderung zu erzielen (1). 19 4.4 Stark wirksame Opioid-Analgetika Morphin Abb. 5: Strukturfor mel M orphin (http://de.wikipedia.org/wiki/Morphin ) Morphin stellt einen reinen Agonisten an den Opioidrezeptoren dar, wobei es fast ausschließlich an μ-Rezeptoren bindet. Wirkung: Morphin wirkt über die Bindung an μ-Rezeptoren überwiegend analgetisch, wobei es insbesondere zur Therapie sehr starker akuter Schmerzen, vorwiegend Nozizeptorschmerzen eingesetzt wird. Pharmakokinetik: Nach oraler Applikation unterliegt Morphin einem ausgeprägten first pass Effekt in der Leber. Dabei wird es zum Großteil in das analgetisch nicht wirksame Morphin-3-Glucoronid und zu einem geringeren Anteil in das analgetisch wirksame Morphin-6-Glucoronid umgewandelt. Die orale Bioverfügbarkeit liegt bei 20-40%, die Proteinbindung im Blutplasma bei 35%, wobei die Halbwertszeit im Plasma etwa 2-4 Stunden beträgt (10). Morphin wird glucuronidiert und danach vorwiegend über die Nieren ausgeschieden. Nebenwirkungen: wie bereits erwähnt, ist die Einnahme von Morphin mit einer Vielzahl von Nebenwirkungen behaftet. Dazu zählen u.a.: Schwitzen, Juckreiz, Einengung der Pupillen, Harnverhaltung, Sedierung, Obstipation, Übelkeit und Erbrechen sowie die Atemdepression, die wohl schwerwiegend- 20 ste Nebenwirkung. Durch die Verwendung oraler Retardpräparate wird aufgrund der langsamen Anflutung jedoch das Risiko einer Atemdepression drastisch vermindert. Kontraindikationen: Zu den wesentlichen Kontraindikationen des Morphins gehören u.a. obstruktive Erkrankungen der Atemwege, paralytischer Ileus, Colitis ulcerosa, Pankreatitis, sowie Hypothyreose. Weiters sollte Morphin nicht in Kombination mit MAO-Hemmern (aufgrund der wechselseitigen Verstärkung der toxischen Wirkungen) eingesetzt werden (10). Insbesondere bei Patienten mit einer Niereninsuffizienz ist eine Dosisreduktion unerlässlich, da der noch aktive Hauptmetabolit Morphin-6-Glucuronid über die Nieren ausgeschieden wird (14). Anwendung und Dosierung: Die Dosierung gestaltet sich individuell angepasst, je nach Stärke und Dauer der Schmerzen, sowie der vorangegangenen Therapie und sollte nicht bei Bedarf, sondern nach einem geregelten Zeitplan erfolgen. Dabei ist es wichtig, mit kleineren Dosen zu beginnen und diese allmählich zu steigern bis eine Schmerzfreiheit erzielt ist. Die orale Einnahme erfolgt in Form von Tabletten, Kapseln, Lösungen oder als Granulat alle 4 Stunden bei einer Einzeldosis von 10-30 mg. Bei Retardtabletten verlängert sich das Einahmeintervall auf 12 bis 24 Stunden bei einer Einzeldosis von 10-200 mg. Bei rektaler sowie subkutaner Applikation liegt die Einzeldosis ebenfalls bei 10-30 mg und bei intravenöser Gabe bei 510 mg (14). Co-Medikation: Aufgrund der rein analgetischen Wirkung des Morphins empfiehlt sich eine gleichzeitige Einnahme entzündungshemmender Medikamente, wobei hierfür insbesondere NSAR geeignet sind. Gerade zu Beginn der Therapie sollten aufgrund der emetischen Wirkung zusätzlich Antiemetika verabreicht werden, sowie bei längerfristiger Anwendung zusätzlich Laxantien, um einer Obstipation entgegenzuwirken. 21 Buprenorphin Abb. 6: Strukturfor mel B uprenorphin (http://de.wikipedia.org/wiki/Buprenorphin) Buprenorphin ist ein partieller Agonist am μ-und δ-Rezeptor, sowie ein Antagonist am κ-Rezeptor. Wirkung: Aufgrund der starken Affinität zu den μ-Rezeptoren wirkt Buprenorphin etwa 20-40 mal stärker analgetisch als Morphin, dennoch wird aufgrund der geringeren intrinsischen Aktivität der maximale analgetische Effekt von Morphin trotz Dosissteigerung nicht erreicht. Man spricht vom sog. „Ceiling-Effekt (2). Dieser glockenförmige Dosis-Wirkungsverlauf wurde bis dato nur anhand von Tierversuchen nachgewiesen (1). Eine Studie an 20 gesunden freiwilligen Probanden hat gezeigt, dass der analgetische Effekt von Buprenorphin bei Verdoppelung der Dosis um den Faktor 3,5 zunahm, die atemdepressive Wirkung hingegen nahezu unverändert blieb. Dabei bekamen je 10 Personen 0,2mg/70kg, 10 andere 0,4mg/70kg Buprenorphin i.v appliziert. Dieser Versuch zeigte also einen ceiling effect hinsichtlich der atemdeppressiven, nicht aber hinsichtlich der analgetischen Wirkung in einem Dosisbereich von 0,05 bis 0,6mg (15). 22 Nebenwirkungen: im Gegensatz zu Morphin sind Nebenwirkungen wie Obstipation und vor allem die Atemdepression eher gering ausgeprägt, da δRezeptor-Agonisten die atemdepressive Wirkung der μ-Rezeptor-Agonisten herabsetzen (1). Ansonsten entsprechen die Nebenwirkungen im Wesentlichen jenen des Morphins. Kontraindikationen: Ähnlich dem Morphin sollte Buprenorphin nicht bei Atemfunktionsstörungen, sowie in Kombination mit MAO-Hemmern verabreicht werden. Anders als Morphin, welches selbst in der Schwangerschaft und Stillzeit kurzzeitig angewendet werden kann, ist Buprenorphin während dieser Zeit kontraindiziert. Anwendung und Dosierung: Buprenorphin kann in Form einer Injektionslösung, als Sublingualtablette oder in Form eines transdermalen Pflasters appliziert werden. Die Einzeldosis bei Anwendung der Sublingualtablette liegt bei 0,4-0,8mg mit einer Wirkdauer von etwa 6-8 Stunden. Bei Anwendung des Pflasters beträgt die Wirkdauer bis zu 96 Stunden (z.B.: Transtec®Pro 35μg/h) (10). 4.5 Schwach wirksame Opioid-Analgetika Tramadol Abb. 7: Strukturfor mel Tra madol (http://de.wikipedia.org/wiki/Tramadol) 23 Laut Mutschler zählt Tramadol zu den am häufigsten verwendeten OpiodAnalgetika weltweit. Obwohl die analgetische Wirkung weit unter jener des Morphins liegt, so ist vor allem die atemdepressive Wirkung im Vergleich zu Morphin sehr gering ausgeprägt (2). Wenngleich auch die Abhängigkeitsrate bei Tramadol deutlich geringer ist (ca. 1:100 000), sollte es bei Patienten mit bekannter Suchterkrankung nicht angewendet werden (16). Im Gegensatz zu den stark wirksamen Opioiden fällt Tramadol nicht unter das Betäubungsmittelgesetz. Wirkung: Die analgetische Wirkung beruht zum einen darauf, dass Tramadol ein Agonist am μ-Rezeptor ist und zum anderen auch darauf, dass es zentrale Schmerzmodulationssysteme durch Hemmung der Wiederaufnahme von Noradrenalin und Serotonin beeinflusst (1). Pharmakokinetik: Nach oraler Applikation wird Tramadol nahezu vollständig (ca. 95%) resorbiert, bei einer oralen Bioverfügbarkeit von etwa 70% und einer Halbwertszeit von ca. 5 Stunden (2). Es wird durch N-und ODemethylierung metabolisiert, wobei sowohl das Tramadol als auch seine Metaboliten fast zur Gänze über die Nieren ausgeschieden werden (10). Nebenwirkungen: Die durchaus schwerwiegenden opioidassoziierten Nebenwirkungen wie Atemdepression, Abhängigkeit und Sedierung treten bei Verwendung von Tramadol eher selten auf. Typische Nebenwirkungen sind in erster Linie Übelkeit und Erbrechen, was nicht zuletzt auf die Beinflussung des Dopaminsystems zurückzuführen ist, Schläfrigkeit und Benommenheit (10). Anhand einer Vergleichsstudie von Wirz et al. (17) wurde die Wirksamkeit und Verträglichkeit von Tramadol im Vergleich zu Oxycodon (reiner Agonist an den Opioidrezeptoren) untersucht. Die Patienten bekamen randomisiert entweder Tramadol oder Oxycodon mit analgetisch gleicher Wirksamkeit. Dabei zeigte sich, daß jene mit Tramadol behandelten Patienten signifikant häufiger und intensiver an Übelkeit und Erbrechen litten als diejenigen, die mit Oxycodon behandelt wurden. Kontraindikationen: Hierzu zählen insbesondere Atemfunktionsstörungen, Epilepsie, in Kombination mit MAO-Hemmern, sowie Schwangerschaft und 24 Stillzeit. Bei Patienten mit eingeschränkter Nieren- und Leberfunktion sollte die Dosis entsprechend herabgesetzt werden (10). Anwendung und Dosierung: Tramadol kann oral in Form von Kapseln, Tabletten oder Tropfen verabreicht werden oder invasiv in Form von Lösungen und Ampullen. Bei oraler Applikation liegt die Einzeldosis bei 50-100mg (20-40 Tropfen) bei einem Dosisintervall von 4-6 Stunden, bei Retardformen 50mg alle 12 Stunden bzw. 100mg alle 8 Stunden. Die maximale Tagesdosis beträgt 400mg bzw. 8 mal 20 Tropfen (18). Co-Medikation: Insbesondere bei Vorliegen entzündlicher Geschehnisse ist eine Kombination mit NSAR, aber auch mit Metamizol von Vorteil. In einer Studie von Medve et al. (19) wurde der analgetische Effekt und die Zeit bis zum Einsetzen der analgetischen Wirkung einer Kombinationstablette aus Tramadol und Paracetamol (37,5mg Tramadol, 325mg Paracetamol) mit Tramadol (37,5mg) und Paracetamol (325mg) alleine verglichen. In einer Doppelblind-Parallelgruppenstudie an insgesamt 1197 Patienten (16 bis 46 Jahre alt, guter Allgemeinzustand) wurden 3 Behandlungsmethoden nach der Extraktion von 2 oder mehreren Weisheitszähnen verglichen, wobei die Patienten unter mittleren bis starken Schmerzen litten und dazu angehalten waren, keinerlei Schmerzmedikamente vor der Extraktion einzunehmen. Die Patienten wurden gleichmäßig in 3 Gruppen randomisiert und bekamen je eine Einzeldosis Tramadol/Paracetamol (75mg/650mg), Tramadol 75mg, Paracetamol 650mg, Ibuprofen 400mg (um die Modellempfindlichkeit zu bestimmen) oder Placebo. Die Patienten mussten danach zumindest 2 Stunden mit der Einnahme weiterer Medikamente warten. Anhand von Skalen wurden die Schmerzlinderung (Skala 0-4) und die Schmerzintensität (Skala 0-3) zunächst 30 Minuten nach Gabe der Einzeldosis und in weiterer Folge stündlich bei einer Gesamtbeobachtungszeit von 8 Stunden bekanntgegeben. Man kam zu dem Ergebnis, daß alle Behandlungen jener mit Placebo überlegen waren. Hinsichtlich Schmerzlinderung, Schmerzintensität und Dauer der Analgesie war die Kombinationstablette sowohl Tramadol als auch Paracetamol alleine überlegen (siehe Abb. 8 und Abb. 9; APAP= Acetaminophen= Paracetamol). Man kam zu dem Schluß, daß die Kombination aus Tramadol/Paracetamol eine 25 rasch wirksame, langanhaltende und gut verträgliche Schmerzmedikation in der Behandlung akuter Schmerzzustände darstellt (19). Abb. 8: Dauer bis zum Einsetzen der Wirkung (Medve et al., Anesth Prog 48:79-81 2001) Abb. 9: Dauer der Wirkung (Medve et al., Anesth Prog 48:79-81 2001) 26 5 Nicht-Opioid-Analgetika Nicht zuletzt aufgrund ihrer entzündungshemmenden Wirkung zählen NichtOpioide zu den am häufigsten in der zahnärztlichen Praxis eingesetzten Analgetika (20). 5.1 Einteilung der Nicht-Opioid-Analgetika Primär lassen sich zwei Gruppen der Nicht-Opioid-Analgetika unterscheiden. Zum einen ist dies die Gruppe der nichtsteroidalen Antiphlogistika bzw Antirheumatika, die sog. NSAR (engl. NSAIDs: non-steroidal anti-inflammatory drugs) und zum anderen die der nicht-sauren antipyretischen Analgetika. Substanzen der Gruppe der NSAR wirken nicht nur analgetisch und antipyretisch, sondern auch in höherem Maße antiphlogistisch. Wichtige Vertreter sind unter anderem die Acetylsalicylsäure (ASS), Dexibuprofen und Diclofenac. Mit Ausnahme einiger selektiver COX-2-Hemmer handelt es sich hierbei um saure Verbindungen. Vertreter der nicht-sauren antipyretischen Analgetika wirken hingegen im Unterschied zu den NSAR in therapeutischer Dosierung nicht entzündungshemmend, wie beispielsweise Paracetamol oder Metamizol. Diese Verbindungen sind entweder schwach basisch oder neutral (2). 5.2 Wirkmechanismen der Nicht-Opioid-Analgetika Die Wirkung der Nicht-Opioid-Analgetika beruht in erster Linie darauf, daß diese Substanzen maßgeblich in die Prostaglandinsynthese durch Hemmung der sog. Cyclooxygenasen (COX) eingreifen. Diese überall im Körper vorkommenden Enzyme metabolisieren Arachidonsäure in die sog. cyclischen Endoperoxide, welche die Vorstufen der Prostaglandine, des Prostacyclins und des Thromboxan A 2 darstellen (2). Prostaglandine sind nicht nur wesentlich an der Schmerzentstehung und an den Entzündungsreaktionen beteiligt, sondern auch an einer Reihe anderer physiologischer Funktionen, wie beispielsweise dem Schleimhautschutz des Magens, der Nierenfunktion und der Gerinnungsfunktion der Thrombozyten 27 (1). Dies hat zur Folge, daß die Einnahme von Nicht-Opioid-Analgetika unweigerlich mit teils unerwünschten Nebenwirkungen einhergeht, die es bei der Verordnung dieser Schmerzmittel zu bedenken gibt (siehe Abb. 10). Abb. 10: B eeinflussung der Prostaglandineffekte durch Prostag landinsynthesehemmung (Mutschler) Zu Beginn der 90er Jahre wurden zwei Isotypen der Cyclooxygenase (siehe Abb. 11) entdeckt, die sich vor allem hinsichtlich ihrer Funktion unterscheiden. Abb. 11: Funktionen der COX-1 und COX-2 Isotypen (Mutschler) Die COX-1, ein konstitutiv exprimiertes Enzym, welches in nahezu allen Organsystemen zu finden ist, ruft physiologischerweise die Synthese von Prostaglandinen beispielsweise in den Thrombozyten, der Niere und dem Magen hervor und wird auch als sog. „housekeeping-enzyme“ bezeichnet. Wird 28 dieses Enzym nun durch NSAR gehemmt, so treten entsprechende Nebenwirkungen in den COX-1 exprimierenden Organen auf (2). Dazu zählen u.a. Erosionen der gastrointestinalen Schleimhaut bis hin zu Ulzerationen, Ödeme, verstärkte Blutungsneigung und Diarrhö. Die COX-2 hingegen ist rasch induzierbar, beispielsweise durch Interleukine und Zytokine in entzündetem Gewebe und führt zu einer vermehrten Bildung von Prostaglandinen, die ihrerseits die klassischen Entzündungszeichen wie Schmerzen, Schwellung, Rötung, etc. hervorrufen. Dies hat letztlich zur Entwicklung sog. „selektiver COX-2 Hemmer“, die sog. Coxibe geführt, dh. Entzündungshemmung und Schmerzlinderung, ohne die teils beträchtlichen Nebenwirkungen (wie z.B. Ulzerationen im Bereich des Gastrointestinaltraktes), die vor allem auf die Wirkung der COX-1 Hemmer zurückzuführen sind (1). Die Tatsache, daß die COX-2 in einigen Organen, wie z.B. Niere, Uterus oder Gefäßendothelzellen auch konstitutiv vorhanden und an diversen physiologischen Prozessen ebenso beteiligt ist, hat gezeigt, daß gewisse Nebenwirkungen der NSAR nicht nur allein durch die Hemmung der COX-1 hervorgerufen werden (2). 5.3 Indikationen der Nicht-Opioid-Analgetika Haupteinsatzgebiet der Nichtopioide sind leichte bis mittelstarke Schmerzen, insbesondere Schmerzen die mit einer Entzündungsreaktion einhergehen wie z.B. Kopfschmerzen und vor allem Zahnschmerzen. Darüberhinaus werden sie auch zur Schmerzbehandlung degenerativer und rheumatischer Erkrankungen, sowie in der Tumortherapie, insbesondere zur Schmerzlinderung bei Knochenmetastasen eingesetzt (20). 5.4 Anwendung und Dosierung Laut Beubler werden Nicht-Opioid-Analgetika in ihrer analgetischen Wirksamkeit zumeist überbewertet, die mit der Anwendung verbundenen Nebenwirkungen werden jedoch meist unterschätzt (1). Werden diese über die normale Dosierung hinaus über einen längeren Zeitraum angewendet, so kann 29 sich dadurch das Risiko gastrointestinaler- und Nierenfunktionsstörungen deutlich erhöhen. Daher gilt die allgemeine Empfehlung, Arzneimittel der Gruppe der Nicht-Opioide nur im normalen Dosisbereich und so kurz wie möglich anzuwenden. Sollte sich dadurch keine Besserung der Beschwerden ergeben, so sollte eine Kombination mit schwachen bzw. mittelstarken Opioiden angestrebt werden. Keinesfalls sollten aber Arzneimittel, die der gleichen Gruppe angehören, miteinander kombiniert werden, da sich dadurch lediglich die Nebenwirkungen verstärken, nicht jedoch ihre analgetische Wirkung (1). 5.5 NSAR (nicht steroidale Antirheumatika) Wie bereits zuvor erwähnt, bewirken NSAR durch Hemmung des Enzyms Cyclooxygenase die Blockade der Prostaglandinsynthese und wirken somit analgetisch, antiphlogistisch und antipyretisch. Die Gruppe der NSAR lässt sich nach Beubler (1) in zwei wesentliche Untergruppen unterteilen. • Saure, antiphlogistisch-antipyretische Analgetika, z.B. ASS, Diclofenac, etc. • Selektive COX-2 Hemmer, z.B. Celecoxib 5.5.1 Saure, antiphlogistisch-antipyretische Analgetika Acetylsalicylsäure (ASS) Abb. 12: Strukturfor mel Acetylsalicylsäure (http://de.wikipedia.org/wiki/Acetylsalicylsäure) 30 Wirkung: Die durch Veresterung von Salicylsäure mit Essigsäure entstehende Acetylsalicylsäure nimmt insofern eine Sonderstellung ein, daß sie beide COX- Isotypen als einziger Wirkstoff durch Acetylierung irreversibel hemmt und neben der analgetischen, antipyretischen und antiphlogistischen auch eine ausgeprägte thrombozytenaggregationshemmende Wirkung besitzt. Durch Hemmung der Cyclooxygenase wird sowohl die Synthese von proaggregatorisch wirksamen Thromboxan A 2 in den Blutplättchen als auch die Synthese von antiaggregatorisch wirksamen Prostazyklin in den Gefäßendothelzellen gehemmt (21). Da Thrombozyten keinen Zellkern mehr besitzen, um die für die Synthese von Thromboxan A 2 notwendige COX-1 regenerieren zu können, hält deren Unfähigkeit zur Aggregation mindestens 1 Woche bis 10 Tage an (entsprechend ihrer Lebensdauer), bis neue Thrombozyten herangereift sind, die ihrerseits wieder die COX-1 exprimieren (2). Indem Acetylsalicylsäure regelmäßig in geringer Dosis (50-100mg/ Tag) verabreicht wird, kann eine selektive Hemmung der Thromboxansynthese in den Blutplättchen bei unveränderter Prostazyklinproduktion in den Endothelzellen erfolgen (siehe Abb. 13). Diesen Effekt mach man sich heutzutage in der Herzinfarkt- und Schlaganfallprophylaxe zunutze (21). Abb. 13: Selektive Hemmung der Thrombox ansynthese (Qu in tessenz 200 9;6 0 (1 2):145 9–1464) Um eine ausreichende analgetische und antiphlogistische Wirkung zu erzielen, benötigt man hingegen eine höhere Dosis (ab 500mg), wodurch auch die Prostazyclinsynthese gehemmt wird und in weiterer Folge auch der aggregationshemmende Effekt einer eventuell gleichzeitig stattfindenden Prophylaxe verloren geht (21). 31 Pharmakokinetik: Nach peroraler Applikation erfolgt eine rasche nahezu vollständige Resorption aus dem Darm, wobei durch Abspaltung des Acetylrestes der Hauptmetabolit Salicylsäure entsteht. Diese wird anschließend in der Leber zu Ester-und Etherglucoroniden sowie zu Salicylursäure umgewandelt. ASS besitzt eine Plasmahalbwertszeit von ca. 15 Minuten, die ihres Hauptmetaboliten Salicylsäure liegt hingegen bei etwa zwei bis drei Stunden. Hauptausscheidungsorgan der ASS-Metaboliten ist die Niere (2). Indikationen: ASS (Handelsname Aspirin) wird vor allem zur Schmerzbehandlung akuter entzündlicher Schmerzen leichten bis mäßigen Ausmaßes verwendet u.a. bei Zahnschmerzen, aber auch zur Behandlung von Fieber und wie bereits zuvor erwähnt in niedriger Dosierung auch zur Thromboseprophylaxe. Nebenwirkungen: Insbesondere Mikroblutungen im Bereich des Gastrointestinaltraktes treten unter Anwendung von ASS häufiger auf als unter Behandlung mit anderen NSAR. Weiters häufig auftretende Nebenwirkungen sind u.a. Sodbrennen, Magenbeschwerden bis hin zur Entwicklung einer Gastritis. In einer Studie von Fries und Bruce (22) wurde die Verträglichkeit hinsichtlich schwerwiegender gastrointesinaler Beschwerden von ASS mit jener von Paracetamol und Ibuprofen verglichen und dabei wurde festgestellt, daß alle 3 Wirkstoffe in niedriger Dosierung annähernd gleich gut verträglich sind unter der Vorraussetzung, daß diese nicht untereinander oder mit Corticosteroiden kombiniert verabreicht werden. In diesem Fall würde nämlich das Risiko für Magenbeschwerden deutlich ansteigen. In besonders hoher Dosierung kann ASS auch Ohrensausen, Schwindel, Übelkeit und Erbrechen hervorrufen. Ulzerationen im Magen-Darm-Trakt, Leberund Nierenfunktionsstörungen sind unter Langzeitanwendung besonders hoher Dosen möglich, wenngleich auch selten (23). Zuletzt sei noch die Verlängerung der Blutungszeit zu erwähnen, die gerade in Hinblick auf die Durchführung oral-chirurgischer Eingriffe einer präoperativen Abklärung bedarf. 32 Kontraindikationen: zu den wichtigsten Kontraindikationen gehören u.a.: • Magen-Darm-Ulzera • Asthma Bronchiale: Durch Hemmung der COX und damit verbundenen Synthesehemmung von Prostaglandinen kommt es zu einer verstärkten Bildung von Leukotrienen, die ihrerseits eine starke brochokonstriktorische Wirkung besitzen. • Schwangerschaft (3. Trimenon): Hierbei besteht die Gefahr, daß der Ductus Botalli vorzeitig verschlossen wird. • Kinder: Insbesondere bei Kindern unter dem 12. Lebensjahr sollte ASS bei viralen fieberhaften Infekten nicht verordnet werden, da ein kausaler Zusammenhang zwischen der Einnahme von ASS mit dem sog. „Reye-Syndrom“ nicht zur Gänze ausgeschlossen werden kann (2). Dabei handelt es sich um eine seltene lebensbedrohliche Erkrankung, die mit einer fettigen Degeneration der Leber und einer Enzephalopathie einhergeht. • Schwere Leber-und Niereninsuffizienz • Orale Antikoagulantien: durch die gleichzeitige Einnahme von ASS mit Cumarinderivaten (z.B: Marcoumar) wird deren gerinnungshemmende Wirkung deutlich verstärkt. Anwendung und Dosierung: ASS kann als Monopräparat sowohl oral als auch intravenös verabreicht werden. Für die orale Applikation wird sie in Form von Tabletten, Brausetabletten, Kautabletten oder als Granulat zur Herstellung trinkbarer Lösungen angeboten (23). In Form eines Salzes, welches die Aminosäure D,L-Lysin enthält, stellt sie eine wasserlösliche und somit injizierbare Form dar (Handelsname Aspirin i.v.), deren Vorteil vor allem in einer größeren Wirkstärke im Vergleich zu den oralen Präparaten besteht (10). Sowohl die Tabletten als auch die intravenös applizierbare Form enthalten dabei jeweils 500mg Acetylsalicylsäure. Dementsprechend beträgt die Einzeldosis zur Schmerzbehandlung 500-1000mg bei einem Dosisintervall von 4-6 Stunden, die Tagesmaximaldosis von 3000mg sollte jedoch nicht überschritten werden. Zur Herzinfarkt- und Schlaganfallprophylaxe reichen 100mg täglich, welche in entsprechenden Tabletten (Thrombo ASS 100mg-Filmatabletten 33 oder HerzASS-ratiopharm 100mg Tabletten) auf dem Markt angeboten werden. CO-Medikation: Eine gleichzeitige Einnahme von ASS und schwach wirksamen Opioiden ist möglich, insbesondere dann wenn eine rasche Schmerzlinderung herbeigeführt werden soll. Kurzfristig angewendet, zeigt diese Kombination im allgemeinen eine gute Verträglichkeit, ohne nennenswerte Nebenwirkungen. Insbesondere bei Patienten, die ASS niedrig dosiert im Rahmen einer Prophylaxe erhalten, sollte auf die gleichzeitige Einnahme von Ibuprofen verzichtet werden, da Ibuprofen die Bindung von ASS an die Cyclooxygenase behindert und somit deren kardioprotektive Wirkung verloren geht. Anders verhält es sich hingegen mit anderen NSAR wie beispielsweise Paracetamol, Rofecoxib oder Diclofenac, deren gleichzeitige Einahme ohne nennenswerte Wechselwirkungen möglich ist. Diclofenac Abb. 14: Strukturfor mel Diclofenac (http://de.wikipedia.org/wiki/Diclofenac) Wirkung: Diclofenac, welches der Gruppe der Arylessigsäurederivate angehört, zeichnet sich insbesondere durch seine starke antiphlogistische Wirkung aus, was mit ein Grund dafür sein könnte, daß es weltweit zu den am häufigsten eingesetzten NSAR zählt. Seine Wirkung beruht wiederum auf Hemmung des Enzyms Cyclooxygenase, wobei die COX-2 etwa 18-fach stärker gehemmt wird als die COX-1 (10). Desweiteren greift Diclofenac auch in den Lipo- 34 xygenase-Stoffwechsel ein, wodurch die Bildung von Leukotrienen (= Entzündungsmediatoren) gehemmt wird. Pharmakokinetik: Nach der Resorption aus dem Gastrointestinaltrakt unterliegt Diclofenac einem relativ hohen „first-pass-Effekt“ in der Leber, sodaß die Bioverfügbarkeit lediglich bei etwa 60% liegt. Der Großteil der phenolischen Metaboliten entsteht in der Leber durch Hydroxylierung, Methylierung und in weiterer Folge durch Glucuronidierung (10). Diclofenac besitzt eine Plasmahalbwertszeit von ungefähr 90 Minuten. Die Ausscheidung erfolgt größtenteils über die Nieren (50-70%), zu einem geringeren Prozentsatz auch biliär. Indikationen: Aufgrund seiner ausgeprägten antiphlogistischen Wirkung ist Diclofenac sowohl bei akuten als auch chronischen Schmerzzuständen entzündlicher Genese indiziert, wobei es sich gerade zur Behandlung von Erkrankungen, die dem rheumatischen Formenkreis zuzuordnen sind, als äußerst wirksam erwiesen hat. Nebenwirkungen: Wie auch bei anderen NSAR betreffen die Nebenwirkungen häufig den Magen-Darmtrakt, wenngleich Blutungen bzw. Ulzerationen eher selten auftreten. Einer Studie von Moore et al. zufolge ist niedrig dosiertes Diclofenac (z.B. Diclofenac-Kalium 12,5mg) hinsichtlich der gastrointestinalen Verträglichkeit mit Ibuprofen durchaus vergleichbar. Es zeigte sich, daß die Patienten unter kurzfristiger Behandlung mit Diclofenac (75mg/d) bzw. mit Ibuprofen (1200mg/d) ein ähnliches gastrointestinales Nebenwirkungsprofil aufwiesen (10). Verglichen mit anderen NSAR geht die Einahme von Diclofenac häufig mit einem Anstieg der Transaminasen in der Leber einher. Auswirkungen auf das ZNS können sich unter anderem durch Schwindel, Benommenheit oder verstärkte Müdigkeit bemerkbar machen. Neuere Studien, u.a. die von Hippisley-Cox et al. (24) zeigen, daß nicht nur selektive COX-2 Hemmer (Rofecoxib) das Herzinfarktrisiko erhöhen, sondern auch NSAR wie Diclofenac und Ibuprofen. Kontraindikationen: Die Kontraindikationen von Diclofenac sind im wesentlichen mit jenen der ASS vergleichbar. Hinzu kommt, daß Diclofenac bei ent- 35 zündlichen Magen-Darm-Erkrankungen wie Mb. Crohn oder Colitis ulcerosa nicht angewendet werden sollte. Insbesondere bei intravenöser Applikation ist vor allem bei prädisponierten Patienten (z.B Asthmatikern) die Gefahr einer anaphylaktischen Reaktion besonders hoch und sollte aus diesem Grund vermieden werden. Anwendung und Dosierung: Diclofenac (bekanntester Handelsname Voltaren) steht in mehreren Applikationsformen zur Verfügung. Oral in Form von Dragees, Tabletten oder als Kapseln, parenteral als Injektionslösung, als Zäpfchen oder auch in Form eines Pflasters. Die jeweilige Einzeldosis beträgt dabei 12,5-25mg bei den rezeptfrei erhältlichen Analgetika (z.B. DiclofenacKalium) bzw. 50-100 mg bei den verschreibungspflichtigen Analgetika, wobei die jeweilige Tagesmaximaldosis von 75-150mg nicht überschritten werden sollte. Die Wirkdauer beträgt dabei jeweils 6-8 Stunden. Die Gesamtbehandlungsdauer richtet sich im wesentlichen nach der Symptomatik, sollte aber dennoch nur kurzfristig (wenige Tage) erfolgen. Dexibuprofen Abb. 15: Strukturfor mel von Ibupr ofen (oben) und Dexibuprofen (unten) (http.//www.a rzn eistoffe.n et) Dexibuprofen gehört zur Gruppe der Arylpropionsäure-Derivate. Es stellt das pharmakologisch wirksame rechtsdrehende S(+) Enantiomer des IbuprofenRazemats dar (1) und ist als solches auch in Reinform im Handel erhältlich 36 (z.B: Seractil). Bei Enantiomeren handelt es sich um chemische Verbindungen, die zwar dieselbe Summenformel aufweisen, sich jedoch in der räumlichen Anordnung bestimmter Molekülgruppen unterscheiden (2). Ibuprofen und Dexibuprofen verhalten sich sozusagen „spiegelbildlich“ zueinander. (siehe Abb. 15) Wirkung: Dexibuprofen hemmt als S-Enantiomer beide Cox-Isotypen bis zu 100 mal stärker als das entsprechende R-Enatiomer (2). Es wirkt dadurch analgetisch, antiphlogistisch, antipyretisch, wobei die analgetische Wirkung jene von ASS und Paracetamol übersteigt. In nur halber Dosierung weist Dexibuprofen die gleiche Wirksamkeit wie das Ibuprofen-Razemat auf (10). Pharmakokinetik: Nach oraler Applikation erfolgt eine nahezu vollständige und rasche Resorption in Magen und Dünndarm. Die Plasmahalbwertszeit liegt bei etwa 2 Stunden. Nach Umwandlung in seine Metaboliten in der Leber, erfolgt deren Ausscheidung zu etwa 90% über die Nieren. Nebenwirkungen: Im Vergleich zu anderen NSAR weisen sowohl Ibuprofen als auch Dexibuprofen das geringste Nebenwirkungsrisiko hinsichtlich schwerer gastrointestinaler Störungen auf (2). Studien haben gezweigt, daß Dexibuprofen in Bezug auf seine Verträglichkeit durchaus mit Paracetamol vergleichbar ist, jedoch deutlich besser verträglich ist als beispielsweise ASS (10). Gelegentlich kann die Einnahme mit Kopfschmerzen, Schwindel, Sodbrennen oder Übelkeit einhergehen. Kontraindikationen: Insbesondere bei allergischen Reaktionen nach Einnahme von ASS bzw. anderen NSAR in der Anamnese sollte auf Dexibuprofen als Schmerzmittel verzichtet werden. Aufgrund der Tatsache, daß Dexibuprofen in höherer Dosierung die kardioprotektive Wirkung von ASS aufhebt, sollte es bei Patienten, die diese prophylaktisch erhalten, möglichst vermieden werden. Ist die Einnahme dennoch indiziert, so sollte in jedem Fall die gleichzeitige Gabe beider Arzneimittel vermieden werden, dh. die Einnahme von Dexibuprofen sollte mindestens 2 Stunden nach ASS-Gabe erfolgen (10). Anwendung und Dosierung: Der Wirkstoff Dexibuprofen ist in Form von Filmtabletten im Handel erhältlich. Die in den Tabletten enthaltenen Dosie37 rungen reichen dabei von 200-400mg Dexibuprofen. Zu den bekanntesten Produkten gehören u.a. Seractil 300mg und Seractil forte 400mg. Die maximale Einzeldosis sollte 400mg, die Tagesmaximaldosis 1200 mg nicht überschreiten, dh. 3 mal täglich eine Tablette alle 6-8 Stunden. Es empfiehlt sich auch hier die Einnahme über einen kürzest möglichen Zeitraum (ca.3-4 Tage) vorzunehmen. Ibuprofen als Razemat wird ebenfalls oral in Form von Tabletten oder Dragees (z.B. Dolgit®) angeboten. Diese enthalten je nach Indikation zwischen 200 und 800mg Ibuprofen. Die Tagesmaximaldosis liegt bei 1200-2400mg. Naproxen Abb. 16: Strukturfor mel Naprox en (http://de.wikipedia.org/wiki/Naproxen ) Ebenfalls zur Gruppe der Arypropionsäurederivate gehörend, zeichnet sich Naproxen vor allem durch seine lange Wirkungsdauer von bis zu 12 Stunden aus. Im Vergleich zu anderen NSAR wirkt es zusätzlich spasmolytisch. Naproxen-Natrium 220mg (Handelsname Aleve), welches rezeptfrei im Handel erhältlich ist, enthält wie Dexibuprofen nur das S-Enantiomer. Dadurch ist es besonders gut wasserlöslich, wird schnell resorbiert und bietet dadurch einen raschen Wirkungseintritt. Die Plasmahalbwertszeit beträgt 1314 Stunden und die Ausscheidung erfolgt zu circa 95% renal. Naproxen im Rahmen der Selbstmedikation gilt allgemein als gut verträglich und weist ein ähnliches Nebenwirkungsprofil wie Ibuprofen auf. Vergangene Studienergebnisse, die Naproxen mit einem erhöhten kardialen Risiko in Zusammenhang brachten, wurden bereits mehrfach revidiert (10). 38 In einer Studie von Polat et al. (25) wurde die Wirksamkeit von präoperativ verabreichtem Naproxen-Na mit jener von Ibuprofen und Placebo verglichen. Dabei erhielten die Patienten jeweils eine Stunde vor Beginn der kieferorthopädischen Behandlung je eine Einzeldosis Naproxen-Na 550mg bzw. Ibuprofen 400mg oder Placebo. Im Anschluß an die Behandlung zeigte sich bei den Patienten, die Naproxen-Na erhielten eine signifikant geringere Schmerzwahrnehmung beispielsweise beim Zubeißen als bei jenen mit Ibuprofen behandelten Patienten. Naproxen wird in Tablettenform mit jeweils 250mg, 500mg oder 750mg verabreicht bzw. zur Selbstmedikation als rezeptfrei erhältliches NaproxenNatrium 220mg Filmtabletten. Man beginnt zunächst mit einer Einzeldosis von 500mg und reduziert diese in weiterer Folge auf 250mg alle 8 Stunden. Die empfohlene Tagesmaximaldosis sollte dabei 1250 mg nicht überschreiten. 5.5.2 Selektive COX-2 Hemmer Selektive COX-2 Hemmer, auch „Coxibe“ genannt, weisen ein deutlich höheres Sicherheitsprofil hinsichtlich gastrointestinaler Nebenwirkungen im Vergleich zu herkömmlichen NSAR auf. Ursache dafür ist die fehlende Hemmung der COX-1. Dennoch erfolgt auch die Einnahme von Coxiben nicht unbedingt nebenwirkungsfrei. Zu den am häufigsten mit Coxiben einhergehenden Nebenwirkungen werden u.a. Blutdruckanstieg , Flüssigkeitsretention und das Auftreten peripherer Ödeme genannt (2). Aufgrund des nicht zur Gänze unumstrittenen erhöhten kardiovaskulären Risikos in Assoziation mit der Langzeitanwendung von Coxiben, sollten diese bei bestehenden Herz-Kreislauf-Erkrankungen (Hypertonie, koronarer Herzkrankheit,etc.) nicht verwendet werden. Weitere Kontraindikationen stellen u.a. schwere Leberfunktionsstörungen (Kreatinin-Clearence < 30ml/min), Schwangerschaft sowie entzündliche Darmerkrankungen dar (10). Obwohl in diversen Studien keine eindeutig bessere Wirksamkeit von Coxiben gegenüber herkömmlichen NSAR (v.a. Ibuprofen) in der Behandlung akuter 39 Zahnschmerzen nachgewiesen werden konnte, so zeigten sie dennoch häufig eine längere Wirkungsdauer verglichen mit Ibuprofen (26). Dies wird auch durch eine weitere Studie von Stephen E. Daniels (27) nicht widerlegt, in der Valdecoxib (mittlerweile nicht mehr im Handel erhältlich) mit einer Kombination aus Oxycodon/Paracetamol nach zahnärztlichen Eingriffen verglichen wurde. Auch hier zeigte sich bei Valdecoxib eine längere Wirkdauer mit dem Vorteil eines längeren Dosisintervalls. Einen wichtigen Vertreter stellt Celecoxib (Handelsname Celebrex) dar. Dabei handelt es sich um ein Sulfonamidderivat, welches die COX-2 ca. 375 mal stärker hemmt als die COX-1 (2). Es besitzt eine Plasmahalbwertszeit von etwa 11 Stunden und wird vorwiegend biliär ausgeschieden. Die Applikation erfolgt oral in Form von Hartkapseln, wobei die Einzeldosis bei 100-200mg alle 12 Stunden liegt. Coxibe sollten generell in möglichst geringer Dosis und so kurz wie möglich eingenommen werden, um das kardiovaskuläre Risiko weitestgehend gering zu halten (1). 5.6 Nicht-saure antipyretische Analgetika Neben den NSAR stellen nicht-saure antipyretische Analgetika die zweite große Gruppe der Nicht-Opioide dar. Zu den wichtigsten Vertretern dieser Gruppe gehören Paracetamol und Metamizol. Obwohl der genaue Wirkmechanismus dieser Analgetika bis dato noch nicht eindeutig geklärt werden konnte, geht man heute davon aus, daß deren analgetische Wirkung auf einer Hemmung der Prostaglandinsynthese auf Rückenmarks- sowie zentralnervöser Ebene beruht. In der Peripherie hingegen bleibt die Prostaglandinsynthese weitgehend aufrecht, was mit ein Grund dafür ist, daß nicht-saure antipyretische Analgetika kaum entzündungshemmend wirken, aber auch entsprechende NSAR-typische Auswirkungen auf die Nieren, den Gastrointesinaltrakt und die Blutgerinnung fehlen. 40 Paracetamol Abb. 17: Strukturfor mel Paracetamol (http://de.wikipedia.org/wiki/Paracetamo l) Wirkung: Paracetamol, im engl. Sprachraum auch unter Acetaminophen bekannt, gehört zur Gruppe der Anilinderivate. Paracetamol selbst ist in therapeutischer Dosierung kein COX-Hemmer, dh. seine eigentliche Wirkung kommt erst durch Umwandlung in seinen aktiven Metaboliten 4-Aminophenol durch das ZNS- spezifische Enzym Fettsäureamidhydrolase (FAAH) zustande. 4-Aminophenol reagiert in weiterer Folge mit Arachidonsäure zu Arachidonoylaminphenol (AM-404), welches letztlich die Hemmung der Cyclooxygenasen 1 und 2 im ZNS bewirkt (2). Weiters wird vermutet, daß Paracetamol u.a. auch durch Eingriff in das Cannabinoidsystem analgetisch wirksam ist. AM-404 stellt ein Derivat des Endocannabinoids Anandamid dar. Durch AM-404 wird dessen Aufnahme in Nervenzellen blockiert, dh. es verbleibt im synaptischen Spalt und kann letztlich über Cannabinoidrezeptoren analgetisch wirksam werden (10). Paracetamol wirkt ausgesprochen gut antipyretisch, in etwas geringerem Ausmaß analgetisch, aber aufgrund der fehlenden peripheren COX-Hemmung kaum antiphlogistisch. Pharmakokinetik: Paracetamol wird nach oraler Gabe nahezu gänzlich aus dem GIT resorbiert. Daraufhin wird es in der Leber metabolisiert und in seine beiden Hauptmetaboliten Glucuronid und Sulfat übergeführt, die dann über die Nieren ausgeschieden werden. Nur ein geringer Teil des Wirkstoffes (< 4%) wird in der Leber zu dem hepatotoxisch wirksamen N-Acetylchinonimin oxidiert, welches aber unter Gabe therapeutischer Dosen durch Konjugation 41 mit Glutathion rasch inaktiviert wird (siehe Abb. 18). Die Plasmahalbwertszeit beträgt etwa 2½ Stunden. Abb. 18: Biotransformation und Elimination der Metaboliten (Qu in tessenz 200 9;6 0 (1 2):144 1–1451) Nebenwirkungen: Paracetamol gilt allgemein als gut verträgliches Arzneimittel. Lediglich bei Einzeldosen von > 10g, sowie bei Patienten mit schwerer Leberinsuffizienz steigt das Risiko von unter Umständen tödlich endenden Leberzellnekrosen. Ursache dafür stellen die unter diesen Bedingungen erschöpften Glutathionspeicher dar, welche dann nicht mehr in der Lage sind, das hoch reaktive lebertoxisch wirkende N-Acetylchinonimin zu neutralisieren. Durch dessen Reaktion mit Proteinen der Hepatozyten kommt es in weiterer Folge zu deren Untergang (28). Über eine unter Langzeitgabe möglicherwiese nierentoxische Wirkung liegen bis dato noch keine relevanten Daten vor. Anders verhält es sich hingegen mit der Annahme, daß unter Anwendung von Paracetamol ein erhöhtes Risiko für die Entwicklung von Asthma besteht. In einer Studie von Beasley et al. (29) ist man zu der Erkenntnis gelangt, daß Paracetamol in der Kindheit, v.a. aber im ersten Lebensjahr, eingenommen, das Risiko, im Kindesalter an Asthma zu erkranken, deutlich erhöht. Kontraindikationen: Im Gegensatz zu den NSAR kann Paracetamol sowohl während der Schwangerschaft als auch in der Stillzeit eingenommen werden. Vorsicht ist hingegen bei Patienten geboten, deren Leber beispielsweise durch 42 Alkoholabusus bereits geschädigt ist. Hier kann es unter Umständen bereits durch niedrigere Dosen zu lebensbedrohlichen Komplikationen kommen. Als weitere Kontraindikation ist die hämolytische Anämie durch Glucose-6Phosphat-Dehydrogenase-Mangel (sehr seltene Stoffwechselerkrankung) zu nennen. Anwendung und Dosierung: Das Anwendungsspektrum als Monopräparat reicht von Tabletten (bekanntester Handelsname: Mexalen), über Zäpfchen bis hin zu Infusionslösungen. Bei oraler Anwendung beträgt die Einzeldosis 500-1000mg alle 4-6 Stunden, wobei die maximale Tagesdosis von 4000mg nicht überschritten werden sollte. Bei Kindern erfolgt die Dosierung in Abhängigkeit von Alter und Gewicht, wobei die Einzeldosis 10-15mg/kg, die Tagesdosis 50mg/kg Körpergewicht nicht übersteigen sollte. Co-Medikation: Gerade aufgrund der äußerst schwach ausgeprägten entzündungshemmenden Wirkung empfiehlt sich eine Kombination mit einem NSAR in der Behandlung akuter postoperativer Schmerzen. In einer Studie von Rømsing et al. (30) zeigte sich eine deutlich bessere Schmerzlinderung unter Anwendung einer Kombination aus Paracetamol/NSAR als unter Anwendung von Paracetamol alleine. Umgekehrt zeigte sich jedoch keine eindeutige Wirkungsverbesserung eines NSAR unter Zugabe von Paracetamol. Auch eine Kombination mit einem Opioid erweist sich durchaus als sinnvoll, da, wie einige Studien bereits gezeigt haben, sich dadurch der analgetische Effekt signifikant verbessert (31). Metamizol Abb. 19: Strukturfor mel M etamizol (http://de.wikipedia.org/wiki/Metamizo l) 43 Neben Paracetamol stellt auch Metamizol einen wichtigen Vertreter der nichtsauren antipyretischen Analgetika dar, wobei es anders als Paracetamol den Pyrazol-Derivaten zugeordnet ist. Es zeichnet sich vor allem durch seine starke analgetische, antipyretische und spasmolytische Potenz aus, bei gleichzeitig gering ausgeprägter entzündungshemmender Eigenschaft. Ähnlich dem Paracetamol, sind auch hier die genauen Wirkmechanismen bis heute nicht eindeutig geklärt, wobei die Vermutung nahe liegt, daß es sowohl zentral als auch peripher wirksam ist. Nach einer Metaanalyse von Edwards et al. (32) ist die analgetische Wirkung von 500mg Metamizol in etwa mit jener von 400mg Ibuprofen oder 1g Paracetamol vergleichbar. Pharmakokinetik: Nach oraler Gabe erfolgt im Gastrointestinaltrakt die Umwandlung des Metamizols in seine wirksamen Metaboliten, u.a. 4- Methylaminophenazon, welches im Anschluß rasch resorbiert wird. Seine Halbwertszeit liegt bei etwa 2-5 Stunden und die Ausscheidung erfolgt größtenteils über die Nieren (2). Nebenwirkungen: Eine seltene, aber dennoch gefürchtete Nebenwirkung des Metamizols stellt die Agranulozytose dar. Hinsichtlich des Agranulozytoserisikos haben sich in der Vergangenheit deutliche regionale Unterschiede gezeigt, was dazu führte, daß in manchen Ländern wie beispielsweise Schweden, wo die Inzidenz sehr hoch lag, das Medikament bereits vom Markt genommen wurde (10). Mit 0,01% wird das Risiko in den westlichen mitteleuropäischen Ländern jedoch als gering eingestuft (2). Möglicherweise lassen sich diese geographischen Unterschiede teilweise in der Art der Anwendung, den unterschiedlichen Dosierungsrichtlinien, etc. erklären (33). Dennoch, obgleich dieses Risikos stellt Metamizol ein effektives Analgetikum dar und sollte gerade auch in der Zahnheilkunde stets als Reserveanalgetikum verfügbar bleiben (28). Im Falle einer längeren Anwendung empfiehlt sich in jedem Fall eine regelmäßige Blutbildkontrolle, da nach Absetzung des Medikaments die Agranulozytose rasch reversibel ist. Eine weitere wichtige Nebenwirkung, die v.a. mit einer parenteralen Gabe einhergehen kann, ist die anaphylaktische Reaktion. Um das Risiko einer solchen zu minimieren, ist es wichtig Metamizol langsam und fraktioniert zu verabreichen. 44 Kontraindikationen: Zu den wichtigsten Kontraindikationen zählen eine bestehende Schwangerschaft, insbesondere im 3. Trimenon (Gefahr des vorzeitigen Verschlusses des Ductus arteriosus Botalli), Asthma bronchiale, sowie Patienten mit Alkoholintoleranz. Letztere reagieren bereits auf geringe Alkoholmengen mit Niesen, Gesichtsrötung, etc., möglicherweise ein Hinweis auf ein bestehendes, bisher unerkannt gebliebenes Analgetika-Asthma-Syndrom (10). Wegen der Gefahr eines weiteren Blutdruckabfalles, ist besonders bei Patienten mit Blutdruckwerten unter 100mm Hg systolisch Vorsicht geboten. Anwendung und Dosierung: Die orale Applikation erfolgt zumeist in Tablettenform. Das wohl bekannteste Markenprodukt stellt hierbei Novalgin dar. Die Einzeldosis liegt bei 500-1000mg, die Tagesmaximaldosis bei 3000mg. Da bei Patienten mit Leber- Niereninsuffizienz die Elimination eingeschränkt sein kann, sollten hohe Dosen vermieden und die Therapiedauer kurz gehalten werden. 45 6 Diskussion Trotz der enormen Zahl an Nebenwirkungen, die die einzelnen Wirkstoffe teilweise mit sich bringen können, bleibt das Risiko in der Behandlung akuter Zahnschmerzen dennoch überschaubar, da die Einnahme der Analgetika in erster Linie oral erfolgt und lediglich auf wenige Tage bis zu einer Woche beschränkt ist. Dennoch dürfen diese keinesfalls außer Acht gelassen werden. Die zum Teil schwerwiegenden Nebenwirkungen im Bereich des GIT sind besonders auf die Hemmung der COX-1 zurückzuführen. Durch die verminderte Produktion des magenschleimhautschützenden Prostaglandins E 2, sind Erosionen bereits frühzeitig möglich. Studien zufolge zeigen sich deutliche Unterschiede hinsichtlich des gastrointestinalen Risikos zwischen den einzelnen Wirkstoffen. So scheint Ibuprofen mit Abstand das geringste Nebenwirkungsprofil im GIT zu haben, gefolgt von Diclofenac und Naproxen (34). Ältere Patienten, die gleichzeitig Corticosteroide einnehmen und/oder bereits Magen-Darmerkrankungen in ihrer Anamnese aufweisen, sollten in jedem Fall gleichzeitig Protonenpumpenhemmer (z.B. Pantoloc®)verordnet bekommen, um das gestörte Gleichgewicht der Magenschleimhaut durch Unterdrückung der Magensäureproduktion wiederherzustellen (35). Allenfalls kann in Erwägung gezogen werden, in solchen Fällen selektive COX-2 Hemmer einzusetzen, die wesentlich besser magenverträglich sind, aber dennoch aufgrund ihres erhöhten kardiovaskulären Risikos nur kurzfristig und in ihrer niedrigsten effektiven Dosis einsetzbar sind. Dennoch rücken nun auch immer mehr klassische NSAR ins Blickfeld rund um die Diskussion über die kardiotoxische Wirkung selektiver COX-2 Hemmer. Untersuchungen zufolge, zeigt vor allem Diclofenac ein Zunahme des Herzinfarktrisikos um ca. 44-55% (10). Unter allen NSAR scheinen Ibuprofen und Naproxen am sichersten, was kardiovaskuläre und gastrointestinale Komplikationen betrifft (34). 46 Hinsichtlich ihrer Effektivität in der Schmerzlinderung akuter postoperativer Zahnschmerzen zeigen sich, durch zahlreiche Studien bestätigt, teilweise deutliche Unterschiede zwischen den einzelnen Analgetika. Wie in der „Oxford League Table“, einer Rangliste von Analgetika zur Behandlung akuter Schmerzen, ersichtlich, zeigen traditionelle NSAR wie Ibuprofen, Diclofenac, Naproxen sowie selektive COX-2 Hemmer die besten Ergebnisse. Diese sind hinsichtlich ihrer Wirksamkeit sowohl dem Aspirin als auch dem Paracetamol deutlich überlegen. Die in Abb. 20 dargestellte NNT (= number needed to treat) beschreibt dabei die jeweilige analgetische Wirksamkeit. Potente Analgetika besitzen eine niedrige NNT. Eine NNT von 2 bedeutet, daß die Hälfte der behandelten Patienten zumindest eine Schmerzlinderung von 50% gegenüber Placebo über einen Behandlungszeitraum von 4-6 Stunden erfahren. Abb. 20: Ox ford Leag ue Table (http://www.medicine.ox.ac.uk) Ein weiterer Unterschied besteht in den unterschiedlichen Halbwertszeiten der einzelnen Substanzen. Je länger die HWZ, desto später der Wirkungseintritt. Grundsätzlich sollte zu Beginn der Therapie ein Analgetikum mit kurzer HWZ in höherer Dosierung verabreicht werden, um einen raschen Wirkungseintritt und eine möglichst lange Wirkdauer zu erzielen (34). 47 In Anlehnung daran, finden sich in der Literatur immer häufiger Empfehlungen, die Effektivität der Analgetika dadurch zu erhöhen, indem sie bereits präoperativ verabreicht werden. Daraus ergibt sich der Vorteil, schon frühzeitig hemmend in die Prostaglandinsynthese einzugreifen und nicht erst zu einem Zeitpunkt, wo sie bereits entstanden sind und Entzündungsschmerzen verursachen. Gleichzeitig könnte dadurch auch der Bedarf an postoperativer Analgetikagabe sinken (36). Eine weitere Möglichkeit besteht auch darin, zu Beginn die doppelte Einzeldosis zu verabreichen, um möglichst rasch eine optimale analgetische Wirkung zu erzielen und darauffolgend die weiteren Dosen zu minimieren (37). Diese Maßnahmen tragen letztlich dazu bei, das Nebenwirkungsrisiko gering zu halten. Obwohl Paracetamol Untersuchungen zufolge einen deutlich stärker schmerzlindernden Effekt nach Weisheitszahnentfernungen gegenüber Placebo zeigt, ist dessen Einsatz in der Zahnheilkunde vor allem aufgrund der fehlenden entzündungshemmenden Wirkung, nach wie vor limitiert. Dennoch stellt es das Mittel der Wahl sowohl in der Behandlung von Schwangeren als auch bei Vorliegen von Kontraindikationen gegenüber NSAR dar. Abgesehen davon haben zahlreiche Studien gezeigt, daß die Kombination von Paracetamol mit klassischen NSAR (v.a Ibuprofen) zu einer Wirkungsverstärkung beider Substanzen geführt hat. Opioide finden in der Therapie postoperativer Schmerzen nach wie vor kaum Anwendung, da in der Regel NSAR zumeist ausreichend wirksam sind. Sollte sich die Behandlung durch alleinige Gabe von NSAR dennoch als insuffizient herausstellen, so sollte als erstes eine Kombination mit nicht-sauren antipyretischen Analgetika wie Paracetamol oder Metamizol erfolgen und erst dann auf schwach wirksame Opioide wie z.B. Tramadol zurückgegriffen werden (20). Dennoch sollten diese nie als alleinige Schmerzmittel verwendet werden, sondern lediglich in Kombination mit Nicht-Opioiden, mit dem Ziel deren analgetische Wirkung, nicht aber deren Nebenwirkungen zu verstärken. Vor allem Kombinationen von Opioiden mit Ibuprofen und Paracetamol erweisen sich in der Behandlung postoperativer Zahnschmerzen als äußerst effektiv. Ein kürzlich in den USA veröffentlichter Artikel zeigte, daß etwa 85% der Oral- und Kieferchirurgen Kombinationen aus Opioid- mit Nicht-Opioid48 Analgetika nach Extraktion impaktierter Zähne verschreiben (38). Dabei gilt es, wie in der Literatur beschrieben, stets Kombinationen von Wirkstoffen mit annähernd gleicher Wirkdauer zu verwenden, um den bestmöglichen analgetischen Effekt für den Patienten zu erzielen (1). Da alle Hemmstoffe der COX-1, u.a. auch NSAR, negativen Einfluß auf die Thrombozytenaggregation aufweisen, ist deren Einnahme unweigerlich mit einem erhöhten Blutungsrisiko verbunden. Dies gilt es vor allem vor geplanten oral-chirurgischen Eingriffen zu bedenken. Gegebenenfalls macht dies eine präoperative Abklärung durch Bestimmung der Blutungzeit notwendig. Mehr Sicherheit bieten diesbezüglich selektive COX-2 Hemmstoffe wie z.B. Celecoxib (39). Der Einsatz von, zum Teil rezeptfrei erhältlichen, Kombinationspräparaten in der Zahnheilkunde ist nach wie vor umstritten, da die Konzentrationen der einzelnen Wirkstoffe oft zu gering sind, um eine ausreichende analgetische Wirkung zu erzielen. Gerade fixe Kombinationen mit Coffein werden in der Literatur unterschiedlich bewertet. So wird u.a. davon ausgegangen, daß Coffein aufgrund seiner zentralen Wirkung möglicherweise dazu führt, daß solche Medikamente über das normale Maß hinaus eingenommen werden und so letztlich zu einer Abhängigkeitsentwicklung und damit verbunden zu Mißbrauch führen (1). Andererseits findet man in diversen Studien aber auch durchwegs positive Aspekte des Koffeins. So wurde beispielsweise in einer dieser Studien die Wirksamkeit einer Kombination aus Paracetamol 1000mg/Koffein 130mg mit jener von Paracetamol 1000mg alleine und Placebo nach operativer Weisheitszahnentfernung verglichen, mit dem Ergebnis, daß die Kombination die beste Schmerzlinderung hervorrief (40). Eine endgültige Bewertung von Kombinationspräparaten hinsichtlich ihres NutzenRisiko-Verhältnisses ist demnach noch nicht zur Gänze möglich (2). Nicht-Opioide stellen in der Therapie akuter entzündlicher, sowie postoperativer Schmerzen nach wie die Mittel der 1. Wahl dar. Gerade in der Verordnung als Monopräparate gelten sie bei ordnungsgemäßer und vor allem kurzfristiger Anwendung als äußerst sicher. Dosierungsempfehlungen der einzelnen Analgetika sind nochmals in Tabelle 1 zusammengefaßt. 49 Tabelle 1: Dosierung sempfehlung en und K enndaten der Analgetika (Qu in tessenz 200 6;5 7 (9 ):941–945) 50 7 Literaturverzeichnis 1 Beubler E.; Kompendium der medikamentösen Schmerztherapie; 3.Auflage; Springer-Verlag Wien 2006 2 Mutschler E.; Arzneimittelwirkungen. Lehrbuch der Pharmakologie und Toxikologie; 9. Auflage; WVG Stuttgart 2008 3 International Association for the Study of Pain; Global Year Against Pain in women; www.iasp-pain.org; 2007 4 Deutsche Gesellschaft zum Studium des Schmerzes; Frauen und Schmerz „Global Day against Pain" 2007 am 15. Oktober; Pressemitteilung der Deutschen Gesellschaft zum Studium des Schmerzes vom 05.10.2007; 2007 5 International Association for the Study of Pain; Global Year Against Pain in women; Fact-Sheet: Differences in pain between women and men; www.iasp-pain.org; 2007 6 International Association for the Study of Pain; Global Year Against Pain in women; Fact-Sheet: Gender and the brain in pain; www.iasppain.org; 2007 7 International Association for the Study of Pain; Global Year Against Pain in women; Fact-Sheet: Sex hormones and pain; www.iasp-pain.org; 2007 8 International Association for the Study of Pain; Global Year Against Pain in women; Fact-Sheet: Epidemiology of pain in women; www.iasppain.org; 2007 9 Vargas-Schaffer G.; Ist the WHO analgesic ladder still valid? 24 years of experience; Canadian Family Physician; 56(6); 514-517; Juni 2010 10 Bastigkeit M.; Analgetische Arzneistoffe; Pharmakologie und Anwendung; Govi-Verlag; 2008 51 11 Porter J., Jick H.; Addiction rare in patients treated with narcotics; The New England Journal of Medicine; 302 (2); 123; 1980 12 Adams E. H., Breiner S., Cicero T. J., Geller A., Inciardi J. A., Schnoll S. H., Senay E. C., Woody G. E.; A comparison of the Abuse Liability of Tramadol, NSAIDs, and Hydrocodone in Patients with Chronic Pain; Journal of Pain and Symptome Management; 31 (5); 465-476; 2006 13 Becker D. E., Phero J. C.; Drug Therapy in dental practice: Nonopioid and Opioid Analgesics; Anesthesia Progress; 52(4); 140-149; 2005 14 Lemmer B., Brune K.; Pharmakotherapie; klinische Pharmakologie; 14.Auflage; Springer-Verlag; 2010 15 Dahan A., Yassen A., Romberg R., Sarton E., Teppema L., Olofsen E., Danhof M.; Buprenorphin induces ceiling in respiratory depression but not in analgesia; British Journal of Anaesthesia; 96 (5); 627-632; 2006 16 Mehlisch D. R.; The efficacy of combination analgesic therapy in revieling dental pain; The Journal of the American Dental Association; 133 (7); 861-871; July 2002 17 Wirz S., Wartenberg H.-C., Wittmann M., Nadstawek J.; Post-operative pain therapy with controlled release oxycodone or controlled release tramadole following orthopedic surgery: A prospective, randomized, double-blind investigation; The Pain Clinic; 17(4); 367-376; 2005 18 http://www.schmerznetz.at/view.php?datID=1121 - top 19 Medve R. A., Wang J., Karim R.; Tramadol and Acetaminophen tablets for dental pain; Anesthesia Progress; 48 (3); 79-81; 2001 20 Nickel U.; Analgetika in der zahnärztlichen Praxis; Quintessenz; 57 (9); 941-945; 2006 21 Ziegler A.; Acetylsalicylsäure: Hemmung der Thrombozytenaggregation; Konsequenzen für die zahnärztliche Praxis?; Quintessenz; 60 (12); 14591464; 2009 52 22 Fries J. F., Bruce B.; Rates of serious gastrointestinal events from low dose use of acetylsalicylic acid, acetaminophen, and ibuprofen in patients with osteoarthritis and rheumatoid arthritis; The Journal of Rheumatology; 30 (10); 2226-2233; 2003 23 Beubler E.; Kompendium der Pharmakologie; 2.Auflage; Springer-Verlag Wien; 2007 24 Hippisley-Cox J., Coupland C.; Risk of myocardial infarction in patients taking cyclo-oxygenase-2 inhibitors or conventional non-steroidal antiinflammatory drugs: population based nested case-control analysis; BMJ; 330 (7504); 2005 25 Polat O., Karaman AI., Durmus E.; Effects of preoperative ibuprofen and naproxen sodium on orthodontic pain; The Angle Orthodontist; 75(5); 791-796; 2005 26 Huber M. A., Terezhalmy G. T.; The use of COX-2 inhibitors for acute dental pain, a sekond look; JADA; 137 (4); 480-487; 2006 27 Daniels S. E., Desjardins P. J., Talwalker S., Recker D. P., Verburg K. M.; The analgesic efficacy of valdecoxib vs. oxycodone/acetaminophen after oral surgery; JADA; 133; 2002 28 Ziegler A.; Die Analgetika in der Zahnmedizin; Quintessenz; 60 (12); 1441-1451; 2009 29 Beasley R., Clayton T., Crane J., von Mutius E., Lai CK., Montefort S., Stewart A.; Association between paracetamol use in infancy and childhood, and risk of asthma, rhinoconjunctivitis, and eczema in children aged 6—7 years: analysis from Phase Three of the ISAAC programme; The Lancet; 372 (9643); 1039-1048; 2008 30 Rømsing J., Møiniche S., Dahl J. B.; Rectal and parenteral paracetamol, and paracetamol in combination with NSAIDs, for postoperative analgesia; British Journal of Anaesthesia; 88 (2); 215-226; 2002 53 31 Craen A. J., Di Giulio G., Lampe-Schoenmaeckers J. E., Kessels A. G., Kleijnen J.; Analgesic efficacy and safety of paracetamol-codeine combinations versus paracetamol alone: a systematic review; BMJ; 313 (7053); 321-325; 1996 32 Edwards JE., Meseguer F., Faura CC., Moore RA., McQuay HJ.; Singledose dipyrone for acute postoperative pain; Cochrane Database Syst Rev.; 2001 33 Ibáñez L., Vidal X., Ballarín E., Laporte JR.; Agranulocytosis associated with dipyrone (metamizol); European Journal of clinical Pharmacology; 60 (11); 821-829; 2005 34 Ong C. K. S., Seymour R. A.; An evidence-based update of the use of analgesics in dentistry; Periodontology 2000; Vol.46; 143-164; 2008 35 Herdegen T.; Der sichere Umgang mit Analgetika-Teil 2, Nutzen und Risiko von nicht-steroidalen Analgetika (NSA); http://www.zmkaktuell.de/zahnheilkunde/allgemeine-zahnmedizin/story/der-sichereumgang-mit-analgetika-teil-2.html; 2011 36 Haas D. A.; An Update on Analgesics for the Management of Acute Postoperative Dental Pain; Journal of the Canadian Dental Association; 68 (8); 476-482; 2002 37 Kermalli J., Tenenbaum H. C.; Prevention And Management Of Acute Orofacial Pain; Treating The Whole Spectrum; Oral Health Journal; 2008 38 Hersh E. V., Golubic S., Moore P. A.; Analgesic Update: Tapentadol Hydrochloride; http://cde.dentalaegis.com/courses/4465; 2011 39 Herdegen T.; Der sichere Umgang mit Analgetika-Teil 3, Nutzen und Risiko von nicht-steroidalen Analgetika (NSA); http://www.zmkaktuell.de/zahnheilkunde/allgemeine-zahnmedizin/story/der-sichereumgang-mit-analgetika-teil-3.html; 2011 54 40 Wynn R. L.; Analgesics in dentistry; CME Resource; 2011 55 8 Abbildungsverzeichnis Abb. 1: Übersicht der nozizeptiven Reizleitung zum Gehirn Schmidt, Thews: Physiologie des Menschen Abb. 2: Skalen zur Schmerzmessung Beubler: Kompendium der medikamentösen Schmerztherapie Abb. 3: WHO Stufenschema http://www.medizinfo.de/schmerz Abb. 4: Wirkmechanismus von Opioiden auf Rückenmarksebene Mutschler: Arzneimittelwirkungen - Lehrbuch der Pharmakologie und Toxikologie Abb. 5: Strukturformel Morphin http://de.wikipedia.org/wiki/Morphin Abb. 6: Strukturformel Buprenorphin http://de.wikipedia.org/wiki/Buprenorphin Abb. 7: Strukturformel Tramadol http://de.wikipedia.org/wiki/Tramadol Abb. 8: Dauer bis zum Einsetzen der Wirkung Medve et al., Anesth Prog 48:79-81 2001 Abb. 9: Dauer der Wirkung Medve et al., Anesth Prog 48:79-81 2001 Abb. 10: Beeinflussung der Prostaglandineffekte durch Prostaglandinsynthesehemmung Mutschler: Arzneimittelwirkungen - Lehrbuch der Pharmakologie und Toxikologie 56 Abb. 11: Funktionen der COX-1 und COX-2 Isotypen Mutschler: Arzneimittelwirkungen - Lehrbuch der Pharmakologie und Toxikologie Abb. 12: Strukturformel Acetylsalicylsäure http://de.wikipedia.org/wiki/Acetylsalicylsäure Abb. 13: Selektive Hemmung der Thromboxansynthese Quintessenz 2009;60(12):1459–1464 Abb. 14: Strukturformel Diclofenac http://de.wikipedia.org/wiki/Diclofenac Abb. 15: Strukturformel von Ibuprofen (oben) und Dexibuprofen (unten) http.//www.arzneistoffe.net Abb. 16: Strukturformel Naproxen http://de.wikipedia.org/wiki/Naproxen Abb. 17: Strukturformel Paracetamol http://de.wikipedia.org/wiki/Paracetamol Abb. 18: Biotransformation und Elimination der Metaboliten Quintessenz 2009;60(12):1441–1451 Abb. 19: Strukturformel Metamizol http://de.wikipedia.org/wiki/Metamizol Abb. 20: Oxford League Table http://www.medicine.ox.ac.uk Tabelle 1: Dosierungsempfehlungen und Kenndaten der Analgetika Quintessenz 2006;57(9):941–945 57