Signalwege und neuartige Therapieansätze für hämatologische
Werbung

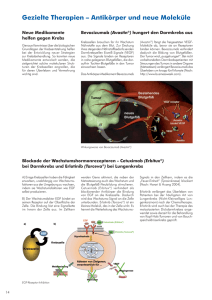
Signalwege und neuartige Therapieansätze für hämatologische Anomalien Einleitung Leukämie ist ein Krebs der weissen Blutzellen, welche Teil des Immunsystems sind und im Knochenmark produziert werden. Im genetischen Material von Krebspatienten wurden mehrere Veränderungen identifiziert, wie zum Bespiel der Verlust oder die Duplizierung von Genen, sowie der Austausch von genetischem Material zwischen verschiedenen Chromosomen (sogenannte Translokationen). Diese genetischen Veränderungen resultieren in der Produktion von funktionell veränderten Proteinen. Das Labor von Oliver Hantschel interessiert sich hierbei für ein bestimmtes Protein, Bcr-Abl, welches in Folge einer chromosomalen Translokation in bestimmten Leukämieformen hergestellt wird. Hierbei ist es wichtig zu wissen, dass Bcr-Abl in zwei verschiedenen Grössen bzw. Isoformen vorkommt: Die längere Form (p210) ist ursächlich für die chronische myeloische Leukämie, während die kürzere Form (p190) ausschliesslich in der B-Zell akuten lymphoblastischen Leukämie auftritt. Letztere ist eine sehr aggressive Form der Leukämie, die schwierig zu therapieren ist und oftmals innerhalb weniger Monate zum Tod von Patienten führt. Es ist derzeit nicht bekannt, welche molekularen Mechanismen den Unterschied zwischen den beiden Isoformen ausmachen. Zudem ist es wichtig, neue und effektive Therapieansätzen für die B-Zell akut lymphoblastische Leukämie zu entwickeln. Ergebnisse Das Labor von Oliver Hantschel verwendete verschiedene Techniken der Proteomik, um die molekularen Unterschiede zwischen den beiden Bcr-Abl Isoformen besser zu verstehen. Proteomik ist ein innovatives Forschungsfeld basierend auf der Massenspektrometrie, welche die Analyse des ganzen Proteingehalts eines Organismus, genannt Proteom, erlaubt. In Zellen, die BcrAbl herstellen, wurden insbesondere zwei Aspekte des Proteoms untersucht: Zunächst wurde überprüft, ob p210 und p190 mit unterschiedlichen Proteinen in der Zelle interagieren und des Weiteren wurde dann nach Veränderungen des Phosphoproteoms gesucht. Für die Analyse des Phosphoproteoms betrachtet man kleine chemische Veränderungen der Proteine in Form einer Phosphatgruppe. Diese Veränderung der Proteine ist von zentraler Bedeutung, da sie von Krebszellen häufig genutzt wird, um Signalwege zu aktivieren, die dann unbegrenzte Zellvermehrung ermöglichen und den Zelltod verhindern. Obwohl die beiden Bcr-Abl Isoformen einander sehr ähnlich sind, zeigten sie starke Unterschiede in der Proteomanalyse. Mehr als ein Duzend interagierender Proteine, sowie mehr als 100 Phosphatgruppen wurden eindeutig der einen oder anderen Bcr-Abl Isoform zugeordnet. Diese starken Unterschiede zwischen den Interaktionen und Aktivierungen verschiedener Signalwege könnten erklären, wie die jeweiligen Isoformen ein unterschiedliches Krankheitsbild hervorrufen. Zudem erlauben die Ergebnisse eine effizientere und effektivere zielgerichtete Therapie von Bcr-Abl-abhängigen Signalwegen in Leukämiepatienten. Generell können diese Experimente auch für andere Krebsformen angewendet werden, um einen detaillierteren Einblick in die Signalwege der Krebszelle zu erhalten. Sina Reckel, Romain Hamelin, Sandrine Georgeon, Florence Armand, Qinfang Jolliet, Diego Chiappe, Marc Moniatte, Oliver Hantschel. Differential signaling networks of Bcr-Abl p210 and p190 kinases in leukemia cells defined by functional proteomics. Leukemia 23 January 2017. DOI: 10.1038/leu.2017.36 Abbildungstext Darstellung der unterschiedlichen Signalwege der beiden Bcr-Abl Isoformen.