versuc~1
Werbung

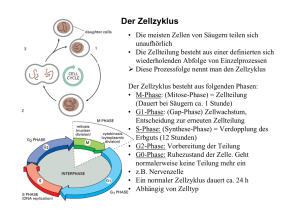
Versuch 9 „Immunfluoreszenzfärbung“ Protokollant: E-mail: Studiengang: Gruppen-Nr: Semester: Betreuer: Wird benotet?: Max Mustermann [email protected] X X X JP Dr. Gehrig & S. Lemcke Einleitung Ziel des Versuches ist die Fluoreszenzfärbung von Mikrotubuli und DNA in glatten Gefäßmuskelzellen. Die Färbung der Mikrotubuli erfolgt durch Immunfluoreszenzfärbung, die DNA wird mit dem interkalierenden Fluoreszenzfarbstoff DAPI gefärbt. Die gefärbten Zellen wurden vorher entweder mit Nocodazol, mit Taxol oder gar nicht behandelt (Kontrolle). Fluoreszenzmikroskopie Bei der Fluoreszenzmikroskopie werden Zellbestandteile mit fluoreszierenden Farbstoffen markiert und so sichtbar gemacht. Die Färbung geschieht meist mittels direkter oder indirekter Immunfluoreszenzfärbung. Bei der direkten Immunfluoreszenzfärbung bindet ein, für den zu färbenden Zellbestandteil (Antigen) spezifischer, fluoreszenzmarkierter Antikörper (ein mit einem Fluorophor verknüpftes Immunglobulin) direkt an das Antigen der Zelle. Bei der meist verwendeten indirekten Immunfluoreszenzfärbung bindet der fluoreszenzmarkierte Antikörper (Sekundärantikörper) nicht direkt an das Antigen, sondern an einen unmarkierten Primärantikörper, welcher für das Antigen spezifisch ist. Die Methode der indirekten Färbung erlaubt mehr Flexibilität, da eine Vielzahl von Primärantikörpern mit den gleichen markierten Sekundärantikörpern kombiniert werden können, was eine Kostenersparnis mit sich bringt. Ausserdem ist diese Methode um ein Vielfaches empfindlicher, da mehrere Sekundärantikörper mit den verschiedenen Epitopen des Primärantikörpers reagieren können. Ist die Behandlung mit den Fluorenszenzfarbstoffen erfolgt wird die Zelle mit Licht bestrahlt, welches die Fluorophore absorbieren und kurz darauf (im Femtosekundenbereich) in einer für sie spezifischen Wellenlänge (die länger ist die des absorbierten Lichts) wieder emittieren. Mit Fluoreszenzmikroskopen kann die behandelte Probe mit Licht der benötigten Wellenlänge bestrahlt werden und das emittierte Licht gleichzeitig beobachtet werden. Material und Methoden Der Versuch wurde nach Versuchsanleitung durchgeführt. Diese und die verwendeten Reagenzien sind auf den Seiten 42 – 44 im Skript zu finden. Ergebnisse Vascular-smooth-muscle-cell (VSMC) aus der Kontrollgruppe Vergr. 100x; Balken = 10 µm − α-Tubulin gefärbt mit Cy3 in rot − Nucleus gefärbt mit DAPI in blau Bild 1 ___________________________________________________________________ VSMC behandelt mit Nocodazol Bild 2 − α-Tubulin gefärbt mit Cy3 in rot − Nucleus gefärbt mit DAPI in blau Bild 3 VSMC behandelt mit Taxol Bild 4 Bild 5 − α-Tubulin gefärbt mit Cy3 in rot − Nucleus gefärbt mit DAPI in blau ___________________________________________________________________ Vergleicht man die Kontrollzellen mit denen, die mit Nocodazol oder Taxol behandelt wurden, kann man sehen, dass - die mit Taxol behandelten Zellen eine sehr längliche, schmale Form haben. - bei den mit Taxol behandelten Zellen der Zellkern dadurch teilweise sehr eingeengt ist. - die unbehandelten Kontrollzellen und die mit Nocodazol behandelten Zellen breiter sind als die mit Taxol behandelten. - bei den mit Taxol behandelten Zellen insgesamt, jedoch speziell in der Peripherie des Zellkerns, im Vergleich zu Kontroll- und Nocodazolgruppe eine höhere Dichte von α-Tubulin zu erkennen ist. - bei den mit Nocodazol behandelten Zellen auch im Vergleich zu den Kontrollzellen eine geringere Dichte an α-Tubulin (nur vereinzelte Stränge) zu erkennen ist. Diskussion der Ergebnisse Das Zytoskellet ist für Tierzellen, die keine Zellwände besitzen, besonders wichtig. Das Gerüst, welches sich aus drei Proteinfilamenttypen zusammensetzt, repräsentiert nicht nur die „Knochen“ sondern auch die „Muskeln“ der Zelle. Die drei Filamenttypen sind die Intermediärfilamente (oft aus Vimentin), Mikrofilamente (aus Actin) und die Mikrotubuli (aus Tubulin). Mikrotubuli haben in Zellen mehrere Aufgaben. Sie bilden innerhalb der Zelle ein Schienensystem für Vesikel, Organellen und andere Zellkomponenten. Somit legen sie weitgehend die Lage der membranumhüllten Organellen in der Zelle fest und lenken den intrazellulären Transport. In der M-Phase der Mitose bilden Mikrotubuli die Mitosespindel aus und sind so essentiell für die Zellteilung. Mikrotubuli als Axonem angeordnet können auch zur Fortbewegung ganzer Zellen oder zur Bewegung von Flüssigkeiten über Zelloberflächen dienen. Mikrotubuli sind auch zu einem Großteil an der Gestalt und Stabilität (Druckresistenz) von Zellen beteiligt. Die Mikrotubuli des Zytoskeletts sind keine statischen Strukturen, sondern werden laufend auf- und abgebaut und neu umorganisiert. Dieses Charakteristikum der Mikrotubuli nennt man dynamische Instabilität. Wenn die Untereinheiten, Dimere bestehend aus den globulären Proteinen α- und β-Tubulin, sich an wachsende Mikrotubuli addieren, haben sie GTP gebunden. Gebundenes GTP verleiht den Dimeren eine hohe Affinität zu anderen Tubulin Dimeren. Wird das GTP allerdings zu GDP hydrolysiert verringert sich die Affinität der Untereinheiten zueinander stark. Findet die Hydrolyse von GTP am Plus-Ende des Mikrotubulus statt, kann dies den Zerfall dessen in seine Untereinheiten bewirken. Um sich erneut an einen wachsenden Mikrotubulus oder das Centrosom zu lagern, müssen die Dimere die frei im Cytosol vorliegen, ihr GDP gegen GTP austauschen um wieder polymerisationsfähig zu werden. Nocodazol verhindert das. ___________________________________________________________________ Nocodazol ist das künstliche Äquivalent zum Colchizin, dem Gift der Herbstzeitlose. Es lagert sich an die „exchange site“ des Tubulin Dimers und verhindert so den Austausch von GDP gegen GTP. Am Bild 2 sieht man, dass in der Tat die mit Nocodazol behandelte Zelle eine im Vergleich zur Kontrollgruppe niedrigere Dichte an Mikrotubuli aufweist. Nur einzelne Stränge, die wahrscheinlich durch Proteine stabilisiert sind, befinden sich im polymerisierten Zustand (Ausschnitt Bild 3). ___________________________________________________________________ Taxol ist das Gift der pazifischen Eibe. Es wirkt im Gegensatz zu Nocodazol oder Colchizin bei Bindung an Mikrotubuli stabilisierend auf diese. Die Mikrotubuli können dann nicht mehr depolymerisieren, sondern sich nur noch verlängern. Dies sieht man gut an Bild 4 und 5. Die Zellen sind hier unnatürlich langgestreckt (Kontrollzellen sind breiter), sodass sogar einmal der Zellkern eingequetscht wird (Bild 4). Der Grund für die Streckung der Zellen ist, wie oben genannt, dass die Mikrotubuli bei Behandlung mit Taxol nur noch wachsen können. Dies haben die Mikrotubuli auch Taxol getan und haben sich solange verlängert bis die Zelle sich nicht mehr mit verlängern konnte. Der daraus resultierende Endzustand ist auf Bild 4 und 5 zu sehen. Mitosestadien Nocodazol und Taxol sind beide Spindelgifte. Beide sind für Zellen tödlich und verhindern die Zellteilung. Somit stammen Bilder zu den Mitosestadien von der Kontrollgruppe. Die Bilder zeigen in schwarz-weiß nur die DNA, die mit DAPI angefärbt worden ist. Minus Cy3 Bild 6 Bild 7 Zeitliche Abfolge der Bilder Bild 8 Bild 11 Bild 9 Bild 10 1. In Bild 8 sieht man den Zellkern während der Prophase. In der Prophase kondensieren die replizierten Chromosomen, die auf dem Bild als ineinander verworrene dicke Linien zu erkennen sind 2. In Bild 9 beginnen sich die nun fertig kondensierten Chromosomen in der Äquatorialebene der Zelle anzuordnen. Zuvor ist der Zellkern in Bruchstücke zerfallen und hat die DNA ins Zytosol freigegeben. Die Zelle befand sich wahrscheinlich in der Metaphase. 3. In Bild 10 sind die Chromosomen schon weiter von der Äquatorialebene entfernt als ein Bild zuvor. Der Spindelapparat zieht nun die Tochterchromosomen zu den Zellpolen. Beginnende Anaphase. 4. Auf Bild 11 sind die Chromosomen schon in der Nähe der Zellpole. Telophase und Cytokinese. 5. Bild 7 könnte den Zustand darstellen der auf Bild 11 folgen würde. Die Cytokinese, der letzte Teil der M-Phase, ist vorüber und die DNA liegt unkondensiert in den Zellkernen der jetzt eigenständigen Zellen vor, wo sie erneut repliziert wird. In diesem Zustand, der Interphase genannt wird, verbringt die Zelle über 90% der Zeit. Quellen -Skript zum Biochemischen Grundpraktikum, Institut für Biochemie, J.-G.-Universität-Mainz -Biochemie, Stryer, Spektrum 1994 (2. durchgesehene Auflage) -Lehrbuch der molekularen Zellbiologie, Alberts, Wiley-VCH, 2001 (2. korrigierte Auflage) http://www.med-rz.uni-sb.de/med_fak/humangenetik/skripte/skriptgrundpraktikumbioinformatik.pdf http://pharm1.pharmazie.uni-greifswald.de/systematik/6_droge/taxol.htm