Verdopplung der Centrosomen
Werbung
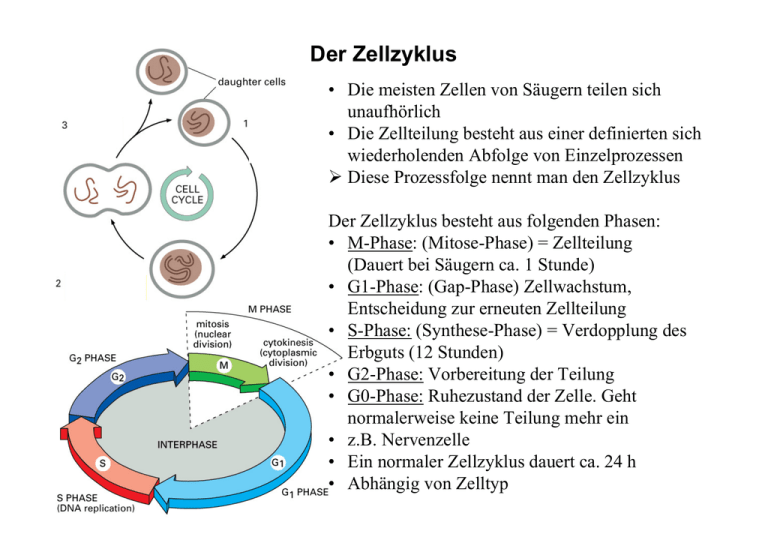
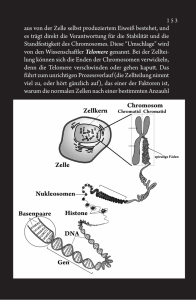
Der Zellzyklus • Die meisten Zellen von Säugern teilen sich unaufhörlich • Die Zellteilung besteht aus einer definierten sich wiederholenden Abfolge von Einzelprozessen ¾ Diese Prozessfolge nennt man den Zellzyklus Der Zellzyklus besteht aus folgenden Phasen: • M-Phase: (Mitose-Phase) = Zellteilung (Dauert bei Säugern ca. 1 Stunde) • G1-Phase: (Gap-Phase) Zellwachstum, Entscheidung zur erneuten Zellteilung • S-Phase: (Synthese-Phase) = Verdopplung des Erbguts (12 Stunden) • G2-Phase: Vorbereitung der Teilung • G0-Phase: Ruhezustand der Zelle. Geht normalerweise keine Teilung mehr ein • z.B. Nervenzelle • Ein normaler Zellzyklus dauert ca. 24 h • Abhängig von Zelltyp Die M-Phase teilt sich in viele Einzelphasen auf Mitose bezeichnet nur die Kerntrennung – weitere Unterteilung: • Prophase: Bildung der Mitosespindel, Kondensation der Chromosomen • Prometaphase: Auflösung der Kernhülle, Tochterchromatide an Spindel • Metaphase: Anreihung der Chromosomen entlang des Spindeläquators • Anaphase: Trennung der Chromosomen hin zu den Spindelpolen • Telophase: Bildung einer neuen Kernhülle, Abschluss der Mitose Cytokinese ist die Trennung der Zellkörper • Die Cytokinese kann auch Ausbleiben ¾ Es bilden sich mehrkernige Zellen Die Zellteilung wird durch das Zytoskelett bewerkstelligt Die Zellteilung wird in Mitose und Cytokinese unterteilt • Die Mitose wird durch hauptsächlich durch Mikrotubuli und Kinesine gesteuert • Die Zytokinese wird durch das Zusammenspiel von Actinfilamenten und Myosinen bewerkstelligt. • Die Regelung der komplexen Prozesse wird durch Cycline und Cyclinabhängige Kinasen (Cdk) gesteuert. • Cycline sind Proteine, die in bestimmten Phasen des Zellzyklus exprimiert werden • Um die richtige Reihenfolge bei der Zellteilung aufrecht zu erhalten inhibieren die Mitose-bewirkenden Cycline gleichzeitig die Cytokinese • Der für die Cytokinese wichtige kontraktile Ring heftet sich an die Mitosespindel an • Dadurch wird die Reihenfolge dieser Vorgänge ebenfalls gesteuert In der sogenannten Interphase werden die Vorbereitungen für die Mitose getroffen: • Verdopplung der Chromosomen als Schwesterchromatide • Verdopplung der Centriolen aus denen sich die Mitosespindel ausbildet Cohesine vermitteln den Zusammenhalt der Chromatide • Nach der DNA-Replikation bleiben die beiden Kopien der verdoppelten Chromosomen paarweise als identische Schwesterchromatide verbunden • So wird sichergestellt, das jeweils eine Kopie in die Tochterzellen überführt wird • Das Protein Cohesin vermittelt die Bindung der beiden Chromatide untereinander • Das sehr ähnlich aufgebaute Condensin bewirkt eine intramolekulare Quervernetzung der DNA die zur Superspiralisierung und Kondensation führt Verdopplung der Centrosomen • Jedes Centrosom besteht aus zwei Centriolen • Aus dem Centrosom wachsen die Astermikrotubuli ¾ Die Minus-Enden zentrieren sich am Centrosom • Die Verdopplung der Centrosomen ist Voraussetzung für den Übergang in die M-Phase • Der Mechanismus ist ist noch ungeklärt • Durch Minus-gerichtete Kinesine können sich jedoch spontan centromerartige Strukturen bilden Die Spindelmikrotubuli unterteilen sich in drei Klassen • Astralmikrotubuli: strahlen vom Centrosom in alle Richtungen aus ¾ Vermutlich verantwortlich für Trennung der Pole • Kinetochor-Mikrotubuli: Binden mit ihren Enden an das Kinetochor und damit die Chromatide an die Spindel • Polare Mikrotubuli: Überlappen entlang des Längengrads der Mitosespindel ¾ Formgebung der Spindel Die Instabilität der Mikrotubuli ist in der M-Phase stark erhöht • • • • In der Interphase sind einige wenige Mikrotubuli an einem Centrosom angehaftet Die Dynamik erhöht sich in der M-Phase schlagartig: mehr, dafür kürzere Mikrotubuli um jedes Centromerenpaar Steuerung durch MAP und Catastrophin (siehe Abb. Links) Wechselwirkung zwischen Motorproteinen und Mikrotubuli bewirken die Spindelbildung Auseinanderdrücken der Centrosomen Chromosomenbewegung zur Metaphaseplatte Die Ausrichtung der Chromosomen an der Metaphaseplatte geschieht vermutlich durch gegensätzliche Kräfte: - Außen Plus-gerichtete Kinesine, - Am Kinetochor Minus-gerichtete Kinesine Chromatidseparation während der Anaphase Es sind zwei Phasen innerhalb der Anaphase unterscheidbar A) Chromatide werden voneinander gelöst und wandern zum Zentromer B) Eine astrale Kraft drückt die Centromere auseinander Es gibt noch eine zusätzliche Zugkraft an den Centromeren Zwei Modelle der Chromosomenwanderung zum Centrosom Aktive Motorproteine in der Anaphase B • Die Unterteilung in Anaphase A und B gelang durch differentielle Hemmung der einzelnen Schritte durch unterschiedliche Zellgifte ¾ Unterschiedliche Motorproteine beteiligt ¾ Ein Teil der Motorproteine ist an der Zellmembran (und deren Filamenten) gebunden Sie zellmembranständigen Motorproteine richten den Spindelapparat aus Ein „kontraktiler Ring“ aus Actin- und Myosinfilament hilft bei der Cytokinese • Während die Tubulinfilamente für die Mitose verantwortlich sind, bewirkt ein Mikromuskel die Cytokinese • Funktionsweise analog zum Muskel • Die Mitosespindel gibt den Ort der Ausbildung des Rings und der Zellteilung vor Cytokinese unterm Mikroskop Das Zytoskelett – Ein neuartiges Drug Target • • ¾ • ¾ Das Zytoskelett ist in vielen Eukaryonten stark konserviert Das Zytoskelett ist daher Angriffspunkt vieler natürlich vorkommender Gift Abwehr von Fraßfeinden Beispiel Phalloidin aus dem Knollenblätterpilz hemmt die Actindepolarisation Verringerte Zellwanderung, Muskellähmung Naturstoffe die auf Mikrotubuli wirken sind ebenfalls starke Zellgifte • Stärkere Wirkung bei mitotischen Zellen ¾ Anwendung in der Krebstherapie Beispiele: Colchicin aus der Herbstzeitlosen (Colchicum Autumnale) • Starkes Zellgift • destabilisiert Mikrotubuli durch Bindung der Monomereinheiten • Zellsterben (Apoptose) verursacht starke Immunreaktionen H3CO OCH3 H3CO H3CO Einsatz nur in der Gichttherapie. ¾ Verhindert vermutlich das Einwandern von Leukozyten in den Entzündungsherd O NHAc Die Vinca-Alkaloida Vinblastin und Vincristin • Stammen aus der rosafarbenen Catharanthe (Vinca rosea), einer strauchartigen Blume aus Madagaskar • In der Pflanze wurden bisher ca. 70 biologisch aktive Alkaloide identifiziert • Vinblastin und Vincristin werden in der Krebstherapie eingesetzt (Leukämie und Hodgkins Lymphom) • Destabilisieren Mikrotubuli durch Bindung an das monomere Tubulin • Schwere Nebenwirkung: Neurotoxizität OH • Alternative Arzneimittel gesucht N O N H O O NH H OH O H N O O Vinblastin O Taxol – Mitosehemmer der zweiten Generation • Taxol = Paclitaxel ist ein Naturstoff aus der pazifischen Eibe (Taxis brevifolia) • Wirkt ebenfalls auf die Mikrotubuli • Im Gegensatz zu Colchicin und den Vincaalkaloiden stabilisiert Taxol die Mikrotubuli • Lange Zeit der einzige bekannte Wirkstoff mit dieser Wirkweise • Andere Indikationen als für Vinblastin: Ovarial- und Mammakarzinome • Wie alle Cytostatika verursacht Taxol starke Nebenwirkungen: Neuropathie, Blutbildveränderung Weitere Nachteile: • Schlecht Wasserlöslich • Wird von Drug Resistance Transportern aus der Zelle geschleust • Kompliziertes Molekül, teure Herstellung HO O O NH O O OH O O H O H O Taxol O OH Epothilone – Konkurrenz für Taxol • Epothilon wurde von Reichenbach und Höfle an der GBF Braunschweig aus Myxobakterien isoliert Myxobakterien bilden Fruchtkörper wie z.B. Pilze ¾ Kultivierung galt lange Zeit als unmöglich • Patentierung 1993 – kein Interesse der Industrie an der Substanz • Epothilon zeigte 1996 in den Labors von Merck (USA) eine Taxol-artige Aktivität auf Krebszellen: • Ebenfalls Stabilisierung des Cytoskeletts HO • Zahlreiche Vorteiele gegenüber Taxol: O • Besser Wasserlöslich O R OH • Werden nicht durch ABC-Transporter ausgeschieden H O • Können gegen Taxol-resistente Tumoren eingesetzt werden N O • Fermentierbar S • Synthese ist einfacher als die von Taxol R = H Epothilon A R = CH3 Epothilon B • Derivate möglich • Erste Synthesen von Danishefsky, Nikolaou und Schinzer Epothilon verringert die kinetische Hemmung der Mikrotubulibildung – Viele kleine Mikrotubuli Links: unbehandelte Zellen Rechts: Epothilon-behandelte Zellen Hemmer von Mitotischen Kinesinen – Zukünftige Antikrebsmittel ? • Generell auf Mikrotubuli/Tubulin wirkende Stoffe haben oft starke Nebenwirkungen • Relativ kleines „therapeutisches Fenster“ zwischen guter Wirkung und Toxizität • Die Inhibition von Kinesinen und KRPs könnte dieses Problem vermindern • Es gibt ca. 45 verschiedene Kinesine im Menschen OH • Zelltypspezifisch • Verschiedene Funktionen OH • Kinesin EG5 ist Interessantes Target NH • Bewirkt Centrosomentrennung • Naturstoff Monastrol hemmt EG5 (IC50 = 14 µM) N S H • Ausbildung eines „Monoaster“ Monastrol Mikroskopgestütztes High Throughput Screening hilft bei der Identifizierung von weiteren Kinesininhibitoren • Substanzen werden in Zell-basierten Screenings durch automatisierte Mikroskope ausgewertet • Substanzen werden nach dem Phänotyp der Zelle bewertet • Erste Studien mit Monastrol zeigen in der Tat stark verringerte Toxizität F Weitere EG5 Inhibitoren: S-Tritylcystein (IC50 = 1 µM) KSP-IA (IC50 = 11 nM) F S HO NH2 O N O NH2 Literatur: V. Sarli, A. Giannis ChemMedChem 2006, 1, 293-298