Cytoskelett, Zellgestalt, Zellbewegung, Trennung der Chromosomen
Werbung

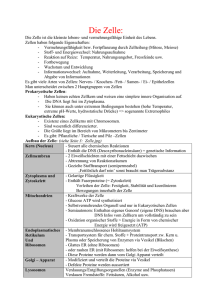
Cytoskelett, Zellgestalt, Zellbewegung 6. Die Funktionen des Zytoskeletts: Es verleiht der Zelle Form und Reissfestigkeit Es ermöglicht verschiedene Arten zellulärer Bewegung. Separiert die Chromosomen bei der Zellteilung Es liefert „Schienen” für Motorproteine, die an der Bewegung von Zellbestandteilen beteiligt sind. Wechselwirkt mit extracellulären Strukturen, um die Zelle in Position zu halten. 7.-11. Filme, die die unterschiedlichen Funktionen des Zytoskeletts demonstrieren 12.-13. Beweglichkeit der Zellen ist eine ihrer erstaunlichen Eigenschaften; wie z.B. Zellen des Immunsystems wandern an Ort der Verletzung/Infektion. Die meisten Zellen sind nicht beweglich, sondern an einen festen Ort gebunden, aber sie sind zu morphologischen Änderungen fähig, wie Muskelkontraktion, die Verlängerung der Axonen, Bildung von Oberflächenausstülpungen, die Einschnürung des Zellkörpers bei der Mitose. Innerhalb der Zellen laufen Bewegungen ab, wie zB.die Trennung der Chromosomen, die Strömung des Cytosols, der Transport der Membranvesikeln. Die für Zellbewegung benötigte mechanische Arbeit ermöglichen Proteine, welche die in ATP gespeicherte chemische Energie in Bewegung umsetzen. Die im Elektronenmikroskop sichtbare, auf den ersten Blick offensichtlich ungeordnete Ansammlung von Fasern lassen sich in drei Kategorien klassifizieren: Die 7-9 nm dicke Mikrofilamente (Actin) Die 10 nm dicke Intermediärfilamente Die 24 nm dicke Mikrotubuli (Tubulin) Die Fasern werden von Proteinpolymere gebildet, die durch nichtkovalente Bindungen zusammengehalten werden. Der Aufbau des Cytoskeletts ist klar struktruiert, bestehen aus Faserbündel, Netzwerke der Bündel, als gelartige Matrix. 14.-17. Intermediärfilamente: Eine Gruppe von Cytoskelettfasern in der Zellen sind die Intermediärfilamente, welche man in Zellen findet, die sich zu Geweben zusammenschliessen. Intermediärfilamente bestehen aus eine Reihe unterschiedlicher Proteine, davon die Lamine in allen Kernmembranen der Zellen, die übrigen IF-Proteine in besimmten Gewebe vorkommen. Intermediärfilamente durchziehen die Zellen und treten mit Desmosomen zwischen den Zellen, Hemidesmosomen in der basalen Membran und der peripheren Proteine in der apikalen Membran in Kontakt. Funktionen: Stabilisieren die Form der Zelle und verleihen ihr Reissfestigkeit. Unterstützen den Zusammenhalt von Nachbarzellen Werden Gewebespezifisch expremiert Es sind keine Motorenproteine bekannt, die sich entlang Intermediärfilamente bewegen. 1 Typen: I., II, Keratine (Desmosomen, Haar, Nagel) III., Vimentin (Anfang der Zelldifferenzierung), Desmin (Muskeln). IV., Neurofilamente (Axone von Neuronen); V., Lamin (Innere Seite der Kernmembran); Krankheiten: epidermolysis bullosa simplex, (Keratin) amyotrophic lateral sclerosis (ALS) (Neurofilament) 18.-20. Aktinfilamente Actin, das Monomer der Mikrofilamente ist das häufigste Protein der eukaryontischer Zelle. In Muskelzellen bestehen zehn Prozent aller Proteine aus Actin, in Nichtmuskelzellen 1-5 Prozent. Actin ist ein ungefähr 40 kDa Protein und wird von einer Familie hochkonservierter Gene kodiert. Einzellige Eukaryonten, wie Hefe besitzen ein einziges Actingen, dessen Mutation tödlich (lethal) ist. Die Lethalität kann durch z.B. menschliches Actingens komplementiert werden, als ein Beispiel der konservierten Natur von Actin unter der Gattungen. Mehrzellige Eukaryonten, inklusive Menschen, beherrschen sechs Actingene, Pflanzen sogar sechszig. Das Monomer von -Actin, oder globulär, G-Actin besitzt eine tellerförmige Struktur, die in vier Subdomäne geteilt ist. Innerhalb des Moleküls befindet sich eine Tasche, welche ATP und Mg2+ bindet. Im Elektronenmikroskop erscheinen Actinfilamente als lange, flexible und sich gedrehte Stränge aus perlenförmigen Untereinheiten. Wie das Modell darstellt, liegen die Untereinheiten dicht gepackt entlang des Filaments in einer helikalen Struktur. Eine periodisch wiederkehrende Einheit besteht aus 28 Untereinheiten. Die ATP-Bindungstasche weist in allen Untereinheiten in dieselbe Richtung, nach oben, welches das minus Ende des Filaments ist. Die einzelne Actinfilamente werden von Actinquervernetzende Proteine zusammengehalten. Kurze proteine, wie Fascin fixieren die Filamente nahe beieinander und bilden parallele Anordnungen, oder Bündel. Lange, biegsame Proteine, wie Filamin dienen für Bildung mehr oder weniger rechtwinkligen Netzwerke. Die actinquernetzenden Proteine sind zahlreich und gewährleisten Quernetze aller Arten. 21.-30. Zellbewegung Zellen führen Bewegungen auf zwei Weisen auf. Motorproteine verwandeln die chemische Energie aus ATP-Hydrolyse in Bewegung entlang von Mikrofilamenten oder Mikrotubuli. Der zweite Mechanismus beruht auf dem Auf- und Abbau von Mikrofilamenten oder Mikrotubuli. Polarität der bewegende Zelle heisst, dass bestimmte Strukturen an der Vorderseite, andere Strukturen an der entgegengesetzten Seite gebildet sind. Der ausgestreckte Membran-Finger, das Filopodium weist in der Richtung der Bewegung. Die grosse und breite Ausstülpung, das Lamellipodium enthält zahlreiche Actinbündel, und die Stressfasern bestehen auch aus Actinbündel/Mikrofilamenten. Die Bündel und deren Netzwerken aus Actinfilamenten füllen die Zellen an. Einzelne Bündel bilden strahlenförmige Filopodien, und gleichzeitig ein Netzwerk, welches das gesamte Cytosol erfüllt. Im Gegensatz zu der parallelen Anordnung der einzelne Filamenten der Filopodien liegen die Filamente in den Netzen rechtwinklig zueinander. 2 24. In vitro polymerisiert Actin in drei Phasen nach der Zugabe von Ionen oder Actin selbst. In der ersten Phase sich langsam kurze und instabile Oligomere aus ATP-G-Actin bilden, die als Keime dienen. In der zweiter Phase findet die rasche Verlängerung des Filaments statt, und in der dritten Phase steht das System in Gleichgewicht, ohne Kettenverlängerung (Abb. 13). Die im Gleichgewicht vorliegende Konzentration an monomerem Actin nennen wir kritische Konzentration Cc, welche unter in vitro Bedingungen 0.1 M beträgt. In höher konzentrierten Lösungen von G-Actin kommt es zur Polymerisation, während F-Actin in verdünnten Lösungen depolymerisiert. Als das gebundene ATP langsam zu ADP hydrolysiert, die Filamente aus ADP-Actin bestehen und ATP-G-Actin nur an den Enden der Kette vorliegt. Die Hydrolyse ist keine Voraussetzung für Polymerisation, da ADP-G-Actin auch polymerisieren kann. Die Geschwindigkeit der Monomerenanlagerung an beiden Enden der Kette verschieden ist, und das Plus-Ende wächst fünf- bis zehnmal schneller, als das MinusEnde. Die Unterschiedlichen Wachstumsgeschwindigkeiten an den beiden Enden beruhen auf unterschiedlichen Cc-Werten. Infolge der unterschiedlichen Cc-Werte zwischen 0.1 – 0.8 M Konzentrationen wird das Plus-Ende wachsen, und dissoziieren Actinmonomere vom MinusEnde, aber die Filamentlänge bleibt konstant, und kann das Filament in die Richtung PlusEnde fortbewegen, Filopodien bilden (Tretmühle oder treadmill Modell). In vivo, die Steuerung der Actinpolymerisation benötigt regulatorische actinbindende Proteine, da die Ionoder Actinkonzentration innerhalb der Zellen relativ konstant ist. Profilin bildet einen 1:1 Komplex mit monomerem Actin, damit das Gleichgewicht in Richtung Polymerisation verschiebt. Im Gegensatz, Thymosin 4 hemmt der Aufbau der Actinfilamente. Das Protein bindet sich an G-Actin in Verhältnis 1:1, welches in diesem Komplex nicht mehr polymerisieren kann. 25. Während der Wanderung bleibt die Länge der Aktinfilamente im Lamellipodium wegen der treadmilling konstant. Es werden an der Zellperipherie neue Aktinmonomere ins Aktinfilament eingebaut (Polymerisierung) und am Zellkörper werden Aktinmonomere von den Aktinfilamenten entfernt (Depolymerisierung). 27.-30. Während der Wanderung wird der hintere Teil der Zelle danach vorwärts gezogen, und Neukontakt, oder Adhäsionsplaque (Fokalkontakt) an dem Substrat in Bewegungsrichtung gebildet. Zwischen den Fokalkontakten werden die Stressfasern gebildet, die aus kontraktilen Aktinfilamenten und Myosin bestehen. AktomyosinKontraktion der Stressfasern yieht das Zellende zurück. Integrine (alfa und beta) sind die Transmebranproteine, die das Aktinnetzwerk durch Adaptorproteine an das extrazelluläre Matrix binden können. Fokalkontakte sind dynamisch, sie mussen rechtzeitig abgebaut werden, damit sich die Zelle sich nach vorne bewegen kann. Die dynamischen Mikrotubuli berühren die Fokalkontakte regelmässig und transportieren die Faktoren, die für den Abbau der Fokalkontakte notwendig sind. Die nächste Stufe der Organisation der Actinfilamente ist ihre Verknüpfung an der Membran-Mikrofilamentverbindende Proteine. Deshalb die höchste Dichte an Actinfilamenten besteht im Cortex, in der schmalen Region direkt unterhalb der Plasmamembran. 31. Normalerweise, WASP-Protein der Zelle aktiviert das Arp2/3-Complex im Lamellipodium, was zur Entstehung einer quervernetztes Aktinnetzwerks führt. Viele Pathogene benutzen das Aktin der Wirtszelle, um sich in der infizierten Zelle zu bewegen und zu einer anderen Zelle übertragen zu werden. Sie lassen Aktin-Schwänze wachsen. Listeria: Expremiert ein Wasp-homologes bacterielles Protein auf seiner Oberfläche, wodurch das Arp2/3-Complex um die Bacteriumszelle aktiviert wird. Shigella: Eine seiner Oberflächenproteine bindet direkt an WASP und aktiviert WASP. Vaccinia virus: Eine seiner Oberflächenproteine bindet durch Adaptoren an WASP und aktiviert WASP. Salmonella: Seine Aktin-bindende Proteine polymerisieren direkt F-actin. 3 32. In der Mitte der Fingerförmigen Microvilli des Dünndarms liegt ein Bündel von Actinfilamenten, welches die Gestalt der Mikrovilli stabilisiert. 33. In der Membran der Muskelzellen sind Actinfilamente über Dystrophin an einem integralen Membranglykoproteinkomplex gebunden. Dieser Komplex bindet sich an Laminin und Agrin, die Komponente der extrazellulären Matrix sind. Das Dystrophin Gen ist auf dem Chromosom X gekoppelt, dessen Mutationen die geschlechtsgebundene vererbte degenerative Muskelerkrankung Duchenne-Muskeldystrophie (DMD) verursacht. 34.-40. Obwohl die Polymerisationsfähigkeit von Actin die Gestaltänderungen und Beweglichkeit der Zellen gewährleistet, erfordern viele Arten der zellulären Bewegung eine Wechselwirkung zwischen Actinfilamente und Myosin. Myosin ist eine ATP-ase, die sich entlang der Actinfilamente bewegt. Myosin kann die chemische Energie in mechanische umwandeln, weshalb man es als mechanochemisches Enzym oder Motorprotein bezeichnet. Myosin ist der Motor, der von ATP angetrieben ist und sich auf den als Schienen dienenden Actinfilamenten fortbewegt. 41-56. Mikrotubuli Mikrotubuli sind Polymere aus Proteinuntereinheiten, welche den Raum zwischen dem Zellkern und der Plasmamembran ausfüllen. Mikrotubuli gewährleisten zahlreiche zelluläre Bewegungsarten, die auf der Polymerisation und Depolymerisation der Mikrotubuli, oder auf der Aktivität von Mikrotubulimotorproteinen beruhen. Während Mikrotubuli und Aktinfilamente bei den Zellbewegungen eine wichtige Rolle Spielen, dienen Intermediärfilamente ausschliesslich für strukturelle Aufgaben. Mikrotubuli bestehen aus Heterodimere von - und -Tubulin, die man mit Molekulargewichten von jeweils 55.000 bei allen Eukaryonten findet, und beide Proteine sehr stark konserviert ist. -Tubulin enthält ein nicht austauschbares GTP, und -Tubulin ein austauschbares GDP; diese Bindungstelle wird als austauschbar bezeichnet, da GDP wieder durch GTP ersetzt werden kann. Der Aufbau der Mikrotubuli fängt mit der Bildung des Profilaments an. Die dimerische Untereinheiten sind mit ihren Enden aneinander gelagert. Die säulenformige Profilamente lagern sich Seite an Seite zusammen und bilden dabei die zylinderförmige Wand eines röhren-ähnliches Microtubulus. Nahezu alle Mikrotubuli bilden eine Röhre oder Singulett; in seltenen Ausnahmen könnnen sich Protofilamente auch zu Duplett- oder Triplettmikrotubuli zusammenlagern, wie in Cilien und Geisseln. Die zwei moleküle GTP-gebundene Tubulindimere lagern sich an die Plus-Ende existierender Mikrotubuli an. Nach dem Einbau -Tubulin-gebundenes GTP wird langsam zu GDP hydrolysiert. Die an ihren Ende GTP-Tubulin-Kappe tragenden Mikrotubuli sind stabil und können weitere Dimere anlagern. Microtubuli zeigen dynamische Instabilität, sie wechseln zwischen Phasen von Wachstum und Schrumpfen. Microtubule-Flux: Treadmilling der Microtubuli durch Depolymerisierung am –Ende und Polymerisierung am +Ende. Die mikrotubuliassoziierte Proteine (MAPs) spielen eine wichtige Rolle in Vernetzung der Mikrotubuli, die aus zwei Domänen bestehen: Eine mikrotubulibindende- und eine abstehende Domäne. Diese Domäne kann sich an Membranen, Intermediärfilamente, oder andere Mikrotubuli binden. Mechanochemische Enzyme, oder Motorproteine der Mikrotubuli sind Kinesin und Dynein. Kinesin verwendet Mikrotubuli-Schiene während der 4 Fortbewegung in der Richtung Plus-Ende der Mikrotubuli, Dynein bewegt sich in der Gegenrichtung. Beide Proteine weisen strukturelle und funktionelle Ähnlichkeiten mit Myosin auf . 57.-60. Centrosomen Bei den meisten Interphasezellen gehen die Mikrotubuli ähnlich wie Speichen einer Nabe von der Nähe des Zellkerns aus, wo das Wachstum beginnt. Centrosomen sind „T“-ähnliche Strukturen, die aus zwei Centriolen und der pricentriolaren Materie (PCM) bestehen. Centriolen bestehen aus 9 Mikrotubuli-Triplets. In den meisten Fällen sind die Centrosomen die Mikrotubuliorganisationszentren (MTOC), wo sich das Minus-Ende der Mikrotubuli bindet. Mikrotubuli verschwinden nach Zugabe von Colcemid oder bei 0 oC, und sich neubilden durch Entfernung Colcemid oder bei 37 oC. Die Mikrotubuli von dem MTOC zur Zellperipherie ausstrahlen, wodurch ihre Polarität in einer ganz bestimmten Richtung festgelegt wird. Diese Polarität wird während der gesamten Mitose beibehalten, bei der sich das Centrosom/MTOC verdoppelt. In Cilien oder Geisseln Centrosom dient als der Basalkörper, wo das Minus-Ende der Mikrotubuli angeheftet sind. Im Gegenstand, pflanzliche Zellen weisen zahlreiche MTOCs auf. In manchen Tierzellen fällt das Zentrosom und das MTOC nicht überein. 61.-64. Mitose und Meiose Der mitotische Zellzyklus sorgt dafür, dass beide Zellen nach der Teilung genetisch identisch sind. Die Mitose ist der letzte Abschnitt des mitotischen Zellzyklus und dauert in einer normalen tierischen Zelle ungefähr eine Stunde. Für diese Zeitdauer bildet die Zelle eine vorübergehende Struktur aus Mikrotubuli, die als mitotischer Apparat bezeichnet wird. Um sicherzustellen, dass die Mitose über mehreren Milliarden Zellteilungen während der gesamten Lebensdauer fehlerfrei abläuft, hat die Natur einen redundanten Mechanismus entwickelt, der durch die Dynamik der Mikrotubuli gesteuert ist. Die Meiose sorgt für genetische Variabilität, und dafür, dass das bei der Bildung der Geschlechtszellen das Chromosomenzahl halbiert wird. + Biologie 7. Auflage S.197-S.219 65-67. Die Spindel Die Anzahl, Grösse und Form der Chromosomen ist genetisch festgelegt, und art- und zelltypisch ist. Die primäre Einschnürung, das Zentromer kann in der Mitte (metazentrisch, Chr. 1), am Ende (telozentrisch, X-Chr.), oder irgendwo inzwischen (submetazentrisch, YChr.) des Chromosoms liegen. Der längerer Arm/Schenkel des Chromosoms heisst q, der kürzere p. Manche Chromosomen tragen sekundäre Einschnürung, den Nukleolenbildungsort (NO, nucleolus organiser). Euchromatin ist der genetisch aktiver Bereich des Chromosoms, der entspiralisiert ist, während Heterochromatin (z.B. Zentromerbereich) bleibt kondensiert, spiralisiert. Während der Mitose oder der Meiose müssen die Chromosomen im Vergleich der Länge ihre DNA ungefähr 1:10000 spiralisiert werden. In der Metaphase wird der mitotische Apparat in zwei Teile geteilt: Ein zentraler Spindelapparat, und ein Paar Microtubuliastern an jedem Spindelpol. Am Pol jeder Halbspindel befindet sich ein Centrosom, das vorher in der Interphase (G2) sich verdoppelt hat. Die Astralmikrotubuli, die aus dem Centrosom ausstrahlen, posizionieren das 5 Spindelapparat und legen die Trennebene zwischen beiden Zellen während der Cytokinese fest. Die Pol- und Kinetochormikrotubuli bilden die Spindel. Die Kinetochormikrotubuli halten die Chromosomen an den Kinetochoren fest, während Polmikrotubuli gehen keine Wechselwirkung mit den Chromosomen ein. Das flache Kinetochor besteht aus drei Schichten, liegt in dem Centromer der Schwesterkromatiden mithilfe von centromerbindende Faktoren (CBF). „Search and capture“- Model: +Enden der Microtubuli wachsen und schrumpfen dynamisch und erwischen dabei ein Kinetochor und binden es. 68-70. Bewegung der Chromosomen Während der Chromosomenbewegung in der Anaphase, dynamische Polymerisation und Depolymerisation der Mikrotubuli, sowie Mikrotubulimotorproteine gewährleisten die Zugkraft für Trennung der Chromosomen. Pac-Man Modell: Microtubuli werden am +Ende depolymerisiert. Aufrollen-Modell: Dynein bindet die Chromosomen an die +Enden und Microtubuli werden am –Enden depolymerisiert. 71-73. Spindel ohne Centrosom Während der weiblichen Meiose gehen die Centrosomen verloren und die Spindel ensteht ohne Centrosomen. Dabei werden die Mikrotubuli an den kondensierten Chromosomen nukleiert. Die +Enden wachsen an den Chromosomen und schieben die –Enden aus. Regulierte Zusammenarbeit verschiedener Mikrotubulimotoren fokusieren die –Enden an den zwei Seiten der Chromosomen und so entstehen die zwei Spindelpolen. 74-77. Fehler bei der Meiose Aneuplode Keimzellen entstehen wegen Chromosomen-nondisjunktion, die während der ersten oder der zweiten meiotischen Teilung auftreten kann. Fehler bei Meiose I: Die homologen Chromosomen werden in der AnaphaseI nicht separiert und wander zur gleichen Spindelpol. Fehler bei Meiose II: Die Schwesterchromatiden der ZweichromatidenChromosomen werden in der AnaphaseII nicht separiert und wander zur gleichen Spindelpol. Die häufigste und bekannteste Trisomie ist die Trisomie des Chromosomes 21. (DownSyndrom). Die Häufigkeit ist 1:800-1:1000 pro Geburt. In den meisten Fällen tritt die Nondisjunktion in der Mutter während der Oogenese auf. Andere Trisomien: TurnerSyndrom (XXX), Klinefelter- Syndrom (XXY). 78-79. Zytokinese In der Telophase gibt es zwei Zellkerne in einer gemeinsamen Zytoplasma. Die Zytokinese ist die Teilung der Zytoplasma. Dabei wird in der Anaphase ein kontraktiler Acto-Myosin-Ring gebildet, dessen Kontraktion am Ende der Mitose die zwei Zellen voneinander separiert. Der kontraktile Acto-Myosin-Ring ensteht an der Stelle, wo die „zentrale Spindel” (midbody) gewesen ist. Zur Trennung der Zellen ist die Einbau von neuen Zellmembranvesikeln notwendig. 80-83 Regulierung des Zellzykluss Der mitotische Zellzyklus sorgt dafür, dass beide Zellen nach der Teilung genetisch identisch sind. In der G1-Phase (gap, Lücke) des Zellzyklusses dient dafür, dass die Zelle für die 6 Teilung sich vorbereitet. Zur Vorbereitung auf eine Mitose müssen das Genom und das Zytoplasma verdoppelt werden. Die Chromosomenverdopplung geschieht in der S-Phase (Synthese) der Interphase. Die Interphase besteht aus S-Phase, G1- und G2-Phasen des Zellzyklusses. Die in der S-Phase verdoppelten Chromosomen sind die genetisch identischen Schwesterchromatiden, oder Zwei-Chromatid-Chromosomen. In der Interphase liegen die Chromosomen als entspiralisiertes Chromatin vor, nur während der Mitose kondensieren sie, sich verkürzen, und werden zytogenetisch sichtbar. Die meisten Zellen vielzelliger Organismen unterbrechen den Zellzyklus in der G1-Phase, treten in die G0-Phase ein, und beginnen Differenzierung (postmitotische Zellen). Die nichtteilenden Zellen treten von G0 in die G1-Phase ein, wenn der Verlust von Zellen einen Ersatz durch Neubildung nötig ist. 84. Der Zellzyklus ist irreversibel, kann aber an den Kontrollpunkten angehalten werden. Wenn die Umweltbedingungen ungünstig sind, oder die DNA nicht perfekt repliziert wurde oder beschädigt ist, oder wenn die Chromosomen nicht an die Spindel gebunden sin, wird der Zellzyklus arretiert. Es gibt drei Kontrollpunkte: G1/S-Übergang, G2/M-Übergang, Metaphase/Anaphase-Übergang. 85-87. Kennenlernen die Schritte die den Zellzyklus der Eukaryonten steuern hat - unter anderen eine wichtige Bedeutung: Für jeden sechsten Todesfall sind in den Industrieländer die Krebserkrankungen, oder Störungen der Regulierung des Zellzyklus verantwortlich. Gegen Ende der achtziger Jahre wurde deutlich, dass die Chromosomen- und Zellteilung in allen eukaryontischen Zellen durch ähnliche molekulare Vorgänge reguliert wird. Die Verdopplung von Zellen wird durch die Bestimmung des Zeitpunts überwacht, andem zwei wichtige Ereignisse des Zellzyklus eintreffen: Die DNA-Synthese und die Mitose. Diese Vorgänge werden in erster Linie durch eine kleine Gruppe von heterodimeren Proteinkinasen reguliert, die jeweils aus einer regulatorischen und einer katalytischen Untereinheit bestehen. Die regulatorische Untereinheit dieser Proteine sind die Cycline, da ihr Gehalt im Verlauf des Zellzyklus zu- und abnimmt. Die katalytische Untereinheit nennt man cyclin-dependentkinase (Cdk), cyclinabhängige Kinase, da sie erst nach der Assoziation mit einem Cyclin aktiviert wird. Die katalytischen Untereinheiten können sich mit verschiedenen Cyclinen verbinden, die dann festlegen, welche Proteine durch den Cdk-Cyclin-Komplex phosphoryliert wird. Dementsprechend der Komplex reguliert die Durchführung G1-Phase, SPhase und die Mitose. Sobald eine Zelle nach der Stimulierung durch Wachstumsfaktoren (NGF, EGF, usw.) die Verdopplung beginnt, werden die G1-CdkCs exprimiert, als ruhende Zellen in der G1-Phase zu finden sind. Sie bereiten die Zelle für den Eintritt in die S-Phase vor, aktivieren bestimmte Transkriptionsfaktoren, die die Enzyme für DNA-Synthese und SPhase-Cdks bewirken. Während der S- und G2-Phase werden die mitotischen CdkCs bereitgestellt, die Chromosomenkondensation, den Aufbau von Spindelapparates, Zerfall der Kernhülle, und die Ausrichtung der Chromosomen in der Metaphaseebene steuern. Schliesslich aktivieren mitotische CdkCs den anaphasefördernden Komplex (anaphasepromoting complex, APC), der die Proteinkomplexe inaktiviert, die in der Metaphase die Schwesterkromatide miteinander verbinden. Während der Entwicklung von vielzelligen Organismen ist die genaue Steuerung des Zellzyklus äusserst wichtig, womit jede Gewebe die richtige Grösse und Form erhält. Die Zellteilung wird durch ein Netzwerk der Signalwegen gesteuert, durch ein integriertes 7 Program, welches den Z Metaphase/Anaphase ustand der Zellen kontrolliert (Grösse, Identität) Die bei den Hefen und Froschembryonen entdeckten Mechanismen zur Regulierung des Zellzyklus sind auch in den Körperzellen bei höheren Eukaryonten, inklusive Menschen, wirksam , als Vorgänge der Zellzyklusregulierung hochkonserviert sind. Im Gegensatz zu Hefen, die eine einzige cyclinabhängige Kinase (CDK) besitzen, wird bei Säugetierzellen der Ablauf des Zellzyklus von einer Familie verwandter CDK-Moleküle reguliert, nähmlich Cdk1, -2, -3, -4 und -6, davon Cdk3 und -6 werden sehr geringer exprimiert. Wie die Hefezellen besitzen auch Säugetierzellen mehrere Arten von Cyclinen, Cyclin A, -B, -D und –E. 88-91. Mechanismen der Regulierung der CDKs 1. Anheften des Cyklins aktiviert die CDK 2. Aktivierende Phosphorilierung durch eine CAK (Cyklin-aktivierende Kinase) 3. Hemmende Phosphorilierung duch eine Inhibitor-Kinase (z.B. Wee1) 4. Anheften von CDKIs (CDK-Inhibitoren) hemmen die CDKs 94-98. G1/S Kontrollpunkt Der G1/S-Übergang wird durch CDK4/CyclinD und CDK2/CyclinE reguliert. Sind diese Komplexe aktiv, dann tritt die Zelle in die S-Phase ein. In der späten G1-Phase reguliert der CyclinD/Cdk4/6 Komplex die Aktivität von Retinoblastoma-Protein/E2F Transkriptionsfaktor-Komplex durch Phosphorylierung. Der Rb/E2F Protein-Komplex ist wegen der Anwesenheit von Rb inaktiv. Der Cyclin D/Cdk4/6 Komplex phosphoryliert Rb, womit E2F freigesetzt wird, und die Transkription der zur S-Phase notwendigen Targetgene beginnen kann. Ist die DNA beschädigt, dann bleiben CDK4/CyclinD und CDK2/CyclinE Komplexe inaktiv und der Zellzyklus wird in G1 arretiert. DNA-Schäden werden vom ATM Protein detektiert, was zur Aktivation des p53 Tumorsupressors führt. (Der Name erhielt dieses Protein nach seiner Grösse bei der SDS-Polyacrylamidgelelektrophorese). Beschädigte DNA stabilisiert das normalerweise instabiles p53-Prritein. p53 wirkt als Transkriptionsfaktor und leitet die Expression des Cyclin-Kinase-Inhibitorproteins p21 ein, worauf sämtliche Cdk/CyclinKomplexe gehemmt werden, und wird der Zellzyklus in der G1- oder in der G2-Phase angehalten. Im Falle der meisten Krebserkrankungen der Menschen ist sehr häufig das Tumorsuppressorgen p53 mutiert.Natürlich können nicht nur DNA-Schäden sondern auch Signalwege, Kontakt-Inhibition, UV-Strahlung diesen Kontrollpunkt blokkieren. 99-101. G2/M Kontrollpunkt Der G2/M-Übergang wird durch CDK1/CyclinB-Komplex (MPF, M-phase förderndes Faktor) reguliert. Ist dieses Komplex aktiv, dann tritt die Zelle in die M-Phase ein. Ist die Replikationb nicht abgeschlossen, oder ist die DNA beschädigt, dann wird es vom ATM Protein detektirt. Dass führt zur Aktivierung der Chk-Kinasen, die die cdc25 Phospatese inaktivieren. Normalerweise ist cdc25 zur Aktivierung des MPFs notwendig. Auch das ATMp53-p21 Signalweg kann (ähnlich wie bei der G1/S Kontrollpunkt) den G2/M-Übergang blokkieren. 102-106. Metaphase/Anaphase-Kontrolpunkt 8 Beendung der Mitose wird durch den Abbau von mitotischen Cyclinen und Securin vermittelt. Biochemische Untersuchungen ergaben, dass der Abbau der Cyclinen durch die Anheftung von Ubiquitin gewährleistet wird. Das ubiquitinaktivierendes Enzym E1 herstellt zwischen dem C-Terminus (freie COOH-Gruppe) von Ubiquitin und einem eigenen Cysteinrest eine Thioesterbindung und dadurch das Ubiquitin-Protein aktiviert. Schliesslich E1 überträgt es auf einen Cysteinrest des ubiquitinkonjogierenden Enzym E2. Anschliessend wird von E2 und einer Ubiquitin-Ligase E3, die auch als anaphasefördernder Komplex (anaphase-promoting complex, APC) bezeichnet wird, die Abbaubox erkannt und Ubiquitin auf einen von Abbaubox C-Terminal liegenden Lysinrest auf das Substrat-Cyclin übertragen. Die Wiederholungen dieser Vorgänge führt zu polyubiquitinierten Cyclinen, die sehr schnell an den Proteasomen abgebaut werden. Eintritt in die Anaphase der Mitose bedeutet die Trennung der Schwesterchromatiden, die am Centromer und an mehreren anderen Stellen durch Cohesin-Proteinkomlex zueinander angeheftet sind. Die Funktion von Cohesin wird durch das Anaphaseninhibitor-ProteinKomplex Separase/Securin gesteuert. Zu beginn der Anaphase wird der Inhibitor Securin von anaphasefördernden-Komplex (APC) polyubiquitiniert und rasch abgebaut. Dadurch wird Separase aktiv und baut Cohesin ab. Dann werden die Schwesterchromatiden von den auf die Kinetochoren wirkenden, zu den Polen gerichteten Kräften zu gegenüberliegenden Spindelpolen gezogen. Der anaphasefördernder Komplex (APC) baut also zwei Klassen von Proteine (Cyclin und Securin) ab. Fehlerhafter Spindelapparat verhindert die Aktivierung von APC-Komplex der den Anaphaseinhibitor Securin für den Abbau markiert. Aus diesem Grund setzt die Anaphase erst ein, wenn alle Kinetochoren/Zentromeren an Spindelmikrotubuli gebunden sind. Mad2 Protein detektiert, wenn nicht alle Kinetochoren/Zentromeren an Spindelmikrotubuli gebunden sind, und inaktiviert mit cdc20 das APC-Komplex. Sehr selten tritt Nondisjunktion bei Menschen auf: Die Anaphase beginnt bevor beide Kinetochoren/Zentromeren des verdoppelten Chromosomes an die Mikrotubuli angeheftet sind. 9