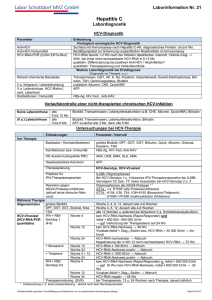
Empfehlungen des bng zur Therapie der chronischen Hepatitis C
Werbung

Empfehlungen des bng zur Therapie der chronischen Hepatitis C Update 2011 Herausgeber: T. Berg, S. Mauss, D. Hüppe, P. Buggisch 1 © bng 2011 Herausgeber: bng, Berufsverband Niedergelassener Gastroenterologen Deutschlands e.V.; T. Berg, S. Mauss, D. Hüppe, P. Buggisch Redaktion: MEDICAL COMMUNICATION CONSULTING, Dr. Barbara Schäfer, Grenzach-Wyhlen Gestaltung: Lorenz IT-Dienstleistungen Ltd. & Co. KG, Rheinfelden Titelfoto: © Fotolia.com (Hepatitis C Virus ) ISBN 978-3-00-037015-1 Alle Rechte vorbehalten, auch die des Nachdrucks, der photomechanischen Wiedergabe und der Übersetzung. Die hier empfohlenen Dosierungen, die Therapiedauer und Dosisanpassungen sind aufgrund neuester wissenschaftlicher Erkenntnisse und klinischer Erfahrungen zusammengestellt und entsprechen der Mehrheitsmeinung der teilnehmenden Kolleginnen und Kollegen basierend auf dem Wissensstand im September 2011. Die Empfehlungen können von den Fachinformationen der Präparate abweichen. Zur Therapie der chronischen Hepatitis C stehen zwei pegylierte Interferone (Peg-IFN alfa 2a und alfa-2b) zur Verfügung (Pegasys®, PegIntron®), deren empfohlene Initialdosierung bei 180 µg (Pegasys®) bzw. 1,5 µg/kg (PegIntron®), liegt. Die Dosierung von Ribavirin ist dem Genotyp und anderen Faktoren anzupassen. Zur Therapie der chronischen HCV-Infektion vom Genotyp 1 sind zudem zwei Proteaseinhibitoren, Boceprevir (Victrelis®) und Telaprevir (Incivo®) zugelassen, die jeweils in Kombination mit PEG-IFN alfa und Ribavirin angewendet werden (Triple-Therapie). 2 Vorwort Die Therapie der chronischen Hepatitis-C-Virus(HCV)-Infektion befindet sich in einem stetigen Wandel. Die Zulassung von direkt antiviral wirksamen Substanzen führt zu einer Verbesserung des Therapieerfolges, gleichzeitig wachsen die Anforderungen an den Therapeuten in der Indikationsstellung, im Behandlungsmanagement und der Förderung der Compliance des Patienten. Mit der Zulassung der Proteaseinhibitoren Boceprevir und Telaprevir stehen wir am Beginn einer neuen Ära in der Therapie der chronischen HCV-Infektion vom Genotyp 1. Die Heilungschancen werden durch den Einsatz dieser direkt antiviralen Substanzen in Kombination mit Peginterferon alfa (PEG-IFN) plus Ribavirin deutlich erhöht und erreichen mit ca. 75% das Niveau der SVR-Raten bei der chronischen HCV-Infektion vom Genotyp 2- und 3. Darüber hinaus kann bei vielen Patienten die Therapiedauer durch die Triple-Therapie auf 24 Wochen verkürzt werden. Die neuen und komplexeren Therapieregime stellen uns jedoch auch vor neue Herausforderungen im therapeutischen Management der HCV-Infektion. In dieser Broschüre haben erfahrene Therapeuten auf dem Gebiet der Hepatitis C auf Einladung und Initiative des Berufsverbandes Niedergelassener Gastroenterologen e.V. (bng) den aktuellen Stand der Therapieindikation sowie das Behandlungs- und Nebenwirkungsmanagement zusammengefasst. Sie soll dem klinisch tätigen Arzt in Praxis und Klinik eine kompetente Hilfe bei seiner täglichen Arbeit mit Hepatitis-C-Patienten sein, ein Vademecum bei Therapieproblemen darstellen, die Grenzen seiner Behandlungsmöglichkeiten aufzeigen und ihn zur interdisziplinären Zusammenarbeit mit Hausärzten und Fachärzten (Netzwerk der Therapie) motivieren. Wir danken allen Teilnehmern für ihr großes Engagement bei der Vorbereitung, Diskussion und Formulierung der Inhalte des gemeinsamen Tagungsergebnisses. Berlin, im November 2011 Prof. Dr. Thomas Berg Dr. Stefan Mauss Dr. Dietrich Hüppe Dr. Peter Buggisch 3 3 Autoren des Updates 2011 Dr. med. Axel Baumgarten Praxis Dres. Stephan Dupke, Axel Baumgarten und Andreas Carganico u.w. Driesener Str. 11 10439 Berlin Prof. Dr. med. H. Klinker Universitätsklinikum Würzburg ZIM (Zentrum Innere Medizin) Haus A3/A4 Oberdürrbacherstr. 6 97080 Würzburg Prof. Dr. med. Thomas Berg Sektion Hepatologie Klinik für Gastroenterologie und Rheumatologie Universitätsklinikum Leipzig Liebigstr. 20 04103 Leipzig Dr. med. Stefan Mauss Zentrum für HIV und Hepatogastroeneterologie Grafenberger Allee 128a 40237 Düsseldorf Leber- und Studienzentrum am Checkpoint Charlottenstr. 81 10969 Berlin Dr. med. Peter Buggisch Med. Versorgungszentrum ifi-Institut Lohmühlenstr. 5 20099 Hamburg Dr. med. Jörg Gölz Praxiszentrum-Kaiserdamm Kaiserdamm 24 14057 Berlin PD Dr. med. Holger Hinrichsen Hepatologische Schwerpunktpraxis bng Preetzer Chaussee 134 24146 Kiel Dr. med. Dietrich Hüppe Hepatologische Schwerpunktpraxis bng Wiescherstraße 20 44623 Herne Prof. Dr. med. Birgit Kallinowski Hepatologische Schwerpunktpraxis bng Scheffelstraße 63 68723 Schwetzingen 4 Dr. med. Gero Moog Gastroenterologische Facharztpraxis Marburger Str. 85 (Im Marienkrankenhaus) 34127 Kassel Prof. Dr. med. Jörg Petersen Med. Versorgungszentrum ifi-Institut Lohmühlenstr. 5 20099 Hamburg PD Dr. Martin Schäfer Klinik für Psychiatrie, Psychotherapie und Suchtmedizin - Kliniken-Essen-Mitte Akademisches Lehrkrankenhaus der Universität Duisburg/Essen Ev. Huyssenstift Henricistr. 92 45136 Essen PD Dr. med. Regina Treudler Universität Leipzig Klinik für Dermatologie, Venerologie und Allergologie Philipp-Rosenthal-Str. 23 04103 Leipzig Dr. med. Bernd Weber Schwerpunktpraxis für Suchtmedizin Königsplatz 36b 34117 Kassel Inhalt Ziele der Hepatitis-C-Therapie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7 Indikationen zur Therapie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 8 Kontraindikationen. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 10 Check-up vor Therapie. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 12 Basisdiagnostik vor geplanter Therapie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 15 Fibrose-Diagnostik: Leberbiospie, nicht-invasive Verfahren. . . . . . . . . . . . . . . . . . . . . . . . . 16 Therapiemanagement Triple-Therapie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 18 Triple-Therapie des HCV-Genotyps 1 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 19 • Triple-Therapie mit Boceprevir in Kombination mit PEG-IFN alfa (PEG-IFN) und Ribavirin (RBV). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 20 • Triple-Therapie mit Telaprevir in Kombination mit PEG-IFN alfa (PEG-IFN) und Ribavirin (RBV). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 22 Response-gesteuerte duale Therapieregime mit Peginterferon alfa (PEG-IFN) und Ribavirin für • • Patienten mit chronischer HCV-Infektion vom Genotyp 1, 4-6 mit Kontraindikation für Proteaseinhibitoren oder . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 24 Patienten mit chronischer HCV-Infektion vom Genotyp 2/3 . . . . . . . . . . . . . . . . . . . . . . . . . . . 25 Medikamentendosierung: Proteaseinhibitoren Boceprevir und Telaprevir . . . . . . . . . . . . 27 Medikamentendosierung: Ribavirin und PEG-Interferon . . . . . . . . . . . . . . . . . . . . . . . . . . . 28 Labormonitoring unter Therapie. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 31 5 Inhalt Management von Patienten mit Relapse oder Non-Response. . . . . . . . . . . . . . . . . . . . . . . . 32 Spezielle Patientengruppen Therapie bei HIV/HCV-Koinfektion . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 33 Therapie HCV-infizierter Patienten mit einer Substitutionsbehandlung . . . . . . . . . . . . . . . . 36 Nebenwirkungsmanagement Psychiatrie. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 38 Dermatologie. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44 Hämatologie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 52 Endokrinologie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 55 Interaktionen. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 53 Literatur. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 62 Anhang . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 65 • Aufklärungsbogen „Duale Therapie“ für Patienten • Aufklärungsbögen „Triple-Therapie“ für Patienten (Boceprevir) • Aufklärungsbögen „Triple-Therapie“ für Patienten (Teleprevir) • Fibrosediagnostik: Leberbiopsie (Staging) • Fibrosediagnostik: Leberbiopsie (Grading) 6 Ziele der Hepatitis C-Therapie • Ziel der Therapie ist die dauerhafte Elimination der HCV-Infektion (SVR, Sustained Virological Response) und damit verbunden die Ausheilung der chronischen Hepatitis. Es ist bekannt, dass die Prognose des Patienten durch die Viruselimination verbessert wird. • Gleichzeitig sollen Komplikationen der Erkrankung vermieden werden (Zirrhose, Karzinom, extrahepatische Manifestationen). • Die SVR ist definiert als negative HCV-RNA im Serum 6 Monate nach Therapieende. • In Einzelfällen kann auch bei fehlender virologischer Response die Hemmung der Fibroseprogression (bei Patienten mit fortgeschrittener Fibrose) bzw. die Kontrolle extrahepatischer Manifestationen und Symptome ein Therapieziel darstellen. 7 Indikationen zur Therapie (modifiziert nach Leitlinienempfehlung) • Eine chronische Hepatitis C stellt unter Berücksichtigung der Kontraindikationen eine Indikation zur antiviralen Therapie dar. • Ein frühzeitiger Behandlungsbeginn im Verlauf der chronischen Infektion erhöht die Chancen auf eine anhaltende virologische Response (SVR) und wird daher empfohlen. • Erhöhte Transaminasen und/oder Nachweis einer Fibrose sind keine in jedem Fall notwendigen Voraussetzungen für die Indikationsstellung zur Therapie. • Bei fortgeschrittener Fibrose bzw. kompensierter Zirrhose besteht eine dringende TherapieIndikation. Die mit einer Zirrhose assoziierten Komplikationen können jedoch eine Einschränkung der Therapiemöglichkeiten darstellen. • Extrahepatische Manifestationen (Ausnahme extrahepatische Manifestationen, bei denen ein signifikantes Risiko der Aggravation der Erkrankung unter einer Interferon-basierten Therapie besteht). • HCV-assoziierte niedrig-maligne Non-Hodgkin-Lymphome (NHL) in stabiler Krankheitsphase (Kooperation mit einem Hämatologen). • Berufliche Gründe, eine Elimination des Transmissionsrisikos sowie ein Therapiewunsch des Patienten können ebenfalls unabhängig von der Erkrankungsaktivität eine Therapieindikation darstellen. Indikation zur Triple-Therapie Die Zulassung der Proteaseinhibitoren erfolgte ausschließlich für die HCV-Genotyp-1-Infektion. • Unvorbehandelte Patienten mit HCV-Genotyp-1-Infektion profitieren signifikant von der TripleTherapie und sollten primär mit einer Proteaseinhibitor-basierten Therapie behandelt werden. • Bei unvorbehandelten Patienten mit günstigen Baselinefaktoren für ein rasches virologisches Ansprechen auf eine PEG-IFN/Ribavirin-Therapie (d.h. IL28B-CC-Genotyp, keine fortgeschrittene Fibrose, HCV-RNA < 600.000 IU/ml) kann auch primär eine duale Therapie mit PEG-IFN plus Ribavirin erwogen werden. Dies sollte individuell mit dem Patienten diskutiert werden. • Therapie-erfahrene Patienten mit HCV Typ 1 ohne anhaltende Remission sollten eine Re-Therapie mit Proteaseinhibitor-basiertem Regime erhalten. 8 Indikationen zur Therapie (modifiziert nach Leitlinienempfehlung) Indikation zur Triple-Therapie bei Patienten mit Begleiterkrankungen, Suchterkrankungen, Komedikationen, Niereninsuffizienz und Z. n. Lebertransplantation Die Indikationsstellung zur Therapie hat sich bei den o.g. speziellen Patientengruppen durch die Zulassung der Proteaseinhibitoren nicht grundsätzlich geändert (siehe Leitlinie 2010). Für einige dieser Patientengruppen liegen jedoch noch keine ausreichenden Erfahrungen für den Einsatz von Proteaseinhibitoren vor. Die Einschränkung der Therapiefähigkeit ergibt sich vor allem durch die potentiellen Medikamenteninteraktionen bei Patienten mit Begleiterkrankungen bzw. Begleitmedikation. • Die Sicherheit und Wirksamkeit von Proteaseinhibitoren bei Patienten nach Organ-(Leber)Transplantation ist bisher nicht untersucht worden. Medikamtenteninteraktionen v.a. mit den Calcineurininhibitoren sind zu beachten und erfordern ein spezielles Management. • Bei Patienten mit Niereninsuffizienz (auch Dialyse) ist keine Anpassung der Boceprevir-Dosis notwendig. Ebenso muss auch die Telaprevir-Dosis bei kompensierter Niereninsuffizienz nicht angepasst werden. Daten zum Einsatz bei Dialysepatienten liegen bisher nicht vor, so dass derzeit die Gabe von Telaprevir hier nicht empfohlen werden kann. Eine fortgeschrittene bzw. terminale Niereninsuffizienz erfordert in jedem Fall eine spezielle Anpassung der PEG-IFN/Ribavirin-Therapie entsprechend der Leitlinien-Empfehlungen 2010. 9 Kontraindikationen Kontraindikationen bzw. Einschränkungen der Therapiefähigkeit für eine Therapie mit PEG-IFN alfa plus Ribavirin plus/minus Proteaseinhibitor ergeben sich aus den möglichen Nebenwirkungen der eingesetzten Substanzen wie z. B. der Induktion einer Leuko- oder Thrombozytopenie bzw. Anämie. Deshalb sollte vor Therapie keine ausgeprägte Thrombozytopenie (< 50.000/µl) und Leukozytopenie (< 1.500/µl) bestehen. Die Therapie sollte nur von einem mit den Substanzen und potentiellen Nebenwirkungen bzw. Risiken der Therapie vertrauten Arzt durchgeführt werden. Häufig wird man mit Situationen konfrontiert, in denen z. B. aufgrund von Begleiterkrankungen eine Einschränkung der Therapiefähigkeit besteht. In solchen Situationen bedarf es einer individuellen Abwägung der Vor- und Nachteile einer antiviralen Therapie, die nach einem ausführlichen Gespräch mit dem Patienten getroffen werden sollte. Man wird evtl. hinsichtlich der Dosierung des PEG-IFN alfa und Ribavirin und der Verlaufskontrollen unter Therapie vom Standardschema abweichen müssen. Begleiterkrankungen müssen vor Therapiebeginn adäquat behandelt werden. Eine Zusammenarbeit mit entsprechenden anderen Fachdisziplinen kann ratsam sein. Spezielle Kontraindikationen gegenüber dem Einsatz von Proteaseinhibitoren ergeben sich vor allem durch die potentiellen Medikamenteninteraktionen bei Patienten mit Begleitmedikation (siehe Seite 59). Beim Einsatz von Proteaseinhibitoren müssen vor allem Interaktionen mit Medikamenten, die über Cytochrom P450 3A (CYP3A, v.a. CYP3A4) verstoffwechselt werden, beachtet werden. Die Interaktionen können sowohl zu einer Steigerung als auch zur Reduktion der jeweiligen Medikamentenspiegel führen. Boceprevir und Telaprevir zeigen unterschiedliche Interaktionen. Ein Drug monitoring ist für beide Medikamente bisher nicht etabliert. 10 Kontraindikationen 1. In den folgenden Situationen ist eine Interferon-alfa-basierte Therapie kontraindiziert: • schwere Zytopenien • Malignom mit ungünstiger Prognose • schwerwiegende/symptomatische kardio-pulmonale Erkrankungen • schwere aktive Autoimmunerkrankungen • Schwangerschaft, Stillen • Kinder < 3 Jahre • aktueller Alkoholabusus • unkontrollierter Drogenabusus • unbehandelte schwere psychiatrische Erkrankung • akute Suizidalität • schwere akute und chronische neurologische Erkrankungen 2. Eine individuelle Nutzen-Risiko-Abwägung sollte insbesondere bei folgenden Erkrankungen erfolgen:* • dekompensierte Zirrhose vor geplanter Lebertransplantation (nur in Absprache mit einem Transplantationszentrum) •Autoimmunerkrankungen** •Hämoglobinopathien • asymptomatische koronare Herzerkrankungen/unbehandelter Hypertonus/vaskuläre Erkrankungen • unbehandelte Schilddrüsenerkrankungen •Epilepsie •Polyneuropathie • frühere schwere Depression • Suizidversuche in der Vorgeschichte • aktuell bestehende psychische Erkrankungen • unzureichend eingestellter Diabetes mellitus • Neurodermitis, Psoriasis, Sarkoidose •Retinopathien • Organtransplantation (nicht Lebertransplantation) • aktive Infektionen * Diese Erkrankungen stellen keine absoluten Kontraindikationen dar, sondern weisen in definierten Fällen auf eine mögliche Einschränkung der Therapiefähigkeiten des Patienten hin. ** Bei Autoimmunerkrankungen besteht das Risiko der Reaktivierung durch eine IFN-basierte Therapie. Bei einer Sarkoidose sollte eine IFN-basierte Therapie nur nach Absprache mit einem Spezialisten erfolgen. 11 Check-Up vor Therapie Vor Therapiebeginn sollte ein spezieller Check-up durchgeführt werden, dessen wichtigste Faktoren hier aufgeführt sind. Grundsätzlich ist eine individuelle Abwägung der Vor- und Nachteile einer antiviralen Therapie erforderlich und eine Zusammenarbeit mit anderen Fachdisziplinen ist bei Multimorbidität ratsam, z.B. bei psychiatrischen oder dermatologischen Erkrankungen. Begleiterkrankungen müssen vor Therapiebeginn adäquat behandelt werden. Insbesondere autoimmunologische Erkrankungen müssen in einem kompensierten, kontrollierten Stadium sein, bevor eine Therapie mit PEG-IFN alfa und Ribavirin mit/ohne Proteaseinhibitoren erwogen werden kann. 1. Diagnose gesichert? (Anti-HCV positiv, HCV-RNA positiv) 2. Soziale Anamnese (Abschätzung der Compliance, Arbeitsplatzsituation und soziale Integration) 3. Psychiatrische Erkrankungen: aktuelle Suchterkrankung -> Suchtmediziner schwere Depression, Psychose, etc. -> Psychiater 4. Relevante internistische Begleiterkrankungen und Komorbiditäten Alter, Nikotin, Alkoholkonsum, Adipositas, Familienanamnese, kardiovaskuläre Erkrankungen (KHK, Hypertonie, Herzinsuffizienz, Retinopathie), Diabetes mellitus, Asthma bronchiale, therapiebedürftige Schilddrüsenerkrankungen, Autoimmunerkrankungen (Rheumatoide Arthritis, Kollagenosen, Autoimmunhepatitis, Sarkoidose), Niereninsuffizienz, Nikotin-/Alkoholabusus, Extrahepatische Manifestationen der Hepatitis, (Gelenkbeschwerden, Purpura, Proteinurie, monoklonale Gammopathie, Kryoglobulinämie, etc.) 5. Dermatologische Erkrankungen: Psoriasis, Neurodermitis, (kutane Sarkoidose) 6. Hämatologische Systemerkrankungen, Hämoglobinopathien (Sichelzellanämie, Thalassämie, etc.) 7. Aufklärung über potentielle Nebenwirkungen der Therapie, Kontrazeption (siehe Aufklärungsbögen Anhang Seite 65ff) 8. Spezieller Check-up vor Einsatz von Proteaseinhibitoren 12 Check-Up vor Therapie Check Begründung und Konsequenz HCV-Typ und -Subtyp Zulassung nur für HCV-Genotyp 1, Subtyp 1b mit besserer Prognose, geringeres Resistenzrisiko Hinweis für zirrhotische Patienten Höhere Relapserate bei Zirrhose, daher längere Therapiedauer empfohlen (siehe Therapieschemata Seite 21 und 23) Check Begründung und Konsequenz Bei virologischen vorbehandelten Patienten: Charakterisierung der viralen Response in der Vortherapie mit PEG-IFN alfa plus Ribavirin (siehe Tabelle ↓) • Das Ausmaß der viralen Suppression in der Vortherapie bestimmt den Erfolg der Triple-Therapie. • Unterschiedliche Therapieschemata in Abhängigkeit von der Response in der Vortherapie Kategorie Definition 1. Non-Response Kein negatives HCV-RNA Ergebnis während der Therapie 1a) Null-Response Abfall der Virämie zu Woche 4 < 1 log Stufe und/oder zu Woche 12 < 2 log Stufen 1b) Partial-Response Abfall der Virämie zu Woche 4 ≥ 1 log Stufe und zu Woche 12 ≥ 2 log Stufen, HCV-RNA zu Woche 24 positiv 2. Relapse Negative HCV-RNA am Therapieende und positive HCV-RNA 6 Monate nach Therapieende 3. Breakthrough HCV-RNA positiv unter Therapie nach Induktion einer kompletten virologischen Response (HCV-RNA negativ) Generell zeigte sich, dass die individuelle Response auf die Vorbehandlung mit PEG-IFN alfa und Ribavirin den entscheidenden Faktor für die Prädiktion der Effektivität der Triple-Re-Therapie darstellt. Je besser die Patienten auf die Vortherapie angesprochen haben, desto höher liegen die Heilungschancen bei der Proteaseinhibitorbasierten Re-Therapie. Die exakte Kategorisierung der initialen virologischen Response auf die vorangegangene duale Therapie gewinnt daher eine zunehmende Bedeutung. 13 Check-Up vor Therapie Check Begründung und Konsequenz Aktuelle Begleitmedikation (auch pflanzliche Präparate z.B. Johanniskraut) Potentielle Interaktionen und Kontraindikationen beachten (siehe Seite 56ff) Check Begründung und Konsequenz Adhärenz zur Medikamenteneinnahme (alle 8 ± 1 Stunden) und Planung der Verlaufskontrollen unter Therapie (engmaschige Überwachung insbesondere in den ersten 12 Wochen) Aufklärung über tägliche Medikamentenzahl: - Boceprevir insgesamt 12 Kapseln (3x 4 Kps.) - Telaprevir insgesamt 6 Tabletten (3x 2 Tabl.) jeweils plus Ribavirin gewichtsadaptiert 4–6 Tabletten. Resistenzrisiko und verminderte Wirksamkeit bei inadäquater Adhärenz Check Begründung und Konsequenz Einnahmehinweise Boceprevir: Boceprevir zusammen mit Nahrung (eine Mahlzeit oder ein leichter Imbiss) Die Einnahme ohne Nahrung kann mit einer signifikanten Reduktion der Wirksamkeit von Boceprevir aufgrund nicht optimaler Resorption verbunden sein. Einnahmehinweise Telaprevir: Einnahme mit kleiner fettreicher Mahlzeit (20 g Fett) Die Einnahme ohne fettreiche Mahlzeit führt zu einer reduzierten Telaprevir-Plasmakonzentration und damit zu einer verminderten Wirksamkeit. Folgende Mahlzeiten sind zu empfehlen: z.B. eine Handvoll Erdnüsse, ca. 60 g Chips, 60 g Käse, 1 Milchreis, 3 Esslöffel Erdnussbutter, 1 Rollmops, 1 Paar Wiener, 2 Portionen Kalbsleberwurst usw. Check Begründung und Konsequenz Sicherstellung der Erreichbarkeit von Arzt und Patient insbesondere in den ersten 12 Wochen der Behandlung. Beachtung von Stoppregeln zur Verhinderung von Resistenzentwicklungen; Management von Nebenwirkungen Merke: Niemals Dosis-Reduktionen von Proteaseinhibitoren, nie Monotherapie! Check Begründung und Konsequenz Patientenaufklärung Aufklärungsbögen für Triple-Therapie mit Boceprevir oder Telaprevir aushändigen (s. Anhang Seite 66 und 67) 14 Basisdiagnostik vor geplanter Therapie 1. Labor • GOT, GPT,γ-GT, AP • Bilirubin, TPZ (Quick), Ferritin, Glucose, Elektrophorese • Hb, Erythrozyten, Leukozyten mit Differenzialblutbild, Thrombozyten • Immunglobuline IgG, IgA, IgM • HCV-RNA (quantitativ), •HCV-Genotypisierung, • HBs-Ag, anti-HBs, anti-HBc, HIV-Ak (Einverständnis des Patienten) • Autoantikörper*: ANA, AMA, SMA, LKM, SLA/LP • TSH basal, Anti-TPO (MAK), TRAK • Kreatinin, Urinsticks (Proteinurie) • AFP, Rheumafaktor** * Die Bestimmung der Autoantikörper empfiehlt sich insbesondere bei V.a. Autoimmunhepatitis, PBC und PSC **Als Surrogatmarker für eine Kryoglobulinämie ist der Rheumafaktor geeignet • Bestimmung des IL28B Status (optional) Der IL28B-Genotyp erlaubt eine individuelle Einschätzung des Therapieansprechens sowohl auf die duale als auch auf die Triple-Therapie. •Resistenztestungen Eine Testung auf Proteaseinhibitor-assoziierte Resistenzvarianten vor und/oder unter Therapie ist aktuell nicht etabliert und wird nicht empfohlen. 2. Sonografie der Oberbauchorgane 3. Beurteilung einer möglichen Leberfibrose • • Leberbiopsie: (nur bei Therapie-relevanter Fragestellung erwägen), siehe Seite 16 und Anlage Seite 68ff Die Indikation zur Leberbiopsie ist gegeben, wenn zu erwarten ist, dass der Befund hinsichtlich des weiteren Vorgehens Konsequenzen hat. Sofern eine Biopsie durchgeführt wird, ist ein Grading (entzündliche Aktivität) und ein Staging (Fibrose) gemäß der Klassifikationssysteme zu fordern. Nicht-invasive Verfahren (FibroScan), siehe Seite 17 15 Fibrosediagnostik: Leberbiopsie Die Einschätzung des Schweregrades einer Leberfibrose bietet eine wichtige Möglichkeit zur Beurteilung der Prognose einer chronischen HCV-Infektion. Auch der Erfolg einer antiviralen Therapie ist vom Grad der Leberfibrose abhängig. Die Leberbiopsie ist somit nicht nur eine sehr gute Möglichkeit den Grad der Fibrose, sondern auch den Grad der Inflammation zu bestimmen. Komplikationen der Leberbiopsie (5-20 % für kleinere Komplikationen und 0,3-0,5 % für ernsthafte Komplikationen) schränken den Nutzen ein und haben den Fokus auf nicht-invasive Maßnahmen zur Fibrosebestimmung gelegt (siehe Seite 17). Hinzu kommt der Stichprobenfehler, insbesondere bei zu geringer Größe des Bioptates, und die nicht unerhebliche Interbeobachtervarianz der histologischen Auswertung. Trotzdem hat auch die Leberbiopsie nach wie vor ihre Berechtigung, da die Histologie zusätzliche Aussagen über die Fibroseentwicklung hinaus ermöglicht, was im Einzelfall sicher sinnvoll sein kann. In der Routine hat die Leberbiopsie bei der Indikationsstellung für die Therapie der Hepatitis C aber heute sicher keine zentrale Bedeutung mehr. Einheitliche Beurteilung: Hepatitis-Aktivitäts-Index (HAI-Score) Entsprechend den Empfehlungen der pathologischen Konsensuskonferenz sollten einheitliche Fibrose-Klassifikationssysteme und Grading-Scores Verwendung finden [Schirmacher 2004]. Zusätzliche Veränderungen (Verfettung, Siderose) sind zu dokumentieren (siehe Anhang Seite 68ff). 16 Fibrosediagnostik: Nicht-invasive Verfahren In den letzten Jahren wurden erhebliche Fortschritte in der Entwicklung von Verfahren zur nicht-invasiven Bestimmung der Leberfibrose / Zirrhose gemacht. Biochemische Tests auf der Basis routinemäßig bestimmter Laborparameter, teilweise in Kombination mit Fibrosemarkern, haben sich bisher auf Grund schlechter Sensitivität und noch schlechterer Spezifität nicht durchgesetzt. Die größte Erfahrung liegt bisher für die transiente Elastografie (Fibroscan®, Echosense Germany, Norderstedt) vor. Es handelt sich um ein nicht-invasives Verfahren zur Bestimmung des Stadiums der Leberfibrose, das auch zur Unterscheidung Fibrose/Zirrhose geeignet ist. Die Technik beruht auf der Messung der Lebersteifheit anhand eines perkutan applizierten Ultraschall-Impulses in den rechten Leberlappen und der durch die Gewebskonsistenz bedingten Abscherung des reflektierten Signals. Da das Verfahren jedoch eine Stand-alone-Lösung mit einem nach wie vor recht teuren technischen Equipment erfordert, wurde intensiv an der Integration solcher Messverfahren in das B-mode-Verfahren der handelsüblichen Ultraschallgeräte geforscht. Bewertung des Steifheitsgrades der Leber mit dem Fibroscan in kPa-Kategorien, verglichen mit Ergebnissen der Leberbiopsie < 5kPa normal 7-9 kPa F2 > 14 kPa F4 Seit kurzem hat sich ein neues Verfahren, das sogenannte Acoustic Radiation Force Impulse (ARFI)-Verfahren (Siemens AG, Healthcare Sector, Erlangen), etablieren können. Auch mit diesem nichtinvasiven Verfahren wird die Elastizität der Leber nach Abgabe eines akustischen Impulses gemessen. Allerdings kann die gemessene Region in der Leber mit dem ARFI-Verfahren besser eingegrenzt werden („Messfenster“). Darüber hinaus ist die Messung während einer normalen B-mode-Untersuchung der Leber möglich. 17 Therapiemanagement Triple-Therapie Die Response-gesteuerte Proteaseinhibitor-basierte Triple-Therapie ist der aktuelle Standard für erwachsene Patienten mit einer chronischen HCV-Genotyp-1-Infektion. Die Response-gesteuerte duale Therapie mit PEG-IFN alfa und Ribavirin findet weiterhin Anwendung bei: • • • Patienten mit chronischer HCV-Genotyp-1-Infektion mit Kontraindikation für Proteaseinhibitoren HCV-Genotyp-1-infizierten Patienten mit hoher Wahrscheinlichkeit für eine rasche virologische Response und Verkürzung der Therapiedauer auf 24 Wochen (günstiger IL28B-Genotyp, niedrige Ausgangsviruslast, keine fortgeschrittene Fibrose) Patienten mit chronischer HCV-Infektion Genotyp 2, 3, 4, 5 und 6 Therapie, Therapiedauer und Stoppregeln einer Proteaseinhibitor-basierten Triple-Therapie Die Therapie mit den beiden Proteaseinhibitoren Boceprevir und Telaprevir, die jeweils in Kombination mit PEG-IFN alfa und Ribavirin eingesetzt werden, unterscheidet sich in folgenden Punkten: • Lead-in-Phase (nur bei Boceprevir) • Dauer der Proteaseinhibitor-Therapie (12 Wochen bei Telaprevir; 24–48 Wochen bei Boceprevir) •Stoppregeln Daher sind für jeden der beiden Proteaseinhibitoren spezifische Schemata für die Durchführung der Response-gesteuerten Triple-Therapie zu beachten (siehe Seite 20ff). 18 Triple-Therapie des HCV-Genotyps 1 Warum Lead in? – Erfahrung aus den Studien Unter einer Lead-in-Phase versteht man die 4-wöchige Vorbehandlung mit PEG-IFN alfa und Ribavirin vor Beginn der Proteaseinhibitor-basierten Triple-Therapie. Die Rationale für die Lead-in-Phase ist 1. 2. 3. 4. die Evaluation der individuellen Suszeptibilität gegenüber der Standardtherapie (dem Rückgrat der Proteaseinhibitor-basierten Behandlung), das Erreichen eines Steady states der Plasmaspiegel beider Präparate und durch initiale Senkung der Viruslast eine günstige Ausgangssituation für die Proteaseinhibitorbasierte Therapie zu schaffen (niedrigere Viruslast = raschere HCV-RNA-Negativierung = niedrigeres Resistenzrisiko). Bei Patienten, die in der dualen vierwöchigen Lead-in-Phase zu Woche 4 HCV-RNA-negativ (RVR) geworden sind, ist bei guten prädiktiven Faktoren (niedrige Ausgangsviruslast, keine Zirrhose, IL28B-CC-Genotyp) der Einsatz von Proteaseinhibitoren nicht unbedingt notwendig. Das Konzept der Lead-in-Phase wurde im Rahmen der Boceprevir-Phase-II-Studie (SPRINT-1) im Vergleich zu einem sofortigen Beginn der Triple-Therapie evaluiert. Eine komplette virologische Response wurde nach 4-wöchiger Triple-Therapie bei 60-64 % der Patienten mit Lead-in- und 37-39 % ohne Lead-in-Phase erreicht. Vier Wochen später glichen sich die kompletten Responseraten jedoch an (62-66 % in den verschiedenen Therapiearmen). Ein signifikanter Effekt auf die SVR-Raten konnte nicht nachgewiesen werden. Numerisch kam es in den Lead-in-Armen seltener zu einem virologischen Durchbruch (Breakthrough-Rate 4 % bzw. 5 % bei Lead-in- vs. 7 % bzw. 12 % ohne Lead-in-Phase). Das Konzept mit sofortigem Beginn der Triple-Therapie wird bei Einsatz von Telaprevir sowie auch bei den meisten aktuellen Entwicklungen mit direkt antiviralen Substanzen favorisiert. In der REALIZE-Studie zeigte sich bei der Telaprevir-basierten Triple-Therapie von vorbehandelten Patienten auch kein signifikanter Vorteil für die mit Lead-in behandelten Patienten. Daher gibt es in Abhängigkeit des verwendeten Proteaseinhibitors zwei unterschiedliche zugelassene Therapieschemata (mit bzw. ohne Lead-in-Phase). Der generelle Nutzen der Lead-in-Strategie ist jedoch nicht gut belegt. Weitere Studien müssen zeigen, welche Patienten von diesem Ansatz profitieren. 19 Triple-Therapie mit Boceprevir in Kombination mit Peg-Interferon alfa und Ribavirin A) Unvorbehandelte Patienten ohne Zirrhose Stoppregel beachten Absetzen aller Medikamente, wenn zu • Woche 12 HCV-RNA ≥ 100 IE/ml • Woche 24 HCV-RNA nachweisbar HCV-RNA nicht nachweisbar HCV-RNA nachweisbar * Kommentar zur HCV-RNA-Bestimmung nach der Lead-in-Phase: Eine HCV-RNA-Bestimmung nach der Lead-in-Phase wird nicht generell empfohlen, könnte aber für die Frage der Notwendigkeit einer Triple-Therapie im Einzelfall sinnvoll sein. PR: PEG-IFN + Ribavirin * Wo 0 Wo 4 HCVRNA HCVRNA Wo 8 Wo 12 Wo 24 4 Wo PR 24 Wo Boceprevir + PR 4 Wo PR 32 Wo Boceprevir + PR HCVRNA Wo 28 Woche 36 Wo 48 HCV-RNA: Kontrolle 24 Wochen nach Therapieende 12 Wo PR B) Partielle Response oder Relapse in der Vortherapie, keine Zirrhose * HCVRNA Wo 0 Wo 4 * HCVRNA HCVRNA Wo 8 Wo 12 Wo 24 4 Wo PR 32 Wo Boceprevir + PR HCVRNA Wo 28 Woche 36 12 Wo PR Wo 48 HCV-RNA: Kontrolle 24 Wochen nach Therapieende Stoppregel beachten * Bei raschem virologischem Ansprechen zu Woche 4 unter Triple-Therapie (= Behandlungswoche 8) und nicht nachweisbarer HCV-RNA zu Woche 24 kann gemäß der US-amerikanischen Fachinformation die gesamte Therapie nach Woche 36 beendet werden. 20 Triple-Therapie mit Boceprevir in Kombination mit PEG-Interferon alfa und Ribavirin C) Null-Response in der Vortherapie und Patienten mit Zirrhose HCVRNA Wo 0 A) Bei Verträglichkeit B) Bei BoceprevirNebenwirkungen* (z.B. Anämie) 4 Wo PR 4 Wo PR Wo 4 HCVRNA Wo 8 Wo 12 HCVRNA Wo 24 HCVRNA Wo 28 Woche 36 44 Wo Boceprevir + PR 32 Wo Boceprevir + PR 12 Wo PR Wo 48 HCV-RNA: Kontrolle 24 Wochen nach Therapieende Stoppregel beachten * Der Vorteil einer 44-wöchigen gegenüber einer 32-wöchigen Triple-Therapie mit Boceprevir ist nicht gut belegt. Daher kann bei deutlichen Nebenwirkungen unter Boceprevir-Therapie in Betracht gezogen werden, in den letzten 12 Wochen statt mit der Triple-Therapie für 12 Wochen lediglich mit der dualen Therapie aus PEG-IFN und Ribavirin fortzufahren. Merke: Therapieverkürzungen auf 28 Wochen nur bei unvorbehandelten Patienten mit rascher virologischer Response (HCV-RNA < 10 IU/ml) zu Woche 8 und 24. 21 Triple-Therapie mit Telaprevir in Kombination mit PEG-Interferon alfa und Ribavirin A) Unvorbehandelte Patienten und Patienten mit Relapse, keine Zirrhose Stoppregel beachten Absetzen aller Medikamente, wenn zu • Woche 12: HCV-RNA > 1.000 IE/ml • Woche 24 oder 36 HCV-RNA nachweisbar * HCVRNA Wo 0 Wo 4 * HCV-RNA nachweisbar HCVRNA HCVRNA Wo 8 Wo 12 12 Wo Telaprevir + PR HCV-RNA nicht nachweisbar Wo 24 12 Wo PR 12 Wo Telaprevir + PR / 36 Wo PR HCVRNA HCVRNA Woche 36 Wo 48 HCV-RNA: Kontrolle 24 Wochen nach Therapieende *Um die Gesamtbehandlungsdauer festlegen zu können, muss in Woche 4 und 12 die HCV-RNA bestimmt werden. In den Phase-3-Studien wurde ein empfindlicher Real-time-PCR-Test (COBAS®-TaqMan® HCV-Test; Version 2.0) mit einer Quantifizierbarkeitsgrenze von 25 IU/ml und einer Nachweisgrenze von 10–15 IU/ml verwendet, um zu entscheiden, ob die HCV-RNA-Konzentrationen nicht mehr nachweisbar waren. Nachweisbare HCV-RNA unterhalb der Bestimmungsgrenze des Assays sollte nicht als Ersatz für „nicht nachweisbar“ angesehen werden, wenn Entscheidungen über die Behandlungsdauer getroffen werden, da dies zu einer unzureichenden Behandlungsdauer und höheren Relapse-Raten führen kann. Merke: Eine Therapieverkürzung auf 24 Wochen erfolgt nur bei • unvorbehandelten Patienten oder Patienten mit Relapse •Patienten ohne Zirrhose • Patienten mit rascher virologischer Response zu Woche 4 und 12 (eRVR; HCV-RNA < 10 IU/ml) Bei allen anderen Patienten wird nach 12-wöchiger Triple-Therapie eine 36-wöchige Erhaltungstherapie mit PEG-IFN und Ribavirin empfohlen. 22 Triple-Therapie mit Telaprevir in Kombination mit PEG-IFN alfa (PEG-IFN) und Ribavirin B) Partielle Response und Null-Response in der Vortherapie, alle Patienten mit Zirrhose HCVRNA Wo 0 Wo 4 HCVRNA Wo 8 Wo 12 12 Wo Telaprevir + PR Wo 24 36 Wo PR HCVRNA HCVRNA Woche 36 Wo 48 HCV-RNA: Kontrolle 24 Wochen nach Therapieende Stoppregel beachten 23 Response-gesteuerte duale Therapieregime mit PEG-Interferon alfa (PEG-IFN) und Ribavirin* • Für Patienten mit chronischer HCV-Genotyp-1** und 4–6-Infektion Therapiebeginn (HCV-RNA Konzentration) Woche 4 HCV-RNA Bestimmung Woche 12 HCV-RNA <12-15 IU/ml1 + vor Therapie <6-8x105 IU/ml2 2 Therapieabbruch HCV-RNA Bestimmung HCV-RNA <12-15 IU/ml1 1 <2 log Abfall bzw. >30.000 IU/ml Woche 24 HCV-RNA Bestimmung HCV-RNA pos. Therapieabbruch HCV-RNA <12-15 IU/ml1 24 Wochen Therapie 48 Wochen Therapie 72 Wochen Therapie Rapid-Responder RVR Standard-Responder cEVR Slow-Responder HCV-RNA mit einem hochsensitiven Assay nicht nachweisbar, <12–15 IU/ml. Grenzwert für Ausgangsviruslast vor Therapie in den zugrundeliegenden Studien für PEG-Interferon alfa 2b bei 600.000 und für PEG-Interferon alfa 2a bei 800.000 IU/ml. Ggf. keine Therapieverkürzung bei negativen Prädiktoren wie fortgeschrittene Fibrose / Zirrhose, ungünstiger IL28B-Genotyp, metabolisches Syndrom, Insulinresistenz und Steatosis hepatis. Keine Daten für Patienten mit normalen Transaminasen. * Dosierungen siehe Seite 28 und 29. **z.B. bei Kontraindikationen für Proteaseinhibitoren oder hoher Wahrscheinlichkeit für RVR in der Lead-in-Phase 24 Response-gesteuerte duale Therapieregime mit PEG-Interferon alfa (PEG-IFN) und Ribavirin* • Für Patienten mit chronischer HCV-Genotyp-2/3-Infektion Therapiebeginn (HCV-RNA Konzentration) Woche 4 HCV-RNA Bestimmung HCV-RNA <12-15 IU/ml1 HCV-RNA <12-15 IU/ml1 + Woche 12 HCV-RNA Bestimmung <2 log Abfall Therapieabbruch HCV-RNA ≥2 log Abfall3 vor Therapie <6-8x105 IU/ml2 12 Wochen Therapie 24 Wochen Therapie 48 Wochen Therapie4 HCV-RNA mit einem hochsensitiven Assay nicht nachweisbar, < 12-15 IU/ml. Keine Therapieverkürzung bei negativen Prädiktoren wie fortgeschrittene Fibrose / Zirrhose. Ggf. Berücksichtigung weiterer negativer Prädiktoren wie Steatosis hepatis und niedrige ALT-Konzentration vor Therapiebeginn. Keine Daten für Patienten mit normalen Transaminasen. 3 Bei fehlendem Abfall der HCV-RNA unter die Nachweisgrenze (< 12-15 IU/ml) bis Woche 24 Therapieabbruch empfohlen. 4 Optimale Therapiedauer bei Slow response nicht bekannt. 48 Wochen werden generell empfohlen. Bei Z. n. Relapse und Slow response können 72 Wochen von Vorteil sein. * Dosierungen siehe Seite 28 und 29. 1 2 Hinweis: Proteaseinhibitoren sind in Kombination mit PEG-IFN alfa und Ribavirin nur zur Behandlung der chronischen HCV-Genotyp-1-Infektion zugelassen. Merke: Telaprevir besitzt keine relevante antivirale Aktivität gegenüber dem HCV-Genotyp 3 und nur begrenzte Wirksamkeit gegenüber dem HCV-Genotyp 4. Telaprevir ist wirksam beim HCV-Genotyp 2. 25 Für Patienten, die nicht für eine Triple-Therapie mit Proteaseinhibitoren in Frage kommen, gelten weiter folgende Regeln: Das Ansprechen auf eine PEG-IFN/Ribavirin-Therapie kann individuell unterschiedlich schnell eintreten. Folgende Response-Typen werden aktuell definiert: • Rasche virologische Responder (RVR): HCV-RNA nicht detektierbar (mittels Real-time-PCRVerfahren oder TMA) innerhalb von 4 Wochen • Komplette frühe virologische Responder (cEVR): HCV-RNA nicht detektierbar zur Woche 12 • Langsame virologische Responder (pEVR): erstmals HCV-RNA nicht detektierbar zur Woche 24, aber Abfall der Viruslast zur Woche 12 >2 log-Stufen im Vergleich zum Therapiebeginn bzw. HCV-RNA-Konzentration< 30.000 IU/ml • Nonresponder (NVR): HCV-RNA > 30.000 IU/ml zur Woche 12 oder HCV-RNA positiv zur Woche 24. 26 Medikamentendosierung: Proteaseinhibitoren Boceprevir und Telaprevir Boceprevir Dosis 800 mg Boceprevir (= 4 Kapseln á 200 mg) alle 7-9 Stunden, insgesamt 12 Kapseln pro Tag Einnahmehinweis Boceprevir soll zusammen mit Nahrung (eine Mahlzeit oder ein leichter Imbiss) eingenommen werden Vergessene Dosis Wenn die Anwendung der nächsten Dosis in weniger als 2 Stunden vorgesehen ist: → vergessene Dosis weglassen. Wenn die Anwendung der nächsten Dosis in 2 oder mehr Stunden vorgesehen ist: → vergessene Dosis zusammen mit Nahrung einnehmen und das übliche Dosierungsschema fortführen. Telaprevir Dosis 750 mg Telaprevir (= 2 Tabletten á 375 mg) alle 8 Stunden, insgesamt 6 Tabletten pro Tag Einnahmehinweis Telaprevir soll zusammen mit einer kleinen fettreichen Mahlzeit (20 g Fett) eingenommen werden. Die Tabletten sind im Ganzen zu schlucken, ohne sie vorher zu kauen, zu teilen oder aufzulösen Vergessene Dosis Wenn dies innerhalb von 4 Stunden nach der normalen Einnahmezeit bemerkt wird: → verschriebene Dosis so rasch wie möglich zusammen mit Nahrung einnehmen Wenn dies erst mehr als 4 Stunden nach der üblichen Einnahmezeit bemerkt wird: → vergessene Dosis auslassen und mit dem normalen Einnahmerhythmus fortfahren. Merke: Die Dosis des Proteaseinhibitors darf nicht reduziert werden! Eine Dosisunterbrechung ist unbedingt zu vermeiden und sollte nur nach Rücksprache mit einem Gastroenterologen erfolgen. 27 Medikamentendosierung: Ribavirin und PEG-IFN Empfehlungen zur Ribavirindosierung zu Therapiebeginn Die Ribavirindosierung erfolgt nach dem Körpergewicht mit ca. 15 mg/kg bei HCV-Genotyp 1 und 4-6 sowie von 12-15 mg/kg Körpergewicht beim Genotyp 2 und 3. Eine höhere Ribavirindosis sollte bei zunehmender Wahrscheinlichkeit eines fehlenden raschen virologischen Ansprechens angestrebt werden (z.B ungünstige Baselinefaktoren wie HCV-Genotyp 3 und hohe Viruslast, fortgeschrittene Fibrose/Zirrhose oder Re-Therapie). Cave: Unter Triple-Therapie ist eine rasche Anämieentwicklung möglich. Daher sind engmaschige Hb-Kontrollen und ggf. Therapieanpassungen durchzuführen. In den Tabellen sind die in der Fachinformation empfohlenen Ribavirindosierungen für die (Triple-)Therapie mit PEG-IFN alfa 2a und 2b wiedergegeben. Körpergewicht (kg) PEG-IFN alfa 2a: Ribavirindosis bei Genotyp 1, 4-6 (nach Fachinformation) < 75 1000 mg > 75 1200 mg Bei HCV-Genotyp 2 und 3: Ribavirindosis 800 mg/d. Bei ungünstigen Baselinefaktoren (z.B. HCV-Genotyp 3, hohe Viruslast, fortgeschrittene Fibrose/Zirrhose) oder Re-Therapie kann bei der dualen Therapie eine Steigerung der Ribavirindosis sinnvoll sein. Körpergewicht (kg) PEG-IFN alfa 2b: Ribavirindosis unabhängig vom HCV-Genotyp (nach Fachinformation)* < 60 800 mg 65 – 80 1000 mg 81 - 105 1200 mg > 105 1400 mg Bei Körpergewichtsverlust muss keine Adjustierung der Dosis erfolgen. (Nebenwirkungsmanagement siehe Seite 52ff) 28 Medikamentendosierung: Ribavirin und PEG-IFN Bitte beachten Sie auch die Hinweise in den jeweiligen Fachinformationen der genannten Präparate. Bei Patienten >60 Jahren oder eingeschränkter Kreatinin-Clearance1 sollten die Ribavirindosis eher nach unten korrigiert werden und eine engmaschige Kontrolle des Hb-Wertes erfolgen. C-Krea (ml/min) = 1 (140-LJ)x KH 72 x S-Krea (mg/ml) [ x 0,85 nur bei Frauen ] 29 PEG-IFN alfa-Dosierung zu Therapiebeginn Die PEG-IFN alfa 2a (Pegasys®)-Dosierung wird unabhängig vom Genotyp und Körpergewicht mit 180 μg/Woche s.c. dosiert. Für PEG-IFN alfa 2b (Pegintron®), sind folgende Dosierungsschritte erforderlich: Körpergewicht (kg) PEG-IFN alfa-2b (Pegintron®) Dosierung/Woche (1,5 µg/kg) s.c. Wöchentliche Dosis Stärke des Injektors (µg/0,5 ml) <50 70 µg 0,45 ml (80-µg-Injektor) 50 80 µg 0,5 ml (80-µg-Injektor) 60 90 µg 0,45 ml (100-µg-Injektor) 70 100 µg 0,5 ml (100-µg-Injektor) 80 120 µg 0,5 ml (120-µg-Injektor) >90 150 µg 0,5 ml (150-µg-Injektor) Zu injizierende ml Die Dosierung kann nach klinischer Verträglichkeit im Therapieverlauf angepasst werden, wobei jeweils nach oben aufgerundet werden sollte. 30 Labormonitoring unter Therapie Nachbeobachtung Woche -1 0 2 4 6 8 12 16 20 24 28 32 36 40 44 48 4 12 24 Basisdiagnostik GPT1 Hb2 Diff.-Blutbild, bei Leukopenie Thrombozyten TSH Glucose HCV-RNA* (quantitativ) Duale Therapie Boceprevir - Triple 3 ()4 Telaprevir - Triple 3 ()4 Kreatinin AFP6 ()5 ()5 * Real-time-PCR 1 Transaminasen können unter Therapie trotz virologischer Response erhöht bleiben. Bei Anstieg der Transaminasen im Verlauf der Therapie: V. a. Breakthrough, evtl. HCV-RNA-Kontrolle erforderlich 2 Unter Triple-Therapie können ggf. noch engmaschigere Hb-Kontrollen notwendig sein. 3 HCV-RNA-Kontrolle zu Woche 2 unter Triple-Therapie empfohlen (Therapieadhärenz, Abschätzung des Therapieerfolges) 4 Laborkontrollen mit Beginn der Triple-Therapie. Während der 4-wöchigen Lead-in-Phase können Laborkontrollen zu Woche 2 (Hb, Blutbild?) und zu Woche 4 (Blutbild, HCV-RNA?) sinnvoll sein. 5 Weitere engmaschige HCV-RNA-Kontrollen können bei Patienten mit persistierender Virämie innerhalb der Stoppregeln sinnvoll sein, um eine Resistenzentwicklung frühzeitig zu erkennen. 6 Bei Zirrhose alle 6 Monate Bei Therapieverlängerung in der dualen Therapie auf 72 Wochen im 4-wöchentlichen Abstand die Kontrollen wie in Woche 24–48 31 Management von Patienten mit Relapse oder Non-Response HCV-Genotyp 1 Empfehlungen bei Relapse Beim HCV-Genotyp 1 sollte eine Re-Therapie mit Proteaseinhibitor-basierten Regimen erfolgen (siehe Therapiealgorithmen, Seite 20 und 22). Empfehlungen bei Non-Response Beim HCV-Genotyp 1 sollte eine Re-Therapie mit Proteaseinhibitor-basierten Regimen erfolgen (siehe Therapiealgorithmen, Seite 21 und 23). Für Patienten, die in der Vorgeschichte auf eine Therapie mit einem HCV-Proteaseinhibitor in Kombination mit PEG-IFN und Ribavirin nicht angesprochen haben, liegen keine klinischen Daten für eine erneute Behandlung vor. HCV-Genotyp nicht-1 Bei HCV-Genotyp-nicht-1-Infektion ist vor dem Hintergrund zukünftiger Therapieoptionen abzuwägen, wie dringend die Indikation für eine erneute duale antivirale Therapie ist (rasche Progression der chronischen Hepatitis C bzw. fortgeschritten Fibrose oder Zirrhose). Eine Biopsie ist zu diesem Zeitpunkt empfehlenswert zur Bestimmung des Fibrosestadiums. Eine Re-Therapie sollte entsprechend der Empfehlungen wie bei bisher nicht vorbehandelten Patienten in Abhängigkeit von der Viruskinetik, gegebenenfalls auch über 72 Wochen durchgeführt werden. 32 Spezielle Patientengruppen: Therapie bei HIV/HCV-Koinfektion Seit der Einführung der gut wirksamen antiretroviralen Therapien haben sich Komplikationen der chronischen HCV-Infektion zu einer der häufigsten verbleibenden Todesursachen bei HIV-Patienten entwickelt. Dies ist teilweise durch den rascheren Verlauf der Leberfibrose bei zellulärer Immundefizienz begründet. Durch eine frühzeitige antiretrovirale Therapie kann die Immundefizienz zumindest teilweise aufgehoben und dadurch die leberbedingte Mortalität reduziert werden. Aus diesem Grunde ist unabhängig von einer möglichen Therapie der chronischen HCV-Infektion die Indikation für eine antiretrovirale Therapie frühzeitig gegeben. Bei der Auswahl der antiretroviralen Substanzen sollte das mögliche lebertoxische Nebenwirkungspotential berücksichtigt werden. Generell sollte bei jeder Erstdiagnose einer HIV-Infektion unter anderem eine Untersuchung der HCVAntikörper erfolgen. Diese sollte bei erhöhten Leberwerten oder einem entsprechenden Expositionsrisiko wiederholt werden. Bei Patienten mit dem Verdacht auf eine akute Hepatitis C bzw. auf eine Reinfektion ist ergänzend die Bestimmung der HCV-RNA erforderlich. Als Basisuntersuchung sollten identische Untersuchungen wie für HCV-monoinfizierte Patienten erfolgen (HCV-RNA, HCV-Genotyp, Transaminasen, Cholestaseparameter, Lebersyntheseparameter, invasive oder nicht-invasive Fibrosebestimmung, ggf. IL28B-Polymorphismus, Abdomensonographie). Für Patienten mit Leberzirrhose sollte eine Ösophagogastroduodenoskopie zur Abklärung von Varizen erfolgen. Zur Verlaufskontrolle der chronischen HCV-Infektion bei HIV-Koinfizierten sind neben einer Kontrolle der Laborparameter alle 3-6 Monate eine Abdomensonographie alle 12 Monate und ggf. eine Bestimmung des Leberfibrosegrades einmal pro Jahr erforderlich. Für Patienten mit Leberzirrhose werden eine Abdomensonographie alle 6 Monate zum Screening des hepatozellulären Karzinoms und ein Staging der Ösophagusvarizen einmal pro Jahr empfohlen. 33 Spezielle Patientengruppen: Therapie bei HIV/HCV-Koinfektion HCV-Genotypen 2, 3 und 4–6 Durch die Verfügbarkeit der neuen HCV-Proteaseinhibitoren Boceprevir und Telaprevir, die zur Behandlung der chronischen Hepatitis C vom Genotyp 1 zugelassen sind, hat sich die Behandlung der HCV-Genotypen 2, 3 und 4-6 nicht verändert. Diese HCV-Genotypen sollten 48 Wochen mit einem dualen Regime aus PEG-IFN und Ribavirin therapiert werden. Die Patienten erhalten eine Ribavirindosis von 1000–1200 mg/Tag, unabhängig vom HCVGenotyp. Wenn der Abfall der HCV-RNA nach 12 Wochen weniger als 2 log10 Stufen beträgt, oder die HCV-RNA zu Woche 24 der Therapie weiter positiv ist, sollte die Therapie abgebrochen werden. Unter einer Behandlung mit Interferon und Ribavirin ist die gleichzeitige Gabe von Didanosin und Ribavirin kontraindiziert; Stavudin oder Zidovudin sollten, wenn möglich, ebenfalls nicht mit Ribavirin zusammen eingesetzt werden. Im Falle einer gleichzeitigen Therapie mit Abacavir sollte die Ribavirindosis >15 mg/kg Körpergewicht betragen. HCV-Genotyp 1 Bisher bestand die Standardtherapie der HCV-Genotyp-1-Infektion aus einer Behandlung mit PEG-IFN alfa und Ribavirin (1000-1200 mg/d) über 48 Wochen (RVR, Fibrosegrad < METAVIR 2) bzw. 72 Wochen. Mit der Zulassung der beiden HCV-Proteaseinhibitoren Boceprevir und Telaprevir haben sich die therapeutischen Optionen für Patienten mit dem HCV-Genotyp 1 erweitert. Jedoch liegen bisher nur Interimsergebnisse für HIV/HCV-koinfizierte Patienten kleinerer Studien mit Telaprevir und Boceprevir vor. Dabei wurde eine deutliche Verbesserung der Ansprechraten zu Beginn der Therapie (RVR, EVR, Woche 24) beschrieben. Langzeitergebnisse (SVR) für HIV/HCV-koinfizierte Patienten sind wahrscheinlich für Anfang 2012 zu erwarten. Aufgrund bisher vorliegender Interaktionsstudien ist der gemeinsame Einsatz von Telaprevir mit Atazanavir/r in der Standarddosis oder mit Efavirenz in einer Dosissteigerung von Telaprevir auf 1125 mg alle 8 Stunden empfohlen. Aufgrund einer deutlichen Spiegelreduktion von Telaprevir wird von einer Kombination mit Lopinavir/r, Darunavir/r oder Fosamprenavir/r abgeraten. Ein Einsatz zusammen mit Raltegravir ist möglich. 34 Spezielle Patientengruppen: Therapie bei HIV/HCV-Koinfektion Für Boceprevir liegen derzeit keine abschließend beurteilbaren Interaktionsdaten vor. Der gemeinsame Einsatz mit Tenofovir ist möglich. Die klinische Bedeutung der reduzierten mittleren Talspiegel von Boceprevir durch den NNRTI Efavirenz ist beispielsweise noch unklar. Daten zu den HIV-Proteaseinhibitoren oder Raltegravir stehen noch aus. Da sich die Datenlage in der nahen Zukunft erweitern dürfte, ist eine Aktualisierung z. B. unter www.hep-druginteractions.org erforderlich. Es sollten nur antiretrovirale Medikamentenkombinationen mit ausreichenden Interaktionsdaten eingesetzt werden. Seit mehreren Jahren findet eine Epidemie der akuten Hepatitis C unter schwulen Männern statt. Die frühzeitige Behandlung der Hepatitis C innerhalb der ersten Monate nach Infektion ist mit deutlich besseren SVR-Raten verbunden. Aus diesem Grund wird die Behandlung der akuten Hepatitis C mit PEG-IFN alfa in der Regel mit gewichtsadaptiertem Ribavirin über 24-48 Wochen je nach RVR für alle Patienten ohne Kontraindikation empfohlen. 35 Spezielle Patientengruppen: Therapie HCV-infizierter Patienten mit einer Substitutionsbehandlung Zeitpunkt der Behandlung: Die Substitutionsbehandlung mit Opiaten stellt keine Kontraindikation für eine HCV-Behandlung dar. Die Substitutionsbehandlung gilt als ein besonders gutes Setting für eine HCV-Therapie. Spezielle Vorbedingungen Die Patienten sollten bestimmte persönliche und soziale Bedingungen erfüllen: • hohe Motivation zur antiviralen Behandlung • stabile Substitution oder stabile Abstinenz. Bei Einsatz von Proteaseinhibitoren ist aufgrund der Arzneimittelinteraktionen ggf. eine Dosisanpassung von Methadon notwendig. • kein unkontrollierter Beikonsum. Bei Einsatz von Proteaseinhibitoren ist ein eventueller Beikonsum von Benzodiazepinen im Hinblick auf Arzneimittelinteraktionen zu beachten (s. S. 56ff). • gute Compliance • fester Wohnsitz und geregelte finanzielle Versorgung Die Behandlungseinrichtung sollte auf hepatologischem sowie suchtmedizinischem / psychiatrischem Gebiet spezialisiert sein. Aktiv konsumierende Patienten können in besonderen Ausnahmefällen ebenfalls behandelt werden, wenn die Heroinversorgung unter stabilen Bedingungen geschieht. 36 Spezielle Patientengruppen: Therapie HCV-infizierter Patienten mit einer Substitutionsbehandlung Management psychiatrischer Begleiterkrankungen Drogenkonsumenten weisen in 30-60 % der Fälle neben der Abhängigkeit eine weitere psychiatrische Diagnose auf. Häufig muss in Absprache mit dem Psychiater prophylaktisch eine antidepressive, anxiolytische oder neuroleptische Therapie vor der HCV-Therapie begonnen werden. Wegen der Interaktionen und Nebenwirkungen eignen sich für die antidepressive Therapie besonders Escitalopram1, für die anxiolytische Therapie Escitalopram1 plus Alprazolam und für die neuroleptische Therapie vor allem atypische Neuroleptika mit Ausnahme von Clozapin. Bei der gleichzeitigen Gabe von Telaprevir und (Es)Citalopram1 kommt es zu einer geringen Senkung der (Es)Citalopram-Spiegel1; demzufolge ist evtl. eine moderate Citalopram1-Dosissteigerung notwendig. Besondere Komplikationen •Heroinrückfälle • Erhöhter Nebenkonsum von psychoaktiven Substanzen • Psychiatrische Episoden (psychotische Phasen, delirante Episoden, Derealisation, Depersonalisation, Angstattacken, Depression) 1 Hinweise: • Citalopram und Escitalopram werden mit dosisabhängiger QT-Intervall-Verlängerung in Zusammenhang gebracht (Rote-Hand-Briefe vom 31.10.2011 (Citalopram) und 5.12.2011 (Escitalopram). • Die Maximaldosis von Citalopram beträgt jetzt 40 mg täglich. Bei älteren Patienten und Patienten mit eingeschränkter Leberfunktion wird die Maximaldosis auf 20 mg täglich gesenkt. • Bei Patienten über 65 Jahren wird die Maximaldosis von Escitalopram auf 10 mg täglich gesenkt. Bei erwachsenen Patienten unter 65 Jahren bleibt die Maximaldosis von Escitalopram bei 20 mg täglich. • Citalopram und Escitalopram sind bei Patienten mit bekannter QT-Intervall-Verlängerung oder angeborenem Long-QT-Syndrom kontraindiziert. • Die gleichzeitige Anwendung von Citalopram und Escitalopram mit anderen Arzneimitteln, die bekannterweise das QT-Intervall verlängern, ist kontraindiziert. • Bei Patienten mit erhöhtem Risiko für eine Torsade-de-Pointes-Tachykardie, z.B. bei denen mit Herzinsuffizienz, einem kürzlich aufgetretenen Myokardinfarkt, Bradyarrhythmien oder einer aufgrund von Begleiterkrankungen oder Begleitmedikation bestehenden Neigung zu Hypokaliämie oder Hypomagnesiämie, ist Vorsicht geboten. • Patienten sollten angewiesen werden, sofort einen Arzt aufzusuchen, wenn sie während der Einnahme von Escitalopram eine anormale Herzfrequenz oder einen anormalen Herzrhythmus feststellen. 37 Nebenwirkungsmanagement: Psychiatrie Was ist vor Beginn der HCV-Therapie zu tun? 1. Psychiatrische / Psychosomatische Basiserhebung • aktuelle Befragung nach emotionalen Problemen wie Traurigkeit, Ängste, Antriebsarmut, Sorgen, Schlafstörungen, Impulsivität, Reizbarkeit • Frage nach früheren oder aktuellen psychiatrischen oder psychotherapeutischen Behandlungen • Frage nach psychopharmakologischer Therapie • Suchtanamnese mit der Frage nach Drogenabusus, regelmäßigem Konsum von Alkohol, Schlafmittel • Frage nach psychosozialer Situation: Soziale Kontakte, Berufsanamnese, familiäre Situation, Kinder (Kleinkinder!), fester Wohnsitz, aktuelle psychosoziale Belastungen (Schulden, Kündigung, etc.) 2. Wann ist eine fachärztliche Psychiatrische / Psychosomatische Konsultation vor Therapiebeginn empfehlenswert? • bei Vorliegen von psychiatrischen Risikofaktoren • bei Patienten mit psychiatrischen Erkrankungen oder auffälliger psychosozialen Anamnese 3. Risikofaktoren für psychiatrische Nebenwirkungen während einer IFN-Therapie • Aktuelle Drogenabhängigkeit (Delir, Psychosen) • Depressionen zu Beginn der Therapie • Hirnorganische Vorschädigung (Delir, kognitive Störung) • HIV-Koinfektion • Eigene oder familiäre Vorgeschichte von mehreren Suizidversuchen • Impulskontrollstörung (Reizbarkeit, Impulsivität) • Dissoziale Persönlichkeitsstörung (Reizbarkeit, Impulsivität) 38 Nebenwirkungsmanagement: Psychiatrie 4. Wann ist eine prophylaktische antidepressive Therapie indiziert? Eine antidepressive Vorbehandlung (Prophylaxe) erscheint sinnvoll bei Risikofaktoren für die Entwicklung IFN-induzierter Depressionen. Dazu gehören: • Depressionen in der Anamnese • Entwicklung einer Depression bei einer vorangegangenen Interferon-basierten Therapie • Suchterkrankungen in der Anamnese Patienten mit aktueller Depression erhalten eine antidepressive Therapie vor Beginn der IFN-Therapie. Die antidepressive Vorbehandlung sollte 2-4 Wochen vor, spätestens bei Beginn der antiviralen Therapie begonnen werden. Die Indikation und Art einer psychopharmakologischen Vorbehandlung sollte auf Empfehlung des Psychiaters erfolgen. Psychiatrische Erkrankungen stellen unter Berücksichtigung einer interdisziplinären Zusammenarbeit und ggf. prophylaktischen Therapie keine Kontraindikation gegen eine IFN-Therapie dar. Ausnahmen: Absolute Kontraindikationen gegen eine Interferontherapie stellen schwere nicht ausreichend therapierbare oder stabilisierbare psychiatrische Syndrome bzw. Krankheitsbilder und akute Suizidalität dar. Bei einer Proteaseinhibitor-basierten Triple-Therapie sind darüber hinaus die Kontraindikationen und Empfehlungen bezüglich der Arzneimittelwechselwirkungen zu beachten (siehe Seite 56ff.). 39 Nebenwirkungsmanagement: Psychiatrie Psychiatrisches Monitoring während der Therapie Psychiatrische Erkrankungen, insbesondere Depressionen können zu jeder Zeit unter Therapie und auch in den ersten Monaten nach Therapieende auftreten. Das Häufigkeitsmaximum liegt zwischen der 4. und 12. Therapiewoche. Bei jeder Visite erfolgt daher eine Befragung nach depressiven Symptomen (z.B. Traurigkeit, Antriebsarmut, Schlafstörungen, Reizbarkeit bzw. Impulskontrollstörungen, etc.). Als Hilfe kann der Patientenfragebogen „Kurzfragebogen zur Einschätzung psychiatrischer Veränderungen während einer IFN-Behandlung (KIB)“ dienen. Haben Sie bei sich unter der Therapie mit Interferon alfa folgende Symptome bemerkt? Zutreffendes bitte ankreuzen ja nein leicht/ selten mittel/ häufig 1. Schlafstörungen (verkürzt, unterbrochen) 2. ständige Müdigkeit, verlängerter Schlaf 3. erhöhte Reizbarkeit 4. erhöhte Ängstlichkeit 5. Stimmungsinstabilität, spontanes Weinen 6. Antriebslosigkeit, Lustlosigkeit 7. depressive Verstimmung 8. Konzentrations- und Gedächtnisstörungen 9. Gefühl der inneren Leere/Gefühllosigkeit 10. Rückzug von Famiilie und Freundeskreis 11 . Gefühl, dass alles sinnlos ist/Lebensüberdruss 12. Selbstmordgedanken 13. Gefühle, beobachtet oder verfolgt zu werden 14. Gefühl, dass sich die Umwelt und das Verhalten der Mitmenschen seltsam verändert haben Kurzfragebogen zur Einschätzung psychiatrischer Veränderungen während einer IFN-Behandlung [Schäfer 2004] 40 schwer/ dauernd Nebenwirkungsmanagement: Psychiatrie 1. Interferon-assoziierte Schlafstörungen (Insomnien) • treten oft am Therapiebeginn auf und können ein Frühsymptom einer psychiatrischen Erkrankung (Depressionen, Manien, Psychosen) sein. Eine Schilddrüsenfunktionsstörung sollte ausgeschlossen werden Therapieempfehlung: • Schlafmittel (z.B. Zolpidem, Zopiclon) bei fehlender depressiver Symptomatik, zeitlich limitiert. Bei Anwendung mit Telaprevir ist die Zolpidem-Exposition um 47 % reduziert, so dass ggf. eine Dosissteigerung von Zolpidem in Erwägung gezogen werden sollte. Für die Anwendung von Boceprevir mit Zolpidem liegen keine Daten vor. Die gleichzeitige Behandlung mit oral angewendetem Midazolam oder Triazolam und Telaprevir ist kontraindiziert. • Antidepressiva bei Depression (z.B. Mirtazapin, Doxepin). o Mirtazapin ist ein CYP3A4-Substrat. Daher sind bei Anwendung mit Telaprevir bzw. Boceprevir erhöhte Mirtazapin-Spiegel möglich! Untersuchungen hierzu liegen bisher noch nicht vor. o Doxepin ist ein CYP2D6-Substrat, so dass Interaktionen mit den beiden HCV-Protease inhibitoren unwahrscheinlich sind. Untersuchungen hierzu liegen bisher noch nicht vor. 2. Interferon-assoziierte Depressionen Therapieindikation • • • bei schwerer depressiver Symptomatik ist eine antidepressive Therapie zwingend indiziert bei leichten bis mittelschweren depressiven Symptome kann ebenfalls eine antidepressive Therapie erwogen werden die Indikationsstellung zur Therapie und Wahl der psychopharmakologischen Behandlung sollte in Zusammenarbeit mit einem Psychiater erfolgen 41 Nebenwirkungsmanagement: Psychiatrie Therapievorschläge: • Citalopram ist am besten untersucht bezüglich der Wirksamkeit und Verträglichkeit bei IFN-induzierten Depressionen Dosierung (Einmalgaben): Citalopram beginnend mit 10 mg/Tag bzw. Escitalopram beginnend mit 5 mg/Tag, Dosiserhöhung nach klinischer Symptomatik alle 8-14 Tage (bis maximal 40 mg/Tag bei Citalopram bzw. 20 mg/Tag bei Escitalopram). • Citalopram und Escitalopram werden mit dosisabhängiger QT-Intervall-Verlängerung in Zusammenhang gebracht. o Die Maximaldosis von Citalopram beträgt jetzt 40 mg täglich. Bei älteren Patienten und Patienten mit eingeschränkter Leberfunktion wird die Maximaldosis auf 20 mg täglich gesenkt. o Bei Patienten über 65 Jahren wird die Maximaldosis von Escitalopram auf 10 mg täglich gesenkt. Bei erwachsenen Patienten unter 65 Jahren bleibt die Maximaldosis von Escitalopram bei 20 mg täglich (siehe auch Hinweise auf Seite 37). Bei Anwendung mit Telaprevir ist die Escitalopram-Exposition um 35 % reduziert, was jedoch bei der großen therapeutischen Breite von Escitalopram als nicht relevant erachtet wird. Ggf. kann eine Dosissteigerung von Escitalopram in Betracht gezogen werden. Untersuchungen zur Anwendung von Boceprevir und Escitalopram liegen bisher noch nicht vor. • Mirtazapin ist das Medikament der ersten Wahl bei Schlafstörungen. Dosierung: abends beginnend mit 15 mg, Erhöhung um 15 mg alle 8-14 Tage bis maximal 60 mg/Tag (siehe auch Hinweise zu Mirtazapin auf Seite 41). Die antidepressive Therapie sollte für mindestens 6 Wochen nach Therapieende fortgeführt und dann ausgeschlichen werden. Eine Nachbeobachtung des Patienten ist notwendig. 3. Kognitive Störungen / Gedächtnisstörungen • Während einer IFN-Therapie können vorübergehende leichte kognitive Störungen beobachtet werden. In Einzelfällen wurden lang anhaltende kognitive Störungen beobachtet. • Bei schweren kognitiven Störungen bzw. Gedächtnisstörungen ist fachärztliche psychiatrische Abklärung empfohlen (DD: Schilddrüsenfunktionsstörungen, Depressionen, Delir). 42 Nebenwirkungsmanagement: Psychiatrie 4. Reizbarkeit / Impulskontrollstörungen • Das Vorhandensein von Reizbarkeit und Störungen der Impulskontrolle sollten auch durch die Fremdanamnese (Vertrauensperson) regelmäßig erfragt werden. • Bei schwerer Reizbarkeit mit Aggressivität und Impulskontrollstörungen ist eine fachärztliche psychiatrische Abklärung empfohlen (DD: Schilddrüsenfunktionsstörungen, Manie). • Therapieoptionen sind neben der Schlafregulation auch die Gabe von Antidepressiva (z.B. Citalopram/Escitalopram). Siehe auch Hinweise auf Seite 42. 5. Manie • Eine Manie stellt einen psychiatrischen Notfall dar und erfordert eine sofortige fachärztliche psychiatrische Behandlung 6. Suizidalität • Eine Abklärung der Suizidalität erfolgt bei allen Patienten mit psychiatrischen Symptomen (aktiv erfragen). Bei Verdacht auf Suizidalität ist die fachärztlich psychiatrische Abklärung umgehend erforderlich. Wann ist eine sofortige psychiatrische Vorstellung notwendig? • Akute Suizidalität • Unklare oder schwere psychiatrische Syndrome bzw. Krankheitsbilder (Manie, Psychose, mittelschwere bis schwere Depression, Delir, Wesensänderung, Impulsivität, Aggressivität, etc.) Therapieabbruch: Bei schweren psychiatrischen Nebenwirkungen (Manie, Suizidalität, schwere nicht kontrollierbare Depression, etc.) sollte bei fehlenden Therapiemöglichkeiten und aufgrund einer Risiko-Nutzen Abwägung ein Abbruch der IFN-basierten antiviralen Therapie erwogen werden. 43 Nebenwirkungsmanagement: Dermatologie Im Folgenden werden zunächst die dermatologischen Nebenwirkungen der IFN-/Ribavirin-Therapie der Hepatitis C besprochen, beginnend mit den am häufigsten auftretenden Nebenwirkungen der Behandlung. Diese sind zumeist leichter Natur und in der Regel nicht dosisabhängig. Anschließend werden spezielle Empfehlungen zum Rash-Management bei einer Telaprevir-basierten Triple-Therapie gegeben. Dermatologische Nebenwirkungen der IFN-/Ribavirin-Therapie Häufige leichtgradige kutane Nebenwirkungen einer IFN alfa Therapie:* Nebenwirkung Häufigkeit Maßnahmen Zu beachten Xerosis (Trockenheit) Ca. 30 % Haut: rückfettende Maßnahmen Sehr trocken: Dermatop Basisfettsalbe® Trocken: Dermatop Basissalbe® Mäßig trocken: Dermato Basiscreme®, handelsübliche Cremes oder Salben (keine Lotiones) Harnstoffhaltig begleitend: Excipial U Lipolotio®, Optiderm Fettcreme® Mund: Lutschbonbons, Kaugummi (Wrigley´s extra®), künstlicher Speichel (Glandosane-Spray®) Nase: Coldastop Nasenöl® Augen: Liquifilm®, Sicca Protect® Vagina: Linoladiol N-Creme®, Vaginalgel Fetten der Haut wichtigste Propyhlaxe Pruritus Ca. 30 % Juckreizstillende Cremes (Physiogel® a.i. Creme, Optiderm® Creme/Fettcreme) Wenn notwendig orale Antihistaminika: Fenistil ®, Xusal ® (nicht sedierend); Atarax ® (leicht sedierend). Zu möglichen Interaktionen s. Seite 49 und 50. Diffuse Alopezie Bis 50 % Keine spezifischen Maßnahmen. Ausschluss Schilddrüsenstörung, Eisen-Stoffwechselstörung. Aufklärung des Patienten vor Therapie. Normales Haarkleid nach Beendigung der Therapie Reaktion an der Injektionsstelle häufig Erythem: keine Behandlung, Induration: feuchte Umschläge, bei Schmerzen Voltaren Emulgel® lokal Superinfektion: Antiseptikum (Linola Sept Creme®) Ulzeration/Nekrose: Konsil Dermatologie Erythem generalisiert selten Keine Ödem selten Keine (wenn kardiale Ursachen ausgeschlossen) * Bei schwerer Ausprägung Mitbehandlung durch Dermatologen empfohlen 44 Haarverlust von 5-15 % der Haare. Keine totale Alopezie Auf Ungefährlichkeit hinweisen Nebenwirkungsmanagement: Dermatologie Aufgrund der Schwere des Krankheitsbildes gehören die folgenden Erkrankungen zu den Kontraindikationen für eine IFN-Therapie: Pemphigus vulgaris, Lupus erythematodes. Schwere kutane Nebenwirkungen einer IFN alfa Therapie: Mitbehandlung durch Dermatologen empfohlen. Nebenwirkung Häufigkeit Maßnahmen Zu beachten Psoriasis Selten Psorcutan®, Daivobet®, Psoralon® 0.5-3.0 %, Lygal-Kopfsalbe® (Kopf), UV-Bestrahlung, ggf. antipsoriatische Systemtherapie Bei ausgeprägter Gelenkbeteiligung Therapieabbruch Vaskulitis Selten Lokale oder systemische Immunsuppression Immer genaue Diagnostik erforderlich! Nur bei schweren Formen Therapieabbruch UrtikariaVaskulitis Selten NSAIDs, Cyclophosphamid Urtikae ortsständig Pemphigus vulgaris Selten systemische Immunsuppression Therapieabbruch Bullöses Pemphigoid Selten systemische Immunsuppression Abbruch nur bei schwerer Verlaufsform Porphyria cutanea tarda Selten Aderlässe, Chloroquin 2x125 mg/Woche , Lichtschutz Zusätzliche Auslöser: Alkohol, Östrogene, Barbiturate SLE Selten systemische Immunsuppression ANA nur bei 75 % der Patienten; Therapieabbruch Raynaud Symptomatik Selten Glukokortikosteroide, Cyclophosphamid, Nifedipin (oral und topisch möglich), Pentoxifyllin, ggf. Iloprost (Ilomedin®) Bei schweren Formen Therapieabbruch Lichen ruber Bis 30 % Topische Klasse IV Glukokorticosteroide (Dermoxin®), UV-Bestrahlung, Retinoide (Neotigason 30 mg/d), Antihistaminika: Fenistil® ,Atarax® (sedierend), Cetirizin®, Xusal®, Lorano®, Aerius® (nicht sedierend); Zusätzliche Assoziation: Diabetes mellitus, Hypercholesterinämie, Hyperurikämie, Colitis ulcerosa, Pemphigus vulgaris, Lupus E. Pyoderma gangraenosum Selten Lokalbehandlung (z.B: Hydrokolloidverbände) topische (z. B. Glukokortikosteroide, Calcineurininhibitor Protopic®) und systemische Immunsuppression oftmals notwendig Zusätzliche Assoziation: M. Crohn, Colitis ulzerosa, Lymphome, Leukämien 45 Nebenwirkungsmanagement: Dermatologie Diese Hauterkrankungen können unter einer IFN-Behandlung neu auftreten oder sich verschlechtern, bedingen aber nicht notwendigerweise einen Behandlungsabbruch. Sollte eine immunsuppressive Therapie der Hauterkrankung nötig sein, kann in der Regel die antivirale Therapie fortgesetzt werden. Mögliche Interaktionen zwischen Telaprevir und Glukokortikosteroiden sollten jedoch Beachtung finden (siehe auch Seite 50). Nicht jede dieser dermatologischen Erkrankungen ist eine Nebenwirkung der IFN-Therapie. Die folgenden Erkrankungen können durch die Hepatitis C selbst ausgelöst werden: Lichen ruber planus, Vaskulitiden (z.B. Kryoglobulin-assoziierte Vaskulitis, Immunkomplexvaskulitis, Urtikaria-Vaskulitis), Porphyria cutanea tarda. Kutane Nebenwirkungen einer Ribavirin-Therapie sind: Pruritus, Alopezie, Psoriasis, Xerostomie, Urtikaria. Da diese Nebenwirkungen auch unter einer IFN-Therapie auftreten können, sollte dies bei der Frage nach den Auslösern berücksichtigt werden. Abb. 1: Porphyria cutanea tarda Abb. 2: Vaskulitis Abb. 3: Psoriaris vulgaris Abb. 4: Lichen ruber 46 Nebenwirkungsmanagement: Dermatologie Rash-Management bei einer Telaprevir-basierten Triple-Therapie Während der Behandlung mit Telaprevir waren die allgemeine Inzidenz und der Schweregrad von Hautausschlägen erhöht, wenn Telaprevir gemeinsam mit PEG-IFN alfa und Ribavirin (Triple-Therapie) angewendet wurde. Bei der Triple-Therapie wurden Hautauschläge (alle Schweregrade 1-3) bei 55 % der Patienten und bei 33 % der Patienten unter PEG-IFN alfa und Ribavirin allein beobachtet. Hierbei waren mehr als 90 % der Exantheme leicht oder mittelgradig (Grad 1-2) ausgeprägt (siehe Tabelle unten). Rash-Management: Übersicht zu Hautausschlägen unter Telaprevir-basierter Triple-Therapie und zur Adaptation der Therapie Hautbefall Adaptation des Therapieregimes Grad I (leicht) lokalisierte Hautveränderungen oder Hautveränderungen mit begrenzter Verteilung, mit oder ohne Pruritus, keine systemischen Symptome, kein Befall von Schleimhäuten, keine Zeichen der Epidermolyse In der Regel kein Absetzen von Telaprevir notwendig Grad II (mittelgradig) Disseminierter Hautbefall bis zu 50% der gesamten Hautoberfläche mit oder ohne oberflächliche Abschälung, Juckreiz, Befall der Schleimhäute ohne Ulzeration, keine Mitreaktion anderer Organe Absetzen von Telaprevir meist nicht nötig - bei fortschreitendem Hautbefall sollte Telaprevir abgesetzt werden - das Absetzen von Ribavirin und PEG-IFN alfa sollte erwogen werden, wenn innerhalb von 7 Tagen keine Besserung der Symptome eintritt, oder auch früher, wenn es zu einer Verschlimmerung nach Absetzen des Telaprevir kommt. Grad III (schwer) generalisierte Hautveränderungen entweder, - > 50% der Hautoberfläche betreffend oder Exanthem mit oBläschen/Blasen o Oberflächlichen Mundschleimhautulzerationen, oEpidermolyse, o typischen oder atypischen „Zielscheiben“-Läsionen o tastbarer Purpura/nicht abblassendem Erythem Umgehendes Absetzen von Telaprevir Lebensbedrohlich oder systemisch Stevens-Johnson-Syndrom (SJS), Toxische epidermale Nekrolyse (TEN), Drug reaction with eosinophilia and systemic symptoms (DRESS), Erythema multiforme (EM)*, Akute generalisierte exanthematische Pustulose (AGEP), Exanthem, das eine systemische Steroidgabe erfordert Dauerhafter Abbruch aller Therapeutika Das Absetzen von Ribavirin und PEG-IFN alfa sollte erwogen werden, wenn innerhalb von 7 Tagen keine Besserung der Symptome eintritt, oder auch früher, wenn es zu einer Verschlimmerung nach Absetzen des Telaprevir kommt. *Das EM ist nicht lebensbedrohlich, erfordert aber eine sorgfältige Überwachung bezüglich einer möglichen Entwicklung von SJS oder TEN, die einen sofortigen Therapieabbruch erfordern. 47 Nebenwirkungsmanagement: Dermatologie 48 Abb. 5: Grad 1 Reaktion (lokalisiert) Abb. 6: Grad 2 Reaktion (bis zu 50% der Körperoberfläche) Abb. 7: Grad 3 Reaktion (mit Vesikeln und Pusteln) Abb. 8: „Target“-Läsion Nebenwirkungsmanagement: Dermatologie Grad 1-2 Reaktion Charakteristika der Hautveränderungen Grad 1-2 (>90% der Hautreaktionen) • Beginn zu einem beliebigen Zeitpunkt (zur Hälfte innerhalb der ersten 4 Wochen) •Juckreiz •Trockenheit • ekzematöse Hautveränderungen • langsames Fortschreiten oder stabiler Befund Management von Hautveränderungen Grad 1-2 Die Patienten sollten bereits vorbeugend zu einer regelmäßigen Hautpflege mit rückfettenden Cremes (siehe Tabelle Seite 44) angehalten werden. Für die Hautpflege empfiehlt es sich, ca. 15 Minuten täglich, am besten gleich nach Dusche oder Bad (z. B. mit rückfettendem Balmandol Ölbad) einzuplanen. Zudem sollten Faktoren, die die Hauttrockenheit fördern (z. B. trockenes Klima, häufiges Waschen und Baden) vermieden werden. Beim Auftreten von Hautveränderungen können topische Glukokortikosteroide der Klasse 2-3 (mittelstark bis stark wirksam) zum Einsatz kommen, zum Beispiel: • Klasse 2 Glukokortikosteroide: Dermatop® Creme/Fettsalbe • Klasse 3 Glukokortikosteroide: Ecural® Creme/Fettcreme, MomeGALEN® Es sollte auf das Auftragen einer genügenden Menge geachtet werden, wobei eine Fingerspitze voller Creme ca. für ein Areal von zwei Handflächen ausreichen sollte. Topische Calcineurininhibitoren sind aufgrund der gestörten Hautbarriere und des Risikos von systemischen Spiegeln eher nicht indiziert. Zusätzlich zur topischen Glukokortikosteroidtherapie können orale Antihistaminika angewendet werden. Hierbei sind jedoch bestimmte Kontraindikationen und Anwendungshinweise aufgrund von Arzneimittelinteraktionen zu beachten, weil Telaprevir nicht gleichzeitig mit Wirkstoffen angewendet werden darf, deren Clearance stark von CYP3A abhängt. Weil das Antihistaminikum Terfenadin (Teldane®) intensiv über CYP3A4 metabolisiert wird, ist mit erhöhten Plasmakonzentrationen von Telaprevir zu rechnen, die mit schweren lebensbedrohlichen Ereignissen (Herzrhythmusstörungen) assoziiert sein können. Daher ist die gleichzeitige Anwendung von Telaprevir und Terfenadin kontraindiziert. Darüberhinaus sollte das Antihistaminium Fexofenadin (Telfast®), das Wirkungen auf das Transporterprotein P-Glykoprotein hat, wegen möglicher Interaktionen mit Telaprevir nicht eingesetzt werden. 49 Nebenwirkungsmanagement: Dermatologie Alternativen sind Dimetinden1 (Fenistil®), Hydroxyzin2 (Atarax®) (sedierend), Cetirizin® (Cetirizin)3 und Lorano® (Loratadin)4. Hinweise: 1. 2. 3. 4. Eine Interaktion mit Dimetinden ist unwahrscheinlich, jedoch bisher nicht untersucht. Vorsicht: Hydroxyzin ist ein CYP3A4-Substrat. Eine Interaktion mit Telaprevir (erhöhte Plasmakonzentrationen von Hydroxyzin) ist möglich, jedoch bisher nicht untersucht. Cetirizin und Levocetirizin: Die Kombination mit Telaprevir ist möglich. Eine Interaktion mit Telaprevir wurde bisher nicht untersucht, ist jedoch unwahrscheinlich. Vorsicht: Loratadin ist ein CYP3A4-Substrat. Eine Interaktion mit Telaprevir (erhöhte Plasmakonzentrationen von Loratatdin) ist möglich, jedoch bisher nicht untersucht. Systemische Glukokortikosteroide werden in der Regel bei Grad 1-2 Reaktionen nicht erforderlich sein. Die Gabe ist auch nicht empfehlenswert, da Prednison und Methylprednisolon über CYP3A verstoffwechselt werden: Der CYP3A Inhibitor Telaprevir kann somit zu erhöhten Dosisspiegeln der Glukokortikosteroide führen. Systemisches Dexamethason wiederum induziert CYP3A und kann zu einem verstärkten Abbau von Telaprevir führen (cave: Wirkungsverlust). Bei Grad 1 Reaktionen sollten die Patienten zwei bis vier Tage nach Beginn des Exanthems wieder einbestellt werden, bei Grad 2 Reaktionen bereits nach zwei Tagen, um eine mögliche Progredienz der Erkrankung zu beurteilen, wobei diese jedoch bisher selten (in weniger als 10%) der Fälle aufgetreten ist. Ein Abbruch der Kombinationsbehandlung mit Telaprevir ist bei leichten und in der Regel auch bei mittelgradigen Hautveränderungen nicht erforderlich. Grad 3 Reaktion In Studien kam es bei 4,8 % der Patienten unter Triple-Therapie mit Telaprevir, PEG-IFN alfa und Ribavirin sowie bei 0,4 % unter der dualen Therapie mit PEG-IFN alfa und Ribavirin zu schweren Hautausschlägen (überwiegend ekzematös pruritisch und mit einer Ausdehnung auf mehr als 50% der Körperoberfläche). Telaprevir sollte bei Grad 3 Reaktionen umgehend abgesetzt werden, ggf. auch die gesamte Kombinationstherapie (siehe Empfehlungen Seite 47). 50 Nebenwirkungsmanagement: Dermatologie Schwere, lebensbedrohliche Hautausschläge Bei 0,4 % der Studienpatienten bestand ein Verdacht auf ein schweres Arzneimittelexanthem unter dem Bild eines Drug rash with eosinophilia and systemic symptoms/DRESS. Weniger als 0,1 % der Patienten hatten ein Stevens-Johnson-Syndrom. Beim Auftreten solcher schwerer, lebensbedrohlicher Hautreaktionen muss die Kombinationstherapie umgehend abgebrochen werden, und es besteht die Notwendigkeit zu einer intensiven topischen und systemischen Therapie unter Hinzuziehung eines Dermatologen. Kriterien, bei denen eine schwere, lebensbedrohliche Hautreaktion in Betracht gezogen werden sollte DRESS SJS/TEN Alarmzeichen: 1. Beginn 5-10 Wochen nach der ersten Gabe 2. Schnell fortschreitendes Exanthem 3. Prolongiertes Fieber (>38,5°C) 4.Gesichtsödem Bestätigungskriterien: 1. Vergrößerte Lymphknoten 2. Eosinophilie (>700/µl oder >10 %) 3. Atypische Lymphozyten 4. Erhöhung der ALAT oder AP (> das Zweifache) 5. Kreatininanstieg (>150 %) Wenn ein Bestätigungskriterium gefunden wird, so ist die Therapie umgehend abzubrechen und dermatologischer Rat einzuholen 1. 2. 3. 4. Schnell fortschreitendes Exanthem Schmerzen der Haut Schleimhautläsionen an >2 Stellen Blasen oder Epidermolyse (unabhängig von der Einstichstelle des PEG-IFN) 5. Atypische/typische „Zielscheiben(Target)“– Läsionen* Bei Auftreten von Symptom 3 oder 4, ist die Therapie umgehend abzubrechen und dermatologischer Rat einzuholen * Zielscheiben-(Target)-Läsionen sind Hautveränderungen, die typischerweise einen dreizonalen Aufbau zeigen mit einem zentralen lividen Erythem, ggf. mit Blasenbildung, einer mittleren Zone mit abgeblasstem Erythem und einem äußeren stärkeren Erythem (siehe Abb. 8). Atypische Läsionen lassen den dreizonalen Aufbau vermissen. An eine AGEP-Reaktion (Akute generalisierte exanthematische Pustulose) sollte gedacht werden, wenn nicht follikulär gebundene pustulöse Hautveränderungen auf erythematösem Grund, bevorzugt in den Hautfalten, auftreten. Begleitend können eine Neutrophilie und Allgemeinsymptome auftreten. Auch hier ist umgehend ein Therapieabbruch indiziert und dermatologischer Rat einzuholen. Ärzte sollten sicherstellen, dass die Patienten vollständig über das Risiko schweren Hautausschlages informiert sind und sich mit ihrem behandelnden Arzt unverzüglich in Verbindung setzen, sobald ein Hautausschlag erstmals auftritt oder sich ein bestehender Hautausschlag verschlechtert. Alle Hautausschläge sollten auf eine Progression hin und bis zu ihrem Abklingen überwacht werden. Andere Arzneimittel, die mit schweren Hautreaktionen assoziiert sind (z. B. Sulfonamide, Allopurinol, Carbamazepin, Phenytoin, Piroxicam, Meloxicam), sollten während der Telaprevir-Kombinationsbehandlung mit Vorsicht angewendet werden, damit mögliche Unklarheiten bei der Zuordnung von schweren Hautreaktionen zum auslösenden Arzneimittel vermieden werden. Auch nach Ende der Telaprevir-Gabe kann es einige Wochen dauern, bis Hautausschläge abgeklungen sind. 51 Nebenwirkungsmanagement: Hämatologie Empfehlungen zum Management der Anämie bei Triple-Therapie mit den Proteaseinhibitoren Telaprevir bzw. Boceprevir: Empfohlene Blutbildausgangswerte vor Beginn der Therapie Hämoglobin ≥ 12-13 g/dl Thrombozyten ≥ 90.000/mm³ Neutrophile Granulozyten ≥ 1500/mm³ Blutbildkontrollen unter Therapie: Woche 2, 4, 6, 8, 12, dann monatlich Bei Abfall des Hämoglobins ≤ 10g/dl und ≥ 8,5 g/dl: Reduktion des Ribavirin um je 200 mg Bei Abfall des Hämoglobins ≤ 8 g/dl bei Herzgesunden ≤ 10 g/dl bei Patienten mit KHK trotz Ribavirin Dosisreduktion Transfusionen erwägen vor Absetzen des Ribavirins 1. 2. Ribavirin Dosisreduktion als 1. Maßnahme, da eine reduzierte Ribavirindosis in der Triple-Therapie mit Proteaseinhibitoren keinen negativen Einfluss auf die SVR hat. Die Gabe von Erythropoetin-Produkten ist off label. Cave: Keine Dosisreduktion der Proteaseinhibitoren erlaubt. Eine einmal unterbrochene Behandlung mit Proteaseinhibitoren sollte nicht wieder aufgenommen werden. 52 Nebenwirkungsmanagement: Hämatologie Inzidenz der Zytopenien unter Triple- vs. duale Therapie Telaprevir + PEG/Riba Dual PEG/Riba Boceprevir + PEG/Riba Dual PEG/Riba Lymphopenie <500 /ml 15 % 6 % k.A. k.A. Leukopenie < 1500 /ml < 500 /ml 6 % k.A. 5 % k.A. 23 % 7 % 10 % 4 % Thrombopenie < 50.000/ml 3% 1% 5% 2 % Empfehlungen zum Management der Neutropenie bei Triple-Therapie mit den Proteaseinhibitoren Telaprevir bzw. Boceprevir nach Fachinformation: Bei Abfall der Neutrophilenzahl ≤ 750/µl: Dosisreduktion des PEG-IFN alfa Bei Abfall der Neutrophilenzahl < 500/µl: Absetzen der Kombinationstherapie bis zur Erholung der Neutrophilenzahl > 1000/µl Hinweise Infektionsrisiko unter PEG-IFN-basierter Therapie unabhängig von Leukozytenzahl erhöht Risikofaktoren für Infektionen: - höheres Alter - Diabetes mellitus - fortgeschrittene Fibrose / Zirrhose Leukopenie ist reversibel keine Indikation für die Gabe von Wachstumsfaktoren wie z.B. G-CSF Empfehlungen zum Management der Thrombozytopenie bei Triple-Therapie mit den Proteaseinhibitoren Telaprevir bzw. Boceprevir: Bei Abfall der Thrombozytenzahl ≤ 50.000/µl: Dosisreduktion des PEG-IFN alfa Bei Abfall der Thrombozytenzahl < 25.000/µl: Absetzen der Kombinationstherapie bis zur Erholung der Thrombozytenzahl > 50.000/µl 53 Nebenwirkungsmanagement: Hämatologie Hinweise Nadir der Thrombozytopenie zwischen Woche 12-48 zu erwarten. Thrombozytopenie ist reversibel. 54 Blutungsgefahr erst bei Thrombozyten <25.000/µl erhöht. Cave: Bei PEG-IFN alfa-induzierter Immunthrombopenie hohes Blutungsrisiko. Generell keine Indikation für die Gabe von Thrombozyten-Wachstumsfaktoren (z.B. Elthrombopag), da hierunter vereinzelt Pfortaderthrombosen beobachtet wurden. Bei Zirrhose-Patienten in Studien war die Gabe von Elthrombopag mit höheren SVR-Raten assoziiert. In Einzelfällen kann der Einsatz von Thrombopoetinagonisten indiziert sein (z.B. HIV-Infektion + ITP). Es sollte dann mit einer niedrigeren Dosis begonnen werden. Ziel: Thrombozytenzahl zwischen 30 und 40/µl. Nebenwirkungsmanagement: Endokrinologie Schilddrüsenfunktionsstörungen infolge Autoimmunthyreopathien sind mit etwa 15 % die häufigsten endokrinen Nebenwirkungen der Interferon-Therapie. Alle übrigen unter Interferon-Therapie vorkommenden endokrinen Nebenwirkungen sind extrem selten. Die Schilddrüsenfunktionsstörungen sind meist reversibel und der Verlauf blande. Risikofaktoren für die Entwicklung einer Schilddrüsenfunktionsstörung sind die Hepatitis C selbst, weibliches Geschlecht, Alter, vorbestehende Autoimmunthyreopathien, begleitende Tumorerkrankungen, Dauer der Therapie und Dosis des Interferons. Basisdiagnostik vor Beginn der Therapie Anamnese, klinischer Befund, Schilddrüsensonografie, sowie die Bestimmung von TSH, TRAK und Anti-TPO (MAK). Monitoring während der Therapie Im Rahmen des Therapiemonitorings sind regelmäßige TSH-Kontrollen zur Woche 0, 12, 24, 36, 48, 72 oder bei schilddrüsenassoziierten Symptomen zu bestimmen. Bei TSH > 2,5 mU/ml (Hypothyreose) sollte zusätzlich fT4 bestimmt werden, bei TSH < 0,3 mU/ml (Hyperthyreose) fT4 und fT3 sowie TRAK. Die Bestimmung von Anti-TPO und TRAK im Verlauf ist nur bei unklaren Befunden erforderlich, eine erneute Sonografie der Schilddrüse kann sinnvoll sein, ist aber nicht unbedingt erforderlich. Eine Therapie der Schilddrüsenfunktionsstörungen erfolgt nur bei entsprechender Klinik, bei Hypothyreose mit L-Thyroxin, bei Hyperthyreose mit Thiamazol oder Carbimazol (ggf. in Kombination mit einem Betablocker). 55 Interaktionen Pharmakologische Interaktionen spielten in der HCV-Therapie mit PEG-IFN alfa und Ribavirin bislang eine sehr untergeordnete Rolle. Dies hat sich mit der Zulassung der ersten Proteaseinhibitoren, Boceprevir und Telaprevir, grundlegend geändert. Beim Einsatz von Proteaseinhibitoren müssen Interaktionen mit Medikamenten, die über Cytochrom P450 3A (CYP3A, v.a. CYP3A4) verstoffwechselt werden, beachtet werden, wobei Boceprevir und Telaprevir unterschiedliche Interaktionen zeigen. Die Interaktionen können sowohl zu einer Steigerung als auch zur Reduktion der jeweiligen Medikamentenspiegel führen. Einer sorgfältigen Medikamentenanamnese kommt daher große Bedeutung zu. Zu berücksichtigen sind dabei auch Genussmittel und pflanzliche Stoffe. So ist z. B. Johanniskraut ein potenter Induktor des CYP3A4, Naringin (ein Bestandteil in Grapefruitsaft) ein potenter Inhibitor. Ein drug monitoring für Boceprevir und Telaprevir ist bisher nicht etabliert. Da in der nächsten Zeit neue Daten zu Interaktionen zu erwarten sind, sollte bei Fragestellungen zu möglichen Interaktionen bei einer Proteaseinhibitor-basierten Triple-Therapie nicht nur die jeweilige Fachinformation konsultiert werden, sondern auch ein Interaktions-Check in der laufend aktualisierten Datenbank http://www.hep-druginteractions.org der Universität Liverpool vorgenommen werden. Die Tabelle auf Seite 60-61 gibt einen Überblick über mögliche Interaktionen (Stand der Information: Sept. 2011). 56 Interaktionen A) Boceprevir Boceprevir ist ein starker CYP3A4/5-Inhibitor. Bei Arzneimitteln, die hauptsächlich durch CYP3A4/5 verstoffwechselt werden, kann es bei gleichzeitiger Anwendung mit Boceprevir zu einer erhöhten Exposition kommen, wodurch die therapeutischen Wirkungen und Nebenwirkungen dieser Arzneimittel möglicherweise verstärkt bzw. verlängert werden. Die Substanz hemmt oder induziert nicht die anderen Enzyme von CYP450. Boceprevir wird auch durch die Aldo-Keto-Reduktase (AKR) metabolisiert. Daher sind Interaktionen in insgesamt geringerem Umfang als unter Telaprevir zu erwarten. In Wechselwirkungsstudien mit Arzneimitteln, die mit den AKR-Inhibitoren Diflunisal und Ibuprofen durchgeführt wurden, stieg die Boceprevir-Verfügbarkeit nicht auf ein klinisch relevantes Ausmaß an. Boceprevir kann mit AKRInhibitoren zusammen angewendet werden. Boceprevir ist kontraindiziert bei gleichzeitiger Anwendung von Arzneimitteln, deren Clearance in hohem Maße von CYP3A4/5 abhängt und bei denen erhöhte Plasmakonzentrationen mit schwerwiegenden und/oder lebensbedrohlichen Ereignissen assoziiert sind, beispielsweise bei • oraler Anwendung von Midazolam und Triazolam • Bepridil, Pimozid • Lumefantrin, Halofantrin • Tyrosin-Kinase-Inhibitoren und Ergotderivaten (Dihydroergotamin, Ergonovin, Ergotamin, Methylergonovin) Nicht empfohlen wird die gleichzeitige Anwendung von Boceprevir mit Rifampicin oder Antikonvulsiva (wie Phenytoin, Phenobarbital oder Carbamazepin), die signifikant den Plasmaspiegel von Boceprevir senken können. Mit Vorsicht sind Arzneimittel (wie Amiodaron, Chinidin, Methadon, Pentamidin und einige Neuroleptika) anzuwenden, für die eine Verlängerung des QT-Intervalls bekannt ist. 57 Interaktionen B) Telaprevir Telaprevir wird im Wesentlichen durch das CYP3A metabolisiert. Telaprevir ist kontraindiziert bei gleichzeitiger Anwendung mit Wirkstoffen, deren Clearance stark von CYP3A abhängt und deren erhöhte Plasmakonzentrationen mit schweren und/oder lebensbedrohlichen Ereignissen assoziiert sind, wie • • • • Herzrhythmusstörungen (z. B. Amiodaron, Astemizol, Bepridil, Cisaprid, Pimozid, Chinidin, Terfenadin), peripheren Vasospasmen oder Ischämien (z. B. Dihydroergotamin, Ergometrin, Ergotamin, Methylergometrin), Myopathie einschließlich Rhabdomyolyse (z. B. Lovastatin, Simvastatin, Atorvastatin), verlängerter oder verstärkter Sedierung oder Atemdepression (z. B. oral angewendetes Midazolam oder Triazolam) oder Hypotonie oder kardialer Arrhythmie (z. B. bei Alfuzosin und Sildenafil zur Behandlung einer pulmonal-arteriellen Hypertonie) • Telaprevir darf nicht gleichzeitig mit Klasse-Ia- oder Klasse-III-Antiarrhythmika, außer intravenös verabreichtem Lidocain, angewendet werden. • Telaprevir soll gemeinsam mit den Klasse-Ic-Antiarrhythmika Propafenon und Flecainid mit Vorsicht angewendet werden, angemessene klinische und EKG-Kontrollen eingeschlossen. • Rifampicin reduziert die AUC im Plasma für Telaprevir um ungefähr 92%. Aus diesem Grund darf Telaprevir nicht gleichzeitig mit Rifampicin angewendet werden. • Die Plasmakonzentrationen von Telaprevir können bei gleichzeitiger Anwendung des pflanzlichen Arzneimittels Johanniskraut (Hypericum perforatum) vermindert sein. Aus diesem Grund dürfen pflanzliche Präparate, die Johanniskraut enthalten, nicht gleichzeitig mit Telaprevir angewendet werden. • Die gleichzeitige Anwendung mit Enzyminduktoren kann zu einer verringerten Exposition mit dem Risiko einer verminderten Wirksamkeit von Telaprevir führen. Starke CYP3A-Induktoren wie Carbamazepin, Phenytoin und Phenobarbital sind kontraindiziert. • Schwache und mäßige CYP3A-Induktoren sollten gemieden werden, insbesondere bei Patienten, die frühere Non-Responder sind (partielle oder Null-Responder für PEG-IFN alfa/Ribavirin), es sei denn, es liegen spezifische Dosierungshinweise vor. 58 Interaktionen Kontraindizierte Arzneimittel bei Anwendung von Boceprevir und Telaprevir Arzneimittelklasse Kontraindizierte Arzneimittel Alpha 1-Adrenorezeptor Antagonist Alfuzosin Antikonvulsiva Carbamazepin, Phenobarbital, Phenytoin Antimykotika Rifampicin Ergotamin Derivative Dihydroergotamin, Ergonovin, Ergotamin, Methylergonovin GI-Motilitätshemmer Cisaprid Pflanzliche Arzneimittel Johanniskrautpräparate (Hypericum perforatum) Arzneimittelklasse Kontraindizierte Arzneimittel HMG CoA Reduktase Inhibitoren Lovastatin, Simvastatin Orale Kontrazeptiva Drosperinon PDE5-Inhibitoren Sildenafil oder Tadalafil bei Anwendung zur Behandlung der pumonal-arteriellen Hypertonie Neuroleptika Pimozid Sedativa / Hypnotika Triazolam; oral verabreichtes Midazolam Boceprevir Telaprevir Boceprevir Telaprevir (auch Atorvastatin) FDA. http://www.accessdata.fda.gov/drugsatfda_docs/label/2011/202258lbl.pdf. Aufgerufen Juni 2011. FDA. http://www.accessdata.fda.gov/drugsatfda_docs/label/2011/201917lbl.pdf. Aufgerufen Juni 2011. 59 Daten zu pharmakokinetischen Wechselwirkungen von Boceprevir und Telaprevir. Stand der Information: September 2011 Boceprevir Telaprevir Analgetika Boceprevir Buprenorphin o Clozapin o Diflunisal Pimozid Ibuprofen Virostatika Methadon Amantadin Antiarrhythmika Cidofovir Amiodaron Foscarnet Bepridil Anxiolytika / Hypnotika / Sedativa Digoxin Alprazolam o Midazolam (parenteral) Propafenon Triazolam Quinidin Zolpidem Antibakterielle Arzneimittel Bronchodilatatoren Aminoglykoside (IV) Salmeterol Clarithromycin Theophyllin o Kalziumkanalblocker Dapson Amlodipin o Moxifloxacin Diltiazem o Rifabutin Felodipin Rifampicin Nicardipin Erythromycin Telithromycin o o Nifedipin Trimethoprim/ Sulfamethoxazol Nisoldipin o Verapamil o Vancomycin Kontrazeptiva und Hormonersatztherapien Antikonvulsiva Drospirenon Carbamazepin Ethinylestradiol Phenobarbital Norethindron Phenytoin PDE5-Inhibitoren (Erektile Dysfunktion) Antidepressiva Sildenafil o o Tadalafil Desipramin Escitalopram o Vardenafil Trazodon Magen-/Darm-Therapeutika Antimykotika Antazida Amphotericin B Cimetidin Itraconazol Cisaprid Ketoconazol Esomeprazol Posaconazol Ranitidin Voriconazol Arzneimittel zur Behandlung von Hepatitis Anti-Migränemittel Interferone Dihydroergotamin PEG Interferon alfa Ergonovin Ergotamin Methylergonovin 60 o Midazolam (oral) Flecainid Lidocain Telaprevir Antipsychotika/Neuroleptika o o o o Boceprevir Telaprevir Boceprevir Nukeosid/tid Analoga Lipidsenkende Arzneimittel Adefovir Atorvastatin Entecavir Fibrate Lamivudin Lovastatin Ribavirin Simvastatin Telbivudin Andere Medikamente Tenofovir Alfuzosin Bosentan Pflanzliche Arzneimittel o Colchicin Johanniskrautpräparate Tolbutamid Arzneimittel zur Behandlung von HIV Warfarin Entry / Integrase Inhibitoren Maraviroc Telaprevir o Steroide o Raltegravir Budesonid NNRTIs Dexamethason Fluticason Efavirenz Etravirin o o Nevirapin o o Methylprednisolon o Prednison o Antihistaminika* NRTIs Abacavir Terfenadin Didanosin (DDI)* Fexofenadin o Hydroxyzin o Loratadin o Emtricitabin Stavudin (d4T)* Dimetinden Zidovudin (AZT)* Cetirizin / Levocetirizin Proteaseinhibitoren * siehe auch Hinweise Seite 49/50 Atazanavir Darunavir Fosamprenavir Indinavir o Lopinavir Nelfinavir o Modifiziert nach Nelson D, Jensen D und Sulkowski M. HCV Clinical Management Resource 2011. http://img.medscape.com/article/746/388/HCV_746388.pdf (aufgerufen am 7. Sept. 2011). o Saquinavir o Tipranavir o PDE-5 Inhibitoren zur Behandlung der PAH** Sildenafil Tadalafil Immunosuppressiva Azathioprin Cyclosporin LEGENDE Gefüllte Symbole zeigen an, dass weitere Informationen zu den Wechselwirkungen auf der Webseite www.hep-druginteractions.org abrufbar sind. Leere Symbole zeigen an, dass die Interaktion nicht beurteilt worden ist (weder in einer Studie noch innerhalb der Fachinformation) und auf Basis des metabolischen Profils prädiziert wurde. Sirolimus / / Tacrolimus dürfen nicht zusammen verabreicht werden mögliche Interaktion, engmaschiges Monitoring, Änderung der Dosierung oder des Zeitpunktes der Verabreichung gegebenenfalls in Betracht ziehen * Wegen Interaktionen/additiver Toxizität gilt eine Komedikation von IFN/Ribavirin mit DDI, d4T oder AZT als kontraindiziert ** PAH = pulmonal-arterielle Hypertonie / keine klinisch signifikanten Interaktionen zu erwarten 61 Literatur Afdhal N, Dieterich D, Pockros PJ et al. Epoetin alfa maintains ribavirin dose in HCV-infected patients: A prospective double-blind, randomized controlled study. Gastroenterology 2004; 126:1302-1311 Aspinall R, Pockros P. Review article:the management of side-effects during therapy for hepatitis C . Aliment Pharmacol Ther 2004; 20: 917-929 Backmund M, Hinrichsen H, Rossol S, Schütz Ch, Soyka M, Wedemeyer H, Reimer R. Therapie der chronischen Hepatitis C bei intravenös Drogengebrauchern. Suchtmed 2006;8:129-133 Bacon BR, Gordon SC, Lawitz E, Marcellin P, Vierling JM, Zeuzem S, Poordad F, Goodman ZD, Sings HL, Boparai N, Burroughs M, Brass CA, Albrecht JK, Esteban R; HCV RESPOND-2 Investigators. Boceprevir for previously treated chronic HCV genotype 1 infection. N Engl J Med. 2011 Mar 31;364(13):1207-17. Beck AT, Ward CH, Mendelson M et al.: An inventory for measuring depression. Arch Gen Psychiatry 1961; 4: 561–571 Bedossa P, Poynard T, the METAVIR Cooperative Group. Inter- and intra-observer variation in the assessment of liver biopsy of chronic hepatitis C. Hepatology 1994;20;1:15-20. Berg T, von Wagner M, Nasser S, Sarrazin C, Heintges T, Gerlach T, Buggisch P, Goeser T, Rasenack J, Pape GR, Schmidt WE, Kallinowski B, Klinker H, Spengler U, Martus P, Alshuth U, Zeuzem S. Extended treatment duration for hepatitis C virus type 1: comparing 48 versus 72 weeks of peginterferon-alfa-2a plus ribavirin. Gastroenterology. 2006;130(4):1086-97 Bräu N, Salvatore M, Ríos-Bedoya CF, Fernández-Carbia A, Paronetto F, Rodríguez-Orengo JF, Rodríguez-Torres M. Slower fibrosis progression in HIV/HCV-coinfected patients with successful HIV suppression using antiretroviral therapy. J Hepatol. 2006 Jan;44(1):47-55. EACS Guidelines: www.europeanaidsclinicalsociety.org Gölz J. DGS-Leitlinien für die Basisdiagnostik, das Monitoring und die Behandlung der Hepatitis C bei Drogenkonsumenten mit intravenösem Konsum. Suchttherapie 2002;3:1-6 van Heeswijk R, Vandevoorde A, Boogaerts G, Vangeneugden T, de Paepe E, Polo R, Van Solingen-Ristea R, de Backer K, Garg V and Beumont M: Pharmacokinetic Interactions Between Antiretroviral Agents and the Investigational HCV Protease Inhibitor Telaprevir in Healthy Volunteers: CROI 2011: 119 Jacobson IM, McHutchison JG, Dusheiko G, Di Bisceglie AM, Reddy KR, Bzowej NH, Marcellin P, Muir AJ, Ferenci P, Flisiak R, George J, Rizzetto M, Shouval D, Sola R, Terg RA, Yoshida EM, Adda N, Bengtsson L, Sankoh AJ, Kieffer TL, George S, Kauffman RS, Zeuzem S; ADVANCE Study Team. Telaprevir for previously untreated chronic hepatitis C virus infection. N Engl J Med. 2011 Jun 23;364(25):2405-16. Jensen DM, Morgan TR, Marcellin P, Pockros PJ, Reddy KR, Hadziyannis SJ, Ferenci P, Ackrill AM, Willems B. Early identification of HCV genotype 1 patients responding to 24 weeks peginterferon alfa-2a (40 kd)/ribavirin therapy. Hepatology. 2006 May;43(5):954-60 Kasserra C, Hughes E, Treitel M, Gupta S and O'Mara E: Clinical Pharmacology of Boceprevir: Metabolism, Excretion, and Drug-Drug Interactions CROI 2011: 118 Kasserra C, Hughes E, Treitel M, Gupta S and O‘Mara E: Clinical Pharmacology of Boceprevir: Metabolism, Excretion, and Drug-Drug Interactions. CROI 2011: 118. Kwo PY, Lawitz EJ, McCone J, Schiff ER, Vierling JM, Pound D, Davis MN, Galati JS, Gordon SC, Ravendhran N, Rossaro L, Anderson FH, Jacobson IM, Rubin R, Koury K, Pedicone LD, Brass CA, Chaudhri E, Albrecht JK; SPRINT-1 investigators. Efficacy of boceprevir, an NS3 protease inhibitor, in combination with PEG-IFN alfa-2b and ribavirin in treatment-naive patients with genotype 1 hepatitis C infection (SPRINT-1): an open-label, randomised, multicentre phase 2 trial. Lancet. 2010 Aug 28;376(9742):705-16. Kwodley K. Hematologic side effects of interferon and ribavirin therapy. J Clin Gastroenterol 2005,39: S3- S9 Laufer N, Laguno M, Perez I, Cifuentes C, Murillas J, Vidal F, Bonet L, Veloso S, Gatell JM, Mallolas J. Abacavir does not influence the rate of virological response in HIV-HCV-coinfected patients treated with pegylated interferon and weight-adjusted ribavirin. Antivir Ther. 2008;13(7):953-7 Lewden C, Salmon D, Morlat P, Bévilacqua S, Jougla E, Bonnet F, Héripret L, Costagliola D, May T, Chêne G; Mortality 2000 study group. Causes of death among human immunodeficiency virus (HIV)-infected adults in the era of potent antiretroviral therapy: emerging role of hepatitis and cancers, persistent role of AIDS. Int J Epidemiol. 2005 Feb;34(1):121-30. Louie KS, Micallef JM, Pimenta JM, Forssen UM. Prevalence of thrombocytopenia among patients with chronic hepatitis C: a systematic review. J Viral Hepat 2011; 18:1-7. Mocroft A, Rockstroh J, Soriano V, Ledergerber B, Kirk O, Vinogradova E, Reiss P, Katlama C, Phillips AN, Lundgren JD; EuroSIDA Study Group. Are specific antiretrovirals associated with an increased risk of discontinuation due to toxicities or patient/physician choice in patients with hepatitis C virus coinfection? Antivir Ther. 2005;10(7):779-90 62 Poordad F, McCone J Jr, Bacon BR, Bruno S, Manns MP, Sulkowski MS, Jacobson IM, Reddy KR, Goodman ZD, Boparai N, DiNubile MJ, Sniukiene V, Brass CA, Albrecht JK, Bronowicki JP; SPRINT-2 Investigators. Boceprevir for untreated chronic HCV genotype 1 infection. N Engl J Med. 2011 Mar 31;364(13):1195-206. Qurishi N, Kreuzberg C, Lüchters G, Effenberger W, Kupfer B, Sauerbruch T, Rockstroh JK, Spengler U. Effect of antiretroviral therapy on liver-related mortality in patients with HIV and hepatitis C virus coinfection. Lancet. 2003 Nov 22;362(9397):1708-13. Radloff, L.S. The CES-D Scale: A self-report depression-scale for research in the general population. Applied Psychological Measurement 1977;1:385-401 Radloff LS. The CES-D Scale: A self-report depression-scale for research in the general population. Appl Psychol Meas 1977;1:385-401. Raison CL, Demetrashvili M, Capuron L, Miller AH. Neuropsychiatric adverse effects of interferon-alpha: recognition and management. CNS Drugs 2005;19(2):105-23. Sarrazin C, Berg T, Ross RS, Schirmacher P, Wedemeyer H, Neumann U, Schmidt H. HJ, Spengler U, Wirth S, Kessler HH, Peck-Radosavljevic M, Ferenci P, Vogel W, Moradpour D, Heim M, Cornberg M, Protzer U, Manns MP, Fleig WE, Dollinger MM, Zeuzem S. Leitlinie Prophylaxe, Diagnostik und Therapie der Hepatitis-C-Virus (HCV)-Infektion. Update der S3 Leitlinie, AWMF-Register-Nr.: 021/012. Z Gastroenterol 2010;48:289-351. Sarrazin C, Berg T, Cornberg M, Dollinger M, Ferenci P, Hinrichsen H, Klinker H, Kraus M, Manns M, Mauss S, PeckRadosavljevic M, Schmidt H, Spengler U, Wedemeyer H, Wirth S, Zeuzem S. Expertenempfehlungen zur Triple-Therapie der HCV Infektion mit Boceprevir und Telaprevir. Z Gastroenterol in press. Peck-Radosavljevic M, Schmidt H, Spengler U, Wedemeyer H, Wirth S, Zeuzem S. Expertenempfehlungen zur Triple-Therapie der HCV Infektion mit Boceprevir und Telaprevir. Z Gastroenterol in press. Schäfer M. Hepatitis C Therapie: Management psychiatrischer Nebenwirkungen von Interferon alfa, Thieme Verlag 2004. Schirmacher P, Fleig WE, Dienes HP; Deutsche Gesellschaft fur Pathologie (DGP), Deutsche Gesellschaft fur Verdauungs- und Stoffwechselkrankheiten (DGVS), Kompetenznetz Hepatitis (HepNet). Bioptische Diagnostik der chronischen Hepatitis C- Ergebnisse einer evidenzbasierten Konsensukonferenz der Deutschen Gesellschaft für Pathologie (DGP), der deutschen Gesellschaft für Verdauungs- und Stoffwechselerkrankungen (DGVS) und des Kompetenznetzes Hepatitis (HepNet). Z Gastroenterol. 2004;42(2):175-85. Sherman M, Cohen L, Cooper M, Elkashab M, Feinman V, Fletcher D, Girgrah N, Heathcote J, Vevstik M, McNaull WB, Wong D, Wong F, Yim C. Clinical recommendations for the use of recombinant human erythropoietin in patients with hepatitis C virus being treated with ribavirin. Can J Gastroenterol 2006;20: 479-485. Sherman KE, Flamm SL, Afdhal N, Nelson D, Sulkowski M, Everson GT, Fried M, Kleber K, Martins M, Sankoh AJ, Kauffman R, George S, Wright CI and Poordad F. Response-Guided Telaprevir Combination Treatment for Hepatitis C Virus Infection. N Engl J Med 2011; 365:1014-1024. Snoeck E, Wade JR, Duff F, Lamb M, Jorga K. Predicting sustained virological response and anaemia in chronic hepatitis C patients treated with peginterferon alfa-2a (40KD) plus ribavirin. Br J Clin Pharmacol 2006 62(6):699-709. Sulkowski M, Dieterich DT, Sherman KE, Rockstroh JK, Adda N, Mahnke L, Garg V, Gharakhanian S, McCallister S and Soriano V. Interim Analysis of a Phase 2a Double-Blind Study of Telaprevir in Combination with Peginterferon Alfa-2a and Ribavirin in HIV/HCV Coinfected Patients: CROI 2011: 146LB. Sulkowski MS, Shiffman ML, Afdhal NH, Reddy KR, McCone J, Lee WM, Herrine SK, Harrison SA, Poordad FF, Koury K, Deng W, Noviello S, Pedicone LD, Brass CA, Albrecht JK, McHutchison JG; IDEAL Study Team. Hepatitis C virus treatment-related anemia is associated with higher sustained virologic response rate. Gastroenterology 2010;139(5):1602-11. Vogel M, Dominguez S, Bhagani S, Azwa A, Page E, Guiguet M, Valantin MA, Katlama C, Rockstroh JK, Nelson M. Treatment of acute HCV infection in HIV-positive patients: experience from a multicentre European cohort. Antivir Ther 2010;15(2):267-79. Younossi ZM, Ong JP, Collantes R. Darbopoetin alfa (DA) für ribavirin-induced anemia in patients with chronic hepatitis C (CH-C) treated with pegylated interferon and ribavirin (PEG-IFN/RBV): a preliminary analysis. Gastroenterology, 2004;126(Suppl1): 83 A. Zeuzem S, Buti M, Ferenci P, Sperl J, Horsmans Y, Cianciara J, Ibranyi E, Weiland O, Noviello S, Brass C, Albrecht J. Efficacy of 24 weeks treatment with peginterferon alfa-2b plus ribavirin in patients with chronic hepatitis C infected with genotype 1 and low pretreatment viremia. J Hepatol 2006;44(1):97-103. Zeuzem S, Andreone P, Pol S, Lawitz E, Diago M, Roberts S, Focaccia R, Younossi Z, Foster GR, Horban A, Ferenci P, Nevens F, Müllhaupt B, Pockros P, Terg R, Shouval D, van Hoek B, Weiland O, Van Heeswijk R, De Meyer S, Luo D, Boogaerts G, Polo R, Picchio G, Beumont M; REALIZE Study Team. Telaprevir for retreatment of HCV infection. N Engl J Med 2011;364(25):2417-28. Zung WW. A Self-Rating Depression Scale. Arch Gen Psychiatry 1965;12:63-70. 63 Wir danken den Teilnehmern des bng-Workshops am 3. April 2011 in Berlin, die den Inhalt dieser Broschüre diskutiert haben. Das Zustandekommen des Workshops und die Erstellung dieser Broschüre wurde von der Firma Roche Pharma AG, 79630 Grenzach-Wyhlen unterstützt. Es erfolgte keine Einflussnahme auf die Inhalte dieses Leitfadens. 64 Anhang: Aufklärungsbogen „Duale Therapie“ für Patienten Unter www.gastromed-bng.de finden Sie diesen Aufklärungsbogen für Patienten zum Download 65 Aufklärungsbögen „Triple-Therapie“ für Patienten Unter www.gastromed-bng.de finden Sie diesen Aufklärungsbogen für Patienten zum Download Therapie mit Boceprevir (Victrelis®) Liebe Patientin, lieber Patient, Sie haben sich zu einer Therapie Ihrer Hepatitis C mit PEG-Interferon, Ribavirin und Boceprevir entschlossen: ein Schritt, der Ihre nächsten Monate prägen wird. Die Behandlung eröffnet die Möglichkeit der Heilung Ihrer Hepatitis. Andererseits ist diese Therapie körperlich und psychisch belastend. Diese kurze Information soll helfen, Fehler zu vermeiden und die Heilungschancen zu verbessern. Hinweise zur Therapie Derzeit besteht die Standardtherapie der Hepatitis C aus einer Kombination mit PEG-Interferon, Ribavirin und einem Proteaseinhibitor. Das PEG-Interferon wird als langwirksames Interferon einmal wöchentlich unter die Haut gespritzt. Die Ribavirin-Kapseln werden zweimal täglich zum Essen eingenommen. Die Menge der einzunehmenden Ribavirin-Kapseln legt Ihr Arzt fest. Boceprevir wird 3 Mal täglich eingenommen (s.u.). Das Injizieren des PEG-Interferons erfolgt unter die Haut im Bereich des Bauches und Oberschenkels. Es darf nicht in den Muskel (= zu tief), in der Nähe des Nabels oder in die Leiste gespritzt werden. Die Stelle der Injektion ist jedes Mal zu wechseln. Die Injektionstechnik wird Ihnen von geschultem Personal gezeigt. Spritzen Sie bitte erst dann selbständig, wenn Sie in der Technik sicher sind. Zur Vermeidung von Fieber und grippalen Beschwerden können vor der Injektion von PEG-Interferon und gegebenenfalls auch danach „Grippemittel“ wie ASS, Paracetamol oder Ketoprofen eingenommen werden. In der Regel sollte die Einnahme von Grippemitteln auf 4 Tabletten pro Tag begrenzt werden. ASS kann die Blutungsneigung fördern. Hohe Dosen von Paracetamol (>4 g/Tag) können die Leber schädigen. Die Kontrollen des Blutbildes und der Blutwerte erfolgen anfänglich alle 2 Wochen, dann alle 4 Wochen! Längere Abstände der Kontrolluntersuchungen müssen mit Ihrem Arzt individuell vereinbart werden. In der Anfangsphase müssen Sie die Ergebnisse persönlich mit Ihrem Arzt besprechen. Im weiteren Verlauf der Therapie können die Laborwerte gegebenenfalls auch telefonisch ausgewertet werden. PEG-Interferon und Ribavirin können schwere Nebenwirkungen haben, deshalb sind die Kontrolltermine unbedingt einzuhalten! Durch den Hepatitis-C-Proteaseinhibitor Boceprevir wird die Hepatitis-Therapie für Patienten mit HCV-Genotyp 1 wirksamer, aber auch nebenwirkungsreicher. Typische Nebenwirkungen von Boceprevir sind eine Blutarmut und ein metallischer Geschmack im Mund, der sich nach Ende der Therapie rasch zurück bildet. Die Dauer der Dreifachtherapie mit PEG-Interferon, Ribavirin und Boceprevir ist unterschiedlich und wird von Ihrem Arzt festgelegt. Die Einnahme der Tabletten erfolgt 3 Mal täglich im Abstand von 8 Stunden (z.B. 8:00, 16:00 und 24:00 Uhr), zusammen mit einer kleinen Mahlzeit. Da Boceprevir die Wirkung anderer Medikamente verändert, ist die Einnahme weiterer Medikamente mit Ihrem Arzt zu besprechen. Bei Fragen und Problemen stehen wir gerne zur Verfügung. Das frühzeitige Ansprechen und Erkennen von auftretenden Problemen trägt ganz wesentlich zu einer erfolgreichen Therapie bei. Ihr Praxis-Team 66 Aufklärungsbögen „Triple-Therapie“ für Patienten Unter www.gastromed-bng.de finden Sie diesen Aufklärungsbogen für Patienten zum Download Therapie mit Telaprevir (Incivo®) Liebe Patientin, lieber Patient, Sie haben sich zu einer Therapie Ihrer Hepatitis C mit PEG-Interferon, Ribavirin und Telaprevir entschlossen: ein Schritt, der Ihre nächsten Monate prägen wird. Die Behandlung eröffnet die Möglichkeit der Heilung Ihrer Hepatitis. Andererseits ist diese Therapie körperlich und psychisch belastend. Diese kurze Information soll helfen, Fehler zu vermeiden und die Heilungschancen zu verbessern. Hinweise zur Therapie Derzeit besteht die Standardtherapie der Hepatitis C aus einer Kombination mit PEG-Interferon, Ribavirin und Telaprevir. Das PEG-Interferon wird als langwirksames Interferon einmal wöchentlich unter die Haut gespritzt. Die Ribavirin-Kapseln werden 2 Mal täglich zum Essen eingenommen. Die Menge der einzunehmenden Ribavirin-Kapseln legt Ihr Arzt fest. Telaprevir wird 3 Mal täglich eingenommen (s.u.). Das Injizieren des PEG-Interferons erfolgt unter die Haut im Bereich des Bauches und Oberschenkels. Es darf nicht in den Muskel (= zu tief), in der Nähe des Nabels oder in die Leiste gespritzt werden. Die Stelle der Injektion ist jedes Mal zu wechseln. Die Injektionstechnik wird Ihnen von geschultem Personal gezeigt. Spritzen Sie bitte erst dann selbständig, wenn Sie in der Technik sicher sind. Zur Vermeidung von Fieber und grippalen Beschwerden können vor der Injektion von PEG-Interferon und gegebenenfalls auch danach „Grippemittel“ wie ASS, Paracetamol oder Ketoprofen eingenommen werden. In der Regel sollte die Einnahme von Grippemitteln auf 4 Tabletten pro Tag begrenzt werden. ASS kann die Blutungsneigung fördern. Hohe Dosen von Paracetamol (>4 g/Tag) können die Leber schädigen. Die Kontrolle des Blutbildes und der Blutwerte erfolgt anfänglich alle 2 Wochen, dann alle 4 Wochen! Längere Abstände der Kontrolluntersuchungen müssen mit Ihrem Arzt individuell vereinbart werden. In der Anfangsphase müssen Sie die Ergebnisse persönlich mit Ihrem Arzt besprechen. Im weiteren Verlauf der Therapie können die Laborwerte gegebenenfalls auch telefonisch ausgewertet werden. PEG-Interferon und Ribavirin können schwere Nebenwirkungen haben, deshalb sind die Kontrolltermine unbedingt einzuhalten! Durch den Hepatitis-C-Proteaseinhibitor Telaprevir wird die Hepatitis-Therapie für Patienten mit HCV-Genotyp 1 wirksamer, aber auch nebenwirkungsreicher. Typische Nebenwirkungen von Telaprevir betreffen die Haut. Deshalb sollten Sie Ihre Haut vorbeugend mit rückfettenden Cremes einreiben und alles vermeiden, was die Hautaustrocknung fördert, z.B. übermäßiges Händewaschen, häufige Wannenbäder, keine Sonnenbäder. Weitere Nebenwirkungen können Juckreiz, anale Beschwerden, Durchfälle und ein verstärkter Abfall des roten Blutfarbstoffes sein. Die Dauer der Dreifachtherapie mit PEG-Interferon, Ribavirin und Telaprevir beträgt 12 Wochen. Die Einnahme der Tabletten erfolgt 3 Mal täglich im Abstand von 8 Stunden (z.B. 8:00, 16:00 und 24:00 Uhr) mit einer fettreichen Mahlzeit (20 g Fett). Da Telaprevir die Wirkung anderer Medikamente verändert, ist die Einnahme weiterer Medikamente mit Ihrem Arzt zu besprechen. Bei Fragen und Problemen stehen wir gerne zur Verfügung. Das frühzeitige Ansprechen und Erkennen von auftretenden Problemen trägt ganz wesentlich zu einer erfolgreichen Therapie bei. Ihr Praxis-Team 67 Fibrosediagnostik: Leberbiopsie Staging Score Verbal Histologische Merkmale 0 Keine Fibrose Keine Faservermehrung 1 Milde / geringgradige Fibrose Portale Faservermehrung, keine Septen 2 Mäßige / mittelgradige Fibrose Inkomplette oder komplette portoportale Fasersepten*, erhaltene Architekur 3 Schwere/hochgradige Fibrose Septenbildende Faservermehrung mit Architekturstörung**, kein Anhalt für kompletten zirrhotischen Umbau 4 Zirrhose Wahrscheinlicher*** oder definitiver zirrhotischer Umbau * Unabhängig von Zahl und Breite der Septen. ** Zum Beispiel portozentrale Septen, Verschiebung der portalen / azinären Architektur (portal-zentralvenöser Abstand). *** Zum Beispiel ohne definitiven Nachweis vollständig bindegewebig separierter Pseudolobuli, aber aufgrund indirekter Zeichen (z. B. fragmentierte, herausgebrochene Pseudolobuli) anzunehmen. 68 Fibrosediagnostik: Leberbiopsie Modifizierter histologischer Aktivitätsindex nach Ishak (HAI): Grading Gruppe A B C D Kriterien Score Periportale oder periseptale Grenzzonenhepatitis (so genannte Mottenfraßnekrosen) • Keine • Fokal, wenige Portalfelder • Fokal, Mehrzahl der Portalfelder • Kontinuierlich um weniger als 50 % der Portalfelder • Kontinuierlich um über 50 % der Portalfelder 0 1 2 3 4 Konfluente Nekrosen • Keine • Fokal • Zone-3-Nekrosen, wenige • Zone-3-Nekrosen, zahlreiche • Zone-3- und einzelne portozentrale Brückennekrosen • Zone-3- und multiple portozentrale Brückennekrosen • Panazinäre oder multiazinäre Nekrosen 0 1 2 3 4 5 6 Fokale kleinherdige lytische Nekrosen, Apoptosen und fokale Entzündungsherde* • Keine • Bis 1 Herd pro Gesichtsfeld (10x-Objektiv) • 2-4 Herde pro Gesichtsfeld (10x-Objektiv) • 5-10 Herde pro Gesichtsfeld (10x-Objektiv) • Mehr als 10 Herde pro Gesichtsfeld (10x-Objektiv) 0 1 2 3 4 Portale Entzündung • Keine • Gering, wenige oder alle Portalfelder • Mäßig, wenige oder alle Portalfelder • Mäßig / ausgeprägt, alle Portalfelder • Ausgeprägt, alle Portalfelder 0 1 2 3 4 Maximaler Score 18 * Diffuse lymphozytäre Infiltrate in den Sinusoiden gehen nicht in den Score ein. 69 Berufsverband Niedergelassener Gastroenterologen Deutschlands e. V. Insel 3 · 89231 Neu-Ulm Telefon (0700) 264 264 26 Telefax (0731) 705 47 11 [email protected] Besuchen Sie uns im Internet: www.bng-gastro.de