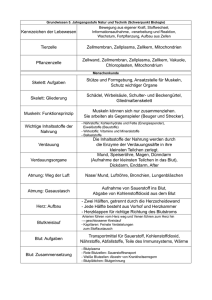
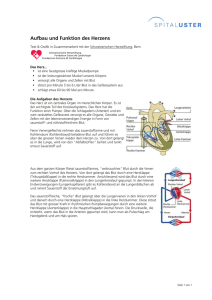
BLUT - Vetstudy
Werbung

ZELLEN 1. Zelle Die Zelle ist die kleinste lebens- und vermehrungsfähige Funktionseinheit des Organismus. 2. Lebenskriterien Vorhandensein eines Genoms (DNA) Fähigkeit zur Mutation Stoffwechsel (Anabolismus/ Katabolismus) Austausch von Stoffen und Energie mit der Umgebung führt zu einem Fließgleichgewicht (Permeabilitätseigenschaften der Zellmembran) Reizbarkeit der Zelle (Rezeptoren) 3. Bestandteile einer Zelle Zellmembran: s. Aufgaben der Zellmembran Cytoskelett: aufgebaut aus Mikrotubuli, Actinfilamenten und intermediären Filamenten Cytosol: Grundsubstanz außerhalb des Zellkerns Cytoplasma: membranfreie Grundsubstanz außerhalb des Zellkerns für Stoffwechsel, Proteinsynthese, Glykogen, intrazelluläre Bewegung, Cytoskelett Endoplasmatisches Retikulum mit glattes ER (Lipidsynthese) und rauhes ER durch Ribosomen (Proteinsynthese) Golgi-Apparat bzw. Dictyosomen: Membranvesikelstapel zur Oligound Polysaccharidproduktion Lysosomen: Lyse endozytierter Substanzen durch Hydrolasen Peroxisomen: Kompartiment für spezifische Aufgaben mit Oxidasen und Katalasen, Verdauungssystem der Zelle Zellkern: Speicherung des genetischen Codes in Form von DNA, DNA-Replikation, Bildung von mRNA zur Transkription, RNA-Prozessierung, Bildung ribosomale Vorstufen Mitochondrien: oxidative Energiegewinnung, Atmung, Bildung von ATP Ribosomen: frei im Cytoplasma oder an ER, Ort der Proteinsynthese, Translation 4. Aufbau der Zellmembran Zellmembran Die Zellmembran ist eine 5 - 6 nm dicke Grenzschicht zwischen Cytoplasma und Extrazellulärräumen. Sie besteht aus Lipiddoppelschicht (Bilayer) mit 50 % Phospholipiden, 20 % Cholesterin und 10 % Glycolipiden. Die Membranlipide haben einen amphiphilen Charakter, d. h. sie besitzen langkettige hydrophobe Kohlenwasserstoffketten der Fettsäurereste, die sich gegeneinander gruppieren und hydrophile Anteile, die sich zur wässrigen Phase ausrichten. Membranproteine 1 Der Proteinanteil der zellulären Membranen schwankt zwischen 20 - 80 %. Sie weisen an ihrer Oberfläche Anhäufungen von hydrophoben Aminosäuren auf, mit denen sie mit der hydrophoben Phase der Membran in Wechselbeziehungen stehen. Man bezeichnet das als Transmembrandomänen. Fas alle Glycoproteine weisen an ihrer Oberfläche Kohlenhydrat-Seitenketten auf, die das Erkennungsmerkmal jeder Zelle (Zell-Zell-Erkennung und Zell-Matrix-Erkennung) bilden. Die gebildete Struktur wird als Glycokalix bezeichnet. Extrinsische Proteine: sind nur an die Membran angelagert, da sie keine hydrophoben Anteile besitzen, z. B. Cytochrom C, ATP-Synthase Intrinsische Proteine: Sind nur in die innere Schicht verankert, z. B. G-Proteine Integrale Proteine mit einfachem Membrandurchtritt, z. B. Rhodopsin oder mehrfachem Membrandurchtritt, z. B. G-Protein-gekoppelte Rezeptoren, Ionenpumpen, Ionenkanäle Periphere Proteine: liegen extrazellulär, sind über Lipidanker an der Membran gebunden Fluidität Diese wird bestimmt vom Cholesteringehalt (flüssiger, gallertartiger Zustand fester kristalliner Zustand). Der Gehalt an ungesättigten Fettsäuren hingegen bestimmt die Viskosität. Permeabilität Jede Zellmembran stellt eine Barriere für hydrophile Substanzen dar. Sie ist abhängig von Asymmetrie und Fluidität der Zellmembran und der Beschaffenheit der Substanzen. So können z. B. kleinere polare Moleküle (Harnstoff, Ethanol) und lipophile Substanzen die Membran per Diffusion leicht passieren (Frick’sches Gesetz, s. Diffusion). Größere hydrophile Substanzen und geladene Teilchen können die Membran nur mit Hilfe von Transportproteinen passieren. (Atemgase > Steroide > H2O > Glycerin > Monosaccaride > Ionen) Die Diffusionsgleichung für Nichtelektrolyte leitet sich vom Fick’schen Diffusionsgesetz ab (s. Diffusion). Dabei stellt P die Permeabilität der Membran dar. Es ist ein Charakteristikum der Membran und des diffundierenden Stoffes. dm ------- = - P A c dt 5. Hauptaufgaben der Zellmembran Sie bildet eine Barriere zwischen intra (IZF)- und extrazellulärer (EZF) Flüssigkeit, die durch Ionenpumpen, Carriersysteme und Ionenkanäle aufrecht erhalten wird. Spezifischer Stofftransport (selektiver Filter) Begrenzung der Zelle Endo- und Exocytose Signalaufnahme und Verarbeitung, z. B. Begrenzung von IZF und EZF, Flexibilität (Zellteilung, Wachstum), Signalübermittler (Oberflächenstrukturen, Rezeptoren), Zellerkennung Weitergabe an Rezeptoren Ausbildung von Zell-zu-Zell-Verbindungen 2 Filterfunktion 6. Transport durch die Zellmembran Die Zahl der membranassoziierten Transportsysteme ist sehr vielfältig. Allerdings sind viele von ihnen ATP-abhängig, so daß ein erheblicher Teil der Stoffwechselenergie für die Transportarbeit verwendet werden muß. Man unterscheidet zwischen: Passiver Transport Erleichterte Diffusion Kanäle Diffusion Transportrichtung Membranproteine Sättigber Spezifität Energieabhängigkeit Aktiven Transport mit ATP-Verbrauch Prim. akt. Sek. akt. Transport Transport Bergab Bergab Bergab Bergauf Bergauf - Carrier (Uniporter) Ionenkanäl e Pumpen Nein Nein Ja Ja (Nein) Ja Ja Ja Austauscher (Antiporter) Cotransporter (Symporter) Ja Ja Nein Nein Nein Ja Ja Diffusion Alle Teilchen sind in der Lage sich zu bewegen. Durch ihre Bewegung kommt es automatisch zu einer gleichmäßigen Verteilung im Raum. Tritt ein Konzentrationsunterschied zwischen zwei Seiten auf, so wird durch die Diffusion Konzentrationsgradienten ausgeglichen. Es können nur sehr kleine Moleküle, z. B. gelöste Gase wie CO2, O2, N2 oder lipidlösliche Moleküle, z. B. Steroide (chemischer Gradient) diffundieren. Berechnet wird die Diffusion nach dem Frick’schen Diffusionsgesetz: dm A ----- = - D ----- (c1 - c2) dt d dm A ----- = - D ----- c dt d c1, c2 = A= d= m= t= D= Konzentration eines Stoffes in zwei Kompartimenten mit unterschiedlicher Konzentration Fläche der Trennschicht Dicke der Trennschicht Fluß des Stoffes Zeit Diffusionskoeffizient des jeweiligen Stoffes dc = dx = Konzentrationsunterschied Strecke Allgemeiner formuliert gilt: dm dc ----- = - D A ----dt dx 3 Erleichterte Diffusion Unter erleichterter Diffusion versteht man den Bergabtransport eines Teilchens entlang eines elektrochemischen Gradienten, der durch ein Transportprotein (Carrier, Uniporter) vermittelt wird. Dazu gehören Na+-unabhängiger Glucosetransporter und Na+-unabhängiger Aminosäure-Carrier. Ionenkanäle Für Teilchen, die durch die Lipiddoppelschicht der Membran nicht einfach so hindurchtreten können, befinden sich sog. Ionenkanäle in der Membran. Sie werden durch Transmembranproteine, die sich zu einer „Pore“ formen, gebildet. Durch diese können geladene Teilchen diffundieren. Sie können in 2 Konformationen auftreten, offen bzw. geschlossen. Die treibende Kraft sind chemische und/ oder elektrische Gradienten. Es können nur geladene Teilchen, Ionen, z. B. Na+, K+, Cl- diffundieren. Die Ionenkanäle haben eine hohe Transportrate und während des Transportes fließt Strom (elektrogen). Primär aktiver Transport Ionen können durch Ionenpumpen unter ATP-Verbrauch entgegen dem Konzentrationsgradienten durch die Membran transportiert werden. Das dazu benötigte ATP wird in der Zelle selbst aufgebaut. Zur Gewinnung muß eine Substratlieferung in Form von Glucose und Sauerstoff erfolgen. An die Lieferung schließt sich die Umwandlung des Substrates in der Zelle an. ADP (Adenosindiphosphat) + Pi (Phosphat) wird zu ATP (Adenosintriphosphat) aufgebaut, die Speicherform der Energie. Bei Bedarf wird ATP wieder zu ADP + Pi und die gespeicherte Energie wird frei. Es dient der Stabilisierung der Ionenkonzentration, da z. B. die Membran für K+ und Na+ relativ durchlässig ist und die Konzentration nach einiger Zeit angeglichen werden würde Ein Beispiel für den primär aktiven Transport ist die Na+-K+-Pumpe oder auch Na+-K+-ATPase. Es ist ein Proteinkomplex, der aus -Untereinheit und einer -Untereinheit aufgebaut ist. Die katalytische Funktion (Bindung des ATP) und die Bindung von Na+ und K+ können der -Untereinheit zugeordnet werden. Die -Untereinheit ist dafür nicht nötig. Zum Pumpen der Ionen müssen aber beide Untereinheiten vorhanden sein. Sie dient zur Aufrechterhaltung des Konzentrationsgradienten, da dies für die elektrische Weiterleitung, Antrieb anderer aktiver Transportmechanismen und der Einstellung des Zellvolumens dient. Es werden jedes Mal 3 Na+ raus und 3 K+ in die Zelle rein transportiert. Der Vorgang wirkt elektrogen (treibt einen elektrischen Strom über die Membran aus der Zelle raus). Der Transport ist höchst effektiv: 150 - 600 Na+/ s. Neben dieser Pumpe kommen noch Protonen-ATPasen (pumpen Protonen in ein Kompartiment (z. B. Mitochondrien oder Lysosomen) und Ca2+-ATPasen (halten das große Konzentrationsgefälle zwischen Extrazellulärraum und Zytosol aufrecht) vor. Sekundär aktiver Transport Prinzip des sekundär aktiven Transportes ist der Transport eines Teilchen bergab und gleichzeitig Bergauftransport eines zweiten Teilchens. Der Transport selbst benötigt keine Energie, ist aber davon abhängig, daß ein aktiver Transporter (Pumpe) den Ionengradienten aufrecht erhält. Auf der „cis“-Seite wird das Substrat gebunden und durch die Konformationsänderung auf die „trans“-Seite der Membran befördert. Die Richtung wird vom Konzentrationsunterschied bestimmt. Eine Vielzahl von Carrierproteine nutzen den Gradienten mit Na+ um bestimmte Substrate in die Zelle hinein (Cotransport/ Symport) oder hinaus (Austausch/ Antiport) zu transportieren. Transportiert werden z. B. kleine Ionen oder kleine organische Teilchen (Monosaccharide, Aminosäuren). 4 7. Zell-Zell-Verbindungen Verbindungen Die Zell-Zell-Verbindungen werden durch spezifische Membranproteine gebildet, die u. U. auch noch Beziehungen zum Cytoskelett aufweisen. Sie dienen der mechanischen stabilen Verbindung von Zellen zu Gewebeverbänden oder zur Befestigung von Zellen an der extrazellulären Matrix. Man unterscheidet zwischen verschiedenen Formen mit verschiedenen Funktionen. Stofftransfer („Signale“) mit Gap junctions (Nexus) Haftkomplex („mechanisch“) mit Tight junctions, Desmosomen oder Zonula adhaerens Gap junctions (Nexus) Die Gap junctions bilden Verbindungen zwischen benachbarten Zellen, die den direkten Stoffaustausch ermöglichen. Sie werden durch zwei Halbkanäle (Konnexone) der benachbarten Zellen gebildet, die wiederum aus jeweils 6 Connexinmolekülen aufgebaut sind. Durch eine besondere Anordnung der Membranproteine („Tunnelproteine“) werden Kanälchen bzw. eine Pore in den Oberflächenmembranen ausgebildet. Dies ermöglicht den Durchtritt von kleinstmolekularen Stoffen , z. B. anorganische Ionen, cAMP, IP3, ATP, Glucose, Aminosäuren, etc. von einer Zelle zur anderen. Die Regulation erfolgt z. B. durch eine Erhöhung der zytosolischen Ca2+-Aktivität und durch einen sauren pH-Wert, der die Poren schließen läßt. Bedeutung: Durch die Kopplung der Zellen werden „Probleme“ der Einzelzelle durch den Zellverband kompensiert und ausgeglichen. Durch eine Erhöhung der Ca2+-Konzentration, kann die Zelle jedoch von den anderen abgekoppelt werden. Im Herzmuskel und in glatter Muskulatur sorgen sie für die elektrische Kopplung. „Schrittmacherzellen“ können somit die benachbarten Zellen steuern, wie dies beispielweise im Pankreas (-Zellen) der Fall ist. Sie spielen eine wichtige Rolle bei der Embryogenese. Differenzierungskompartimente werden eng aneinander gekoppelt, andere koppeln sich ab. Tight junctions (Schlußleisten, Zonula occludens) Sie liegen hauptsächlich am luminalen, apikalen Pol eines Epithelzellenverbandes. Die äußeren Schichten gegenüberliegender Oberflächenmembranen verschmelzen miteinander, wodurch sich 5 lamilläre Strukturen bilden. Der intrazelluläre Spaltraum verschwindet vollständig. Es bildet eine Stoffwechselbarriere an allen Stellen, an denen ein hoher transepithelialer Gradient besteht, z. B. Harnblase, Sammelrohr und Kolon. Desmosomen (Haftplatte, Maculae adhaerentes) Sie sind punktförmig bis elliptisch, mit einem Durchmesser von 0,3 - 0,5 m Punktdesmosomen. Sie haben einen erweiterten Intrazellulärspalt von 25 bis 35 nm, gefüllt mit mikrofilamentösem Material. Außen inserieren dicke Bündel von intrazytoplasmatischen Filamenten (Tonofibrillen), die die Stabilität der Zellverbindung verstärken. 5 Funktion ist die mechanische Zellverbindung. Zonula adhaerens (Schlußleiste, gürtelförmige Desmosomen) Die Zellmembranen der Gürteldesmosomen sind angenähert, so daß sich ein verengter Intrazellularspalt bildet. Dieser ist gefüllt mit filamentösem Material. Aktinfilamente verstärken zusätzlich die Zellmembranen. 8. Endo- und Exozytose Endozytose Die Plasmamembran stülpt sich ein und bildet eine Grube, die sich immer weiter vertieft und schließlich im intrazellulären Raum sich abschnürt und ein Vesikel bildet, das extrazelluläre Flüssigkeit oder Makromoleküle enthält. Man unterscheidet hierbei: Pinozytose (Aufnahme von Flüssigkeit) Phagozytose (Aufnahme von korpuskulären Stoffen) Rezeptorvermittelte Endozytose (Makromoleküle werden von membranständigen, spezifischen Rezeptoren gebunden, der ganze Komplex wird endozytiert) Exozytose An den Zellorganellen werden Vesikel abgeschnürt, die mit einem auszuscheidenden Stoff (Hormone, Enzyme, ...) beladen sind. An der Zellmembran kann die Lipidmembran des Vesikels mit der Plasmamembran verschmelzen. Der Inhalt des Vesikels wird somit in das Außenmedium entleert. Das Ausmaß der Exozytose wird durch die Höhe der cytosolischen Ca2+-Ionenkonzentration gesteuert. 9. Signaltransduktion Extrazelluläre Signale können durch Bindung an einen Rezeptor spezifische intrazelluläre Vorgänge auslösen. Zu den extrazellulären Signalstoffen gehören Hormone, Membranproteine benachbarter Zellen, Plasmaproteine, Nahrungsbestandteile und körperfremde Substanzen, z. B. Arzneimittel. Rezeptortyp 7-Membrandomänenrezeptor Tyrosinkinaserezeptor Cytokinrezeptor Beispiele Adrenorezeptoren Glucagonrezeptoren Rezeptoren für GeschmacksGeruchsstoffe Insulinrezeptor IGF 1-Rezeptor Wachstumshormonrezeptor Erythropoetin-Rezeptor und 10. Second-messenger-System Das Second-messenger-System leitet zu steuernde Informationen innerhalb der Zelle durch sekundäre Botenstoffe, second-messengers. Im Gegensatz dazu stehen die Steuermechanismen, die von außen die Zelle beeinflussen, sog. „erste“ Botschaften. Das sind Reaktionen von extrazellulären Substanzen 6 mit spezifischen Rezeptoren an der Plasmamembran, z. B. synaptische Überträgerstoffe oder lokale Wirkstoffe (Hormone, Antigene) Calcium, Ca2+ Das Calcium ist der einfachster intrazellulärer Botenstoff. In der ruhenden Zelle ist die Ca 2+-IonenKonzentration sehr gering. Nach einer Membranpotentialänderung öffnen sich Membrankanälen, durch die Ca2+ einströmen kann. Die Ca2+-Konzentration in der Zelle steigt an und ermöglicht so wichtige Reaktionen, wie die Kontraktion der Myofibrillen in Muskelzellen oder die Freisetzung von Überträgervesikeln in den Nervenendigungen. Die Freisetzung kann auch über intrazelluläre Speicher (endoplasmatisches Retikulum, ER oder auch sarkoplasmatisches Retikulum, SR) erfolgen. Cyclisches Adenosinmonophosphat, cAMP Das cAMP ist ein Derivat von ATP und der wichtigster intrazellulärer Botenstoff. Es ist wasserlöslich und leitet die Informationen des Rezeptors RS (stimulierender Rezeptor) im Zellinneren weiter. a) Syntheseweg An den Rezeptor RS mit einer spezifischen Bindungsstelle für Botenstoffe, z. B. Hormone, liegt an der Außenseite der Membran. Hier erfolgt die Bindung mit einem „Reiz“-Molekül. Das Rezeptormolekül ändert seine Konformation und gibt die Stimulation an das Protein G S, das an der Innenseite der Membran liegt, weiter. GS kann nun durch Guanosintriphosphat (GTP) aktiviert werden. Das aktive GS stimuliert die Adenylatcyclase, welches ATP in cAMP umwandelt. Das cAMP reagiert mit der Adenylatkinase (A-Kinase), wobei eine katalytische Untereinheit C frei wird, die wiederum die Phosphorylierung von Proteinen katalysiert. Die Proteine werden funktionsfähig und können den spezifischen Effekt der Steuerung auslösen. b) Hemmung Ein extrazellulärer Überträgerstoff oder ein Hormon stimuliert den hemmenden Rezeptor R i (inhibierender Rezeptor). Analog zum Syntheseweg hemmt ein über GTP aktiviertes Protein Gi die Adenylatcyclase und damit die Entstehung von cAMP. c) Hormonale Steuerung Die Hormone werden von den Rezeptorproteinen erkannt, gebunden und initiieren dort einen Prozeß, der sich Transduktion nennt. Ein Beispiel hierfür ist die Bindung von Adrenalin an bUntereinheiten von Leber- und Muskelzellen. Die Vermittlung der Information erfolgt wie oben beschrieben. Die gebildeten Proteine am Ende der Reaktionskette vermitteln dann die Hormonfunktion, wie hier die Förderung der Glycogenolyse. CAMP stimulierende Hormone Adrenalin () Histamin Adiuretin Dopamin Oxytocin glandotrope Hormone Prostaglandine Glucagon Phosphoinositoltriphosphat, IP3 7 cAMP hemmende Hormone Adrenalin (2) Acetylcholin Dopamin Prostaglandine Somatostatin Serotonin Angiotensin II etc. Das Phosphoinositol hat einen ähnlichen Syntheseweg wie das cAMP, aber ohne Hemmsystem. Die Reizung des Rezeptor R erfolgt durch die Bindung eines „Signal“-Moleküls an den Rezeptor R. Es folgt eine Konformationsänderung des Rezeptors, die den Reiz auf ein GTP-aktiviertes Protein G auf der Innenseite der Membran überträgt. Im nächsten Schritt wird nun ein gewöhnliches Lipid, PI (Phosphaditylinositol), aus der Membran mit zwei zusätzlichen Phosphatgruppen bestückt. Das entstandene PIP2 (Phosphoditylinosindiphosphat) wird nun durch die aktivierte Phospholipase C in zwei Bestandteile gespalten. Es entsteht: Inositoltriphosphat (IP3), das durch seine Wasserlöslichkeit in das Cytoplasma diffundiert und die Freisetzung von Ca2+ aus dem ER ermöglicht Lipid Diacylglycerin (DAG), das innerhalb der Lipidphase der Membran diffundiert. Zusammen mit Phosphatidylserin aktiviert es eine membranständige C-Kinase, die dadurch die Phosphorylierung von Proteinen fördert. Die Wirkung von IP3 über Hormone erfolgt wie oben beschrieben. Die wichtigsten Hormone sind: IP3 stimulierende Hormone Acetylcholin Adiuretin Histamin Angiotensin II Adrenalin Vasopressin Serotonin Thyreotropin 11. Regulation des Zellvolumens Sekundär kompensatorische Volumenzunahme Bei osmotisch bedingter Zellschwellung kommt es zu einer Aktivierung der Pumpen (Na+-K+-ATPase) und dehnungsempfindlicher Kanäle (K+, Cl-). Durch den Efflux von Osmolyten folgt ein physiologischer Wasserausstrom regulatorische Volumenabnahme Sekundär kompensatorische Volumenabnahme Bei osmotisch bedingter Zellschrumpfung werden von der Zelle Ionen ausgenommen durch Aktivierung von Na+-H+-Austauschern und (Na+-K+-2 Cl- -Cotransportern. So kommt es zur Natriumaufnahme und zu einem physiologischen Wassereinstrom regulatorische Volumenzunahme. 8 NERVEN 1. Strukturelle und funktionelle Gliederung des Nervensystems Zerebrospinales, willkürliches Nervensystem Gehirn und Rückenmark bilden das zentrale Nervensystem (ZNS) Rückenmarksnerven, Ganglien und Rezeptoren das periphere Nervensystem (PNS) Vegetatives, unwillkürliches, autonomes Nervensystem (VNS) Zentrales vegetatives Nervensystem mit Zentren im zentralen Nervensystem Peripheres vegetatives Nervensystem mit dem intramuralen, sympathischen parasympathischen System somatische motorische Fasern ZNS afferente und efferente vegetative Fasern vegetative 2. Bauelemente des Nervensystems Was gehört dazu? Zu den Bauelementen des Nervensystems gehören die nervöse Substanz bzw. das Nervengewebe und das umhüllendes Bindegewebe, sowie die sekundär einwachsende Blutgefäße. Zum Nervengewebe gehören: Gliazellen (Abgrenzungs- und Stoffwechselfunktionen) Erregungsbildende und -leitende Nervenzellen und deren Fortsätze, Axone Unterschiede zwischen markhaltigen und marklosen Nerven marklose Nervenfaser Kontinuierliche Ausbreitung Gliazellen umhüllen die Nervenfaser nicht vollständig Ausgleichströme zur Auffrischung der 9 markhaltige Nervenfaser Saltatorische Ausbreitung Gliazellen bilden dicke Myelinscheide Ausgleichströme nur an Ranvier’schen Schürringen (Auffrischung der Depolarisation Hoher Energieverbrauch Wesentlich langsamer Depolarisation durch Na+-Einstrom) Energiesparsam Viel schneller 3. Funktion des Nervensystems Das Nervengewebe dient der schellen Signalübermittlung und ist an der Regulation, Koordination und Kontrolle aller Körpervorgänge beteiligt. 4. Die nervalen Grundstrukturen Neuron Eine Nervenzelle besteht aus dem Zellkörper, Perikaryon oder Soma und mehreren Fortsätzen (mehrere Dendriten und 1 Axon). Perikaryon oder Soma Das Perikaryon enthält den Zellkern und Zytoplasma, sowie raues ER, Nissl-Schollen bzw. NisselSubstanz (Polysomenansammlungen), Golgi-Apparat, Mitochondrien, Lysosomen, Neurofilamente, Neurotubuli und Einschlüsse in Form von Pigmenten. Dendriten Baumartig verzweigte Fortsätze, i. d. R. in der Mehrzahl Dient der Oberflächenvergrößerung des Nervensystems Enthalten Neurofilamente und Neurotubuli Erregungsleitung erfolgt immer in Richtung des Perikaryons Perikaryon und Dendriten bilden den Rezeptorteil des Nervensystems!! Axon Jeder Nervenzelle hat nur 1 Axon Bildet am Soma einen zylindrischen Fortsatz Urspungskegel und Axon unterteilt man in ein Anfangssegment, die Hauptverlaufsstrecke und in die Endaufzweigungen Das Axon kann auch Stoffe transportieren. Der Transport erfolgt entlang der Mikrotubuli bzw. den Neurofilamenten. Man unterscheidet zwischen: Anterograder Transport: Dieser Transport wandert vom Soma Axonterminal. Transportiert werden z. B. Membranbestandteile und zur Sekretion bestimmter Stoffe. Ein myosinähnliches Makromolekül, das Kinesin, transportiert den in Vesikel verpackte Stoffe unter ATP-Verbrauch am Axon entlang. Retrograder Transport: Der Transport erfolgt in umgekehrter Richtung. Transportiert werden z. B. brauchbare Endprodukte aus dem Stoffwechsel oder auch den Nerve growth factor (NGF), der 10 für das Überleben der Neurone von Bedeutung ist. Das Motorprotein für den retrograden Transport ist das Dynein. Der schnelle axonale Transport kann sowohl anterograd (mit bis zu 400 mm/Tag), als auch retrograd (200 - 300 mm/Tag) erfolgen. Neurotrope Vieren nutzen diesen Prozeß des retrogranden Transportes (z. B. Herpesvirus, Virus der Kinderlähmung und der Erreger des Wundstarrkrampfes „Tetanus“). Der langsame axonale Transport (etwa 1 mm/Tag) dient zum Wiederaufbau v. a. bei der Regeneration von peripher durchtrennten Nerven. Synapse Die Synapse ist der Ort für die Übertragung nervöser Signale von einer Nervenzelle auf eine Folgezelle (Nervenzelle oder Effektorzelle) Die Synapse zwischen einem Nerv und einer Muskelfaser wird als motorische Endplatte oder neuromuskuläre Endplatte bezeichnet. Man unterscheidet zwischen einer präsynaptische Seite und einer postsynaptischen Seite. Dazwischen liegt der synaptische Spalt. Die präsynaptische Membran ist zu einem synaptischen Kopf aufgetrieben, der synaptische Bläschen und zytoplasmatische Strukturen enthält. Die Membran ist aus proteinreichem Material verdichtet, in denen sich kleine Räume befinden, in die die synaptischen Bläschen eintreten und dort mit der Oberfläche Kontakt aufnehmen. Synaptische Bläschen: bestehen aus einer Doppellipidschicht und enthalten die Neurotransmitter (Acetylcholin, Noradrenalin, Adrenalin und Dopamin, manche benutzen auch Peptide). Sie werden durch Exozytose freigesetzt und erreichen die postsynaptische Membran durch Diffusion. Zytoplasmatische Bestandteile: dazu gehören Mitochondrien (im synaptischen Kopf sind davon sehr viele enthalten), Mikrofilamente, glattes ER und synaptische Bläschen Der synaptische Spalt befindet sich zwischen prä- und sub- bzw. postsynaptischer Membran. Er ist ein Teil des Interzellularraumes mit ca. 20 nm bis 50 nm Breite. Er enthält verdichtetes Material, das aus Glycoproteinen besteht. Man kann nun die Synapsen aufgrund ihrer Art der Übertragung klassifizieren: Chemische Synapsen: Übertragung durch Neurotransmitter, mit zwei verschiedenen Formen. Zum einen kann der Transmitter an der nachfolgenden Zelle gleich eine Reaktion auslösen (schnell) oder es wird erst eine Reihe chemischer Prozesse in Gang gesetzt, bevor der Reiz weitervermittelt werden kann (langsam). Elekrische Synapsen: Kontaktstellen an den Neuronen mit Gap juctions; die Erregung gelangt ohne Verzögerung von einer Nervenzelle zur Nächsten. Gemischte Synapsen: ein Teil der Synapse ist nach der Art der chemischen und der andere Teil nach der Art der elektrischen Synapse gebaut. Die Erregungsübertragung erfolgt über ein Aktionspotential, das zu einer Depolarisation an der Synapse führt. Es kommt zur Öffnung spannungsabhängiger Ca2+-Kanäle Ca2+-Einstrom Ca2+induzierte Exozytose der Neurotransmittervesikel (die Vesikel verschmelzen mit der Außenmembran) Neurotransmitter diffundieren in den synaptischen Spalt. Die Rezeptoren in der postsynaptischen Membran besitzen ligandengesteuerte Kanäle (z. B. bei nikotinischen Synapsen), die nun durchlässig für Kationen (v. a. Na+) werden, aber keine Anionen durchlassen. Die Neurotransmitter öffnen die Kanäle und es kommt zum Na+-Einstrom. Der Na+-Einstrom bewirkt eine Depolarisation, die als exzitatorisches postsynaptisches Potential (EPSP) bezeichnet wird Öffnung spannungsabhängiger Na+-Kanäle Aktionspotential. 11 5. Diffusionspotentiale Entstehung An Zellen beobachtet man das Phänomen, daß an der Zellmembran eine elektrische Potentialdifferenz anliegt, die man als Membranpotential bezeichnet. Diese Spannung entsteht als Diffusionspotential, welches sich durch die unterschiedlich schnelle Diffusion von Ionen durch die Membran und die asymmetrische Ionenverteilung auf beiden Seiten der Membran aufbaut. Im Gleichgewichtszustand gilt, daß die elektrische Potentialdifferenz E gerade so groß ist, daß der Unterschied im chemischen Potential zwischen Intra- und Extrazellulärraum durch die elektrische Spannung an der Membran ausgeglichen wird. Bei dem sich einstellenden Gleichgewichtspotential gilt, daß der Nettostrom des jeweiligen Ions durch die Membran 0 beträgt. Die Lage des Gleichgewichtspotentials läßt sich mit Hilfe der Nernst-Gleichung berechnen. Nernst-Gleichung RT [Ion]a Egleichgewicht = --------- ln -------zF [Ion]i E= R= F= z= T= [Ion]a = [Ion]i = Potential (V) Allgemeine Gaskonstante (8,314 J/ K mol) Faraday-Konstante (96487 C/mol) Wertigkeit des Ions Temperatur (in Kelvin, 393 K = 20° C) Extrazelluläre Ionenkonzentration intrazelluläre Ionenkonzentration 6. Ruhemembranpotential Bei der Nervenzelle liegt das Membranruhepotential um - 90 mV. Die Membran ist durchlässiger für K+-Ionen, so daß das Potential ein K+-Gleichgewichtspotential darstellt. Wenn die Zelle nicht erregt (aktiv) wird, bleibt das Membranruhepotential auf einem konstanten Wert, dem Ruhemembranpotential. Eine elektrische Spannung tritt auf, wenn eine Membran verschiedene oder verschieden konzentrierte Elektrolytlösungen voneinander trennt oder wenn sich für die Ionen eines Elektrolyten eine unterschiedlich hohe Durchlässigkeit besitzt. Ionenkonzentrationen Na+ K+ Andere ClHCO3Protenat intrazellulär 12 155 4 8 155 extrazellulär 145 4 5 120 27 27 Goldmann-Gleichung Bei der Entstehung des Membranpotentials spielen die Konzentrationsgradienten zwischen der extrazellulären und der intrazellulären Flüssigkeit sowie die Permeabilitäten für alle Ionen eine Rolle, für die die Zellmembran durchlässig ist. Das sind unter physiologischen Bedingungen in der Hauptsache Na+, K+ und Cl-. Dieser Tatsache trägt die Goldman-Gleichung Rechnung, in der als zusätzlicher Term die Permeabilität für die jeweiligen Ionen eingeführt wurde. 12 RT PK [K+]a + PNa [Na+]a + PCl [Cl-]a Egleichgewicht = --------- ln -----------------------------------------zF PK [K+]i + PNa [Na+]i + PCl [Cl-]i PK, PNa und PCl sind die Membranpermeabilitäten für K+, Na+ und Cl-. Sie werden meist als relatives Maß, bezogen auf K+, angesehen. So gilt an vielen Zellen PK = 1, PNa = 0,01 und PCl = 0,01. Das heißt z. B., daß Na+ bei gleichem Konzentrationsgradienten unter Ruhebedingungen 100-fach langsamer durch die Membran permeirt als K+ das Ruhemembranpotential liegt demnach sehr nahe am K+bzw. dem Cl- -Diffusionspotential liegt. Ruhe Der überwiegende Teil der Kanäle sind K+-Kanäle, so daß K+-Ionen diffundieren können. Demnach entspricht das Ruhepotential dem K+- Diffusionspotential bzw. dem Cl- -Diffusionspotential. Die nicht erregte Membran ist fast undurchlässig für Na+. erregbare Zellen K+ Na+ Innen Außen + 7. Aktionspotential Beim Aktionspotential kommt es zu einer schnellen Veränderung des Membranpotentials, das sich aber von selbst wieder beendet, so daß das Membranpotential zum Ruhepotential wieder zurückkehrt. Es wird durch eine Depolarisation der Membran über einem gewissen Wert, Schwellenwert ausgelöst. Es gilt hier das Alles-oder-nichts-Gesetz. Dauer Nerv: 1 ms Muskel: 10 ms Herzmuskel: 200 ms Phasen Kurze Vordepolarisation bis zum Schwellenwert Aufstrich: sehr rasche Depolarisierung bis zum Überschuß = „overschoot“ in den positiven Bereich hinein. Die Membran verliert ihre „Polarisation“ (= Aufladung). Die Depolarisation überschreitet i. d. R. die 0-Linie das Membranpotential wird positiv bis ~ + 30 mV (spannungsgesteuerte Na+-Kanäle werden geöffnet) Überschuß: ist nur der positive Anteil des Aktionspotentials (Na+-Kanäle werden geschlossen) Repolarisation: nach Überschreitung der Spitze, stellt sich das alte Ruhepotential wieder ein (spannungsgesteuerte K+-Kanäle werden geöffnet) Hyperpolarisierendes Nachpotential (K+ - Kanäle werden geschlossen) 13 Refraktärphase (Na+ - Kanäle geschlossen inaktiv) Das Ruhepotential oder auch Gleichgewichtspotential der K +-Ionen ist die Basis der Erregung. Durch die Depolarisation auf -50 mV (Schwellenwert) wird eine erhöhte Leitfähigkeit der Na +-Ionen hergestellt. Es wird ein Aktionspotential ausgelöst, wenn bis zum Schwellenwert depolarisiert wurde. Die Repolarisation wird durch K+-Ausstrom beschleunigt (verzögerte Erhöhung der K+-Leitfähigkeit). Innerhalb der Millisekunde wird durch die Depolarisation die erhöhte Na +-Leitfähigkeit inaktiviert. Danach folgt die Refraktärzeit der Membran. Refraktärität Es ist die Folge der Inaktivierung des Na+-Systems. Depolarisiert man unmittelbar nach einem Aktionspotential die Membran, so tritt keine Erregung auf = absolute Refraktärphase. Sie begrenzt die maximale Frequenz mit der in der Zelle ein Aktionspotential ausgelöst werden kann. Anschließend folgt die relative Refraktärphase. Hier können durch große Depolarisationen Aktionspotentiale ausgelöst werden, jedoch ist die Amplitude verkleinert. Zustände der schnellen spannungsgesteuerten Na+ -Kanäle geschlossen - aktivierbar geschossen - inaktiviert offen - aktivierbar Der „geschlossen - inaktivierbare“ Zustand ist verantwortlich für die absolute Refraktärzeit. Erst wenn der Kanal spontan bei einem hyperpolarisierenden Potential in den Zustand „geschlossen aktivierbar“ übergegangen ist, ist eine erneutes Öffnen bei der Depolarisation möglich. Eigenschaften von Rezeptorpotentialen und Aktionspotentialen Rezeptorpotentiale, Postsynaptische Potentiale Abgestufte Antwort, die den Reiz analog abbildet Keine Schwelle Keine Refraktärzeit Summation möglich Depolarisation und Hyperpolarisation Weiterleitung in benachbarte Membranbezirke passiv mit Amplitudenabfall Auslösung an spezialisierten Membranbezirken, die den adäquaten Reiz beantworten Aktionspotentiale Alles-oder-nichts-Antwort Amplitude ist abhängig von der auslösenden Ursache Amplitude des auslösenden Ereignisses kodiert in der Frequenz der Aktionspotentiale oder durch Entladungsmuster Definierte Schwelle Refraktärzeit Keine Summation Immer Depolarisation Aktive Regeneration an Membran führt zu verlustfreier Erhaltung der Amplitude Auslösung an Membranen mit schnelle, spannungsgesteuerten Na+-Kanälen 8. Generatorpotential Das Generatorpotential ist eine qualitative Differenzierung von Reizen auf der Ebene von Rezeptoren infolge ihrer spezifischen Empfindlichkeit. Die quantitative Unterscheidung von Intensitäten erfolgt 14 dadurch, daß die Membran von Rezeptorzellen örtliche Potentiale erzeugen, deren Amplituden proportional zur Stärke des adäquaten Reizes ist. Das Rezeptorpotential (Sensorpotential) oder Generatorpotential erzeugt an der dazugehörigen afferenten Nervenfaser ein Aktionspotential. Wechselnde Reizstärken bewirken eine Amplitudenmodulation, die dann wiederum die Frequenzmodulation der Aktionspotentiale beeinflußt. Sensoren, Rezeptoren Rezeptoren sind spezialisierte Nervenzellen (Sinneszellen), die Reize aus der Um- und Innenwelt in einen lokalen Generatorstrom umwandelt, der von der Reizstärke abhängt und der sich in einer reizabbildenden (analogen) Depolarisation des Rezeptor-Membranpotentials wiederspiegelt. Je nach Größe und Dauer löst das Generatorpotential nach Überschreitung der Membranschwelle am ersten Ranvierschen Schnürring der afferenten Nervenfaser Aktionspotentiale aus, die an das ZNS weitergeleitet werden. Sensoren sind Zellen oder Membranabschnitte von Zellen, die Sensorpotentiale ausbilden, welche in den Afferenzen in Aktionspotentialsequenzen umkodiert werden. Die Kanäle deren Permeabilitätsänderung das Rezeptorpotential des Sensors verursachen, werden nicht selektive Kationenkanäle genannt. Sensorpotentiale Das sind abgestufte Antworten. Sie bilden mit ihrer Amplitude die Reizgröße ab. Der Reiz muß jedoch die Erregungsschwelle überschritten haben. Reizstärke Amplitude des Generatorpotentials Frequenz des Aktionspotentials Reizdauer Dauer des Generatorpotentials Dauer der Frequenzen insgesamt Beispiele a) Dehnungsrezeptor, z. B. Muskelspindel Ein Dehnungsrezeptor besteht aus einer Nervenzelle mit relativ großem Soma, deren Dendriten Muskelfasern anliegen und von der ein Axon Aktionspotentiale fortleiten kann. Bei der Dehnung des Muskels wird im Soma eine Depolarisation gemessen. Die Depolarisation hört auf, wenn der Muskel nicht mehr gedehnt wird. Die Depolarisation wird Rezeptor- oder Generatorpotential genannt. b) Mechanorezeptoren, z. B. Vater-Pacini-Körperchen Ein Druck löst die Bildung eines Generatorpotential aus, dabei nehmen sowohl Anstiegsgeschwindigkeit als auch die Amplitude mit der Reizstärke zu. Örtliche Potentiale führen zu elektrotonischen Depolarisationen des Axons und damit zur Ausbildung eines Aktionspotentials, deren Frequenz der Amplitude des Generatorpotentials und damit der Reizstärke proportional ist. Die Proportionalität zwischen Reizstärke und Frequenz des Aktionspotentials ist nicht linear, sondern logarithmisch. c) Sehzellen 15 Die Generatorpotentiale der primären Sehzellen (Stäbchen und Zapfen) nehmen eine Sonderstellung ein, da sie bei der Belichtung hyperpolarisieren. Transformation Das ist die Auflösung einer Frequenz von Aktionspotentialen durch das Generatorpotential. Die Amplitude des fortschreitenden Aktionspotentials folgt dem Alles-oder-nichts-Gesetz. Die Abbildung der Reizgröße erfolgt durch die Frequenzänderung. 9. Elektrotonus Ein Elektrotonus ist eine passive Potentialänderung durch einen Ionenstrom. Er kann sich nur über eine kurze Strecke ausbreiten. An einer kugeligen Zelle Bei einem Versuch wird eine Mikroelektrode in eine kugelförmige Zelle eingestochen. Bei Einspeisung eines positiven Stroms wird eine Depolarisation der Zelle hervorgerufen. Der Einstrom positiver Ionen kann aber nur langsam die Ladung des durch die Zellmembran gebildeten Kondensators verändern. Es führt zu einer exponentiell sich an einen Grenzwert annähernde Potentialänderung. Die Annäherung an den Grenzwert erfolgt mit der Zeitkonstante . Die Veränderung des Membranpotentials bildet sich also mit einer zeitlichen Verzögerung aus. Gleichzeitig erhöht die durch den Ioneneinstrom bewirkte Depolarisation der Zellmembran, aber auch den K+-Ausstrom, so daß schließlich ein neues Gleichgewicht zwischen Ioneneinstrom und Ionenausstrom entsteht und sich ein neuer Endwert des Membranpotentials einstellt. Die Änderung des Membranpotentials nennt man elektrotonisches Potential. An langgestreckten Zellen Der Ionenstrom führt zu einer Potentialänderung, die exponentiell mit der Längenkonstante entlang des Axons abfällt. 10. Erregungsleitung Kontinuierliche Erregungsausbreitung Eine kontinuierliche Erregungsausbreitung erfolgt an marklosen Nervenfasern. Die elektrotonische Ausbreitung der Depolarisation entlang der Nervenfaser erfolgt über Ausgleichsströme, die wiederum benachbarte Bezirke depolarisieren und dort ein Aktionspotential auslösen. Es ist eine einseitig gerichtete Erregungsausbreitung, da sich die bereits erregten Bezirke in der Refraktärphase befinden. An jeder Stelle der Nervenfaser erfolgt eine vollständige Erregung nach dem Alles-oder-nichtsGesetz. Die Amplitude der Aktionspotentiale ist an allen Stellen gleich. Das Aktionspotential erscheint jedoch gegenüber dem Reiz mit Verzögerung und wächst proportional zum Abstand an. Die Erregungen sind aneinander gekoppelt, d. h. die elektrotonische Ausbreitung von Reizströmen erfolgt entlang der Faser. Einströmende Na+-Ionen wirken auf die benachbarte, noch nicht erregte Membranstelle als Stromquelle für ein depolarisierendes elektrotonisches Potential. 16 Saltatorische Erregungsleitung Eine saltatorische Erregungsleitung findet an markhaltigen Nervenfasern statt. Die Ausgleichsströme können wegen der Isolierung der Myelinscheiden nur an Ranvier’schen Schnürringen die Membran passieren. Es bildet sich daher nur an den Ranvier’schen Schnürringen ein Aktionspotential. Die saltatorische Erregungsleitung ist energiesparsam und schneller als die kontinuierliche Erregungsleitung in marklosen Nerven. 11. Erregende und hemmende Synapsen Erregende, exzitatorische Synapse An erregenden Synapsen kommt nach der Depolarisation einer präsynaptischen Nervenendigung durch ein Aktionspotential zu einer Ausschüttung der Überträgerstoffe, die mit den Rezeptoren der postsynaptischen Membran reagieren. Bei der erregenden Übertragung kommt es zum Öffnen von ligandengesteuerten Kationenkanälen (Na+- oder Ca2+-Einstrom) und somit zur Depolarisation. Es entsteht ein EPSP = exzitatorisches postsynaptisches Potential und im Anschluß daran folgt ein Aktionspotential. Hemmende, inhibitorische Synapse An hemmenden Synapsen führt die Reaktion des präsynaptisch freigesetzten Transmitters mit den postsynaptischen Rezeptoren zur Permeabilitätsänderung durch Öffnen von K +- und/ oder Cl- Kanälen. Die Öffnung dieser Kanäle setzt den Membranwiderstand herab. Der Ionenstrom bewirkt eine Hyperpolarisation und damit Bildung eines IPSP = inhibitorisches postsynaptisches Potential. Das IPSP entfernt das Membranpotential von der Schwelle. Es führt zur Widerstandsabnahme, schließt die erregende Depolarisation kurz und stabilisiert das Membranpotential auf seinem Ruhewert, kurz: führt zu einer Abschwächung der exzitatorischen Signale. 12. Hemmungsvorgänge Präsynaptische Hemmung Kommt eher selten vor. Die Transmitterfreisetzung an der präsynaptischen Endigung wird reduziert oder völlig verhindert, durch die Aktivierung einer hemmenden Synapse. Diese löst auf die erregende Synapse ein IPSP aus, wodurch das EPSP an dieser verringert wird Verringerung der Transmitterfreisetzung. Postsynaptische Hemmung Der Erregungszustand der Soma- und Dendritenmembran wird herabgesetzt, d. h. hier führt ein Zwischenneuron zu einer Hyperpolarisation des postsynaptischen Neurons. 13. Neuronale Rezeptoren Ligandengesteuerte Kanäle, isotrope Rezeptoren Als Ligand werden alle an Rezeptoren bindende spezifische Substanzen bezeichnet. Ein Transmittermolekül bindet an den Rezeptor, der Ionenkanal wird für Millisekunden geöffnet. 17 Ein Beispiel sind: cholinerge Rezeptoren des nikotinischen Typs, z. B. in Endplatten enthalten. Das Acetylcholin koppelt an gesteuerte Kanäle an den neuromuskulären Endplatten. Es folgt ein zyklisches Reaktionsschema, in dem mehrere Öffnungen, die durch kurze Intervalle getrennt sind, erfolgen. Es kommt zu einer schnellen Konformationsänderung des Moleküls: Acetylcholin-Konzentration Öffnungswahrscheinlichkeit . Indirekt ligandengesteuerte Kanäle, metabotrope Rezeptoren Der Transmitter öffnet nicht direkt den Ionenkanal, sondern löst eine Kaskade chemischer Reaktionen aus. Ein Beispiel sind cholinerge Rezeptoren des muskarinischen Typs. Das Acetylcholin bindet an den Rezeptor. Ein trimeres G-Protein bildet dann mit dem Rezeptor einen Komplex. Das an das G-Protein gebundene GDP wird durch GTP ersetzt, so daß ein aktives G-Protein entsteht, besteht aus dem GTP und der -Untereinheit, das nun den K+-Kanal öffnet. Am Herz würde es nun zu einer Frequenzabsenkung kommen. (Hemmung der Erregungsbildung im Sinusknoten) Weitere Möglichkeiten für das Öffnen von Kanälen wäre die Zwischenschaltung von cAMP oder durch Phosphorylierung über die Proteinkinase C. Dieser Vorgang geht von einem G-Protein aus, das über die Bildung von Diacylglycerin (DAG) die Proteinkinase aktiviert. 14. Neurotransmitter Aufgaben und Vorkommen Neurotransmitter sind chemische Substanzen, die an den Synapsen im ZNS und an den peripheren Nerven eine Erregung weiterleiten. Sie werden in den Vesikeln der präsynaptischen Nervenendigungen gespeichert und durch ein Aktionspotential freigesetzt. Nach Diffusion im synaptischen Spalt bewirken sie an der postsynaptischen Membran eine Permeabilitäts- und Potentialänderung. Es kommt zu einer De- bzw. Hyperpolarisation. Transmitter zwischen prä- und postganglionärem Neuron ist beim Sympathikus und Parasympathicus das Acetylcholin (nikotinerge Rezeptoren). Transmitter zwischen postganglionärem Neuron und Endorgan ist beim Sympathikus in der Regel Noradrenalin (- und -Rezeptoren), beim Parasympathicus Acetylcholin (muskarinerge Rezeptoren). Neurotransmitter Acetylcholin GABA (-aminobuttersäure): wirkt als hemmender Überträgerstoff im ZNS Glycin: Hemmung von -Motoneuronen Glutamat: wichtigste erregender Überträgerstoff im ZNS Serotonin: überall im Körper, Kontrolle vieler neuronaler Funktionen Histamin: v. a. im Gehirn (Schlaf-Wach-Regulation, Motorik, Sexualverhalten, ...) Adrenalin: an wenigen Synapsen im Gehirn Noradrenalin: hat Einfluß auf Lernprozesse, Verarbeitung von Sinnesreizen, Schafregulation im Gehirn, in der Peripherie an Synapsen von Herz- und Gefäßmuskulatur Dopamin: im Gehirn (Parkinson-Krankheit: durch Untergang von Nerven die Dopamin als Transmitter haben, sinkt der Dopaminspiegel ab typische Symptome der Krankheit treten dann auf) Benennung der Rezeptoren 18 Cholinerge Rezeptoren Transmitter Subtypen Adrenerge Rezeptoren Adrenalin und Noradrenalin (Katecholamine) Acetylcholin (Ach) nikotinerge Rezeptoren muskarinerge Rezeptoren mit M1, M2 und M3-Rezeptoren -Rezeptoren mit 1- und 2-Rezeptoren -Rezeptoren mit 1- und 2-Rezeptoren Cholinerge Rezeptoren a) Nikotinerge Rezeptoren b) Sie übertragen die Information über ligandengesteuerte Kanäle. Sie befinden sind an den Übertragungsstellen vom prä- auf das postganglionäre Neuron von Sympathikus und Parasympathicus sowie an motorischen Endplatten, Muskarinerge Rezeptoren Sie befinden sich an den Kontaktstellen parasympathisches postganglionäre Neuron auf den Effektor oder auf eine andere Nervenzelle. Rezeptor Botenstoff Vorkommen M1-Rezeptoren Ca2+ vor allem auf Neuronen, Förderung der Erregbarkeit M2-Rezeptoren cAMP Herzmuskel Hemmung der Herzfrequenz glatte Muskulatur Kontraktion M3-Rezeptoren Ca2+ Drüse Sekretion Adrenerge Rezeptoren a) b) -Rezeptoren Rezeptor Botenstoff 1-Rezeptoren1 Ca2+ 2-Rezeptoren2 cAMP Vorkommen Endorgane des peripheren Nervensystems: Kontraktion (Vasokonstriktion, Uteruskontraktion, Kontraktion intestinaler Sphincter) Dilatation (Pupillendilatation) präsynaptischen Hemmung der Noradrenalinfreisetzung Sympathicotonus intestinale Relaxation -Rezeptoren Erhöhung der K+-Leitfähigkeit durch die Aktivierung der Adenylatcyclase über ein Gs-Protein und die damit verbundene Erhöhung des sekundären Botenstoffs cAMP. 1 Sie vermitteln ihre Wirkung durch die Phospholipase C, die IP 3 und Diacylglycerin synthetisiert. Das IP3 öffnet Ca2+-Kanäle 2 Ein Gi-Protein vermittelt die Hemmung der Adenylatcyclase Konzentrationsverminderung des cAMP zur Unterbrechung des K+-Ruhestroms. Es ist direkt an Ionenkanäle gebunden. 19 Rezeptor Botenstoff 1-Rezeptoren cAMP 2-Rezeptoren cAMP Vorkommen Herz Kontraktionskraft und Frequenz Macula densa Freisetzung von Renin Fettgewebe freien Fettsäuren Rezeptoren der Endorgane: Dilatation (Vasodilatation, Bronchodilatation) Glycogenolyse Relaxation (Uterusrelaxation, intestinale Relaxation) Thermogenese Wirkungsweise von Adrenalin und Noradrenalin Die Wirkungsweise von Adrenalin und Noradrenalin ist an den Rezeptoren verschieden: Adrenalin haben die gleiche Wirkung 1-Rezeptoren 2-Rezeptoren 1-Rezeptoren 2-Rezeptoren Bildung und Freisetzung am Beispiel von Acetylcholin Noradrenalin Bildung: Sie erfolgt nahe am präsynaptischen Ende eines Neurons durch die Übertragung einer Acetylgruppe von einem Acetyl-CoA auf Cholin. Dieser Vorgang wird durch das Enzym CholinAcetyltransferase katalysiert. Die Speicherung erfolgt in synaptischen Vesikeln. Freisetzung: Freigesetzt wird das Acetylcholin, wenn ein Aktionspotential die Öffnung spannungsgesteuerter Ca2+-Kanäle auslöst. Ca2+ fließt in das präsynaptische Nervenende ein, setzt die Exozytose der präsynaptischen Vesikel in Gang. Es kommt zur Freisetzung der Vesikel in den synaptischen Spalt. Abbau: Gespalten wird das Molekül im Extrazellularraum durch das Enzym Acetylcholinesterase, die an der Membran der Endorgane und der Nerven selbst lokalisiert ist. Das Acetylcholin wird in Cholin (Aufnahme und Recycling) und Acetat gespalten. 15. Der einfache Reflexbogen Der einfache Reflexbogen stellt die Antwort von Effektoren des Körpers auf eine Erregung der Rezeptoren dar = Reflex. Es ist die automatische, zielgerichtete Antwort auf einen Reiz. Eigenschaften: Ist willentlich nicht unterdrückbar. Automatisch zielgerichtete Antwort auf einen Reiz Reflexbogen Der Reflexbogen ist eine neuronale Verschaltung, ausgehend vom peripheren Rezeptor zu einem oder mehreren zentralen Neuronen im ZNS bis zum peripheren Rezeptor. afferenter Schenkel AFFERENZ Reflexzentrum Interneurone im ZNS Rückenmarksneurone 20 efferenter Schenkel EFFERENZ sensible Fasern motorische ZNS Einheiten Sensoren Rezeptortypen Erfolgsorgan Effektor Die Rezeptoren bilden mit ihren afferenten Fasern den afferenten Schenkel des Reflexbogens. Die Anzahl der zentralen Neurone ist bis auf den monosynaptischen Dehnungsreflex immer größer als eins. Motoaxone oder postganglionäre Fasern des vegetativen Nervensystems bilden den efferenten Schenkel. Effektoren des Reflexbogens sind Skelettmuskulatur, glatte Muskulatur, Herz oder Drüsen. Reflexzeit Es ist die Zeit zwischen Beginn des Reizes und Antwort des Effektors. Sie ist vorwiegend bedingt durch die Leitungszeit in den Fasern und zentralen Teilen des Reflexbogens. Außerdem kommt hinzu: Umwandlung des Reizes in eine fortleitende Erregung Übertragungszeit in den Synapsen (Synapsenzeit) Übertragung vom efferenten Schenkel auf den Effektor Aktivierung des Effektors durch diese Membranerregung Hemmende Schaltkreise z. B. Patellasehnenreflex. Der Ib-Motoneurone und damit den Antagonisten über hemmende Interneurone. Der Strecker wird erregt Strecken des Beins. 16. Der monosynaptische Eigenreflex (Muskelspindel) Beim monosynaptischen Dehnungsreflex ist der afferente Schenkel direkt mit dem efferenten Schenkel verbunden. Das System dient der Lagestabilisierung. Typische monosynaptische Reflexe sind Muskeldehnungsreflexe (Sehnenreflexe). Die Dehnung führt zu einer Erregung von Muskelspindelafferenzen (Ia-Fasern), die eine Erregung in den Motoneuronen des dazugehörigen Muskels hervorrufen. Die Erregung wird über monosynaptische Nerven (A-Fasern) weitergeleitet und führt zur Muskelkontraktion. Sensor: ist die Muskelspindel. Sie besteht aus intrafusalen Muskelfasern und dem nervalen Teil, die Endigungen der Ia-Muskelafferenzen spirale und nicht kontraktilen Mittelteil der intrafusalen Fasern. Stammfasern: Das ist der afferente Schenkel mit einer hohen Leitungsgeschwindigkeit. Der efferente Schenkel besteht aus den Motoneuronen der sensortragenden Muskeln. Adäquater Reiz: Dehnung des Muskels. Dabei sind die Muskelspindeln die Meßfühler für Lage und Längenveränderungen. Eine dynamische Dehnung des Muskels führt zur Entladungssalve in den Ia-Afferenzen. Dadurch wir der Motoneuronenpool aktiviert und es kommt zur Spannungszunahme im Muskel. Eigenreflex Hier liegen Affektor und Effektor im selben Organ. Es existiert nur eine Synapse zwischen dem efferenten und afferenten Neuron. Die Reflexzeit ist dadurch sehr kurz (ca. 20 ms). Da der Reiz und die Antwort im selben Organ liegen, heißt diese Reaktion auch Eigenreflex. 21 Dehnungsreflex Beim Dehnungsreflex sind Effektoren die Muskelspindelrezeptoren. Sie liegen als intrafusale Muskelfasern, von Bindegewebe umhüllt, zwischen der extrafusalen Arbeitsmuskulatur. Das Mittelstück der intrafusalen Faser ist der eigentliche Dehnungsrezeptor, an den Enden ist die typische Querstreifung zu erkennen. Somit sind diese Abschnitte kontraktil und werden von -Motoneuronen innerviert. Werden beim Dehnungsreflex die Muskelrezeptoren gedehnt, kommt es zu einem Generatorpotential und zur Bildung eines Aktionspotentials. Sie laufen über 1a-Fasern zum Rückenmark und von dort über -Motoneurone zu der extrafusalen Arbeitsmuskulatur um eine Kontraktion auszulösen. Dadurch werden die Dehnungsrezeptoren entspannt und das Generatorpotential läßt nach. Aber auch über -Motoneurone können Dehnungsreize aktiviert werden. Es kommt dabei zu einer erhöhten Spannung in den Enden der intrafusalen Fasern, also zu einer Vordehnung. Je höher diese ist, um so größer ist die Impulserzeugung im Mittelstück. Der Rezeptor wird daraufhin bei relativ geringer Dehnung schon große Generatorpotentiale, also auch Aktionspotentiale haben. Dadurch kann der Organismus Reflexabläufe beeinflussen bzw. den Muskeltonus erhöhen. Mit Hilfe des Jendrassischen Handgriffs (gebeugte Finger verhaken und kräftig auseinander ziehen) können Reflexe, z. B. der Quadrizepsreflex leichter ausgelöst werden 17. Polysynaptischer Fremdreflex Außer der monosynaptische Dehnungsreflex sind alle anderen Reflexe über mehrere zentrale Neurone im Reflexbogen hintereinander geschaltet. Sie sind deshalb polysynaptisch. Hier sind Rezeptor und Effektor im Organismus räumlich voneinander getrennt, nicht im gleichen Erfolgsorgan, so daß sie als Fremdreflex bezeichnet werden. Man teilt die Fremdreflexe auch noch in vegetative Reflexe (Refelxbögen enden in den Effektoren des vegetativen Nervensystems) und polysynaptische motorische Reflexe (Effektoren sind Skelettmuskeln) unterteilen. Bei polysynaptische Reflexen kann durch die größere Anzahl der zentralen Neurone die Reflexantwort noch besser an die jeweiligen Erfordernisse des Organismus angepaßt werden. Kennzeichen Sind über spinale Interneuronketten mit den motorischen Einheiten verknüpft Bei einem schmerzhaften Reiz am einer Extremität wird diese reflektorisch angezogen, z. B. Wegziehen er Hand, Lidschluß, Anpassung der Bauchdecke Es ist der erste Schritt einer Schutz- und Fluchthandlung Summation, Ausbreitung (Irridiation) Unterschwellige Reize können sich zu einem überschwelligen Reiz summieren. Diese Summation findet an den Interneuronen und Motoneuronen statt. Subjektive Empfindungen gehen der Reflexauslösung voraus (z. B. Kitzeln, Kratzen vor dem eigentlichen Hustenreflex), d. h. die Rezeptoren sind schon erregt. Die Reflexzeit hängt stark von der Reizintensität ab. Dei sehr starker Reizintensität kommt es zur Ausbreitung des Reflexbogens auf bisher unbeteiligte Muskelgruppen. Es werden dabei bisher unterschwellig erregte Neurone überschwellig erregt (z. B. bei sehr starkem Husten arbeitet die Brust-, Schulter-, Bauch- und Zwerchfellmuskulatur mit). 22 Beugereflex Wird bei einem Tier die Hinterpfote schmerzhaft gereizt, so kommt es zu einem reflektorischen Wegziehen dieser Extremität, also zu einer Beugung. Die entsprechenden Streckmuskeln werden während dieser Beugung gehemmt (über hemmende Interneurone). Die Rezeptoren für den Beugereflex liegen in der Haut. Da der Reflex die Extremität aus einem ihr schädlichen Bereich wegzeiht, wird er auch als Schutzreflex bezeichnet. Wiederholte schmerzhafte Reize führen zu einer Sensitivierung d. h. die Reflexschwelle ist gesenkt, die Reflexzeit ist verkürzt und das rezeptive Feld vergrößert. Es kann also Ausbreitung stattfinden. Der Beugereflex kann auch abhängig vom Reizort unterschiedlich stark ausfallen, was als Lokalzeichen bezeichnet wird. Gekreuzter Streckreflex Die Beugung einer Extremität führt immer zu einem erhöhten Streckertonus in der contralateralen Muskulatur der Extremität. Dadurch ist dieses Bein befähigt, die zusätzlich einwirkende Kraft zu tragen. Die contralateralen Beuger werden gehemmt, d. h. sie erschaffen. Fällt ein Reiz z. B. an der Hinterpfote sehr stark aus, so bleibt die Reflexantwort nicht auf das hintere Bein beschränkt, sondern breitet sich über das Rückenmark auf die vorderen Extremitäten aus. Dort wird ebenfalls (jedoch Seitenverkehrt) ein gekreuzter Streckreflex ausgelöst. Diese Reflexantwort bereitet den Organismus auf eine Flucht vor. Habituation, Gewöhnung Bei häufiger, nicht schmerzhafter Wiederholung eines Hautreizes am selben Ort mit gleicher Intensität läßt die Reflexantwort nach. Komplizierte Schutzreflexe sind: Pupillenreflex3 Tränenfluß Hustenreflex Niesen 18. Unterschied zwischen Eigenreflex und Fremdreflex Eigenreflex Monosynaptisch Motorisch Angeboren Beispiel: Patellasehnenreflex Fremdreflex Polysynaptisch Motorisch oder vegetativ Angeboren oder erworben Beispiel: Pupillenreflex 19. Bedingte Reflexe Die bisher behandelten Reflexe können bei allen Individuen der gleichen Art beobachtet werden. Sie sind im Bauplan des Nervensystems festgelegt und somit angeboren. Es besteht aber auch die 3 Er wird durch plötzlich vermehrten Lichteinfall ausgelöst. Das efferente Signal läuft über parasympathische Fasern des N. oculomotorius und bewirkt das Engerwerden der Pupillen. Es reagieren stets beide Pupillen. Es reagieren stets beide Pupillen gleichzeitig, auch wenn der Reiz nur ein Auge trifft (konsensueller Reflex). 23 Möglichkeit bestimmte reflektorische Reaktionen zu lernen, um besser auf wechselnde Situationen reagieren zu können. Dafür muß das ZNS Informationen mit anderen vergleichen und speichern. Ein Beispiel dafür liefert Pawlow. Wird einem Hund ein Stück Fleisch ins Maul gelegt, so kommt es reflektorisch zur Speichelsekretion. Wird statt dessen eine Glocke geläutet kommt es nicht zur Speichelsekretion. Pawlow hat nun in unablässigem Forschdrang festgestellt: wird das Glockenläuten immer mit der Fütterung ausgelöst, registriert das Gehirn diese Kombination. So passiert es nach einiger Zeit, daß der Speichelfluß schon beim Glockenschlag ausgelöst wird. Dieser bedingte Reflex wird durch Übung erhalten oder durch Unterlassen vergessen. Ähnlich geschieht dies beim erscheinen des Melkers Einschießen der Milch (Milch-Ejektions-Reflex). 20. Gliazellen Funktion der Gliazellen Ernährung und Stoffaustausch der Nervenzellen Förderung der Erregungsleitung (Ausbildung von Nervenfaserhüllen) = Isolator Unspezifische Abwehraufgaben, Fähigkeit zur Phagozytose Ionenspeicher Stützfunktion: sie füllen die Räume zwischen Perikaryon, Dendriten und Axonen von Nervenzellen aus, dienen der Organisation und der räumlichen Trennung der Neurone Stoffwechselaktive Aufgaben: Stoffaustausch zwischen Nervenzellen und Kapillaren Bilden die Axonscheide markhaltiger und markloser Nervenfasern und beeinflussen dadurch die Leitungsgeschwindigkeit Sind an Regulationsvorgängen beteiligt Bilden die Blut-Hirn-Schranke Gliazellen des ZNS Ependymzellen: Kleiden die Hohlräume des ZNS und den Zentralkanal des Rückenmarks aus Bewegung des Liquor cerebrospinalis Transport von Stoffwechselmetaboliten Makroglia: Liegen auch den Blutkapillaren perivaskulär an und sind Bestandteil der Blut-Hirn-Schranke Verbindet sich durch die zytoplasmatischen Ausläufer mit den Nervenzellen (Nervensystem und den weichen Gehirnhäuten) zum Flüssigkeits- und Stofftransport (NZ Kapillare) Regulieren die Ionenkonzentration des Nervengewebes Photoplasmatischer Astrozyt: Liegt in der grauen Substanz des ZNS Kennzeichnet ein polygonales Kerngebiet Hat eine Vielzahl von reich verzweigten Fortsätzen. Oligodendrozyt: Sind kleine Gliazellen in der grauen und weißen Substanz des Rückenmarks 24 Bilden die Myelinscheiden um die Nervenzellenfasern im ZNS Mikroglia: Klein, meist sternförmig Liegen in der Nähe von Gefäßen und in der grauen und weißen Substanz Schließt häufig phagozytiertes Material aus abgestorbenen Nervenzellen ein (Phagolysomen) Gliazellen im peripheren ZNS Schwann’sche Zellen: Bilden die Myelinscheide um periphere Nervenzellenfortsätze Amphizyt: Umgeben das Perikaryon von Nervenzellen der vegetativen Ganglien und von Spinalganglien Stoffwechselaktive Aufgaben MUSKELN 1. Vergleich von quergestreifter und glatter Muskulatur In den Muskelfasern von Skelett- und Herzmuskulatur liegen die Aktin- und Myosinfilamente streng geordnet, so daß eine optische Querstreifung entsteht. Diese fehlt der glatten Muskulatur. Bei der Innervation gibt es ebenfalls Unterschiede, so wird die Skelettmuskulatur durch motorische Endplatten innerviert, das Herz allerdings durch Eigenerregung in den Automatiezentren. quergestreifte Muskeln Hexagonales Gitter der Myofilamente im Querschnitt Jedes „dicke“ Myosinfilament ist von 6 „dünnen“ Aktinfilamenten umgeben Daraufhin folgt wieder eine hexagonale Anordnung von 6 Myosinfilamenten Verhältnis Aktinfilament:Myosinfilamet = 2:1 Aktinfilamente sind über -Actinin an ZStreifen befestigt Sarkolemm bildet eine Verbindung zwischen kontraktilem Apparat und extrazellulärer Matrix Muskelfasern bis zu 15 cm lang 25 glatte Muskeln Hohes Ordnungsprinzip ist nicht vorhanden Keine Querstreifung Enthält mehr Aktin als die Skelettmuskeln Verhältnis Aktin : Myosin = 12 : 1 bis 18 : 1 Vernetzungspunkte bilden sog. „dense bobies“ Aktinfilamente inserieren am Sarkolemm unter Bildung von „dense patches“ bzw. „dense bands“ Während der Kontraktion wird die Zellmembran eingezogen Muskelfaserlänge zwischen 30 bis 200 m Vorkommen in den Eingeweiden, in der Wand von Blutgefäßen und im Auge 2. Muskelfasertypen glatte Muskulatur 1 Zellkern Wenig sarkoplasmatisches Retikulum Unregelmäßige Anordnung der Aktin-Myosinfilamente mit Befestigungsplatten Intermediärfilamente Keine motorische Endplatte Langsame Bewegung Energiesparend Automatie Desmosomen Viele Gap junctions Tetanisierbar Wenig Mitochondrien Herzmuskel 1 Zellkern Mittelmäßig viel sarkoplasmatisches Retikulum Querstreifung Keine motorische Endplatte Rhythmische Bewegungen Ausdauernde Funktion Automatie (Steuerung) ist möglich Viele Gap junctions Nicht tetanisierbar (lange Refraktärzeit) Viele Mitochondrien Skelettmuskel Viele Zellkerne Ausgeprägtes sarkoplasmatisches Retikulum Querstreifung Motorische Endplatte Schnelle Bewegungen Energieaufwendig Steuerung Keine Gap junctions Tetanisierbar Wenige Mitochondrien Langsame, kaum ermüdbare Fasern mit hoher oxidativer Enzymaktivität Schnelle, wenig ermüdbare, dünnere Fasern mit hoher Myosin-ATPase, hoher glykolytischer und stärkerer oxidativer Enzymaktivität Schnelle, ermüdbare, dicke Fasern mit hoher Myosin-ATPase und hoher glykolytischer (anerober) Enzymaktivität 3. Struktur und Zusammensetzung des Muskels Die mit bloßem Auge erkennbaren „Fleischfasern“ sind Faserbündel aus Muskelfasern 0 Muskelzelle. Die Zellmembran der Muskelzelle ist das Sarkolemm. Es umschließt die Myofibrillen, das Sarkoplasma (Zytoplasma), mehrere Zellkerne, Mitochondrien, Lysosomen, Fetttröpfchen und Glycogenkörnchen. Im Sarkoplasma gelöst sind Glycogen, glykolytische Enzyme, Kreatinphosphat, Aminosäuren und andere Substanzen. Der Muskel ist aus Muskelfasern (lang, kernreich, zylindrisch, Durchmesser von 80 m) aufgebaut. Die Muskelfaser enthält einige 100 Myofibrillen. Die einzelne Myofibrille ist durch Z-Scheiben in Sarkomere eingeteilt. Struktur der Myofibrillen Sie bestehen aus Myofilamenten, die aus Myosin, Aktin, Tropomyosin und Troponin aufgebaut sind. a) Aktinfilament (dünnes Filament) Hat einen Durchmesser von etwa 6 nm und verhält sich im polarisierenden Licht isotrop, einfach brechend. Es besteht aus: Aktin Tropomyosin und Bei quergestreifter Muskulatur dem Troponinkomplex, Bei glatter Muskulatur Caldesmon und Calmodulin 26 Etwa 400 kugelförmige (globuläre) Aktinmoleküle sind entlang der fadenförmigen Tropomyosinmoleküle über Aktin-Aktin-Bindungsstellen hintereinander aufgereit und bilden so ein F-Aktion (f-fibrös) mit einer Doppelhelixstruktur. Ein Tropomyosinmolekül erstreckt sich über 7 Aktinmoleküle, wobei in einem gewissen Abstand (etwa 40 nm) Troponinmoleküle eingelagert sind. Sie bestehen aus 3 Untereinheiten: Troponin C = bindet Calcium Troponin I = bindet Actin (verhindert in Ruhe die Brückenbildung zwischen Mysin und Aktin. Der Hemmeffekt wird durch die Bindung von Ca2+ an Troponin C aufgehoben. Troponin J = bindet Tropomyosin Dem glatten Muskel fehlt Troponin, enthält stattdessen das Ca 2+-bindende Protein Calmodulin. Caldesmon verläuft parallel zum Tropomyosinmolekül, während das globuläre Calmodulin in regelmäßigen Abständen auf dem Tropomyosin liegt. b) Myosinfilament (dickes Filament) Sie entstehen durch eine Zusammenlagerung von Myosinmolekülen, die im polarisierten Licht anisotrop, doppeltbrechend wirken und rufen so die dunklen Abschnitte der Querstreifung hervor. Die Länge beträgt in Skelett- und Herzmuskulatur etwa 1,6 m und in der glatten Muskulatur 2,2 m. Das Molekül setzt sich aus zwei langgestreckten, miteinander verdrillten Eiweißmonomeren zusammen, die sich zum Ende hin zu zwei Köpfchen verdichten. Man unterscheidet an ihnen Myosinkopf, Myosinhals und Myosinschaft, die gelenkig miteinander verbunden sind. Die Kopfregion enthält die Myosin-ATPase. Struktur der Sarkomere I-Streifen: beidseitig der A-Streifen gelegene, helle (isotrope) Bande, bestehend aus nur dünnen Filamenten (Durchmesser bis 5 nm), die an den Z-Scheiben befestigt sind A-Streifen: in der Mitte des Sarkomers gelegene dunkle (anisotrope), 1,6 m breite Bande besteht aus den dicken Myosinfilamente (Durchmesser von 10 nm) und den sich dazwischenschiebenden dünne Filamenten aus der I-Bande. H-Zone: ist ein Teil des A-Streifens, in dem nur dicke Filamente enthalten sind. Z-Scheibe: Befestigung der Aktinfilamente 4. Elektromechanische Kopplung Sie dienen der Übermittlung der Kontraktionssignale von der erregten Zellmembran auf die Myofibrillen. Man spricht dann von elektromechanischer Kopplung, wenn die Erhöhung der sarkoplasmatischen Calciumkonzentration durch die Änderung des Membranpotentials hervorgerufen wird. Quergestreiften Muskulatur Das Sarkolemm bildet zwei verschiedene Formen des Calciumspeichers: a) Longitudinales tubuläres System (L-System) Es ist als tubuläres System parallel zur Zelloberfläche angeordnet und liegt längs zu den Faserbündeln. Diese intrazellulär gelegenen Speicher sorgen für kurze Diffusionswege und so zu 27 schnellen Muskelkontraktionen. Die Calciumfreisetzung erfolgt aus den erweiterten Endbezirken des sarkoplasmatischen Retikulums (terminale Zisternen). Sie liegen in der Nähe des transversalen Systems. b) Transversales tubuläres System (T-System) Das sind regelmäßige Einstülpungen der äußeren Zellemembran, des Sarkolemm. Wenn sich auf beiden Seiten das transversalen Systems terminale Zisternen bilden, so bilden sich Triaden. Es sorgt für eine rasche Erregungsleitung von der äußeren Zellmembran in das Innere der Muskelfaser. Glatte Muskulatur In der glatten Muskulatur liegt das sarkoplasmatische Retikulum (longitudinale tubuläre System) in Vesikelform vor; nahe der äußeren Zellmembran. Das transversale System fehlt vollständig. In diesem Muskeltyp speichern auch die Mitochondrien das Calcium. Ca2+ + Calmodulin Ca2+-Calmodulin Myosinkinase (inaktiv) Calmodulin-Myosinkinase (aktiv) Myosin-ATPase (inaktiv) phosphoryliertes Myosin (aktiv) 5. Innervation der quergestreiften Muskulatur Skelettmuskel Die motorische Faser spaltet sich am Ende mehrfach auf und bildet neuromuskuläre Endplatten. Sie werden eben durch die Abspaltung des Motoaxons gebildet, das seine Markscheide verloren hat und innervierte mehrere Muskelfasern. Auf der präsynaptischen Seite der Endplatte erfolgt bei Erregung die Ca 2+-abhängige AcetylcholinFreisetzung durch Exozytose. Durch Diffusion im synaptischen Spalt verteilt sich der ausgeschüttete Transmitter und bindet an der postsynaptischen Seite an Rezeptoren, die wiederum ligandengesteuerte Ionenkanäle öffnen (cholinerge Rezeptoren des nicotinergen Typs, allerdings Öffnung von unselektiven Kationenkanälen). Die postsynaptische Membran (Sarkolemm) ist zur Oberflächenvergrößerung aufgefaltet und bildet im Bereich der motorischen Endplatte den postsynaptischen Faltetapparat. Es kommt zum Na+-Einstrom, dann zur überschwelligen Depolarisation und zur Bildung eines EPSP, das an der motorischen Endplatte ein Endplattenpotential bildet. Es öffnen sich spannungsabhängige Na+-Kanäle, die ein Muskelpotential (Aktionspotential) auslösen. Die Steuerung der quergestreiften Muskulatur erfolgt über motorische Zentren des ZNS (nervöse Kontrolle des Zusammenspiels von Haltung und Bewegung und deren adäquate Kopplung), dabei werden unbewußte Reaktionen über das Rückenmark und bewußte Reaktionen über das Gehirn gesteuert. Ein Reflex stellt eine automatische, beliebig wiederholbare zweckgerichtete Antwort auf einen Reiz dar. Des weiteren Unterscheidet man noch: 28 Stützmotorik = wahren der Haltung: Die Regulation erfolgt auf der Rückenmarksebene. Informa -Motoneu -Motoneurone korrigiert (schnelle Efferenzen) Zielmotorik = nach außen gerichtete Bewegung: Das sind komplexe, willentlich gesteuerte Bewegungen. Die Koordination liegt in motorischen Assoziationsfeldern. Die Bewegung folgt dem polysynaptischen Reflex. Es sind Dehnungsrezeptoren zur Lagekontrolle vorhanden. An einer motorischen Endplatte, eine spezialisierte Kontaktstelle des Axons mit der Skelettmuskelfaser, unterscheidet man folgende Strukturen: Nervenendigung mit präsynaptischer Membran (enthält die Vesikel mit dem Transmitter) Synaptischer Spalt Subsnaptischer Faltenapparat, gebildet vom Sarkolemm der Myosinfibrillen Derartige Endplatten existieren nur in den Skelettmuskelfasern. Jede Muskelfaser hat eine motorische Endplatte, aber ein Motoaxon versorgt durch die Aufspaltung mehrere Muskelfasern, was dann als motorische Einheit4 zusammengefaßt wird. Feinmotorik: 1 Neuron 5 - 6 Fasern (z. B. Mittelohrmuskeln) Grobmotorik:1 Neuron bis 1000 Fasern (z. B. Rumpfmuskulatur) Die Größe der motorischen Einheit ist für die Abstufbarkeit der Bewegung wichtig. Je weniger Muskelfasern zu einer Einheit zusammengefaßt werden, desto feiner kann die Motorik gesteuert werden. Herzmuskulatur Der Herzmuskel entspricht einer einzelnen motorischen Einheit. Die Erregung breitet sich über Gap junctions in den Glanzsteifen (Disci intercalares) auf benachbarte Muskelfasern aus. Nerven sind daran nicht beteiligt. Die für die Erregung wichtigen Schrittmacherpotentiale werden im Herzen selbst gebildet. Das vegetative Nervensystem paßt die Tätigkeit des Herzens über die Transmitter Noradrenalin ( 1-Rezeptoren: cAMP , Kontraktionskraft und Frequenz ) und Acetylcholin (M2: cAMP ; Hemmung der Herzfrequenz) den Bedürfnissen des Organismus an. 6. Erregung der glatten Muskulatur Myogene Erregung Das ist eine im Gewebe entstandene Erregung. Schrittmacherzellen lösen hierbei spontane Kontraktionen aus. Sie depolarisieren Anteile der Membran bis zur Schwelle, es kommt zum Ca2+Einstrom und damit zu einer Depolarisation mit nachfolgendem Aktionspotential. (Präpotentiale = Schrittmacherpotentiale) Die Ausbreitung der Erregung erfolgt über Gap junctions (Nexus). Es gibt zwei verschiedene Typen: Single-unit-Typ: Diese Form findet man im Magen-Darm-Kanal, im Uterus und im Ureter. Die glatten Muskelzellen werden über interzelluläre Gap junctions zu größeren Einheiten zusammengefaßt. Die Erregung breitet sich daher auf benachbarte Muskelzellen aus. Nervöse 4 Definition der motorischen Einheit: Darunter versteht man das Motoneuron und alle von ihm innervierten Muskelfasern. 29 Strukturen (Ganglienplexus) koordinieren den Kontraktionsablauf. Oft wird die Tätigkeit durch verschiedene Transmitter (Noradrenalin, Ach, Serotonin, Bradykinin, Histamin, ...) beeinflußt. Multi-unit-Typ: Diese Form ist in den größeren Blutgefäßen und in den Bronchen vorhanden. Die Aktivität ist enger an die Nerven des vegetativen Nervensystem gekoppelt. Neurogene Erregung Sie wird durch Nervenimpulse ausgelöst. Die Innervation erfolgt über das vegetative Nervensystem, das allerdings keine motorischen Endplatten besitzt und daher keine spezialisierten Kontaktstellen zwischen Nerv und Muskelfaser vorhanden sind. Die Transmitterfreisetzung erfolgt aus Varikositäten (Auftreibungen des Nervs). Transmitter Noradrenalin Adrenalin Acetylcholin Funktion Erschlaffen oder Kontraktion5 Erschlaffen Kontraktion vegetative Nervensystem Sympathikus Sympathikus Parasympathicus Hormonelle Erregung Hormone erreichen über das Blut die glatte Muskulatur. An den Rezeptoren: Das Acetylcholin induziert die Schrittmacherzellen, die eine Depolarisation auslösen. Es kommt zu einer Erhöhung der Aktionspotentialfrequenz und damit zur Kontraktion. Die Hormone aus der Nebennierenrinde Adrenalin und Noradrenalin führen zu einer Hyperpolarisation der Membran. Die Frequenz der Aktionspotentiale wird herabgesetzt und der Muskeltonus sinkt damit auch. 7. Kontraktionsauslösung, Ausbreitung des Aktionspotentials In der Skelettmuskulatur Die durch das Aktionspotential bewirkte Depolarisation verteilt sich über die Triaden und springt zum Longitudinalsystem über, so daß depolarisierte Membranbezirke den terminalen Zisternen des longitudinalen Systems gegenüberliegen. Die Depolarisation öffnet Rezeptoren, die das Signal an den Calciumfreisetzungskanal im sarkoplasmatischen Retikulum weiterleiten. Ca2+-Kanäle der Terminalzisternen werden geöffnet, es kommt zum Ca2+-Ausstrom. Die Ionen diffundieren zu den Myofilamenten, werden dort vom Troponin gebunden, das nun das Freilegen der Myosinbindungsstellen am Aktin induziert. Der Myosinkopf kann nun angelagert werden und es kommt zur Kontraktion. (Weichmacherwirkung des Ca2+). Das Zurückpumpen des Ca2+ in die Terminalzisternen geschieht über Ca2+-ATPasen, die unter ATP-Verbrauch jeweils 2 Ca2+ transportieren. Im Herzmuskel Die in der Depolarisationsphase über das Sarkolemm einströmende Calciumionen setzten seinerseits wieder Calciumionen aus dem sarkoplasmatischen Retikulum frei (Freisetzungsfunktion des Aktionspotentials). Andererseits werden sie dort gespeichert (Speicherfunktion des Aktionspotentials). Ein komplizierter Mechanismus bewirkt eine Steigerung der Kontraktion 5 rezeptorabhängig 30 In der glatten Muskulatur Spannungsgesteuerte Calciumkanäle liegen insbesonders in koordiniert tätigen Muskeln. Die Aktionspotentiale breiten sich über die Membranoberfläche eines Zellverbandes aus. Einige glatte Muskelzellen bilden sponatne Depolarisationen aus. Das elektrische Signal wird über Gap junctions weitergegeben. (s. auch Singe-unit-Typ) Rezeptorgesteuerte Ca2+-Kanäle unterliegen dem Einfluß lokaler Transmitter. Es kommt so zu einer Öffnung der Kanäle und damit zu einem Ca2+-Einstrom (pharmakomechanische Kopplung). Der Einstrom kann in geringer Weise auch durch Inositoltriphosphat aus den lokalen Speichern bewirkt werden. Im Gegensatz zu den Skelettmuskeln wirkt hier der Transmitter auf den gesamten Bereich des Sarkolemms. (s. auch Multi-unit-Typ) 8. Kontraktion des Muskels Um die Kontraktion eines Muskels besser erklären zu können, bemüht man sich der Gleitfilmtheorie. Diese sagt aus, daß die Myosin- und Aktinfilamente übereinander hinweggleiten ohne sich selbst zu verkürzen. Daher unterscheidet man: Verkürzung (Kontraktion) = Abnahme der Sarkomerenlänge Verlängerung (Dehnung) = Zunahme der Sarkomerenlänge Der zyklische Grundprozeß der Kontraktion Phase 1: Der Myosinkopf ist fest mit dem Aktinmolekül verbunden. Es liegt Aktomyosin vor. Zum Lösen des Myosinkopfes ist ATP im Zytosol notwendig. Phase 2: Der Myosinkopf bindet ATP, so nimmt seine Affinität seiner Bindung zu Aktin stark ab. Der Myosinkopf trennt sich am Aktin. Der Zyklus kann nur weiterlaufen, wenn nun das ATP zu ADT + Pi (ATPase-Wirkung des Myosin) abgebaut wird. Dies kann nur in Anwesenheit von Mg2+ geschehen. Das gebundene ADP + Pi am Myosinkopf läßt die Affinität wieder steigen und legt sich an das Aktinmolekül wieder an. ADP + Pi werden nun unterschiedlich rasch abgegeben, wobei das Pi durch Beschleunigung durch das Aktin schneller entfernt wird. Phase 3: Phase 4: Der Übergang in diesen Zustand ist die eigentliche Kraftstufe. Man erklärt dies durch eine Dehnung des Myosinkopfes, der nun einen Schritt zwischen die Aktinfilamente gezogen wird und abkippt. Mit der Abgabe des ADP ist der Zyklus beendet. Funktion der Querbrücken Der oben beschriebene Zyklus nennt sich auch ATP-getriebener Querbrückenzyklus. Für das Durchlaufen des Zyklus wird pro Querstück 1 Molekül ATP gebraucht. Je mehr Querbrücken gleichzeitig aktiv sind, und je rascher der Querbrückenzyklus durchlaufen wird, desto höher ist der ATP-Verbrauch. Gesteigerte Kraftentwicklung und zunehmende Kontraktionsgeschwindigkeitserhöhung den Energieumsatz des Muskels. Regulation der Muskelkontraktion Über die Reizfrequenz 31 Über die Anzahl der angesprochenen motorischen Einheiten 9. Ruhedehnungskurve und Längen-Kraft-Beziehung Elastische Elemente des Muskels Die Kraftentwicklung bei passiver Dehnung (Ruhedehnungskurve) wird hervorgerufen durch: Parallelelastische Elemente: Die elastischen Elemente liegen parallel zu den Sarkomeren, verursacht durch Sarkolemm und Bindegewebe (Faszien), die auch verhindern, daß die Filamente bei Dehnung in Ruhe auseinanderfallen. Die Wirksamkeit ist in der Ruhe-Dehnungskurve sichtbar. Serienelastische Elemente: Sie sind hinter und vor das Sarkolemm geschaltet, z. B. Sehnen. Ruhedehnungskurve Kraft = Vordehnung, die man durch verschiedene schwere Gewichte erhält relative Muskellänge a) Ruhedehnungskurve: b) Die Ruhedehnungskurve stellt den Zusammenhang zwischen dehnender Kraft (Spannung) und Muskellänge dar. Am nicht erregten Muskel werden mit zunehmender Dehnung die daraus resultierende Längenveränderung geringer, d. h. die Dehnbarkeit des Muskels nimmt ab. Die höchste Kontraktionskraft ist bei einer Sarkomerlänge von 2,0 bis 2,2 m. Die normale Vordehnung im Körper beträgt 1/3 der maximalen Dehnungsfähigkeit. Die Vordehnung verursacht in situ eine erhöhte Arbeitsleistung. Die Dehnung steigt nicht proportional mit den anhängenden Gewichten (Spannung) an, sondern nimmt immer weniger zu. Um so steiler sie Kurve ist, desto stärker wird der Muskel gedehnt, d. h. die Elastizität nimmt beim gedehnten Muskel zu. Kurve der isotonischen Maxima Kurve der Punkte, die man erhält, wenn der Muskel in allen Belastungsstufen maximal isoton reizt, z. B. ein mit 500 g belasteter Muskel, also ein vorgedehnter Muskel, kann sich bei maximaler Reizung nicht so stark kontrahieren wie ein unbelasteter Muskel. Die neuen Kontraktionslängen in Abhängigkeit von der neuen Belastung wird in ds Koordinatensystem eingetragen. c) Kurve der isometrischen Maxima Kurve, die man erhält, wenn man den Muskel in allen Belastungsstufen der Ruhedehnungskurve maximal isometrisch Reizt. d) Punkt der absoluten Kraft 32 Dieser ist erreicht, wenn der Muskel kein Gewicht mehr heben kann = Grenze der Reißfestigkeit. Kraft-Geschwindigkeitsbeziehung Verkürzung Schnell - leichte Last: die Geschwindigkeit einer isotonen Kontraktion ist um so kleiner, je größer die Kraft ist. a) Langsam - schwere Last: schwere Gegenstände können nur sehr langsam angehoben werden. Durch zusätzlichen Aufwand von Muskelarbeit kann bei gleichbleibender Muskelbelastung die Kontraktion gesteigert werden. b) Zeit Vmax. Da sich Verkürzungsgeschwindigkeit der in drei Myofibrillen hintereinandergeschalteten Sarkomeren addieren, werden bei gleicher Verkürzungsgeschwindigkeit lange Muskeln mehr kontrahiert. 1. 2. 2. 1. kurze Muskelfaser lange Muskelfaser Muskelkraft in Nm Längen-Kraft-Beziehung Die Kraftentwicklung hängt von der Vordehnung des Muskels ab. Die maximale Kraftentwicklung liegt bei einer Sarkomerslänge von 2,0 bis 2,2 m. Man kann berechnen: Arbeit = Länge Last (Kraft) Kraft = Gschwindigkeitsbeziehung Leistung = Kraft Verkürzungsgeschwindigkeit Belastung = während der Verkürzung aufzubringende Kontraktionskraft Hill-Kraft-Geschwindigkeitsrelation Vmax 0 Die Kontraktionsgeschwindigkeit nimmt mit zunehmender Belastung hyperbolisch ab. Fmax. Variation der Kontraktionsgeschwindigkeit Alle Fasern relative Belastung einzelner Fasern Kontraktionsgeschwindigkeit Teil der Fasern relative Belastung Kontraktionsgeschwindigkeit 10. Kontraktionsformen 33 Isotonische Kontraktion Kraft Verkürzung des Muskels bei konstanter Krafteinwirkung, z. B. Anheben von einem leichten Gegenstand Länge Isometrische Kontraktion Kraft Kraftentwicklung bei konstanter Muskellänge (die Muskelenden sind fixiert, keine gegenseitige Verschiebung), z. B. Haltefunktionen und fixiertes Gelenk (Anheben von einem schweren Gegenstand) Länge Auxotonische Kontraktion Kraft gleichzeitige Änderung von Kraft und der Muskellänge. Länge Positiv auxotone Kontraktion: Kraftentwicklung nimmt während des Vorgangs zu (Abduzieren des herabhängenden Armes) Negative auxotone Kontraktion: Kraftentwicklung nimmt ab Unterstützungskontraktion Kraft Länge Die Kontraktion läßt sich in zwei Phasen einteilen, die nacheinander ablaufen: erst isometrisch, dann isotonisch. Man findet das z. B. bei der Skelettmuskulatur beim Hochheben eines Gewichtes vom Boden, Aufstehen von liegenden Tieren und bei der Systole des Herzens. (konstante Länge mit Kraft Überwindung des Gewichtes Kraft konstant, Länge ) Anschlagkontraktion Kraft Die beiden Phasen folgen in umgekehrter Reihenfolge, erst isotonisch, dann isometrisch, z. B. beim Anschlag gegen „Hindernisse“ (Ohrfeige, Schließen des Kiefers mit anschließenden Kaudruck) Länge 11. Beeinflussung der neuromuskulären Erregung Acetylcholinesterasemangel Acetylcholin im synaptischen Spalt bindet an Rezeptoren, die Na+-Kanäle öffnen. Es wird ein Aktionspotential hervorgerufen. Da das Ach allerdings nur sehr langsam abgebaut werden kann, kommt es zu einer Dauerdepolarisation, so daß keine neuen Aktionspotentiale mehr gebildet werden können 34 Störung der Na+-Kanäle Ein Wirkstoff, der die Acetylcholinrezeptoren blockiert, ist das d-Tubocurarin. Es kommt zu einer kompetitiven Blockade der Rezeptoren, so daß die postsynaptische Membran nicht erregt werden kann. Dieser Wirkstoff kann nur die Rezeptoren in den Skelettmuskeln blockieren, hat aber keinen Einfluß auf die Herztätigkeit oder die Tätigkeit der glatten Muskulatur. Atropingabe Das Atropin kann ebenfalls an die Rezeptoren des Acetylcholins anlagern. Es herrscht eine Konkurrenz mit Ach um die selben Rezeptoren, was zu einer Erschlaffung der Muskulatur führt. Weitere Störungen Hypokalzämische Tetanie Krampf Wundstarrkrampf Vergiftung des Nervs Mg2+-Mangel 12. Energieumsatz im Muskel Muskelstoffwechsel Die Muskelzelle kann chemische Energie zu 20 - 30 % in mechanische Energie umwandeln. Der Rest geht in Form von Wärme verloren. Ruhestoffwechsel der Skelettmuskulatur (20 % des Gesamtumsatzes) Ruhestoffwechsel bei Arbeit (35 % des Grundumsatzes) Erhöhter Stoffwechsel ist mit einer erhöhten Durchblutung verbunden, um den Bedarf an Sauerstoff und Nahrungsstoffen zu decken und um die anfallenden Stoffwechselprodukte abzubauen. Energiequellen für die Kontraktion Adenosintriphosphat (ATP)6 Kreatinphosphat7 Glucose/ Glykogen8 Trigyceride9 ATP ist die primäre Energieform, wenn es verbraucht ist (ATP ADP + Pi), muß in der Zelle durch Resynthese neues ATP gebildet werden. Es gibt verschiedene Möglichkeiten ATP aufzubauen, wie bei b), c) und d). 7 Kreatinphosphat + ADP Kreatin + ATP 8 Es kann entweder ohne Sauerstoff (anaerob: Glucose 2 Lactat + 2 ATP/mol) oder mit Sauerstoff (aerob: Glucose CO2 + H20 + 36 ATP/mol) umgewandet werden. Bei der aeroben Glycolyse entsteht meist eine Sauerstoffschuld. 9 Sie werden bei der Fettsäureoxidation umgesetzt CO2 + H20 + 27 ATP 6 35 Sauerstoffschuld Während der Arbeit entsteht im Muskel ein Sauerstoffmangel. Dies kommt dadurch zustande, daß in den Zellen ATP vorhanden ist, das schneller verbraucht wird, als wieder resynthetisiert werden kann. Es kommt vorrübergehend zu einer erhöhten mechanischen Arbeit des Muskels. In Ruhe wird die Sauerstoffschuld in Form von Sauerstoffatmung wieder aufgenommen und das Lactat aus der anaeroben Glykolyse zur Bildung von ATP abtransportiert. Bei der Kreatinphosphatspaltung und bei der anaeroben Glykolyse geht der Organismus eine Sauerstoffschuld ein. So atmen man z. B. nach einem 50 m Sprint eben diese Sauerstoffmenge nach, auch wenn man sich ruhig hinsetzen wollte, um den Kreatinphosphatspeicher wieder aufzufüllen. Die entstandene Milchsäure wird in Herz und Leber wieder zu Glucose aufgebaut. Bei schwerer Arbeit benötigt man 50 mal mehr O2 für die Muskulatur. Der Kreislauf wird angeregt. 13. Ermüdung der Skelettmuskulatur Isolierter Muskel Es kommt zu einer Anhäufung von Milchsäure mit einem damit verbundenem pH-Abfall und einer ungenügenden ATP-Synthese. Die Erschlaffungen des Muskels werden allmählich verlangsamt. Die Zuckungsamplituden nehmen ab. Bei 20° C kommt man in den Zustand der Dauerverkürzung (Kontraktur) Bei 0° C ist der Muskel total erschlafft, auch ohne weitere Kontraktionsfähigkeit. Im Gesamtorganismus a) Periphere Ermüdung Rhythmische Reize bis zu einer Grenzfrequenz führen nicht zur Ermüdung, weil sich der Muskel zwischen den Kontraktionen erholen kann. Für jeden Muskel besteht eine Grenzfrequenz, so daß unter physiologischen Bedingungen dauernd tätige Muskeln, wie z. B. Atem- und Herzmuskulatur nicht ermüden. Oxidative Vorgänge während der Erschlaffung (Erholung), z. B. Blut begleicht Sauerstoffschuld, Brenztraubensäure und Milchsäure werden oxidativ wieder abgebaut, Energiespeicher werden wieder aufgefüllt, tragen dazu bei. Oberhalb dieser Grenze kommt es zur Ansammlung von Stoffwechselmetaboliten im Muskel durch ungenügende Sauerstoffzufuhr. Es wird vermehrt anaerobe Arbeit geleistet. Die energiereichen Verbindungen verschwinden aus der Zelle, was nur durch Sauerstoffzufuhr behoben werden kann. „Muskelkater“ bei überhöhter Beanspruchung. b) Zentrale Ermüdung Die Ursache hierfür liegt in den nervalen Strukturen des zentralen Nervensystems oder aber das Endplattenpotential ist unterschwellig geworden. Subjektives Müdigkeitsgefühl von der Formatio reticularis und Rezeptionsstörungen in den verschiedenen Sinnesorganen führen zu einer Verlängerung der Reaktionszeit und zu einer Abnahme der Leistungsfähigkeit. 14. Alles zu Kontraktionen 36 Definitionen Kontraktur = das sind Muskelverkürzungen, reversibel, die ohne reguläre Aktionspotentiale ausgelöst wurden, z. B. durch eine lokale Depolarisation (Änderung der Natriumoder Kaliumpermeabilität) oder durch Calciumfreisetzung durch Pharmaka (Coffein). Das Membranpotential ist lokal dauerdepolarisiert. Bestimmte Tonusfasern der quergestreiften Skelettmuskulatur in den langsameren äußeren Augemuskeln oder in den Muskelspindeln reagieren mit so einer derartigen Membrandepolarisation. Kontraktion = wird durch Aktionspotentiale ausgelöst, die über das Sarkolemm ablaufen Starre = Tetanus = irreversible Starre (Rigor): Erschöpfung der ATP-Vorräte. Das lösen der Aktin-Myosin-Verbindung ist nicht mehr möglich, z. B. bei der Totenstarre (Rigor mortis) reversible Starre (Tetanus): durch ständige Aktionspotentiale ausgelöste Dauerkontraktion in der Physiologie wird so eine Kontraktionsform der Skelettmuskulatur bezeichnet (tetanische Kontraktion). in der Medizin bedeutet es Wundstarrkrampf mit krampfartigen, lang anhaltenden Kontraktionen der Skelettmuskeln Krämpfe = gehen von Motoneuronen oder motorischen Nerven aus. Superposition = Es ist ein Merkmal der tetanischen Kontraktion. Durch Erhöhung der Reizfrequenz erfolgt eine Überlagerung der Kontraktionen. Die vom Muskel entwickelte Kraft steigt mit der Frequenz der Aktionspotentiale bis auf das 5 - 10fache einer Einzelzuckung an. Tetanie = Überregbarkeit im ZNS, verursacht durch das Absinken des Plasmacalciumspiegels. Auch hier entstehen krampfartige Skelettmuskelkontraktionen EMG = bedeutet Elektromyographie. Die Erregungsprozesse der Skelettmuskulatur lassen sich anhand des EMG registrieren. Die Ableitung erfolgt entweder über Elektroden auf der Hautoberfläche (transkutane Registrierung) oder es werden Nadelelektroden zwischen die Fasern von zwei verschiedenen motorischen Einheiten des Muskels gestochen. Die Nadelelektrode liefert ein EMG mit besserer räumliche Zuordnung. Die Ableitung stellt die neuromuskuläre Aktivität dar. Muskeltonus = das ist die Muskelgrundspannung durch abwechselnde Kontraktionen verschiedener motorischer Einheiten. Tonische Dauerdepolarisationen kommen bei „Taiusfasern“ am Auge vor. Hier gilt das Alles-oder-nichts-Gesetz nicht. Reflextonus = Neurogene -Fasern beeinflussen den Muskeltonus im Halteapparat. Zusammenhänge Ein Einzelreiz führt immer zu einer maximalen Ca2+-Freisetzung und damit auch zu einer maximalen Einzelkontraktion der Skelettmuskelfaser. Trotzdem führt ein Einzelreiz nicht zu einer maximalen 37 Verkürzung der Muskelfaser, da dies zu kurz ist, um das relativ langsame Filamentgleiten bis zur Endstellung in Gang zu bringen. Eine weitere Verkürzung nur dann, wenn während dieser Einzelzuckung ein zweiter Reiz eintrifft. Solchermaßen wiederholte Reize führen zu einer stufenweisen Summation von Einzelzuckungen (Superposition). Wird die Reizfolge noch mehr erhöht, kommt es zur maximal möglichen Kontraktion der motorischen Einheit (Tetanus). Gegenüber einer Einzelzuckung erhöht sich dadurch die Muskelkraft auf das 4fache. Während die Calcium-Konzentration bei einer Summation zwischen den Reizen immer wieder absinkt, bleibt sie beim Tetanus erhöht. Bei eine Kontraktur hat man eine Dauerverkürzung des Muskels, ist jedoch von Tetanus und Rigor zu unterscheiden. Sie entsteht nicht durch die Überlagerung von Aktionspotentialen, sondern entweder durch eine lokale Dauerdepolarsation, z. B. bei erhöhter K+-Konzentration im EZR oder durch pharmakologisch verursachte Ca2+-Freisetzung im Zellinneren, z. B. durch Koffein. Auch die Kontraktion sog. Tonusfasern (Muskelspindeln) ist eine Kontraktur. Sie beantworten einen Reiz nicht mit einer Alles-oder-Nichts-Zuckung, sondern kontrahieren sich nach Maßgabe der Depolarisation (kein Aktionspotential). Hier wird die Kontraktion durch Variierung der Ca 2+-Konzantration im IZR geregelt. Der allgemeine Tonus, Reflextonus der Skelettmuskulatur wird durch Aktionspotentiale an einzelnen motorischen Einheiten verursacht. Dabei sind keine Einzelzuckungen sichtbar, da die motorischen Einheiten asynchron (wechselweise) erregt werden. Besonders die Haltemuskulatur ist auch bei scheinbarer Ruhe in diesem unwillkürlichen Spannungszustand, der über Reflexe angeregt wird und z. B. bei erhöhter Aufmerksamkeit zunimmt. Einzelkontraktion - tetanische Kontraktion a) Einzelkontraktion Ein Aktionspotential oder ein elektrischer Einzelimpuls löst eine Kontraktion aus. Das Aktionspotential entsteht an der motorischen Endplatte und läuft von dort über das Sarkolemm mit einer Leitungsgeschwindigkeit von 3 - 10 m/s. Es depolarisiert aber nur einen sehr kleinen Oberflächenteil des Sarkolemms. b) Tetanische Kontraktion (Tetanus) Hier folgen Aktionspotentiale rasch nacheinander, die auf der Oberfläche der Skelettmuskellaser (Länge bis zu 15 cm!) gleichzeitig Platz finden. Jede Konztraktionsantwort auf zwei oder mehrere ergibt eine tetanische Kontraktion. Superposition. Man unterscheidet hier wiederum zwei Arten: Unvollständige tetanische Kontraktion: bei schwache Willkürbewegungen treten im Motoneuron Aktionspotentiale mit einer niedrigen Frequenz auf. Die Abstände sich länger als die Konztraktionsdauer, so daß der Verlauf der Kontraktionen in der Muskelfaser wellenförmig ist. Durch die unterschiedliche Erregung der gesamten motorischen Einheit, tritt trotzdem ein glatter Kontraktionsablauf im Muskel auf. Vollständige tetanische Kontraktion: bei repetitiver Reizung einer Einzelfaser geht bei der Verschmelzungsfrequenz die unvollständige tetanische Kontraktion in eine vollständige (glatte) tetanische Kontraktion über. 38 15. Begriffserklärungen Wärmebildung bei Muskelarbeit, weil es ja auch mechanische Arbeit ist, entsteht Wärme. Dabei wird chemische Energie (ATP) mechanischer Energie + Wärme. Aktivierungswärme entsteht durch die Wechselwirkungen zwischen Aktin und Myosin und ist von der nach außen abgegebenen Leistung abhängig. Erschlaffungswärme entsteht aus gespeicherter potentieller Energie, z. B. aus gedehnten elastischen Strukturen. Erholungswärme stammt aus den chemischen Prozessen zum Auffüllen der Energiespeicher Erhaltungswärme: entsteht bei Haltearbeit Verkürzungswärme: entsteht bei der isometrischen Kontraktion. Wirkungsgrad () oder auch Nutzeffekt des Muskels liegt bei 30 - 35 %, der Rest endet in Wärme. Der Wirkungsgrand der Energietransformation liegt bei 40-50 %, der mechanische Nutzeffekt10 liegt bei 20-30 %. äußere Arbeit [%] = 100 Energieumsatz Erholungspulssumme Das beschreibt die Anzahl der Pulse, die in der Erholungspause über dem Ausgangswert liegen. Es stellt ein Maß für die muskuläre Ermüdung dar. Dauerleistungsgrenze Dauerleistungsfähigkeit: ist ohne muskuläre Ermüdung und mindestens 8 Stunden durchführbar, ist durch Training beeinflußbar Höchstleistungsfähigkeit: die Leistung ist zeitlich limitiert. Es gilt: Je länger die Arbeitszeit, desto niedriger ist die Höchstleistungsgrenze, ist ebenfalls durch Training beeinflußbar 16. Muskelstoffwechsel Weiße Muskeln 10 Dick Viele Myofibrillen Wenig Mitochondrien Arbeiten schnell, aber rasch ermüdend Dienen raschen Bewegungen z. B. M. gastrognemius: laufen, gehen Rote Muskeln Dünn Wenig Myofibrillen Mehr Mitochondrien Mehr Myoglobin Arbeiten langsamer, aber viel ausdauernder Dienen der Haltearbeit, z. B. M. soleus: stehen Mechanischer Nutzeffekt (Energie für Ionen geht ab) + Wärmebildung = Erholungswärme. 39 17. Pathophysiologie Spaszitität: unwillentliche Muskelkontraktionen. Es kommt zu einer Vermehrung des Muskeltonus und zu einer gesteigerten zahl von Muskelreflexen Rigidität: bedeutet Steifheit. Es kommt zu einer Erhöhung des Muskeltonus. Myotonie: ist ein tonischer Krampf der Muskulatur durch fehlende oder verzögerte Erschlaffung nach Kontraktionen Poliomyelitis: „Kinderlähmung“. Das ist eine Rückbildung der Nerven. Andere Nerven übernehmen die Innervation, so daß größere motorische Einheiten entstehen. Amotrope Lateralsklerose: Rückbildung der Nerven SINNE 1. Allgemeines zur Sinnesphysiologie 1.1 Allgemeiner Bau und allgemeine Funktionen der Sinnesorgane Funktion 40 Aufnahme von Informationen aus der Umwelt oder aus dem eigenen Körper Ablauf einer Sinneswahrnehmung Adäquate Reize sind Reize, auf die ein Sinnesorgan optimal reagiert. Auch auf andere Reize spricht ein Sinnesorgan an, aber mit einer viel geringeren Empfindlichkeit. Es können z. B. alle Sinnesorgane durch elektrischen Strom gereizt werden. Trifft ein adäquater oder inadäquater Reiz auf das Sinnesorgan, so kommt es dort zur Erregung der sensorischen Nerven. Die Impulse werden an die sensorischen Gebiete des ZNS weitergeleitet, wo es nur Wahrnehmung kommt. Bau der Sinnesorgane Sinnesorgane werden aus einem Zusammenschluß vieler Rezeptoren oder Sensoren gebildet, die auf denselben adäquaten Reiz reagieren. Funktion der Sinnesorgane Im Sensor bzw. Rezeptor führt der physiologische oder chemische Reiz zur Veränderung der Membraneigenschaften des Rezeptors. Es entsteht ein Generatorpotential. Dieser Prozeß wird als Transduktion bezeichnet. Je stärker der Reiz ist, desto höher ist das Rezeptorpotential. Wird ein Schwellenwert überschritten, so bildet sich ein Aktionspotential = Transformation des Reizes. Die Reizgröße wird durch die AP-Frequenz kodiert. Je stärker also der Reiz ist, desto größer ist das Rezeptorpotential, desto größer ist auch die AP-Frequenz. Die Fortleitung des Aktionspotentials erfolgt über periphere Nerven zum ZNS, wo es zur Wahrnehmung kommt. 1.2 Typen von Sensoren Proportionalitätsfühler Er depolarisiert für die Dauer des Reizes proportional zur Stärke des Reizes. (langsame Adaptation) Proportional-Differentialfühler Es kommt zu einer starken Depolarisation am Anfang des Reizes und bleibt für die Dauer des Reizes depolarisiert. Differentialfühler Es kommt zu einer starken Depolarisation am Anfang, fällt aber wieder auf 0 ab. Er reagiert auf Signaländerungen, kann aber nicht die Dauer eines Reizes erkennen. 1.3 Definitionen Generatorpotential 41 Änderung des Potentials der Rezeptorzelle durch einen Reiz. Es ist abhängig von der Reizstärke. Reizstärke Absolutschwelle, Reizschwelle: Mindeststärke, die zur Empfindung führt, d. h. die kleinste Reizstärke, für die eine Änderung der Impulsfrequenz des Neurons feststellbar ist. Unterschiedsschwelle: Stärkedifferenz, damit ein Unterschied festgestellt werden kann. Es ist der Betrag, um den ein Reiz größer sein muß, damit gerade noch eine merkliche Steigerung festgestellt werden kann (Vergleichsreiz). Räumliche + zeitliche Summation Addition von zeitlich und räumlich getrennten Strömen am Neuron. Addition hochfrequenter Erregung Arbeitsbereich Empfindlichkeitsbereich von Sensoren Adaptation Einstellung des Empfindlichkeitsbereiches der Sensoren. Bei langandauernden Reizen nimmt die Reizantwort langsam ab. Es kommt zu einer Verringerung der Reaktionen am Sensor. Die Adaptationsgeschwindigkeit ist abhängig vom Bau der Sensoren und von den Transformationsprozessen an der Nervenfaser. Die Adaptation bewirkt, daß ein Sinnesorgan für eine Reizänderung empfindlicher ist, als für einen statischen Reiz. Habituation Die Habituation verringerte Reaktionen des gesamten Organismus bei länger dauernder Reizeinwirkung Rezeptives Feld Das rezeptive Feld sensorischer Neuronen ist der Bereich aus dem sie die Informationen über Sinnesreize erhalten. Man unterscheidet: Konvergente Schaltung (Konvergenz): 1 Neuron enthält Informationen verschiedener Sinneszellen Divergente Schaltung (Divergenz): 1 Sinneszelle liefert Infos an mehrere Neuronen Beide Mechanismen bewirken eine Verstärkung schwacher Reize. Die Größe der peripheren und zentralen rezeptiven Felder ist funktionsangepaßt. Bei kleineren Feldern gibt es ein besseres sensorisches Auflösungsvermögen. Die genaue Lokalisation eines Reizes innerhalb des rezeptiven Feldes ist durch die Überlappung der rezeptiven Felder mehrer Neurone möglich. Innerhalb eines rezeptiven Feldes reagieren Zentrum und 42 Peripherie gegensätzlich: bei der Erregung des Zentrums wird das Umfeld gehemmt und umgekehrt. Das ist die sog. „ON-OFF-Reaktion“, der die laterale Hemmung zugrunde liegt. Sensorische Bahnen Sensorische Bahnen sind Ketten hintereinander geschalteter Neuronen. Vom Sensor zieht die afferente Nervenfaser an das sekundär sensorische Neuron ... (Rückenmark oder Hirnstamm) thalamische Projektionskerne Projektionsfelder der Hirnrinde. Durch Konvergenz und Divergenz entstehen neuronale Netzwerke. Eine sensorische Bahn besteht aus einem Netzwerk hintereinander geschalteter zentraler Neurone, die mit Synapsen miteinander verbunden sind. Sinnessystem Gesamtheit der miteinander verschalteten sensorischen Bahnen und den Hemmsystemen 2. Tastsinn und Temperatursinn der Haut 2.1 Tastsinn - Mechanorezeptoren Definitionen Tastpunkte: Sie sind unterschiedlich verteilt. Man hat an der Hand viele (20/cm2), am Rumpf weniger. Räumliches Auflösungsvermögen: ist definiert als die Zweipunktschwelle. Das ist der kleinste Abstand, bei dem noch zwei Reizpunkte festgestellt werden können. Es ist abhängig von der Innervationsdichte ( zwischen 1mm bis 70 mm). Funktionseinteilung der Mechanorezeptoren a) Druckwahrnehmung SAI = Merkel-Zellen: Sie nehmen Reize wahr, die senkrecht auf die Haut treffen. Sie sind ohne Reiz nicht aktiv. Reagieren aber bei einem anhaltenden Druckreiz mit einer anfänglich gesteigerten, dann aber weitgehend gleichbleibenden Frequenz. SAII = Ruffini-Körperchen: Sie sind spontan aktiv und durch Druck, Dehnung, Kühlung der Haut reizbar. Sie liegen u. a. in Knochen und Gelenken Beteiligung an Wahrnehmung der Gelenkstellung (Propriozeption) SAI und SAII-Rezeptoren sind Proportionalitätsfühler, die langsam adaptieren. Lage: im Corium Identitätssensoren übertragen die Information über die Stärke eines anhaltende Drucks auf die Haut oder einer Hautdehnung b) Berührungswahrnehmung Ra-Sensoren = Meissner-Körper (Rezeptoren der unbehaarten Haut) Haarfollikelrezeptoren (Berührungsrezeptor der behaarten Haut) 43 Beide Rezeptoren adaptieren schnell (Geschwindigkeit des mechanisches Reizes) Lage: Corium bis Epidermis Geschwindigkeitssensoren übertragen die Informationen über die Geschwindigkeit des Eindrucks c) Vibrationswahrnehmung PC-Sensoren = Pacici-Körperchen Sie sind sehr schnell adaptierend (Geschwindigkeitsänderung des mechanischen Reizes). Lage: Subcutis Beschleunigungssensoren: Reizung durch die Beschleunigung des Hautdrucks Mechanosensitive Kanäle Bei Dehnung öffnen sich dehnungssensitive Kationenkanäle. Es kommt zum Na +-Einstrom und somit zur Depolarisation. Es entsteht ein Generatorpotential (bis zum 1. Schnürring), das beim Überschreiten des Schwellenwertes zum Öffnen spannungsabhängiger Na+-Kanäle führt. Es bildet sich ein Aktionspotential am Axon. Tastsinn Ein räumliches Muster bildet sich durch viele Mechanorezeptoren, die ihre Informationen an das ZNS weiterleiten. Dort findet die Verarbeitung der Sinneswahrnehmung statt. 2.2 Temperatursinn - Thermorezeptoren Rezeptoren a) Kaltrezeptoren Sie sind langsam spontan aktiv. Es ist abhängig von der Kühlung des rezeptiven Feldes. Bei geringfügiger Abkühlung kommt es nur zu einer sehr geringen Frequenzzunahme. Der Rezeptor adaptiert in wenigen Minuten. Die Frequenzzunahme ist um so größer und schneller, je größer der Temperaturunterschied ist. Sie sind am empfindlichsten bei normalen Hauttemperaturen um 30° C. Empfindlichkeit und Spontanaktivität nimmt zu höheren und tieferen Temperaturen hin ab. Oberhalb von 40° C und unterhalb von 10° C reagieren sie nicht mehr. b) Warmrezeptoren Sie sind im Bereich von 30 - 45° C spontan aktiv und haben ein kleines rezeptives Feld. Erwärmung der Haut führt zu einer Frequenzzunahme, bei Abkühlung hört die Impulserzeugung auf. Sie adaptieren ähnlich schnell wie Kaltrezeptoren. Temperaturempfindung 44 a) Statische Temperaturempfindung11 b) Alles was über 45° C liegt Hitzeempfindung Alles was unter 17° C liegt Kälteschmerz dynamische Temperaturempfindung Sie ist abhängig von der Ausgangstemperatur und der Geschwindigkeit der Temperaturänderung. 2.3 Schmerzempfinden - Nocizeptoren Schmerzwahrnehmung Ein adäquater Reiz wird gebildet bei Gewebsschädigung oder potentieller Gewebsschädigung. Die Sensoren sind freie Nervenendigungen, die bei der Zellschädigung freigesetzt werden oder direkt Druck erregt werden können. Eine weitere Möglichkeit ist die direkte Einwirkung durch Hitze oder Kälte und eine daraus resultierende indirekte Erregung der Nervenzellen durch freigesetzte parakrine Substanzen (Prostaglandine, Bradykinin, Serotonin, ...) aus Fibroblasten, Mastzellen, ... . Schmerztypen Somatischer Schmerz: Oberflächenschmerz (Haut) und Tiefenschmerz (Muskel, Knochen, Gelenke, Bindegewebe) Visceraler Schmerz: Eingeweideschmerz Schmerzkomponenten Sensorische (Lokalisation, Dauer, Intensität) Emotionale Vegetative (reflektorische Reaktionen auf den Schmerz) Motorische (Flucht zu Schutzreflex) Subjektive Bewertung Schmerzschwelle Schmerzintensität Schmerzintoleranzschwelle Schmerzrezeptoren a) Mit markhaltigen Axonen: 11 A-Mechanorezeptoren (reagieren hauptsächlich auf starke spitze mechanische Reize) A-polymodale Nocizeptoren (reagieren wie A-Mechanorezeptoren, aber noch zusätzlich auf Hitzereize und chemische Reize) bezogen auf die Hauttemperatur 45 b) Mit marklosen Axonen: C-polymodale Nocizeptoren (reagieren auf starke mechanische, chemische und Hitzereize) Schmerzausschaltung a) Schmerzmittel b) Nicht narkotische, schmerzhemmende Mittel: Sie hemmen den Entzündungsprozeß. Die Aktivierung und die Sensibilität der Rezeptoren wird gemindert. Narkotische Mittel: Sie binden an Opioidrezeptoren im Rückenmark. Dadurch wird die neuronale Aktivität im ZNS herabgesetzt. Örtliche Betäubung Nervenblock Infiltrationsanästesie Neurektomie 3. Sehsinn 3.1 Dioptrinischer Apparat des Auges Der dioptrinische Apparat Er ist ein zusammengesetztes Linsensystem mit mehreren Übergangsflächen und brechenden Medien. Es besteht aus: Durchsichtige Hornhaut (Cornea), geschützt durch einem Tränenfilm (Ultrafiltrat des Plasmas) Mit Kammerwasser gefüllte vordere und hintere Augenkammer Iris mit Pupille Linse (mit durchsichtiger Linsenkapsel umgeben) Glaskörper Der dioptrinische Apparat entwirft auf die Netzhaut ein umgekehrtes und verkleinertes Bild. Für die Abbildung eines Gegenstandes gilt bei achsennahen Strahlen: 1 1 1 --- = --- + --f B G B = Bildweite G = Gegenstandsweite f = Brennweite Der Kehrwert der Brennweite ergibt den Brechwert D in Dioptrien (dpt): D = 1/f. Die Gesamtbrechkraft des Auges beträgt 58,9 dpt. Dabei liegt die Hauptbrechkraft bei der Cornea und der Linse. Brechkraft 46 Licht wird beim Übertritt in ein anderes Medium gebrochen. Die Lichtbrechung der Linse hängt von ihrer Krümmung der Oberfläche (Radius) ab. Je kleiner der Radius ist, desto stärker ist die Brechkraft und desto kleiner ist die Brennweite. Die Veränderung der Linsenkrümmung Akkomodation. Akkomodation dient zur Fokussierung von Gegenständen in der Bildebene. Um Gegenstände in unterschiedlichen Entfernungen immer scharf sehen zu können, muß die Brechkraft der Linse verändert werden. Das geschieht durch die Änderung der Krümmung vorwiegend der vorderen Linsenfläche mit Hilfe des Ziliarmuskels. Es ist ein Gegenspiel von Zonulafasern und dem Ziliarmuskel. a) Fernakkomodation Zur Fernakkomodation ist die Linse flach. Der Ziliarmuskel ist entspannt. Die Übertragung der elastischen Kräfte ausgehend von Sklera und Chorioidea wird über die Zonulafasern auf die Linse übertragen: Kontraktion des Ziliarkörpers Befreiung der Linse vom Zug der Zonulafasern aufkugeln der Linse durch ihre eigene Elastizität Nahakkomodation b) Nahakkomodation Bei der Nahakkomodation kontrahiert sich der Ziliarmuskel. Der Zug der Zonulafasern auf die Linse wird unterbrochen. Die Elastizität der Linse führt zu einer stärkeren Krümmung: Erschlaffen des Ziliarkörpers Zonulafasern ziehen wieder an der Linse abflachen der Linse Fernakkomodation. c) Akkomodationsbreite Es ist die Differenz zwischen den beiden Brechkräften bei der Nah- und Fernakkomodation. Bei jugendlichen Menschen beträgt sie 14 dpt. Bei älteren Menschen ist sie aufgrund der abnehmenden Elastizität der Linse geringer. Beim Tier ist die Akkomodationsbreite relativ gering: bei der Katze beträgt sie z. B. 3 - 4 dpt. 3.2 Sehfehler Physiologische Sehfehler Sphärische Aberrationen: Kornea und Linse haben im Randbereich eine kürzere Brennweite, so daß einfallende Strahlen stärker gebrochen werden. Eine Engstellung der Pupille blendet den Randbereich aus. Chromatische Aberrationen: kurzwelliges Licht wird stärker gebrochen als langwelliges Licht, z. B. blau stärker als rot. Ein Ausgleich erfolgt über verschiedene Akkomodationen bei den verschiedenen Farben. Zur scharfen Abbildung der roten Gegenstände muß stärker akkomodiert werden als für die blauen Gegenstände, daher erscheinen die roten Flächen bei gleicher Entfernung näher. Astigmatismus: Brechkraftunterschiede an verschiedenen Stellen der Linse durch die ungleichen Krümmungsradien. Die vertikale Linie ist stärker gekrümmt als die horizontale, daher werden die in der vertikalen Ebene einfallende Strahlen stärker gebrochen als andere. Ein physiologischer Astigmatismus besteht bei < 0,5 dpt und ein pathologischer Astigmatismus bei > 0,5 dpt. Die Korrektur erfolgt durch zylindrische Linsen. 47 Streulicht: entsteht durch diffuse Dispersionen des Lichtes (Tyndall-Effekt), wegen den in der Linse und dem Glaskörper enthaltenen Strukturproteinen Pathologische Sehfehler Myopie (Kurzsichtigkeit): Der Bulbus ist zu lang. Die Bildebene liegt „vor“ der Netzhaut Brechkraft der Linse ist zu schwach Korrektur: Streulinse Hypermetropie (Fernsichtigkeit): Der Bulbus ist im Vergleich zur Brechkraft der Linse zu kurz. Das Bild wird „hinter“ der Netzhaut abgebildet Korrektur: Sammellinse Grauer Star: bei alten Menschen entstehen Färbungen der Linse, die durch Wasserverlust hervorgerufen werden 3.3 Innervierung und Funktion der Iris Die Iris bildet die Pupille. Die Pupillenweite wird durch den M. dilatator pupillae und den M. sphincter pupillae eingestellt. Sie ist abhängig von der Stärke des Lichteinfalls. Der Pupillenreflex ermöglicht einen relativ schnellen Schutz vor Blendung. Pupillenreaktionen Lichtreaktion: Die Pupille ist um so enger, desto stärker die Beleuchtung ist. Man unterscheidet zwischen: Direkte Lichtreaktion: belichtetes Auge verengt sich Konsensuelle Lichtreaktion: anderes nicht belichtetes Auge verengt sich auch. Naheinstellungsreaktion = Konvergenzreaktion: Bei Nahakkomodation verengt sich die Pupille, so kommt es zu einem Anstieg der Tiefenschärfe. Funktion und Innervation der pupillenmotorischen Muskeln Die beiden Muskeln gehören zur glatten Muskulatur und werden vom vegetativen Nervensystem aus gesteuert. Deshalb ist die Pupillenweite ein Indikator der vegetativen Tonuslage. Ein Signal von den Sinnesrezeptoren in der Netzhaut Tractus opticus prätektale Region, von dort aus wird nun die Pupillenreaktion gesteuert. M. sphincter pupillae Miosis12 parasympathische, pupillenkonstriktorische Bahn13 über den Edinger-Westphal-Kern zum Ganglion ciliare mit pupillenmotorischen Neuronen 12 M. dilitator pupillae Mydriasis eine sympathische, dilatatorische Bahn geht vom Hypothalamus aus über das ziliospinale Zentrum des Rückenmarks zum Ganglion cervicale superius mit Ziliarnerven Es besteht eine Kopplung mit Informationen aus der Ganglienzellschicht der Retina und der Sehrinde in den prätektalen Nervenzellen. 13 Atropin hemmt den Parasympathicus Mydriasis 48 Der Pupillenreflex spielt eine wichtige klinische Rolle bei der objektiven Prüfung der afferenten Leitungen im ersten Abschnitt der Sehbahn vom Auge bis zum Zwischenhirn. Es dient zur Beurteilung von Narkosestadien und der Tiefe der Bewußtlosigkeit. 3.4 Hell-Dunkel-Adaptation Dunkeladaptation Die absolute Empfindlichkeit des Sehsystems nimmt zu, i. d. mehr lichtempfindlicheres 11-cisRetinal in die Scheibenmembranen eingelagert wird. Die Sehschärfe wird geringer als bei Tageslichtsehen durch die Umschaltung auf das Stäbchensehen. Stäbchen besitzen größere rezeptive Felder und sie sind nicht in der Fovea centralis enthalten. Schwellenreizstärke nimmt ab (Dunkeladaptationskurven) Das Stäbchensystem hat eine wesentliche höhere Empfindlichkeit als das Zapfensystem. Es gibt dazu noch eine hohe Stäbchendichte neben der Fovea (parafoveal). Helladaptation Sie läuft schneller als die Dunkeladaptation ab. Lichteinfall führt zu einer Umwandlung des Rhodopsins in das Metarhodopsin II, das ein GProtein, das Transducin, aktiviert. Vom Transducin wird durch die GTP-Bindung die -Einheit abgespalten, die eine Phosphodiesterase aktiviert. Diese spaltet das intrazelluläre cGMP. Der Abfall der cGMP-Konzentration führt zu einer Verminderung des Ca2+- bzw. Na+-Einstroms und damit zu einer Hyperpolarisation der Zelle. Bei der Helladaptation führt der Abfall der intrazellulären Calciumkonzentration zu einer Stimulation der Guanylatcyclase und damit zu einem Wiederanstieg des cGMP in der Zelle. Mechanismen der Hell-Dunkel-Adaptation Änderung des Gleichgewichtes zu zerfallenem und nicht zerfallenem Farbstoff Im Dunkeln lösen die Horizontalzellen eine Umschaltung vom Zapfensehen auf das Stäbchensehen um niedrigere Reizschwelle Im Dunkeln erfolgt eine Vergrößerung der rezeptiven Felder durch die Herabsetzung der lateralen Hemmung der Ganglienzellen durch Amakrine Abnahme der Sehschärfe Dunkel: Weiten der Pupille (Mydriasis) Hell: Verengend der Pupille (Myosis) 3.5 Die Retina Bau der Retina Die Retina ist embryologisch eine Ausstülpung des Zwischenhirnbodens und besteht aus einem Netzwerk von Stütz und Pigmentzellen. Die Schichtung von außen nach innen: Pigmentepithelzellen Photorezeptorzellen mit Zapfen für das photoptistisches Sehen = Tagessehen (6 Mio.) und Stäbchen für das skotoptistisches Sehen = Dämmerungs- und Nachtsehen (120 Mio.) Horizontalzellen Bipolarzellen amakrine Zellen 49 Ganglienzellen Die Zapfen sind über ON- und OFF-Bipolarzellen mit den Ganglienzellen verbunden. Eine Weiterleitung der Informationen erfolgt über den N. opticus. Die Stäbchen sind über stäbchenamakrine Zellen mit den Zapfenbipolarzellen verbunden. Zwei Interneuronsysteme (Horizontalzellen und amakrine Zellen) ermöglichen die Weitergabe von Informationen schon innerhalb der Netzhaut. Die Horizontalzellen ermöglichen eine horizontale Ausbreitung von Hemmung und bietet die Möglichkeit zur Rückkopplung des Signalflusses auf die Photorezeptoren. Die amakrinen Zellen sind sehr vielfältig, wirken aber i. d. R. hemmend. Bau der Photorezeptoren und des Rhodopsins14 Stäbchen und Zapfen haben einen typischen Ausbau, mit eine Außenglied, das über ein dünnes Zilium mit dem Innenglied verbunden ist. Im Stäbchenaußenglied liegen Scheibenmembranen, die den Sehfarbstoff Rhodopsin enthalten. Phototransduktionsprozeß15 am Beispiel der Stäbchen Der Sehfarbstoff der Stäbchen ist das Rhodopsin. Es wird im Außenglied der Rezeptorzelle in Membranscheiben gelagert. Das Extinktionsmaxima des Farbstoffs liegt bei 500 nm (grün) und 350 nm (blau). Das vom Licht ausgehende Photon wird im -Bereich der Doppelbindung absorbiert. Das 11-cis-Retinal geht in All-trans-Retinal über. Mehrere Zwischenstufen führen zum Metarhodopsin II. Diese Konformationsänderung führt zu einer Verminderung der Permeabilität der äußeren Stäbchenmembran für Natrium- und Calcium-Ionen, das zu einer Hyperpolarisation in der Zelle führt. Es wird vermindert Transmitter abgegeben. Der zelluläre Botenstoff, der die Konformationsänderung an die Stäbchenaußenmembran mitteilt, ist das cGMP. Es hält die Natrium- und Calcium-Kanäle im Dunkeln offen, die die Zelle depolarisieren. Nach Belichtung induziert das Metarhodopsin II mit GTP die Aktivierung von Transducin (GProtein), das eine Phosphodiesterase aktiviert und die Hydrolyse von cGMP zu GMP einleitet. Die Konzentration des cGMPs sinkt. Die entsprechenden cGMP-sensitiven Kanäle schließen, wodurch der Na+- und Ca2+-Einstrom gemindert wird. Es kommt dadurch zur Hyperpolarisation, welches wiederum die Transmitterausschüttung herabsetzt. Die Weiterleitung der Informationen erfolgt über zwei Systeme: Direkter Signalfluß: Photorezeptor Bipolarzelle Ganglienzelle Lateraler Signalfluß: Photorezeptor Interneurone Bipolar- und Ganglienzellen 3.6 Sehbahn und Reizverarbeitung Sehbahn Die von den Lichtsinneszellen weitergeleiteten Informationen, werden über des N. opticus Chiasma opticus Tractus opticus Corpus geniculatum laterale visuellen Cortex im Gehirn weitergeleitet. Erst in der visuellen Cortex findet die Verarbeitung der Informationen statt. 14 15 Rhodopsin = Opsin (Glycoprotein) + 11-cis-Retinal (chromophore Gruppe; Aldehyd von Vitamin A1) Prinzip der Signaltransduktion: Licht Hyperpolarisation Verminderung der Transmitterabgabe 50 Hauptganglienzellen In der Retina werden drei Hauptganglienzellen unterschieden: -Zellen -Zellen -Zellen antworten auf konstante heterogene Gruppe retinaler Lichtreize Zellen sind farbempfindlich und deshalb für das Farbensehen von Bedeutung haben kleine RF mit einer hohen räumlichen Auflösung Fasern gehen über Thalamus zur primären Sehrinde Fasern ziehen zum Mittelhirn haben größere rezeptive Felder antworten auf Leuchtdichteveränderungen im RF sind für das Bewegungssehen geeignet 3.7 Zellarten zur Informationsweitervermittlung Die Signalverarbeitung in Rezeptoren und Bipolarzellen erfolgt über Veränderungen von Membranpotentialen. An den Ganglienzellen entstehen die ersten Aktionspotentiale. Durch die Verschaltung entstehen rezeptive Felder (RF). Es ist derjenige Bereich, in dem die Aktivität beeinflußt werden kann. Es gibt RF bei Bipolar- und Ganglienzellen, wobei diejenigen der Ganglienzellen in ein Zentrum und eine Peripherie eingeleitet sind. ON-Zentrum- und OFF-Zentrum-Ganglienzellen bilden zwei getrennte Systeme für die Hell-DunkelWahrnehmung. Erregende Synapsen geben die Membranpotentialänderungen weiter, hemmende Synapsen kehren sie um. Sie gehören ebenfalls zum bewegungsempfindlichen System Erfassen von Bewegungen. Die Summation von Aktivierung und Hemmung wird über den N. opticus an das Gehirn geschickt. Dort erfolgt die Auswertung zu Helldunkel- und Farbwerten. Erst hier entsteht das Bild. 3.8 Farbensehen - trichromatisches Farbensehen Licht ist elektromagnetische Strahlung, die in einer Wellenlänge von 400 bis 750 nm wahrgenommen werden kann. Die Wellenlänge eines monochromatischen Lichtes bestimmt die Farbempfindung. Mischfarben wie weiß empfindet man durch Addition von mehreren monochromatischen „Farben“. In der Retina befinden sich 3 Typen von Zapfen mit verschiedenen Farbstoffen, die unterschiedliche Extinktionsmaxima haben. Die Farben werden getrennt an den Rezeptoren wahrgenommen und erst im Gehirn miteinander verrechnet. Rotzapfen (absorbieren bei 575 nm) Blauzapfen (absorbieren bei 425 nm) Grünzapfen (absorbieren bei 525 nm) Bei Lichteinfall kommt es zur Absorption der Grundfarbe .... Hyperpolarisation ... Verarbeitung der Reize im Gehirn. Hier wird die Mischfarbe zusammengesetzt. Es können ca. 7 Mio. Farben unterschieden werden. 51 Gegenfarbentheorie Sie besagt, daß es 3 Systeme gibt, in denen zueinander komplementäre Farebn jeweils antagonistische Wirkungen hervorrufen. zeitliche und räumliche Signalverarbeitung in Retina und Gehirn gelb - blau RFZ RFP rot - grün RFZ RFP weiß - schwarz 3.9 Räumliches Sehen, Tiefensehen, plastisches Sehen Es ist auf das bioculare Gesichtsfeld beschränkt. Durch die Konvergenzbewegungen beider Augen wird ein fixierter Punkt auf die korrespondierende Stelle der Netzhaut abgebildet. Bei Tiefenwahrnehmung werden Phänomene wie Konturüberschneidungen, Schattenwurf und Größenunterschiede zur Hilfe genommen. Durch die Bewegung des Kopfes und durch Relativbewegungen (nahe Dinge bewegen sich schneller als weite) kann die Tiefenwahrnehmung erleichtert werden. 3.10 Augenbewegungen Sakkaden: ruckförmige Bewegungen beim Abtasten des Blickfeldes Nystagmus: Kombination von langsamen und diesen entgegengesetzten Augenbewegungen, z. B. beim Schauen aus dem Zugfenster. Folgebewegungen: „im Auge behalten“ eines bewegten Gegenstandes schnellen 3.11 Visus Die Sehschärfe (Visus) ist definiert als das Auflösungsvermögen des Auges. Das Maß dafür ist der kleinste Gesichtswinkel, unter dem 2 Punkte betrachtet werden müssen, um noch getrennt wahrgenommen werden zu können. Bei normaler Netzhaut beträgt der Winkel beim Menschen eine Bogenminute. 1 V = ----16 Visus = 1: normal Auflösungsvermögen besteht bei einem Winkel von 1’ (1 Bogenminute) Visus > 1: größeres Auflösungsvermögen Auflösung erfolgt sogar bei einem noch kleineren Winkel als 1’ 4. Hör- und Gleichgewichtssinn 4.1 Bau und Funktion des äußeren Ohrs Bau des äußeren Ohrs Ohrmuschel äußerer Gehörgang Trommelfell Funktion des äußeren Ohrs 16 = Winkel 52 Es sammelt die Schallwellen und leitet sie zum Trommelfell. 4.2 Bau und Funktion des Mittelohrs Bau des Mittelohrs Zum Mittelohr gehören die luftgefüllte Paukenhöhle und die Gehörknöchelchenkette, die miteinander gelenkig verbunden sind. Hammer (Malleus): ist mit dem Trommelfell verwachsen Amboß (Incus) Steigbügel (Stapes): verschließt mit der Fußplatte das ovale Fenster . Die Abdichtung erfolgt durch ein Ringband Tuba eustachii: dient dem Druckausgleich zwischen Mittelohr und der Außenwelt Funktion des Mittelohrs Über Luftteilung werden die Schallwellen17 über die Gehörknöchelchenkette auf die Perilymphe der Scala vestibuli übertragen. Die Schallübertragung ist frequenzabhängig. Die beste Übertragung ist bei 2000 - 4000 Hz. a) Funktion des Trommelfell-Gehörknöchelchen-Apparates Der Schall wird vom äußeren Ohr aufgefangen und gelangt ans Trommelfell, das in Schwingungen versetzt wird. Da der Hammerstil fest mit dem Trommelfell verbunden ist, gerät auch er in Schwingungen und überträgt diese auf die anderen Gehörknöchelchen bis hin zur Grundplatte des Steigbügels, die über das ovale Fenster die Verbindung zum Innenohr herstellt. Auf diese Weise wird auch die Perilymphe in Schwingungen versetzt. Der Schallwellenwiderstand (Impendanz) der Luft ist wesentlich geringer als das der Perilymphe. Bei einem solchen Übertritt von Schallwellen auf ein anderes Medium geht ein großer Teil der Schallenergie durch Reflexion verloren. Der Trommelfell-Gehörknöchelchenapparates dient der Anpassung der Schallwiderstände von Luft und Innenohr. Sie reduzieren die Reflexionsverluste = Impendanzanpassung. Die Mechanismen der Druckübertragung sind: Da die Fläche des Trommelfells wesentlich größer als die Steigbügelplatte ist, entsteht am ovalen Fenster ein höherer Druck. (Druck Kraft Fläche) Verstärkung Durch die unterschiedliche Länge der Hebel der Gehörknöchelchen gelten Hebelgesetzte Druckerhöhung am runden Fenster Die beiden Muskeln des Innenohrs dienen der Anpassung des Ohrs an die momentane Schallintensität und zum Schutz vor unphysiologischen Schalleinwirkungen. b) Mittelohrmuskeln Bei lauter Beschallung kontrahieren sich M. tensor tympani und M. stapedius. Sie verschlechtern damit die Schallübertragung zum Schutz des Innenohrs. Sie kontrahieren sich bei lauten Schallreizen. Der M. tensor tympani zieht bei seiner Kontraktion das Trommelfell etwas in 17 Schallwellen: mechanische Schwingungen, die mit dem Ohr wahrgenommen werden können. Wichtige Einheiten sind die Frequenz [Hz] und der Schalldruckpegel [dB]. 53 Richtung Paukenhöhle. Dadurch erhält das Trommelfell eine höhere Spannung und die Schwingungen nehmen ab. Der M. stapedius stellt durch seine Kontraktion die Grundplatte des Steigbügels schräg. Auf diese Weise erhöht sich die Spannung im schalleitenden System und hohe Frequenzen werden besser übertragen. c) Mittelohrschwerhörigkeit d) Das ist eine Schallübertragungsstörung. Es kommt zum Hörverlust bei der Luftleitung. Kein Hörverlust tritt bei der Knochenteilung auf. Da diese ungestört ist, erscheint diese im kranken Ohr lauter als im gesunden. Es stört v. a. die Übertragung tiefer Töne. Knochenleitung Die Erregung des Innenohrs kann durch die Schalleitung über den Schädelknochen zur Hörschnecke transportiert werden. Es spielt bei normalen Hören keine Rolle. Hier entsteht allerdings ein größerer Schallverlust als bei der Luftleitung. Es dient zur Diagnose von Schallleitungsschwerhörigkeit und Innenohrschwerhörigkeit (Weberscher Versuch). 4.3 Bau und Funktion des Innenohrs Lage des Innenohrs Das Innenohr liegt im Felsenbein. Bau des Innenohrs Es besteht aus dem knöchernen und dem häutigen Labyrinth. Das letztere ist mit Endolymphe gefüllt und mit Sinnesepithel ausgekleidet. Es enthält die Rezeptoren für den Gleichgewichts- und den Hörsinn. Zwischen dem knöchernen und dem häutigen Labyrinth befindet sich die Perilymphe. Endolymphe: K+- reiche Flüssigkeit (145 mmol/l), ähnlich einer intrazellulären Flüssigkeit. Sie wird von Strias vascularis produziert und befindet sich in der Scala media. Perilymphe: Na+- reiche Flüssigkeit (140 mmol/l), ähnlich einer extrazellulären Flüssigkeit. Es ist ein Ultrafiltrat aus dem Blut und befindet sich in der Scala vestibuli und der Scala tympani. Das Gleichgewichtsorgan besteht aus dem Vorhof (Vestibulum) mit Saccus und Utriculus und den 3 Bogengängen. Das Hörorgan aus der Cochlea (Schnecke) mit Scala media, Scala vestibuli18 und Scala tympani19. Scala vestibuli und Scala tympani sind über Helikotrema (Schneckenspitze) verbunden. Bau der Scala media, Ductus cochlearis a) Aufbau 18 19 Reissnersche Membran: liegt zwischen der Scala media und der Scala vestibuli und trennt damit die beiden fast identischen Flüssigkeiten Endolymphe und Perilymphe voneinander. Basilarmembran: bildet die Grenze zur Scala tympani und trägt den sensorischen Apparat, das Corti-Organ. Paukenhöhle ovales Fenster Scala vestibuli Paukenhöhle rundes Fenster Scala tympani 54 Corti-Organ: wulstige Verdickung mit inneren und äußeren Haarzellen, die die Rezeptorzellen (sekundäre Sinneszellen mit Stereovilli), die von Stützzellen umgeben sind, trägt. Tektorialmembran: gallertartig, bedeckt das Corti-Organ. An der Unterseite sind die Spitzen der langen Stereovilli der äußeren Haarzellen daran befestigt. Das ist wichtig für die Schalltransduktion. Haarzellen: sekundäre Sinneszellen mit Stereovilli, die mit tip-links miteinander verbunden sind. An den Ansatzstellen der tip-links befinden sich Ionenkanäle. Hier wird der Schallreiz in ein Rezeptorpotential umgewandelt. Ihre afferenten Nervenfasern ziehen zum Ganglion spirale, das mitten in der Cochlea liegt. Von hier aus werden die Informationen zum Gehirn weitergeleitet. afferente Fasern Haarzellen Ganglion spirale Nucleus cochlearis efferente Fasern äußere Haarzellen ZNS b) Funktion Transduktion der Schallwellen in elektrische Impulse Informationsweiterleitung an das ZNS. Die Schwingungen der Steigbügelplatte werden zum einen auf die Perilymphe übertragen. Zum anderen gerät auch die Scala media mit der Endolymphe, der Reissnerschen und der Basilarmembran in Schwingungen. Dadurch entsteht eine sog. Wanderwelle, die sich vom Stapes in Richtung Helikotrema fortsetzt. Da die Wände der Scala media zum Helikotrema hin an Steifheit verlieren, buchten sie sich bei der wellenförmigen Bewegung immer weiter aus. Die Folgen davon sind: Wellenlänge und Wellengeschwindigkeit nehmen ab Wellenamplitude nimmt zu bis zu einem Maximum Das Maximum der Auslenkung liegt jeweils dort, wo die Resonanzfrequenz des Membranabschnittes der erregenden Schallfrequenz entspricht. Je kürzer die anfängliche Wellenlänge (d. h. je höher die Schallfrequenz) war, desto näher liegt das Wellenmaximum am ovalen Fenster. Im umgekehrten Fall findet man die Auslenkung langer Wellen (tiefer Frequenzen) in der Nähe des Helikotremas. Somit ist jeder Schallfrequenz eine bestimmte Stelle des Endolymphschlauches zugeordnet, an der die Auslenkung ein Amplitudenmaximum erreicht. 4.4 Wanderwellentheorie Signaltransduktion Der Steigbügel überträgt Schallschwingungen über das ovale Fenster an die Scala vestibuli. Es kommt zur Flüssigkeitsverschiebung zwischen dem ovalen Fenster und dem runden Fenster. Die Basilarmembran gerät in schallsynchrone Schwingungen. Dies wird durch die Wellenbewegung, die vom Steigbügel zum Helikotrema verläuft (Wanderwelle) hervorgerufen. Frequenz-Ort-Transformation 55 Die Steife der Basalmembran nimmt vom Steigbügel Richtung Helikotrema ab. Die Fortpflanzungsgeschwindigkeit der Welle wird langsamer, dadurch steigt die Höhe der Amplitude an. Durch Reibungsverluste wird die Welle vor erreichen des Helikotremas gebremst. Zwischen Steigbügel und Helikotrema entsteht ein Amplitudenmaximum, das für jede Frequenz an einem anderen Ort liegt. 4.5 Transduktion Die Wellenbewegungen führen zu gleichzeitigen Auf- und Abwärtsbewegungen von Basilar- und Tektorialmembran, demzufolge können die äußeren Haarzellen gebogen werden. Bei einer Aufwärtsbewegung werden die tip-links gedehnt und Ionenkanäle (Transduktionskanäle) öffnen sich. Bei Abwärtsbewegungen werden sie wieder geschlossen. Der Endolymphraum (+ 80 mV) ist gegenüber dem Cytoplasma der äußeren Haarzellen (- 70 mV) positiv geladen. Entlang dieses Potentialgefälles fließen K+-Ionen durch die geöffneten Ionenkanäle in die Haarzellen und führen zur Depolarisation. Es entsteht ein Rezeptorpotential. Die äußeren Haarzellen erfüllen bei der Transduktion eine Doppelfunktion: Der mechanische Schallreiz wird transduziert. Der kontraktile Apparat in der Zellmembran verkürzt bzw. verlängert die Haarzellen produzieren so zusätzliche Schallenergie. Durch die verstärke Schwingungen, die durch die äußeren Haarzellen hervorgerufen werden, werden nun die Stereovilli der inneren Haarzellen abgebogen. Durch die tip-links werden nun in den inneren Haarzellen die Transduktionskanäle geöffnet. Es fließen K+-Ionen in das Innere. Über ein Ca2+-Einstrom wird nun Transmitter (Glutamat) am basilaren Pol der Haarzelle ausgeschüttet. Dadurch werden die afferenten Nervenfasern erregt und es entsteht ein Aktionspotential. Also: Depolarisation der äußeren Haarzelle aktive Längenveränderung Verstärkung der Maximalamplitude Depolarisation der inneren Haarzelle Transmitterausschüttung (Glutamat) Nervenimpuls 4.6 Hörbahn ... Ggl. spirale Nucleus cochlearis (dorsal und ventral) Olivenkerne Corpus geniculatum mediale Hörrinde 4.7 Raumhören Es entsteht durch Laufzeitunterschiede und Verzerrung des Schalls in der äußeren Ohrmuschel. 4.8 Bau und Funktion des Vestibularapparates Bau des Gleichgewichtsorgans Knöchernes Labyrinth wird gebildet aus dem Felsenbein. Darin liegt das Häutige Labyrinth besteht aus zwei Maculaorganen und den drei Bogengängen (1 vertikalen, 1 sagitalen, 1 horizontalen) 56 Bogengänge und Maculaapparat enthalten Haarzellen, die mit vielen Stereovilli (60 - 100 Stück) an ihrer freien Oberfläche besetzt sind, aber auch noch zusätzlich 1 langes Kinozilium. Maculaorgane: Statiolithenorgane bestehend aus Macula utriculi (Utriculus) und Macula sacculi (Sacculus) Otolithenmembran: das ist eine gallertartige Substanz aus Mukopolysacchariden, die das Sinnesepithel der Maculaorgane überzieht. Es enthält feine Kalzitkristalle (Otolithen, Ohrsteinchen), die die spezifische Dichte der Membran erhöhen. Cupula: ist eine Gallerte, die das Sinnesepithel in den Bogengängen bedeckt, aber keine Kristalle enthält. Es ist ein fahnenförmiges Gebilde mit der selben Dichte, wie die umgebende Endolymphe. Haarzellen: sind ebenfalls wieder sekundäre Sinneszellen, die über tip-links miteinander verbunden sind. Jede Haarzelle trägt 60 - 80 Stereovilli und 1 Kinozilium. Sie werden innerviert von: afferente Fahnen Haarzellen vestibularis Ganglion vestibuli Nervus efferente Fasern Haarzellen ZNS Funktion der Makulaorgane Bei aufrechter Körperhaltung liegt die Macula utriculi horizontal und die Macula sacculi senkrecht dazu. Die Maculaorgane befinden sich je 1 x im Sacculus und im Utriculus. Sie bestehen aus Sinneszellen, die von Stützzellen eingebettet sind und von einer gallertigen Masse bedeckt werden, der Otholithenmembran. Die Gallerte, in die die Stereovilli eingebettet sind, besitzt eine höhere Dichte als die umgebende Endolymphe. Bei einer geradlinigen Bewegung verschieben sich die Otholithenmembran und die Endolymphe aufgrund ihrer unterschiedlichen Trägheit verschieden stark. Die Otolithenmembran rutscht bei Einwirkung von Beschleunigung ein wenig über dem Sinnesepithel ab. Es kommt zur Reiztransduktion. Die Kopfstellung kann über die Linearbeschleunigung (Gravitation) berechnet werden. Die Beschleunigung nach Vorwärts und Rückwärts wird registriert. Reiztransduktion Die Stereovilli sind über die Eiweißfaden als tip-links miteinander verbunden. Beim Zug in Richtung des Kinoziliums kommt es zur Dehnung und damit zum Öffnen von dehnungsabhängigen Kanälen, die durch K+-Einstrom eine Depolarisation und damit eine Transmitterausschüttung (Glutamat) hervorrufen. Bei einer Stauchung weg vom Kinozilium werden die Kanäle wieder geschlossen. Der verminderte K+-Einstrom führt zur Hyperpolarisation und damit zur Senkung der Transmitterausschüttung. Die Transduktion erfolgt wie in den Haarzellen der Cochlea. Eine Besonderheit des Gleichgewichtsorgans ist das Ruhepotential. In den vestibulären Rezeptoren ist eine stetige Transmitterausschüttung auch in Ruhelage der Stereovilli. Somit entstehen ständig Aktionspotentiale am N. vestibularis. 57 Bau und Funktion der Bogengengsorgane a) Bau der Bogengangsorgane Horizontaler Bogengang Vertikaler Bogengang Sagitaler Bogengang Sie liegen in den Ampullen der Bogengänge und ähneln in ihrem Aufbau den Maculaorganen. Ein wichtiger Unterschied besteht jedoch darin, daß die Gallerte über den Sinneszellen keine Kristalle enthält. Daher ist die Dichte der Cupula gleich der Dichte der Endolymphe. Aus diesem Grund können die Schwerkraft oder geradlinige Bewegungen nicht zum Auslenken der Zilien führen. Hingegen bleibt bei Drehung des Kopfes (Winkel-, Dreh, Rotationsbeschleunigung) die Endolymphe aufgrund ihrer Trägheit zurück, während die Bogengänge sich mitdrehen. Das führt zu einer Auslenkung der Cupula in die entgegengesetzte Richtung und damit zu einem Abbiegen der Zilien. Da die Bogengänge in 3 Richtungen angeordnet sind, kann so die Richtung der Drehung festgestellt werden. b) Funktion der Bogengangsorgane Die Cupula besitzt die gleiche Dichte, wie die Endolymphe. Sie wird allerdings nicht durch die Linearbeschleunigung beeinflußt, sondern über die Winkelbeschleunigung. Bei der Winkelbeschleunigung (Drehung) werden die Wände der Bogengänge wie der Knochen von der Bewegung erfaßt, die Endolymphe bleibt aber wegen ihrer Trägheit zurück. Dadurch entsteht ein Druckunterschied zwischen beiden Cupulaseiten, so daß die elastische Cupula entgegen der Drehrichtung ausgelenkt wird. Damit werden auch die Kinozilien und Stereovilli der Haarzellen gebeugt. Transduktion. Im Gehirn werden die Informationen über die Drehbewegungen im Raum und der Drehbeschleunigung verarbeitet. Die Auslenkung der Cupula erfolgt immer bei einer beschleunigenden Bewegung, denn wenn die Drehbewegung für längere Zeit andauert, paßt sich die Endolymphe der Bewegung des Kopfes an und dreht sich in der gleichen Geschwindigkeit mit, so daß keine Verbiegung der Zilien mehr auftritt. Erst wenn die längere Rotation des Kopfes gestoppt wird kommt es zu einer Cupulaauslenkung und zwar in die entgegengesetzte Richtung, denn aufgrund ihrer größeren Trägheit dreht sie sich noch etwas weiter als der Kopf selbst. 4.9 Die Gleichgewichtsbahn N. vestibularis Vestibularkerne Motoneurone der Hals- und Extremitätenmuskeln Augenmuskelkerne Kleinhirn Thalamus Großhirnrinde Die Verbindung mit dem Kleinhirn und dem Rückenmark ist wichtig für die Aufrechterhaltung des Gleichgewichtes. Die Verbindung mit den Augenmuskeln führt dazu, daß sich beim Einsetzten und Abklingen von Kopfdrehungen auch der Bulbus bewegt und zwar in die entgegengesetzte Richtung. Diese Bulbusbewegung wird als Nystagmus bezeichnet. Sie habt den Sinn, bei einer Kopfdrehung möglichst viel von der vorbeihuschenden Umgebung im Auge zu behalten und die Raumorientierung zu gewährleisten. Dabei werden die Augen erst langsam gegen und dann schnell mit der Drehbewebung geführt. Je nachdem, wodurch der Nystagmus hervorgerufen wurde, unterscheidet man: Vestibulärer Nystagmus (bei Kopfdrehung) Optokinetischer Nystagmus (z. B. bei der Zugfahrt) 58 5. Geschmackssinn 5.1 Morphologie Geschmackspapillen Papillae fungiformis = Pilzpapillen (3 – 4) Papillae foliatae = Blätterpapillen (50) Papillae vallatae = Wallpapillen (> 100) Geschmacksknospen Jede Papille enthält 3 bis 100 Geschmacksknospen, die wiederum 10 bis 50 Sinneszellen enthält. Die Geschmacksknospe selbst besteht aus Stützzellen, Sinneszellen und einen mit Flüssigkeit gefüllten Porus. Geschmackssinneszellen Es sind sekundäre Sinneszellen, die unterschiedlich empfindlich für alle 4 Geschmacksrichtungen sind. Morphologisch gesehen sind es modifizierte Epithelzellen mit Mikrovilli, die über tight junctions mit den Nachbarzellen verbunden sind. 5.2 Signaltransduktion Die Erregung der Sinneszellen erfolgt bei ihrem Kontakt mit den Geschmacksstoffen. Die Stoffe sind aber nur reizwirksam, wenn sie im Speichel oder in Flüssigkeit gelöst sind. Es bildet sich ein Rezeptorpotential aus, das auf afferente Fasern vom Gehirnnerven umgeschaltet und in Form von Nervenimpulsen weitergeleitet wird. Sauer wird durch Hydroniumionen ausgelöst. Dabei nimmt mit der Konzentration von H+-Ionen die Intensität des Sauergeschmacks zu. Die Kaliumkanäle werden durch H+-Ionen gehemmt K+-Ausstrom wird vermindert Depolarisation Transmitterausschüttung Salzig sind ausnahmslos wasserlösliche Salze (Salze dissoziieren in Anionen und Kationen). Es wirken sowohl Kationen, als auch Anionen am salzigen Geschmack mit. Die Intensität der Salzigkeit wird bestimmt durch: NH4 > K > Ca > Na > Li > Mg. Na+-Einstrom durch Kationenkanäle Depolarisation Transmitterabgabe. Bitter wird durch Stoffe mit ganz unterschiedlicher Struktur hervorgerufen. Typische Bitterstoffe sind Alkaloide wie Koffein, Morphin und Nikotin. Da viele der Stoffe toxisch sind, haben Lebewesen eine angeborene Abneigung gegen diese Stoffe. Sie schütz sie gegen Vergiftungen. Der Bitterstoff bindet an ein Rezeptorprotein (G-Protein) Aktivierung der Phospholipase C Freisetzung von IP3 Freisetzung von Ca2+ aus dem Endoplasmatischen Retikulum Depolarisation Transmitterausschüttung Süß sind nur wenige, organische Substanzen, z. B. Zucker, Aminosäuren (bei neutralem pH), Alkohole und Glykole, die die Rezeptoren reizen können. Der süße Geschmack signalisiert das Vorhandensein von Kohlenhydraten und Eiweiß, weshalb Lebewesen eine angeborene Vorliebe für süße Stoffe besitzen. Zucker bindet an ein G-Protein-abhängigen Rezeptor Aktivierung der Adenylatcyclase Freisetzung von cAMP Hemmung der K+-Kanäle 59 Depolarisation Transmitterfreisetzung 5.3 Geschmacksbahn Wall- und Blätterpapillen N. glossopharyngeus und Pilzpapillen N. facialis Tractus solitarius Gyrus postcentralis Hypothalamus (limbisches System) Amygdala Striata terminalis 6. Geruchssinn 6.1 Morphologie Nasenhöhle In der Nasenhöhle sind 3 Conchae, die 3 Meatus nasi bilden. Der dorsale Nasengang führt in den Riechgrund. Alle Conchae sind mit respiratorischen Schleimhautepithel ausgekleidet. Der Riechgrund ist allerdings mit olfaktorischen Epithel, dem Riechepithel überdeckt. Riechepithel Im Riechepithel befinden sich 3 Zelltypen: Riechzellen, Stützzellen und Basalzellen. Riechsinneszellen Es sind primäre bipolare Sinneszellen, die d. h. ihre Fortsätze bilden die Axone der dazugehörigen Nerven und ziehen als Fila olfactoria durch das Siebbein. Apikal sind die Zellen mit Zilien bedeckt, die von Schleimhaut bedeckt sind. Sie dient zum Schutz vor Austrocknung und zur Lösung der Geruchsstoffe. 6.2 Transduktion Transduktion Der Duftstoff bindet an ein G-Protein-gekoppelten Rezeptor Aktivierung der Adenylatcyclase Freisetzung von cAMP es öffnen sich cAMP-abhängige Kationenkanäle Kationenstrom Depolarisation Erhöhung der AP-Frequenz. Es gibt noch einen zweiten Weg über den Second-messenger IP3. Durch die Aktivierung des IP3 wird Ca2+ freigesetzt Depolarisation Erhöhung der AP-Frequenz Geruchsschwellen Man unterscheidet zwischen einer Wahrnehmungsschwelle und einer Erkennungsschwelle. Die Schwellenwerte sind abhängig von der Tierart, Luftfeuchtigkeit, Temperatur und der Art des Geruchsstoffes. Wahrnehmungsschwelle (unspezifisch): der Geruch wird wahrgenommen, kann aber nicht näher charakterisiert werden. 60 Erkennungsschwelle (spezifisch): die Qualität (spezifische Geruchsnote) des Geruchsstoffes kann erkannt werden. 6.3 Riechbahn Die zusammengefaßten Axonen der einzelnen Riechsinneszellen, Fila olfactoria bilden den N. olfactorius. Dieser zieht zum Bulbus olfactorius, in dem eine Verschaltung der Nerven stattfindet. Axone, die gleiche Riechempfindungen vermitteln sammeln sich in einem Netzwerk, den Glomeruli olfactorii. Riechzellaxone und Mitralzelldentriten sind die funktionelle Einheit der Riechinformationen. Hier wird die Information der Riechzellaxone auf die pyramidenförmigen Mitralzellen übertragen. Eine laterale Hemmung erfolgt über Körnerzellen und periglomeruläre Zellen. Tractus olfactorius Riechhirn 1. Neocortex Cortex präpiriformis 2. Limbisches System Hypothalamus Formatio reticularis BLUT 1. Allgemeines 1.1 Physikochemische Eigenschaften des Blutes Zusammensetzung Blut Plasma Fibrinogen Blutkörperchen Serum gelöste Bestandteile anorganische Bestandteile Elektrolyte (Salze, Mineralstoffe) Kationen Anionen rote Blutkörperchen, Erythrozyten Wasser Granulozyten Organische Bestandteile Spurenelemente Fe weiße Blutkörperchen, Leukozyten Lymphozyten neutrophil e Proteine Albumin 61 Globuline eosinophile Blutplättchen, Thrombozyten Monozyten basophile Rest-N sonstige organische Verbindungen AS Harn- Hormone + - Na K+ Ca2+ Mg2+ HCO3 HPO42HSO4Cl- Cu Zn J Mn Co stoff Kreatinin Kreatin Harnsäure Glucose Lipide Intermediärstoffwech selprodukte Enzyme Funktionen 1. Transportfunktionen 2. Atemgase O2, CO2 werden durch Hämoglobin gebunden (Atemfunktion) Nährstoffe und Metabolite Körpereigene Wirkstoffe (Hormone) Wärme Haemostase Haemostase bedeutet die weitgehende Konstanz des inneren Milieus (gelöste Stoffe, Temperatur, pH-Wert). Die Regulation erfolgt über komplexe Mechanismen. 3. Isohydrie: Aufrechterhaltung des pH-Wertes. Die Regulierung erfolgt durch Plasmaproteine die mit Basen und Säuren Salze bilden können und durch Puffer Isoionie: konstante Ionenzusammensetzung, die für die normale Funktion der Zellen von Bedeutung ist, z. B. Na+/ K+-Regulation erfolgt über Hormone der NNR, Mg2+ und Ca2+ sind häufig an Proteine gebunden. Das Osmoregulationszentrum liegt im Hypothalamus. Isotonie: konstanter osmotischer Druck (= 0,9 % NaCl-Lösung) Isothermie: Aufrechterhaltung der Wärme Wärmebildung durch biochemische Reaktionen oder mechanisch durch z. B. Muskelzittern Wärmeabgabe (physikalisch) durch Strahlung, Leitung und Verdunstung über die Haut. Wärmetransport erfolgt über Konvektion. Schutz vor Blutverlusten 4. Blutstillung (Zellen) Blutgerinnung (Fibrinogen) Abwehr Phagozytose Chemische Bildung von Antikörpern Blutvolumen Es beträgt 6 - 8 % des Körpergewichtes oder 70 ml/kg. (Blutvolumina der Haustiere: s. Skript). Die Blutmenge ist abhängig vom Körpergewicht, vom Ernährungs- und Trainingszustand. So steigt bei Muskelvermehrung das Blutvolumen dementsprechend, bei Fettansatz pro kg steigt das Blutvolumen nicht dementsprechend. Jungtiere haben eine relativ größere Blutmenge und Lauftiere haben große 62 Blutreserven in Milz und Leber, die sie z. B. bei der Flucht durch den erhöhten O2-Verbraucht ausschütten können. Zur Bestimmung des Blutvolumens (V) wird ein Farbstoff in bekannter Menge (V i ei) die Blutbahn injiziert. Nach Verteilung wird die Konzentration des Indikators (ex) in einer entnommenen Blutprobe bestimmt. Mit der Formel erhält man dann das Blutvolumen. (Ein Blutverlust von - 25 % führt zum Koma, von - 50 % zum Tod.) V i ei V = ----------ex Hämatokrit Plasmavolumen Anteil der Leukozyten ist relativ klein, „buffy coat“ Anteil der Erythrozyten Der Hämatokrit beschreibt den Anteil des Zellvolumens am gesamten Blutvolumen. Er läßt sich durch zentrifugiren einer aus der Vene entnommenen Blutmenge bestimmen, da die Zellen ein höheres spezifisches Gewicht haben. Der normale Wert liegt bei 0,32 - 0,46 l/l, davon sind 99 % Erytrozyten. Abhängig vom Hämatokrit ist die Viskosität. Er kann sich bei verschiedenen Ursachen ändern: Änderung der Erythrozytenkonzentration: bei einer Polyglobulie (Erhöhung der Erythrozytenkonzentration), des HK oder bei einer Anämie, z. B. verminderte Bildung von Erythrozyten (Erythropoese), der HK Änderung des Flüssigkeitsbestandes: bei einer Dehydration, der HK oder bei einer Hyperhydration der HK Änderung des Volumens der einzelnen Erythrozyten, z. B. osmotische Schwellung/ Schrumpfung Viskosität Um funktionsfähig zu sein, muß das Blut bestimmte Fließeigenschaften aufweisen. Dabei ist die Viskosität (innere Reibung) des Blutes von Bedeutung. Sie ist abhängig vom Hämatokritwert, vom Eiweißgehalt des Plasmas, von Veränderungen im Wasserhaushalt und von der Zahl der gelösten Bestandteile. Der Normalwert liegt bei 3,9 5,4, der vom Plasma bei 2,2 und zum Vergleich der von Wasser bei 1. Die Viskosität nimmt mit steigendem Hämatokrit überproportional zu, was zu einer Mehrbelastung des Herzens führt. Druck a) Osmotischer Druck 63 Der osmotische Druck liegt bei 730 kPa (5500 mmHg). Er ist deshalb so hoch, weil viele Elektrolyte und niedermolekulare Teilchen gelöst sind. Abweichungen vom osmotischen Druck kann zur Hypertonie oder Hypotonie führen. Unter Hypertonie versteht man den Ausstrom von Wasser aus den Zellen, so daß diese durch den Verlust des normalen Gewebeturgors schrumpfen. Eine Hypotonie verursacht einen Einstrom von Wasser in die Zelle, diese schwillt an und kann letztendlich auch platzen. b) Onkotischer, kolloidosmotischer Druck Dieser Begriff beschreibt den osmotischen Druck einer kolloidalen Lösung, d. h. durch Proteine erzeugte osmotische Druck. Der Wert liegt bei 3,3 kPa (25 mmHg). Er ist mitbestimmend für die Wasserverteilung zwischen Plasma und Interstitium. Dies kommt daher, daß Elektrolyte sich gleichmäßig verteilen können und daher osmotisch nicht wirksam sind Proteine nur bedingt die Membran passieren können, sind also an der Gefäßwand osmotisch voll wirksam Proteine bestimmen trotz ihres geringen Anteils an der Gesamtkonzentration praktisch allein die Wasserverteilung pH-Wert Er liegt bei 7,4 0,03 und wird durch Puffersysteme relativ konstant gehalten. Der wichtigste Puffer ist der Kohlensäure-Bikarbonat-Puffer. Gefrierpunkt Der Gefrierpunkt liegt bei - 0,56° C. Farbe Die Farbe ist abhängig vom Sauerstoffgehalt. So ist arterielles Blut hellrot und venöses Blut bzw. ruhig stehendes Blut dunkelrot gefärbt. Blut ist auch in dünnen Schichten undurchsichtig. Nach Hämolyse wird es lackfarben und durchsichtig. Dichte, spezifisches Gewicht Die Dichte hat einen Wert von 1,05 - 1,06. Bei Jungtieren ist der Wert niedriger als bei Erwachsenen und kann zusätzlich durch Nahrungsaufnahme oder durch eine Änderung der Zellzahl verändert werden. 1.2 Blutplasma Es ist die extrazelluläre Flüssigkeit des Blutes. Sie ist besonders eiweißreich, weil die Membranen zwar für Elektrolyte und Glucose durchlässig sind, aber nicht für Proteine. Die Zusammensetzung entspricht der intestinalen Flüssigkeit und besteht aus 90 % Wasser, 6 - 8 % Eiweiß und 2 % kleineren Bestandteilen. Die Proteinkonzentration des Plasmas beträgt 60 - 80 g/l. 64 Gewinnung a) Plasmagewinnung Blut wird ungerinnbar gemacht durch Zugabe von Gerinnungshemmern (Citrat, EDTA, Heparin) und dann zentrifugiert. Der Überstand ist das Blutplasma, das eine schwach gelbliche Farbe hat. Es besteht aus Serum + Fibrinogen. Das Sediment besteht aus Blutzellen b) Serumgewinnung Nach der Blutentnahme läßt man das Blut gerinnen und zentrifugiert den Blutkuchen ab. Der Überstand ist das Serum, in dem kein Fibrinogen mehr enthalten ist. Der Blutkuchen beinhaltet die mit Fibrinfäden zusammengehaltenen Blutzellen. Plasmaproteine 1. Proteinfraktionen In der Elekrophorese erhält man zwei verschiedene Arten: die Albumin (60 %) und die Globuline (40 %) mit 1-Glubulin, 2-Globulin, -Globulin und -Globulin. Aufgrund ihrer physiologischen Eigenschaften kann man sie mittels der Elekrophorese (zweidimensionale Elektrophorese, Immunelektrophorese) bestimmen. 2. Funktionen 3. Träger- und Vehikelfunktion: An der großen Oberfläche besitzen sie viele hydrophobe bzw. lipophile Haftstellen, die zur Bindung von wasserunlöslichen, fettartigen Substanzen dient. Sie werden vom Darm zu den Speicher- und Verbrauchsorganen transportiert. Durch die Bindung an die Proteine wird der osmotische Druck aufrecht erhalten. Nähstoffunktion: Schnell verfügbarer Eiweißpool durch den hohen Proteingehalt des Plasmas. Die Proteine werden von Zellen des RES aufgenommen und in Aminosäuren zerlegt. Diese werden vom Blut in die verschiedenen Organe transportiert und dienen hier der Eiweißversorgung. Erzeugung des kolloidosmotischen Drucks: Es entsteht, weil die Eiweißkörper zu große sind, um aus den Gefäßen zu diffundieren und so kein Konzentrationsausgleich stattfinden kann. Pufferung des pH-Wertes: Proteine sind zum größten Teil Ampholyte, so daß sie je nach dem Säuren oder Basen binden können. Schutz vor Blutverlusten: Das Fibrinogen, ein Globulin, spielt bei der Blutgerinnung eine wichtige Rolle. Es wird unter Einwirkung von Thrombin in ein unlösliches Polymer Fibrin umgewandelt. Abwehrfunktion: Die -Globuline sind spezifische Eiweißkörper, die bei der Immunabwehr tätig sind. Fraktionen Albumine werden in der Leber gebildet. Bei Eiweißmangelernährung werden Muskelproteine abgebaut, so daß der Albuminspiegel konstant gehalten wird. Er sinkt nur bei langem 65 Eiweißmangel ab. Im umgekehrten Fall werden Albumine von den Organen zur Bildung organspezifischen Proteinen herangezogen und dienen somit der Eiweißversorgung von Organen (Reserveeiweiß). Proteinfraktion Funktionen Präalbumin Bildung von Thyroxin Koloidosmotischer Druck (80 %) Albumin Vehikelfunktion für freie Fettsäuren, Gallenfarbstoffe, Aminosäuren, körperfremde Stoffe (Penicilline, Sulfonamide, Quecksilber) Globuline sind schlecht wasserlöslich. Man unterscheidet hier zwischen , und -Globulinen, die jeweils unterschiedliche Aufgaben haben. Proteinfraktion 1-Globulin 2-Globuline -Globuline Fibrinogen Prothrombin -Globuline Funktionen Vehikel-Proteine für den Transport von Lipiden, Thyroxin (thyroxinbindendes Protein), NNR-Hormonen (cortisolbindendes Protein) und Vitamin B12 (Transcobalamin) Inhibitor für Trypsin und Chymotrysin Protoglycane (Mucoproteine) Cu2+-Transport über das Coeruloplasmin Plasmin- und Proteinkinaseninhibitatoren (2-Makroglobulin) Bindung von freiem Hämoglobin an das 2-Haptoglobulin Transport von Schwermetallen (Fe, Zn) Eisentransport durch Transferrin (Eisenbindungskapazität des Plasmas hängt vom Gehalt der Transferrine ab) Zn-Gehalt beeinflußt die Fruchtbarkeit von Schweinen. Transport von Lipiden durch das -Lipoprotein Blutgerinnung(Vorstufe von Fibrin) Blutgerinnung (Vorstufe von Thrombin) Immunglobuline, Antikörper (IgG, IgM, IgA, IgD, IgE) Lipoproteine Serumlipoproteine sind wasserlösliche Komplexe, deren Anteil von Proteinen und Fetten jeweils unterschiedlich ist. Sie dienen dem Transport von Cholesterin, Cholesterinester, Phospholipide, Triacylglyceride und fettlösliche Vitaminen. Der Bildungsort ist die Leber und der Darm. Sie sind auch für die Entstehung von Arteriosklerose der Blutgefäße von Bedeutung. Hier kommt es zu einer Ablagerung von Cholesterin und Cholesterinestern in der Gefäßwand. Sonstige organische Bestandteile Organischen Bestandteile, die im Stoffwechsel eine Rolle spielen, z. B. Hormone, Enzyme, .... Plasmafarbstoffe, die entweder exogener Herkunft (Karotin aus Grünpflanzen) sind oder im Körper selbst entstehen. Zu den endogenen Farbstoffen gehören Gallenfarbstoffe, Hämoglobin nach der Hämolyse von Erythrozyten) und Myoglobin. Reststickstoff (Harnstoff, Gallensäuren, u. ä.) Immunkörper Plasmaproteine Nach der Nahrungsaufnahme steigen noch die Konzentrationen der Nahrungsstoffe, da diese zu den Zielorganen transportiert den müssen: 66 Kohlenhydrate, v. a. Glucose führen im Blut zu einer kurzzeitigen Hyperglycämie = Erhöhung des Blutzuckerspiegels. Beim Wiederkäuer findet man eine Konzentration von 50 mg/ 100 ml, bei den anderen Haussäugetieren 100 mg/ 100 ml Plasma. Die Regulation des Blutzuckerspiegels wird von den Hormonen Insulin, Glucagon und STH geregelt. Als Produkt des Kohlenhydrastoffwechsels entsteht Lactat, das in einer Konzentration von 10 - 15 mg/ 100 ml Plasma vorhanden ist. Lipide, dazu gehören Fette und Lipoide. Der Fettgehalt des Blutes hängt von der Nahrungsaufnahme ab. Die Gesamtlipidkonzentration (Cholesterin, Neutralfette, Phosphilipide, ...) beträgt 400 mg/ 100 ml Plasma. Die Lipide bilden zusammen mit den Proteinen Lipoproteine. 2. Erythrozyten 2.1 Erythropoese Erythropoese Die Erythropoese erfolgt beim Erwachsenen ausschließlich im roten Knochenmark. Beim Neugeborenen auch noch in der Leber und der Milz. Man unterscheidet bei der Erythropoese verschiedene Speicher, wodurch die Entwicklung der Zellen bis zu ihrer endgültigen Ausdifferenzierung verdeutlicht werden kann. Stammzellenpool: In ihm liegt die pluripotente Stammzelle, aus der noch alle Blutzellen entstehen können. Diese Stammzelle determiniert und ist jetzt in ihrer weiteren Entwicklung festgelegt (determinierte Stammzelle) Proliferationspool (Vorrat an determinierten Vorläuferzellen): Die determinierte Vorläuferzelle wächst zum Proerythroblasten heran, der sich teilt, woraus eine determinierte Stammzelle und ein Makroblast resultiert. Noch während der Teilung der Proerythroblasten setzt die Hämoglobinsynthese ein. Der Makroblast teilt sich 3 x, so daß am Ende 8 Normoblasten entstehen. Reifungspool (Zellen, die in mehreren Schritten differenziert wurden, erhalten nur noch einen Reifungszustand und treten dann über in den Funktionspool): Die Normoblasten sind nicht mehr teilungsfähig. Sie stoßen ihren Kern aus (Enukleation), woraus Retikulozyten entstehen. Sie wandern ins Blut aus und reifen dort in 2 weiteren Tagen zu Erythrozyten heran. Funktionspool: Zellen des peripheren Blutes Im Knochenmark befinden sich 1012 Zellen in hämopoetischen Vorstufen, davon sind 106 bis 107 undeterminierte Stammzellen oder sog. pluripotente Stammzellen. Sie sind zur Differenzierung und zur Proliferation fähig. Man nennt sie auch CFU („colony forming units“). Sie entwickeln sich weiter zu determinierten Vorläuferzellen, aus denen nur noch Granulozyten, Erythrozyten, Makrophagen, Megakaryozyten oder Lymphozyten werden können. Die entsprechenden Wachstumsfaktoren heißen CSF („colony stimulating factors“). Andere Wachstumsfaktoren sind Interleukin IL-3 und Interleukin IL-5. Pluripotente ProerytErytroNormoReticuReticuErythro 20 21 22 Stammzelle roblast blast blast lozyt lozyt zyt 20 kernhaltig, aber nicht mehr teilungsfähig kernlos, so daß die Passage durch den engen Marksinus möglich ist, mit netzartiger Struktur im Inneren, bindet noch Hämoglobin 22 Im Blut reift der Retikulozyt in 2 Tagen zum Erythrozyten heran, verliert die Netzstruktur im Plasma 21 67 Die Stammzelle wird über mehrere Stadien in ca. 4 bis 6 Tagen zum Normoblast. Das ist die letzte kernhaltige Vorstufe. Es kommt zur Ausstoßung des Kerns (Enukleation). Die neue Stufe ist der Retikulozyt. Ohne Kern ist eine Passage durch den engen Marksinus möglich, wodurch der Retikulozyt noch verformt werden kann. Nach dem Verlust der Mitochondrien und der Ribosomen ist der Erytrozyt ferig gereift. Seine Energie erhält er nun aus der Glykolyse. Etwa 99 % aller roten Blutkörperchen sind Erythrozyten Etwa 0,8 - 1 % des roten Blutbildes sind Reticulozyten Lebensdauer von ca. 120 Tagen Neubildungsrate beträgt 0,8 % aller im Blut vorhandenen Erythrozyten pro Tag Regulation der Erythropoese Steigerung s. bei Regulation der Erythrozytenzahl durch Erythropoetin. Hemmung Vermehrung der Erythrozyten im Blut Gesteigerter pO2-Wert der Atemluft Verminderter O2-Bedarf 2.2 Erythrozyenabbau Physiologisch - durch mechanischer Beanspruchung: Einschränkung der Glykolyse Vermehrte Tätigkeit der Membranpumpen (Verlust von K+) Verlust von Membranmaterial Hämoglobinkonzentration steigt wegen dem Wasserverlust an Abnahme der Deformierbarkeit Sequestration, Abbau in der Milz a) Retikuloendotheliales System (RES) Selektion der nicht mehr deformierbaren Erythrozyten, z. B. durch Defekte in Oberflächenstruktur (Glykokalix). Sie bleiben in den engen Schlitzen des Milzsinus stecken. Die Erythrozyten werden durch Phagozytose in Makrophagen aufgenommen. Dort erfolgt der Abbau in Hämoglobin und die restlichen Bestandteile des Erythrozyten. Das Eisen wird resorbiert und zur Neusynthese von Hämoglobin im Knochenmark transportiert. Das freie Hämoglobin wird an ein Haptoglobin gebunden, zur Leber transportiert und unter Bildung von Bilirubin und Biliverdin (Gallenfarbstoffe) abgebaut. Das Eisen wird wieder ins Knochen gebracht. b) Pathologisch Übertritt von Hämoglobin ins Plasma (Hämolyse) bei gesteigerter Durchlässigkeit Aufreißen der Zellmembran Durch Seifen, tierische Gifte oder lysierende Antikörper, die die Oberflächenmembran angreifen und so zu einem übermäßigen osmotischen H2O-Einstrom führen. Hämoglobin zerfällt bei größerer Freisetzung in Di- und Monomere. Sie passieren die Filtrationsbarriere der Glomeruli verstopfen die Tubuli führen zu Nierenschäden. 68 2.3 Regulation der Erythrozytenkonzentration im Blut Erythrozytenzahl a) Abhängigkeiten RBC gibt die durchschnittliche Zahl der Erythrozyten im Blut an. Sie wird entweder mittels der Bürker-Zählkammer bestimmt. (s. auch Praktikumanleitung) Der RBC ist abhängig von: b) Alter (Alter , RBC ) Tierart Rasse Geschlecht (männliche Tiere haben mehr als weibliche oder Kastraten) Ernährungs- und Haltungsbedingungen körperlicher Beanspruchung Änderungen der Erythrozytenzahl Veränderter O2-Partialdruck in der Atemluft (pO2 , RBC ) Nach erheblichen Blutverlusten, da das Plasma nach 2 - 3 Tagen nachgebildet wird, die Erythrozyten aber erst nach 1 - 2 Wochen Bei Fe- und Cu-Mangel ist die Erythropoese gestört Regulation der Erythrozytenzahl durch Erythropoetin Das steuernde Hormon der Erythropoese ist das Erythropoetin (EPO), ein Glykoprotein, das in der Niere gebildet wird. Es stimuliert die Differenzierung der schon determinierten Vorläuferzellen und die Hämoglobinsysthese v. a. in den Erythroblasten. Verschiedene Hormone, wie z. B. Androgene, Thyroxin und Wachstumshormon verstärken die Wirkung EPO. Zusätzlich muß noch Eisen, Vitamin B12 und Folsäure vorhanden sein (limitierte Faktoren). Es wird bei Senkung des lokalen O2-Partialdrucks23 vermehrt gebildet. Der pO2 sinkt durch: Verminderte Erythrozytenzahl (Blutverlust, Hämolyse) Verminderter pO2-Wert der Atemluft Hormone, wie STH, Glucocorticoide, Schilddrüsenhormone, Testosteron, steigern der O 2-Verbrauch Gesteigerter O2-Verbrauch der Organe (körperliche Arbeit) Störungen der Regulation a) Anämie Verminderung der Hämoglobin- oder Erythrozytenkonzentration im Blut. Der HK fällt unter die altersentsprechenden und geschlechtsspezifischen Normwerte. Da sich die 3 Parameter (Eryzahl, Hämoglobin und HK) nicht immer gleichzeitig ändern, sollte man bei Verdacht auf eine Anämie alle 3 Parameter testen. Die Verminderung nur einer dieser Parameter ist nur dann ein Anzeichen, für eine Anämie, wenn das Blutvolumen normal ist , nicht jedoch bei stärkeren Blutverlusten, Exsikkose (Pseudoglobulie) und Hydrämie (Pseudoanämie). Die Berechnung der Senkung des O2-Partialdrucks vermehrt Bildung von EPO mehr Erythrozyten werden gebildet und umgekehrt: Steigerung des O2-Partialdrucks geringere Bildung von EPO 23 69 Erythrozytenindices (MCV, MCHC, MCH) erlaubt eine Einteilung nach der Morphologie und dem Hämoglobingehalt der Erythrozyten. Nach dem Färbekoeffizient (MCV = mittlere Hämoglobin-Gehalt der Erythrozyten) unterscheidet man hypochrome, normochrome und hypochrome Anämien. Formen der Anämie: Hypochrome Anämie: Störung der Hämoglobinsynthese in Folge eines Eisenmangelns. Es ist die häufigste Form der Anämie. Normochrome Anämie: unmittelbar nach einem Blutverlust wird das intravasale Flüssigkeitsdefizit schneller ersetzt als Erythrozyten gebildet werden können. Hyperchrome Anämie: Bildungsstörung der Erythrozyten, z. B. bei ungenügender Resorption von Vit. B12 oder Folsäure. Entstehung: Störung der Hämoglobinsynthese Bildungsstörung der Erythrozyten Akute Blutung, unmittelbarer Blutverlust Aplastische Anämie durch eine Knochenmarksstörung Chronische Niereninsuffizienz Eisen-, Vitamin B12- und oder Folsäuremangel Vermehrter Abbau b) Einteilung nach der Pathogenese: Nach den unterschiedlichen Ursachen (Pathogenese), die eine Anämie auslösen können, unterscheidet man 3 verschiedene Klassen: Anämien durch übermäßigen Blutverlust: akute oder chronische Blutungsanämie Anämien in Form von verminderter oder ineffektiver Erythropoese: Eisenmangelanämie und perniziöse Anämie24 Anämien infolge von übermäßigem Erythrozyenabbau: hämolytische Anämie25 Polyglobulie, Polyzythämie26 Erhöhung der Hämoglobin- oder Erythrozytenkonzentration im Blut (Erythrozytose). Entstehen tut’s durch eine gesteigerte Erythropoese. Vorkommen kann es: Chronisch verminderter pO2 durch Sauerstoffmangel, z. B. bei längere Aufenthalt im Gebirge (Höhenglobulie, Herzfehler) Gestörte Sauerstofftransportfunktion des Hämoglobin Gestörte Produktion von Erythropoetin (EPO), z. B. hervorgerufen durch einen Nierentumor 2.4 Morphologie und Zusammensetzung der Erythrozyten Morphologie Durchmesser von 7 - 8 m 24 Die perniziöse Anämie ist eine Vitamin B12-Mangeanämie. Ein Mangel an Cobalamin entsteht durch verminderte Cobalaminresorption infolge von verminderter oder fehlender Bildung des Intrinsic Factors, durch Magenschleimhautatrophie oder Malabsorptionssyndrom. 25 Eine hämolytische Anämie entsteht durch einen beschleunigten Erythrozyenabbau, eine verkürzte Lebensdauer oder Hämolyse der Erythrozyten mit kompensatorisch gesteigerter Erythropoese, Reticulozytose und Ansteig des Bilirumins im Serum, evtl. auch mit Hämoglobinämie und Hämoglobinurie. 26 Vorsicht! Es kann vorgetäuscht sein durch ein vermindertes Plasmavolumen bei normaler Erythrozytenkonzentration (Pseudopolyglobulie). 70 Runde, meist bikonkave, kernlose Scheiben (Säugetieren) Vogelerythrozyten aber mit Kern Große Speziesabhängigkeit in der Größe, z. B. Pferd: 6,6 m; Ziege; 4,1 m und Rind: 5,7 m Deformierbar, ist aber abhängig von den osmotischen Verhältnissen zwischen Blut und Erythrozyten. Bei Störungen entstehen: Stechapfelform (Echinozyt) in hyperpolarer Lösung entweicht Wasser, weil das Blut einen höheren osmotischen Wert besitzt. Die Erythrozyten schrumpfen aufgrund ihres Volumenverlustes Kugelform (Sphärozyt) Schwellung der Erythrozyten durch eine intrazellulär höhere Osmolarität und durch eine Senkung der extrazellulären Osmolarität. Bei < 180 mmol/l platzen die Zellen (osmotische Hämolyse). Zusammenhänge mit der veränderten Form Bei veränderter Form sind die formstabil, können sich unterschiedlichen Strömungsverhältnissen nicht mehr anpassen. Sie verursachen in engen Kapillaren einen höheren Strömungswiderstand. Bei geringen Strömungsverhältnissen führt es zur Zusammenlagerung der Erythrozyten zu Geldrollen. Es ist ein reversibler Vorgang und beruht auf der Aggregation der Erythrozyten bei langsamen Strömungsverhältnissen (s. auch Kreislauf) Fibrinogen, 2’-Makroglobulin und andere Globuline fördern die Aggregation (bei Entzündungen deutlich gesteigert) Zusammensetzung Enthält ein wichtiges Protein: Hämoglobin zum O2-Transport. Das Hämoglobin besteht aus 4 Polypeptidketten + 4 Häm (Porphyrinring mit Fe2+) Enzyme zur glykolytischen Energiegewinnung und zum aktiven Elektrolyttransport (Cl- HCO3) Membran und submembranöses Skelett (biegsam) Antigene (Blutgruppen) auf der Membran Erkrankungen des erythropoetischen Systems Makrozytose: anormal große Erythrozyten (> als 8 m), z. B. bei perniziöser Anämie Mikrozytose: anormal kleine Erythrozyten (< als 6 m), z. B. bei Eisenmangel Anisozytose: Erythrozyten sind z. T. > als 8 m bzw. auch < 6 m Poikilozytose: unregelmäßige Gestaltung der Erythrozyten, z. B. bei periziöse Anämie Anzahl Die Anzahl beträgt 5 - 14 1012 / l (ist speziesabhängig) Es sind über 99 % aller Zellen im peripheren Blut Erythrozyten Eigenschaften Gastransport durch die große Diffusionsfläche bei kurzen Diffusionsstrecken Verformbarkeit ermöglicht die Passage durch enge und gekrümmte Kapillaren Osmotische Eigenschaften Anfärbbarkeit mit rotem Farbstoff 71 MCV27 Hämatokrit(l/l) MCV (fl) = Eryzahl (1012/l) 2.5 Hämoglobin Das Hämoglobin macht 90 % der Trockenmasse der Erythrozyten aus. Es ist der rote Blutfarbstoff, der in den Erythroblasten gebildet (noch im Knochenmark) wird. Das Hämoglobin kann auch frei im Plasma, gebunden an Haptoglobin als Chromoprotein vorkommen. Chemischer Aufbau Häm besteht aus einem Tetrapyrrol, welches über die 4 Stickstoffatome der Pyrrolringe ein zentrales Fe2+-Atom als Komplex gebunden hat. 4 Polypeptidketten mit je einem Häm (Farbstoffgruppe). Die Globinketten sind tierartlich unterschiedlich aufgebaut. Es gibt sogar einzelne Rassenunterschiede. Man unterscheidet bei den Peptidketten nach deren O2-Affinität 4 Gruppen ( und Ketten), von denen je zwei identische vorhanden sind. Sie sind im fetalen Hämoglobin (Hb-F) und im adulten Hämoglobin (Hb-A) miteinander in unterschiedlicher Weise kombiniert. Hb-A1 = 2 2 Hb-A2 = 22 Hb-F = 22 Funktion des Hämoglobin 96 - 98 % 1-3% Fetal-Hb28 Bindung von Sauerstoff in der Lunge durch Bildung von Oxy-Hämoglobin, Transport bis in die Kapillaren der Gewebe, in denen er durch Dissoziation wieder abgegeben wird. Ein Molekül Hämoglobin kann 4 O2 in den Alveolen aufnehmen und in das Gewebe tragen (1 g Hämoglobin 1,34 ml O2). Beteiligung an der pH-Regulation des Blutplasmas, wobei Oxy-Hämoglobin ein höheres Basenbindungsvermögen als das reduzierte Hämoglobin hat. Sättigungskurve Der Transport des Sauerstoffs erfolgt über eine reversible Bindung mit dem zentralen Eisenatom des Häm. Dieser Vorgang wird auch als Oxygenierung bezeichnet. Bei der Sauerstoffbeladung ist ein positiver kooperativer Effekt zu beobachten, d. h., die Anlagerung des Sauerstoffs erfolgt um so leichter, je mehr Untereinheiten mit Sauerstoff bereits beladen sind. In der Muskelzelle erfolgt die Sauerstoffanlagerung an das sauerstoffspeichernde Myoglobin nach der klassischen Sättigungskurve. 27 MCV = Mittleres Cell Volumen der einzelnen Erythrozyten. Der Wer ist bei Anämien verändert. Das fetale Hämoglobin bindet Sauerstoff schon bei geringem pO2. Der Fetus lebt dadurch mit einem O2Mangel, der durch die erhöhte Erythrozytenkonzentration wieder ausgeglichen wird. 28 72 Die Sättigungskurve hat einen sigmoiden Verlauf, der die Beziehung zwischen Sauerstoffsättigung und Sauerstoffpartialdruck erklärt. Diese Form hat eine große physiologische Bedeutung, da man auf hohen Bergen immer noch eine fast ausreichende Sättigung gegenüber dem Meeresniveau hat. Des weiteren ist der steile Verlauf günstig für die Entkopplung im Gewebe. Abhängig ist die O 2-Sättigung des Hämoglobins vom O2-Partialdruck. Die Affinität des Hämoglobins ist abhängig von Temperatur, die bei Warmblütern zu vernachlässigen ist, dem 2,3 Bisphosphoglycerat, dem pH-Wert und dem CO2-Partialdruck. Die beiden letzten Werte stehen in enger Beziehung zueinander: ein Ansteig des CO2-Partialdruckes führt zu einem Absinken des pH-Wertes. Dadurch sinkt die Affinität des Hämoglobins zu Sauerstoff ab. Dies führt zu einer erleichternden O2-Aufnahme in der Lunge, sowie zu einer erleichterten O2-Abgabe ins Gewebe. Das ganze nennt man auch den Bohr-Effekt. Kurz: Er unterstützt den Austausch von O2 im Gewebe und in der Lunge. pH-Wert: durch die erhöhte H+- und CO2-Konzentration nimmt der pH-Wert ab mit gleichzeitiger Rechtsverschiebung der Sauerstoffbindungskurve. Dies führt zu einer gesteigerten Acidität, wodurch die die O2-Affinität zum Hämoglobin sinkt und somit die Desoxygenierung erleichtert wird. (Bohr-Effekt) pCO2: wenn der pCO2-Spiegel steigt, sinkt der pH-Wert, daher gelten die gleichen Verhältnisse wie beim pH. 2,3 DPG: es lagert sich an das desoxygenierte Hämoglobin an und setzt dessen Sauerstoffaffinität herab. Es führt zu einer erleichterten Sauerstoffabgabe im Gewebe. Im Gebirge und bei Anämien kommt es zu einer deutlichen Zunahme der 2,3-Bisphosphoglycerat-Konzentration Hämoglobinderivate Oxy-Hämoglobin: oxygeniertes Hämoglobin beim Transport des O2, d. h. Anlagerung von je 1 Molekül O2 an das Eisenatom den Häms. Das Eisenatom bleibt dabei 2-wertig. Desoxyhämoglobin: Das ist die reduzierte Form des Hämoglobin (ohne O2), das die Fähigkeit zum Sauerstofftransport besitzt. Methämoglobin: Das Fe2+ wird zu Fe3+ oxidiert. Es entsteht toxisch durch Oxidasen (Sulfonamide) sowie durch Spontanoxidation beim Vorhandensein von O2, wie es bei erhöhten Sauerstoffkonzentrationen vorkommen kann. Es kann so keinen O2 mehr binden. Eine Anhäufung in den Erythrozyten kann durch die Methämoglobinreduktase verhindert werden Carboxy-Hämoglobin: Es entsteht schon beim Vorhanden sein von kleinen Mengen an CO in der Atemluft, da das Kohlenmonoxyd (CO) eine 300 x höhere Affinität zu Hämoglobin hat wie der Sauerstoff. Es vermindert die Sauerstoffbindung und damit die Kapazität des Sauerstofftransportes im Blut. Gleichzeitig führt CO zu einer Linksverschiebung der Sauerstoffbindungskurve, so daß auch die Sauerstoffabgabe in den Geweben behindert wird. Ein, 65%-iger Anteil an Carboxy-Hämoglobin ist tödlich. Die einzige sinnvolle Therapie bei CO Vergiftung ist die Erhöhung des CO2-Partialdruckes (CO2-Rückatmung), do saß HbCO zu HbO2 überführt werden kann. Sulfhämoglobin: Es entsteht bei einer längeren Einnahme von Sulfonamiden oder bei Schwefelwasserstoffverbindungen. Hämoglobinkonzentration Die Hämoglobin-Konzentration wird photometrisch bestimmt. Dabei wird das Hämoglobin in stabiles Cyanhämiglobin überführt. Der Hb-Gehalt korreliert auch mit der Zahl und der Größe der Erythrozyten, womit auch der höhere Hb-Gehalt bei Neugeborenen erklärt werden kann. Erwachsene haben mehr Hämoglobin, wenn sie in großen Höhen lebt (Grund: trotz niedrigem pO2 ist eine ausreichende Versorgung sichergestellt). Ein Absinken des Hb-Wertes kann ein Hinweis für eine Anämie sein. 73 Normwerte Pferd: 110 g/l Schaf: 125 g/l Hund:150 g/l Rind: 115 g/l MCH29 Hämoglobinkonzentration (g) MCH = = [pg] Erythrozyten (1012) MCHC30 Hämoglobinkonzentration (g) MCHC = Hämatokrit (%) Myoglobin Es ist ähnlich aufgebaut wie das Hämoglobin. Es enthält ebenfalls das Häm als prostethische Gruppe, aber es hat nur 1 Häm-Molekül in der Struktur. Funktionelle Bedeutung der Hämoglobin-Einlagerung Das Blutplasma enthält ca. 7 % Eiweiß. Wenn nun das Hämoglobin frei im Plasma vorliegen würde, so enthielte dieses ca. 22 % Eiweiß. Daraus ergibt sich eine hohe Viskosität, woraus schlechtere Fließeigenschaften des Blutes resultieren würden. Der kolloidosmotische Druck würde um das 3fache ansteigen. Ein Nachteil des Hämoglobin-Einschlusses in die Erythrozyten ist, daß die O2-Aufnahme und Abgabe verlangsamt sind, weil das Gas erst die Erythrozytenmembran durchdringen muß. Das wird dadurch ausgeglichen, daß die Erythrozyten in einem bestimmten Blutvolumen eine große Oberfläche in Bezug auf die Gefäßwände haben. Die O2-Transportkapazität läßt sich aber nicht beliebig erhöhen, da die Viskosität stark zunehmen würde. 29 Der MCH-Wert stellt den Färbekoeffizient dar (mean corpuscular hemoglobin), ein errechneter Wert über die mittlere Hämoglobinkonzentration eines Erythrozyten. Je nach Färbbarkeit kann die Art der Anämie (normochrom, hyperchrom, hypochrom) bestimmt werden. Die Hämoglobin-Beladung eines einzelnen Erythrozyten berechnet man: 30 Der MCHC-Wert ist die mittlere Hämoglobinmasse pro Volumeneinheit Zellmasse (mean corpuscular hemoglobin concentration). Man berechnet den Wert nach der Formel: 74 Abbau des Hämoglobin a) Extravasal Das Globin wird gespalten, im Häm wird der Ring geöffnet und es wird zu Gallenfarbstoffen umgebaut. Diese werden mit dem Kot ausgeschieden. Das Eisen wird zum größten Teil zurückgehalten. Es wird an ein -Globulin (Siderophillin) gebunden und in Leber, Milz und Knochenmark in Form von Ferritin oder Hämosiderin gespeichert. b) Intravasal Tritt das Hämoglobin intravasal aus dem Erythrozyten aus, z. B. bei der Hämolyse, so wird es zuerst an ein Globulin (Haptoglobulin) gebunden. Der Komplex wird vom RES aufgenommen und abgebaut. Das nicht an Haptoglobulin gebundene freie Hämoglobin tritt mit dem Primärharn durch die Glomeruluswand, kann aber im proximalen Tubulus z. T. wieder resorbiert werden. Der Rest wird mit dem Urin ausgeschieden (Hämoglobinurie). c) Biochemie des Abbaus Das sowohl im Hämoglobin, als auch in verschiedenen anderen Enzymen vorhandene Häm kann im Gegensatz zu den anderen Bestandteilen nicht wiederverwendet werden und muß daher dem Abbau zugeführt werden. Durch Spaltung zweier Pyrrolringe durch die Hämoxygenase wird Fe 2+ und CO freigesetzt. Es entsteht Biliverdin, das durch die Biliverdinreduktase zu Bilirubin reduziert wird. Das wasserunlösliche Bilirubin wird an Albumin gebunden und zur Leber transportiert. Die Ausscheidung des Bilirubins erfolgt entweder als Bilirubindiglucuronid in der Leber oder als Urobilinogen im Urin. 2.6 Hämolyse Hämolyse ist die Auflösung der Erythrozyten infolge einer Zerstörung ihrer Zellmembranen. Sie kann in vivo und in vitro durch verschiedene Faktoren ausgelöst werden: chemische Faktoren Säuren Fettlösungsmittel Oberflächenaktive Substanzen (Seifen) Insekten- und Schlangengifte Hämolysierende Antikörper physikalische Faktoren Änderung des osmotischen Drucks Mechanische Beanspruchung Mechanische Einwirkungen, z. B. künstlicher Herzklappen Ionisierende und UV-Strahlung Starke Temperaturschwankungen Osmotische Hämolyse kann man am leichtesten beobachten, in dem man die Erythrozyten in ein hypotones Medium gibt. Durch Wasseraufnahme schwellen die Erythrozyten an, werden kugelig und ab einer bestimmten Größe tritt das Hämoglobin diffus aus, ohne daß die Erythrozyten platzen. Bei weiterem Wassereintritt platzt die Erythrozytenmembran. Das Medium wird durch das Hämoglobin transparent rot gefärbt (lackfarben), die Erythrozytenbruchstücke sedimentieren. Gegen alle hämolytischen Einflüsse zeigen die Erythrozyten eine gewisse Widerstandfähigkeit. So auch im Falle der osmotischen Hämolyse. Diese Erscheinung nennt man osmotische Resistenz. 75 Physiologische Hämolyse Intravasale Hämolyse nach 120 Tagen. Gealterte Erythrozyten werden durch mechanische Beanspruchung zerstört. Die Zellbruchstücke werden vom Monozyten-Makrophagen-System phagozytiert. Das freiwerdende Hämoglobin wird an Haptoglobin gebunden, zur Leber transportiert und dort abgebaut. (s. auch bei Hämoglobin) Pathologische Formen der Hämolyse Es kommt zu einem Übertritt des Hämoglobins ins Plasma durch eine gesteigerte Durchlässigkeit oder durch Aufreißen der Zellmembran. Dies geschieht durch die o. g. chemischen oder physikalischen Einflüsse 2.7 Osmotische Resistenz Erythrozyten können bestimmte osmotische Veränderungen tolerieren Bei osmotischen Wassereinstrom bildet sich die Kugelform (Sphärozyt) bzw. bei osmotischem Wasserverlust bildet sich die Stechapfelform (Echinozyt) Veränderte Formen sind stabil, auch noch bei einem höheren Strömungswiderstand Gemessen wird die Minimalresistenz (1. Erythrozyt reißt auf) und die Maximalresistenz (alle Erythrozyten sind aufgerissen) 2.8 Blutsenkungsgeschwindigkeit = BSG Die Blutsenkungsgeschwindigkeit gibt die Geschwindigkeit an, mit der die Erythrozyten in einer stehenden, ungerinnbar gemachten Lösung absinken. Sie wird in einem Röhrchen mit Skala (nach Westerngreen) gemessen, wobei man die blutkörperchenfreie Plasmasäule der Blutsäule/ Zeit abliest. Das Prinzip der Blutsenkung beruht auf der Sedimentation der Erythrozyten aufgrund der Schwerkraft. Es dient als unspezifischer Suchtest auf ein pathologisches Plasmaproteinspektrum. Phasen des BSG Langsame Phase: Die Erythrozyten sinken einzeln und lagern sich dabei zu Agglomeraten zusammen. Schnelle Phase: Die Agglomerate sinken wegen ihres ungünstigen Oberflächen-Massen-Verhältnisses rasch ab. Langsame Phase: Die Senkungsgeschwindigkeit nimmt ab, weil sie sich gegenseitig behindern. Faktoren der BSG Ballungsbereitschaft der Erythrozyten: Sie ist tierartlich unterschiedlich. Die Blutsenkung ist beim Wiederkäuer sehr gering < Hund und Katze < Huhn und Schwein < Pferd (Geldrollenbildung). Plasmaeigenschaften: Bei vielen Erkrankungen, besonders bei Entzündungen, verändert sich die Zusammensetzung der Plasmaproteine. Es kommt zu einer Vermehrung der -Globuline, während die Albuminmenge abnimmt. So bleibt die Gesamtmenge der Plasmaproteine erhalten, nur der Albumin/Globulin-Quotient wird erniedrigt bei Entzündungen ist der Normwert reduziert. 76 Als Agglomerine wirken Fibrinogen, Cuerulolasmin, 2 Haptoglobuline und -G-Proteine (Anti-A und Anti-B). Sie werden reversibel an Rezeptoren der Erythrozytenmembran gebunden und erhöhen so die Haftfähigkeit der Erythrozyten. Albumin vermindert hingegen die Agglomerationsbereitschaft und wirkt suspensionsstabilisierend. Bestimmung des BSG Die BSG wird mit ungerinnbargemachten Blut vorgenommen. Bei der Methode nach Westerngreen wird das Blut in eine Kapillare aufgezogen und stehen gelassen. Die Länge der Ery-freien Plasmasäule wird in bestimmten Abschnitten abgelesen. In der Veterinärmedizin wird wegen der sehr langsamen Senkungsgeschwindigkeit bei vielen Haussäugetieren eine Schrägsenkung eingesetzt. Hier werden die Kapillaren in einem bestimmten Winkel zur Horizontalen gestellt. Dadurch wird die BSG beschleunigt, weil die Agglomerate nur eine kurze Strecke frei im Plasma sinken müssen. Danach rollen sie an der Gefäßwand herunter und behindern sich dabei kaum. 3. Leukozyten 3.1 Leukozyten Einteilung und Differenzierung Es gibt mehrere Lymphozytenarten, die sich morphologisch und funktionell voneinander unterschieden. Die Verteilung wird im Differentialblutbild bestimmt. Neutrophile Granulozyten (stabkernig oder segmentkernig) Eosinophile Granulozyten Basophile Granulozyten Lymphozyten (groß oder klein) Monozyten Eigenschaften Amöboid bewegliche Zellen Sind zur Phago- und Pinozytose befähigt Sie kommen nicht nur in der Blutbahn vor, sondern wandern auch ins Gewebe aus Anzahl Allgemein kann man sagen, daß die Konzentration 3 - 24 109 / l beträgt. Die Anzahl wird durch die Leukozytenzahlung mittels einer Zählkammer ermittelt. Wie das durchgeführt wird, s. Praktikumanleitung. Ca. 50 % der weißen Blutkörperchen sind Granulo- bzw. Lymphozyten Speicher der Leukozyten sind Lunge, Unterhautgewebe und Milz. Man erstellt die Leukozytenverteilung an fixierten gefärbten Blutausstrichen (Differenzialblutbildern). Anhand der Verteilung der einzelnen Leukozyten kann man das Blutbild bei Wiederkäuern und Nagern als lymphophil und das vom nicht Wiederkäuer als neutrophil bezeichnen. 77 in % Mensch Pferd Rind Schaf Ziege Schwein Hund Katze Kaninchen Meerschwinchen Ratte Maus Huhn neutrophile eosinophile Granulozyten Granulozyten 60 - 70 2-4 55 - 60 2-4 25 - 35 5-6 30 - 40 5 - 15 40 - 45 3-5 45 - 55 2-3 55 - 75 3 - 10 55 - 60 3-6 35 - 55 1-3 40 - 45 3-6 20 - 25 2-3 20 - 30 2-3 25 - 50 2-3 Basophile Granulozyten <1 <1 <1 <1 <1 <1 <1 <1 2-6 <1 <1 <1 2-3 Lymphozyten Monozyten 20 - 30 30 - 40 55 - 65 45 - 70 50 - 55 40 - 50 20 - 25 30 - 35 40 - 60 45 - 50 70 - 75 40 - 60 40 - 60 5-7 3-4 5 - 10 2-5 3-5 2-6 2-6 2-5 2-6 3-5 2-3 3-5 2-5 Gesamtkonzentration Die Gesamtkonzentration im peripheren Blut teilt man ein in einen marginierte, einen zirkulierenden und einen Reservepool ein: Marginierter Pool: Zellen haften an der Gefäßwand und können bei Bedarf leicht rekrutiert werden, z. B. bei Streß und körperlicher Arbeit durch Katecholamine. Sie treten dabei in den zirkulierenden Pool über. Die Erhöhung der Leukozytenkonzentration (Leukozytose) bei körperlicher Arbeit wird Pseudoleukocytose genannt und bei Entzündungen tritt eine Granulozytose auf. (Schließlich sind viele Leukozyten an der Infektabwehr beteiligt). Zirkulierender Pool: in der Blutbahn vorhandene Zellen Reservepool: Zellen, die sich im Knochenmark befinden Leukozytose Darunter versteht man die Vermehrung der Leukozytenzahl. Vorkommen kann es bei vermehrter körperlicher Arbeit und bei infektiösen Prozessen mit akuter Entzündung, v. a. von bakteriellen Infektionen. Leukopenie Es ist die Verminderung der Gesamtleukozytenzahl v. a. der neutrophilen Granulozyten. Als Ursachen kommen Bildungsstörungen im Knochenmark, vorzeitiger Lymphozytenuntergang oder Verteilungsstörung in betracht. Vorkommen kann es bei toxischen oder physiologischen Knochenmarksschädigung, Blutkrankheiten (perniziöse Anämie), bei viralen Infektionen, selten bei bakteriellen Infektionen (Typhus, Brucellose). Entwicklung Die Entwicklung der Leukozyten findet im Knochenmark statt. Aus einer pluripotenten Stammzelle entwickelt sich als erstes ein Myeloblast, dann ein Promyelozyt. Dieser differenziert sich einerseits zu eosino- neutro- oder basophilen Myelozyten bzw. Granulozyten oder andererseits über einen zweiten Entwicklungsweg zu einem Monoblasten und letztendlich zu einem Monozyten. 78 Stabkernige und segmentkernige Granulozyten wandern wegen ihrer hohen Migrationsfähigkeit durch die Gefäßendothelien aus dem Knochenmark in die Blutbahn. Den weiteren Reifungsprozeß erkennt man an der zunehmenden Kernsegmentierung. Bei neutrophilen Granulozyten findet man gewöhnlich bis zu 5 Kernsegmenten, bei den basophilen und eosinophilen Granulozyten bis zu 2. pluripotente Stammzelle determinierte Stammzelle (CFU-GM) Myeloische Entwicklungsreihe Monozytäre Entwicklungsreihe GFU-G GFU-M Myeloblat CFU-E Monoblast neutrophiler basophiler eosinophiler Metamyelozyt Metamyelozyt Metamyelozyt neutrophiler Granolozyt basophiler Granulozyt Monozyt eosinophiler Granulozyt Entzündungsreaktion Bei infektiösen Erkrankungen kommt es zu phasenhaft ablaufenden Veränderungen der Leukozytenverteilung, die im Differentialblutbild erfaßt werden können und einen Rückschluß auf den Krankheitsverlauf ermöglichen. 1. Neutrophile Kampfphase 2. Abwehr des eingedrungenen Erregers, die einhergeht mit der Vermehrung der neutrophilen Granulozyten (Linksverschiebung: relative Vermehrung der stabkernigen, jugendlichen, neutrophilen Granulozyten) und gleichzeitiger Verminderung der eosinophilen Granulozyten und der Lymphozyten. Monozytäre Abwehr oder Überwindungsphase Mit Monozytose (Vermehrung der Monozyten) als Zeichen der Aktivierung des Monozyten-Makrophagen-Systems. Es tritt bei beginnender Immunisierung und beim Höhepunkt der Erkrankung auf und deutet meist auf einen Verlauf mit Heilung hin. Es tritt auch bei chronisch rezidivierenden Erkrankungen (Tuberkulose, Malaria) auf. 3. Lymphozytäre-eosinophile Heilungsphase (Morgenröte) Mit Lymphozytose (Vermehrung der Lymphozyten) und Eosinophilie (Vermehrung der eosinophilen Granulozyten). Es tritt oft auf bei parasitären Erkrankungen insbesondere bei Trichinose, aber auch bei anderen Wurmkrankheiten (Askariden, Echinococcen, ...), allergischen Reaktionen (Asthma bronchiale), sog. flüchtige eosinophile Lungeninfiltration durch 79 Askaridenlarven in der Lunge, durch Einatmung von pflanzlichen/ bakteriellen Allergenen, Insektenstichen, Hautkrankheiten (Pemphigus vulgaris) .... . Es ist verbunden mit einem Rückgang der absoluten Leukozytenzahl und der Linksverschiebung. 1. Phase: 2. Phase: 3. Phase: Neutrophile Granulozyten (Linksverschiebung ) Monozyten Lymphozyten und eosinophile Granulozyten und Absolute Leukozytenzahl und Linksverschiebung 3.2 Granulozyten Funktion Alle haben die Fähigkeit zur Phagozytose und Adhäsion am vaskulären Endothel (Bestandteil des marginierten Pools) Alle sind migrationsfähig, d. h. sie können ins Gewebe durch Chemotaxis einwandern (chemotaktische Strukturen sind Sekrete von Mastzellen, Kinine, aktivierte Faktoren des Komplementsystems, Leukotriene und Peptide aus Bakterien) Lebensdauer beträgt 2 bis 3 Tage Neutrophile Granulozyten Sie gehören zur unspezifischen Immunabwehr, in dem sie zusammen mit anderen Freßzellen, z. B. Monozyten, bei der Phagozytose von Mikroorganismen, körperfremden Antigenen, virsusinfizierten Körpern und Tumorzellen beteiligt sind. Sie werden auch als Mikrophagen, kleine Freßzellen, bezeichnet, weil sie mit Enzymen, Proteasen, Lipasen, ... ausgestattet sind. Zusätzlich setzen sie Entzündungsmediatoren, z. B. Prostaglandine und Leukotriene, frei. Sie werden bei akuten nicht infektiösen, bakteriellen Entzündung (Immunsystem) als erstes vermehrt gebildet, so daß man im Differentialblutbild diese Phase als 1. Phase: Angriffsphase bei Entzündungen charakterisiert werden kann. Eine Vermehrung der neutrophilen Granulozyten wird als Neutrophilie bezeichnet. Eosinophile Granulozyten Sie kommen hauptsächlich im Gewebe vor und dienen helfen bei der Phagozytose von Stoffen. Sie sind deshalb bei parasitären und allergischen Reaktionen erhöht (Eosinophilie). Glucocorticoide, die v. a. in der Streßsituation vermehrt ausgeschüttet werden, führen zu einer Verminderung der eosinophilen Granulozyten (Eosinopenie). Allergische Reaktionen: Sie sind beteiligt an der Allergie Typ I (unter Beteiligung von IgE) und Allergie Typ IV. Dabei stimulieren eosinotaktische Substanzen die Emigration der eosinophilen Granulozyten. Man unterscheidet zwischen: Exogenen Substanzen: Sie wirken über die Haut oder Schleimhaut; sitzen unter der epithelialen Oberfläche von Haut, Darm und Lunge Endogenen Substanzen: z. B. Histamin, eine Mediatorsubstanz, die von Gewebsmastzellen gespeichert wird und bei einer sensibilisierenden Antigen-Antikörperreaktion freigesetzt werden Parasitäre Infektionen: Sie werden durch chemotaktische Stoffe angelockt. Zusammen mit Antikörpern zerstören sie die Parasiten, so daß die Bruchstücke phagozytiert werden können. Bei Wurmbefall erhöht sich ebenfalls die Anzahl der Eos im Blut. 80 Basophile Granulozyten (Phagozytose) Sie haben ähnliche Funktionen wie die Gewebsmastzellen. Sie kommen Hauptsächlich im lockeren Bindegewebe und in Nachbarschaft von Gefäßen vor. Besitzen IgE auf ihrer Zellmembran. Bei Kontakt mit Antigenen kommt es zur Freisetzung von Mediatoren aus den Granula (histamin- und heparinhaltige Granula) Degranulation Immunabwehr bei Parasitenbefall Bei Stimulation kommt es zur Freisetzung von PAT (plättchenaktivierender Faktor) Aktivierung und Aggregation von Thrombozyten, Ausschüttung gefäßaktiver Amine aus den Thrombozyten Granulozytopoese Die Bildung der Granulozyten läuft im Knochenmark ab. Man unterscheidet im Knochenmark den Proliferationspool und den Reifungspool. Proliferationspool: Hier befinden sich eine Reserve von 10 Tagesproduktionen. Die Teilung erfolgt nur für Nachschubzwecke. Reifungspool: Hier befinden sich Granulozyten, die sich Reifungszustand eines Meta-/ Promyelozyten befinden. Aus einer pluripotenten Stammzelle wird ein Myeloblast und dann ein Meta- bzw. Promyelozyt. Dieser differenziert sich aus zu entweder einem basophilen Granulozyten, einem neutrophilen Granulozyten oder einem eosinophilen Granulozyten. Die Determinierung zu verschiedenen Sorten wird über humorale Mediatoren (z. B. Interleukine) gesteuert. 3.3 Lymphozyten Deskription Kleine und große Lymphozyten Basophiles, granuliertes Zytoplasma Relativ großer, unregelmäßiger runder Kern Fähigkeit zur Teilung Verteilung (4 % im Blut, 70 % in lymphatischen Organen, 10 % im Knochenmark, Rest in anderen Organen) Anzahl Lymphozytose: Vermehrung der Lymphozytenzahl Lymphopenie: Verminderung der Lymphozytenzahl, z. B. bei Überfunktion der NNR oder der Thyreoidea, Streßsituationen durch die Ausschüttung von ACTH oder Korticoiden, tageszeitliche Schwankungen, körperliche Arbeit, Nahrungsaufnahme Bildung pluripotente Stammzelle im Knochenmark Vorläuferzellen Wanderung zu den lymphatischen Organen: 81 Prägung im Tymus Prägung im Bursa-Äquivalent im Knochenmark B-Lymphozyt T-Lymphozyt Antigen Aufenthalt in den sekundären lymphatischen Organen (Lymphknoten, Milz, ...) T-Effektorzellen TGedächtniszellen CD4-T-Lymphozyten: T-Helferzellen (Chemotaxis) T-Lymphokinzellen (Lymphokine) Antigen Plasmazellen Y Gedächtniszellen CD8-T-Lymphozyten T-Killerzellen T-Supressorzellen spezifische zelluläre Abwehr spezielle humorale Abwehr Population und Funktion a) T-Lymphozyten Sie dienen der Vermittlung von zellulären Immunreaktionen. Zu den allgemeinen Funktionen gehören Bildung von Antikörpern und zytotoxische Killerfunktion. Man unterscheidet folgende Typen: b) T-Helferzellen: fördern durch Lymphokinine die Antikörperbildung der B-Lymphozyten und aktivieren andere T-Lymphozyten durch Interleukin 2 T-Induktorzellen: unterstützen die T-Helferzellen T-Supressorzellen: wirken der Tätigkeit der T-Helferzellen und der cytotoxischen Lymphozyten entgegen. Sie beenden die Abwehrreaktionen nach 8 - 10 Tagen cytotoxische T-Lymphozyten: zerstören virusinfizierte Zellen T-Gedächtniszellen: speichern die Information über den Antigenkontakt und führen auch noch nach Jahren zu einer schnellen und heftigen Abwehrreaktion (Booster-Effekt) TDTH-Zellen: sind verantwortlich für die Allergie vom Spättyp. Sie wirken infiltirierend, z. B. bei der Tuberkulinreaktion B-Lymphozyten Sie dienen der humoralen Abwehr, z. B. durch Aktivierung durch Antigene, Umwandlung zu Plasmazellen und Produktion spezifischer Antikörper. Man unterscheidet folgende Typen: B-Gedächtniszellen: zirkulieren Monate lang oder sind in lymphatischen Geweben sessil. Auch hier führt ein erneuter Antigenkontakt zu einer starken Zellproliferation und somit zu einer raschen Immunreaktion Plasmazellen: Sie produzieren Antikörper, die ins Blut abgegeben werden. Die Antikörperbildung wird durch T-Helferzellen gefördert und durch T-Supressorzellen gehemmt. Je öfter ein Antigenkontakt stattfindet, desto höher ist der AK-Titer im Blut 82 c) Nullzellen Naturalkiller (NK-Zellen, natural killer cells): Sie sind große granuläre Lymphozyten, die ohne immunologischen Bezog zytotoxisch auf alle körperfremden Zellen wirken und zur Lyse von körperfremden Substanzen führen. K-Zellen: Sie sind Zellen der AK-abhängigen Cytolyse, da sie die mit AK markierten Zellen mittels der Fc-Rezeptoren für IgG-Antikörper erkennen können Interleukin Interleukin 1: wird von Makrophagen gebildet, die mit einem Antigen in Kontakt gekommen sind. Das IL-1 aktiviert die T-Zellen. Die aktiven T-Zellen geben dann Interleukin 2 ab. Interleukin 2: regt die T-Lymphozyten zur Teilung an. Dies geschieht durch direkten Kontakt. Das IL-2 lagert sich an einen T-Lymphozyten an, der daraufhin anfängt sich zu teilen. 3.4 Monozyten Deskription größte mononukleäre Zellen im Blut großer, hufeinsenförmiger gelappter Kern grobmaschiges Chromatingerüst basophiles, ungranuliertes Cytoplasma Funktion Monozyten wandern ins Gewebe aus (Migration) und werden zu Makrophagen (Histiophagen), die zur Phagozytose (durch viele Lysosomen) befähigt sind Rezeptoren für Komplementpoteine auf der Membran Rezeptoren für IgE (Anlagerung und Phagozytose von Mikroorganismen) höchste Phagozytoseaktivität unter den Blutzellen nichtabbaubare Substanzen können gespeichert werden Produktion von Zytokinen (Interleukin 1, Interferone, zytotoxische Substanzen) 2. Phase: Überwindungsphase (späte Phase der Abwehr-Reaktion) Bildung pluripotente Stammzelle Myeloblast Promyelozyt Monoblast Monozyt (1 - 2 Tage im Blut,) ortsständiger, gewebetypischer Histiozyt (Auswanderung in Organe und ins Gewebe) 4. Thrombozyten 4.1 Allgemeines Struktur 83 Abstammung vom Monozyten im Blut Kernlose, flache Scheibe mit einem Durchmesser von 1 - 3 m und einer Dicke von 1 m Zellmantel mit afferenten Kanälchen, Mikrotubuli Mitochondrien, Glykogen, Enzyme der Glykolyse, Citratcyclus, Pentosephosphat Im strömenden Blut sind etwa 200 000 - 800 000 / l Bei Aktivierung wird Blutplättchenfaktor 3 ausgeschüttet (Phospholipid der äußeren Plättchenmembran) und Tromboxan A2 (TXA2), die aus der Arachidonsäure gebildet wird. Zirkulationsform dendritische Form der Aggregation (mit Pseudopodien) Granulons mit -Granula, Granula, Lysosomen, ATP, Serotonin (5-Hydroxy-Tryptamin-5-HT), Gerinnungsfaktoren (Plättchenfaktor 3) Eigenschaften Sie befinden sich nur intravasal. Sie lagern sich gerne zusammen und zerfallen sehr leicht. Dies ist für ihre Beteiligung an der Blutstillung von Bedeutung. Die Atmosphère plasmique enthält alle plasmatischen Gerinnungsfaktoren. Deshalb findet die Fibrinbildung v. a. außen an den Thrombozyten statt. Im inneren der Plättchen befinden sich die autochronen Gerinnungsfaktoren, vasoaktive Substanzen (z. B. Serotonin. Adrenalin, Noradrenalin, ATP und ADP) Beim Geflügel findet man an der Stelle der Thrombozyten Spindelzellen. Diese betreiben zusätzlich noch Pinozytose. Funktion können kolloidale Partikel phagozytieren Aufrechterhaltung der Haemostase primäre und sekundäre Haemostase (Blutstillung, Gerinnung, Wundheilung: sie werden durch Oberflächenkontakt mit endothelialen Strukturen der Gefäßwand klebrig. Es kommt zur Adhärenz der Thrombozyten an der Wand, wo sie nun ihre Inhaltsstoffe freisetzten können, die eine verstärkte Aktivierung von Gerinnungsfaktoren hervorrufen). Bildung Sie entstehen - wie alle anderen Blutzellen auch - aus einer pluripotenter Stammzelle im Knochenmark, sind aber eigentlich Abschnürungen vom Megakaryozyten (Knochenmarksriesenzellen). Ihre Lebensdauer beträgt ca. 8 - 12 Tage, bis sie schließlich in der Milz abgebaut werden. Reguliert wird die Bildung vom Thrombopoetin, das in der Niere gebildet wird. Pathologie Thrombozytopenie: Mangel an Thrombozyten Thrombozytopathie: Funktionsschwäche der Thrombozyten, es kommt zu punktförmigen Blutungen = hämmorrhagische Diathese 4.2 Blutstillung, Primäre Haemostase 1 - 3 Minuten Adhäsion und Aggregation der Thrombozyten 84 1. Stufe: Thrombozytenadhäsion Bei einem Defekt, bei dem die subendothelialen Basalmembran (Strukturen = Kollagenfasern) freigelegt wurde, bildet sich ein einschichtiger Rasen adhärierender Thrombozyten. Durch Adhäsion bleiben die Plättchen mit Randströmung unmittelbaren Kontakt an der Gefäßwand heften. Als Auslöser wirkt der beim an Kontakt mit kollagenen Typ IV und V. Ein weiterer Faktor, der von Willebrand-Faktor, beschleunigt (über spezifische Rezeptorbindung) die Thrombozytenadhäsion. Der Faktor wird von Thrombozyten abgegeben positive Rückkopplung. 2. Stufe: Thrombozytenaggregation Kollagen Typ I und III, die sich in der Tiefe der Basalmembran befinden, lösen erst eine reversible Aggregation aus (Anlagerung der vorbeiströmenden Blutplättchen. Durch ATP und ADP (aus verletztem Endothel) die Aggregation gefördert und geht schließlich in eine irreversible Aggregation (Plättchenverschmelzung) unter Auslösung der Zellmembran) wenn Thrombin dazukommt. Dabei wird die Membran der Thrombozyten selbst und der Granula zerstört, so daß Serotonin, ADP und Arachnidonsäure freigesetzt werden kann, die die Aggregation verstärken. Es folgt die visköse Metamorphose mit Degranulierung und Ausbildung von Pseudopodien. 3. Stufe: Hämostatischer Pfropf und Gefäßkonstriktion Es lagern sich mehr und mehr Plättchen an , so daß es zur Bildung eines Aggregationspfropfs, weißer Thrombus (Thrombozytenaggregat) kommt. Unterstützend wirken noch freigesetzte Katecholamine und Serotonin, die eine Gefäßkonstriktion bei verletzten Gefäßen (entgegengesetzt dem Normalzustand) bewirken. Die Pfropfbildung und die Vasokonstriktion erfolgt nach 1 - 3 Minuten Blutungszeit. Daraufhin kommt es zum Blutstillstand. 4.3 Blutgerinnung und endgültige Blutstillung, Sekundäre Haemostase 1. Faktorenaktivierung exogenes System endogenes System Phospholipide aus dem Gewebe plasmatische Faktoren extrinsische intrinsische Die Blutgerinnung wird nach einer Gewebeläsion auf exogenem Weg (extrinsisches System: Vorraussetzung ist die Freisetzung von Gewebethromboplastin) und auf endogenem Wege (intrinsisches System: Vorraussetzung ist das Freilagen von Fremdoberflächen oder Kollagenfasern im verletzten Endothel und Thrombozytenzerfall) ausgelöst. Im exogenen System wird Faktor VII durch seien spezifischen Aktivator in die aktive Form überführt. Faktor VIIa verbindet sich unter Mitwirkung von Ca2+ mit Phospholipidmizellen der verletzten Gewebezellen. Dieser Komplex stellt den Faktor X-Aktivator des extrinsischen Systems dar. Im endogenen System beginnt die Reaktionsfolge mit der Kontaktaktivierung des Faktors VII. Faktor VIIa bildet zusammen mit dem aktivierten Faktor XIa und Calciumionen einen Komplex zur Umwandlung des Faktor IX in seine aktive Form. Faktor IXa bildet mit Faktor VIIIa, Ca 2+ und dem Plattchenfaktor 3 den Faktor X-Aktivator des intrinsischen Systems. 85 In dem folgenden, von beiden Systemen gemeinsamen Reaktionsablauf, bildet der aktivierte Faktor X zusammen mit FVa, Ca2+ und Phospholipoprotein einen Komplex (Prothrombinaktivator), der Prothrombin in Thrombin umwandelt. 2. Koagulationsphase, Fibrinbildung Das im bei der Faktorenaktivierung gebildete Thrombin spaltet vom Fibrinogenmolekül die Fibrinpeptide A und B ab. Die lösliche Fibrinmonoesterase führt zur Gelierung des Plasmas, das unlösliches Polymer Fibrin bildet fasrige Strukturen im Plasma. Dieser Polymerisationsabschritt wird durch die Umgebung gefördert (z. B. durch Ca2+) Thrombin Fibrinogen Fibrinmonomere (lösliches Produkt) 3. Retraktionsphase, Thrombusbildung Der Faktor XIII verfestigt die Fibrinstrukturen, wobei seine Wirkung durch Thrombin und Fibronektin, das von den defekten Rändern sezerniert wird, verstärkt. Fibrinfäden und Blutzellen vernetzten sich und bilden einen roten Thrombus (Fibrin und Blutzellen). Dieser verschließt das Gefäß durch anhaften an den Rändern und durch das Zusammenziehen der Ränder (Retraktion). Die Retraktion wird durch Thrombostenin (ATPase) hervorgerufen, das von den Thrombozyten während viskösen Metamorphose freigesetzt wird. Faktor XII, Ca2+ Fibrinmonomere Produkt) Fibrinpolymere = Fibrin (unlösliches Fibrin + Trombozytenaggregat roter Thrombus 4.4 Fibrinolyse physiologische Bedeutung der Fibrinolyse Aufrechterhaltung des dynamischen hämostatischen Gleichgewichtes durch Neutralisierung der kontinuierlich ablaufenden Blutgerinnung. Entfernung des Thrombins aus dem zur Blutstillung gebildeten Thrombus. Ablauf der Fibrinolyse Über eine Kette von Aktivoren kommt es zur Bildung von Plasmin. Diese Aktivoren verwandeln inaktives Plasminogen, ein Plasmaprotein der Globulinfraktion, zu Plasmin um. Das Plasmin, eine Protease, spaltet vom Fibringerüst des Thrombus Fibrinspaltprodukte (FDP = fibrin degeneration products) ab und löst ihn auf. Des weiteren vermindert es die Gerinnungsfähigkeit des Blutes durch 86 die Zerstörung von sich bildendenden Fibrinfäden und durch Spaltung eine Reihe von Gerinnungsfaktoren. 4.5 Blutgerinnungshemmung In vivo Endothel: Das Endothel selbst sezerniert luminal Adenosin, Prostacyclin (PGI2) und EDRF. Des weiteren wird ein großer Teil der Verminderung der Spontangerinnung gesteuert. Strukturen des antithrombogenen Gefäßendothels: Die Anhaftung wird von Glykolproteinen der endothelialen Glykokalix unterdrückt, dazu gehören: Antithrombin III 2-Makroglobin Ist an Hemmt Faktor II Heparansulfat und Kallikrein gebunden Hemmt Plasmin Hemmt aktivierte Gerinnungsfaktore n (Faktoren II, X, IX, XI, XII) Vermindert die Aktivierung, Bildung und Wirkung von Thrombin Protein C c1-Inaktivator Hemmt die Hemmt die Gerinnungsfaktore Faktoren II und n VII und Va XII Fördert die Hemmt Fibrinolyse Kallikrein (Konzentration von Plasminogen-Aktivoren) Therapeutisch einsetzbare Hemmstoffe: Heparin, Hirudin Steigern die Wirkung von Antithrombin Cumarinderivate31 Vitamin K-Antagonist Blockieren die Synthese der Gerinnungsfaktoren VII, XI, X in der Leber schnelle Blutströmung32 Verdünnung des Blutes Aktive und passive Bewegung der Extremitäten In vitro Auffangen den Blutes mit nicht benutzbaren Oberflächen, z. B. Silikone Niedrige Temperatur Zusatz von gerinnungshemmenden Substanzen: Zusatz Wirkung 31 Durch Cumarin verringert sich in wenigen Wochen der Prothrombingehalt des Blutes, die Gerinnungszeit wird herabgesetzt. Es besteht Verblutungsgefahr aus bei kleinen Verletzungen, weshalb man es als Rattengift verwendet. Die vergifteten Ratten verbluten nach ihren Rangordnungskämpfen. Cumarole entstehen in faulem Süßklee, durch schlecht gelagertes Heu u. ä., wodurch es zu Vergiftungen bei den Haussäugetieren kommen kann. 32 Thromboseprophylaxe 87 Natrium-, Kalium- oder Ammoniumoxalat Natriumcitrat oder EDTA Heparin Cumarinderivate Wegfangen von Ca 2+ Freie Ca2+-Ionen werden gebunden Ca2+-anhängige Schritte werden dadurch blockiert 4.6 Blutgerinnungsfaktoren Fakto r Bezeichnung / Synonym Bildungsort I Fibrinogen Leber Lösliches Eiweiß Vorstufe des Fibrin II Prothrombin Leber (Vitamin Kabhängig) 1-Globulin Proenzym des Thrombin (Protease) III IV Gewebethromb Gewebszellen oplastin Ca2+ V Proaccderin VI - Leber Leber (Vitamin Kabhängig) VII Proconvertin VIII Antihapophiles Globulin (AHG) XI Christmas Faktor Leber (Vitamin Kabhängig) X StewardPower-Faktor Leber (Vitamin Kabhängig) XI XII XIII Eigenschaften / Funktion Plasmathrombo plastinanteceda nt (PTA) HagemannFaktor Fibrinstabilisie render Faktor Phospholipoprotein Aktiv im extrinsischen Gerinnungssystem Notwendig bei der Aktivierung der meisten Gerinnungsfaktoren Lösliches -Globulin Bindet an die Thrombozytenmembran Wird aktiviert durch Faktor II und Ca2+ Bestandteil des Prothrombinaktivators -Globulin Proenzym (Protease) Aktiviert mit Faktor III und Ca2+ den Faktor X im extrinsischen System 2-Globulin Bildet Komplex mit von-Willebrand-Faktor Wird aktiviert durch Faktor II und Ca2+ Profaktor bei der Umwandlung von Faktor X in seine aktive Form 2-Globulin Kontaktsensibles Proenzym (Protease) Aktiviert mit Plättchenfaktor 3, Faktor VIII und Ca2+ den Faktor X im intrinsischen System 1-Globulin Proenzym (Protease) Bestandteil des Prothrombinaktivators -Globulin Kontaktsesnsibles Proenzym (Protease) Aktiviert mit Ca2+ den Faktor IX -Globulin Kontaktsensibles Proenzym (Protease) -Globulin Proenzym (Protease) Transaminase Bewirkt die Fibrinverankerung 5. Abwehr – Immunsystem 88 5.1 Einleitung Abwehrmechanismen Zwischen jedem Individuum und seiner Umwelt gibt es zahlreiche Grenzflächen, die verteidigt werden müssen (Lungenparenchym. Magen-Darm-Trakt, Uro-Genitaltrakt, ...) Die Aufgabe des Organismus vor äußeren Einflüssen zu schützen, hat das Abwehrsystem. Es läßt sich bei höheren Tieren in 2 Teile teilen, zwischen denen zahlreiche Wechselwirkungen bestehen. Abwehrmechanismen Spezifisch Unspezifisch Immunabwehr Resistenz humoral zellulär Immunglobuline (Ig) = Antikörper (Globuline), die von Plasmazellen (BLymphozyten) gebildet werden und in Körperflüssigkeiten vorkommen T-Lymphozyten mit Subpopulationen: Cytotoxische TLymphozyten T-Supressorzellen T-Helferzellen T-Gedächtniszellen Zelullär Makrophagen (Histiozyten) des mononukleären Phagozytosesystems (MPS) Mikrophagen (neutrophile Granulozyten) v. a. gegen Bakterien gerichtet humoral Bestimmte Plasmaproteine C-reaktives Protein Interferone Lysozym Komplementanteile 5.2 Unspezifische Abwehrfunktionen Die unspezifische Abwehr, auch als Resistenz bezeichnet, wird durch allgemeine Fremdkörpereigenschaften einer eingedrungenen bzw. im Körper gebildeten Substanz aktiviert. Unter den unspezifische Abwehrfunktionen versteht man im engen Sinne die Antigenausschaltung durch Phagozytose (Aufnahe und Verdauung von Fremdstoffen in Mikrophagen, Monozyten, Thrombozyten und Leukozyten). Die freigesetzten Fremdstoffe können wieder als Antigene wirken und so die spezielle Immunabwehr aktivieren. Es unterscheidet zwei unterschiedliche Versionen: Unspezifische humorale Abwehr 1. Komplementsystem Es besteht aus ca. 20 verschiedene Plasmaeiweißkörper (-Globuline), die sich gegenseitig regulieren und deren Aktivität durch Regulatorproteine reguliert werden. Die Hauptgruppe besteht aus 9 Plasmaproteinen, die von C 1 - C 9 benannt sind. Es löst Antigen-AntikörperKomplexe auf und zerstört die Membran von Fremdzellen. Weitere Aufgaben des Komplementsystems: Immunadhärenz (Zusammenkleben von Fremdzellen) Opsonierung (Sie lagern sich an die Oberfläche von Fremdkörperzellen an und führen somit zu einer Veränderung der Oberflächenstrukturen Einleitung der Phagozytose bzw. Virolyse durch Zerstörung der Viren) Durch Proteolyse werden die Komplementfaktoren bei ihrer Aktivierung in 2 Fragmente gespalten: 89 a-Fragment (klein): Chemotaxis Permeabilitätssteigerung Entzündungen b-Fragment (groß): Bindung an die Zellmembran, Bildung eines cytolytischen Komplexes, der körperfremde Zellen schädigt und abtötet Aktivierung der nächsten Komponente in der Komplement-Reaktionskette (Aktivierungskomplex) Die Aktivierung des Komplementsystems entweder auf dem klassischen Weg durch AntigenAntikörper-Komplexe und bakterielle Wirkstoffe oder auf dem alternativen Weg durch Properdin. 2. Lysozym 3. C-reaktives Protein 4. Ist ein mukolytisches (schleimhautlösendes) Enzym, v. a. in hohen Konzentrationen Bildung erfolgt in den Granula der Leukozyten und den Alveolarmakrophagen (Lunge), bei Zerfall der Granula erfolgt die Freisetzung Hemmung von Wachstum und Vermehrung von Bakterien und Viren Ist das „Akute-Phase-Protein“, aber nur bei höheren lokalen Konzentrationen wirksam Aktivierung von Komplement Fördert Opsoniation, Koagulation, Präzipitation und Phagozytose von Bakterien Zytokine - Interferone Gehören zu der Gruppe der Glycoproteinen Wirken antiviral und werden hauptsächlich bei Infektion gebildet (in besonderen Zellen von Leber und Milz) Produktion innerhalb von Stunden Interferone -Interferon (Lymphozyten) -Interferon (Fibroblasten) -Interferon (T-Lymphozyten) Wirkung mit ihren Sie reagieren Wirtszellen nicht spezifisch Hemmen die Proliferation der Leukozyten Steigern die cytotoxische Aktivität der Makrophagen (Makrophagenaktivierung) Hemmen die Proteinsynthese Herabsetzung der Vermehrung von Viren Unspezifische zelluläre Abwehr Die unspezifische zelluläre Abwehr bezieht sich auf die Phagozytose von Fremdzellen durch Monozyten und neutrophile Granulozyten. a) Phagozytose Adhäsion: Die Phagozyten werden durch Chemotaxis der Entzündungsorte, z. B. durch Komplementfaktoren, Lymphokine oder Sekreten aus Mastzellen, angelockt. Das zu 90 b) phagozytierende Teilchen muß an der Membran haften, was z. B. bei Bakterien durch die Einwirkung von Opsoninen möglich ist. Aufnahme des Teilchens: Es kommt zur Bildung von Pseudopodien, die die Fremdkörper einschließen (Phagosombildung). Das Teilchen befindet sich im Zellinneren und ist immer noch durch eine Membran abgrenzt. Digestion: Das Phagosom verschmilzt mit den intrazellulären Lysosomen (Phagolysosom). Jetzt kann der Abbau der eingeschlossenen Substanzen beginnen. Antigenprozessierung Darunter versteht man die Bindung von Antigenen über Immunglobuline und dessen zerlegen in kleine Bestandteile. Makrophagen besitzen an ihrer Zellmembran Fc-Rezeptoren, an die sich Ig anhaften, mit deren Hilfe nun die Makrophagen Antigene binden können. Durch lysosomale Enzyme wird das Antigen abgebaut. 5.3 Antigen Definition Das sind Substanzen, die vom Organismus als fremd erkannt werden und dadurch eine spezifische Immunantwort auslösen. Man unterscheidet zwischen Isoantigenen (nur unter gleichartigen Individuen), Heteroantigenen (bei unterschiedlichen Arten) und Autoantigene (körpereigene Moleküle und Zellen werden als körperfremd angesehen, z. B. HLA). Sie setzten sich zusammen aus einem Trägermolekül (Polysaccharide, Proteine, komplexe Lipoproteine) und spezifischen Teilstrukturen, den antigenen Determinaten, die an der Oberfläche der Moleküle sitzen. Sie lösen die Bildung von Antikörpern aus. Antigen-Antikörper-Komplex Histokompatibilitätsantigene (HLA) Auf der Zelloberfläche präsentieren Zellen das Antigen und die HLA. Sie sind v. a. bei der Transplantation von Organen von Bedeutung, weil sie die Abstoßreaktion hervorrufen. HLA-Klasse I Art Bildung Aufgabe Kernartige Zellen und Thrombozyten (infizierte Zellen) CD8-T.Lymphozyten (Killerzellen) Setzt Perforin (Protein) frei, das die Zellmembran löchert. Es kommt zu unkontrollierten Ionenströmen, das zum Platzen der Zelle führen kann. HLA-Klasse II Mononukleäre Phagozyten und BLymphozyten (antigenpräsentierende Zellen) CD4-T.Lymphozyten (Helferzellen) Setzt Interleukin 2 (IL-2) frei und bildet Rezeptoren aus. 5.4 Immunglobuline Immunglobuline sind Antikörper bzw. ein spezifisches Reaktionsprodukt gegen Fremdkörper. Sie werden von B-Lymphozyten und Plasmazellen produziert. Es sind Glykoproteine, die aus 4 Ketten (2 91 schwere33 und 2 leichte34 Ketten) bestehen. Jede Kette besteht wieder aus sog. Domänen, die durch Disulfidbrücken miteinander verbunden sind. Die einzelnen Immunglobuline unterscheiden sich in AS-Sequenzen und Kohlenhydratanteilen. V = variable Region Fab = antigenbindendes Fragment Komplementbindung Fc-Rezeptoren (Fc = kristallisierbares Fragment reagiert mit Makrophagen, Lymphozyten und Komplementfaktoren) C = konstante Region Unterscheidung der Immunglobuline Immungloblin Schwerkettentyp Ig G Ig M Ig A Ig E Ig D Antikörperfunktion Opsonierung Neutralisation, Agglutination Neutralisation Bildung von Mastzellen und basophilen Granulozyten Bestandteil der BLymphozytenmembran Komplementaktivierung klassischer alternativer Weg Weg + + + + + Plazentagä ngigkeit + - - - - - - - Ig G Sie machen 80 % der Immunglobuline im Plasma aus. Das Molekulargewicht ist relativ gering (150 kDa), weshalb sie beim Hund, bei der Katze und beim Menschen die Plazentaschranke passieren können. Es sind wichtige Antikörper der sekundären Immunantwort. Sie spielen eine Rolle bei der Aktivierung des Komplementsystem und der Opsonierung. Antigenen. Es bindet diese und erleichtert somit die Phagozytose. Durch die Größe des Molekül, das die Plazentaschranke passieren kann, bietet es einen Infektionsschutz für Neugeborene. Ig M IgM ist das größte Antikörpermolekül im Blut (900 kDa) und bestehen aus 5 Untereinheiten, die mit Disulfidbrücken miteinander verbunden sind. Es macht 7 - 10 % der Gesamtglobuline aus. Dazu gehören Rheumafaktoren, Kälteagglutinine und Antikörper des ABO-Systems. Sie können Gefäß- und Plazentarschranke nicht passieren. Zu ihren Aufgaben gehören die Neutralisation von Fremdkörpern (abgestorbene Zellen und Bakterien), Agglutination (Verklumpen von Zellen) und die Komplementaktivierung. Ig A Sie liegen als monomere IgA im Plasma und als dimere IgA im Sekret vor. Zu den Aufgaben gehören die lokale Abwehr an Schleimhäuten (Neuralisation), die Komplementaktivierung und dienen als Inschwere Ketten besitzen 4 Domänen CH von den Typen , , , und (über die CTypen der schweren Ketten werden die Ig ihren in Klassen zugeteilt) 34 leichte Ketten besitzen 1 Domäne CL vom Typ oder 33 92 fektionsschutz im Gastrointestinaltrakt. Sie werden mit Speichel-, Bronchial-, Magen- und Darmsekreten abgegeben. Ig E Sie sind mit dem Fc-Fragment an die Oberflächenrezeptoren von basophilen Granulozyten und Mastzellen gebunden. Zum Einsatz kommen sie bei anaphylaktischen und allergischen Reaktionen (Heuschnupfen, Asthma, ...) und lösen dabei eine Freisetzung von vasoaktiven Stoffen (z. B. Histamin) aus, die dann die typischen allergischen Vorgänge hervorrufen. IG D Sie dienen als Bestandteil der B-Lymphozytenmembran und treten in variablen Konzentrationen auf. Ihre Aufgabe ist die Antigenerkennung (kommen nur beim Menschen vor). 5.5 Immunisierung Immunität Fähigkeit Fremdstoffe unschädlich zu machen, ohne daß es zu pathologischen Reaktionen kommt. Eine wiederholte Exposition zu dem gleichen Fremdstoff führt in der Regel zur verstärkten Abwehrreaktionen des Organismus Aktive Immunisierung Konfrontation des Organismus mit geringen Mengen des Antigens (abgetötete, in ihrer Virulenz abgeschwächte oder lebende Antigene). Man nimmt hierbei die Primärreaktion voraus, so daß daraufhin Antikörper gebildet werden. Passive Immunisierung Antiseren werden gespritzt, die die Antikörper eines anderen Individuums enthalten Immuntoleranz Trotz Zugabe eines Antigens findet keine Antikörperbildung statt schutzlose Auslieferung gegen Fremdstoffe. Dies kommt zum Einsatz bei dr Abstoßung von Transplantaten durch gezielte Ausschaltung des Abwehrsystems. 5.6 Immunantwort durch die spezifische Abwehr Die spezifische Immunität ist erworben, wenn Gedächtniszellen nach einer Infektion ausgebildet werden (immunologisches Gedächtnis). Es ist ein Teil des lymphatischen Systems. Immunkompetente Zellen, das sind zur Immunreaktion befähigte Zellen, die Fremdkörper erkennen und spezifische Antikörper und Rezeptoren bilden ( spezifische „zelluläre“ Abwehr), mit gleichzeitiger Bildung von Gedächtniszellen. Dazu gehören die B- und die T-Lymphozyten, sowie die Nullzellen. 93 Humorale Immunantwort Die B-Lymphozyten machen 15 % der Lymphozyten im Blut aus. Die Zellmembran besitzt Ig M und Ig D (spezifische Rezeptoren für Antigene). Bei Antigenkontakt wandeln sich die B- Lymhozyten in Anwesenheit von Zytokininen (Lymphokine aus T-Helferzellen oder Monokine aus Makrophagen) in Plasmazellen und B-Gedächtniszellen um. Zudem werden monoklonale Antikörper (Antikörper der selben Antigenspezifität) gebildet. B-Gedächtniszellen Teilungsfähig mit membranständigen Ig Langlebig Teilen sich bei wiederholtem Antigenkontakt in Plasmazellen und BGedächtniszellen Effektor-/ Plasmazellen Gewebsständig Lebensdauer 2 bis 3 Tage Produktion und Abgabe von Immunglobulinen spezifisch gegen Antigene (humorale Antikörper) Zelluläre Immunreaktion T-Lymphozyten haben einen Anteil von 70 - 80 %. In Ruhe befinden sie sich in den sekundären lymphatischen Organen. T-Rezeptor (Antigenrezeptor) besteht aus 1 antigenspezifischen Glycoprotein (CD4- bzw. CD8-Glykoprotein) und 3 spezifischen Proteinen (T3-Proteinen). Bei Antigenkontakt bilden sich T-Effektorzellen und T-Gedächtniszellen. T-Gedächniszellen Langlebig Kreisen im Blut Bei neuen Antigenkontakt folgt eine Teilung in T-Effektorzellen und TGedächtniszellen T-Effektorzellen CD4-T-Lymphozyten (T4-Helferzellen): Setzten Lymphokinine frei (hormonartige Stoffe Aktivierung von Makrophagen und Stammzellen zur Produktion von BLymphozyten Chemotaxis CD8-T-Lymphozyten (T-Killerzellen): Zerstören Antigenzellen durch Lyse der Membran Kopplung erfolgt über Antikörper und den Fc-Faktoren der Ig CD8-T-Lymphozyten (T-Supressorzellen): Hemmen die Aktivität von B- und TLymphozyten (Hemmung der Antikörperproduktion) Verhindern überschießende Immunantwort durch die Freisetzung von verschiedenen Lymphokininen Nullzellen 10 % der lymphozytenähnlichen Zellen Ins Blut verirrte hämotopoetische Vorläuferzellen Killerzellen (zerstören mit Ig G markierte Zellen antigenabhängig, aber antigenunspezifisch) 94 Natürlichen Killerzellen (können antigen- und antikörperunabhängig Zellen töten (z. B. Tumorzellen) 5.7 Immunreaktion Die Immunreaktion ist eine Kombination aus humoralen und zellulären Mechanismen. Beim 1. Antigenkontakt läuft die sog. Primärreaktion ab. Es kommt zur Bildung von T- und B-Gedächtniszellen. Jeder weitere Kontakt löst die sehr viel schnelleren und stärkeren Sekundärreaktionen aus, da die Gedächtniszellen sofort mit der Antikörperproduktion beginnen können. Spezifische humorale Immunantwort läuft über die B-Lymphozyten Immunreaktion vom Soforttyp Spezifische zelluläre Immunantwort läuft über die T-Lymphozyten (48 h) Immunreaktion vom verzögerten Typ 5.8 Abwehrreaktionen Neutralisation von Antigenen durch Antikörper (Ig G und Ig M) Aktivierung von Mastzellen: Antigene werden von Mastzellen Ig E gebunden Freisetzung von Histamin, Serotonin und Eikosanoiden Opsonierung und Phagozytose durch Makrophagen: Bindung des Antigen-Antikörperkomplexes über Fc-Rezeptoren und C3-Rezeptoren, Chemotaxis durch das Komplement) Sensibilisierung von T-Lymphozyten: Erkennen der Antigendeterminante und HLA des antigenprozessierenden neutrophilen Granulozyten Differenzierung zu T-Helfer-, T-Killer-, TSuppressor- oder T-Gedächtniszellen 5.9 Allergien Änderung der Reaktionsfähigkeit des Immunsystems gegenüber körperfremden, eigentlich unschädlichen Substanzen Überempfindlichkeitsreaktionen An der Allergie beteiligte Substanzen Mediatorsubstanzen Histamin Leukotriene (C4, D4, E4) Prostaglandine (D2, E2) Thromboxan (A2) Kallikrein PAF (Plättchenaktivierender Faktor) Serotonin Lymphokine/ Kinine Typen a) Frühtyp, Soforttyp (humorale Allergie) 95 Mittler, hormonähnliche Wirkstoffe Gewebshormone Neurotransmitter biogene Amine Angitensinogen und Angitensine Spaltprodukte des Komplements lysosomale Enzyme Heparin Leukotriene b) Anaphylaktische Form: Entzündungsmediatoren werden von Ig E beladenen Mastzellen und basophilen Granulozyten freigegeben. Diese fördern die Kapillarpermeabilität, so daß es zu einer vermehrten Durchblutung von Haut und Schleimhäuten kommt. Quaddelbildung, Bronchospasmen und eine gesteigerte Sekretion von endogenen Drüsen können auch vorkommen Zytotoxische Form: nach Ablagerung von Fremdeiweiß kommt es durch Ig G und Ig M zur Aktivierung des Komplement Zerstörung eigener Zellen, z. B. Hämolyse bei der Transfusion gruppenunverträglichen Blutes Immunkomplex-Form: z. B. Anlagerung an die Gefäßwand Spättyp, verzögerter Typ (zelluläre Allergie) Die Reaktion erfolgt erst nach mehreren Tagen. Sie wird ausgelöst durch aktivierte TLymphozyten (Infiltration und Entzündungsreaktionen), z. B. Kontaktallergie, Abstoßreaktionen gegenüber Transplantaten 6. Blutgruppen 6.1 Begriffsdefinitionen Agglutinogene: spezifische Glykolipide mit Antigeneigenschaften an der Zellmembran von Erythrozyten Agglutinine: im Blutplasma gelöste Antikörper gegen Agglutinogene (Ig M) gehören zur Proteinfraktion Antigen-Antikörper-Reaktion: Antikörper bilden Brücken zwischen Erythrozyten Agglutination 6.2 AB0-System Die Blutgruppenzugehörigkeit richtet sich nach den Agglutinogenen des Trägers. Sie sind abhängig von der Art der endständigen Zucker (unterschiedlich aufgebaute Oligosaccharidreste) und bestimmter membrangebundener Glykoproteinen und Sphingolipiden. Die Erythrozyten sind die wichtigsten Träger der Blutgruppen. Es sind Antikörper gegen die Antigene, die die eigenen Erythrozyten nicht besitzen. Antikörper des Ig M-Typs mit 10 Bindungsstellen führen zur Agglutination. Sie werden erst in den ersten Lebensjahren erworben. Blutgruppe 0 A B AB Genotyp 00 A0 oder AA B0 oder BB AB Agglutinogene auf der Zelloberfläche H A B A und B Agglutinine im Seruma Anti-A und Anti-B Anti-B Anti-A - 6.3 Rhesus-System Regt man Kaninchen durch Injektion von Rhesusaffenerythrozyten zur Antikörperbildung an, so ruft dies Serum bei vielen Menschen eine Agglutination der Erythrozyten hervor. Dies Blut bezeichnet man als Rhesus-positiv (Rh). Findet keine Erythrozytenaggregation statt, sind die entsprechenden Personen Rhesus-negativ (rh). Die Rh-Eigenschaft der Erythrozyten wird durch mehrere Antigene (=Partialantigene) bestimmt. Sie werden mit den Buchstaben D, C, E, c und e benannt, wobei D die stärkste antigene Wirksamkeit besitzt. 96 Blut mit D-Eigenschaft D Blut ohne D-Eigenschaft d (d ist rezessiv) Rh-positiv (Rh) rh-negativ (85 %) (15 %) Agglutinine sind nicht im Serum enthalten, sondern müssen erst nach Antigenkontakt induziert werden. Wird nun Rh-positives Blut einem rh-negativen Empfänger infundiert, so bildet der Empfänger Antikörper gegen die fremden Erythrozyten. Erst bei der zweiten Infusion werden die Rhpositiven Erythrozyten agglutiniert. Antikörper des Rh-Systems gehören zu den inkompletten Ig G Antikörpern und können die Plazentaschranke passieren. Dies führt zu Schwierigkeiten bei der Schwangerschaft einer rh-negativen Mutter mit einen Rh-positiven Kind. Am Ende der Schwangerschaft können Erythrozyten des Kindes in den Blutkreislauf der Mutter gelangen, die daraufhin Antikörper gegen Rh-positiven Erythrozyten bildet. Dies geschieht jedoch so langsam, daß bei der 1. Schwangerschaft und deren Geburt keine Schwierigkeiten gibt. Bei der 2. Schwangerschaft können die Agglutinine die Plazentaschranke durchqueren und in das Blut des Kindes gelangen. Sie zerstören die kindlichen Erythrozyten, was zu schweren Schäden und zum Tod führen kann. Durch die Gabe von Anti-D--Globulinen kann die Antikörperbildung im Körper der Mutter verhindert werden, da die Rh-positiven Erythrozyten zerstört werden. 6.4 Blutgruppen der Tiere Es gibt eine Vielzahl von Blutgruppen, die mit Buchstaben bezeichnet werden. Dabei muß die Blutgruppe A beim Rind nicht mit der Blutgruppe A beim Schwein übereinstimmen. a) Bluttransfusion Ersttransfusion: bei Rind und Schaf muß keine Kreuzprobe gemacht werden, bei Hund, Schwein und Pferd muß eine Kreuzprobe gemacht werden, da die Gefahr einer Unverträglichkeitsreaktion gegeben ist Zweittransfusion: immer Kreuzprobe bzw. biologische Vorprobe machen b) Kreuzprobe Majortest: Spendererythrozyten + Empfängerserum darf auf keinen Fall eine Reaktion zeigen Minortest: Spenderserum + Empfängerserum Beide Tests müssen negativ ausfallen!!! c) Biologische Vorprobe Wird im Stall gemacht, wenn keine geeigneten Geräte und Instrumente für die Kreuzprobe vorhanden sind. Man zapft (beim Rind) ca. 2 l Blut vom Spender ab. Davon infundiert man 100 ml dem Empfänger (Hund: 10 ml). Man wartet 10 Minuten und währenddessen infundiert man physiologische NaCl-Lösung, um die Kanüle frei zu halten. Zeigen sich nach dieser Zeit keine Störungen (Unruhe, Schweiß, ...), kann das restliche Blut infundiert werden. 97 HERZ & KREISLAUF 1. Herz 1.1 Herzstruktur Allgemeiner Aufbau Das Herz besteht aus 2 Vorhöfen (Atria) und 2 Kammern (Ventrikel), die durch ein Septum in eine rechte und eine linke Herzhälfte unterteilt sind. Klappen des Herzens Zwischen dem Vorhof und der Kammer befindlichen Segelklappen (Semilunarklappen) werden als AV-Klappen (Atrioventrikularklappen) bezeichnet. Links: als Bicuspitalis oder Mitralklappe Rechts: als Tricuspitalis Zwischen der Kammer und den ableitenden Arterien befindlichen Taschenklappen heißen: Linke Kammer Aorta: Aortenklappe Rechte Kammer Lunge: Pulmonarklappe Zellen des Herzens Zellen des Erregungsbildungs- und leitungssystems: Hier erfolgt die Bildung der Impulse und über diese Zellen wird die Erregung auch weitergeleitet. Arbeitsmyocard: Das sind die Zellen der Arbeitsmuskulatur von Vorhöfen und Kammern, die die Impulse mit einer Kontraktion beantworten und die Pumparbeit leisten. Die Zellen des Reizbildungs- und Erregungsleitungssystems besitzen wenig Mitochondrien und Myofibrillen, so daß sie nur eine spärliche Querstreifung aufweisen. Funktionselemente des Herzens sind die Herzmuskelfasern, eine Kette hintereinander geschalteter Herzmuskelzellen, die von einer gemeinsamen Hülle umgeben sind (Perimembran). Alle Herzmuskelzellen sind durch gap junctions miteinander gekoppelt und bilden somit ein funktionelles Synzytium. 98 1.2 Erregungsbildung und Erregungsleitung im Herzen Erregungsbildung Die Reizbildung erfolgt im Gegensatz zum Skelettmuskel im Organ selbst und ist rein auf das Erregungsbildungs- und das leitungssystems beschränkt. Die Fasern können auch ohne äußere Depolarisation spontan Aktionspotentiale generieren, was als Autorhythmie bezeichnet wird. Herzmuskelfasern besitzen ein Ruhemembranpotential und reagieren auf überschwellige Reizung mit einem Aktionspotential. Sie sind in der Lage ein Aktionspotential ohne Abschwächung weiter zu leiten (Verbindung durch gap junctions = funktionelles Synzytium). Die Erregungsbildung erfolgt in sog. Schrittmacherzellen. Grundlage dafür ist die Abnahme der K+Leitfähigkeit während der systolischen Depolarisation bis zu einer bestimmten Schwelle, dann öffnen sich spannungsabhängige Ca2+- und Na+-Kanäle. Es kommt zu einem Aktionspotential. Alles-oder-nichts-Gesetz Das Herz antwortet auf einen Reiz mit der Erregung aller Fasern und deren Kontraktionen oder es reagiert gar nicht, d. h. jeder Reiz irgendwo im Ventrikel führt zur vollständigen Kontraktion oder zu keiner. Erregungsausbreitung Primärer Schrittmacher ist der Sinusknoten (60 - 80/ min.). Dieser liegt im rechten Vorhof nahe der Einmündung der V. cava cranialis. Vom Sinusknoten aus geht die Erregung weiter auf die Arbeitsmuskulatur beider Vorhöfe. Die Überleitung auf die Kammern erfolgt nur über den Atrioventrikularknoten (40 - 60/min.), da Vorhöfe und Kammern mit Bindegewebsringen elektrisch voneinander isoliert sind. Die Erregung der Kammern erfolgt mit einer geringen Verzögerung, damit die vollständige Vorhoferregung ablaufen kann. Über die Hisbündel, die mit ihrem rechten und linken Bündelschenkel (Tawara-Schenkel) und den Endaufzweigungen (Purkinje-Fäden), wird die Erregung schnell (2 m/s) zu den verschiedenen Regionen der Herzkammern weitergeleitet, so daß diese gleichzeitig oder kurz nacheinander von der Erregung erfaßt werden. Die weitere Erregung wird über die Kammermuskulatur, etwas langsamer (1 m/s), weitergeleitet. Sinusknoten Arbeitsmuskulatur der Vorhöfe Atrioventrikularknoten Hisbündel mit rechtem und linken Schenkel (Tawara-Schenkel) Purkinjesche Fasern Kammermuskulatur Auch alle anderen Teile der Erregungsleitungssystems besitzen die Fähigkeit der automatischen Erregungsbildung. Bei Ausfall des Sinusknotens erfolgt die Erregungsbildung in nachgeordneten Automatiezentren, wobei aber die Eigenfrequenz mit der Entfernung zum Sinusknoten sinkt. Hier entstehen die Ersatzrhythmen. Primäre Schrittmacher ist der Sinusknoten mit der höchsten Entladungsfrequenz Sekundäres Erregungsbildungszentrum ist der AV-Knoten Tertiäres Zentrum über nimmt die Funktion bei einem totalen Herzblock. Hierbei schlagen die Vorhöfe und die Kammern unabhängig voneinander. 1.3 Herzmuskelaktionspotential 99 Ein Aktionspotential hat eine Dauer von 200 - 400 ms und ist damit mehr als 100 x länger als das der Skelettmuskulatur. Während des Aktionspotentials und der folgenden Repolarisation (bis - 45 mV) ist die Muskelfaser absolut refraktär. Während dieser Zeit ist das Na+-Leitungssystem inaktiviert und zwar so lange, bis das Membranpotential wieder einen Wert unter -45 mV erreicht hat. Eine Tetanie ist nicht möglich. Es bildet einen Schutz vor Dauererregung. Die Form des Aktionspotential teilt man in zwei Phasen ein: Depolarisationsphase (Na+-Leitfähigkeit): Sie hat eine Dauer von 1 bis 2 ms. Es beginnt, ausgehend von einem Ruhepotential von ungefähr -90 mV, mit einer raschen Depolarisation (Aufstrich durch Na+-Einstrom) über den Nullpunkt auf + 30 mV (overschoot). Der gesamte Aufstrich dauert nur wenige Millisekunden. Es bildet sich eine initiale Spitze, bei der der Na +Einstrom zum erliegen kommt. Repolarisation (K+-Leitfähigkeit): Es schließt sich an die Repolarisationsphase an.. Es besteht aus drei Abschnitten: Kurze Repolarisationsphase durch K+-Ausstrom. Das Muskelpotential nähert sich O, wobei es die zweite Hälfte der initialen Spitze bildet. Langandauernde Plateauphase durch Ca2+-Einstrom, dabei sinkt die K+-Leitfähigkeit (der Ca2+-Einstrom ist wesentlich für die elektromechanische Kopplung und damit für die mechanische Kontraktion des Herzmuskels verantwortlich) Abschließende Repolarisation zum Ruhepotential. Dabei steigt die K+-Leitfähigkeit wieder. Langsamer Ca2+-Einwärtsstrom durch Ca2+-Kanäle während des Aktionspotentials, dient der Verlängerung des Aktionspotentials und zur Auslösung der Kontraktion, sowie die Steuerung der Kontraktionskraft. Ionenleitfähigkeit und Ionenströme 1. Ruhepotential Vorwiegend ein K+-Potential spezifische K+-Leitfähigkeit der Membran (K+-Gleichgewichtspotential) 2. Aufstrichphase: Entsteht durch den sog. schnellen Na+-Einwärtsstrom durch kurzdauernde Erhöhung der Na+-Leitfähigkeit 3. Plateau: 4. Repolarisation: Verzögert einsetzende, langsam abklingende Öffnung von Ca2+-Kanälen langsamer, depolarisierender Ca2+-Einstrom Verminderung der K+-Leitfähigkeit infolge Depolarisation (Gleichrichterwirkung) reduziert den repolarisierenen K+-Ausstrom Verzögerte Aktivierung spezieller K+-Kanäle Abnahme der Ca2+-Leitfähigkeit Wiederanstieg der K+-Leitfähigkeit Refraktärzeit In bestimmten Phasen des Aktionspotentials ist die Ansprechbarkeit auf Reize aufgehoben oder vermindert. Das ist bei der Refraktärzeit der Fall. Man unterscheidet zwischen Absoluter Refraktärzeit Dauer vom Ende der Plateauphase bis - 45 mV 100 Relativer Refraktärzeit Während der Repolarisation (< - 40 mV) Beim Einpendeln des Membranpotentials ist Hier ist keine Erregung möglich eine Erregung durch einen Reiz möglich, dieser muß allerdings über das normal erforderliche hinausgehen. Die Ursache dafür ist die Inaktivierung der Na+-Kanäle bei andauernder Depolarisation 1.4 Elektromechanische Kopplung am Myokard Elektromechanische Kopplung Unter der elektromechanischen Kopplung versteht man den Übergang von elektrischer Reizung zur mechanischen Antwort. Auch im Herzmuskel löst das Aktionspotential eine neue Kontraktion aus (analog zum Skelettmuskel). Ein Aktionspotential streicht über die äußere Membran bin hinein in die T-Tubuli. Dort ruft es eine Freisetzung von Ca2+ aus dem sarkoplasmatischen Retikulum hervor. Der Anstieg der cytosolischen Ca2+-Konzentration vermittelt die elektromechanische Kopplung. Calcium wird an Troponin gebunden. Die Verbindung führt zur Aufhebung der Hemmwirkung des Tropomyosins auf die Interaktion der Aktin + Myosinfilamente. Zusätzlich wird ein transmuraler Ca2+-Einstrom für den normalen Kontraktionsablauf notwenig. Der Einstrom erfolgt entlang des hohen elektrochemischen Gradienten. Das Aktionspotential verknüpft 2 Aufgaben des Ca2+-Einstroms für die Kontraktionen: Triggereffekt: Auslösung der Kontraktion durch Ca2+-induzierte, getiggerte Freisetzung von Ca2+ aus den intrazellulären Depots (sarkoplasmatisches Retikulum, SR oder Mitochondrien) Auffülleffekt: Wiederauffüllung der intrazellulären Speicher (SR und Mitochondrien), damit Ca 2+ für die nächste Kontraktion bereitgestellt werden kann Die Auffüllung der Calciumspeicher erfolgt durch: ATP-getriebene Ca2+-Pumpe im Sarkolemm, die das Calcium wird in die terminalen Zisternen und Mitochondrien pumpt Ca2+-Ausstrom aus dem Myoplasma erfolgt mit Hilfe eines Na+-Ca2+-Austauschers im Sarkolemm der Zellmembran. Das Natrium wird wieder über die Na+-K+-ATPase hinausgepumpt Funktionsträger35 Transversales Tubulussystem (T-System): Einstülpung der Membranoberfläche, leitet die Erregung schnell in das Zellinnere weiter (= deutlich entwickelt!) Sarkoplasmatisches Retikulum (longitudinales System): intrazelluläre Calciumspeicher (= schwächer ausgebildet!) Mechanismen der Kontraktionsbeeinflussung Eine Beeinflussung der Kontraktion ist nur über den Erregungsvorgang bzw. über direkten Eingriff in die elektromechanischen Kopplungsvorgänge möglich. Dazu gibt es verschiedene Möglichkeiten: 35 intensive Wechselwirkung zwischen den inrazellulären Calciumspeichern und dem Außenmedium. 101 Über Veränderungen der AP-Dauer (Ca2+-Einstrom) Durch K+-Erhöhung und Acetylcholin (Verkürzung der AP-Dauer und Abschwächung der Kontraktionskraft) AP-Verlängerung durch Abkühlung (Kontraktionsverstärkung) Frequenz-Isotropie (Vermehrungen der Zahl der Erregungen in einer Zeiteinheit) Einfluß des Parasympathicus: Acetylcholin Kaliumleitfähigkeit , Calciumleitfähigkeit Dämpfung der Herztätigkeit Sinusknoten: Spontandepolarisation flacher Dauer länger als ein AP Herzfrequenz Vorhöfe: kürzeres Aktionspotential schneller Ruhemembranpotentialwert AV-Knoten: Depolarisationsgeschwindigekit Einfluß über den Sympathikus: Adrenalin und Noradrenalin Ca2+-Leitfähigkeit , cAMP Herzfrequenz Steilere Standarddepolarisation schnellere Abfolge Erregungsleitung Treppenphänomen: stufenweises Ansteigen der Kontraktionsamplitude nach vorrübergehendem Stillstand auch abhängig von der Wiederaufnahme von Ca2+ in die intrazellulären Speicher Verminderte Aufnahme von Ca2+ in die Zelle, z. B. hervorgerufen durch Pharmaka, hemmen den Ca2+-Einstrom während des Aktionspotentials (Verapalmin, Nifedipin, Diltiazem) = Kalziumantagonisten Steigerung durch Stoffe, die den Ca2+-Einstrom während des Aktionspotential verstärken: Adrenalin und Noradrenalin sowie Herzglykoside (Digitalis, Strophantin), sie hemmen die Na+-K+-ATPase Anstieg des intrazellulären Na+-Konzentration verminderter Austausch von intrazellulärem Ca2+ durch extrazelluläres Na+ Anreicherung von Ca2+ im Inneren der Zelle 1.5 Chonotrope, dromotrope und inotrope Einflüsse Definitionen Chonotropie: Frequenz der Impulsbildung des Schrittmachers mit direkter Auswirkung auf die Schlagfrequenz des Herzens. Sie wird beeinflußt durch die Wirkung des Sympathikus und des Parasympathicus. (+ = Frequenz / = Frequenz ) Inotropie: Kontraktilität des Herzens (systolische Kraftentwicklung), wird hauptsächlich über den Sympathikus gesteuert (+ = Kontraktionsstärke / = Kontraktionsstärke ) Dromotropie: Geschwindigkeit der atrioventrikulären Übertragung, Sympathikus und Parasympathicus modulieren die Herztätigkeit über Änderung des Präpotentials und über das veränderte maximale diastolische Potential (+ = Geschwindigkeit / = Geschwindigkeit ) Chonotrope Wirkung36 a) Positive chonotrope Wirkung Der Sympathikus hat einen Einfluß auf das Herz über postganglionäre Anteile der Nn. cardiaci, die auf die verschiedenen Anteile des Herzens wirken und die lokale Freisetzung von Katecholaminen aus dem NNM (mehr Adrenalin als Noradrenalin), die im Blut zirkulieren. Ebenso funktioniert auch die direkte Applikation von Adrenalin. Es führt zu einer Frequenzsteigerung, d.h. die Steilheit der diastolischen Depolarisation steigt an, wodurch das Schwellenwertpotential früher erreicht wird. 36 Bei Ruhebedingungen heben beide ihren Einfluß auf das Herz auf. Es herrscht ein Sympathicotonus und ein Vagotonus gleichzeitig. 102 b) Negative chonotrope Wirkung Der Parasympathicus hat Einfluß über die den N. vagus (Sinusknoten und Vorhöfe), wobei der linke Anteil des Vagus auch auf den AV-Knoten wirkt. Der Transmitter ist das Acetylcholin. Man erreicht die gleiche Wirkung auch über die direkte Applikation von Acetylcholin. Es führt zu einem Frequenzabfall, d. h. die Steilheit der diastolischen Depolarisation fällt ab, wodurch das Schwellenwertpotential erst nach längeren Intervallen erreicht wird Inotrope Wirkung a) Positive inotrope Wirkung Der Sympathikuseinfluß führt zu einer Steigerung des Kontraktionskraft von Vorhof und Kammermyokard. Es ist die Grundlage des Schlagvolumens bei gesteigerter Herztätigkeit. Der Kontraktionsablauf hat dadurch eine steilere Anstiegsflanke, eine verkürzte Anstiegsdauer und eine beschleunigte Erschlaffung (Ca2+LF ); das Aktionspotential bleibt aber unverändert. b) Negative inotrope Wirkung Der Vaguseinfluß beschränkt sich auf Kontraktionsstärke des Vorhofmyocards, diese sinkt bei Warmblütern und die Verkürzung der AP-Dauer, die durch den Vagus ansteigt (K+LF ). Eine Abschwächung der Herzkraft ist nicht möglich. Dromotrope Wirkung a) Positive dromotrope Wirkung Der Sympathikus beschleunigt die atrioventriculäre Überleitung, verkürzt die Pause zwischen Vorhof- und Kammeraktion und hat eine schnellere Aufstiegsphase. b) Negative dromotrope Wirkung Der Vaguseinfluß führt zu einer verlangsamten oder zu einer vollständigen Blockade der atrioventrikulären Leistung, wodurch ein vorrübergehender totaler AV-Block entstehen kann. Zusätzlich kommt es zu einer Abflachung der Aufstiegsphase durch K +LF (stabilisiert das Ruhemembranpotential). Generelle Wirkung von Sympathikus und Parasympathikus auf die Herztätigkeit Parasympathikus Acetylcholin Sympathikus Adrenalin und Noradrenalin 103 K+-Leitfähigkeit führt zu einer Hyperpolarisation bzw. zu einer verminderten Erregbarkeit des Membran Ca2+-Leitfähigkeit und ist nur an der negativen Wirkung muskarinerge Rezeptoren cAMP Ca2+-Leitfähigkeit , v. a. in der Plateaupause des Aktionspotentials, das die elektomechanische Kopplung intensiviert. Es kommt zu einer Verkürzung der Kontraktionsdauer, da bei einer höheren Frequenz, weniger Zeit zur Verfügung steht. Die Stimulation erfolgt über Ca2+-Pumpen in den Muskelzellen, die das Calcium in die Speicher zurückpumpen. 1-Rezeptoren cAMP Begriffe Herzdynamik: Anpassung des Herzens an den Bedarf Herzminutenvolumen: Schlagvolumen Frequenz/Minute 1.6 Elektrokardiogramm (EKG) Ein Elektrokardiogramm entsteht durch die Erregungsvorgänge im Herzen. Sie werden in Form von Zacken und Wellen registriert. Grundlage ist die Weiterleitung der elektrischen Ereignisse über Volumenleiter der Körperflüssigkeiten bis an die Körperoberfläche. Grundlagen der EKG-Registrierung Bei der Ausbreitung und Rückbildung der Erregungen des Herzens entstehen Stromschleifen, die sich bis zur Körperoberfläche ausbreiten. Eine Erregung führt zu einem elektrischen Dipol im extrazellulären Raum, d. h. erregt (-) unerregt (). Das EKG ist die Aufzeichnung von Potentialdifferenzen zwischen definierten Meßpunkten in Abhängigkeit von der Zeit. Es ist ein Ausdruck der Herzerregung. Bei der Ausbreitung und Rückbildung der Erregung des Herzens entsteht ein elektrisches Feld (Veränderungen in Größe und Richtung) dessen Potentialdifferenzen zwischen verschiedenen Stellen der Körperoberfläche gemessen werden können. Für die Interpretation sind folgende Überlegungen hilfreich: Zu jedem Zeitpunkt des Ausschlags im EKG besteht die Herzmuskulatur aus zwei Anteilen, einem aktivierten (depolarisierten) und einem inaktivierten Anteil. Hierdurch entsteht eine Potentialdifferenz, die von den Meßelektroden erfaßt werden kann. Elektrische Abläufe an den Vorhöfen und an den Ventrikeln werden getrennt voneinander registriert, so als ob eine Isolationsschicht dazwischen existieren würde. Anatomische Grundlage ist der Anulus fibrosus. Der einzige elektrische Übergangspunkt ist der Atrioventrikularknoten (AVKnoten). Es können keine Potentialdifferenzen zwischen Vorhöfen und Kammern entstehen! Die extrazelluläre Potentialdifferenz, die vom EKG erfaßt wird, ist als Dipol (zwei gleichgroße entgegengesetzte Ladungen im bestimmten Abstand) oder als Vektor (Richtung und Größe der Potentialdifferenz darstellbar. Hier ist die Richtung des Vekors definitionsgemäß von minus nach plus dargestellt. An jeder erregten Herzmuskelfaser entsteht ein Einzelvektor, dessen Richtung und Größe sich während der Erregung dauernd ändern. Alle Einzelvektoren summieren sich, so daß der resultierende Vektor der Summations- bzw. Integralvekor ist. Form des EKG 104 Man unterscheidet einen Vorhof- und einen Kammeranteil. Der Vorhofteil beginnt mit der P-Welle und setzt sich mit der PQ-Strecke fort. Die Erregungsausbreitung in den Vorhöfen fällt mit der Anfangsschwankung des Kammerteils zusammen (PQ-Intervall ist die Überleitzeit zu QRS) Vorhofteil: P-Welle: Erregungsausbreitung über die Vorhöfe (von Basis an die Spitze) PQ-Strecke: vollständige Vorhoferregung Das PQ-Intervall ist der Zeitraum vom Beginn der Vorhoferregung bis zum Beginn der Kammererregung. Normalerweise ist diese Strecke kürzer als die QRS-Strecke. Verlängerung bedeutet eine Störung der Erregungsweiterleitung im Bereich des AV-Knotens oder des His-Bündels. Der Kammerteil beginnt an Q und Endet mit T. Dazwischen liegt QRS-Gruppe für die Erregungsausbreitung über beide Kammern, die T-Welle aus Ausdruck der ventrikulären Erregungsrückbildung und dazwischen liegt die ST-Strecke, die die Totalerregung beider Ventrikel darstellt. Kammerteil: QRS-Gruppe: Erregungsausbreitung über die Kammern mit Q = herzbasiswärts, R = herzspitzenwärts und S = herzbasiswärts ST-Strecke: vollständige Kammererregung T-Welle: Erregungsrückbildung Eine Verlängerung der QRS-Gruppe über 0,12 s bedeutet eine Störung der intraventrikulären Erregungsausbreitung. Das QT-Intervall ist frequenzabhängig. Bei steigender Herzfrequenz, fällt die QTDauer. Das RR-Intervall stellt die Dauer einer Herzperiode dar. Meßbar sind Frequenz Erregungsursprung Impulsleitung Erregungsrückbildung Erregungsrhythmus Herzlage EKG-Interpretation Potentialdifferenzen in den einzelnen Herzmuskelfasern werden als elektrische Dipole betrachtet, die sich zu jedem Zeitpunkt der Erregung zu einem Summendipol (Integralvektor) des Herzens addieren. Zu jedem Zeitpunkt der Herzerregung summieren sich die Dipolvektoren zu einem räumlichen Integralvektor, dessen Größe und Richtung die Form der EKG-Kurve bestimmt. Die Veränderungen von Größe und Richtung des Integralvektors im Verlauf eines Herzzyklus lassen sich in einer Hüllkurve = Vektorschleife darstellen. Sie besteht aus 3 EKG-analogen Komponenten (P-, QRS- und T-Schleife). Die Größe und Richtung der EKG-Ausschläge ergibt sich aus der Größe des entsprechenden Integralvektors. 105 Ableitungsformen Es gibt Extremitäten- und Brustwandableitungen. Die Kurvenform der gebräuchlichen Ableitungen entspricht der Projektionen der dreidimensionalen Vektorschleife aus verschiedenen Angriffsrichtungen. Dabei unterschiedet man nach dem Ort der Ableitungen (Extremitäten oder Brustwand) bzw. nach der Art und Weise der Ableitungen (unipolar oder bipolar). So ergeben sich verschiedene Ableitungsformen: Extremitätenableitungen Bipolar (Standardableitungen nach Einthoven mit I, II, III) Unipolar (Ableitungen nach Goldberg mit aVR, aVL, aVF) Brustwandableitungen Bipolar (kleines Brustwanddreieck nach Nehb mit D, A, I) Unipolar (Ableitung nach Wilson mit V1 bis V6) Extremitätenableitungen nach Einthoven37 Einthovendreieck: Bei einer bipolaren Extremitätenableitung nach Einthoven wirken Arme und Beine wie verlängerte Elektroden. Die eigentlichen Ableitungsorte liegen am Rumpf. Die Polung ist immer von - +). Bei diesem verfahren wird 3 x die Spannung gemessen und anschließen verrechnet. Rechter Arm - linker Arm (I) Rechter Arm - linkes Bein (II) Linker Arm - linkes Bein (III) Lagetypen: frontale QRS-Schleife = elektrische Herzachse = längliche Form, Richtung des großen Integralvektors elektronische Herzachse. Ist die Erregungsausbreitung normal, so stimmt diese annähernd mit der anatomischen Längslage des Herzens überein. Eine Rechtsherzhypertrophie zeigt der Vektor mehr nach rechts, bei einer Linksherzhypertrophie zeigt sie mehr nach links. Der Bezugspunkt ist die Horizontallinie bei 0°. Eine Winkelabweichung von der Horizontalebene bestimmt den Lagetyp: Linkstyp: (- 30 ° < < 0 °) Horizontaltyp: (0 ° < < 30 °) Indifferenztyp: (30 ° < < 60 °) Steiltyp: (60 ° < < 90 °) Rechtstyp: (90 ° < 120 °) Extremitätenableitung nach Goldberg Elektroden von je zwei Extremitäten sind zusammen geschaltet und dienen als Bezugselektrode zum dritten. Es entsteht dadurch ein größeres Potential, das als augmented voltage, aV bezeichnet wird. Beispielsweise bedeutet die Ableitung aVR nach der Goldberger Spannungsmessung, daß zwischen dem rechten Arm und einer Bezugselektode, die aus der die Spannungsableitung zwischen dem linken Arm und dem linken Bein entsteht, eine Spannung gemessen wird. Die anderen Ableitungen verhalten sich dementsprechend. So wird die Ableitungslinie, auf die sich die Vektorschleife projiziert zur Winkelhalbierenden zwischen der Ableitung I und II im Einthofendreieck. (Das Einthovsche Dreieck wird dabei um 30° gedreht) 37 Linker Arm + linkes Bein gegen den rechten Arm (aVR) Rechter Arm + linkes Bein gegen den linken Arm (aVL) Rechter Arm + linker Arm gegen das linke Bein (aVF) Aus Extremitätenableitungen kann man Rückschlüsse auf die Lage des Herzens ziehen. 106 Brustwandableitung nach Nehb Nach dieser Art der Brustwandableitung wird hauptsächlich die Hinterseite des Herzens untersucht. Brustwandableitung nach Wilson (unipolar) Die Brustkorbableitung gibt Auskunft über die horizontale Vektorprojektion. Durch die Zusammenschaltung der drei Extremitätenkabel über Widerstände indifferente Bezugselektrode, gegen die definierte Orte auf die Brustwand in Herzhöhe abgeleitet werden. Der Vektorverlauf ist von anterior nach posterior. Es wird damit v. a. die Vorderseite des Herzens begutachtet. Brustkorb - 3 zusammengesetzte Extremitätenableitungen Was kann man aus einem EKG ersehen? Herzlage: Über die Extremitätenableitungen kann man Rückschlüsse auf die anatomische Lage des Herzen ziehen. Rhythmusstörungen: Man kann die Art und den Ursprung der Rhythmusstörung (Sinusarrhythmie, ...) unterscheiden. Leistungsstörung: Differenzierung nach der Grad und der Lokalisation (Leistungsverzögerung oder Herzblock) Frequenz: Bradykardie (unter 60 /min.), normale Ruhefrequenz (60 - 90/ min.) oder Tachykardie (über 90/ min.) Ursprung der Erregung: Es gibt eine Unterscheidungsmöglichkeit, ob Erregungen im Sinusknoten, in den Vorhöfen, in AV-Knoten38 oder im rechten bzw. linken Ventrikel39 entstehen. extrakardiale Einflüsse: Anhalspunkte für die Einflüsse vegetativer Art, Stoffwechselstörungen, hormonelle Störungen, Elektrolytveränderungen, Vergiftungen, Arzneimittel, ... primärkardiale Störungen: Hinweis auf ungenügende Koronardurchblutung, Entzündungen, Traumen, angeborene oder erworbene Herzfehler Myocardinfarkt: Unterbrechung der Koronardurchblutung in einem umschriebenen Bezirk Es liefert Anhaltspunkte über die Lokalisation, Ausdehnung und Verlauf. Sinusrhythmus: Erregungsursprung im Sinusknoten dem Kammerkomplex geht eine normal geformte P-Welle voraus. Extrasystole: Das sind vorzeitige Herzschläge, die den Grundrhythmus vorrübergehend ändern (Kontraktion außerhalb der normalen Reihe), die durch einen zusätzlichen Reiz ausgelöst werden Man unterscheidet je nach Ursprung: supraventrikuläre Extrasystolen (Sinusknoten, Vorhof, AV-Knoten) oder ventrikuläre Extrasystolen40. Interponierte Extrasystolen sind eingeschaltet zwischen zwei normalen Schlägen, stört den Grundrhythmus nicht (niederfrequenter Grundrhythmus) Erregungsursprung im AV-Knoten: Vorhöfe und Sinusknoten werden rückläufig erregt negative P-Welle!! Am Kammerkomplex gibt es keine Änderung, da die Kammererregung regulär abläuft. 39 Erregungsursprung in den Ventrikeln: Die Ausbreitung ist abhängig vom Ursprung und wann die Erregung Anschluß an das Erregungsleitungssystem gewinnt. Dauer der Erregungsausbreitung ist meist erheblich verlängert. Durch den veränderten Leitungsweg Ventrikelkomplex ist stark deformiert. 40 Bei einer erhöhten Grundfrequenz folgt auf eine ventrikuläre Extrasystole in der Regel eine sogenannte kompensatorische Pause. Eine reguläre Kammererregung fällt dann aus. Die zurückgeleitete Erregung unterbricht die im Sinusknoten angelaufene diastolische Depolarisation und stößt somit einen neuen Erregungszyklus an. (Ausgleich durch kompensatorische Schleife - Grundrhythmus wird wieder hergestellt) 38 107 Herzblock: Das ist eine Störung der Erregungsleitung im Herzen. Es kann ein Block an verschiedenen Stellen (sinoaurikulär oder atrioventrikulär) und in verschiedenen Graden (Verlängerung der Leitungszeit, Ausfall einzelner Leitungen oder totale Unterbrechung). Beim totalen Herzblock schlagen Vorkammern und Kammern voneinander unanhängig und mit verschiedenen Frequenzen. Beim partiellen Herzblock ist die Überleitung nur verlangsamt.. Vorhofflattern41 und Vorhofflimmern42: Es sind Rhythmusstörungen, bei denen die Erregungsausbreitung über die Vorhöfe unkoordiniert verläuft. Einzelne Vorhofbezirke kontrahieren sich, andere erschlaffen gleichzeitig. Kammerflattern43 und Kammerflimmern44: Das sind lebensbedrohliche Rhythmusstörungen!!! Durch eine unkoordinierte elektrische Aktivität gibt es keine wirksame Füllung und Entleerung der Ventrikel mehr. Kreislaufstillstand und Bewußtlosigkeit tödlich! Die Ursachen für das Herzflimmern und -flattern sind von sehr unterschiedlich. Es liegt entweder eine Störung der automatischen Erregungsbildung oder der Erregungsausbreitung vor. Hervorgerufen wird es durch eine Schädigung des Herzens. Beispiele: Sauerstoffmangel, Coronarverschluß (Myocardinfarkt), Hypoxie (Herzinfarkt), starker Stromstoß durch Elektrounfall, Überdehnung, Unterkühlung, Narkotika, Überdosierung von Medikamenten Mechanismen: Grundstörung betrifft die elektrische Aktivität. Das sind Störungen der Erregungsausbreitung durch Wiedereintritt der Erregungswelle. Es entsteht somit eine kreisende Bewegung. Beim sog. Wiedereintritt finden die Erregungswellen im Herzen nach durchlaufen einer gewissen Wegstrecke zu ihrem Ausgangpunkt zurück, treffen diesen wiedererregbar an nehmen den selben oder einen ähnlichen Weg. Ist unter normalen Bedingungen nicht möglich, weil eine normale Erregungswelle nicht als Ganzes auf dem Herzen Platz findet und so auch nicht im Herzen kreisen kann. Die Länge der Erregungswelle muß so stark verkürzt sein, daß ein Wiedereintritt innerhalb des Netzwerkes der Herzmuskulatur möglich wird. Dies geschieht durch: Durch Verkürzung der Refraktärzeit Verminderung der Leitungsgeschwindigkeit Erregungsausbreitung muß vorrübergehend in eine Richtung blockiert sein. Vulnerable Periode: Flimmern kann durch einen überschwelligen Reiz ausgelöst werden, wenn dieser das Herz in einer bestimmten Phase der Erregungsrückbildung trifft. Das ist am Ende der Systole, während der T-Zacke, der Fall. Manche Herzmuskelfasern befinden sich in der relative Refraktärphase, während andere noch erregbar sind. Erregungen, die in der relativen Refraktärzeit ausgelöst werden, weisen selbst auch eine kurze Refraktärzeit auf. 1.7 Herzaktion 41 Vorhofflattern (250 - 250/min.): anstelle der P-Welle gibt des Flatterwellen mit einer sägezahnähnliche Form, denen in periodischen Abständen reguläre Kammerkomplexe folgen. Partielle AV-Blockierung durch die Refraktärzeit des Erregungsleitungssystems. 42 Vorhofflimmern (> 350/min.): Vorhofaktivität nur noch in frequenten, unregelmäßigen Schwankungen der Grundlinie. Es ist ein unkoordiniertes Zucken einzelner Muskelbündel in schneller Folge keine Förderleitung mehr, einzelne Erregungen werden noch an die Kammern weitergeleitet. Kammerkomplexe treten in irregulären Abständen auf = absolute Arrhythmie. Es hat aber nur einen geringen hämodynamischen Einfluß auf die Herzfüllung, da es mit 10 bis 30 % daran beteiligt ist. 43 Kammerflattern: frequente Wellen von hoher Amplitude 44 Kammerflimmern: sehr unregelmäßige, in Frequenz, Form und Amplitude rasch wechselnde Potentialänderungen (hochfrequentes Zucken einzelner Muskelgruppen in unregelmäßiger Folge). Als Folge: keine Gesamtkonzentration, kein Blutauswurf und Kreislaufstillstand. 108 Systole und Diastole Systole = Kontraktion des Herzens (Blutauswurf) mit Anspannungsphase = isovolumetrische Kontraktion (Kontraktion bei konstantem Volumen) und Austreibungsphase Diastole = Erschlaffung des Herzens (Blutfüllung) mit Entspannungsphase = isovolumetrisches Erschlaffen (Kontraktion bei konstantem Volumen) und Füllungsphase (Ventilebenenmechanismus) Das Öffnen und Schließen der Herzklappen wird vom Verhalten des Drucks in den angrenzenden Herzhöhlen und Gefäßen bestimmt. Systole und Diastole weisen Aktionsphasen auf. Druckveränderungen bei konstantem Volumen Volumenverschiebungen bei mäßiger Änderung des Drucks Phasen a) Anspannungsphase Die Anspannungsphase ist gleichzeitig der Beginn der Kammersystole. Durch den Anstieg der intraventrikulären Drucks durch Kontraktion der Ventrikelmuskulatur schließen sich die AVKlappen. Die Arterienklappen sind auch verschlossen. Die Ventrikelmuskulatur spannt sich an den inkompressiblen Inhalt an schneller Druckanstieg. Da alle Klappen geschlossen sind und das Blutvolumen konstant bleibt, spricht man von einer isovolumetrische Kontraktion. Es kommt zu einer Umformung beider Ventrikel (Konfigurationsänderung) in Richtung Kugelform alle Myokardfasern ändern ihre Lage (aktiv und passiv) b) Austreibungsphase Wenn der intraventrikuläre Druck (120 mm HG) größer als der die diastolische Durch in der Aorta bzw. der A. pulmonalis ist, öffnen sich die Taschenklappen Beginn der Austreibung. Das Schlagvolumen45 wird anfänglich sehr schnell ausgeworfen (60 % im ⅓ der Kontraktion), do daß man bei höheren Frequenzen eine höhere Auswurfleistung hat. Nach Auswurf des Schlagvolumens, am Ende der Systole bleibt ein Restvolumen in der Herzkammer zurück. Das ist entspricht etwa ½ des Volumens. Danach entspannt sich die Herzmuskulatur. Der Ventrikeldruck (80 mm Hg im rechten Ventrikel, 10 mm Hg im linken Ventrikel) steigt bis zum Maximalwert an und fällt bis zum Ende der Systole wider ab. c) Entspannungsphase Beim Schluß der Taschenklappen, aufgrund des niederen Drucks, beginnt die Diastole. Es entspricht einer kurze Pause, in der alle Klappen geschlossen sind (isovolumetrische Erschlaffung). Der intraventrikuläre Druck fällt ab auf fast 0 mm Hg. Bei Unterschreiten des Vorhofdrucks werden die AV-Klappen geöffnet Beginn der Füllung des Ventrikels für die nächste Systole. 45 Auswurffraktion (Ejektionsfraktion) = Anteil des Schlagvolumens am enddiastolischen Füllungsvolumen. Es beträgt etwa 50 % des enddiastolischen Volumens 109 d) Füllungsphase Die Füllungsphase beginnt beim Öffnen der AV-Klappen. Ventrikeldruck steigt wenig an. Es kommt zu einer Volumenvergrößerung (zu erst schnell, dann langsam). Kammerfüllung ist zum Zeitpunkt der Vorhofkontraktion schon fast weitgehend abgeschlossen. Wie bei der Austreibung des Blutes wird auch hier in der Anfangsphase das größte Volumen gefördert. 80 % der Füllung erfolgt im ¼. Dies ermöglicht eine effektive Füllung bei hohen Frequenzen. Die letzte Phase ist die Kontraktion der Vorhöfe (Vorhofsystole während der Diastole). Sie liefert einen mäßigen Beitrag zur Ventrikelfüllung, nämlich nur 10 - 30 %. Es kommt allerdings bei hohen Frequenzen für Beeinträchtigung, wenn noch eine Störung vorlegt wie z. B. ein Vorhofflimmern, da die Diastole stark verkürzt ist. Ventilebenenmechanismus Der Ventilebenenmechanismus liefert einen Beitrag zur schnelleren Füllung der Ventrikel. Die Ventilebene ist die Vorhof-Kammer-Grenze mit den Atrioventrikularklappen als Ventile. Es kommt zu einer Verschiebung dieser Ebene bei der Ventrikelsystole durch die Kontraktion der Muskulatur in Richtung Herzspitze, das Ventrikelvolumen ist verkleinert sich. Dadurch wird ein Sog auf die herznahen Gefäße ausgeübt. Bei nach nachfolgenden Diastole bewegt sich die ventilebene mit den geöffneten AV-Klappen aufgrund der elastischen Rückstellkräfte dem angesaugten Blut entgegen, so daß ein teil der Ventrikelfüllung ohne unmittelbare Bewegung des Blutes erfolgen kann. Fördervolumina Enddiastolisches Volumen = Schlagvolumen + Endsystolisches Volumen (Restvolumen) Endsystolisches Volumen = Reservevolumen + Residualvolumen Begriffe Schlagvolumen 100 % Ejektionsfraktion = -----------------------------------------Enddiastolisches Volumen Herzzeitvolumen = Schlagvolumen Frequenz Herzminutenvolumen = Schlagvolumen Frequenz Arbeitsdiagramm Das Arbeitsdiagramm stellt den Kontraktionszyklus der Herzkammern in einer Druck-Volumen-Beziehung (Schleifenfigur) mit dazugehöriger Ruhe-Dehnungskurve dar. Es ergibt sich aus dem Füllungsdruck, der für ein bestimmtes Volumen notwendig ist. 110 Die Ruhe Dehnungskurve wird am erschlafften Ventrikel aufgenommen. Ihr Verlauf zeigt eine abnehmbare Dehnbarkeit des erschlafften Herzens bei zunehmender Füllung des Ventrikels. Ausgehend davon kann jede Kontraktion des Herzens dargestellt werden. Die beiden Extreme wären eine rein isovolumetrische oder eine reine isobare Kontraktion. In Wirklichkeit kontrahiert sich der Herzmuskel als erstes isovolumetrisch und dann auxobar. Die Kurve der Unterstützungsmaxima hängt vom jeweiligen enddiastolischen Füllungsvolumen ab, d. h. daß für jeden Punkt in der Ruhe-Dehnungs-Kurve eine spezielle Kurve der Unterstützungsmaxima konstruiert werden muß. Es beginnt mit der diastolischen Füllungsphase (IV). Im Beginn dieser Phase fällt der Druck zunächst noch weiter ab. Als Folge der elastischen Rückstellkraft der erschlaffenden Kammerwand wird ein Sog auf den Vorhof ausgeübt. Danach folgt wieder die Volumenzunahme unter steigendem Füllungsdruck bis zum Erreichen des Endiastolischen Volumens. Die Systole beginnt mit der isovolumetrischen Anspannungsphase (I). Beim Druckanstieg (diastolischer Aortendruck) öffnen sich die Aortenklappen. Das ist der Beginn der Austreibungsphase (II). Der weitere Druckanstieg wird bedingt durch die Änderung der Ventrikelgeometrie. Weil sich dabei Druck und Volumen gleichzeitig ändern, spricht man von einer auxonomen Kontraktion. Die isovolumetrische Erschlaffungsphase (III) der beginnenden Diastole schließt die DruckVolumen-Schleife. Es beginnt ein neuer Zyklus. Vor jedem Punkt der Ruhedehnungskurve bei Kontraktion bestimmtes isovolumetrisches/ isobares Maximum erreichbar. Der Zyklus besteht aus der isometrischen Kontraktion (Anspannung), auxotoner Kontraktion (Austreibung), isovolumetrische Erschlaffung (Entspannung) und Dehnung (Füllung). 1.8 Kardiale Autoregulation Die Anpassung an wechselnde Belastungen (Volumen und Druck) erfolgt am herzen durch die Veränderung der Förderleistung. Diese kann in weiten Grenzen variieren. Dies geschieht durch: Intrakardiale Regulation: natürliche Grundeigenschaften der Herzmuskulatur Extrakardial ausgelöste Regulationen: neurovegetative und humorale Einflüsse Anpassung an akute Volumenänderungen a) Sympathikus Dieser führt mit seinen Transmittern Adrenalin und Noradrenalin zu einer Steigerung der Herzfrequenz, die für die Steigerung des Herzminutenvolumens von Bedeutung ist. Zusätzlich kommt es noch zu einer Steigerung der Kontraktionskraft des Herzens. Durch die Steigerung des isovolumetrischen Maximums und im geringeren Maße des isobaren Maxima bei gleichbleibende Füllungsvolumen (enddiastolisches Volumen) das Schlagvolumen gegen einen höheren Druck in die Aorta ausgeworfen werden. Grundlage ist der erhöhte Ca2+-Einstrom. b) Frank-Starling-Mechanismus Dieser beschreibt den Zusammenhang von Herzfüllung und Auswurfleistung des Herzens. Eine entscheidende Rolle spielt dabei die Vordehnung der Muskelfasern, die durch die enddiastolische Herzfüllung bestimmt wird. Es gibt dabei zwei Parameter: 111 Vorlast, (preload): enddiastolische Füllung Nachlast (afterlead): Aortendruck, gegen den das Herz das Blut auswerfen muß Beide Veränderungen führen am Herzen zu einem erhöhten enddiastolischen Volumen, wobei ein afterlead vorübergehend ein kleines Schlagvolumen zur Folge hat. Nur durch den venösen Rückstrom, der das enddiastolische Volumen verursacht, ist ein normales Schlagvolumen bei erhöhtem Aortendruck möglich. Grundlage hierfür ist die erhöhte Vordehnung durch Vermittlung des Troponin C die Empfindlichkeit für Ca2+ erhöht. Der Frank-Starling-Mechanismus wird immer dann wichtig, wenn eine Veränderung der Volumenfüllung (unter vergrößerten venösen Zustrom stärkere diastolische Füllung) vorliegt. Es dient der langfristigen Anpassung der Förderleistung vom rechten und linken Ventrikel. Eine Volumenänderung tritt auch z. B. beim Aufstehen auf (Veränderung Liegen Stehen)!!! Die Kraftentfaltung ist um so stärker, je stärker die Vorfüllung ist Anpassung an Druck- oder Volumenbelastung Anpassung an akute Druckbelastung Durch die Erhöhung des Strömungswiderstand stufenweise Umstellung der Herztätigkeit. Bei einem erhöhten Außenwiderstand fällt der Aortendruck in der Diastole nicht auf den ursprünglichen Wert ab, so daß der linke bei der folgenden Systole einen höheren Druck aufbringen muß, bevor die Austreibung einsetzt. Dies führt zu einer Verkleinerung des Schlagvolumens. Dadurch bleibt ein größeres Restvolumen zurück. Der venöse Zustrom wird dabei konstant gehalten, so daß es zu einer stärkeren diastolischen Füllung kommt. Der Arbeitsbereich des linken Ventrikels wird entlang der Ruhedehnungskurve zu größeren Volumina verschoben, bis er unter höherem Druck das ursprüngliche Volumen auswirft. Eine Nachlasterhöhung durch einen vergrößerten Aortendruck führt zu einer Verminderung des Schlagvolumens und nachfolgend bei gleichem Zufluß eine Vergrößerung des enddiastolischen Volumens. Das kann aus der größeren Vordehnung einen größeren Druck entwickeln. 1.9 Herztöne (puh - dupp) und Herzgeräusche Herztöne Sie sind der physiologische Herzschall mit einer Frequenz von 15 - 400 Hz. Man unterscheidet verschiedene Töne: 1. Herzton = systolischer Herzton 2. dumpf und lang Anspannungston durch isovolumetrische Kontraktion der Ventrikel zu Beginn der Systole (Anpassung des Ventrikelmyokards beim Schluß der AV-Klappen) Schwingung der Kammermuskulatur, des enthaltenen Blutes und der AV-Klappen (Der 1. Herzton wird um so lauter, je plötzlicher die Anpassung erfolgt) Einteilung in ein Vorsegment, Hauptsegment und Nachsegment Herzton = diastolischer Herzton kürzer und heller 112 3. Herzton = Füllungston 4. Klappenton durch Zuschlagen der Taschenklappen Schwingung der Blutsäule in der Aorta (das Blut prallt gegen die zuschlagenden Klappen) Ein gespaltener 2. Herzton entsteht durch den asynchonen Fluß der Aorten - und Pulmonarklappe (z. B. physiologische Grund, da die Systole des rechten Ventrikels 6 x länger ist als die des linken Ventrikels. Vorkommen bei Jugendlichen) Schwingungen der Kammerwand beim Einströmen des Blutes in der frühen Füllungsphase Eher selten wahrnehmbar Herzton = Vorkammerton Schwingung der Vorhofwand während der Vorhofsystole eher selten wahrnehmbar Carotiswelle = spiegelt Vorgänge im linken Herzen wieder Jugularispuls = spiegelt Vorgänge im rechten Herzen wieder Herzgeräusche Es abnormale Schallerscheinungen, die während der Herzaktion entstehen. Sie treten bei Turbulenzen des Blutstromes auf, die z. B. durch defekte Herzklappen entstehen. Sie werden spezifiziert durch den Zeitpunkt und ihr Punctum maximum (Auskultationsstelle, an der es am lautesten ist) Stenose: ungenügende Öffnung (zwischen dem 1. und dem 2. Herzton) Insuffizienz: undichter Verschluß (kurz nach dem 3. Herzton) 1.10 O2-Bedarf des Herzens s. auch Kreislauf Das Herz muß die Vergrößerung seines O2-Bedarfs durch eine erhöhte Durchblutung decken. Da schon eine hohe O2-Entnahme in der Ruhe erfolgt, müssen bei einem erhöhten Bedarf mehrere Mechanismen zusammenwirken: Durch Weitstellung der Gefäße und Reduktion des Strömungswiderstandes starker Dilatationsreiz = O2-Mangel Koronarerweiternde Einflüsse durch Adenosin (Abbaubauprodukt energiereicher Phosphate), führt zu einem Anstieg der extrazellulären K+-Konzentration Vielleicht auch vegetative Herznerven (Sympathikus = gefäßverengende Wirkung, Parasympathicus = gefäßerweiternde Wirkung) Endothelial gebildete Faktoren Stickstoffmonoxid (NO) = wichtigster vasodilatierender Faktor, Freisetzung aus dem Endothel durch die Erhöhung des Blutflusses durch Acetylcholin, Histamin, Serotonin, Noradrenalin 113 Endothelin = stärkster endogener Vasokonstriktor (21 AS), wird unter Einwirkung von Thrombin, Adrenalin, Interleukin-1, Endotoxin aus einer Vorstufe gebildet. 2. Kreislauf 2.1 Gliederung der Kreislaufabschnitte Bauelemente des Kreislaufs Herz als Pumpe, die Energie dadurch zur Verfügung stellt, indem sie Druck erzeugt. Arterien als Verteilungssystem, die das Blut unter hohem Druck den Organen zuführt. Arteriolen sind Regulierventile, die durch ihren Widerstand bestimmen wieviel Blut zu den einzelnen Organen fließt Kapillaren dienen dem Stoffaustausch zwischen der Zelle der einzelnen Organen und dem Blut Venen sind das Blutreservoir infolge ihrer hohen Kapazität (Kapazitätsgefäße) Blutkreislauf Der Blutkreislauf ist ein geschlossenes System von parallel oder seriell geschalteten Blutgefäßen. Es wird durch 2 funktionell hintereinander geschalteten Pumpen, den rechten und den linken Ventrikel (Herz oder Druck-Saug-Pumpe) ein Druckgefälle erzeugt, das eine gerichtete Blutströmung aufrecht erhält. Die Umlaufgeschwindigkeit des Blutes wird den jeweiligen Bedürfnissen des Organismus angepaßt. Man unterscheidet zwei verschiedene Kreisläufe. Das Lymphgefäßsystem ist dabei funktionell parallel. Es sammelt Flüssigkeit aus dem interstitiellen Raum und leitet es zurück in das Blutgefäßsystem. 1. Körperkreislauf oder „großer Kreislauf“: Dieser umfaßt das Stromgebiet ab dem linken Ventrikel bis zum rechten Vorhof mit Organstromgebieten und mehrfacher Parallelschaltung. Der Verlauf des Kreislaufs ist: linker Ventrikel (linke Kammer des Herzens) Aorta große Arterien Abzweigungen zu den verschiedenen Organgebieten46 (Gesamtzahl , Durchmesser ) Arteriolen Kapillaren (bilden ein dichtes Gefäßnetz, in denen der Austausch zwischen Blut und interstitiellen Gewebe stattfindet) Venolen kleine Venen (Zahl der Venen , Durchmesser ) münden als Vena cava cranialis und Vena cava caudalis in den rechten Vorhof 2. Lungenkreislauf oder „kleiner Kreislauf“: umfaßt das Stromgebiet vom rechten Ventrikel bis zum linken Vorhof. Der Verlauf ist: rechter Ventrikel A. pulmonalis Verzweigungen zu kleineren Lungenarterien Arteriolen Kapillaren 4 große Lungenvenen linker Vorhof Drucksysteme 46 Hochdrucksystem = Druckspeicher (Druck wird durch die Pumpe bestimmt) Bei P > 30 mm Hg Dazu gehört der linke Ventrikel (während der Systole) und die Arterien Mesenterialgefäße: umfaßt das Kapillarnetz des Darms und das der Leber 114 Niederdrucksystem = Volumenspeicher (Druck durch den Füllungszustand) Bei P < 30 mm Hg Dazu gehören Kapillaren, Lymphgefäße, Venen, rechtes Herz, Lungenkreislauf, linker Vorhof und linker Ventrikel (während der Diastole) 2.2 Koronardurchblutung Der Koronarkreislauf des Herzens ist ein Teil des großes Kreislaufs. Meist zwei Koronararterien entspringen aus der Aortenwurzel, die venöse Drainage übernehmen der Sinus coronarius und die Vv. parvae cordis (Vv. cordis minimae). Der Anteil der Koronardurchblutung beträgt ca. 5 %, bezogen auf das Minutenvolumen, kann aber bis zum 4-fachen anstiegen. Gleiche Größenordnung = O2-Verbrauch des Herzens (Arbeit). Koronarkreislauf Er ist betroffen von starken Schwankungen des Blutstromes im Rhythmus von Systole und Diastole. Die rhythmische Pulsation des Aortendrucks und Veränderungen des interstitiellen Myokarddrucks wirken von außen auf die Gefäße (in mittlerer und innerer Wandschicht des Herzens verlaufende Gefäße). Linke Koronararterie: der Einstrom erfolgt in der Diastole, mit Beginn der Systole wir sie vollständig unterdrückt Rechte Koronararterie: Einstrom erfolgt nach den Schwankungen des Aortendrucks intramuraler Druck ist gering Koronarsinus: Entleerung ist in der Systole in Folge der Kompression der muskulösen Herzwand 2.3 Alles zur Blutströmung Gesetzmäßigkeiten der Blutströmung Reale Flüssigkeiten besitzen eine innere Flüssigkeitsreibung. Sie setzen somit einer Strömung einen Widerstand entgegen. Für die Überwindung des Strömungswiderstandes ist eine Druckdifferenz zwischen Anfang und Ende des durchströmenden Gefäßes notwendig. Zeichenerklärung I= Stromstärke ist das durch einen Gefäßabschnitt strömende Volumen (V) pro Zeiteinheit (t) P = Treibende Druckdifferenz R= Strömungswiderstand ist der Quotient von Druckdifferenz (P) und Stromstärke (I). Er nimmt mit der Länge des Gefäßes und mit der Viskosität des durchströmenden Blutes zu und mit der 4. Potenz des Gefäßradius ab. V= Strömungsgeschwindigkeit ist die Geschwindigkeit der einzelnen Flüssigkeitsteilchen, die in verschiedenen Entfernungen von der Rohrachse verschieden groß ist. Man unterscheidet lamillare oder turbulente Strömungen. Sie nimmt ab, wenn die Querschnittsfläche des durchströmten Gefäßbettes zunimmt. Q= Rohrquerschnitt 115 Gesetzmäßigkeiten a) Kontinuitätsgesetz Durch jeden Abschnitt des Gefäßsystems fließt zu jeder Zeit das selbe Stromvolumen. Dieses Stromzeitvolumen entspricht dem Herzminutenvolumen. Definiert ist es als V I = ---------t Dies erklärt das Phänomen, daß in der Aorta die Strömungsgeschwindigkeit größer ist als in den Kapillaren. Da die Aorta nur eine relativ kleine Querschnittsfläche von wenigen cm hat, dem gegenüber aber die gesamten Kapillaren zusammen eine insgesamt viel größere (riesige) Querfläche haben, ist demnach die Geschwindigkeit in der Aorta wesentlich höher. b) Druck-Strom-Beziehung Die einfachste Druck-Strom-Beziehung ist das Ohmsche Gesetz, das definiert ist als: (p1 - p2) I = ---------------R So errechnet sich der Widerstand des großen Kreislaufs aus der Druckdifferenz zwischen dem rechten Vorhof und Aorta dividiert durch das Herzminutenvolumen. Eine Erweiterung des Ohmschen Gesetztes stellt das Hagen-Poiseuille-Gesetz dar. Es dient zur genaueren Darstellung des Widerstandes der Blutgefäße. ri4 P I = -----------------8l 8l R = ------------ri4 P = Druckdifferenz (p1 - p2) = Viskosität ri = Innenradius l = Länge Strömungswiderstand nimmt mit der Länge des Gefäßes und mit der Viskosität des durchströmenden Blutes zu und mit der 4. Potenz des Gefäßradius ab. Die Formel sagt aus, daß Stromstärke und Spannungswiderstand sich direkt umgekehrt proportional zur 4. Potenz des Gefäßradius ändern. Strömungsarten 116 a) Lamilläre Strömung In einem zylindrischen Gefäß ist die Bewegung aller Flüssigkeitsteilchen parallel zur Gefäßachse. Die Schichten gleicher Geschwindigkeit sind konzentrisch angeordnet. Es ergibt sich daraus ein parabolisches Geschwindigkeitsprofil. Das Maximum der Geschwindigkeit liegt im Axialstrom. Die Stromstärke ist proportional zur Druckdifferenz. b) Turbulente Strömung Die lamilläre Strömung kann in eine turbulente Strömung übergehen. Die Flüssigkeitsbewegung wird langsamer, denn die entstehenden Wirbel (Flüssigkeitsteilchen bewegen sich parallel und quer zur Gefäßachse) schlucken Energie (zusätzliche Energieverluste Wärmebildung). Das Herz muß dadurch eine erhöhte Pumparbeit leisten. Es kommt auch zu einer Abflachen des Strömungsprofils. Die Stromstärke ist proportional zur Quadratwurzel der antreibenden Druckdifferenz. Über die Reynold’sche Zahl kann der Zeitpunkt bestimmt werden, an dem die lamilläre Strömung in eine turbulente Strömung übergeht. 2r v p Re = --------------- r = Gefäßdurchmesser v = mittlere Strömungsgeschwindigkeit p = Massendichte der Flüssigkeit = Viskosität Strömungsbedingungen im Gefäßsystem Nicht stationär, sondern pulsierend Gefäßdurchmesser steigen mit zunehmendem Druck an Strömungswiderstand ist abhängig von der Höhe des Blutdrucks Viskosität des Blutes ist abhängig von den Strömungsbedingungen Größter Teil des Strömungswiderstandes im Kreislaufsystem liegt im Bereich der Arteriolen und Kapillaren („Widerstandsgefäße“) 1. 2. 3. 4. 5. 6. elastisch, Windkesselfunktion Widerstandsgefäße Sphinctergefäße Austauschgefäße Kapazitätsgefäße Nebenschlußgefäße Aorta terminale Arterien präkapilläre Sprinter Kapillaren Venen Anastomosen Viskosität, Zähflüssigkeit Die Viskosität ist ein Maß für die innere Reibung in einer nicht idealen Lösung. Das Blut ist eine heterogene Flüssigkeit und weißt somit eine variable Viskosität auf. Sie ist abhängig von der jeweiligen Menge der suspendierten Zellen (Hämatokrit), vom Proteingehalt des Plasmas und vom Gefäßdurchmesser. Je höher der Gehalt ist, desto zähflüssiger ist das Blut. Ebenso spielt die 117 Aggregationsneigung und Deformierbarkeit der Erythrozyten eine Rolle, das das Newton’sche Fließverhalten des Blutes erklärt. Es kommt zu einer Veränderung der Strömungsbedingungen und somit auch zu einer Veränderung der Viskosität. Von einer scheinbaren oder aparten Viskosität spricht man bei einer langsamen Strömung mit geringer Schubspannung. Je niedriger die Schubspannung ist desto mehr nimmt die Viskosität zu (Aggregation der Erythrozyten). Bei hohen Strömungsgeschwindigkeiten herrschen hingegen höhere Schubspannungen die auf das Blut einwirken, so daß die Blutviskosität relativ niedrig ist. = ---------- = Schubspannung bewirkt die Verschiebung der einzelnen Flüssigkeitsschichten gegeneinander = Schergrad ergibt sich aus der Geschwindigkeit der Verschiebung und der Dicke der Schicht. Fåhraeus-Lindqvist-Effekt Eine hohe Fluidität der Erythrozyten in Blutgefäßen mit einem Durchmesser von weniger als 5 - 10 m führt zu einer Axialemigration der Erythrozyten. Die Erythrozyten werden von der Randzone des durchströmten Gefäßes durch Rotationsbewegungen zur Gefäßachse hin verschoben geringere Scherung. Die Ausbildung einer zellarmen Randzone dient als niedervisköse Gleitschicht zur Verminderung der Reibung, die der Fortbewegung der zentralen Zellsäule dient Herabsetzung der scheinbaren Viskosität. Die Blutviskosität ist in der Kreislaufperipherie erheblich niedriger als in einem großkalibrigen Viskosimeter. Strömungsgeschwindigkeit Die Strömungsgeschwindigkeit ist die Geschwindigkeit der einzelnen Flüssigkeitsteilchen, die in verschiedenen Entfernungen von der Rohrachse verschieden groß ist. Kontinuitätsbedingungen: Stromstärke (I) = Strömungsvolumen (V) Querschnitt (Q) In einem aus verschieden weiten Rohren zusammengesetzten System (Gefäßsystem) muß die Stromstärke unabhängig vom Durchmesser der einzelnen Röhren in jedem beliebigen Querschnitt immer konstant sein. Bei gleichbleibender Stromstärke verhält sich die Strömungsgeschwindigkeit in hintereinander geschalteten Gefäßabschnitten umgekehrt proportional zum Querschnitt der einzelnen Teilabschnitte. 2.4 Hochdrucksystem Zum Hochdrucksystem gehört der linke Ventrikel während der Systole und das ganze arterielle System bis ans Ende der Arteriolen. Kennzeichen des Systems: Hoher Druck Geringe Dehnbarkeit der Gefäße 118 15 % des Blutvolumens sind darin enthalten Definitionen der Pulsarten Bei der arterielle Blutströmung entstehen durch pulsatilen Antrieb des Kreislaufs verschiedene Pulswellen. Puls = Auswurf des Schlagvolumens. Es läßt sich einteilen in Druckpuls und Strompuls Strompuls = Geschwindigkeit der Blutströmung während der Austreibungsphase des Herzens. Die maximale Geschwindigkeit beträgt 1 m/s. Im Mittel sind es allerdings 20 bis 60 cm/s. Druckpuls = Änderung des Blutdrucks. Die Druckwelle ist an den arteriellen Gefäßen meßbar und entsteht durch die nicht augenblickliche Weiterleitung des Schlagvolumens. Volumenpuls = Änderung der Gefäßweite durch den Druck Venenpuls = Druck- und Volumenschwankungen an herznahen Venen, die durch die Herzaktion entstehen und sich retrograd auf das Venensystem fortpflanzen Pulswellengeschwindigkeit Die Pulswellengeschwindigkeit ist die Ausbreitungsgeschwindigkeit mit der sich die Pulswelle ausbreitet. Sie ist schneller als der Strompuls. Windkesselfunktion der Aorta Durch die Dehnung der Aorta während der Systole und Entdehnung während der Diastole werden die Druckschwankungen gedämpft. Bei der arteriellen Blutströmung wird etwa die Hälfte des Schlagvolumens gespeichert und während der Diastole durch Entdehnung wieder weiterbefördert. Es dient dazu die nicht kontinuierliche Blutströmung beim Auswurf aus dem herzen in eine kontinuierliche Strömung umzuwandeln. Bei arteriosklerotischen Veränderungen sinkt die Dehnbarkeit der Aorta. Sie ist meßbar durch die Vergrößerung der Differenz zwischen dem systolischen und dem diastolischen Blutdruck (Blutdruckamplitude!). 2.5 Blutdruck und Blutdruckmessung Blutdruck Das ist die Kraft, die vom Blut gegen die Gefäßwand ausgeübt wird. In der Praxis wird nur der arterielle Blutdruck gemessen. Dieser schwankt zwischen einem systolischen Maximum (systolischer Blutdruck bei 120 mmHg) und einem diastolischen Minimum (diastolischer Blutdruck bei 8 mmHg). Der arterielle Mitteldruck ist das zeitliche Mittel des Blutdrucks. Der Druckpuls hat einen ganz charakteristischen Verlauf. An herznahem Gefäßen: Hier hat man einen steilem systolischen Ansteig mit nachfolgendem kurzen Abfall und Bildung einer Incisur. Sie entsteht durch ein kurzes Rückströmen des Blutes in den linken Ventrikel am Ende der Systole, das den Schluß der Aortenklappe beendet wird. Danach folgt eine sekundäre langsamere Druckwelle durch Wellenreflexion. 119 In der Periphere: Hier folgt nach einem schnellen Druckabfall zu Beginn der Diastole eine zweite Anstiegswelle, die dikrote Welle. Sie entsteht durch Reflexion von orthograd, also vom Zentrum zur Peripherie hin, verlaufenden Pulswellen. Diese Wellen, auch Wellenreflexion genannt, entstehen an Übergängen von mehr elastischen zu mehr muskulösen arteriellen Gefäßen. Die Überlagerung von orthograden und retrograden Pulswellen führt zu einer Zunahme der Amplitude des Druckpulses. Blutdruckmessung a) Direkte Blutdruckmessung wenn das Manometer mit einer an Meßort befindlichen „Nadel im Blut“ und somit mit dem Blut selbst, direkt in offener Verbindung steht. b) Indirekte Blutdruckmessung Messung nach Riva-Rocci. Hier wird eine Manschette um den Oberarm gelegt, die mit einem Manometer in Verbindung steht. Daran kann man Blutdruck ablesen und zusätzlich noch mit einem Stethoskop, das in der Ellenbogenbeuge liegt, Geräusche auskultieren (nach Korotkow). Die Geräusche, sog Korotkow-Geräusche, treten dann auf, wenn der Manschettendruck zwischen systolischen und diastolischen Blutdruck liegt. Die Manschette wird so stark komprimiert, daß die A. brachialis verschossen wird (Druck höher als der arterielle Druck). Danach wird der Druck abgesenkt, bis das 1. Geräusch zu hören ist. Es entsteht durch den turbulente Einströmung des Blutes am systolischen Maximum = systolischer Blutdruck. Das Geräusch verändert sich von klopfend in Richtung zischend, wird leiser und verschwindet letztendlich vollständig. Das 2. „Geräusch“ entsteht durch die normale Strömung = diastolische Blutdruck (danach keine Geräusche mehr) Geräusch = systolisches Maximum = systolischer Blutdruck Geräusch = diastolisches Minimum = diastolischer Blutdruck 2.6 Aufbau und Stoffaustausch in der Mikrozirkulation Stoffaustausch zwischen Blut und Gewebe erfolgt in der terminalen Strombahn. Das ist das Austauschgebiet der Kapillaren und postkapillären Venolen. Aufbau47 a) Arteriolen b) Terminale Arteriolen 47 Innerer Durchmesser zwischen 40 bis 100 m Media besteht aus 1 bis 2 Lagen zirkulär verlaufender glatter Muskulatur Durchmesser zwischen 20 bis 40 m Basalmembran bildet die Grenzschicht zwischen Endothel und glatter Muskulatur Das Austauschgebiet umfaßt eine Fläche von 300 m2. 120 c) Metarteriolen d) Echte Kapillaren e) Innendurchmesser von 8 bis 30 m Entstehen aus dem Zusammenschluß mehrerer venöser Kapillaren Wandung ist ohne Muskulatur, besteht aus Endothel, der Basalmembran und kollagenen Fasern Umhüllung mit Perizyten (Rouget-Zellen) Venolen g) Direkt aus den Arteriolen und Metarteriolen Bestehen nur noch aus einer Endothelschicht und der Basalmembran Es gibt arterielle und venöse kapillaren In einigen Geweben befinden sich am Ursprung der Kapillaren ein Ring glatter Muskulatur (präkapilläre Sphincter), die eine weitgehende Drosselung der Kapillarströmung bewirken Postkapilläre Venolen f) Mit präkapillaren Sphinctern Innendurchmesser von 8 bis 20 m Lückenhafte Schicht glatter Muskelzellen Bilden die Hauptstrombahn mit einem direkten Anschluß an die postkapillären Venolen Innendurchmesser von 30 bis 50 m Besitzen glatte Muskelzellen Arteriovenöse Anastomosen Kurzschlußverbindungen zwischen Arteriolen und Venolen Mit besonders dicker, muskelreicher Wand Können bei geringer konstriktorischer Aktivität vollständig geschlossen werden Befinden sich in der Haut von Finger- und Zehenspitzen, Nase, Ohrläppchen und Lunge Kapillartypen a) Kontinuierlicher Typ Barriere aus Endothelzellen und einer Basalmembran Vorkommen in ZNS, Herz- und Skelettmuskulatur, Haut, Binde- und Fettgewebe, Lunge Interzellularspalten sind der Hauptpassierweg für Wasser, Glucose, Harnstoff und andere lipidlösliche Moleküle (Plasmaproteine) Transport von Makromolekülen erfolgt durch Diffusion und Konvektion durch große transendotheliale Poren. Sie entstehen flüchtig oder sind stabil durch die Verschmelzung luminaler und abluminaler Invagination 121 b) Fenestrierter Typ c) Permeabel für Wasser und kleine hydrophile Moleküle in Geweben, die auf den Austausch von Flüssigkeiten spezialisiert sind: Glomeruli der Niere, exokrine Drüsen, Darmschleimhaut, Plexus des Ziliarkörpers, Plexis chorioidei, endokrine Drüsen Endothel nur mit interzellulären Poren, meist mit einer dünnen, sternförmig perforierten Membran (Diaphragma) überdeckt Basalmembran ist vollständig enthalten Diskontinuierlicher Typ Sinusoikapillaren von Leber, Milz und Knochenmark Inter- und intrazelluläre Lücken, die die Basalmembran mit einschließen Durchtritt von Proteinen und anderen Makromolekülen und korpuskulären Elementen, z. B. Blutzellen Korpuskeln: Materialteilchen mit Ruhemasse, können elektrisch geladen oder ungeladen sein Stoffaustausch durch Diffusion48 Lipidlösliche Stoffe: Lipidlösliche Stoffe und Atemgase (O2 und CO2) diffundieren transzellulär durch die Plasmamembranen der Endothelzellen. Die Austauschfläche zieht sich über die ganze Endothelfläche der Kapillaren und postkapillären Venolen . Die Diffusionsgeschwindigkeit wird von der Kapillardurchblutung begrenzt = durchblutungslimitierter Austausch. Die Austauschrate steigt mit steigender Durchblutung. Wasserlösliche Stoffe: Wasserlösliche Stoffe und Wasser selbst ist beschränkt auf den Passageweg durch Poren und Interzellularspalten. Das ist weniger als 1 % der Kapillaroberfläche, trotzdem beträgt der kapilläre Wasseraustausch 55 l/ Minute. Auf diesem Weg diffundieren auch kleinmolekulare Substanzen (Elektrolyte) Große Moleküle: Sie werden durch Pinozytose in die Zellen aufgenommen. Flüssigkeitsaustausch Ein Flüssigkeitsaustausch zwischen intravaskulärem und interstitiellem Raum erfolgt bei hydrostatischen und kolloidosmotischen Druckdifferenzen durch Filtration und Reabsorption über die Kapillarwand. Die Kapillarwand ist eine poröse Membran. Durch die Druckdifferenz (intrakapilläre Druck > hydrostatischer Druck im Interstitium) strömt die Flüssigkeit aus den Kapillaren in das Interstitium = Auswärtsfiltration. Die entgegengerichtete Einwärtsfiltration oder Resorption wird durch die Differenz des kolloidosmotischen Drucks des Blutplasmas und des Interstitiums hervorgerufen. Der effektive Filtrationsdruck bestimmt den Flüssigkeitstransport über die Kapillarwand. Er ergibt sich aus der Differenz des hydrostatischen und des kolloidosmotischen Drucks zwischen Kapillarinnenraum und interstitiellem Raum. Der kolloidosmotische Druck muß um den osmotischen Reflexionskoeffizienten korrigiert werden. (Ableitung nach Starling: Das Starling-Gleichgewicht besagt: bei Filtration + bei Resorption -). Effektiver Filtrationsdruck = 9,5 mm Hg Effektiver Resorptionsdruck = 8,0 mm Hg 48 Der durch Diffusion erreichte Stoffaustausch zwischen Blut und Interstitium ist weitgehend ausgeglichen. Es gibt Abweichungen bei Stoffen, die im Gewebe verbraucht werden. 122 Filtration49 und Resorption50 a) Arterieller Schenkel der Kapillare Transmuraler Druck ist größer als die Differenz zwischen kolloidosmotischem Druck des Plasmas und dem der interstitiellen Flüssigkeit Filtration (20 l/d) = Auswärtsbewegung von Wasser und porengängigen Molekülen b) Venöser Schenkel der Kapillare Filtrationsdruck von außen nach innen. Das Wasser tritt mit den darin gelösten Kristalloiden in die Kapillare ein Resorption (18 l/d) 2.7 Niederdrucksystem Zu Niederdrucksystem gehören alle Gefäße und Teile des Herzens, die nicht zum Hochdrucksystem gehören (Kapillaren, Lymphgefäßen, Venen, rechtes Herz, Lungenkreislauf und linker Vorhof). Eine Ausnahme bildet der linke Ventrikel, der bei der Systole zum Hochdrucksystem und bei der Diastole zum Niederdrucksystem gehört. Es verhält sich funktionell einheitlich wie ein passiv-elastischer Behälter dessen mittlerer Druck annähernd parallel steigt und fällt. Kennzeichen sind: Kapazitätsgefäße, weil 85 % des Blutvolumens darin enthalten ist = Volumenspeiche Hohe Dehnbarkeit Niedriger Druck (mittlere Druck liegt hier bei < 30 mm Hg) Die Herzaktion beeinflußt den zentralen Venendruck und bestimmt die Form des Venepulses. Der zentralvenöse Druck ist der wichtigste extrakardiale Faktor für die Füllung und die Auswurfleistung des Herzens. Venenpuls Die im Rhythmus der Herzaktion auftretenden Druck- und Durchmesserschwankungen werden als Pulswellen vom rechten Vorhof entgegen der Blutströmungsrichtung auf die herznahem Venen übertragen. Es ist ein Abbild des Druckverlaufs im rechten Vorhof mit einer zeitlichen Verzögerung. Beeinflußt wird der Venenpuls durch die Atmung und die Schwerkraft. a-Welle = Durch die Vorhofkontraktion c-Welle= Vorwölbung der Tricuspidalisklappe in den rechten Vorhof während der Anspannungsphase des Ventrikels starke Senkung zu x x= Durch die Verschiebung der Ventrikelebenen während der v-Welle = Austreibungszeit - Entspannung des Ventrikels, aber durch die geschlossenen 49 Der Druck in der Kapillare nimmt vom arteriellen zum venösen Schenkel hin ab. In der Mitte befindet sich ein Filtrationsgleichgewicht. 50 Im Organismus ist die Resorption etwas kleiner als die Filtration. Ca. 10 % des Filtrates werden über die Lymphgefäße aus dem interstitiellen Raum abtransportiert. 123 Atrioventrikularklappen steigt der Druck im Vorhof steil an, fällt aber nach Öffnung der Klappe durch den nachfolgenden Bluteinstrom vorrübergehend wieder ab (Bildung einer positiven Welle) y= Nachfolgende Senkung Dehnungsverhalten der Venen Die Wand der Venen sind dünner und muskelärmer (Kapazitätsgefäße). Bei einem Druckbereich um 0 mm Hg sind die Venen kollabiert. Die Endothelflächen berühren sich, bilden aber kein Hindernis für den venösen Rückstrom. Bis zu einen wieder kreisrunden Gefäßdurchschnitt benötigt man nur einen geringfügigen Druckzuwachs. Das Dehnungsverhalten51 der Venen ist die Vorraussetzung für die Blutvolumenverlagerungen, die beim Lagewechsel im Niederdrucksystem stattfinden. Die Körperlage hat ebenso einen Einfluß auf den Druck im Gefäßsystem. So beeinflussen bei aufrechter Körperlage die hydrostatischen Drücke (durch Schwerkraft) stark die an sich niedrigen venösen Drücke. Der Anstieg ist unterhalb und der Abfall oberhalb der hydrostatischen Indifferenzebene 52. Zentrale Venendruck (ZVD) Er ist ein Maß für den Füllungszustand des Gefäßsystems. Dieser Wer findet Anwendung in der Intensivmedizin, weil daraus eben Rückschlüsse auf den Füllungszustand gezogen werden können. Statistische Blutdruck, mittlere Füllungsdruck Der statistische Blutdruck oder mittlere Füllungsdruck liegt bei einem hydrostatischen Druck von 7 mmHg. Dieser wird bei Herzstillstand gemessen. Bei Wiederaufnahme der Herztätigkeit steigt der Druck im Hochdrucksystem an und im Niederdrucksystem fällt er ab. Beeinflußt wird es durch das vorhandene Blutvolumen und der Dehnbarkeit des gesamten Gefäßsystems. Druckgradient für den venösen Rückstrom Dieser wird gebildet aus der Druckdifferenz zwischen mittlerem Füllungsdruck und dem zentralen Venendruck (ZVD). Muskelpumpe Die Venen sind nicht für längere Druckbelastungen geeignet, die v. a. beim langen Stehen wirken. Durch die Skelettmuskulatur, die die Venen in den Beinen umgibt, wird die Muskulatur gestützt und die Gefäße dadurch komprimiert. Venenklappen, die sich öffnen und schließen verhindern das Absacken des Blutes in die Beine. Dadurch ist auch eine Bewegungsrichtung (Richtung Herz) vorgegeben. 51 Die Compliance ist das passive Dehnungsverhalten (je höher der Muskeltonus, desto kleiner ist der Wert der Compliance). Die venöse Compliance ist ein variabler wert, der abhängig ist von Füllungszustand des Niederdrucksystems, transmuralen Druck und Venentonus. 52 Die hydrostatische Indifferenzebene ist derjenige Ort im Gefäßsystem, dessen Druck und damit auch der Gefäßdurchschnitt sich bei Lagewechsel nicht ändert. (Mensch 5 - 10 cm über dem Zwerchfell) 124 Bei einer Insuffizienz der Venenklappen kann die Muskelpumpe nicht mehr wirksam werden. Der hohe druck der nun auf den Venen der Beinen lastet, kann diese Ausdehnen. Es kommt zur Ödembildung und die Thrombosegefahr steigt an. Ödeme Es sind pathologische Flüssigkeitsansammlungen im Interstitium oder in den Zellen selbst. Sie entstehen durch: Erhöhung des kapillaren Blutdrucks Erniedrigung des kolloidosmotischen Drucks Gesteigerte Durchlässigkeit der Kapillarwand Störung des Lymphabflusses Rückstau vor dem Herzen bei Insuffizienz Sicherheitsmechanismen: Arteriellen Sicherheitssystem: bei Rückstau werden die venösen Gefäße gedehnt, so daß der veno-arterielle Reflex eine Drosselung des Einstroms durch die vorgeschalteten Wiederstandgefäße hervorrufen kann. Intestinelles Sicherheitssystem: die gelartige Struktur des Interstitiums erschwert die Ödembildung Lymphatische Sicherheitssystem: das Lymphsystem kann bis zu eine bestimmte Menge an zuströmender Flüssigkeit aus dem Interstitium abtransportieren. 2.8 Aufgabe des Lymphsystems Über die Lymphgefäße wird die überschüssige und interstitielle Flüssigkeit in das venöse System transportiert. Es dient auch der Rückführung von Eiweiß und anderen Stoffen aus dem interstitiellen Raum zurück ins Blut. Aufbau Lymphkapillaren sind zu einem engmaschigen Netzwerk in allen Geweben (außer: oberflächliche Hautschichten, ZNS und Knochen) verzahnt. An ihrem gewebeseitigen Rand sind sie geschlossen. Die Wand besteht aus Endothelzellen. Sie ist durchlässig für alle in der interstitiellen Flüssigkeit enthaltenen Stoffe und Eiweiß. Sie werden zu Lymphgefäßen und ziehen letztendlich als Ductus thoracicus und Ductus lymphaticus dexter in die linke V. subclavia. In größeren Lymphgefäßen befinden sich Lymphknoten. Dort werden Lymphozyten gebildet für Siebund Abwehrfunktionen. Phagozytierende Retikulumzellen nehmen Fremdstoffe auf. Aufnahme und Transport Die Aufnahme der interstitiellen Flüssigkeit erfolgt über Spalten. Durch die Entleerung der distalen Lymphgefäßabschnitte wird ein Druckgradient erzeugt. Der Transport wird durch die rhythmische Kontraktion der mit glatter Muskulatur ausgestatteten Lymphgefäße gesichert. Klappen sorgen für die 125 ausschließliche Strömung der Lymphe zu den Venen. Ebenso sorgten Kompressionskräfte durch die Kontraktion der Skelettmuskulatur für eine erhöhte Lymphstromstärke (Muskelpumpe) Zusammensetzung Die Zusammensetzung gleicht grundsätzliche der interstitiellen Flüssigkeit. Der Gehalt der gelösten Stoffe entspricht denen des Blutplasmas, der Eiweißgehalt ist unterschiedlich. Im Magen-Darm-Kanal kommt zusätzlich noch der Abtransport absorbierter Stoffe (Fette) hinzu. Die Lymphe ist gerinnungsfähig! Eiweißkörper haben ein Molekulargewicht wie das Fibrinogen (Fibrinogengehalt!) 2.9 Blutdruckregulation Funktion Sicherstellung der Mindestdurchblutung aller Organe Optimierung von Herzaktion und Blutdruck Verteilung des Blutstroms nach aktuellen Bedürfnissen Mechanismen der Regulation a) Zentrale Regulation durch ZNS und Hormone b) Sympathisch-noradrenerge Steuerung: Arteriolen und im geringen Maße auch Venen sind von einem postganglionären noradrenergen Netzwerk mit Nervenfasern umgeben, die über den Sympathikus gesteuert werden. In der Regel haben sie einen bestimmten Spannungszustand, den sog. Ruhetonus, der sich bei einer niederfrequenten Entladungsrate einstellt. Bei einer Steigerung der Entladungsrate und dadurch einer erhöhten Freisetzung von Noradrenalin, verengen (konstringieren) sich die Gefäße, bei einem Absinken der Rate unter den Wert des Ruhetonus, erweitern (dilatieren) die Gefäße. Hormonale Steuerung durch zirkulierende Katecholamine: Die Wirkungen sind unterschiedlich. Sie können die Gefäße sowohl erweitern, als auch verengen. Die Katecholamine werden aus den perivaskulären Nervenendigungen (Noradrenalin) oder aus dem NNM (Adrenalin) freigesetzt. Sympathisch-cholinerge Steuerung: Bei einigen Spezies werden Stellen der glatten Muskulatur nicht durch Adrenalin, sondern durch Acetylcholin innerviert. Parasympathisch-cholinerge Steuerung: Diese Art der Innervation ist relativ unbedeutend. Steuerung durch Kotransmission: Zahlreiche Neurone können neben den regulären Transmittern auch noch vasoaktive Peptide bilden. Dazu gehören das vasoaktive intestinale Peptid (dilatierend) und das Neuropeptid Y (konstringierend). Periphere Regulation Autoregulation: Bei steigendem intravasalen Druck werden die Gefäße passiv gedehnt, so daß eine größeres Volumen hindurchströmen kann (Lunge). Bei autoregulatorischen Gefäßen spannt sich die Muskulatur an, so daß der Gefäßwiderstand ansteigt. Diese Regulation ist nur bis zu einem Perfussionsdruck von 150 - 180 mmHg möglich. Autoregulation bedeutet die weitgehende Konstanz der Durchblutung bei wechselnden Perfussionsdrücken. Lokale Regulation der Durchblutung: Bei einer lokalen Regulation werden je nach Bedarf lokale Faktoren freigesetzt, die in Abhängigkeit von der funktionellen Aktivierung gebildet 126 werden und gleichzeitig vasodilatierend auf die Widerstandsgefäße einwirken. Diese Regulation wird ergänzt durch eine lokale, metabolische Regulation. Die vom Stoffwechsel produzierten Substanzen gelangen zu den Gefäßen und werden dort vasoaktiv. Dazu gehören: Wasserstoffionen, Adenosin und das bei der ATP-Spaltung freiwerdende anorganische Phosphat (Pi). Gewebshormone53: Die wichtigste konstringierende Substanz ist das von der Niere gebildete Angiotensin II. (s. auch Renin-Angiotensin-Aldosteron-System, RAAS). Vasodilatierende Wirkung haben die Hormone Histamin und Bradykinin. Sie wirken besonders bei allergischen Reaktionen, z. B. Rötung der Haut, aber auch an der glatten Muskulatur der Bronchen und des Interstitiums. Alle an die Kreislaufregulation beteiligten Vorgänge beeinflussen direkt oder indirekt: Herzzeitvolumen (Änderung der Herzleistung) Totalen peripheren Widerstand (Änderung der Gefäßweite) Gefäßkapazität Intravasales Volumen (Blutzeitvolumen) Regulation bei Störungen durch Erkrankungen des Gefäßsystems: Bei akuten Störungen erfolgt ein Ausgleich über die Reaktion des Gefäßsystems. Bei chronischen Störungen erfolgt eine Änderung des Blutvolumens (Wasser- und Elektrolythaushalt, Änderung der Plasmaproteine und der zellulären Bestandteile des Blutes) Kurzfristige Anpassungsvorgänge Pressorezeptorenreflexe bewirken eine Änderung des Sympathiko- und Parasympathikotonus, ausgelöst durch Dehnungsrezeptorenreflexe und Verhaltensreaktionen (Kreislaufregulation bei Alarmreaktionen). Es sind nerval gesteuerte vasomotorische Umstellungen durch Presso- bzw. Dehnungsrezeptorreflexe, Chemorezeptoren hervorgerufene Kreislaufeffekte und Ischämiereaktion des ZNS. Sie wirken innerhalb von Sekunden und werden durch humorale Einflüsse ergänzt (Adrenalin, Noradrenalin, Adiuretin und Angiotensin II). a) Presso- und Barorezeptoren Eine Dehnung der Gefäßwand führt zu einer Reizung der Rezeptoren. Sie sind besonders wichtig im Aortenbogen und im Karotissinus. Sie liefern Informationen über: den mittleren arteriellen Druck Größe der Druckamplitude Steilheit des Druckanstiegs Herzfrequenz Bei Pressorezeptoren führt eine Hemmung von sympathischen und parasympatischen Neuronen zu einer Blutdrucksenkung (Vasomotorentonus sinkt). Eine Hemmung erfolgt schon bei normalen Blutdruckwerten. Bei einer Erregung werden die sympathischen Efferenzen gehemmt, 53 Ein besonders großes Spektrum zeigen die Prostaglandine, z. B. Thromboxan A2 (TXA2), das in den Blutplättchen gebildet wird und eine Vasokonstriktion und Plättchenaggregation hervorruft. Ein anderes Beispiel ist das Prostacyclin (PGI2), das in Endothelzellen gebildet wird und eine Vasodilatation sowie eine Hemmung der Plättchenaggregation hervorruft. 127 die parasympathischen Nerven des Herzens werden erregt. Die sympathischen adrenergen vasokonstriktorischen Fasern besitzen einen Basistonus: Durch Erhöhung der Sympathikus-Frequenz X Durch Senkung der Sympathikus-Frequenz In den Widerstandsgefäßen kommt es zu einer totalen Abnahme des peripheren Widerstandes (TRP ). In den Kapazitätsgefäßen kommt zu einer Zunahme der Kapazität, was die Senkung des arteriellen Blutdrucks zur Folge hat. Das Ganze wird durch die Abnahme des Herzzeitvolumens noch verstärkt. Hämostatische Steuermechanismen des Kreislaufs funktionieren über eine negative Rückkopplung in einem geschlossenen Regelkreis. Die Aktivität der arteriellen Pressorezeptoren beeinflußt auch andere zentral gesteuerte Funktionen (Atmung und Muskeltonus). Rezeptoren sind über den Einfluß auf das kapilläre Filtrations-Reabsoptions-Gleichgewicht an der Regulation des Blutvolumens beteiligt. b) Kardiale Dehnungsrezeptoren und arterielle Chemorezeptoren Vorhofrezeptoren sind sog. Dehnungsrezeptoren. Man unterscheidet zwei verschiedene Typen: c) A-Rezeptoren: Vorhofkontraktion. Sie werden durch die Kontraktion der Vorhofmuskulatur aktiviert. Durch eine Erregung wird das sympathische System aktiviert. B-Rezeptoren: späte Ventrikelsystole (Vorhofdruck ). Sie werden durch passive Dehnung erregt. Die Erregung erfolgt wie bei den Pressorezeptoren. Sie haben jedoch besonders starke vasomotorische Wirkungen an den Nierengefäßen. Sie beeinflussen die renale Flüssigkeitsausscheidung. Es kommt zu einer Abnahme der Renin-Freisetzung, was zu einer verminderten Aktivität des Renin-Angiotensin-Aldosternon-Systems führt. Ischämie-Reaktionen des ZNS Es kommt zu einer Erregung der medullären sympatho-exzitatorische Neutone vasokonstriktorische Reaktion Blutdruck steigt. Es entsteht durch eine unzureichende Versorgung des Gehirns (arterieller Druck sinkt, arterielle Hypoxie, Störungen der Hirndurchblutung). Erregungen entstehen durch die Zunahme der H+- / CO2-Konzentration. Das führt zu einer Freisetzung von Adrenalin und Noradrenalin (s. hormonelle Regulation) Mittelfristige Anpassungsvorgänge bei plötzlicher Druckänderung (innerhalb von Minuten Stunden) wird eine Volumen- und Druckkompensation durch transkapilläre Flüssigkeitsverschiebungen (Mikrozirkulation) und eine Änderung der Reninabgabe hervorgerufen Langfristige Anpassungsvorgänge Anpassung der Größe des Extrazellulärraumes an Blutdruckänderungen (Änderung der Flüssigkeitsausscheidung durch die Niere) = renale Volumenregulation. Es ist eine Anpassung des Blutvolumens an die jeweilige Kreislaufsituation: Über vasomotorische Reaktionen und das Renin-Angiotensin-System 128 Durch transkapillären Flüssigkeitsaustausch (Flüssigkeitsverschiebungen zwischen intravasalem und interstitiellem Volumen) Renales Volumenregulationssystem: Ansteig des arteriellen, renalen Blutdrucks führt zu einer erhöhten renalen Flüssigkeitsausscheidung. Bei gleichbleibender Flüssigkeits- und Salzaufnahme extrazelluläres Flüssigkeitsvolumen und Blutvolumen mittlerer Füllungsdruck Herzzeitvolumen Senkung des Blutdrucks Dieses System wird über hormonelle und nervöse Einflüsse moduliert greifen an der Niere und an der glatten Gefäßmuskulatur an. Hormonelle Wirkungen auf den Blutdruck 1. Atriopeptin (ANP) das ist ein Peptidhormon mit 28 AS. Die Bildung erfolgt in den Myozyten des linken und rechten Vorhofs. Die Dehnung der Vorhöfe stellt einen adäquaten Reiz dar und führt zur Sekretion von ANP. Weiteres Vorkommen in Gehirn, Aortenbogen, Nebenniere und Niere). Funktionen: 2. Reduktion des Blutdrucks, des Blutvolumens und des Herzschlagvolumens Hemmung der Freisetzung von Renin, Adiceretin und Aldosteron Steigerung der glomerulären Filtrationsrate und Hemmung der Na+-Resorption in der Niere Zelluläre Effekte über die Stimulation der Guanylatzyklase cGMP vasodilatatorischer Effekt Renin-Angiotensin-Aldosteron-System (RAAS) Renin aus dem juxtaglomerulären Apparat der Niere) spaltet das aus der Leber synthetisierte Angiotensinogen in das Angiotensinogen I. Dies wird durch das angiotensin-converting-enzyme (ACE) an der luminalen Oberfläche des Endothels in das Angiotensin II umgewandelt. Es wirkt sehr stark vasokonstriktorisch und führt zu einem Blutdruckanstieg. An den Nieren: Verminderung der renalen Durchblutung Abnahme der glomerulären Filtrationsrate. 3. Adrenalin und Noradrenalin Sie werden im Nebennierenmark gebildet. Funktion: 4. In niedrigen Konzentrationen führt es in den meisten Geweben zu einer Kontraktion der Arteriolen und Venen In hohen Konzentrationen führt es zu einer Vasokonstriktion aller Gefäße Infusion von Noradrenalin führt zu einer Vasokonstriktion und damit zu einem Blutdruckanstieg Infusion von Adrenalin erniedrigt den peripheren Widerstand, es kommt zu einer Vasodilatation in der Skelettmuskulatur und kompensiert dadurch die Vasokonstriktion in den anderen Gefäßgebieten vollständig. Senkung von Adrenalin führt in Skelettmuskulatur, Myokard und Leber zu einer Dilatation. Das Adrenalin hat eine hohe Affinität zu den -Adrenorezeptoren. Nach einer Blockade der -Rezeptoren erfolgt die Erregung über die -Rezeptoren und führen zur Vasokonstriktion! Adiuretin (ADH, Vasopressin) 129 Funktion: Wasserrückresorption am Sammelrohr der Niere Vasomotorische Aktivitäten Bei ADH-Anstieg kommt es in den meisten Geweben und der Niere zur Vasokonstriktion Endothelial vermittelte Vasodilatation kommt an Hirn- und Koronargefäßen von. ADH stimuliert die Freisetzung von Stickoxyd (NO) über einem am Endothel befindlichen Rezeptor. 130 HORMONE 1. Allgemeines 1.1 Funktion der Hormone Es sind chemische Nachrichtenüberträger, die in spezialisierten Zellen produziert werden und von diesen in die Blutbahn sezerniert werden. Über die Blutbahn gelangen sie zu ihren Zielzellen, die nur für sie spezielle/ spezifische Rezeptoren besitzen. Die Hormone binden an den Rezeptor und übermitteln so die Information. Sie beeinflussen den Körper in verschiedenen Bereichen, v. a. in der Funktion und der Regelung von Vorgängen. Sie Regelung kann innerhalb von Minuten oder Stunden erfolgen, ist aber alles in allem wesentlich langsamer, wie die Steuerung über das Nervensystem. 1.2 Hormonproduktion Hormone werden in speziellen Drüsenzellen produziert, die entweder einzeln oder in Gruppen zusammengefaßt als Organ im Körper liegen. Die Speicherform sind Granula, in denen die Hormonmoleküle aufbewahrt werden. Bei Gebrauch verschmilzt die Membran der Granula mit der Plasmamembran, so daß die Hormone in den interzellulären Raum gelangen. Dieser Vorgang wird als Exozytose bezeichnet. 1.3 Hormonklassen Lipidhormone Sind fettlöslich Diffundieren durch die Zellmembran Binden an Rezeptoren im Zellinneren (Cytoplasma) Protein- und Peptidhormone Bestehen aus Aminosäuren Besitzen ein höheres Molekulargewicht Sind i. d. R. weniger lipophil und können daher die Membran schlechter Passieren Rezeptoren liegen an der Außenseite der Membran Schilddrüsenhormone Bestehen aus 2 AS, die über eine Ätherbrücke verknüpft sind Binden an Rezeptoren im Zellkern 1.4 Wirkmechanismen 131 Durch die Tatsache, daß ein Hormon nur an spezifische Rezeptoren binden kann, die sich entweder im Cytoplasma oder an der Zellmembran befinden, unterscheidet man 2 Wirkmechanismen: a) Intrazellulärer Hormonkomplex Das Hormon bindet an einen Rezeptor im Zellinneren und kann somit direkt genetische Informationen beeinflussen. Diese genome Wirkung beeinflußt wiederum die Syntheseleistung der Zellen, z. B. die Proteinsynthese. b) Plasmamembranständiger Hormonkomplex Bei der Bildung eines plasmamembranständigen Komplexes werden die Informationen über einen Second messenger, der sich innerhalb der Zelle befindet, weitergeleitet. 2. Hypothalamus 2.1 Lage und Hormone Der Hypothalamus ist ein Teil des ZNS. Die hypothalamischen Nervenzellen produzieren chemische Nachrichtenträger, die bei Aktivierung des Nervensystems in ein spezielles Gefäßsystem, dem Portalsystem (Eminentia mediana), sezerniert werden. Dieses liegt zwischen dem Hypothalamus und der Hypophyse. Es reguliert somit den Hypophysenvorderlappen (HVL). Die unterschiedlichen Wirkungen werden über unterschiedliche Neutrohormone bewirkt. Eine Ausschüttung eines HVL-Hormons wird über Releasing Faktor (RF) oder Releasing Hormon (RH) geregelt, während die Sekretion eines HVL-Hormons von Inhibiting Faktor (IF) oder Inhibiting Hormon (IH) verhindert wird. Releasing Hormone (RH) Kurzbezeichnung Name TRH Thyreotropin-Releasing-Hormon GnRH Gonadotropin-Releasing-Hormon CRH Corticotropin-Releasing-Hormon GHRH Growth Hormone-Releasing-Hormon PRH Prolaktin-Releasing-Hormon Wirkung auf ... TSH LH und FSH ACTH GH (STH) PRL Inhibiting Hormone (IH) Kurzbezeichnung GHIH oder SS PIH Name Growth Hormone-Inhibiting-Hormon bzw. Somatostatin Prolaktin-Inhibiting-Hormon Wirkung auf ... GH PRL 2.2 Beeinflussung der Hormonproduktion Die Hormonproduktion des Hypothalamus wird beeinflußt durch intra- und extrahypothalamische Neurone. Die Kontrolle erfolgt dann häufig durch: 132 Mittelhirn: durch noradrenerge, adrenerge und serotonerge Neurone Limbische Strukturen: durch die Nuclei amygdalae und den Hippocampus Ebenso erfolgt eine Integration von Einflüssen aus der Umwelt und der Innenwelt, sowie durch emotionale Regungen. 3. Hypophyse 3.1 Anatomie Die Hypophyse liegt im Schädelinneren in der Sella turcica und kann so vor mechanischen Einflüssen (Traumen) geschützt werden. Sie besteht aus 3 völlig verschiedenen Strukturen: Hypophysenhinterlappen (HHL), die sog. Neurohypophyse, besteht aus einer Ansammlung von Axonendigungen, deren Somata m Hypothalamus liegen) Hypophysenvorderlappen (HVL), die sog. Adenohypophyse, besteht aus hormonproduzierenden Zellen Hypophysenzwischenlappen (HZL) bildet eine Trennlinie zwischen HVL und HHL, hat aber keine größere Bedeutung für die Säugetiere. 3.2 Hypophysenvorderlappen (HVL) Im Gegensatz zum HHL wird die Drüse nicht über nervale Impulse, sondern ausschließlich über Neurohormone reguliert. Durch die Anfärbung von histologischen Schnitten des HVL, kann man 3 verschiedene Zellarten unterschieden: acidophile (eosinophile), basophile und neutrophile, chromophobe Zellen. Insgesamt werden 6 Hormone gebildet, die sich in glandotrope und nicht-glandotrope Hormone einteilen lassen. 3.3 Glandotrope Hormone Glandotrope Hormone haben als Zielorgan eine Hormondrüse. Sie stimulieren dort die Funktion. Kurzbezeichnung ACTH TSH FSH LH Name Adrenocorticotropes Hormon, Corticotropin Thyreotropes Hormon, Thyreotropin Follikelstimulierendes Hormon Luteinisierendes Hormon Bildungsort Steuerfaktor des Hypothalamus Zielorgan neutrophile Zellen CRF Nebennierenrinde basophile Zellen TRF Schilddrüse basophile Zellen GnRH Follikel basophile Zellen GnRH Gelbkörper Als Glandotropine werden das Follikelstimulierende Hormon (FSH) und das Luteinisierende Hormon (LH) bezeichnet, weil sie auf die Gonaden wirken. Bei der Frau wirk das FSH bei der Reifung der ovariellen Follikel mit und das LH bewirkt die Ruptur des Follikels und die Bildung des Gelbkörpers (Corpus luteum). Beim Mann sind die Hormone ebenfalls vorhanden. So erfüllt das FSH eine wichtige Funktion bei der Reifung der Spermien und das LH führt zu einer vermehrten Testosteronproduktion. 133 3.4 Nicht-glandotrope Hormone Die nicht-glandotropen Hormone wirken auf Organsysteme oder auf den gesamten Organismus. KurzbeSteuerfaktor des Name Bildungsort Zeichnung Hypothalamus human growth hormon, GRF und HGH oder GH Wachstumshormon (Somatotropes Hor- eosinophile Zellen Somatostatin mon, Somatotropin, STH) PRL Prolaktion eosinophile Zellen PRF und PIH Melanozytenstimulierendes Hormon, MSH Melanotropin Wachstumshormon (GH) a) Regelung des Wachstums GHRH und Somatostatin aus der Hypophyse wirken stimulierend oder hemmend auf die Hypophyse und dessen Produktion von Wachstumshormonen (GH und STH). Werden die Wachstumshormone sezerniert, so wirken sie direkt auf die Steigerung der Lipolyse und der Glycogenolyse, sowie indirekt über in der Leber gebildete Somatomedine. Diese Faktoren, v. a. das Somatomedin C, bewirken eine Steigerung der Proteinsynthese, der Zellteilung, der Chondrogenese und des Knochenwachstums. Hypothalamus GHRH Somatostatin Hypophyse + Wachstumshormon - Somatomedine Chondrogenese Knochenwachstum Zellteilung Proteinsynthese (insulinagonistische Wirkungen) b) Lipolyse Glycogenolyse (insulinantagonistische Wirkungen) Krankheitsbilder Proportionierte Zwerge: Mangel an Wachstumshormonen während der Entwicklung (v. a. bei Kindern). Das Wachstum erfolgt proportioniert, bleibt jedoch zu gering. Häufig liegt eine Hypophysenunterfunktion vor. Eine Stimulation des Wachstums erzielt man bei der Gabe von Wachstumshormon-Realeasing-Hormonen (GHRH). Gigantismus (Riesenwuchs): Tumorartige Entartungen der eosinophilen Zellen, die für die Bildung von Wachstumshormonen verantwortlich sind, führen zu einer übermäßigen Produktion von GH. Die Kinder wachsen dadurch mehr als normal, bis das Wachstum durch den Epiphysenschluß abgeschlossen wird. 134 Akromegalie: Bei Erwachsenen kann durch die übermäßige Produktion von GH kein Längenwachstum des Körpers mehr stattfinden. Statt dessen wachsen die Körperspitzen (Akren), v. a. Finger, Füße, Kinn und Ohren. Damit verbunden ist häufig noch Diabethis mellitus durch die insulinantagonistische Wirkung der Wachstumshormone. Prolaktin Die Regelung der Prolaktinfreisetzung erfolgt hauptsächlich über das inhibitorische System, dem Prolaktin-Inhibiting-Hormon. Das PIH ist das biogene Amin Dopamin. Bei Säugetieren wirkt es auf die Brustdrüse, beim Menschen führt es zur Ingangsetzung und Erhaltung der Laktation (Galaktogenese und Galactopoese). Melanozytenstimulierendes Hormon, Melanotropin Das MSH hat nur eine Bedeutung bei den Tieren. Es führt bei niederen Wirbeltieren zur Bildung von Pigmentzellen und beim Säugetier trägt es mit zur Entwicklung der Feten bei. 3.5 Hormone des Hypophysenhinterlappens (HHL) Die Vorläufer des Hormons werden im Nucleus supraopticus und im Nucleus paraventricularis des Hypothalamus gebildet. Über den axonalen Transport, bei dem sie an ein Carrier (Neurophysin) gebunden sind, gelangen sie zum HHL. Hier werden sie in Granula gelagert und bei Bedarf freigesetzt. Die Freisetzung erfolgt aus den Nervenendigungen der HHL durch Exozytose. Es werden 2 Hormone produziert: Antidiuretisches Hormon (ADH, Vasopressin) a) Wirkungen b) Regulation c) Eine vermehrte Ausschüttung von ADH bewirkt in der Niere eine Wasserpermeabilitätssteigerung des Sammelrohrepithels. Dies führt zur Diurese und zum Einbau von Wasserkanälen zur Rückresortion von Wasser. Es steigt die Konzentrierung des Tubulusharn, so daß ein hypoosmolarer Harn gebildet und ausgeschieden wird. Bei hohen Konzentrationen führt es zur Vasokonstriktion der Gefäße und somit zu einer Erhöhung des Blutdrucks. Im Pfortadersystem kommt es dagegen zu einer Blutdrucksenkung. Beim Huhn wirkt es auf die glatte Muskulatur und auf die Eiablage. Freisetzung bei Hyperosmolarität (Osmorezeptoren; die Regulation erfolgt über den Hypothalamus und die Leber) Freisetzung bei Hypervolämie (Volumenrezeptoren in Venen und im rechten Vorhof) Freisetzung wird stimuliert über Angiotensin II und durch Streß. ADH-Mangel Bei einem Ausfall der ADH-Produktion kommt es zu einem Zustandsbild des Diabethis insibitus. Hierbei steigt die Urinausscheidung, so daß große Mengen an einem hyperosmolaren Urin 135 ausgeschieden werden Zusätzlich stellt man eine Erniedrigung des Blutvolumen und des Blutdruck fest. Oxytocin Das Oxytocin ist das sog. („Wehen-Hormon“). Es wirkt auf das Myometrium des Uterus, sowie auf das Myoepithel der Brustdrüse. a) Geburt Wenige Tage vor der Geburt steigt die Konzentration der Östrogene an und damit auch die Sensibilität des Myometriums des Uterus Die Cervix und die Vagina sind besonders empfindlich für mechanische reize. Wenn nun der Fetus im Geburtskanal auf die Cervix drückt, nehmen Mechanorezeptoren die Reize wahr und leiten die Information über das Rückenmark weiter zum Hypothalamus. Dort wird durch die Dehnung vermehrt Oxytocin produziert und ausgeschüttet (Ferguson-Reflex). Dieses bindet an die Rezeptoren der glatten Muskelzellen und führt somit zu Uteruskontraktionen und zum Einsetzen der Wehen. (Die Regulation erfolgt über eine positive Rückkopplung!) b) Milchejektion Das Saugen des Säuglings bildet einen mechanischen Reiz an der Brustwarze. Über Rezeptoren wird diese Information wieder zum Hypothalamus geleitet, wo Oxytocin ausgeschüttet wird. Dieses bewirkt eine Kontraktion des Myoepithels, das sich um die Alveolen spannt, so daß dadurch die Milch entleert wird. Das Ganze heißt auch Milchejektionsreflex. 4. Schilddrüse 4.1 Anatomie Die Schilddrüse besteht aus Follikeln, die von Epithelzellen ausgekleidet sind. Es dient zur Speicherung der Hormone. Die Speicherung erfolgt in Form von Thyreoglobin, ein Glykoprotein. 4.2 Hormone Trijodthyronin (T3): T3 ist die Wirkform Thyroxin (T4): T4 ist eigentlich nur ein Prohormon. Es verzeichnet eine geringere Aktivität 4.3 Synthese Jod wird durch die Nahrung als Jodid (J -) aufgenommen. Die Resorption erfolgt im Darm und über den Blutweg gelangt es in die Schilddrüse. Die Schilddrüsenzellen nehmen das Jod über den sekundär aktiven Transport auf. (Hemmung durch ClO4-, SCN- und NO3-) Die Schilddrüsenzellen produzieren ein hochmolekulares Protein, das Thyreoglobin. Es enthält auch Tyrosinmoleküle (Aminosäure). Durch eine Peroxidase wird das Jodid zu atomaren Jod oxidiert, das nun an die Thyrosinradikale des Thyreoglobins angelagert wird. Dieser Vorgang wird als Jodierung, wobei Mono- und Dijodthyrosyl gebildet wird. Die jodierten Thyrosinradikale kondensieren zu Thyroxin (Tetrajodthyronin, T 4) und zu geringen Mengen Trijodthyronin (T3). Beide werden in das Thyreoglobin eingebaut und im Kolloid der Schilddrüsenfollikel gelagert. 136 Schritt Formel Jodid wird durch die Peroxidase aktiviert. J + H2O2 J + 2 OHDas Jod wird an die Thyrosinradikale des J + Thyrosinrest Mono- und Dijodtyrosin Thyreoglobins angelagert. (Jodierung) Über eine Kondensationsreaktion reagieren 2 Dijodthyrosin Tetrajodthyronin (T4) bzw. die Mono- bzw. Dijodthyrosin zu Thyroxin. 1 Mono- + 1 Dijodthyrosin Trijodthyronin (T3) 4.4 Freisetzung Thyreoglobin wird aus dem Follikellumen durch Pinozytose aufgenommen. In den Zellen wird es durch Proteasen aus den Lysosomen umgewandelt und als T 3 und T4 durch Proteasen freigesetzt. Die Abgabe nach „außen“ in die Blutbahn erfolgt über Exozytose. Die Moleküle werden dort mit einer nicht-kovalenten Bindung an Plasmaproteine gebunden. Es sind hauptsächlich Proteine, wie z. B. Albumin, T-bindendes Globulin oder T-bindendes Präalbumin. In der Peripherie wird das Thyroxin in die Wirkform T3, das Trijodthyronin, durch Iodabspaltung umgewandelt. Nur ein sehr kleiner Teil liegt ungebunden im Blut vor. Aktiviert wird es durch die Freisetzung von TSH aus der Hypophyse. 4.5 Regelung der Hormonbildung Regelung der Hormonbildung Neuroendokrine Zellen (Neurone) des Hypothalamus bilden den TRF (Thyreotropin-ReleasingFaktor). Über den axonalen Transport gelangt es an die Nervenendigungen, von dort ins Blut und zum HVL. Es fördert dort die Abgabe von TSH (Thyreotropin). Es ist glandotropes Hormon, das auf die Drüse wirkt, in dem Fall die Schilddrüse. In der Schilddrüse hat es Rezeptoren für TSH. Es führt dort zu einer Erhöhung des cAMP und zu einer Abgabe von Schilddrüsenhormonen. Das cAMP führt zu einem vermehrten Abbau von Thyreoglobulin (Speicherform) und stimuliert alle Funktionen zur Neubildung von Schilddrüsenhormon. TRF Hypothalamus TSH HVL Schilddrüse Über die negative Rückkopplung wird die Produktion geregelt. Bei einer Steigerung der Schilddrüsenhormonkonzentration, wird die Abgabe von TRF aus dem Hypothalamus und damit auch die Abgabe von TSH aus der Hypophyse aus dem HHL gehemmt. Wirkungen von TSH auf die Schilddrüse Proteolyse von Thyreoglobin (Abbau ) Jodidtransport Jodierung des Thyrosins und Kopplung des jodierten Thyrosins (Kondensation ) Vergrößerung der Schilddrüsenzellen Zellwachstum (Hyperplasie) Schilddrüsenwachstum Stimulierung der Peroxidasen 4.6 Wirkung der Hormone54 54 Die Hormone wirken auf alle Zellen und stimulieren den gesamten Stoffwechsel im Körper. 137 Wirkungen auf den Stoffwechsel Enzymaktivität und -synthese Energiestoffwechsel Kohlenhydratstoffwechsel Fettstoffwechsel Proteinstoffwechsel Aktivierung von Enzymen, z. B. für die Atmungskette Regulation der Synthese von Proteinen, v. a. Neusynthese Turnover (ATP) Thermogenese Oxidativer Stoffwechsel ATP-Synthese und ATP-Verbrauch Turnover Glucoseoxidation, Glycogenolyse, Gluconeugenese und Glucoseresorption Blutzuckeranstieg Fettoxydation und Lipolyse Blutcholesterinkonzentration Proteinturnover (Neubildung und Abbau) Stimulieren das ZNS Verkürzung der Reflexzeiten Verstärkung der Wirkung des Symathicus Frequenz Schlagkraft Gesamtorganismus Nervensystem Herz und Kreislauf Wachstum und Differenzierung Stimulation von Wachtum- und Differenzierung, v. a. in der Fetal- und Postnatalperiode. Hier können Störungen der ZNS-Entwicklung auftreten.) Jodmangel im Muttertier wirkt sich auf den Fetus aus! 4.7 Pathophysiologie Unterfunktion (Hypothyreose) Bei einem Erwachsenen führt die Unterfunktion (Hypothyreose) hauptsächlich zu einer Verlangsamung der Stoffwechselvorgänge. Zusätzlich treten noch eine verzögerte Reaktionen auf Umweltreize und das Myxödem (ödematös-teigige Infiltration der Haut, des Unterhaut- und Muskelgewebes aufgeschwemmtes Aussehen). Krankheitsbild: Stoffwechsel , Wachstum , Kälteempfindlichkeit, Muskelschwäche, Myxödem und Haasausfall. Fehlen die Schilddrüsenhormone schon im Kindesalter, tritt eine schwere körperliche und geistige Behinderung auf, die als Kretinismus bezeichnet wird. Die Kinder sind i. d. R. klein und wirken sehr plump. Überfunktion (Hyperthyreose) Die Patienten, die unter der Schilddrüsenüberfunktion leiden, zeigen das links angegebene Krankheitsbild. Sie haben einen erhöhten Stoffwechsel und wirken permanent sehr nervös. 138 Krankheitsbild: Grundumsatz , Gewichtsverlust, Hyperphagie, Hitzeempfindlichkeit, Tachykardie55, Nervosität, Exophtalmus56 und Kropfbildung. Jodmangel Bei Jodmangel wird mehr TSH abgegeben. Es wirkt als Wachstumsreiz auf die Schilddrüse, es entsteht ein Kropf oder Struma, wie auch das Krankheitsbild bezeichnet wird. Da eine negative Rückkopplung unterbleibt, vergrößert sich die Schilddrüse. Es tritt v. a. im Gebirge und im Landesinneren auf. Eine geringere Synthese der Schilddrüsenhormone, die bei Jodmangel auftreten, führen zu einer Senkung der Konzentration von T3 und T4 im Blut. Dies führt zu einer Enthemmung der TRF- und TSH-Ausschüttung, so daß es zu einer Schilddrüsenvergrößerung durch TSH kommt. 4.8 C-Zellen Anatomie Die C-Zellen der Nebenschilddrüse sind parafollikuläre Zellen mit einem ausgeprägten rauen Endoplasmatischen Retikulum (rER). Die Hormonspeicherung erfolgt im Bindegewebe zwischen den Schilddrüsenfollikeln. Weitere C-Zellen befinden sich noch im Thymus, der Hypophyse und im Hypothalamus. Beim Vogel erfolgt die Bildung in den ultrabronchialen Körperchen. Calcitonin (Thyreocalcitonin) Es ist ein Peptidhormon aus 32 Aminosäuren. Die Stimulation der Freisetzung und dessen Wirkung erfolgt nach den folgenden Prinzipien. Sie dienen alle dazu die Calciumkonzentration im Blut zu erniedrigen. Die Stimulation zur vermehrten Ausschüttung kommt durch den Anstieg der Ca2+- (und Mg2+-) Konzentration im Blut. Es führt zu einer verminderten Osteolyse, d. h. die Osteoklastentätigkeit wird vermindert, so daß der Ca2+-Einbau in den Knochen ansteigt. Während der Nahrungsaufnahme steigt die Konzentration gastrointestinaler Hormone (Gastrin, Cholezystokinin), sowie Pankreacymin und Glucagon, die die Stimulation zur vermehrten Ausschüttung von Calcitonin den C-Zellen geben. Das Calcitonin wirkt noch während der Nahrungsaufnahme auf die Tätigkeit des Magen-Darm-Kanals. Es kommt zu einer verlangsamten Verdauung, zur Herabsetzung der Magensekretion, der Pankreassekretion und der Magenmotalität, so daß es zu einer langsameren und gleichmäßigeren Ca2+-Aufnahme kommen kann. Sinn und Zweck ist es, die Calciumkonzentration nicht zu stark ansteigen zu lassen, da sonst die antagonistische Wirkung mit PTH (Parathormon) aufgehoben werden würde. (Regulation des Calcium-und Phosphathaushaltes!) 5. Nebenschilddrüse 5.1 Anatomie Sie liegt dorsal der eigentlichen Schilddrüse und wird aus 4 sog. Epithelkörperchen gebildet. Es besteht aus hellen und dunklen Hauptzellen und oxyphilen Zellen. 55 gesteigerte Herzfrequenz ein- oder beidseitiges Bewegungseinschränkung 56 hervortreten des Augapfels 139 aus der Orbita (Froschaugen) mit einer 5.2 Hormone Parathormon (PTH) Am Knochen Es bewirkt eine Calciumfreisetzung zum Knochenaufbau. Man unterscheidet zwischen einer Frühphase (Angriff der Osteozyten) und einer Spätphase (Angriff der Osteoklasten). Die Bildung und Freisetzung erfolgt je nach Bedarf. An der Niere Förderung der Ca2+-Rückresorption (Verminderung der Ausscheidung von Ca2+ionen) Hemmung der Phosphat-Rückresorption Stimulation des Umbaus vom Vitamin-D in das Vitamin-D-Hormon der Aktivierung von Vitamin D Das Hormon ist das Parathormon (PTH). Es ist ein Peptidhormon bestehend aus 84 Aminosäuren. Beim Absinken der Plasmaionenkonzentration (Hypocalcämie) wird die Freisetzung des Hormons veranlaßt. Die Wirkungen treten an der Niere und am Knochen auf, dienen aber allesamt der Regulation des Calciumhaushaltes. Das Parathormon erhöht die Calciumkonzentration im Blut. Vitamin D3-Hormon Das Vitamin D-Hormon wird aus Calciferolen gebildet. Es sind fettlösliche Substanzen, die den Steroiden nahe stehen. Man unterscheidet hier das Ergocalciferol (Vitamin D 2) und das Cholecalciferol (Vitamin D3). Sie entstehen aus ihren Provitaminen durch Ultraviolettstrahlung (Hydroxylierung). Am Beispiel des Cholecalciferol (Vitamin D3), das aus der Nahrung oder dem Cholesterinstoffwechsel, stammt, durch UV-Licht und der 1-Hydroxylase umgewandelt bzw. hydroxyliert. Es entsteht 1,25 - Dihydroxycholecalciferol, das sog. „Vitamin-D3-Hormon“. Stimuliert wird die Reaktion durch PTH (Parathormon) und gehemmt durch Phosphat- und Calciumionen Reguliert wird es über die negative Rückkopplung, die die PTH-Sektretion aus der Schilddrüse hemmt. Das Hormon entfaltet seine Wirkung bei der Resorption von Calcium und Phosphat aus dem Darm, die dadurch gesteigert wird. Des weiteren wirkt es indirekt auf den Knochenumbau (Aufund Abbau des Knochens). Ein Mangel an Vitamin D3 führt zur Rachitis. Das ist eine mangelhafte Mineralisierung des Knochens durch Ca2+-Mangel. Es entsteht durch eine gestörte Nahrungsaufnahme oder Produktion im Körper. Dies führt zur Deformation, Verbiegung und zur Instabilität der Knochen. 5.3 Stoffwechsel des Calciums Es führt dazu, daß die Ca2+-Konzentration im Blut relativ konstant gehalten wird: Ca2+ Calcitonin Ca2+ Parathormon Hemmung des Knochenabbaus verlangsamt die Ca2+-Aufnahme mobilisiert Ca2+-Reserven Resorption über Vitamin D3 6. Nebenniere 6.1 Nebennierenmark (NNM) 140 Bau und Funktion Das Nebennierenmark leitet sich aus der Neuralleiste ab (ektodermale Herkunft). Sie entsteht aus sympathischen Ganglienzellen und postganglionären Neuronen, die ihre Äste verloren haben und zu sezernierenden Zellen geworden sind (chomafine Zellen). Alle Zellen des NNM haben eine enge Beziehung zu Kapillaren und Venolen und enthalten auch einzelne sympathische Ganglienzellen. Innerviert werden die demnach auch über den Sympathikus (adrenerges System). Die Zellen enthalten große Mengen an Sekretganula, die die Hormone des NNM enthalten. Hormone a) Peptide b) Die Zellen enthalten außerdem noch -Endorphin, Enkephaline, Cholecystokinin, Somatostatin, Substanz P und VIP, die im ZNS oder im Gastro-Intestinal-Trakt wirken. Catecholamine Adrenalin (zu 80 %) und Noradrenalin (zu 20 %) werden in Granula zusammen mit ATP und Enzyme gespeichert, die den letzten Schritt der Synthese katalysieren. Sie dienen der Speicherung der Hormone, die dann über Exozytose abgegeben werden. Man unterschiedet zwei Arten von NNM-Zellen. Die einen synthetisieren das Adrenalin, die anderen das Noradrenalin, wobei das Noradrenalin die Vorstufe des Adrenalin ist. Wirkung der Calecholamine Adrenalin und Noradrenalin sind wasserlösliche Hormone. Die Rezeptoren befinden sich an der Zelloberfläche. Es gibt - und -Rezeptoren, die sich noch nach der Affinität für pharmakologische Substanzen in 1, 2, 1 und 2 einteilen lassen. Die Wirkung des Hormons ist also abhängig vom Rezeptortyp. 1-Rezeptoren57 2-Rezeptoren 1-Rezeptoren 2-Rezeptoren58 57 58 Vasokonstriktion Kontraktion intestinaler Sphincter Pupillendilatation Uteruskontraktion (Wehen) Hemmung der Noradrenalinfreisetzung Sympathikustonus intestinale Relaxation Macula densa (Niere) Vasokonstriktion Reninfreisetzung Herzfrequenz Schlagkraft Kontraktionskraft Vasodilatation der Koronar- und Skelettmuskulaturgefäße Bronchodilatation Uterusrelaxation Glykogenolyse in Leber und Muskel Lipolyse im Fettgewebe Ca2+ cAMP cAMP cAMP Wirkung auf Gefäße, Haut, Schleimhaut und Magen-Darm-Trakt Wirkung auf Gefäße, Skelettmuskel, Bronchen, Leber, braunes Fettgewebe und weißes Fettgewebe. 141 Thermogenese Die Catecholamine wirken bei Belastungssituationen, v. a. Streßsituation mit einer Steigerung der Herztätigkeit, Vasokonstriktion, Hemmung der Verdauungstätigkeit und einer Bronchodilatation. Des weiteren kommt es zu einer Steigerung des Stoffwechsels, da Energie für die Kampf- oder Flucht bereitgestellt werden muß. Es steigt der Glycogenabbau in der Leber, die Lipolyse im Fettgewebe und die Proteolyse im Lebergewebe. Zusätzlich wirken sie noch wie das Glucagon, in dem sie den Blutzuckerspiegel erhöhen und damit ein Antagonist zum Insulin sind. Physiologische Reaktionen des Organismus auf Belastung und Streß Es dient der raschen Bereitstellung von Energieträgern (metabolische Wirkung der Glucocorticoide). Bei akuten Streßsituationen wird die Achse Hypothalamus - Hypophyse - ... aktiviert. Es gibt dann zwei Reaktionen: Es führt zu einer Erhöhung der Cortisolspiegels im Blut. Durch das Cortisol kommt es zu einer Erhöhung der Blutglucose und es hat einen prenessiven Effekt auf die Wirkung von Katecholaminen auf die Gefäßwände. Streß stimuliert die Ausschüttung von Adrenalin und Noradrenalin aus dem NNM. Dieses bewirkt die Kontraktion der glatten Muskulatur von haut- und Darmgefäßen, Muskelfasern der Gefäße der Skelettmuskulatur erschlaffen. Dies führt zu einer Umverteilung des O 2-reichen und nähstoffhaltige Blut für die evtl. Muskelanstrengungen (Flucht, Kampf) Synthese von Adrenalin und Noradrenalin Die Grundlage bildet die Aminosäure Tyrosin. Sie wird durch Tyrosinhydroxylase in Dopa umgewandelt. Dieses wiederum durch Dopadecarboxylase in Dopamin. Es gelangt über Vesikel in das Nebennierenmark. Dort wird es durch Dopamin--hydroxylase in Noradrenalin umgebaut. Das Noradrenalin ist nur die Vorstufe des Adrenalins. Deswegen wird in einem letzten Schritt, der durch die Phenylethanolamin-N-transferase synthetisiert wird, das Noradrenalin in Adrenalin umgebaut. Tyrosinhydroxylase Dopadecarboxylase Tyrosin Dopa Dopamin Phenylethanolamin-N-transferase Dopamin--hydroxylase Dopamin Noradrenalin Adrenalin Abbau der Hormone Der Abbau der Hormone erfolgt enzymatisch in der Leber, aber auch durch Erythrozyten in der Lunge. Die Hormone COMT und MAO spielen dabei eine wichtige Rolle. Es entsteht Vanilinmandelsäure59, die über die Leber und schließlich über den Urin ausgeschieden wird. 6.2 Nebennierenrinde (NNR) Bau, Hormone und dessen Synthese 59 Bei der Diagnostik von Tumoren im Nebennierenmark wird die Vanilinmandelsäurekonzentration gemessen. (Vanilinmandelsäure ) 142 Die Nebennierenrinde ist mesodermaler Herkunft. Sie besteht aus 3 Schichten und bildet verschiedene Steroidhormone: Zonen60 Synthese von ... Zona glomerulosa Mineralokortikoide (Aldosteron) Zona fasciculata Glucocorticoide (Cortisol und Cortison) Zona reticularis Sexualhormone (Androgene und Östrogene) Glucocorticoide Wirkung Regulation des Elektrolyt- und Wasserhaushaltes Regulation des Kohlenhydrat-, Protein- und Fettstoffwechsels Alle Hormone stammen von einer gemeinsamen Vorstufe ab. Sie entstehen aus Cholesterin, das in der Leber aus Acetat aufgebaut wird. Die Vorstufe wird zu Pregnenolon, das durch Transformation zu Progesteron und anderen Hormonen wird. Die Nebennierenrinde erhält das Cholesterin über den Blutweg. Es wird jedoch auch am glatten ER gebildet und in Lipidtröpfchen der Rindenzellen gespeichert. Es ist die Grundlage der Hormonsynthese. In den Mitochondrien wird es in Pregnenolon umgewandelt. Dieses dient allen Steriodhormonen als gemeinsame Vorstufe. Regulation am Beispiel der Glucocorticoide Im Hypothalamus wird das Corticotropin-Releasing-Hormon (CRH) gebildet, das über das portale Gefäßsystem in der Hypophyse die Ausschüttung von ACTH veranlaßt. Das ACTH gelangt nun über das Blutsystem in die NNR, um dort die Sekretion von Glucocorticoiden anzuregen. Bei langfristigen Entzündungen kommt es zur Atrophie der Nebennierenrinde. Glucocorticoide (Cortisol und Cortison)61 a) Aufgabe b) Einfluß auf den Stoffwechsel der Kohlenhydrate, Proteine und Fette Veränderungen des Stoffwechsels in Muskulatur, Fettgewebe, Haut und Leber Wirkung Steigerung der Gluconeogenese in der Leber. Hier werden Aminosäuren in Glucose umgewandelt, die aus dem Abbau von Muskelproteinen stammen (eiweißkatabole Wirkung). Steigerung des Blutzuckerspiegels durch die Verminderung der Glucoseutilisation in Körperzellen, sowie durch den erschwerten Glucosetransport in die Zellen. Antianabole Wirkung durch den verminderten Aufbau von Muskelproteinen, da der Aminosäuretransport in die Zellen erschwert wird. Die Aminosäureaufnahme in die Leber wird erleichtert Verminderung der Biosynthese von Fetten, da die Aufnahme von Glucose in die Zellern vermindert ist. 60 Zonen von oben nach unten = von außen nach innen Sie wirken langsamer, da sie lipophil sind und die Rezeptoren intrazellulär liegen. Sie wirken demnach auf den Kern. Die Ausschüttung erfolgt v. a. in Belastungszuständen. Alle Glucocorticoide wirken im geringen Maße wie Mineralcorticoide. 61 143 Zusätzlich werden sie aufgrund ihrer entzündungshemmenden Wirkung sehr häufig als Pharmaka verwendet. Sie führen zu ... Immunsuppression (bei Transplantationen) durch Hemmung der Antikörperbildung Geburtsinduktion beim Wiederkäuer (Cortisol und Cortison wirken auf den Fetus. Die Nebennierenrinde produziert Cortisol, das nun die Uteruskontraktionen und die Geburt auslöst) Entzündungshemmung in dem die Anzeichen einer Entzündung und die immunologische Abwehrreaktion reduzieren. hemmen die zelluläre und humorale Abwehr Aldosteron a) Funktion b) Das Aldosteron ist der wichtigste Vertreter der Minealcorticoide. Er ist an der Regelung des Elektrolyt- und Wasserhaushaltes beteiligt, in dem es die Transkription für Na +-K+-Pumpen und Na+-Kanäle fördert. Wirkung Seine Wirkung bezieht sich hauptsächlich auf den distalen Tubulus der Niere. Hier wird die Na+Rückresorption und damit verbunden die Rückresorption von Wasser gesteigert. Zusätzlich öffnen sich pH-abhängig K+-Kanäle. Durch Na+ kommt es zu einer Depolarisation und damit zur Öffnung der K+-Kanäle, was die K+- und Protonensekretion gefördert. Am Dickdarm, sowie in den Speichel- und Schweißdrüsen fördert das Aldosteron die Na+-Resorption und die K+Sekretion. c) Regelung Die Produktion und Abgabe von Aldosteron wird auf drei verschiedenen Wegen geregelt: 1. 2. 3. Natriummangel und Kaliumanstieg im Blut wirken direkt auf die Zona glomerulosa Abnahme der Natriumkonzentration Einschränkung der Nierenproduktion (s. auch RAAS-System) Renin-Angiotensin-Aldosteron-System (RAAS) Die juxtaglomerulären Zellen werden über eine Einschränkung der Nierenfunktion, Hyponatriämie (Natriummangel), Hypovolämie und Blutdruckabfall, sowie durch den Sympathikus ( 1-Rezeptoren) aktiviert. In der Macula densa wird Renin gebildet und ausgeschüttet. Das Renin ist eine Protease, die aus dem in der Leber gebildeten 2-Globulin Angiotensinogen (inaktives Prohormon), Angiotensin I abspaltet. Das Angiotensin I wird durch eine Peptidase, das converting enzyme, in das Angiotenin II umgewandelt. Zu den Aufgaben des Angiotensin II gehören: Vasokonstriktion mit anschließendem Blutdruckanstieg vermehrte Bildung von Aldosteron, das zu einer Na+-Rückresorption in Niere und Darm führt. Die Wirkung tritt nur langsam ein, ist jedoch für die mittelfristige Blutdruckregulation wichtig. Durstzentrum im Gehirn vermehrte Wasseraufnahme allgemeine Wirkungen sind Kontrolle des Na+-Bestandes, Kontrolle des extrazellulären Flüssigkeitsvolumens und der Blutdruckregulation 144 7. Langerhans’schen Inseln der Bauchspeicheldrüse 7.1 B-Zellen Insulin a) Bildung Die Bildung erfolgt in den B-Zellen (früher -Zellen) der Langerhans’schen Inseln des Pankreas. Es wird jedoch nur ein Prohormon, das Proinsulin gebildet. Es besteht aus 2 Polypeptidketten, wobei die A-Kette aus 21 Aminosäuren und die B-Kette aus 30 Aminosäuren besteht. b) Biosynthese Die Synthese beginnt im rER. Hier wird eine einkettige Vorstufe, bestehend aus 104 bis 109 Aminosäuren, das Prä-Proinsulin gebildet. In einem weiteren Syntheseschritt wird aus dem PräProinsulin, das Proinsulin. Es besteht aus einer A,B-C-Kette, die durch Disulfidbrücken miteinander verbunden ist. Es ist keine lineare Kette. Durch die Abspaltung der C-Kette durch Endopeptride, wird aus dem Proinsulin das Insulin, das nur noch aus der A,B-Kette besteht. Dieser Schritt erfolgt in den Transportvakuolen vom rER (Golgi-Apparat, Sekretgranula). Die Speicherung erfolgt als Zink-Komplex. c) Freisetzung -Zellen können den Glucosespiegel erkennen und vermitteln das Sekretionssignal nach intrazellulär. -Granula wandern entlang der Mikrotubuli und verlagern sich somit zur Zellmembran. Dort verschmelzen sie mit der Zellmembran. Die Sekretabgabe erfolgt durch Exozytose. Die -Zellen werden direkt durch die Glucosekonzentration beeinflußt. Ist viel Glucose vorhanden, wird der Stoffwechsel der Zelle angekurbelt. Es entsteht mehr ATP. Dieses wirkt auf einen besonderen K+-Kanaltyp hemmend (ATP-sensitive Kaliumkanäle). Der K+Anstieg in der Zelle führt zur Depolarisation (Membranpotential ), wodurch wieder spannungsabhängige Ca2+-Kanäle aktiviert werden. Die Kanäle öffnen sich und der nachfolgende Ca2+-Einstrom löst die Exozytose der insulinhaltigen Granula aus. Hemmende und stimulierende Einflüsse auf die B-Zellen Stimulation N.vagus (Parasympaticus) freie Fettsäuren Aminosäuren Glucose Kamium gastointestinale Hormone Hemmung Sympathikus (wird bei Streß aktiviert) Somatostatin (Bildung in D-Zellen des Pankreas) Insulinwirkung Insulin hat viele Stoffwechselwirkungen, die alle zu einer Senkung des Blutzuckerspiegels führen. Nach der Aufnahme von Kohlenhydraten kommt es zum Anstieg der Glucosekonzentration im Blutplasma Stimulation der Insulinabgabe. Dadurch wird Glucose in fast alle Körperzellen aufgenom145 men, so daß die Blutglucosekonzentration wieder abfällt. Ein Mangel an Insulin führt zum Diabetes mellitus. Man unterschiedet zwei verschiedene Typen: Typ I: absoluter Insulinmangel (Zerstörung der Zellen) Typ II: relativer Insulinmangel (Adipositas) Glucosestoffwechsel von Muskelzellen Bei niedrigem Insulinspiegel sind die Muskelzellen impermeabel für Glucose. Bei Insulinmangel erfolgt die Energiegewinnung über den Fettsäuremetabolismus. Steigt der Insulinspiegel an, wird die Muskelzelle jedoch permeabel für die Aufnahme von Glucose (v. a. nach den Mahlzeiten). Andere Muskeltypen, v. a. die stark beanspruchten Muskeln, können auch insulinabhängig permeabel werden.. An der Membranoberfläche befinden sich Insulinrezeptoren. Sie bestehen aus 4 Untereinheiten, die sich in 2 -Untereinheiten (Bildungsstelle) und 2 -Untereinheiten (Tyrosinkinase) aufteilen lassen. Bindet nun das Insulin an die -Untereinheit, kommt es zu einer Aktivierung der Tyrosinkinase und zur Aktivierung von Ser/Tyr-Kinasen. Mehrere Reaktionen werden daraufhin ausgelöst: 1. 2. 3. Aktivierung der Phospholipase C zur Proteinphosphorylierung Phosphorylierung von Phosphatasen zur Proteindephosphorylierung Phosphorylierung einer Phosphodiesterase, die den cAMP-Abbau fördert Ziel ist der Einbau von Glucosetransportern in die Zellmembran von Muskel- und Fettzellen. Es wird angenommen, daß die größte Anzahl an Glucosetransportern in zellinternen Membranvesikeln gespeichert wird, bei Stimulation durch Insulin fusionieren die Vesikel durch Exozytose mit der Zellmembran Anzahl der Glucosetransporter . Förderung Glucoseaufnahme Aminosäureaufnahme Proteinsynthese Kaliumaufnahme Hemmung ATP Stimulation der Pumpen Proteinabbau Glucosestoffwechsel der Leber62 Die Leber ist ein glucosespeicherndes Organ. Die Glucose kann in die Leberzelle frei diffundieren (in beide Richtungen). Durch die Wirkung von Insulin wird die Glucose in Glycogen umgebaut. Die Blutglucose fällt ab. Dazu wird vom Insulin verschiedene Fördersysteme und Hemmsysteme aktiviert. Förderung Aktivierung des Enzyms Glycokinase (Phosphorylierung von Glucose in den Leberzellen. Die phosphorylierte Glucose kann die Leberzelle nicht mehr verlassen.) Aktivierung der Phosphofructokinase und Glycogensynthetase zum Glycogenaufbau (Glycogensynthese) Hemmung 62 Proteinsynthese Fettsynthese glycogenabbauende Enzyme (Phosphorylasen) Ketogenese (Ketonkörperbildung) Gluconeogenese Durch die rasche Speicherung der Glucose nach der Nahrungsaufnahme, sinkt der Glucosespiegel im Blut wieder ab. Damit fehlt der Stimulator für die Insulinsekretion. 146 Proteinsynthese Glucosestoffwechsel in Nervenzellen Die Zellen des ZNS decken ihren Energiebedarf fast ausschließlich durch Glucose. Das Insulin hat aber keinen Einfluß auf die Membranpermeabilität oder intrazelluläre Enzymsysteme (insulinunabhängig!) Beim Absinken der Blutglucose unter den kritischen Wert (0,5 - 0,2 g/l) kommt es zum hypogykämischen Schock mit Bewußtseinstrübung oder Koma. Wirkung auf den Fettstoffwechsel Insulin stimuliert den Aufbau von Glycogen in den Leberzellen. Diese können jedoch ein bestimmtes Maß nicht überschreiten. Die Glucosemenge, die darüber hinaus in die Leberzelle diffundiert, wird phosphoryliert. Die Glucose wird anstatt in Glycogen in Fett umgewandelt. Es ist eine direkte Wirkung des Insulins auf die Umwandlung. Die Fettsäuren gelangen auf dem Blutweg, gebunden an Lipoproteine, zu den Fettzellen. Dort werden sie aufgenommen und gespeichert. Die Speicherform der Fettsäuren sind Trigyceride. Zusätzlich wird vom Insulin noch die Bereitstellung von Glycerin in den Fettzellen gefördert, da 3 Fettsäuren an ein Glycerinmolekül gebunden werden. Förderung Hemmung Glucoseaufnahme hormon-sensitive Lipase (Abbau des Fettsynthese Fettes) Lipoproteinlipase Wirkung auf den Proteinstoffwechsel Die Abbauprodukte der aus der Nahrung aufgenommenen Proteine, sind die Aminosäuren. Die Neubildung körpereigener Proteine erfolgt unter der Einwirkung von Insulin. Insulin hat verschiedene Einflüsse auf die Proteinsynthse: 1. 2. Es ermöglicht den aktiven Transport von vielen AS in die Zelle (ähnliche Wirkung wie Wachstumshormone). Der intrazellulär erhöhte AS-Spiegel induziert eine vermehrte ribosomale Proteinsynthese. Es erhöht außerdem die Transkriptionsrate von DNA im Zellkern. Die Zunahme der RNA führt zu einer mittelfristigen Steigerung der Proteinsynthese. 7.2 A-Zellen Gucagon a) Bildung und Biosynthese Die Bildung erfolgt in den A-Zellen (früher -Zellen) der Langerhans’schen Inseln des Pankreas. Die Zellen liegen in der Inselperipherie (ca. 20 %). Die Sekretionsgranula sind azidophil. Das Glucagon ist ein Polypeptid, das aus 29 Aminosäuren aufgebaut ist. Aus einem Prä-Progucagon entsteht zuerst das Proglucagon am ER. Durch die Proteolyse zu einem sekretionsfähigen Produkt geworden, wird es im Golgi-Apparat verpackt. Das Glucagon wird in Sekretionsgranula gespeichert. b) Freisetzung 147 Freigesetzt wird es bei: Hypoglycämie, Überangebot von Aminosäuren und Erniedrigung der Plasmakonzentration von freien Fettsäuren. Förderung Aminosäurekonzentration Adrenalin und Noradrenalin Cholecystokinin Hemmung Glucosekonzentration Insulin Somatostatin Aufgaben Das Glucagon wirkt insulinantagonistisch. Es stimuliert die Glycogenolyse (Abbau des Leberglycogens) zur Steigerung des Blutglucosespiegels. Effekte des Glucagons in der Leber: Glykogenolyse Gluconeogenese Fettsäureoxidation Ketogenese Aminosäure-Aufnahme sowie Aminosäure-Abbau Harnstoffbildung Sättigung (Signal für das ZNS Abgabe des Sättigungshormons) Wirkmechanismus Das Glucagon bildet mit einem Rezeptor der Plasmamembran einen Hormon-Rezeptor-Komplex. Es kommt zur Stimulation der Adenylatzyklase, die ATP zu cAMP werden läßt. Das cAMP ist ein second messeger, der biochemische Prozesse stimuliert. In diesem Fall den Abbau von Glycogen in der Leber fördert. Die Leber ist der Hauptspeicher des Glycogen und somit auch der der des Glucagon. 7.3 Regulation der Blutglucosekonzentration Insulin Senkung der Blutglucosekonzentration Bildung und Freisetzung in und aus den -Zellen: hohe Blutglucosekonzentration Glucagon Erhöhung der Blutglucosekonzentration Glucoseaufnahme in die -Zellen durch die Atmungskette bildet sich ATP Hemmung der ATP-sensitiven K+-Kanäle K+-Anstieg Depolarisation Öffnen der spannungsabhängigen Ca2+-Kanäle Ca2+-Einstrom Exozytose und Freisetzung des Insulins Leberzellen Bildung und Freisetzung in und aus den -Zellen: Glykolyse Glycogensynthese Proteinsynthese Fettsynthese Ketogenese (Ketonkörperbildung) Gluconeogenese – – – niedrige Blutglucosekonzentration hohe Aminosäurekonzentration wenige freie Fettsäuren Leberzellen Glycogenolyse Gluconeogenese Fettsäureoxidation Aminosäureaufnahme Aminosäureabbau Harnstoffbildung Sättigung 148 Muskelzellen Glucoseaufnahme Aminosäureaufnahme Proteinsynthese Kaliumaufnahme Proteineinbau Fettzellen Glucoseaufnahme Lipoproteinlipase Fettsynthese Hormon-sesntitive Lipase Muskelzellen Fettzellen 7.4 D-Zellen Somatostatin Es besteht aus 14 Aminosäuren. Das Somatostatin wird in vielen Körperzellen gefunden, an denen es hauptsächlich inhibitorische Wirkungen zeigt. Im Hypothalamus wird die Bildung von Somatotropin gehemmt. Das im Pankreas gebildet Somatostatin hat parakrine Wirkung. Es hemmt die Sekretion von Insulin und Glucagon. Darüber hinaus wirkt es noch hemmend auf den Verdauungstrakt, Sekretion von Gallenblasensekret und von Verdauungssäften. Alles in allem wird die Verdauungsaktivität vermindert und dadurch der Blutglucosespiegel relativ konstant gehalten. 8. Endokrin-wirkende Organe 8.1 Niere Renin a) Bildung Es wird von in den Gefäßwänden der Atriolen gelegenen Epithelzellen des juxtaglomerulären Apparates der Nieren (Macula densa) gebildet. Eine extrarenale Bildung erfolgt noch im Uterus, der Leber und in Gefäßwänden. b) Stimulation der Ausschüttung Minderdurchblutung der Nieren, hervorgerufen durch Hypovolämie, Blutdruckabfall bestimmte Zusammensetzung (in Abhängigkeit der NaCl-Konzentration) der Flüssigkeit im distalen Tubulus Ausscheidung von NaCl wird durch die Drosselung der Nierendurchblutung herabgesetzt Glomerulusfiltrat 1-Rezeptoren reagieren auf Adrenalin und sympathische Nerven der Niere Ansteig des K+-Spiegels im Blut, Hypercalcämie Abfall des Na+-Spiegels im Blut, Hyponatriämie c) Hemmung der Ausschüttung 149 Angiotensin II wirkt über die negative Rückkopplung als Aldosteron und -Rezeptorblocker. Erythropoetin a) Hormon und Bildung Das Erythropoein ist ein Glykoprotein, das aus 165 Aminosäuren aufgebaut ist. Es wird von Nierenzellen und in geringen Mengen auch in der Leber produziert Die Ausschüttung wird stimuliert durch den Abfall des pO2-Wertes. b) Wirkung Es wirkt hauptsächlich auf das Knochenmark: Differenzierung der Erythrozytenvorstufen Synthese von Hämoglobin Abgabe jugendlicher Erythrozyten an das Blut Die Wirkung wird verstärkt durch: Androgene Thyroxin Wachstumshormon Vitamin D-Hormon s. Vitamin D3-Hormon 8.2 Herz Atriales Natriuretisches Peptid a) Bildung Die Bildung erfolgt in myoendokrinen Zellen der Vorhöfe. Die Zellen sind ähnlich aufgebaut wie Muskelzellen und enthalten Granula. Stimuliert werden sie durch die Dehnung der Vorhöfe (mechanosensitiv) bei zu hohem Blutdruck und Hypervolämie. b) Synthese Aus einem Präproatriopeptin wird die Speicherform, das Proatriopeptin, synthetisiert. Aus diesem erfolgt dann die Bildung des Atrialen Natriuretisches Hormon bzw. Atriopeptin. Es ist ein Polypeptid, das aus 28 Aminosäuren aufgebaut ist. c) Wirkungen Niere: Hemmung von Rückresorptionsmechanismen, dadurch steigt die Na+- und Wasserausscheidung an, sowie der GFR 150 Herz und Kreislauf: Vasodilatation mit dausfolgenden Abfall des Blutdrucks Gehirn: Senkung des Durstgefühls Hormonsystem: Senkung der Produktion von Renin, Aldosteron und ADH Niere 1. Allgemeine Funktionen der Niere Exkretion: Ausscheidung von Stoffwechselprodukten (z. B. Harnstoff, Kreatinin, Harnsäure, Allantoin, HN4+, Phosphate, Sulfate, Protonen, ...), Fremdstoffe (Medikamente, Gifte und Drogen) und Wasser Konservierung: Resorption aus dem Ultrafiltrat, z. B. Kohlehydrate, Aminosäure, Fettsäuren und Wasser Regulation des Elektrolyt- und Wasserhaushaltes: Anpassung der Ausscheidung von Elektrolyten (Na+, K+, Mg2+, Ca2+, Cl-, HCO3-, ...) und Wasser Regulation des Säure-Basen-Haushaltes, pH-Wert: Anpassung der Ausscheidung von H+, NH4+ und Pufferbasen (Säureanionen, Cl-, HCO3-, SO42-, PO42-) Endokrine Funktion: Die Niere dient als Zielorgan für viele Hormone (ADH, Aldosteron, Parathormon). Ebenso metabolisiert sie Hormone (Corticosteroide, Testosteron und Proteohormone) oder synthetisiert welche als endokrine Organ (Erythropoetin, Eikosanoide, Gewebehormone). 2. Bau der Niere Querschnitt Bindegewebige Kapsel, Capsula fibrosa Nierenrinde, Cortex renis mit Zona peripherica (außen) und Zona juxtamedullaris (medullanah) Nierenmark, Medulla renis mit Zona externa (Außenzone mit Außen- und Innenstreifen) und Zona interna (Innenzone) 151 Harnbildender Teil Es befinden sich ca. 2 Millionen Nephrone in der Niere. Sie bestehen aus dem Nierenkörperchen und dem Tubulussystem und den Sammelrohren. Diese beiden Anteile werden aber noch weiter unterteilt: 1. 2. 3. Nierenkörperchen, Corpusculum renalis, Malpighisches Körperchen, das aus dem Gefäßknäul, Glomerulum und der doppelwandigen Kapsel, Capsula glomeruli, Bowman’sche Kapsel besteht Tubulus renalis bestehend aus 3 Abschnitten: Tubulus contortus proximalis. Henkelschleife, Ansa nephroni mit einem dünnen absteigenden, einem dünnen aufsteigenden und einem dicken aufsteigenden Schenkel sowie der Makula densa (juxtaglomerulärer Apparat) besteht. Tubulus contortus distalis mit einem gewundenen und einem gestreckten Abschnitt. Sammelrohre, die einen kortikalen Teil und einen medullären Teil besitzen. Diese münden dann auf der Area cibrosa, so daß die Flüssigkeit weiter Richtung Nierenbecken (Pelvis renalis) transportiert werden kann. Gefäßsystem Aus der Aorta zweigt zu jeder Niere eine A. renalis ab, die sich im Hilus renalis weiter zu den Aa. renales verzweigt. Diese verzweigen sich weiter zu Aa. interlobares Aa. arcuatae63 Aa. interlobulares afferente Arteriolen glomeruläre Kapillaren64 efferente Arteriolen und letztendlich zu peritubulären Kapillaren65. Afferente Arteriolen, glomeruläre Kapillaren, efferente Arteriolen und peritubuläre Kapillaren werden auch als Portalkreislauf bezeichnet. Epitheltypen Die Zellverbindungen, die sog. Schlußleisten, tight junctions bestehen aus: Dichte Epithelien (Schlußleisten durchlässig) Mäßig dichte Epithelien (Schlußleisten reißverschlußartig) Lecke Epithelien (Schlußleisten punktförmig) Im proximalen Abschnitt des harnbildenden Systems ist eher leckes Epithel vorhanden, in den distalen Abschnitten und in den Sammelröhren findet man zunehmend dichteres Epithel (funktionelle und morphologisch longitudinale Heterogenität der Tubulusepithelien). An Epithelzellen findet man in den Sammelrohren die Hauptzellen, die K+ und H+ sezernieren, sowie die Zwischenzellen, die K+ resorbieren. 3. Grundmechanismen der Nierenfunktion Der Grundmechanismus besteht darin, daß durch glomeruläre Filtration Vorurin gebildet wird. Im weiteren Verlauf des harnbildenden Systems kommt es zur Veränderung des Volumens und der Zusammensetzung durch tubuläre Resorption und Sekretion. Schlußendlich wird der Endurin ausgeschieden. 63 Sie befinden sich zwischen Mark und Rinde. Bildung des Ultrafiltrats (Primärharn) 65 Hier findet die Rückresorption und Bildung des Sekundarharns statt. 64 152 4. Prinzipien des epithelialen Transportes Passive Transport66 Filtration (Ultrafiltration): Transport von Lösungsmitteln und filtrierbaren Soluten aufgrund des hydrostatischen Druckgradienten durch einen Filter (Poren sind so klein, daß auch große gelöste Teilchen zurückgehalten werden) Diffusion: Bewegung aufgrund eines Konzentrationsgradienten, elektrischen Gradienten oder elektrochemischen Gradienten Erleichterte Diffusion: alle Formen von Kanal-, Carrier-, oder vesikelvermittelter Diffusion (Phagozytose, Pinozytose, Exo- und Endozytose, Transzytose) Osmose: Diffusion des Wassers Solvent drag: Teilchenmitführung im Lösungsmittel aufgrund der Trägheit der Teilchen. Es wird auch als Konvektion bezeichnet. Aktiver Transport67 Primär aktiver Transport: ATPasen (Pumpen), die Solute gegen ihren elektrochemischen Gradienten pumpen können und metabolische Energie verbrauchen, z. B. Na+-K+-Pumpe Sekundär aktiver Transport: Carriervermittelter Cotransport, angetrieben von einem Ionengradienten. Der Gradient wird durch primär aktiven Transport aufrecht erhalten, z. B. Symporter, Antiporter. Die Summer der Gradienten aller Teilchen muß in die Transportrichtung weisen. Der sekundär aktive Transport besitzt 2 Komponenten: passiver Cotransporter und angetriebener primäraktiver Transporter. Tertiär aktiver Transport: Cotransport der durch sekundären aktiven Transport angetrieben wird 5. Glomerulumfunktion Funktion a) Ultrafiltration, Ultrafiltrat Durch den Blutdruck wird aus den glomerulären Kapillarschlingen 1/5 des Serums in die Bowman’sche Kapsel gepreßt. Das entstandene Ultrafiltrat enthält Wasser, Harnstoff, Kreatinin, Glukose, Galaktose, Aminosäuren, Phosphat, HCO3-, Na+, Cl-, K+, Ca2+, ... . Es wird auch als Glomerulusfiltrat bzw. GFR bezeichnet. Dieses fließt Richtung Nierenbecken, allerdings wird davon nur 1/100 ausgeschieden. b) Filtrationsbarriere Sie wird gebildet aus (innen außen): Endothelzellen, Basalmembran (> 200 kDa) und epitheliale Podozyten (> 65 kDa). Wasser und kleinmolekulare Bestandteile können leicht passieren. Stoffe mit einem höheren Molekulargewicht (> 65 kDa) und Plasmaproteine können nicht passieren, da die Schlitze, die von den Podozyten gebildet werden, zu klein sind. Anionische Substrate treten leichter hindurch als kationische Substrate. c) 66 67 Kapillarwände Dieser wird betrieben durch den äußeren Gradienten. Dieser kann gegen einen Gradienten erfolgen, getrieben durch Stoffwechselenergie (ATP). 153 Sie sind selektiv permeabel. Folgende Faktoren spielen dabei eine Rolle: Größe, Form und Ladung der Moleküle Verformbarkeit Größe der filternden Fläche Porengröße Fixladungsdichte Dies hat zur Folge, daß kleinstmolekulare Stoffe nicht filtriert wrden können, wenn sie im Plasma an Proteine gebunden sind (z. B. Medikamente, Hormone, ...), kleinstmolekulare Teilchen eine 5 % höhere Konzentration im Ultrafiltrat haben als im Plasma, ein geringer Donnan-Effekt vorliegt, d. h. Kationen werden auf der Proteinseite zurückgehalten, Anionen werden hingeben abgestoßen. Glomerulusfiltrat, GFR a) GFR Die Ultrafiltration wird beeinflußt durch Größe und Permeabilität der filtrierednden Fläche sowie dem transmuralen hydrostatischen und kolloidosmotischem Druckunterschied. Bestimmt wird es durch exogene (PAH-Clearance) und endogene (Kreatinin-Clearance) Clearance-Tests. Der Volumenfluß durch die glomerulären Kapillarwände läßt sich ausdrücken durch: GFR = LP F Peff GFR = Kf Peff b) = Wasserpermeabilität Fläche effektiver Druck = Filtrationskoeffizient effektiver Druck Regulation der GFR Die Regulation erfolgt über den RBF (renaler Blutfluß), der eine hohe spezifische Durchblutung von ca. 20 - 25 % des Herzzeitvolumens hat. Im Mark herrscht ein höherer Widerstand, der durch die langen Vasa recta mit den Kapillarflächen gebildet wird. So findet man zusätzlich noch eine ungleiche Verteilung der Durchblutung zwischen Mark (10 %) und der Rinde (90 %). Humorale und nervöse Impulse verändern den Gefäßradius der afferenten und efferenten Arteriolen. Bei einer afferenten Volumenänderung Ändern sich GFR und RBF in der gleichen Weise, bei einer Veränderung des efferenten Volumenwiderstandes ändern sich GFR und RBF gegensinnig. Die Auswirkungen von Änderungen des afferenten und efferenten Arteriolenwiderstandes auf das GFR und RBF sind in der folgenden Tabelle dargestellt: Raff normal Reff normal normal Rtotal 154 Pglom GFR RBF normal c) Autoregulation An den Nieren kann man beobachten, daß bei einer Veränderung des arteriellen Mitteldrucks die Durchblutung der renalen Gefäße in einem bestimmten Bereich konstant gehalten wird. (Blutdruckschwankungen im Bereich von 80 bis 180 mm Hg sind selbstregulierend.) Dieser Vorgang ist unabhängig von nervösen und humoralen Einflüssen und kann auch an isolierten Nieren beobachtet werden. Myogener Mechanismus: einer Erhöhung des arteriellen Drucks über eine Zunahme des transmuralen Drucks und der Wandspannung der afferenten Arteriolen führt zu einer Vasokonstriktion. Renin-Angiotensinsystem: kann auch über Barorezeptoren in den afferenten Arteriolen aktiviert werden, so daß dies auch zur Autoregulation beitragen kann. 6. Renale Resorption von Na+, Cl- und H2O Der Gesamtkörpergehalt am austauschbaren Na+ wird ca. 9 x am Tag filtriert. Dabei werden 99 % rückresorbiert und < 1 % ausgeschieden. 2/3 des filtrierten Na + und Cl- wird zusammen mit dem Wasser im proximalen Tubulus resorbiert. (H2O ca. 170 l / Tag und Na+ ca. 25 Mol / Tag) Proximaler Tubulus Im proximalen Tubulus erfolgt die Rückresorption von 65 % des GFR. Es ist v. a. Na + und H2O enthalten, wobei das Na+ mit 60 % über einen aktiven Transport und mit 40 % über einen passiven Transport in die Epithelzellen aufgenommen werden. a) Frühproximaler Tubulus Die ersten 25 % des proximalen Tubulus werden als frühproximaler Tubulus bezeichnet. Dieser Abschnitt resorbiert schon fast vollständig Glucose und Aminosäuren, so daß man anhand der unterschiedlichen Transportcharakteristika einen frühproximalen und einen spätproximalen Tubulusanteil unterscheiden muß. Na+ wird durch Antiport mit H+ und durch Symport mit Glucose, Galaktose, Aminosäuren, Phosphat, Sulfat, u. a. in die Epithelzelle aufgenommen. Mittels der Na+-K+-ATPase in das interstitielle Lumen oder gleich in die Kapillare abgegeben. Cldiffundiert passiv über parazellulären Weg durch: Das H+ wird mittels HCO3- als CO2 und H2O wieder in die Zelle aufgenommen. H2O den erhält seinen Antrieb durch die Resorption der Summer aller Solute und wird paraDiffusion aufgrund des zellulär durch Osmose elektrischen Gradienten, da resorbiert. durch den aktiven Transport des Natriums eine -2 mV Spannung aufgebaut wird. Diffusion aufgrund des Konzentrationsgradienten, da durch die Wasserresorption die Cl- -Konzentration im Tubulus ansteigt. Konvektion (Solvent drag) mit 155 dem resorbierten Wasser b) Spätproximaler Tubulus Na+ wird weiter so aufgenommen wie in den oben geschilderten Wegen, allerdings existieren zusätzlich noch Na+-Kanäle. Durch die HCO3- -Resorption wird hier die elektrische Spannung positiv (+ 2 mV), so daß die parazelluläre Aufnahme über Diffusion aufgrund des elektrischen Gradienten erfolgen kann. Die Abgabe in das Interstitium bzw. in die in die Kapillare erfolgt wieder über die Na+-K+-ATPase. ClH2O wird parazellulär mittels Diffusion parazellulär durch Osmose durch den elektrischen Gradienten in das Epithel aufgenommen. Durch die Cl- und die HCO3- Aufnahme in die Epithelien entsteht eine + 2 mV transepitheliale Spannung entsteht. Diese fördert die parazelluläre Aufnahme von Kationen (Na+, K+, Mg2+, Ca2+) und hemmt gleichzeitig die weitere Aufnahme von Anionen. Neben der parazellulären Aufnahme gibt es noch die zelluläre Aufnahme von Cl- durch Cl-/Formiat-Carrier. Das Cl- verläßt die Zelle über Cl/K+-Symport bzw. über Cl-/HCO3-Antiport. Henle Schleife a) Dünne Abschnitte In diesem Teil befinden sich keine Transportsysteme, so daß hier keine Transportleistung verzeichnet werden kann. b) Na+ Cl- - - H2O diffundiert durch Osmose durch permeable Membran (25 %) Dicker Anteil Dieser Teil ist für Wasser völlig impermeabel, do daß diesen nicht diffundieren kann. Es können daher nur Solute aufgenommen werden, was zu einer Osmolaritätsabnahme der Tubulusflüssigkeit führt. Dieser Abschnitt wird deshalb auch als „Verdünnungssegment“ bezeichnet. Cl- , Na+ werden über Na -K -2 Cl - Kotransporter aufgenommen. Hier werden 25 % der Gesamtrückresorption von Natrium und Chlor in die Epithelzellen transportiert. In die Kapillare gelangen die Ionen über die Na+-K+-ATPase und über Cl- -Kanäle. + + H2O - 156 - Distaler Tubulus Dieser wird hormonell beeinflußt. Na+ wird über Na+-H+-Antiport und Na+-Cl- - Symport aufgenommen, wobei in diesem Abschnitt eine Rückresorption von 10 % zu verbuchen ist. Gehemmt wird die Aufnahme durch Furosemid. Clwird über Na+-Cl- - Symport aufgenommen. In diesem Abschnitt findet eine Rückresorption von 10 % statt. H2O Permeabilität ist sehr hoch, so daß über eine kurze Strecke im Tubulusapparat die Flüssigkeit wieder isoton wird. Die Aufnahme erfolgt über Osmose. Sammelrohr Hier befinden sich 2 verschiedene Zelltypen, die Hauptzellen und Zwischenzellen. Na + wird durch einen Kanal aufgenommen, der durh Aldosteron aktiviert wird. unterliegt ebenfalls der hormonellen Kontrolle Cl- , Na+ werden gegen den Konzentrationsgradienten aufgenommen (ca. 5 %) H2O - Der Na+-Transport wird proximal der Sammelrohre durch die „glomerulotubuläre Balance“ und distal davon vor allem durch das Hormon Aldosteron geregelt. Glomerulotubuläre Balance Unter dem Begriff „glomeruläre Balance“ versteht man die Fähigkeit vor allem des proximalen Tubulus, auf Änderungen der filtrierten Menge mit einer Anpassung der Resorption zu reagieren, so daß die prozentuale Resorption fast aller Solute und Wasser praktisch gleich bleibt 7. Renale Kaliumresorption und -sekretion Im proximalen Tubulus werden schon 60 - 70 %, in der Henle Schleife weitere 25 - 35 % resorbiert. Im distalen Tubulus ist der Transport sehr variabel. Es kann zwischen Resorption und starker Sekretion schwanken, je nach dem wie hoch die K+-Zufuhr ist. Weiter distal wird weder Kalium resorbiert noch sezerniert. Proximaler Tubulus Die K+-Resorption erfolgt ausschließlich über Schlußleisten und damit parazellulär. Es ist abhängig vom Wassergehalt des interzellulären Gewebes, das wiederum von der Na + und Cl- -Resortpion abhängig ist. 157 Henle Schleife a) Dünner absteigender Teil Hier findet keine K+-Resorption statt. b) Aufsteigender dicker Schenkel Wie bereits bei Na+- bzw. Cl- -Resorption beschrieben, wird hier das Kalium über einen Ha+-K+2 Cl- -Kotransporter in die Zelle aufgenommen. Ebenso enthält die apikale Seite noch K +-Kanäle durch die das Kalium in den Tubulus diffundieren kann und dort eine positive Ladung verursacht. Die basolaterale Seite enthält K+-Cl- - Kotransporter, der beide Ionen aus der Zelle hinaustransportiert und somit die K+-Resorption antreibt. Distaler Tubulus und Sammelrohr Die Aufnahme, sowie die Abgabe erfolgt entweder zellulär über Na+-K+-ATPasen oder parazellulär über Schlußleisten. Wenn Kalium in die Zelle aufgenommen wurde, kann es diese wieder über K +Kanäle auf der apikalen und der basolateralen Seite verlassen. Sekretion: passiver Transport, der über das Aldosteron gesteuert wird. Dieses bewirkt eine lumennegative Spannung, so daß das K+ passiv durch Kanäle oder die Schlußleisten in das Lumen strömen kann. Resorption: primär aktiver Transport über H+-K+-ATPase gelangt das Kalium in die Zwischenzellen der Sammelrohre. 8. Renale Rückresorption von Glucose und Aminosäuren Glucose und Aminosäuren werden im proximalen Tubulus in Cotransport mit Na + fast vollständig resorbiert. Bei normalen Plasmakonzentrationen ist die Resorption schon im frühproximalen Tubulus abgeschlossen. Glucose Glucose wird über ein 3-teiliges System aufgenommen, das aus einem Na+-Glucose-Symport, einer Na+-K+-ATPase als Antrieb dieses Systems und einem basolateralen Uniporter, mit dem der Zucker die Zelle wieder verläßt. Es werden 765 mmol/Tag herausgefiltert. Es erfolgt keine Ausscheidung. Aminosäuren Aminosäuren werden wie die Glucose in einem Na+-AS-Symport in die Epithelzelle aufgenommen. Man unterscheidet noch zwischen neutralen und sauren Aminosäure, die über einen Symport aufgenommen werden und den basische Aminosäuren, die durch Uniporter aufgenommen werden. Auf der basolateralen Seite verlassen die Aminosäuren durch Uniporter passiv die Zelle. Es werden 425 mmol/Tag herausfiltriert, 0,1 % bis 6 % werden ausgeschieden. 158 9. Ausscheidung von Harnstoff, Harnsäure, Oxalat und organischen Säuren Harnstoff (Urea) Der Harnstoff ist ein Stoffwechselprodukt aus dem Aminosäure-Stoffwechsel. Es ist bereits im Ultrafiltrat enthalten, wird aber im proximalen Tubulus bis zu 50 % wieder resorbiert. Dies geschieht durch Diffusion oder solvent drag. Die distalen Tubuli und die Sammelrohre sind für Harnstoff impermeabel. Im medulären Teil der Sammelrohre befinden sich Harnstoff-Carrier. Der aufgenommene Harnstoff diffundiert wieder in die Henle Schleife, um wieder im Tubulus zurückzufließen. Die Harnstoffkonzentration ist im Sammelrohr ca. 100 x höher als im Plasma. Dieses System ermöglicht es, den Harnstoff in hohen Konzentrationen mit einem geringen Wasseranteil auszuscheiden. Harnsäure Die Harnsäure ist das Endprodukt der Purinsynthese und findet sich im Plasma hauptsächlich als Na +Urat, das sehr schlecht löslich ist. Die Ausscheidung erfolgt über die Niere mit 70 % und über das Interstitium mit 30 %. Bei einer erhöhten Konzentration im Plasma, kann es zu Ablagerungen in den Gelenkkapseln führen, in denen die Harnsäure mit Ca2+ Kristalle bildet. Das Krankheitsbild ist die Gicht. Im Urin befinden sich direkte Komplexbildner (Citrat, Ca2+-bindende Proteine, Mukopolysaccharide) und weitere Inaktivoren, die eine Bildung von Harnsäurekristallen verhindern. Bei Hyperuricämie kann es aber zur Bildung kommen. Oxalat Kalciumoxalat ist der häufigste Bestandteil von Nieren und Harnsteinen. Oxalat entsteht im Aminosäurestoffwechsel und kann aber ebenso mit der Nahrung aufgenommen werden (Tee, Kakao, Rhabarber, ..) Es wird im proximalen Tubulus sezerniert und resorbiert. Sekretion von organischen Ionen Sie werden entweder gleich im Glomerulum in das Ultrafiltrat gefiltert oder später durch tertiär aktive tubuläre Sekretionsmechanismen in das Tubulussystem sezerniert. a) Organische Anionen Dazu gehören PAH, cAMP, Furosemid, Konjugate, Oxalat, Penicillin, Salicylat, ... Diese werden auf der basolateralen Seite durch einen Dicarboxylat-org. Anionen-Antiporter gegen den elektrochemischen Gradienten in die Zelle aufgenommen und auf der apikalen Seite erfolgt der Efflux durch Anionen-Antiporter. Der Antrieb dieses Stoffaustausches (tertiär aktiver Transport) ist der Dicarboxylat-Gradient, der durch Na+-Dicarboxylat-Antiporter aufrecht erhalten wird. b) Organische Kationen Die Kationen werden auf der basolateralen Seite passiv aufgenommen und an der apikalen Seite durch einen tertiär aktiven H+-org. Kationen-Antiporter in das Tubulussystem abgegeben. Der Antrieb des Antiports wird aus dem H+-Gradient gespeist, der durch einen apikalen Na+-Ka+159 Antiporter erzeugt wird. Wichtige anorganische Kationen sind Methylnikotinamid, Adrenalin, Atropin, Acetylcholin, Dopamin, Histamin und Morphin. 10. Resorption von Kalzium, Magnesium, Phosphat und Sulfat Kalzium Das Kalzium wird zu 60 % im proximalen Tubulus, 30 % in der Henle Schleife und zu 9 % in den distalen Tubulusabschnitten resorbiert. Als Transportformen findet man: Einen passiven Mechanismus: Permeabilität des Tubulussystems, so daß das Kalzium parazellulär diffundieren kann, oder aufgrund eines elektrischen Gradienten bzw. eines Konzentrationsgradienten diffundieren kann Einen primär aktiven Mechanismus: in der basolateralen Membran befinden sich Ca 2+-ATPasen, die das Kalzium in das Interstitium transportieren Einen sekundär aktiven Mechanismus: in Form von 3 Na2+-Ca2+-Antiporter in der basolateralen Membran Die Regulation des Kalziumhaushaltes wird von 3 Hormonen gesteuert, dem Parathormon (PTH, Parathryin), Kalzitonin und dem Vitamin D-Hormon (1,25 (OH)2-Cholekaziferon), sowie über die Kalzium-Konzentration des Plasmas. Magnesium Magnesium wird im proximalen Teil und im dicken aufsteigenden Teil der Henle Schleife vorwiegend parazellulär resorbiert. Phosphat und Sulfat Beides wird schon zum größten Teil im proximalen Tubulus resorbiert. Das Phosphat als HPO 42- und Sulfat wird im Austausch mit 2 Na2+ in die Zelle aufgenommen und auf der basolateralen Seite aufgrund eines elektrochemischen Gradienten wieder aus der Zelle hinausgeschleust. 11. Regulation des Säure-Base-Haushaltes durch die Niere Protonen-, Ammonium- und Bikarbonat-Transport a) H+-Sekretion Die H+-Ionen werden durch einen primär oder sekundär aktiven Transport gegen den elektrochemischen Gradienten in die Tubuluszelle befördert. Da H+ und HCO3- im Gleichgewicht stehen, sammelt sich genausoviel HCO3- an, wie an H+-Ionen vorhanden ist. Über HCO3--Cl-Antiport oder HCO3-CO32Na+-Symport wird das Bikarbonat auf der basolateralen Seite wieder aus der Zelle hinausbefördert. b) Phosphatausscheidung Das Phosphat liegt im Plasma als HPO42- vor. Bei einer Azidose steigt die Plasmakonzentration an Phosphat an, da vermehrt P aus den Kochen freigesetzt wird. In den Nieren wird daraufhin vermehrt Na2HPO4 herausgefiltert, das sich im Primärharn befindet. Im Tubulus reagiert das 160 Na2HPO4 mit H+ zu NaH2PO4-, ein schwer resorbierbarer Komplex, der somit ausgeschieden wird. Das Na+ wird über einen Na+-H+-Antiporter rückresorbiert. c) Ammoniumausscheidung In den Tubuluszellen, v. a. im proximalen Teil, wird in 2 Desaminierungsschritten aus Glutamin über Glutamat 2-Oxo-glutarat2- und 2 NH4+ gebildet: Glutaminase Glutamin Glutamat- + NH4+ 2-Oxo-glutarat2- + NH4+ Es wird das NH4+ als NH3 in das Lumen der Tubuli angegeben, das sich im dort mit H+ zu NH4+ verbindet. Die Konzentration an Ammoniumionen steigt dadurch sehr an, weil die Epithelzellen relativ impermeabel dafür sind. In der aufsteigenden Henle Schleife kann ein Teil des NH 4+/NH3 wieder resorbiert werden, wodurch es zu einem korticomedullären Gradienten führt. Nach dem Prinzip der Gegenstromkonzentrierung diffundiert NH4+/NH3 aus dem Interstitium und den Epithelien der Sammelrohre wieder in die Sammelrohre hinein. d) Bei einer Azidose ist die Aktivität der Glutaminasen erhöht, so daß vermehrt NH4+/NH3 gebildet werden kann. Dieses diffundiert entlang des Konzentrationsgradienten in das Lumen, so daß der Gradient für NH3 NH4+ ansteigt. Dies führt zu einer vermehrten Bildung von neuen NH3. Ein niedriger pH-Wert erhöht den Konzentrationsgradienten für NH3, weil das Gleichgewicht von NH3: NH4+ auf die Seite des NH4+ verschoben ist. NH4+ kann nicht durch die Membran diffundieren, so daß vermehrt NH3 in das Tubuluslumen sezerniert wird. Bikarbonatresorption Die Resorption ist abhängig von der Konzentration des HCO3- im Plasma bzw. im Filtrat. Bei einer normalen HCO3- -Konzentration, wird es komplett resorbiert. Bei Überschreitung eines bestimmten Schwellenwertes, wird das HCO3- so lange ausgeschieden, bis sich ein normaler Wert wieder eingestellt hat. Die Aufnahme des Bikarbonats im Tubulus erfolgt durch die Verbindung des HCO3- + H+ H2CO3, das daraufhin wieder zu H2O + CO2 zerfällt und so in die Epithelzellen aufgenommen wird. Das intrazellulär angereicherte H2CO3 gibt das H+ über einen Na+-H+-Antiporter wieder in das Lumen ab, während das verbleibende HCO3- auf der basolateralen Membran in Blut diffundiert. Regulation erfolgt über die Ausscheidung. Bei einer Azidose wird der Urin angesäuert, bei einer Alkalose dagegen alkalisiert. a) Azidose68 Vollständige Bikarbonatresorption Steigerung der H+-Sekretion durch einen Na+/H+-Antiport in den Tubuli und der Henle Schleife, sowie einen Einbau von K+-H+-ATPasen in die Zwischenzelle vom Typ A (apikale 68 Bei einer Acidose kann der Urin einen pH-Wert bis zu 4 erreichen, jedoch nicht saurer. Das entspricht etwa 1 % der auszuscheidenden sauren Valenz. Titrierbare Säuren puffern den Urin ab. 161 b) Alkalose c) Seite) des corticalen Sammelrohrs. Auf der gegenüberliegenden Seite befinden sich HCO3- Cl- -Antiporter. Glutaminaseaktivität steigt, so daß es zu einer Ausscheidung von Ammonium-Ionen kommt. Phosphatausscheidung puffert den Harn Bikarbonatresorption ist vermindert. Protonensektretion ist ebenfalls vermindert, da hier die Zwischenzellen vom Typ B des kortikales Sammelrohrs mitwirken. Durch einen Cl- -HCO3- - Antiport auf der apikalen Seite der Tubuluszelle wird vermehrt Bikarbonat ausgeschieden, so daß sich dieses in der Reaktion HCO3- + H+ H2CO3 verbindet und als CO2 + H2O wieder in die Zelle diffundieren kann. In der Zelle selbst wird aus dem H2O + CO2 HCO3- + H+, so daß das H+ auf der basolateralen Seite der Tubuluszelle durch eine H+-K+- ATPase ins Blut abgegeben werden kann. Normalerweise Bei der normalen Urinkonzentrierung hat man eine vollständige HCO3- -Resorption und eine H+Sekretion. Allerdings erfolgt die renale Säure-Base-Ausscheidung in Anpassung an den GesamtSäure-Base-Haushalt! 12. Harnkonzentrierung im Nierenmark Konzentration des Urins nach dem Gegenstromprinzip im äußeren Mark lokalisierter aktiver Na+-Cl- -Transport in den wasserimpermeablen dicken Henle-Schleifenschenkeln passive Harnstoffzirkulation zwischen Mark und Rinde geringe Durchblutung in den wenig autoregulierten Markgefäßen ADH-regulierte H2O-Permeabilität in den Sammelrohren Gegenstromprinzip Durch das Gegenstromsystem ist eine 100 x Konzentrierung möglich, so daß insgesamt nur ca. 1 % des Glomerulafiltrates ausgeschieden werden. Wasserdiurese: viel Wasseraufnahme führt zu einem hypoosmolalen Urin ( bis 290 mosmol/kg) Antidiurese: wenig Wasseraufnahme hat einen hyperosmolaren Urin zur Folge Die Konzentrierung bei Antidiurese bzw. Verdünnung bei Diurese wird von ADH-abhängigen Wasserkanälen in den Sammelrohren regelt. Gegenstromprinzip im äußeren Mark Permeabilität für: Wasser 162 Na+ Harnstoff aktiver Na+Transport dünn absteigend (DTL) Henle Schleife dünn aufsteigend (ATL) dick aufsteigend (TAL) kortical (CCT) Sammelrohre medullär (MCT) + 0 0 (ADH = 0): 0 (ADH = +): + (ADH = 0): 0 (ADH = +): + + + + + 0 0 0 0 + + + (+) Ausgelöst wird die Urinkonzentrierung durch die im äußeren Mark erfolgende Na +-Cl- - Resorption aus dem wasserimpermeablen TAL in das Interstitium. Die tubuläre Flüssigkeit wird, wenn sie nach distal fließt, hypoosmolal. Das Interstitium wird statt dessen hyperosmolar und die in den absteigenden dünnen Schenkel einströmende tubuläre Flüssigkeit wieder hyperosmolar durch den H2O-Ausstrom. Konzentrierung im Mark Hier ist für die Konzentrierung v. a. der Harnstoff verantwortlich. Dieser wird durch die enddistal einsetzende Wasserresorption entlang der Sammelrohre zunehmend konzentriert, da die kortikalen Sammelrohre zwar permeabler für Wasser werden, nicht aber für Harnstoff. Erst die medullären Sammelrohrabschnitte besitzen Carrier für den Harnstofftransport, so daß hier der Harnstoff entlang eines Konzentrationsgradienten diffundieren kann. Ein Teil des Harnstoff unterliegt so der Rezirkulation. Wichtig für das Funktionierens des Gegenstromsystems ist der Aufbau eines hyperosmolalen Interstitiums. Im Mark ist das Interstitium hyperosmolal,. Durch die niedrige Durchblutung der Vasa reca wird verhindert, daß die Solute ausgeschwemmt werden. Stoffe, die mit dem Blut in die Vasa recta einfließen, werden durch die Anordnung der Vasa recta-Gefäßbündel nicht angereichert. Diese Gegenstromdiffusion bewirkt eine Rezirkulation der Solute. 13. Nierenfunktionsprüfungen Urinanalysen a) Urinzeitvolumen (V)U Das Urinzeitvolumen wird gemessen in [l/d] oder [ml/min]. Eine normale Urinausscheidung (Diurese) liegt bei 1 ml/min. Liegt ein Wasserüberschuß oder ein vermehrter Anfall von Soluten im Körper, kann VU auf mehrere l/d ansteigen (Polyurie). Bei Wassermangel sinkt die Urinausscheidung bis auf 700 ml/d (physiologische Oligurie), was gerade noch ausreichend für das entfernen der anfallenden Stoffwechselprodukte ist. Sinkt die Ausscheidungsmenge unter diesen Wert (pathologische Oligurie) bzw. bleibt die ganz aus (Anurie) kommt es zu einer Anhäufung von Soluten und Wasser im Körper (Urämie). b) Urinzusammensetzung Die Urinzusammensetzung ist abhängig von der Konzentration einzelner Solute [X] U in mmol/l und der Gesamtkonzentration [Osmol]U in mosmol/kg. Es gibt keine normalen Werte für [X] U und [Osmol]U. Sie sind abhängig von Nahrung, körperlicher Aktivität und V U. Urin ist frei von Glucose, Aminosäuren, Plasmaproteinen, Blutzellen (Erythrozyten, Leukozyten) 163 Plasmaanalysen Plasmaanalysen [X]P dienen zur Erfolgskontrolle der Nierenfunktion. Wenn eine Störung der Nierenfunktion vorliegt, ist die Zusammensetzung des Plasmas verändert, z. B. bei Diabetes mellitus oder bei einer Azidose. Deshalb sollte immer zusammen mit einer Plasmaanalyse eine Urinanalyse durchgeführt werden. Beide Werte können zur Berechnung der Clearence verwendet werden. Clearance Dieser wert beschreibt das Verhältnis der pro Zeiteinheit ausgeschiedenen Substanzmengen zur Plasmakonzantration des betreffenden Stoffes. Es beschreibt somit das Plasmavolumen, das pro Minute durch die Nieren fließen muß, um die ausgeschiedene Substanzmenge der Niere zuzuführen. Dabei ist Cx der Klärwert der Substanz. Gemessen wird in [ml/min] oder [l/d]. VU [X]U Cx = ------------------[X]P Meßwerte variieren unter normalen Bedingungen nur wenig: wenn die Plasmakonzentration steigt, steigt auch die ausgeschiedene Stoffmenge an. Es ist ein empfindlicher Indikator für die Störungen der Nierenfunktion. Man unterscheidet noch eine exogene von einer endogenen Clearence Die endogene Clearance ist der Klärwert für die körpereigenen Substanzen, z. B. endogene KreatininClearance, Aminosäure-Clearance oder H2O-Clearance. Als Faustregel kann man sich merken, daß die Abnahme des GFR auf 1/5 der Norm zu einem Ansteig von [K]P um das 5-fache der Norm führt. VU [K]U Ckreatinin = GFR = --------------------[K]P Die exogene Clearance ist der Klärwert von außen durch Dauerinfusion zugeführten Meßsubstanzen, z. B. Inulin, PAH. a) Bestimmung des RBF über Clarence Die Bestimmung des RBF ist rechnerisch möglich, da das PAH beim passieren der Niere durch Filtration und tubuläre Sekretion vollständig extrahiert wird. Deshalb ist [X]VP = 0. VU [X]U Cx = ------------------[X]aP - [X]VP b) PAH-Clearance 164 Die PAH-Clearence dient der Bestimmung der Gesamtfiltrationsrate, da das PAH (p-Amino-hippurat) fast vollständig eliminiert wird. Deshalb gilt: CPAH = RPFeff69 RPFeff RBFeff = -------------------------(1 - Hämatokrit) c) Inulin-Clearance Dieser Wert dient zur Bestimmung der glomerulären Filtrationsrater. Das Inulin ist ein Fructopolysaccharid aus den Wurzeln der Dahlien. Es hat den Vorteil, daß es ungehindert filtriert und vom Tubuli weder resorbiert noch sezerniert wird. Es wird in der Niere auch nicht metabolisiert oder synthetisiert. Das Verfahren fällt unter die exogene Clearence, da das Inulin im Körper nicht selbst synthetisiert werden kann, sondern durch Dauerinfusion zugeführt werden muß. VU [Inulin]U CInulin = GFR = ----------------------[Inulin]P d) Clearance-Quotient Der Clearence-Quotient ist das Verhältnis der Substanzmenge X zur gemessenen Clearence von Inulin (Cx / Cinulin). Der Wert gibt Auskunft über: =1 <1 >1 Substanz wird weder resorbiert noch sezerniert Substanz wird netto resorbiert Substanz wird netto sezerniert + filtriert 14. Stickstoffhaltige Substanzen im Harn Es sind Endprodukte aus dem Stoffwechsel N-haltiger Substanzen (Proteine, Aminosäuren, Nukleotide). Dazu gehören: Stoff Harnstoff Harnsäure NH3 69 % N-Abgabe 90 % bei Säugetieren 95 % bei Vögeln und Reptilien 5 % bei Affe, Dalmatiner, Mensch Fische, Wasservögel und Kolibri RPFeff = renaler efferenter Plasmafluß 165 Eigenschaften Ungiftig und wasserlöslich Ungiftig, schwer wasserlöslich und kann zu Nierensteinen und zur Gicht führen Giftig Kreatinin Hypoxantin 2 - 4 % bei Säugetieren und Vögeln 5 % bei Säugetieren Besser wasserlöslich 15. Miktionsreflex Miktion Dehnung der Blase erregt parasympathische Neurone (Dehnungsrezeptoren) und hemmt die sympathischen Neurone. Es kommt zur Kontraktion des Detrusors und zum Erschlaffen des inneren Sphincters. Hemmung der Motoneurone führen zum Erschlaffen des äußeren Sphincters. Eine Verstärkung der Reflexe durch das Miktionszentrum im Hirnstamm: hier wird entschieden, ob die Miktion in Gang kommt. Harnmenge Sie variiert nach der Wasseraufnahmemenge und der körperlichen Arbeit. Viel Wasser führt zur Diurese, normal oder wenig Wasser zur Antidiurese. 16. Eigenschaften und Bestandteile des Harns Eigenschaften Aussehen: klarer Harn, nur Pferd trüb (Schleim aus den Nierenbeckendrüsen), flockt nach stehen lassen aus (Schleim, Kristalle, ...) Farbe: Urochrome färben den Harn gelb (Porphyrine, Bilirubin, Urubilin) Geruch: aromatisch Menge: Polyurie, Oligurie, Anurie Relative Dichte: abhängig vom Harnvolumen, < 1,032 Osmolarität: 800 - 900 mosmol/kg pH: 6 Bestandteile Organische Bestandteile: stickstoffhaltige Substanzen(Harnstoff, Creatinin, Ammonium, Aminostickstoff , Aminosäuren und Harnsäure), Hormone, Medikamente, Enzyme, Kohlenhydrate (fast gar nicht), organische Säuren, Fettsäuren (langkettige nur sehr wenig), Vitamine Anorganische Bestandteile: Natrium, Chlor, Kalium, Sulfat, Phosphat, Calcium, Magnesium, Wasser 17. Niere als endokrines System Auf die Funktionen der Niere üben verschiedene Hormone einen Einfluß aus. Sie werden entweder in der Niere selbst synthetisiert oder sind bereits an einer anderen Stelle im Körper synthetisiert worden. 17.1 Intrarenal gebildete Hormone Renin-Angiotensin-System 166 a) Bildung Die juxtaglomerulären Zellen werden über eine Einschränkung der Nierenfunktion, Hyponatriämie (Natriummangel), Hypovolämie und Blutdruckabfall, sowie durch den Sympathikus ( 1-Rezeptoren) aktiviert. In der Macula densa wird Renin gebildet, in Granula gespeichert und ausgeschüttet. Das Renin ist eine saure Protease, die aus dem in der Leber gebildeten 2-Globulin Angiotensinogen (inaktives Prohormon), Angiotensin I abspaltet. Das Angiotensin I wird durch eine Peptidase, das converting enzyme, in das Angiotensin II umgewandelt. Renin converting enzyme Angiotensin Angiotensin I Angiotensin II b) Aufgaben des Angiotensin II Vasokonstriktion, die eine Erhöhung des afferenten Arteriolenwiderstandes zur Folge hat und somit zum Blutdruckanstieg führt Vermehrte Bildung von Aldosteron, das zu einer Na+-Rückresorption in Niere (tubuläre Rückresorption) und Darm führt. Die Wirkung tritt nur langsam ein, ist jedoch für die mittelfristige Blutdruckregulation wichtig. Wirkt auf das Durstzentrum im Gehirn vermehrte Wasseraufnahme Allgemeine Wirkungen sind Kontrolle des Na+-Bestandes, Kontrolle des extrazellulären Flüssigkeitsvolumens und der Blutdruckregulation Erythropoetin a) Hormon und Bildung Das Erythropoetin ist ein Glykoprotein, das aus 165 Aminosäuren aufgebaut ist. Es wird von Nierenzellen und in geringen Mengen auch in der Leber produziert Die Ausschüttung wird stimuliert durch den Abfall des pO2-Wertes. b) Wirkung Es wirkt hauptsächlich auf das Knochenmark, zu dem es mit dem Blut transportiert wird. Dort fördert es die Differenzierung der Erythrozytenvorstufen, die Synthese von Hämoglobin und die Abgabe jugendlicher Erythrozyten an das Blut. Vitamin-D-Hormon, Cholekalziferol, Kalzitriol a) Bildung Das Vitamin D-Hormon wird aus Calciferolen gebildet. Es sind fettlösliche Substanzen, die den Steroiden nahe stehen. Man unterscheidet hier das Ergocalciferol (Vitamin D2) und das 167 Cholecalciferol (Vitamin D3). Sie entstehen aus ihren Provitaminen durch Ultraviolettstrahlung (Hydroxylierung). Am Beispiel des Cholecalciferol (25 (OH)-Cholekalziferol), das aus der Nahrung oder dem Cholesterinstoffwechsel, stammt, wird durch UV-Licht und der 1-Hydroxylase umgewandelt bzw. hydroxyliert in 1,25 - Dihydroxycholecalciferol, das sog. „Vitamin-D3-Hormon“. Stimuliert wird die Reaktion durch PTH (Parathormon) und gehemmt durch Phosphat- und Calciumionen. Aus dem 25 (OH)-Cholekalziferol kann auch eine inaktive Form, das 24,25-Cholekalziferol gebildet werden, das durch PTH gehemmt und von Ca2+ und 1,25-Dihydroxycholekaliferiol stimuliert wird. b) Wirkung Die Abgabe erfolgt bei Kalzium- und Phosphatmangel. Im Plasma ist das Hormon fast vollständig an das Vitamin-D-bindende Protein, ein Albumin, gebunden. Seine Wirkungen beschränkt sich auf die Resorption von Calcium und Phosphat aus dem Darm, die dadurch gesteigert wird. Eikosanoide Die Eikosanoide, werden aus ungesättigten Fettsäuren in der Niere selbst,sowie auch in anderen Geweben gebildet. Sie haben verschiedene Wirkungen auf die Niere: Beeinflussung des renalen Gefäßtonus durch Vasokonstriktion (TxA2, PGF2 und LTD4) bzw. Vasodilation (PGI2 und PGE2), das zu einem Ansteig der Durchblutung im juxtamedulären Bereich führt. Beeinflussung der tubulären Na+-Resorption (PGI2 und PGE2) durch Hemmung der Transporter im aufsteigenden Schenkel der Henle Schleife, sowie in den Sammelrohren. Modulation der Wirkung von ADH, da PGE2 zum einen die Sekretion von ADH fördert, aber andererseits die Wirkung des ADH am Tubulus abschwächt. 17.2 Extrarenal gebildete Hormone Aldosteron Das Aldosteron wird in der Zona glomerulosa der Nebennierenrinde (Syntheseort) gebildet und gelangt über das Blut nur Niere. Es ist ein Mineralocorticoid und hat eine Latenzzeit von 60 bis 90 Minuten. In der Niere wirkt es auf die distalen Tubuli und die Sammelrohre (Wirkort) und steigert dort die Na+-Resorption. Dies geschieht durch Zunahme der Anzahl an apikalen Na +-Kanälen (über die mRNA erfolgt ein erhöhter Einbau von Na+-Kanälen, die eine Steigerung der Na+-Resorption zur Folge hat), sowie eine Erhöhung der Offen-Wahrscheinlichkeit der Kanäle. Zusätzlich steigert es noch die Sekretion von K+, da es durch die erhöhte Aufnahme des Na+ im Lumen der Tubuli zu einer negativen Spannung kommt. Atriopeptin, ANF Das Atriopeptin oder auch atrialer natriuretischer Faktor wird in den Vorhöfen des Herzens (Syntheseort) gebildet und bei starker Kochsalzausnahme oder extrazelluläre Volumenzunahme 168 ausgeschüttet. Es wirkt gefäßaktiv (gefäßerweiternd), steigert die GFR, steigert die H 2OAusscheidung, hemmt die Na+-Resorption im Sammelrohr und fördert somit die Na+-Ausscheidung. ADH, antidiuretisches Hormon, Vasopressin Das Vasopressin wird in der Neurohypophyse, Hypophysenhinterlappen (HHL) gebildet und bei einer Abnahme des Plasmavolumens, sowie bei einer Zunahme der Osmolarität des Extrazellulärraumes ausgeschüttet. Es hat eine Latenzzeit von 1 bis 2 Minuten und wirkt wie die anderen Hormone am distalen Tubulus und den Sammelrohren. Seine Aufgaben sind: Erhöhung der Wasserpermeabilität im Bereich der Sammelrohre Verminderung der glomerulären Filtrationsrate Parathormon (PTH) Das Hormon ist das Parathormon (PTH). Es ist ein Peptidhormon bestehend aus 84 Aminosäuren. Beim Absinken der Plasmaionenkonzentration (Hypocalcämie) wird die Freisetzung des Hormons veranlaßt. An der Niere hat es folgende Wirkungen: Förderung der Ca2+-Rückresorption, d. h. Verminderung der Ausscheidung von Calciumionen Hemmung der Phosphat-Rückresorption Stimulation des Umbaus vom Vitamin-D in das Vitamin-D-Hormon Verminderung der glomerulären Filtrationsrate HAUSHALT 169 1. Säure-Base-Haushalt 1.1 Chemische Grundlagen der pH-Regulation Definition des pH-Wertes Der pH-Wert ist als der negativ-dekadische Logarithmus der H+-Ionen definiert: pH = - log [H+]. In der extrazellulären Flüssigkeit liegt der pH-Wert bei 7,4 schwankt aber normalerweise zwischen 7,35 und 7,45. Die Wasserstoffionenkonzentration wird in einer bestimmten Schwankungsbreite reguliert, wofür Puffersysteme notwendig sind.. Wichtige physiologische Puffer befinden sich in den Nieren und der Lunge. Die chemischen Puffer sind zu gleichen Teilen im intrazellulären (vorwiegend Proteine und org. Phosphate) und dem extrazellulären Raum (Hämoglobin, Plasmaproteine, Bikarbonat) verteilt. Definition von Säure / Base Säure = Protonendonator (H+) Base = Protonenakzeptor (OH-) Chemische Gleichgewichte assoziiert HA H+ + A- dissoziiert Im Gleichgewicht: VDissoziation = Vassoziation Massenwirkungsgesetz [H+] [A-] k1 K = ------------------- = -----[HA] k2 70 Puffer Ein Puffer ist eine Lösung aus einer schwachen Säure und ihrer korrespondierenden Base. Wirkung: HA + OH- A- + H2O A- + H3O+ HA + H2O Die Pufferkapazität ist die Mol-Menge, die zugegeben werden kann, bis der pH-Wert sich um 1 verändert. Die höchste Pufferkapazität eines Puffers liegt um den pKS-Wert71 1 und ist pHabhängig. Henderson-Hasselbach-Gleichung 70 K = Dissoziationskonstante/ Gleichgewichtskonstante Der pKS ist der - log K und stellt ein Maß für die Stärke einer Säure dar. Je niedriger der pK S-Wert, desto stärker dissoziiert die Säure in Wasser, desto saurer reagiert sie. 71 170 Diese Gleichung verwendet man für die Berechnung des pH-Wertes einer Pufferlösung. [A-] pH = pKS + log ---------[HA] Salz --------Säure pK ist der dementsprechend dem pH-Wert symbolisierte negativ-dekadische Logarithmus der Massenwirkungskonstante K. Dieser Wert gibt an, bei welchen pH-Wert beider Parameter unter dem Logarithmus gleich sind. 1.2 Störungen des Säure-Base-Haushaltes Azidose und Alkalose pH des Blutes Azidose72 Alkalose73 Toleranzwerte 7,4 ± 0,03 < 7,37 > 7,43 7,0 - 7,8 (7,37 - 7,43) (sauer < 7) (basisch > 7) Respiratorische Störungen74 a) Respiratorische Azidose Eine respiratorische Azidose wird durch eine ungenügende alveoläre Ventilation hervorgerufen werden, da nicht genug CO2 abgeatmet werden kann, so daß der pCO2 im arteriellen Blut ansteigt (Hyperkapnie): H2O + CO2 H+ + HCO3- pH . Vorkommen bei Lungenkrankheiten, Störungen des Atemzentrums im Gehirn b) Respiratorische Alkalose Eine respiratorische Alkalose entsteht durch Hyperventilation, da es dadurch zu einem vermehrten ausatmen von CO2 kommt, der pCO2 fällt (Hypokapnie) pH . Vorkommen bei Hyperventilation. Metabolische Störungen75 a) Metabolische Azidose Die Ursache für eine metabolische Azidose ist die Abnahme der Bikarbonatkonzentration, obwohl eine weitgehende ungestörte Atemfunktion mit normalen pCO2 vorliegt. Vorkommen bei schwerem Durchfall (HCO3- -Verlust), Nierenschädigungen (Insuffizienz mit ungenügender H+- 72 Abweichungen in den sauren Bereich Abweichungen in den basischen, alkalischen Bereich 74 Abweichung vom pCO2 durch Ventilationsstörungen, Basenüberschuß (BE = base excess) normal 75 Abweichungen vom BE durch Änderungen der Bikarbonatkonzentration, pCO 2 normal 73 171 Ionen-Elimination), Diabethis mellitus (vermehrtes Auftreten von Ketonsäuren) und bei verstärkter Milchsäurebildung bei körperlicher Arbeit. b) Metabolische Alkalose Eine metabolische Alkalose entsteht bei länger andauerndem Erbrechen, da dadurch die verloren gegangene Magensäure ersetzt wird und gleiche Mengen an Bikarbonat in das Blut eingelagert werden (BE pH ). Vorkommen ist bei starkem Erbrechen. Diagnostik unkompensierte Störungen PH BE respiratorische Azidose respiratorische Alkalose metabolische Azidose metabolische Alkalose pCO2 Partiell76 oder komplett77 kompensierbare Störungen PH BE pCO2 respiratorische Azidose respiratorische Alkalose metabolische Azidose metabolische Alkalose Kompensationsmechanismen a) Respiratorische Alkalose Bikarbonat muß zusätzlich noch eliminiert werden. Dies geschieht durch die Niere. Durch den verminderten PCO2 ist dort die zelluläre Bereitstellung von H+-Ionen vermindert, der Na+-H+Antiport hat einen geringen Umsatz, und die treibende Kraft für die Bikarbonatresorption ist vermindert. Es wird mehr HCO3- ausgeschieden. b) Respiratorische Azidose Hier kommt es in der Niere zu einer Regeneration von Bikarbonat. Für jedes über NichtBikarbonatpuffer (NH3, Phosphat) eliminierte H+-Ion wird ein HCO3- -Molekül in der Tubuluszelle gebildet und in das Blut resorbiert. Es folgt daraus ein Ansteig der Bikarbonatkonzentration im Blut. 76 77 Respiratorische Azidose Basenüberschuß HCO3- -Resorption durch die Niere H+-Ausscheidung Respiratorische Alkalose Basendefizit Ausgleichsversuche der BE und der Atmung nur noch bestimmbar ob Azidose oder Alkalose, die Ursache ist nicht mehr bestimmbar 172 c) Metabolische Alkalose Hier kann nur die Niere eine Kompensation schaffen. In der Niere ist ein „Schwellenwert“ für die Konzentration von Bikarbonat registriert, so daß der Überschuß so lange ausgeschieden wird, bis der Schwellenwert unterschritten wird. d) Metabolische Azidose Über die extrazelluläre H+-Ionen-Konzentration werden Chemorezeptoren in der Medulla oblongata erregt, die eine Ventilationssteigerung auslösen. Es wird vermehrt CO 2 ausgeatmet. Im Blut verringert sich dadurch auch der CO2-Partialdruck. Wenn die Ventilationssteigerung nicht mehr ausreicht, muß die Niere helfend eingreifen. Durch die verstärkte H +-Elimination wird Bikarbonat aufgebaut. Gesamtpufferbasen oder auch Pufferbasen fassen diejenigen Puffersysteme zusammen, die als Anionen schwacher Säuren H+-Ionen binden könne. Dazu zählen neben dem Bikarbonat-Puffersystem auch Proteine und anorganische Phosphate. Zu dem Verhältnis der Proteinat-Bikarbonatpuffern im arteriellen Blut tragen das Plasma infolge seiner niedrigen Proteinkonzentration und die Erytrozyten infolge ihrer hohen Hämoglobinkonzentration sowie des begrenzten Lösungsraums für HCO3- in unterschiedlicher Weise bei. Bei Reaktionen bleibt die Gesamtpufferbase konstant und kann daher als Bezugsgröße für metabolische Störungen des Säure-Base-Haushaltes herangezogen werden. Im Normalfall liegt die Konzentration der Gesamtpufferbasen im arteriellen Blut bei 48 mmol/l. Ein Mehrbetrag bezeichnet man als Basenüberschuß wie es bei der metabolischen Alkalose der Fall ist. Bei der metabolischen Azidose mißt man dementsprechend das Basendefizit. 1.3 Extrazelluläre pH-Regulation Puffersysteme Puffersysteme im Blut: Bikarbonat / CO2-Puffer Atmung (½), Plasmaeiweiß-Puffer (⅓), Hämoglobin-Puffer (1/6), Phosphat-Puffer Regulation durch renale Säure-Base-Ausscheidung Diagnostische Parameter pH pCO2 Gesamtpufferbasen 7,4 0,03 40 5 mmHg 48 mmol/l Standardbikarbonat: Bikarbonatkonzentration im Plasma bei 37° C und pCO2 40 mmHg 24 mmol/l Basenüberschuß (BE): Abweichung vom Normalwert der Gesamtpufferbasen (48 mmol/l) BE = 0 BE > BE < 2,5 mmol/l + 2,5 mmol/l - 2,5 mmol/l 173 Puffersysteme a) Bikarbonat / CO2-Puffer H2O + CO2 H2CO3 H+ + HCO3[CO2] = 0,03 pCO2 Offenes System, da CO2 abgeatmet werden kann und HCO3- durch die Niere ausgeschieden wird. (Konzentration von CO2 und HCO3- kann nach Bedarf verändert werden.) Hohe Konzentration: 24 mmol/l HCO3Die Regulation des pHs erfolgt über die Atmung (bei pH-Abfall und bei pH-Anstieg ) H+ + HCO3- CO2 (Abatmen) + H2O OH- + H2O + CO2 (Einatmen) 2 H2O + HCO3- b) Plasmaeiweiß-Puffer c) Wirkung der ionisierbaren Seitengruppen des Aminosäuren (Imidazolgruppe am Histidin) Beste Wirkung liegt am isoelektrischen Punkt Relativ hohe Konzentration: 15 mmol/l Gleicht bei Gesamtpufferbasen CO2-Schwankungen aus Wichtiges Plasmaprotein ist das Albumin Hämoglobin-Puffer Hoher Anteil an Histidin (pKS 6) Der hohe O2-Austausch verstärkt die Pufferwirkung von Hämoglobin Relativ hohe Konzentration im Blut von 7 mmol/l Änderung des pKS vom Hämoglobin bei Sauerstoffbeladung pHS desoxygeniertes Häm (schwächere Säure) pKS Hämoglobin d) > CO2-Aufnahme: CO2 + H2O HCO3- + H+ CO2-Abgabe: Bindung von H+ an das Hämoglobin Phosphat-Puffer78 78 pKS oxygeniertes Häm (stärkere Säure) pKS Hämoglobin mit O2 > Intrazellulärer Puffer und Puffer im Harn pKS pH Blut (6,8) H2PO4- (Dihydrogenphosphat) HPO42- (Hydrogenphosphat) 174 Nur geringe Plasmakonzentration von 1mmol/l Regulation durch renale Säure-Base-Ausscheidung HCO3- -Rückresorption Protonen-Sekretion (< 1% der Säurevalenz) Phosphat-Puffer im Harn Ammoniaksekretion Regulationsmechanismen: Azidose HCO3--Resorption Glutaminaseaktivität NH3-Sekretion (Pufferwirkung des Urins) NH3-NH4+-Gleichgewicht auf der Seite von NH4+ Alkalose HCO3- -Resorption H+- Sekretion 1.4 Intrazelluläre pH-Regulation Passive Mechanismen Phosphat-Puffer Bikarbonat-Puffer Aminosäure-Puffer Protein-Puffer Aktive Mechanismen a) Baseneliminierung b) Bicarbonat-Chlorid-Austauscher: sekundär aktiver Transport, Ausschleusen von HCO3- aus der Zelle HCO3- -Kanal: Diffusion durch elektrischen Gradienten oder elektrochemisch Protoneneliminierung H+-Na+-Antiport: sekundär aktiver Transport, Ausschleusen von H+-Ionen aus der Zelle Na+-Bikarbonat-Symport: sekundär aktiver Transport, Einschleusen von HCO3- in die Zelle H+-K+-Austauscher (Pumpe): primär aktiver Transport H+-Kanal (bei Depolarisation): H+-Ausschleusung aus der Zelle 2. Wasserhaushalt 2.1 Flüssigkeitsräume Das Volumen und die Verteilung des Körperwassers ist anhängig vom Alter und dem Geschlecht. Beim Säugling macht das Wasser 75 % des Körpergewichtes aus. Beim Erwachsenen sind es nur noch 65% und im Greisenalter sind es nur noch 55 %. 175 Von diesem Wassergehalt befinden sich im Knochen- und Fettgewebe weniger als 30 %. Der übrige Teil verteilt sich auf des Rest des Körpers. Flüssigkeitsräume Die Gesamtheit des Wassers (Gesamtkörperflüssigkeit, GFR) ist in verschiedene Flüssigkeitsräume oder Kompartimente verteilt. Man unterscheidet hier: Flüssigkeitsräume Intrazellulärer Raum Extrazellulärer Raum Transzellulären Raum79 Was gehört dazu? Zellen Interstitium (Zellen unmittelbar umgebender Flüssigkeitsraum) Blutplasma (extrazellulärer flüssiger Anteil des Blutes) Magen-Darm-Trakt Augenkammern Liquor cerebrospinalis Exkretorische Drüsen Nierentubuli und ableitende Harnwege Volumen 63 % Abkürzung IZR 37 % EZR Messung der Flüssigkeitsräume Gemessen werden Flüssigkeitsräume durch die Indikatorverdünnungsmethode. Zur Bestimmung des Blutvolumens (V) wird eine geeignete Substanz (Indikator) in bekannter Menge in ein Kompartiment mit unbekanntem Volumen gegeben. Nach Verteilung wird die Konzentration des Indikators (C) in dem entsprechendem Raum gemessen. Mit der Formel erhält man dann das Blutvolumen. Menge der Indikatoren Volumen = ----------------------------------------- = Konzentration der Indikatoren Direkt meßbare Komponenten: GFR, Plasmavolumen und extrazellulare Flüssigkeit Raum Gesamtkörperflüssigkeit Extrazellulärflüssigkeit Plasmavolumen Erythrozytenvolumen Indikator D2O, Antipyrin, TOH Inulin, Iothalamat, DTPA Evans Blau, markierte Proteine markierte Erythrozyten Nicht direkt meßbare Komponenten: intrazelluläre Flüssigkeit, Interstitium und Blutvolumen Raum intrazelluläre Flüssigkeit Interstitium Blutvolumen 79 M ----------C Berechnung GKF – EZF EZF – Plasmavolumen Plasmavolumen / (1 - Hämatokrit) von Epithelien umschlossener Flüssigkeitsraum 176 Zusammensetzung der extrazellulären un der intrazellulären Flüssigkeit EZF [mmol / l] 145 4 120 27 2 Teilchen Na+ K+ ClHCO3Proteine Phosphat IZF [mmol / l] 12 155 4 8 155 100 Osmotisch wichtige Bestandteile Extrazelluläre Flüssigkeit: Na+, Cl- und HCO3Intrazelluläre Flüssigkeit: K+, Phosphat und Proteine Die Osmolarität aller Kompartimente ist gleich (außer Schweiß, Urin und ähnliches). Der Austausch der Flüssigkeit zwischen Interstitium und Blutplasma erfolgt durch kapilläre Filtration und Resorption. 2.2 Wasserbilanz80 Ausscheidung Bei normaler Ernährung müssen über die Nieren ca. 1200 mosmol an harnpflichtigen Stoffen, wie z. B. Kreatinin, Harnstoff, Harnsäure oder auch Ionen wie Ammonium, Sulfat oder Phosphat, die als Abbauprodukt von Proteinen anfallen. Die Niere konzentriert dabei die Flüssigkeit bis auf das 4-fache der Plasmakonzentration. Weiteres Wasser geht über den Kot verloren. Schließlich verliert man noch durch Verdunstung (Perspiratio insensiblis oder insensible Abgabe) einen Teil des Wassers. Dazu gehört die Diffusion von Wasser durch die Haut, das dort verdunstet oder auch durch H2O in der Expirationsluft (wasserdampfgesättigte Expirationsluft). Bei zusätzlichen Belastungen des Organismus durch eine erhöhte Umgebungstemperatur und erhöhte körperliche Arbeit verliert der Körper auch über den Schweiß Wasser. Wasserabgabe [ml/Tag] 2500 Obligater Wasserverlust über die Nieren 1500 Perspiratio insensiblilis, insensible Abgabe 750 Kot 150 Schweiß 100 % 100 60 30 6 4 Aufnahme Über das Trinken wird ca. die Hälfte des Wasserverlust wieder ausgeglichen. Fast genausoviel Wasser wird über die Nahrung aufgenommen. Schließlich dient auch noch der Stoffwechsel zur Bildung von Wasser. Bei Stoffwechselprozessen, d. h. Abbau von Proteinen, Kohlenhydraten und Fetten, wird 80 Zwischen Aufnahme, Bildung und Ausscheidung von Wasser besteht normalerweise ein Gleichgewicht. 177 das sog. Oxidationswasser gebildet. Und zwar entstehen 0,44 ml H2O aus 1 g Protein, 0,6 ml H2O aus 1 g Kohlehydrate und 1,09 ml H2O aus 1 g Fett. Wasseraufnahme [ml/Tag] 2500 1250 1000 250 Flüssigkeitsaufnahme durch Trinken Nahrung Stoffwechsel % 100 50 40 10 2.3 Regulation des Wasserhaushaltes Osmoregulation Bei einer Änderung der extrazellulären Osmolarität (Abweichung < 1%), erfolgt eine Einstellung der Osmolarität auf ca. 290 mosmol/kg. Stellglieder sind: Wasseraufnahme durch Durst (hyperosmotischer Durst) Wasserabgabe der Niere (ADH) Nach der Wasseraufnahme diffundiert dieses ins Blut. Aus dem Pfortadersystem entweicht Na + und Cl- so daß das Blut hypoton wird. In der isotonen Leber kommt es zur Wasseraufnahme in die Zellen (physiologische Leberschwellung). Osmorezeptoren der Leber signalisieren dem Hypothalamus, daß die Synthese und Freisetzung von ADH reduziert werden soll. Durch den Rückgang der ADH-Konzentration wird in der Niere eine erhöhte Wasserdiurese einsetzten - noch bevor die enterale Wasseraufnahme abgeschlossen ist. Wenn die Leber kein Wasser mehr aufnehmen kann, sinkt die Osmolarität im arteriellen Blut. Osmorezeptoren, die im Hypothalamus gelegen sind, verstärken noch die ADH-Hemmung. Bei einer Erhöhung der Osmolarität laufen dann die folgenden Reaktionen ab: Osmolarität des Blutes H2O-Aufnahme in Leberzellen Osmorezeptoren der Leber Osmorezeptoren des Hypothalamus ADH Wasserresorption der Niere afferente Fasern Hypothalamus ADH-Synthese und Freisetzung Wasserkanäle in Sammelrohr Wasserresorption der Niere Volumenregulation81 81 Tritt eine Gefährdung der Kreislaufstabilität ein, wird die Osmoregulation über die Volumenregulation überspielt. Es ist wichtiger den drohenden Kreislaufkollaps abzuwenden, als die mit einer Wasseraufnahme bedingten Blutverdünnung (Hyponatriämie) auszugleichen. 178 Bei Zunahme isotoner Flüssigkeit im Extrazellulärraum sprechen Volumenrezeptoren im Niederdruckbereich des Kreislaufs an. Sie liegen in der Wand der intrathorakalen Hohlvenen und in den Herzvorhöfen. Informationen werden an den Hypothalamus weitergeleitet und lösen dort eine Hemmung der ADH-Synthese aus. Bei einem größeren Volumenverlust reagieren zentrale Osmorezeptoren mit einer Steigerung der ADH-Synthese, damit die Niere ihre H2O-Resorption steigert. Gleichzeitig wird das Durstzentrum aktiviert. Volumenrezeptoren sind in der Regel relativ unempfindlich. Fällt allerdings das Volumen unter einen kritischen Wert, findet eine exponentielle Steigerung der Ansprechempfindlichkeit statt. Die ADHSynthese wird aktiviert. Sinkt auch noch der Blutdruck, reagieren Barorezeptoren, die sich in der Wand des Aortenbogens befinden, so daß wiederum die ADH-Synthese aktiviert wird. Osmotischer Durst82 Das Durstgefühl kann durch eine Erhöhung der Konzentration in der Extrazellulärflüssigkeit (hyperosmotischer Durst) oder durch isotonen Volumenmangel (hypovolämischer Durst) ausgelöst werden. Es wirkt auf das Durstzentrum im Hypothalamus. Als Folge davon bekommt man Durst. 2.4 Hydrations- und Dehydrationszustände83 Dehydration a) Isotone Dehydration Verlust von extrazellulärer Körperflüssigkeit (Verbrennungen, Blutverlust, ...) oder auch durch den Verlust von transzellulärer Flüssigkeit (Durchfall, Erbrechen, ...) Osmolarität konstant, Volumen (EZF) b) Hypotone Dehydration Es entsteht durch eine mangelnde Wasserzufuhr. Die Osmolarität des EZF , das Volumen . Es kommt zu einem vermehrten Wasserausstrom aus dem IZR in das EZR. Dieser Zustand kann aber durch die Zufuhr von Wasser wieder kompensiert werden. c) Hypertone Dehydration Sie wird durch Salzmangel hervorgerufen. Ein z. B. Na+-Mangel führt zu einer Steigerung der Osmolarität des EZF, wobei das Volumen aber konstant bleibt. Dies führt dann wiederum zu einem Wasserausstrom aus dem EZR in das IZR. Korrigiert wird dieser Zustand über eine Na +Zufuhr durch Salzappetit. Hyperhydration 82 Regelung der Aufnahme durch Durstmechanismus und Regelung der (renalen) Abgabe durch das ADH-System Primäre Störungen der Wasserbilanz (Volumenänderungen) oder des Elektrolythaushaltes (Osmolaritätsänderungen) können sekundär korrigiert werden. Verschiebung von Soluten und Wasser zwischen EZR und IZR oder durch eine unausgeglichene Wasserbilanz. 83 179 a) Isotone Hyperhydration b) Bei einer vermehrten Zufuhr von isotonen Elektrolytlösungen bleibt die Osmolarität konstant, aber das Volumen des Extrazellulärraumes steigt an. Es führt zu Wassereinlagerungen und zu Ödemen. Hypotone Hyperhydration Bei einer gesteigerten Wasserzufuhr fällt die Osmolarität des EZF ab, das Volumen steigt dafür an. Es kommt zu einem Wasserausstrom aus EZF in das IZF. Die Korrektur erfolgt durch eine H2O-Ausscheidung (Diurese) c) Hypertone Hyperhydration Entsteht durch Salzüberschuß, z. B. bei Schiffsbrüchigen kann dies vorrübergehend der Fall sein, wenn die das Salzhaltige Wasser getrunken haben. Die Osmolarität des EZF steigt an, das Volumen bleibt konstant. Es folgt ein Wasserausstrom aus dem IZF in das EZF. Eine Korrektur erfolgt über die Na+-Ausscheidung durch Atriopeptin. Andere Einteilung der Störungen a) Isoosmolare Veränderungen ohne Osmolaritätsänderung mit Volumenänderung b) isoosmolale Dehydration isoosmolale Hyperhydration Primäre Veränderungen der Wasserbilanz mit Osmolaritätsänderung mit Volumenänderung c) hyperosmolale Dehydration hypoosmolale Hyperhydration Primäre Veränderungen des Elektrolythaushaltes mit Osmolaritätsänderung ohne Volumenänderung hypoosmolare Dehydration hyperosmolale Hyperhydration 3. Energiehaushalt 3.1 Energieumsatz Energieumsatz Es ist die Energiemenge, die in einer bestimmten Zeiteinheit unter bestimmten Bedingungen im Organismus eines Tieres umgesetzt wird. Der Energieumsatz bei Haustieren ist von Körpermasse, Umgebungstemperatur und Leistung abhängig. Es besteht aus Umsatzgrößen der Zellen und des Gesamtorganismus. Gesamtumsatz 180 Summe aus äußerer Arbeit, abgegebener Wärme und gespeicherter Energie bzw. Wärme einer Zelle Wirkungsgrad Der Wirkungsgrad oder Nutzeffekt () entspricht dem 2. Hauptsatz der Thermodynamik. geleistete Arbeit Wirkungsgrad [%] = ---------------------------- 100 umgesetzte Energie Energie Die Energie entsteht aus Kohlenhydraten und Fette, die für den Betriebsstoffwechsel benötigt werden, sowie aus Eiweißen für den Baustoffwechsel (+ anabol bzw. - katabol). Begriffserklärungen Anabolismus: Aufbau spezifischer, körpereigenen Substanzen Katabolismus: Abbau von körpereigenen Substanzen oder von aufgenommenen Substraten biologischer Brennwert: Energiemenge, die beim Abbau von Kohlenhydraten, Fetten und Proteinen entsteht und frei wird. Es entspricht im Prinzip dem physikalischen Brennwert. physikalische Brennwert: Energie, die in Form von Wärme bei der Verbrennung entsteht, z. B. Glucose hat einen Brennwert von 3,75 kcal. 3.2 Umsatzgrößen Umsatzgrößen der Zelle Erhaltungsbedarf (Erhaltung der Zellstrukturen, ca. 15 %) Bereitschaftsbedarf (sofortige, uneingeschränkte Funktionsbereitschaft, ca. 50 %) Tätigkeitsbedarf (zellspezifische Leistungen, ca. 100 %) Umsatzgrößen des Gesamtorganismus a) Ruheumsatz Er ist nicht identisch mit der Summer der Bereitschaftsumsätze, da einige Organe immer Arbeit verrichten, z. B. Herz. Deshalb wurde ein Energiegrundumsatzes formuliert.) b) Energiegrundumsatz, Minimalbedarf Geringmöglicher Substratumsatz, der zur Aufrechterhaltung lebensnotwendiger Stoffwechselvorgänge dient. Es entspricht dem Energiebedarf unter Standardruhebedingungen, d. h. 181 Morgens Körperliche Ruhe Nüchternheit Neutral-/ Indifferenztemperatur Der Grundumsatz hat allerdings für die praktische Fütterung wenig Bedeutung, da z. B. Wiederkäuer durch ihre mikrobielle Verdauung nie nüchtern sind und völlige Muskelruhe bei den Tieren kaum vorkommt. c) Arbeitsumsatz Energieumsatz unter körperlicher Arbeit 3.3 Einflüsse auf den Energieumsatz Masse – Oberfläche: Je größer und schwerer ein Tier ist, desto kleiner ist sein Energieumsatz. Für kleine Tiere gilt genau das Gegenteil! Alter: Mit zunehmendem Alter geht der Energieumsatz (pro kg Körpergewicht) zurück. Umgebungstemperatur: Bei sinkender Umgebungstemperatur nimmt die Wärmeerzeugung und damit auch der EU im Körper zu, um die Ankühlungstemperatur auszugleichen Arbeit: Je höher die motorische Aktivität (sprich die Arbeit) ist, desto höher ist der Energieumsatz. Mitochondrienanzahl Temperatur: nach der RGT-Regel. Für den Organismus bedeutet das, daß sich der Energieumsatz verdoppelt, wenn die Kerntemperatur um 10 K ansteigt. Die in Hyperthermie beobachtete Energieumsatzsteigerung ist aber überwiegend auf die Aktivierung der Wärmeabgabemechanismen und auf die Ausschüttung von stoffwechselaktiven Hormonen zurückzuführen. Wachstum: Der Energieumsatz eines wachsenden Organismus ist höher als der eines gleichschweren ausgewachsenen Tieres Verdauung: Fleischfresser und Allesfresser brauchen für die Verdauung nur 1 - 2 % der Energie (enzymatische Verdauung), Pflanzenfresser hingegen 15 - 20 % (mikrobielle Verdauung) Ernährungszustand: Im Hungerzustand fällt der Energieumsatz in den ersten Tagen sehr stark ab. Da der Körper aber eine bestimmte Energiemenge braucht, um die Lebensnotwendigen Vorgänge aufrecht zu erhalten, kann der Energieumsatz nur bis zu einem Minimalwert angesetzt werden EU Zeit (t) Endokriner Zustand: Mangel oder Fehlen an Schilddrüsenhormonen T3 und T4 führt zu einer Verminderung des Energieumsatzes. 182 Bei Proteinmangel wird weniger T3 und T4 ausgeschüttet, was zu einer Verminderung des Energieumsatzes führt. Bei wachsenden Organismen führt dies zur Unterentwicklung des Gehirns und zu Wachstumsverminderung. Ein Mangel an Hormonen aus der Nebennierenrinde (Glucocorticoide) führt ebenfalls zur Verminderung des Energieumsatzes. 3.4 Tierkaloriemetrie Kaloriemeter, Bombenkaloriemeter Verbrennung eines Futtermittels (vollständig) in einem mit isolierten Doppelwandgefäß, das in einem Wasserbecken steht. Die Erwärmung des Wassers durch die bei der Verbrennung freiwerdende Energie wird zur Bestimmung der Gesamtenergie und des Energieumsatzes verwendet. Gemessen wird die Temperaturdifferenz des Wassers. Dabei bedeutet 1 cal = 1 g H2O von 14,5° C auf 15,5° C. a) Direkte Kaloriemetrie Die vom Tier in Form von Wärme abgegebene Energie wird in einem geschlossenen System mit physikalischen Methoden bestimmt und ins Verhältnis zur Energie der aufgenommenen Nahrung gesetzt. Es ist Messung der Wärmeabgabe eines Tieres im Tierkaloriemeter. In Ruhe wir die dem Körper in Form von Nahrung zugeführte Energie zum größten Teil in Wärmeenergie umgewandelt, da kaum äußere mechanische Arbeit geleistet wird. (bei konstanter Temperatur). Die Wärmeabgabe entspricht demnach dem Energieumsatz innerhalb des Organismus. Nachteile sind: b) Der Versuch kann nur bei einer Umgebungstemperatur von O° C durchgeführt werden. Das vom Tier abgegebene CO2 muß abgeführt werden (ungenaues Ergebnis) Indirekte Kaloriemetrie Die Wärmeproduktion wird aufgrund von Stoffwechselgrößen berechnet. Die 3 Hauptnähstoffe (Fette, Eiweiße, KH) brauchen zur vollständigen Oxidation im Intermediärstoffwechsel eine bestimmte Menge O2 und CO2 wird daraufhin frei. Bei der Umsetzung von Proteinen wird noch zusätzlich Stickstoff (N) freigesetzt, der ins Blut und damit zur Niere gelangt und dort als harnpflichtige Stoffe ausfiltert wird (d. h. nur der Harn-N und nicht der Kot-N ist hier wichtig!). Man geht davon aus, daß die Oxidation der Nährstoffe mit dem Verbrauch an O2 und der Produktion von CO2 und Stickstoff in Zusammenhang steht, d. h. man kann Durch die Messung der O2-Aufnahme bzw. dessen verbrauch in [l] und der CO2-Abgabe bzw. dessen Produktion in [l] und der Harn-N-Produkte in [g] den Umsatz berechnen (pO2 und pCO2 in Umgebungs- und Expirationsluft). c) Tierkaloriemetrie bei Herbivoren Berechnung des Energieumsatzes direkt aus den Werten für O2-Aufnahme und CO2- und Harn-NAbgabe, wobei die Pflanzenfresser die Abgabe von CH4, H2 (Wiederkäuer durch Mikroorganismen) und Hippursäure (durch Ligninspaltung, Pferd bis zu 130 g/Tag, Wiederkäuer 30 g/Tag) berücksichtigt werden muß. Die umgesetzte Energie beim Pflanzenfresser: 183 EU = 3,87 O2 + 1,2 CO2 - 1,43 Harn-N - 0,32 CH4 - 1,12 H2 + 0,4 Hippursäure d) Tierkaloriemetrie bei Carni- und Omnivoren Der Energieumsatz errechnet sich aus den Werten für die O2-Aufnahme, der CO2-Abgabe und der Harnstoff-Ausscheidung. Die umgesetzte Energie: EU = 3,87 O2 + 1,2 CO2 + 1,43 Harn N (Brouwer’sche Formel) Respiratorischer Quotient Es ist ein ungefähres Maß dafür, wieviel Nahrungsstoffe gerade verbrannt werden und setzt sich zusammen aus der CO2-Abgabe durch die O2-Aufnahme. CO2-Abgabe RQ = -----------------------O2-Aufnahme Kalorisches Äquivalent Kalorisches oder Energieäquivalent beschreibt die Wärmemenge pro Volumen [l] O2 3.5 Energie der Futtermittel Gesamtnährstoffe Summe aller verdaulichen Energie pro Gewichtseinheit Futtermittel. Es gibt große tierartliche und belastungsabhängige Unterschiede im jeweiligen Erhaltungs- und Leistungsbedarf. Bruttoenergie (Brennwert) Verdauliche Energie Umsetzbare Energie Nettoenergie Energie im Kot Energie im Urin, Methanenergie Thermische Energie des Futtermittels Energie für die Erhaltung Energie für tierische Produkte Bruttoenergie Es ist die gesamte Energie, die bei vollständiger Verbrennung eines Futtermittels als Wärme frei wird. Für die Verbrennung reiner Nährstoffe erhält man folgende Brennwerte: Proteine: 5,7 kcal/g Fette: 9,5 kcal/g 184 Hohlenhydrate: 4,2 kcal/g Verdauliche Energie84 Da die Höhe der verdaulichen Energie von der Verdaulichkeit, d.h. dem Grad der Ausnutzung der aufgenommenen Roh- und Nährstoffe eines Futtermittels im Verdauungstrakt abhängt, ist sie tierartlich unterschiedlich groß. Umsetzbare Energie85 Die umsetzbare Energie kann umgesetzt werden, muß aber nicht. Die Fermentationsgase können im Bombenkaloriemeter bzw. durch Respirationsanlagen für die gasförmigen Ausscheidungen der Wiederkäuer bestimmt werden. Thermische Energie86 Sie läßt sich nicht durch Messung bestimmen. Sie wird im Intermediärstoffwechsel umgesetzt, kann aber nicht angesetzte werden, weil sie als Wärme frei wird. man unterscheidet zwischen: Verdauungswärme: Sie wird bei der Verbrennung frei (Fermentationswärme beim Wiederkäuer wird durch die Energie verursacht, die von Mikroorganismen bei der Verdauung umgesetzt wird) Ansatzwärme: Sie wird bei der ATP-Bildung frei. Denn die umsetzbare Energie kann zu 40 % nicht angesetzt werden. Nettoenergie87 Es stellt einen Teil der Bruttoenergie dar. Gesamtnährstoff Summer der verdaulichen Energie Gesamtnährstoff = --------------------------------------------Gewichtseinheit der Futtermittel Stärkeeinheit Fettansatz, den 1 kg eines Futtermittels bei einem Tier hervorruft, wird verglichen mit demjenigen, das durch 1 kg Stärke hervorgerufen wird. 1 Stärkewert = Fettansatz durch 1 kg Stärke. 3.6 Bewertungsmaßstäbe der Nahrungsproteine 84 Verdauliche Energie = verfütterte Bruttoenergie - ausgeschiedener Kot-Energie Umsetzbare Energie = verdauliche Energie – Energie im Harn und den Fermentationsgasen 86 Thermische Energie = Umsetzbare Energie – Nettoenergie 87 Nettoenergie = Umsetzbare Energie – Thermische Energie (für die Verdauungsarbeit) 85 185 Proteinwirkungsverhältnis Es ist die Gewichtszunahme eines Tieres je g aufgenommenes Eiweiß (bzw. je g aufgenommenes Stickstoff). Biologische Proteinwert Der biologische Proteinwert wird auch als biologische Wertigkeit bezeichnet. Es ist das Verhältnis an relativem Stickstoff und dem Stickstoff im Harn und Kot zur Menge an resorbierenden Stickstoffs [%]. Relativer N + Harn-N + Kot-N Biologischer Proteinwert = -------------------------------------------------Menge an resorbierenden Stickstoffs Chemical Score Der Chemical score hingegen stellt ein Verhältnis an essentiellen Aminosäuren im Testprotein dividiert durch die Prozentzahl an essentiellen Aminosäuren in einem Vergleichseiweiß (z. B. Milchprotein, Eiprotein) dar. essentielle Aminosäuren im Testprotein chemical score = --------------------------------------------------------essentielle Aminosäuren im Vergleichseiweiß 4. Wärmehaushalt 4.1 Normothermie Definitionen Gleichwarm = homiotherm mit höher Wärmebildung (Tachymetabolismus) Wechselwarm = poikilotherm, die Körpertemperatur liegt nur wenig Umgebungstemperatur und folgt auch dessen Schwankungen (Bradymetabolisbus) über der Homiothermie Es ist die Fähigkeit, mit den Mitteln der autonomen Thermoregulation die Temperatur des Körperinneren auf einem konstanten Niveau zu halten. Normothermie bezeichnet wahrscheinlich die normale Körpertemperatur. Vorteil: temperaturabhängiger Ablauf des Stoffwechsels Nachteil: hoher Energiebedarf 186 Beispiele88 Pferd (> 5 Jahre) Rind (> 1 Jahr) Kalb Schwein Hund Huhn ca. 38° C 37,5° - 40,0° C 38,5° - 40,0° C 38,0° - 40,0° C 37,5° - 39,0° C 40,5° - 42,0° C Abhängigkeit der Temperatur Tagesperiodische Schwankungen (je nach dem ob tag- oder nachtaktiv) Alter Geschlecht und Zyklus (v. a. beim Menschen) Arbeit und Nahrungsaufnahme (Ursache: höhere Wärmebildung Energiebedarf) durch gesteigerten 4.2 Temperaturtopographie Begriffe Körperkern: im ZNS (Gehirn und Rückenmark), sowie Brust- und Bauchhöhle gibt es eine weitgehende konstante Temperatur. Von dort radiales Temperaturgefälle zur ... Körperschale: mit einer hohen Variabilität der Körpertemperatur Indifferenztemperatur: Umgebungstemperatur oder Temperaturzone, bei der der Energieumsatz minimal ist, d. h. der Organismus muß praktisch keine Energie für die Regulation seiner Körpertemperatur aufbringen (thermische Neutralzone) Wärmebedarf: ist abhängig vom Alter, Größe, Fellkleid und der Dicke der isolierenden Substanzen (Fettgewebe) Übersicht der Mechanismen Körperschale Körperkern Regler Steuersignale der Stellgröße Sollwert Stellglieder: Muskulatur braunes Fett Hautdurchblutung Schweißbildung Verhaltensthermoregulation (Kern) Meßfühlersignale warm warm 88 kalt kalt (Haut) Jüngere und kleiner Tiere haben eine höhere Körpertemperatur. Sie haben wegen ihrer größeren Oberfläche im Gegensatz zu ihrer Masse gesehen einen intensiveren Stoffwechsel. 187 4.3 Wärmebildungsmechanismen Die Wärmebildung pro kg Körpermasse nimmt mit zunehmender Körpergröße ab. Es gibt verschiedene Mechanismen der Wärmebildung: Wärmeproduktion durch Zellstoffwechsel stoffwechselintensiver Organe (z. B. Leber) Willkürliche Zunahme der motorische Aktivität, Steigerung des Muskeltonus bis hin zu rhythmischen Muskelkontraktionen (Kältezittern) Zitterfreie Thermogenese durch Stimulation der -adrenergen Rezeptoren von Lipasen in den braunen Fettzellen. Sie zeichnen sich durch eine hohen Mitochondrienzahl aus. Dort findet eine Entkopplung der oxidativen Phosphorylierung. Bei Neugeborenen und über die gesamte Lebenszeit bei kleineren kälteadaptierenden Tieren und bei Winterschläfern wird diese Art der Wärmeproduktion benutzt. Vasokonstriktion der Hautgefäße Aufstellen der Fellhaare zur Bildung eines Luftpolsters Protonengradient im Körperkern 4.4 Wärmeabgabemechanismen Wärmestrom Zur Abgabe der Stoffwechselwärme an die Umgebung passiert der innere Wärmestrom die Körperschale. Ihre isolierende Wirkung, die von der Dicke der subcutanen Fettschicht abhängt, wird konvektiv oder auch durch Leitung (direkte Abgabe von Wärme von einem Gewebe an ein angrenzendes) überbrückt und geregelt und durch die Hautdurchblutung an die Umgebung angepaßt. Der innere Wärmestrom ist der Transport der Wärme vom Körperkern zur Körperschale. Sie erfolgt über Konvektion (Blutstrom) und Konduktion (Gewebe). Die Durchblutung der haut wird der Außentemperatur angepaßt. Die Wärmeabgabe durch Wärmetransport vom Bildungsort an die Peripherie und von dort an die Umgebung. Der äußere Wärmestrom ist die Wärmeabgabe an die Umgebung. Sie erfolgt über Leitung, Konvektion, Strahlung und Verdunstung. Definitionen Möglichkeit Definition Leitung, Konduktion Wärmefluß von Körper zu Körper, z. B. eine Unterlage auf der man sitzt Konvektion Strahlung Wärmefluß im bewegtem Medium z. B. Luft oder Blut. Die Abgabe erfolgt an die sich bewegende Außenluft. Wärmeabgabe durch langwellige Infrarotstrahlung 188 Voraussetzungen, Abhängigkeiten Temperaturdifferenz Wärmeleitfähigkeit Temperaturdifferenz Wärmeleitfähigkeit Dicke der Grenzschicht Luftdruck Windgeschwindigkeit Körperradius Temperaturdifferenz zwischen Haut und angestrahlter Fläche Verdunstung89 Atriovenöse Anastomosen Es ist eine sehr effektive Wärmeabgabe. Die Verdunstung von 1 l Wasser von der Hautoberfläche entzieht dem Körper 2400 kJ Wärme. Gegenstrom-Wärmeaustausch in den Extremitäten. Perspiratio insensiblis Schweiß aus Schweißdrüsen Hecheln Möglichkeiten Perspiratio insensiblis Extraglanduläre oder insensible Wasserabgabe Diffusion erfolgt durch Haut und Schleimhäute Unwillkürlich steuerbar Schweiß glanduläre Wasserabgabe Zusammensetzung: hypotone Lösung mit 90 % Wasser, 1 % Elektrolyte, Harnstoff und Aminosäuren Elektrolytverlust pH-Wert liegt zwischen 7,8 - 8,9 Hecheln Je weniger Schweißdrüsen vorhanden sind, desto mehr hecheln Es ist eine hochfrequente, flache Atmung - Verhinderung der Hyperventilation Totraumbelüftung Vorteil gegenüber Schwitzen: kaum Elektrolytverlust Nachteil gegenüber Schwitzen: Atemfrequenz ist der limitierende Faktor (Hund bis zu 400 x/min.) 4.5 Thermoregulation Elemente der Thermoregulation Fühler: Wärme- und Kältesensoren in der Haut (Hauttemperatur) und im ZNS (Bluttemperatur) Regler: Hypothalamus mit Wärmeabgabezentrum sowie Wärmebildungsund Konservierungszentrum Stellglieder: 89 Hitze Schweißdrüsen Atmung (hecheln) Speichseldrüsen Hautgefäße Verhalten Kälte Muskeln (Kältezittern) braunes Fettgewebe Hautgefäße Piloaurektoren (Aufstellen des Fells) Schilddrüse (Stoffwechsel ) Verhalten evorative Wasserabgabe 189 Temperaturregulation a) Zu kalt Das Temperaturempfinden wird über Rezeptoren der Haut wahrgenommen. Diese peripheren Kälterezeptoren leiten ihre Information weiter an das Wärmebildungs- und Konservierungszentrum im Gehirn, das nun die Mechanismen der Wärmebildung aktiviert. Ein zweiter Informationsweg beginnt bei den zentralen Kälterezeptoren, die die Temperatur des Blutes wahrnehmen. Ihre Informationen werden ebenfalls an das zentrale Regelzentrum geleitet. periphere Kälterezeptoren registrieren die Hauttemperatur Wärmebildungs- und Konservierungszentrum zentrale Kälterezeptoren registrieren die Bluttemperatur zitterfreie Thermogenese, Kältezittern, Vasokonstriktion, Gänsehaut, Piloarektoren b) Zu warm Bei einem Ansteig der Bluttemperatur oder der Hauttemperatur wird dies wieder durch die zentralen bzw. peripheren Rezeptoren erkannt und an das Wärmebildungszentrum geleitet. Hier werden die Mechanismen der Wärmeabgabe stimuliert. periphere Kälterezeptoren registrieren die Hauttemperatur Wärmebildungs- und Konservierungszentrum zentrale Kälterezeptoren registrieren die Bluttemperatur Schweißsekretion, Vasodilatation, Speichelsekretion, hecheln, Verhalten (In der Thermoneutralzone der Außentemtemperatur reicht die Regelung der Hautdurchblututung zum Ausgleich der Wärmebilanz aus) Pathophysiologie der Temperaturregulation Definition: 90 Fieber Sollwertverstellung im Regelzentrum durch endogene (Leukozyten, Stoffwechselprodukte) oder exogene Pyrogene (Bakterien) Hyperthermie Die Wärmeaufnahme oder Wärmeproduktion übersteigt die Wärmeabgabemöglichkeiten des Tieres. (60° bis 70° C) Anwendung der Hypothermie: bei der Transplantation (künstliche Hypothermie) 190 Hypothermie90 Steigerung der Wärmeabgabe über die maximal mögliche Wärmeproduktion des Individuums Folgen: Fieberanfall: subjektive Kälteempfindung (Istwert < Sollwert), Anpassung des Istwertes Stimulierung der Wärmebildung und Hemmung der Wärmeabgabe subjektive und objektive Wärmeempfindung (Istwert > Sollwert) Stimulierung der Wärmeabgabe und Hemmung der Wärmebildung Hitzeschlag Sonnenstich Hitzeschock 33 °C Bewußtseinstrübung 28 °C narkoseähnlich 25° C Tod, Kammerflimmern, Atemstillstand ATMUNG 1. Allgemeines Definition Atmung ist der Gaswechsel zwischen den Zellen und der Umgebung, die man in eine innere und eine äußere Atmung unterteilt. Inspiration = Gasaufnahme Expiration = Gasabgabe in der Lunge Sympathicus Bronchiodilatation (Inspiration) Parasympathicus Bronchokonstriktion (späte Expiration) Zusammensetzung der Inspirationsluft Der Anteil des O2 an der Atemluft beträgt 20,9 %. Der Rest besteht aus Stickstoff (N), Kohlendioxid (CO2) und Edelgasen. Der jeweilige Volumenanteil eines Gases am Gesamtgasvolumen wird als Fraktion (F) bezeichnet und in der Physiologie zum Beispiel beim O2-Anteil als FIO 2 = 0,21 beschrieben. Partialdrücke Gase üben in einem gegebenen Volumen einen Druck aus, der proportional zur Anzahl der vorhandenen Gasmoleküle ist. Jedes Gasgemisch übt dabei einen Partialdruck aus, der für jedes Gas spezifisch 191 ist. Der Partialdruck errechnet sich aus dem Gesamtdruck (Barometerdruck, PB) und dem fraktionellen Anteil des Gases: PGas = PB FGas F gilt nur für trockene Gase, do daß die Formel etwas umgewandelt werden muß, weil ja noch Wasser in der Inspirationsluft enthalten ist. PGas = (PB - PH2O) FGas Partialdrücke im Körper Aufgrund der Partialdruckdifferenz in den verschiedenen Abschnitten diffundiert der Sauerstoff bis in die Zelle. Bei CO2 ist zwar die Partialdruckdifferenz nicht sehr hoch, aber sein Bunsenscher Diffusionskoeffizient ist 23 größer als der des Sauerstoffs, wodurch die CO2-Abgabe erleichtert wird. O2 [in mm Hg] CO2 [in mm Hg] Luft 158 0,23 Alveolarraum arterielles Blut 100 95 39 41 venöses Blut 40 45 Zelle 40 45 2. Die äußere Atmung Definition Unter der äußeren Atmung versteht man die Lungenatmung, d. h. den Luftaustausch mit der Umgebung. Der Transport des Sauerstoffs erfolgt dann über: 1. 2. 3. von der Außenluft in die Lungenalveolen: über Konvektion, d. h. O2 gelangt mit der Außenluft durch die Atembewegungen in die Alveolen der Lunge (Ventilation, Belüftung) von der Alveole in das Kapillarblut: über Diffusion von den Lungenkapillaren zu den Gewebekapillaren: durch das Blut. Das Gleiche gilt auch für das CO2, nur in umgekehrter Richtung. Atemweg Äußere Nase / Mund Nasenhöhle / Mundhöhle Atmungsrachen Kehlkopf Trachea Bronchialsystem (Haupt-, Lappen-, Segment-, Terminalbronchen) Bronchuli und respiratorischen Bronchuli. Zu den respiratorischen Abschnitten gehören die respiratorischen Bronchuli, die Alveolargänge, die Alveolarsäcke und die Lungenalveolen. Funktion des Atemweges Erwärmung durch den langen Weg und Venengeflächten Befeuchtung 192 Säuberung, z. B. durch Schleimhäute der Nase oder durch Zilien des Respirationsepithels Zuleitung auf oralem oder nasalen Weg Verteilung 3. Atemtechnik Einatmung, Inspiration Es ist ein aktiver Vorgang, wobei die Lunge erweitert wird. Es entsteht ein negativer Unterdruck in den Alveolen Luft strömt ein. Sie erfolgt durch die Erweiterung des Brustkorbraumes durch die Atemmuskeln (Mm. intercostales externi, Diaphragma, Atemhilfsmuskulatur) und durch relativ alveolären Unterdrucks in der sich ausdehnenden Lunge entwickelt. Durch den erfolgenden Lufteinstrom kommt es zum Druckausgleich. Ausatmung, Expiration Es ist ein passiver Vorgang. Er erfolgt vorwiegend durch die passive Verkleinerung des Thorakalraumes und zwar durch Brustkorbsenkung und durch elastizitätsbedingte Volumenabnahme (Retraktion) der Lunge, die zum Ausstrom der Luft in Folge relativen alveolären Überdrucks führt. Nur bei forcierter Ausatmung werden die Atemhilfsmuskeln, z. B. Mm. intercostles interni zu Hilfe genommen. Atemruhelage Nach einer normalen Expiration erreicht die Lunge und der Thorax einen Zustand größtmöglicher Entspannung, die sog. Atemruhelage. Das Bestreben des Thorax sich zu erweitern und das Bestreben der Lunge sich aufgrund ihrer Eigenelastizität zusammen zu ziehen ist hier im Gleichgewicht. Pneumothorax Unter dem Begriff Pneumothorax versteht man eine Luftansammlung im Brustkorb, v. a. im Pleuralraum bzw. im Pleuralspalt. Die Luftansammlung entsteht durch eine Verletzung, die zur Folge einen intrapleuralen Druckverlust hat. Die Lunge fällt aufgrund ihrer Eigenelastizität in sich zusammen und steht für die Atmung nicht mehr zur Verfügung. a) Geschlossener Pneumothorax Entsteht ohne eine durchgängige Verbindung mit der Außenluft, z. B. bei einem Riß, der sich zwischen Lunge und viszeraler Pleura befindet, der zu einer offenen Verbindung zwischen Bronchialsystem und Pleuraraum führt. Luft tritt in den Pleuralspalt ein, es ist darin kein Unterdruck mehr vorhanden, die Lunge kann sich nicht mehr ausdehnen. b) Offener Pneumothrorax Entsteht durch eine Verletzung mit scharfen Gegenständen an der Brustwand, so daß eine Verbindung direkt nach außen entsteht. Die betroffene Lunge kollabiert. Die andere Lungenhälfte ist auch beeinträchtigt, da ein Teil der Atemluft zwischen gesunder und kollabierter Lunge hin und her pendelt und damit nicht zum Gasaustausch beiträgt. 193 c) Ventilpneumothorax Hier kann die bei jeder Atembewegung eingedrungene Luft nicht mehr entweichen (ein Hautlappen an der Wund wirkt als Ventil). Es kommt zum Überdruck im Pleuraraum der kranken Seite. Dies führt zur Behinderung der Herzfüllung und Kompression der gesunden Lunge. (Therapie: langsames Ablassen des Überdrucks und Verhinderung weiterer Ventilwirkung.) 4. Atmungstypen Brustatmung, kostaler Atmungstyp Die Erweiterung des Brustraumes erfolgt überwiegend durch Hebung der Rippen. Die Atmungsarbeit wird also hauptsächlich von der Interkostalmuskulatur geleistet, während das Zwerchfell mehr passiv den Druckveränderungen im Thoraxraum folgt. (Heben der Rippen durch die Intercostalmuskulatur Zwerchfell folgt der Druckveränderung im Thorax passiv) Bauchatmung, abdominaler Atmungstyp Die Erweiterung des Brustraumes mehr durch Senkung des Zwerchfells. Bei der Bauchatmung bewirkt die stärkere Kontraktion der Zwerchfellmuskulatur v. a. eine inspiratorische Erweiterung (Sinus phrenicocostalis) des unteren Thoraxraumes, wobei wegen der Verlagerung der Baucheingeweide die Bauchwand vorgewölbt wird. (Kontraktion der Zwerchfellmuskulatur erweiterte Inspiration) Die meisten Tiere sind ein gemischter (costoabdominaler) Atmungstyp. Eine Zwerchfellatmung tritt bei den landwirtschaftlichen Nutztieren nur bei Erkrankung der Brustorgane auf 5. Atmungsarten Arten Normale Ruheatmung, Eupnoe Cheyne-Stokes-Atmung: Sie ist durch eine Atempause nach wenigen immer schwächer werdenden Atemzügen gekennzeichnet. Möglich, bei Schlaf in großer Höhe (Hypoxie), aber auch bei Schädigung des Atemzentrums. Ataktische bzw. Biot-Atmung: Sie ist durch gleichmäßige tiefe Atemzüge gekennzeichnet mit plötzlich auftretenden Pausen, z. B. bei Hirnverletzungen oder bei erhöhtem Hirndruck. Kußmaul bzw. vertiefte Atmung: ist eine vertiefte und beschleunigte Atmung, wie sie typischerweise bei der metabolischen Azidose eines entgleisten Diabetes mellitus auftritt. Durch die vertiefte Atmung versucht der Körper vermehrt CO2 abzuatmen, um so die metabolische Azidose respiratorisch zu kompensieren. oberflächliche Atmung, tritt beim Lungenödem auf Apneustische Atmung, z. B. bei Hypoxie Schnappatmung Atemstillstand, Apnoe Weitere Unterscheidungen Hyperpnoe =vertiefte Atmung 194 Tachypnoe = Zunahme der Frequenz Bradypnoe = Abnahme der Frequenz Dispnoe = erschwerte Atmung Orthopnoe = starke Dyspnoe, führt zu einer Stauung des Blutes in Lungenkapillaren 6. Compliance, statische Volumendehnbarkeit Compliance ist der Kehrwert des elastischen Widerstandes und stellt ein Maß für die Volumendehnbarkeit von Lunge und Thorax dar. Zur Messung werden, von der Atemruhelage ausgehend, jeweils bestimmte, abgemessene Volumina in ein Spirometer eingeatmet (+ V pulm.) oder ausgeatmet (- Vpulm.). Die Verbindung zum Spirometer wird dann geschlossen und nun der zum jeweiligen Volumen gehörende Druck in den Atemwegen gemessen. Diese sind dabei nach außen abgedichtet und alle Atemmuskeln müssen dabei entspannt sein. Je nach Lungenfüllung läßt sich durch die passiv elastischen Kräfte von Lunge und Thorax ein gegenüber der Atmosphäre positiver oder negativer Druckunterschied über ein seitenständiges Manometer messen und daraus eine Ruhe-Dehnungs-Kurve festlegen. Sie verläuft im Bereich der Atemruhelage linear und hat hier die größte Steilheit. Diese Steilheit wird als Compliance bezeichnet. V C = -----------P Die größte Compliance findet man zwischen Atemruhelage und Vpulm. = + 1 l, also im normalen Arbeitsbereich. Hier muß pro Volumeneinheit am wenigsten Gegendruck überwunden werden. Atemruhelage (Vpul = 0) Nach Einatmung eines gewissen Volumens (Vpul > 0) ergibt sich ein positiver Druck Nach Ausatmung eines gewissen Volumens (Vpul < 0) ein negativer Druck 7. Antiatelektasefaktor, Surfactant (surface active agent) Für die Größe der Comliance ist auch die Oberflächenspannung der Alveolen von Bedeutung. Durch die Wirkung von Anziehungskräften auf die Oberfläche der Alveolen, immerhin insgesamt 70 m2, müßten die Lunge sehr instabil sein. Eine kleine Alveole würde oberhalb eines gewissen Druckes kollabieren oder sich bei einer nebenliegenden größeren Alveole zugunsten dieser weiter verkleinern. Hintergrund ist die Annahme, daß Kugeln mit einem kleinen Radius einem größeren Druck wiederstehen müssen, weil sie eine verhältnismäßig große Oberfläche haben. Dieses wird durch die Bildung von sog. Oberflächenfaktoren, Sufactants, einen Protein-PhospholipidKomplex (wesentliche Komponente ist das Dipalmityl-Lecithin, 90 % Phospholipide, spezifische Surfacetant-Proteine und Kohlenhydrate) verhindert. Sie setzten die Oberflächenspannung zwischen Lungengewebe und Luft der Alveolen herab. Bildungsort sind die kubischen Alveolarepithelzellen (Pneumozyten Typ II). Bei manchen Neugeborenen sind sie unzureichend vorhanden, was zu einer ernsten Störung des Gasaustausches führt. Bei einer Sauerstoffvergiftung liegt eine Störung des Surfacetant vor, was zu einer Herabsetzung der Compliance führt, das nun die Alveolen kollabieren läßt (Atelektasen). Es kommt zu einem Lungenödem. (Atelektase = zusammengefallene Lungenblase) 195 8. Atemwiderstand = Strömungswiderstand Elastischer Widerstand Sie treten nur bei der Inspiration auf und müssen hier überwunden werden. Dazu zählen: Elastizität von Lunge und Thorax Zugspannung der Lungenoberfläche = Oberflächenspannung der Alveolen Visköse Widerstände Visköse Widerstände sind sowohl bei der Inspiration als auch bei der Expiration zu überwinden. Dazu gehört: Strömungswiderstand der Atemwege (Resistance) = 90 % Nichtelastische Gewebewiderstände (Gewebereibung bei Bewegung) = 10 % Trägheitswiderstände (z. B. des Thorax, vernachlässigbar klein) Je mehr Atemzüge pro Minute gemacht werden, desto mehr steigt die visköse Arbeit an und desto mehr fällt die elastische Arbeit ab.. Gewebewiderstand Dieser wird bei der Gewebereibung bei der Lungenbewegung hervorgerufen und entspricht etwa 10 % des viskösen Widerstandes. Strömungswiderstand 1. Strömungswiderstand in den Atemwegen, Resistance (R): Der Strömungswiderstand ist nach dem Ohmschen Gesetz zu definieren. Es ist das Verhältnis von treibender Kraft und der Atemstromstärke. P R = -------V R = Resistance (Strömungswiderstand in den Atemwegen P = Druckdifferenz zwischen Mund und Alveolaren V = Atemstromstärke Dieser Widerstand wird hauptsächlich durch die Strömungsverhältnisse der Trachea und der großen Bronchen bestimmt. Er entsteht durch turbulente Strömung, Verengung der Bronchen und Schleim in den Atemwegen und ist bei allen obstruktiven Atemstörungen (Asthma bronchiale, spastische Bronchitis, ...) herabgesetzt. 2. Lungenblutgefäße: Der Strömungswiderstand ist im Lungengefäßsystem relativ gering. Alveoläre Hypoventilation führt jedoch zu einer Hypoxie (herabgesetzter Sauerstoffpartialdruck im arteriellen Blut) bedingten Konstriktion der Arteriolen. Der Widerstand steigt an. Die Durchblutung wird an die verminderte Ventilation angepaßt (Euler-Liljestran-Mechanismus). 9. Atmungsfrequenz 196 Atmungsfrequenz = Anzahl der Atemzüge in der Minute (s. auch Skript) Die Atmung wird durch O 2Mangel, motorische Aktivität und Erregungszustände gesteigert. Junge und kleine Tiere haben eine gesteigerte Atemfrequenz als größere und ältere Tiere. 10. Künstliche Beatmung Erweiterung des Thorax Lunge muß ihm folgen (Unterdruckkammer). Bei einer länger anhaltenden Atemlähmung führt dies zu einer „eisernen Lunge“. Der Körper des liegenden Patienten ist dabei mit Ausnahme des Kopfes in einer Kammer eingeschlossen, in der während der Inspirationsphase ein Unterdruck erzeugt wird. Inspiratorisch ist also der intrathorakale Druck größer als der Umgebungsdruck in der Kammer. Erweiterung der Lunge z. B. bei der Mund-zu-Mund-Beatmung oder mit der Atemmaske. Diese wird auf das Gesicht des Patienten luftdicht ausgesetzt. Mit einem Atemventil und einem angeschlossenen Beutel, der von Hand rhythmisch zugepreßt und entlastet wird. Trachealtubus (Operation) Bei Gasnarkoseverfahren wird eine Beatmungsmaschine über einen Trachealtubus angeschlossen. Bei Druckerhöhung entfaltet sich die Lunge inspiratorisch und die anschließende Expiration erfolgt passiv (Überdruckbeatmung). 11. Lungenvolumina Respirationsvolumen und Lungenkapitzitäten Atemzugvolumen: normales In- bzw. Expirationsvolumen, nimmt mit sinkender Körpergröße ab, so hat das Pferd 6 l, die Katze 0,04 l Inspiratorisches Reservevolumen: Volumen, das nach normaler Inspiration noch zusätzlich ausgeatmet werden kann Expiratorisches Reservevolumen: Volumen, das nach normaler Expiration noch zusätzlich ausgeatmet werden kann. Vitalkapazität: Volumen, das nach maximaler Inspiration maximal ausgeatnet werden kann. Es ist die Summe aus 1, 2 und 3. und ist abhängig von Geschlecht, Größe, Alter, Körperposition, Trainingszustand. Residualvolumen: Volumen, das nach maximaler Expiration in der Lunge zurückbleibt (dieses und auch alle anderen Kapazitäten können mit einem Spirometer nicht gemessen werden) Inspirationskapazität: Volumen, das nach normaler Expiration maximal eingeatmet werden kann. Es ist die Summe aus 1 und 2. Funktionelle Residualkapazität: Volumen, das nach normaler Expiration noch in der Lunge vorhanden ist. Es ist die Summe aus 3 und 4. Die physiologische Bedeutung liegt im Ausgleich der O2- und CO2-Konzentration im Alveolarraum. Totalkapazität: Volumen, das nach maximaler Inspiration in der Lunge enthalten ist. Es ist die Summe aus 4 und 5. 197 Atmungsarbeit Es ist die Arbeit, die gegen Strömungs- und Reibungswiderstände von Lunge und Thorax geleistet wird. Sie ergibt sich aus dem Produkt von Druck und Volumen. Da bei der Einatmung gegen die elastischen Kräfte geatmet wird, während diese bei der Ausatmung ganz im Gegenteil die treibende (passive) Kraft sind. Bei vertiefter und beschleunigter Atmung muß auch die Expirationsmuskulatur zur Überwindung der Strömungswiderstände eingesetzt werden. In Ruhe entspricht die Atemarbeit für Inspiration normalerweise der gesamten Atemarbeit für Inspiration und Expiration. Totraum Als Totraum bezeichnet man den am Gasaustausch nicht beteiligten Raum des Respirationsstrahles (der eher als Luftleitungsraum dient). Als anatomischen Totraum werden die Nase bzw. Mund, Pharynx, Larynx, Trachea, Bronchen und Bronchiolen bezeichnet. (Leitender Atemweg) Er stimmt in seiner Größe normalerweise ungefähr mit dem sog. funktionellen Totraum überein. Dieser wird jedoch dann größer, wenn auch in einem Teil der Alveolen kein Gasaustausch stattfindet, z. B. sie durchlüftet, aber nicht durchblutet werden. Der Totraum hat einige wichtige Funktionen: Zuleitung Säuberung Anfeuchtung Erwärmung Stimmorgan Hecheln Hecheln dient normalerweise v. a. der Wärmeabgabe. Es ist eine erhebliche Steigerung der Atemfrequenz bei homiothermen Tieren ohne ekkrine Schweißdrüsen (aus thermoregulatorischen Gründen). 12. Ventilation, Belüftung Atemzeitvolumen, Atemminutenvolumen Die Lungenbelüftung wird durch die Tiefe der einzelnen Atemzüge (VT) und der Atemfrequenz (f) bestimmt und errechnet sich formal aus: Atemzeitvolumen = Atemzugvolumen Atemfrequenz ^VT = VT f Alveoläre Ventilation ^VA = ^VT - VD oder ^VA = (VT - VD) f Es ist der Anteil, der in die Alveolen gelangt und dem Gasaustausch zur Verfügung steht. Totraumventilation Von jedem einzelnen Atemzug (VT) gelangt nur ein Teil in den Alveolarraum und nimmt am Gasaustausch teil (VA). Der Rest bleibt im sog. anatomischen Totraum (VD). Es gilt: VT = VA + VD 198 Bei der Ruheatmung beträgt der alveoläre Anteil 2/3, der Anteil des Totraumes 1/3 des Atemzeitvolumens. Bei einer flachen Atmung wird bei gleichbleibendem Atemzugvolumen V T die Atemfrequenz f auf Kosten von VT erhöht, dadurch sinkt die für den Gasaustausch wichtige Größe V A ab. Der Grund dafür ist der Anstieg von VD, weil es eine anatomische Größe ist und f angestiegen ist. Bei gegebenem Atemzeitvolumen führt eine vertiefte Atmung (nicht jedoch eine f-Steigerung!) zu einer besseren Belüftung der Alveolen. Normalverhältnisse Bei einer normalen Ventilation wird in den Alveolen ein CO2-Partialdruck von etwa 40 mm Hg aufrecht erhalten (PCO 2 = 40 mm Hg) Hyperventilation Steigerung der alveolären Ventilation, die über die jeweiligen Stoffwechselbedürfnisse herausgeht = Steigerung der alveolären Ventilation, über Stoffwechselbedürfnisse (PCO 2 < 40 mm Hg) Sie tritt bei Tieren normalerweise nur bei schwerer Arbeit auf. Es entsteht dabei sehr viel CO 2, was abgeatmet werden muß. Bei Erregungszuständen, wobei keine allzu große Arbeit geleitet wird, sprich kein übermäßiges CO2 anfällt, folgt durch Hyperventilation eine Hypokaprie (PCO 2 ) und ist mit einer Alkalose verbunden. Hypoventilation Änderung der totalen/ gesamten Ventilation (es wird insgesamt weniger geatmet), was dazu führt, daß auch die alveoläre Ventilation unter den Wert, der den Stoffwechselbedürfnissen entspricht = Senkung der gesamten Ventilation, unter Stoffwechselbedürfnisse (PCO 2 > 40 mm Hg) Ventilationsstörungen Restriktive Ventilationsstörung Ausdehnungsfähigkeit der Lunge Compliance Vitalkapazität Atemgrenzwert z. B. bei Lungenfibrose und Pleuraverwachsungen Obstruktive Ventilationsstörung Atemwege sind eingeengt Resistance Sekundenkapazität Atemgrenzwert z. B. bei Asthma bronchiale, Bronchitis, Pneumonie 13. Atemgase Diffusion der Atemgase Aus den Alveolen diffundiert der Sauerstoff in die Lungenkapillaren. In Ruheatmung haben die Alveolen: 100 mm Hg O2 und das venöse Blut: 40 mm Hg O2. Es kommt zu einem vollständigem Angleich der Werte! Die treibende Kraft ist die PO2-Differenz zwischen beiden Räumen (P). Über das 1. Ficksche Diffusionsgesetz kann man die duffundierende Substanzmenge (M) bestimmen: F M = KD --- P KD = Kroghscher Diffusionskoefizient (Diffusionsleitfähigkeit), Naturkonstante, die vom Diffusionsmedium, Temperatur, Art und Größe der diffundierenden Teilchen abhängt 199 d F = Fläche der Diffusionsschicht d = Dicke der Diffusionsschicht Die Austauschfläche muß relativ groß sein, daß eine optimale Versorgung mit Sauerstoff gewährleistet werden kann. Die Lunge, die mit etwa 300 Millionen Alveolen ausgestattet ist, hat eine Oberfläche von 70 m2. Zusätzlich besteht nur ein kleiner Abstand von wenigen m zwischen Alveolarwand, Interstitium und Kapillare bis hinein in die Erythrozyten, so daß eine Berührung der Erythrozyten mit der Kapillarwand von 0,3 s Sekunden für den Gasaustausch ausreicht. Sauerstofftransport a) Transportform des Sauerstoffs (O2) b) Umgebung Lunge: Konvektion mit der Luft durch die atemleitenden Wege Lungenalveole Kapillarblut: Diffusion durch die Zellmembran im Blut selbst gibt es 2 Wege: physikalisch gelöst (ca. 1 - 2 %): Das ist abhängig vom Konzentrationsgradienten und v. a. von Sauerstoffpartialdruck. chemisch gebunden an das Hämoglobin: Das Hämoglobin ist ein Protein, das aus 4 Polypeptidketten mit jeweils einer Hämgruppe, der Farbkomponente, besteht. Jedes Häm besitzt ein zentrales zweiwertiges Fe2+, an das die Anlagerung des Sauerstoffs erfolgt. Der Sauerstoff wird an das 1. Häm gebunden, wodurch sich die Affinität des zweiten für Sauerstoff erhöht, usw. Bei voller Sättigung bindet 1 g Hämoglobin 1,34 ml O2 (Hüfnersche Zahl: 1,34 ml O2/ g Hämoglobin). Maximale O2-Bindungskapazität Sie kann man mittels der Hüfnerschen Zahl berechnen. In vivo ist eine solche Sättigung nicht möglich, weil ... in das arterielle Blut noch ein geringer Anteil an venösem Blut durch die Zuführung aus den Vv. cordis minimae und Vv. bronchiales vorhanden ist („physiologischer Shunt“). im menschlichen Blut noch das Methämoglobin oder Hemiglobin vorhanden ist. Durch eine Oxidationsreaktion wird Fe2+ in Fe3+ überführt, so daß eine Anlagerung von O2 nicht mehr möglich ist. Durch das Enzym Methämoglobin-Reduktase wird diese Reaktion wieder rückgängig gemacht. c) Oxygenation, Desoxygenation Die physiologische Anlagerung des O2 an das Fe2+, das seine Zweiwertigkeit nicht verliert, wird als Oxygenation bezeichnet, die Entkopplung als Desoxygenation. Das Ausmaß der Sauerstoffbindung ist vom PO2 abhängig. In den arteriellen Lungenkapillaren ist der Wert relativ hoch (95 mmHg), so daß das Hämoglobin fast vollständig in seine oxygenierte Form überführt werden kann. Bei absinken des Wertes nimmt der Oxygenierungsgrad erst langsam, dann immer schneller ab. Es entsteht eine s-förmige Kurve, die O2-Dissoziationskurve oder O2-Bindungskurve. d) O2-Bindungskurve Der sigmoide Verlauf der Kurve hat eine große physiologische Bedeutung, z. B. auf hohen Bergen hat man immer noch eine fast ausreichende Sättigung gegenüber dem Meeresniveau. Des 200 weiteren ist der steiler Verlauf günstig für die Entkopplung im Gewebe. Abhängig ist die O 2Sättigung des Hämoglobins vom O2-Partialdruck. Die Affinität des Hämoglobins ist abhängig von Temperatur, die bei Warmblütern zu vernachlässigen ist, dem pH-Wert und dem CO2-Partialdruck. Die beiden letzten Werte stehen in enger Beziehung zueinander: ein Ansteig des CO2Partialdruckes führt zu einem Absinken des pH-Wertes. Das ganze nennt man auch den BohrEffekt. e) Bohr-Effekt Er unterstützt den Austausch von O2 im Gewebe und in der Lunge. Steigt der CO2-Partialdruck an so sinkt die Affinität des Hämoglobins zu Sauerstoff ab. Die führt zu einer erleichterten O 2Aufnahme in der Lunge, sowie zu einer erleichterten O2-Abgabe ins Gewebe. f) Positiv kooperativer Effekt bzw. kooperative Bindungsaffinität Trotz langsamer Sättigung immer noch Steigerung der Gerade. Es ist abhängig vom Partialdruck O2 (bei pO2 Sauerstoff löst sich vom Hämoglobin). g) Transport des Sauerstoffs Sauerstoff diffundiert aufgrund der Partialdruckdifferenz (Palveole = 100 - Pkapillare 40) von der Alveole in das Blut und dort in den Erythrozyten an das Hämoglobin. Das Hämoglobin besteht aus 4 Polypeptidketten (2 und 2 -Ketten), von denen je eine als „Häm“ bezeichnet Farbkette trägt. Jedes Häm besitzt ein zweiwertiges Fe-Atom, an das die Anlagerung des O2 erfolgt. Es können an 1 Hämoglobin 4 O2 gebunden werden (maximaler O2-Gehalt). (Sauerstoffbindungskurve ist sigmoid aufgrund von positiv kooperativer Bindungsaktivität.) In vivo wird eine solche vollständige Aufsättigung des Blutes bei der Lungenpassage nicht erreicht. Dies liegt daran, daß das arterielle Blut eine geringe Beimischung von venösem Blut (über die Vv. bronchales und die Vv. cordis minimae - physiologisch als „shunt“ bezeichnet) erfolgt. Die O2-Bindungskurve de Blutes hängt von folgenden Faktoren ab: Temperatur pH-Wert CO2-Partialdruck 2,3-Diphosphoglycerat Der relativ niedrige pH-Wert und der relativ hohe PCO 2-Wert im peripheren Gewebe bewirkt eine vermehrte O2-Abgabe des Hämoglobins (Bohr-Effekt). Die Zellen werden beatmet. Kohlenstoffdioxidtransport a) Transportform des Kohlendioxid (CO2) Physikalisch gelöst (6 %) In gebundener Form an das Hämoglobin als Carbaminoverbindung als Bicarbonat, das in einer Reaktion von Wasser und Kohlendioxyd zu Kohlensäure (H2O + CO2 H2CO3) entsteht. Kathalysiert wird die Reaktion von dem Enzym Carbanhydrase. Aus dem Gewebe diffundiert das CO2 in den Erythrozyten. Dort wird mit Hilfe des Enzyms Kohlensäure aufgebaut, das dann wieder in Bikarbonat- (HCO3-) 201 und Wasserstoffionen (H+) dissoziiert. Das Bikarbonat wird mit Hilfe eines HCO3- - Cl-Antiport aus der Zelle hinausgeschleust. Dieser Vorgang wird als Chlorid-Shift oder Hamburger-Zyklus bezeichnet. im Plasma im Erythrozyten 63,0 % als HCO3(wichtigstes 26,0 % als HCO3Puffersystem) 5,0 % Carbaminobindung (H-Hb-NH-COO-) 3,2 % als CO2 physikalisch gelöst 2,6 % CO2 physikalisch gelöst 0,5 % Carbaminobindung (H-Hb-NH-COO-) b) Kohlendioxidtransport Das im Gewebe produzierte CO2 diffundiert in das Plasma und dann in die Erythrozyten. Es wird dort physikalisch und chemisch gelöst. In Erythrozyten erfolgt mit Hilfe der Carboanhydratase (die im Erythrozyten vermehrt vorkommt) die Umwandlung des CO2 in Kohlensäure und weiter in Bicarbonationen und H+ dissoziiert. Dieses HCO3- diffundiert aber sehr schnell ins Plasma aufgrund Konzentrationsgradienten, der noch durch einen elektrischen Gradienten verstärkt wird. Dabei wird Cl- in die Zelle eingeschleust, weil die elektrische Ladung im Gleichgewicht bleiben muß (Cl--Verschiebung oder Hamburgershift). Die bei der Bikarbonatbindung im Ery freiwerdenden H+-Ionen werden vom Hämoglobin gepuffert. Das ist im Gewebe besonders gut möglich, weil durch das entkoppeln des CO2 das oxygenierte Hämoglobin in die desoxygenierte Form übergeht und dabei seinen Säurecharakter abschwächt. Es kann dadurch leichter H+ aufnehmen, was nun seine Pufferwirkung erklärt. Je stärker daher das Hämoglobin entsättigt wird, um so mehr kann CO2 in Form von Bikarbonat oder in Form von Carbaminobindungen gebunden werden. Der sog. Haldane Effekt beschreibt die verstärkte CO2-Bindung durch die O2-Entsättigung des Hämoglobin In der Lunge wird das im Plasma vorliegende HCO2- wieder vermehrt (wenn nötig) in die Erythrozyten aufgenommen, dort wieder in CO2 umgewandelt und per Diffusion an die Alveolen abgegeben. c) Kurzbeschreibung des CO2-Transport Das im Stoffwechsel gebildete CO2 gelangt in gelöster Form ins Blut. In den Erythrozyten wird das CO2 unter Mitwirkung von Carboanhydrase zu Kohlensäure hydratisiert, die sofort in Protonen und Bocarbonat dissoziiert. Während die Protonen überwiegend an Hämoglobin gebunden werden, diffundiert HCO3- im Austausch gegen Cl- ins Plasma (Hamburgershift). CO2 reagiert außerdem mit der Aminogruppe des Hämoglobin unter Bindung von Carbamat. Alle diese Prozesse werden bei der pulmonalen CO2-Abgabe in umgekehrter Richtung durchlaufen. Gesetzmäßigkeiten des Atemgastransportes Der Atemgastransport hängt v. a. vom Partialdruck des jeweiligen Gases ab. Die O2- und CO2-Partialdruckwerte, die sich nach der Lungenpassage im Blut einstellen, werden primär durch die alveoläre Ventilation, die Lungenperfusion (Durchblutung) und die Diffusionskapazität bestimmt. Zusätzlich beeinflußt die regionale Verteilung (Distribution) dieser Größen, den Arterialisierungsgrad. In den Lungenspitzen hat das Ventilations-Perfusions-Verhältnis und damit auch der alveoläre PO2 einen größeren Wert als in der Lungenbasis. 202 Außerdem: Ein reduziertes Hämoglobin kann besser H+ aufnehmen als Oxy-Hämoglobin Die Abgabe des O2 begünstigt eine CO2-Aufnahme (Haldane-Effekt) Erhöhter PCO 2 im Gewebe erhöht die O2-Abgabe des Hämoglobin (Bohrscher Effekt) CO2-Gehalt: O2-Gehalt: Im arteriellen Blut 0,4 l CO2 / l Blut 0,2 l O2 / l Blut Im venösen Mischblut 0,52 l CO2 / l Blut 0,15 l O2 / l Blut Begriffe Hyperkapnie, -karbie: erhöhter PCO 2 im arteriellen Blut meist infolge von (alveolärer) Minderbelüftung (alveoläre Hypoventilation) und dann mit vermindertem PO 2. Hypokapnie: verminderter PCO 2 im Blut, z. B. bei Hyperventilation, respiratorischer Alkalose 14. Atemmechanik, Spirometrie Spirometrie und Pneumotachometrie messen direkt das Atemvolumen, das inspiratorische Reservevolumen und das expiratorische Reservevolumen. Spirometrie Bestimmung der Ventilationsgrößen mittels Spirometer als Ruhe- oder Ergospirometer. (s. auch Praktikumsanleitung!) Glocke taucht ins Wasser ein Innenraum des Spirometers ist luftdicht abgeschlossen Ausgleich des Glockengewichtes durch ein Gegengewicht am Schieber CO2-Absorber filtert das CO2 ab Volumenabnahme O2-Verbrauch Glockenhebung und -senkung durch Volumenänderung Schreibhebel Spirogramm Pneumotachographie Fortlaufende Registrierung der Strömungsgeschwindigkeit der Atemluft. Der Pneumotachograph funktioniert wie ein Spirometer nur mit einem eingeschalteten Widerstand. 15. Atemgeräusche Bronchiales Atemgeräusch Hört sich an wie das Aussprechen eines „ch“ mit am Gaumen gelegter Zunge. Es entsteht durch die Bildung von Wirbeln beim Vorbeistreifen der Luft an den Stimmbändern. Man kann es am besten an der Trachea und über den großen Bronchen hören. Wenn sich in der Lunge Flüssigkeitsansammlungen befinden, kann es auch über das Lungenfeld wahrgenommen werden. Verstibuläre Atemgeräusche 203 Kann durch das inspiratorische Aussprechen eines „V“ nachgeahmt werden. Es entsteht durch die Schwingungen der feinsten Bronchuli und der Alveolargänge. Man kann es über das gesamte Lungenfeld hören. Bei Ansammlungen von Sekret im Lungenparenchym ist es nicht mehr nachzuweisen. Stridor pfeifendes Atemgeräusch bei der Inspiration oder der Expiration, z. B. durch die Luftröhren- oder Bronchenenge. 16. Lungenfunktionsprüfungen Sie gestatten die Differenzierung zwischen restriktiven und obstruktiven Ventilationsstörungen. Diagnostisch relevante Parameter zur Beurteilung der Erkrankung sind: Vitalkapazität: Sie ist meßbar mit dem Spirometer. Atemgrenzwert: Es bezeichnet das Atemminutenvolumen bei maximaler forcierter willkürlicher Hyperventilation. Relative Sekundenkapazität (Tiffenau-Test): Unter dieser Kapazität versteht man dasjenige Volumen, das innerhalb einer Sekunde forciert ausgeatmet werden kann. Das ausgeatmete Volumen wird spirographisch gemessen und als Anteil der Vitalkapazität angegeben. Werte unter 70 % sprechen für das Vorliegen eines erhöhten Strömungswiderstandes in den Atemwegen. 17. Drücke im Atmungsapparat Pleuralspalt Das ist ein Flüssigkeitsgefüllter Raum zwischen Pleura pulmonalis und parietalis. Der Thorax hat das Bestreben sich zu erweitern, die Lunge hingegen sich zu zusammenzuziehen aufgrund ihrer Eigenelastizität und der Oberflächenspannung der Alveolen. Die einander entgegengesetzten Zugkräfte führen dazu, daß im Pleuraspalt, ein gegebener Unterdruck von - 8 cm H2O (- 0,8 kPa) bei der Inspiration und - 5 cm H2O (- 0,5 kPa) bei der Expiration entsteht. In Ruhe liegt der Unterruck bei - 4 cm H2O (- 0,4 kPa). Bei einer Stichverletzung kommt es zu einem Druckabfall, die Lunge kollabiert zum Pneumothorax und der Thorax expandiert. Intrapulmonal Bei der Einatmung (- 1 cm H2O) der Druck in den Alveolen niedriger sein als der atmosphärische Druck der Umweltluft. Durch visköse Widerstände kommt es zu dieser Negativierung des Pleuradrucks, nur so kann die Luft eingezogen werden. Bei der Ausatmung (+ 1 cm H2O) muß eine umgekehrte Druckdifferenz bestehen, um die Luft wieder herauszupressen. Durch positive Widerstände kommt es zur Positivierung des Pleuradrucks. Um diese Drücke herzustellen, muß das Lungenvolumen muß das Lungenvolumen bei der Inspiration vergrößert werden. Dies wird zum einen direkt übe die Bewegung des Zwerchfells, zum anderen mit Hilfe der sonstigen Atemmuskeln indirekt über die Bewegung des Thorax erreicht. 18. Retraktionskraft der Lunge Die Retraktionskraft der Lunge wird bei der Expiration ausgenutzt. Es ist Zurückzuführen auf die Elastizität der Lunge und die Oberflächenspannung der Alveolen. Compliance = 1/10 = 0,1 [l/cm H2O] 204 19. Druck-Volumen-Diagramm Analog zur Ruhedehnungskurve kann das Druck-Volumen-Diagramm auch bei maximaler Anstrengung der Atmungsmuskulatur aufgenommen werden (expiratorische und inspiratorische Maxima). Dynamisches Druck-Volumen-Diagramm Dehnungskurve von Lunge und Thorax während des Atmens91 Ppul = 0 Ppleu = negativ Statistisches Druck-Volumen-Diagramm Compliance entspricht der Ruhedehnungskurve. Bei sehr langsamer Atmung statisch.92 Ppul = - 1 bis + 1 Ppleu = negativer bis weniger negativ 20. Pulmonale Regulation des Blut-pH-Wertes An der Konstanthaltung des Blut-pH sind mehrere Faktoren beteiligt: Puffereigenschaften des Blutes93 Es sind die ionisierbaren Seitengruppen besonders wichtig, unter denen der Imidazolring (Proteine) des Histidins besonders wirksam ist (v. a. im Hämoglobin, weil hier der Histidinanteil besonders groß ist). Das Hämoglobin hat im physiologischen pH-Wert als Oxy-Hämoglobin (starke Säure) eine stärkere Azidität als das Deoxy-Hämoglobin (schwache Säure). Bei O2-Abgabe, kann es bei der stattfindenden CO2-Aufnahme die dabei gleichzeitig entstehenden H+-Ionen abpuffern. (HämoglobinPuffer). Hämoglobin-Puffer Plasmaeiweiß-Puffer Phosphat-Puffer Gasaustausch in der Lunge Die Gesamtkonzentration der Pufferbasen verändert sich bei der Variation des CO 2-Partialdruckes nicht, z. B. PCO 2 H+ + HCO3- . P- (Proteinatanionen/ Pufferbasen) fängt die H+-Ionen ab und neutralisiert diese zu HP + HCO3-. Die Gesamtgleichung lautet: P- + H+ HP + HCO3-. Die negative Ladung bleibt konstant, nur daß nicht die P--Ionen mehr die negative Ladung darstellen, sondern HCO3-. Die Konzentration der Pufferbasen, d. h. aller pufferwirksamen Anionen, beträgt 48 mmol/l Abweichungen davon werden als Basenüberschuß bzw. Basendefizit bezeichnet. Henderson-Hasselbach-Gleichung: [ HCO3- ] pH = pK + log ---------------[ CO2 ] 91 Inspiration: negativer/ Expiration: weniger negativ visköse Widerstände können vernachlässigt werden; nur elastische Widerstände 93 v. a. Plasmaproteine des Hämoglobin 92 205 Störungen des Säure-Base-Gleichgewichtes Störungen des Säure-Basen-Gleichgewichtes können respiratorisch und renal kompensiert werden. Die Atmung ist an der Aufrechthaltung eines stationären Säure-Basen-Gleichgewicht maßgebend beteiligt. Ansteig der Blutazidität z. B. durch eine Stoffwechselstörung. Es kommt zu einer Zunahme der H+-Konzentration. Ein zusätzlicher Atmungsantrieb führt zu einer stärkeren Ventilation. CO 2Moleküle, die aus der Reaktion ( HCO3- + H+ H2CO3 H2O + CO2) stammen, werden im erhöhten Maße eliminiert, der pH-Wert kehrt zu seiner Norm wieder zurück. Bei einer Basenzunahme sinkt die Ventilation (Hypoventilation). Daraufhin steigt der P CO 2 und die Konzentration der H+-Ionen an, was zu einen pH-Ansteig führt. Dieser kann zumindest teilweise wieder rückgängig gemacht werden. Ausscheidungsmechanismen der Niere Siehe pH-Haushalt der Niere und Säure-Base-Haushalt 21. Regulation der Atmung Es ist die Anpassung der Lungenbelüftung an die Stoffwechselbedürfnisse des Organismus. Zentrale Rhythmogenese, neuronaler Atemrhythmus In der Medulla oblongata liegen inspiratorische und expiratorische Neurone. Die respiratorischen Neurone haben Kontakt zu spinalen Motoneuronen der Atemmuskulatur. Die Neuronen sind abwechselnd tätig, wodurch es zu alternierenden In- und Expirationen kommt. Dieser Atemrhythmus läuft selbstständig ab und stellt einen der stabilsten Rhythmen dar. Der neuronale Atemrhythmus und die entsprechenden Muskelkontraktionen laufen in 3 Zyklen ab: Während der Inspirationsphase (I-Phase) erfolgt die Einatmung bis Dehnungsrezeptoren in der Lunge erregt werden, deren Aktivierung die inspiratorischen Neurone hemmt. (langsam adaptierend: Hering-Bauer-Reflex). Schnelladaptierende Rezeptoren in der Schleimhaut des Bronchialbaumes = Irritationsendigungen, z. B. Hustenreflex. Während der Postinspirationsphase (PI-Phase) beginnt die erste Phase der „passiven Ausatmung“ (sobald die Kontraktion des Zwerchfells und der inspiratorischen Interkostalmuskeln auch nur geringfügig nachlassen), die überleitet zur „aktiven Ausatmung“. Die sich anschließende Expirationsphase (E2-Phase) beinhaltet die Erregung und die Kontraktion der expiratorischen Atemmuskeln. Chemische Atmungsregulation moduliert die autonomen Prozesse chemische Atemreize durch CO2, H+ und O2 Die chemische Atmungsregulation steht im Dienste der Homöostase (weitgehende Konstanz der Konzentration gelöster Stoffe, der Temperatur und des pH) und sichert die Anpassung der Ventilation an die zellulären Bedürfnisse des Organismus 206 a) CO2 - am empfindlichsten Rezeptoren an nervösen Strukturen des Hirnstammes selbst. CO2 ist ein Gas und kann deshalb die Blut-Hirn-Schranke passieren. Die CO2-Antwortkurve steigt bis zu einem Atemzeitvolumen von 70 - 80 l / min. bei einem Pa CO 2 von 60 - 70 mm Hg. Die Steilheit dieser Beziehung gibt die Empfindlichkeit der Atmungsregulation durch Pa CO 2 an. b) H+ - eigentlich gekoppelt an Pa CO 2 Die Rezeptoren sitzen wahrscheinlich an der Aufzweigung der A. carotis communis. Es ist ein überraschend flacher Ansteig bei nicht respiratorischen Azidosen zu verzeichnen. Diese scheinbare geringe Empfindlichkeit der physiologischen Atemregulation erklärt sich aus der hyperventilationsbedingten vermehrten Abgabe von CO2. Gerade diese Abgabe von CO2 ist es, die eine respiratorische Kompensation einer nichtrespiratorischen Azidose bewirkt. c) O2 - eigentlich an Pa CO 2 gekoppelt Die scheinbar geringe O2-Empindlichkeit der Atmungsregulation kommt durch die Verminderung des CO2 Antriebs zustande, da eine hypoxiebedingte Erhöhung der Atemfrequenz zu einem Abfall des Pa CO 2 führt. Einflüsse auf die zentrale Atmensteuerung Dehnungsrezeptoren Chemorezeptoren Pressorezeptoren Mechanorezeptoren zentrale Antriebe pCO2 und pH höhere Zentren Schmerzrezeptoren Körpertemperatur Hormone Thermorezeptoren der Haut 22. Atmung des Vogels Vögel besitzen neben der Lunge unterschiedlich große Luftsäcke, die sich durch den ganzen Körper ziehen. Die für die Ventilation wichtigen Volumenänderungen finden nicht in der Lunge, sondern in den Luftsäcken statt. Die Atemgase streichen bei der In- und Expiration durch die Parabronchen. Dort findet der Gasaustausch zwischen der Außenwelt und dem blut nach dem Kreuzstromprinzip statt. In der Lunge (Paleopulmo) kann die Luft nur in eine Richtung fließen. In der Neopulmo in beide Richtungen und kann dort auch 2 x verwendet werden. Unterschiede Anatomie Volumenänderung Säuger Lunge innerhalb der Lunge 207 Vogel Lunge und Luftsäcke in den Luftsäcken Lungenstruktur Strömungsmodell Ventilationsrichtung blind endendes Alveolarsystem ventilierter Raum bidirektional Durchflußsystem Kreuzstromsystem unidirektional (exkl. Neopulmo) VERDAUUNG 1. Allgemeines 1.1 Vergleich von körpereigener und mikrobieller Verdauung Mikrobielle Verdauung Durch Mikroorganismen Nährstoffarmes und rohfaserreiches kann gut verwendet werden Energielieferant von Bakterien 208 Produzierte Fettsäuren aus minderwertigen pflanzlichen Proteinen und auch aus Nicht-Protein-N wird mittelwertiges Bakterienprotein aufgebaut (Eiweißveredelung) 70 % Resorption im Vormagen, 20 % im Dünndarm, 10 % im Dickdarm Synthese von wasserlöslichen Vitaminen und Vitamin K Energiereiche, hochwertige Nährstoffe werden abgebaut und wie mittelwertige Nährstoffe verwendet Energieverlust durch Gärungswärme und CH4-Abgabe Aus wertvollem Pflanzenfett (ungesättigte Fettsäuren) wird minderwertiges Körperfett (mit gesättigten Fettsäuren) gemacht Gefahr des Glucosemangels Körpereigene Verdauung Durch Enzyme Abbau nach mechanischer Zerkleinerung (Zähne) Verflüssigung mit Speichel, Ansäuerung und Proteindenaturierung durch den Magensaft, Fettemulgierung durch Gallenflüssigkeit Resorption durch Dünndarmschleimhaut (aktiver Transport, passive Diffusion) Unverdaute Reste werden im Dickdarm durch Bakterienflora weiterverdaut Energielieferant Glucose Darmflora spielt keine Rolle für die Verwertbarkeit der Nahrung, aber für die Versorgung mit Vitamin K und andern Vitaminen Regulation durch nervöse Steuerung (Plexus myentericus und submucosus) und gastrointestinale Hormone 1.2 Unter Verdauung versteht man ... Freisetzung der absorbierbaren Nährstoffe aus dem aufgenommenen Futter im Verdauungstrakt Absorption dieser Niedermolekularen Nährstoffe, d. h. ihr Übergang aus dem Lumen des Verdauungstraktes in den Intermediärstoffwechsel Ausscheiden nicht absorbierbarer Nährstoffe und endogener Stoffwechselprodukte mit dem Kot 1.3 Aufgaben der Verdauung Durch die Verdauungsvorgänge wird die Nahrung bzw. die darin enthaltenen Nährstoffe: Resorbierbar/ absorbierbar, d. h. die hochmolekularen Nährstoffe werden in kleinere Bestandteile zerlegt Transportierbar, damit die Versorgung aller Zellen gewährleistet ist Assimilierbar zum Aufbau neuer körpereigener Substanzen Die antigene Wirkung der Nahrung wird aufgehoben. Würden die hochmolekularen Nährstoffe unzerkleinert und unverdaut in den Organismus gelangen, käme es zu einer Antigen-AntikörperReaktion, denn die Nährstoffe würden vom Immunsystem als fremd angesehen werden. 1.4 Intestinale Durchgangszeiten Definition 209 Darunter versteht man die unterschiedlichen Durchgangzeiten des Magen-Darm-Inhaltes durch den Verdauungskanal. Die Geschwindigkeit ist abhängig vom Nahrungszustand (fest, breiig), vom Bau, Länge und Fassungsvermögen der einzelnen Abschnitte des Verdauungskanals. Mensch Magen: ca. 3 Stunden Dünndarm: ca. 7 - 8 Stunden Dickdarm: ca. 24 - 120 Stunden Carnivore Kurzer, wenig kompartimentierter Magen-Darm-Trakt Keine Gärkammer Großer Magen Rasche Passage Herbivore Sie kennzeichnen sich aus durch einen langen Magen-Darm-Trakt, der z. T. stark kompartimentiert ist (Magen beim Rind oder Dickdarm beim Pferd). Die Verweildauer der Nahrung ist deshalb sehr lang. Rind: besitzt eine große Gärkammer vor dem Darm. Die Mikroorganismen gelangen mit in den Darm und werden mitverdaut. Die große Darmlänge mit großer Oberfläche gewährleistet eine gute Resorption. Pferd: Die Gärkammer ist der Dickdarm. Die Mikroorganismen sorgen dort für die Nachverdauung und werden mit dem Kot ausgeschieden. Omnivore Große Variabilität 1.5 Nahrungsaufnahme Fleischfresser Herausbeißen von Stücken Wasseraufnahme mit der Zunge Wiederkäuer Umschlingen des Grases mit der Zunge Abkneifen mit den Kiefern Bewegliche Zunge und gespaltene Oberlippe (kl. Wdk.) erlaubt tiefes abweiden Wasseraufnahme durch Ansaugen, fester Schluss von Ober- und Unterlippe und vorschieben des Kiefers 210 Pferd Greifen der Nahrung mit beweglichen Lippen, Abreißen von Gras zwischen den Schneidezähnen Schwein Wühlen mit dem Rüssel 1.6 Kauen Willkürlich und reflektorisch gesteuert (Herbivoren zermahlen, Carnivoren quetschen) Zerkleinert feste Nahrung Durchmischung mit Speichels, erleichtert das Schlucken und gleichzeitig schon Vorverdauung durch Amylasen und prägastrische Lipasen Oberflächenvergrößerung des Bissens erleichtert den enzymatischen Abbau Geschmack wird wahrgenommen (giftig?) 1.7 Speicheln Funktion Schutz der Mundschleimhaut und Zähne (Austrocknen, Säure) Bakterizide Wirkung (Lecken von Wunden, Neugeborene) Gleitfähigkeit des Bissens Einleitung der Kohlenhydrat- und Fettverdauung durch Amylase und prägastrische Lipase Regulation des Pansen-pH-Wertes und der Pansenflora (Wiederkäuer) Phosphatausscheidung (Wiederkäuer) Sekretion von Harnstoff für die ruminale Proteinsynthese (Wiederkäuer) Trennung von fein geriebenen Futter von größeren Bestandteilen beim Fluß durch die Vormägen Temperaturregulation (Hund 10 x Volumenzunahme bei Hitze) Abwehrfunktion (Lama) Regulation und Innervation der Speicheldrüsen Die Speichelsekretion wird über unbedingte (angeborene) und bedingte (erworbene) Reflexe ausgelöst, wobei sich das Speichelzentrum in der Medulla oblongata befindet. Sympathicus Fördert die Abgabe von mukösem Sekret Über das Thorakalmark zum Ganglion cervicale craniale und innerviert alle 3 großen Drüsen 211 Parasympathicus Fördert die Abgabe von vom proteinarmen, serösen Sekret Über die Ncll. salivatorii in der Medulla oblongata Ganglion oticum die Gl. parotis Ganglion submandibularis Gl. mandibularis und Gl. sublingualis Speichelbildung a) Aufbau der Speicheldrüsen traubenartige Struktur sekretorische Einheit ist ein kleines Säckchen (Acinus) Ableitung erfolgt über Schalt- und Streifenstücke Myoepithel zur mechanischen Unterstützung In der in der Schleimhaut der Backen befinden sich viele kleine Drüsen, die musöses Sekret sezernieren. Des weiteren haben die Tiere große paarige Speicheldrüsen, zu denen die Ohrspeicheldrüse, Gl. parotis (serös), die Gl. mandibularis (Unterkieferspeicheldrüse) und die Gl. sublingualis (Zungenspeicheldrüse, sero-mukös) gehören. b) Sekretion von Elektrolyten Blut und Speichel fließen wie in der Niere nach dem Gegenstromprinzip. Der Primärspeichel ist isoton, der Sekundärspeichel hypoton (außer Wiederkäuer: isoton). Bildung des Primärspeichels In Acini erfolgt die Bildung von plasmaänlichem Primärspeichel. Dazu wird Cl- und HCO3- durch transzelluläre Sekretion in die Acini befördert. Na+ und K+ folgen parazellulär und passiv. Wasser folgt aus osmotischen Gründen nach. Beim Wiederkäuer gibt es eine aktive Sekretion von Phosphat und Harnstoff später in den Schaltstücken. c) Bildung des Sekundärspeichels In den Schaltstücken wird der Sekundärspeichel gebildet. Dazu kommt es zur aktiven Na+- und passiven Cl- -Resorption und zur weiteren Sekretion von K+ und HCO3-. So verhält sich die Konzentration im Sekundärspeichel: K+ und HCO3- und Na+ und Cl- . Die Ausführungsgänge sind sehr wasserundurchlässig, so daß der Sekundärspeichel hypoton werden kann. Die Zusammensetzung ist anhängig von der Flußrate. Ist der Speichelfluß langsam, so bleibt viel Zeit für Resorptions- und Sekretionsvorgänge. Bei einer schnell Flußrate, ist der Sekundärspeichel dem Primärspeichel sehr ähnlich. Sekretion von Proteinen Die Speicheldrüsen produzieren Makromoleküle, die durch Exozytose in den Speichel gelangen und mit diesem zusammen abgegeben werden. Dazu gehören Amylase, Glycoprotreine, Mucopolysaccharide (Schleim) prägastrischer Lipase aus den Acinuszellen. 1.8 Abschlucken Beim Abschlucken (Deglutition) der Nahrung, wobei der Nahrungstransportweg vom Mund zum Magen den Atemweg kreuzt, handelt es sich um einen reflektorischen Vorgang, der über das ZNS koordiniert wird. das Schluckzentrum liegt in der Medulla oblongata. 212 Phasen des Abschluckens orale Phase Teilweise willkürlich Bissen wird durch die Zunge nach dorso-caudal Richtung Schlundenge (Isthmus faucium) verschoben pharyngeale Phase Rein reflektorisch Bissen tritt in den Pharynx ein Nasenraum und Kehlkopf sind verschlossen Kontraktion der Pharynxund Larynxmuskulatur ösophageale Phase Rein reflektorisch Perestaltische Welle Ösophagus des Aufbau des Ösophagus Der Ösophagus besitzt proximal quergestreifte Muskulatur und distal glatte Muskulatur. Die Verhältnisse von glatter zu quergestreifter Muskulatur sind tierartlich unterschiedlich. Es existiert ein proximaler und ein distaler Ösophagussphincter. Vogel: nur glatte Muskulatur Ratte und Maus: nur quergestreifte Muskulatur Rest: mehr quergestreift als glatt (Hd, Schw, Ktz, Rind: wenig glatte Muskulatur; Primaten, Equiden: etwas mehr über die Hälfte ist quergestreift) Innervation des Ösophagus Plexus myentericus (glatte Muskulatur) befindet sich zwischen der Ring- und der Längsmuskulatur N. vagus (glatt und quergestreift) reflektorische Kontrolle des Schluckens erfolgt über das Schluckzentrum der Medulla oblongata Ösophagusperistaltik94 a) Primäre Peristaltik Sie wird über das Schluckzentrum kontrolliert. Die Druckwelle ist die Fortsetzung des willkürlichen Schluckens. b) Sekundäre Peristaltik Sie wird über kurze Äste des Plexus myentericus kontrolliert. Es sind Druckwellen infolge einer Wanddehnung (Fremdkörper, steckengebliebene Nahrungsreste, Ballonsonden) 1.9 Steuerung Nervensystem a) Vegetatives Nervensystem 94 Nach dem Schluckreflex erschlafft der obere Sphincter, der nach dem Durchgang des Bolus wieder verschlossen wird. Der Nahungsbrei wird aboral transportiert, passiert den bereits erschlafften unteren Sphincter und gelang somit in den Magen. Der Verschluss der beiden Spincter wird mit einem erhöhten Ruhetonus bewirkt. 213 Die Steuerung erfolgt über den Sympathicus und den Parasympathicus. Dabei wirkt der Sympathicus hemmend auf die Verdauungsvorgänge, in dem sich die Sphincter kontrahieren und der Speisebrei länger im Magen verweilt. Zum Schutz vor Selbstverdauung werden zusätzlich mukösen Drüsen innerviert. b) Sphincter: Pylorus und Ileo-Caecal-Muskel Speicher: Magen und Kolon Intramurales Nervensystem In der Wand der Verdauungsorgane liegen mehrere relativ selbständige Reflexapparate, die autonome Bewegungen auslösen können., aber bei verändertren Bedürfnissen der Organismus vom vegetativen Nervensystem gesteuert werden können. Dazu gehören der Plexus subserosus, Plexus myentericus (Auerbach’sche Plexus) und der Plexus submucosus (Meißner’scher Plexus). Gastrointestinale Hormone Diese Polypeptide werden im Magen-Darm-Trakt gebildet (enteroendokrines System), die auf Magen, Dünndarm, Leber und Pankreas hemmend oder fördert wirken. Sie wirken ebenso noch bei der Aufspaltung und der Resorption der Nahrung mit. Hormon Gastrin Sekretin Cholezystokinin Vasoaktives Intestinales Peptid (VIP) Gastro-intestinales Peptid (GIP) Bulbogastrone Enteroglucagon Enteropeptidase Motilin Villikinin Serotonin Wirkort und Funktion Magensekretion Pankreassekretion Pankreassekretion Gallenblasenkontraktion Stimulation der Pankreassekretion Relaxation der glatten Muskulatur 2. Mehrhöhlige Mägen 2.1 Anatomie Er besteht aus dem dreiteiligen, von einer drüsenlosen, kutaten Schleimhaut augekleideten Vormagen = Proventriculus, mit Pansen, Rumen, Haube oder Netzmagen, Reticulum, die funktionell als Ruminoreticulum zusammengefaßt werden, und Psalter, Buch, Blättermagen, Omasum, sowie einer vierten Abteilung, dem mit drüsenhaltiger Schleimhaut versehenen Drüsen- oder Labmagen, Abomasum. Vormagen, Proventriculus (drüsenlose, kutane Schleimhaut) mit Pansen, Rumen und Haube oder Netzmagen, Reticulum, zusammen als Ruminoreticulum bezeichnet und dem Psalter, Buch, Blättermagen, Omasum. Drüsen- oder Labmagen, Abomasum (drüsenhaltige Schleimhaut) 214 Pansen, Rumen Der Pansen ist ein gewaltiger, seitlich abgeflachter Sack, der den Bauchraum zu einem erheblichen Teil in Anspruch nimmt. Er füllt, vom Zwerchfell bis zum Beckeneingang reichend, die linke Bauchhälfte vollständig aus und nimmt mit seinem kaudoventralen Blindsack noch einen beträchtlichen Teil der rechten Bauchhöhlenhälfte mit ein. Haube, Netzmagen, Reticulum Die Haube schiebt sich als kugeliges, in kranio-kaudaler Richtung leicht abgeflachtes Organ zwischen das Zwerchfell und das Kranialende des ventralen Pansensackes ein und liegt im thorakalen Raum der Bauchhöhle vorwiegend links. Dorsal geht die Haube ohne sichtbare Grenze in den Pansenvorhof über, während sie ventral und seitlich durch einen tiefen Einschnitt, die Pansen-Hauben-Furche vom Pansen getrennt ist. Grenzt nach kranial an das Zwechfell an, nach rechts an den linken Leberlappen, den Blätter- und Labmagen, nach links an die Pars costalis des Zwerchfells und nach ventral liegt sie dem Brustbeinende, sowie dem Schaufelkorpel auf. Er dient als Misch- und Separationsmagen, in dem grobes Futter zurück in den Pansen und feines Futter vorwärts in das Omasum transportiert wird. Die Funktion erfordert eine starke Muskulatur, die mit der Magenstraße kommuniziert und diese mit Hilfe der Lippen (Labia) schließen können Blättermagen, Buch, Psalter, Omasum Rind: etwa kugelige Gestalt und liegt im ventralen intrathorakalen Abschnitt der Bauchhöhle und schiebt sich rechts von der Medianeben zwischen den Pansensack und der Leber (links), sowie der rechten Bauchwand kleiner Wiederkäuer: etwa oval und liegt im mittleren thorakalen Bereich der Bauchhöhle und berührt die Bauchwand nicht. (Unterschied zum Rind) Labmagen, Drüsenmagen, Abomasum Der Labmagen schließt sich als vierte Abteilung den drei Vormägen an. Er hat eine birnenförmige oder retortenförmigen Form mit Fundus (größter Durchmesser) und einem Corpus abomasi, der zur Pars pyloria hin ausgezogen ist. Er liegt ventral vom Recessus ruminis, caudal vom Netzmagen, der ventralen Bauchwand anliegend zwischen den Rippenbögen. (von links cranio-ventral nach rechts caudo-dorsal über die Medianebene schwingend) 2.2 Mikroorganismen der Vormägen Art und Funktion In den Vormägen befinden sich Bakterien und Infusorien (Ciliaten, Flagellaten), Pilze und nicht verspornende Anaerobier. Die Mikroorganismen gelangen über das Futter in die Vormägen. Deshalb ist ihre Zusammensetzung von der Zusammensetzung des Futters abhängig. Raufutterreiche Rationen liefern vielfältige Populationen und kraftfutterreiche Rationen haben eine geringere Artenvielfalt, dafür eine höhere Keimzahl. In einem Liter Pansensaft kommen i. d. R. 109 bis 1011 Bakterien vor. Es gibt im Pansen ca. 60 verschiedene Bakterienarten, die sich in Aussehen und in ihren Eigenschaften unterscheiden. 215 a) Bakterien Der weitaus größte Anteil wird von Kokken, Stäbchen und spiraligen Zellen gebildet. Ihre Eigenschaften sind sehr vielfältig. Man unterschiedet hier: b) cellulolytische Bakterien (cellulosespaltende Bakterien) amylolytische Bakterien (stärkeverwertende Bakterien) glucoseverwertende Bakterien laktatverwertende Bakterien proteolytische Bakterien lipolytische Bakterien NH3-bildende Bakterien Methanbakterien Protozoen Das sind begeißelte Mikroorganismen (Ciliaten, Flagellaten und Infusorien), die über „protozoenbefallene“ Tiere übertragen werden. Sie sind nicht lebenswichtig, aber für das Wirtstier überwiegend günstig. Sie tragen bei zur: c) Abbau von Fetten, Kohlenhydraten und Proteinen Verbesserung der N-Retension NH3-Konzentration im Pansensaft (ist dort 3 x so hoch) Ciliaten bilden mehr Propion- und Buttersäure bilden Reservekohlenhydrate für die Futterpausen zur Energiegewinnung Protozoenprotein ist wertvoller als das Bakterienprotein Ciliatenarten sind untereinander antagonistisch und fressen auch Bakterien Hefen Sie kommen zwar regelmäßig im Pansen vor, sind aber für die Verdauung nicht so wichtig. Symbiose a) Leistungen des Wiederkäuers b) Bereitstellung einer Fermentationskammer kontinuierliche Zufuhr von zerkleinerter Nahrung als Energiequelle für die Fermentation Aufrechterhaltung eines konstanten Milieus Flüssigkeitszufuhr (Speichel) Temperatur zwischen 39 - 41° C anaerobe Bedingungen Pufferung (Speichel) Entfernung mikrobieller Stoffwechselprodukte Leistungen der Mikroorganismen 216 Synthese aller essentiellen Aminosäuren unter Verwendung einfachster N-Quellen. Es fließt ständig ein Teil der Bakterien in den Labmagen, so daß die Versorgung des Wiederkäuers sichergestellt ist. Es ist also unabhängig von der Futterqualität. Synthese wasserlöslicher Vitamine und damit Unabhängigkeit von deren Vorkommen im Futter Aufschluß von für den Wirt unverdaulichen Kohlenhydrate, z. B. Cellulose 2.3 Abbau der Proteine Abbau der Proteine Futterproteine NPN im Futter Speichel-Harnstoff NPN Plasma-Harnstoff HarnstoffExkretion im Harn NH4+ Plasma-NH3 HarnstoffSynthese in der Leber Proteine Peptide Vormagen Aminosäuren Mikrobielles Zellprotein Proteine Labmagen und Darm Sekret-Proteine Peptide Aminosäuren Kot Plasma-AS Körperprotein unverdaute N-Verbindungen aus Futter, Mikroorganismen und Sekreten Das aufgenommene Futterprotein wird von proteolytischen Bakterien im Pansen zu Peptiden und Aminosäuren abgebaut (70 % des Futterproteins). Die Aminosäuren werden in den Bakterien zu Bakterienprotein aufgebaut oder zu NH3 und Ketonen abgebaut. Pansenbakterien und nicht abgebautes Futterprotein (30 %) gelangen in den Labmagen (Durchflußfutterprotein, lipophile Proteine) und in den Dünndarm zur Verdauung. Die hierbei freiwerdenden Aminosäuren und das NH 3 werden resorbiert und gelangen über das Blut in die Leber. Die Aminosäuren werden dort zu Gewebeprotein und das NH3 zu Harnstoff umgewandelt, wobei 50 % wieder ausgeschieden wird. Inwieweit das Rohprotein im Pansen durch Mikroorganismen abgebaut wird, hängt von der Löslichkeit der N-Verbindungen im Pansensaft ab, von der Verweildauer im Vormagen und der Zusammensetzung der Mikroorganismen. Zusätzlich zum Futterprotein wird noch Nicht-Protein-N (NPN), z. B. Harnstoff aufgenommen und abgebaut. Es entsteht NH3 (Ammoniak), das dann hauptsächlich zum Aufbau von Bakterienprotein dient. Sollte die NH3-Konzentration im Pansen zu hoch werden, kann das Ammoniak von den Pansenzotten ins Blut resorbiert werden (Rumino-hepatischer-Kreislauf) Ruminohepatischer Kreislauf 217 Darunter versteht man den Kreislauf des Stickstoffs in Form von NH3 und Harnstoff zwischen Pansen und Leber über Blut und Speichel zur Bereitstellung von NH3 für die Proteinsynthese der Mikroorganismen. Wenn die NH3-Konzentration im Pansen ist zu hoch ist, diffundiert dieses anhand des Konzentrationsgefälles ins Blut und gelangt so über die Pfortader in die Leber. Dort kommt es zur Produktion von Harnstoff, der in das Blut abgegeben wird. Ist die Konzentration des Harnstoffs im Blut höher als im Pansen, so erfolgt wiederum eine Diffusion durch die Pansenwand. Außerdem gelangt über den Speichel Harnstoff in den Magen, wo es zu einer erneuten Spaltung zu NH3 und CO2 kommt. Harnstoff dient somit als N-Quelle für die Zeit nach der Futteraufnahme. Der Umbau des NH3 zu Harnstoff erfolgt unter Energieaufwand. Dabei werden 50 % über die Nieren ausgeschieden, 10 % gelangen über den Speichel und 40 % direkt über die Blutbahn in den Pansen. 2.4 Abbau der Kohlehydrate Beim Wiederkäuer werden 2/3 der Kohlehydrate von den Mikroorganismen im Pansen gleich zu niederen Fettsäuren zerlegt. Entlang des Konzentrationsgefälles erfolgt die Resorption über die Pansenwand ins Blut. Glucose gelangt nur in ganz geringen Mengen in den Dünndarm, wo es dann ebenfalls wie bei den Monogastrischen Tieren resorbiert werden kann. Neben Stärke und Zucker werden auch Cellulose, Pektine, Fructosane und Hemicellulosen abgebaut. Das Pyruvat wird in der Glycolyse verwertet, so daß man als Endprodukt Essigsäure (C2), Buttersäure (C4), Propionsäure (C3), Milchsäure (C3) und Ameisensäure (C1) erhält. Ameisensäure wird zu CO2 und H2 abgebaut, woraus die Methanbakterien H2O und CH3 bilden und dadurch ihren Energiebedarf decken. Das Methan und geringe Mengen an Wasserstoff werden über den Ructus abgegeben. Milchsäure wird so Propion- und Essigsäure umgewandelt. Essig-, ButterPropionsäure sind Energielieferanten für die Oxidation über den Zitronensäurezyklus (ATP) und dienen als Substrate für die Synthese von Körperfetten. Fett besteht aus Glycerin, das ausschließlich aus Propionsäure gebildet wird, und Fettsäuren, die aus aus Acetat und Butyrat aufgebaut werden. Propionsäure Aufbau von nicht-essentiellen Aminosäuren Gluconeogenese aus Kohlenhydraten (Laktose und Glucose), das zur Aufrechterhaltung des Blutzuckerspiegels dient kann in Butter- und Essigsäure umgewandelt werden kann im Gegensatz zu Acetat und Buytrat auch Pyruvat bilden bei Gärung wird es weniger als Acetat und Butyrat produziert Methanogenese Das Methan wird aus Ameisensäure von methanbildenden Bakterien erzeugt, die dadurch ihre Energie erhalten. Die Ameisensäure wird zu CO2 + H2 abgebaut, woraus die Bakterien CH4 + H2O + Wärme produzieren. Das CH4 wird zusammen mit geringen Mengen an H2 über den Ructus abgegeben. Da das Methan noch einen geringen Heizwert hat, führt der ausgeatmete Teil zu Verlusten von Futterenergie für den Wiederkäuer. Ein Teil wird nach dem Ructus sofort wieder eingeatmet, so daß wenigstens nicht alles verloren geht. 218 Zellulose Stärke Cellobiose Maltose Saccharose Fructosane Pektine Pentosane Galakturonsäur e Glucose Fructose Glucose-P Fructose-P Pentosen Fructose-1,6-Diphosphat GLYCOLYSE Pyruvat Formiat CO2 + [2 H] Acetyl CoA Butyryl CoA CO2 Oxalacetat Lactat Succinyl CoA Acylyl CoA Propionyl CoA Methan Butyrat Acetat Propionat 2.5 Bedeutung der kurzkettigen Fettsäuren für den Vormagen Essig-, Butter- und Propionsäure wichtiges Nährsubstrat für Pansenschleimhaut wichtigster Energieträger für das Gesamttier (Oxidation im Citratzyklus, ATP-Bildung) Herstellung von Fetten Bildung von Glucose Substrate für Synthese von Körpergeweben Einfluß der Ernährung auf die Produktion von Fettsäuren Es ist abhängig von der Art des Futtermittels bzw. von dessen Zusammensetzung, sowie von der Struktur des Futters. Die im Futter enthaltene Stärke und der Zucker führen zu einem Anstieg des Propion- und Buttersäureanteils, während Zellulose die Fettsäure-Verteilung zugunsten der Essigsäure verschiebt. Des weiteren muß grobes Futter wiedergekaut werden. Es hat dadurch eine längere Verweildauer im Pansen, so daß Mikroorganismen mehr Zeit zur Fettsäureproduktion haben. Acetat Propionat Butyrat Cellulosereich (Heu) 60 - 70 % 15 - 20% 10 - 15 % 219 Stärkereich (Kraftfutter) 45 % 30 % 10 - 15 % Pansenacidose, Lactatacidose Bei der Verfütterung stärkereicher Rationen, d. h. eine überhöhte Aufnahme an leicht verdaulichen Kohlenhydraten an nichtadaptierte Tiere kommt es zu einem raschen Abbau und zu einem schnellen Anstieg kurzkettiger Fettsäuren. Bei z. B. fein zerkleinerten Hochleistungsfutter geht die Speichelproduktion zurück, so daß durch den Bicarbonatmangel die Abpufferung der Pansensäuren vermindert ist. Zusätzlich kommt es zu einer Zunahme der laktatbildenden und gleichzeitig zu einer Abnahme der laktatabbauenden Bakterien. Die Konzentration von Laktat steigt, der pH-Wert fällt ab. Wenn der Wert unter 5,5 fällt, wird die Pansenmotorik und die Resorption der Fettsäuren gehemmt. Zusätzlich kommt es zu einem Rückgang der Methanbildung. Der Pansen wir immer saurer, so daß letztendlichen die Mikroorganismen an ihren eigenen Fettsäuren zugrunde gehen. Deshalb sollte der mindest. Rohfaseranteil bei Milchkühen 18 % und bei Mastkühen 10% betragen. Ketose, Acetonämie (Laktationsketose) Eine Ketose tritt bei Störungen im Kohlenhydrat- und Fettstoffwechsel in den ersten Wochen nach dem Abkalben auf, wenn die Tiere die erhöhte Stoffwechselbelastung durch die Milchbildung nicht verkraften und minderwertiges Futter erhalten. Diese Tiere leiden oft unter Glucosemangel. Um genügend Milch produzieren zu können, wird Glucose über die Gluconeogenese durch Lipolyse geonnen. Es kommt zu einer vermehrten Produktion von Acetyl-CoA, dessen Abbau über den Citratcyclus durch Oxalacetatmangel (Verbrauch für Gluconeogenese) blockiert wird. Das AcetylCoA wird in Acetoacetat umgewandelt, das die Ausgangssubstanz für Ketonkörper, Aceton und Hydroxybuttersäure bildet. Die Ketonkörper gelangen ins Blut und werden teilweise mit dem Harn ausgeschieden. 2.6 Abbau der Fette im Vormagen Mono- und Digalactosylglyceride Triacylglyceride Phospholipide Galaktose Glycerin Fettsäuren kurzkettige Fettsäuren Palmitat Stearat Oleat mikrobielle Lipide Resorption im Pansen Resorption im Labmagen und im Dünndarm Der Abbau der Fette erfolgt zum größten Teil im Pansen. Hier findet eine vollständige Lipolyse von Fetten zu Glycerin und freie Fettsäuren statt. Dabei werden die kurzkettigen Fettsäuren bereits im Pansen absorbiert, die langkettigen zum Dünndarm weitertransportiert und dort resorbiert. Das Glycerin wird in für den Wiederkäuer wertvolles Propionat umgewandelt. Durch umfangreiche Hydrierung (H2-Anlagerung) werden ungesättigte Fettsäuren in gesättigte Fettsäuren umgewandelt (Fetthärtung). Ein teil des Nahrungsfettes wird von Mikroorganismen aufgenommen, das dort in Bakterienfett überführt wird. Die Bakterien werden in im Darm verdaut, wodurch der Wiederkäuer seinen Bedarf an essentiellen Fettsäuren decken kann. 220 2.7 Motorik der Mägen Hauben-Pansen-Motorik a) Schichtung des Mageninhaltes Gasblase besteht aus CH4 und CO2 und nimmt ca. ¼ des Panseninhaltes ein. Die Pansengase werden über den Ructus abgegeben. Da der Pansen nur zu 2/3 gefüllt ist, kann der Inhalt gut durchmischt werden. Rauhfutter, das nach der Futteraufnahme auf der Pansenflüssigkeit schwimmt bis es vollgesogen ist und dann absinkt. Futtersee aus Pansenflüssigkeit und Nahrungsbestandteilen Bodensatz mit Steinchen und Sand b) Funktion und Steuerung der Motorik Inhalt des dorsalen Pansensackes darf nicht zu sehr austrocknen Versorgung der bereits am Futter anhaftenden Mikroorganismen mit Nährstoffen Abpufferung der von den Miroorganismen produzierten Säuren. Abtransport der Gärungsprodukte Verhinderung der Sedimentation der Futterbestandteile Transport der Nährstoffe zu den Mikroorganismen Durch die Durchmischung des Panseninhaltes gelangen immer wieder neue Fettsäuren zur Pansenwand, wo sie resorbiert werden können Die Steuerung erfolgt über das Zentrum für Vormagenmotorik in der Medulla oblongata. Die Informationen werden parasympathisch über den N. vagus weitergeleitet. Über mechanische Reize, die durch Raufutteraufnahme über Mechanorezeptoren der Vormagenschleimhaut aufgenommen werden, wird die Vormagenmotorik induziert. c) Kontraktionsformen Unvollständige primäre Kontraktionswelle (Haube - Haube - Vorhof - dorsaler Pansensack) Vollständige primäre Kontraktionswelle (Haube - Haube - Vorhof - dorsaler Pansensack ventraler Pansensack) Sekundäre Kontraktionswelle (dorsaler Pansen - ventraler Pansen) Die primäre Kontraktionswelle entspricht der A-Welle und die sekundäre Welle entspricht der BWelle. Die Häufigkeit und die Kombination der einzelnen Kontraktionsformen richten sich nach dem Zeitpunkt der Futteraufnahme. Ebenso kann man anhand der Länge und der Pausen der einzelnen Kontraktionswellen, die als zusammenhängendes Pansengeräusch zu hören sind, die Form der Bewegungen erkennen. A-Welle Sie dient zur Durchmischung des Panseninhaltes. Dazu gehören eine 2-phasige Haubenkontraktion, die Kontraktion des Pansenvorhofs, des dorsaler Pansens und des ventralen Pansen. Die A-Welle läuft vollständige nach Fütterung (Haube - Haube - Vorhof - dorsaler Pansen - ventraler Pansen - ventraler Blindsack) und unvollständig beim Wiederkauen (Haube 221 Haube - Vorhof - dorsaler Pansen) ab. Die Bewegung ist immer von kranial nach kaudal und dorsal nach ventral. 1. 2. 3. 4. 5. 6. 7. Die erste Kontraktion dient zum Durchmischen. Der stark flüssiger Inhalt wird von der Haube in den Pansen transportiert. Danach erfolgt eine vollständige (Rind) bzw. unvollständige (Ziege, Schaf) Erschlaffung der Haube. Bei der zweiten Kontraktion verschwindet das Haubenvolumen fast vollständig (Faustgröße) Noch während der zweiten Haubenkontraktion beginnt der Hauben-Pansen-Pfeilers sich zu kontrahieren. Er bildet eine Barriere um den Inhalt im Pansen zu halten. Die Haube erschlafft, dabei bleiben die Hauben-Pansen-Pfeiler geschlossen. Die Kontraktionswelle läuft über die Kardia nach kaudal. Die beiden Längs-, kaudaler Haupt-, dorsaler Kranzpfeiler und dazwischenliegende Abschnitte der Pansenwand kontraheren sich. Dabei wird der Inhalt vom dorsalen in den ventralen Pansensack befördert. Die Kontraktion des ventralen Pansensacks (vorderer Haupt-, ventraler Kranzpfeiler), der dorsale Blindsack ist noch kontrahiert, befördert den Inhalt zurück in den dorsalen Pansensack. Der ventrale Pansen kontrahiert sich nie zusammen mit der Haube! Nach erschlaffen des ventralen Pansenpfeilers kontrahiert sich der ventrale Blindsack. B-Welle Sie dient zur Gasentfernung im Pansen und stellt sich als eine von kaudal nach kranial fortschreitende Kontraktion des dorsalen und ventralen Pansensacks dar. Beim Schaf kontrahiert sich nur der kaudoventrale Blindsack, beim Rind findet eine Kontraktion des kaudoventralen und des kaudodorsalen Blindsacks statt. % der Häufigkeit der Kontraktionsformen bei bzw. nach der Futteraufnahme beim Wiederkauen (Reurgination) im Ruhezustand unvollständig vollständige Ae A-Welle Welle unvollständige AWelle und BWelle vollständiger AWelle und BWelle 1% 27 % 5% 56 % 22 % 28 % 37 % 6% 10 % 35 % 25 % 22 % Psalter Motorik Die Psaltermotorik ist in den Hauben-Pansen-Zyklus mit integriert. Der Psalterkanal kontrahiert sich immer zusammen mit dem dorsalen Pansensack, nie zusammen mit dem Psalterkörper und der Haube. Der Psalterkörper kontrahiert sich unregelmäßig und anhaltend. Die Kontraktionen sind isometrisch. Die Funktion der Psaltermotorik ist die Differenzierung des Futters in feste und flüssige Bestandteile. Die Schlundrinnenlippen wirken wie in Filter, in dem noch großen und festen Bestandteile wieder zurück in die Haube und dann in den Pansen transportiert werden und die bereits zerkleinerte Nahrung weiter in Richtung Labmagen transportiert wird. Labmagen und Haube funktionieren wie eine Saug-Druck-Pumpe. Nach zwei Haubenkontraktionen wird das fein zermahlene Futter in 100 g-Portionen in den Psalterkanal gepreßt, der wiederum das Futter durch Unterdruck ansaugt. Die Schlundrinnenlippen sortieren dabei das grobe Futter aus. Nachdem das Futter in den Psalter gelangt ist, kontrahieren sich Psalterkanal und Psalterkörper, um den Nahrungsbrei portionsweise in den Labmagen zu pressen. Die Psalterblätter verzögern den Durchtritt der Ingesta und dienen zur Resorption von H2O und Nährstoffen. Hier werden die Gärungsvorgänge fortgesetzt. 222 Saugphase 1. Druckphase 2. Druckphase kontrahierte Haube schafft den kontrahierter Psalterkanal kontrahierter Körper schiebt Inhalt in erschlafften transportiert den Inhalt in den den Inhalt in Richtung Psalterkanal, der Körper ist erschlafften Körper Labmagen dabei kontrahiert 2.8 Ruktus, Eruptation Eine Kuh produziert ca. 500 l Gas am Tag, das 10 - 60 mal in der Stunde mit jeweils 0,5 - 6 l je Ructus abgelassen wird. Phasen des Ructus 1. 2. 3. 4. 5. 6. 7. Die Cardia liegt normalerweise unter dem Flüssigkeitsspiegel, nur nach der 2. Haubenkontraktion liegt sie kurz frei. Bei der 1. Haubenkontraktion gelangt das Futter in den Pansen und den Labmagen. Bei der 2. Haubenkontraktion kontrahieren sich auch die kranialen Pansenpfeiler und die Hauben-Pansen-Falte. Es bildet somit eine Barriere , so daß das Futter nicht mehr zurückströmen kann. Nach erschlaffen der Haube sinkt der Flüssigkeitsspiegel kurz ab. Die Cardia liegt frei. Durch die Kontraktion des dorsalen Pansens und der Unterstützung der Bauchpresse wird Druck auf die Gasblase ausgeübt, wobei die Haube immer noch erschlafft ist. Der Ructus erfolgt zu 1/3 nach der Kontraktion des dorsalen Pansensackes bei der A-Welle und zu 2/3 bei der B-Welle, weil hierbei die Kontraktionswelle von kaudal nach kranial verläuft und so das Gas leichter zur Cardia transportiert werden kann. Der Oesophagus füllt sich mit Gas, wobei die kranialen Sphincter geschlossen sind (kaudale Schlundkopfschnürer). Antiperistaltik des Oesophagus bei geschlossen kaudaler Sphincter. Reflektorischer Atemstillstand bei geöffneter Glottis. Die Pansengase gelangen in den Rachenraum und in den oberen Bereich der Trachea. Der Atemstillstand wird jetzt aufgehoben und ein Teil der Gase wieder eingeatmet (Resorption in der Lunge). Über den Blutkreislauf gelangen sie zu den Organen und in die Milch (Geruchs- und Geschmacksqualität wird dadurch beeinflußt). Der andere Teil wird ausgeatmet. Steuerung des Ructus Dehnungsrezeptoren im Pansen nehmen den intramuralen Gasdruck wahr. Über den Bauchvagus wird der Reiz zum Eruptationszentren weitergeleitet und der Ructus ausgelöst. 2.9 Pansengase Es entsteht hauptsächlich CO2 und CH4. Neben O2 und N2 sind außerdem Spuren von H2, H2S und CO enthalten. Die Zusammensetzung ist von Futter abhängig. O2 N2 CH4 gleich nach der Futteraufnahm e 3% 15 % 25 % CO2 55 % 4 Stunden später 0% 0% 30 % 70 % Wieso? wenig mitgeschluckt, wird schnell reduziert Resorption über die Pansenwand ins Blut CH4-Entstehung durch Bakterien, CO2 als H2-Akzeptor CO2-Entstehung durch Decarboxylierung von Säuren, Hydrolyse von Harnstoff und durch Hydrogencarbonat des 223 Speichels nur bei Fütterung nach Hungerperiode H2 2.10 Wiederkauen Phasen des Wiederkauens Der eigentliche Vorgang des Wiederkauens besteht aus 3 Teilen: Rejektion, Wiederkauen und Abschlucken. Die Rejektion ist der Transport der Ingesta zurück in die Mundhöhle. 1. 2. 3. 4. 5. 6. 7. 3 bis 7 Sekunden vor der eigentlichen Haubenkontraktion wird eine Extrakontraktion eingeleitet. Ansaugphase: tiefe Inspiration bei geschlossener Glottis erzeugt einen Unterdruck im Brustraum, wobei das Futter angesogen wird. Auspreßphase: Durch Expiration bei geschlossener Glottis unterstützt durch die Antiperistaltik des Oesophagus gelangt das Futter in die Mundhöhle. Erschlaffung der Kardiasphincter sofortiges Abschlucken der Transportflüssigkeit Wiederkauen mit Einspeichelung Abschlucken des Bissens vor der nächsten Kontraktion, Vermischung mit Hauben-Pansen-See Vorteile, Aufgabe Zerkleinerung der groben Futterbestandteile Anregung der Speichelsekretion (Pufferung der Säuren) Zunahme der Angriffsfläche für Mikroorganismen (leichtere Fermentation) Erleichterter Passage durch die Vormägen (durch die Schlundrinnenlippen) Intensität ist abhängig von ... Der Futtermenge Dem Raufuttergehalt der Rationsbestandteilen (pelletiert kurz; Heu lang) Der Struktur des Futters Innervation Mechanorezeptoren in der Vormagenwand werden gereizt. Die Reizweiterleitung erfolgt über den N. vagus zur Medulla oblongata, in der das Rejektionszentrum liegt. Es ist ein reflektorischer Vorgang, der bewußt unterdrückt werden kann. Was ist sonst noch so von Bedeutung? Wiederkauzeit pro Bissen: Gewicht eines Bissens ohne Wasser: 224 40 - 60 Sekunden 100 g Kieferschläge pro Bissen Wiederkauperioden Periodendauer: 1. Periode nach Futteraufnahme: gesamt Wiederkauzeit am Tag Gesamtfuttermasse: 40 - 60 10 - 20 15 - 60 Minuten 30 - 30 Minuten später 4 - 10 Stunden (1/3 Tag) 50 kg 2.11 Regulation des pH-Wertes Der normale Pansen-pH-Wert liegt zwischen 5,5 und 7,4. Die Abpufferung erfolgt normalerweise durch Bicarbonat und Phosphat im Speichel. Physiologischerweise nimmt die Aciditä nach der Futterzunahme zu, ist aber nach 10 Stunden wieder zum Ausgangswert zurückgekehrt. Einen Ansteig des pH-Wertes hat man bei Hunger zu verzeichnen. Puffersysteme NH4 NH3 + H H2PO4- HPO42- + H+ CO2 + H2O HCO3- + H+ Buttersäure Butyrat + H+ Propionsäure Propionat + H+ Essigsäure Acetat + H+ Milchsäure Lactat + H+ + + pKS 9,6 6,8 6,1 4,9 4,9 4,8 3,9 Konzentration [mmol/l] 10 - 100 10 - 24 4 - 80 > 40 (Abfall bei akuter Acidose) 30 (nüchtern), 75 - 160 (nach dem Fressen) 0,3 - 20 (normal), 40 - 140 (bei Pansenacidose) Puffer bei einem hohen pH-Wert Puffer bei einem niedrigem pH-Wert Bei einem regulären pH-Abfall, z. B. nach der Nahrungsaufnahme, wirkt der im Speichel enthaltene Hydrogencarbonat als Puffer. Reagieren die freiwerdenden Kationen mit den flüchtigen Fettsäuren, so puffert meistens der Acetat-Puffer. Fällt der pH-Wert unter 6, so puffern im wesentlichen nur noch die Salze der flüchtigen Fettsäuren. Puffermöglichkeiten sind abhängig von: Futterzusammensetzung (viel Stärke Abnahme des pH) Phosphat-, Hydrogencarbonatgehalt Menge des aufgenommenen Wassers Konzentration der freien Fettsäuren 2.12 Regulation der Vormagenmotorik Nervensystem Nerval werden die Vormägen durch den N. vagus und den N. splanchnicus versorgt. Dabei spielt der Vagus eine erheblich größere Rolle, denn er ist für alle motorischen Vorgänge lebensnotwendig. Der dorsale Ast zieht mediale und kaudale an die Haube, innerviert den Pansen, Psalter und den Labmagen. Der ventrale Ast innerviert medial und kranial die Haube, den Psalter und den Labmagen, 225 der nicht den Pansen. Bei Vagusdurchtrennung funktioniert weder die Motorik noch der Ructus. Es können eine mechanischen Impulse zum motorischen Zentrum der Medulla oblongata geleitet werden. Magenreflexe Die Magenreflexe werden über verschiedene Rezeptoren der Vormägen ausgelöst: Spannungsrezeptoren in der Pansenwand epitheliale Rezeptoren in Pansen und Haube Spannungsrezeptoren in Labmagen Schleimhautrezeptoren in Labmagen und Duodenum Dabei werden hemmende und erregende Impulse an die Medulla oblongata eitergeleitet: Erregend mäßige Haubendehnung Reizung der Backen Labmagen erhöhter Säuregrad hemmend Starke Hautdehnung Dehnung der Labmagenwand Schmerz pH-Abweichungen 3. Einhöhliger Magen 3.1 Anatomie Unterscheidungsmöglichkeiten einhöhlige Mägen (Fleischfresser, Schwein, Pferd) mehrhöhlige Mägen (Wiederkäuer) einfache Mägen (Auskleidung von einer mit drüsenhaltigem, einschichtigem Zylinderepithel bedeckten Schleimhaut) zusammengesetzte Mägen (besteht aus einem Teil drüsenloser, kutaner Schleimhaut - Pars nonglandularis und einer Drüsenschleimhaut - Pars glandularis) Fleischfresser Pferd Schwein Wiederkäuer einhöhlig-einfacher Magen einhöhlig-zusammengesetzter Magen einfachen-zusammengesetzter Magen mehrhöhlig-zusammengesetzter Magen Bau der Magenwand Die Magenwand ist von innen nach außen mit Schleimhaut, Tunica mucosa, Muskelhaut, Tunica muscularis und dem Bauchfellüberzug, Tunica serosa geschichtet. Am Magen selbst unterscheidet man verschiedene Zonen: Pars nonglandularis (kutane Schleimhaut, weißlich, derb; beim Pferd bildet eine wulstige, gezackte Falte, Margo plicatus, den Übergang zur drüsenhaltigen Schleimhaut: hier sind oft Parasitenlarven zu finden) Kardiadrüsenzone, Pars cardiaca Fundus- oder Eigendrüsenzone, Pars glandularis gastr. propr. (braunrot) 226 Pylorusdrüsenzone, Pars pylorica (graugelb, weißlich) Muskeln a) Schließmuskel das Mageneingangs, M. spincter cardiae b) Fleischfresser: relativ schwach, häufiges Erbrechen Schwein: mittelmäßig entwickelt Pferd: stark kaum Erbrechen Schließmuskel des Pförtners, M. sphincter pylori Fleischfresser: relativ stark vollfressen Schwein: unterbrochen durch Torus pyloricus ( mit Fettpolster), der als Ventil wirkt Pferd: zusätzlich M. sphincter antipylori 3.2 Aufgaben Aufnahme der zerkleinerten und eingespeichelten Nahrung Speicherung der Nahrung (proximaler Magen) Durchmischung von Verdauungssekreten und Weiterverdauung langsamer Vorschub des Nahrungsbreis Zerkleinerung und Weitertransport in den Zwölffingerdarm (distaler Magen) 3.3 Motorik Motorische Eigenschaften a) Speicherfunktion Die Speicherfunktion bezieht sich hauptsächlich auf den proximalen Magen. Dieser Teil besitzt eine relativ dünne Muskulatur mit einem aktiven Tonus, der sich dem Magenbinnendruck anpassen kann, aber keine peristaltischen Wellen aufweist. Der Magenbinnendruck sinkt bereits, bevor ein Bissen aus dem Oesophygus in den Magen übertritt (rezeptive Relaxation) und stellt sich dann auch auf ein größeres Volumen ein (adaptive Relaxation). Die Regulation erfolgt über nervale (N. vagus, Plexus myentericus), humorale (Noradrenalin, Adrenalin, Vip, NO) Reize und über gastrointestinale Hormone (Gastrin, CCK, Sekretin, GIP) Die abgeschluckten Nahrungsstücke lagern sich übereinander an, während die flüssige Nahrung an der Außenseite abfließen kann. Es bildet sich ein zwiebelartiger Nahrungskloß (außen Pepsin und HCL, innen Amylasen und Lipasen), der über langsame tonische Kontraktionen (1 - 3 Minuten), Richtung Pylorus bewegt wird. Die Auslösung der Kontraktion ist nicht myogen. b) Zerkleinerung und Weitertransport des festen Mageninhaltes Im mittleren Bereich liegen an der großen Kurvatur myogene Schrittmacherzellen mit langsamen Potentialwellen (slow wavers) deren Amplitude von dem Dehnungszustand der Magenwand abhängt. Erreicht bei Füllung des Magens das Membranpotential die Schwelle, treten SpikeAktivitäten auf, die im mittleren Abschnitt peristaltische Wellen auslösen. Beginnend an der 227 großen Curvatur und dem Antrum wandern sie in Richtung Pylorus. Nicht jede slow wave wird von einer Muskelkontraktion verfolgt, jedoch stehen sie mit ihnen im Zusammenhang. Die Regulation erfolgt weiterhin über nervale und humorale Reize. Die Muskelkontraktionen sind für die Vermischung, Zerkleinerung den Weitertransport der Nahrung, sowie für die Entleerung des Magens in das Duodenum verantwortlich. Gastrointestinale Hormone und Peptide Hormone Gastrin Sekretin Cholezystokinin Somatostatin Pankreatisches Polypeptid Urogastrone Enteroglucagon GIP (gastric inhibiting peptide) VIP (vasoaktive intestinale peptid) Substanz P Enkephaline, Endorphine Hauptfunktion Magensekretion (HCL, Pepsinogen, Schleimhaut) Steigerung der Magenmotalität Pankreassekretion (Bicarbonat) Hemmung der HCl-Sekretion Steigerung der Pepsinogensekretion Pankreassekretion (Enzyme) Gallenblasenkontraktion Hemmung der HCl-Sekretion Steigerung der Pepsinogensekretion Sekretionshemmung (Magen, Pankreas) Hemmung der intesinalen Motalität Generalhemmung für Gastrin, VIP, Motilin, CCK, Sekretin Sekretionshemmung (Pankreas) Sekretionshemmung (Magen) Sekretionshemmung (Magen, Pankreas) Förderung des Schleimhautwachstums im Duodenum Insulinfreisetzung, deshalb auch der Name glucosedependent insulinotropic peptide Hemmung der HCl-Sekretion, Magenmotalität Hemmung der Magensekretion Relaxation der glatten Muskulatur Stimulation der Pankreassekretion (Bicarbonat) und des gallensäurenunabhängigen Gallenflusses Hemmung der HCl-Sekretion Stimulation der Speicheldrüsen Kontraktion der glatten Muskulatur Steigerung der gastrointestinalen Motalität Hemmung der Kontraktion der glatten Muskulatur biologisch aktive Peptide Neuropeptide Ablauf der peristaltischen Welle Der Beginn der peristaltischen Welle liegt in Magenmitte, wobei die Ausbreitung nach distal erfolgt. Der Inhalt des Magens wird in Richtung Pylorus bewegt. Bei der Zunahme der Fortleitungsgeschwindigkeit bei geschlossenem Pylorus wird ein Teil des Mageninhaltes überholt und in den Magen zurückgepreßt bzw. zurückgeworfen. Die Kontraktionskraft ist stark genug um gesamtes distales Antrum zu verschließen, so wird nur ein kleiner Teil der Nahrung ins Duodenum befördert (der Durchmesser der Nahrung muß klein genug sein) und der weitaus größerer Teil wird in den Magen zurückgeworfen. Dabei reiben die einzelnen Partikel gegeneinander und können dabei noch weiter 228 zerdrückt und zerkleinert werden. Zwischen den einzelnen peristaltischen Wellen liegt eine Ruhepause. Substanzen, wie z. B. Cholezystokinin, Gastrin und Motilin verstärken die Kontraktion, während Sekretin, Glucagon, GIP, VIP und Somatostatin die Kontraktion hemmen. Magenentleerung Die Magenmotorik, v. a. die Entleerung zum einen über autonome Nerven, die über den Plexus coeliacus (Parasympathicus (N.vagus) und Sympathicus), Plexus gastricus, Plexus mesentericus cranialis, Plexua myentericus und Plexus submucosus. Die Magenentleerung ist abhängig vom Füllungszustand, der Partikelgröße und deren Viskosität. Zusätzlich steuert noch der Dünndarm über Chemorezeptoren die Entleerung, so daß saurer Inhalt viel langsamer entleert wird als neutraler Inhalt, hyperosmolarer langsamer als hypoosmolarer, Fette langsamer als Eiweiße, Eiweiße langsamer als Kohlenhydrate, usw. Die Rate der Magenentleerung ist abhängig von der Druckdifferenz zwischen Magen und Duodenum und dem Wiederstand im Pylorus. Der Tonus des Pylorus wird gesteigert durch CCH, Sekretin, GIP und Enteroglucagon, abgeschwächt durch Gastrin und Motilin. Kontraktion des leeren Magens Alle 90 - 120 Minuten erfolgen sog. Hungerkontraktionen. Der nüchterne Magen weist 3 verschiedene Phasen auf: 1. 2. 3. keine mechanische Aktivität schwache Kontraktionen starke Kontraktionen (Magenknurren) Auch während der Ruhepausen ist ein basaler elektrischer Rhythmus (BER) an Schrittmacherzellen zu erfassen, der zu unterschwelligen Depolarisationen führt. Ebenso rufen humorale Faktoren (Motilin) und vagale Efferenzen verstärkte Kontraktionswellen (N. vagus) hervor. Die ganzen Kontraktionen im nüchternen Zustand dienen dem Putzeffekt. Unverdauliche Teilchen werden hinausbefördert. 3.4 Schichtung des Magens Die Nahrung wird entsprechend der Aufnahme geschichtet. So liegt die zuletzt aufgenommene Nahrung an der kleinen Curvatur und die bereits am längsten aufgenommenen Teile nahe an Pylorus. Durch den Muskeltonus wird der Inhalt des proximalen Magens langsam in den unteren Abschnitt geschoben. Die Flüssigkeiten fließen an der Innenwand in den distalen Abschnitt. Die eigentliche Verdauung beginnt außen mit Pepsin und HCL. Da der Magensaft so nicht mit der gesamten Nahrung durchmischt wird, bleibt er konzentrierter und damit wirkungsvoller. Von innen wird der Bolus durch Amylase und Lipase weiterverdaut. Neue Nahrungsteile lagern sich zwiebelförmig an. 3.5 Motalität des Drüsen- und des Muskelmagens bei Vögeln 229 Die Vögel nehmen die Nahrung auf, können sie aber wegen der fehlenden Zähne nur bedingt zerkleinern. Zahlreiche Speicheldrüsen sezernieren einen schleimigen Speichel, der die Gleitfähigkeit der Nahrung steigert. Nach dem Abschlucken gelangt die Nahrung nicht direkt in den Magen, sondern wird im Kropf gespeichert. Das Futter wird durch Trinkwasser und Speichel eingeweicht und aufgenommene Körner können so quellen. Portionsweise wird der Kropfinhalt in den Drüsenmagen abgegeben. Ohne längerem Aufenthalt dort, wird es weiter in den Muskelmagen transportiert. Der Muskelmagen übernimmt die Kaufunktion und wird deshalb auch als Kaumagen bezeichnet. Die Nahrung pendelt zwischen Muskel- (Zerkleinerung) und Drüsenmagen (Eiweißverdauung durch Salzsäure und Enzyme) hin und her: 1. 2. 3. 4. Kontraktion des dünnen Muskels schiebt die Digesta in den Dünndarm 2 - 3 peristaltische Wellen im Duodenum Kontraktion des dicken Muskels , so daß die Digesta in den Drüsenmagen geschoben werden Drüsenmagenperistaltik befördert die Digesta wieder in den Muskelmagen 3.6 Magensekretion Bestandteile und deren Funktion Bestandteile Funktion Es ist eine Vorstufe des eiweißspaltenden Enzyms Pepsin. Es hat sein WirkungPepsinogen soptimum bei einem stark sauen pH-Wert (1,8 - 3,5). Es ist eine Endopeptidase, Prorennin (Kalb) d. h. spaltet Proteine und Peptide in der Mitte und Casein durch Säurehydolyse. Das Rennin dient zur Ausfällung des Caseins beim Kalb. Es ist ein Labferment und hauptsächlich im Magen von noch saugenden Kälbern vorhanden. Es wird durch HCl aktiviert und hat sein Wirkungsoptimum bei Chymosin einem pH-Wert von 4 - 5. Es ist eine Endopeptidase und spaltet casein ohne Säurebildung. Im Laufe des Lebens wird es allmählich durch Pepsin ersetzt. es wird von der Pylorusschleimhaut produziert und spaltet Fett in Diglyceride Magenlipase (wichtig für Schwein und Jungtiere) Der gesamte Magen wird mit einer dicken Schleimschicht überzogen, die permanent reproduziert wird (hohe Regenerationsfähigkeit - alle 3 Tage neu). Sie dient Mucine zur Gleitfähigkeit des Chymus und schützt somit auch vor mechanischer Bean(Schleim) spruchung. Sie schütz auch vor Säureschäden und vor Selbstverdauung. Die Schleimzellen nehmen Wasser auf gegen Austrocknung auf. Beide Bestandteile sind die Vorraussetzung der Vitamin B12-Absorption im Ileum. Das R-Protein, ein Vitamin B12-bindendes Protein, nimmt es im sauren pH Intrinsic-Faktor des Magens auf. Im Verlauf wird es an den Intrinsic Faktor gebunden, wodurch R-Protein es vor Proteasen geschützt wird. Bei einem Mangel an Vitamin B 12 hat man ein Krankheitsbild der perniciösen Anämie. HCl dient zur Fäulnisvermeidung (bakterizide Wirkung) und zur Denaturierung Salzsäure von Eiweiß (Eiweißverdauung). Des weiteren ist ein tiefer pH-Wert die Vorraussetzung der Pepsinaktivierung und dessen Wirkung. Belegzellen sezernieren H+, K+ und Cl-, Schleimzellen Na+, K+, Cl- und HCO3-. Sie nehmen in gleichen Anteilen zu, die Konzentration von Na+ hingegen ab. Elektrolyte HCO3- reagiert im Magen zu H2CO3 H2O + CO2 Gastrin endokrine Funktion Magendrüsen95 95 Kardiadrüsen: Haupt- und Nebenzellen, Fundusdrüsen: Beleg-, Haupt- und Nebenzellen und Pylorusdrüsen: Haupt- Neben- und G-Zellen 230 Zellen Hauptzellen Belegzellen Nebenzellen G-Zellen Lage in tieferen Regionen vereinzelt zwischen Hauptzellen und Mittelteil an Magenoberfläche und im Drüsenhals in der Epithelschicht des Antrum Substanz Pepsinogen im Salzsäure und Intrinsic-Faktor Schleim und HCO3Gastrin Magensaftsekretion Die Sekretion wird über Gastrin gesteigert, das ins Blut abgegeben wird. Man kann eine basale (interdigestive) und eine stimulierte (digestive) Phase unterteilen. In der Nüchternperiode sezernieren die Zellen ca. 15 % des Sekretes. Bei der Nahrungsaufnahme und damit Auslösung durch einen adäquaten Reiz hin, unterscheidet man 3 weitere Phasen: a) Kephale Phase Auslöser sind Geruch, Geschmack, Vorstellung und Anblick. Die Sekretion ist dabei zentralnervös induziert. Der Reiz wird vom ZNS übe den N. Vagus zum Magen geleitet und löst dort eine Vagusinguzierte Gastrinfreisetzung aus. Die Sekretion beträgt daraufhin ca. 45 % der gesamten Sekretion b) Gastrale Phase Auslöser ist eine Magendehnung und chemische Einflüsse bestimmter Nahrungspartikel. Es folgt eine reflektorische Vermittlung über den N. vagus und intramurale Reflexwege. Chemische Reize (Eiweißprodukte, davon bestimmte Aminosäuren, Ca2+, Alkohol (Aperitiv-Effekt) und Coffein) fördern die Sekretion von Gastrin, Somatostatin hemmt diese und wird bei einem pHWert < 3 im Antrum ausgeschüttet. c) Intestinale Phase Auslöser sind Dehnung des Dünndarm, Eiweißprodukte, pH-Wert, Fette und hyperosmolarer Chymus. Die Regulation der Magensaftsekretion: tritt saurer, stark fetthaltiger oder hyperosmolarer Chymus in das Duodenum erfolgt die Freisetzung von Sekretion zur Hemmung der HCl-Produktion im Magen. Die Pepsinogenproduktion wird stimuliert. 3.7 Mechanismus der Salzsäuresekretion Belegzellen sind gekennzeichnet durch Mikrovili, die in ihrer Membran die Protonenpumpe, K +-H+ATPase, enthält und durch intrazelluläre Canaliculi die auf der apikalen Seite der Membran münden. Nach der Stimulation fusionieren die Tubulovesikel mit den Canaliculi (Oberflächenvergrößerung), in die ebenfalls ATPasen eingebaut werden. Dadurch wird H+ gegen K+ ausgetauscht. Das H+ stammt aus der Dissoziationsreaktion der Kohlensäure, wobei Cl- in die Zelle rein und HCO3- aus der Zelle raus in das Blut transportiert wird. Am Höhepunkt kommt es zur Alkaliflut, d. h. mit den H +-Ionen werden auch K+ und Cl- angegeben. Dem Transport der Ionen folgt noch ein osmotisch bedingter Wassereinstrom. 3.8 Bildung und Freisetzung von Pepsin 231 Die Pepsinogene werden durch die HCl-Wirkung, Abspaltung eines blockierenden Peptids, zu den wirksamen eiweißspaltenden Enzymen, Pepsine. Sie werden aus den Hauptzellen in einem Gemisch aus Proteasevorstufen und Pepsinogen sezerniert. beim Kalb: Prorennin Rennin sonste Tiere: Pepsinogen Pepsin 3.9 Sekretion des Intrinsic Factors Der Intrinsic-Faktor ist ein Glycoprotein und entscheidend für die Resorption des Vitamin B12. Im Magen ist das Vitamin B12 hauptsächlich an das R-Protein aus dem Mundspeichel gebunden und bildet damit einen magensaftresistenten Komplex. Nach Spaltung durch die Pankreasenzyme erfolgt die Bindung an den Intrinsic Faktor, der wiederum resistent gegen die Proteolyse und Resorption im oberen Dünndarm ist. Durch rezeptorvermittelte Exozytose gelangt der Komplex in das Pfortaderblut, mit es zur Leber transportiert wird. Dort wird das Vitamin B12 entweder gelagert oder zum Weitertransport an Transcobalamin gebunden. 3.10 Hormonelle und neurale Regulation der Motorik Neuronale Regulation a) BER (basaler elektrischer Rhythmus) Slow waves führen zu unterschwelligen Depolatisationen und zu Kontraktionen in variablen Abständen. Die Ausbreitung erfolgt elektrotonisch über Cajal-Zellen im Interstitium zwischen Längs- und Ringmuskulatur. b) Enerales NS (ENS) Es beinhaltet verschiedenartige Neurone mit vielen Neurotransmittern- und Peptiden, submucöses zu einem myenterischen Geflecht verknüpft sind. Es ist unabhängig von extrinsischer Innervation. Dehnungsafferenzen führen zu zwei intramuralen Reflexen, die in aboraler Richtung verlaufen: c) Kurze Erschlaffung der Ringmuskulatur über serotonerge Interneurone (durch VIP übertragen) Cholinerge Kontraktion der Ring- und Längsmuskulatur, so lange wie der Dehnungsreflex da ist, so daß dies zur Peristaltik führt. Neurovegetative Innervation Der Parasympathicus fördert die Sekretion und Motorik über cholinerge-muskarinerge Neurotransmitter, der Sympathicus hemmt die Sekretion und Motorik über noradrenerge Nervenendigungen. Dabei beschränkt sich die Sympathicuswirkung auf die Hemmung der cholinergen Neurotransmission. Sie ist beeinflußbar durch Agonisten und Antagonisten (Atropin) d) ZNS 232 Das ZNS ist mit dem ENS über neurovegetative Innervation verknüpft. Permanente Afferenzen von Dehnungs-, Chemo-, Glucorezeptoren regulieren die Darmmotorik mit. Vielleicht wird es auch über das Eßverhalten gesteuert. Reflektorische Beeinflussung durch viscerosensible Afferenzen. Humorale Regulation Hier erfolgt die Wirkung nach einer bestimmten Latenzzeit, da die Distanz der Diffusionsstrecke (Freisetzung - Zielzelle) mitberücksichtigt werden muß. Die Einteilung erfolgt über die Übertragungsart (auto-, para-, endokrin), wobei ein Spezialfall die neurokrine Freisetzung aus Nervenendigungen ist. Die Darmwand enthält viele endokrine Zellen, wobei eine Zelle ein bestimmtes Hormon oder Peptid produziert. Hormonpeptide (Hormone sind nur Gastrin, Sekretin, Cholezystokinin (CCK) und GIP) werden als Vorläuferproteine im Golgi-Apparat produziert und als Sekret in Vesikel verpackt. Die Freisetzung erfolgt nach einem adäquaten Reiz. Für die Motorik fördernd: Gastrin, Cholezystokinin, Motilin, Serotonin hemmend: Sekretin, Somatostatin, Adrenalin Sympathicus: Erschlaffung der Muskulatur, Kontraktion der Sphinkteren Parasympathicus: Erschlaffung der Sphincteren, Kontraktion der Darmmuskulatur 3.11 Erbrechen, Vomitus Ablauf Salivatio (Speichelsekretion) Aniperistaltik im Duodenum und im Magen Inspiration bei geschlossener Glottis (Würgen) -> Steigerung des thorakalen Unterdrucks Erschlaffung des kaudalen Ösophagussphincters und Ansaugen des Mageninhaltes in den Ösophagus Expiration bei geschlossener Glottis Druckanstieg im Thorax führt zum Übertritt des Ösophagusinhaltes in die Mundhöhle Es kann sich auch die Gallenblase kontrahieren, so daß die Galle durch die Antiperistaltik im Duodenum und Erschlaffung des Pylorus ebenfalls mit austreten. Aktivierung Dehnungs- und Chemorezeptoren in der Magen-Darm-Mucosa geben über vagale und splanchische Afferenzen Informationen an das Brechzentrum (von Area postrema innerviert) weiter. Auch bei Reizung des Gleichgewichtsorgans (Reisekrankheit, Schwerelosigkeit) oder olfaktorischen Reizen (Medizinstudenten im Sezerniersaal) kann dies ausgelöst werden. Funktion Motorisches Programm zum Entfernen von Schadstoffen 233 4. Dünndarm 4.1 Motorik des Dünndarms Funktion Durchmischung des Chymus mit Verdauungssekreten mit Weitertransport bringt die Nahrung mit der Bürstensaummembran der Epithelzellen Anatomie und Funktion der Darmmuskulatur Muskularis propria mit Ring- und Längsmuskulatur für Einschnürungen und Pendelbewegungen Muskularis mucosae zum Durchmischen Myofribillen dienen als Zottenpumpe zur Sekretion Aktin- und Myosinfilamente in Mikrovilli sind wichtig für die lokale Durchmischung Formen der Dünn- und Dickdarmmotorik a) Mischbewegungen b) Pendelbewegungen (rhythmische Kontraktion der Längsmuskulatur) rhythmische Segmentationen (stationäre, circuläre Ringkontraktionen benachbarter Bereiche) nichtpropulsive Peristaltik (lokale, ringförmige Kontraktionen über eine kurze Strecke ohne nennenswerte Vorwärtsbewegung) Propulsive Peristaltik Die Schnürwellen verlaufen in Richtung anal. Die Peristaltik an sich ist ein Komplex aus aszendierender Kontraktion und deszendierender Relaxation, die sich nach distal ausbreitet. Transmitter der Kontraktion sind Acetylcholin und Substanz P, die Transmitter für die Relaxation sind VIP, ATP und NO. Im Kolon werden sie als „Massenbewegung“ bezeichnet. Sie werden durch Dehnung der Darmwand ausgelöst und Überlagern die Durchmischungsvorgänge. Sie dienen dem Weitertransport des Chymus c) Antiperistaltik Die Schnürwellen verlaufen Richtung oral. Im Dünndarm treten sie nur kurz vor dem Erbrechen auf. Im Dickdarm sind sie physiologischerweise vorhanden, weil sie hier der Verlängerung der Verweildauer in der „Fermentationskammer“ dienen. Bei einigen Spezies dienen sie auch zur Füllung des Blinddarms. 4.2 Pankreas Zusammensetzung des Pankreassekret 234 Die Enzyme und Proenzyme stammen aus zymogenen Granula, eine Speicherform der Zellen, die den Schaltstücken der Acini aufsitzen. 90 % der Enzyme sind proteolytisch (Endo- und Exopeptidasen). Die Proenzyme werden im Duodenum erst durch eine in der Dünndarmschleimhaut gelegene Enteropeptidase (Endokinase) aktiviert. Enterokinase Trypsinogen Trypsin Trypsin Proenzym Enzym Im Pankreassaft enthaltener Thrysininhibitor hemmt die Wirkung des Trypsin zum Schutz vor Selbstverdauung. Lipase, Amylase und Ribunukleasen werden aktiv sezerniert. Im Pankreassekret sind weiterhin noch Elektrolyte, wie Na+, HCO3-, Cl- und K+ enthalten. Proenzyme Endopeptidasen: Trypsinogen Chymotrypsinogen Proelastase Exopeptidasen: Procarboxylase A Procarboxylase B Proaminopeptidase Nukleasen: aktive Enzyme Spaltstoffe Produkte Trypsin Chymotrypsin Elastase Proteine, Polypeptide Proteine, Polypeptide Proteine, Elastin Poly- und Oligopeptide Poly- und Oligopeptide Poly- und Oligopeptide Carboxylase A Carboxylase B Aminopeptidase Poly- und Oligopeptide Poly- und Oligopeptide Poly- und Oligopeptide Aminosäuren Aminosäuren Aminosäuren Ribonuklease Desoxyribonuklease RNA DNA Nukleotide Nukleotide Lipase Triacylglycerine Phospholipase A Phospholipide Fettsäuren, Monoacylglycerine Fettsäuren, Lysolezithin -Amylase Maltase Stärke, Glycogen Maltose lipidspaltende Enzyme: Prophospholipase A kohlenhydrat-spaltende Enzyme: Oligosaccharide, Maltose Glucose Auscheidung Die basale Rate beträgt 2-3 % Elektrolyte und 10 %Enzyme. Bei Nahrungsaufnahme wird die Sekretion durch den N. vagus und CCK stimuliert. Die in der Membran sitzenden Rezeptoren für Acetylcholin und CCK aktivieren über DAG und IP3 Proteinphosphorylierungsvorgänge, die zur Exozytose von Proenzymen und Enzymen führen. Es existieren wiederum 3 Phasen: Kephale Phase: Sekretionssteigerung in Acinuszellen durch Acetylcholin, Bicarbonatsekretion durch VIP Gastrale Phase: Sekretionssteigerung Intestinale Phase: Sekretionssteigerung durch gastrointestinale Hormone Funktion 235 Enzyme und Proenzyme dienen der Eiweiß-, Fett-, KH- und Nukleinsäureverdauung, wobei die Proenzyme erst im Dünndarm aktiviert werden durch Trypsin (Schutz vor Selbstverdauung). Das Pankreassekret an sich ist alkalisch, die Enzyme wirken aber am besten beim neutralen pH. Im Duodenum vermischen sich Magensaft und Pankreassaft und werden so neutralisiert, v. a durch Elektrolyte wie Bicarbonat. Regulation der Pankreassekretion Botenstoff Wirkung extrazellulär intrazellulär Acetylcholin, IP3 und DAG, Cholezystokinin (CCK) Aktivierung über Ca2+ Sekretin, VIP cAMP Somatostatin cAMP Acinuszellen Enzymsekretion und Elektrolytausscheidung Sekretion Gangzellen Elektrolytsekretion aus den Epithelzellen Sekretion 4.3 Galle und Gallensekretion Anatomie der Gallenblase, Vesica fellea In den Hepatozyten entstehende Filtrat wird in die Gallenkapillare (Canaliculi) ausgeschieden, diese anastomosieren und münden in die intralobulären Gallengänge ein. Diese vereinigen sich zum Ductus hepaticus. Der Ductus cysticus bildet die Verbindung zwischen der Gallenblase und dem Ductus hepaticus. Nach der Vereinigung dieser beiden Gänge, wird der Rest als Ductus choledochus bezeichnet, der im Dünndarm mündet. Zusammensetzung Gallensäuren (Cholsäure, Chenodesoxycholsäure (primären Gallesäuren, Desoxycholsäure und Lithecholsäure: sekundären Gallensäuren, konjugiert mit Taurin und Glycin) Cholesterin Gallenfarbstoffe (Abbauprodukte des Hämoglobin, z. B. Bilirubin, Biliverdin, konjugiert mit Glucuronsäure) Phospholipide (Lecithin) fettlösliche Substanzen, z. B. Xenobiothika, Steroidhormone Fettsäuren Ionen (Na+, K+, Cl-, HCO3-) Elektrolyte Primärsekret (Lebergalle) und in den Dünndarm abgegebene Blasnegalle Flüssigkeit unterscheiden sich in Konzentration und Verteilung der Bestandteile. Mechanismus a) 96 Gallensäurenabhängige Sekretion96 Korrelation zwischen Menge der Gallensäureausscheidung und den Gallenvolumina/ - Fluß 236 Gallensäuren werden in den Hepatozyten (primäre Gallensäuren: Chenodesoxycholsäure, Cholsäure) aus Cholesterin gebildet. Aus dem enterohepatischen Kreislauf (Rezirkulation) kommen über die Pfortader sekundäre Gallensäuren (Desoxycholsäure, Lithocholsäure) hinzu. In den Hepatozyten gelangen sie über Na+- abhängige Transportsysteme und werden in der Leber mit Glycin oder Taurin konjugiert und passiv über Carrier in die Gallenkapillaren abgegeben. Zusammen mit der Galle wird auch Bilirubin (Gallenfarbstoff aus dem Abbau des Häms), Cholesterol, Phospholipide, Steroidhormone und Xenobiothika ausgeschieden. Sie wurden vorher aus dem Blut aufgenommen und in der Leber metabolisiert, z. T. auch mit Gallensäuren konjugiert. b) Gallensäurenunabhängige Sekretion Treibende Kraft ist die aktive Sekretion von HCO3- (wie bei der Pankreassekretion). Von der Blutseite gelangt H2CO3 in die Zelle, wird dort zu HCO3- und H+; HCO3- wird sekretiert, das H+ über Na+-H+-Austauscher wieder ins Blut zurückgebracht. Es kann dort wieder mit HCO 2- zu H2CO3 werden, das wieder in die Epithelzellen aufgenommen werden kann. In der Gallenglase wird das Gallensekret konzentriert. Enterohepatischer Kreislauf a) Gallensäuren Die Gallensäure werden wieder komplett resorbiert. Nach ihrer Passage durch den Dünndarm, kommt es zur terminalen Rückresorption im Ileum (passive Resorption im Dünndarm, aktive Resorption im Ileum). Der Resorptionsmechanismus besteht aus einem Na +-Cotransport, so daß die Gallensäuren in den Pfortaderkreislauf eintreten können. Ein Teil tritt in den Dickdarm über (entspricht in etwa der täglichen Neusynthese). Der Gallensäurepool zirkuliert ca. 6 - 10 x am Tag. b) Bilirubin Das Bilirubin ist ein Abbauprodukt des Häm aus dem Hämoglobin. Die Zwischenstufe Biliverdin wird zu Bilirubin und dann an Glucuronsäure angelagert. Hepatozyten extrahieren an Albumin gebundenes Bilirubin und sezernieren es als Digluconid in die Canaliculi. Im Darm wird das Urobilinogen (Resorption 15 %), Urobilin wird zu Stercobilinogen, Sternobilin Abbauprodukte werden resorbiert und über die Pfortader wieder in die Leber transportiert. Ausscheidung nach teilweiser Rezirkulation über die Leber im Stuhl und durch die Nieren. Ikterus, Gelbsucht Beim Ikterus liegt eine gestörte Ausscheidung der Hämabbauprodukte vor. Er kann verschiedene Ursachen haben: a) Hämolytischer Ikterus (prähepatisch) 237 b) Hepatozellulärer Ikterus (intrahepatisch) c) vermehrter Eryabbau Billirubinbildung ist stark erhöht Leber kann angefallenes Bilirubin nicht vollständig verarbeiten Ansteig des primären - nicht konjugierten - Bilirubins im Blut Schädigung der Leberzellen (toxisch, infektiös) Störung der Konjugation Störung des Transportes in die Leberzelle Übertritt von Glucuronisierten Gallenfarbstoffen ins Blut bzw. ungenügende Aufnahme der primären Gallenfarbstoffe Ansteig des primären und sekundären Gallenfarbstoffs im Blut Verschlußikterus (posthepatisch) Abflußstörung normal produzierter Galle Durch Anstau bedingtes Übertreten von konjugierten Galenfarbstoffen ins Blut Ansteig des konjugierten Bilirubins im Blut häufig durch erhöhten Druck im Lebergewebe sekundäre Schdigung der Leberzellen Fettemulgierung durch Galle Gallensäuren haben einen amphiteren Charakter (hydro- und lipophil) und bilden somit filmartige Grenzschichten zwischen Öl und Wasser oder Micellen. Sie dienen der Fettemulgierung im Dünndarm als wichtige Vorraussetzung für die Fettverdauung durch Pankreaslipasen. Fetttröpfchen werden durch Mizellenbildung eingeschlossen, wobei alle fettlöslichen Stoffe aufgenommen werden können (Bildung von gemischten Micellen). So werden z. B. Cholesterin, Fettsäuren, Phospholipide und fettlösliche Vitamine) aufgenommen. Eine prozentuale Abnahme der Gallensäuren unter > pH 4 führt zur Lipidentmischung und Kristallbildung (Cholesteringallensteine) Regulation der Lebersekretion aktive Cl- - Sekretion Bicarbonataustauscher wasser und Ionen fließen mit Sekretion fördert HCO3- - Ausscheidung in Gallenblase: Verdichtung der Galle, Anstieg der Konzentration Kopplung der Motorik des Dünndarms (Putzmechanismus), starke Kontraktion löst Gallenglasenkontraktion aus, Nahrungsresteentfernung. Gallenblasenmotorik VNS Rückresorption von Gallensäuren stimuliert Gallensekretion 238 pH im Duodenum sinkt, Sekretion steigt an, Sekretion von HCO3Lipide CCK steigt an Gallenblasenkontraktion CCK im Blut hoch, Erschlaffung des Sphincter oddii (zwischen Ductus choledochus und Dünndarm) Relaxation der Galleblase durch Pankreatisches Polipeptid, VIP und Somatostatin 4.4 Sekretion der Darmschleimhaut und dessen Regulation Brunnersche Drüsen Sekret gleicht den Pankreassekret. Wenn der pH-Wert ansinkt, fördert das die Sekretion von Somatostation und VIP, so daß -Amylasen, Peptidasen, wenig Mucine und viel Bicarbonationen ausgeschüttet werden. Dafür verantwortlich sind submucöse, tubuloalveoläre Drüsen im Duodenum. Die Sekrete dienen dem Schutz der Schleimhaut, v. a. die Bicarbonatsekretion aus den Brunnerschen Drüsen des Darmepithels und dienen zum Schutz der Schleimhaut durch Bildung von pH-neutralen Zonen. Becherzellen Die Becherzellen befinden sich im Dünn- und Dickdarm. Sie dienen der Schleimsekretion und Glucoproteinenen, um eine Schutzschicht auf der Darmmucosa zu Bilden. Kryoten, Lieberkühnsche Drüsen Sie befinden sich im Dünn- und Dickdarm. Sie sezernieren sekundär aktiv Cl- über basolaterale Na+K+-2 Cl- -Cotransporter. Sie haben eine physiologische Spülfunktion und haben eine wichtige pathophysiologische Bedeutung bei der Entstehung sekretorischer Diarrhoe. 4.5 Regulation des pH-Wertes Wenn der pH-Wert sinkt kommt es zur Ausscheidung von Sekretin, das die Sekretion von Bicarbonat aus der Gallenblase, dem Pankreas, den Becherzellen und Brunnersche Drüsen ansteigen läßt. Die Bicarbonatschicht dient zur Bildung von pH neutralen Zonen und zur Abpufferung der Säureäquivalente aus dem Magen. Über eine gastroduodenale Rückkopplung wird die Magenmotorik gehemmt. 4.6 Körpereigene Verdauung der Proteine Allgemein besteht die Verdauung aus Sekretion (Abgabe von Verdauungsenzymen und Flüssigkeiten zur Verdauung (Spaltung) hochmolekularer Nahrungsbestandteile) und der Resorption (Aufnahme der niedermolekularen Bruchstücke aus dem Darm ins Darmepithel). Die Proteine an sich werden durch Expopetidasen (spalten vom jeweiligen terminalen Ende) und Endopeptidasen (spalten von innen). Dazu gehören Enzyme aus dem Pankreassekret, Pepsin aus dem Magen und Bürstensaumpeptidasen. Die Di- und Tripeptide werden in das Cytosol der Darmepithelzellen aufgenommen und hier durch Aminopeptidasen, Tripeptidasen und Dipeptidasen in die Aminosäuren zerlegt. 239 Beteilgte Enzyme Die Enzyme werden in ihrer inaktiven Form in den Hauptzellen der Magendrüse produziert und durch HCl im Magensaft aktiviert, z. B. Pepsinogen. Die Acinuszellen des Pankreas produzieren Trypsinogen, Chymptrypsinogen, Procarboxypeptidase, Proelastase, die durch Trypsin bzw. der Enterokinasen aktiviert werden. Peptidasen der Bürstensaummembran Orte der Proteinverdauung a) Magen Hier erfolgt das Andauen der Proteine durch Pepsin und die Denaturierung der Proteine (Ausfällen) durch das HCl. b) Darm Hier erfolgt die Weiterverdauung durch pankreatische Proteasen. Durch koordinierte Hydrolyse entstehen aus den Proteinen Oligo- und Aminosäuren. Auch in der Bürstensaummembran liegen Peptidasen zum Weiterabbau. Absorbierbare L-Aminosäuren, Di- und Tripeptide werden zuerst in einer intrazellulären Hydrolyse zu freien AS und dann ins Pfortaderblut abgegeben. Die Abbauprodukte können bis zu 40 % absorbiert werden. Aktivierung der Peptidasen im Darmlumen Startenzym ist die Enterokinase, die in der Bürstensaummembran lokalisiert ist. Sie spaltet Trypsinogen zu Trypsin, das dann wiederum verschiedene Enzyme katalysiert: Chymotrypsinogen Chymptrypsin Proelastase Elastase Procarboxypeptidase Carboxypeptidase Resorption von Aminosäuren und Oligopeptiden Transportsysteme in der Bürstensaummembran Natriumabhängige Aminosäureresorption Sekundär aktiver Transport von Di- und Tripeptiden 4.7 Körpereigene Kohlenhydraverdauung Polysacharide Stärke Glycogen (Cellulose) Abbau von Stärke 240 Die -Amylase spaltet Stärke und Amylose in Maltose und Maltotriose. Amylopektin durch das Enzym -Dextrin zu Maltose und Malotriose. In der Membran liegen weitere Enzyme für den weiteren Abbau der Disaccharide. Enzym Maltase -Dextrinase Saccharase Lactase Trehalase Substrate -Dextrin, Maltotriose, Maltose -Dextrin, Maltotriose, Maltose Maltotriose, Maltose, Saccharose Laktose Trehalose Endprodukt Glucose Glucose Glucose, Fructose Glucose , Galaktose Glucose Resorption der Kohlenhydrate Die Glucose wird über einen 2 Na+-Glucose-Cotransport (erleichterte Diffusion) und parazelluläre Sättigung transportiert. Beim sekundär aktiven Transport sind noch folgende Systeme daran beteiligt: Beteiligung eines speziellen Carriers Transport zeigt Sättigung Energetisierung durch Na+-Gradienten Transport gegen den Konzentrationsgradienten möglich Die Fructose wird über erleichterte Diffusion in die Zelle aufgenommen. Daran beteiligt sind: Beteiligung eines speziellen Carriers Transport zeigt Sättigung Transport nicht entgegen des Konzentrationsgradienten möglich 4.8 Körpereigene Verdauung der Fette Luminale Fettverdauung Beim Nichtwiederkäuer erfolgt im Speichel und im Magen die Verdauung der Fette durch Säurelipasen mit zusätzlicher grober Emulgierung. Hier findet noch keine Resorption statt. Beim Wiederkäuer ist das etwas anders: Abbau von Triglyceriden durch bakterielle Lipasen im Pansen Vollständige Lipolyse zu Glycerin und freien Fettsäuren Keine Resorption mittel- und langkettiger Fettsäuren Hydrierung ungesättigter Fettsäuren. Die Lumenphase im Dünndarm besteht aus: Emulgierung durch Gallensäuren der Nahrungsfette Enzymatische Spaltung in Fettsäuren -Monoglyceride, Cholesterin und Lysophospholipasen Solubilsierung durch gemischte Micellen 241 Enzyme Lipolytische Enzyme des Pankreas sind: Pankreaslipase (Aktiv) Procalipase (inaktiv) Prophospholipase(inaktiv) Cholesterinesterase (Aktiv) Vorgänge bei der Verdauung im Darmlumen Das Fetttröpfchen trifft auf eine Micelle und wird so mit einem Überzug aus Gallensäuren versehen. So können Calipasen und Lipasen mit dem Abbau der eingeschlossenen Triglyceride beginnen. Es kommt zur Bildung gemischter Micellen aus den Spaltprodukten der Lipolyse und Gallensäuren. Die Spaltprodukte sind: Fettsäuren, -Monoglyceride, Cholesterin und Lysophospholipasen. Funktion der Gallensäuren bei der Verdauung 1. 2. 3. 4. 5. Emulgierung der Fette durch Bildung einer monomolekuläaren Schicht um Fetttröpfchen und gleichzeitiger Verringerung der Oberflächenspannung Erhöhung der Effizienz der Pankeaslipase durch Erniedrigung des pH-Oprtimums von pH 8 - 9 auf pH 6 - 7 Solubilisierung der Spaltprodukte aus der Lipolyse durch Bildung gemischter Micellen Micellen als Träger der Lipidmoleküle, da sie alleine nicht wasserlöslich sind und so zur Bürstensaummembran für Absorption transportiert werden können Aktivator für einige Lipasen Spaltung von Phospholipid Phospholipase A2 Cholesterinester Cholesterinesterase freie Fettsäuren + Lysophospholipid freie Fettsäuren + Cholesterin Resorption Die Penetrationsphase ist die Aufnahme der Spaltprodukte aus dem Epithel durch erleichterte Diffusion. Im Darmepithel werden wieder Triglyceride (Wiederaufbau der Triglyceride über Monoglyceridweg oder den Glycerinphosphatweg) aufgebaut, die dann zur Bildung von Chylomikronen mit intrazellulären Apolipoproteinen dienen. Triglycerid (Wideraufbau) + Apolipoproteien Bildung von Chylomikronen Die Chylomikronen gelangen über Exozytose in die Lymphbahn und dann in die Blutbahn und werden so zu den einzelnen Organen transportiert, 242 6. Dickdarm 6.1 Motorik s. Dünndarmmotorik Besonderheiten: a) Passage durch das Ostium ileocaecale b) Caecumkontraktionen beim Pferd c) Gefördert durch den Druck im Ileum Gehemmt durch den Druck im Caecum Segmentierungsbewegungen Hin und Herschieben des Darminhaltes zwischen den Haustiern Durchmischung des Caecuminhaltes Antiperistaltik vom Caecumkopf bis zur -spitze Verlängerung der Verweildauer Peristaltik: Koordinierte Kontraktion der Längs- und Ringmuskulatur in Form von Kontraktion von der Spitze zum Körper -Y Inhalt gelangt in den Caecumkopf Kontraktion Caecumkopf -Y Entleerung in das Colon ascendens durch das Ostium caecocolium Gastrointestinale Reflexe Magendehnung löst Ileumkontraktion aus (gastrointestinaler Reflex) Kolondehnung löst Defäkation aus (gastrokolischer Reflex) Steuerung der Defäkation Tritt Stuhl in das Rektum ein, werden Dehnungsrezeptoren in der anorektalen Darmwand erregt, welche über einen lokalen Reflex NANC-Neurone des enterischen Nervensystems innervieren. Sie bewirken eine Relaxation des M. ani internus dessen Ruhetonus durch sympathische 1-adrenerge Einflüsse aufrecht erhalten wird, gleichzeitig erhöht sich der reflektorische Tonus des M. ani externus. Man hat das Gefühl des Stuhlgangs. 6.2 Funktion des Kolons Reservefunktion Der Ionentransport unterliegt einer neuronalen Kontrolle durch das ENS und durch enge hormonelle Kontrolle durch Hormone, z. B. Aldosteron Resorption von Na+, K+ und ClResorption von H2O 243 mikrobieller Abbau von Strukturkohlenhydraten zu kurzkettigen Fettsäuren Resorption der kurzkettigen Fettsäuren Fermentation Mikrobieller Abbau von Strukturkohlenhydraten zu kurzkettigen Fettsäuren Abbau von Proteinen, v. a. endogenes Protein Synthese von bakteriellen Proteinen Synthese von wasserlöslichen Vitaminen 6.3 Resorption kurzkettiger Fettsäuren Cellulose/ Hemicellulose Fettsäuren97 bakterielle Fermemtation kurzkettigen Diffusion als Säuren durch die Membran (Propionsäure, Buttersäure, Essigsäure) Fettsäure-Bicarbonat-Austauscher 6.4 Transport von Elektrolyten im Magen-Darm-Trakt Generell gilt für die Wasser- und Elektrolytresorption, daß der größte Teil der Resorption im Dünndarm stattfindet (80 %), im Dickdarm erfolgt die Eindickung, die an den Elektrolythaushalt angepaßt ist (10%). a) Na+-Transport b) 97 Dickdarm Na+-K+-Austauscher Natrium-Kanäle, die über Aldosteron gesteuert werden Transport von Cl- c) Dünndarm Cotransport mit Zuckern oder Aminosäuren + + Na -K -Austauscher passiver Ionentransport durch lecke Epithelien (Schlußleisten = solvent drag) durch transepitheliale Druckdifferenz Dünndarm überwiegend passiv, parazellulär über Schlußleisten Dickdarm trans- und parazellulär über: Cl- -HCO3- - Austauscher im Bürstensaum Sekretion über Cl- -Kanäle in der Bürstensaummembran (Krypten) Na+-K+-2 Cl- -Symport Transport von K+ Kurzkettige Fettsäuren sind: Acetat (60 mmol/l), Propionat (25 mmol/l) und Butyrat (20 mmol/l). 244 Dünndarm passiv durch solvent drag d) Dickdarm parazelluläre Sekretion und Resorption über Schlußleisten transzelluläre aktive Resorption durch K+-H+-Pumpe transzelluläre Resorption durch basolaterale und transzelluläre Sekretion durch apikale K+-Kanäle Transport von HCO3Resorption Sekretion findet im Jejunum statt. Die Zellen transportieren findet im Duodenum, Ileum und Colon über Na+-HK+-Austauscher Protonen in das statt. Über Cl- - HCO3- -Austauscher wird Lumen, wo H+ und HCO3- Kohlensäure (H2CO3) das Bicarbonat in das Lumen sezerniert. bilden, das durch die Carbanhydratase zu membrangängigem H2O und CO2 wird. Diese tritt durch Diffusion durch die Membran. FORTPFLANZUNG 1. Sexualzyklus In periodischen Abständen finden beim weiblichen Tier Veränderungen an den Geschlechtsorganen statt, die mehrere Aufgaben haben: Bereitstellung von Eizellen (ovarieller Zyklus) Vorbereitung der Aufnahme und der Entwicklung der Keimblase (uteriner Zyklus) Gewährleistung der Paarungswilligkeit Die Veränderungen kann man dabei beobachten an: Ovar, Eileiter, Uterus, Cervix und Vagina. Man unterscheidet bei den einzelnen Tieren noch: Monoöstrische Tiere Sie haben nur eine Brunst pro Jahr. Dazu gehören: Wildtiere und Hund (Bei manchen Tieren ist der Anöstrus so kurz, daß sie 2 x im Jahr läufig werden; trotzdem zählen die Hunde insgesamt zu den monöstrischen Tieren.) 245 Polyöstrische Tiere Sie haben mehrere Zyklen pro Jahr. Dazu gehören: Pferd, Wiederkäuer, Schwein, Katze, Nager und Huhn. Dauer des Sexualzyklus Bei den meisten Tieren beträgt die Dauer 21 Tage 1 oder 2 Tage. Die Ausnahmen sind: Schaf: 17 Tage Hund: sehr unterschiedlich, v. a. abhängig vom Anöstrus (16 - 56 Wochen) Katze: Bei der Katze findet die Ovulation nicht spontan statt, sondern wird erst durch den Deckakt provoziert. Deshalb unterscheidet man zwischen: Anovulatorischer Zyklus: 14 - 28 Tage (keine Kopulation keine Ovulation) Pseudogravider Zyklus: 40 - 50 Tage (Kopulation erfolgt Ovulation findet statt, aber keine Befruchtung) Bezeichnungen der Brust Rind: stierig Schaf, Ziege: bockig Schwein: rauschig Pferd: rossig Hund: heiß, läufig Katze: rollig Allgemeine Brustsymptome erhöhte Unruhe der Tiere Kontaktuafnahme zu Artgenossen Paarungsbereitschaft (Duldung des Aufsprungs) Ödematisierte Vulva und evtl. Abgang von Sekret aus der Rima vulvae gerötete Vaginalschleimhaut leichte Öffnung der Cervivalkanals, auch hier Sekretaustritt erhöhte Uterusmotorik 2. Phasen des Sexualzyklus Phasen Phase 1. Proöstrus, Vorbrunst Kennzeichen vom Einsetzen der Verhaltensänderung bis zur Paarungsbereitschaft Reifung der Follikel zum Ei Dauer Pferd: 2 - 6 Tage Wdk., Schwein: 2 - 3 Tage Hund: 9 - 13 Tage Pferd: 5 - 7 Tage Rind: 1 Tag Schaf, Ziege:1 - 2 Tage Schwein: 1 - 3 Tage Hund: 6 - 8 Tage 2. Östrus, Brunst Zeit der Paarungsbereitschaft Ovulation 3. Metöstrus, Nachbrunst, Postöstrus 4. Diöstrus, vom Erlöschen der Paarunswilligkeit bis zum Abklingen der Brunstsymptome ca. 3 - 4 Tage Entwicklung des Gelbkörpers Brunstsymptome fehlen 246 Ruheperiode Zwischenbrunst, Interöstrus 5. Anöstrus Ausbleiben des Östrus Der erste Tag nach dem Sexualzyklus ist definitionsgemäß der Beginn der Brunst (1. Tag, an dem Brunstzeichen auftreten) bzw. bei der Hündin das Einsetzen der Genitalblutungen, beim Menschen ist das der 1. Tag der Menstruation. Darum fällt der Proöstrus in den letzten Abschnitt des vorausgegangenen Zyklus. Kennzeichen peakartiger Ansteig von FSH und LH kurz vor der Ovulation Östrogenanstieg vor der Ovulation mit verzögertem Abfall in der 2. Zyklushälfte starker Anstieg der Gestagenkonzentration in der 2. Zyklushälfte Anöstrus Nach der Geburt müssen zuerst einmal die sog. Lochien (Schleim, Blut und Epithelien abgestoßen und die Uterusschleimhaut regeneriert werden. Erst danach kann ein neuer Zyklus beginnen. Der Wiedereintritt in die Brunst erfolgt beim: Pferd: Rind: Schaf: Ziege Hund: Schwein: 7 - 12 Tage 3 - 6 Wochen 3 - 5 Wochen nächste Saison 5 - 6 Monate 5 - 8 Tage nach der Geburt nach der Geburt nach der Geburt nach der Geburt nach dem Absetzten der Ferkel (Laktationsanöstrie) Vorgetäuschte Anöstrie: Brunstsymptome sind wenig oder gar nicht ausgeprägt (stille Brunst) Pathologische Anöstrie: Ursachen sind: hyperphysär oder ovariell bedingte hormonelle Insuffizienz organische oder infektiöse Erkrankungen besonders des Genitaltraktes Mängel bei der Haltung und Fütterung der Tiere 3. Zyklusabhängige Veränderungen am Ovar Primärfollikel Sekundärfollikel Tertiärfollikel Graaf’scher Follikel Ovulation, Ruptur, Eisprung: Freigabe der Eizelle, die dann durch den Eileiter zum Uterus wandert. Die Reste des Tertiärfollikels werden zum Gelbkörper, dem Corpus luteum mit Granulosa und Thecta interna. Wenn nun keine Befruchtung stattfindet, bildet sich der Gelbkörper wieder zurück und der Zyklus beginnt von vorne. Proöstrus: Follikelreifungsphase Unter Einfluß der Gonadotropine (FSH) reifen mehrere Follikel zu Graaf’schen Follikeln heran. Sie synthetisieren Östrogen, das für das Wachstum des weibl. Geschlechtsapparates wichtig ist. Östrus, Ovulationsphase 247 Hier erfolgt ein weiteres Heranreifen der Follikel, sowie ein starker LH-Ansteig bis ein bestimmtes Konzentrationsverhältnis zwischen FSH und LH schließlich zur Ovulation (meist gegen Ende der Brunst, beim Rind erst kurz danach) führt. Nach der Ovulation wird das Ei vom Fibrinrichter des Eileiters aufgenommen und durch Tonussteigerung im Eileiter in Richtung Uterus transportiert. a) Für die Ovulation verantwortliche Faktoren sind b) Vermehrung der Follikelflüssigkeit Druckerhöhung Proteolytische Enzyme, die die Follikelwand an der Austrittsstelle auflösen (ihre Synthese wird durch das LH gefördert) Unterschiede bei den Tierarten Bei multipaaren Tieren erfolgt die Ovulation in beiden Ovarien gleichzeitig. Es ovulieren dabei mehrere Follikel, die auch noch mehrere Eizellen besitzen können. Bei unipaaren Tieren werden oft bestimmte Ovarien bevorzugt: Pferd links, Rind und Schaf rechts. Hier gelangt nur 1 Follikel zur Ovulation, die anderen werden atretisch oder pathologischerweise zu Follikelzysten. Metöstrus: Gelbkörperphase Proliferationsphase: Ausbildung des Gelbkörpers (Corpus luteum) in der Follikelhöhle; er entsteht aus der Wand des Follikels Vaskularisations- und Sekretionsphase: starke Vaskularisation des Gelbkörpers und Progesteronbildung des Gelbkörpers Diöstrus: Blütezeit des Gelbkörpers (Maximale Progesteronsynthese) Wenn keine Befruchtung stattfindet: Inovulationsphase: PGF 2 sorgt für die Rückbildung des Gelbkörpers (Lutheolyse). Corpus luteum rubrum (rot) beim Rind Corpus luteum Corpus luteum cyclicum Corpus luteum albicans oder nigrans (je nach Farbe) bei den anderen Tieren Wenn eine Befruchtung stattfindet: Prolaktin und LH aus der Hypophyse sorgen dafür, daß der Gelbkörper während der Gravidität als Corpus luteum graviditatis bestehen bleibt. Die Progesteronproduktion wird (außer beim Schwein und der Ziege) nach einer gewissen Zeit von der Plazenta übernommen. Bei der Stute gibt es noch eine Besonderheit. Zwischen dem 40. Und dem 70. Trächtigkeitstag degeneriert der Gelbkörper. Unter PMSG-Einfluß kommt es zur Follikelreifung und die sich dabei bildenden Gelbkörper (Corpora lutea auxillaria) sind bis zum 150. Trächtigkeitstag funktionsfähig. Erst danach übernimmt die Plazenta die Progesteronbildung. Pathologisch Corpus luteum persistens: Der Gelbkörper bildet sich nicht mehr zurück, obwohl keine Befruchtung stattgefunden hat. 248 4. Zyklusabhängige Veränderungen am Eileiter Funktion des Eileiters Aufnahme des ovulierten Eis und dessen Transport in die Ampulla tubae Spermientransport zur Eileiterampulle Ernährung der Zygote während des mehrtägigen Tubenaufenthaltes Transport der Zygote in den Uterus hormonelle Steuerung Östrogen und Progesteron sorgen für die Tätigkeit der sekretorischen Zellen und der Flimmerepithelien, sowie für die Kontraktionen. Nach der Befruchtung verweilen die Zygote einige Tage in der Ampulla und dann nur wenige Stunden im Isthmus tubae. Für den zeitgerechten Übertritt sorgt Sympathicus. 5. Zyklusabhängige Veränderungen am Uterus Proöstrus: Proliferationsphase Unter Einfluß der ovariellen Östrogene, kommt es zum Wachstum der Uterindrüsen, Höhenwachstum der Oberflächenepithelien, Ödematisierung der Schleimhaut Cervix- und Uterindrüsen sezernieren dünnflüssigen Brunstschleim Besonderheit bei der Hündin: blutiger Ausfluß wegen der starken Hyperämie Östrus: Proliferationsphase hält an noch stärkeres Längenwachstum der Uterindrüsen und Schleimhautproduktion starke Hyperämie und Durchsaftung der Schleimhaut Zunahme der Uteruskontraktilität: zu Beginn der Tube in Richtung Cervix später von Cervix in Richtung Tube (wichtig für den Spermientransport) Bestimmung der Richtungsänderung der Uteruskontraktionen durch das Verhältnis Östrogen : Progesteron Dauer: Pferd: Rind: Hund: Schaf, Ziege: Schwein: 5 – 7 Tage 1 Tag 6 – 8 Tage 1 – 2 Tage 1 - 3 Tage Metöstrus: Sekretionsphase Unter Einfluß des vom Gelbkörper produzierten Progesterons stärkste Ausbildung und auch stärkste Sekretion der Uterindrüsen das wichtig ist für: die Ernährung der Blastozyste, während sie frei im Uteruslumen schwimmt (die ersten Tage) die anschließende Implatation der Blastozyste in der Uterusschleimhaut 249 Einstellung der Uteruskontraktionen Uterusschleimhaut produziert PGF 2 Diöstrus98 Wenn eine Einnistung der Blastozyste erfolgt: hält die Sekretionsphase an mit starker Drüsenausbildung und –sekretion Wenn keine Einnistung erfolgt: Inovolutionsphase: durch eine Abnahme der Progesteronwirkung: Abbauprozesse am Endometrium Sekretion und Länge der Uterusdrüsen nehmen ab abgestoßene Gewebsbestandteile und in das Uteruslumen austretende Blut werden bei den Haussäugetieren resorbiert 6. Zyklusabhängige Veränderungen am Cervix Funktion der Cervix Die Cervix bildet eine Barriere zwischen Uterus und Vagina um ein Eindringen von Bakterien zu verhindern. Während des Anöstrus und v. a. während der Trächtigkeit verschließt ein fester Schleimpfropf den Cervixkanal. Zyklusphasen Proöstrus: Cervixschleimhaut wird dünnflüssig Östrus: Schleim wird wieder dickflüssig und mukös, Herabsetzung des Tonus der Cervixmuskulatur der Cervixkanal passierbar Di- und Anöstrus: Cervixkanal ist wegen des Tonus der glatten Muskulatur geschlossen und enthält ein dickflüssiges, muköses Sekret 7. Zyklusabhängige Veränderungen am Vagina Die zyklischen Veränderungen des Vaginaepithels werden zur Feststellung des Zyklusstandes herangezogen. Proöstrus Das Vaginaepithel wird infolge einer gesteigerten Mitosetätigkeit mehrschichtig, einige oberflächlichen, kernhaltigen Zellen werden im Schleim zusammen mit Leukozyten abgestoßen. 98 Östrus oberflächliche Zellen verkernen und treten als „Schollen“ im Vaginalschleim auf stärkere Durchblutung der Vagina stärkere Sekretion der Vestibulardrüsen Ödematisierung und Rötung der Vulva Öffnung des Schamspaltes Metöstrus Vaginalepithel verkleinert sich im Vaginalschleim noch wenige Hornschollen, kernhaltige Zellen und Leukozyten Diöstrus Vaginalepithel niedrig in wenig Vaginalschleim viele Leukozyten Im Unterschied zu den Primaten: Es werden ganze Schleimhautschichten abgestoßen (Menstuationsblutungen). 250 8. Regulation des weiblichen Zyklus Die FSH-Produktion bewirkt die Anreifung von Follikeln im Ovar, die sich aus Primär- und Tertiärfollikeln entwickeln. Die heranreifenden Follikel produzieren Östrogene, v. a. Östradiol. Bei niederen Östrädiolkonzentrationen werden die LH- und FSH-produzierenden Zellen auf einem niedrigen Sensibilitätsniveau gehalten. Deshalb bleibt der FSH-Spiegel im Blut relativ niedrig. negativ rückkoppelnde Wirkung der Östrogene Mit zunehmender Reifung des Follikels wird immer mehr Östradiol produziert, so daß der Östrogenspiegel im Blut ansteigt. Unmittelbar vor dem Eisprung, stellt man einen peakartigen Anstieg der LHund FSH-Konzentration fest, daß die Sensibilität der Hypophyse von einer niedrigen auf eine hohe Antwortbereitschaft umschaltet. Es wird noch mehr FSH und LH gebildet. positive Rückkopplung auf die GnRH-produzierenden Neurone durch Östrogene GnRH-Pulsgenerator im Hypothalamus phasenartige GnRH-Abgabe (stärker ausgeprägt beim männlichen Tier) Abgabe ist zyklusabhängig (vor der Ovulation deutlich stärker als danach) Hypothalamus GnRH Hypophysenvorderlappen FSH LH Granulosa-Zellen des Ovars Granulosa- und ThecaZellen des Ovars Östrogene, v. a. Östradiol Östrogene + Gestagene Hormone a) b) Östrogene Bildung: FSH aktiviert die Aromatasen in den Follikelzellen. Dort erfolgt die Bildung von Östrogenen, v. a. Östradiol. Die Abgabe der Östrogene erfolgt in der Pupertät. Es dient zur Stimulation der Entwicklung der weiblichen Geschlechtsorgane. Wirkung: Ausbildung der weiblichen Geschlechtsorgane brunstauslösend Proliferation des Endometriums (Bildung) Unterdrückung der LH- und FSH-Produktion während der Schwangerschaft Gestagene Bildung: LH bewirkt den Prozess des Eisprungs (Ovulation). Danach erfolgt die Umwand251 lung von Zellen des ruptierten Tertiärfollikels zu Gelbkörperzellen. Diese produzieren Gestagene, v. a. das Progesteron. Dieser Prozeß der Umwandlung wird als Luteinisierung der Granulosazellen bezeichnet. Der Follikel wird zum Gelbkörper Wirkung: Nidation der befruchteten Eizelle Unterbrechung des Sexualzyklus bei einem hohen Progesteronspiegel im Blut Luteolyse Unter Luteolyse versteht man die Rückbildung des Gelbkörpers bei ausbleibender Befruchtung. Dies erfolgt nach etwa 14 Tagen nach der Ovulation. Es wird oft unterstützt durch PGF2, das in der Uterusschleimhaut gebildet wird. Es hemmt die Progesteronbildung. 9. Geschlechtstrieb und Sexualverhalten Das Zentrum für den Geschlechtstrieb und Sexualverhalten befindet sich im Hypothalamus. Androgene bewirken das männliche Sexualverhalten. Fehlen Androgene, resultiert daraus das weibliche Sexualverhalten. Die Intensität des Sexualverhaltens ist abhängig von Fütterung, Haltung und dem Gesundheitszustand der Tiere. Für den Geschlechtstrieb verantwortlich sind Testosteron beim männlichen Tier (fortwährend) und Östrogene beim weiblichen Tier (Duldung der Paarung während bestimmten Phasen des Genitalzyklus). 10. Spermiogenese, Spermatogenese Spermiogenese Das ist die Entwicklung der Spermien. In der Embryogenese erfolgt die Entwicklung des primären Keimgewebes. In der Pubertät werden beim männlichen Geschlecht die Urkeimzellen durch mitotische Teilung in Spermatogonien umgewandelt. Sie besitzen einen diploiden Chromosomensatz. Aus ihnen entwicheln sich im Keimepithel der Tubuli seminiferi contorti der Hoden die primären Spermatozyten. Nach der ersten Reifeteilung heißen sie sekundäre Spermatozyten oder Präspermatiden. Aus ihnen entwickeln sich in der zweiten Reifeteilung zwei Spermatiden, die einem einfachen Chromosomensatz haben. Dann erfolgt erst die Differenzierung zu den reifen Spermien (Spermatozoen), die Transportform der Keimzellen. Spermien verlassen das Zytoplasma der Sertolizellen und gelangen in das Lumen der Tubuli seminiferi. Von dort aus geht es durch die Tubuli recti Rete testis Ductuli efferentes in den Ductus epididymidis, der Nebenhodengang, in dem sie gespeichert werden und ausreifen. Spermien Aufbau Sie bestehen aus einem Kopf, der bei den einzelnen Tierarten unterschiedlich aufgebaut ist und aus dem Akrosom und dem Kern besteht. Das Halsstück geht über in ein Mittel- und Hauptstück mit vielen Mitochondrien, die zusammen mit dem Endstück den Schwanz bilden. Ejakulat Das Ejakulat besteht aus 3 - 12 % Spermien und dem Samenplasma, das aus den Akzessorischen Geschlechtsdrüsen sezerniert wird. 252 Gl. vesikularis Prostata Gl. bulbourethralis Nebenhoden Samenleiterampullen Hauptteil des Plasmas, Nähstoffe saure Phosphatase, Glucuronidase mucinreiches Sekret mir HCl Spurenelemente, Minearlien, ... Fructose , Citronensäure Motalität Spermienschwänze führen peitschende, rhythmische Bewegungen aus. Durch positive Rheotaxis (Wanderung gegen den Flüssigkeitsstrom mit einer Geschwindigkeit von 4 - 6 mm/min.) gelangen sie zur Eizelle. Lebensdauer Die Lebensdauer beträgt ca. 2 Tage, beim Pferd bis zu 6 Tagen. Konservierung bei Kühlschranktemperatur im dotterhaltigen Verdünner 2 - 4 Tage haltbar bei Zimmertemperatur durch CO-Zugabe maximal 10 Tage haltbar Einfrieren, Verdünnung aus Glycerin und Eidotter sind sie mehrere Jahre haltbar Bau des Hodens, Testis, Orchis a) Anatomie Der Peritonealüberzug ist mit der Organkapsel, Tunica albiginea testis fest verwachsen. Innerhalb der Organkapsel befindet sich das Hodenparenchym mit Bindegewebskörper, Mediastinum testis, der durch Bindegewebssepten, Septula testis unterteilt ist. Beim Pferd bilden sich richtige Läppchen, Lobuli testis. Im Außenbereich des Hodenparenchyms befinden sich die gewundenen Samenkanälchen, Tubuli seminiferi contorti, in denen die Spermatogenese stattfindet. Die Spermien werden in diese Tubuli entlassen, an die sich die geraden Endabschnitte, Tubuli recti anschließen. Diese münden in ein regelrechtes Gefäßknäul, die mediastinalen Tubuli, Rete testis, die beim Übergang vom Hoden in den Nebenhoden in 8 - 12 Ductuli efferentes testis übergehen. b) Histologie Das Epithel der Tubuli seminiferi contorti besteht aus den Stammzellen der Spermien (Spermatoginien) und den Stützzellen (Sertoli-Zellen). Zwischen den Kanälchen liegen die Leydig-Zwischenzellen. Die Sertoli-Zellen bilden das Maschenwerk. Sie sind notwendig für die Ernährung der Spermazellen und produzieren Inhibine und ein Adrogen-bindendes Protein (ABP), das Testosteron von Leydig-Zwischenzellen in die Sertoli-Zellen transportiert. Es wird dort zu Östrogenen umgebaut, das für die reifung der Spermatocyton notwendig ist. Des weiteren sind sie auch zur Phygozytose befähigt. Die Leydig-Zwischenzellen bilden Gruppen in der Nähe von Kapillaren, um das produzierte Hormon (Testosteron) abzugeben. Hormonale Regulation Der GnRH-Pulsgenerator im Hypothalamus besteht aus einer Gruppe von Neuronen, die das GnRH (Gonadotropin-Realising-Hormon) bilden. Über den axonalen Transport gelangt es zur Eminentia mediana, wo die pulsatile, periodische Abgabe ins Blut erfolgt. Die GnRH erreichen mit der Blutbahn den HVL. Im Hypophysenvorderlappen wird nun FSH und LH gebildet. Die Ausschüttung der Sexualhormone, v. a. Testosteron, führt in den Hoden (Sertoli-Zellen und Leydigsche Zwischenzellen) zur Bildung von Androgenen (Testosteron). Über die negative Rückkopplung erfolgt die Regulation der Androgenbildung. 253 Hypothalamus Rückkopplungsmechanismen: Androgene GnRH und FSH Inhibine FSH und LH GnRH Hypophysenvorderlappen Inhibin FSH Tubuli seminiferi contorti LH Leydigzellen DHT Testosteron, Testosteron wird in den Zellen peripherer Erfolgsorgane erst nach Reduktion des 5-Dihydrotestosteron (DHT) wirksam Wirkungen der Androgene FSH und LH sind Glykoproteine, die an membranständige Rezeptoren von Zellen des Hodens gebunden werden Leydig Zwischenzellen: Hier erfolgt die Bildung von Androgenen, v. a. Testosteron. LH bindet an Rezeptoren der Zellmembran. Das cAMP steigt an, welches die Synthese der Hormone anregt. Die Wirkung wird durch FSH gefördert. Sertolizellen: FSH bindet an Rezeptoren der Sertoli-Zellen, das cAMP steigt in der Zelle an. Es kommt zur Produktion von Androgen-bindendem Protein (ABP) und von Inhibinen. Die androgenen Steroidhormone wirken auf den Stoffwechsel anabol, d. h. die Nucleinsäuren und die Eiweißsynthese steigt an. In ihren Zielorganen erfolgt Stimulation der speziellen Stoffwechselleistungen. An den männlichen Genitalien beeinflussen sie die Ausbildung von Penis, Samenleiter, Samenblase und Prostata und fördern bestimmte Stadien der Spermatogenese. In der Peripherie wirken sie auf eine Erhöhung der Knochenbildung, Fettproduktion und -sekretion der Haut (Seborrhoe). Synthese der Steroide Cholesterin Pregnenolon Progesteron Testosteron 5-Dihydro- Östradiol 17-Hydroxyprogesteron 17-Hydroxypregnenolon Androstendion Dehydroepiandrosteron (DHEA) Östron 254 testosteron (DHT) Östriol 11. Oogenese Ooegese ist die Entwicklung der Eizelle. Die Urkeimzellen differenzieren sich beim weiblichen Embryo in der 5. Woche zu Oogonien und vermehren sich bis zum 5. Monat mitotisch. Die Mehrzahl der Oogonien geht bis zur Geburt zu Grunde, der Rest differenziert sich zwischen dem 3. Bis 7. Monat zu primären Oozyten, die sich bei der Geburt in einem Ruhestadium zwischen Prophase und Metphase der ersten Reifeteilung befinden. Sie bilden in den Ovarien Primärfollikel, die von Epithelzellen umgeben sind. Bei Beginn der Pupertät kommt es zur Vollendung der Follikelreifung. Im Rahmen des Ovarialzyklus erfolgt die erste Reifeteilung zu einer sekundären Oozyte und einem Polkörperchen. Die zweite Reifeteilung beginnt unmittelbar danach und wird nur abgeschlossen, wenn die Eizelle befruchtet wird. 12. Paarung und Befruchtung Begriffe Paarung, Begattung: Koitus zum Zwecke der Befruchtung Besamung: Eindringen des Spermiums in die Ovozyte Befruchtung: Eine weibliche und eine männliche Keimzelle vereinigen sich zu einer befruchteten Eizelle, Zygote mit einem diploiden Chromosomensatz. Die Befruchtung erfolgt in der Eizelle selbst, die sich i. d. R. noch im Eileiter befindet. Nach der Befruchtung beginnt sie sofort sich zu teilen. Der heranreifende Trophoblast produziert das Choriongonadotropin (HCG), das zur Aufrechterhaltung der Progesteronsekretion des Corpus luteum dient. Im Uterus kommt es dann zur Nidation (Einnistung) Ort der Befruchtung Der Ort der Befruchtung ist die Samenleiterampulle. Das ergibt sich daraus, daß die Eizelle nur ca. 18 Stunden ferti ist, ihre Wanderung durch den Eileiter aber 4 - 6 Tage dauert (beim Hund sogar 4 - 8 Tage). Darum müssen die Spermien zur Befruchtung in die Eileiterampulle vordringen. 1. Ejakulation: 2. Transport: Ausstoßung der Spermiums Wiederkäuer = intravaginal kurzer Deckackt Pferd = intracervical Schwein, Katze = intracervival und intrauterin Hund = intrauterin langer Deckakt der Spermien in die Eileiterampulle v. a. passiv durch Uterus- und Eileiterkontraktionen (durch Oxytoxin ausgelöst). Die Wanderungsdauer beträgt ca. 5 - 8 Stunden. 3. Kapazitation: Während des Aufenthaltes im weiblichen Genitaltrakt wird ein Dekapazitationsfaktor (Mukopolysaccharid) entfernt, der im Samenplasma vorkommt. Erst dadurch werdn die Spermien befruchtungsfähig. 4. Akrosomenreaktion: Durch Fusion von Membranabschnitten bilden sich am Spermienkopf Poren, durch die die akrosomalen Enzyme (Hyalonuridase und Proteasen) freigesetzt werden. Sie können die Corona radiata auflösen. 255 Akrosin, eine Protease, sorgt für die Auflösung der Zona pellucida. 5. Zytoplasmafusion: Sie beginnt am Spermienkopf, sobald dieser die Ovozytenoberfläche erreicht. 6. Zonareaktion: Unmittelbar nach dem Eindringen des ersten Spermiums verändert sich die Zona pellucida, wodurch das Eindringen weiterer Spermien verhindert wird (Barriere gegen Polyspermie). 7. Vorkernverschmelzung: Die Chromosomen der Eizelle und des Spermiums bilden die beiden Vorkerne. Sie wachsen heran, wandern aufeiandern zu und treffen sich in der Mitte der Eizelle. Die Kernmembranen verschwinden und die Chromosemen vermischen sich. Es ist eine Zygote mit einem diploiden Chromosomensatz entstanden. Dieser Vorgang dauert etwa 12 Stunden. Abnormale Befruchtung Parthenogenese: Jungfernzeugung; Teilung des Eis ohne Befruchtung. So entstehen die Männchen der Bienen (Drohnen) Überschwängerung, Superfacundatio: In der 1. Ovulationsphase werden Eizellen von mehreren Partnern befruchtet, so daß mehrere Kinder von verschiedenen Vätern her resultieren, z. B. beim Schwein durch die lange Brunstperiode mit mehreren Ovulationen möglich Überbefruchtung, Superfetatio: Trotz der Befruchtung erfolgt eine weitere Brunst mit Ovulation. Es gibt so befruchtete Eier aus mehreren Brustperioden (sehr selten, meist mit Abort) 13. Gravidität Eine hohe Östogen- und Progesteronkonzentration im Blut unterbrechen den normalen Sexualzyklus und verhindern die Rückbildung des Corpus luteum. Das Corpus luteum wird im Ovar nach der Ovulation aus dem gesprungenen Follikel gebildet. Follikelepithelzellen und Zellen der Theka interna bilden eine temoräre endokrine Drüse, die Progesteron und Östrogene produziert. Bei anderen Arten wird die Produktion von der Plazenta übernommen. Gestagenbildung Rind, Ziege und Schwei:n: im Gelbkörper des Ovars Mensch, Pferd, Schaf, Hund und Katze: in den Zellen der Plazenta Östrogenbildung erfolgt v. a. in der Plazenta; kurz vor der Geburt kommt es zu einer Steigerung des Östrogen und zu einem Abfall der Gestagene 14. Hormonelle Regulation der Geburt Nach Ablauf der tierartlich unterschiedlichen Trächtigkeitsdauern kommt es zur Geburt. Die Trächtigkeitsdauer beträgt bei der Katze 58 Tage und beim Pferd bis zu 336 Tagen. Der HVL des reifenden Fetus bildet fetales ACTH, das auf die fetale NNR wirkt. Es führt dort zur Ausschüttung von fetalen Corticosteroiden. Drauf kommt es an der Plazenta zu einer verringerten Progesteronsynthese und zu einer Erhöhung der Östrogensynthese. Der Östrogenanstieg führt zu einem Einbau von Oxytocinrezeptoren in das Myometrium. Ebenfalls steigt die PGF2 Konzentration an. Das Prostaglandin F2 ist ein Derivat der Arachnidonsäure, das in der Uterusschleimhaut gebunden wird. Der Zielort ist das Ovar, wo es zur Luteolyse kommt (Rind, Ziege, Schwein). Das 256 Oxytocin löst Uteruskontraktionen aus. Durch die Dehnung der Cervix (Fetus drückt auf den Geburtskanal) erhöht sich die Oxytocinausschüttung. Durch positive Rückkopplung wird dadurch noch mehr Oxytocin gebildet. Ferguson-Reflex Wenn nun der Fetus im Geburtskanal auf die Cervix drückt, nehmen Mechanorezeptoren die Reize wahr und leiten die Information über das Rückenmark weiter zum Hypothalamus. Dort wird durch die Dehnung vermehrt Oxytocin produziert und ausgeschüttet. Dieses bindet an die Rezeporen der glatten Muskelzellen und führt somit zu Uteruskontraktionen und zum Einsetzen der Wehen. (Die Regulation erfolgt über eine positive Rückkopplung!) Die Ausschüttung wird erst beendet, wenn die Austreibung der Frucht beendet ist. Milchejektionsreflex Das Saugen des Säuglings bildet einen mechanischen Reiz an der Brustwarze. Über Rezeptoren wird diese Information wieder zum Hypothalamus geleitet, wo Oxytocin ausgeschüttet wird. Dieses bewirkt eine Kontraktion des Myoepithels, das sich um die Alveolen spannt, so daß dadurch die Milch entleert wird. 15. Fetale Physiologie Plazentation Nach der Ovulation beginnt unter dem Einfluß von Östrogenen und Progesteron die Sekretionsphase der Uterusschleimhaut. Sie entwickelt sich zur funktionsfähigen Plazenta materna, die auf die Implantation der Keimblase vorbereitet ist. Vor der Implantation erfolgt die Ernährung des Trophoblasten durch Histiotrophe (Uterinmilch). Sie setzt sich aus dem Sekret der Uterindrüsen sowie aus Bestandteilen der Uterusschleimhaut zusammen und enthält Leukozyten, Erythrozyten, Epithelzellen, Proteine, Fette, Kohlenhydrate und Mineralstoffe. Sobald proteolytische Enzyme sie Zona pellucida aufgelöst haben, bekommt der Trophoblast Kontakt zum Uterusepithel und die Implantation (Einnistung, Nidation) der Blastocyste beginnt. Sie erfolgt bei den einzelnen Tieren: Pferd: am 38. Tag Rind: am 35. Tag Schwein: am 13. Tag Hund, Schaf: am 16. Tag Dieser Vorgang setzt sich in der Plazentation fort, bei der eine innige Verbindung zwischen den Eihüllen der Fruchtblase und der Schleimhaut des Uterus entsteht. Dadurch wird ein besserer Stoffund Gasaustausch zwischen Fetus und Muttertiermöglich, allerdings bleiben mütterlicher und embryonaler Kreislauf immer voneinander getrennt. Es laufen lediglich Diffusionsprozesse ab. Plazenta An der Plazenta lassen sich 2 Anteile unterscheiden: 257 Plazenta materna: umgebildete Teile der Uterusschleimhaut (Endometrium) Plazenta fetalis: das aus dem Trophoblast hervorgegangene und mit Zotten besetzte Corion Außerdem dienen folgende Stukturen der Ernährung und dem Schutz des Embryos: Dottersack: beim Wiederkäuer und Schwein bildet er sich bald zurück beim Pferd und Fleischfresser dient er vorrübergehend der Ernährung des Embryos (Ausbildung eines Dottersackkreislaufs mit Dottersackplazenta) Fruchthüllen: Corion: Zottenhaut, sie bildet die Plazenta fetalis. Durch Ausbildung von Primär-, Sekundärund Tertiärzotten wird eine innige Verbindung mit der Uterusschleimhaut hergestellt, die dem Stoffaustausch dient. Amnion: Es entwickelt sich aus der inneren Eihaut und stülpt sich um den ganzen Embryo herum. Die Amnionhöhle enthält Amnionflüssigkeit, die dem Schutz des Embryos dient. Amnionhöhle = Fruchtblase Allantois: Der Harnsack ist eine Ausstülpung des embryonalen Darmes, die die Stoffwechselprodukte des Embryos aufnimmt, also v. a. mit fetalem Harn gefüllt ist. Plazenta-Typen Bei den einzelnen Haussäugetieren gibt es Unterschiede in der äußeren Form der Plazenta in der Innigkeit der feto-maternalen Verbindung im Grad der Gewebszerstörung a) Die äußere Form der Plazenta Sie bezieht sich auf die Verteilung der Zotten über das Chorion. Bei einigen Tieren sind die Zotten gleichmäßig über das ganze Chorion verteilt, bei anderen befinden sie sich in bestimmten Bereichen: b) Plazenta difusa completa: Zotten gleichmäßig über das gesamte Chorion verteilt (Pferd) Plazenta diffusa incompleta: fast das gesamte Chorion ist mit Zotten besetzt (Schwein) Plazenta zonaria: nur ein gürterförmiger Bezirk ist mit Zotten besetzt (Fleischfresser) Plazenta discoidalis: nur ein scheibenförmiger Bezirk ist mit Zotten besetzt (Primaten, Nager) Plazenta cotyledonaria: auf dem Chorion bilden sich verstreute Zottenfelder (Kotyledonen) aus, die sich mit den Karunkeln der Uterusschleimhaut zu Plazentomen zusammenlagern (Wiederkäuer) Innigkeit der feto-maternalen Verbindung In Bezug auf die Innigkeit der foto-maternalen Verbindung unterscheidet man die Halb- und die Vollplazenta. Bei der Vollplazenta ist die Verbindung so innig, daß bei der Geburt größere Wundflächen entstehen, bei der Halbplazenta treten hingegen keine nennenswerten Blut- oder Gewebeverluste auf. c) Gewebszerstörung 258 Ursprünglich befinden sich zwischen dem mütterlichen und dem fetalen Blut 6 Grenzschichten. Sie bilden die sog. Plazentarschranke: 1. Gefäßendothel 2. Bindegewebe 3. Epithel Endometrium der Mutter III. Epithel II. Bindegewebe I. Gefäßendothel Chorium des Fetus Beide Trennwände wurden nun, beginnend beim Muttertier, im unterschiedlichen Maße angebaut: Plazenta-Typ Plazenta epitheliochorialis Plazenta syndesmochorialis Plazenta epitheliochorialis Plazenta haemochorialis Plazentaform Plazentaschranke Mutter Fetus 1. 2. 3. III. II. I. Tierart Pazenta diffusa + + + + + + Pferd, Schwein Placenta cotyledonaria + + - + + + Wiederkäuer Placenta zonaria + - - + + + Hund, Katze Placenta discoidalis - - - + + + Primaten, Nager + vorhanden; - abgebaut Beim Pferd, Schwein und Wiederkäuer ist die Plazenta am stärksten und bei Primaten am kleinsten. Das hat Einfluß auf die Art der Ernährung des Embryos und auf die Übertragung von Antikörpern. Aufgaben der Plazenta Gasaustausch (O2 und CO2) zwischen mütterlichem und fetalen Blut Versorgung mit Nähr- und Abbaustoffen Ausscheidung fetaler Stoffwechselschlacken Barriere gegen die Übertragung von Bakterien und Viren Übertragung von Antikörpern (tierartlich unterschiedlich) Hormonbildung (Progesteron und Östrogene) für die Regulation von Trächtigkeit und Laktation Speicherung von Lipiden, Vitaminen und Hormonen Schutz gegen äußere Schädlichkeiten Ernährung des Embryos Embryothrophe: Gesamtheit der von der Plazenta zum Keim übergeleiteten Nährstoffe. Zusammensetzung: Histiotrophe: Sekret der Uterindrüsen und Zerfallprodukte der Schleimhaut 259 Haemotrophe: Stoffe aus dem mütterlichen Blut Vor der Implantation erfolgt die Ernährung des Keims, wie gesagt mit Hilfe der Histiotrophe. Nach der Implantation wird die histiotrophe Ernährung bei den Tieren mit geringer Plazentarschranke durch die haemotrophe Ernährung abgelöst. Bei den Tieren mit starker Plazenarschranke überwiegt auch nach der Implantation die histiotrophe Ernährung. Über die Plazenta ausgetauschte Stoffe Der Stoffaustausch erfolgt durch Diffusion, aktiven Transport oder Pinozytose. Wasser: Mineralien: Transport durch Diffusion Na+ und K+: auf beiden Seiten gleiche Konzentration, Passage erfolgt in beiden Richtungen, bei starker Schranke aber schwerer Ca2 und PO43-: Präferenz des Fetus zum Knochenaufbau Fe2+: auf histiotrophen und haematrophen Weg übertragbar Blutgase: Transport durch Diffusion Vitamine: wasserlösliche Vitamine durch Diffusion fettlösliche Vitamine über aktiven Transport Proteine und AS: aktiver Transport Proteinsynthese im Fetus aus AS, die mit dem Blut zugeführt werden bei Tieren mit schwacher plazentarer Barriere (Fleischfresser, Nager): Übertragung von Immunglobulinen über die Plazenta, so daß der Globulingehalt des Fetus bei der Geburt genauso groß ist, wie der des Muttertieres bei Tieren mit starker plazentarer Barriere (Pferd, Rind, Schwein): keine Übertragung von Immunglobulinen, sie müssen daher in den ersten Tagen nach der Geburt mit der Kollostralmilch aufgenommen werden. Kohlenhadrate: ständiger hoher Wasserumsatz über Diffusion Basis der Villi (Übertragung ins fetale Blut) Spitze der Villi (Diffusion in entgegengesetzter Richtung) aktiver Transport schwache Plazentarschranke: gleicher Glucosegehalt in fetalem und mütterlichem Blut starke Plazentarschranke: KH-Gehalt höher Lipide: aktiver Transport von Fettsäuren teils direkte Lipidaufnahme, teils Synthese aus Kohlenhydraten Lipidgehalt im fetalen Blut ist nicht von dem des Mutterblutes abhängig Hormone: mütterliche und fetale Kompartimente bilden zusammen eine endokrine Einheit, so daß die einzelnen Hormone in beide Kreisläufe übertreten können Fetaler Blutkreislauf 260 Die Plazenta stellt für den Fetus Lunge, Darm und Niere dar. Das fetale Blut nimmt O2 auf und gibt CO2 ab. Da aber nur relativ wenig O2 über die Plazentarschranke tritt, müssen spezielle Einrichtungen im fetalen Kreislauf eine ausreichende O2-Versorgung gewährleisten: das fetale Blut enthält viel Hb das fetale Hb hat eine höhere Affinität zu O2 als das normale reichliche Kapillarisierung Das in der Plazenta mit O2 und Nährstoffen angereicherte Blut fließt über die Nabelvene in Richtung Herz (denn Venen sind Gefäße, die zum Herz hinführen); das venöse Blut des Embryos ist also O2und nährstoffreich. Die Lunge ist beim Fetus noch nicht in Funktion, die wird darum durch Kurzschlüsse zwischen Herz und Lunge umgangen: Foramen ovale zwischen beiden Kammern Ductus arteriosus zwischen Truncus pulmonalis und Aorta Da kaum Blut durch die Lunge fließt, gelangt auch kein Blut von der Lunge in die linke Vorkammer. Daher herrscht hier gegenüber der rechten Kammer ein Unterdruck, so daß Blut dadurch durch das Foramen ovale in die linke Kammer angezogen wird. Bei der Geburt reißt die Verbindung zwischen Fetus und Mutter ab. Im fetalen Blut reichert sich CO 2 an und der Atemreflex setzt ein. Dadurch vergrößert sich das Lungenvolumen erheblich. Von der Lunge strömt es in die linke Vorkammer. Das hat eine Umkehrung der Druckverhältnisse zwischen den Vorkammern zur Folge, so daß das Foramen ovale sich schließt und später zuwächst. Entsprechend wird auch der Ductus arterious verschlossen. LAKTATION 261 1. Anatomie und Entwicklung der Milchdrüse Anatomie Milchdrüse Mammarkomplex milchbildender Anteil milchführender Anteil Zur Milchdrüse gehören: Strichkanal, Zisternen, Milchgänge, Alveolen (sind mit Myoepithel umgeben und haben die Fähigkeit sich zu kontrahieren, deshalb auch Korbzellen, und werden durch Oxytocin aus dem Hypophysenhinterlappen kontrolliert) Die Innervation der Milchdrüse erfolgt über den Sympathikus, der auf die zuführenden Blutgefäße wirkt. Die eigentliche Milchproduktion ist hormongesteuert über das Oxytocin. Das plazentäreLactogen-Hormon, ein Peptidhormon, wird in der Plazenta gebildet. Entwicklung 1. Allgemeines Wachstum 2. Spezielles Wachstum 3. FSH (Bildung von Östrogenen) LH (Bildung von Progesteron) Prolaktin Wachstumshormon (STH) plazentäres Laktogen Entwicklung der Alveolen 4. Wachstumshormon (STH) ACTH (adrenocorticotropes Hormon aus der NNR) FSH (thyreoidea-stimulierendes Hormon, Schilddrüsenhormon) Schilddrüsenhormone Corticosteron Insulin Östrogene plazentäres Laktogen Entwicklung des Gangsystems Östrogene Wachstumshormon plazentäres Laktogen 2. Mechanismen der Milchbildung 262 Milchdrüse Es ist ein sekundäres Geschlechtsorgan, das sowohl bei weiblichen, als auch bei männlichen Tieren angelegt ist. Es ist eine modifizierte Schweißdrüse (Hautorgan), die zur Ernährung der Nachkommen dient. Sie entwickelt sich schon im Embryo, wo sie als Milchleisten bereits vorhanden ist. In der Pubertät kommt es zum Wachstum und zur Entwicklung des Alveolarepithels. Durch das plazentäres Laktogen entwickelt sich das spezielle Drüsengewebe bei der 1. Trächtigkeit. Milchbestandteile Synthese in der Milchdrüse: Lactose, Milchfett und Kasein Aufnahme aus dem Blut: Elektrolyte, Wasser und manche Eiweiße, z. B. Antikörper Milchbildung Die Bildung erfolgt in den Alveolen der Milchdrüse. Im letzten Abschnitt der Gravidität kommt es zur Veränderungen am sekretorischen Epithel der Milchdrüse. Das endoplasmatische Retikulum und der Golgi-Apparat nehmen an Ausprägung zu, die Epithelzellen werden hochprismatisch, haben Mikrovilli und enthalten Granula. Im Lumen der Alveolen sind Proteingranula und Fettröpfchen zu finden. Es ist nur eine lokale Anpassung an die nun erforderliche Milchbildung Aber es erfordert zusätzlich noch eine Änderung bzw. Anpassung des gesamten Stoffwechsels. Die Wirkungen hat man nur an der Milchdrüse: Durchblutung der Milchdrüse Aminosäure- und Glucoseaufnahme Syntheseleistung Am Euter befinden sich mehr Somatomedin-Rezeptoren. Empfindlicher reagieren auf IGF-1 (auch bei kataboler Stoffwechsellage) Kollostralmilch Es ist die erste Milch, die gebildet wird. sie wird auch Biestmilch bzw. Kollostrum genannt. Beim Rind wird sie 2 Tage vor und 5 - 7 Tage nach der Geburt produziert. Der Trockensubstanzgehalt ist höher als in der darauf folgenden Milch und sie ist auch reich an Immunglobulinen. Bildung der einzelnen Bestandteile a) Lactose Die Lactose besteht aus Galactose und Glucose. Die Bildung erfolgt in den Alveolarzellen (Golgi-Apparat) der Milchdrüse und kann dann nur über die apikale Membran abgegeben werden. Die Glucose entsteht bei der Gluconeogenese in der Leber (aus Aminosäuren), dem Glycogenabbau und aus Propionat beim Wiederkäuer. Es wird in das Blut abgegeben und in der Milchdrüse aufgenommen. Dort erfolgt die Synthese der Galaktose aus Glucose (Epimere). 263 b) Glucose-1-Phosphat + UDP UDP-Glucose-phosphorylase UDP-Glucose UDP-Glucose UDP-Galaktose-4 –Epimerase UDP-Galactose UDP-Galactose + Glucose Lactose Eiweiße, Kasein 30 - 40 % Eiweiß findet man pro Liter Milch. Dabei hast das Kasein einen Anteil von ca. 95 %. Man unterscheidet -, - und -Casein. Es sind Phosphoproteine, die als Calicumsalze vorliegen. Die Bildung erfolgt in den Alveolarzellen (Golgi-Apparat) der Milchdrüse. Es wird durch Exozytose freigesetzt. Für 20 kg Milch wird 1 kg Protein benötigt. Die Vorstufen der Proteine sind v. a. alle essentiellen Aminosäuren. 50 % aller benötigen Aminosäuren stammen aus dem Aminosäure-Pool, der durch die Nahrung und dem Abbau der Körpersubstanz gespeist wird. Die restlichen 50 % werden durch die Synthese in der Milchdrüse selbst gebildet. Alle Aminosäuren wird aus dem Blutaufgenommen. Die weißen Eiweiße, aber auch Serumalbumine, Immunglobuline und Enzyme gelangen durch den transzellulären Transort (Endozytose und Exozytose) in die Milchdrüse selbst. Die Wiederkäuer-Milch ist sehr kaseinreich, während die Stutenmilch einen niedrigeren Anteil an Kasein, dafür mehr Globuline und Albumine hat. Das Kasein ist sehr hitzeresistent - kochen der Milch ist möglich. Wenn die Milch gerinnt, fällt das Kasein aus. c) Milchfett Die Vorstufen des Milchfettes sind Glycerin und Fettsäuren. Glycerin kann z. B. aus Glucose synthetisiert werden oder ist bereits im Blut vorhanden. Die Fettsäuren hingegen stammen entweder aus der Nahrung, aus der Neusynthese mittels Acetat und Butyrat oder aus dem Depotfett. Man muß hier zwischen den Wiederkäuern und den nicht-Wiederkäuern unterschieden. Das Milchfett selbst sind v. a. Triglyceride. Sie werden aus den Vorstufen in der Milchdrüse selbst synthetisiert. Die Tröpfchen werden von Anteilen der Drüsenepithelzellen abgeschnürt. (Haptogenmembran = Protein-Plasmalipidmembran) Wiederkäuer Blutfettsäuren, das sind alle Fettsäuren mit > C16 und alle essentiellen Fettsäuren Fettsäuresynthese der Milchdrüse nur bis bis C16 aus Acetat und -Hydroxybutyrat Glucose ist keine Vorstufe für die Synthese von Fettsäuren nicht-Wiederkäuer Blutfettsäuren sind alle essentiellen Fettsäuren Fettsäuresynthese der Milchdrüse (andere Fettsäuren und Glucose) 50 % des Milchfettes stammt beim Rind aus der Neusynthese, 40 - 45 % sind Nahrungsfette und 5 - 10 % stammen aus Körperfettreserven. Fette sind beim Transport im Blut an Apolipoproteine gebunden, so daß sie die sog. Lipoproteine bilden. Triglyceride bilden dabei bevorzugt Chylomikronen. klein Dichte Groß Größe VLDL LDL HDL 264 (Hälfte der Triglyceride) (fast keine Triglyceride) groß d) Klein Elektrolyte Bei den Elektrolyten hat man einen unterschiedlichen Bedarf (K > Ca > Cl > PO3 > Na > Mg). Der Transport erfolgt durch basolaterale Na+-K+-Kanäle. Die Elektrolyte selbst (Calcium und Phosphor) stammen aus der Nahrung oder aus körpereigenen Depots, z. B. dem Knochen. Bei kataboler Stoffwechselsituation erfolgt die Freisetzung aus den Knochen durch STH. Abgabe der Substanzen Abgabe von Substanzen an Vesikel (Golgi-Apparat, z. B. Laktose, Kasein) Abschnürung von Zellteilen, z. B. Fett Aufnahme aus dem Blut und Abgabe an der apikalen Membran, z. B. Elektrolyte, Spurenelemente, H2O und Ig G. Der wichtigste Transportmechanismus ist dabei die Na +-K+Pumpe. 3. Energie- und Nährstoffbedarf bei der Laktation Einfluß auf die Milchleistung Anzahl der sezernierenden Zellen (Alveolarzellen) ist genetisch bedingt (1 kg Euter 1 l Milch) sekretorische Aktivität der Zellen (abhängig von der Enzymausstattung) Alter (bis 15 Jahre) Gesundheit (bei kranken Tieren fällt die Milchleistung ab) Klima (maximale Milchleistung wird in der Indifferenzzone erbracht) Ernährung (optimale Ernährung bringt eine hohe Milchleistung (Propionat für Glucose, Acetat und Butyrat für Fettsäuren und Calcium). Bei Mangelerscheinungen unterscheidet man zwischen allgemeinen Mangel und speziellem Mangel (Glucose, Energie) Energiebedarf Erhaltung Wachstum (Trächtigkeit) Milchbildung (je nach Leistung) Ein kg Milch enthält 3150 kJ, 525 kJ werden dafür benötigt. Der Ausnutzungsgrad der umsetzbaren Energie für die Milchgewinnung beträgt 60 %. 40 % gehen als Wärme verloren. Man benötigt 5250 kJ umsetzbare Energie zur Bildung von 1 kg Milch. Metabolische Anpassungen erhöhte Aufnahme von Futter und Energie intensivere Ausnutzung des aufgenommenen Futters Nutzung körpereigener Soff- und Energiereserven (Fett) Glucose und Aminosäuren werden zur Milchbildung verwendet Am Anfang der Laktation hat man eine katabole Stoffwechsellage. Es erfolgt der Abbau von Körpermasse. Die Versorgung der Milchdrüse hat höchste Priorität! Kurz nach der Geburt steigt die Futteraufnahme an: 265 Magen-Darm-Trakt Leber a) Förderung Größe und Resorption Gluconeogenese Ketogenese Laktationsketose) Fettgewebe Lipolyse Muskulatur Eiweißabbau Hemmung und ( Glucoseaufnahme, Lipoproteinlipase, Fettsäureveresterung und Lipogenese Glucoseaufnahme und Eiweißsynthese Glucosebedarf 1 kg Kuhmilch enthält 72 g Glucose aus dem Blut. Die Glucosekonzentration im Blut des Wiederkäuers fällt sehr ab, denn die gesamte Vormagenglucose wird von den Vormagenbakterien zu kurzkettigen Fettsäuren umgebaut. Die Leber muß daraufhin wieder aus Propionat Glucose aufbauen. Die Glucose der Wiederkäuer stammt aus verschiedensten Quellen: 1. 2. 3. 4. b) Intestinale Resorption (< 20 %) Gluconeogenese in der Leber aus kurzkettigen Fettsäuren (Propionat) und Aminosäuren. Das ist eine sehr wichtige Glucosequellen für die Zeit der Laktation. Glycogenreserven in der Leber (Glykogenreserven der Muskulatur sind sehr gering) Depotfett (Nachteil, da hier vermehrt Ketonkörper gebildet werden Gefahr der Ketose Acidose) Fettbedarf Das Fett besteht aus Triglyceriden, die aus Glycerin und Fettsäuren aufgebaut sind, die aus dem Blut stammen. Dazu gehören auch noch Phospholipide, Cholesterin, freie Fettsäuren, sowie fettlösliche Vitamine. Ketoseprophylaxe wenig Fett Kraftfutter mit hohem Propionat- und Glucoseanteil kleinere Futterrationen 4. Hormonelle Regulation der Laktation Stimulation durch: a) Prolaktin Das Prolaktin ist ein Peptidhormon aus dem HVL. Die Bildung erfolgt im Hypophysenvorderlappen. Stimuliert wird die Ausschüttung von einem Releasing-Faktor aus dem Hypothalamus. Dieser produziert PRF, der die Sekretion stimuliert und PIF, der die Sekretion hemmt. Die Wirkung des Prolaktin bezieht sich auf die Synthese von Milcheiweiß, Milchzucker und Milchfett. In den Alveolarzellen erfolgt: 266 eine Erhöhung der Na+-K+-ATPase-Aktivität eine Erhöhung der intrazellulären Ca2+-Konzentration eine Aktivierung einer Phospholipase Die Aktivierung der Phospholipase führt zu: b) Freisetzung von Arachnidonsäure aus Phospholipiden Synthese von Prostaglandinen cGMP steigt an, cAMP fällt ab Stimulation der Synthese von spezifischer m-RNA Enzyminduktion Stimulation der Synthese von Milcheiweiß (Kasein) in den Alveolarzellen, Synthese von Milchzucker (Lactose) und Milchfett Abgabe von organischen Milchbestandteilen Plazentares Laktogen Die Bildung erfolgt im fetalen Anteil der Plazenta beim Wiederkäuer und beim Mensch. Stimuliert wird das Wachstum und die Funktion der Milchdrüse während der Reifung. c) Somatostatin C Es wird nach der Einwirkung von STH in der Leber produziert und vermittelt eine STH-anabole Wirkung. Es fördert die Durchblutung der Milchdrüse Somatomedine sind Proteine, die eine 40 %ige Homologie in der Aminosäuresequenz zum Insulin aufweisen. d) Insulin-like-growth-factors (IGF) Sie werden bei anaboler Stoffwechsellage produziert und fördern die Wirkung des Wachstumshormon. Daraufhin stellt sich die Stoffwechsellage um, z. B. mit einer Steigerung der Glucose- und Aminosäureaufnahme am Euter. Die Wirkung tritt hauptsächlich am Euter auf, da hier die Somatomedinrezeptoren empfindlicher auf IGF-1 reagieren. e) Östrogene und Progesteron s. Hormone bzw. Fortpflanzung Allgemeine Hormonwirkung ACTH Corticoide Glucogenese steigt TSH T3 Alveolarzellen Wenn Insulin fällt und Glucagon steigt an Hemmung der Lipolyse STH Somatomedine anabole Stoffwechsellage: Aufnahme und Durchblutung steigen an) 5. Eigenschaften und Zusammensetzung der Milch Zusammensetzung der Kuhmilch 267 Die Zusammensetzung der Kuhmilch ist speziesabhängig. Durchschnittswerte sind 3,6 % Fett, 4,8 % Lactose und 3,5 % Protein (2,7 % davon sind Casein). Bestandteile zelluläre Bestandteile: 100 000 Zellen/ml Milch (50 % Leukozyten, 30 % Lymphozyten) Fett99: Die Fetttröpfchen sind von einer Haptogenmembran, eine Protein-Phospholipid-Membran aus dem Alveolarepithel umgeben. (ca. 3 - 5 m Milchfett). Der Gehalt ist abhängig von der Fütterung: hohe Acetatbildung im Pansen Milchfett steigt an hohe Propionatbildung durch einen hohen Kraftfutteranteil Milchfettgehalt sinkt Eiweiß: -, - und -Kasein (Phosphoproteine) liegen in der Milch als Calciumsalze vor Lactose: besteht aus Glucose + Galactose. Wenn der Gehalt an Galaktose in der Nahrung gering ist, so erfolgt die Neubildung aus Glucose. Mineralstoffe, Elektrolyte, Spurenelemente: Kalium, Calcium, Phosphat, Chlorid, Natrium, Magnesium Vitamine: Es sind alle Vitamine in der Milch enthalten. Die Mengen schwanken sehr stark, d.h. es gibt tierartliche Unterschiede und es ist abhängig von der Fütterung. C- und B-Komplex: ist unabhängig von der Art der Futteraufnahme (werden von Pansenbakterien synthetisiert) A- und D-Komplex (fettlöslich): ist vom Futter abhängig Eigenschaften Milch ist plasmaisoton und hat eine Dichte ~ 1 6. Funktion der Kollostralmilch Die 1. Milch nach der Laktationsperiode wird als Kollostrum bezeichnet. Sie beinhaltet einen höheren Gehalt an Trockensubstanz und Immunglobulinen und einen geringeren Anteil an Wasser. Zusammensetzung (vgl. Zu normal) Wasser Trockensubstanz Kasein Plasmaproteine (Albumine und Globuline) Fett Milchzucker Salze Funktionen Für die Neugeborenen sind leicht verfügbare Nährstoffe und Energie dabei, es ist reich an Vitaminen und Spurenelementen (Jod, Selen). Es wirkt auf den Darm, so daß die Darmtätigkeit in Gang gesetzt 99 Je höher der Fettgehalt der Milch ist, desto niedriger ist der Gehalt der Laktose, desto schneller das Wachstum (Verdopplung des Geburtsgewichtes schnell). Es ist allerdings auch stark Individuenabhängig. 268 wird. Zusätzlich dient es noch der passiven Immunisierung des Neugeborenen, deren Abwehrfunktion ansteigen (IgA und IgG). Die Fähigkeit des Immunsystems eigene Antikörper zu produzieren, setzt erst nach 1 - 10 Tage nach der Geburt ein. IgA: Plasmazellen des Muttertieres IgA direkt in die Milch IgG: Plasmazellen im Blut Alveolarzellen Endozytose + Exozytose: durch rezeptorvermittelte Endozytose in die Alveolarzellen und werden apikal durch Exozytose wieder ausgeschieden. Die Übertragung der Immunglobuline erfolgt mit tierartliche Unterschieden. Entweder über die Plazenta (intrauterin), über das Kollostrum oder manchmal auch über beide Mechanismen. durch Kollostralmilch: Pferd, Rind, Schwein, Ziege, Schaf (nicht selektiv) gemisch: Hund, Katze, Ratte, Maus (selektiv IgG) intrauterin: Primaten, Mensch, Meerschweinchen, Kaninchen (Plazenta-IgG) Schutz der Proteine vor Verdauung Durch die Kollostralmich wird im Magen der Neugeborenen weniger HCL und Pepsin, aus dem Pankreas weniger Peptidasen gebildet und ein in der Milch befindlicher Inhibitor für Trypsin und Chympotrypsin setzt diese außer Gefecht. Zusätzlich wirkt die Kollostralmilch noch als Puffer, so daß die Aufnahme der Immunglobuline gewährleistet ist. Kollostralfaktoren und Hormone (Cortison) sorgen ebenfalls für eine Abdichtung der Darmwand (nach 2 Tagen) und die Bildung neuer Enterozyten. Um zu verhindern, daß die Milch beim Kalb durch Bakterien umgesetzt wird, verschließt der Schlundrinnenreflex den Pansen und dient somit als Verlängerung bis zum Labmagen. 269 WACHSTUM 1. Allgemeines Wachstum: Zunahme der Größe eines Systems Hypertrophie: Zunahme der Größe der Einzelelemente Hyperplasie: Zunahme der Anzahl der Einzelelemente 2. Faktoren des Wachtums100 Genetische Merkmale Unterschiedliche Rassen, z. B. Größenunterschiede Züchterische Selektion Regulation der Futteraufnahme durch Leptin Stoffwechselniveau Ernährung Die Ernährung bezieht sich weitgehend auf die Energie- und Eiweißzufuhr, aber auch auf Mineralstoffe, essentielle Aminosäuren und Kohlenhydrate. Dabei muß die Nahrungsmenge ausreichen, damit die genetischen Merkmale vollständig ausgeprägt werden können. Dazu gehören ZNS, Knochen, Muskeln und Fett, wobei bei der Ausbildung auch verschiedene Prioritäten bei der Versorgung herrschen: ZNS > Knochen > Muskeln > Fett. Ebenso muß der Grund- und Leistungsbedarf mit der Ernährung gedeckt werden. Bei einer Unterversorgung tritt ein vermindertes Wachstum auf. Das gleiche findet man auch bei einem selektiven Mangel. Unter einer kritischen Phase versteht man eine Unterversorgung, die zu irreversiblen Schäden führt. Energie- und Stoffwechsel für andere Leistungen Arbeit Laktation Gravidität Umgebungstemperatur und Klima Bei Themperaturneutalität bzw. Indifferenztemperatur gibt es fast keinen Energieverbrauch für die Wärmeerhaltung optimal für Wachstum geeignet. Zu hohe oder zu niedrige Umgebungstemperaturen vermindern das Wachstum. Der Indifferenzbereich ist aber abhängig von der Isolation, der Größe des Tieres, Fütterung und der körperlichen Leistung. 100 Die Faktoren des Wachstums beschränken sich auf das Einzelwesen. 270 Hormonelle Steuerung beim einzelnen Individuum Wachstumshormon Schilddrüsenhormon 3. Hormone, die das Wachstum beeinflussen Allgemeine Hormone Hormone STH Somatomedine Schilddrüsenhormon Wirkung auf das Wachstum Hormonwirkung am Knochen Hormone STH101 Wirkung auf das Knochenwachstum Die STH-Wirkung wird über Somatomedine vermittelt. Stimulation der Proteinbiosynthese, v. a. Kollagen für Knorpel und Knochen Stimulation des Wachstums durch eine vermehrte Anlagerung von Chondroitinsulfat Geschlechtshormone (Östrogene, Androgene) Die Ausschüttung erfolgt bei einem niederen Ca2+-Spiegel im Plasma. Die Funktion ist sehr vielfältig: Parathormon und Vitamin D3102 Calcitonin103 1. auf die Zellen des Knochens: Osteozyten: Freisetzung von Ca2+ aus dem Osteoid Osteoklasten: Abbau des Knochens durch Säure und Kollagenasen, dabei stiegt die Osteoklastenanzahl an Osteoblasten: Hemmung der Kollagensynthese und der Mineralisation 2. auf die Niere: Hier wird die Vitamin D-1-Hydroxyse aktiviert, so daß Vitamin D3 gebildet wird. Das Vitamin D3 hat seinerseits auch Wirkungen auf das Wachstum: Darm: erhöht die Calciumrückresorption Niere: erhöhte Calciumrückresorption, sowie eine verminderte PO3-Resorption Hemmung der Osteoklastentätigkeit Verdauungstätigkeit wird verlangsamt, so daß es zu einer vermehrten Ca2+-Aufnahme kommen kann Calcitriol104 101 STH sowie Geschlechshormone (Östrogene und Androgene: Wachstum Knochenabbau (Resorption des Knochens) 103 Hemmung der Resorption 104 Knochenumbau 102 271 Thyroxin (T3)105 Glucocorticoide Bildung von STH Förderung des Knochenumbaus Einbau von Na-K-ATPasen Osteoklastenanzahl Hormonwirkung an der Muskulatur Hormone STH106 Geschlechtshormone107 (Östrogene, Androgene) Glucocorticoide108 Thyroxin (T3) Wirkung auf das Muskelwachstum Proteinnettosynthese AS-Passage durch die Zellmembran , verbesserte Aufnahme von Aminosäuren in die Muskelzellen Ribosomenaktivierung AS-Einbau Hemmung des Proteinabbau indirekte Wirkung über STH werden durch Glucocorticoide gehemmt Bildung von STH Einbau von Na-K-ATPasen Hormonwirkung am Fettgewebe Hormone STH109 Insulin110 Adrenalin, Noradrenalin Glucagon Schilddrüsenhormon Glucocorticoide Wirkung auf das Fettgewebe direkte anabole Wirkung auf: Steigerung der Lipolyse zur Energiegewinnung verminderte Glucoseaufnahme Steigerung der Lipogenese durch die Lipoproteinlipase Glucoseaufnahme in die Zelle Hemmung der Lipolyse Aktivierung der hormonsensitiven Triacylglycerinlipase (Stimulation der Lipolyse) Aktivierung der hormonsensitiven Triacylglycerinlipase Aktivierung der hormonsensitiven Triacylglycerinlipase Hemmung der Glucoseaufnahme Hemmung der Lipogenese 4. Wirkungen des STH Wachstumswirkungen (anabol) 105 Thyroxin und Glucocorticoide: Knochenumbau (Resorption des Knochens) Förderung: Knochenwachstum und Lipolyse/ Hemmung: Glucoseaufnahme in die Zelle 107 Muskelwachstum 108 Muskelwachstum 109 STH, Adrenalin und Noradrenalin, Glucagon, Schilddrüsenhormon: Lipolyse 110 Lipolyse 106 272 Das sind indirekte Wirkungen des STH, weil sie über Somatomedine vermittelt werden. Sie werden v. a. in der Leber, aber auch in der Muskulatur gebildet. Knochen und Knorpel: Deposition von Chondroitinsulfat und Bildung von Kollagen Muskulatur und andere Gewebe: Proteinnettosynthese steigt an: vermehrte Aminosäure-Passage über Zellmembranen Ribosomenaktivierung Aminosäureinkorporation steigt an (Aufnahme) Hemmung des Proteineinbaus, dafür Stimulation der Proteinbiosynthese Stoffwechselwirkungen (katabol) Hier handelt es sich um direkte STH-Wirkungen. Fettstoffwechsel: Durch die Stimulation der Lipolyse, kommt es zu einem vermehrten Abbau von Fettsäuren bei reduzierter Gluconeogenese aus Proteinen (ketogener Effekt) Kohlenhydratstoffwechsel: verringerte Glucosepassage in die Zellen (diabetogener Effekt) STH-Sekretion Die STH-Sekretion wird gesteigert: Abfall des STH-Spiegels im Plasma Abfall von Glucose und freien Fettsäuren im Blut Ansteig der Aminosäure-Konzentraion im Blut 5. Knochenwachstums Knochenzellen111 Osteoklasten dienen dem Knochenabbau. Zu diesem Zweck sezernieren sie Kollagenase und Protonen, die das Osteoid auflösen. Sie enthalten viele Mitochondrien, Lysosomen (Sekretgranula), Enzyme (Kollagenasen, Proteasen) und Säuren (Citronensäure). Die Entkalkung des Knochens geschieht durch die Howshipsche Lagune! Chondroblasten werden durch den Aufbau von Knorpel zu Chondrozyten, die dann wieder beim Knochenabbau umgewandelt werden in Chondroclasten. Osteoblasten bilden Knochengrundsubstanz (Osteoid mit hohem Kollagengehalt). Das Osteoid mineralisiert dann durch Einlagerung von Calcium und Phosphat. Eingemauerte Osteoblasten werden zu Osteozyten, die durch Ausläufer miteinander verbunden sind. Mesenchymale Stammzelle Prächondroblast Präosteoblast Chondroblast Osteoblast Aufbau des Knorpels Verknöcherung 111 Während des Wachstums, aber auch im adulten Zustand, muß sich das Knochengewebe laufend den veränderten Bedingungen (Belastungsänderungen) anpassen, das durch Umbau erreicht wird. Osteoklasten bauen ältere Strukturen ab, während Osteoblasten den Knochen in geänderter Form wieder aufbauen. 273 Chondrozyt Osteozyt Abbau des Knorpels Chondroclast Knochenbildung Knochengewebe entsteht entweder direkt aus dem Bindegewebe durch desmale Ossifikation oder indirekt aus Knorpel durch chondrale Ossifikation a) Desmale Ossifikation Osteoblasten scheiden die Grundsubstanz Osteoid und Tropokollagen ab, das zu kollagenen Fibrillen aggregiert. An diese lagern sich die anorganischen Salze an. So entstehen Ossifikationspunkte (Knocheninseln) mit eingemauerten Osteoblasten, die jetzt Osteozyten heißen. Das Ergebnis ist ein Faserreicher, mineralsalzarmer Geflechtknochen, der später zu Lamellenknochen umgebaut wird. Durch desmale Ossifikation entstehen die Knochen des Schädeldaches und des Gesichtsschädels. b) Chondrale Ossifikation112 Bsp. Röhrenknochen. Osteoblasten des Perichondriums bilden nach Art der desmalen Ossifikation um die knorpelige Diaphyse (Mittelstück) eine perichondrale Knochenröhre (perichondrale Ossifikation). Der Knorpel der Diaphyse wird blasig, verkalkt und in die Lücken wachsen Blutgefäße hinein, die Chondroklasten und Osteoklasten transportieren. Durch Knorpelabbau und Knochenbildung (encholdrale Ossifikation) verknöchert die Diaphyse im Inneren. Dabei dildet sich die primäre Markhöhle mit dem primären Mark. Peri- und enchondral gebildetes Knochengewebe verbindet sich und die Ossifikation setzt sich in Richtung auf die Epiphysen fort. 6. Hormonelle Regulation des Knochenwachstums Stimulation des Knochenwachstums Wachstumshormon STH (über Somatomedine) Geschlechtshormone (Testosteron und Östrogene) Knochenresorption Förderung der Resorption Parathormon 1,25-Dihydroxy-Vitamin D3 (Calcitriol) Thyroxin (T3) Glucocorticoide Hemmung der Resorption Calcitonin Aufgaben der Hormone 112 Bei des chondralen Ossifikation bildet sich zuerst ein mechanisch wenig belastbarer Geflechtknochen (entspricht verknöchertem Bindegewebe). 274 Parathormon: Das Parathormon wird abgegeben, wenn die Ca2+-Konzentration im Plasma abfällt. Es ist eng mit dem Calciumhaushalt des Körpers verbunden und hat folgende Wirkungen am Knochen: Osteozyten: Angriff des Osteoid, Freisetzung von Ca2+ aus dem Knochen in EZF Osteoklasten: Auflösung von Knochen durch Säure und Kollagenasen und gleichzeitig Erhöhung der Osteoklastenanzahl Osteoblasten: Hemmung der Kollagensynthese und der Mineralisation Niere: Stimulation von Vitamin D-1-Hydroxyse, Hemmung der Phosphatresorption und Steigerung der Ca2+-Resorption Darm: Ca2+-Resorption und Phosphat-Resorption steigt an (indirekt über D3-Hormon) Calcitonin: wird in der Schilddrüse produziert und wirkt als Antagonist zum Parathormon. Es wird bei einem Ansteig der Plasmacalciumkonzentration ausgeschüttet und hemmt die Osteoklasten Vitamin D3-Hormon: Es ist ein Steroidhormon mit folgender Wirkung: Stimulation der Calcium- und Phosphatresorption im Darm (Mehr Substrat für den Knochenaufbau) wichtig für den Knochenumbau Wachstumshormon (STH): Sekretion von STH: s. vorne! Stimulation der Proteinsynthese Stimulation des Wachstums von Knochen und Knorpel (vermehrte Ablagerung von Chondroitinsulfat) Bildung von Knochengrundsubstanz Vermittlung der Wirkung über Somatomedine Zellvolumen und Zellteilungsrate Thyroxin: Förderung des Knochenumbaus STH-Freisetzung Aktivierung von Na-K-ATPasen Glucocorticoide: Erhöhung der Osteoklastenabzahl für den Knochenabbau Sexualhormone: Knochenwachstum wird gefördert durch Östrogene und Testosteron 7. Regulation des Calciumhaushaltes Im Hungerzustand kommt es zum Fettabbau, Muskelabbau und Knochenabbau. Knochen deshalb, weil es der wichtigste Mineralstoffspeicher im Körper ist. Die Regulation wird durch das gemeinsame Wirken von Parathormon, Vitamin D3 und Calcitonin normalerweise in engen Grenzen konstant gehalten. (s. auch Regulation des Knochenwachstums!) a) Calcitonin Es ist ein Schilddrüsenhormon bestehend aus 32 Aminosäuren. Es wird bei Ansteig des Calciumspiegels im Blut ausgeschüttet und wirkt als Antagonist des Parathormons. Es fördert die Ausscheidung von Ca2+, Phosphat und Natrium durch die Nieren. Wenn der Phosphatspiegel sinkt, sind die Angriffspunkte altersabhängig: b) im Wachstum: am Skelett (Hemmung der Osteoklasten) im Alter: Förderung des Ca2+-Einbaus ins Osteoid Parathormon PTH 275 Es stammt aus der Nebenschilddrüse, hat 84 Aminosäuren und wird abgegeben, wenn der Calciumspiegel abfällt. Angriffspunkte und Stoffwechselwirkungen sind: c) Skelett: Förderung des Knochenabbaus und Förderung der Ca2+-Freisetzung Niere: Hemmung der Phosphatresorption und Stimulation der Calciumresorption durch die Umwandlung von 25-Hydroxycholecalciferol zu Vitamin D3 (1,25-Hydrohycholecalciferol) Vitamin D3 (Calcitriol) Es ist eine fettlösliche Substanz und wird bei einem absinken des Plasma-Ca2+-Spiegels ausgeschüttet. Es führt zur Steigerung der intestinalen Ca2+-Resorption und zur Ca2+Mineralisierung des Knochen. 8. Regulation des Fetthaushaltes Funktion des Fettgewebes Thermoregulation (Isolationsschicht) Langzeitspeicher für Energie (in Form von Triacylglycerinen) Arten des Fettgewebes a) Braunes Fettgewebe Es findet man v. a. bei Jungtieren, kälteadaptierten Tieren und Winterschläfern. Es ist reich an Mitochondrien zur zitterfreien Thermogenese. Stimuliert wird es über -adrenerge Rezeptoren, die die hormonsensitive Lipase in den Fettzellen aktiviert. Stare Wärmebildung in der darauf folgenden Oxidation der freigesetzten Fettsäuren durch Entkopplung der oxydativen Phosphorylierung in den Mitochondrien. b) Wießes Fettgewebe Es dient als Baufett, Schmierfett und als Schutzschicht für Organe. Entwicklung Die Bildung von Fettzellen erfolgt aus undifferenzierten Mesenchymzellen. Bei Haussäugetieren erfolgt der Abbau des braunen Fettgewebes zugunsten des weißen Fettgewebes. Die Vermehrung des Fettgewebes erfolgt durch Hyperplasie und Hypertrophie Fettdepots bei Adulten Speicherung von Lipiden erfolgt in Form von Triglyceriden. Triglyceride werden im Körper durch Lipoproteine transportiert. Subkutanes Fett Intermuskuläres Fett Perirenales Fett (Baufett) Fett im Netz und Mesenterium (Baufett) Intramuskuläres Fett zwischen Muskelfasern 276 Pericardiales Fett (Bafett) Fett im Leistenkanal (Baufett) Hormonelle Regulation a) Lipogenese b) stimuliert durch Insulin (siehe Hormone!) gehemmt durch Glucocorticoide (Bildung erfolgt in den NNR: Cortisol, Cortison, Corticosteron) Lipolyse stimuliert durch das Wachstumshormon, Adrenalin, Glucagon und Schilddrüsenhormon gehemmt durch Insulin 9. Regulation des Muskelwachstums Ablauf Fetus: Hyperplasie (Mengenzunahme) nach der Geburt: Hypertrophie (Größenzunahme) Hormonelle Regulation Sie erfolgt über das Wachstumshormon STH (Aufgaben von STH s. vorne), Östrogene und Androgene durch eine Stimulation des Wachstums. Gehemmt wird das Wachstum durch Glucocorticoide. 277