Hormonelle Regulation und zelluläre Signaltransduktion
Werbung

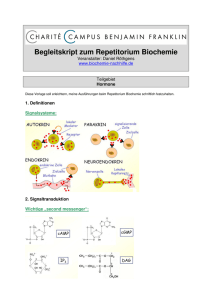
Hormonelle Regulation und zelluläre Signaltransduktion Teil II 1. Allgemeine Prinzipien der zellulären Kommunikation und Signaltransduktion 2. Die G-Protein-gekoppelte Signaltransduktionskaskade: Komponenten und Mechanismen 3. Durch Defekte in der G-Proteinaktivität verursachte Krankheitsbilder 1. Allgemeine Prinzipien der zellulären Kommunikation und Signaltransduktion Der Informationsaustausch zwischen den Zellen kann auf elektrischem oder chemischem Wege stattfinden. Die elektrische Informationsübertragung wird von unserem Nervensystem für eine schnelle Regulation genutzt, unser Hormonsystem hingegen nutzt zum Informationsaustausch den langsameren chemischen Weg. Diese chemische Kommunikation geschieht über Botenstoffe wie Hormone und Mediatoren. Die klassischen Hormone werden von einer endokrinen Drüse gebildet und ins Blut abgegeben, wo sie dann an einer anderen Stelle wirken. Man unterscheidet 4 verschiedene chemische Kommunikationswege. Endokrine Wirkung: Der Pankreas schütte Insulin ins Blut aus, welches dann an z.B. Muskeln wirkt. Als Mediatoren werden Substanzen bezeichnet die nicht direkt ins Blut abgegeben werden sonder gleich auf die Nachbarzellen wirken, was man als parakrine Wirkung bezeichnet. Eine Mediator produzierende Zelle kann sich aber auch selber stimulieren was man als autokrine Wirkung bezeichnet. Neurotransmitter wirken ebenfalls parakrin. Sie werden von der Nervenzelle hergestellt und in den synaptischen Spalt abgegeben. Das Nervensystem ist im Gegensatz zum Hormonsystem zweisprachig, es kommuniziert elektrisch und chemisch. Signaltransduktion Als Signaltransduktion wird die Übertragung eines hormonellen Signals auf die entsprechenden Effektormoleküle im Inneren einer Zelle bezeichnet. Die gleichen Hormone können an verschiedenen Zelltypen unterschiedliche Wirkungen haben. Das liegt daran, dass das intrazelluläre Zielprotein je nach Zelltyp unterschiedlich auf 2 die produzierten second messenger reagieren kann. So führt zum Beispiel eine Erhöhung des second messenger cAMP in glatten Muskelzellen zu einer Kontraktion, in Herzzellen hingegen zu einer Erschlaffung. Innerhalb einer Zelle bewirkt eine cAMP Erhöhung allerdings immer das gleiche, egal durch welches Hormon diese Konzentrationserhöhung verursacht wurde. Der Mechanismus der Signaltransduktion ist auch wichtig, um das hormonale Signal zu verstärken. Ein Hormon, das an seinen Rezeptor bindet, ist in der Lage, viele Effektormoleküle zu aktivieren und damit – zum Teil sich ergänzende – Effekte im Zellinneren zu erzeugen. Man unterscheidet dabei zwischen hydrophilen und lipophilen Hormonen Hydrophile Hormone: Bei den Rezeptortypen I-III handelt es sich um Membranrezeptoren, an denen hydrophile Hormone von außen an die Zelle binden. Mittels eines second messenger werden dann die Signale ans Zellinnere vermittelt. Die second messenger greifen direkt in den Zellstoffwechsel ein indem sie vorhandene Proteine verändern. Lipohile Hormone Der vierte Rezeptor liegt intrazellulär und dient lipohilen Hormonen als Andockstelle. Lipohile Hormone könne die Zellmembran einfach überwinden. Der Hormon-RezeptorKomplex bindet z.B. an die DNA im Zellkern und verändert die Genexpression einer Zelle. Sie beeinflussen damit die Anzahl bestimmter Proteine in einer Zelle. Man unterscheidet bei den Hormonen drei verschiedene chemische Grundgerüste: hydrophile Peptidhormone Über second messenger wird die Wirkung in das Zellinnere vermittelt, wo sie dann eine Umstellung des Stoffwechsel bewirken. Ihr Abbau geschieht entweder im Blut durch Peptidasen oder sie fallen der Nieren zum Opfer wo sie filtriert, resorbiert und dann intrazellulär abgebaut werden. lipophile Steroidhormone da sie apolar und im Blut nicht ausreichend gelöst werden können benötigen sie Proteine um transportiert zu werden. Ein solches Transportprotein ist für das Kortisol das Transkortin. Vor der Zielzelle muss sich dann das Steroidhormon von seinem polaren Transportprotein trennen um die lipophile Schicht der Membran überwinden zu können. Die Wirkung besteht in der langfristigen Änderung der Enzymausstatung bestimmter Zellen, indem deren Expression verändert wird. Im Rahmen der Biotransformation in der Leber werden sie inaktiviert und dann über Niere oder Darm ausgeschieden. Im Fordergrund der Metabolisierung der Hormone stehen dabei die Sulfanierung und die Glukuronidierung. Aminosäure-Derivate (bis auf Thyroxin hydrophil) Entsteht durch chemische Veränderung an einzelnen Aminosäuren. 3 Hydrophile Hormone regulieren die Aktivität vorhandener Enzyme, lipophile Hormone die Menge der Enzyme. Aktivierung oder Deaktivierung brauchen wesentlich weniger Zeit als die Neuproduktion eines Enzyms. Daher werden kurzfristige Regulationsaufgaben von hydrophilen, längerfristige von lipophilen Hormonen übernommen. Bsp. Adrenalin beim Schreck -> hydrophil, Kortisol bei Dauerstress –> lipophil Rezeptortypen Unser Hormonsystem ist nicht in der Lage, irgendwelche Botenstoffe gerichtet an ein bestimmtes Ziel zu schicken. Für die Selektivität ist allein die Rezeptorverteilung im Körper entscheidend. In unserem Körper existieren 4 verschieden Mechanismen, über die eine Hormonwirkung vermittelt werden kann. Typ-I-Rezeptor / Tyrosinkinase-Rezeptoren Die Bindung des Hormons lösen eine oder mehrere Autophosphorylierungen an Tyrosylresten des Rezeptorproteins aus. Sie werden also selbst katalytisch aktiv werden. Insulinrezeptor, das Enzym ist dabei in den meisten Fällen Tyrosinkinase, also ein Enzym, das tyrosinreste von Proteinen phosphoyliert. 4 Typ-II-Rezeptoren / Ligandenaktivierte Ionenkanäle Werden durch extrazelluläre Liganden (Signalstoffe) aktiviert: Acetylcholin Glutamat Serotonin GABA Nach der Hormonbildung werden Ionenkanäle geöffnet, was eine Depolarisation der Zelle zu folge haben kann. Typ-III-Rezeptor / G-Protein-gekoppelte Rezeptoren Sie bilden die größte Gruppe an Hormonrezeptoren. Die Aktivierung der intrazellulären Enzyme übernehmen G-Proteine (Guaninnukleotidbindende Proteine), die von den extrazellulären Hormonen über deren Rezeptor aktiviert werden. Die aktivierten Enzyme produzieren dann ihrerseits weitere Botenstoffe, die den Hormoneffekt in der Zelle auslösen. Intrazelluläre Rezeptoren Typ-IV Im Gegensatz zu den membranständigen Rezeptoren wirken die intrazellulären Rezeptoren in erster Linie auf DNA-Ebene, indem sie dort die Expression verschiedener Gene variieren. Die Rezeptoren sind im Cytosol -> Cortisolrezeptor Nucleär anzutreffen. 5 2. Die G-Protein-gekoppelte Mechanismen Signaltransduktionskaskade: Komponenten und G-Proteine befinden sich an der Innenseite der Membran. Nach ihrem Aufbau kann man sie unterscheiden in: o große heterotrimere G-Proteine o monomere G-Proteine Sie machen 80% aller Rezeptoren aus. Über diese Klasse von Rezeptoren binden Liganden wie: Hormone, Wachstumshormone, Neurotransmitter, autokrine und parakrine Faktoren, olfaktorische und geschmackliche Stoffe, Photonen. Liganden sind chemischer und physikalischer Natur, Proteine oder Aminosäuren. Ihre Aufgabe ist die Übermittlung von Signalen extrazellulärer Rezeptoren in das Zellinnere. Sinn der Signaltransduktion durch eine Reaktionskaskade über G-Proteine ist zum einen eine deutliche Verstärkung des Signals (bis zum Faktor 107), weil ein Rezeptor viele G-Proteine aktiviert, von denen wiederum jedes einzelne unzählige Mengen an primären Effektorenzymen beeinflusst. Ein weiterer Vorteil der G-Proteine ist, dass sie sich selbst rechtzeitig „abschalten“ und es so zu keine Daueraktivierung kommt. G-Protein gekoppelte Rezeptoren sind aus einer einzelnen Peptidkette aufgebaut und durchdringen die Membran siebenfach. Ihr N-Terminus liegt extrazellulär, der C-Terminus reicht in den Intrazelulärraum hinein. Zwischen den sieben Transmembranhelices, die in der Zellmembran ringförmig gruppiert sind, bilden sich zu beiden Seiten der Zellmembran je drei Schleifen aus. Zwischen fünfter und sechster Transmembrandomäne befindet sich eine große cytoplastische Schleife, die den mit dem G-Protein kommunizierenden teil des Rezeptors darstellt. Am wichtigsten sind die heterotrimeren G-Proteine, welche man in drei Komponenten aufteilen kann. Die -, - und -Untereinheiten. Die -Untereinheit hält dabei im inaktiven Zustand ein GDP gebunden, im aktiven ein GTP. Lange ist man davon ausgegangen, das nur die -Untereinheit in der Lage ist Effektor Systeme anzusteuern, neuerdings ist aber bekannt, dass auch die - und -Untereinheiten dazu in der Lage sind. Es sind 20 verschiedene Subtypen von G, 6 von G und 12 von G bekannt. 6 Aktivierung der heterotrimeren G-Proteine 1. Durch Bindung eines Hormons an die Außenseite erfolgt die Aktivierung des Rezeptors, wodurch dieser seine Konformation ändert und das GDP von der Untereinheit des G-Proteins abspaltet. Aufgrund der hohen Affinität des Guaninnucleotid-freien G-Protein zu GTP bindet dieses anstelle des GDP sogleich ein GTP. Dabei geht es vom inaktiven in seine aktive Form über. 2. Das aktive G-Protein löst sich von der Zellmembran ab und dissoziiert in die aktive GTP-Untereinheit sowie den --Komplex. 3. Die -GTP Untereinheit des G-Proteins stimuliert nun z.B. die Adenylatzyklase und es kommt zum Anstieg des „second messengers“ cAMP. 4. Um die stimulierende Wirkung zu beenden, muss die aktive -GTP in die inaktive GDP Form überführt werden. Hierzu besitzt das G-Protein eine GTPase, die oftmals durch ein GTPase aktivierendes Protein aktiviert wird. 5. Die inaktive -Untereinheit lagert sich wieder an die -/-Untereinheit des G-Proteins an. Die von der -GTP-Untereinheit aktivierbaren Enzyme sind die Produzenten des second messenger, die den Zellstoffwechsel beeinflussen. G-Proteine können eine second messenger stimulierende Gs oder inhibitorische Wirkung haben Gi. 7 Wichtige G-Protein gekoppelte Enzyme sind: - Adenylatzyklase welche bei Stimulation cAMP bildet Guanylatzyklase welche bei Stimulation cGMP bildet Phospholipase C welche durch Spaltung von PIP2 die second messenger IP3 und Diazylglycerol synthetisiert. IP3 setzt nach seiner Bindung an seinem Rezeptor aus einem intrazellulären Speicher Ca2+Ionen frei -> diese aktivieren oder hemmen dann Botenstoffe intrazellulärer Enzyme und Ionenkanäle. Diazylglycerol stimuliert Ca2+ abhängig die Proteinkinase C welche die Phosphorylierung von Proteinen fördert. Enzymaktivierung am Beispiel von Adenylatzyklase und dem Liganden Glukagon - - - - - Glukagon lagert sich an das N-Terminale Ende des G-Protein gekoppelten Rezeptors und aktiviert das G-Protein. Die aktive -GTP-Untereinheit des G-Proteins aktiviert nun die Adenylatzyklase, welche aus ATP durch Pyrophosphatabspaltung den second messenger cAMP produziert. Das cAMP übt dann seinen Einfluss auf die Proteinkinase A aus. Die Proteinkinase A liegt in unseren Zellen in inaktiver Form vor und besteht aus zwei katalytischen (C2) und zwei regulatorischen (R2) Untereinheiten. Jeweils vier Moleküle cAMP binden allosterisch an die regulatorischen Untereinheiten und aktivieren die damit. Die beiden aktiven katalytischen C-Untereinheiten der Proteinkinase A gehen dann der Aufgabe eine Kinase nach, sie phospholrylieren Proteine. Die Zielproteine der Proteinkinase A sind verschiedene Proteine des Stoffwechsels, vor allem Enzyme, die durch Anhängen eines Phosphatrestes aktiviert oder inaktiviert werden können. Im Beispiel des Glukagon als Hormons aktiviert die Proteinkinase A Enzyme für die Glukoneogenese. Bei der Phosphorylierung von Enzymen handelt es sich um einen molekularen Schalter, durch den Enzyme einfach und schnell ein- und ausgeschaltet werden können. Die Gegenspieler der Proteinkinase A sind verschiedene Phosphatasen, die die Phosphatreste von den Enzymen wieder entfernen. Entgegen aller bisherigen Aussagen können auch hydrophile Hormone die Transkription einiger Gene beeinflussen. Nicht die Hormone selbst, sondern intrazelluläre second messenger vermitteln die Effekte auf die DNA und die Genexpression. Die Proteinkinase A wandert zu diesem Zweck in den Zellkern und phosphoryliert dort das cAMP-responsive-ElementBindeprotein. Auf diese Weise aktiviert, bindet CREB auf der 8 DNA an bestimmte Regionen, wodurch die Genexpression eines bestimmten Gens aktiviert wird. Der Abbau des cAMP erfolgt durch die cAMP-spezifische Phosphatdiesterase, die es hydrolytsich zu AMP spaltet. Die Zielproteine der PK A werden dann durch den überwiegenden Einfluss der Phosphatasen zunehmend in die dephosphorylierte Form überführt. Koffein greift genau an diese Stelle ein, indem es die cAMP spezifische PDE hemmt. Dies führt zu einem erhöhten cAMP-Spiegel. Folgen z.B. fördert dies in der Leber die Glucosemobilisation, wodurch der Blutglukosespiegel steigt – man strotzt also nur so vor Energie und hat keine Lust mehr, sich schlafen zu legen … Weiter gibt es noch G-Protein gekoppelte Rezeptoren, die Phospholipase C akktivieren. Phospholipase C ist spezifisch für das MembranPhospholipid PIP2. Dieses wird gespalten zu Diacylglycerin (DAG) und zu Inositol-1,4,5-trisphosphat (IP3). Während DAG in der Membran gebunden bleibt führt IP3 durch eine Öffnung der Ca2+-Kanälen am ER zu einer Erhöhung der Ca2+-Konzentration. Calcium wiederum aktiviert als dritten Botenstoff zusammen mit dem DAG die Proteinkinase C. Welche spezifische Proteine aktiviert oder inaktiviert. Die Phopholipase C kann aber nicht nur über G-Protein abhängige sondern auch über Tyrosinkinase Rezeptoren aktiviert werden. 9 Übersicht über Hormone und second messenger Systeme Zielgewebe Hormon Nebennierenrinde Adrenocorticotropes second Wirkung messenger cAMP Cortison-Sekretion Hormon (ACTH) Skelettmuskel Adrenalin cAMP Glycogen-Abbau glatter Muskel Acetylcholin IP3 Kontraktion Mastzellen Antigen IP3 Histamin-Sekretion Blutplättchen Thrombin IP3 Aggregation Herz Adrenalin cAMP Zunahme von Herzschlagfrequenz und amplitude Leber Glucagon cAMP Glycogen-Abbau Leber Vasopressin IP3 Glycogen-Abbau Niere Vasopressin cAMP Wasserresorption Fettgewebe Adrenalin, ACTH, cAMP Triglycerid-Abbau Glucagon, TSH 3. Durch Defekte in der G-Proteinaktivität verursachte Krankheitsbilder Krankheitserreger können mit der Funktion von G-Proteinen interferieren. Dafür 2 Beispiele eins für eine Wirkung auf die Gs-gekoppelten Rezeptoren und eins für die Gi-gekoppelten Rezeptoren. Der Erreger der Cholera Vibrio cholerae führt zu einer ADPRiboyslierung, wodurch die GTPase Aktivität blockiert wird und das GProtein in seinem Aktiven zustand bleibt. Der Abbau von GTP-bindenden Gs-Proteinen wird verhindert, was zu einer kontinuierlichen cAMP-Bildung führt. Dieser second messenger öffnet im Darm Chlorid-Kanäle und bewirkt so einen starken Wasser und 10 Elektrolytverlust, was zu Durchfall, Tachykardie, Anurie, ect. Führt. Die Letalität beträgt unbehandelt 30-60% Das Pertussitoxin dagegen bindet an Gi-Proteinen, GDP bleibt gebunden, so dass diese die Adenylatcyclase nicht hemmen können. Im Trachealepithel kommt es dann, vermittelt durch cAMP, zu stark vermehrter Sekretion, was zu Keuchhusten führt. Mutationen von G-Proteinen oder deren Effektoren kann zu Tumoren führen, da dann evtl. andauernde Signale von Wachstumshormonen vorgetäuscht werden und die Zellen sich unkontrolliert vermehren. Der Diabetes Typ I hängt mit der Störung eines Gi /Adenylatcylase Systems zusammen. 11