1 Biochemie der Hormone 4 - Medi
Werbung

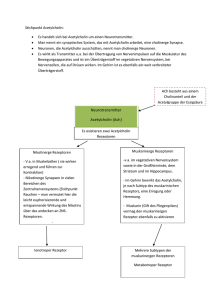
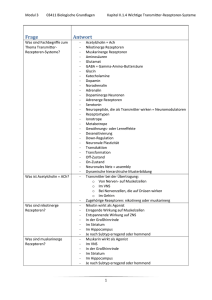
1 Biochemie der Hormone mit Hormon beladenes Serumprotein 1 veränderte Zellfunktion Rezeptor Dimerisierung neues Protein DNA HRE Translation an den Ribosomen RNAPolymerase Gen Transkription mRNA Hormon durchquert Membran g Bindung eines intrazellulären Rezeptorproteins g dieser Hormon-Rezeptor-Komplex dimerisiert (mit einem anderen Hormon-Rezeptor-Komplex) g Bindung an DNA über Zinkfinger g Transkriptionsbeeinflussung Abb. 1: Intrazellulärer Rezeptor 1.2.2 Wirkungsmechanismus ­hydrophiler Hormone Hydrophile Hormone durchdringen die Zellmembran nicht. Sie binden an einen mem­ branständigen Rezeptor, der die Wirkung in das Innere der Zelle vermittelt. Es gibt verschiedene Arten dieser Rezeptoren. Man unterscheidet drei unterschiedliche Klassen von Membranrezeptoren. Eine große und wichtige Gruppe sind die G-Protein-assoziierten (7-Helix-) Rezeptoren. Die sieben Transmembrandomänen dieser Rezeptoren bilden eine Struktur, die sie für die Interaktion mit einem G-Protein prädestiniert. 4 medi-learn.de/6-bc5-1­ Eine ganz andere Wirkungsweise zeigen die 1-Helixrezeptoren. Zu ihnen gehören die Tyrosinkinasen und die Guanylatcyclasen, die sich grundlegend von den anderen Rezeptoren unterscheiden (s. Tyrosinkinasen, S. 10). Die dritte Gruppe – die Ionenkanäle – soll hier nur erwähnt sein. Berühmtestes Beispiel dieser Gruppe ist der nikotinerge Acetylcholin-Rezeptor. G-Protein-assoziierte Rezeptoren G-Proteine werden in der Signaltransduktion als Schalter benutzt. Sie übertragen die extrazellulären Signale, die von membranständigen Rezeptoren empfangen wurden, auf intrazelluläre Signalkaskaden.