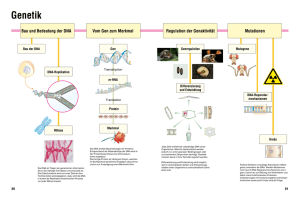
Biochemie: Kapitel 6: Erforschung der Gene
Werbung

Biochemie, Kapitel 6 Isabelle Meyer Biochemie: Kapitel 6: Erforschung der Gene 1.Fundament der Genforschung: Restriktionsenzyme: Spalten lange DNA-Moleküle DNA-Ligasen: verknüpfen Fragmente 2.Fundament: Prinzip der Basenpaarung: Erkennung und Bindung komplementärer Sequenzen Konstruktion neuer DNA-Kombinationen Restriktionsenzymanalyse Für: -Analyse der Chromosomenstruktur -Sequenzierung langer DNA-Stücke -Isolierung von Genen -Erzeugung neuer DNA-Moleküle -> Klonierung Restriktionsenzyme erkennen spezifische Sequenzen von 4-8 Basenpaaren; Spalten Phosphodiesterbindung. Die Schnittstellen sind Palindrome (umgekehrte Sequenzwiederholungen) Bsp: 5’ C-C-G-C–G-G... 3’ G-G-C-G-C-C... Trennen der Restriktionsfragmente Mit Hilfe der Gelelektrophorese. Sichtbar machen durch Southern-Blotting: 1) Fragmentgemisch wird mit Elektophorese aufgetrennt 2) Die Fragmente werden auf eine Nitrocellulosemembran überführt 3) Das gesuchte Fragment wird mit einer 32P-markierten Sonde hybridisiert GAATTC gesucht CTTAAG fluoreszierende Sonde (komplementär) 4) sichtbar machen im Autoradiogramm (Nothern-Blotting: gleiche Methode, aber anstelle der DNA wird RNA verwendet) 6.1.3 Didesoxy-Methode Herstellung von DNA-Fragmenten, deren Länge von der letzten Base in der Sequenz anhängt (durch kontrollierten Abbruch der enzymatischen Replikation) Sie wird an 4 Reaktionsgemischen gleichzeitig durchgeführt: Bei allen 4 wird eine DNA-Polymerase zugesetzt: -> synthetisiert die komplementäre Basenabfolge zu bestimmten Sequenzen Das Inkubationsgemisch der 4 Reaktionsbehälter enthält: -Die 4 Desoxyribonucleosidtriphosphate (A,T,G,C), die radioaktiv markiert sind 1 Biochemie, Kapitel 6 Isabelle Meyer -eine geringe Menge des 2’,3’-Didesoxyanalogs von einem Nucleosidtriphosphat (A oder T oder G oder C); in jedem Ansatz ein anderes: -> blockiert das weitere wachsen der Kette, da ein 3’-Hydroxylende fehlt, um die nächste Phosphodiesterbindung zu knüpfen Polymerase baut meistens das korrekte Nucleotid ein. Ab und zu wird ab und zu das Analog eingebaut, was zum sofortigen Beenden der Reaktion führt. Bsp: dATP (=verändertes A) überall wo im ursprünglichen Strang ein T steht, wird im neu dazu synthetisierten Strang ein dATP eingesetzt und es kommt zum Abbruch. Anschliessend werden die unterschiedlich langen Fragmente durch Gelelektrophorese aufgetrennt. Ziel: Positionen von A,T,G,C können so in den bestimmten Sequenzen bestimmt werden. 6.1.4 Festphasensynthese (vgl Abb. 6.7) Prinzip: automatisierte Synthese von DNA Zur wachsenden Kette wird ein aktiviertes Monomer dazu gegeben. Schutzgruppen: BCE, 5’-OH Gruppe des Monomers, DMT 1) Kopplung: 3’Phosphoratom wird unter Bildung eines Phosphodiesters an das 5’Sauerstoffatom der wachsenden Kette gebunden. 2) Oxidation durch I2, Phosphodiester (3 wertig) -> 5 wertig 3) Abspaltung der Schutzgruppen mit Dichloressigsäure 4) Reaktion kann wieder von vorne starten - Peptidsynthese 6.1.5 Polymerasekettenreaktion (PCR) (vgl Abb. 6.8) Für das vielfache Kopieren bestimmter Sequenzen Zu einer Lösung mit der Zielsequenz werden zugegeben: - Ein Primerpaar, dass mit den flankierenden Sequenzen hybridisiert - A, T, G, C - eine hitzestabile DNA-Polymerase PCR-Zyklus: 1) Trennen der Stränge durch Erhitzen 2) Hybridisierung der Primer, durch schnelles Abkühlen der Lösung-> Primer können mit jeweils einem Streng hybridisieren 3) DNA-Synthese: Erhitzen auf die optimale Temperatur der DNA-Polymerase -> verlängert beide Primer Richtung Zielsequenz 4) Durch Erhitzen trennen sich die Stränge (die Vorlage und der neu dazu synthetisierte Strang) wieder und die Reaktion kann von vorne beginnen 2 Biochemie, Kapitel 6 Isabelle Meyer 6.1.6 PCR in der med.Diagnostik, Forensik und molekularen Evolution Medizin: Mit spezifischen Primern lassen sich Bakterien und Viren nachweisen - HIV bei Personen, bei denen noch keine Antikörper nachweisbar sind - Bazillen der Art Myco-Bakterium in Gewebeproben - Manche Arten von Krebs : Früherkennung - Erfolg einer Chemotherapie kontrollieren - Nachweis bestimmter Leukämien, die auf einer Umordnung Chromosomen beruhen Forensik/ Gerichtsmedizin: Das DNA-Profil eines Individuums charakteristisch - Organtransplantation - Vaterschaftsfragen - Kriminalistik (Blutflecken, Spermaproben, Haarwurzeln) ist der sehr Molekulare Evolution: DNA ist ein sehr stabiles Molekül (v.a. wenn sie vor Luft, Licht und Wasser geschützt ist) - PCR ist ein ideales Verfahren, um fossile DNA zu amplifizieren und charakterisieren - Mittels DNA aus Mikroorganismen können evolutionäre Beziehungen erstellt werden 6.2.1 Restriktionsenzyme und DNA-Ligasen Wie man neue DNA-Moleküle im Labor konstruiert: Das interessierende DNA-Fragment wird kovalent an einen DNA-Vektor gebunden. Dieser repliziert sich autonom im passenden Wirt. Bsp: Plasmide (ringförmige DNA) und der Bakteriophag (Virus) sind die Vektoren für die Klonierung von E.coli 1) Vektor wird an einer spezifischen Stelle mit einem Restriktionsenzym aufgeschnitten. Es entstehen versetzte Schnittstellen mit komplementären einsträngigen Enden (sog. Kohäsive Enden oder sticky Ends) 2) Das einzusetzende DNA-Fragment wird mit dem gleichen Restriktionsenzym behandelt. Dadurch entstehen die gleichen kohäsiven Enden. 3) Plasmid und DNA-Fragment lagern sich aneinander -> DNA-Ligase verknüpft die Basenpaare, in dem sie die Phosphodiester-Bindungen zwischen den zwei DNA-Ketten katalysiert Die Methode der DNA-Verknüpfung über kohäsive Enden ist mit Hilfe von DNALinkern („Verbindungsgliedern“) allgemein anwendbar: (vgl Abb. 6.12) - DNA-Linker wird mit den Enden eines Vektors oder eines DNA-Fragment kovalent verknüpft -> Ligase stellt glatte Enden her Angesetzte Enden werden mit Restriktionsenzym aufgeschnitten ->sticky Ends 3 Biochemie, Kapitel 6 Isabelle Meyer 6.2.2 Plasmide und einige Phagen Plasmide: - natürlich vorkommende, ringförmige doppelhelikale DNA-Moleküle - 2 bis mehrere Hundert Kilobasen lang - tragen Gene für Inaktivierung von Antibiotika, Produktion von Toxinen, Abbau natürlicher Produkte - sind zusätzliche Chromosomen und können unabhängig vom Wirtschromosom replizieren - sind entbehrlich Plasmid pBR322: Gen für Resistenz gegen Tetracyclin und Ampicilin Lambda(λ)-Phage: 1) λ-Phage schleust λ-DNA i Bakterium ein 2) Lytischer Zyklus: - virale DNA und Proteine werden rasch produziert - werden zu Viruspartikel verpackt -> Zerstörung der Wirtszelle und Freisetzug ca. 100 neuer Viruspartikel oder Lysogener Zyklus: - Phagen-DNA fügt sich ins Genom der Wirtszelle ein - Wird über viele Generationen hinweg repliziert ändert sich das Umfeld der Wirtszelle endet der lysogene Zyklus und geht über in den lytischen Zyklus Für wissenschaftliche Zwecke werden Phagen mutiert: Ein Stück λ-DNA wird entfernt und durch ein gewünschtes Stück DNA ersetzt. Man spricht von einem sog. Cosmid. 6.2.3 Genombibliothek / einzelne Gene spezifisch klonieren Herstellung: 1) Eine Probe der gesamten Genom-DNA wird durch Restriktionsenzyme in grosse Fragmente zerlegt 2) Durch Gelelektrophorese trennt man eine Gruppe von Fragmenten an die ca. 15 Kilobasen lang ist 3) Anbringen von Linkern, Erzeugen von kohäsive Enden durch Restriktionsenzym 4) Anbauen an Vektoren (z.B: λ-Phagen) 5) Infizieren der E.coli Bakterien durch die Phagen Das resultierende Lysat enthält eine grosse Anzahl von Viruspartikeln, in denen Fragmente der menschlichen DNA untergebracht sind. Sie stellen eine Genombibliothek dar Wie findet man ein bestimmtes Gen in der Genombibliothek? 1) Eine verdünnte Suspension der rekombinanten Phagen wird auf einem Bakterienrasen gebracht -> 1 Phage infiziert je 1 Bakterium –> es entstehen je eine Kolonie (=Plaque) aus identischen Phagen 4 Biochemie, Kapitel 6 Isabelle Meyer 2) Durch Übertragen auf eine Nitrocellulosemembran fertigt an eine Kopie der ursprünglichen Platte an 3) Die intakten Bakterien werden mit NaOH lysiert. NaOH denaturiert die DNA 4) Denaturierte DNA wird mit einer 32P-Sonde markiert (Je nachdem welches Gen man sucht, werden andere Sonden verwendet) 5) Autoradiographie zeigt die Position des gesuchten Gens an Wie kommt man zu den Sonden? - Mit der entsprechenden mRNA aus solchen Zellen beginnen, die diese reichlich enthält - Man kann eine Gensonde herstellen, wenn ein Teil der Aminosäuresequenz des Proteins bekannt ist, das von diesem Gen codiert wird. Problem: Aminosäuren werden oft von mehreren Codons sequenziert 6.2.4 Chromosomenwanderung Typische Genbibliothek in λ-Phagen-Vektoren bestehen aus DNA-Fragmenten, die ca. 15 kb lang sind. Viele Eukaryotengene sind aber deutlich länger (Bsp: DystrophinGen ca. 2000kb) Wie kann man so lange DNA-Bereiche untersuchen? - künstliche Bakterienchromosomen BAC - künstliche Hefechromosomen YAC: (vgl Abb. 6.21) enthalten: - ein Centromer - eine autonom replizierende Sequenz ARS(an der die Replikation beginnt) - ein paar Telomere (normale Endstücke eukaryotischer Chromosomen) - selektierbare Markergene - Klonierungsstelle Vorgehensweisen: 1) Genomische DNA wird mit Restriktionsenzym partiell verdaut 2) Trennen der Fragmente durch Elektrophorese -> grössere (ca. 450kb) Fragmente werden eluiert und in YAC’s ligiert 3) Vermehren der YAC’s in Hefezellen Chromosomenwanderung: (vgl Abb. 6.22) Um lange DNA-Abschnitte abzusuchen, macht man sich die Fragmentüberlappung innerhalb einer Bibliothek zu nutzen. 1) Fragment mit Region A wird durch Hybridisierung mit der komplementären Sonde A’ selektiert. Das Fragment mit A könnte auch B enthalten. 2) Spaltung des Fragments, Klonierung der Region B ->Herstellung der Sonde B’ 3) Bibliothek mit B’ durchsuchen -> Finden von Fragment mit der Region B (und evt auch Region C) Erforschen langer unbekannter DNA-Abschnitte 5 Biochemie, Kapitel 6 Isabelle Meyer 6.3.1 Herstellung komplementärer DNA (cDNA) Wie lassen sich Säugertier-DNA’s in E.coli klonieren? Problem: Diese Gene enthalten Introns/ Extrons. Den Bakterien fehlt die Fähigkeit Introns aus der Primärstruktur zu schneiden. Lösung: Man veranlasst Bakterien eine jeweils zur mRNA komplementäre rekombinante DNA auszunehmen mit Hilfe reverser Transkriptasen Methode: (vgl Abb. 6.24) Retroviren verwenden reverse Transkriptasen um bei der Replikation RNA-DNAHybrid zu bilden. - Enzym synthetisiert einen DNA-Strang komplementär zur RNA-Matrize (sofern Primer vorhanden) - Primer hybridisiert mit Poly(A)-Schwanz am 3’-Ende der Eukaryoten-mRNA - Erhöhen des pH’s -> hydrolysieren des RNA-Stranges - Synthese des komplementären Stranges der cDNA -> doppelsträngige cDNA Herstellen einer cDNA-Bibliothek (vgl Abb. 6.24) 1) terminale Transferase (Enzym) fügt eine Reihe von dG-Nucleotiden an das 3’Ende einer DNA 2) Oligo (dC) bindet an Sequenz = Primer für Synthese 3) Anhängen synthetischer Linker zur Ligation in geeignetem Vektor Herstellen komplementärer DNA-Sequenzen zu allen mRNA-Arten; inserieren in Vektoren; Einbringen in Bakterien (=cDNA-Bibliothek) 6.3.2 Vergleichen der Expressionslevel Die meisten Gene sind in jeder Zelle in gleicher Menge vorhanden. In welchem Ausmass das Gen jedoch exprimiert wird, ist von Zelltyp zu Zelltyp verschieden. Die effizienteste Methode, dies zu untersuchen, basiert auf dem Prinzip der Hybridisierung: Hybridisierung: Durch lichtgesteuerte chemische Synthesen (wie man sie in der Halbleiterindustrie verwendet) oder durch Aufbringen winzigster Mengen cDNA oder Oligonucleotiden auf einer festen Unterlage hergestellt. Die letzteren werden als DNA-Chips bezeichnet. Durch die Hybridisierung dieser immobilisierten DNA mit fluoreszenzmarkierter cDNA kann man den Expressionslevel jedes einzelnen Gens über seine bekannte Lokalisation auf dem Chip identifizieren. Die Intensität des fluoreszierenden Punkt auf dem Chip ist ein Mass für die Häufigkeit der Transkription bestimmten Gens. 6.3.3 Exprimieren von Genen in Eukaryotenzellen Bakterien führen keine posttranslationalen Modifikationen aus- wie z.B spezifische Spaltung von Polypeptiden und das Anheften von Kohlehydrateinheiten- da ihnen die dazu notwendigen Enzyme fehlen. 6 Biochemie, Kapitel 6 Isabelle Meyer Viele eukaryotischen Gene können nur in eukaryotischen Zellen exprimiert werden. Verfahren: 1) Tierzellen nehmen mit Calcium-Phosphat gefällte fremde DNA-Moleküle auf. Ein kleiner Teil dieser DNA wird stabil in die chromosomale DNA eingebaut. Das Ausmass des Einbaus ist klein, doch die Methode ist sehr nützlich, da sie sehr einfach ist. 2) Mit einer sehr feinen Mikroglaspipette wird die DNA in den Zellkern mikroinjiziert (ca. 2% der so behandelten Zellen sind lebensfähig) 3) Neue Gene mittels Retroviren in die Zelle einschleusen (vgl. 5.3.2). Die DNAVersion des viralen Genoms (=provirale DNA) kann von der Wirtszelle zusammen mit der normalen Zell-DNA exprimiert werden. 6.3.4 Beispiele für transgene Mäuse 6.3.5 Das Ausschalten von Genen Durch Ausschalten eines Genes (Gen-Knockout) lassen sich Rückschlüsse auf die Funktion ziehen. Die Methode es Gen-Knockout basiert auf der homologen Rekombination: (vgl Abb. 6.31) 1) Zunächst wird eine mutierte Version des auszuschaltenden Gens geschaffen, die über weite Bereiche dem normalen Gen homolog ist. 2) Wird das mutierte Fremd-Gen in eine embryonale Stammzelle eingeführt, kommt es in den homologen Bereichen zur Rekombination. Das normale Gen wird durch das Fremd-Gen ersetzt. 3) Die Zelle injiziert man in Embryonen und es entstehen z.B Mäuse, in denen das Gen ausgeschaltet ist (hier: sog. Knockout-Mäuse) 6.3.6 Das Einschleusen von Fremd-DNA in Pflanzenzellen Methoden: - Ti-Plasmide (Tumorinduzierende Plasmide). Vergleichbar mit BakterienPlasmiden. Das Arbeiten mit Ti-Plasmiden ist aber nur bei Dicotyledonen möglich. - „Genkanonen“ zur Transformation durch Beschuss: Wolfram-Kügelchen werden mit DNA beschichtet. Mit diesen Kügelchen werden die Zellen nun mit hoher Geschwindigkeit beschossen. Diese Methode ist eine der Effizientesten. - Elektroporation (vgl. Abb. 6.35): 1) Verdauung der Zellwand durch Cellulase 2) Zufügen von Fremd-DNA; kurze elektrische Impulse -> Vorübergehende Öffnungen: Ermöglichen Aufnahme der Fremd-DNA 3) Rückbildung der Zellwand 6.4.1 Gezielte Veränderungen der DNA Deletionen: Ein Plasmid wird mit einem Restriktionsenzym an 2 Stellen gespalten und unter Bildung eines kleineren Ringes wieder geschlossen. 7 Biochemie, Kapitel 6 Isabelle Meyer Entfernen eines grossen Stück DNA Für kürzere Deletionen schneidet man das Plasmid nur an 1 Stelle auf. Die Enden werden mit einer Exonuclease verdaut, welche Nucleotide von beiden Strängen entfernt. Substitutionen: (vgl Abb. 6.36) Oligonucleotidghesteuerte Mutagenese Bsp: Serin (TCT) soll durch Cystein (TGT) ersetzt werden (=Punktmutation) Diese Mutation kann man erzeugen, wenn man - ein Plasmid mit dem Gen oder der cDNA besitzt und - die Basensequenz in der Umgebung kennt. 1) Man stellt einen Oligonucleotidprimer her, der bis auf den Ersatz des TCT durch ein TGT zu jeder Region des Gens komplementär ist 2) Man trennt die 2 Stränge des Plasmids und hybridisiert den Primer (verändert) mit dem komplementären Strang 3) Die DNA-Polymerase verlängert den Primer 4) Die DNA-Ligase schliesst den doppelsträngigen Ring Insertionen: Kassettenmutatgenase (vgl Abb. 6.37) 1) DNA wird an 2 je 1-Mal vorhandenen Schnittstellen von 2 verschiedenen Restriktionsendonucleasen gespalten 2) Ein synthetisches Oligonucleotid, dessen Enden komplementär zu diesen Schnittstellen sind, wird dann mit der gechnittenen DNA ligiert. 6.4.2 Beispiele für die Verwendung 8