Buch 1.indb - AkadMed.com
Werbung

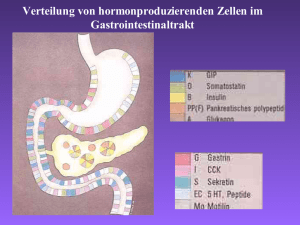
4 Kapitel 4 NEUROPEPTIDE UND BOTENSTOFFE DES GASTROINTESTINALTRAKTS H. Jarz und M. Ledochowski Der menschliche Gastrointestinaltrakt (GI) ist nicht nur Ort der Verdauung und Resorption von Nährstoffen, sondern vielmehr ein komplexes Organ, welches einer nervalen und hormonalen Steuerung unterliegt. Als Antwort auf Reize wie Magendehnung, pH-Wert-Änderung oder das Erscheinen von Nährstoffen werden Botenstoffe sezerniert. Durch diese Sekretion, welche entweder auf endokrinem oder parakrinem Weg erfolgt, kann der GI die eigene Peristaltik und die Ausschüttung der Verdauungssekrete den momentanen Verdauungsprozessen adäquat anpassen. Verantwortlich hierfür sind neuroendokrine Zellen, welche zwischen den Enterozyten eingestreut sind und deren Gesamtmasse insgesamt größer ist als die Masse aller anderen endokrinen Zellen im Körper. Im Folgenden sollen einige Neurotransmitter bzw. Botenstoffe und deren Wirkung auf den GI näher vorgestellt werden. Die Tabellen 2 – 5 geben zudem einen Überblick über die bisher bekannten Botenstoffe. 1. Die Peristaltik fördernde Botenstoffe 1.1. Gastrin Struktur. Das Polypeptid Gastrin ist in drei verschiedenen molekularen Formen zu finden, die sich durch ihre Anzahl an Aminosäuren, sowie durch deren Produktionsort und Halbwertszeit unterscheiden. So existieren Mini-Gastrin (G13), Little-Gastrin (G17) und Big-Gastrin (G34). Für deren biologische Aktivität sind im Wesentli- Buch 1.indb 47 chen die vier C-terminalen Aminosäuren verantwortlich (Uvnas-Wallensten et al., 1976). Produktionsort und Regulation der Freisetzung. Gastrin wird hauptsächlich von den sogenannten G-Zellen im Antrum des Magens, in kleineren Mengen auch von endokrinen Zellen im proximalen Duodenum, Pankreas, Kolon und Hoden produziert. Stimuli für die Gastrinsekretion sind einerseits die Dehnung des Magens, andererseits das Erscheinen von Proteinen im Magen bzw. Darm, sowie der Konsum von Alkohol und Koffein. Ebenso führt das parasympathische Nervensystem und somit der Nervus Vagus über muskarinische Azetylcholinrezeptoren zu einer vermehrten Gastrinsekretion. Auch eine Hyperkalziämie, beispielsweise als Folge hoher Kalziumzufuhr (Milchprodukte), eines Hyperparathyreoidismus oder einer chronischen Niereninsuffizienz, führt zu einer vermehrten Freisetzung von Gastrin. Im Gegensatz dazu hemmt das Absinken des Magen-pHs auf einen Wert unter 3 im Sinne eines Schutzes vor Übersäuerung die Gastrinsekretion. Diese Inhibition erfolgt auf zwei Wegen: Einerseits werden die G-Zellen direkt gehemmt, andererseits werden benachbarte D-Zellen, welche das auf die Gastrinsekretion hemmend wirkende Somatostatin sezernieren, erregt, so dass die GZellen zusätzlich auf parakrinem Weg inhibiert werden. Weiters wirken auch Glucose-dependent Insulin-releasing Peptide (GIP) und Sekretin auf die Gastrinfreisetzung hemmend (Dockray et al., 2001; Friis-Hansen, 2007; McGui­gan, 1968). 15.10.2009 11:10:52 Kap. 4 H. Jarz und M. Ledochowski Erfolgsorgane und Wirkungen. Nachdem die G-Zellen des Magenantrums und Duodenums auf die oben bereits erwähnte Weise zur Gastrinsekretion stimuliert wurden, gelangt Gastrin über das Blut zu den Belegzellen (Parie­ talzellen) des Magens. Auf diese Weise wird die HCl-Sekretion gesteigert und somit der pH des Magensekrets mehr in den sauren Bereich verschoben. Neben den Belegzellen werden auch die Hauptzellen im Magenkorpus zur Freisetzung von Pepsinogen und die benachbarten D-Zellen zur Freisetzung von Somatostatin angeregt. Zusätzlich wirkt Gastrin auch auf die glatte Muskulatur des Magenantrums und –korpus, wodurch die Kraft und Frequenz der digestiven Peristaltik erhöht und somit die Magenentleerung beschleunigt werden. Weiters konnte ein trophischer Effekt auf das Epithel von Magen und Duodenum nachgewiesen werden, welcher sich durch das Vorliegen eines atrophierten Magens nach Antrumresektion besonders veranschaulicht. Außerhalb des Magens übt Gastrin Wirkung auf das Pankreas und die Gallenblase aus. Es fördert einerseits die pankreatische Enzymsowie die Gallensaftsekretion, andererseits die Gallenblasenkontraktion (Friis-Hansen, 2007; Johnson et al., 1975) Klinischer Nachweis und klinische Anwendungsgebiete. Die Konzentration von Gastrin im Serum wird heute nur mehr in seltenen Fällen bestimmt. Indiziert ist dies bei Verdacht auf Vorliegen eines Zollinger-Ellison-Syndroms, bei Ulcus ventriculi unklarer Genese, bei Achlorhydrie oder bei Verdacht auf multiple endokrine Neoplasie (MEN 1). Hierzu wird dem mindestens 12 Stunden nüchternen Patienten morgens Blut abgenommen um die Gastrinkonzentration zu bestimmen. Als normal wird ein Wert unter 100 ng/l angesehen, allerdings können Patienten über dem 65. Lebensjahr durchaus auch Konzentrationen bis 400 ng/l aufweisen. Verminderte Gastrinkonzentrationen finden sich als Folge von Übersäuerung (negative Rückkopplungsschleife) und nach Vagotomie. Erhöhte Werte findet man beim Gastrinom (Zollinger-Ellison-Syndrom), bei Achlorhydrie aufgrund einer atrophen (autoimmunen) Gastritis, sowie unter Therapie mit Protonenpumpenblockern bzw. Antazida. Ebenso können eine ektope Gastrinproduktion durch Pankreasbzw. Dünndarmkarzinome, eine Billroth II-OP (Schleimhautreste im Antrumbereich), sowie ein Hyperparathyreoidismus Ursachen für eine Hypergastrinämie sein. Zur Differenzierung einer tumorbedingten Hypergastrinämie von anderen Formen der Hypergastrinämie kann ein Sekretin-Provokationstest erfolgen. Bei Vorliegen eines Gastrinoms steigt der Gastrinspiegel im Sekretintest um mindestens 100 ng/l, also um mindestens 100 %, an (Arnold, 2007; Banasch et al., 2007). Zollinger-Ellison-Syndrom. Das seltene Zollinger-Ellison-Syndrom ist gekennzeichnet durch das Vorliegen eines oder mehrerer Gastrinome, welche sekretorisch aktiv sind. Lokalisiert sind diese zu 60 % im Pankreas und zu 20 % im Dünndarm. Es handelt sich hierbei meist um einen malignen Tumor, welcher zum Zeitpunkt der Diagnosestellung in 50 % der Fälle bereits metastasiert hat. Das Gastrinom tritt zu 75 % sporadisch auf, in 25 % jedoch im Rahmen einer multiplen endokrinen Neoplasie (MEN 1 oder Wermer-Syndrom; Leitsymptome: primärer Hyperparathyreoidismus, Pankreastumore, Hypophysentumore). Die Symptome des Zollinger-Ellison-Syndroms sind auf die sekretorische Aktivität des Tumors zurückzuführen. Durch die dauerhafte Belegzellstimulation kommt es zu einer gesteigerten Sekretion von HCl und somit zu einer starken Ansäuerung des Magensekrets. Die Folgen sind rezidivierende, meist therapieresistente Ulzera in Magen, Duodenum und Jejunum, sowie Diarrhöen und gelegentlich Steatorrhöen, da die erhöhte Konzentration an HCl zu einer Inaktivierung der Pankreaslipasen und zur Präzipitation von Gallensalzen führt. Das Gastrinom ist zwar selten und bedingt nicht einmal 1 % der Ulkuskrankheit, sollte jedoch bedacht werden, vor allem bei atypisch 48 Buch 1.indb 48 15.10.2009 11:10:52 Neuropeptide und Botenstoffe des Gastrointestinaltrakts Tabelle 1. Neuroendokrine Tumore Neuroendokrine Tumore (NET) sind Tumore, welche von neuroendokrinen Zellen des Gastrointestinaltrakts ausgehen und häufig durch ihre Hormonproduktion symptomatisch werden. Sie sind zu 50 % in der Appendix, zu 20 % in Pankreas, Magen, Duodenum (Insulinom, Glukagonom, Gastrinom), zu 15 % im letzten Teilstück des Ileums und zu 15 % in Kolon und Rektum lokalisiert. Durch ihre Hormonproduktion werden rund 50 % der NET des Vorderdarms (Pankreas, Magen, Duodenum) und sogar >80 % der NET des Mitteldarms (Jejunum, Ileum, Caecum, Appendix) symptomatisch. NET distal des Kolons sind immer nicht-funktionell, produzieren also keine Hormone. Glukagonom Insulinom Definition extrem seltener endokriner Pankreas(A-Zell)-Tumor produziert Glukagon seltener endokriner Pankreas-(B-Zell)-Tumor produziert zu 50 % nur Insulin, zu 50 % auch andere gastrointestinale Hormone zu 90 % solitär, zu 10 % multiple Adenome; oft klein (< 2 cm) zu 4 % im Rahmen einer multiplen endokrinen Neoplasie I (MEN 1) Klinik Hauterscheinungen! Erythema necrolyticum migrans (wandernd, teils bullös, teils nekrotisierend) im Gesicht, an den Extremitäten und in der Leistenregion Diabetes mellitus (meist nicht insulinpflichtig) ev. Anämie Whipple Trias: Hypoglykämien: v. a. nach körperlicher Anstrengung, morgens; Spontanhypoglykämien bei Nahrungskarenz Autonome (Schwitzen, Blässe, Zittern, Herzrasen, Übelkeit, Heißhunger) und neuroglukopenische Symptome (Sehstörungen, Schwindel, Kopfschmerz, Verwirrtheit, Psychotische Zustände,epileptische Anfälle, Parästhesien, Hemiplegie, Aphasie bis hin zu Koma und Tod) prompte Besserung nach oraler oder i. v.-Glukosezufuhr Weiters: Heißhunger führt oft zur Gewichtszunahme Diagnostik Klinik Labor: Glukagon ↑ Stimulationstest mit Arginin oder Tolbutamid: Glukagon im Serum stark erhöht Bildgebung: Sono, CT, MR, Angiographie, ggf. Endosonographie oder operative Exploration; Somatostatin-Rezeptorszintigraphie Stationärer Fastenversuch über 1– 2 Tage führt immer zu Hypoglykämie; fehlende physiologische Insulinsuppression zeigt sich durch Anstieg des Insulin-/Glukosequotienten auf über 0,3 (beim Gesunden: Abfall) Pathologischer oraler Glukose-Toleranztest Labor: Hypoglykämie, Hyperinsulinämie, Proinsulin ↑ Bildgebung: Sono, CT, MR, Angiographie, ggf. Endosonographie oder operative Exploration; Somatostatin-Rezeptorszintigraphie Differential- andere Hauterkrankungen diagnose Anämien anderer Genese anderer Diabetes-Subtyp Hypoglykämien anderer Genese (Bestimmung des CPeptids → exogen zugeführtes Insulin?) Angstattacken, Hyperventilation Phäochromozytom, Karzinoid Therapie Chirurgische Resektion falls Metastasen: lokale Entfernung, Chemotherapie (Streptocozin + 5-Fluorouracil), ev. Radionuklidtherapie Chirurgische Resektion falls inoperabel: Diazoxid- Proglicem® (hemmt Insulinsekretion), Somatostatinanaloga (Octreotid- Sandostatin®) falls Metastasen: lokale Entfernung, Chemotherapie (Streptocozin + 5-Fluorouracil), ev. Radionuklidtherapie Prognose meist maligne zu 90 % gutartig 49 Buch 1.indb 49 15.10.2009 11:10:52 Kap. 4 H. Jarz und M. Ledochowski (Fortsetzung Tabelle 1) Gastrinom (Zollinger-Ellison-Syndrom) Neuroendokrine Tumore (NET) des Dünn­ darms/Karzinoid Definition seltener, sekretorisch aktiver Tumor zu 60 % im Pankreas und zu 20 % im Dünndarm lokalisiert tritt in 75 % sporadisch, in 25 % im Rahmen einer multiplen endokrinen Neoplasie auf (MEN 1 oder Wermer-Syndrom: primärer Hyperparathyreoidismus, Pankreastumore, Hypophysentumore) epithelialer, semimaligner Tumor ausgehend von den enterochromaffinen Zellen des diffusen neuroendo­ krinen Systems produziert zu > 80 % Serotonin, Kallikrein, Tachykinin, Prostaglandine, Histamin; Hormonausschüttung kann durch Alkohol, Nikotin und Nahrungsaufnahme provoziert werden Inzidenz: 1/100 000 EW/Jahr; Häufigkeitsgipfel zw. 40 –70 a am häufigsten (50 %) in der Appendix lokalisiert; zu 15 % im Ileum, zu 25 % im Enddarm Klinik dauerhafte Belegzellstimulation → HClSekretion ↑ therapieresistente, meist rezidivierende Ulzera in Magen, Duodenum und Jejunum (atypische Lokalisation!) Diarrhöen, ev. Steatorrhöen (Inaktivierung von Pankreaslipase durch HCl) die Symptome entstehen meist erst spät durch Hormonproduktion: „Karzinoid-Syndrom“ Kallikrein → Flush: anfallsartige Hitzewallungen, Rötung von Gesicht und Hals, Herzjagen und Schwitzen Serotonin → Durchfälle, Bauchschmerzen, Gewichtsverlust; Endokardfibrose v. a. des rechten Herzens mit eventuell folgender Trikuspidalinsuffizienz und Pulmonalstenose (Hedinger-Syndrom) ev. intermittierender schmerzhafter Subileus ev. Asthmaanfälle ev. Teleangiektasien ev. pellagraartige Hautveränderungen (Tryptophanmangel wegen Verstoffwechselung zu Serotonin durch die Tumorzellen) non-funktionelle NET: Stenosesymptome Diagnostik basale Gastrinkonzentration ↑ (> 1000 ng/l ist beweisend) Sekretin-Provokationstest: Anstieg von Gastrin >100 % Sonographie, Endosonographie, CT, MRT Labor: Serotonin ↑, Chromogranin ↑ Nachweis von 5- Hydroxyindolessigsäure (= Abbauprodukt des Serotonins) im 24h-Harn Nachweis des Primärtumors: Endoskopie, Sono­ graphie, Endosonographie, MRT; ev. KM-CT, Somatostatin-Rezeptorszintigraphie, Metastasensuche (Leber!): Sono, CT Differential- Hypergastrinämien anderer Genese diagnose Systemische Mastozytose: Flush, Pruritus, Kopfschmerz, Fieber, Kollapsneigung, Brechdurchfälle Tryptase erhöht Therapie Chirurgische Resektion des Primärtumors und der regionalen Lymphknoten bei Inoperabilität/Metastasen: Somatostatin­analoga (Octreotid, Lanreotid); α-Interferon, Radionuklidtherapie bei Somatostatin-exprimierenden NET; Symptomatische Serotoninantagonisten (Methysegrid, Cyproheptadin) oder Serotoninsynthesehemmer (Parachlorphenylalanin) zur Linderung der Durchfälle palliative Chemotherapie bei rascher Progredienz: Streptocozin + 5-Fluorouracil Chirurgische Resektion bei Inoperabilität/Metastasen: Chemotherapie mit Streptocozin + 5-Fluorouracil symptomatische Therapie: Protonenpumpenhemmer 50 Buch 1.indb 50 15.10.2009 11:10:53 Neuropeptide und Botenstoffe des Gastrointestinaltrakts (Fortsetzung Tabelle 1) Gastrinom (Zollinger-Ellison-Syndrom) Neuroendokrine Tumore (NET) des Dünn­ darms/Karzinoid Prognose meist maligner Tumor, welcher zum Zeitsolitäres Appendixkarzinoid meist als gutartiger Zupunkt der Diagnosestellung in 50 % der Fälle fallsbefund bei jeder 300. Appendektomie (5-Jahresbereits metastasiert hat überlebensrate: 99 %) meist jedoch schlechte Prognose wegen später Symptome aufgrund von Lebermetastasen, v. a. Dünndarmkarzinoide metastasieren früh (5-Jahresüberlebensrate: lokalisiertes Dünndarmkarzinoid: 75 %; alle Dünndarmcarcinoide: 55 %) Somatostatinom VIPom (Verner Morrison-Syndrom) Definition seltener maligner Tumor, welcher vorwiegend im Pankreas, seltener in der Dünndarmwand lokalisiert ist sezerniert Somatostatin seltener, VIP-sezernierender Tumor zu 25 % ein Nicht-B-Inselzell-Adenom bzw. -Karzinom; zu 25 % eine Inselzellhyperplasie; zu 20 % ein kleinzelliges Bronchuskarzinom; die restlichen 30 % stellen Mischtumore dar Klinik Motilitätsstörungen: gestörte Magenentleerung; gestörte Gallenblasenkontraktion → Steinbildung! Diabetes mellitus Steatorrhö durch massive intestinale und pankreatische Sekretion: wässrige Durchfälle (bis zu 8 l), Hypokaliämie, Hypo- bzw. Anchlorhydrie → Dehydrierung, Gewichtsverlust, metabolische Azidose, abdominelle Krämpfe, Verwirrtheit Diabetes mellitus Diagnostik Klinisches Bild Labor: Somatostatin ↑ Bildgebung: Sono, Endosonogphie, CT, MRT Klinisches Bild Labor: VIP ↑ Bildgebung: Sono, Endosonographie, CT, MRT Differentialdiagnose Ganglionneuroblastom (Kind!) andere gastropankreatische Tumore Laxantienabusus Therapie Chirurgische Resektion medikamentöse Therapie nicht möglich bei Metastasen: Chemotherapie mit Streptocozin und 5-Fluorouracil Chirurgische Resektion (nur bei rund 33 % möglich) falls inoperabel: Therapie mit Somatostatinabkömmlingen (Octreotide) bei Metastasen: Chemotherapie mit Streptocozin und 5-Fluorouracil Prognose meist bösartig; zum Zeitpunkt der Diagnose meist schon metastasiert zu 50 % maligne 51 Buch 1.indb 51 15.10.2009 11:10:53 Kap. 4 H. Jarz und M. Ledochowski lokalisierten und therapieresistenten Ulzera (distales Duodenum, Jejunum), bei positiver Familienanamnese (MEN 1!) und bei gleichzeitigem Vorliegen von Diarrhö und Malabsorption. In diesem Fall sollte der basale Gastrinspiegel gemessen werden, welcher beim Zollinger-EllisonSyndrom fast immer erhöht ist. Ein Wert >1000 ng/l gilt hierbei als beweisend. Im weiteren Verlauf ist eine Tumorlokalisationsdiagnostik notwendig (Collen et al., 1994; Pellicano et al., 2006; Roy et al., 2000; Weber et al., 1995). Einen Überblick über andere neuroendokrine Tumore (NET) im enterogastro-pankreatischen System ist in Tabelle 1 dargestellt. 1.2. Weitere, die Peristaltik fördernde Botenstoffe Neben Gastrin existieren noch weitere Botenstoffe, welche die Peristaltik fördern. Zu diesen gehören beispielsweise der die parasympathische Wirkung mediierende Neurotransmitter Azetylcholin, sowie Histamin und Bombesin. Einzelheiten bezüglich Produktionsort und -reiz sowie zu den Wirkungen dieser verschiedenen Botenstoffe werden in Tabelle 2 angeführt. 2. Die Peristaltik hemmende Botenstoffe 2.1. Sekretin Struktur. Sekretin ist ein aus 27 Aminosäuren bestehendes Peptidhormon, welches strukturelle Homologien zu Glukagon, Enteroglukagon, Glucose-dependent Insulin-releasing Peptide (GIP) und vasoaktivem intestinalem Peptid (VIP) aufweist. Für seine Wirkung ist nicht nur ein Teil, sondern die gesamte Peptidkette verantwortlich (Bayliss et al., 1902). Produktion und Regulation der Freisetzung. Sekretin wird von den S-Zellen des Duodenums, in geringeren Mengen auch vom Jejunum als Antwort auf das Erscheinen von saurem Chymus im Dünndarmlumen produziert. Der pH im Duodenum muss hierbei auf einen Wert unter 4,5 abfallen. Weitere Trigger der Sekretinfreisetzung sind Gallensalze, das Erscheinen von Nährstoffen wie Fette, Aminosäuren und Glukose, sowie eine intraluminale Druckerhöhung im Dünndarm. Hemmend wirkt eine zu hohe Konzentration an Bicarbonat im Duodenum, welche einen alkalischen pH nach sich zieht (Bayliss et al., 1902; Chey et al., 2003; Mutt et al., 1970). Erfolgsorgane und Wirkungen. Die Hauptaufgabe von Sekretin ist es, dem sauren Millieu im Dünndarm, welches durch den Transport von saurem Chymus aus dem Magen in das Duodenum entsteht, entgegenzuwirken. Hierfür fördert es einerseits die Bildung eines bicarbonatreichen und somit alkalischen Sekrets in den Pankreasgängen, andererseits fördert es die Alkalisierung der Galle sowie den Gallefluss. Ebenso werden vermehrt pankreatische Enzyme und auch Insulin freigesetzt. Um das weitere Erscheinen von saurem Chymus einzuschränken, bewirkt Sekretin eine verlangsamte Magenentleerung und eine verminderte Gastrin- und somit HCl-Sekretion. Im Gegensatz dazu wird die Sekretion von Pepsinogen und Muzinen im Magen gesteigert. Weiters konnte eine antitrophische Wirkung auf die Magenschleimhaut nachgewiesen werden (Bayliss et al., 1902; Chey et al., 2003). Klinischer Nachweis und klinische Anwendung. Der Sekretin-Provokations-Test bzw. Sekretin-Pankreozymintest (Sekretin kombiniert mit Cholezystokinin) ist ein sehr aufwendiges, jedoch relativ aussagekräftiges Verfahren, welches bei Verdacht auf exokrine Pankreasinsuffizienz indiziert ist. Hierzu wird einmal vor der Provokation Duodonalsekret über eine Duodenalsonde abgesaugt, und die Konzentration an Bicarbonat und Pankreasenzymen (α-Amylase, Lipase) bestimmt. Nach der Stimulation werden diese Konzentrationen und das Sekretvolumen für 2 Stunden alle 20 Minuten bestimmt. Anhand der Ergebnisse kann die exokrine Pankreasinsuffizienz in eine leichte (teilweise erniedrigte Enzymsekretion bei hochnormaler Sekretmenge und Bicarbonatsekretion), mittelschwere 52 Buch 1.indb 52 15.10.2009 11:10:53 Neuropeptide und Botenstoffe des Gastrointestinaltrakts Tabelle 2. Die Peristaltik des Gastrointestinaltrakts fördernde Neuropeptide und Botenstoffe Neuropeptid/ Botenstoff Bildungsort Zelle Freisetzung ­ stimuliert (+) bzw. gehemmt (–) durch Wirkungen: ↑ fördernd, ↓ hemmend Azetylcholin Sympathikus, Parasympathikus Parasympathikus präganglionäre +:nervale Reize Neurone postganglionäre Neurone HCl-Sekretion ↑ Wasser- und Elektrolytsekretion des Darms ↑ GI-Motilität ↑ Bombesin Magen Duodenum Jejunum neurokrine Zellen +:enterisch nervale Reize Gastrinsekretion ↑ → HClSekretion ↑ CCK-Sekretion ↑ Gallenblasenkontraktion ↑ Pankreatische Enzym-sekretion ↑ Insulinsekretion ↓ Pankreatische Bicarbonat­ sekretion ↓ Magenentleerung ↑ Galanin gesamter GITrakt Mukosazellen und enterische Nervenzellen +:Dehnungsreize im Darm Insulinsekretion ↓ Magenentleerung ↑ +:Protein, Glukose Ileum- und Kolontransit ↑ +:HCl +:Azethylcholin –: Noradrenalin Gastrin Magenantrum Duodenum G-Zelle +:Vagusreizung +:Magendehnung +:Magen pH > 2,5 ­(alkalischer Reflux von Gallensäuren) +:Proteine im Magen +:Alkohol, Koffein +:GRP +:Hyperkalzämie –: H+, Sekretin, GIP, VIP, PGE2 Gastrin releas­ ing peptide (GRP) Magenantrum Duodenum Neuroendokrine +:Vagusreizung Zellen Gastrinsekretion ↑ Pankreasenzymsekretion ↑ HCl-Sekretion ↑ Magenentleerung ↑ Histamin Magenmukosa H-Zellen = Mastzellen +:nerval: N. Vagus +:humoral: Serotonin, Gastrin HCl-Sekretion ↑ Pepsinogen-Sekretion ↑ Magen-Darm-Peristaltiik ↑ (außer Kolon) Motilin Duodenum Jejunum (geringfügig auch im Ileum und Gallengang) MO-Zelle +:pH > 8,2 im Duodenum +:Proteine, Fette im Duodenum Pepsinogensekretion ↑ Gallenblasenkontraktion ↑ stimuliert Magen- und Darmmotilität → beschleu­ nigte Magen-Darm-Passage HCl-Sekretion ↑ Pepsinogenfreisetzung ↑ Somatostatinsekretion ↑ wirkt trophisch auf Magenmukosa Kontraktion des unteren Ösophagussphinkters Motilität von Ösophagus, Magen, Darm, Gallenblase ↑ 53 Buch 1.indb 53 15.10.2009 11:10:54 Kap. 4 H. Jarz und M. Ledochowski (Fortsetzung Tabelle 2) Neuropeptid/ Botenstoff Bildungsort Zelle Freisetzung ­ stimuliert (+) bzw. gehemmt (–) durch Wirkungen: ↑ fördernd, ↓ hemmend Platelet activating factor (PAF) gesamter GITrakt Endothelzelle der Splanchnikusgefäße auch Leukozyten, Thrombozyten, Makrophagen +:Endotoxine, Noxen in der Nahrung +:Thrombin, Kollagen, Kalzium Konstriktion der gastralen und intestinalen Kapillargefäße Entzündungs- und Gerinnungsmediator: aktiviert Thrombo- und Granulozyten Langsame Kontraktion der Darmmuskulatur Prostaglandin E, F gesamter GITrakt Endothelzellen Neutrophile Granulozyten Thrombozyten Mastzellen +:Vagusreizung +:Azethylcholin +:intramurale Druckerhöhung im Darm während der Peristaltik Vasodilatation → Durchblutung ↑ Bicarbonatproduktion ↑ Schleimproduktion im Magen ↑ HCl-Produktion ↓ Glukagonfreisetzung ↑ Insulinfreisetzung ↓ Motilität ↑ Substanz P Duodenum Jejunum Enterochromaffine Zellen +:Vagusreizung Glukagonausschüttung ↑ Insulinausschüttung ↓ Speichel- und Tränen-sekretion ↑ HCl-Sekretion ↓ Blutdruck ↓ Motilität ↑ (Enzymaktivität erniedrigt bei niedrignormaler Sekretmenge und Bicarbonatsekretion) oder schwere (alle Parameter erniedrigt) Insuffizienz eingeteilt werden. Ist die Sekretmenge erniedrigt, die Sekretion von Bicarbonat und Enzymen jedoch erhöht, so kann ein Verschluss des Ductus pancreaticus, beispielsweise durch eine Neoplasie bedingt, vorliegen. Bei Patienten mit Zollinger-Ellison-Syndrom führt der SekretinTest zu einem paradoxen Effekt. Während beim Gesunden die Gastrinproduktion durch Sekretin gehemmt wird, kommt es beim Gastrinompatienten nach dem Provokationstest zu einer Erhöhung der Gastrinkonzentration. 2.2. Weitere die Peristaltik hemmende Botenstoffe Neben Sekretin wirken unter anderem auch Adrenalin, sowie Somatostatin, Polypeptid YY und Pankreatisches Polypeptid auf die Peristaltik hemmend. Einzelheiten bezüglich Produktions­ ort und -reiz sowie zu den Wirkungen dieser verschiedenen Botenstoffe werden in Tabelle 3 angeführt. 3. Auf die Peristaltik bivalent wirkende Botenstoffe 3.1. Cholezystokinin (CCK) Struktur. CCK ist ein Peptidhormon, welches im Serum in mehreren molekularen Formen exis- 54 Buch 1.indb 54 15.10.2009 11:10:54 Neuropeptide und Botenstoffe des Gastrointestinaltrakts Tabelle 3. Die Peristaltik des Gastrointestinaltrakts hemmende Neuropeptide und Botenstoffe Neuropeptid/ Botenstoff Bildungsort Zelle Freisetzung ­ stimuliert (+) bzw. gehemmt (–) durch Wirkungen: ↑ fördernd, ↓ hemmend Adrenalin, Noradrenalin Nebenniere NA: Sympathikus Nebennierenmark Postganglionäres Neuron +:Nervale Erregung Speicheldrüsensekretion ↓ Kontraktion der Sphinkteren Vasokonstriktion im Splanchnikusgebiet Magen-Darm-Motilität ↓ Bulbogastron Bulbos duodeni Mukosazelle +:Saurer Chymus Gastrische HCl-Sekretion ↓ Magenmotilität/-entleerung ↓ Enterogastron auch Gastrischinhibierendes Polypeptid (GIP) Duodenum Jejunum K-Zelle der Mukosa Pankreas A-Zelle +:Erscheinen von Glukose, Sekretion von HCl, Gastrin, Fett, Aminosäuren und Pepsinogen ↓ H+ im Duodenum Insulinsekretion ↑ Pankreatische Elektrolytsekretion ↑ Lipolyse ↓ Magenentleerung ↓ Neurotensin Jejunum Ileum Kolon Rektum N-Zelle +:Fett +:Alkohol HCl- und Pepsinogen-sekretion ↓ Muzinproduktion ↑ Pankreasenzymsekretion ↑ Ausschüttung von Glukagon, Adrenalin, Prolaktin ↑ Insulinausschüttung ↓ Leber: Glykogenolyse ↑ → Hyperglykämie Magen-Darm-Motilität ↓ Pankreatisches Polypeptid (PP) Pankreas PP-Zelle (auch „F-Zelle“) +:Proteine im Magen +:Fett im Darm +:Hypoglykämie +:Vagusreizung +:Ghrelin, Motilin, ­Sekretin –: Somatostatin Pankreas: Enzym- und Bicarbonatsekretion ↓ Gallenblasenkontraktion ↑ Sättigung ↑ Magen-Darm-Motilität ↓ Peptid YY Ileum Kolon L-Zelle +:Fett, Monosaccharide +:HCl +:Gallensäuren +:Bombesin Pankreatische Enzymsekretion ↑ HCl-Sekretion ↓ Sättigung ↑ Magenentleerung ↓ 55 Buch 1.indb 55 15.10.2009 11:10:54 Kap. 4 H. Jarz und M. Ledochowski (Fortsetzung Tabelle 3) Neuropeptid/ Botenstoff Bildungsort Zelle Freisetzung ­ stimuliert (+) bzw. gehemmt (–) durch Wirkungen: ↑ fördernd, ↓ hemmend Sekretin Duodenum Jejunum S-Zelle +:pH < 4,5 im Duodenum +:Gallensalze +:Fett, Protein, Glukose +:intramurale Druck­ erhöhung –: Bicarbonat Gastrinsekretion ↓ → HClSekretion ↓ Pepsinogenfreisetzung ↑ Muzinsekretion von Magen + Duodenum ↑ Pankreas: Anreicherung des Sekretes mit Bicarbonat ↑ Pankreatische Enzymsekretion ↑ Insulinsekretion ↑ Alkalisierung der Galle ↑ Vasodilatation der Splanchnikusgefäße Magenentleerung ↓ Somatostatin Gesamter Gastro- D-Zelle intestinaltrakt +:Fett, Protein +:Adrenalin HCl- und Pepsinogen-sekretion ↓ Gastrinsekretion ↓ Muzinproduktion ↑ Pankreas: Enzymproduktion ↓ Insulinsekretion ↓ Glukagon ↓ VIP ↓ Neurotensin ↓ Magen-Darmmotilität ↓ Vasoaktives intestinales Polypeptid (VIP) Magen bis Rektum +:Vagusreizung +:H+ im Duodenum –: Somatostatin HCl- und Gastrinsekretion ↓ Pankreas: Enzym-, Wasser und Bicarbonatsekretion ↑ Darm: Sekretion von Wasser und Elektrolyten ↑, Wasserabsorption ↓ Darmdurchblutung ↑ Relaxation des unteren Ösphagussphinkters Insulinsekretion ↑ Motilität von Magen, Gallenblase und Kolon ↓ D1-Zelle der Mukosa tiert, die durch unterschiedliches posttranslationales processing des CCK-Genproduktes resultieren und nach der Anzahl ihrer Aminosäuren benannt werden. Einige molekulare Formen, die aus dem 95 Aminosäuren langen Vorläuferprotein pro-CCK entstehen, sind beispielsweise CCK8, CCK22 und das im Serum in höchster Konzentration vertretene CCK33. Die Wirksamkeit von CCK beruht hierbei auf den 8 C-terminalen Aminosäuren, wobei die 5 letzten von diesen mit jenen von Gastrin ident sind. Hierauf sind wohl die zum Teil ähnlichen Wirkungen von CCK und Gastrin zurückzuführen (Eberlein et al., 1992; Rehfeld et al., 2001). 56 Buch 1.indb 56 15.10.2009 11:10:55 Produktion und Regulation der Freisetzung. CCK wird von den I-Zellen des Duodenums, Jejunums und Ileums als Antwort auf das Erscheinen von langkettigen freien Fettsäuren, Peptiden, in geringem Maße auch von Glukose im Dünndarm gebildet. Weiters existiert eine Rückkopplungsschleife: Die vom Pankreas sezernierte Endopeptidase Trypsin wirkt auf die CCK-Ausschüttung hemmend, so dass die CCK-Konzentration abfällt. Daraufhin wird die Sekretion von Trypsinogen im Pankreas, der inaktiven Vorstufe von Trypsin, vermindert, wodurch die luminale Trypsinkonzentration wiederum abfällt und dadurch ein Ansteigen von CCK erneut möglich ist (Liddle et al., 1985; Parker et al., 2005). Erfolgsorgane und Wirkung. Über den CCK1-Rezeptor hat CCK vielfältigen Einfluss auf den gesamten Verdauungstrakt. Das Pankreas wird einerseits zur Sekretion von Verdauungs(pro)enzymen, andererseits zur Freisetzung von Pankreashormonen, wie Insulin, Glukagon, Somatostatin und Pankreatischem Polypeptid (PP) angeregt. Weiters potenziert CCK die Wirkung von Sekretin auf die Pankreasgangzellen, so dass ein bicarbonatreicher und somit alkalischer Saft abgegeben wird. Aufgrund seines großen Einflusses auf das Pankreas wurde CCK früher auch Pankreozymin genannt. Da man aber später erkannte, dass CCK nicht nur auf das Pankreas wirkt, sondern auch die Kontraktion der Gallenblase stimuliert, wurde Pankreozymin in Cholezystokinin umbenannt. Simultan zur Gallenblasenkontraktion bewirkt CCK auch die Öffnung des Sphinkter oddi, wodurch vermehrt Gallensalze in das Duodenum gelangen und somit die Verdauung gefördert wird. Im Gegensatz zur Wirkung auf die Gallenblase führt CCK beim Magen zu einer verminderten Kontraktion und somit zu einer verlangsamten Magenentleerung. Ebenso hemmt es die Gastrin- und HCl-, stimuliert jedoch die Pepsinogensekretion. Weiters wirkt CCK im Gehirn sättigend, und es wird eine trophische Wirkung von CCK, insbesondere auf das Pankreas vermu- Neuropeptide und Botenstoffe des Gastrointestinaltrakts tet. Hierauf ist wahrscheinlich auch die bei Bevölkerungsgruppen, welche sich hauptsächlich von Sojabohnen ernähren, vermehrt zu beobachtende Pankreashypertrophie zurückzuführen. Diese enthalten nämlich einen Trypsininhibitor, woraufhin nach Verzehr der Sojaprodukte die bereits beschriebene Rückkopplungsschleife unterbrochen wird. CCK wird daraufhin ungebremst sezerniert und übt so verstärkt seine Wirkung aus. Aufgrund dieses Pathomechanismus’ wird ein kausaler Zusammenhang mit der unter diesen Bevölkerungsgruppen erhöhten Inzidenz von Pankreaskarzinomen diskutiert (Chen et al., 2004; Gibbs et al., 1973; Harper et al., 1943; Liddle et al., 1985) Klinischer Nachweis und klinische Anwendung. Die Konzentration von CCK im Serum wird mithilfe eines Radioimmunoassays bestimmt. Der kombinierte Sekretin-Pankreo­ zymin-Test wird bei der Diagnostik der exokrinen Pankreasinsuffizienz angewendet und wurde bereits erläutert. 3.2. Weitere auf die Peristaltik bivalent wirkende Botenstoffe Neben Cholezystokinin sind nur wenige andere Botenstoffe, welche auf die Peristaltik bivalent wirken, bekannt. Zu diesen gehören das bei Entzündung oder bei allergischem Geschehen vermehrt ausgeschüttete Bradykinin, das Hunger vermittelnde Ghrelin sowie Serotonin. Diese werden in Tabelle 4 näher beschrieben. 4. Botenstoffe ohne Funktion auf die Peristaltik 4.1. Chromogranin A Struktur. Chromogranin A (CgA) zählt mit Chromogranin B zu der Gruppe der Chromogranine und ist ein saures, hydrophiles Protein, welches aus 439 Aminosäuren besteht und ein Molekulargewicht von 49 kDa aufweist (Deftos, 1991). 57 Buch 1.indb 57 15.10.2009 11:10:55 Kap. 4 H. Jarz und M. Ledochowski Tabelle 4. Auf die Peristaltik des Gastrointestinaltrakts bivalent wirkende Neurotransmitter und Botenstoffe Neuropeptid/ Botenstoff Bildungsort Zelle Freisetzung ­ stimuliert (+) bzw. gehemmt (–) durch Wirkungen: ↑ fördernd, ↓ hemmend Bradykinin Gewebshormon Zellen des Bindegewebes Makrophagen Parenchymzellen +:Gewebsschädigung +:Entzündung +:Allergische Reaktion Splanchnikusdurchblu­tung ↑ Kontraktion des Jejunums und Ileums Duodenum- und Kolon­ motilität ↓ Cholezystokinin Duodenum (CCK) Jejunum Ileum I-Zelle +:langkettige freie Fettsäuren +:Peptide, aromatische Aminosäuren –: Trypsin Pankreas: Enzym- und Bicarbonatsekretion ↑ Pankreaswachstum ↑ Sekretion von Insulin, Glukagon, Somatostatin und Pankreatischem Polypeptid ↑ HCl-Sekretion ↓ Pepsinogensekretion ↑ Gallenblasenkontraktion und Relaxation des Sphinkter Oddi ↑ Magenmotilität ↓ Dünndarmmotilität ↑ Ghrelin v. a. Magenfundus Duodenum Jejunum Ileum Kolon Endokrine Zellen +:leerer Magen Anstiege vor jeder Mahlzeit, schnelles Abfallen nach der Mahlzeit +:Gewichtsverlust HCl-Sekretion ↑ Lipolyse ↓ Körpertemperatur ↓ TSH-Sekretion ↓ Hungersignal Magenmotilität ↑ Dünndarmtransit ↓ Serotonin Dünndarm EC-Zelle Thrombozyt Mastzelle +:N. Vagus Histaminfreisetzung ↑ Sättigung ↑ Dünndarmmotilität ↑ Magen- und Dickdarmmotilität ↓ Produktion und Regulation der Freisetzung. Sowohl in Neuronen als auch in neuroendokrinen Zellen sind Vesikel, welche Peptidhormone, Neurotransmitter und biogene Amine enthalten. Weiters befinden sich dort auch sekretorische Granine, welche in Chromogranine und Sekretogranine unterteilt werden können. Beim Gesunden stammt das im Blut messbare CgA zu 75 % aus dem Nebennierenmark und ist Ausdruck seiner exozytotischen sympathoadrenalen Aktivität. Es konnte gezeigt werden, dass das Nebennierenmark am meisten CgA enthält, gefolgt in absteigender Reihenfolge von Hypophyse, Pankreas, Magen, Dünndarm, Gehirn, Nebenschilddrüse und Schilddrüse (Deftos, 1991). Erfolgsorgane und Wirkung. Die von neuroendokrinen Zellen und Neuronen produzierten Granine sind an drei wichtigen Vorgängen beteiligt. Die ersten beiden wichtigen Funktionen betreffen den Transport von Botenstoffen innerhalb der Zelle, sowie deren Freisetzung, Exozytose, aus der Zelle: Nachdem die Botenstoffe in der Zelle synthetisiert wurden, werden sie von 58 Buch 1.indb 58 15.10.2009 11:10:55 den Graninen gebunden und auf diese Weise deren Transport in den Golgi-Apparat gesteuert. Hier werden die Granine proteolytisch gespalten, wodurch das Signal zur Exozytose gegeben wird. Im Anschluss werden die Spaltprodukte der Granine cosezerniert. Diese Spaltprodukte besitzen unterschiedliche autokrine, parakrine und endokrine regulatorische Eigenschaften, welche die dritte wichtige Funktion der Granine darstellen (Deftos, 1991; Taupenot et al., 2003). Klinischer Nachweis und klinische An­ wendung. Zur Messung von CgA sind inzwischen zahlreiche Testverfahren erhältlich, welche entweder als ELISA oder Radioimmunoassay ausgelegt sind und auf der Verwendung von mono- oder polyklonalen Antikörpern basieren. Aufgrund dieser unterschiedlichen Testverfahren existieren auch unterschiedliche Referenzwerte und unterschiedliche Daten zu Sensitivität und Spezifität. Im Allgemeinen kann man jedoch sagen, dass diese Verfahren eine sehr gute Sensitivität (79 – 92 %) und Spezifität (83 – 91 %) besitzen (Campana et al., 2007). Es konnte gezeigt werden, dass eine erhöhte CgA-Konzentration im Serum bei zahlreichen neuroendokrinen und neuronalen Tumoren zu finden ist (O‘Connor et al., 1986). Dies ist beispielsweise der Fall bei allen Tumoren des Hypophysenvorderlappens, beim Phäochromozytom, beim medullären Schilddrüsenkarzinom, beim Meckelzell-Karzinom der Haut, bei Ganglioneuro-, Neuro- und Medulloblastomen, sowie bei Adenomen, Karzinomen oder Hyperplasien der Nebenschilddrüse. Ebenso steigt der CgASpiegel auch bei neuroendokrinen Tumoren des GI, wie dem Insulinom, Glukagonom, Gastrinom, Somatostatinom, VIPom, PPom und dem Karzinoid. Wichtig ist auch, dass neuroendokrine Tumore, welche hormonell inaktiv sind, als einzigen messbaren Tumormarker CgA freisetzen (Nobels et al., 1997; Taupenot et al., 2003). Beobachten kann man hierbei, dass Patienten, die unter einem Gastrinom leiden, die mit Abstand höchste CgA-Konzentration aufweisen (Campana et al., 2007; Nehar et al., 2004). Der Neuropeptide und Botenstoffe des Gastrointestinaltrakts Grund dürfte wohl die starke Stimulation der endokrinen Zellen der Mukosa durch das übermäßig produzierte Gastrin sein (Kleveland et al., 2001). Generell kann man zudem sagen, dass Patienten mit einem lokalisierten neuroendokrinen Tumor niedrigere CgA-Werte als Patienten mit einem diffusen Befall aufweisen (Campana et al., 2007). Neben der Diagnostik eines endokrinen Tumors kann CgA auch zur Diagnostik einer autoimmunen atrophen Gastritis angewendet werden (Peracchi et al., 2005). Hierbei erreichen die Werte aber nie die Höhe der Werte von Tumor-Patienten und sind bei einer bereits vorliegenden ECL-Zell-Hyperplasie höher als bei deren Nichtvorliegen (Peracchi et al., 2005). Allerdings sind bei der Messung von CgA auch falsch positive Werte möglich. Geringgradig falsch erhöhte CgA-Werte können aufgrund des gesteigerten Sympathikotonus durch das Vorliegen einer essentiellen Hypertonie bedingt sein, sowie aufgrund von einer reduzierten Leberfunktion und dadurch eingeschränkter Elimination von CgA entstehen. Hochgradig falsch erhöhte CgA-Werte finden sich bei einer insulininduzierten Hypoglykämie, bei der Niereninsuffizienz (Kreatinin > 3 mg/dl) und bei der fortgeschrittenen Herzinsuffizienz aufgrund der begleitenden neuroendokrinen Aktivierung. Wie zahlreiche Studienergebnisse belegen, ist das Messen von CgA aufgrund seiner hohen Sensivität und Spezifität ein geeignetes Mittel, um neuroendokrine Tumoren nachzuweisen. Man muss jedoch beachten, dass neuroendokrine Tumore in der Regel erst langsam über Jahre wachsen, bis sie symptomatisch werden. Dementsprechend steigt auch der CgA-Spiegel nur langsam an, so dass vor der klinischen Auffälligkeit nur ein relativ kleiner Anstieg innerhalb des klinischen Referenzbereiches wahrzunehmen ist. In dieser Phase ist der Nachweis des jeweilig produzierten Hormons durch den Tumor wohl aussagekräftiger, mit Ausnahme des hormonell inaktiven neuroendokrinen Tumors. Im fortgeschrittenen Tumorstadium ist das Messen des CgA-Spiegels jedoch ein wertvolles 59 Buch 1.indb 59 15.10.2009 11:10:55 Kap. 4 H. Jarz und M. Ledochowski Tabelle 5. Neurotransmitter und Botenstoffe ohne Wirkung auf die Peristaltik des Gastrointestinaltrakts Neuropeptid/ Botenstoff Bildungsort Zelle Freisetzung ­stimuliert (+) bzw. gehemmt (–) durch Wirkungen: ↑ fördernd, ↓ hemmend Chromogranin A Gesamter GI-Trakt Neuroendokrine Zellen Neurone Cosezerniert bei jeder Vesikel- Exozytose Steuerung des Transports in den Golgi-Apparat Regulation der Exozytose Stark erhöht bei NET!! Chymodenin Dünndarm Mukosazelle +:Fett Pankreatische Chymotryp­ sinsekretion ↑ Enteroglukagon Magen – Rektum Pankreas L-Zelle A-Zelle +:Glukose, Fette HCl-Sekretion ↓ Gastrinsekretion ↓ Resorption von Wasser und Elektrolyten ↑ Trophischer Faktor für Darmepithel Entero-Oxyntin Dünndarm Mukosazelle +:Protein Gastrische H+-Sekretion ↓ Glukagon Pankreas A-Zelle +:niedrige Serumkonzentration von Glukose +:steigende Aminosäurenkonzentration +:Adrenalin –: Fettsäuren, Somatostatin, Insulin Glykogenolyse ↑ Glykogensynthese ↓ Glukoneogenese ↑ Glykolyse ↓ Lipolyse ↑ Ketogenese ↑ Glucagonlike peptide 1 (GLP-1) Ileum Kolon Rektum L-Zelle +:Glukose Insulinfreisetzung ↑ Glukagonfreisetzung ↓ HCl-Sekretion ↓ Guanylin Duodenum Ileum Kolon Rektum Diverse Zellen +:alkalischer pH-Wert Chlorid- und Flüssigkeitssekretion des Darms ↑ Natrium-Chlorid-Resorption ↓ Insulin Pankreas β-Zelle +:Glukose, Aminosäuren (v. a. Arg, Lys), Fettsäuren +:ACTH, Steroidhormone, Gastrin, CCK, Sekretin +:N. Vagus +:intestinale Dehnung? –: Adrenalin, Bombesin, Somatostatin, Neurotensin Aufnahme von Glukose, Aminosäuren, Nucleosiden, Kalium, Kalzium in Muskelund Fettzellen Leber: Stimulation der ­Glykolyse und Glykogenese, Hemmung der Glukoneo-genese Fettgewebe: Hemmung der Lipolyse, Stimulation der Lipogenese Muskel: Steigerung der Proteinsynthese Allgemein wachstumsfördernd 60 Buch 1.indb 60 15.10.2009 11:10:56 Neuropeptide und Botenstoffe des Gastrointestinaltrakts (Fortsetzung Tabelle 5) Neuropeptid/ Botenstoff Bildungsort Zelle Neuropeptid Y (NPY) Gesamter GI-Trakt Plexus submucosus +:nervale Reize Plexus myentericus Mukosazellen? NO Gesamter GI-Trakt: Endothelzelle Blutgefäße Endotheliale NO-Oxidase (eNOS) Relaxation der glatten Gefäßmuskulatur → Durchblutung im Splanchnikusgebiet ↑ Pankreastatin Pankreas D-Zelle ? Insulinsekretion ↓ Villikinin Duodenum Ileum APUD-Zellsystem in Mukosa +:N. Vagus Ursprüngliche Meinung eines prokinetischesn Effekts auf die Mikrovilli, inzwischen jedoch widerlegt Mittel zur Therapie- und Verlaufskontrolle, da er mit der Größe der Tumormasse korreliert (Nehar et al., 2004). 4.2. Weitere nicht auf die Peristaltik wirkende Botenstoffe Neben Chromogranin A zählen beispielsweise auch die für den Kohlenhydratstoffwechsel wichtigen Hormone Insulin und Glukagon, das hungervermittelnde NPY sowie Enteroglukagon zu den Botenstoffen, welche keine Funktion bezüglich der Peristaltik des Magen-Darm-Traktes besitzen. Einzelheiten bezüglich der angeführten und weiterer Botenstoffe sind in Tabelle 5 zu finden. Freisetzung ­stimuliert (+) bzw. gehemmt (–) durch Wirkungen: ↑ fördernd, ↓ hemmend Magen: Sekretion von ­Peptidasen, Muzinen, ­Lysozym ↓ Darm: Resorption von Wasser und Elektrolyten ↑ Vasokonstriktion → Splanchnikusdurchblutung ↓ Vermittelt im Hypothalamus die orexigene Wirkung von Ghrelin Literaturverzeichnis Arnold R (2007) Diagnosis and differential diagnosis of hypergastrinemia. Wien Klin Wochenschr 119: 564 – 569 Banasch M, Schmitz F (2007) Diagnosis and treatment of gastrinoma in the era of proton pump inhibitors. Wien Klin Wochenschr 119: 573 – 578 Bayliss WM, Starling EH (1902) The mechanism of pancreatic secretion. J Physiol 28: 325 – 353 Campana D, Nori F, Piscitelli L, Morselli-Labate AM, Pezzilli R, Corinaldesi R, Tomassetti P (2007) Chromogranin A: is it a useful marker of neuroendocrine tumors? J Clin Oncol 25: 1967–1973 Chen D, Zhao CM, Hakanson R, Samuelson LC, Rehfeld JF, Friis-Hansen L (2004) Altered control of gastric acid secretion in gastrin-cholecystokinin double mutant mice. Gastroenterology 126: 476 – 487 Chey WY, Chang TM (2003) Secretin, 100 years later. J Gastroenterol 38: 1025 –1035 Collen MJ, Jensen RT (1994) Idiopathic gastric acid hypersecretion. Comparison with Zollinger-Ellison syndrome. Dig Dis Sci 39: 1434 –1440 61 Buch 1.indb 61 15.10.2009 11:10:56 Kap. 4 H. Jarz und M. Ledochowski Deftos LJ (1991) Chromogranin A: its role in endocrine function and as an endocrine and neuroendocrine tumor marker. Endocr Rev 12: 181–187 Dockray GJ, Varro A, Dimaline R, Wang T (2001) The gas­ trins: their production and biological activities. Annu Rev Physiol 63: 119 –139 Eberlein GA, Eysselein VE, Davis MT, Lee TD, Shively JE, Grandt D, Niebel W, Williams R, Moessner J, Zeeh J (1992) Patterns of prohormone processing. Order revealed by a new procholecystokinin-derived peptide. J Biol Chem 267: 1517–1521 Friis-Hansen L (2007) Lessons from the gastrin knockout mice. Regul Pept 139: 5 – 22 Gibbs J, Young RC, Smith GP (1973) Cholecystokinin decreases food intake in rats. J Comp Physiol Psychol 84: 488 – 495 Harper AA, Raper HS (1943) Pancreozymin, a stimulant of the secretion of pancreatic enzymes in extracts of the small intestine. J Physiol 102: 115 –125 Johnson LR, Lichtenberger LM, Copeland EM, Dudrick SJ, Castro GA (1975) Action of gastrin on gastrointestinal structure and function. Gastroenterology 68: 1184 –1192 Kleveland O, Syversen U, Slordahl K, Waldum HL (2001) Hypergastrinemia as a cause of chromogranin a increase in blood in patients suspected to have neuroendocrine tumor. Digestion 64: 71–74 Liddle RA, Goldfine ID, Rosen MS, Taplitz RA, Williams JA (1985) Cholecystokinin bioactivity in human plasma. Molecular forms, responses to feeding, and rela­ tion­ship to gallbladder contraction. J Clin Invest 75: 1144 –1152 McGuigan JE (1968) Gastric mucosal intracellular localization of gastrin by immunofluorescence. Gastroenterology 55: 315 – 327 Mutt V, Jorpes JE, Magnusson S (1970) Structure of porcine secretin. The amino acid sequence. Eur J Biochem 15: 513 – 519 Nehar D, Lombard-Bohas C, Olivieri S, Claustrat B, Chayvialle JA, Penes MC, Sassolas G, Borson-Chazot F (2004) Interest of Chromogranin A for diagnosis and followup of endocrine tumours. Clin Endocrinol (Oxf) 60: 644 – 652 Nobels FR, Kwekkeboom DJ, Coopmans W, Schoenmakers CH, Lindemans J, De Herder WW, Krenning EP, Bouillon R, Lamberts SW (1997) Chromogranin A as serum marker for neuroendocrine neoplasia: comparison with neuron-specific enolase and the alpha-subunit of glycoprotein hormones. J Clin Endocrinol Metab 82: 2622 – 2628 O‘Connor DT, Deftos LJ (1986) Secretion of chromogranin A by peptide-producing endocrine neoplasms. N Engl J Med 314: 1145 –1151 Parker BA, Doran S, Wishart J, Horowitz M, Chapman IM (2005) Effects of small intestinal and gastric glucose administration on the suppression of plasma ghrelin concentrations in healthy older men and women. Clin Endocrinol (Oxf) 62: 539 – 5 46 Pellicano R, De Angelis C, Resegotti A, Rizzetto M (2006) Zollinger-Ellison syndrome in 2006: concepts from a clinical point of view. Panminerva Med 48: 33 – 4 0 Peracchi M, Gebbia C, Basilisco G, Quatrini M, Tarantino C, Vescarelli C, Massironi S, Conte D (2005) Plasma chromogranin A in patients with autoimmune chronic atrophic gastritis, enterochromaffin-like cell lesions and gastric carcinoids. Eur J Endocrinol 152: 443 – 4 48 Rehfeld JF, Sun G, Christensen T, Hillingso JG (2001) The predominant cholecystokinin in human plasma and intestine is cholecystokinin-33. J Clin Endocrinol Metab 86: 251– 258 Roy PK, Venzon DJ, Shojamanesh H, Abou-Saif A, Peghini P, Doppman JL, Gibril F, Jensen RT (2000) Zollinger-Ellison syndrome. Clinical presentation in 261 ­patients. Medicine (Baltimore) 79: 379 – 411 Taupenot L, Harper KL, O‘Connor DT (2003) The chromogranin-secretogranin family. N Engl J Med 348: 1134 –1149 Uvnas-Wallensten K, Rehfeld JF (1976) Molecular forms of gastrin in antral mucosa, plasma and gastric juice during vagal stimulation of anesthetized cats. Acta Physiol Scand 98: 217– 226 Weber HC, Orbuch M, Jensen RT (1995) Diagnosis and management of Zollinger-Ellison syndrome. Semin Gastrointest Dis 6: 79 – 89 62 Buch 1.indb 62 15.10.2009 11:10:56