Document
Werbung

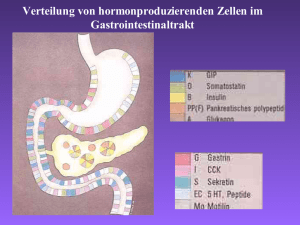
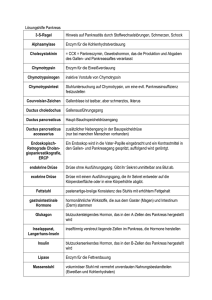
Klinikum Stuttgart – Medizin fürs Leben Neuroendokine Tumore Einteilung, klinisches Bild, Diagnostik Priv. Doz. Dr. Ralf Lobmann Klinik für Endokrinologie, Diabetologie und Geriatrie Klinikum Stuttgart – Bad Cannstatt Neuroendokrine Tumore - Definition • Tumore, ausgehend vom diffusen, endokrinen Zellsystem (Ursprung wahrscheinlich multipotente Stammzellen) im GI-Trakt durch die enterochromaffinen Zellen sowie die Inselzellen des Pankreas repräsentiert • mit Neuronen vergleichbare funktionelle Merkmale ohne Synapsen Sekretion von Neurotransmittern, -peptiden o. Hormonen ca. 50 % klinisch hormonaktiv • NET vom epithelialen Typ in Lunge,Thymus / GI-Trakt • NET vom neuralen Typ: Phäochromozytom, Paragangliom, Neuroblastom • unterschiedliche histologische Differenzierung (trabekulär, gyriform, medullär, insulär, glandulär, rosettenartig) GEP-NET - Phylogenese • Vorderdarm (foregut): Magen, Duodenum, Pankreas, Lunge (Histamin) • Mitteldarm (midgut): Jejunum, Ileum, Appendix, Zoekum (Serotonin) • Enddarm (hindgut): Restkolon, Rektum „Viszeralchirurgie “, Herausgeber Röher/Encke, 1997, Kapitel 47: Karzinoid, Simon D, Seite 631 GEP-NET - Historie Oberndorfer prägt 1907 den Begriff „Karzinoid“ als Tumor mit biologischem Verhalten zwischen benigner Läsion und Karzinom Terminologie 1907 1928 Karzinoide Karzinoid-Tumoren 1969 Oberndorfer Masson APUdom 2000 Pearse NET World Health Organization (WHO) GEP-NET - Klassifikation • Hochdifferenzierter Neuroendokriner Tumor (NET) • Hochdifferenziertes Neuroendokrines Karzinom • Niedrigdifferenziertes Neuroendokrines Karzinom • Vorderdarm: Ösophagus, Magen, Duodenum, Pankreas • Mitteldarm: Dünndarm bis re Flexur • Hinterdarm: rechte Flexur bis Rektum • Funktionell aktiv • Funktionell inaktiv GEP-NET – WHO-Klassifikation Prognose von GEP - NET gut schlecht hoch differenzierter Neuroendokriner Tumor hoch differenziertes Neuroendokrines Karzinom niedrig differenziertes Neuroendokrines Karzinom Stadium I Stadium II Stadium III Benigne o. niedrig maligne niedrig maligne hoch maligne - -/+ + Ki-67-Index (%) <2 >2 > 20 Histologische Differenzierung Hoch Hoch Niedrig - + + WHOKlassifikation Biologisches Verhalten Metastasen Infiltration / Angioinvasion Tumorgröße < 2cm a < 3cm b 2cma > > 3cm b beliebig a NET des Magen-Darm-Trakts; b NET des Pankreas Rindi G, Arnold R, Bosman FT et al. Nomenclature and classification of neuroendocrine neoplasms of the digestive system. In Bosman FT, Hruban RH, Theise ND (eds), WHO Classification of Tumours of the Digestive System. Lyon: IARC 2010; 13–14. Ki67< 2% Ki67 3% - 20% Ki67 > 20% mod. N. Deutsches Ärzteblatt | Jg. 108 | Heft 18 | 6. Mai 2011 Annals of Oncology 23 (Supplement 7): vii124–vii130, 2012 Epidemiologie Die Inzidenz dieser Tumoren, die mit 1 bis 2/100 000/Jahr angegeben wird (für die Insulinome gilt eine Inzidenz von circa 4/1 Million Personen/Jahr), scheint anzusteigen, was wahrscheinlich auf eine verbesserte und intensivere endoskopische Diagnostik zurückzuführen ist Neuroendokrine Tumoren des gastropankreatischen Systems neuroendrokrine Tumoren nicht funktionell ~ 30 - 55 % Problem: Diagnose spät funktionell Pankreas • • • • • • Insulinom Gastrinom Glukagonom VIPom Somatostatinom GRFom Darm • Karzinoid Lunge Nebenniere Thymus Klinik funktioneller GEP-NET Hormone Karzinoid Karzinoid-Syndrom Serotonin, Histamin Tachykinin, Bradykinin fore- /midgut VIPom Wässerige-DiarrhoeHypokaliämieAchlorhydrie Syndrom (WDHA) Vasoaktives-intestinales Peptid (VIP) Pankreas Lunge Glukagonom Glukagonom-Syndrom Glukagon Pankreas, Duodenum und Bereich Endokrinologie & Stoffwechselkrankheiten Syndrom Klinik für Nieren- und Hochdruckkrankheiten, Tumor Gastrinom Lokalisation nekrolytisches migratorisches Erythem Zollinger-Ellison-Syndrom Gastrin Pankreas, Duodenum Insulinom Hypoglykämie-Syndrom Insulin Pankreas Multiple Endokrine Neoplasie (MEN) Typ I Erstbeschreibung durch Wermer 1954 – autosomal-dominant vererbtes Tumorsyndrom sehr variable Kombination aus – Nebenschilddrüsenvergrößerung (pHPT) + – Hypophysenvorderlappentumore + – Inselzelltumore des Pankreas Ursache entdeckt 1988 durch Larsson et al.: Mutation auf Chromosom 11q13 (Menin Gen) neuroendokrine Tumore bei MEN I MEN – I (%) Gastrinom 20 – 61 Insulinom 12 – 21 Glukagonom VIPom Somatostatinom 3 1 1 Klinik: Symptome • Verdrängendes Wachstum • Koliken / Diarrhoe • Hormonspezifische Symptomatik • Flush • Tachykarde Rhythmusstörungen • Klassisches Karzinoidsyndrom: 10-30% aller NET Flush, Diarrhoe, Endokardfibrose (bei Serotonin- und Bradykininproduktion) Das Karzinoidsyndrom • Typische Beschwerden treten einzeln oder gemeinsam auf: • Anfallsartige Gesichtsrötung (Flush) (Serotonin) • Krampfartige Bauchschmerzen und Durchfälle (Serotonin, • • VIP) Dyspnoe (Kallikrein, Substanz P und Neuropeptid K) Kardiale Beschwerden (Serotonin) • • • • ≈80 % Bauchschmerzen und Durchfälle ≈50 % Flush ≈20 % Dyspnoe, ≈6% schwere Dyspnoe ≈30-50% Kardiale Beschwerden (Langzeitfolge) Wege zur Diagnose Klinik: Flush / Diarrhoe /Koliken Hypoglykämien Rezidivierende Ulkus- / Refluxkrankheit Histologie: Neuroendokriner Tumor nach Biopsie/ Operation Genetischer Befund bei Familiendiagnostik: MEN 1, von HippelLindau-Syndrom Labor Endo-/Sonografie (KM) CT/ MRT (Leber-KM) Endoskopie (+Kapsel) SomatostatinrezeptorSzintigrafie PET-CT Andere Hypersekretionssyndrome • Gastrinom (Zollinger-Ellison-Syndrom) – V.a. Pankreas (40%) und Duodenum (40%) – Klinik: Überproduktion von Gastrin -> vermehrte Magensäuresekretion -> Ulcera ventriculi et duodeni, Diarrhö, abdominelle Beschwerden. • Insulinom – Häufigster hormonproduzierender Tumor des Pankreas und in über 95 % gutartig – Klinik: Überproduktion von Insulin -> Hypoglykämie -> Mattigkeit, Schwächegefühl, Zittern, Herzklopfen, Schwitzen, Hungergefühl, Gewichtszunahme und Nervosität. Bewusstlosigkeit, Krampfanfällen und Koma entwickeln. • Glukagonom – Pankreas. Typisch für MEN 1. Fast nie bösartig. – Klinik: Hyperglykämie, Gewichtsverlust, Anämie Wechsel von Obstipation und Diarrhö. Migratorisches nekrolytisches Erythem Sehr seltene Hypersekretionssyndrome • VIPom – <2%, häufig große und maligne Tumoren im Pankreas (90%; ¼ Kopf, ¾ Korpus und Schwanz) oder im Grenzstrang (10%) – Klinik: VIP -> Starke Diarrhö, mit Flüssigkeits- und Elektrolytverschiebungen • Somatostatinom – < 1 %, v.a. in Pankreaskopf (55–75 %) und Duodenum (Hier bei MEN 2b) – Klinik: Diabetes mellitus, Diarrhö, Steatorrhö, Anämie, Cholelithiasis Laboranalytik Bei Verdacht auf eine serotoninproduzierende NEN des Ileum („Ileumkarzinoid“; Diarrhoe, Flushsymptomatik) muss die 5-HydroxyIndolessigsäure, ein Abbauprodukt des Serotonins, im angesäuerten 24-Stunden-Urin bestimmt werden. Falsch positive Werte können durch verschiedene Nahrungsmittel: >>> Pflaumen, Ananas, Bananen, Tomaten, Obergine, Avocados, Nüsse. Auch die Neuronen Spezifische Enolase (NSE) ist ein genereller Serummarker bei NEN, wobei die Bestimmung überwiegend bei den schlecht differenzierten Neuroendokrinen Karzinomen, bei denen Chromogranin A häufiger negativ ist, sinnvoll ist. Ein weiterer genereller Marker, der bei ca. 80% der Patienten mit NEN der Bauchspeicheldrüse und ca. 50% der Patienten mit Dünndarm-NEN erhöht ist, ist das Pankreatische Polypeptid. Da es bei vielen anderen Erkrankungen ( z.B. Durchfall anderer Ursache) erhöht sein kann, wird es vorzugsweise dann als Verlaufsparameter eingesetzt, wenn Chromogranin A nicht erhöht ist. Tumormarker Chromogranin A Genereller Tumormarker für NET des GEP-Systems ist Chromogranin A im Serum. Die Sensitivität liegt bei etwa 30 – 40 % in lokalisierten Tumorstadien und 60 – 80 % in metastasierten Tumorstadien. Die Sensititvität beträgt etwa 50 – 80 % bei NET des Pankreas und 60 – 90 % bei NET des Jejunum/ Ileum. Die Höhe der Serumspiegel von Chromogranin A korreliert mit der Tumorlast und dem Tumorgrößenverlauf . In der Früherkennung von solitären Primärtumoren ohne Metastasierung ist die Sensitivität von Chromogranin A gering. Von einem unspezifischen Einsatz der Chromogranin A Bestimmung zum Screening im Rahmen einer Tumorvorsorge ist abzuraten. Häufige Ursachen für falsch positive Chromogranin A Spiegel chronisch atrophische Gastritis (Typ-A) die Einnahme von Protonenpumpeninhibitoren* Niereninsuffizienz Parkinson Schwangerschaft Steroidtherapie * Bei Chromogranin A Erhöhung unklarer Genese sollten PPIs wenn möglich für 14 Tage pausiert und die Bestimmung wiederholt werden. Insulinome • Bilden Insulin,Proinsulin und C-Peptid • Fast ausschließlich im Pankreas • Symptome: Hypoglykämien; Tremor; Schwitzen; Palpitationen; Krampfanfälle; Verwirrtheit im Rahmen der Blutzuckerwerte < 50mg% • In 5-10% maligne,bei 4% MEN1 • Abgrenzen von Nesidioblastose (diffuse knotige Hyperplasie von Inselzellen) Hungerversuch •Blutzuckermessungen Ca 4-stündlich, wenn BZ >60mg/dl Ca 2-stündlich, wenn BZ 50-60 mg/dl Ca 1-stündlich, wenn BZ< 50 mg/dl •Auf Station gemessene BZ-Werte<45 mg/dl müssen durch eine BZ-Messung im Labor bestätigt werden •1 x tgl Ketone im Urin (Stix) •Abbruch des Versuches: (Whipple-Trias) Bei Symptomen der Hypoglycämie und BZ<45 mg/dl Wenn BZ< 40 mg/dl auch ohne Hypoglycämiesymptome Nach 72 Stunden •Blutentnahme zur Bestimmung von: Insulin C-Peptid Blutzucker Wenn BZ < 50 Mg/dl •Bei Abbruch des Tests Insulin C-Peptid Proinsulin Urin innerhalb von 4 Stunden (SH, Glinide) Insulinogener Index: Seruminsulin (uE/ml) Blutzucker (mg/dl) <0,5 Normalbefund >0,5 endogener Hyperinsulinismus Diagnose Symptome Glucose (mg/dl) Insulin (mU/l) C-Peptid (nmol/l) Proinsulin (pmol/l) Normal nein >40 <6 <0,2 <5 Insulinom ja <45 >6 >0,2 >5 Hypoglycaemia factitia (Insulin) ja <45 >6 < 0,2 <5 Hypoglycemia factitia (Sulfonylharnstoffe) ja <45 >6 >0,2 >5 Pseudohypoglycämie ja >40 <6 <0,2 <5 • Plasmaglukose unter 40 mg/dL bei zugleich nicht supprimierten Insulin- und C-Peptid-Werten spricht für ein Insulinom. • Insulin-Glukose-Quotient fraglich; >0,25 hinweisend auf Insulinom • niedrige C-Peptid-Werte hinweisend auf faktitielle Insulin-Zufuhr • bei Sulfonylharnstoffen Insulin- und C-Peptid-Werte erhöht C-peptid Suppressionstest Blood glucose]/[C-peptide] ratio in patients with insulinoma (closed circles with index of number of patients; Group A2) and patients without insulinoma (open squares; Group B2) during the C-peptide suppression test . Insulin was infused from 0 to 120 minutes as indicated by the box Gastrinom • Klinische Symptomatik – Magensäurehypersekretion – Rezidivierende Ulzera – Steatorrhoe – Diarrhö – Diabetes mellitus – Erythema necretolyticans migrans – Normochrome, normozytäre Anämie • Spezielle Diagnostik – Gastrin i.S. – Sekretintest – Kalzium-, Glukagonstimulation Erhöhte Plasma-Gastrinspiegel Hohe Gastrinwerte finden sich auch bei Patienten mit chronischatrophischer Korpusgastritis. Liegt die Gastrinkonzentration bei Hyperazidität zwischen 150 und 1 000 pg/mL, muss die Diagnose durch einen Sekretin-Test und durch die Bestimmung der basalen Magensäure-Sekretion bestätigt werden. Nüchtern-Gastrin-Werte zwischen 150 und 1.000 pg/mL zeigen sich auch unter einer Protonenpumpenhemmer-Therapie • Gastrinom • Antrale G-Zell-Hyperplasie • Belassener Antrumrest nach BII-Op • Niereninsuffizienz • Ausgeprägte Dünndarmresektion • Atrophische Fundusgastritis mit erhaltenem Antrum (z. B. perniziöser Anämie) • Folge einer Vagotomie ohne Antrumresektion • Magen-Ca mit Sub- und Anazidität Nachweis der Säurehypersekretion bei gleichzeitig bestehender Hypergastrinämie zwingend >>> Hypergastrinämie kommt viel häufiger bei Achlorhydrie (Typ-A-Gastritis) vor Bestimmung des Magen ph-Wertes >>> bei Gastrinom immer < 2 >>> bei Achlorhydrie bei > 3 Die Kombination eines Nüchterngastrinwerts von > 1 000 pg/mL zusammen mit einem intragastralen pHWert von < 2,5 ist praktisch beweisend für diese Erkrankung. Sekretin Test i.v. Applikation Sekretin ist gefolgt von Anstieg des Gastrins 2 IE/kg Körpergewicht Sekretin (z. B. Secrelux Gold-ham) über 2 Minuten. Danach erfolgen die weiteren Blutentnahmen in Abständen von 2, 5, 10 und 30 Minuten Bei anderen Ursachen der Hypergastrinämie fällt Gastrin nach Sekretingabe i.d. Regel ab Test ist nicht spezifisch; Problematisch bei Patienten unter PPI. >>> PPI etwa für 4 Wochen absetzen Gabe von kurzwirksame Histamin-H2-Blocker in hoher Dosierung H2Blocker am Vorabend vor der Testung absetzen VIPom (Synonym:Verner-Morrison-Syndrom, WDHA-Syndrom) • Klinische Symptomatik – Wässrige Diarrhöen (bis 12 l/d) – Hypokaliämie – Achlorhydrie – Dehydratations-Schock – Hyperkalzämie – Lethargie, Muskelschwäche – Übelkeit und Erbrechen – Passagere renal-tubuläre Dysfunktion • Spezielle Diagnostik – Stuhlanalyse – Nachweis erhöhter Plasma-VIP-Konzentrationen Bildgebung • Gute Bilddiagnostik ist wichtig für die optimale Diagnose und das Therapiemanagement – Endoskopie – (Endo)Sonographie – Konventionelle Radiodiagnostik: • CT • MRT • (Angiographie) – Funtionelle Radiodiagnostik • PET • Somatostatinrezeptorszintigraphie (SRS) CT Abdomen Image courtesy of Diane Lauren Reidy, MD, Memorial Sloan-Kettering Cancer Center, New York, NY. Bildgebung: SSTR-Szintigraphie/PET • Somatostatinrezeptoren (SSTR), v.a. SSTR2, wird von fast allen NET exprimiert. Radioaktive markierte Somatostatinanaloga binden an SSTR. • Benutzte Tracer sind: – 111Indium-Octreotid (Octreoscan®) – 90Yttrium-DOTATOC – 68Gallium-DOTATOC / -DOTANOC • Physiologische Anreicherung in Leber, Nieren und Milz. Tumorgrad und Überleben Cumulative Survival 1.0 G1 0.8 G2 0.6 0.4 G1 vs G2 P = 0.040 G1 vs G3 P < 0.001 G2 vs G3 P < 0.001 0.2 G3 0.0 0 50 100 150 200 Survival Time (months) * ENET and AJCC grading system 250 Rindi G, et al. Virchows Arch. 2006;449:395-401. Rindi G, et al. Virchows Arch. 2007;451:757-762. Pape UF, et al. Cancer. 2008;113:256-265. Zusammenfassung NEN entwickeln sich aus vom Mesoderm abstammenden Stammzellen Je nach entsstehungsort haben sie eine unterscheidliche Biologie und immer ein malignes Potential; dieses hängt i.d. Regel von der Primärtumiorgröße ab (Ausnahme duodenale Gastrinome; NET des distalen Jejunum/Illeum) Die meisten funktionellen NeET sind maligne (Ausnahme Insulinome 95% gutartig und klein) Das Grading ist von erheblicher prognostischer Bedeutung 90% der NET weisen Somatostatin-Rezeptoren auf (sstr2a, sstr 5) Vielen Dank für Ihre Aufmerksamkeit