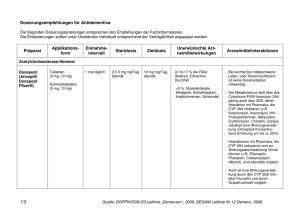
TheMeNhefT neurologie • PsychiAtrie
Werbung

Ausgabe 994a • 67. Jg. • KW 18/2013 TYP 1 UND TYP 2 DIABETES MELLITUS Lantus – mit 1. Juli 2008•bewilligungsfrei (RE2) Themenheft neurologie Psychiatrie Apidra – Positive Opinion der Emea für die ® THEMENHEFT DIABETES * ® Zulassung für Kinder ab 6 Jahren Inkretine – ein neuer Ansatz inderder Therapie Stellenwert Nootropika in des Typ 2 Diabetes der Demenztherapie Insulinanaloga Wearing OFF bei Mb. Parkinson Diabetes im Alter Persönlichkeitsstörungen Antihypertensiva Therapie des Burn-Outbei Diabetes mellitus PROATGLA080601 © Fotolia HbA1c < –7% unter Depression differenziertere Lebensstiltherapie – und verträglichere Therapie was neuere nun? Substanzen durch Fachkurzinformation siehe Seite 30 Symptomatische Diabetes im SpannungsDemenz-Therapie – feld von Lebensstil und Cholinesterasehemmer und Medizin Memantin 24-Stunden Diabetes Hotline: 01/801 85-2448 www.diabetesportal.at * Alle Darreichungsformen sind dokumentationspflichtig P.b.b. Verlagspostamt 1180 Wien • 04Z035389 M • ISSN 0048-5128 Juni 2008 Nr. 940a 62. Jahrgang • • P.b.b. Verlagspostamt 1180 Wien • GZ13Z039504M • ISSN 0048-5128 2 t h e m e n h e f t n e u r o lo g i e • p sy c h i at r i e Therapeutische Heraus­ forderungen im Fokus wissenschaft D emenz, Mb. Parkinson, Persönlichkeitsstörungen bzw. BurnOut stellen allesamt therapeutische Herausforderungen dar – in diesem Themenheft sollen einzelne praxisrelevante Aspekte angesprochen werden. Im Rahmen der Demenztherapie finden oftmals auch Nootropika Einsatz – Priv.-Doz. Dr. Michael Rainer und Mag. Christine Krüger-Rainer aus Wien geben einen Überblick hinsichtlich der dazu bestehenden Datenlage und den daraus resultierenden Empfehlungen bzw. einen Ausblick auf potentielle therapeutische Optionen. Im Krankheitsverlauf des Mb. Parkinson sinkt die Speicherfähigkeit der dopaminergen Neuronen und die medikamentöse Wirkung lässt vor der nächsten Einnahme nach. Die Behandlung ist nicht einfach, weshalb auf die Prophylaxe dieser Zustände großer Wert gelegt wird. Prim. Dr. Dieter Volc aus Wien erläutert in seinem Beitrag therapeutische Ansätze bei Wearing OFF im Rahmen eines Mb. Parkinson. Persönlichkeitsstörungen sind vielfältig und die Abgrenzung zur „Normalität“ oftmals eine überaus schwierige. Diesem komplexen Thema widmet sich Univ.-Prof. Dr. Karin Gutiérrez-Lobos aus Wien in ihrem Artikel – sie gibt einen praxisnahen Überblick über das weite Spektrum der klinischen Präsentationsmöglichkeiten und skizziert differentialtherapeutische Überlegungen. M. Rainer, C. Krüger-Rainer Stellenwert der Nootropika in der Demenztherapie 3 D. Volc Wearing OFF bei Mb. Parkinson 6 K. Gutiérrez-Lobos Persönlichkeitsstörungen 10 P. Hofmann Therapie des Burn-out 15 Fortbildung Symptomatische Demenz-Therapie – Cholinesterasehemmer und Memantin 20 Depression – differenziertere und verträglichere Therapie durch neuere Substanzen 23 IMPRESSUM ISSN 0048-5128 DVR 0163538 Ein nicht zuletzt auch im Rahmen gesellschaftlicher Veränderungen und einer steigenden öffentlichen Thematisierung zunehmend aktuelles Problem ist das Burn-Out-Syndrom. International zwar noch nicht als Krankheit anerkannt, ist es dennoch mit schwerwiegenden Folgen – nicht nur in gesundheitlicher Hinsicht – verbunden. Univ.-Prof. Dr. Peter Hofmann aus Graz berichtet über die vielfältigen eigenen Erfahrungen bei der Betreuung Betroffener. Ihr Dr. Michael Burgmann Schriftleitung ARZT & PRAXIS Medieninhaber und Verleger: ARZT & PRAXIS VerlagsgmbH, Währinger Straße 112, 1180 Wien, Tel. 01/479 05 78, Fax: 01/479 05 78 DW 30, E-Mail: [email protected], www.arztundpraxis.at Herausgeber: Dkfm. Karin Schmitt Geschäftsführung: Mag. Manuela Moya Druckerei: „agensketterl“ Druckerei GesmbH, 3001 Mauerbach Bezugsbedingungen: Der Abonnementpreis beträgt jährlich (einschließlich Porto, in Österreich auch einschließlich Ust.) Euro 35,– . Turnusärzte: Euro 19,– . Abonnement Ausland: Euro 80,– / Erscheinungsort: 1180 Wien. Schriftleitung: Dr. Michael Burgmann, Oberer Panoramaweg 10, 8112 Gratwein, Tel: 0676/671 01 98, [email protected] Druckauflage: 15.000 Namentlich gezeichnete Artikel, Leserbriefe und sonstige Beiträge geben die persönliche und/oder wissenÖAK-geprüft (2.HJ/12) schaftliche Meinung des Verfassers wieder und müssen daher nicht mit der Meinung der Redaktion übereinstimmen. Die Zeitschrift dient zur persönlichen Information des Empfängers und seiner Mitarbeiter, soll aber nicht im Wartezimmer aufgelegt werden. Für Angaben über Dosierungen, Applikationsformen und Angaben pharmazeutischer Spezialitäten kann der Verlag keine Gewähr übernehmen. Sie sind vom jeweiligen Anwender auf ihre Richtigkeit zu überprüfen. Alle Rechte, insbesondere das Recht der Vervielfältigung und Verbreitung sowie der Übersetzung, vorbehalten. Kein Teil des Werkes darf in irgendeiner Form (Fotokopie, Mikrofilm oder ein anderes Verfahren) oder unter Verwendung elektronischer Systeme gespeichert, verarbeitet, vervielfältigt, verwertet oder verbreitet werden. Liebe Leserin, lieber Leser, aus Gründen der besseren Lesbarkeit wird bei Personenbezeichnungen die männliche Form gewählt. Die Angaben beziehen sich aber auf Angehörige beider Geschlechter. Jahrgang 67 / 994a / 2013 t h e m e n h e f t n e u r o lo g i e • p sy c h i at r i e Stellenwert der Nootropika in der Demenztherapie Memory Clinic und Karl Landsteiner Institut für Gedächtnis- und Alzheimerforschung im SMZ-Ost Email: [email protected] Seit Mitte der 50iger-Jahre gibt es für die Behandlung von Demenzerkrankungen zahlreiche unterschiedliche Nootropika. Diese sind im ZNS wirksam und erhöhen nur unter pathologischen Bedingungen die höheren mentalen Funktionen, wie z.B. Gedächtnis-, Orientierungs-, Lern-, Auffassungs-, Denk- und Konzentrationsfähigkeit. Betrachtet man die unterschiedlichen Wirkstoffgruppen der Nootropika, so spiegelt sich darin die beträchtliche Hypothesen-Heterogenität zur Pathogenese der Demenzen wider. Neben den bekannten NeurotransmitterDefiziten, bei denen das cholinerge Defizit eine überragende Stellung einnimmt, gilt die Überstimulation des NMDA-Rezeptors durch Glu­ tamat als gesichert. Da dementielle Syndrome eine große Heterogenität aufweisen, deren Verlauf unterschiedlich ist und die Medikamente unterschiedlich in die Pathophysiologie eingreifen, ist eine reine Einteilung bezüglich der chemischen Struktur und der pharmakologischen Gruppen nicht zielführend. Neben den für die Alzheimer-Demenz zugelassenen drei Cholinesterasehemmern und Memantin werden Patienten noch immer mit einer großen Anzahl von sogenannten Nootropika behandelt. Viele dieser Substanzen sind jedoch nach den neuesten Wirksamkeitskriterien, welche die Zulassungsbehörden – wie die European Agency(EA) 1997 – definiert haben, unzureichend überprüft. Die klinische Wirksamkeit müsste sowohl auf der Hirnleistungsebene als auch in der Alltagskompetenz oder im globalen klinischen Gesamteindruck nachgewiesen sein. Nur für die mittlere bis schwere Alzheimer-Demenz zählt die Verbesserung der Alltagsfähigkeiten bzw. das klinische Globalurteil mehr als die Hirnleistungssteigerung, sodass auf diese in der Überprüfung verzichtet werden kann. Mindestens genauso wichtig, aber in der Praxis schwerer messbar, wären Auswirkungen auf affektive und Verhaltenssymptome, auf die Belastungen der Angehörigen und auf ökonomische Faktoren. Die meisten Nootropika konnten den Nachweis einer positiven Leistungssteigerung meist nur in unzureichenden kognitiven Tests erbringen. In anderen Prüfebenen gelang dies ebenso nur unzureichend. Die Europäische Zulassungsbehörde wurde 1995 gegründet und entwickelte eine „Note for Guidance“, die für klinische Stu­dien 1998 etabliert wurde. Sowohl von der FDA als auch der EMEA (European Medicines Evalua­ tion Agency) wird für Antidementiva der Wirksamkeitsnachweis in zwei kontrollierten, randomisierten, prospektiven Phase-III-Studien über einen Zeitraum von 24 Wochen verlangt. Ist der Placebovergleich in den USA noch unumgänglich, wird dies in der EU auch durch eine aktive Kontrollgruppe möglich. Für die leichte bis mittelschwere Alzheimer-Demenz hat sich zur Beurteilung der Wirksamkeit die kognitive Subskala der Alzheimer Disease Assessment-Scale (ADAS-Cog) durchgesetzt. Darüber hinaus muss eine weitere primäre Zielvariable statistische Signifikanz zeigen, damit eine klinische Relevanz gegeben ist (z.B. klinisches Interview – Clinican Interview Based Impression of Change + Caregiver Input [CIBIC+] oder die Clinical Global Impression of Change [CGI-C]). Für alle älteren Nootropika liegen derartige Untersuchungen nicht vor. Weitere für die praktische Anwendung wichtige Sekundärparameter sind z.B. Verbesserungen im neuropsychiatrischen Inventar (NPI). Da klinische Studien sehr komplex sind, lange dauern und eine große Anzahl von Befunden erhoben bzw. analysiert werden müssen, sind Firmen, deren Medikamente für die Behandlung allgemeiner Hirnleistungsstörungen zugelassen sind, weniger interessiert, derartig aufwendige Studien durchzuführen. Es ist schwierig, eine Verbesserung auf mehreren Prüfebenen gegenüber einer Kon- Priv.-Doz. Dr. Michael Rainer und Mag. Christine Krüger-Rainer Jahrgang 67 / 994a / 2013 trollgruppe zu objektivieren. Es könnte in der Prüfung aber auch eine Progressionsverlangsamung oder -stabilisierung bereits als therapeutischer Erfolg angesehen werden, da die Alzheimer-Demenz als relativ linear fortschreitende Erkrankung definiert ist. Für die Prüfung der Progressionsverzögerung ist ein anderes Studien-Design notwendig. Ein Surrogat-Marker, wie z.B. eine MRI-volume­trische Messung der Temporallappenregion scheint notwendig zu sein. Es ist leicht einzusehen, dass ältere Nootropika-Firmen sich diesen ständig wachsenden Anforderungen an die Wirksamkeitsüberprüfung aus Kostengründen nicht stellen. Obwohl auch derzeit international kein Konsens über die erforderliche Methodik, die zu verwendenden psychologischen Skalen, genaue Krankheitsdefinitionen bzw. den Einschluss von jenen in der Praxis hauptsächlich anzutreffenden Mischformen aus degenerativen und vaskulären Demenzen besteht sowie eine Evidenz über die Wirksamkeit und Progressionshemmung auch für moderne Antidementiva nicht vorliegt, ist es für ältere Nootropika praktisch unmöglich, einen derartigen Wirksamkeitsnachweis zu erbringen. Die FDA forderte darüber hinaus 2002 die Einbeziehung von Surrogat-Endpunkten, wie z.B. MRIKontrollen zur Temporallappenatrophie, welche von den europäischen Behörden noch nicht gefordert werden. Bereits um 1980 wurden viele aus unterschiedlichen Wirkstoffklassen bestehende Nootropika zur Behandlung von Hirnleistungsstörungen im Alter zugelassen. Bestimmte Wirksamkeitskriterien mussten dabei nur in unzureichendem Maße erfüllt werden. Viele dieser Medikamente sind für die große Indikationsgruppe „Hirnleistungsstörung im Alter“ ARZT & PRAXIS 3 4 t h e m e n h e f t n e u r o lo g i e • p sy c h i at r i e registriert, während die neuen Antidementiva für wesentlich engere Indikationsstellungen wie z.B. leichte bzw. mittelgradige AlzheimerDemenz sowie Memantin für mittelgradige bzw. schwere Alzheimer-Demenz zugelassen sind. Erfolgte der Wirksamkeitsnachweis für viele dieser Nootropika nur in unzureichendem Maße, so sind darüber hinaus auch einige „sogenannte Nootropika“ überhaupt nur durch „positive Produktmonographien“ zugelassen worden. Nootropika bei leichter kognitiver Beeinträchtigung Hauptindikationsgebiet für Nootropika sind leichte kognitive Beeinträchtigungen, international auch Mild Cognitive Impairment (MCI) genannt, für die es sinnvoll erscheint, hirnleistungssteigernde Substanzen einzusetzen. Patienten mit einer leichten kognitiven Leistungsminderung zeigen neben typischen Gedächtnisdefiziten auch eine reduzierte Informationsverarbeitungsgeschwindigkeit, Denkflexibilität und schwankende Konzen­ trationsleistungen, sodass sie merken, dass die tagtäglichen Leistungsanforderungen durch ihre eigene Leistungsfähigkeit nicht mehr zufriedenstellend bewältigt werden können. Für die große Patientengruppe der „leicht kognitiv Beeinträchtigten“ (ICD 10: F06.7) liegen bisher keine ausreichenden Wirksamkeitsnachweise vor. Die Gruppe der leicht kognitiv Gestörten, die in Österreich ca. 400.000 Perso- nen beträgt, ist das Hauptindikationsgebiet für Nootropika. Insgesamt ist über die neurobiologischen Grundlagen der leichten kognitiven Beeinträchtigung relativ wenig bekannt, und man weiß bis heute nicht, ob hier die gleichen pathophysiologischen Prozesse vorliegen, wie bei der Alzheimer-Demenz und der vaskulären Demenz. Für diese große Gruppe der leicht kognitiv Beeinträchtigten sind neue Studien mit Nootropika zu fordern, da es nicht schlüssig ist, Studienergebnisse von Demenzprozessen auf die wesentlich größere Gruppe der leicht kognitiv Beeinträchtigten zu extrapolieren. Auch andere Indikationsgebiete für Nootropika, wie z.B. Lernstörungen bei Kindern, Entzugssyndrome bei Alkohol- und Tranquilizerabusus, apoplektische Zerebralinfarkte und Residualsyndrome nach Schädel-Hirn-Traumen sind ebenfalls in zu geringem Ausmaß untersucht, um eine schlüssige Beurteilung der Nootropika abzugeben. Zumeist bleibt von allen Kritikern der berechtigte Vorwurf über, dass die in der Vergangenheit untersuchten Patientengruppen nicht ausreichend genau definiert waren, keine sauberen Differentialdiagnosen durchgeführt wurden sowie die verwendeten primären und sekundären Zielparameter nicht so genau definiert waren, wie dies für Studien mit Cholinesterasehemmern und Memantin bei Demenz gilt. Nootropika können die für die Neuronenverluste und Funktionseinschränkungen wesentlichen Mechanismen wie z.B. oxidativen Stress, reduzierten Neuronen- und Energiemetabolismus, Apoptose, Membrandysfunktionalität und inflammatorische Mitbeteiligung günstig beeinflussen, sodass die Progression verzögert werden könnte. Ein eindeutiger Nachweis, dass die Progression zur Demenzerkrankung durch Nootropika verzögert werden könnte, ist bis heute jedoch nicht erfolgt. Hier gibt es allerdings auch für die Antidementiva im engeren Sinne (Cholinesterasehemmer und Memantin) keinen eindeutigen klinischen Nachweis einer Reduktion der Konversionsrate hin zur Demenz. Patienten mit einer leichten kognitiven Beeinträchtigung haben ein Konversionsrisiko von ungefähr 15 % pro Jahr, eine manifeste Demenz zu entwickeln und nach ca. 5 Jahren sind etwa die Hälfte der Patienten dement geworden. Da sich die Patienten ihrer Defizite sehr wohl bewusst sind, weisen sie auch einen sehr hohen Leidensdruck auf und wenden sich oftmals vertrauensvoll an ihren Arzt, um hilfreiche Medikamente verschrieben zu bekommen. Dieser Bereich ist ein Hauptindikationsgebiet für die große Gruppe der Nootropika, deren Einsatz in der Praxis besonders notwendig erscheint, obwohl deren Wirksamkeit nicht ausreichend nachgewiesen wurde. Auch die klassischen Cholinesterasehemmer, Vitamin E, Antirheumatika und antiinflammatorische Medikamente sind den klinischen Wirksamkeitsnachweis bei MCI schuldig geblieben. Begleitende affektive Symptome wie z.B. depressive Verstimmung und Angst- und Schlafstörungen sind unbedingt zu diagnostizieren und entsprechend medikamentös zu behandeln. Nootropika bei Demenz Abb.1: Alternative Antidementiva – Empfehlungen der österreichischen und deutschen AlzheimerGesellschaft ARZT & PRAXIS Wir können auch nicht behaupten, dass Nootropika nicht symptomatisch vorteilhaft und krankheitsmodifizierend wirken, da sie möglicherweise doch in die komplexen zell- und molekularbiologischen Mechanismen der Demenzerkrankung eingreifen. Auch ältere Nootropika könnten krankheitsmodifizierend und neuroprotektiv wirken. Möglicherweise könnten sie die Aggregation oder den Abbau des Beta-Amyloids günstig beeinflussen, die Tau-Phosphorylierung hemmen, antiinflammatorische und antioxidative Eigenschaften aufweisen, den Lipidstoffwechsel günstig beeinflussen oder eine neurotrophe bzw. -protektive Wirkung entfalten. Niemand kann sagen, ob eine Kombination von älteren Nootropika mit neueren Antidementiva auf Grund der komplexen Pathophysiologie der Alzhei- Jahrgang 67 / 994a / 2013 t h e m e n h e f t n e u r o lo g i e • p sy c h i at r i e mer-Demenz nicht doch sinnvoll wäre. Nootropika und Antidementiva könnten eventuell einen synergistischen, potenzierenden Effekt bewirken. Derartige Kombinationstherapien sind in klinischen Studien noch nie untersucht worden, und wir können dazu keine Aussage treffen. Die Kombination von Memantin und Donepezil war der Monotherapie überlegen, die Kombination mit Vitamin E ergab keinen zusätzlichen Benefit. Wahl des richtigen Nootropikums Auch die Frage, welchem der Nootropika der Vorzug gegeben werden sollte, ist schwierig zu beantworten, da die Verum-Placebo-Differenzen in vielen Studien nur zwischen 15 und 25 % betrugen bzw. nur wenige Vergleichsuntersuchungen durchgeführt wurden. Interessant ist aber eine Studie von Kanovsky aus dem Jahre 1988, in der Nimodipin (Nimotop®) versus Dihydroergotoxin (Ergomed®, Hydergin®) versus Placebo untersucht wurden und eine signifikante Überlegenheit beider Verumpräparate nachgewiesen werden konnte. Die Dauer der Behandlung sollte nicht unter drei Monaten liegen, da kognitive Defizite und die Alltagskompetenz keine derartig rapiden Verbesserungen erwarten lassen. Zu Dihydroergotoxin liegen zahlreiche klinische Studien aus der Vergangenheit vor, die niemals einen eindeutigen Wirksamkeitsnachweis erbrachten, jedoch eine sehr geringe Nebenwirkungsrate nachwiesen. Ein rezentes Cochrane-Review konstatiert, dass Dihydroergotoxin einen gewissen Effekt in der globalen Funktion aufweist, es empfiehlt jedoch weitere Wirksamkeitsstudien. Für das peptiderge Nootropikum Cerebrolysin® gibt es in mehreren klinischen multizentrischen Doppelblindstudien jeweils übereinstimmende Wirksamkeitsnachweise bei Demenz. Cerebrolysin® wird durch standardisierte biotechnologischen Methoden und einen standardisierten proteolytischen Prozess aus Schweinehirnproteinen gewonnen. Hierbei wirken biologisch aktive Peptide wie ein natürlicher Wachstumsfaktor, nämlich neurotroph und -protektiv. Mit seinem geringen Molekulargewicht von unter 10 Kilodalton ist eine ausreichende Bluthirnschrankenpassage gewährleistet. Rezente Studien zeigen, dass Cerebrolysin® sich vor allem in den bei der Alzheimer-Demenz besonders beeinträchtigten Hirnarealen wie dem Hippocampus bzw. dem septalen Nukleus anreichert und eine ähnliche neurotrophe Aktivität entfaltet wie der Ner- Jahrgang 67 / 994a / 2013 venwachstumsfaktor. Cerebrolysin® konnte die Degeneration von medialen septalen cholinergen Neuronen verhindern. Im Tierversuch konnte Cerebrolysin® die synaptische Dichte erhöhen und die neuronale Zytoarchitekturstruktur normalisieren. Auch das räumliche Lernvermögen und Gedächtnisdefizite konnten verbessert werden. Weltweit wurden in klinischen Studien bereits mehr als 1.600 Patienten integriert. Vor allem die Studien von Rüther und die Studien von Alvarez zeigen einen signifikant positiven Effekt von Cerebrolysin® bei Alzheimer-Demenz bzw. nach postakuter traumatischer Hirnschädigung. Hierbei verbesserten sich die Patienten in der Rüther-Studie nicht nur im weltweit führenden primären Zielparameter der Alzheimer Disease Assessment-Scale (ADAS-Cog), sondern auch in den Aktivitäten des täglichen Lebens und in der neuropsychiatrischen Symptomatik. Von allen Nootropika weist Ginkgo biloba (EGB761, Cerebokan®, Ceremin®, Tebofortan®) die dauerhafteste und beste Studienkultur auf, welche über mehr als 30 Jahre verfolgt werden kann. Obwohl die klinische Wirksamkeit nicht restlos nachgewiesen ist, reicht die Datenlage aus, dass in den Guidelines der World Federation of Societies of Biological Psychiatry (WFSBP) zur biologischen Behandlung von Alzheimer-Demenzen und anderen Demenz­ erkrankungen Ginkgo biloba neben den Standard-Antidementiva wie Cholinesterasehemmer und Memantin als 4. Antidementivum angeführt wird. Ginkgo biloba zeigte in vielen klinischen Studien signifikante positive Effekte in validierten kognitiven Tests und es gibt Hinweise, dass die Alltagskompetenz und die soziale Kompetenz verbessert wurden bzw. auch die für die Belastungen der Angehörigen besonders wichtige neuropsychiatrische Symptomatik reduziert werden konnte. Sogar das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWIG) dokumentierte einen klinischen Nutzen von EGB761 in der Dosierung von 240 mg pro Tag. Auch zur Beurteilung der Symptomprogression gibt es eine interessante Untersuchung, die belegt, dass Ginkgo biloba ähnlich wie Cholinesterasehemmer die Demenzprogression verzögern könnte – unter der Voraussetzung, dass die unterschiedlich verwendeten Skalen miteinander vergleichbar wären. Auch eigene Untersuchungen zu den pharmakoökonomischen Auswirkungen der Behandlung nicht-institutionalisierter Demenzpatienten in Österreich sprechen für einen progressionsverzögernden Effekt unter einer Behandlung mit 240 mg Ginkgo biloba pro Tag. Hierbei wurde eine Metanalyse von Daten zur Alltagsaktivität von 1.201 Demenzpatienten durchgeführt, die über nahezu ein halbes Jahr doppelblind mit EGB761 240 mg pro Tag oder Placebo behandelt wurden. Die Progressionsverzögerung und die Reduktion der Alltagskompetenz wurden geschätzt. Die berechneten Gesamtkosten aus Arzneimitteln, Arzthonoraren und Leistungen der Pflegeversicherung für 7 Pflegegeldstufen wurden Guidelines der World Federation of Societies of Biological Psychiatry (WFSBP) zur biologischen Behandlung von Morbus Alzheimer und anderen Demenzerkrankungen mod. nach: World J Biol Psychiatry. 2011 Feb;12(1):2-32. Ergebnisse: Keine Heilung oder Progressionsstopp durch Antidementiva Mäßige Wirkungen bei der Verbesserung der Symptome im Vergleich zu Placebo Medikamentenauswahl (AChE-Hemmer, Memantin oder Ginkgobiloba) abhängig von Art der Demenz, Symptomkonstellation und Verträglichkeit der Therapie Keine Studien, welche die Überlegenheit von AChE-Hemmern über Memantin oder Ginkgo biloba (oder vice versa) belegen Hinweise, dass die Kombinationstherapie von Medikamenten mitunterschiedlichen Wirkmechanismen die Wirksamkeit verbessern könnte Abb. 2: Guidelines der WFSBP (World Federation of Societies of Biological Psychiatry) ARZT & PRAXIS 5 6 t h e m e n h e f t n e u r o lo g i e • p sy c h i at r i e mittels vierer Szenarien berechnet. Verglichen wurde hierbei mit Cholinesterasehemmern, deren Daten aus Cochrane-Metaanalysen vorlagen. Insgesamt konnte eine Nettoeinsparung bei der Behandlung mit EGB761 von Euro 3.692,– bis 29.577,– je nach Szenarium berechnet werden. Der deutliche Effekt kam hauptsächlich durch einen späteren Eintritt in höhere Pflegegeldstufen zustande, während der zusätzliche Therapieerfolg mit EGB761 nur Euro 530,88 kostete. Die Metaanalyse von IQWIG dokumentierte die klinische Evidenz in den Bereichen Hirnleistungsfähigkeit, generelle psychopathologische Symptomatik und Lebensqualität der Angehörigen. Ausblick für Nootropika Parallel zur Entwicklung immer neuer pharmakologischer Möglichkeiten für die Behandlung der Alzheimer-Demenz wurden besonders wichtige Möglichkeiten der Frühdiagnostik und Krankheitsprädiktion entwi- ckelt. Schwerpunkt liegt hierbei auf Neuroimaging-Methoden wie z.B. der Vermessung einer hippokampalen Atrophie im Temporallappen mithilfe des Scheltens-Scores, Bestimmung genetischer Risikoprofile und anderer biologischer Marker, wie z.B. einer Liquordiagnostik, und die Mitbestimmung von Beta-Amyloid und Tau-Protein. Zukünftige Risikopersonen könnten damit auch von einer nootropen Therapie profitieren. Die derzeit in den klinischen Studien verwendeten klinischen und psychometrischen Marker reichen nicht aus, um den strengen Nachweis eines ursächlichen Behandlungseffektes zu verifizieren. Biologische Marker, die als Indikatoren der Wirksamkeit pharmakologischer Behandlungen dienen, sollten künftig parallel dazu eingesetzt werden. Ein Indikationsgebiet der Nootropika wäre die sekundäre Prävention bei Patienten mit nur geringen Symptomen, welche einer leichten kognitiven Beeinträchtigung entsprechen, oder Patienten, die noch keine Symptome auf- weisen, aber bereits pathophysiologische Gehirnveränderungen zeigen. Interessant wird künftig auch der Einsatz von Nahrungsergänzungsmitteln wie z.B. Acutil®, das aus Omega-3-Fettsäuren, Ginkgo biloba, Phosphatidylserin, Vitamin E, Folsäure bzw. Vit. B12 besteht, und Souvenaid® sein. Zu Souvenaid®, das aus Phosphatid-Präkursoren und Ko-Faktoren besteht, liegt eine randomisierte doppelblinde Studie bei 225 Alzheimerpatienten vor. Die Gedächtnisleistung konnte dadurch signifikant verbessert werden. Ob die externe Validität auch der internen entspricht, wird die Zukunft zeigen. ♦ Literatur: - Gleiter CH., Volz HP., Antidementiva, Medizinisch pharmakologisches Kompendium. Band 19, 2008. - Rainer M., Mucke H., Schlaefke S., Ginkgo biloba ex­ tract EGb761 in the treatment of dementia: a pharmacoeconomic analysis of the Austria setting. Wiener Klinische Wochenschrift. Publ.online 5.1.2013 Wearing OFF bei Mb. Parkinson Prim. Dr. Dieter Volc Vorstand der Neurologischen Abt. und Parkinsonzentrum CONFRATERNITÄT-Privatklinik Josefstadt Skodagasse 32, 1080 Wien E-Mail: [email protected] Die DOPA-Behandlung des Mb. Parkinson ist seit ihrer Einführung 1961 durch Birkmayer & Hornykiewicz in Wien der Goldstandard der Therapie geblieben. Auch konnte eine erfolgreiche Verlängerung der Wirksamkeit von Levodopa in der oralen Form bis heute nicht wirklich erreicht werden, und die kurze Halbwertszeit dieser Transmittervorstufe bleibt ihr größtes Problem. Die Behandlung ist anfangs einfach und das Ansprechen auf Medikamente sehr gut. Auch die Frequenz der Einnahme von Medikamenten ist nicht strikt einzuhalten wie in späteren Stadien, daher werden im Anfangsstadium auch die größten Fehler gemacht, weil sich keine unmittelbaren Folgen zeigen. Die ARZT & PRAXIS Die Therapie des Mb. Parkinson ist anfangs einfach und das Ansprechen auf Medikamente sehr gut. Im Krankheitsverlauf sinkt aber die Speicher­ fähigkeit der dopaminergen Neuronen und die Wirkung lässt vor der nächsten Einnahme nach. Die Behandlung ist nicht einfach, weshalb auf die Prophylaxe dieser Zustände großer Wert gelegt wird. Und dabei kann die Ersttherapie nach Diagnosestellung ein wichtiger Grundstein sein. größte Schwierigkeit ist die zu niedrige Einnahmefrequenz – mindestens vier Gaben wären richtig, bei einer Wirkzeit von maximal 4–5 Stunden sind die meist durchgeführten dreimaligen Gaben einfach zu selten. Weiters scheint eine Vorbehandlung mit Dopaminagonisten die Gefahr des späteren Auftretens von Wearing OFF und dem damit einhergehenden Phänomen der Dyskinesien (unwillkürlichen Überbewegungen) zu verringern. Es ist also schon am Beginn der Behandlung das Gespräch mit den Betroffenen bzw. deren begleitenden und betreuenden Angehörigen zu suchen, und sie sind in den Behandlungsplan mit einzubeziehen. Bei einer schlechten Compliance ist die Medikamenteneinnahme nicht gesichert, die Compliance bessert sich aber mit dem Wissensstand um das Warum und Weshalb. Was ist Wearing OFF? Wearing OFF (= sich abnutzen) beschreibt eine Phase zwischen dem Ende der Wirksamkeit einer Dosis und dem Beginn der Wirkung der nächsten Dosis. Das kann sich hinziehen, denn die neuerliche Dosis braucht meist 45–60 Minuten bis zur vollen Wirkung. Es kommt also nicht rasch zu einer Auflösung nach neuerlicher Einnahme. Schematische Darstellungen zur normalen DOPA-Wirkung, Wearing OFF, No Jahrgang 67 / 994a / 2013 t h e m e n h e f t n e u r o lo g i e • p sy c h i at r i e ON bzw. Delayed ON, Dyskinesien sowie ONOFF-Fluktuationen finden sich in den Abbildungen 1a–1e. In frühen Krankheitsstadien sind genügend präsynaptische Speicher vorhanden, die Dopa­min enthalten und im Bedarfsfall freigesetzt werden können. Diese Speicherfähigkeit lässt im Laufe der Erkrankung nach, und es steht Dopamin dann nur noch in dem Maße zur Verfügung, wie es von außen zugeführt wird. Symptome, die durch Levodopa gut coupiert waren, treten vor der nächsten Einnahme zutage. Einerseits sind es die motorischen Beschwerden wie Verlangsamung, Steifigkeit und Zittern, andererseits macht sich Wearing-OFF aber häufig durch nicht-motorische Symptome bemerkbar – insbesondere Ängstlichkeit und depressive Verstimmung (die in deutlichem zeitlichen Zusammenhang mit der DOPA-Gabe schwankt) sowie verlangsamtes Denken, hinzu kommen Schmerzen, Muskelkrämpfe und Müdigkeit. Diagnostisch kann ein Fragebogen hilfreich sein (Wearing-OFF-Fragebogen siehe Tab. 1), jedenfalls sollte bei jedem Kontrollbesuch nach diesen Beschwerden gefragt werden, da sie die Betroffenen meist nicht mit dem Mb. Parkinson in Zusammenhang bringen und oft ohne Befragung nicht darüber sprechen. Die nicht-motorischen Beschwerden tangieren die Betroffenen häufig mehr als die von ärztlicher Seite als wesentlich auffallender gesehenen motorischen Symptome, da sie die Befindlichkeit stärker beeinträchtigen. Das zeitgerechte Erkennen ist für den weiteren Verlauf von entscheidender Bedeutung. Es gibt auch kein vorhersagbares Intervall. Mit dem Nachlassen der Wirkung ist nach etwa fünf Jahren Behandlung zu rechnen, aber im Einzelfall kann auch schon nach einem Jahr der Therapie ein Nachlassen der Wirkung festgestellt werden. Es gibt aber auch Verläufe, bei denen erst nach mehr als zehn Jahren eine solche Beeinträchtigung auftritt. Therapeutische Ansätze Grundvoraussetzung ist eine Optimierung der laufenden Medikation. Schematische An- sätze gibt es kaum, denn die Therapie des Mb. Parkinson ist grundsätzlich eine auf die betroffene Person zugeschnittene und angepasste Behandlungskombination. Bei der Optimierung des Dopaminersatzes bei Mb. Parkinson stellt sich als Schlüsselfrage, wie eine physiologische, kontinuierliche, dopaminerge Stimulation herbeigeführt werden kann. Es bieten sich mehrere Möglichkeiten zur Linderung der motorischen Fluktuationen an: • Früher Einsatz oder die Beigabe von Dopaminagonisten in Retard-Formulierung • Dosisfraktionierung von L-Dopa (= häufigere Gaben von niedrigeren Dosen) • Einsatz von L-Dopa in Retard-Formulierung • Beigabe eines COMT-Hemmers • Beigabe eines MAO-B-Hemmers • Einsatz invasiver Methoden Wichtige einfache Maßnahmen sind: • Beschleunigung der Magenpassage durch Einnahme von Levodopa auf nüchternen Magen mit einem großen Glas Wasser, um die Transitzeit zu verkürzen; Schematische Darstellung von Wearing Off und Fluktuationen „Wearing off“ Die Wirkung setzt nach 60 Minuten ein und hält gut bis zu 5 Stunden an Abb. 1a Die Wirkung setzt gar nicht ein Abb. 1d Jahrgang 67 / 994a / 2013 Die Wirkung setzt nach 60 Minuten ein, hält aber nur knapp 3 Stunden an Abb. 1b Die Wirkung setzt nach 60 Minuten mit Überbewegung ein, hält auch nur wenige Stunden an Abb. 1e Die Wirkung setzt nach 120 Minuten ein und hält weniger als 2 Stunden an Abb. 1c Die Wirkung setzt nach 60 Minuten ein, hält nur kurz an, kann einoder mehrmals auftreten und klingt dann ab Abb. 1f ARZT & PRAXIS 7 8 t h e m e n h e f t n e u r o lo g i e • p sy c h i at r i e • keine gleichzeitige Einnahme von Eiweiß, weil es die Resorption von Levodopa im Dünndarm stört; • Beschleunigung der Darmmotilität und Bekämpfung einer Obstipation. Mit dem Einsatz der neueren Dopaminagonisten in Retard-Formulierungen kommen wir heute dem Prinzip der kontinuierlichen dopaminergen Stimulation bereits deutlich näher. tion mit Levodopa/Carbidopa oder als Einzelsubstanz für die freie Kombination mit allen DOPA-Präparaten verfügbar – ist im Blutkreislauf aktiv. Es hemmt den Abbau von DOPA zu Dopamin im Blut, so kommt es zu einer höheren Verfügbarkeit von DOPA über einen längeren Zeitraum. Rasagilin ist ein starker, irreversibler selektiver MAO-B-Hemmer (MAO = Monoaminooxidase). Es ist zur Behandlung der idiopathischen Parkinson-Krankheit als •Tremor (z.B. zitternde Hände, Arme, Beine) •Verlangsamung der Bewegungen (z.B. beim Gehen oder beim Essen) •Stimmungsschwankungen •Allgemeines Steifigkeitsgefühl (z.B. steife Arme, Beine) •Schmerzen/Gliederschmerzen •Verminderte Geschicklichkeit (z.B. Schwierigkeiten beim Schreiben oder beim Auf- bzw. Zumachen von Knöpfen) •Depressive Episoden/verlangsamtes Denken •Angstgefühle/Panikattacken •Muskelkrämpfe (z.B. Arme, Beine, Füße) Tab. 1: Wearing-OFF-Fragebogen: Und hier gilt wiederum, dass der frühzeitige Einsatz von Retard-Präparaten wahrscheinlich das Auftreten von Wearing OFF und Fluktuationen verzögern kann, ihre Stellung als Ersttherapie ist damit gerechtfertigt. Im Gegensatz zu den pulsatil eingesetzten „Immediate release“-Präparaten ist 24 Stunden nach der Einnahme der Wirkspiegel nicht auf null, sondern – wenngleich niedriger – so doch noch vorhanden. Manchmal bei höheren Dosierungen ist auch eine Aufteilung zwischen morgens und abends eine gute Option. Levodopa soll am Beginn in niedrigen Einzeldosen, aber ausreichender Frequenz – also mindestens vier Gaben in 24 Stunden – eingesetzt werden. Durch die kurze Halbwertszeit wird bei seltenerer Gabe die pulsatile Stimulation der Rezeptoren gefördert. Eine höhere Einzeldosis bewirkt keine längere Wirkdauer, nur einen kurzfristig höheren Plasmaspiegel nach der Einnahme. Individuelle und schrittweise Steigerung der Dosen ist empfehlenswert. Die Wirkung ist am besten, wenn die Medikation immer auf nüchternen Magen eingenommen wird (mit einem großen Glas Wasser) – so erreicht die Dosis rasch den Resorptionsort im Jejunum und wird nicht durch den postprandialen Pylorusverschluss an der Passage gehindert. Entacapon (COMT-I = Catecholamin-O-Methyltransferase-Inhibitor) – in fixer Kombina- ARZT & PRAXIS Monotherapie (ohne Levodopa) oder als Zusatztherapie (mit Levodopa) bei Patienten mit End-of-dose-Fluktuationen und Dyskinesien zugelassen, aber auch im frühesten Stadium der Erkrankung indiziert. Fluktuationen werden durch Rasagilin verkürzt. Es kann von Beginn an in einer festen einmal täglichen Dosis von 1 mg gegeben werden. Ein Cheese-Effekt wurde bisher nicht beobachtet. Unerwünschte Amphetamin-Metaboliten treten nicht auf, sodass keine negativen Auswirkungen auf den Nachtschlaf zu erwarten sind. Mit dem Auftreten einer verlängerten Wirkeintrittszeit (Delayed ON) oder fehlenden Wirkung (No ON) und mit dem Wirkungsverlust nach kurzer Zeit stellt sich irgendwann im Verlauf auch die Frage, ob eine weitere Verkürzung der Intervalle noch sinnvoll ist. Dies ist bei einem Nachlassen nach weniger als drei Stunden zu überlegen. Allerdings stehen dann mit den invasiven Methoden gute Strategien zur Verfügung: DOPA-Pumpe: Dopa kann kontinuierlich als gastrointestinales Gel mithilfe einer außen getragenen Pumpe über eine Sonde dem Darm zugeführt werden – die übliche PEG-Sonde ist mit einem zusätzlichen Schlauch versehen (PEJ-Sonde), der in den Dünndarm gelegt wird. Auf diese Weise wird unabhängig von Magenentleerungen ein gleichmäßiger DopaZufluss erreicht. Das Gel gelangt über die Sonde direkt in den Dünndarm, wo Levodopa sehr schnell von einem Hochleistungs-Transportsystem für Aminosäuren aufgenommen wird. Der Vorteil ist eine sehr stabile Blut- und damit Gehirnkonzentration. Dadurch verschwinden die bei anderen Parkinson-Medikamenten häufig beobachteten Wirkungsfluktuationen, und die Patienten haben einen erheblich größeren Teil des Tages eine gute Beweglichkeit ohne Überbewegungen. APOMORPHIN-Pumpe: Der Dopamin­ agonist Apomorphin hat eine sehr kurze Halbwertszeit und läuft daher als Akuttherapie dem Therapieprinzip der kontinuierlichen dopaminergen Stimulation zuwider, aber der Einsatz der Apomorphin-Pumpe gilt als gute Möglichkeit, hier therapeutisch einzugreifen. Über den (wachen) Tag wird Apomorphin subkutan infundiert, wodurch auch eine gleichmäßige Stimulation der Rezeptoren erzielbar ist. DBS (deep brain stimulation) / Tiefe Hirnstimulation: Die Tiefe Hirnstimulation gibt es bereits über 20 Jahre – sie ist mittlerweile eine gut etablierte Methode. An den fortschrittlichsten Zentren erfolgt sie bereits in Vollnarkose, was auch den Komfort der Behandlung steigert. Die Implantationstechnik wurde in den letzten Jahren stetig verfeinert. Die Bildfusion zwischen Kernspin- und Computertomographie liefert Bilder von einer hervorragenden Güte, Schärfe und Genauigkeit. Die Mikroelektrodenableitung (Hirnstrommessung in den Zielregionen des Gehirnes während der Operation) zusammen mit den aus den gespeicherten Daten vieler Patienten gewonnenen Zielpunkt-„Landkarten“ führten zur Möglichkeit, auf die aktive Mithilfe des Patienten während der Operation und damit auf seine Wachheit zu verzichten – einer Narkose für die gesamte Dauer der Operation steht damit nichts mehr im Wege. Bislang wurde die Methode angewandt, wenn die medikamentöse Behandlung nicht mehr ausreichend möglich war oder Nebenwirkungen auftraten. Nun liegt das Ergebnis der EARLYSTIM-Studie vor, die sehr deutlich zeigen konnte, dass die möglichst frühzeitige Anwendung der DBS bei Jüngeren eine entscheidende Verbesserung der Lebensqualität bringt. Gerade Wearing OFF ist auch eine Symptomatik, die mit DBS gut behandelbar ist – diese sollte daher nach den nun vorliegenden Ergebnissen deutlich früher zum Einsatz kommen. ♦ Jahrgang 67 / 994a / 2013 Fachkurzinformationen siehe Seite 19 10 t h e m e n h e f t n e u r o lo g i e • p sy c h i at r i e Persönlichkeitsstörungen ao. Univ.-Prof.in Karin Gutiérrez-Lobos FÄin für Psychiatrie und Psychotherapie Medizinische Universität Wien [email protected] Die Frage nach dem Konzept von Persönlichkeit und deren Abweichungen hat die Menschheit seit jeher beschäftigt. Was heute Persönlichkeitsstörung genannt wird, hieß früher Psychopathie, Charakterneurose oder Soziopathie und war durch stigmatisierende Elemente charakterisiert. Auch das moderne Konzept der Persönlichkeitsstörungen wird kritisch diskutiert, handelt es sich doch um eine dia­gnostisch heterogene Gruppe mit nur geringem allgemeinen Konsens über die Abgrenzung zur gesunden Persönlichkeit sowie ihren Ursachen und Entstehungsmechanismen. Wann von einer Störung der Persönlichkeit gesprochen wird, ist zumeist vom sozialen und kulturellen Kontext abhängig. Erst durch die Einschätzung anderer wird ein bestimmtes Verhalten als sonderbar, auffällig oder von der Norm abweichend definiert. Gerade diese Ausrichtung an der „Norm“ macht das Konzept der Persönlichkeitsstörungen nach wie vor anfällig für Unschärfen, pejorative Anwendung und Stigmatisierung. Für das neue DSM-V ist eine Reduktion der Persönlichkeitsstörungstypen von 11 auf 5 sowie eine genauere Differenzierung vorgesehen. Begriffsdefinition „Persönlichkeit“ Mit Persönlichkeit wird die Gesamtheit der psychischen Eigenschaften und Verhaltensweisen, die dem einzelnen Menschen eine eigene unverwechselbare Individualität verleihen, beschrieben. Jeder Mensch verfügt über eine ihm eigene individuelle Art zu denken, zu fühlen, mit anderen in Beziehung zu treten und auf soziale Anforderungen zu reagieren. Mit zunehmender Entwicklung stabilisieren sich bestimmte Eigenschaften und Merkmale einer Person. Gleichzeitig kann die Persön- ARZT & PRAXIS Persönlichkeitsstörungen sind überdauernde Verhaltens- und Beziehungsstörungen, die sich in abweichenden und unflexiblen Mustern der Wahrnehmung, des Denkens und des Fühlens sowie in Beziehungen zu anderen äußern. Aufgrund des fließenden Übergangs zur gesunden Persönlichkeit ist eine detaillierte Diagnose notwendig. lichkeit ständig weiterentwickelt und an besondere Umstände angepasst werden. Unter „Temperament“ werden der vitale Antrieb und die Intensität, der Rhythmus und die Schwelle der affektiven Reaktionen verstanden, die biologisch determiniert sind. Unter „Charakter“ versteht man langfristige Einstellungen, Werte und Normen, die im Laufe der Entwicklung erworben werden (Stone 1999). Persönlichkeitsstörungen – Definition und Diagnostik Der Übergang von Persönlichkeit zu Persönlichkeitsstörungen ist fließend. Eine Störung wird in Betracht gezogen, wenn verschiedene Verhaltensweisen oder ihre Ausprägung von einer – gedachten – Norm abweichen und zu subjektivem Leid sowie Beeinträchtigungen der sozialen Funktionen führen. In einigen Fällen kann es auch zu antisozialem Verhalten kommen. Im ICD-10 werden unter F 60 Persönlichkeitsstörungen wie folgt definiert: „Diese Störungen umfassen tief verwurzelte, anhaltende Verhaltensmuster, die sich in starren Reaktionen auf unterschiedliche persönliche und soziale Lebenslagen zeigen. Dabei findet man bei Personen mit Persönlichkeitsstörungen gegenüber der Mehrheit der betreffenden Bevölkerung deutliche Abweichungen im Wahrnehmen, Denken, Fühlen und in Beziehungen zu anderen. Leidensdruck und Nachteile in der Lebensführung resultieren aus diesen Verhaltensweisen, die in Widerspruch zu den soziokulturellen Erwartungen stehen.“ Im klinischen Alltag können großer, immer wiederkehrender psychosozialer Stress (häufiger Berufs- und Partnerwechsel, konfliktreiche Beziehungen), konflikthafter Umgang mit Entwicklungsaufgaben, Unsicherheiten bezüglich des Selbstkonzeptes, häufige Krisen, wiederholte Selbstbeschädigungen, multiples Suchtverhalten oder etwa nicht adäquates Ansprechen auf Therapie bei Angst und Depression erste Hinweise auf das Vorliegen einer Persönlichkeitsstörung darstellen. Zur Diagnostik von Persönlichkeitsstörungen stehen neben der klinischen Exploration (die nicht reliabel und sehr ungenau ist) Fragebögen (die ihren besonderen Wert für Screening, nicht jedoch für Diagnostik haben) und strukturierte klinische Interviews (z.B. IPDE, SKID-II) zur Verfügung. Letztgenannte weisen die größte Reliabilität auf, sind aber sehr zeitaufwendig. Eine organische Krankheit bzw. eine Erkrankung des Gehirns und andere psychische Störungen müssen ausgeschlossen werden. Vor dem 18. Lebensjahr sollte eine Persönlichkeitsstörung nur sehr zurückhaltend diagnostiziert werden. Studien zur Prävalenz der Persönlichkeitsstörungen in der Allgemeinbevölkerung ergeben einen Anteil von 4,4 (Coid et al. 2006) – 14,6 % (Zimmermann & Coryell 1989). Bezüglich der Geschlechtsverteilung kann man innerhalb der Gesamtgruppe der Persönlichkeitsstörungen von einem ausgeglichenen Verhältnis sprechen. Bei einzelnen Subtypen finden sich hingegen bedeutsame Geschlechtsunterschiede. So sind bis zu 80 % der Personen mit antisozialer Persönlichkeitsstörung Männer, während bei der Borderline-Persönlichkeitsstörung bis zu 80 % weiblich sind (Samuels et al. 2002, Paris 2003). Das DSM-IV — das Klassifikationssystem der American Psychiatric Association — ordnet die spezifischen Persönlichkeitsstörungen nach gemeinsamen Charakteristika drei übergeordneten Clustern zu, nach denen im Fol- Jahrgang 67 / 994a / 2013 Fachkurzinformationen siehe Seite 19 12 t h e m e n h e f t n e u r o lo g i e • p sy c h i at r i e genden die Persönlichkeitsstörungen dargestellt werden. Cluster A – „sonderbar, exzentrisch“: Vorherrschende Charakteristika: exzentrisches Verhalten, Misstrauen, Affektarmut, Gefühlskälte sowie eingeschränkte zwischenmenschliche Kontakte . Die paranoide Persönlichkeitsstörung (ICD-10 F 60.0) ist gekennzeichnet durch Misstrauen, anderen Menschen kann nicht vertraut werden. Die Betroffenen verhalten sich anklagend und kritisierend. Weiters besteht eine erhöhte Empfindlichkeit gegenüber Rückschlägen, nachhaltiger Groll und Streitbarkeit. Im Gegensatz zur wahnhaften Störung sind die Inhalte einfühlbarer und korrigierbar. Bei der schizoiden Persönlichkeitsstörung (ICD-10 F 60.1) stehen emotionale Kälte, In­ trovertiertheit, Interesselosigkeit an Tätigkeiten und Beziehungen sowie soziale Isolation im Vordergrund. Die Betroffenen sind ungesellig und fühlen sich alleine am wohlsten. Von anderen werden sie oft als unabhängig und gleichgültig wahrgenommen. Im Gegensatz zur selbstunsicheren PS, bei der der soziale Rückzug aus Angst vor Zurückweisung und Kritik erfolgt, spielt hier die Interesselosigkeit die Hauptrolle. Bei der schizotypen Persönlichkeitsstörung (ICD-10 F 21 - gehört zu den schizophrenen Spektrumerkrankungen und nicht zu den Persönlichkeitsstörungen) fallen das gekünstelte und umständliche Denken, Argwohn, seltsame Überzeugungen und ungewöhnliche Wahrnehmungen auf. Differentialdia­gnostisch ist sie vor allem von der Schizophrenie abzugrenzen. Der Unterschied besteht hauptsächlich in fehlenden Halluzinationen und Wahnideen. Psychotische Ereignisse treten höchstens passager auf, die Störung beginnt in Kindheit oder Jugend und nicht wie die Schizophrenie im jungen Erwachsenenalter, meistens durch Auftreten eines charakteristischen „Leistungsknickes“. Cluster B – „dramatisch, emotional, launisch“: Vorherrschende Charakteristika: Impulsivität, starke Wut, Idealisierung und Entwertung, geringes Selbstwertgefühl und selbst- bzw. fremdschädigendes Verhalten. Das Beschwerdebild der histrionischen Persönlichkeitsstörung (ICD-10 F60.4) ist gekennzeichnet durch dramatische Selbstdarstellung (Koketterie, Stimmungskanone, Geschichten erfinden, Schmeichelei, unkontrolliertes Weinen aus banalem Anlass), um die Aufmerksamkeit auf sich zu ziehen, über- ARZT & PRAXIS triebenen Ausdruck von Gefühlen, Suggestibilität, oberflächliche und labile Affekte, Suche nach aufregenden Erlebnissen und nach Aufmerksamkeit, verführerische Erscheinung und Verhalten sowie übermäßige Beschäftigung mit Attraktivität und Aussehen. Das zugrunde liegende Gefühl ist „nicht wichtig, nichts wert zu sein“. Die betroffenen Personen sind überzeugt, ständig handeln zu müssen, um andere dazu zu bringen, ihre Wichtigkeit zu bestätigen und uneingeschränkte Aufmerksamkeit zu erhalten. Die ständige Beschäftigung damit lässt das Verhalten überzogen und theatralisch erscheinen, diese Personen sind expansiv und lassen anderen nur wenig Handlungsspielraum. Die narzisstische Persönlichkeitsstörung (ICD-10 F60.8) ist charakterisiert durch Größengefühl in Bezug auf die eigene Bedeutung (z.B. übertreiben die Betroffenen ihre Leistungen und Talente bzw. erwarten, ohne entsprechende Leistungen als bedeutend angesehen zu werden), Beschäftigung mit Fantasien über unbegrenzten Erfolg, Macht, Scharfsinn, Schönheit oder ideale Liebe, Überzeugung, „besonders“ und einmalig zu sein und nur von anderen besonderen Menschen oder solchen mit hohem Status (oder von entsprechenden Institutionen) verstanden zu werden oder mit diesen zusammen sein zu können. Es besteht ständiges Bedürfnis nach übermäßiger Bewunderung und nach besonders günstiger Behandlung. Andere werden ausgenutzt, um eigene Ziele zu erreichen. Generell besteht ein Mangel an Empathie, häufiger Neid auf andere oder Überzeugung, andere seien neidisch auf die Betroffenen. Die Betroffenen fallen häufig durch arrogante, hochmütige Verhaltensweisen auf. Bei einer narzisstischen Persönlichkeitsstörung spezialisieren sich die Betroffenen gleichsam auf sich selbst. Gleichzeitig sind die Empfindung von Traurigkeit und Sehnsucht nahezu unmöglich, Gefühle sind flach und oberflächlich. Wut und Neid spielen eine große Rolle. Andere Menschen werden entweder nur als „gut“ oder „böse“ erlebt. Eine momentane Bewunderung anderer kann schnell in Entwertung umschlagen. Zentrales Anliegen dieser Personen ist die Suche nach Liebe bei gleichzeitiger Angst vor Nähe und Abhängigkeit, da beides zur Vernichtung der eigenen Person führen würde. Um dieser befürchteten Vernichtung zu entgehen, sind manipulative, rücksichtlose und ausbeuterische Verhaltensweisen legitim. Gesunde Menschen mit narzisstischen Zügen weisen eine leichte Selbstüberschätzung auf, die sie befähigt, schwierige Aufgaben in Angriff zu nehmen und Entscheidungen zu treffen. Sie haben ein stabiles Selbstwertgefühl, sind empathiefähig und können Herausforderungen optimal bewältigen (Morf & Rhodewald 2001). Auch Kernberg (1996, 2000) betont, dass ausreichend starke narzisstische Eigenschaften wichtig für erfolgreiches Leadership sind. Vamik Volkan (2006) — einer jener Autoren, der sich neben Kernberg (2000), Wirth (2002) u.a. mit der Bedeutung narzisstischer Personen in der Politik beschäftigt hat — meint, dass neben realpolitischen Anforderungen auch die Persönlichkeiten von Politikern einen großen Einfluss auf die Gestaltung eines Staates haben. In Krisenzeiten sei die Chance eines narzisstischen Politikers auf Erfolg besonders groß, da die ihm eigene Grandiosität und Selbstüberschätzung das Volk vor Angst und Unsicherheit schütze. Differentialdiagnostisch ist die Unterscheidung zu einer manischen Phase, die ebenso mit Größenideen einhergehen kann, vorzunehmen. Die Borderline-Persönlichkeitsstörung (ICD-10 F60.31) wird im ICD-10 unter der emotional instabilen Persönlichkeitsstörung subsumiert. Bei ihr stehen impulsives Handeln, Streitsucht bei Kritik, Neigung zu Wut oder Gewalttätigkeit, unbeständige und unberechenbare Stimmung, Unsicherheit über das Selbstbild, intensive, aber instabile Beziehungen sowie wiederholte Drohungen oder Handlungen mit Selbstbeschädigung und anhaltende Gefühle von Leere im Vordergrund. Personen mit einer Borderline-PS weisen eine erhöhte Affektinstabilität auf – das bedeutet niedrige Reizschwelle, hohe Affektintensität bzw. verlängerte Dauer bis zum Abklingen der Gefühle. Es werden oft quälend lange Spannungszustände erlebt, die durch selbstverletzendes Verhalten wie Zufügen von Schnitt-, Beißoder Kratzwunden zu einer raschen Entlastung führen können. Auch dissoziative Symptome wie z.B. Gefühle der Fremdheit und der mangelnden Kontrolle über die Wirklichkeit stehen mit den als unerträglich empfundenen Spannungszuständen in Zusammenhang. Die Betroffenen sehnen sich nach vertrauensvollen Beziehungen, die dann aber nicht ertragen werden können. So gehen sie häufig intensive aber meist nur kurz dauernde Beziehungen ein, die geprägt sind von einem raschen Wechsel zwischen Nähe und Distanz bzw. Idealisierung und Entwertung. Die Borderline-PS ist mit einem Auftre- Jahrgang 67 / 994a / 2013 t h e m e n h e f t n e u r o lo g i e • p sy c h i at r i e ten von 0,7 (Coid et al. 2006) – 5,9 % (Swartz et al. 1990) in der Allgemeinbevölkerung eine der am häufigsten diagnostizierten PS (Lieb et al. 2004), wobei Frauen deutlich häufiger betroffen sind. Wie keine andere Persönlichkeitsstörung ist sie an traumatische Erfahrungen in der Kindheit oder Jugend gekoppelt. Die überwiegende Mehrheit der Betroffenen erlebte sexuellen Missbrauch und Vernachlässigung in der Kindheit (Zanarini et al. 1997). Außerdem scheint ein Zusammenhang der Schwere des erlebten kindlichen Missbrauches mit der Ausprägung der Borderline-Symptomatik zu bestehen (Zanarini et al. 2002). Neben diesen Traumatisierungserfahrungen werden biologische Faktoren wie eine Störung im frontolimbischen System diskutiert (z.B. Herpertz et al. 2001). Kurze psychotische Episoden bei BorderlinePS sind im Gegensatz zu wahnhaften Störungen meist an Auslöser gekoppelt. Wie bei der posttraumatischen Belastungsstörung (PTBS) spielen auch bei der Borderline-PS traumatische Ereignisse eine wesentliche Rolle. Bei der PTBS stehen die Symptome jedoch in zeitlichem Zusammenhang mit dem Auslöser, während es sich bei der Borderline-PS um überdauernde stabile Verhaltensweisen handelt. Die Stimmungsschwankungen sind im Gegensatz zu jenen bei histrionischen Patienten jedoch intensiver und länger andauernd. Die dissoziale Persönlichkeitsstörung (ICD 10 F 60.2) imponiert durch einen Mangel an Empathie, deutliche und andauernde Verantwortungslosigkeit, Missachtung sozialer Normen, das Unvermögen zur Aufrechterhaltung längerfristiger Beziehungen, sehr geringe Frustrationstoleranz sowie eine niedrige Schwelle für aggressives, auch gewalttätiges Verhalten. Schuldbewusstsein wird nicht erlebt, vielmehr besteht die Neigung, andere zu beschuldigen. Differentialdiagnostisch ist an Alkohol- und Substanzabhängigkeit zu denken. Finden die genannten Verhaltensweisen damit in Zusammenhang statt, sollte die Diagnose dissoziale PS nicht gestellt werden. Auch Menschen mit Borderline-PS handeln impulsiv, bei ihnen sind jedoch Empathiefähigkeit und Schuldgefühle erhalten. Im Wesentlichen handelt es sich bei dem Begriff der Dissozialität um ein moralisches Konzept: Was antisozial ist, wird von der Gesellschaft bestimmt. Menschen, die man für „normal“ hält, können ebenso gut wie Menschen, die man für „pathologisch“ hält, asozial handeln. Alle Menschen verfügen über ein beträchtliches Reservoir an unbewussten antisozialen Fantasien. Wie diese antisozialen Bestrebungen jedoch abgewehrt (d.h. verdrängt oder umgesetzt bzw. ausagiert) werden, variiert beträchtlich. Sogenannte „Kavaliersdelikte“, wie z.B. Übertretung der Höchstgeschwindigkeit oder Schwarzfahren, werden nahezu von allen Menschen gelegentlich begangen, ohne dass deswegen eine „dissoziale Persönlichkeitsstörung“ bestünde. Auch wiederholte schwere strafbare Handlungen alleine reichen für die Diagnose einer „dissozialen Persönlichkeitsstörung“ nicht aus (GutiérrezLobos & Schmidl-Mohl 2000). Die Sichtweise, dass diese Störung alle Delinquenten betrifft, wurde aufgegeben und auf jene Personen eingeschränkt, die nicht nur wiederholt, sondern auch ziellos antisoziale Taten begehen, generell andere missachten und schwere Beziehungsstörungen aufweisen. Antisoziales Verhalten kann durch äußere Wirkfaktoren moduliert werden. So hat z.B. Dicks (1972) in seiner Untersuchung an SS-Mördern ein Vorherrschen der antisozialen Persönlichkeitsstörung gefunden. Die offenen sadistischen und kriminellen Handlungen wurden jedoch erst unter einem politischen System manifest, das für dieses antisoziale Verhalten die gesellschaftlichen Rahmenbedingungen geschaffen hatte. Cluster C – „ängstlich, furchtsam“: Vorherrschende Charakteristika: Hilflosigkeit und Abhängigkeit, leichte Verletzbarkeit und ständige Anspannung. Zur Diagnose der ängstlich-vermeidenden Persönlichkeitsstörung (ICD-10 F 60.6) müssen andauernde Gefühle von Anspannung, sozialer Unbeholfenheit und Minderwertigkeit bestehen. Übertriebene Sorge wegen Kritik oder Ablehnung wird geäußert, die Anlass für sozialen Rückzug sein kann. Betroffene fühlen sich gehemmt, schüchtern, stehen nicht gerne im Mittelpunkt, prüfen ihre Beziehungen lange und meiden häufig aus Sorge vor Ablehnung Sozialkontakte. Im Gegensatz zur schizoiden PS meiden sie Kontakte nicht wegen Gleichgültigkeit, sondern aus Angst vor Zurückweisung. In der Symptomatik ähnelt die ängstlich-vermeidende PS der Sozialphobie, bei der die entsprechenden Ängste meist aber auf bestimmte Situationen beschränkt sind (z.B. Prüfungen). Typisch für die abhängige Persönlichkeitsstörung (ICD-10 F 60.7) ist die Unterordnung eigener Bedürfnisse unter die anderer Personen, von denen Abhängigkeit besteht. Wichtige Entscheidungen werden an ande- re delegiert, von diesen werden auch ständig Ratschläge und Bestätigung benötigt. Das Selbstbild der abhängigen PS ist geprägt vom Gefühl der Schwäche, Inkompetenz und Hilflosigkeit. Andere Menschen werden zum Überleben benötigt, da es bei Einsamkeit zu unerträglichen Gefühlen der Hilflosigkeit kommt. Aus Furcht vor dem Verlassenwerden sind die Betroffenen bereit, sich bis zur Unterwürfigkeit unterzuordnen. Die anankastische (zwanghafte) Persönlichkeitsstörung (ICD-10 F 60.5) ist geprägt durch starken Zweifel und übermäßige Vorsicht, Beschäftigung mit Details, Perfektionismus, übermäßige Gewissenhaftigkeit bzw. unverhältnismäßige Leistungsbezogenheit unter Vernachlässigung von Vergnügen und zwischenmenschlichen Beziehungen. Die Betroffenen sind pedantisch, rigide und eigensinnig. Zwanghafte Persönlichkeiten sind bemüht, sich stets moralisch einwandfrei zu verhalten, Regeln und Vorgaben werden pedantisch eingehalten. Ordnung und Regeln sichern den angstfreien Umgang mit der Welt. Sie sind äußerst selbstkritisch, verlangen ähnlich übertrieben genaues Verhalten auch von anderen. Mangelnde Flexibilität sowie Genuss- und Erlebnisfähigkeit resultieren aus dem rigiden Verhalten. Behandlungsprinzipien der Persönlichkeitsstörungen Psychotherapie ist aktuell die Methode der Wahl zur Behandlung von Persönlichkeitsstörungen (Übersicht: Oldham et al. 2005, Kernberg 2006). Für einige Persönlichkeitsstörungen, wie z.B. antisoziale PS, Borderline-PS oder ängstlich-vermeidende PS, gibt es auf das jeweilige Störungsbild abgestimmte störungsspezifische Therapieverfahren. Diese scheinen anderen Therapieformen überlegen zu sein. Eine Behandlung mit Psychopharmaka orientiert sich an den Zielsymptomen und ist nicht zuletzt aufgrund der oft eingeschränkten Compliance und mangelnden Motivation schwierig (Laux 2008). SSRIs scheinen besonders gut zur Behandlung impulsiven Verhaltens der Cluster-B-Störungen geeignet zu sein. Atypische Antipsychotika wie Risperidon oder Quetiapin zeigen gute Effekte bei Aggressivität und Impulsivität – besonders bei Borderline- und antisozialer PS. Für die schizotype PS könnten sich aus neuesten Untersuchungen zur Wirkung von Omega-3-Fettsäuren neue therapeutische Möglichkeiten eröffnen (Amminger et al. 2010, Überblick z.B. Wedekind & Bandelow 2006). 13 14 t h e m e n h e f t n e u r o lo g i e • p sy c h i at r i e Literatur: Amminger GP et al. (2010), Long-chain omega-3-fatty acids for indicated prevention of psychotic disorders: a randomized placebo-controlled trial. Arch Gen Psychiatry 67(2):146-154 APA (1996), Diagnostic and statistical manual of mental disorders (DSM-IV) American Psychiatric Press, Washington DC [Dt. Bearbeitung: Saß H, Wittchen HU, Zaudig M (1996), Diagnostisches und statistisches Manual psychischer Störungen DSM-IV. Hogrefe, Göttingen] Cervone D, John OP und Pervin LA (2005), Persönlichkeitstheorien. von UTB, Stuttgart Coid J, Yang M, Tyrer P, Roberts A, Ulrich S (2006), Correlates and prevalence of personality disorders in Great Britain. Br J Psychiatry 188: 423-431 Dicks HV (1972), Licensed Mass Murder: A Socio-Psychological Study of Some SS Killers. London. Chatto-Heinemann/Sussex University Press. DSM IV, Deutsche Ausgabe Saß H, Wittchen HU, Zaudig M, Houben I, Diagnostische Kriterien – DSM-IV-TR, 2003, Hogrefe. ARZT & PRAXIS Gutierrez-Lobos K, Schmidl Mohl K (2000), Die antisoziale Persönlichkeitsstörung aus psychodynamischer Sicht. In: Katschnig H, Demel U, Lenz G: Die extrovertierten Persönlichkeitsstörungen Facultas Verlag Wien, 144-151 Herpertz SC, Dietrich TM, Wenning B, Erberich SG, Krings T, Thron A, Sass H (2001), Evidence of abnormal amygdale functioning in borderline personality disorder: a functional MRI study. Biol Psychiatry 50: 292-298 IPDE (1996) International Personality Disorder Examination; ICD-10 Modul / von A.W. Loranger. Dt.-sprachige Ausg. von Mombour W, Zaudig M, Berger P, Gutierrez K, Berner W, Berger K, v. Cranach M, Giglhuber O, v. Bose M (1996), Weltgesundheitsorganisation. Huber, Bern Kernberg OF (1983), Borderline-Störungen und pathologischer Narzissmus" Kernberg OF (1996), Die narzißtische Persönlichkeitsstörung und ihre differentialdiagnostische Abgrenzung zum antisozialen Verhalten. In: Kernberg OF (Hrsg.): Narzißtische Persönlichkeitsstörungen. Schattauer, Stuttgart-New York, 52-70 Kernberg OF (2000), Ideologie, Konflikt und Führung. Psychoanalyse von Gruppenprozessen und Persönlichkeitsstruktur" Kernberg OF (2006), Schwere Persönlichkeitsstörungen. Theorie, Diagnose und Behandlungsstrategie. Klett Cotta. Laux G (2008), Psychopharmaka bei Persönlichkeitsstörungen? Fortschr Neurol Psychiatr 76(3): 131 Lieb K, Zanarini MC, Schmahl C, Linehan MM, Bohus M (2004), Borderline personality disorder. Lancet. 2004 Jul 31-Aug 6;364(9432):453-61. Loranger AW, Janca A, Sartorius N (1997), Assessment and Diagnosis of Personality Disorders. The ICD-10 International Personality Disorder Examination (IPDE). Cambridge University Press, Cambridge U. K. Morf CC, Rhodewalt F (2001), Unravelling the paradoxes of narcissism: A dynamic self-regulatory processing model. Psychol Inq. 12: 177-196 Oldham J, Skodol A, Bender D (eds.) (2005), Textbook of Personality Disorders. American Psychiatric Publishing Inc., Arlington Paris J (2003), Personality Disorders Over Time. American Psychiatric Press. Washington DC. Samuels J, Eaton WW, Bienvenu J, et al. (2002), Prevalence and correlates of personality disorders in a community sample. Br J Psychiatry 180:536-542 Saß H, Wittchen HU, Zaudig M (1998), Diagnostisches und Statistisches Manual Psychischer Störungen DSM-IV. Hogrefe: Göttingen SKID-II (1998), Strukturiertes klinisches Interview für DSM-IV, Achse-II (Persönlichkeitsstörungen). Von Fydrich T, Renneberg B, Schmitz B und Wittchen HU. Eine deutschsprachige, erweiterte Bearbeitung der amerikanischen Originalversion des SCID-II von: First MB, Spitzer RL, Gibbon M, Williams JBW und Benjamin L (1998), Hofgrefe, Göttingen Stone MH (1999), Persönlichkeit und Persönlichkeitsstörung. Lindauer Texte, 70-92 Swartz M, Blazer D, George L, Winfield I (1990), Estimating the Prevalence of Borderline Personality Disorder in the Community. Journal of Personality Disorders: Vol. 4, No. 3, pp. 257-272 Volkan V (2006), Großgruppen und ihre politischen Führer. In: Narzissmus: Grundlagen - Störungsbilder – Therapie (Hrsg Kernberg OF, Hartmann HP) Schattauer Wirth HJ (2002), Narzissmus und Macht. Zur Psychoanalyse seelischer Störungen in der Politik. Psychosozial-Verlag, Gießen Wedekind D, Bandelow B (2006) Pharmakotherapie bei Persönlichkeitsstörungen. In: Remmel A, Kernberg OF, Vollmöller W, Strauß B (Hrsg.). Handbuch Körper und Persönlichkeit. Entwicklungspsychologie, Neurobiologie und Therapie von Persönlichkeitsstörungen Stuttgart: Schattauer: 305-317 Zanarini MC, Williams AA, Lewis RE, Reich RB, Vera SC, Marino MF, Levin A, Yong L, Frankenburg FR (1997), Reported pathological childhood experiences associated with the development of borderline personality disorder. Am J Psychiatry. 1997 Aug;154(8):1101-6 Zanarini MC, Yong L, Frankenburg FR, Hennen J, Reich DB, Marino MF, Vujanovic AA (2002), Severity of reported childhood sexual abuse and its relationship to severity of borderline psychopathology and psychosocial impairment among borderline inpatients. J Nerv Ment Dis. 190(6):381-7 Zimmerman M, Coryell W (1989), DSM-III personality disorder diagnoses in a nonpatient sample: Demographic correlates and comorbidity. Arch Gen Psychiatry 46: 682689 Jahrgang 67 / 994a / 2013 t h e m e n h e f t n e u r o lo g i e • p sy c h i at r i e Therapie des Burn-out Univ.-Prof. Dr. Med. Peter Hofmann FA f. Psychiatrie, Univ.-Klinik f. Psychiatrie Graz, Auenbruggerplatz 31, 8036 Graz E-Mail: [email protected] Wie soll man sich nun in der Praxis dem Thema nähern? Patienten kommen in unsere Ordination, sagen, sie haben ein Burn-out und fordern eine entsprechende Therapie ein. Da ist guter Rat teuer, vor allem weil es von verschiedensten Seiten Therapieangebote gibt – verschiedenste Professionen signalisieren auch in der Tagespresse Zuständigkeit, Behandlungskompetenz etc. Was tun in der ärztlichen Praxis? Zuerst einmal ärztlich-medizinisch abklären Die Burn-out-Symptomatik ist in aller Regel eine bunte Mischung aus zahlreichen psychischen und körperlichen Symptomen. Deshalb ist es in jedem Falle notwendig, eine medizinische Basisabklärung durchzuführen. Bekanntermaßen können anämische Zustände bis hin zu Schilddrüsenfunktionsstörungen, aber auch Entwicklungen im Rahmen schwerer körperlicher Erkrankungen zu ähnlichen Symptombildungen führen. Es ist die genuin ärztliche Kompetenz, hier profund Befunde zu erheben und entsprechend abzuklären. Dabei ist es empfehlenswert, sich an die üblichen Standards – ähnlich wie bei der Gesundenuntersuchung – zu halten, um grob einen Eindruck zu bekommen, ob es irgendwelche Störungen im Bereich des Blutbildes, der Nieren- bzw. Leberfunktion oder in einem anderen Bereich gibt. Ganz wesentlich ist natürlich auch eine Abklärung der Herzfunktion. Wenn sich hier eindeutige Befunde ergeben, so heißt dies aber noch lange nicht, dass man nun darauf abstellen darf und ganz klar sagen kann: „Das ist jetzt eine Beeinträchtigung der Herzfunktion und deshalb gibt es diese Symp­ tomatik, die so aussieht wie eine Burn-out- Jahrgang 67 / 994a / 2013 Da wie bereits vielfach ausgeführt Burn-out als psychische Erkrankung noch nicht eindeutig definiert und auch keine der bisherigen Definitionen tatsächlich gut in der Fachwelt etabliert ist, gibt es keine großen kontrollierten klinischen Studien zur Fragestellung der Wirksamkeit von therapeutischen Maßnahmen. Symptomatik.“ Es kann naturgemäß so sein, dass hier vieles Hand in Hand geht, nämlich körperliche Problemstellung und psychische Symptombildung, die durchaus auch als Burnout-Prozess zu sehen ist. Hier gibt es sehr oft Wechselwirkungen. Bekannter ist dieses Feld der körperlich-psychischen Wechselwirkung aus der Erforschung von Angststörungen. Bestes Beispiel hierfür ist die Panikstörung – so sind im Rahmen von Panikattacken etwa erhebliche Tachykardien, aber auch Rhythmusstörungen und massive Blutdruckanstiege messbar. Der pragmatisch-klinische Ansatz In unseren großen Untersuchungen zum Thema Burn-out bei verschiedenen Berufsgruppen wie Ärzten, Richtern etc. haben wir an vielen Tausenden Teilnehmern auch die Frage nach dem gleichzeitigen Bestehen einer Depression bei Burn-out beleuchtet. Im Ergebnis ist eindeutig feststellbar, dass Burn-out ab einem bestimmten Schweregrad durchaus mit einer Depression vergleichbar ist. Bekanntermaßen haben wir aufgrund der großen Datenmenge, die uns zu Verfügung steht, ein Drei-Stufen-Konzept von Burn-out rechnerisch erarbeitet. Hier muss man feststellen, dass ab der Phase 2 bei fast allen Probanden gleichzeitig eine erhebliche krankheitswertige Depression besteht. Daher ist es am vernünftigsten, davon auszugehen, dass Burn-out als depressiver Entwicklungsprozess zu sehen ist. Deshalb kommen auch alle unsere Standardbehandlungsstrategien aus dem Gebiet der Depressionsbehandlung zum Tragen. Wenn man sich die zentralen Elemente in der Burn-out-Entwicklung ab einen bestimmten Schweregrad ansieht, so haben wir es in aller Regel mit Schlafstörungen, erhöhter Erschöpfund Ermüdbarkeit, Interesse- und Freudverlust, Konzentrations- und Aufmerksamkeitsstörungen zu tun. Diese Symptome bestehen in aller Regel über Wochen, bis der Patient in die ärztliche Praxis kommt. Hier ist es augenscheinlich, dass es zentrale depressive Kernsymptome sind, die es zu behandeln gilt. Die Rolle der Antidepressiva Selbstverständlich wird in der Behandlung des Burn-out den Psychopharmaka – im Speziellen den Antidepressiva – eine spezielle Rolle zugebilligt, da gerade diese den großen Vorteil haben, dass sie nicht abhängig machen bzw. nicht die Persönlichkeit verändern, sehr wohl aber gerade diese Kernsymptome depressiver Natur gut erreichen können. Wenn es um die Behandlung von Konzentrations- bzw. Aufmerksamkeits- oder Befindlichkeitsstörungen, aber auch Schlafstörungen geht, ist es naturgemäß sinnvoll Antidepressiva einzusetzen, die hier besonders gut wirksam sind. Genannt seien hier Trazodon, Mirtazapin, Bupropion etc. Leitgedanke sollte immer sein: Ist die Behandlung mit diesem oder jenem speziellen Medikament mit einer Berufstätigkeit vereinbar. Es gehört also im Vorfeld geklärt, ob der Betroffene weiter berufstätig bleibt oder in den Krankenstand geht. Wenn er weiter berufstätig ist, was aufgrund der Angst um den Arbeitsplatz heute allerorten zu beobachten ist, muss man sich auch die Frage stellen, ob der Betroffene ein Auto lenken bzw. vielleicht irgendeine gefährliche Maschine bedienen muss oder Ähnliches. Entsprechend ist auch die medikamentöse Therapie zu gestalten. Hier kommen die selektiven Serotonin-Wiederauf- ARZT & PRAXIS 15 16 t h e m e n h e f t n e u r o lo g i e • p sy c h i at r i e nahmehemmer ins Spiel. Diese haben ja teilweise den großen Vorteil, dass man sie nur einmal täglich – nämlich morgens – einnimmt. Dabei entfalten sie in aller Regel keine Vigilanzbeeinträchtigenden Nebenwirkungen. Die medikamentöse Schiene – die sogar eine Kombinationstherapie aus den genannten Substanzen sein kann – ist also eine sehr wesentliche Möglichkeit, schwerwiegende Burn-out-Entwicklungen entsprechend zu behandeln. Hier gilt es natürlich, entsprechende Überzeugungsarbeit zu leisten. Viele Betroffene sind der Meinung, dass die Burn-out-Entwicklung mit Überforderung und Problemen am Arbeitsplatz zu tun hat – dies ist durchaus richtig, nur muss man die sich dadurch entwickelnde Eigendynamik depressiver Störungen berücksichtigen. Es ist nun mal so, dass schwere Belastungen zu Depressionen führen können, die aber dann völlig eigenständig weitergehen. Hier ist es nicht mehr alleine damit getan, Fragen des klugen Selbstmanagements zu berücksichtigen, sondern hier muss man sich schlichtweg am Schweregrad klinischer Symptome orientieren. Aus reichhaltiger Erfahrung auf diesem Gebiet ist aus meiner Sicht festzustellen, dass man niemals davon ausgehen darf, eine lange Auszeit mit der Möglichkeit zur Selbstfindung reiche aus, damit auf einmal alles an Symptombildungen verschwindet, ohne dass man Medikamente zum Einsatz bringt – im Gegenteil dazu besteht sogar die Gefahr der eigendynamischen Weiterentwicklung der Depression mit Chronifizierung. Natürlich ist auch die Frage zu beantworten, wie man das Therapieziel wählt. Ist es das Therapieziel, dass der Betroffene wieder auf sein ursprüngliches Leistungsniveau zurückkommt und seinen Herausforderungen im Arbeitsalltag wieder gerecht werden kann, oder ist es das Ziel, es etwas „billiger“ zu geben, allenfalls den Arbeitsplatz oder den Beruf zu wechseln, um weniger Belastung zu haben. Aus meiner Erfahrung ist es zielführender, den ersteren Ansatz zu wählen und in einer konsequenten Kombination aus psychopharmakologischer Therapie bei erheblichem Krankheitswert und anderen therapeutischen Interventionen anzubieten. Zur Beurteilung des Therapieerfolgs sind dieselben Kriterien anzuwenden wie in der Behandlung der Depression selbst. Dies bedeutet, das Ziel ist Symptomremission – d. h. ARZT & PRAXIS alle Symp­tome sollen verschwinden, nicht mehr und nicht weniger. Hier gilt generell genauso wie in der Depressionsbehandlung, dass Restsymptome prognostisch ungünstig sind bzw. häufiger zu Chronifizierung und Rückfällen führen. Die große Gefahr der psychopharmakologischen Therapie besteht vor allem darin, dass Betroffene den Medikamenten zu viel Bedeutung zuordnen, nicht bereit sind, in einem Selbstreflexionsprozess eigene krankmachende Anteile zu erspüren und allenfalls Muster im eigenen Verhalten zu ändern, sondern sich schlichtweg auf die medikamentöse Therapie verlassen und im günstigen Falle, dass Medikamente auch wirklich greifen, einfach so weitermachen, wie sie es zuvor gewohnt waren. Dies ist eine fatale Fehleinschätzung, vor der man den Patienten unbedingt bewahren muss. Im Idealfall kommt es eben durch eine medikamentöse Therapie zu einer deutlichen Symp­ tomlinderung, z.B. schon alleine dadurch, dass der Schlaf wiederhergestellt wird. Damit ist aber natürlich das Problem der Selbstausbeutung nicht erledigt. Die große Chance bei Wirksamwerden von Antidepressiva ist, dass Energie zur Verfügung steht, Veränderungen anzugehen. Keinesfalls darf man sich vor Freude gegenseitig auf die Schulter klopfen und vermeinen, dass damit das Problem erledigt ist. Im Gegenteil gilt es hier, immer ganz bewusst nachzuforschen bzw. nachzufragen, ob sich am Handlungsstil etwas geändert hat oder ob der Betroffene weiterhin in denselben Mustern verbleibt. Tranquilizer sind keine Option, da sie die Angst und die Hemmschwelle herabsetzen und Lernprozesse in aller Regel konterkarieren. Nicht-pharmakologische Behandlungsstrategien Hier erheben zahlreiche äußerst divergente Therapieangebote Anspruch auf Wirksamkeit. Dazu muss man ausführen, dass die wenigsten davon über eine fundierte Studienlage verfügen, welche diesen Anspruch rechtfertigt. Wenn man zunächst wieder einmal symp­ tom­orientiert denkt, so muss man sich den wesentlichen Symptomen in der Entwicklung des Burn-out-Prozesses zuwenden. Dazu gehören Unfähigkeit zur Entspannung, Erschöpfbarkeit etc. Dies ist natürlich ein ideales Feld für den Einsatz von Entspannungsverfahren. Erwähnt seien hier autogenes Training, progressive Muskelrelaxation, Meditation, Yoga, Tai Chi etc. Das Angebot ist so vielfältig, dass für jeden etwas dabei ist. Man muss die Betroffenen schlichtweg ermuntern, dass sie sich verschiedene Ansätze anschauen und sehen, was ihnen persönlich vom Typ her am besten entgegenkommt. Reine Wellnessverfahren wie ein verlängertes Wochenende in einem Thermenhotel greifen – wenn überhaupt – nur bei sehr wenig belasteten Persönlichkeiten, also bei Menschen, die nur vorübergehend vermehrt unter Druck gestanden haben und durch solch ein Wochenende eine gute Regeneration erreichen können. Für fortgeschrittene Stadien des Burn-out reicht es sicherlich nicht aus. Auch Abenteuerurlaube wie das Besuchen von Kletterparks oder Rafting oder Canoeing sind sicherlich nicht geeignet, Burn-out-Betroffene entsprechend positiv therapeutisch zu beeinflussen. Coachingverfahren eigenen sich im Wesentlichen nur bei geringem Ausprägungsgrad von Symptomen, wo also noch keine Krankheitswertigkeit vorliegt. Coachingverfahren arbeiten zielorientiert an Problemstellungen – dabei muss natürlich eine entsprechende Fitness des Betroffenen gegeben sein, damit er die Pro­blematik erkennen, kritisch durchleuchten sowie Strategien mit dem Coach gemeinsam entwickeln und diese auch umsetzen kann. Das ist oftmals ab einen bestimmten Schweregrad schlichtweg nicht mehr möglich. Hier greifen dann sicherlich psychotherapeutische Verfahren, bei denen aus meiner Sicht vor allem sehr konkrete handlungsorientierte Verfahren zur Anwendung kommen sollten, weil es oftmals einfach darum geht, bestimmte Dinge auch zu üben, wie z.B. sich abzugrenzen bzw. Nein zu sagen – vor allem Nein gegenüber den eigenen Ansprüchen. Was man nie übersehen darf, ist, dass der Burn-out-Prozess in den seltensten Fällen ein isolierter auf den Arbeitsplatz bezogener Prozess ist. In aller Regel gibt es eine ganze Fülle von Zusatzproblemen – vor allem auch im privaten Bereich, oftmals gibt es dann Partnerschaftsprobleme oder generell erhebliche Spannungen und Schwierigkeiten in der Familie. Hier ist natürlich eine Gesprächstherapie sinnvoll, um einen entsprechenden Veränderungsprozess auch im privaten Umfeld anzugehen. Sehr verunsichert werden Betroffene hier vor allem durch tatsächlich widersprüchliche Informationen. So gibt es Therapieangebote, welche in die Richtung gehen, dass es sich hier um einen sehr langen therapeutischen Prozess Jahrgang 67 / 994a / 2013 Fachkurzinformationen siehe Seite 19 18 t h e m e n h e f t n e u r o lo g i e • p sy c h i at r i e handeln muss, der auch eine entsprechende Auszeit verlangt und eine intensive psychotherapeutische Betreuung braucht. Mir sind aus der Praxis Fälle bekannt, bei denen Betroffenen tatsächlich Auszeiten von einem Jahr empfohlen wurden. Dies ist aus meiner Sicht angesichts der heutigen Arbeitswelt in aller Regel völlig unrealistisch. Es gibt nur ganz wenige Enklaven in der Arbeitswelt, wo es noch möglich ist, ein solches Vorgehen zu wählen. Hier kommt aber auch noch das Problem dazu, wie man aus ärztlicher Sicht die Betroffenen unterstützen kann: Ab wann soll man krankschreiben und noch dazu für wie lange? Diese Frage ist schlichtweg nicht generell beantwortbar. Es bedarf einer kritischen Einschätzung des aktuellen Leidenszustandes unter Einbeziehung des Schweregrades der depressiven Symptomatik – je nachdem kann es durchaus Sinn machen, auch Krankenstände von bis zu einem Monat zu empfehlen, dies aber nur in schweren Fällen. Der Vorschlag mit 3–4 Wochen Krankenstand hat auch eine Rationale im Hintergrund. Es gibt einige Studien, die zeigen, dass die durch den Burn-out-Prozess entstandene Einschränkung der Kritikfähigkeit bezüglich des eigenen Handelns ungefähr diesen Zeitraum zur Regeneration braucht, d. h. man kann davon ausgehen, dass nach 3–4 Wochen doch eine so gute Distanz zum Arbeitsplatz geschaffen werden kann, dass man mehr und mehr in die Lage versetzt wird, sich kritisch mit krankhaften Entwicklungen am Arbeitsplatz auseinanderzusetzen. Fatal ist in dieser Situation – was ich auch oftmals beobachtet habe, – dass Betroffene über Firmenhandy bzw. E-Mails mit dem Arbeitsplatz verbunden sind, dass es zum einen gutgemeinte, mitfühlende Nachfragen nach der Befindlichkeit gibt, aber auch ganz konkrete Anfragen, die Druck aufbauen, durch Vorgesetzte, wann mit einem Wiedereinsatz gerechnet werden kann. Wenn Krankenstand, dann richtig – also Abbruch der Beziehungen zum Arbeitsplatz, damit von dieser Seite her Stille herrscht, diese Front begradigt ist und der Betroffene sich tatsächlich seinem Gesundungsund Veränderungsprozess widmen kann. Die Burn-out-Entwicklung ist in jedem Fall eine krisenhafte Entwicklung, die aber naturgemäß wie alle Krisen die Chance auf positive Veränderung birgt, d. h. durch die Burnout-Entwicklung kommt es oft zur kritischen Reflexion über eigene Überforderung, wo Betroffene tatsächlich nach einiger Zeit erstaunt ARZT & PRAXIS sind, was sie sich selbst alles abverlangen, wo der Einsatz in keiner Relation mehr zum Ergebnis steht. Gerade in jenem Moment, in dem die ausgeprägt schwere Burn-out-/Depressionssymptomatik zurückgeht, sind Veränderungsprozesse durch Coaching bzw. therapeutische Gespräche zu beginnen. Hier liegt die größte Chance auf Veränderung. Ein besonderes Problem in diesem Zusammenhang ist natürlich der gekränkte Selbstwert, da der Betroffene feststellen muss, dass er nicht einmal annähernd in der Lage ist, früher für ihn selbstverständliche Tätigkeiten und ein entsprechendes Arbeitspensum zu bewältigen. Mit diesem Knick muss man umgehen lernen, aber auch hier liegt natürlich die Chance auf Erneuerung. Prophylaktische Aspekte Gerade bei der Burn-out-Entwicklung sind Strategien zur Prophylaxe gefragt. Unter dem Schlagwort der Effizienzsteigerung wird völlig unkritisch der Druck auf die Arbeitnehmer mehr und mehr erhöht, dasselbe gilt übrigens aber auch für Unternehmer. Nur wenige Firmen bieten Ausgleichs- und Stützungsprogramme an, vielfach herrscht noch der Gedanke, dass die persönliche Fitness und Leistungsfähigkeit ein Thema des Privaten ist, für das der Arbeitgeber nicht zuständig ist. Bei einigen Unternehmungen hat sich hier in den letzten Jahren vieles zum Guten verändert. Man muss aber auch dort feststellen, dass neben entsprechenden Stützungsprogrammen, welche sogar so weit gehen, dass Arbeitgeber anteilig Coaching- oder Therapiestunden bzw. Anteile an Rehabilitationsverfahren zahlen, weiterhin aber der Arbeitsdruck erhöht wird und hier kein Ende in Sicht ist. Daher ist es wesentlich, dass jeder beizeiten darauf achtet, wo seine Schwachpunkte liegen und wo er durch kluges Selbstmanagement etwas zum Guten verändern kann – und zwar im Sinne, dass er widerstandsfähiger wird. Hierher gehören tatsächlich Strategien wie „Schauen auf die eigene Energiebilanz“, d. h. steht der Energieeinsatz am Arbeitsplatz noch in einer Relation zu meinen Energieaufwendungen im privaten - und Freizeitbereich oder hat der Arbeitsplatz schon überhandgenommen? Dabei darf man nicht übersehen, dass Arbeit zutiefst sinnstiftend ist und viele Menschen sich über Arbeit auch sehr gut definieren, dort ihre Stärken und Fähigkeiten ausleben können. Dies soll auch so sein und wird aus meiner Sicht viel zu sehr unterschätzt - vielmehr gehört dies gestützt und herausgearbeitet. Dennoch ist gerade die Burn-out-Entwicklung ein Signal dafür, dass in aller Regel diese Balance zwischen Arbeit und privater Freizeit nicht mehr existiert. Wesentliche Elemente, die der Einzelne sehr schwer beeinflussen kann, die aber für die Entwicklung von Burn-out unseren Forschungen zufolge hoch relevant sind, sind die Fragen nach dem Arbeitsklima im Allgemeinen und nach der Führungskultur, der Kultur der Anerkennung bzw. des Lobens, aber auch nach dem Umgang im Team im Speziellen. Hier finden sich teilweise dramatische Defizite, die dazu führen, dass zahlreiche Mitarbeiter in die innere Emigration gehen und aufgeben, weil sie sich sagen, den Chef oder die Kollegen können sie sowieso nicht verändern. Das ist auch zum großen Teil richtig, und es ist die Aufgabe der Führungskräfte, hier entsprechend positiv zu wirken. Es ist aber zumindest einen Versuch wert, Fehlentwicklungen aufzuzeigen und konstruktive Veränderungsvorschläge einzubringen. Das Um und Auf ist, auf das eigene Energiekonto positiv einzuzahlen, indem man ausreichend Pausen macht bzw. Erholung hat sowie positive Dinge wie Beziehungen, Sport bzw. Hobbys würdigt und entsprechend auslebt. Das sind die Kernfaktoren, die uns gesund erhalten – hier liegt die besondere Herausforderung, vor allem auch im städtischen Bereich, wo Verstädterung mit der Entwicklung hin zu Mega-Citys und einem immer größeren Anteil an Single-Haushalten es schwer macht, entsprechende Beziehungen aufzubauen und gehaltvoll zu leben. Das ist sicherlich eine der größten Herausforderungen in einer sich immer rascher wandelnden Zeit mit immer größerer Unsicherheit. Es gilt, Positivität im Alltag zu erleben bzw. erlebbar zu machen, indem man auch einfache Konzepte aus der positiven Psychologie anwendet. Hier sei nur ein kleines Beispiel angeführt. Viele Menschen funktionieren nach dem Muster, dass sie sich am Abend ins Bett legen und darüber nachdenken, was sie tagsüber alles belastet hat und wo Probleme waren bzw. sie sich in weiterer Folge darüber Gedanken machen, was alles an Belastungen und Problemen auf sie zukommt. In dieser Stimmung und Energielage schlafen sie dann ein. Eine einfache Übung wäre, sich die Fragen zu stellen, was ist am heutigen Tag positiv gelaufen, welche Jahrgang 67 / 994a / 2013 t h e m e n h e f t n e u r o lo g i e • p sy c h i at r i e meiner persönlichen Stärken konnte ich zum Einsatz bringen, dass mir das eine oder andere gelungen ist? Über ein solches Vorgehen gibt es Studien – es wurde in der Realität überprüft, dass, wenn man so etwas regelmäßig macht, eine positivere Grundstimmung entsteht. Hier gibt es noch viele andere Aspekte und Verfahren, die eingesetzt werden können. Stationäre psychiatrische Rehabilitation In den letzten Jahren erlebten wir einen regelrechten Boom an Neugründungen von sogenannten psychiatrischen Reha-Kliniken. Der große Vorteil dieser Institute besteht darin, dass eine definierte Aufenthaltsdauer von 5–6 Wochen vorgesehen ist und rehabilitative Aspekte im Vordergrund stehen. Daher eignen sich diese Einrichtungen naturgemäß auch für die Rehabilitation von Burn-out-Betroffenen und bildet diese Gruppe einen recht großen Anteil jener Klienten, welche regelmäßig diese Häuser frequentieren. Man muss dazu aber auch ausführen, dass abgesehen von oftmals idyllischer Lage die Therapieprogramme sehr standardisiert sind. Der Vorteil liegt darin, dass der Betroffene letztlich „6 Wochen“ Auszeit verordnet bekommt, und das ist für viele Betroffene eine wunderbare Gelegenheit, einmal loszulassen und sich fernab der Arbeitsrealität auf einen Reflexionsprozess einzulassen. Daher wird den Betroffenen dieser Weg von mir – aufgrund von guter Erfahrung – sehr häufig vorgeschlagen und in der Antragstellung u.a. auch entsprechend unterstützt. Zu viel darf man sich naturgemäß nicht erwarten, es stellt aber eine gute Chance dar, auf den richtigen Weg zu kommen. Fazit Fasst man die aktuelle Studienlage zusammen, so muss man sagen, dass Interventionen bei Burn-out-Betroffenen sinnvoll sind und etwas Positives bewirken können – die Datenlage ist aber nicht annähernd so breit wie in der Behandlung anderer depressiver Störungen. Hier fehlt sicherlich die Definition des Burn-out als eigenständige Erkrankungsidentität, die man dann auch entsprechend beforschen kann bzw. wo dann auch entsprechende Fragestellungen auf der Therapieebene beleuchtet werden können. Hier ist sicherlich noch sehr viel zu tun, und es fehlen einfache pragmatische, wirksame Strate♦ gien für die große Anzahl an Betroffenen. Fachkurzinformationen Cipralex® 5 mg/10 mg/20mg – Filmtabletten; ATC-Code: N 06 AB. Qualitative und quantitative Zusammensetzung: Jede Filmtablette enthält 5 mg bzw. 10 mg bzw. 20mg Escitalopram (als Oxalat); Liste der sonstigen Bestandteile: Tablettenkern: Mikrokristalline Cellulose, Hochdisperses wasserfreies Siliciumdioxid, Talk, Croscarmellose-Natrium, Magnesiumstearat; Tablettenhülle: Hypromellose, Macrogol 400, Titandioxid (E-171). Anwendungsgebiete: Behandlung von Episoden einer Major Depression. Behandlung von Panikstörung mit oder ohne Agoraphobie. Behandlung von sozialer Angststörung (Sozialphobie). Behandlung von generalisierter Angststörung. Behandlung von Zwangsstörung. Gegenanzeigen: Überempfindlichkeit gegen Escitalopram oder einen der sonstigen Bestandteile. Die gleichzeitige Behandlung mit nicht selektiven, irreversiblen Monoaminoxidase-Hemmern ist kontraindiziert aufgrund des Risikos eines SerotoninSyndroms mit Agitation, Tremor, Hyperthermie etc. (siehe Abschnitt 4.5). Eine Kombination von Escitalopram mit reversiblen MAO-A Hemmern (z.B. Moclobemid) oder dem reversiblen nicht selektiven MAO-Hemmer Linezolid ist kontraindiziert aufgrund des Risikos eines Serotonin-Syndroms (siehe Abschnitt 4.5). Escitalopram ist bei Patienten mit bekannter QT Intervall Verlängerung oder vererbtem langem QT Syndrom kontraindiziert. Die Kombination von Escitalopram mit Arzneimitteln die bekannterweise das QT Intervall verlängern, ist kontraindiziert (siehe Abschnitt 4.5). Zulassungsinhaber und Hersteller: H. Lundbeck A/S, Ottiliavej 9, DK-2500 ValbyKopenhagen Dänemark. Vertrieb: Lundbeck Austria GmbH, Dresdner Straße 82, 1200 Wien. Verschreibungspflicht/Apothekenpflicht: Rezept- und apothekenpflichtig, wiederholte Abgabe verboten. Weitere Angaben zu Dosierung, Nebenwirkungen, Wechselwirkungen, Schwangerschaft und Stillzeit und zu den besonderen Warnhinweisen zur sicheren Anwendung sind der veröffentlichten Fachinformation zu entnehmen. Trittico retard 150mg – Tabletten Zusammensetzung (arzneilich wirksame Bestandteile nach Art und Menge): 1 Tablette enthält 150mg Trazodonhydrochlorid. Hilfsstoffe: Saccharose 84 mg, Polyvinylpyrrolidon, Carnaubawachs, Magnesiumstearat. Anwendungsgebiete: Zur Behandlung von Depressionen unterschiedlicher Ätiologie mit oder ohne Angstkomponente; anhaltenden Schlafstörungen bei Depressionen; im Rahmen von Depressionen auftretende erektile Dysfunktionen ohne schwerwiegende organische Ursachen. Gegenanzeigen: Überempfindlichkeit gegen einen Bestandteil des Präparates; Alkohol-und Schlafmittelvergiftung, frischer Herzinfarkt. Bei Patienten mit Herzerkrankungen, Epilepsie sowie eingeschränkter Nieren-oder Leberfunktion empfehlen sich die üblichen Vorsichtsmaßnahmen. Über die Anwendung bei Kindern und Jugendlichen liegen keine ausreichenden klinischen Erfahrungen vor. Name oder Firma und Anschrift des pharmazeutischen Unternehmers: CSC Pharmaceuticals Handels GmbH, 2102 Bisamberg. Verschreibungspflicht/Apothekenpflicht: Rp, apothekenpflichtig. Weitere Angaben zu Nebenwirkungen, Wechselwirkungen, Gewöhnungseffekten und zu den besonderen Warnhinweisen zur sicheren Anwendung sind der veröffentlichten Fachinformation zu entnehmen. AZILECT 1 mg Tabletten Qualitative und quantitative Zusammensetzung: Jede Tablette enthält 1 mg Rasagilin (als Mesilat). Liste der sonstigen Bestandteile: Mannitol (Ph. Eur.), Maisstärke, Vorverkleisterte Stärke (aus Mais), Hochdisperses Siliciumdioxid, Stearinsäure (Ph. Eur.), Talkum. Anwendungsgebiete: Azilect ist zur Behandlung der idiopathischen Parkinson-Krankheit (PK) als Monotherapie (ohne Levodopa) oder als Zusatztherapie (mit Levodopa) bei Patienten mit End-of-dose-Fluktuationen indiziert. Gegenanzeigen: Überempfindlichkeit gegen den arzneilich wirksamen Bestandteil oder einen der sonstigen Bestandteile (siehe Abschnitt 6.1). Gleichzeitige Behandlung mit anderen Monoaminoxidase-(MAO)-Hemmern (einschließlich nicht verschreibungspflichtiger Arzneimittel und Naturheilmittel z.B. Johanniskraut) oder Pethidin (siehe Abschnitt 4.5). Mindestens 14 Tage müssen zwischen dem Absetzen von Rasagilin und der Einleitung einer Behandlung mit MAO-Hemmern oder Pethidin liegen. Rasagilin ist bei Patienten mit stark eingeschränkter Leberfunktion kontraindiziert. Pharmakotherapeutische Gruppe: MonoaminoxidaseB-Hemmer, ATC-Code: N04BD02 . Inhaber der Zulassung: Teva Pharma, Kirchzarten, Deutschland. Verschreibungspflicht/Apothekenpflicht. Rezept- und apothekenpflichtig, wiederholte Abgabe verboten. Weitere Angaben zu Dosierung, Nebenwirkungen, Wechselwirkungen, Schwangerschaft und Stillzeit und zu den besonderen Warnhinweisen zur sicheren Anwendung sind der vollständigen Fachinformation zu entnehmen. Quetialan® XR 50 mg-Retardtabletten, Quetialan® XR 200 mg-Retardtabletten, Quetialan® XR 300 mg-Retardtabletten, Quetialan® XR 400 mg-Retardtabletten Zusammensetzung: 1 Retardtablette enthält 50/200/300/400mg Quetiapin (als Quetiapinfumarat). Sonstige Bestandteile: Tablettenkern: 50/200/300/400mg: Lactose-Monohydrat, mikrokristalline Cellulose, leichtes Magnesiumoxid, Carrageen (E 407), Povidon K 30, Magnesiumstearat. Tablettenüberzug: 50mg: Carrageen (E 407), Titandioxid (E 171), Macrogol 400, Eisenoxid Gelb (E 172), Eisenoxid Rot (E 172). 200/300mg: Carrageen (E 407), Titandioxid (E 171), Macrogol 400, Eisenoxid Gelb (E 172).. 400mg: Carrageen (E 407), Titandioxid (E 171), Macrogol 400. Anwendungsgebiete: Quetialan® XR wird verwendet zur • Behandlung der Schizophrenie, einschließlich der Rückfallprävention bei mit Quetialan® XR stabil eingestellten Patienten • Behandlung der bipolaren Erkrankung (zur Behandlung von mittelgradigen bis schweren manischen Episoden innerhalb der bipolaren Erkrankung, zur Behandlung von Episoden der Major Depression innerhalb der bipolaren Erkrankung, zur Rückfallprävention bei bipolaren Patienten, die in der manischen oder depressiven Episode auf die Quetiapin-Behandlung angesprochen haben). • Behandlung depressiver Episoden (Episoden einer Major Depression) als Zusatztherapie bei Patienten, die unzureichend auf die Monotherapie mit einem Antidepressivum angesprochen haben. Vor Beginn der Behandlung sollte der behandelnde Arzt das Sicherheitsprofil von Quetialan® XR beachten. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile des Arzneimittels. Die gleichzeitige Anwendung von Cytochrom P450 3A4-Hemmern wie HIV-Proteasehemmern, Antimykotika vom Azoltyp, Erythromycin, Clarithromycin und Nefazodon ist kontraindiziert. Wirkstoffgruppe: Pharmakotherapeutische Gruppe: Antipsychotika, Diazepine, Oxazepine und Thiazepine, Quetiapin. ATC-Code: N05A H04. Inhaber der Zulassung: G.L. Pharma GmbH, 8502 Lannach Rezept- und apothekenpflichtig, wiederholte Abgabe verboten. Packungsgrößen: 50mg und 200mg: 10, 30 Stück, 300 und 400mg: 10, 60 Stück. Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln oder sonstige Wechselwirkungen, Schwangerschaft und Stillzeit, Nebenwirkungen sowie Angaben über Gewöhnungseffekte entnehmen Sie bitte den veröffentlichten Fachinformationen! Pram 10 mg-Filmtabletten, Pram 20 mg-Filmtabletten, Pram 40 mg-Filmtabletten Zusammensetzung: Eine Filmtablette enthält 10/20/40 mg Citalopram als Hydrobromid. Sonstige Bestandteile: Tablettenkern: Mannitol, mikrokristalline Zellulose, hochdisperses Siliziumdioxid, Magnesiumstearat. Filmüberzug: Hypromellose, Titandioxid E 171, Macrogol 6000. Anwendungsgebiete: Depressive Störungen und Zustände verschiedenen Schweregrades, verschiedener Ätiologie und Symptomatologie auch im höheren Lebensalter (Altersdepression) sowie die Vermeidung von Rückfällen/Rezidiven; depressive Verstimmungen bei dementiellen Störungen; Angst- und Panikstörungen, Phobien, Panikattacken mit oder ohne Agoraphobie; Zwangsstörungen (OCD = Obsessive Compulsive Disorder). Gegenanzeigen: Überempfindlichkeit gegen Citalopram oder einen der sonstigen Bestandteile; Kombination mit MAO-Hemmern (Monoaminoxidasehemmer) - in einigen Fällen ähnelten die Symptome einem Serotonin-Syndrom. Citalopram darf Patienten, die gleichzeitig Monoaminooxidasehemmer (MAOI) erhalten, einschließlich des selektiven MAO-B-Hemmers Selegilin in täglichen Dosen, die 10 mg überschreiten, nicht gegeben werden. Eine Behandlung mit Pram darf erst 14 Tage nach Absetzen eines irreversiblen MAO-Hemmers begonnen werden. Nach Absetzen eines reversiblen MAO-Hemmers (RIMA) z.B. Moclobemid, muss die in der entsprechenden Fachinformation des RIMA vorgeschriebene Zeit eingehalten werden. Eine Behandlung mit MAO-Hemmern darf erst 7 Tage nach dem Absetzen von Pram begonnen werden; Kombination mit Linezolid, es sei denn es besteht die Möglichkeit für eine genaue Beobachtung und Überwachung des Blutdrucks; Citalopram ist bei Patienten mit bekannter QT-Intervall-Verlängerung oder angeborenem „Long-QT-Syndrom“ kontraindiziert; Kombination mit Arzneimitteln, die bekanntermaßen das QT-Intervall verlängern; Kombination mit Pimozid. Wirkstoffgruppe: Pharmakotherapeutische Gruppe: Antidepressiva, Selektive Serotonin-Wiederaufnahmehemmer; ATC-Code: N06AB04. Inhaber der Zulassung: G.L. Pharma GmbH, 8502 Lannach. Rezept- und apothekenpflichtig, wiederholte Abgabe verboten. Packungsgrößen: 14 und 28 Stück. Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln oder sonstige Wechselwirkungen, Schwangerschaft und Stillzeit, Nebenwirkungen sowie Angaben über Gewöhnungseffekte entnehmen Sie bitte den veröffentlichten Fachinformationen! Jahrgang 67 / 994a / 2013 ARZT & PRAXIS 19 20 fortbildung Symptomatische Demenz-Therapie – Cholinesterasehemmer und Memantin Diese stellen zentrale medikamentöse Optionen in der Therapie kognitiver wie auch nicht-kognitiver Demenz-Symptome dar. Konkret sind derzeit in Österreich vier Substanzen verfügbar – und zwar die Cholinesterasehemmer Donepezil, Galantamin und Rivastigmin sowie der NMDA-Rezeptorantagonist Memantin. Untersuchungen zu deren therapeutischem Einsatz liegen für Alzheimer- bzw. vaskuläre Demenz sowie Mischformen, des weiteren für die Parkinson-assoziierte Demenz, die Demenz mit Lewy-Körperchen und die frontotemporale Demenz sowie für das Mild Cognitive Impairment (MCI) vor. Einzig bei letzteren beiden besteht derzeit keine Evidenz für eine Gabe der genannten Substanzen. Sich aus den bisherigen wissenschaftlichen Erkenntnissen ergebende Empfehlungen sowie Beachtenswertes zum Management im Praxis­ alltag werden in der Folge zusammengefasst – zum einen fließen Aussagen von J. Rodda und J. Carter aus ihrem rezent im BMJ veröffentlichten Review [1] und zum anderen Empfehlungen aus dem österreichischen Konsensusstatement „Demenz 2010“ [2] darin ein. Cholinesterase-Inhibitoren (ChEI) hemmen die Acetylcholinesterase und somit den Abbau von Acetylcholin im synaptischen Spalt – dadurch verlängert sich dessen Wirkdauer. Klinisch wird durch eine gesteigerte cholinerge Aktivität eine Verbesserung von darüber vermittelten Defiziten erwartet. Darüber hinaus inhibiert Rivastigmin auch die Butyrylcholinesterase bzw. verstärkt Galantamin die intrinsische Aktivität von Acetylcholin an nikotinergen Rezeptoren, wahrscheinlich durch Bindung an eine allosterische Rezeptorstelle. Die Bedeutung dieser additiven Effekte ist allerdings laut Rodda und Carter noch unklar. Memantin ist ein NMDA-Rezeptorantagonist und greift somit am glutamatergen System an – es reguliert die Wirkung pathologisch erhöhter toxischer Glutamat-Konzentrationen, die zu neuronalen Funktionsstörungen führen können. ChEI bei leichter bis mittelschwerer Alzheimer-Demenz Laut österreichischem Demenz-Konsensus werden ChEI als Mittel der ersten Wahl zur ARZT & PRAXIS Behandlung der leichten bis mittelschweren (MMSE 11-26) Alzheimer-Demenz empfohlen. Donepezil, Galantamin und Rivastigmin sind in Österreich dafür auch zugelassen. Sie zeigen eine günstige Beeinflussung von kognitiven Funktionen, Alltagsaktivitäten und globalem klinischen Eindruck. Diese Effekte sind moderat und vorwiegend durch dosisabhängige Verbesserungen oder Stabilisierung der Behandlungsgruppen bei fortlaufender Verschlechterung der Placebogruppen bedingt. Die Behandlungseffekte sind alltagsrelevant. Belegt ist eine Wirksamkeit für eine Therapiedauer von 6 — 12 Monaten. In einem Cochrane Review fasste J. Birks Daten für alle drei Substanzen zusammen und inkludierte 13 Studien mit einer Dauer von 6 bzw. 12 Monaten. Diese Metaanalyse bestätigte ebenso die Effektivität von ChEI im leichten und mittleren Schweregrad der Alzheimer-Demenz. Zudem hielt Birks Folgendes fest: Eine Voraussage, wer auf welche Substanz anspricht, sei nicht möglich. In Bezug auf die Wirksamkeit sei keine Evidenz für die Überlegenheit einer Substanz festzustellen. Es sei keine Kostenineffektivität bei einem Einsatz dieser Substanzen zu beobachten gewesen. Hierzu ergänzten Rodda und Carter in ihrem Review, dass beobachtete moderate Änderungen in den klinischen Skalen immer wieder Gegenstand kontroverser Diskussionen wären. Für manche Experten seien sie zu klein, um klinische Bedeutung zu erlangen – für andere wiederum seien die moderaten Mittelwerte Ausdruck eines substantiellen Benefits einiger weniger Patienten bei gleichzeitig fehlendem Ansprechen der überwiegenden Mehrzahl. Gegenwärtig würden allerdings Anstrengungen unternommen, die Gruppe der möglichen „Responder“ genauer definieren zu können. In verschiedenen Studien wiederum wurde ein Ansprechen auf die Therapie als eine „geringere Verschlechterung, als diese in unbe- handeltem Zustand zu erwarten gewesen wäre“, definiert. So wählten etwa Wilkinson et al. in ihrer Arbeit an Patienten mit leichter bis mittelschwerer Alzheimer-Demenz eine Definition der „klinischen Verschlechterung“, welche Kognition, Alltagsfunktionalität und globalen klinischen Eindruck miteinbezog. Im Studienzeitraum von 6 Monaten schnitten die antidementiv (hier mit Donepezil) Behandelten signifikant besser ab – nur 14 versus 30 % unter Placebo zeigten eine klinische Verschlechterung. Diese Daten sprechen zum einen dafür, dass selbst vermeintliche „Non-Responder“ von einer antidementiven Therapie profitieren, und zum anderen dafür, dass klinisch repräsentative Aussagen zum Benefit einer Therapie nur mittels mehrdimensionaler Betrachtung zu gewinnen sind. Dementsprechend könne der MMSE nicht alleinige Grundlage von diesbezüglichen Entscheidungen sein. ChEI bei schwerer Alzheimer-Demenz Mittlerweile besteht ein zu Memantin identer wissenschaftlicher Evidenzgrad auch für Donepezil. Benefits fanden etwa Cummings et al. rezent in einer gepoolten Datenanalyse. Dies führt zu gleicher Einschätzung der Studienlage für Memantin und Donepezil bei schwerer Demenz – dementsprechend wird im österreichischen Demenz-Konsensus Donepezil neben Memantin als Mittel der ersten Wahl in der Behandlung der schweren Alzheimer-Demenz (MMSE 1 — 10) empfohlen. Eine Zulassung von Donepezil für die Indikation „schwere Alzheimer-Demenz“ durch die EMEA besteht derzeit allerdings nicht. Praxisrelevante Aspekte einer ChEITherapie ChEI sind laut österreichischem DemenzKonsensus als Langzeittherapie einzusetzen. Placebo-kontrollierte Studien liegen über Zeiträume bis zu einem Jahr vor. Mehrfach wurden Jahrgang 67 / 994a / 2013 fortbildung allerdings offene Extensionsstudien durchgeführt, die für eine Wirksamkeit auch über diese Zeitspanne hinweg sprechen — aus verschiedenen studientechnischen Gründen sind diese Ergebnisse jedoch mit Vorsicht zu beurteilen. Des Weiteren wird im besagten Konsensus festgehalten, dass Therapieunterbrechungen vermieden werden sollen bzw. ein Absetzen von ChEI bei einem MMSE ≤ 10 Punkten abzulehnen ist. Für Donepezil zeigten randomisierte Doppelblindstudien bei Patienten mit 1 — 10 Punkten im MMSE Verbesserungen von Kognition und Alltagsfunktionalität im Vergleich zu Placebo (Feldman et al., Winblad et al.) – gegenwärtig besteht allerdings keine europäische Zulassung bei schwerer Demenz. Daten für andere ChEI liegen zwar nicht vor, die Konsensuskonferenz-Teilnehmer gingen aber von einem Klasseneffekt auch bei schwerer AlzheimerDemenz aus. Der Versuch eines Präparatwechsels bei Unverträglichkeit wird laut Konsensus empfohlen, bei mangelnder Wirksamkeit sei er möglich und kann auch Sinn machen, da ChEI unterschiedliche pharmakologische Eigenschaften aufweisen. Für die Überlegenheit eines ChEI gegenüber einem anderen besteht keine eindeutige Evidenz. Zur Verbesserung der Compliance wird im österreichischen DemenzKonsensus die tägliche Einmalgabe von ChEI empfohlen. Darreichungsformen, Wirkstärken: Konkret ist Donepezil oral in Form einer Filmta­ blette sowie einer sich im Mund auflösenden Schmelztablette (jeweils in Wirkstärken von 5 bzw. 10 mg), Galantamin oral als Lösung zum Einnehmen (4 mg / ml) sowie als Retardkapsel (8 mg – 16 mg – 24 mg) und Rivastigmin oral als Hartkapsel bzw. ebenfalls als Schmelztablette (jeweils in Wirkstärken von 1,5, 3, 4,5 bzw. 6 mg) sowie transdermal als Pflaster (4,6 mg/24 Stunden – 9,5 mg/24 Stunden) verfügbar. Dosierungen: Für Donepezil wird die initiale Gabe von 1 x 5 mg/die (vorzugsweise abends) empfohlen, diese kann bei Bedarf nach einem Monat auf 1 x 10 mg/die gesteigert werden, die maximale Tagesdosis liegt bei 10 mg. Donepezil wurde bereits in den originalen Zulassungsverfahren in Einmalgabe angeboten. Die Schmelztablette ist entsprechend pharmakokinetischer Untersuchungen bioäquivalent zur Filmtablette und weist ein identes Einsatzgebiet auf. Galantamin sollte als Lösung zum Einnehmen initial in einer Dosierung von 2 x 4 mg Jahrgang 67 / 994a / 2013 (vorzugsweise zum Frühstück und Abendessen) eingenommen werden — diese Tagesdosis von 8 mg sollte über 4 Wochen beibehalten werden. Die anfängliche Erhaltungsdosis beträgt 16 mg/die (2 x 8 mg/die) — auch diese Dosis sollte über mindestens 4 Wochen beibehalten werden. Eine Titrierung auf 24 mg/die (2 x 12 mg/die) kann nach individueller Nutzen-Risiko-Abwägung erfolgen. Alternativ dazu steht Galantamin auch in einer oralen Retardform für die tägliche Einmalgabe (vorzugsweise morgens) zur Verfügung. Die Wirkdosen von 16 bzw. 24 mg/ die werden durch Hochtitrieren über initiale 8 mg/die in frühestens 4 bzw. 8 Wochen erreicht. Galantamin in Retardform war mit si­ gnifikanter Verbesserung am ADAS-Cog, aber nicht auf CIBICplus oder NPI-Score assoziiert — die Teilnehmer der Konsensuskonferenz sahen aber auch hier eine Übertragbarkeit der bisherigen Galantamin-Ergebnisse auf diese Darreichungsform. Eine orale Rivastigmin-Therapie (Hartkapsel, Schmelztablette) sollte in einer Dosierung von 2 x 1,5 mg/die begonnen und über mindestens 2 Wochen beibehalten werden, bevor eine Steigerung auf 2 x 3 mg/die erfolgt. Weitere Dosiserhöhungen auf 2 x 4,5 bzw. 2 x 6 mg/die sind nach Intervallen von ebenfalls mindestens je 2 Wochen möglich. Die maximale Tagesdosis liegt bei 2 x 6 mg. Einmal täglich kann Rivastigmin transdermal verabreicht werden – und zwar initial als 4,6 mg/24 Stunden-Pflaster. Nach einem Monat kann dann auf die empfohlene Erhaltungsdosis in Form eines 9,5 mg/24-Stunden-Pflasters aufdosiert werden. In der IDEAL-Studie erwies sich das 9.5 mg/24 Stunden-Pflaster als ähnlich wirksam wie eine orale Gabe von 2 x 6 mg/ die in Kapselform. Nebenwirkungen: Die Metaanalyse im bereits genannten Cochrane Review von J. Birks erbrachte Evidenz für eine insgesamt höhere Nebenwirkungsrate unter ChEI-Therapie im Vergleich zu Placebo – signifikant häufiger wurde dabei über Übelkeit/Erbrechen bzw. Diarrhoe berichtet. Unter Donepezil wurden vergleichsweise weniger Nebenwirkungen beobachtet – laut Birks könnte aber bei vorsichtiger schrittweiser Titration von Galantamin bzw. Rivastigmin über mehr als 3 Monate hinweg eine mit Donepezil vergleichbare Verträglichkeit zu erzielen sein. Eine demgegenüber raschere Dosistitration sei bei Donepezil zwar möglich, die niedrige Einstiegsdosierung verdiene aber dennoch eine ausreichende thera- peutische Beachtung. Der Devise „Start low, go slow“ – also Beginn mit der niedrigsten Dosis und langsame schrittweise Titration unter Beachtung von Wirkung und unerwünschten Effekten – zur Minimierung von Nebenwirkungen schlossen sich auch Rodda und Carter in ihrem Review an. Darüber hinaus dürften auch verschiedene Darreichungsformen zur täglichen Einmalgabe diesbezüglich vorteilhaft sein. So erwies sich im Falle von Galantamin die tägliche Einmalgabe der Retardform in den Dosierungen 16 bzw. 24mg/Tag hinsichtlich Verträglichkeit und Sicherheit zwar ähnlich jener der Zweimalgabe, allerdings berichteten Dunbar et al. in einer Post-hoc-Analyse über einen signifikant geringeren Einsatz von Antiemetika unter der Retardform. Was die transdermale Applikation von Rivastigmin betrifft, so war in der IDEALStudie die Nebenwirkungsrate beim 9,5mg/24Stunden-Pflaster nahezu ident zur Placebogruppe und signifikant niedriger als bei jenen Patienten, die Kapseln erhielten. Zudem war die Hautverträglichkeit des Pflasters im Allgemeinen gut. Zusammenfassend zählen also Übelkeit/Erbrechen, Durchfall, Abdominalschmerz, Ano­ rexie oder Schwindel zu den häufigen ChEINebenwirkungen – deren Auftreten lasse sich aber laut Rodda und Carter gewöhnlich durch vorsichtige Dosistitration minimieren bzw. durch Dosisreduktion beherrschen. Darüber hinaus sahen Kim et al. in ihrer Metaanalyse unter ChEI ein erhöhtes Risiko für Synkopen (OR 1,53), nicht hingegen für Stürze. Schwere kardiovaskuläre Nebenwirkungen sind laut Rowland et al. nach Durchsicht der vorhandenen Datenlage selten. Eine Bradykardie wird als gelegentlich auftretend beschrieben. Rodda und Carter empfahlen regelmäßige Pulskontrollen, wenngleich es für die Intervalle dieses Monitorings noch keine klaren Daten gäbe – Rowland et al. sahen in ihrem Protokoll während Dosistitration monatliche und danach halbjährliche Kontrollen vor. Für ein generelles EKG-Monitoring vor Therapiebeginn sahen Rowland et al. hingegen keine Evidenz. Als absolute Kontraindikation gilt bei allen drei Substanzen die Überempfindlichkeit gegenüber der Wirksubstanz, oder einen der sonstigen Inhaltsstoffe sowie bei Donepezil bzw. Rivastigmin eine solche gegenüber Piperidin- bzw. Carbamat-Derivaten. Nachdem keine Daten über die Anwendung von Galantamin bei Patienten mit schweren Leber- (Child-Pu- ARZT & PRAXIS 21 22 fortbildung gh-Score > 9) bzw. Nierenfunktionsstörungen (Kreatinin-Clearance < 9 ml/min.) vorliegen, ist Galantamin bei diesen Personen kontraindiziert – ebenso wie bei Patienten mit sowohl signifikanten Nieren- als auch Leberfunktionsstörungen. Eine Vorgeschichte mit Reaktionen an der Anwendungsstelle als Hinweis auf eine allergische Kontaktdermatitis mit Rivastigmin-Pflastern stellt ebenfalls eine Kontraindikation dar. Vorsicht ist durch direkte cholinerge Effekte oder einen erhöhten Vagotonus in verschiedenen Situationen geboten. So etwa bei Sick-Sinus-Syndrom oder anderen supraventrikulären Störungen des Herzreizleitungssystems (z.B. SA-, AV-Block), Asthma/COPD, erhöhtem Ulkusrisiko (positive Ulkus-Anamnese, NSAR-Therapie) sowie Harnretention. Wenngleich es laut Rodda und Carter potentielle Synergien zwischen ChEI und Substanzen mit Herzfrequenz-verlangsamender Wirkung (z.B. Digitalis, Betablocker) gäbe, so bestehe dennoch keine Indikation für deren routinemäßiges Absetzen vor dem Beginn einer ChEITherapie. Darüber hinaus besitzen alle ChEI das Potential, anticholinerg wirkende Arzneimittel zu beeinflussen. Zudem kann unter Narkose mit einer Wirkverstärkung der Muskelrelaxantien vom Succinylcholintyp gerechnet werden. Memantin bei Alzheimer-Demenz Memantin wird im österreichischen DemenzKonsensus bei Patienten mit mittelschwerer Alzheimer-Demenz (MMSE 11 — 19) sowie bei Unverträglichkeit oder mangelnder Wirksamkeit von ChEI bei Patienten mit leichter bis mittelschwerer Alzheimer-Demenz (MMSE 11 — 22) empfohlen. Darüber hinaus wird es im gleichen Konsensus als Mittel der ersten Wahl neben Donepezil in der Behandlung der schweren Alzheimer-Demenz (MMSE 1 — 10) genannt. Eine Zulassung besteht in Österreich für die symptomatische Behandlung von mittelschwerer bis schwerer Alzheimer-Demenz. McShane et al. beschrieben in ihrem Cochrane Review moderate Benefits hinsichtlich Kognition, Alltagsfunktion, Verhalten und globalem klinischem Eindruck bei Patienten mit moderater bis schwerer Alzheimer-Demenz nach 6 Monaten. Bei milder bis moderater Erkrankung war hingegen nur ein marginaler positiver Effekt auf die Kognition zu beobachten. Hinsichtlich der Kombinationstherapie mit ChEI wird im österreichischen Konsensus festgehalten, dass eine solche bei Patienten mit ARZT & PRAXIS mittelschwerer bis schwerer Alzheimer-Demenz (MMSE 5 — 14) anzustreben sei. So konnten etwa Tariot et al. eine Überlegenheit der Kombination aus Memantin und Donepezil gegenüber einer Monotherapie mit Donepezil hinsichtlich Kognition, Alltagsfunktion und globalem klinischem Eindruck feststellen. Für eine Kombination mit Rivastigmin bestehen ebenfalls Daten (Dantoine et al., Lopez et al.) zur überlegenen Wirksamkeit gegenüber einer Monotherapie mit diesem ChEI. In einer weiteren Studie (Atri et al.) konnte der positive Effekt einer Kombinationstherapie gegenüber der alleinigen Verwendung von ChEI über einen mehrjährigen Zeitraum belegt werden. Praxisrelevante Aspekte einer Memantin-Therapie Darreichungsformen, Wirkstärken: Memantin steht oral in Form einer Filmtablette (5 mg — 10 mg — 15 mg — 20 mg) oder einer Lösung (5 mg / Pumpenhub) zur Verfügung. Dosierung: Initial sollte mit einer Dosierung von 1 x 5 mg/die (zur jeweils gleichen Zeit) begonnen und diese in jeweils wöchentlichen Abständen über 1 x 10 bzw. 1 x 15 mg/die auf die empfohlene Erhaltungsdosis von 1 x 20 mg/die gesteigert werden. Nebenwirkungen: Wie Rodda und Carter ausführten, seien die Nebenwirkungen von Memantin verglichen mit jenen unter ChEI seltener und weniger ausgeprägt – so sahen etwa McShane et al. in ihrem Cochrane Review unter Memantin Therapieabbruchraten auf Placeboniveau. Als häufig auftretende Nebenwirkungen gelten Obstipation, erhöhter Blutdruck, Kopfschmerz, Schwindel und Schläfrigkeit. Einzige absolute Kontraindikation stellt eine Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile dar. Wenngleich bei Patienten mit Epilepsie, Krämpfen in der Anamnese oder prädisponierenden Faktoren dafür Vorsicht geboten ist, so wurde der Effekt von Memantin auf die Anfalls-Aktivität nie systematisch untersucht und tierexperimentelle Studien sprechen sowohl für pro- als auch antikonvulsive Effekte, welche über das NMDA-Rezeptorsystem mediiert werden. Einsatz bei weiteren Demenzformen Vaskuläre Demenz: Im österreichischen Demenz-Konsensus wurden Donepezil und Me- mantin als Mittel der ersten Wahl bei vaskulären Demenzen empfohlen. Allerdings werde der globale klinische Eindruck nicht beeinflusst. Galantamin könne mit geringerer Zuverlässigkeit empfohlen werden und sei wahrscheinlich auch bei Mischformen der Demenz effektiv – weitere Studien zu den häufigen Mischformen wurden dabei dringlich angeregt. Rivastigmin könne mit niedrigerer Zuverlässigkeit empfohlen werden, auch bestünde für Mischformen der Demenz eine geringere Evidenz für die Wirksamkeit. Demenz mit Levy-Körperchen: Laut Konsensus zu empfehlen sei Rivastigmin bzw. mit niedrigerer Zuverlässigkeit Donepezil, wobei diesem Statement nur Fallstudien zugrunde lagen. Parkinson-assoziierte Demenz: Als Mittel der ersten Wahl wird im Konsensus Rivastigmin empfohlen – in Österreich ist diese Substanz für die Behandlung einer leichten bis mittelschweren Demenz bei idiopathischem Parkinson-Syndrom zugelassen. Als Mittel zweiter Wahl werden Donepezil und Memantin angegeben. Frontotemporale Degenerationen: ChEI sind gemäß Konsensus nicht zu empfehlen, Memantin stelle hingegen eine Second-LineOption dar. Einsatz bei nicht-kognitiven Symptomen ChEI wurden von den Teilnehmern der österreichischen Konsensuskonferenz in der Behandlung von Verhaltensauffälligkeiten und psychotischen Symptomen als wirksam angesehen und daher in dieser Indikation empfohlen. Allerdings würde eine Monotherapie oft nicht ausreichen und in solchen Fällen eine Kombination mit Antipsychotika erforderlich machen. Memantin wurde im Konsensus in der Behandlung von Verhaltensauffälligkeiten insbesondere für Aggression bzw. Agitiertheit als wirksam angesehen und dementsprechend in dieser Indikation empfohlen. –mb– ♦ Literatur: [1] Rodda J, Carter J: Cholinesterase inhibitors and memantine for symptomatic treatment of dementia; BMJ 2012; 344: e2986 [2] Schmidt R et al.: Konsensusstatement „Demenz 2010” der Österreichischen Alzheimer Gesellschaft; Neuropsychiatrie 2010; 24 (2): 67 — 87 Jahrgang 67 / 994a / 2013 fortbildung Depression – differenziertere und verträglichere Therapie durch neuere Substanzen Das Zeitalter der neueren Antidepressiva hat mit der Einführung der selektiven Serotonin-Wiederaufnahmehemmer (SSRI) begonnen. Inzwischen sind zahlreiche weitere Substanzen mit unterschiedlichsten Wirkungen auf verschiedene Neurotransmittersysteme verfügbar. Dieses breiter gewordene Spektrum hat die differentialtherapeutischen Möglichkeiten erweitert unter gleichzeitigen Verbesserungen von Sicherheitsprofil und Verträglichkeit. Im rezent publizierten österreichischen Konsensus-Statement zur medikamentösen Therapie der Depression [1] hielten die Vorsitzenden o. Univ.-Prof. Dr. h.c. mult. Dr. Siegfried Kasper und Prim. Univ.-Prof. DDr. Michael Lehofer in ihrem Vorwort dazu fest: „Nach wie vor zählen Depressionen nicht nur zu den häufigsten Erkrankungen der Psychiatrie, sondern werden auch bei verschiedenen organmedizinischen Erkrankungen, z.B. kardiovaskulären Erkrankungen, neuroendokrinologischen Erkrankungen, rheumatischen Erkrankungen, und in der Onkologie beobachtet. In den 90er-Jahren hat sich durch die Einführung moderner Therapieprinzipien, die vorwiegend durch die selektiven Serotonin-Wiederaufnahmehemmer (SSRI) gegeben waren, eine therapeutische Akzeptanz von Antidepressiva entwickelt, die in den letzten zehn Jahren noch verfeinert wurden. Insbesondere hinsichtlich des Nebenwirkungsprofils haben sich dabei deutliche Fortschritte ergeben.“ Wesentliche Aussagen aus diesem Konsensus-Statement werden in der Folge zusammengefasst. Antidepressiver Therapiealgorithmus Eine sorgfältige Diagnosestellung umfasst insbesondere den Ausschluss anderer Pathologien mit unterschiedlichem therapeutischen Zugang wie Dysthymie, bipolare Depression, Angststörung, somatoforme Störung, schizodepressive Episode, depressives Syndrom bei Schizophrenie, organischer oder Suchterkrankung. Im Rahmen eines verständnisvollen, stützenden ärztlichen Gespräches erfolgt daraufhin die Erstellung eines Gesamtbehandlungsplanes. Der Schwerpunkt der Therapiemaßnahmen orientiert sich dabei am syndromalen klinischen Zustandsbild bzw. am Depressions-Subtyp. Jahrgang 67 / 994a / 2013 Die WFSBP(World Federation of Societies of Biological Psychiatry)-Guidelines sehen hinsichtlich medikamentöser Behandlung folgenden Therapiealgorithmus vor: • Therapiebeginn mit einem Antidepressivum in Monotherapie • Bei partiellem Ansprechen oder Non-Re­ sponse nach 2 – 4 Wochen Therapie: Optimierung der Dosis (Dosiserhöhung) • Bei weiterem mangelndem Ansprechen: Kombination zweier Antidepressiva mit unterschiedlicher Pharmakodynamik Augmentationsstrategien (Kombination mit einer anderen Klasse von Medikamenten – z.B. atypischen Antipsychotika, modernen Hypnotika bzw. Stimmungsstabilisierern wie etwa Lithium) Wechsel zu einem neuen Antidepressivum derselben oder einer anderen Klasse Akutbehandlung: Die Monotherapie mit einer antidepressiven Substanz ist zu Beginn einer Behandlung grundsätzlich einer Kombinationsbehandlung vorzuziehen. Kann damit kein Erfolg erzielt werden, erscheint die Kombination zweier Antidepressiva mit unterschiedlichem Wirkmechanismus aufgrund der vorliegenden Daten günstiger als der Wechsel auf ein anderes Antidepressivum. Hochselektive 5-HT2a-Rezeptorantagonisten wie z.B. Trazodon oder Mirtazapin tragen zu einer Verbesserung der antidepressiven Eigenschaften bei einer gleichzeitigen Gabe mit SSRI bei. Bei Bestehen psychotischer Symptome ist die Kombination eines Antidepressivums mit einem atypischen Antipsychotikum zu empfehlen. Nach der Akutbehandlung einer ersten depressiven Episode sollte die weitere medikamentöse Behandlungsdauer im Sinne einer Erhaltungstherapie etwa 4 — 6 Monate ab dem Zeitpunkt der Remission betragen. Danach kann die Medikation langsam ausgeschlichen werden, wenn keine Indikation für eine pro- phylaktische Therapie besteht. Phasenprophylaxe: Bei unipolaren Depressionen soll nach dem Abklingen der depressiven Symptomatik im Sinne eines Rückfallschutzes etwa 9 — 12 Monate mit jenem Antidepressivum weiterbehandelt werden, das zum Abklingen der Symptomatik geführt hat (Erhaltungstherapie). Die Dosis soll jener der Akutbehandlung entsprechen – eine Dosisreduktion erhöht das Rezidiv-Risiko. Eine prophylaktische Langzeittherapie über Jahre (oder lebensbegleitend) zur Verhinderung neuer depressiver Episoden kann bei Patienten mit komplexen Verläufen angezeigt sein – zur Langzeitbehandlung eignen sich alle neueren Antidepressiva. Fachärztliche bzw. stationäre Therapie: Patienten mit einer schweren Depression, psychotischen Symptomen oder Suizidalität sollten fachärztlich-psychiatrisch behandelt werden bzw. ist bei Vorliegen einer mittelschweren oder schweren Depression (insbesondere mit folgenden Risikofaktoren: Suizidgefahr, psychotische Symptomatik, Therapieresistenz, signifikante soziale oder berufliche Funktionsstörungen) eine stationäre Behandlung indiziert. Dies gilt ebenso bei Komorbiditäten wie Sucht- bzw. anderen psychiatrischen sowie relevanten somatischen Erkrankungen. Auch die Art der Behandlung kann eine Indikation zur stationären Aufnahme darstellen (z.B. Elektrokrampftherapie). Auswahlkriterien für Antidepressiva Klinisch effektive und in Österreich für die Indikation „Depression“ zugelassene neuere Antidepressiva sind der Tabelle 1 zu entnehmen. Da die klinische Wirksamkeit sowohl zwischen den Substanzgruppen als auch innerhalb dieser Gruppen statistisch vergleichbar ist, erfolgt die Auswahl des Antidepressivums nach syndromalen Kriterien, Nebenwirkungs- ARZT & PRAXIS 23 24 fortbildung Substanz Präparate Startdosis (mg/Tag) Dosisbereich (mg/Tag) Standardtagesdosis (mg) Selektive Serotonin-Wiederaufnahmehemmer (SSRI) Citalopram Seropram® div. Generika 20 20 – 40 20 Fluoxetin Fluctine® div. Generika 20 20 – 80 20 Fluvoxamin Floxyfral® 50 100 – 300 100 Paroxetin Seroxat div. Generika 20 20 – 50 20 Sertralin Gladem® Tresleen® div. Generika 50 50 – 200 50 10 10 – 20 10 60 – 120 60 ® Allosterischer Serotonin-Wiederaufnahmehemmer (ASRI) Escitalopram Cipralex® Serotonin- und Noradrenalin-Wiederaufnahmehemmer (SNRI) Duloxetin Cymbalta® 60 Milnacipran Ixel 50 100 100 Venlafaxin Efectin® div. Generika 50 75 – 375 100 37,5 37,5 37,5 Remeron® div. Generika 30 15 – 45 30 Edronax® 4 4 – 10 8 300 300 – 600 300 50 75 – 600 200 Wellbutrin® dzt. ein Genericon 150 150 – 300 150 Agomelatin Valdoxan® 25 25 – 50 25 Mianserin Tolvon div. Generika 30 30 – 90 60 ® Glutamat-Modulator (GM) Tianeptin Stablon® Noradrenalin- und Serotonin-spezifisches Antidepressivum (NaSSA) Mirtazapin Noradrenalin-Wiederaufnahmehemmer (NARI) Reboxetin Reversibler Monoaminooxidase-A-Hemmer (RIMA) Moclobemid Aurorix® Serotonin-5-HT2-Antagonist und -Wiederaufnahmehemmer (SARI) Trazodon Trittico® Noradrenalin- und Dopamin-Wiederaufnahmehemmer (NDRI) Bupropion Andere Antidepressiva ® Tab. 1: Klinisch effektive und in Österreich zur Behandlung der Depression zugelassene neuere Antidepressiva – modifiziert nach (1) profil und möglichen Wechselwirkungen, der individuellen Verträglichkeit (Alter, Komorbidität, Verkehrstauglichkeit), den Vorerfahrungen und Erwartungen des Patienten sowie den Vorerfahrungen des Arztes, der aktuellen wissenschaftlichen Datenlage bzw. der Applikationsform. Differentialtherapeutische Überlegungen Die Rezeptorprofile der einzelnen Substanzen ARZT & PRAXIS weisen sowohl auf spezifische Wirkprofile als auch auf mögliche Nebenwirkungen hin. Den folgenden Neurotransmitter-Systemen werden differenzierte Wirkungen zugeordnet: • Serotonin (5-HT): Regulation von Appetit und Schlaf, Vorteile bei komorbiden Angstund Zwangssymptomen, Impulskontrolle • Noradrenalin (NA): Aktivität • Dopamin (DA): Therapie der anergischen Depression, Kognition • Histamin (H): Appetit • Melatonin (M): Regulation des Schlaf-Wach-Rhythmus Die Nebenwirkungen stehen in folgendem Zusammenhang: • Serotonin (5-HT): gastrointestinale Beschwerden, sexuelle Störungen • Noradrenalin (NA): Unruhe, kardiale Nebenwirkungen • Anticholinerg (mACH): Mundtrockenheit, kognitive Störungen, Prostatahypertrophie, Miktionsbeschwerden, Herzleistungsstö- Jahrgang 67 / 994a / 2013 Fachkurzinformationen siehe Seite 19 26 t h e m e n h e f t n e u r o lo g i e • p sy c h i at r i e Substanz Anticholinerge Wirkung Übelkeit/Erbrechen/ Diarrhoe Sedierung Agitation/ Schlafstörungen Sexuelle Funktionsstörungen 0 ++ 0 + + Citalopram 0 ++ 0 + + Fluoxetin 0 ++ 0 ++ ++ Paroxetin + ++ 0 + ++ Sertralin 0 ++ 0 ++ + Duloxetin 0* ++ 0 + 0 Milnacipran 0* + 0 + 0 Venlafaxin ret. 0* ++ 0 + + 0 + 0 0 0 0 0 ++ 0 0 0 + ++ 0 0 0* + 0 ++ + 0 0 0 ++ 0 0 0 0 + 0 0 + 0 0 0 ASRI Escitalopram SSRI SNRI GM Tianeptin NaSSA Mirtazapin SARI Trazodon NARI Reboxetin NDRI Bupropion RIMA Moclobemid Andere Agomelatin 0 = keine Wirkung, + = geringe Wirkung, ++ = moderate Wirkung, +++ = starke Wirkung * Pseudoanticholinerge, noradrenerge Wirkung wie z.B. Mundtrockenheit, Obstipation, Schwitzen ** Nur in Depressionsstudien mit Kapseln, bei anderen Indikationen und Tabletten nicht vorgekommen Tab. 2: Nebenwirkungsprofil neuerer Antidepressiva – modifiziert nach (1) rungen, Glaukom, Verschwommensehen • Histamin (H) : Gewichtszunahme, Sedierung • Serotonin-2-Blockade (5-HT2): Sedierung • α1-Blockade: orthostatische Hypotension Zum Nebenwirkungsprofil neuerer Antidepressiva gibt Tabelle 2 Auskunft. Metabolismus: Ein Großteil der Antidepressiva wird sehr stark hepatisch über das Cytochrom-P-450-Enzymsystem metabolisiert – von Bedeutung sind vor allem die Isoenzyme CYP3A4, 2D6, 2C19 bzw. 1A2. Für das Auftreten klinisch relevanter Wechselwirkungen ist dabei entscheidend, ob ein Pharmakon nur als Substrat eines Cytochroms ARZT & PRAXIS ab- bzw. umgebaut wird oder ob es dieses auch hemmt (Inhibitoren) bzw. induziert (Induktoren). So bewirkt zum Beispiel die gleichzeitige Verabreichung von Fluoxetin, einem sehr starken Inhibitor von CYP2D6, und des trizyklischen Antidepressivums Amitriptylin eine massive Steigerung des Plasmaspiegels des Trizyklikums. Mit einem verstärkten Auftreten von anticholinergen, sedierenden und kardiotoxischen Nebenwirkungen muss daher gerechnet werden. Auch Paroxetin hemmt sehr stark CYP2D6 und in Kombinationen mit Betablockern ist auf Bradykardien zu achten. Wenn auch viele Vertreter der neueren Antidepressiva nur Substrate sind, so ist doch bei der gleichzeitigen Verabreichung von Indukto- ren wie Phenytoin, Carbamazepin bzw. Hypericin auf unzureichende Wirkkonzentrationen zu achten. In der Kombination eines neueren Antidepressivums mit Inhibitoren wie Clarithromycin, Ketokonazol, Verapamil, Cimetidin bzw. Omeprazol ist hingegen auf eine Erhöhung der Plasmaspiegel bis in den toxischen Bereich (Kumulierung) und ein verstärktes Auftreten von klinisch sichtbaren unerwünschten Arzneimittelwirkungen zu achten. Auch Nahrungsmittel können das Enzymsystem blockieren. So ist etwa Grapefruitsaft ein starker CYP3A4-, aber auch CYP1A2-Inhibitor und sollte genauso wie Rotwein (CYP1A2-, 3A4-Inhibitor) nicht gleichzeitig mit entspre- Jahrgang 67 / 994a / 2013 t h e m e n h e f t n e u r o lo g i e • p sy c h i at r i e Substanz Orthostatische Hypotonie Gewichtszunahme EKGVeränderungen Thrombozytenaggregationshemmung 0 0 0 ++ Citalopram 0 0 0 ++ Fluoxetin 0 0 0 ++ Paroxetin 0 0/+ 0 ++ Sertralin 0 0 0 ++ Duloxetin 0 0 0 0 Milnacipran 0 0 0 0 Venlafaxin ret. 0 0 +** 0 0 0 0 0 + ++ 0 0 + 0 0 0 ASRI Escitalopram SSRI SNRI GM Tianeptin NaSSA Mirtazapin SARI Trazodon NARI Reboxetin ++ 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 NDRI Bupropion RIMA Moclobemid Andere Agomelatin Tab. 2: Nebenwirkungsprofil neuerer Antidepressiva – modifiziert nach (1) (Fortsetzung) chenden Arzneimitteln genommen werden. Für einige CYP-Enzyme existieren genetisch bedingte Aktivitätsunterschiede: So sind bezüglich CYP2D6 etwa 7 — 10 % der mitteleuropäischen Bevölkerung „poor metabolizer“ mit fehlender oder reduzierter Funktion bzw. rund 2 % „ultrarapid metabolizer“ mit gesteigerter Enzymaktivität. Menschen mit anderer ethnischer Herkunft können deutlich häufiger „ultra­rapid metabolizer“ sein. Tianeptin und Milnacipran werden nicht über die CYP-Enzyme metabolisiert und haben daher bei Multimedikation ein geringeres Wechselwirkungspotential mit anderen Pharmaka. Da Fluvoxamin, Milnacipran, Mirtazapin, Sertralin und Venlafaxin zum Großteil über die Jahrgang 67 / 994a / 2013 Niere ausgeschieden werden, sollte bei stark eingeschränkter Nierenfunktion eine Dosisreduktion vorgenommen werden. Im Umkehrschluss erscheint etwa Milnacipran als sinnvolle Therapieoption bei Patienten mit eingeschränkter hepatischer Funktion. Sedierung: Da die Sedierung hauptsächlich auf einer Blockade der 5-HT2-, α1-adrenergen und Histamin-H1-Rezeptoren beruht, ist diese bei den meisten neuen Substanzen wie den SSRI nicht gegeben, vielmehr kann es sogar zu Schlafstörungen (Insomnie) kommen. Ist eine sedierende bzw. schlaffördernde Wirkung gewünscht, so kommen Mirtazapin und Trazodon unter den neueren Antidepressiva infrage. Bei Mirtazapin ist eine initial sedierende Wir- kung, die allerdings nach einer etwa zweiwöchigen Gabe abnimmt (Adaptationseffekt), bekannt. Der Sedierungseffekt dieser Substanz ist wegen der sequenziellen dosisgebundenen Rezeptorbindung bei niedriger Dosierung deutlicher als bei höherer. Auch bei Trazodon nimmt die sedierende Wirkung nach der Anfangsphase (ca. 14 Tage) ab und kann durch die empfohlene langsame initiale Dosissteigerung minimiert werden. Im Unterschied zu Mirtazapin kommt es bei Trazodon zu keiner Gewichtszunahme oder Appetitsteigerung. Das melatonerge Antidepressivum Agomelatin führt aufgrund seiner Wirkungen an den MT1/MT2- und 5-HT2c-Rezeptoren zu einer Wiederherstellung des Schlaf-Wach-Rhythmus. Für Agomelatin wurden mehrfach in Studien eine rasche Verbesserung der Schlafqualität, eine Zunahme der Tiefschlafphasen und keine Beeinflussung des Leichtschlafes bei gleichzeitiger Verbesserung der Tageswachsamkeit gezeigt. Empfehlungen zur Dosierung Die individuelle Dosierung hängt von Indikationsstellung, Therapiephase (Beginn, Ausschleichen), optimaler Verabreichungsform und Halbwertszeit ab. Bei Antidepressiva kann der Wirkeintritt mit einer Latenzzeit von mindestens 2 Wochen erwartet werden – am Beginn der Therapie empfiehlt es sich daher, eine Standarddosis (= jene Dosis mit der optimalen Wirkungs-Nebenwirkungs-Relation) zu verwenden. Bei unangenehmen Nebenwirkungen wird eine reduzierte, bei mangelndem Therapieerfolg nach 2 Wochen eine erhöhte Dosis verordnet. Bei einigen wenigen Substanzen wird eine Dosis-Wirkungs-Beziehung diskutiert. Auch angesichts der nicht irrelevanten Prozentsätze an „poor“ und „ultrarapid metabolizern“ ist bei Therapieresistenz an ein Therapeutic Drug Monitoring zu denken. –mb– ♦ Literatur: [1] Kasper S, Lehofer M: Depression – Medikamentöse Therapie / Konsensus-Statement – State of the art 2012; CliniCum neuropsy, Sonderausgabe November 2012 ARZT & PRAXIS 27 Fachkurzinformation siehe Seite 19