Blut
Werbung

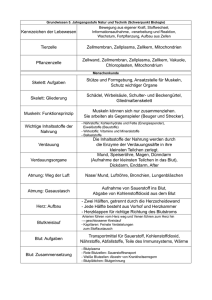
V. Blut Blut Voraussetzungen Kenntnisse über - Zusammensetzung des Blutes, - Funktionen der zellulären und nichtzellulären Blutbestandteile, - Aufbau und Funktionen des Hämoglobins, - Blutsenkung, - Blutstillung und Gerinnung, - Blutgruppeneigenschaften. Inhaltsübersicht 1. Blutentnahme 2. Blutkörperchensenkungsgeschwindigkeit (BSG) 3. Rotes Blutbild 4. Blutstillung 5. Blutungszeit 6. Differentialblutbild 7. Blutgruppen Organisatorische Vorbemerkung a) Blut ist grundsätzlich als potentiell infektiöses Material zu betrachten. Sie sollen deshalb die umseitig aufgeführten Verhaltensregeln vor Praktikumsbeginn verinnerlichen und - in Ihrem eigenen Interesse - strikt einhalten (nicht nur im Physiologie-Praktikum, sondern immer, wenn Sie mit Blut zu tun haben!). b) Sie werden zu Beginn des Praktikums in 2 Gruppen eingeteilt. Gruppe 1 bearbeitet zuerst folgende Aufgaben: 1) Venenpunktion / Blutentnahme 2) Blutsenkung 3) rotes Blutbild 4) Blutstillung / Gerinnung Gruppe 2 beschäftigt sich währenddessen mit folgenden Themen: 5) Blutungszeit 6) Differentialblutbild 7) Blutgruppen Nach ca. 90 Minuten wechseln die Gruppen die Aufgaben. c) Die Ergebnisse werden im Protokollblatt notiert (s. Anhang). 1 V. Blut Verhaltensregeln für das Arbeiten mit menschlichem Blut zur Verhinderung von Infektionen mit HIV und HBV - Prinzipiell sollte jedes Blut (bzw. sämtliche Blutbestandteile wie Serum, Plasma, u.a.) als potentiell infektiös angesehen werden, ebenso Samenflüssigkeit, Vaginalsekret, Liquor, Gelenksflüssigkeit, Pleura-, Perikard-, Peritonealflüssigkeit (Aszites), Fruchtwasser und alle Gewebe. Andere Ex- und Sekrete (Harn, Stuhl, Speichel, Nasensekret, Tränen, Erbrochenes) haben - außer wenn sichtbare Blutbeimengungen enthalten sind - für die Übertragbarkeit von HIV (human immunodeficiency virus; Erreger von AIDS) und HBV (Hepatitis-B-Virus) eine geringere Bedeutung. (Natürlich können Harn, Stuhl, Speichel, etc. mit anderen Erregern kontaminiert und hoch infektiös sein, so dass auch für das Arbeiten mit diesen Materialien entsprechende Schutzmaßnahmen erforderlich sind.) - Alle Personen, die mit Blut bzw. potentiell infektiösen Körperflüssigkeiten (in der Folge nur "Blut" genannt) arbeiten, sollten gegen Hepatitis B geimpft sein. Schutzmaßnahmen bei Gefahr von Blutkontakt, Handschuhe verwenden Handschuhe nicht desinfizieren (oder mit Seife waschen), sondern ggf. wechseln bzw. nach Gebrauch verwerfen nach dem Ausziehen der Handschuhe, Hände waschen nicht mit dem Mund pipettieren besondere Vorsicht bei der Verwendung von Pasteurpipetten (hohe Verletzungsgefahr durch [häufig vorkommenden] Glasbruch) Kittel oder andere Schutzkleidung benutzen Mund-Nasen-Schutz und Brille verwenden, wenn mit dem Verspritzen von Blut gerechnet werden muss; unter besonderen Umständen (Möglichkeit des Verspritzens größerer Volumina, z.B. bei Sektionen) auch flüssigkeitsdichte Schutzkleidung beim Ab- und Umfüllen von Blut darauf achten, dass die Außenseite des Gefäßes (Röhrchen usw.) nicht kontaminiert wird Nadeln und Skalpelle nie in die Hülle zurückstecken (häufigste Ursache für Verletzungen!), sondern unmittelbar in einem stichfesten und verschließbaren Behälter entsorgen bei bereits vorher sichtbaren Verletzungen oder größeren Läsionen (Ekzeme o.ä.) an den Händen möglichst nicht mit Blut arbeiten (bzw. nur unter speziellen Schutzmaßnahmen [Schutzverband, 2 Paar Handschuhe, etc.]) verspritztes oder verschüttetes Blut mit Einmalwischtuch entfernen (Handschuhe!), anschließend entsprechende Flächendesinfektionen durchführen Verhalten bei Zwischenfällen Maßnahmen bei Kontakt der Haut mit Blut: sofort unter fließendem Wasser gründlich abspülen und anschließend mit Wasser und Seife waschen mit Einmalhandtuch abtrocknen viel Haut-Desinfektionsmittel mindestens 30 Sekunden lang einwirken lassen (und danach nicht sofort mit Wasser abspülen) 2 V. Blut Maßnahmen bei Kontakt der Schleimhaut mit Blut: Schleimhäute (Mund, Augen) sofort und ausgiebig mit Wasser spülen (evtl. auch mit einem Schleimhaut verträglichen Desinfektionsmittel) Maßnahmen bei Verletzungen (Nadelstiche, Schnittwunden): Blutung induzieren, d.h. Wunde sofort und ausreichend lange (mehrere Minuten) auspressen und mit Haut-Desinfektionsmittel (evtl. auch Wasser) „ausschwemmen“ (auch bei Schmerzen) falls es sich um HIV-positives Blut handelt, mit dem die Kontamination bei der Verletzung erfolgte, ist eventuell eine Einnahme von AZT (Retrovir) angezeigt. Dafür ist eine sofortige Kontaktaufnahme mit der nächstgelegenen Notfallaufnahme erforderlich, da diese Maßnahme nur sinnvoll ist, wenn sie möglichst rasch begonnen wird in allen Fällen sollte möglichst bald Kontakt mit einem mit der Problematik befassten Arzt des Vertrauens aufgenommen werden, um zu besprechen, ob weitere Maßnahmen (z.B. HBV- oder HIV-Antikörperteste, Hepatitis-B-Impfung usw.) erforderlich sind um eventuelle Ansprüche an die Versicherung zu wahren, muss jeder Zwischenfall sorgfältig dokumentiert werden 3 V. Blut 1. Blutentnahme Sie haben im Laufe des Blutpraktikums die Gelegenheit, eine Venenpunktion an einer Kommilitonin/einem Kommilitonen vorzunehmen. Dies darf nur unter Aufsicht erfolgen. Praktikumsteilnehmer, die an einer parenteral übertragbaren Infektionskrankheit (z.B. Hepatitis, AIDS) leiden oder jemals litten, dürfen nicht punktiert werden. Durchführung: a) Material bereitlegen: Stauschlauch, Desinfektionsmittel, sterile Kanülen, sterile Blutröhrchen, Tupfer, Heftpflaster b) Lagerung: Patient sitzend oder liegend, Arm gestreckt; „Arzt“ sitzt so, dass er entspannt in Richtung des venösen Blutstroms einstechen kann c) Stauschlauch proximal der Punktionsstelle anlegen, der arterielle Puls muss dabei tastbar bleiben d) Kubitalvene tasten; falls nicht möglich, andere, tastbare Vene suchen (Radiuskopf, Handrücken; ggf. anderer Arm) (Unterscheidung zwischen Vene und Arterie: Puls; Unterscheidung zwischen Vene und Nerv bzw. Sehne: Vene verschwindet nach Lösen der Stauung) e) Punktionsstelle mit Desinfektionsmittel einsprühen, danach nicht mehr berühren, nicht abwischen, sondern einwirken lassen f) währenddessen Kanüle, evtl. Adapter und Blutröhrchen zusammenstecken, Öffnung der Kanüle muss mit der Anschliffseite nach oben zeigen; falls versehentlich das Metallteil der Kanüle berührt wird, Kanüle verwerfen g) Haut im Winkel von ca. 30° durchstechen, dann die Venenwand flach punktieren, Kanüle ca. 1 cm in die Vene vorschieben h) Blut mit wenig Sog entnehmen (1 rote [mit EDTA-Zusatz], 1 grüne [mit Citrat-Zusatz] und 1 violette Monovette [mit Citrat-Zusatz]), letztes Röhrchen von der Kanüle trennen (grüne Monovette sogleich 10 min zentrifugieren) i) Stauschlauch lösen, Kanüle rasch herausziehen und sofort in bereitgestellten Behälter werfen; trockenen Tupfer auf die Punktionsstelle drücken, Arm bleibt gestreckt; wenn die Blutung steht, Heftpflaster aufkleben 2. Blutkörperchensenkungsgeschwindigkeit (BSG; violette Monovette) Da Erythrozyten schwerer als Plasma sind, sedimentieren sie, d.h. sie sinken im nichtströmenden Blut ab. Die Senkung beträgt unter den üblichen Bedingungen (Methode nach WESTERGREN) bei Frauen normalerweise 6 bis 11 mm innerhalb einer Stunde und bei Männern 3 bis 9 mm. Die Bestimmung der BSG ist eine unspezifische Untersuchungsmethode. Erhöhungen der BSG werden insbesondere bei entzündlichen und neoplastischen Erkrankungen beobachtet. Es sind hierbei verschiedene Plasmaproteine (Fibrinogen, Immunglobuline, Akute-Phase-Proteine) vermehrt, die zu einer lockeren Zusammenballung (Agglomeration) der Erythrozyten führen und als Agglomerine bezeichnet werden. 4 V. Blut Geräte und Reagenzien: Sedivette, Sedivetten-Ständer. Durchführung: Der Inhalt der Sedivette (violett) wird durch mehrmaliges Kippen durchmischt und die Sedivette senkrecht in den Ständer gestellt. Nach einer Stunde wird die Strecke der erythrozytenfreien Plasmasäule notiert. 3. Rotes Blutbild 3.1. Die Hämoglobinkonzentration im Blut ([Hb], rote Monovette) Hämoglobin lagert Sauerstoff reversibel an und ermöglicht dadurch den O2-Transport zu den Geweben. Die normale Hämoglobinkonzentration [Hb] beträgt im Mittel beim Mann 160 g/l, bei der Frau 140 g/l; es wird angenommen, dass dieser geschlechtsspezifische Unterschied v.a. auf einer Steigerung der Erythropoiese durch Androgene beruht. Eine deutliche Herabsetzung der [Hb] kennzeichnet eine Anämie. Bei leichter bis mittlerer Anämie beträgt die [Hb] 80 bis 120 g/l. Bei schwerer Anämie ([Hb] < 80 g/l) ist die Sauerstoffversorgung der Gewebe gefährdet. Typische Symptome bei Anämie sind Blässe, Müdigkeit, Herzklopfen bei Belastung und Kopfschmerzen. Ein abnormaler [Hb]-Anstieg erhöht die Viskosität des Blutes und damit die Herzarbeit. Die [Hb]-Bestimmung gehört zu den häufigsten und wichtigsten klinischen Basisuntersuchungen. In der Regel wird die Cyanmethämoglobin-Methode benutzt. Prinzip der Cyanmethämoglobin-Methode: Das Blut wird hämolysiert, das Hb in das stabile Cyanmethämoglobin überführt und dessen Konzentration photometrisch bestimmt. Alle Hämoglobinformen, die im Blut vorkommen können (Desoxyhämoglobin, Oxyhämoglobin, Carboxyhämoglobin, Methämoglobin) werden dabei in Cyanmethämoglobin überführt. Die Methode ist unabhängig davon, ob die einzelnen Hb-Formen O2 binden können. Geräte und Reagenzien: Pipettierhilfe, Reagenzgläser, 20-µl-Glaskapillaren, Photometer, Küvetten, Transformationslösung (0,5 g Natriumbicarbonat, 100 mg Kaliumhexacyanoferrat (K3Fe(CN)6) und 25 mg Kaliumcyanid in 500 ml Aqua dest. gelöst und in brauner Flasche [Lichtschutz!] aufbewahrt). Die Lösung ist giftig! Durchführung: 5 ml Transformationslösung wird in ein Reagenzglas pipettiert. Zum Pipettieren wird wegen der Giftigkeit der Transformationslösung ein Dispenser als Pipettierhilfe benutzt. Eine 20-µl-Glaskapillare wird an eine Stichwunde bzw. die Blutprobe gehalten, so dass sie sich mit Blut füllt. Die Kapillare wird außen abgewischt und in die Transformationslösung des Reagenzglases geworfen. Das Reagenzglas wird mit Parafilm verschlossen und anschließend kräftig geschüttelt. Nach 20 bis 30 min wird mit einem Photometer die Extinktion (E) bei 546 nm abgelesen. Berechnung der Hb-Konzentration: Die Hämoglobinkonzentration in g/l ergibt sich aus: [Hb] (g/l) = 368 E Der Faktor 368 ergibt sich aus dem Extinktionskoeffizienten von Cyanmethämoglobin bei 546 nm und der Verdünnung der Probe. 3.2. Die Erythrozytenzahl im Blut Die Neubildungsrate der Erythrozyten wird durch den Sauerstoffpartialdruck (pO2) im Gewebe geregelt. Fällt der pO2 ab, wird in der Niere vermehrt Erythropoietin gebildet, das die Erythropoiese im Knochenmark stimuliert (z.B. beim Aufenthalt in großer Höhe). Die normale Lebens5 V. Blut dauer der Erythrozyten beträgt rund 120 Tage. Sie kann unter pathologischen Bedingungen verkürzt sein (Beispiel: hämolytische Anämie). Prinzip der Methode: Blut wird verdünnt und in eine durchsichtige Kammer bekannten Volumens gefüllt (Zählkammer mit Deckglas). Die Erythrozyten in der Kammer werden unter dem Mikroskop ausgezählt und zu dem unverdünnten Blutvolumen in Beziehung gesetzt. Geräte und Reagenzien: Pipettierhelfer (Mikro-Pipex), Erythrozytenpipette (gekennzeichnet durch eine rote Perle) mit Stauschlauch, Zählkammer mit Deckgläschen, Mikroskop, HAYEMsche Lösung (5,0 g Natriumsulfat, 2,0 g Natriumchlorat und 0,5 g Sublimat ad 200 ml Aqua dest.). Die hypertone Lösung fixiert die Zellmembranen und macht damit die Erythrozyten deutlicher erkennbar. Durchführung: Die Klemmbacken des Pipettierhelfers werden mit dem Stellrad in Startposition gebracht. Dann wird die Erythrozytenpipette vorsichtig aufgesteckt. Zum Füllen mit Blut wird das Stellrad langsam in Richtung Abwurftaste gedreht, bis die Marke 0,5 erreicht ist. Die Pipettenspitze wird abgetupft. Von Marke 0,5 bis 101 wird HAYEMsche Lösung aufgesaugt. Hierbei entsteht eine 200fache Verdünnung des Blutes, da nur im birnenförmigen Teil der Pipette Mischung erfolgt. Die Pipette wird auf einem Rüttelgerät ca. 2 min geschüttelt. Die ersten aus der Kapillare der Pipette stammenden Tropfen werden verworfen, weil dort die Durchmischung unvollständig ist. Die Pipette wird seitlich an den Deckglasrand gehalten, so dass die Suspension durch Kapillarkräfte in die Zählkammer einströmen kann. Die Zählkammer muss zuvor sorgfältig gereinigt und mit einem Deckglas versehen sein. Das Deckglas sitzt fest, wenn am Rand NEWTON-Ringe zu sehen sind. Mit der Zählung wird ca. 2 min gewartet, damit sich die Erythrozyten absetzen können. Unter dem Mikroskop (Objektiv 40) sind an dem Boden der Zählkammer Quadrate erkennbar. Je 16 der kleinsten Quadrate bilden ein mittelgroßes Quadrat. Die Erythrozyten über 5 mittelgroßen Quadraten, d.h. über 80 der kleinsten Quadrate werden ausgezählt. Die auf der oberen und linken Begrenzungslinie liegenden Erythrozyten werden dem betreffenden Quadrat zugezählt. Auf diese Weise wird vermieden, dass Blutkörperchen doppelt gezählt werden. Berechnung der Erythrozytenzahl: Die Seitenlänge von einem kleinsten Quadrat beträgt 1/20 mm, seine Fläche ist demnach 1/400 mm². Die Höhe der Kammer beträgt 1/10 mm. Das Kammervolumen über einem der kleinsten Quadrate beträgt somit 1/4000 mm3 = 1/4000 µl. Die ausgezählten 80 Quadrate entsprechen einem Volumen von 80/4000 = 1/50 µl. Wenn EZ die Anzahl der Erythrozyten in 80 Quadraten ist, gilt demnach bei einer 200fachen Blutverdünnung: 200 50 EZ = 10.000 EZ = Erythrozyten pro µl Blut 3.3. Der Hämatokrit Der Volumenanteil der Erythrozyten am Blut wird Hämatokrit (Hkt) genannt. Prinzip der Bestimmung: Die Blutzellen haben ein höheres spezifisches Gewicht als das sie umgebende Plasma; sie können daher abzentrifugiert werden. Nach der Zentrifugation bilden Zellen und Plasma in einem Zentrifugenröhrchen scharf getrennte Schichten (Säulen). Der Hämatokritwert ergibt sich aus der Höhe der roten Zellsäule in Prozent der Gesamtsäule. Geräte: Heparinisierte Hämatokritröhrchen, Mikro-Hämatokritzentrifuge, HAWKSLEY-Skala, Knetmasse. Durchführung: Zwei dünne Glasröhrchen (Hämatokritröhrchen) werden schräg in das Blut gehalten. Kapillarkräfte ziehen das Blut in die Kapillare. Ein Ende des Hämatokritröhrchens wird mit Knetmasse verschlossen. Die Röhrchen werden mit dem verschlossenen Ende nach außen in 6 V. Blut die Zentrifuge gelegt und 5 min bei 10.000g zentrifugiert. Der Hämatokrit wird auf einer speziellen Skala abgelesen. 3.4. Berechnungen 3.4.1. Mittlerer Hämoglobingehalt der Erythrozyten (HbE, MCH) Die Kenntnis der Erythrozytenzahl und der Hämoglobinkonzentration erlaubt die Berechnung des durchschnittlichen Hämoglobingehaltes eines einzelnen Erythrozyten. Eine Erniedrigung des HbGehaltes der Erythrozyten kennzeichnet die hypochrome Anämie (z.B. bei Eisenmangel), seine Erhöhung die hyperchrome Anämie (z.B. die so genannte perniciöse Anämie bei Vitamin-B12Mangel). Der mittlere Hb-Gehalt eines einzelnen Erythrozyten (mittleres korpuskuläres Hämoglobin = MCH) wird nach folgender Beziehung aus der Hämoglobinkonzentration [Hb] und der Erythrozytenzahl (EZ) im Blut berechnet: [Hb] (g/l) MCH (pg) = 10 6 EZ/µl 3.4.2. Mittleres Erythrozyteneinzelvolumen (MCV) Zur Differenzierung der Anämien dient weiterhin die Bestimmung des Erythrozyteneinzelvolumens (mittleres korpuskuläres Volumen = MCV). Es wird aus dem Verhältnis zwischen dem Hämatokrit und der Erythrozytenzahl (EZ) pro Blutvolumen berechnet. Wenn der Hämatokrit in l/l (nicht in %!) und die Erythrozytenzahl pro µl Blut eingesetzt werden, gilt (1 µl = 109 µm3; 1 µm3 = 1 fl): Hkt (l/l) MCV (µm3) = 109 EZ/(µl) 3.4.3. Intraerythrozytäre Hämoglobinkonzentration (MCHC) Aus dem Hämatokrit und der Hb-Konzentration im Blut kann die Hb-Konzentration im Erythrozyten errechnet werden (MCHC = mittlere korpuskuläre Hämoglobinkonzentration): [Hb] (g/l) MCHC (g/l) = Hkt (l/l) 3.5. Die Leukozytenzahl im Blut Die Leukozyten dienen u.a. der Abwehr von Krankheitserregern. Einen Anstieg der Leukozytenzahl im Blut findet man daher bei den meisten Infektionskrankheiten, es können aber auch andere Ursachen vorliegen (z.B. Leukämie). Ein Absinken der Leukozytenzahl kann auf einer Schädigung des Knochenmarks beruhen. Eine Verminderung der Leukozytenzahl unter 4000 pro µl Blut wird Leukopenie, eine Erhöhung über 10000 pro µl Blut Leukozytose genannt. Prinzip der Bestimmung: Durch eine stark hypotone Essigsäurelösung werden die Erythrozyten zerstört. Die Leukozyten werden mit Gentianaviolett angefärbt und können dann in einer Zählkammer ausgezählt werden. 7 V. Blut Geräte und Reagenzien: Leukozytenpipette (durch eine weiße Perle gekennzeichnet), TÜRKsche Lösung (3 %ige Essigsäurelösung mit Gentianaviolett). Durchführung der Bestimmung: In die Leukozytenpipette wird Blut bis zur Marke 1 aufgezogen. Die Pipette wird abgewischt und TÜRKsche Lösung bis zur Marke 11 nachgesaugt (Verdünnung 1 : 10 entsprechend dem Mischraum). Die Pipette wird zwischen Daumen und Zeigefinger ca. 2 min geschüttelt. Die Lösung wird in eine Zählkammer eingefüllt. Die Leukozyten werden über 4 gegenüber liegenden großen Quadraten ausgezählt (Objektiv 10). Berechnung der Leukozytenzahl: Jedes der ausgezählten großen Quadrate hat eine Fläche von 1 mm². Die Höhe der Zählkammer beträgt 1/10 mm. Das Volumen über einem Quadrat beträgt also 1 /10 µl. Das Gesamtvolumen des Kammerraumes über 4 Quadraten ist demnach 4/10 µl. Da das Blut 1 : 10 verdünnt wurde, ergibt sich die Leukozytenzahl pro Blutvolumen wie folgt aus der Anzahl der Leukozyten (LZ), die über 4 großen Quadraten gefunden wurden: (10 10 LZ) / 4 = 25 LZ = Leukozyten pro µl Blut 4. Blutstillung (grüne Monovette) Die physiologische Blutstillung nach einer Gefäßverletzung verläuft in zwei Phasen: 1. Zunächst wird die Blutung vorläufig gestoppt durch Vasokonstriktion und Thrombozytenaggregation (weißer Abscheidungsthrombus). Die Geschwindigkeit der Vasokonstriktion und Thrombozytenaggregation bestimmt die Blutungszeit (Normalwert < 6 min). Eine Verlängerung der Blutungszeit deutet auf eine Vasopathie (Erkrankung der Blutgefäße), eine Thrombozytopenie (Verminderung der Thrombozyten) oder eine Thrombasthenie (Funktionsstörung der Thrombozyten) hin. 2. Die endgültige Blutstillung erfolgt durch Gerinnung des Blutes, d.h. durch Bildung von Fibrinfäden, welche sich um eingeschlossene Erythrozyten zusammenziehen (roter Abscheidungsthrombus). Intravaskuläres System Extravaskuläres System XIIa,XIa,IXa,VIIIa,Ca2+ Gewebethromboplastin + Plättchenfaktor 3 + VIIa,Ca2+ Prothrombinaktivator (Xa, Va, Ca2+, Phospholipide) Prothrombin Thrombin Fibrinogen Fibrin Abb.1: Kaskadenschema der Blutgerinnung Abb. 1 zeigt die Faktoren der Blutgerinnung. Das extravaskuläre System wird durch Gewebethromboplastin (ein Komplex aus dem Membranprotein „Tissue Factor“ und Phospholipiden), das intravaskuläre System durch den aktivierten Faktor XII und den Plättchenfaktor 3 eingeleitet. 8 V. Blut 4.1. Die partielle Thromboplastinzeit (PTT) Die partielle Thromboplastinzeit ist die Zeit bis zur Ausbildung eines Gerinnsels nach Mischung von Citratplasma mit einer Lösung von Plättchenfaktor 3 und Kalziumionen. Mit dem Test werden die Faktoren des intravaskulären Systems (mit Ausnahme des Plättchenfaktors 3) und außerdem Prothrombin und Fibrinogen geprüft (s. Abb. 1). Geräte und Reagenzien: PTT-Reagenz (Pathromtin®, enthält den Plättchenfaktor 3), CaCl2Lösung, Plasma, Wasserbad mit Thermostat, Reagenzgläschen, Plastiköse, Stoppuhr, Pipetten. Durchführung: Zu 0,2 ml Plasma wird 0,2 ml PTT-Reagenz pipettiert. Die Lösungen werden gut durchmischt und 2 min im Wasserbad auf 37°C angewärmt. Anschließend wird 0,2 ml CaCl2Lösung zupipettiert. Die Lösung wird geschüttelt. Gleichzeitig wird eine Stoppuhr gedrückt. Die Plastiköse wird durch das Gemisch gezogen, bis ein Gerinnsel an ihr hängen bleibt. Zu diesem Zeitpunkt wird die Stoppuhr wieder gedrückt und die Zeit abgelesen. 4.2. Die Thromboplastinzeit (QUICK-Test) Die Thromboplastinzeit ist die Zeit bis zur Gerinnselbildung nach Zusatz von Gewebethromboplastin und Kalzium zu Plasma. Die Thromboplastinzeit erfasst die Faktoren des extravaskulären Systems (außer Gewebethromboplastin), Fibrinogen und die Konzentration an Prothrombin. Geräte und Reagenzien: Gewebethromboplastin mit Kalziumzusatz (Thromborel®), Plasma, Wasserbad mit Thermostat, Reagenzgläschen, Plastiköse, Pipetten und Stoppuhr. Durchführung: Das Kalzium-Thromboplastin wird 5 min im Wasserbad auf 37°C erwärmt. In ein bei 37°C vorgewärmtes Röhrchen werden 0,1 ml des zu untersuchenden Plasmas pipettiert und 30 s bei 37°C inkubiert. Dann wird 0,2 ml Kalzium-Thromboplastin-Reagenz zugegeben. Sofort nach dem Schütteln wird die Stoppuhr gedrückt und das Gemisch mit der Plastiköse gerührt, bis ein Gerinnsel sichtbar wird. Die abgelesene Zeit ist die Thromboplastinzeit. Im klinischen Gebrauch wird die Thromboplastinzeit häufig als "QUICK-Wert" in Prozent des Normalwertes angegeben. Zum Vergleich werden hierbei Kalibrierkurven in Verdünnungsreihen mit normalem Plasma erstellt. Die Untersuchung dient u.a. zur Überwachung einer Antikoagulantientherapie und zur Leberfunktionsdiagnostik. Neuerdings wird häufig statt des QUICK-Wertes die INR angegeben („International Normalized Ratio“). Dabei wird das verwendete Thromboplastin gegen eine Referenzpräparation der Weltgesundheitsorganisation (WHO) abgeglichen. 4.3. Die Thrombinzeit Die Zeit, die nach Mischung von Thrombin mit Plasma bis zur Bildung eines Gerinnsels verstreicht, wird Thrombinzeit genannt. Sie hängt u.a. von der Konzentration des Fibrinogens ab. Das gebildete Fibrin kann durch das fibrinolytische System wieder aufgelöst werden und evtl. gar nicht in Erscheinung treten. Die Thrombinzeit ermöglicht somit eine Kontrolle einer Fibrinolysetherapie u.a. (Auflösung eines Blutgerinnsels bei einem akuten Gefäßverschluss). Reagenzien: Test-Thrombin aus Rinderplasma, Aqua dest. Durchführung: In ein bei 37°C vorgewärmtes Röhrchen werden 0,1 ml des zu untersuchenden Plasmas sowie 0,1 ml Aqua dest. pipettiert und das Gemisch 20 bis 30 s im Wasserbad angewärmt. Dann wird 0,1 ml Test-Thrombinlösung zugegeben. Beim Schütteln wird die Stoppuhr gedrückt. Mit der Plastiköse wird solange gerührt, bis ein Gerinnsel daran hängen bleibt. Dann wird die Stoppuhr wieder gedrückt und die Zeit abgelesen. 9 V. Blut 5. Die Blutungszeit Die Blutungszeit gibt an, wie lange eine kleine stichförmige Wunde blutet. Die Bestimmung der Blutungszeit ist die wichtigste Routinemethode zur Überprüfung der primären Hämostase. Geräte und Reagenzien: Einmal-Lanzetten, Tupfer, Alkohol, Zentrifugenglas mit steriler Kochsalzlösung, Stoppuhr. Durchführung: Mit einer Lanzette wird etwa 4 mm tief in die Fingerbeere oder ins Ohrläppchen gestochen. Gleichzeitig wird eine Stoppuhr gedrückt. Die Fingerbeere wird in ein mit steriler physiologischer Kochsalzlösung gefülltes Zentrifugenglas getaucht. Das Blut sinkt als dünner Faden in der Kochsalzlösung ab. Wenn der Blutfaden abreißt, wird die Stoppuhr angehalten und die Zeit abgelesen. Anmerkung: Die Blutungszeit wird von der Einstichtiefe und der Hauttemperatur beeinflusst. 6. Differentialblutbild Entnahme von Kapillarblut: Nach der Desinfektion der Haut (Fingerbeere oder Ohrläppchen) wird mit einer Lanzette ca. 4 mm tief eingestochen (Blut muss spontan austreten). Der erste Tropfen wird abgetupft, bevor die Probe entnommen wird. Nach der Blutentnahme wird die Blutung mit einem Pflaster oder Tupfer zum Stehen gebracht. Anfertigung eines Blutausstriches: a) 1 kleiner Tropfen Kapillarblut wird auf das rechte äußere Drittel eines sauberen, fettfreien Objektträgers gegeben (ggf. vorher mit Alkohol reinigen). b) Von der blutfreien Seite her wird ein zweiter Objektträger an den Tropfen herangeführt und so gekippt, dass der Tropfen im spitzen Winkel (ca. 45°) „gefangen“ wird. Durch schnelles und gleichmäßiges Ziehen in Richtung des stumpfen Winkels wird der Tropfen ausgestrichen. Am dünnen Ende des Ausstrichs sollen die Zellen einschichtig liegen; zu dicke Ausstriche sind nicht beurteilbar. c) Das Präparat wird zum Trocknen beiseite gelegt (5 bis 10 min). d) Währenddessen wird GIEMSA-Gebrauchslösung angesetzt (1 Tropfen Stammlösung auf 1 ml Aqua bidest.). e) Das Präparat wird mit konzentrierter MAY-GRÜNWALD-Lösung überschichtet (nicht eintrocknen lassen, ggf. Farblösung erneut auftragen) und nach genau 3 min abgekippt und kurz gewässert. f) Die GIEMSA-Gebrauchslösung wird hinzugegeben (für 15 bis 20 min). g) Dann wird die Farblösung von der Seite her mit Aqua bidest. abgespült (nicht abgießen). h) Das Präparat wird zum Trocknen schräg aufgestellt. Beurteilung des Blutausstriches: a) Präparat auf den Kreuztisch des Mikroskops legen und mit schwacher Vergrößerung geeignete Stelle aussuchen, b) 1 Tropfen Immersionsöl auftragen und Ölimmersionsobjektiv in den Strahlengang schwenken, c) unter seitlicher Blickkontrolle Objektiv bis auf 1/10 mm an den Objektträger heranfahren, dann durch vorsichtiges Drehen am Feintrieb scharf stellen, d) Ausstrich mäanderförmig abfahren und 100 Leukozyten den einzelnen Populationen zuordnen. Geben Sie den prozentualen Anteil der Leukozytensorten an und vergleichen Sie Ihr Ergebnis mit der normalen Verteilung. 10 V. Blut 7. Die Blutgruppen Die Blutgruppeneigenschaften ergeben sich aus der genetisch festgelegten Struktur der Kohlenhydratkomponenten von Glykolipiden oder dem Vorkommen bestimmter Proteinstrukturen der Erythrozytenmembran. Die Bestimmung der Blutgruppen ist zur Vermeidung von Transfusionszwischenfällen sowie zur Verhinderung der Sensibilisierung von rh-negativen Personen erforderlich. Daneben spielt die Blutgruppenbestimmung eine Rolle in der forensischen Medizin (z.B. Vaterschaftsgutachten). 7.1. Das AB0-System Die antigenen Strukturen im AB0-System sind endständige Zuckerreste von Glykolipiden der Erythrozytenmembran. Die antigenen Zucker kommen auch in den Glykolipiden und -proteinen anderer Zellen sowie in sezernierten Glykoproteinen vor. Prinzip der Bestimmung: Die Blutkörperchen des zu testenden Blutes werden mit Lösungen (Testseren) vermischt, welche Anti-A bzw. Anti-B oder beide Isohämagglutinine enthalten. Es wird geprüft, ob eine Agglutination auftritt. Als Gegenprobe wird Serum des zu untersuchenden Blutes mit Testerythrozyten bekannter Blutgruppenzugehörigkeit vermengt. Wieder wird das Auftreten einer Agglutination geprüft. Geräte und Reagenzien: Probandenblut, Testseren, Testerythrozyten, Objektträger, Glasstäbchen. Durchführung: Aus Gründen der Zeitersparnis wird die Bestimmung im Praktikum mit Plasma einer Versuchsperson durchgeführt. In der klinischen Diagnostik wird stattdessen Serum verwendet, das durch Zentrifugation geronnenen Blutes gewonnen wird. Bei der Zugabe von Plasma können sich Gerinnsel bilden, die eine Agglutination vortäuschen. Das Plasma wird vorsichtig mit einer Pasteurpipette abgesaugt. Die antigenen Eigenschaften können nun wie folgt bestimmt werden: (a) Reaktion der zu prüfenden Erythrozyten aus Kapillarblut mit bekannten Testseren (Anti-A, Anti-B und Anti-AB) und (b) Reaktion des Probandenplasmas mit Testerythrozyten. Die Agglutination bei Test (b) ist meist nicht so stark ausgeprägt, da die Antikörper-Konzentration im Probandenserum geringer ist als die AntikörperKonzentration in den hochtitrigen käuflichen Testseren. Bestimmung der Erythrozyteneigenschaften mit bekannten Testseren: Je ein Tropfen der Testseren Anti-A, Anti-B und Anti-AB wird auf den Objektträger gegeben. In einigem Abstand davon wird je ein Tropfen der zu testenden Erythrozyten aufgebracht. Testseren und Erythrozyten werden mit Glasstäbchen gemischt (immer neue benutzen!) und auf Agglutination geprüft. Negativ ist die Prüfung, wenn die Mischung nach 5 min noch homogen ist. Positiv ist die Prüfung, wenn die Agglutination während des Mischens beginnt und sich während Rotierens verstärkt. Fehlermöglichkeiten: „Geldrollenbildung“ kann Agglutination vortäuschen; die Unterscheidung gelingt mikroskopisch: durch nachträgliche Zugabe von 1 Tropfen physiologischer NaCl-Lösung wird die Geldrollenbildung rückgängig gemacht. Panagglutination kann bei bakterieller Verunreinigung der Blutprobe zu unspezifischen Reaktionen führen. Gerinnung kann bei Verwendung von Vollblut (Notfalluntersuchung) aus Fingerbeere oder Ohrläppchen eine Agglutination vortäuschen. 11 V. Blut 7.2. Das Rh-System Die Antigene im Rhesus-System sind Proteine der Erythrozytenmembran. Prinzip der Bestimmung des Rh-Faktors D: Erythrozyten des zu prüfenden Blutes werden mit einem Testserum vermischt, das Anti-D enthält. Die Anwesenheit des Rh-Faktors D wird an dem Auftreten einer Agglutination erkannt. Geräte und Reagenzien zur Bestimmung des Rh-Faktors D: Anti-D-Testserum, Anti-Human-уGlobulin, Probandenerythrozyten aus Kapillarblut in NaCl-Lösung, Objektträger, Glasstäbchen. Durchführung: Zunächst wird 1 Tropfen Anti-D-Testserum auf einen Objektträger gebracht, danach 1 Tropfen der zu untersuchenden Erythrozyten sowie Anti-Human- у-Globulin Lösung zugefügt und mit einem Glasstäbchen gemischt. Unter Rotieren des Objektträgers wird das Ergebnis abgelesen. Gelegentlich wird die Agglutination nach Inkubation der Objektträger bei 37°C deutlicher. Auswertung: Eine Agglutination zeigt, dass die geprüften Erythrozyten den Faktor D (RhD-Protein) besitzen, d.h. Rh-positiv sind. Frage: Warum wird Anti-Human--Globulin zum Ansatz gegeben? 7.3. Kreuzprobe Bei der Kreuzprobe wird vor jeder Transfusion untersucht, ob das Serum des Empfängers Antikörper gegen Erythrozyten des Spenders enthält (= Major-Test) und ob im Serum des Spenders Antikörper gegen die Erythrozyten des Empfängers vorliegen (= Minor-Test). Ungekreuztes Blut darf nur bei vitaler Bedrohung des Patienten transfundiert werden. Geräte und Reagenzien: Objektträger, 2 zentrifugierte Blutproben, Pasteur-Pipetten. Auswertung: Eine Agglutination in einem oder in beiden Testansätzen zeigt, dass eine Transfusion nicht erfolgen darf. Was haben Sie beobachtet? 12 V. Blut PROTOKOLLBLATT Name: Geschlecht: Gruppe: Datum: Blutsenkungsgeschwindigkeit (BSG): ............ mm nach 1 Std. Hämoglobin-Konzentration [Hb]: ............ g/l Blut Erythrozytenzahl: ............ /µl Leukozytenzahl: ............ /µl Hämatokritwert (Hkt): ............ l/l mittl. Hämoglobingehalt pro Erythrozyt (MCH): ............ pg mittl. Erythrozytenvolumen (MCV): ............ µm3 mittl. Hb-Konz. in den Erythrozyten (MCHC): ............ g/l Blutungszeit: ............ min partielle Thromboplastinzeit (PTT): ............ s Thromboplastinzeit: ............ s Thrombinzeit: ............ s Blutgruppe: ............ 13 V. Blut NORMALWERTE (in Klammern der 95 %-Wert) Die angegebenen Normalwerte sind als Richtwerte anzusehen. Es werden in den verschiedenen Lehrbüchern geringfügig unterschiedliche Angaben gefunden. Frauen Männer Hämoglobinkonzentration 140 g/l (120 - 160) 160 g/l (140 - 180) Hämatokrit 0,42 l/l (0,37-0,46) 0,47 l/l (0,41-0,50) Erythrozytenzahl 4,8 106/µl (4,0 - 5,2) 5,3 106/µl (4,6 - 5,9) Mittlerer Hb-Gehalt der Erythrozyten (MCH) 30 pg (27-34) Mittleres Volumen eines Erythrozyten (MCV) 85 µm3 (80 - 96) Mittlere Hb-Konzentration der Erythrozyten (MCHC) 340 g/l (300 - 360) Leukozytenzahl 7000/µl (4000 - 10000) Differentialblutbild: → stabkernige Neutrophile → segmentkernige Neutrophile → Eosinophile → Basophile → Monozyten → Lymphozyten 1- 5% 45 - 75% 2 - 4% 0,5 - 1% 2 - 10% 20 - 50% BSG (1 h) 6 - 11 mm 3 - 9 mm Blutungszeit < 6 min partielle Thromboplastinzeit 23 - 35 s Thromboplastinzeit 11 - 13 s (laborabhängig) Thrombinzeit 12 - 19 s (laborabhängig) 14 V. Blut Seminarthemen „Blut“ 1) Sauerstofftransport - Erythrozyten: Zahl, Volumen, Hb-Gehalt, Produktion und Abbau, Grundzüge pathophysiologischer Veränderungen (Anämien, Erythrozytosen) - Hämoglobin: Struktur, Funktion, O2-Bindungskurve 2) Blutstillung - Thrombozyten: Zahl, Produktion und Funktion - intra- und extravaskuläres Gerinnungssystem: Funktion, Aktivierung, Laborparameter, Wirkung von Antikoagulantien (EDTA, Heparin, Cumarin-Derivate) 3) Immunologie des Blutes - Immunglobuline - Leukozyten: Einteilung, Funktionen - Blutgruppensystem des Menschen 15 V. Blut 16