1 Zusammenfassung Fragestellung: Die folgende Arbeit soll
Werbung

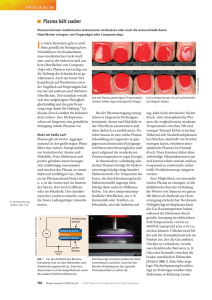
Zusammenfassung Fragestellung: Die folgende Arbeit soll einzelne Merkmale im Implantatdesign und deren Einfluss auf die Plaqueretention aufzeigen. Material und Methode: Als Grundlage dienten die im Literaturverzeichnis aufgeführten Arbeiten (von 1981 bis 2007), die mit den Suchbegriffen und deren Kombinationen: - „implant, design, plaque, retention, bacterial, surface, roughness, surface free energy, bacterial adherence, biofilm“ - in der Datenbank des PubMed und im Internet ermittelt wurden. Es wurden zunächst aktuelle relevante Publikationen und im Anschluss daran themenbezogene Artikel erarbeitet. Ergebnisse: Die knöcherne Einheilung von dentalen Implantaten stellt in der heutigen Zeit kaum noch ein Problem dar. Der langfristigen Osseointegration unter der Kaubelastung und dem bakteriellen Kontakt aus dem oro-pharyngealen Bereich kommt daher in den letzten Jahren zunehmend eine größere Bedeutung zu. Die Hauptursachen des späten Implantatverlustes stellen der Knochenverlust durch unphysiologische Belastungen und Implantatdesign die bakterielle beeinflusst dabei plaqueinduzierte den Schweregrad Periimplantitis und die dar. Qualität Das der Plaqueretention. Die einzelnen Faktoren, wie Spaltbildung, Oberflächenrauigkeit, Materialeigenschaften und freie Oberflächenenergie der verwendeten Oberflächen haben dabei unterschiedliche Auswirkungen. Ein optimales Implantatdesign bezüglich der Minderung der Plaqueretention ist möglichst spaltfrei zu gestalten. Vorhandene Spalten sollten mindestens einen Abstand von 2mm vom krestalen Knochenrand haben, nicht beweglich sein und eine minimale Spaltbreite aufweisen. Eine dauerhafte Rautiefe von unter 0,2µm aller Implantatteiloberflächen oberhalb des Knochenniveaus ist anzustreben, wobei eine Hartbeschichtung, z.B. mit TiN und ZiN, aufgrund ihrer Materialhärte und der niedrigen freien Oberflächenenergie eine langfristige Reduzierung der Plaqueretention verspricht. Schlussfolgerung: Entscheidend für die Plaqueakkumulation beim Implantatdesign scheinen die Größe eines Spaltes, seine Mobilität bzw. die der spaltbildenden Bauteile zueinander und die Lage des Spaltes zu den periimplantären Hart- und Weichgeweben zu sein. Die Oberflächengestaltung von Implantaten sollte daher dahingehend verbessert werden, dass eine Spaltbildung im Implantatdesign minimiert oder generell eliminiert wird. -2- Inhaltsverzeichnis Zusammenfassung 1 Inhaltsverzeichnis 2 1. Einleitung 4 2. Material und Methode 7 3. Ergebnisse 8 3.1 Übergänge, Grenzflächen und Spaltbildung an Implantaten 8 3.1.1 Übergänge, Grenzflächen und Spaltbildung zwischen osseointegrierender Implantatoberfläche und poliertem Implantathals 8 3.1.2 4. Übergänge, Grenzflächen und Spaltbildung zwischen Implantat und Abutment 9 3.1.3 Übergänge, Grenzflächen und Spaltbildung zwischen Abutment und prothetischem Aufbau 12 3.1.4 Übergänge, Grenzflächen und Spaltbildung zwischen Implantat und prothetischem Aufbau 12 3.2 Oberflächenrauigkeit 13 3.3 Materialien und Beschichtungen 14 3.4 Freie Oberflächenenergie 16 Diskussion 4.1 19 Übergänge, Grenzflächen und Spaltbildung an Implantaten 19 4.1.1 Übergänge, Grenzflächen und Spaltbildung zwischen osseointegrierender Implantatoberfläche und poliertem Implantathals 19 4.1.2 Übergänge, Grenzflächen und Spaltbildung zwischen Implantat und Abutment, Abutment und prothetischem Aufbau sowie Implantat und prothetischem Aufbau 20 -34.2 Oberflächenrauigkeit 22 4.3 Materialien und Beschichtungen 23 4.4 Freie Oberflächenenergie 24 5. Schlussfolgerungen 26 6. Literaturverzeichnis 28 7. Abkürzungsverzeichnis 35 8. Danksagung 37 9. Eidesstattliche Erklärung 38 -41. Einleitung Orale Implantate sind offene Implantate. Sie stehen mit der bakteriell besiedelten Mundhöhle in Verbindung. Während das Problem der Verankerung enossaler Implantate im Knochen (Osseointegration) nach der Implantation weitgehend gelöst erscheint, bedarf das zweite Hauptproblem, die langfristige Integration des Implantates im umliegenden Gewebe, weiterhin der Diskussion und Weiterentwicklung. Der frühzeitige Implantatverlust in der Zahnmedizin resultiert in der Regel aus fehlender Osseointegration nach der Implantation. Er ist häufig auf die schlechte Auswahl des Patientengutes oder eine unzureichende chirurgische Durchführung der Implantation zurückzuführen. Die verfrühte Belastung der Implantate ist ein weiterer Faktor, der den frühzeitigen Verlust von Implantaten begünstigt. In der Frühphase der Implantatosseointegration führen solche Faktoren zur erschwerten Einheilung oder zum Verlust der noch unreifen Knochenanlagerung an der Implantatoberfläche.(4) Ein Implantatverlust zu einem späteren Zeitpunkt hat jedoch andere Ursachen. In diesem Fall ist davon auszugehen das eine Osseointegration des Implantates bereits stattgefunden hat. Nicht selten wurde die prothetische Versorgung vorgenommen und das Implantat stand für längere Zeit unter physiologischer Belastung. Im Gegensatz zum frühzeitigen Implantatverlust liegt hier ein Verlust von krestalem Knochen nach erfolgreicher Osseointegration des Implantates vor.(40) Der verspätete Knochenverlust hat verschiedene Ursachen. Im ersten Jahr nach Implantation ist ein Knochenverlust von 0,4 bis 1,6mm (29) bzw. bis 1,2 mm hinnehmbar (2), ein weiterer Verlust von 0,1 (29) bis 0,2mm (5) pro Jahr ist akzeptabel. Als Ursachen hierfür sind vor allem das chirurgische Trauma, die Implantatbelastung und die periimplantär veränderte Gefäßversorgung zu nennen.(2,3,5) Übergänge und Stufenbildung zwischen verschiedenen Oberflächen, so wie Spaltbildung zwischen dem Implantat und dem Implantatabutment und/oder dem prothetischem Aufbau begünstigen ebenfalls Knochenverlust.(17,18,21,56) In der Literatur werden Fälle beschrieben, in denen ein stark fortschreitender Knochenverlust beobachtet wurde. Dieser führt letztendlich zu einem ungünstigen KronenImplantatverhältnis, zur Lockerung und häufig zum Implantatverlust. Für diesen verstärkten Knochenverlust werden zwei ursächliche Faktoren genannt. Zum einen eine unphysiologische bzw. Überlastung des Implantates (50), zum anderen die bakterielle plaqueinduzierte Periimplantitis (6,45). -5Die Mundhöhle ist ein offenes System. Um zu überleben, haben die Bakterien die Fähigkeit entwickelt, sich auf Hart- und Weichgeweben anzuheften, um Scherkräften zu widerstehen. Zähne, Zahnersatz oder Implantate haben nicht die Möglichkeit, wie die die Mundhöhle auskleidenden Schleimhäute, ihre Oberfläche regelmäßig zu erneuern und abzustoßen. Deshalb ermöglichen diese Oberflächen die Bildung eines bakteriellen Biofilmes. Diese unkontrollierte Plaqueakkumulation ist der Hauptgrund für Karies, Gingivitis, Parodontitis und Periimplantitis. Durch den Einsatz modernster Materialien und Oberflächengestaltungen gilt es, die Plaque-Akkumulation und Biofilm-Bildung auf den Implantat- und Suprastrukturen zu reduzieren, da bei der Periimplantitis nicht nur mit der Schädigung des periimplantären Weichgewebes, sondern auch der knöchernen Stützgewebe gerechnet werden muss. Dabei tragen verschiedene Faktoren zur Plaqueretention bei. Neben der Auswahl des Werkstoffes, der Rauigkeit der Oberflächen vom Implantat, Abutment und prothetischer Versorgung, spielt die Größe von Mikrospalten eine wichtige Rolle. Auch die Lokalisation der Mikrospalten zum angrenzenden Gewebe, wie z.B. Knochen und Bindegewebe, ist hierbei von Bedeutung. Weitere Faktoren, welche die Plaqueretention indirekt beeinflussen können, sind das Emergence profile, die Ausdehnung von Implantatkronen und die fehlerhafte Passform einzelner Implantatkomponenten. Diese Arbeit soll den Einfluss der einzelnen Parameter auf die Plaqueretention an Implantaten aufzeigen. Entstehung der bakteriellen Plaque Die Entstehung der bakteriellen Plaque verläuft in vier Phasen. Zunächst kommt es zur Annäherung des Bakteriums an die Oberfläche durch die Braunsche Molekularbewegung (1. Phase), mit einer durchschnittlichen Geschwindigkeit von 40µm/h, durch konvektiven Transport innerhalb beweglicher Flüssigkeiten oder durch die bakterielle Eigenbewegung (Chemotaxis). Es folgt die initiale Adhäsion. Je nach Abstand des Bakteriums zur Oberfläche ist dieser Zustand reversibel oder irreversibel (2. Phase). Die initiale Adhäsion beruht auf Interaktion des Bakteriums und der Oberfläche mittels Kräften, welche über verschiedene Entfernungen wirken. Die van der Waalschen Kräfte wirken über größere Abstände (etwas mehr als 50 nm) und elektromagnetische Kräfte bei kleineren Abständen. Ab einem Abstand von unter 2nm zur Oberfläche treten andere Kräfte (Wasserstoffbindungen, Ionen- Paarbildung, -6Brückenbildung) auf, welche als Oberflächenspannung bzw. als freie Oberflächenenergie (sfe) die Adhäsion des Bakterium an eine Oberfläche beeinflussen. In der dritten Phase etabliert sich eine feste Verbindung zwischen Bakterium und Oberfläche aufgrund Wasserstoff-, Ionenbindungen oder unpolarer Bindungen. Darüber hinaus entsteht ein direkter Kontakt und eine Überbrückung mit filamentären Fortsätzen (3. Phase). Nach der festen Anheftung der Mikroorganismen kommt es in der 4. Phase zu einem Zellwachstum und neue Zellen heften sich an, Mikrokolonien bzw. ein Biofilm entsteht.(vgl.51,67) Es ergeben sich folgende Fragestellungen: 1. Welche Zusammenhänge bestehen zwischen der Plaquebildung bzw. bakterieller Besiedlung der Implantatoberfläche und den einzelnen Übergangsregionen (Interface) des Implantatsystems? 2. Welche Faktoren führen zu einer Reduktion der Plaqueakkumulation an Implantaten? 3. Welche Konsequenzen ergeben sich aus den vorangegangenen Fragen für die Optimierung des Implantatdesigns? -72. Material und Methode Die vorliegende Arbeit wurde anhand einer Literaturrecherche erstellt. Als Grundlage dienten die im Literaturverzeichnis aufgeführten Arbeiten (von 1981 bis 2007), die mit den Suchbegriffen und deren Kombinationen: - „implant, design, plaque, retention, bacterial, surface, roughness, surface free energy, bacterial adherence, biofilm“ - in der Datenbank des PubMed, der Zweigbibliothek Medizin der Universität Münster und im Internet ermittelt wurden. Auswahlkriterien für die Artikel waren, dass der Suchbegriff oder eine Kombination verschiedener Suchbegriffe im Titel oder in der Zusammenfassung enthalten war. Es wurden zunächst aktuelle relevante Publikationen und im Anschluss daran themenbezogene Artikel Artikel“ erarbeitet. über die Verlinkung „ähnliche -83. Ergebnisse 3.1 Übergänge, Grenzflächen und Spaltbildung an Implantaten Je nach Art der industriellen Fertigung und Typ des Implantataufbaus gibt es drei verschiedene aneinandergrenzende Nahtstellen eines Implantates. Die basalste Grenzfläche (r/s) befindet sich zwischen der rauen osseoinduktiven Oberfläche des Implantates und dem meist maschinell polierten oder beschichteten glatten Kragen (smooth collar) des Implantates. Weiter cranial schließt sich die Nahtstelle zwischen dem Implantat und dem transmukösen Aufbau an (ITAI). Hier handelt es sich im Gegensatz zu der erstgenannten Grenzfläche um einen echten Spalt (microgap). Die dritte Nahtstelle bildet der Übergang zwischen dem transmukösen Aufbau und der prothetischen Versorgung (TAPI). Auch bei dieser Nahtstelle liegt ein Mikrospalt vor.(39) Bei einem einteiligen Implantatsystem gibt es nur den Spalt zwischen dem Implantat und dem prothetischen Aufbau (IPI). Die Lage zum crestalen Knochen variiert je nach Implantatsystem. Im Folgenden wird der Zusammenhang zwischen Plaquebildung bzw. bakterieller Besiedlung der Implantatoberfläche und den einzelnen Übergangsregionen (Interface) in der Literatur untersucht. 3.1.1 Übergänge, Grenzflächen und Spaltbildung zwischen osseointegrierender Implantatoberfläche und poliertem Implantathals Bei dieser Nahtstelle handelt es sich nicht um einen echten Spalt, sondern nur um den Übergang zweier verschiedener Oberflächen. Auch hat dieser Übergang keinen funktionellen Nutzen, dennoch besteht die Möglichkeit einer bakteriellen Besiedlung, wenn eine Verbindung zum periimplantären Sucus besteht.(39) In elektronenmikroskopischen Untersuchungen konnte eine signifikante Plaqueakkumulation am Übergang der osseoinduktiven Implantatoberfläche und dem polierten Schmutzkragen des Implantates (r/s) nachgewiesen werden.(17) In einer Untersuchung von Hermann et al. zeigen die Ergebnisse, dass bei inserierten Implantaten das krestale Knochenniveau nach Einheilung des Implantates auf Höhe des Überganges r/s liegt.(27,28) Voraussetzung hierbei ist das Fehlen eines Spaltes oberhalb -9dieser Grenze, also ein einteilig offen eingeheiltes Implantat, oder eine Entfernung eines Spaltes (ITAI oder TAPI) von r/s von mehr als 2mm.(27,28) Dabei ist es unabhängig, ob es sich um eine geschlossene bzw. nicht geschlossene Einheilung der Implantate, bzw. um einteilige oder zweiteilige Implantatsysteme handelt. In dieser Untersuchung wird der Zusammenhang zwischen dem r/s Übergang, seine Beziehung zum krestalen Knochen und der Einfluss auf die röntgenologische Höhe des ersten KnochenImplantatkontaktes aufgezeigt. Diese Ergebnisse wurden durch neuere Untersuchungen in einer Studie von Alomrani et al. bestätigt.(7) 3.1.2 Übergänge, Grenzflächen und Spaltbildung zwischen Implantat und Abutment Bei den osseointegrierten Implantaten wird zwischen einzeitigen und zweizeitigen Implantaten unterschieden. Aufgrund der unterschiedlichen chirurgischen Vorgehensweise bei der Implantation resultiert ein konstruktiver Unterschied. Bei geschlossen einheilenden, zweizeitigen Implantatsystemen liegen zwei Spalten auf unterschiedlicher Höhe vor. Der untere Spalt am ITAI liegt nahe des krestalen Knochenniveaus, der obere des TAPI befindet sich in der Nähe des marginalen Schleimhautrandes am Übergang zum prothetischen Aufbau. Bei den einzeitigen, offen einheilenden Implantaten fehlt der transgingivale Aufbau und man findet nur den Spalt zwischen dem Implantat und dem prothetischen Aufbau. Je nach System liegt er auf einer Höhe zwischen krestalen Knochenrand und dem Rand marginalen Schleimhaut.(39) Genaugenommen müsste dieser als Implant-Prothesis interface (IPI) bezeichnet werden. Spaltbildung an der Implantatoberfläche unterstützt deren Besiedlung mit bakterieller Plaque und verhindert, dass der entstandene Biofilm zersetzt werden kann. Dieses führt im periimplantären Gewebe zur Entzündung und kann zum krestalen Knochenverlust führen. Bei der Spaltbildung spielen die Größe, die Lage zum krestalen Knochenniveau, seine Beweglichkeit, der Zeitpunkt der Spaltentstehung, so wie das Fehlen bzw. das Vorhandensein des Spaltes unterschiedliche Rollen. Die Beteiligung des Mikrospaltes in Zusammenhang mit der periimplantären Entzündung ist belegt. So kommt es zur Fistelbildung aufgrund gelockerter Implantataufbauten.(2,32) Die Fisteln verschwinden wieder, wenn die Aufbauten fest angezogen werden.(2,32) - 10 Untersuchungen im Tierversuch zeigen, dass die Positionierung des ITAI die Knochenhöhe selber beeinflusst.(17,28) Als Ergebnis dieser Studien lassen sich folgende Aussagen festhalten: 1. Das Knochenniveau reicht maximal bis zum Übergang der osseoinduktiven Implantatoberfläche und poliertem Implantathals (r/s), wenn kein Spalt am ITAI vorliegt (einteilige geschlossen einheilende Implantate). 2. Wenn ein Spalt vorhanden ist (ITAI), liegt das krestale Knochenniveau nach Einheilung des Implantates immer ca. 2mm unterhalb des Spaltes. 3. Der Knochenverlust tritt im zeitlichen Zusammenhang mit der Positionierung des Spaltes (ITAI) auf (bei den einzeitigen Implantaten sofort nach Implantation, bei den zweizeitigen Implantaten erst nach Einbringen des transmukösen Aufbaus). 4. Die Höhe des Knochenverlustes und damit Höhe des krestalen Knochenrandes bestimmt die Lage des Spaltes (ITAI), nicht der Übergang der rauen zur glatten Implantatoberfläche (r/s). 5. Es besteht kein Zusammenhang zwischen offener und geschlossener chirurgischer Vorgehensweise. Dabei heilen die einteiligen Implantate ohne bzw. mit nur geringen Entzündungsanzeichen, die zweiteiligen mit ITAI mit deutlichen bis starken Entzündungszeichen ein.(28) Die Größe des ITAI wird in verschiedenen Studien in einem Mittel von 2 bis 7µm (44), 5 bis zehn µm (30), zehn bis 15 µm (12), 20,0 bis 40,5 µm (39), 20 bis 49 µm (11) bzw. 40 bis 60 µm (63) angegeben. Auch wenn dieses wenig erscheint, so lässt sich bei einer durchschnittlichen bakteriellen Größe von 2 µm mikrobielle Plaque und bakterielle Penetration in einen Spalt schon bei einer Größe von nur 10 µm nachweisen.(53) Die bakterielle Besiedlung erfolgt hierbei nicht nur entlang des ITAI, sondern auch durch den Spalt in das Innere der einzelnen Implantatkomponenten, so wie entlang der Schraubenverbindung innerhalb des Implantatabutments.(53) Der dadurch bedingte bakterielle Rückfluss aus dem Implantatinneren in das periimplantäre Gewebe erschwert die Behandlung der Periimplantitis. Die Größe des Spaltes spielt jedoch nur eine untergeordnete Rolle.(26,34) Der Vergleich zwischen einteiligen und zweiteiligen - 11 Implantaten zeigt, dass das alleinige Vorhandensein des ITAI der entscheidende Faktor ist.(34) Der zeitliche Zusammenhang zwischen Knochenverlust und Spaltentstehung am ITAI unterstreicht diese Ergebnisse.(27,28) Weitere Untersuchungen zeigen den Zusammenhang zwischen der Beweglichkeit des ITAI und dem daraus resultierenden Knochenverlust auf.(26) Bei gleichen Implantattypen (7mm Länge, innerer Durchmesser 3,5mm, äußerer Durchmesser 4,1mm, Zylinderform, gestrahlte bzw. geätzte Titanoberfläche mit 20µm bzw. 40µm Rauigkeit, 3mm maschinell poliertem Aufbau), wurde der Aufbau jeweils mit einer Spaltbreite von unter 10µm, 50µm und 100µm eingebracht. In einer Vergleichsgruppe wurde der Aufbau jeweils durch vier Laserpunkte mit dem Implantat verbunden, eine Beweglichkeit zwischen den Implantatteilen damit verhindert. Der ITAI lag immer 1mm suprakrestal und der Übergang zwischen osseoinduktiver Implantatoberfläche und poliertem Implantatkragen auf Höhe des Knochenrandes. Während die Implantate mit dem gelaserten Aufbau generell keine bzw. nur minimale Entzündungszeichen aufwiesen, zeigte die Gruppe mit den beweglichen Aufbauten mäßige bis starke Grade der Entzündung.(26) Andere Untersuchungen kommen zu dem Ergebnis, dass ein Verschluss des ITAI durch Zementierten der Aufbauten Vorteile gegenüber verschraubten Aufbauten bringt, da so eine Penetration von Bakterien in das Implantatinnere vermieden wird.(44) Während geschraubte Aufbauten einen Spalt von 60µm aufwiesen und Bakterien sowohl im Spalt, als auch in inneren Gewindegängen vorhanden waren, zeigten zementierte Aufbauten nur einen Spalt von 40µm und waren gänzlich mit Zement aufgefüllt. Hier konnten keine Bakterien am Spalt oder gar im Inneren des Implantates festgestellt werden.(63) Die Spaltgröße des ITAI wird darüber hinaus auch von nicht axialen Fehlbelastungen des Implantataufbaus beeinträchtigt. Eine Verwindung des Aufbaus ermöglicht zusätzlich durch Aufbiegen des Spaltes das Eindringen von Bakterien bis in das Innere des Aufbaus.(39) Neuere Untersuchungen stützen die Ergebnisse.(7) Parodontalpathologische Untersuchungen von Broggini et al. (2006) zeigen den Zusammenhang zwischen Lokalisation des ITAI und der Veränderung der Zellzusammensetzung der periimplantären Entzündung auf. Alle Implantate zeigen hierbei ein ähnliches Muster auf. Neutrophile polymorphkernige Leukozyten häufen sich dabei koronal des ITAI an. Die Zellvermehrung steigert sich dabei progressiv der Tiefe des ITAI. Subkrestale Spalten führen zu einer stark erhöhten neutrophilen - 12 Zelldichte gegenüber suprakrestal gelegenen Spalten und sind deutlich mit Knochenverlust verbunden. Im Gegensatz dazu hat die suprakrestale Lage des ITAI keine Bedeutung für die Zellzusammensetzung aus neutrophilen oder mononuklearen Zellen oberhalb des Knochenrandes.(15) Die bakterielle Besiedlung auf Mikrospaltebene wird auch von Covani et al. bestätigt, die eine Anhäufung von Kokken und Filamenten mit orthogonaler Ausrichtung zur Längsachse des Implantates ausmachten.(110) 3.1.3 Übergänge, Grenzflächen und Spaltbildung zwischen Abutment und prothetischem Aufbau Die Spaltbildung an dem TAPI fällt im Vergleich zum ITAI in verschiedenen Untersuchungen größer aus. Die Spaltgrößen variieren von 28,1 + 9,8 µm (66), 31 bis 62 µm (11), 66,0 + 15,8 µm (66) bis zu Werten von 35,0 bis 75,0 µm bei einem Mittel von 5,4 + 36,4 µm (39). Die Unterschiedlichkeit liegt teilweise an der Fixierung des prothetischen Aufbaus, wobei der zementierte Aufbau eine größere Spaltbildung mit sich bringt.(66) Eine Untersuchung von Keller et al. zeigt auf, dass ein Durchsickern von Bakterien in den Spalt zwischen transmukösem Aufbau und prothetischer Versorgung eine wichtige Rolle bei der bakteriellen Besiedlung vom Implantatinneren bei verschraubten Implantaten spielt. Die Entzündungsparameter bei den zementierten Aufbauten sind gegenüber den verschraubten Aufbauten nur leicht erhöht und klinisch nicht signifikant.(33) 3.1.4 Übergänge, Grenzflächen und Spaltbildung zwischen Implantat und prothetischem Aufbau In einer Studie von Vela-Nebot et al. wurden 30 Implantate mit modifiziertem Aufbau untersucht. Der Versuchsgruppe wurde eine Kontrollgruppe mit ebenfalls 30 Implantaten gegenübergestellt. Der Unterschied zwischen den beiden Gruppen bestand im Durch-messer des Aufbaus. Während in der Kontrollgruppe (Gruppe1) der Aufbau denselben Durchmesser wie das Implantat aufwies, wurde der Durchmesser des Aufbaus in der Versuchsgruppe modifiziert und gegenüber dem Implantatdurchmesser - 13 verkleinert (platform shifting), mit dem Ziel, die bakterielle Invasion zu minimieren. Die approximale Knochenresorption wurde durch digitale Röntgenkontrolle nach einem, vier und sechs Monaten kontrolliert. An den mesialen Messpunkten der Kontrollgruppe wurde eine Resorption von 2,53mm, an den distalen Messpunkten eine von 2,56mm festgestellt. An den Versuchsimplantaten wurde hingegen an den distalen Messpunkten eine Resorption von nur 0,76mm, an den mesialen von nur 0,77 festgestellt. Die Knochenresorption war in der Versuchsgruppe deutlich reduziert (P<0,0005).(70) 3.2 Oberflächenrauigkeit Viele Untersuchungen beschäftigen sich mit dem Zusammenhang der Oberflächenrauigkeit und der daraus resultierenden Plaqueadhäsion. Dabei werden die unterschiedlichsten Oberflächen (Zähne, Kronen, Implantate und Implantataufbauten) teilweise für sich alleine, teilweise im Vergleich zueinander untersucht. Ihnen allen ist gemeinsam, dass die Rauigkeit der jeweiligen Oberfläche die zu untersuchende Größe darstellt. Untersuchungen mit dem Rasterelektronenmikroskop (REM) zeigen eine mäßige bis schwere Plaqueansammlung auf der Oberfläche des transgingivalen Aufbaus. Die Oberflächenrauigkeit (Ra) liegt zwischen 0,157 und 1,036 µm, der Mittelwert beträgt 0,548 µm.(39) Dabei zeigen raue Oberflächen eine bis zu 25-fach erhöhte Bakterienanhaftung, gegenüber glatten Oberflächen.(47) Weitere Untersuchungen geben eine kritische Rauigkeit von Ra = 0,2 µm (13) bzw. 0,088 µm (60) an, unterhalb derer Werte es keine signifikanten Veränderungen in der bakteriellen Plaqueakkumulation mehr zu geben scheint. Untersuchungen an sechs verschiedenen Aufbauten gängiger Implantatsysteme ergaben einen Mittelwert von unter Ra = 0,3.(52) Bollen et al. stellt die kritische Rauigkeit von 0,2µm für die bakterielle Plaqueakkumulation anderen dentalen Materialien (Zähne, Implantataufbauten, Gold, Amalgam, Resinzement, Glasionomeren, Kompomeren und Keramiken) und den Folgen auf deren Oberflächenrauhigkeit durch verschiedene Bearbeitungsvorgänge gegenüber.(14) In einer Splitmouth Studie untersuchten Quirynen et al. die bakterielle Besiedlung von vier unterschiedlichen Implantataufbauten, sowohl supra-, als auch subgingival nach - 14 einem und nach drei Monaten. Hinsichtlich der bakteriellen Zusammensetzung gab es nur wenig Unterschiede zwischen den verschiedenen Oberflächen, überall wurden grampositive und gramnegative Stäbchen gefunden. Es konnten keine Unterschiede bei der Anzahl der CFU analysiert werden. Gleiches wurde für die subgingivale Plaque festgestellt. Die Ergebnisse dieser Studie zeigen, dass eine Reduktion der Oberflächenrauigkeit unterhalb von 0,2µm keinen weiteren Effekt auf die mikrobielle Plaqueentstehung hat, weder supra-, noch subgingival und bestätigen eine „GrenzwertRauigkeit“ von 0,2µm.(48) Untersuchungen der Rauigkeit von Oberflächen in Verbindung mit der sfe von Quirynen et al. bestätigen eine dramatische Verzögerung der Plaquebildung und der Plaquereifung bei Verminderung der Oberflächenrauigkeit, die ggü. der sfe den deutlich größeren Einfluss auf die Plaquebildung hat.(47,55) Zitzmann et al. vergleicht die Reaktion der periimplantären Mukosa auf Plaqueansammlung auf Implantataufbauten. Es wurden Oberflächen unterschiedlicher Rauigkeit getestet, eine raue säuregeätzte und eine glatte polierte Oberfläche. Das Ergebnis dieser Studie ergab trotz unterschiedlicher Oberflächenbeschaffenheit der Implantataufbauten keine Auswirkung auf die Plaquebildung und die Bildung entzündlicher Zellläsionen in der periimplantären Mukosa.(101) Eine Übersichtstabelle von Teughels et al. mit insgesamt 24 klinischen Studien in einem Zeitraum von 1972 bis 1997 zeigt eine Zusammenfassung der Auswirkung der Oberflächenrauigkeit auf die Bildung der supra- und subgingivalen Plaque.(67) 3.3 Materialien und Beschichtungen Titan ist als Werkstoff in der Implantologie nicht mehr wegzudenken. Es ist korrosionsbeständig, ruft keine erkennbaren Überempfindlichkeitsreaktionen, allergische oder immunologischen Reaktion hervor. Aufgrund der Oxidschicht seiner Oberfläche ist es im hohen Maße biokompatibel und wegen seiner guten Verträglichkeit im Knochen ist es mittlerweile der Werkstoff der Wahl. Neben der Spaltbildung und der Oberflächenrauigkeit hat auch das Material als solches Bedeutung für die Plaqueretention. In letzter Zeit wurden zunehmend Untersuchungen vorgenommen, den Werkstoff Titan zu verändern, zu beschichten oder gegen einen anderen Werkstoff zu ersetzen mit dem Ziel, im suprakrestalen periimplantären Bereich die Plaqueakkumulation zu vermeiden bzw. zu verringern. - 15 Größner-Schreiber et al. verglichen in einer Studie vier verschiedene beschichtete Titanoberflächen auf die Adhärenz von Streptococcus mutans bzw. Streptococcus sanguis. Die dabei verwendeten Titanscheiben wurden mit Titannitrit (TiN) oder Zirconnitrit (ZiN) beschichtet, thermisch oxidiert (TiO2) oder es wurde durch eine Hardlaserbehandlung eine Oberflächenveränderung hervorgerufen. Als Kontrollgruppe diente poliertes Titan. Die untersuchten Oberflächen waren annähernd gleich, ihre Rauigkeit (Ra) lag zwischen 0,14µm und 1,00µm. Die freie Oberflächenenergie (sfe) zeigte bei allen untersuchten Gruppen ähnliche Werte (34,3 mN/m bis 38,7 mN/m). Auf den mit den Hartstoffschichten (TiN/ZiN) beschichteten Titanscheiben und den oxidierten Titanoberflächen wurde eine signifikant geringere Bakterienadhärenz im Vergleich zu den polierten Titanoberflächen festgestellt.(22) Eine in vivo Studie bestätigt die oben gewonnen Ergebnisse. Titannitrit und Zirkonnitrit beschichtete Keramikträger wurden im Vergleich zu reintitanbeschichteten Plättchen für 60 Stunden dem Mundmilieu ausgesetzt. Im Anschluss daran wurde der Biofilm analysiert. Auf dem mit Reinkeramik beschichteten Keramikplättchen wurde eine höhere Bakterienzahl gezählt als auf den TiN und ZiN beschichteten. Die niedrigsten Bakterienansammlungen wurde auf den mit Zirkonnitrit beschichteten Keramikplättchen festgestellt. Zusätzlich konnte nachgewiesen werden, dass die metabolische Aktivität der Bakterien auf den mit TiN und ZiN beschichteten Oberflächen niedriger waren als auf den titanbeschichteten.(23) Der Vergleich zwischen 30 hydroxylapatitbeschichteten Implantaten und zehn Reintitanimplantaten ohne Beschichtung ergab keine signifikanten klinischen oder mikrobiologischen Unterschiede.(57) Zu dem gleichen Ergebnis kamen auch Morris et al..(38) Scarano et al. untersuchten in einer in vivo Studie die Bakterienadhärenz an ReintitanScheiben (Kontrollgruppe) und Zirkonoxid-Scheiben, welche 24 Stunden dem Mundmilieu ausgesetzt wurden. Bei annähernd gleicher Oberflächenrauigkeit innerhalb beider Gruppen fand sich in der Kontrollgruppe eine Bakterienbesiedlung von 19,3%+2,9%; in der Testgruppe eine Besiedlung von 12,1%+1,96%. Die Bakterienbesiedlung der mit zirkonoxidbeschichteten Scheiben war deutlich niedriger (P=0,0001).(62) In einer anderen in vivo Studie wurden TiN beschichtete und nicht beschichtete Implantate auf die bakterielle Adhäsion untersucht. Die Oberflächenrauhigkeit war annähernd gleich. Nach 24 Stunden im Mundmilieu wurden die Implantate - 16 rasterelektronenmikroskopisch untersucht. Die TiN beschichteten Implantate zeigten eine deutlich niedrigere Bakterienadhäsion.(61) Ergebnisse aus der Humanmedizin zeigen den Einfluss von Human Serum Albumin (HSA) auf die bakterielle Anheftung auf Titanimplantaten. In Abhängigkeit von der Konzentration der HSA-Beschichtung reduzierte sich die bakterielle Besiedlung durch Staphylococcus aureus an Titanoberflächen in einer in vitro Studie um bis zu 95% und die Besiedlung durch Pseudomonas aeruginosa um bis zu 37%.(35,42) 3.4 Freie Oberflächenenergie Die Annäherung von Bakterien verläuft in vier verschiedenen Phasen, in denen jeweils verschiedene Kräfte und Mechanismen zwischen dem Bakterium und der Oberfläche wirken. Ab einer Entfernung von unter 50nm wirken die van der Waalschen Kräfte (GA) anziehend auf die Grenzflächen. Bei einer weiteren Annäherung der Grenzflächen werden zusätzlich die elektrostatischen Kräfte (GE) zwischen Bakterium und Oberfläche wirksam. In dieser Phase der initialen Adhäsion ist der Zustand der Adhäsion zunächst reversibel (R) bei weiterer Annäherung irreversibel (IR). Es folgen die Anheftung des Bakteriums (3. Phase) und die Kolonisation (4. Phase). Die Kraft, mit der ein Bakterium an eine Oberfläche angezogen wird, resultiert in diesem Stadium aus der Summe der beiden genannten Kräfte (GA+GE) und ist abhängig von der Entfernung beider Grenzfläche zueinander. Sie wird auch Gibbs-Energie genannt (Gtot=GA+GE). Es werden drei Arten verschiedener Ionisierungskräfte beobachtet: schwache (L), mittlere (M) und hohe (H) ionisierende Kräfte. Elektrostatische Wechselwirkungen beginnen, wenn sich die elektrischen Felder des Bakteriums und der Oberfläche überschneiden. Dabei gibt es eine feste Oberfläche T (z.B. Zahn, Implantat), die Bakterienoberfläche C und die Dicke der elektrischen Felder (t). Je nach der Stärke von GE und GA und dem Abstand der Oberflächen zueinander ergibt sich für die resultierende Gibbs-Energie (Gtot) ein negativer bzw. positiver Wert und damit eine resultierende Anziehung bzw. Abstoßung. Bei der Annäherung des Bakteriums an die Oberfläche muss je nach Ionisierungsgrad des Bakteriums bzw. der Oberfläche und den daraus resultierenden elektrischen Feldern zuerst ein Widerstand bzw. eine Kraft über eine Grenzkraft (B) hinweg aufgeboten werden, um es zur irreversiblen Adhäsion des Bakteriums kommen zu lassen. Diese ist erkennbar durch den Abfall des Wertes für die Gibbs-Energie (Gtot). Die irreversible Adhäsion bei niedrig ionisierenden Kräften (L) - 17 liegt bei einem Minimalabstand der Oberflächen von <2nm. Bei den mittleren ionisierenden Kräften liegt eine Zone der äußeren niedrigen Energie bei +10nm Oberflächenabstand und die Höhe der aufzuwendenden Kraft (Gto t) bei B ist geringer. Bei den hoch ionisierenden Kräften ist Gtot immer negativ. In diesem Fall können alle Teilchen den Zustand der irreversiblen Adhäsion erreichen. Sind die Oberflächen gegensätzlich gepolt, so unterstützen sich die Kräfte GA und GE und es kommt ohne Schwierigkeiten zur irreversiblen Adhäsion.(51,67) Bakterien und Oberflächen sind vornehmlich negativ geladen und Bakterien eher große Partikel. Für Bakterien liegt die Entfernung zur Oberfläche für das äußere Energie Minimum (secundary minimum) bei zwischen 5 und 20nm zur Oberfläche.(68) Überschreitet das Bakterium die Energiegrenze B und erreicht den direkten Kontakt mit der Oberfläche (primary minimum), entstehen neue Verhältnisse der Oberflächen zueinander. Vor dem Kontakt gibt es je eine Grenzfläche zwischen dem Bakterium und dem Lösungsmittel (bl) bzw. dem Festkörper und dem Lösungsmittel (sl). Nach dem irreversiblen Kontakt von Bakterium und Festkörperoberfläche wird das Lösungsmittel verdrängt. Daraus resultiert der direkte Oberflächenkontakt vom Bakterium zur Festkörperoberfläche (sb). Dieser Wandel an den Oberflächen wirkt sich über eine Veränderung der Gibbs-Energie auf die Adhäsion des Bakteriums aus und wird mit folgender Formel beschrieben.(1,10) Δ Gadh = γsb - γsl – γbl In dieser Funktion wird die freie Oberflächenenergie eines Bakteriums (Δ Gadh) für die Adhäsion an einer Oberfläche ins Verhältnis zur freien Oberflächenenergie der Festkörper-Bakterium-Grenzfläche (γsb), der Festkörper-Lösungsmittel-Grenzfläche (γsl) und der Bakterium-Lösungs-Grenzfläche (γbl) gesetzt. Hierbei wird unterstellt, dass der Effekt, elektrische Ladungen, wie auch spezifische biochemische Wechselwirkungen vernachlässigt werden können. Ist Δ Gadh negativ, verläuft die Adhäsion spontan. (vgl. 51,67) Bei einer Untersuchung wurden Streifen aus Fluorethylenpropylene (FEP) und Celluloseacetat (CA) auf die labialen Zahnflächen von 16 Probanten aufgebracht. Die sfe betrug für das FEP 20, für das CA 58 und für den natürlichen Zahn 88 erg/cm². Die Rauigkeit der Streifen betrug je zur Hälfte Ra +0,1µm und Ra +2,2µm. Der Vergleich - 18 nach sechs Tagen ergab für das glatte FEP eine Plaquebehaftung von 19,4% gegenüber dem gleich glatten CA von 39,5%. Zwischen den rauen Oberflächen gab es keine Unterschiede. Die Ergebnisse dieser Studie unterstreichen den Einfluss der sfe auf die Plaqueakkumulation.(47) Bei dem Vergleich zweier Implantataufbauten mit unterschiedlichen Oberflächen (Titan und FEP) zeigten die Ergebnisse nach drei Monaten einen signifikanten Unterschied, vor allem in der supragingivalen Plaquezusammensetzung. FEP-beschichtete Aufbauten beherbergten vermehrt Kokken, während Spirochäten und bewegliche Erreger nur um den Titanaufbau zu finden waren. Die subgingivale Plaquebildung war auf dem Titanaufbau fünfmal höher bezüglich der CFU als auf dem FEP beschichteten Aufbau, erreichte jedoch keinen signifikanten statistischen Wert. Es bestätigt sich eine Reduzierung der Bakterienkolonisation und eine Verminderung des Reifegrades für die supragingivale Plaque, für die subgingivale Plaque ist der Einfluss der sfe nicht eindeutig.(49) Der Einfluss der sfe einer Oberfläche auf die sfe eines adhärenten Bakteriums zeigt sich darin, dass Oberflächen mit niedrigen sfe vornehmlich von Bakterien mit niedrigem sfe besiedelt werden. Den gegenteiligen Effekt beobachtet man bei Werkstoffoberflächen mit einer hohen sfe, wie z.B. Titan oder Keramik.(36,71) 16 oberflächenbehandelte Titanproben mit einer Rauigkeit von Ra 0,03457 bis 0,44942 µm wurden verschiedenen Polituren unterzogen, weitere sechs Proben wurden mit Argon-Plasma-Verfahren bearbeitet und in Siliciumwasserstoff getaucht, um unterschiedliche hydrophobe Eigenschaften zu erzielen. Porphyromonas gingivalis wurde zur Untersuchung der unterschiedlichen Bakterienadhärenz eingesetzt. Während die glatteren Oberflächen zu einer Reduzierung der Adhärenz führten, hatte die Oberflächenveränderung bezüglich der Hydrophobie keine Auswirkung auf die Plaquebildung.(46) Eine Zusammenfassung verschiedener Studien aus einem Zeitraum von 1969 bis 1993 findet sich in einem Review von Teughels et al. (2006).(67) - 19 4. Diskussion Die Entstehung bakterieller Plaque verläuft in vier Phasen (s.a. Einleitung). Dabei ist sie abhängig von chemischen, physikalischen, physiologischen und zellulären Prozessen, welche teilweise reversibel sind. Das Implantatdesign kann bezüglich der Materialzusammensetzung, der Oberflächenbeschaffenheit und seines Makrodesigns unterstützend oder hemmend auf den Prozess der bakteriellen Biofilmbildung Einfluss nehmen. Im Folgenden werden die einzelnen Parameter diskutiert. 4.1 Übergänge, Grenzflächen und Spaltbildung 4.1.1 Übergänge, Grenzflächen und Spaltbildung zwischen osseointegrierender Implantatoberfläche und poliertem Implantathals Nach chirurgischer Insertion eines Implantates kommt es im ersten Jahr zu einer hinnehmbaren Knochenresorption von ca. 1,2 mm bzw. 0,4mm bis 1,6mm aufgrund des chirurgischen Traumas.(3,29) An der Nahtstelle (r/s) zwischen der osseointegrierenden Implantatoberfläche, welche während des chirurgischen Insertion des Implantates möglichst vollständig in den krestalen Knochen versenkt wird, und den sich coronal anschließenden durch Politur und/oder Beschichtung glatt gestalteten Implantathals, befindet sich nach erfolgreicher Implantateinheilung der krestale Knochenrand, unabhängig des chirurgischen Vorgehens (offene oder geschlossene Einheilung) bzw. vom Implantatsystem (einteilig oder zweiteilig).(7,27,28) Ein problematischer Knochenverlust an dieser Nahtstelle entsteht erst, wenn Bakterien von coronal aus dem oro-pharyngialen Bereich penetrieren können. Dann kommt es zur Periimplantitis aufgrund bakterieller Besiedlung vor allem an der raueren osseointegrierenden Implantatoberfläche. Dieses ist jedoch mehr als ein Problem der Oberflächenrauigkeit an r/s und weniger als eines der Übergänge der Grenzflächen als solche zu verstehen. Die eigentliche Ursache für die bakterielle Besiedlung scheinen eher Übergänge und Spaltbildungen zu sein, welche weiter coronal gelegen sind.(43,56) - 20 4.1.2 Übergänge, Grenzflächen und Spaltbildung zwischen Implantat und Abutment, Abutment und prothetischem Aufbau sowie Implantat und prothetischem Aufbau Die Ergebnisse der klinischen Studien hinsichtlich der Spaltbildung im Implantatdesign und dem bakteriell bedingten Knochenabbau der Periimplantitis zeigen, dass es bei der bakteriellen Plaquebildung weniger von der Art des Spaltes - Spalt zwischen Implantat und transmukösem Aufbau (ITAI), zwischen Implantat und Prothetik (IPI) bzw. zwischen transmukösem Aufbau und Prothetik (TAPI) - als vielmehr von seinen verschiedenen Eigenschaften abhängt. Aus diesem Grunde wird hier die Diskussion der Ergebnisteile 3.1.2., 3.1.3. und 3.1.4. zusammengefasst. Entscheidend für die Plaqueakkumulation beim Implantatdesign scheinen die Größe eines Spaltes (11,12,30,39,44,63,66), seine Mobilität bzw. die der Spalt bildenden Bauteile zueinander (118) und die Lage des Spaltes zu den periimplantären Hart- und Weichgeweben (15,18,27,28) zu sein. Die Untersuchungen lassen den Schluss zu, dass die Oberflächengestaltung von Implantaten dahingehend verbessert werden sollte, dass eine Spaltbildung im Implantatdesign generell eliminiert wird.(39) Da es sich bei der Implantologie jedoch um eine Zusammenarbeit verschiedener zahnärztlicher Fachrichtungen wie Chirurgie, Prothetik und Parodontologie handelt, wird eine Spalteliminierung nur selten oder gar nicht zu erreichen sein. Beim Knochenaufbau vor oder während der Implantation und durch Maßnahmen zur Weichgewebsregeneration und -gestaltung hinsichtlich der Optimierung der roten Ästhetik, wird bei einem geschlossen einheilenden, zweizeitigen und damit mehrteiligem Implantatsystem immer ein Spalt vorhanden ein. Zur Minimierung des Spaltes gibt es derzeit diverse Verfahrensansätze. Andere Implantatsysteme versuchen durch eine spezielle Ausformung des Implantathalses die Spaltbildung zum Implantataufbau möglichst klein zuhalten und eine Bakterienundurchlässigkeit zu erreichen. Mit dem Locking-Taper-System konnte erreicht werden, dass der Spalt weder von außen nach innen, noch in anderer Richtung bakteriendurchlässig war.(19) Durch die einwirkenden Kräfte beim Anziehen der Verschraubung kann es jedoch zu einer unerwünschten Kaltverschweißung der Bauteile kommen. Vor- und Nachteile gilt es auch hier abzuwägen. Der bakterielle Befall des - 21 Mikrospaltes steht auch im direkten Zusammenhang mit der Kraft, mit der die Verschraubung des Aufbaus angezogen wird.(21) Ein anderer Weg vorhandene Spalten zu eliminieren ist ein Auffüllen der Implantat- und Aufbauholräume mit Sealern, wie z.B. „gap-seal“ (64) oder “cervitec” (20), die das Eindringen von Bakterien verringern bzw. vermeiden sollen. Dabei ist eine Reduzierung der Bakterienzahl um das bis zu 500-fache möglich, jedoch nur für einen vergleichsweise kurzen Zeitraum von fast neun Monaten.(64) Die Zementierung von Implantatteilen bewirkt gegenüber der Verschraubung ebenfalls eine Abdichtung eines Spaltes. In einigen Studien zeigt sich die Spaltgröße zwar erhöht (66), und die Entzündungsparameter dadurch nicht signifikant verändert (33), neuere Untersuchungen über einen Zeitraum von 16 Jahren kommen jedoch auf eine Spaltreduzierung von 60µm auf 40µm und eine deutliche Verringerung der Bakterienzahl am Spalt bzw. keine Bakterienbesiedlung des Implantatinneren.(63) Es mag hier der Verweis auf die endodontische Problematik der dauerhaften bakteriellen Penetration aus einem unvollständig abgefüllten, bzw. einem nicht aufbereiteten Wurzelkanal erlaubt sein. In diesem Fall gilt es, den Wurzelkanal zuallererst keimfrei und sodann bakteriendicht abgefüllt zu bekommen. Die Abdichtung des Spaltes und des Implantatinneren birgt eine ähnliche Kausalität. Die Größenordnung der Spaltbildungen zwischen den einzelnen Implantatteilen wird in dem Moment unerheblich, wenn es zur unkorrekten Anordnung oder schlechten Passform der Implantateinzelteile kommt. Es resultiert ein Rand oder schlecht sitzende Gewindegänge. Eine bakterielle Besiedlung ist auch bei guter Mundhygiene des Patienten nicht zu verhindern. Die Passform und der genaue Sitz der prothetischen Aufbauten sollte nach Fertigstellung der Arbeit und nach jedem neuen Zusammenbau röntgenologisch kontrolliert werden.(39) Eine zu große Ausdehnung von Implantatkronen kann neben Biegekräften im Knochen auch eine Aufbiegung von Implantatspalten mit bakterieller Besiedlung hervorrufen. Neben der Größe des Spaltes ist die Verringerung der Mobilität von Implantatteilen untereinander ein weit wichtigerer Faktor in der Genese der Plaquebildung.(26) Durch die Beweglichkeit der Spalten gelangen Bakterien durch den Spalt ins Innere der Implantate bis in die Verschraubung und können von dort wieder in das periimplantäre Gewebe penitrieren. Der Innensechskant zur Rotationssicherung bei vielen gängigen Implantatsystemen trägt diesem Umstand Rechnung. Eine weitere Optimierung der - 22 Passgenauigkeit, wie z.B. bei dem Camlog-Implantatsystem, muss Ziel weiterer Studien sein. Die Lage eines Spaltes zum periimplantären Gewebe scheint ein weiterer wichtiger Faktor bei der Plaqueentstehung zu sein. Dabei variiert das Keimspektrum je nach Lage des Spaltes zum Knochen.(15,17) Eine direkte Beziehung scheint hierbei für die Entfernung des Spaltes zum krestalen Knochenniveau bei zweiteiligen Implantaten zu bestehen. Im zeitlichen Zusammenhang mit einer Spaltentstehung (Montieren des Aufbaus) kommt es zur Knochenresorption bis 2mm unterhalb des Spaltes (27,28) auch bei nicht belasteten Implantaten. Eine Resorption aufgrund Fehlbelastungen kann hier ausgeschlossen werden. Der Zusammenhang zwischen Knochenabbau und bakteriell induzierter Periimplantitis scheint sich hier zu bestätigen. Dabei scheint das chirurgische Vorgehen (offenes bzw. geschlossenes Einheilen des Implantates) keine Rolle zu spielen. Da es einteiligen offeneinheilenden Implantatsystemen am ITAI fehlt, mag diesem Design aufgrund des fehlenden Spaltes in der Nähe des krestalen Knochens gegenüber anderen Designvarianten hinsichtlich der Plaqueretention der Vorzug gegeben werden. 4.2 Oberflächenrauigkeit Die Oberflächenrauigkeit scheint vor allem in der vierten Phase der bakteriellen Plaqueakkumulation von besonderer Bedeutung zu sein. Auf rauen Oberflächen sind Bakterien besser vor abscherenden Kräften geschützt, als dieses auf glatten Oberflächen der Fall ist. Der Übergang von der reversiblen zur irreversiblen Adhäsion verläuft einfacher, vielleicht auch schneller. Die Anheftung beginnt an Oberflächenunregelmäßigkeiten, wie z.B. Einziehungen, Kerben oder Kanten. Ein Anrauen von intraoralen Oberflächen resultiert in einer erhöhten Plaqueakkumulation, die in einer Periimplantitis und Implantatverlust enden kann. Neben dem Schutz vor abscherenden Kräften in den Nischen der Oberflächen ist die Oberflächenzunahme bei erhöhter Rauigkeit eine mögliche Erklärung der bakteriellen Plaquezunahme. Die für Bakterien erreichbare Oberfläche kann um das Zwei- bis Dreifache zunehmen. Es stellt sich weiterhin die Frage, ob eine Plaquezunahme auf der Oberfläche das Resultat einer schnelleren Akkumulation an der raueren Oberfläche, oder einer schwierigeren Plaqueentfernung von derselben ist. Diese Frage gilt es in weiteren Studien zu klären. - 23 Eine Übersicht über die vorhandenen Studien bezüglich der Rauigkeit von Oberflächen im Mundbereich legt nahe, dass auf raueren Oberflächen eine erhöhte Plaqueakkumulation stattfindet. Im Umkehrschluss führen glatte Oberflächen zu einer Reduktion der Bakterienakkumulation. Es scheint eine „Grenzwert-Rauigkeit“ von 0,2µm zu geben (13,14,48,52,60), unterhalb derer keine signifikante Reduktion der Plaquebildung mehr zu beobachten ist. Da Titan ein eher weiches Metall ist, welches relativ einfach an der Oberfläche durch chirurgische, prothetische und parodontalprophylaktische Maßnahmen beschädigt werden kann (58), gilt es, deren Oberflächen nicht nur mit einer Oberflächenrauigkeit von unter 0,2µm zu präfabrizieren, sondern die Oberfläche ggf. durch Hartbeschichtungen wie TiN oder ZiN so zu veredeln, dass eine Rauigkeit von unter 0,2µm langfristig gewährleistet bleibt. Bei Untersuchungen der Oberflächenrauigkeit wird häufig die Bedeutung der sfe der Oberflächen mituntersucht. In diesem Zusammenhang wird herausgestellt, dass die Oberflächenrauigkeit im Vergleich zur sfe, den deutlich wichtigeren Faktor bei der Plaquebildung darstellt. (47,55,67) Eine Reduzierung der Rauigkeit resultiert dabei in einem deutlichen Rückgang der Plaquebildung und des Plaquereifungsprozesses. Eine Reduzierung der freien Oberflächenenergie hat eine Abnahme der Plaquewachstumsrate, der Fähigkeit der Plaqueretention an der Oberfläche und eine Änderung der Bakterienzusammensetzung zur Folge.(55) 4.3 Materialien und Beschichtungen TiN und ZiN sind Nitride des Titans bzw. des Zirkoniums. Sie sind nur wenige Mikrometer dick und werden durch Plasmaverfahren aufgebracht. Sie haben eine hohe Verschleißfestigkeit mit keramikähnlichen Eigenschaften.(59) Frühere Untersuchungen bestätigen schon die keimreduzierende Wirkung auf Modellgussklammern.(25) Sie haben gute mechanische Eigenschaften und besitzen in wässrigen Lösungen eine hohe Korrosionsbeständigkeit.(31,37) Verschiedene Studien belegen eine Reduktion der Bakterienadhärenz an hart beschichteten Oberflächen. Während es im Vergleich von hydroxylapatit-beschichteten Oberflächen und Reintitan keine signifikanten klinischen oder mikrobiologischen Unterschiede zu geben scheint (38,57), zeigen in vitro und in vivo Studien, dass Oberflächen, welche mit Titannitrit oder Zirkonnitrit beschichtet wurden, eine deutliche Absenkung der Bakterienadhärenz bewirken.(22,23,61,62) - 24 Da bei den Untersuchungen darauf geachtet wurde, dass die Oberflächenrauigkeit und freie Oberflächenenergie der hart beschichteten Testobjekte und der Vergleichsoberflächen nahezu gleich waren, scheint der hemmende Einfluss von TiN und ZiN auf die Bakterienadhärenz belegt. Eine Möglichkeit hierfür besteht in der Überlagerung der sehr reaktiven Titanoberfläche. Darüber hinaus zeigt sich, dass die genannten Hartbeschichtungen eine zelluläre Anheftung von gingivalen Fibroblasten fördern.(24) In weiteren Studien gilt es zu untersuchen, wie die hartbeschichteten Oberflächen sich im Laufe der Zeit verhalten. Einflüsse durch den Kontakt mit dem oropharyngialen Milieu und die Reaktion der hartbeschichteten Oberflächen auf Fluoridierung, Airpolishing und Politur im Rahmen dentaler Prophylaxemaßnahmen müssen langfristig belegt werden. Neben den Hartbeschichtungen mit TiN und ZiN gibt es weitere Gedankenansätze, die antimikrobielle Eigenschaft der Titanoberfläche zu erhöhen. Der photokatalytische bakterizide Effekt des Titandioxid (TiO2) (65), das Einbringen von F+ Ionen (74) oder eines Antibiotikums in die Titanoberfläche (41) seien hier als Beispiele genannt. Die Fähigkeit von Hartbeschichtungen, die Plaquebildung zu reduzieren und das Fibroblastenwachstum zu unterstützen, kann die Möglichkeit zur Entstehung einer Periimplantitis und den Schweregrad ihrer Verlaufsform verringern. (24) 4.4 Freie Oberflächenenergie Die freie Oberflächenenergie einer Implantatoberfläche scheint sich in zweierlei Hinsicht auf die Plaquebildung auszuwirken. Bakterien mit niedriger sfe scheinen dabei eher Oberflächen mit niedriger sfe und umgekehrt Bakterien mit hoher sfe Oberflächen mit hoher sfe zu besiedeln.(8,16,36,71) Des Weiteren scheint sich die sfe einer Oberfläche auch auf das Spektrum der sie besiedelnden Bakterien selektierend auszuwirken.(1,72) Eine verzögerte Plaquereifung kann hierbei durch die niedrigeren Bindungskräfte der Bakterien und der Oberfläche mit niedriger sfe in den ersten Stadien der Bakterienadhäsion erklärt werden. Für die supragingivale Plaquebildung unterstreicht dieses eine Studie von Van Pelt el al. 1985, die zeigt, dass die sfe einer Oberfläche in direktem Zusammenhang mit den Bindungskräften der Bakterien steht.(69) Da die meisten Bakterien der oralen Plaque - 25 eine hohe sfe haben, ist die Plaqueadhäsion an Oberflächen mit niedriger sfe herabgesetzt.(72) Bei der Entstehung der subgingivalen Plaque scheint es keine offensichtlichen Unterschiede hinsichtlich Oberflächen mit niedriger bzw. hoher sfe zu geben. Dieses mag an den hier unterschiedlichen Bedingungen liegen, welche im Vergleich zur supragingivalen Plaquebildung vorliegen. In der Tiefe der gingivalen Tasche fehlen jene Scherkräfte, welche die bakterielle Adhärenz an der Implantatoberfläche bei der Supragingivalen erschweren.(8) Weiterhin zeigt sich, dass eine Veränderung der sfe einer Oberfläche unwesentlich wird, wenn sich deren Rauigkeit erhöht. Untersucht man die Rauigkeit und die sfe zusammen, zeigt sich, dass die Rauigkeit stets die Ausschlag gebende Komponente ist.(47,55,67) Eine Minderung der sfe ist nur von Interesse, wenn eine glatte Oberfläche vorausgesetzt werden kann. - 26 5. Schlussfolgerungen Innerhalb des Implantatdesigns gibt es verschiedene Faktoren, welche Einfluss auf die Plaqueretention haben. Neben der Stufen- und Spaltbildung sind dieses die Rauigkeit der Oberflächen am Implantat, dem Implantataufbau und der prothetischen Versorgung, das Material der Oberfläche und ihre energetischen Eigenschaften in Form der freien Oberflächenenergie. Die einzelnen Faktoren scheinen dabei eine unterschiedlich ausgeprägte Auswirkung auf die Plaquebildung zu haben. Während der Spaltbildung, der Rauigkeit der Oberflächen und dem Material der Oberflächen eine größere Bedeutung zukommen, sind die Auswirkungen der freien Oberflächenenergie eher gering. Spalten sollten möglichst vermieden werden, da diese den unkontrollierten Eintritt der Bakterien in das Implantatinnere ermöglichen. Der unkontrollierbare Rückfluss in das periimplantäre Gewebe kann zur Periimplantitis mit Verlust des krestalen Knochens und letztendlich zum Verlust des Implantates führen. In diesem Punkt ist dem einteiligen Implantatsystem der Vorzug zu geben. Fällt die Wahl bei dem Implantatsystem z.B. aufgrund des chirurgischen Vorgehens, auf ein mehrteiliges Implantatsystem, lässt sich eine Spaltbildung nicht vermeiden. In diesem Fall gilt es, den Spalt möglichst weit cranial vom krestalen Knochen zu positionieren und/oder die Spaltbreite zu verringern. Dieses kann unter Zuhilfenahme präziser präfabrizierter Implantatteile oder Verschluss des Spaltes durch Zementierung der Aufbauten erfolgen. Das Auffüllen des Spaltes durch Füllstoffe, sogenannter Sealer, welche ggf. antibiotisch angereichert sind, muss in weiteren Studien näher untersucht werden. Ein Problem scheint hier die Entstehung antibiotikaresistenter Keime zu sein. Hinsichtlich des Implantatdesigns ist der genauen Passform der Einzelteile (zur Verringerung der Mobilität des Spaltes) eine größere Bedeutung zuzurechnen, als der Größe der Spalten an sich. Eine optimale Geometrie scheint hier noch nicht gefunden. Die Rauigkeit von Implantatteilen, d.h. der Implantatkragen, die Aufbauten und die prothetische Versorgung, sind bis auf den osseointegrierenden Teil des Implantates, welcher gänzlich in den Knochen versenkt werden sollte, mit einer Rautiefe von unter 0,2µm, möglichst glatt zu halten. Auch wenn sich das Titan in der Implantologie für die Osseointegration als Material der Wahl herausgestellt hat, so bedarf es für das sehr reaktive und weiche Metall doch einer Verbesserung hinsichtlich der Plaqueretention, da deren Reduktion für einen - 27 langfristigen Behandlungserfolg von größter Bedeutung ist. In diesem Zusammenhang scheinen die Hartbeschichtungen in Form von TiN und ZiN gute Ansätze zu bieten, da sie die Plaqueretention im Vergleich zu Titanoberflächen deutlich verringern. Aufgrund ihrer Härte haben die Hartbeschichtungen ebenfalls den Vorteil, dass sie sich gegenüber späteren Einflüssen wie z.B. Fluoridierung, Bearbeitung durch Parodontalinstrumente und Airpolishing weniger anfällig zeigen. Die freie Oberflächenenergie spielt eine eher untergeordnete Rolle bei der Plaqueretention. Sie nimmt zwar Einfluss auf die Menge der adhärenten Plaque, sowie auf den Reifungsgrad der Plaque, eine Bedeutung kommt ihr jedoch nur auf sehr glatten Oberflächen zu. Bei einer höheren Oberflächenrauigkeit hat diese einen größeren Einfluss auf die Plaqueretention. Bei einer dauerhaften Rautiefe von unter 0,2µm hat eine Implantatoberfläche mit einer niedrigeren freien Oberflächenenergie Vorteile. Hinsichtlich der Oberflächengestaltung von Implantaten besteht somit die Tendenz zu glatten Oberflächen mit niedriger freier Oberflächenenergie, um der Plaqueretention und damit der Periimplantitis vorzubeugen. - 28 6. Literaturverzeichnis 1. Absolom DR, Lamberti FV, Policova Z, Zingg W, van Oss CJ, Neumann AW (1983): Surface thermodynamics of bacterial adhesion. Appl Environ Microbiol. 46: 90-97. 2. Adell R, Lekholm U, Rockler B, Brånemark PI (1981): A 15-year study of osseointegrated implants in the treatment of the edentulous jaw. Int J Oral Surg. 10: 387-416. 3. Adell R, Lekholm U, Rockler B, Brånemark PI, Lindhe J, Eriksson B, Sbordone L (1986): Marginal tissue reactions at osseointegrated titanium fixtures (I). A 3year longitudinal prospective study. Int J Oral Maxillofac Surg. 15: 39-52. 4. Albrektsson T (1983): Direct bone anchorage of dental implants. J Prosthet Dent. 50: 255-261. 5. Albrektsson T, Zarb G, Worthington P, Eriksson AR (1986): The long-term efficacy of currently used dental implants: a review and proposed criteria of success. Int J Oral Maxillofac Implants. 1: 11-25. 6. Albrektsson T, Isidor F (1994): Consensus report of session IV (implant dentistry). In: Lang NP, Karring T (eds). Proceedings of the 1st European Workshop on Periodontology. Chicago Quintessence. 365-369. 7. Alomrani AN, Hermann JS, Jones AA, Buser D, Schoolfield J, Cochran DL (2005): The effect of a machined collar on coronal hard tissue around titanium implants: a radiographic study in the canine mandible. Int J Oral Maxillofac Implants. 20: 677-686. 8. Baker PJ, Butler R, Wikesjö UME, (1991): Bacterial sampling by absorbent paper points. An in vivo study. J Periodontol. 62: 142-146. 9. Becker W, Becker BE, Newman MG, Nyman S (1991): Clinical and microbiological findings, that can cause failure of dental implants. Quintessenz. 42: 9-21. 10. Bellon-Fontaine MN, Mozes N, Van der Mei HC, Sjollema J, Cerf O, Rouxhet PG, Busscher HJ (1990): A comparison of thermodynamic approaches to predict the adhesion of diary microorganism to solid substrata. Cell Biophys. 17: 93106. 11. Binon P, Weir D, Watanabe L (1992): Implant component compatability. In: Laney WR, Tolman DE (eds). Tissue Integration in Oral, Orthopedic and - 29 Maxillofacial Reconstruction. Proseedings of the Second International Congress on Tissue Integration in Oral, Orthopedic and Maxillofacial Reconstruction. Chicago: Quintessence. 218-226. 12. Binon PP (1996): Evaluation of three slip fit hexagonal implants. Implant Dent. 5: 235-48. 13. Bollen CM, Papaioanno W, Van Eldere J, Schepers E, Quirynen M, van Steenberghe D(1996): The influence of abutment surface roughness on plaque accumulation and peri-implant mucositis. Clin Oral Implants Res. 7: 201-211. 14. Bollen CM, Lambrechts P, Quirynen M (1997): Comparison of surface roughness of oral hard materials to the threshold surface roughness for bacterial plaque retention: a review of the literature. Dent Mater. 13: 258-269. 15. Broggini N, McManus LM, Hermann JS, Medina R, Schenk RK, Buser D, Cochran DL (2006): Peri-implant inflammation defined by the implant-abutment interface. J Dent Res. 85: 473-478. 16. Busscher HJ, Weerkamp AH, Van der Mei HC, Van Pelt AWJ, De Jong HP, Arends J (1984): Measurements of the surface free energy of bacterial cell surfaces and its relevance for adhesion. Appl Env Microbiol 48: 980-983. 17. Callan DP, O'Mahony A, Cobb CM (1998): Loss of crestal bone around dental implants: a retrospective study. Implant Dent. 7: 258-266. 18. Covani U, Marconcini S, Crespi R, Barone A (2006): Bacterial plaque colonization around dental implant surfaces. Implant Dent. 15: 298-304. 19. Dibart S, Warbington M, Su MF, Skobe Z (2005): In vitro evaluation of the implant-abutment bacterial seal: the locking taper system. Int J Oral Maxillofac Implants. 20: 732-737. 20. Duarte A, Rössetti PHO, Rössetti LMN, Torres SA, Bonachela WC, (2006): In vitro sealing ability of two materials at five different implant-abutment surfaces. J Periodontal 77: 1828-1832. 21. Gross M, Abramovich I, Weiss EI (1999): Microleakage at the abutmentimplant interface of osseointegrated implants: a comparative study. Int J Oral Maxillofac Implants. 14: 94-100. 22. Groessner-Schreiber B, Griepentrog M, Haustein I, Muller WD, Lange KP, Briedigkeit H, Gobel UB (2001): Plaque formation on surface modified dental implants. An in vitro study. Clin Oral Implants Res. 12: 543-551. - 30 23. Groessner-Schreiber B, Hannig M, Dück A, Griepentrog M, Wenderoth DF (2004): Do different implant surfaces exposed in the oral cavity of humans show different biofilm compositions and activities? Eur J Oral Sci. 112: 516-522. 24. Groessner-Schreiber B, Herzog M, Hedderich J, Duck A, Hannig M, Griepentrog M (2006): Focal adhesion contact formation by fibroblasts cultured on surface-modified dental implants: an in vitro study. Clin Oral Implants Res. 17: 736-745. 25. Gütschow F (1994): Untersuchungen zur Beschichtung von Co-Cr-MoLegierungen mit Titannitrid. Zahnärztliche Welt; 102: 350-355. 26. Hermann JS, Schoolfield JD, Schenk RK, Buser D, Cochran DL. (3.1.2. Beweglichkeit, nicht Größe) (2001): Influence of the size of the microgap on crestal bone changes around titanium implants. A histometric evaluation of unloaded non-submerged implants in the canine mandible. J Periodontol. 72:1372-1383. 27. Hermann JS, Buser D, Schenk RK, Cochran DL (2000): Crestal bone changes around titanium implants. A histometric evaluation of unloaded non-submerged and submerged implants in the canine mandible. J Periodontol. 71: 1412-1424. 28. Hermann JS, Cochran DL, Nummikoski PV, Buser D (1997): Crestal bone changes around titanium implants. A radiographic evaluation of unloaded nonsubmerged and submerged implants in the canine mandible. J Periodontol. 68: 1117-1130. 29. International Medical College (2007); www.med-college.de 30. Jansen VK, Conrads G, Richter EJ (1997): Microbial leakage and marginal fit of the implant-abutment interface. Int J Oral Maxillofac Implants. 1997; 12: 527540. Erratum in: Int J Oral Maxillofac Implants. 12: 709. 31. Jehn HA, Baumgaertner ME (1992): Corrosion studies with hard coatingsubstrate systems. Surface and Coatings Technology. 54-55: 108-114. 32. Jemt T, Laney WR, Harris D, Henry PJ, Krogh PH, Polizzi G, Zarb GA, Herrmann I (1991): Osseointegrated implants for single tooth replacement: a 1year report from a multicenter prospective study. Int J Oral Maxillofac Implants. 6: 29-36. 33. Keller W, Bragger U, Mombelli A (1998): Peri-implant microflora of implants with cemented and screw retained suprastructures. Clin Oral Implants Res. 9:209-17. - 31 34. King GN, Hermann JS, Schoolfield JD, Buser D, Cochran DL (2002): Influence of the size of the microgap on crestal bone levels in non-submerged dental implants: a radiographic study in the canine mandible. J Periodontol. 73: 11111117. 35. Kinnari TJ, Peltonen LI, Kuusela P, Kivilahti J, Kononen M, Jero J (2005): Bacterial adherence to titanium surface coated with human serum albumin. Otol Neurotol. 26: 380-384. 36. Mabboux F, Ponsonnet L, Morrier JJ, Jaffrezic N, Barsotti O (2004): Surface free energy and bacterial retention to saliva-coated dental implant materials – an in vitro study. Colloids and surfaces B, Biointerfaces 39: 199-205. 37. Milosev I, Navinsek B (1994): A corrosion study of TiN (physical vapour deposition) hard coatings deposited on various substrates. Surfaces and Coatings Technology; 63: 173-180. 38. Morris HF, Ochi S, Spray JR, Olson JW. (2000): Periodontal-type measurements associated with hydroxyapatite-coated and non-HA-coated implants: uncovering to 36 months. Ann Periodontol. 5: 56-67. 39. O'Mahony A, MacNeill SR, Cobb CM. (2000): Design features that may influence bacterial plaque retention: a retrospective analysis of failed implants. Quintessence Int. 31: 249-256. 40. Parr GR, Steflik DE, Sisk AL, Aguero A (1988): Clinical and histological observations of failed two-stage titanium alloy basket implants. Int J Oral Maxillofac Implants. 3: 49-56. 41. Parvizi J, Wickstrom E, Zeiger AR, Adams CS, Shapiri IM, Purtill JJ, Sharkey PF, Hozack WJ, Rothman RH, Hickok NJ (2004): Titanium surface with biologic activity against infection. Clin Orthopaedics and Related Res. 429: 3338. 42. Peltonen LI, Kinnari TJ, Aarnisalo AA, Kuusela P, Jero J (2007): Comparison of bacterial adherence to polylactides, silicone, and titanium. Acta Otolaryngol. 127: 587-593. 43. Perrson LG, Lekholm U, Leonhardt A, Dahlèn G, Lindhe J (1996): Bacterial colonization on internal surfaces of Brånemark system implant components. Clin Oral Implants Res. 7: 90-95. 44. Piattelli A, Scarano A, Paolantonio M, Assenza B, Leghissa GC, Di Bonaventura G, Catamo G, Piccolomini R (2001): Fluids and microbial - 32 penetration in the internal part of cement-retained versus screw-retained implant-abutment connections. J Periodontol. 72: 1146-1150. 45. Piattelli A, Scarano A, Piattelli M (1998): Histologic observations on 230 retrieved dental implants: 8 years' experience (1989-1996). J Periodontol. 69:178-184. 46. Pier-Francesco A, Adams RJ, Waters MG, Williams DW (2006): Titanium surface modification and its effect on the adherence of Porphyromonas gingivalis: an in vitro study. Clin Oral Implants Res. 17: 633-637. 47. Quirynen M, Marechal M, Busscher HJ, Weerkamp AH, Darius PL, van Steenberghe D (1990): The influence of surface free energy and surface roughness on early plaque formation. An in vivo study in man. J Clin Periodontol. 17: 138-144. 48. Quirynen M, Bollen CM, Papaioannou W, Van Eldere J, van Steenberghe D (1996): The influence of titanium abutment surface roughness on plaque accumulation and gingivitis: short-term observations. Int J Oral Maxillofac Implants. 11: 169-178. 49. Quirynen M, Van der Mei HC, Bollen CM, Van den Bossche LH, Doornbusch GI, van Steenberghe D, Busscher HJ (1994): The influence of surface-free energy on supra- and subgingival plaque microbiology. An in vivo study on implants. J Periodontol. 65: 162-167. 50. Quirynen M, Naert I, van Steenberghe D (1992): Fixture design and overload influence marginal bone loss and fixture success in the Brånemark system. Clin Oral Implants Res. 3: 104-111. 51. Quirynen M, Bollen CM (1995): The influence of surface roughness and surface-free energy on supra- and subgingival plaque formation in man. A review of the literature. J Clin Periodontol. 22: 1-14. 52. Quirynen M, Bollen CM, Willems G, van Steenberghe D (1994): Comparison of surface characteristics of six commercially pure titanium abutments. Int J Oral Maxillofac Implants. 9: 71-76. 53. Quirynen M, Bollen CM, Eyssen H, van Steenberghe D (1994): Microbial penetration along the implant components of the Brånemark system. An in vitro study. Clin Oral Implants Res. 5: 239-244. - 33 54. Quirynen M, De Soete M, van Steenberghe D (2002): Infectious risks for oral implants: a review of the literature. Clin Oral Implants Res. 13: 1-19. 55. Quirynen M. (1994): The clinical meaning of the surface roughness and the surface free energy of intra-oral hard substrata on the microbiology of the supraand subgingival plaque: results of in vitro and in vivo experiments. J Dent. 22 Suppl. 1: 13-16. 56. Quirynen M, van Steenberghe D (1993): Bacterial colonization of the internal part of two-stage implants. An in vivo study. Clin Oral Implants Res. 4:158-161. 57. Rams TE, Roberts TW, Feik D, Molzan AK, Slots J (1991): Clinical and microbiological findings on newly inserted hydroxyapatite-coated and pure titanium human dental implants. Clin Oral Implants Res. 2: 121-127. 58. Rapley JW, Swan RH, Hallmon WW, Mills MP (1990): The surface characteristics produced by various oral hygiene instruments and materials on titanium implant abutments. Int J Oral Maxillofac Implants. 5: 47-52. 59. Repenning D (1993): Korrosionsschützende Beschichtungen für Dentalimplantate mit Langzeitwirkung. GOI-Jahrbuch 1993: 19-26. 60. Rimondini L, Farè S, Brambilla E, Felloni A, Consonni C, Brossa F, Carrassi A (1997): The effect of surface roughness on early in vivo plaque colonization on titanium. J Periodontol. 68: 556-562. 61. Scarano A, Piattelli M, Vrespa G, Caputi S, Piattelli A (2003): Bacterial adhesion on titanium nitride-coated and uncoated implants: an in vivo human study. J Oral Implantol. 29: 80-85. 62. Scarano A, Piattelli M, Caputi S, Favero GA, Piattelli A (2004): Bacterial adhesion on commercially pure titanium and zirconium oxide disks: an in vivo human study. J Periodontol. 75: 292-296. 63. Scarano A, Assenza B, Piattelli M, Iezzi G, Leghissa GC, Quaranta A, Tortora P, Piattelli A (2005): A 16-year study of the microgap between 272 human titanium implants and their abutments. J Oral Implantol. 31: 269-75. 64. Schmüdderich W, (2001): Entwicklung eines Materials für die Versiegelung von Implantatinnenräumen zur Prophylaxe bakterieller Kontamination. Diss. Univ. Düsseldorf 65. Suketa N, Sawase T, Kitaura H, Naito M, Baba K, Nakayama K, Wennerberg A,, Atsuta M (2005): An antibacterial surface on dental implants, based on the - 34 photocatalytic bactericidal effect. Clinical Implant Dentistry and Related Research, 7: 105-111. 66. Sutherland JK, Loney RW, Jarotskic TJ (1996): Marginal discrepancy of ceramic crowns with redesigned implant components. J Prosthet Dent. 75: 540544. 67. Teughels W, Van Assche N, Sliepen I, Quirynen M (2006): Effect of material characteristics and/or surface topography on biofilm development. Clin Oral Implants Res. 17 Suppl 2: 68-81. 68. Van Loosdrecht M, Zehnder A (1990): Energetics of bacterial adhesion. Experientia 46: 817-822. 69. Van Pelt AWJ, Weerkamp AH, Uyen MHW, Busscher HJ, De Jong HP, Arends J (1985): Adhesion of streptococcus sanguis CH3 to polymers with different surface free energies. Appl Environ Microbiol 49: 1270-1275. 70. Vela-Nebot X, Rodríguez-Ciurana X, Rodado-Alonso C, Segalà-Torres M. (2006): Benefits of an implant platform modification technique to reduce crestal bone resorption. Implant Dent. 15: 313-320. 71. Weerkamp AH, Uyen HM, Busscher HJ (1988): Effect of zeta potential and surface energy on bacterial adhesion to uncoated and salivacoated human enamel and dentin. J Dent Res. 67: 1483-1487. 72. Weerkamp A, Quirynen M, Marechal M, van der Mei HC, van Steenberghe D, Busscher H (1989): The role of surface free energy in the early in vivo formation of dental plaque in human enamel and polymeric substrata. Microbial Ecol Health and Dis 198; 2: 11-18. 73. Zitzmann NU, Abrahamsson I, Berglundh T, Lindhe J (2002): Soft tissue reactions to plaque formation at implant abutments with different surface topography. An experimental study in dogs. J Clin Periodontol. 29: 456-61. 74. Yoshinari M, Oda Y, Kato T, Okuda K (2001): Influence of surface modifications to titanium on antibacterial activity in vitro. Biomaterials 22: 2043-2048. - 35 7. Abkürzungsverzeichnis (bl) bacterium/liquid = Grenzfläche Bakterium/Lösungsmittel bzw. beziehungsweise CA Celluloseacetat CFU Anzahl der koloniebildenden Einheiten Δ Gadh Formel für die freie Oberflächenenergie FEP Fluorethylenpropylene GA van der Waalsche Kraft (anziehend) GE elektrostatische Kraft (abstoßend) Gtot Gibbs- Energie γsb freie Oberflächenenergie der FestkörperBakterium-Grenzfläche γsl freie Oberflächenenergie der FestkörperLösungsmittel-Grenzfläche γbl freie Oberflächenenergie der BakterienLösungsmittel-Grenzfläche HA Hydroxylapatit HSA Human Serum Albumin ITAI Implant-transmucosal abutment interface (Spalt zwischen Implantat und Implantataufbau) IPI Implant-prothesis interface Ra Oberflächenrauigkeit r/s Übergang der rauhen (rough) osseoinduktiven Implantatoberfläche zum glattpolierten bzw. beschichtetem glatten (smooth) Implantathals (sb) solid/bacterium = Grenzfläche Festkörper/Bakterium REM Rasterelektronenmikroskop - 36 (sl) solid/liquid = Grenzfläche Festkörper/Lösungsmittel sfe surface free energy TAPI Transmucosal abutment – prothesis interface (Spalt zwischen Implantataufbau und Prothetischer Versorgung) TiN Titannitrit TiO2 Titatandioxid u.a. unter anderem vergl. vergleiche ZiN Zirkonnitrit - 37 8. Danksagung Ich danke Herrn Univ.-Prof. Dr. Dr. Dr. h. c. U. Joos für die freundliche Überlassung des Themas. Frau Dr. Dr. Kruse-Lösler danke ich für ihre hilfreiche und angenehme Unterstützung bei der Anfertigung der Arbeit. Außerdem danke ich Frau Lütkefels-Ehn für die tatkräftige Unterstützung bei der Literaturrecherche, sowie Frau Dr. Ute Wegmann und Frau Dr. Eva-Maria Dirkmann für ihre motivierende Begleitung. Meiner Familie danke ich ganz herzlich für ihr Verständnis und ihre Unterstützung während dieses Studienganges und meiner Frau für ihre Hilfe bei der Korrektur der Arbeit. - 38 9. Eidesstattliche Erklärung Hiermit erkläre ich, Dr. Vorname Name, eidesstattlich, die vorliegende Arbeit selbstständig verfasst zu haben. Sie wurde bisher nicht anderweitig für Prüfungszwecke vorgelegt. Weiterhin erkläre ich, dass ich keine anderen Quellen oder Hilfsmittel als die angegebenen verwendet habe und wörtliche, wie auch sinngemäße Zitate als solche gekennzeichnet habe. Münster, den XX.XX.2009 (Dr. Vorname Name)