LEKTION 6 CHEMISCHE REAKTIONEN 1. Hören. Sehen Sie sich
Werbung

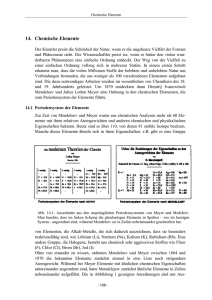
LEKTION 6 CHEMISCHE REAKTIONEN 1. Hören. Sehen Sie sich das Video an und beantworten Sie folgende Fragen. 2. Lesen Sie den Text und ergänzen Sie die Lücken mit diesen Termini Reaktionsschema, Katalysators, Reaktionen, Aufnahme, Reaktionsgeschwindigkeit, Energie Bei chemischen _________________________ werden Stoffe (Edukte) unter Abgabe oder _____________________________ von Reaktionswärme in andere Stoffe (Produkte) umgewandelt. Aus "Stoff a" (z.B. Kupfer) und "Stoff b" (Schwefel) wird ein neuer "Stoff c" (Kupfersulfid). Dies stellt der Chemiker in einem __________________________dar: Kupfer + Schwefel Kupfersulfid "Kupfer und Schwefel reagieren zu Kupfersulfid" Bei der Reaktion selbst wandeln sich chemische Stoffsysteme in neue Stoffsysteme um. Dabei wird entweder _____________________________ frei (exotherme Reaktion) oder Energie verbraucht (endotherme Reaktion). Der Reaktionsprozess unterliegt einem Zeitfaktor. Die Änderungen, die dabei in einer bestimmten Zeitspanne auftreten, bezeichnet man als _____________________________ . Damit eine chemische Reaktion überhaupt anläuft, ist in der Regel Aktivierungsenergie oder ___________________________ notwendig. Reaktionstypen 3. Lesen Sie den Text und finden Sie die deutschen Entsprechungen zu diesen lateinischen Begriffen. Analysen Synthesen Es existieren verschiedene Typen von Reaktionen. Bei Stoffzerlegungen entstehen aus chemischen Verbindungen chemische Elemente oder einfachere Verbindungen. Zu dieser Art von Reaktionen gehören die Reduktionen und in der organischen Chemie die Eliminationsreaktionen. Die Buchstaben in den Beispielen stehen für Atomsorten (ohne Berücksichtigung der Anzahl): Wasser AB Kupferacetat ABCD Wasserstoff + Sauerstoff A + B Kupfer + Essigsäure A + BCD 1 Bei Stoffvereinigungen entstehen aus chemischen Elementen chemische Verbindungen oder aus Verbindungen höhere Verbindungen. Hierzu zählen die Oxidationen, die Sulfidreaktionen und in der organischen Chemie die Additionsreaktionen. Beispiele: Kupfer + Schwefel A + B Kohlenstoffdioxid + Wasser AB + CB Kupfersulfid AB Kohlensäure ABC Chemische Gesetze Bei chemischen Reaktionen gelten verschiedene Gesetze: Gesetz der Massenerhaltung Volumengesetz von Gay-Lussac Gesetz der konstanten Massenverhältnisse Satz des Avogadro 4. Lesen Sie die Texte und ordnen Sie diesen passende Überschriften zu. Die Überschriften sind die Benennungen der Gesetze. TEXT 1 Dieses Gesetz wurde von dem französischen Chemiker Antoine Lavoisier (1743-1794) und dem russischen Naturforscher Michail Wassiljewitsch Lomonossow (1711-1765) formuliert: ___________________________________________ "Nichts wird bei den Operationen künstlicher oder natürlicher Art geschaffen, und es kann als Axiom angesehen werden, dass bei jeder Operation eine gleiche Quantität Materie vor und nach der Operation existiert". Antoine Lavoisier 2 Dabei berücksichtigten sie allerdings nicht, dass bei einer chemischen Reaktion die Masse auch minimal abnehmen kann, während Energie in die Umgebung abgegeben wird. TEXT 2 Der französische Chemiker Joseph Louis Proust (1754-1826) formulierte ein anderes Gesetz. _________________________________________ In einer chemischen Verbindung sind die Atome stets in einem bestimmten Massenverhältnis enthalten. Bei einer chemischen Reaktion reagieren die beteiligten Stoffe stets in typischen, konstanten Massenverhältnissen. Joseph Louis Proust TEXT 3 Der französische Physiker und Chemiker Joseph Louis Gay-Lussac (1778-1850) formulierte folgende Theorie: _________________________________________________ Gase reagieren stets in Volumenverhältnissen kleiner ganzer Zahlen: H2 und Chlor im Verhältnis 1:1 H2 und Sauerstoff im Verhältnis 2:1 H2 und Stickstoff im Verhältnis 3:1 Gay-Lussac 3 TEXT 4 Der Italiener Amedeo Avogadro (1776-1856) stellte auf der Grundlage dieser Erkenntnisse diese Hypothese auf: __________________________________________ In einem bestimmten Gasvolumen sind bei gleichen äußeren Bedingungen (Druck, Temperatur) immer gleich viele zählbare Einheiten (Teilchen) enthalten, unabhängig um welches Gas es sich handelt. Diese bekannte Aussage besagt, dass in einem Liter Wasserstoff, Stickstoff, Sauerstoff oder Wasserdampf gleich viele Wasserstoff-, Stickstoff, Sauerstoff- oder Wasser-Moleküle enthalten sind. Aufstellen von Reaktionsgleichungen - chemische Zeichensprache Reaktionsgleichungen werden nach der chemischen Zeichensprache in Formelschreibweise angegeben. Dabei gilt: Die Zahl der beteiligten Atome der Ausgangsstoffe entspricht der Zahl der Atome bei den Produkten (nach dem Gesetz der Erhaltung der Masse). Die Reaktionswärme wird in kJ/mol angegeben (bei Werten <0 wird Energie frei). Wasserstoff + Sauerstoff 2 H2 + O2 Wasser 2 H2O Das Ausgleichen der Gleichung und die Berechnung der Massen und Volumina der beteiligten Stoffe erfolgt mit Hilfe der Stöchiometrie. Dabei dürfen die bei einer Reaktionsgleichung verwendeten chemischen Formeln nicht verändert werden. Es dürfen aber beliebig viele Atome oder Atomverbände verwendet werden (nach dem Gesetz der konstanten Massenverhältnisse). Diese Verhältnisse drücken sich in den ganzen Zahlen vor den chemischen Formeln aus. Zur genauen Ausbeuteberechnung von chemischen Reaktionen werden chemische Einheiten wie die Stoffmenge und die molare Masse benötigt. 4 Umkehrbarkeit von chemischen Reaktionen Chemische Reaktionen sind prinzipiell auch umkehrbar. So kann aus Wasser durch eine Elektrolyse wieder Wasserstoff und Sauerstoff gewonnen werden: Wasser 2 H2O Wasserstoff + Sauerstoff 2 H2 + O2 DHR = +572 kJ/mol (endotherm) Der Energieumsatz kehrt sich dabei um: Während bei der exothermen Reaktion zwischen Wasserstoff und Sauerstoff Energie frei wird, benötigt man bei der elektrolytischen Zerlegung von Wasser Energie in Form von elektrischen Strom. Verlaufen chemische Reaktionen dagegen in einem geschlossenen System, stellt sich ein chemisches Gleichgewicht ein, so dass Ausgangsstoffe und Produkte in einem bestimmten Mengenverhältnis gleichzeitig vorliegen. Chemische Zeichensprache 5. Lesen Sie den Text und beantworten Sie die Fragen. Was ist die IUPAC-Nomenklatur? Hatten Alchemisten ein Symbol für jedes Element? Wer war der Begründer der einheitlichen Elementensymbolik? Was drückt ein Elementsymbol aus? Was wird als Summenformel bezeichnet? Welche Formen der Elektronenpaarbindung kennt man? Damit sich Chemiker weltweit verständigen können, gebrauchen sie eine gemeinsame Fachsprache, die in der IUPAC-Nomenklatur (International Union of Pure and Applied Chemistry = Internat. Union für Reine u. Angewandte Chemie) einheitlich geregelt ist. Eine Symbolsprache für die Chemie gab es schon im Mittelalter bei den Alchemisten. Dort waren viele der Symbole so verschlüsselt, dass sie nur von "Eingeweihten" gebraucht werden konnten. So gab es für das Gold eine Vielzahl an Symbolen (siehe oben). Die heute für die Elemente gebräuchlichen Symbole wurden ab dem Jahre 1811 im Wesentlichen von dem schwedischen Chemiker Jöns Jacob Freiherr von Berzelius geschaffen. Berzelius benutzte nur Buchstaben und Ziffern. 5 Summenformel Die Elementsymbole kennzeichnen in der Regel ein Atom eines Elements und in chemischen Gleichungen ein Mol des Elements. Bei chemischen Verbindungen wird die Anzahl der beteiligten Atomen durch Aufreihung der Buchstaben und einer Zahl rechts nach unten versetzt angezeigt. In einem Molekül Wasser H2O verbinden sich Wasserstoff- und Sauerstoffatome im Verhältnis 2:1. Diese Form der Darstellung mit Aufzählung der Anzahl der Atome wird als Summenformel bezeichnet. Bei den Salzen werden üblicherweise zuerst die Metall-Ionen und dann die Nichtmetall-Ionen genannt, Beispiel: NaCl für Natriumchlorid. Bei den anorganischen Säuren beginnt man mit dem H-Atom, Beispiel: HCl für Salzsäure Organische Stoffe (und Säuren) beginnen immer mit dem C-Atom, Beispiel: COOH für Ameisensäure. Gemalte Punkte in Formeln von Salzen bedeuten soviel wie "und", Beispiel: Kristallwasseranteil im blauen Kupfersulfat CuSO4 . 5H2O Elektronenpaarbindung Bei der Elektronenpaarbindung benutzen Moleküle gemeinsame Elektronenpaare. Die Strukturformel zeigt die Art und Weise, wie Atome in einem Molekül miteinander verknüpft sind. Die einfache Strukturformel gibt allerdings keinen Aufschluss über tatsächliche räumliche Anordnungen und Abstände zwischen den Atomen Strukturformel von Glycerin Strukturformel von Propylalkohol Dabei verdeutlicht der Strich zwischen zwei Atomen die einfache Elektronenpaarbindung. Eine Doppelbindung wird durch einen doppelten Strich und eine Dreifachbindung durch einen dreifachen Strich angezeigt: Ethan: Einfachbindung Ethen: Doppelbindung Ethin: Dreifachbindung 6 Lösung lt das Gesetz der Erhaltung der Masse. Dieses Gesetz wurde von dem französischen Chemiker Antoine Lavoisier (1743-1794) und dem russischen Naturforscher Michail Wassiljewitsch Lomonossow (1711-1765) formuliert: Gesetz der Massenerhaltung "Nichts wird bei den Operationen künstlicher oder natürlicher Art geschaffen, und es kann als Axiom angesehen werden, dass bei jeder Operation eine gleiche Quantität Materie vor und nach der Operation existiert". Antoine Lavoisier (Dabei berücksichtigten sie allerdings nicht, dass bei einer chemischen Reaktion die Masse auch minimal abnehmen kann, während Energie in die Umgebung abgegeben wird.) Der französische Chemiker Joseph Louis Proust (1754-1826) formulierte als erster das Gesetz der konstanten Massenverhältnisse: Gesetz der konstanten Massenverhältnisse In einer chemischen Verbindung sind die Atome stets in einem bestimmten Massenverhältnis enthalten. Bei einer chemischen Reaktion reagieren die beteiligten Stoffe stets in typischen, konstanten Massenverhältnissen. Joseph Louis Proust 7 Der französische Physiker und Chemiker Joseph Louis Gay-Lussac (1778-1850) formulierte das Volumengesetz: Volumengesetz von Gay-Lussac Gase reagieren stets in Volumenverhältnissen kleiner ganzer Zahlen: H2 und Chlor im Verhältnis 1:1 H2 und Sauerstoff im Verhältnis 2:1 H2 und Stickstoff im Verhältnis 3:1 Der Italiener Amedeo Avogadro (1776-1856) stellte auf der Grundlage dieser Erkenntnisse diese Hypothese auf: Satz des Avogadro In einem bestimmten Gasvolumen sind bei gleichen äußeren Bedingungen (Druck, Temperatur) immer gleich viele zählbare Einheiten (Teilchen) enthalten, unabhängig um welches Gas es sich handelt. 8 Die als Satz des Avogadro bekannte Aussage besagt, dass in einem Liter Wasserstoff, Stickstoff, Sauerstoff oder Wasserdampf gleich viele Wasserstoff-, Stickstoff, Sauerstoffoder Wasser-Moleküle enthalten sind. 9