Zusammanfassung
Werbung

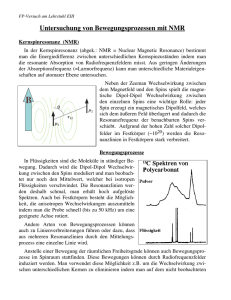
MRI- Eine Einführung Die Kernspintomographie ist ein bildgebendes Verfahren, welches auf dem Prinzip der Kernspinresonanz beruht. Dabei wird die Kernspindichte in Abhängigkeit des Ortes dargestellt. Es ist nicht invasiv, benötigt keine ionisierende Strahlung und es sind keine anhaltenden Nebenwirkungen bekannt. Dieses Verfahren ermöglicht eine gute Gewebedarstellung, aber eine schlechte Knochendarstellung. Es sind verschiede Gewichtung der Bildparameter möglich. Die MRI wurde in den 1970er Jahren entwickelt, insbesondere von Paul Lauterbur und Peter Mansfield, welche dafür im Jahre 2003 mit einem Nobelpreis geehrt wurden. Kernstück eines MR-Tomographen ist eine supraleitende Feldspule, die ein möglichst homogenes statisches Feld in z-Richtung erzeugt. Je nach Modell erzeugt es ein Magnetfeld der Stärke 1,5 T bis zu über 10 T in Forschungsgeräten. Zur Aufrechterhaltung dieses Feldes werden eine Kühlung und verschiedene Abschirmungen benötigt. Der Tomograph beinhaltet weitere Spulen, z.B. mehrere Gradientenspulen zur Ortsauflösung und Sender und Empfängerspulen, die dem zu untersuchenden Körperteil angepasst sind. In dem -Feld werden alle Spins parallel oder antiparallel zum Feld ausgerichtet. Jedoch sind 6 ppm mehr Spins parallel als antiparallel ausgerichtet, was sich als effektive Magnetisierung messen lässt. Die Ausrichtung bewirkt nach dem Zeeman-Effekt eine Aufspaltung des Energieniveaus . Dabei ist die Larmorfrequenz, welche auch die Resonanzbedingung , bei welcher die Spins ausgelenkt werden können, festlegt. Die chemische Umgebung der Kernspins erzeugt eine magnetische Umgebung, welche die Resonanzfrequenz der Spins verschieben und aufspalten kann. Anhand dieser Resonanzfrequenzen werden Substanzen unterscheidbar. Die Sendespule kann nun ein magnetisches Wechselfeld mit der Resonanzfrequenz senkrecht zum Feld, welches die Spins auslenkt, einstrahlen. Nach Abschalten des Resonanzfeldes relaxieren sie in einer Präzessionsbewegung zurück in die zum -Feld parallele Position, die Gleichgewichtsposition. Diese Auslenkung wird mit Hilfe des Faraday’schen Induktionsgesetz detektiert, wonach die veränderliche Magnetisierung der Spins eine zeitabhängige Spannung in der umgebenen Spule erzeugt. Diese ist von der Anregungseffizienz und der Spindichte abhängig. Zur Beschreibung der Rückkehr in die parallele Position der Spins gibt es zwei wichtige Relaxationszeiten. beschreibt den Aufbau der Längsmagnetisierung und den Abbau der Quermagnetisierung . Beide Vorgänge sind exponentiell wobei jedoch etwa fünfmal kürzer ist als . Aufgrund der chemischen Verschiebung sind beide Zeiten gewebeabhängig. Das umliegende Gewebe erzeugt, durch Molekularbewegungen und magnetische Dipolfelder von ungepaarten Elektronen und weiteren Kernen, Feldschwankung. In Flüssigkeiten ist dieser Effekt stärker als z.B. in Fett, da es hier schnellere Molekularbewegungen gibt, also mehr Feldschwankungen. So erreicht das effektive Feld seltener die Resonanzfrequenz der Spins und der Zustandswechsel verläuft langsamer. So ist in Flüssigkeiten teilweise 10mal länger als in Fetten. Bei ist es sogar ein Faktor 15. Der große Unterschied zwischen und entsteht, da bei der die Spin-Spin-Relaxation eine wichtige Rolle spielt. Die effektive Quermagnetisierung setzt sich aus den Magnetisierungen der einzelnen Spins zusammen. Anfangs sind diese alle parallel ausgerichtet, aber mit der Zeit dephasieren sie in ihrer Präzessionsbewegung. So nimmt , welche durch die effektive Quermagnetisierung definiert ist, sehr schnell ab. Das Grundelement von Pulsexperimenten sind Einzelpulse. Dazu wird kurzzeitig ein Radiofrequenzfeld mit der Resonanzfrequenz, wie oben erläutert, eingestrahlt. Es lenkt die Spins um 90° aus und wird daher auch 90° oder Puls genannt. Aus dem oszillierendem Signal wird mit einer Fouriertransformation das Frequenzspektrum ermittelt. Jedoch fällt das -Signal noch schneller ab als , da das statisches Magnetfeld Inhomogenitäten besitzt. Hier kommt die Spin-Echo-Sequenz zum Einsatz. Dabei wird nach der Zeit ein 180°-Puls eingestrahlt, sodass die Dephasierung der Spins umgekehrt wird und die Spins wieder rephasieren. Nach der Zeit ist ein Echo des ursprünglichen Signals zu detektieren. Es ist jedoch weniger stark als das ursprüngliche Signal. Bei der Multi-Echosequenz wird diese Echoerzeugung mehrmals wiederholt. Mit der Abnahme der Signalamplituden lässt sich bestimmen. Die bisher diskutierten Signale sind noch nicht räumlich aufgelöst. Dazu werden verschiedene Gradientenfelder benötigt. Ein Gradientenfeld ist ein Magnetfeld, dessen Stärke entlang einer Raumkoordinate linear zunimmt. Es wird durch Spulenpaare gleicher Stromstärke aber gegensätzlicher Polung erzeugt. Diese Konfiguration wird Maxwell-Paar oder Anti-HelmholtzKonfiguration genannt. Für jede Raumrichtung gibt es ein solches Paar. Durch das nun veränderte effektive Feld wird die Resonanzfrequenz der jeweiligen Spins größer bzw. kleiner, je nachdem ob sich das Gradientenfeld und das stationäre Feld addieren oder subtrahieren. Nur am Nulldurchgang der Gradientenfunktion bleibt das ursprüngliche Feld erhalten. Dieses Phänomen macht man sich bei der Schichtselektion zu Nutze. Nur in der Schicht mit verschwindendem Gradient ist die Resonanzfrequenz erhalten und so wird nur diese Schicht angeregt, wenn ein RF-Puls eingebracht wird. Um eine ausreichende Signalstärke zu ermöglichen beinhaltet der RF-Puls ein kleines Frequenzintervall , sodass die Schicht eine Schichtdicke erhält. Die zu untersuchende Schicht ist frei wählbar, da der Gradient durch die 3 Gradientspulenpaare zusammengesetzt werden kann. Um nun diese angeregte Schicht räumlich aufzulösen werden zwei weitere Gradienten benötigt. Eine Dimension wird mit Hilfe der Frequenzkodierung unterschieden. Durch einen Gradient, der beim Auslesen geschaltet wird, werden die Frequenzen der einzelnen Signale, welche einer Position im Bild entsprechen, ein wenig verschoben. Mit der Fouriertransformation kann dann hinterher ein Frequenzspektrum ermittelt werden, wobei die Signalstärke der Frequenz durch ein Grauwert im Bild dargestellt wird. Die zweite Dimension wird mit der Phasenkodierung kodiert. Dazu wird zwischen dem RF-Puls und dem Echo kurzzeitig ein Gradient geschaltet. So präzidieren die Spins kurzzeitig mit einer unterschiedlichen Geschwindigkeit und eine Phasenverschiebung entsteht. Mit einer weiteren Fouriertransformation kann auch hier die Phasenlage ermittelt werden. Jedoch muss die Phasenkodierung für jede Pixelreihe bzw. Voxelreihe im Bild wiederholt werden. So ergeben sich für ein Bild mit der Auflösung 256x256 256 Phasenkodierung, die jeweils 0,5-3 s dauern, da zwischen jedem Schritt eine Ruhezeit liegen muss, in der sich die Spins wieder ausrichten. Eine Schicht dauert demnach 2-12 Minuten. Nun ist eine Schicht in zwei Dimensionen im k-Raum als Rohdatenmatrix kodiert. Der k-Raum ist quasi der Rohdatenraum und kann auch als Speicher im Computer verstanden werden. Die Daten sind hier als Streifenmuster verschlüsselt und können erst durch die 2-dim-Fouriertransformation in ein reales Bild übersetzt werden. Die verschiedenen Streifenmuster bilden zusammen ein Punktebild. Dabei beschreiben die inneren Anteile die grobe Struktur und außen wird die Feinstruktur definiert. Jedoch kann nur ein begrenzter Teil der äußeren Fläche mit in die Bildrekonstruktion eingerechnet werden, da bei größerer k-Raum-Auflösung der SNR-Wert immer kleiner wird. Die Qualität des Bildes wird insbesondere durch das Signal-Rausch-Verhältnis SNR, den Kontrast, das Kontrast-Rausch-Verhältnis und die Auslösung bestimmt. Bei diesem Verfahren können auf vielerlei Weisen Fehler im Bild auftreten. Diese werden Artefakte genannt und beschreiben Fehler im Bild, welche in der Realität keine Entsprechung finden. Prominente Artefakte sind z.B. Bewegungsartefakte, welche durch Bewegungen des Probekörpers entstehen. Dabei können Geistersignale entstehen. Weitere Artefakte treten durch Inhomogenitäten, Chemische Verschiebung, digitale Bildartefakte und aufgrund vieler weiterer Effekte auf. In der MRI-Technik gibt es noch viele Bereiche in denen Forschungsbedarf besteht. So gibt es auch schon jetzt viele weitere Methoden Sequenzen zur allgemeinen Bildverbesserung, oder auch bestimmten Problemstellungen. Forschungsziele sind zum Beispiel schnellere Sequenzen, höhere Feldstärken, bessere Bildqualität und Kombination mit anderen diagnostischen Verfahren.