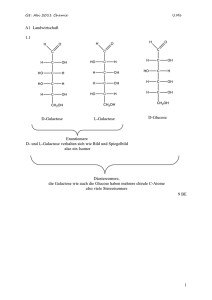
Ka = thermodynamische Gleichgewichtskonstante
Werbung

129 14 Das chemische Gleichgewicht Beispiel : Bildung und Zerfall von Iodwasserstoff, HI, bei 490° C Bringt man in ein Reaktionsgefäß 1 mol H2 und 1 mol I2, so bilden sich bei 490° C nur 1,544 mol HI im Gemisch mit 0,228 mol H2 und 0,228 mol I2, die nicht miteinander weiterreagieren. Bringt man dagegen in das Reaktionsgefäß 2 mol HI, so erfolgt ein Zerfall von HI-Molekülen in H2- und I2-Moleküle. Auch diese Reaktion verläuft nicht vollständig. Bei 490° C zerfallen nur solange HI-Moleküle bis im Reaktionsgefäß wiederum ein Gemisch von 0,228 mol H2, 0,228 mol I2 und 1,594 mol HI vorliegt. Es bildet sich also bei beiden Versuchen ein Gemisch von HI, I 2 und H2 mit der gleichen Zusammensetzung. Zwischen I2 und H2 einerseits und HI anderseits hat sich ein chemisches Gleichgewicht gebildet. Dieser Gleichgewichtszustand ist kein Ruhezustand. Nur makroskopisch sind keine Veränderungen festzustellen. Tatsächlich erfolgt im Gleichgewichtszustand dauernd Zerfall und Bildung von HI-Teilchen (das chemische Gleichgewicht ist dynamisch). Das Auftreten eines Gleichgewichts wird bei der Formulierung von Reaktionsgleichungen durch einen Doppelpfeil wiedergegeben, wodurch Hin- (Bildung von HI) und Rückreaktion (Zerfall von HI) symbolisiert werden. H2 + I2 2 HI Bei vielen chemischen Reaktionen sind allerdings im Gleichgewicht überwiegend Komponenten einer Seite vorhanden. Man sagt dann, dass das Gleichgewicht ganz auf einer Seite liegt. Beispiel: Knallgasreaktion 2 H2 + O2 2 H2O Das Gleichgewicht bei der Knallgasreaktion liegt ganz auf der rechten Seite, d. h. im Gleichgewichtszustand sind praktisch nur H2O-Moleküle vorhanden. Das Massenwirkungsgesetz (MWG) Mit dem MWG wird die Lage eines chemischen Gleichgewichts beschrieben. Es lautet für die Gleichgewichtsreaktion H2 + I2 2 HI c2 (HI) Kc c(H 2 ) c(I 2 ) c(HI), c(I2) und c(H2) sind die Stoffmengenkonzentrationen von HI, I2 und H2 im Gleichgewichtszustand. Eine große Konzentration bedeutet eine große Teilchenzahl pro Volumen. Kc wird Gleichgewichtskonstante oder Massenwirkungskonstante genannt. Sie ist definiert als Produkt der Konzentrationen der Endstoffe dividiert durch das Produkt der Konzentrationen der Ausgangsstoffe. Die Gleichgewichtskonstante hängt nur von der Temperatur ab. Für die HI-Bildung erhält man den Wert für Kc bei 490°C aus den angegebenen Gleichgewichtskonzentrationen (Volumen des Reaktionsgefäßes = 1 l). Kc (1,544mol / l) 2 45,9 0,228mol / l 0,228mol / l 130 Es gibt beliebig viele Kombinationen der H2-, I2 und HI-Konzentrationen, für die das MWG erfüllt ist. Lässt man z. B. 1 mol I2 mit 0,5 mol H2 in einem 1l-Reaktionsgefäß reagieren, dann sind bei 490° C im Gleichgewichtszustand 0,930 mol HI, 0,535 mol I2 und 0,0035 mol H2 nebeneinander vorhanden. Kc (0,9290mol / l) 2 45,9 0,5352mol / l 0,0352mol / l Für die allgemeine Reaktionsgleichung aA + bB cC + dD lautet das MWG Kc cc (C) cd (D) ca (A) c b (B) Die stöchiometrischen Zahlen a, b, c und d treten als Exponenten der Konzentrationen auf. Die Gleichgewichtskonstanten verschiedener chemischer Reaktionen können sehr unterschiedliche Werte haben: a) b) c) Ist K >> 1, läuft die Reaktion nahezu vollständig in Richtung der Endprodukte ab. Ist K 1, liegen im Gleichgewichtszustand alle Reaktionsteilnehmer in vergleichbar großen Konzentrationen vor (Beispiel HI-Bildung). Wenn K << 1 ist, läuft die Reaktion praktisch nicht ab. Im Gleichgewichtszustand sind ganz überwiegend die Ausgangsprodukte vorhanden. Für Gasreaktionen ist es zweckmäßig, das MWG in der Form pc (C) pd (D) K p zu schreiben pa (A) p b (B) p(C), p(D) p(A) und p(B) sind die Partialdrücke (vergl. S. 49) von C, D, A und B im Gleichgewichtszustand. Der Zusammenhang zwischen den Gleichgewichtskonstanten Kc und Kp lautet: K p Kc (RT) (c d a b) Homogene Gleichgewichte sind Gleichgewichte, bei denen alle Stoffe, die an der Reaktion teilnehmen, in derselben Phase vorhanden sind. Heterogene Gleichgewichte sind Gleichgewichte, an denen mehrere Phasen beteiligt sind. 131 Beispiele: a) feste und gasförmige Phase – Kalkbrennen CaCO3 (s) CaO (s) + CO2 (g) Kp = p (CO2) b) flüssige und feste Phase – schwerlösliches AgCl in H2O AgCl (s) Ag+ (aq) + Cl- (aq) Kc = c(Ag+) c (Cl-) Die Gegenwart fester Stoffe wie CaCO3, CaO, AgCl ist zwar für den Ablauf der Reaktion notwendig, aber es ist gleichgültig, in welcher Menge sie bei der Reaktion vorliegen. Sie haben keine veränderlichen Konzentrationen, es treten daher im MWG für feste reine Phasen keine Konzentrationsglieder auf. Aktivität a Bei Anwendung des MWG auf Ionengleichgewichte in wässrigen Lösungen darf nur bei idealen Lösungen (keine interionischen Wechselwirkungen) die Ionenkonzentration in das MWG eingesetzt werden, bei konzentrierten Lösungen ist die Aktivität a (wirksame Konzentration) zu verwenden. Man erhält die Aktivität a durch Multiplikation der Stoffmengenkonzentration c mit dem Aktivitätskoeffizienten f, durch den die Wechselwirkungskungskräfte zwischen den Ionen berücksichtigt werden. a= f c (f = Werte von 0 bis 1, ideale Lösung f 1 a c) Mit zunehmender Gesamtionenkonzentration (Ionenstärke) wird f kleiner. Bei Ionenkonzentrationen c ≤ 10-3 mol/l kann c näherungsweise gleich a gesetzt werden. Nur sehr verdünnte Lösungen sind ideale Lösungen in denen die Ionen soweit voneinander entfernt sind, dass keine Wechselwirkungen zwischen ihnen auftreten. In nichtidealen Lösungen sind Wechselwirkungskräfte vorhanden, die z. B. die Wanderung der Ionen im elektrischen Feld behindern und zu einer Verringerung der Leitfähigkeit führen. MWG für nichtideale Lösungen: a c (C) a d (D) f c (C) f d (D) Ka a Kc a a (A) a b (B) f (A) f b (B) Ka = thermodynamische Gleichgewichtskonstante Gleichgewicht und freie Reaktionsenthalpie Die freie Reaktionsenthalpie G und die Gleichgewichtskonstante K sind über folgende Beziehung verknüpft: G = -RTlnK 132 Je negativer die freie Reaktionsenthalpie ist, um so größer ist die Gleichgewichtskonstante, d.h. um so deutlicher liegt das chemische Gleichgewicht auf der Seite der Endprodukte. Verschiebung der Gleichgewichtslage, Prinzipien von Le Chatelier Die Gleichgewichtslage chemischer Reaktionen kann durch die Änderung folgender Größen beeinflusst werden: a) Änderung der Konzentrationen bzw. der Partialdrücke der Edukte bzw. der Produkte, b) Änderung der Reaktionstemperatur, c) Änderung des Gesamtdrucks. a) Konzentrationsänderungen Beispiel: Oxidation von SO2 zu SO3 mit Luftsauerstoff (vergl. Abschnitt 21) SO2 + 1 O2 2 MWG: Kc SO3 c (SO3 ) c (SO2 ) c 2 (O2 ) 1 c (SO 3 ) 1 Kc c 2 (O 2 ) c (SO 2 ) oder umgeformt (1) Wenn man die Konzentration von Sauerstoff erhöht, muss sich, wie Gleichung (1) zeigt, dass Konzentrationsverhältnis c (SO3) / c (SO2) im Gleichgewicht ebenfalls erhöhen. Man kann also eine Verschiebung des Gleichgewichts in Richtung auf das erwünschte Reaktionsprodukt SO3 (erhöhter - fast vollständiger - Umsatz des wertvollen SO2) durch einen O2-Überschuss erreichen. Durch die fortwährende Entfernung eines Produktes kann eine Gleichgewichtsreaktion zum vollständigen Ablauf gebracht werden. Zum Beispiel kann die Umwandlung von CaCO3 (s) zu CaO (s) (Kalkbrennen, vergl. Abschnitt 25) bei erhöhter Temperatur vollständig durchgeführt werden, wenn das entstehende CO2-Gas laufend entfernt wird: CaCO3 (s) CaO (s) + CO2 (g) Kp = p (CO2) b) Änderung der Reaktionstemperatur Die Beeinflussung der Gleichgewichtslage durch die Temperatur erfolgt über die Temperaturabhängigkeit der Gleichgewichtskonstanten. Faustregel: Temperaturerhöhung führt bei einer exothermen chemischen Reaktion zu einer Verschiebung des Gleichgewichts in Richtung der Ausgangsstoffe, bei endothermen Reaktionen in Richtung der Endprodukte. Beispiel: Ammoniak-Synthese (vergl. Abschnitt 22) 133 N2 (g) + 3H2 H = - 92,4 kJ/mol 2NH3 (g) T [°C] c2 (NH 3 ) Kc c (N 2 ) c3 (H 2 ) 300 9,6 400 0,5 500 0,06 600 0,014 Eine Temperaturerhöhung ist für eine große NH3-Ausbeute ungünstig, da Kc kleiner wird. Durch eine T-Erhöhung wird die Rückreaktion (der Zerfall von NH3, endotherme Reaktion) begünstigt. Die Dimerisierung von Stickstoffdioxid, NO2, zu Distickstofftetraoxid, N2O4, ist eine exotherme Reaktion: 2NO2 (g) braun N2O4 (g) H = - 57 kJ/mol farblos Bei T-Erniedrigung wandelt sich braunes NO2 in farbloses N2O4 um. c) Änderung des Gesamtdrucks Allgemein gilt: Bei Reaktionen mit Stoffmengenänderung der gasförmigen Komponenten verschiebt sich durch Druckerhöhung das Gleichgewicht in Richtung der Seite mit der kleineren Stoffmenge. Beispiel: NH3-Synthese (s. oben) Bei der NH3-Synthese entstehen aus 4 mol gasförmige Edukte 2 mol gasförmige Produkte. Bei Druckerhöhung verschiebt sich das Gleichgewicht in Richtung der NH3-Bildung (NH3-Synthese auch als Hochdrucksynthese bezeichnet), da das Volumen der gasförmigen Produkte kleiner ist, als das Volumen der gasförmigen Edukte. Das System weicht der Druckerhöhung dadurch aus, dass sich das Gleichgewicht nach rechts verschiebt, wodurch die Gesamtzahl von Teilchen im Reaktionsraum und damit der Druck vermindert wird.