Druckversion
Werbung

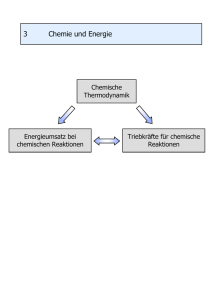
Allgemeine Chemie Die chemische Reaktion Dirk Broßke Berlin, Dezember 2005 1 3.Die chemische Reaktion In chemischen Reaktionen sind eine Vielzahl von Teilchen beteiligt. Die Gesetzmäßigkeiten chemischer Reaktionen sind Gesetzmäßigkeiten des Kollektivverhaltens von Teilchen. Zur quantitativen Beschreibung benötigen wir zunächst Definitionen über die an der Reaktion beteiligten Stoffportionen. 3.1. Stoffmenge, Konzentration, Anteil, Äquivalent Die SI-Einheit der Stoffmenge n(X) ist das Mol Ein Mol ist diejenige Menge einer Substanz X, in der soviel Teilchen enthalten sind wie Atome in 12g des Kohlenstoffnuklids 12C. Die Teilchen können Atome, Moleküle, Ionen, Elektronen oder Formeleinheiten sein. Die Teilchenanzahl, die ein Mol eines Stoffes enthält beträgt: NA=6,02217*1023mol-1 Molare Masse : M(x) = m(x) / n(x) angegeben in g/mol Bsp.: M(Na)=22,99g/mol Stoffmengenkonzentration: c(x) = n(x) / V angegeben in mol/l 3.2. Ideales Gas Ein Gas verhält sich ideal, wenn zwischen den Gasteilchen keine Anziehungskräfte wirksam sind und wenn das Volumen der Gasteilchen vernachlässigbar klein ist gegenüber dem Volumen des Gasraumes. Ideales Gasgesetz: pV = nRT p in bar V in l T in Kelvin R = 0,083143 bar l K-1 mol-1 (universelle Gaskonstante) für T=const: pV=const (Bogle-Mariottsche Gesetz) p1V1 = p2V2 2 für p=const: V=const*T (Gay-Lussac Gesetz) für V=const: p=const*T Für ein mol eines idealen Gases gilt, V = RT/p = 22,414l unter Normbedingungen (0°C; 1atm (1,013bar)). Wann verhält sich ein Gas Ideal? ...bei geringen Drücken und bei hohen Temperaturen (z.B. O2; Cl2; CO; N2; H2; CO2; CH4 bei p<1bar und T>273K) Partialdruck:pGesamt = pA+pB+pC+... Für Mischungen au idealen Gasen gilt ideales Gasgesetz auch für die Einzelkoponenten. pA = nART / V p = (nA+nB) RT / V => (Stoffmengenanteil x(A) (Molbruch von A) = Der Partialdruck einer Komponente des Gemisches ist gleich dem Produckt aus Stoffmengenanteil und Gesamptdruck. Gasgesetz: Chemisches Volumengesetz. Bsp.: 2 Volumenteile H + 1 Volumenteil O ergibt 1 Volumeneinheit Wasserdampf. 2 Volumeneinheiten H2 + 1 Volumeneinheit O2 ergibt 2 Volumeneinheiten H2O Dampf. Die makroskopischen Gaseigenschaftenwie Druck und Temperatur können auf die mechanischen Eigenschaften der einzelnen Gasteilchen zurückgeführt werden: T ist Maß für mittlere kinetische Energie (½ mv2) der Moloküle. p entsteht durch Aufprall der Moleküle auf die Gefäßwand p= 2/3 NV (mv2 / 2) => 2/3 RT = NA (mv2 / 2) => T ist Maß für mittlere Energie. 3 3.3. Zustandsdiagramme 3 Agregatszustände: fest, flüssig, gaffötmig Bsp.: Wasser: Eis; flüssiges Wasser; Wasserdampf in Abhängigkeit von T und p. Den Zusammenhang stellt das Zustandsdiagramm dar: Bei sehr hohen Dampfdrücken erreicht der Dampf die gleiche Dichte wie die Flüssigkeit => einheitliche Phase am kritischen Punkt; oberhalb der kritischen Temperatur können Gase auch bei beliebig hohen Drücken nicht verflüssigt werden. Dampfdruckerniedriegung von Lösungen Auflösen nichtflühtiger Stoffe in Lösungsmittel => Dampfdruckerniedrigung => Gefrierpunkterniedrigung und Siedepunkterhöhung Gefrierpunkterniedrigung: Δtg = Egb Siedepunkterhöhung: Δts = Esb Eg/s: Lösungsmittelkonstante b : Zahl der Mole gelöster Stoffe je kg Beeinflusst wird die Gefrierpunkterniedrigung/ Siedepunkterhöhung nur durch die Anzahl gelöster Teilchen Für ideale Lösungen mit den Komponenten A und B (Wechselwirkung A/A, A/B und B/B alle gleich groß) gilt das Gesetz von Raoult: pA = xAp°A 4 3.4. Reaktionsenthalpie, Standartsbildungsenthalpie Beschreibt den Zustand mit Zuszandsgrößen p, T, V, c(x) Bsp.: Für 1mol ideales Gas gilt pV = RT => 2 Zustandsgrößen beschreiben Zustand eindeutig Wichtige Zustandsgröße: innere Energie u. Andert sich wenn vom System Wärme Q aus der Umgebung aufgenommen bzw. abgegeben oder vom System Arbeit W geleistet wird 1. Hauptsatz der Thermodynamik: Δu = Q+W in geschlossenen System. Q und W negativ wenn Wärme bzw. Arbeit abgegeben wird. isoliertes System: Δu = 0 ; u = const => Energie kann nicht vernichtet oder neu entstehen. Volumenarbeit: W = -p*ΔV also Δu =QV für V positiv = Volumenzunahme; V negativ =Volumenabnahme Also: Entlpie H = U + pV für p = const gilt ΔH = ΔU + pΔV = Qp Die bei einer chemischen Reaktion pro Formelumsatz entwickelte oder verbruchte Wärmemenge heißt Reaktionswärme. Bei konstanten Druck heißt sie Reaktionsenthalpie (ΔH) Bsp.: 3H2 + N2 2NH3 ΔH = -92,3 KJ mol-1 => exotherme Reaktion O2 + N2 2NO ΔH = 180,6 KJ mol-1 => endotherme Reaktion Man gibt daher die Reaktionsenthalpie für einen definierten Anfangs- und Endzustand der Reaktionsteinehmer, den sogenanten Standartzustand Gase: idealer Zustand fest/ flüssige Stoffe: 1,013bar = 1atm Satz von Heß: Bei gleichen Anfangs und Endzustand der Reaktionsenthalpie für jeden Reaktionsweg gleich groß. Standartsbildungsenthalpie Reaktionsenthalpie ΔH = Σ H Endstoffe - Σ H Ausgangsstoffe Aufstellen einer Enthalpieskala mit willkürlichen Nullpunkt: Stabielst Form eines Elementes bei 25°C und 1atm besitzt die Enthalpie null. Die Standartbildungsenthalpie ΔBH° einer Verbindung ist die Reaktionsenthalpie, die bei der Bildung von 1mol der Verbindung im Standartzustand bei der Reaktionstemperatur 25°C auftritt aA + bB cC + dD ΔH°298 = d ΔBH°(D) + c ΔBH°(C) - b ΔBH°(B) - a ΔBH°(A) 5 3.5. Das chemische Gleichgewicht 3.5.1. Allgemeines Bsp.: H2 + I2 2HI Zwischen H2, I2 und HI bildet sich ein Zustand, bei dem keine weitere Änderung der Zusammensetzung des Reaktionsgemisches erfolgt => chemisches Gleichgewicht. Bildung von HI H2 + I2 2HI 1 Mol H2 1 Mol I2 Gleichgewicht H2 + I2 2HI 0,228 Mol H2 0,228 Mol I2 1,544 Mol HI Zerfall von HI H2 + I2 2HI 2 Mol HI 3.5.2. Massenwirkungsgesetz Die Lage des Gleichgewichtes wird durch das Massenwirkungsgesetz beschrieben. Kc wird die Gleichgewichtskonstante genannt. Sie ist deffiniert als das Produkt der konzentrationen der Endstoffe dividiert durch das Produkt der Konzentrationen der Ausgangsstoffe. Die Gleichgewichtskonstante hängt nur von der Reaktionstemperatur ab. Bsp.: H2 + I2 2HI 6 Allgemein: aA + bB cC + dD k >> 1 : Reaktion verläuft nahezu vollständig in Richtung der Endprodukte (Bsp.: 2H2 + O2 2H2O => Kp = 1080 bar-1) K ~ 1 : Alle Reaktionsteilnehmer liegen in vergleichbar großer Konzentration vor K << 1 : Reaktion läuft praktisch nicht ab ( Bsp.: N2 + O2 2NO Kp = 10-30) Homogenes Gleichgewicht: alle an der Reaktion beteiligten Stoffe sind in der selben Phase vorhanden. Bsp.: 3H2 + N2 2NH3 => Heterogenes Gleichgewicht: die an der Reaktion beteiligten Stoffe kommen in mehreren Phasen vor. Bsp.: CaCO3(l) CaO(f) + CO2(g) => cCO2 (oder pCO2) = Kp/c Für feste Phasen treten im Massewirkungsgesetz keine Konzentrationsglieder auf. Zusammenhang Kc / Kp : pH2 = nH2 RT/V = cH2RT 3.5.3. Prinzip von Le Chatelier Gleichgewichtslage kann beeinflusst werden durch Änderung von c(x) (p(x)), T und p Kp und Kc sind abhängig von: T => verschiebung des Gleichgewichtes p => bei Reaktionen, bei denen sich die Gesamstoffmenge der gasförmigen Reaktionspartner ändert 7 Übt man auf ein System, das im Gleichgewicht ist, durch Druckänderung oder Temperaturänderung einen Zwang aus, so verschiebt sich das Gleichgewicht, so dass sich ein neues Gleichgewicht einstellt, bei dem dieser Zwang vermindert ist. Bsp.: 3H2 + N2 2NH3 = -92 kJ mol-1 => Erhöhung von T oder Erniedrigung von p -> Verschiebung nach links Manche Vorgänge laufen freiwillig nur in eine Richtung ab (z.B. Mischung von Gasen) => Irreversibilität; Ordnungsgrad nimmt ab. Zustandsgröße zur Beschreibung des Ordnungsgrades: Entropie(S). S steigt mit fallendem Ordnungsgrad; 2.Hauptsatz der Thermodynamik: In einem energetisch und stofflich abgeschlossenen Reaktionsraum können nur Vorgänge ablaufen, bei denen die Entropie wächst. Das System strebt einen Zustand maximaler Entropie an. Nützliche Regel: Nimmt bei einer Reaktion die Stoffmenge gasförmiger Stoffe ab, so sinkt die Entropie => S der Umgebung muss zunehmen, damit S insgesammt größer wird. Bsp.: wird an die Umgebung abgegeben ( negativ) => SUmgebung nimmt um Betrag =/ T zu. Gleichgewichtslage einer chemischen Reaktion hängt also von und ab => Verknüpfung zu neuer Zustandsgröße: freie Enthalpie G; = -T oder wenn alle Reaktionsteilnehmer im Standartzustand vorliegen: freie Standartreaktionsenthalpie: = -T Damit die Reaktion freiwillig abläuft muss gelten: => Reakt Reakt / T > 0 und Reakt < 0 Gleichgewicht: Reakt Ges = Reakt + Umgeb >0 =0 Je mehr Reaktionswärme frei wird und je mehr die Entropie zunimmt, umso weiter liegt bei einer chemische Reaktion das Gleichgewicht auf Seite der Endstoffe. Außerdem: Bei tiefer Temperatur laufen nur exotherme Reaktionen freiwillig ab, denn: T << => ~ -T 8 Bei hoher Temperatur können nur Reaktionen ablaufen, bei denen die Entropie der Endstoffe größer ist als die der Edukte, denn: T >> => ~ -T 3.6. Die Geschwindigkeit der chemischen Reaktion Bei einer bestimmten Temperatur besitzen nur ein Teil der Moleküle die für die Reaktion erforderliche Mindestenergie (je größer de Aktivierungsenergie, desto weniger); mit Erhöhung der Temperatur steigt die Zahl der Moleküle mit mindestenergie und die Reaktionsgeschwindigkeit nimmt zu. Manche Reaktionen können beschleunigt werden, wenn man dem Reaktionsgemisch einen Katalysator zusetzt. Katalyse Katalysatoren greifen in das Reaktionsgeschehen ein, werden aber nicht verbraucht und sie verändern die Lage des Gleichgewichtes nicht. Wirkungsweise: Änderung des Reaktionsmechanismuses; Verkleinerung der Aktivierungsenergie; Erhöhung der Reaktionsgeschwindigkeit 9 Bsp.: Katalyse der Schwefeltrioxid-Synthese durch NO NO + ½O2 NO2 SO2 + NO2 SO3 + NO => SO2 + ½O2 SO3 (Bruttogleichung) Bsp.: 3H2 + N2 2NH2 ΔH° = -92KJ mol-1 Bei erhöhung der Temperatur oder Erniedrigung von vom Druck, verschiebt sich das Gleichgewicht nach rechts. Dilema: Bei 20°Cist die Amoniakausbeute Groß, aber die Reaktionsgeschwindigkeit ~ 0. Eine ausreichende Reaktionsgeschwindigkeit wird erst bei Temperaturen erreicht bei denen die Ausbeute ~ 0 ist. => Katalysator ; α-Fe + Zusätze: wirkt erst bei 500°C => Ausbeute bei 1bar = 0,1% => 250350 bar (Haber-Bosch-Verfahren) 90% aller Industrieproduckte werden katalytisch hergestellt. 3.7. Gleichgewichte von Salzen, Säuren und Basen 3.7.1. Lösungen, Elektrolyte Lösung : homogene Mischung; Hauptkomponenten : Lösungsmittel (LM) Bsp.: Wasser als Lösungsmittel + Zucker oder Alkohol => keine Leitung des elektrischen Stroms => Nichtelektrolyte Aber: Viele polare Verbindungen lösen sich in Wasser unter frei beweglichen Ionen => Leitung des elektrischen Stroms => Elektrolyte; Träger des Stroms sind Ionen. 10 In Ionenkristallen: Ionen liegen in bestimmter geometrischer Anordnung vor; Ladungsvorgang: Ordnung geht verlohren; Dissoziation; Ionen werden mit Hülle von Wasser-Molekülen umgeben, denn: elektrische Ladngen der Ionen ziehen Wasser-Moleküle an (Hydration) Bei kovalenten Bindungen: Ionen entstehen erst durch die Reaktion vom Lösungsmittel Die in wässrigen Elektrolytlösungen ablaufenden Reaktionen sind Ionenreaktionen. Die Geschwindigkeit solcher Reaktionen ist so groß, dass die Gleichgewichtseinstellung sofort erfolgt. 11