Alle Stoffe sind diskontinuierlich aufgebaut
Werbung

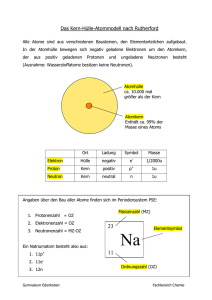
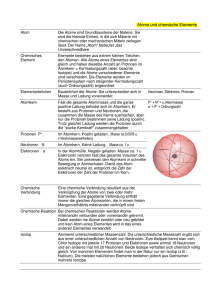
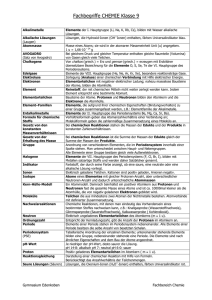
Lerninhalt (F) – Chemische Grundlagen für Elektrotechniker ATOMBAU AUFBAU DER ATOME ATOMKERN UND ATOMHÜLLE Alle Stoffe sind diskontinuierlich aufgebaut. Sie bestehen aus kleinsten Untereinheiten, den Atomen. Leukipp und Demokrit begründeten diese Vorstellung, welche in der Neuzeit bestätigt wurde. Es zeigte sich jedoch, daß die Atome selbst ebenfalls teilbar sind und aus einer großen Anzahl unterschiedlicher Elementarteilchen aufgebaut erscheinen. Die Anzahl dieser bekannten Elementarteilchen wächst ständig. Eine befriedigende Theorie über den Zusammenhang der Elementarteilchen untereinander fehlt noch. Definitionsgemäß umfaßt die Chemie nur Atome, Moleküle und Ionen. Zum Verständnis der chemischen Prozesse genügt im allgemeinen ein vereinfachtes Atommodell. Das Atom ist das kleinste Teil eines Elements und unveränderlicher Träger seiner Eigenschaften. Der mittlere Durchmesser der Raumerfüllung eines Atoms variiert zwischen 1 bis 10·10–10 m. Der Kerndurchmesser liegt bei ca. 10–14m. Die Atome der verschiedenen Elemente werden mit dem ersten (oder den ersten beiden) Buchstaben ihrer lateinischen Namen benannt. Alle Atome enthalten einen Atomkern und eine ihn umschließende Atomhülle, welche aus Elektronen gebildet wird. Atome bestehen aus dem Atomkern und der Atomhülle. Nach Auffassung von Niels Bohr bewegen sich die Elektronen in bestimmten Bahnen (Schalen) um den Kern. Das Elektron (Symbol e–) ist Träger der negativen Elementarladung und nahezu masselos. Der Atomkern besteht aus Protonen und Neutronen. Diese Kernbausteine werden als Nukleonen bezeichnet. Insgesamt kompensieren sich die elektrischen Ladungen der einzelnen Elementarteilchen, so daß das Atom nach außen hin elektrisch neutral erscheint. Atomkerne bestehen aus Protonen und Neutronen (Nukleonen). Das Proton (Symbol H+ bzw. p+) ist Träger der positiven Elementarladung und hat Masse. Die Anzahl der Protonen ist die Kernladungszahl bzw. die Ordnungszahl. Das Neutron (Symbol n) ist nach außen hin als elektrisch neutral anzusehen und hat fast dieselbe Masse wie das Proton. Alle Atome des gleichen Elements enthalten stets die gleiche Anzahl von Protonen. Sie haben die gleiche Kernladungszahl. Die Protonen werden durch die Kernkraft (die starke Wechselwirkung) zusammengehalten. Diese ist im Atomkern wesentlich stärker wirksam als die gegenseitig abstoßend wirkende Coulomb Kraft, jedoch von außerordentlich geringer Reichweite. Proton Neutron Elektron Masse 1,673·10–27kg 1,675·10–27kg 9,1·10–31kg Durchmesser 10-17 bis 10–16m Ladung +1,602·10–19As 0 1,602·10–19As Zwei Größen charakterisieren im wesentlichen das Atom: Die Protonenzahl Z (Kernladungszahl oder Ordnungszahl) und die relative Atommasse. bin-br (Bä) 14.05.2016 03:06 68629512- 1/1