Fachbegriffe CHEMIE Klasse 9 - chemie
Werbung

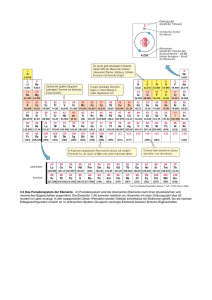
Fachbegriffe CHEMIE Klasse 9 Alkalimetalle Alkalische Lösungen (Laugen) Atommasse AVOGADRO (Satz von Avogadro) Chalkogene Edelgase Elektrolyse Elektronen Element Elementarteilchen Element–Familien Erdalkalimetalle Formeln für chemische Stoffe Gesetz von den konstanten Massenverhältnissen Gesetz von der Erhaltung des Masse Gruppe Halogene Indikator Ionen Isotope Kern-Hülle-Modell Moleküle Nachweisreaktionen Neutron Ordnungszahl Periode Periodensystem (PSE) pH-Wert Proton Reaktionsgleichung Saure Lösungen (Säuren) Gymnasium Edenkoben Elemente der I. Hauptgruppe (Li, Na, K, Rb, Cs), bilden mit Wasser alkalische Lösungen. Lösungen, die Hydroxid-Ionen (OH—Ionen) enthalten, färben Universalindikator blau. Masse eines Atoms; sie wird in der atomaren Masseneinheit Unit (u) angegeben. 1 u = 1,66·10 – 24 g Bei gleichem Druck und gleicher Temperatur enthalten gleiche Raumteile (Volumina) von Gasen gleich viele Teilchen. Von chalkos (griech.) = Erz und gennan (griech.) = erzeugen mit Erzbildner übersetzbare Bezeichnung für die Elemente O, S, Se, Te der VI. Hauptgruppe des Periodensystems. Elemente der VIII. Hauptgruppe (He, Ne, Ar, Kr, Xe), besonders reaktionsträge Gase. Zerlegung (Analyse) einer chemischen Verbindung mit Hilfe elektrischer Energie. Elementarteilchen mit negativer elektrischer Ladung; nahezu masselose Bausteine der Atome, bilden die Atomhülle. Reinstoff, der mit chemischen Mitteln nicht weiter zerlegt werden kann. Jedem Element entspricht eine bestimmte Atomart. Bausteine der Atome. Protonen und Neutronen bilden den Atomkern und die Elektronen die Atomhülle. Elemente, die aufgrund ihrer chemischen Eigenschaften (Bindungsverhalten) zu einer Gruppe zusammengefasst werden, z.B.: Elementfamilie der Alkalimetalle. Elemente der II. Hauptgruppe des Periodensystems Be, Mg, Ca, Sr, Ba). Verhältnisformeln geben das Atomanzahlverhältnis einer Verbindung an; Molekülformeln geben die zahlenmäßige Zusammensetzung eines Moleküls an. Bei chemischen Reaktionen stehen die Massen der Edukte und der Produkte in konstanten Zahlenverhältnissen. Bei chemischen Reaktionen ist die Summe der Massen der Edukte gleich der Summe der Massen der Produkte. Anordnung von verschiedenen Elementen, die im Periodensystem innerhalb einer Spalte stehen. Man unterscheidet zwischen Haupt- und Nebengruppen. Alle Elemente einer Gruppe besitzen gleich viele Außenelektronen. Elemente der VII. Hauptgruppe des Periodensystems (F, Cl, Br, I), bilden mit Metallen salzartige Stoffe und werden daher Salzbildner genannt. Farbstoff, der durch seine Farbe anzeigt, ob eine saure, eine neutrale oder eine alkalische Lösung vorliegt. Elektrisch geladene Teilchen. Kationen sind positiv geladen, Anionen negativ. Atome eines Elementes mit gleicher Protonen-Anzahl, aber unterschiedlicher Neutronen-Anzahl und dadurch unterschiedliche Atommassen Ein Atommodell. Demnach beinhaltet ein positiver Atomkern aus Protonen und Neutronen fast die gesamte Masse eines Atoms und ist ca. 10000mal kleiner als die Atomhülle, die von negativ geladenen Elektronen gebildet wird. Teilchen die aus mindestens zwei Atomen der Nichtmetalle bestehen. Atomverbände mit definierter Zusammensetzung. Chemische Reaktionen, mit denen man eindeutig das Vorhandensein eines bestimmten Stoffes nachweisen kann, z.B.: Knallgasprobe (Wasserstoffnachweis), Glimmspanprobe (Sauerstoffnachweis), Kalkwasserprobe ( Kohlendioxid). Elektrisch ungeladenes Elementarteilchen des Atomkerns (m ≅ 1 u). Entspricht der Kernladungszahl, gibt die Anzahl der Protonen im Atomkern an. Elemente einer Periode stehen im Periodensystem nebeneinander. Alle Elemente einer Periode besitzen die selbe Anzahl von besetzten Schalen. Tabellarische Anordnung der einzelnen Elemente; untereinander stehende Elemente bilden eine Gruppe, nebeneinander stehende eine Periode. Die Elemente sind nach ähnlichen Eigenschaften und dem Bau der Atome angeordnet. Je niedriger der pH-Wert, desto saurer die Lösung. pH 14-8: alkalisch pH 7: neutral pH 6-0: sauer Positiv geladenes Elemantarteilchen im Atomkern ( m ≅ 1 u). Darstellung einer chemischen Reaktion mit Hilfe von Formeln. Berücksichtigt das Anzahlverhältnis der Teilchenmengen. Lösungen, die Oxonium-Ionen (H3O+-Ionen) enthalten, färben Universalindikator rot. Fachbereich Chemie