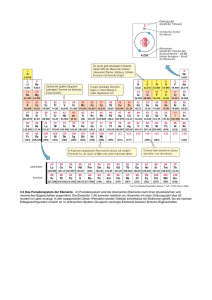
Zusammenfassung 1 Massengesetze Massenerhaltungsgesetz ⚠ Gesetz von der Erhaltung der Masse: Bei jeder chemischen Reaktion ist die gesamtmasse, der Reaktionsprodukte gleich der gesamtmasse der eingesetzen Stoffe Edukte). /c → Veruch: Entzünden von Streichhölzern Streichhölzer haben sowohl vor sie gebrannt haben als auch danach (also nach der Reaktion) die gleiche Masse) Gesetz der konstanten Massenverhältnisse ⚠ Gesetz der konstanten Massenverhälnisse: Elemente reagieren immer in einem ganz bestimmten (konstanten) Massenverhältnis zu einer Verbindung. Formelsprache in der Chemie Wie schwer ist ein Atom Aufgrund der sehr kleinen Zahlenwerte der Masse eines Atoms wird häufig die atomare Masseneinheit u (unit) verwendet. 1u = 0, 0000000000000000000000016g = 1, 6∗10−24 g Wertigkeit und Werigkeitformel ⚠ Zusammenfassung 1 Die Wertigkeit gibt die maximale Anzahl der möglichen Bindungen eines Atoms an. Oder: Wertigkeit = Zahl der einzelnen Valenzelektronen 1 Vorgehen: Die Wertigkeit der zwei Elemente dem PSE entnehmen (oder vorgegebene Werte nehmen) ggf. Modell skizzieren Atomanzahlverhältnis bestimmen Vormel der Verbindung bestimmen Das Periodensystem der Elemente PSE ⚠ Das Periodensystem der Elemente enthält alle Elemente mit ihrem Elementrsymbol. Dabei wird jedes Element grundsätzlich mit seinem lat. (bzw. griechischen) Anfangsbuchstaben gekennzeichnet. Die Anordnung der Elemente erfolgt nach steigender Atommasse & nach ähnlichen chemischen Eigenschaften. Vom Reaktionsschema zur Reaktionsgleichung Reaktionsgleichung ≠ Anzahlverhältnis in dem die Teilchen reagieren (Wertigkeit und Formel) Beispiel und Vorgehen: ⟶ Bildng von Kupfer(1)sulfid aus Kupfer und Schwefel Reaktionsschema aufstellen: Kupfer + Schwefel → Kupfer(1)sulfid Zuordnung von Elementsymbolen und Formeln Cu2 (I) S(II) Cu2 S Vorläufige Reaktionsgleichung Cu + S ⟶ Cu2 S Ausgleichende Reakionsgleichung (→ Gesetz der konstanten Anzahlverhältnisse) ⚠ ⚠ Die Anzahl und die Art der beteiligten Atome bleibt unverändert Die Folgenden Elemente kommen in der Natur in Form von zweiatomigen Molekülen vor. Wasserstoff (H2 ), Sauerstoff ( O2 ), Stickstoff (N2 ), Chlor (Cl2 ), Brom (Br2 ), Iod (I2 ), Fliur (F2 ) → Merksatz: HONCl-BrIF Daltons Atomvorstellung ⚠ Atomare Verbindungen werden Moleküle genannt. Grundlegende Annahmen Dalton's: Jedes Element ist aus kleinsten, nicht mehr weiter teilbaren Teilchen, den Atomen, aufgebaut. Alle Atome eines Elements sind gleich. Das bedeutet, dass sie die gleiche Masse und das gleiche Volumen besitzen. Es existieren genauso viele Atomsorten wie Elemente. In einem chemischen Vorgang können Atome weder erzeugt noch vernichtet werden. Sie sind somit unveränderlich. Während einer chemischen Reaktion zweier (oder mehrerer) Stoffe werden die Atome der Ausgangsstoffe neu angeordnet. Dies geschieht in einem bestimmten Zahlenverhältnis. Modellvorstellung: Zusammenfassung 1 2 Zusammenfassung 1 3