41 bis 50
Werbung

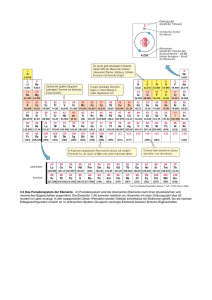
_________________________ Der Aufbau der Materie __________________________________ Bis heute hat man 116 verschiedene chemische Elemente entdeckt. Jedes von ihnen trägt einen Namen und wird durch ein chemisches Symbol (ein oder zwei Buchstaben) dargestellt. Auf die Namen und Symbole der Elemente 110-116 hat man sich bisher noch nicht festgelegt. Einige Elemente waren bereits im Altertum bekannt und wurden entweder nach einer Eigenschaft (z.B. Chlor nach dem altgr. Wort gelbgrün) oder nach der Abbaustätte (z.B. Cu von dem lat. Wort cuprum (Zypern)) benannt. Das Periodische System der Elemente (Periodensystem) enthält die Symbole aller chemischen Elemente in einer besonderen Anordnung (Gruppen: vertikale Spalten, Perioden: horizontale Reihen). 41 _________________________ Symbole und ihre Herkunft __________________________________ 42 _________________________ Das Periodensystem der Elemente __________________________________ Auf die Namen und Symbole der Elemente 110-116 hat man sich bisher noch nicht festgelegt. 43 _________________________ Das Periodensystem der Elemente __________________________________ 44 _________________________ Das Periodensystem der Elemente __________________________________ Die Systematik des Periodensystems dient dazu, ein Ordnungssystem bezüglich der Eigenschaften der bisher bekannten chemischen Elemente zu erstellen. Im Wesentlichen ordnet das Periodensystem die verschiedenen Elemente nach der Feinstruktur ihrer Atome und erlaubt die Betrachtung von Gruppen (vertikale Spalten) und Perioden (horizontale Reihen). Diese Feinstruktur werden wir im Detail in Kürze kennenlernen. 45 _________________________ Gruppen im Periodensystem der Elemente __________________________________ Verschiedene Nomenklatur: I, II, III, ……. VIII Hauptgruppen 1A, 2A, ……… 8A Hauptgruppen 1B ……………. 8B Nebengruppen 1,2,13 ………… 18 3 ……………… 12 Hauptgruppen Nebengruppen IUPAC-Empfehlung 46 _________________________ Haupt/Nebengruppen __________________________________ Hauptgruppen: Alkalimetalle Erdalkalimetalle Edelgase Halogene Nebengruppen: Übergangsmetalle 47 _________________________ Metalle, Nichtmetalle, Halbleiter __________________________________ Ein Metall leitet den elektrischen Strom, besitzt einen metallischen Glanz und ist plastisch verformbar. Beispiel: Kupfer Ein Nichtmetall leitet den elektrischen Strom nicht und ist nicht schmied- und verformbar. Beispiel: Schwefel Halbleiter haben äußerlich die Eigenschaften eines Metalls, verhalten sich chemisch jedoch wie ein Nichtmetall. Die Grenzen sind schwer definierbar. Beispiel: Germanium, Silicium 48 _________________________ Atome __________________________________ Atom (griechisch): unteilbar Hypothesen von John Dalton (1776-1844): • Die Materie ist aus Atomen aufgebaut. • Alle Atome eines gegebenen Elementes sind gleich. • Die Atome verschiedener Elemente unterscheiden sich in ihrer Masse. • Eine Verbindung entsteht durch eine spezifische Kombination der Atome mehrerer Elemente. • Bei einer chemischen Reaktion werden die Atome weder gebildet noch zerstört. Sie bilden lediglich neue Kombinationen miteinander. 49 _________________________ Der Aufbau der Atome __________________________________ Die wichtigsten Beiträge dazu stammen von Joseph John Thomson (1856-1940), Robert Millikan (1868-1953), Marie Curie (1867-1934), Henri Becquerel (1852-1908), Ernest Rutherford (1871-1937) Atome bauen sich aus drei Arten subatomarer Teilchen auf: Elektronen, Protonen und Neutronen. Die subatomaren Teilchen und ihre Eigenschaften Teilchen Symbol Ladung* Masse in kg Masse in u** Elektron e- -1 9.109 x 10-31 0.00055* Proton p +1 1.673 x 10-27 1.0078 Neutron n 0 1.675 x 10-27 1.0087 * Ladungen in Vielfachen von 1.602 x 10-19 C ** in atomaren Masseneinheiten * Die Masse des Elektrons beträgt nur 1/1832 des Protons. 50