Document
Werbung

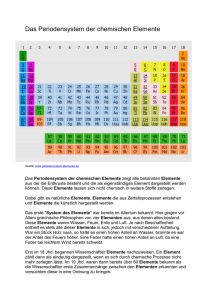
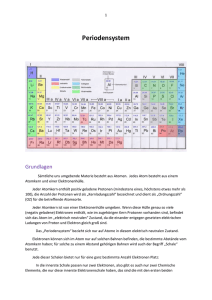
Der atomare Aufbau der Materie 6. Jhd. v. Chr.: Thales von Milet Wasser = Urgrund aller Dinge 5. Jhd. v. Chr.: Demokrit Atombegriff 5. Jhd. v. Chr.: Empedokles vier Elemente: Erde, Wasser, Feuer, Luft (unterstützt von Platon, Aristoteles) Blockierung der Forschung, Mittelalterliche Alchemie 1808: Dalton (3 Postulate) I) Chemische Elemente bestehen aus extrem kleinen Teilchen (Atome). Alle Atome eines Elements sind untereinander gleich - Atome verschiedener Elemente sind verschieden. II) Bei chemischen Reaktionen werden Atome miteinander verbunden oder voneinander getrennt. Dabei werden sie nie zerstört oder neu gebildet. Kein Atom ein Elements wird in das eines anderen verwandelt. III) Eine chemische Verbindung resultiert aus der Verknüpfung der Atome von zwei oder mehr Elementen. Eine gegebene Verbindung enthält immer die gleichen Atomsorten, die in einem festen Mengenverhältnis miteinander verknüpft sind. Atommodelle 1905: Ernest Rutherford (Streuversuch von α-Strahlen an Goldfolie) Das Atom ist leer ! Atomkern: enthält Masse, Radius ca. 10-15 m Elektronenhülle: Volumen, Radius ca. 10-10 m Atommodelle Problem: Linienspektren von Elementen Spektrum des Wasserstoffs: Atommodelle 1913: Niels Bohr 1. Bohr'sches Postulat: Elektronen bewegen sich auf konzentrischen Kreisbahnen um den Atomkern, auf denen keine Energie abgestrahlt wird (stationäre Zustände) für diese gilt: m·v·r = n·(h/2π); n = 1,2,3 ... (h = 6.626.10-34 Js,Planck'sches Wirkungsquantum) 2. Bohr'sches Postulat: Der Übergang zwischen zwei stationären Zuständen erfolgt unter Aussenden eines Lichtquants. Für dessen Energie gilt: oder: E = En2 – En1 h·ν = R·(1/n22 - 1/n22) Atommodelle Erklärung der Linienspektren des Wasserstoffs Aber: weiter unerklärt bleiben Linienintensitäten Feinaufspaltung Mehrelektronensysteme Chemische Bindungen Quantenmechnische Beschreibung 1924: de Broglie (Welle-Teilchen Dualismus) λ = h/p (de Broglie – Wellenlänge) n·λ = 2·π·r = u (de Broglie - Bahnen) 1927: Heisenberg (Unschärferelation) (siehe auch: http://theory.gsi.de/~vanhees/faq/quant/node12.html oder http://www.roro-seiten.de/physik/quanten/quantenobjekte/heisenbergsche_unscharferelation.html ∆x·∆p ≤ h/4π (∆x = 10-12 m, v(Bohr) = 2.2·106 m/s ⇒ ∆Ekin = 104 eV, EI(H) = 13.4 eV ∆ v(Bohr) = 2.2·104 m/s ⇒ ∆x ≥ 2.6·10-9 m, r(H) = 10-10 m) Bahnbegriff muss verworfen werden 1926: Schrödinger (Wellenfunktion Ψ) Elektronenbahnen werden durch Wellenfunktionen Ψn,l,m,s ersetzt. Elektronenwellenfunktionen stellen Lösungen von HΨ = EΨ dar (Schrödingergleichung). Das Quadrat der Wellenfunktion Ψ2 ergibt die Aufenthaltswahrscheinlichkeit des Elektrons. Der dreidimensionale Aufenthaltsraum eines Elektrons wird als Orbital bezeichnet. Pauliprinzip (Ausschlussprinzip) Zwei Fermionen dürfen nicht den gleichen Quantenzustand besetzen. ) Atommodelle Folgerungen des Quantenmechanischen Atommodells Die räumliche Ausrichtung der Orbitale wird durch die 4 Quantenzahlen bestimmt. Haupt- Neben- magn. Spin- n (1,2,3...) l (0 ... n-1) m (l ... l-1) s (±½) 1 0 1s 0 1 +½,-½ 2 2 2 0 1 2s 2p 0 -1,0,+1 1 3 +½,-½ +½,-½ 2 6 8 0 1 2 3s 3p 3d 0 -1,0,+1 -2,-1,0,+1+2 1 3 5 +½,-½ +½,-½ +½,-½ 2 6 10 0 1 2 4s 4p 4d 0 -1,0,+1 -2,-1,0,+1+2 1 3 5 +½,-½ +½,-½ +½,-½ 2 6 10 2 4d +3-2,-1,0,+1+2,+3 7 +½,-½ 14 3 4 Orbital Orbitahlzahl 18 32 max. Elektronen Das Periodensystem "Gelegentlich bin ich gefragt worden, wie man so sicher sein kann, daß es nicht irgendwo im Weltall weitere Elemente gibt, die anders sind, als die im Periodensystem vorkommenden. Ich habe darauf zu antworten versucht, indem ich sagte, dass dies etwa der Frage entspricht, woher man weiß, dass nicht irgendwo im Universum noch eine ganze Zahl zwischen 4 und 5 existiert. Leider gibt es jedoch Leute, die auch dies für eine gute Frage halten." (Georg Wald, 1964) Entwicklung des Periodensystems 1829 J. W. Döbereiner: Triaden Li Na K Ca Sr Ba S Se Te Cl Br I Ordnungsprinzip: Chemisches Verhalten und Elementarmassen 1865 J. A. R. Newland: Oktavengesetz H F Cl Li Be B C Na Mg Al Si K Ca Cr Ti N P Mn O S Fe 1869 Mendelejeff/Meyer: Periodensystem Periodengesetz: Die Eigenschaften von chemischen Elementen ändern sich nicht willkürlich, sondern systematisch mit der relativen Atommasse. Entwicklung des Periodensystems Entwicklung des Periodensystems Weitere wichtige Erkenntnisse: ab 1894 J. W. Raleigh, W. Ramsay, M. W. Travers: Entdeckung der Edelgase und Einordnung in das Periodensystem als 8. Hauptgruppe 1913 J. Moseley: Entdeckung der Kernladungszahl als ordnendes Prinzip 1913 N. Bohr: Vorhersage von 14 Lanthanoiden 1944 G. T. Seaborg: Vorhersage und korrekte Einordnung der 14 Actinoiden Das Periodensystem heute Ordnungsprinzip: Kernladungszahl und Elektronenkonfiguration Die Elektronenkonfiguration der Elemente • Besetzung der Orbitale in energetischer Reihenfolge • Beachtung des Pauli-Prinzips • Berücksichtigung der Hundschen Regel: Der resultierende Spin des Grundzustandes eines Atoms nimmt den größtmöglichen Wert an, der noch mit dem Pauli'schen Ausschließungsprinzip verträglich ist






![2. Tag: Atommodelle [1, 2] 1. Atomtheorie 2. Der Aufbau der Atome](http://s1.studylibde.com/store/data/002489402_1-195f0685b92c2c6d270c65292bba19f4-300x300.png)