Planung der 1
Werbung

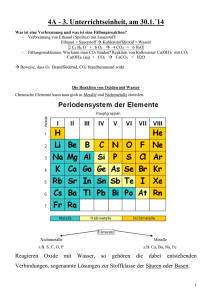
4A - 2. Unterrichtseinheit, am 24.1.´14 Begrüßung aller S/S Vorstellen & Unterrichtsstil (Fragen haben Vorrang) Gibt´s Fragen an mich? Ablauf mit den Kopien (kosten 0,08€, werden halbjährlich verrechnet) – kommen in die Mappe mit Datum und Name Homepage: http://biomilldachsberg.jimdo.com/ Einführung: Lehrplan/Lehrstoff: siehe HP bzw. Buch 4. Klasse: 1 Elektrolyse – Hoffmann´scher Zerlehungsappart Destilliertes Wasser hat die Formel H2O – und kann mittels Hoffmann´schem Zerlegungsapparat in die Elemente Wasserstoff H und in Sauerstoff O zerlegt werden. Wasser + elektrische Energie 2 Teile H (am –Pol) + 1 Teil O (am +Pol) Gleichstrom angelegt: links Pluspol, rechts Minuspol Verbindungen sind Reinstoffe, die durch chemische Reaktionen noch in weitere Stoffe zerlegt werden können. Sie enthalten ihre Bestandteile stets in einem bestimmten, konstanten Verhältnis. Reinstoffe, die durch chemische Reaktionen nicht mehr weiter zerlegt werden können, bezeichnen wir als Elemente. Reaktionsabläufe mit Sauerstoff 1. Explosion: Gemische aus brennbaren Gasen und dämpfen mit Luft explodieren. Je größer der Zerteilungsgrad eines Stoffes ist, desto rascher kann seine chemische Umsetzung verlaufen. 2. Flammenbildung: Eine Flamme ist ein brennender Gasstrom unter Luftzufuhr. (Kerze-Parafin) 3. Verglühen: Nennt man Oxidationen gasloser Stoffe (Holzkohle, Eisen) 4. Stille Oxidation: langsam verlaufende Reaktion mit Sauerstoff. 5. Verbrennung in reinem Sauerstoff: Verbrennung läuft rascher ab und die Temperatur ist höher. Merke: Bei der Verbrennung eines Stoffes tritt eine Stoffumwandlung ein. Dennoch gilt im geschlossenen System das Gesetz der Massenerhaltung. 2 Durchführung des Versuches Anzünden einer Kerze und von Brennspiritus. Oberfläche für O2 ist wichtig!! Abbildung „die Flamme der Kerze“ Ev. anschließend auch - Verbrennung von Ethanol (Spiritus) mit Sauerstoff: - Fällungsreaktionen: Reaktion von Kalkwasser mit CO2 Was ist eine Verbrennung und was ist eine Fällungsreaktion? - Verbrennung von Ethanol (Spiritus) mit Sauerstoff: Ethanol + Sauerstoff Kohlenstoffdioxid + Wasser 2 C2 H6 O + 6 O2 4 CO2 + 6 H2O - Fällungsreaktionen: Wie kann man CO2 binden? Reaktion von Kalkwasser Ca(OH)2 mit CO2 Ca(OH)2 (aq) + CO2 CaCO3 + H2O Beweise, dass O2 Brandfördernd, CO2 brandhemmend wirkt Schüler/-innenaufgabe! Pyrit (FeS2) ist ein Rohstoff, bei dessen Verwertung er zunächst verbrannt wird. Es entstehen Eisenoxid und Schwefeldioxid SO2. Formuliere das Reaktionsschema! 2FeS2 + 5O2 2FeO + 4SO2 Die Reaktion von Oxiden mit Wasser Chemische Elemente kann man grob in Metalle und Nichtmetalle einteilen. Elemente Nichtmetalle Metalle z.B. S, C, O, P z.B. Ca, Ba, Na, Fe Reagieren Oxide mit Wasser, so gehören die dabei entstehenden Verbindungen, sogenannte Lösungen zur Stoffklasse der Säuren. Beispiele: 1) S + O2 SO2 (Schwefeldioxid) SO2 + H2O H2SO3 schwefelige Säure 2) C + O2 CO2 (Kohlenstoffdioxid) CO2 + H2O H2CO3 Kohlensäure 3) 4P + 5O2 P4O10 (Phosphoroxid) P4O10 + 6H2O 4H3PO4 Phosphorsäure Zu den Eigenschaften saurer Lösungen gehören ein saurer Geschmack und die Fähigkeit, den Lackmusfarbstoff, der blau oder violett ist, rot zu färben. Saure Lösungen färben Lackmus (Indikator) rot. Reaktionen von Wasser mit Metalloxiden ergeben die Stoffklasse der Hydroxide. Hydroxidlösungen bezeichnet man als alkalische Lösungen. Im Gegensatz zu sauren Lösungen haben wässrige Lösungen 3 von Hydroxiden einen leicht seifigen Geschmack. Außerdem färben sie Lackmus, der vorher rot oder Violett war, blau. 2Ca + O2 2CaO CaO + H2O Ca(OH)2 Calciumhydroxid V 2Ba + O2 2BaO BaO + H2O Ba(OH)2 Bariumhydroxid V Alkalische Lösungen färben Phenolphthalein (Indikator) rot. Laugen: so nennt man sehr stark alkalisch reagierende Lösungen So zum Beispiel: - Natronlauge: NaOH(aq) - Kalilauge: KOH(aq) Durchführen der Versuche S/S arbeiten selbst? Natrium und Kalium sind sehr gut in Wasser löslich. Neutral: so nennt man Lösungen, die weder sauer noch basisch sind, wie zum Beispiel reines Wasser (schmeckt nach nichts). Dieses verändert auch die Farbe des violetten Lackmus nicht. Neutralisation: Mischt man saure und alkalische Lösungen im richtigen Verhältnis, so heben sich die Eigenschaften auf und es entsteht eine neutrale Lösung. Den Vorgang nennt man neutralisieren. Nichtmetall Metall ↓ Oxidation ↓ Nichtmetalloxid ↓ Metalloxid ↓ Reaktion mit Wasser ↓ Säure ↓ Hydroxid (Base) ↓ lösen in Wasser ↓ saure Lösung ↓ alkalische Lösung neutrale Lösung Indikator: Indikatoren (Anzeiger) zeigen an, ob eine saure, eine neutrale oder eine alkalisch/basische Lösung vorliegt. (Lackmus, etc.) C + O2 CO2 …man muss den Kohlenstoff nur oxidieren lassen (erhitzen/verbrennen) Übungsbeispiele: - In unserem Labor ist das CO2 – Gas ausgegangen. Es steht Calciumcarbonat zur Verfügung. Kann man daraus Kohlenstoffdioxid gewinnen? Wenn ja, dann stelle die Reaktionsgleichung auf! CaCO3 + O2 CaO + CO2 …man muss das Calcium nur oxidieren lassen (erhitzen/verbrennen)! - Bilde aus schwefeliger Säure und Kalkwasser das Produkt Caltuimsulfat. H2SO3 + Ca(OH)2 2H2O + CaSO3 Grundlagen des chemischen Rechnens Herstellung von Bariumsulfat: Notieren: Bariumchlorid + Natriumsulfat Bariumsulfat + Kochsalzlösung BaCl2(s) + Na2SO4(s) BaSO4(s) + 2NaCl(aq) Herzeigen von Indikatorpapierstreifen und etwas ausprobieren! 4 Notiere: Bariumsulfat hat eine Dichte von ρ = 4,48 g/cm3 Lesen des Punktes „Wichtige Größen für chemische Berechnungen“ auf Kopie! KOPIE Besprechung und Durchführung des Übungsbeispieles Theoretischer Weg zur Berechnung: Zur Ausführung von Berechnungen benötigt man folgende Informationen: a) Formeln der beteiligten Stoffe, somit kann man das Reaktionsschema erstellen. b) Gegebene und gesuchte Größen (kg,g,mg,l,ml,mol) 12 1 Atom C hat die Masse von 12 u 12 n( n…Stoffmenge C ) = 1mol Ein Mol beinhaltet 6,002 * 10^23 Stück. Bsp.: 1 mol Schwefel besteht aus 6,002 * 10^23 Schwefelatomen, das ist eine Gesamtmasse von 32,064g. Notiere: „Größen dienen der qualitativen Beschreibung des Systems. Jede Größe ist das Produkt aus Zahlenwert und Einheit.“ Größe = Zahlenwert x Einheit Bsp.: m(Fe) = 5 . 1kg Größe: m…Masse Zahlenwert…5 kg…Einheit 1 mol Kohlenstoff 12C hat die Masse m = 12g Lehrsatz: Definition des mol: 1Mol ist die Stoffmenge eines Systems, das aus ebenso vielen Einzelteilchen besteht wie Atome in 12g des Kohlenstoffisotops 12C enthalten sind. Bei Verwendung des Mols müssen die Einzelteilchen des Systems genau bezeichnet sein. Es können Atome, Moleküle, Ionen, Elektronen sowie andere Teilchen oder Gruppen solcher Teilchen genau angegebener Zusammensetzung sein. „Ein mol Wurstsemmerl besteht aus 1 mol Semmel + 1 mol Wurst + 1 mol Gurkerl + 1 mol Senf“ Avogadro-Konstante NA : gib die Teilchenanzahl an, die ein Mol eines jeden Stoffes enthält N(X) / n(X) = NA -1 NA = 6.022 . 10^23 mol Je größer die die Stoffmenge n einer Stoffportion, desto größer ist die Anzahl N der Teilchen, aus denen die Stoffportion besteht: (n…Stoffmenge N…Anzahl der Teilchen) Zusammenhang zwischen Teilchenanzahl N und Stoffmenge n: ~ … Zeichen für proportional n(X) ~ N(X) oder N(X) / n(X) = konstant Aufgabe1: Berechne, aus wie viel Teilchen (Molekülen) eine Stoffprobe von 10g Wasser besteht! Gesucht: N Gegeben: m=10g NA = 6.022 . 10^23 / mol MH2O = 18g/mol 5 Lösungsmöglichkeit 1: Wenn man weiß, welche Stoffmenge im Wasser vorhanden ist, kann man die Teilchenanzahl berechnen. N = NA . n (n…Stoffmenge N…Anzahl der Teilchen) n = m/M N = NA . m/M N = 6,022 . 10^23 . 10g x mol / 18g . mol 10g Wasser enthalten 3,35 . 10^23 Wassermoleküle. N = 3,35 . 10^23 Lösungsmöglichkeit 2: Die Avogadro-Konstante NA ist eine festgelegte Konstante für alle Stoffe; die molare Masse eine Stoffkonstante. Für den Zusammenhang zwischen Teilchenanzahl und Masse eines Stoffes gilt: N ~ m N NA = m M \\\ mal NA N = m / M . NA = 3,35 . 10^23 10g Wasser enthalten 3,35 . 10^23 Wassermoleküle. Stoffproben können durch die Größen Masse, Volumen, Teilchenanzahl und Stoffmenge gekennzeichnet werden. Rechne Aufgabe 2: Wie viele Eisen-Atome enthalten 2 Mol Eisen? Anzahl N(Fe) in der Stoffmenge n(Fe) = 2 mol? N(X) = n(X) . NA N(Fe) = 2 mol . 6.022 . 10^23 / mol N(Fe) = 1,2044 . 10^24. Zwei Mol Eisen enthalten also 1,2044 . 10^23 Eisen-Atome. Ü2.: Edukte: C6H12O6 ; O2 ; Produkte: CO2 ; H2O Stelle die Reaktionsgleichung für die Verbrennung (Oxidation) von Traubenzucker auf! C6H12O6 + 6O2 6CO2 + 6H2O + Energie↑ (exotherme Reaktion) Für uns ist die Umkehrreaktion besonders wichtig, die sogenannte Photosynthese. Sie findet in den Chloroplasten der grünen Pflanzen statt. Dabei wird aus energiearmen Stoffen energiereicher Traubenzucker (Glucose). - Stelle die vollständige Wortgleichung dieser chemischen Synthese auf! Wasser + Kohlendioxid + Energie Glucose + Sauerstoff + Wasser(g) - Stelle die Reaktionsgleichung für die Photosynthese auf und überprüfe sie! 6CO2 + 12H2O + Energie (Sonne!) C6H12O6 + 6O2 + 6H2O - Um welche Reaktion handelt es sich aus energetischer Sicht? Es handelt sich dabei um eine Endotherme Reaktion! 6 - Fertige ein Energiediagramm dieser Synthese an! Beschrifte exakt und erkläre alle wichtigen Begriffe E ½ Rk Erklärung der Begriffe: E = Energie EA = Aktivierungsenergie zum Starten der Reaktion Rk = Reaktionskoordinate Eendo = aufgenommene, gebundene Energie (1) = Edukte (2) = Edukte aktiviert (3) = Produkte ------------------------------------------------------------------------------------------------------------------------------Neue Überschrift “Reaktionsenthalpie ∆HR“ (∆…Delta) „H“ kommt von heat…Wärme //// Enthalpein(gr.)…heizen //// ∆…Delta…Differenz „Die Reaktionsenthalpie ist eine Größe, welche die Reaktionswärme in das Reaktionsschema einbezieht.“ Beispiel: Bei der Reaktion von Magnesium(s) mit Salzsäure(aq) entstehen Wasserstoff (g), Magnesiumchlorid (aq), Wärmeenergie und Arbeit. Mg(s) + 2HCl(aq) H2(g) + MgCl2(aq) Anfangssystem S(I) Endsystem S(II) Beim Übergang von des Systems S(I) in das System S(II) ändert sich die innere Energie Ei. Die Energieänderung gibt man als die Differenz aus der inneren Energie Ei(II) des Endsystems S(II) und der inneren Energie Ei(I) des Anfangssystems S(I) an. Diese Energiedifferenz bezeichnet man mit ∆Ei : ∆Ei = Ei(II) – Ei(I) 7 Die Änderung der inneren Energie wird über das Vorzeichen gekennzeichnet. Ist die Energie der Produkte geringer als die der Edukte, dann ist der Energieänderungswert negativ. Ist die Produktenergie größer als die der Edukte, dann ist sie positiv. Die Energieänderung von ∆Ei die bei der Reaktion von Magnesium mit verdünnter Salzsäure läuft folgendermaßen ab: - von S(I) wird Wärme an Umgebung abgegeben. Dafür schreibt man Qp (p steht für konstanten Druck)! - Außerdem wird Arbeit (W…work), sogenannte Volumenarbeit in Form der Gasausbreitung des Wasserstoffes geleistet. ∆Ei = Qp Man kann zusammenfassen: + W Änderung der inneren Energi = Reaktionswärme bei konstantem Druck + Wärme 1 Die Reaktionswärme Qp bei konstantem Druck bezeichnet man als Enthalpieänderung ∆H . Sie ist also von Normaldruck (1013hPa) und Normaltemperatur (298°K) abhängig. Genauso wie bei der Änderung der inneren Energie wird bei exothermen Reaktionen eine negative Enthalpieänderungen notiert, bei endothermen Reaktionen erhält die Enthalpieänderung ein positives Vorzeichen! Die Einheit wird in Kilojoule kJ gemessen! So gilt: oder 2H2 + O2 2H2O ∆HR = - 484kJ 2H2O 2H2 + O2 ∆HR = + 484kJ 2Mg + O2 2MgO ∆HR = - 1204kJ 2HgO 2Hg + O2 ∆HR = + 180kJ Die Enthalpieänderung bei einer Reaktion ist auch von der umgesetzten Stoffmenge anhängig. So kann man sagen dass die molare Energieänderung ∆Hm der Quotient aus der Enthalpieänderung ∆H und der Stoggmenge n. ∆Hm = ∆H / n Reagiert ein mol Mg mit gelöster HCl, dann werden 460 kJ frei. ∆Hm = - 460 kJ / mol Reagiert hingegen ein mol verdünnte HCl mit Mg, so werden 230 kJ frei. ∆Hm = - 230 kJ / mol Somit lautet ein vollständiges Reaktionsschema mit Einbeziehung der Reaktionsenthalpie bei der Reaktion von Magnesium mit verdünnter Salzsäure: Mg(s) + 2HCl(aq) H2(g) + MgCl2(aq); ∆HR = - 460 kJ / mol 8