des Scriptes als Word
Werbung

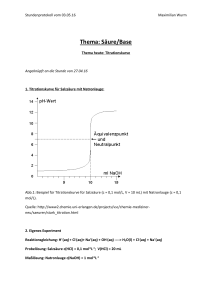
Auch im Internet unter: An die i³ Geschäftsstelle Ideenmanagement Gebäude 14.5 (Grafische Betriebe) www.fz-juelich.de/bd/ideen Verbesserungsvorschlag - Mitmachen lohnt sich - Ich/wir habe(n) eine Idee, wie man im Forschungszentrum Jülich Geld und Zeit sparen, die Sicherheit verbessern oder die Arbeit effektiver gestalten kann. Deshalb reiche(n) ich/wir diesen Verbesserungsvorschlag ein. Die Einzelheiten stehen auf der Rückseite. Die Rechte übertrage(n) ich/wir der Forschungszentrum Jülich GmbH. Ich/wir weiß(wissen), dass über angenommene Verbesserungsvorschläge in „intern“ berichtet wird. Dabei darf auch mein/unser Name genannt werden (wenn nicht: ) Die Idee ist nicht von mir allein. Beteiligt ist: Name: Kastenholz Name: Vorname: Bernd Vorname: Personal-Nr.: Personal-Nr.: Org-Einh. ICG-3 Org-Einh. Telefon: 02461-614825 Telefon: Unterschrift Datum 21.02.2008 Datum Unterschrift 96.13.046/10.03 Verbesserungsvorschlag Nachgedacht – aufgeschrieben – eingereicht Das ist mir aufgefallen: Formel zur Vereinfachung des chemischen Rechnens in der Laborpraxis Zur Herstellung von verdünnten Säuren und Basen aus höher konzentrierten Chemikalien werden in chemischen, biologischen und anderen Laboratorien häufig verschiedene Arten zur Berechnung der einzelnen Bestandteile einer herzustellenden Lösung verwendet. Dazu zählen z.B. die Anwendung von Dreisätzen und/oder die Verwendung eines Mischungskreuzes. Nachteilig dabei ist, dass diese Vorgehensweisen zeitaufwendig und umständlich sind, weil je nach den Erfordernissen zahlreiche Parameter mit in die Berechnung einfließen können. Ziel des Verbesserungsvorschlags ist es daher, eine einheitliche Rechenvorschrift für diese Fälle zu entwickeln. So wäre es besser: In der Literatur zum stöchiometrischen Rechnen (z.B. Hübschmann-Links) existieren unter anderem auch Formeln zur Berechnung von verschiedenen in den Naturwissenschaften gebräuchlichen Parametern. Dazu zählen beispielhaft: 1) Die Stoffmenge: n c V n steht für die Stoffmenge einer Reinsubstanz mit der Einheit [mol] c steht für die Stoffmengenkonzentration einer Reinsubstanz in einem bestimmten Volumen [mol/l] V steht für das Volumen der Lösung mit der Einheit [l] 2) Die Molmasse: M m n M steht für die molare Masse einer Reinsubstanz mit der Einheit [g/mol] m steht für die Masse einer Reinsubstanz (r.S.) [g] n siehe 1) 3) Die Dichte: m V steht für die Dichte einer Lösung oder Reinsubstanz mit der Einheit [g/ml] m steht für die Masse einer Reinsubstanz oder Lösung [g] V steht für das Volumen einer Reinsubstanz oder Lösung [ml] 4) Der Massenanteil: m m steht für den Massenanteil, den eine Reinsubstanz in einer Lösung hat, Einheit [%] oder 1 m siehe 3) 96.13.046/10.03 Ziel der folgenden Operationen ist es nun, aus diesen vier Formeln eine neue allgemeingültige Formel für das chemische Rechnen zu entwickeln, mit deren Hilfe man bei bekannter Zusammensetzung z.B. einer Säure (z.B. konzentrierte Salzsäure, (HCl) = 37 %, (HCl) = 1,19 kg/l, M (HCl) = 36,46 g/mol) beliebige Verdünnungen für diese Säure in kurzer Zeit berechnen und herstellen kann. Um 1 l einer Salzsäure mit der Stoffmengenkonzentration von 0,1 mol/L zu erhalten, die aus einer konzentrierten Säure hergestellt werden soll, stellt man die obigen vier Formeln 1) - 4) wie folgt um: 1’) n c V 2’) n m M 3’) m V 4’) m(r.S .) (r.S .) m( Lsg .) Die Stoffmenge an HCl muß vorher und nachher gleich sein. Daher gilt: n1 = n2 5) aus 1’) und 2’) folgt: c V 1 6) aus 5) und 4’) folgt: c V 1 7) aus 6) und 3’) folgt: c V 1 8) aus 7) folgt: V m M m M V M c V 1 M Mit Hilfe der Formel 8) können nun die Volumen aus einer Ausgangslösung berechnet werden, um z.B. eine verdünnte Säure oder Base mit einem bestimmten Volumen und einer bestimmten Konzentration zu erhalten. V bezeichnet das zu entnehmende Volumen der Ausgangslösung. Die Größe c betrifft die geforderte Stoffmengenkonzentration der Säure/Base und V 1 ist das geforderte Volumen der Lösung. Die Größen M, und sind bekannt und gehören zur Ausgangslösung. Sie können in Tabellen nachgesehen werden oder sind meist auf den Flaschenetiketten deklariert. 96.13.046/10.03 Das aufgeführte Beispiel berechnet sich somit folgendermaßen: gefordert: 1 Liter 0,1-molare HCl-Lösung vorhanden: konzentrierte Salzsäure, (HCl) = 37 %, (HCl) = 1,19 kg/l, M (HCl) = 36,46 g/mol Berechnung: V 0,1 * 1 * 36,46 mol * l * kg * l V 0,00828l * 1000 * 0,37 * 1,19 l * mol * kg Mit einer Messpipette werden also 8,3 ml der konzentrierten Salzsäure abpipettiert und in einem Messkolben auf 1000 ml mit Wasser aufgefüllt und erhält somit 1 Liter einer 0,1 M Salzsäure. Das hätte folgende Vorteile: Zeitersparnis bei Labortätigkeiten und Optimierung von Arbeitsabläufen. Weil der Platz nicht reicht, habe(n) ich/wir Anlagen beigefügt weitere Blätter, Zeichnung(en) 96.13.046/10.03