Übungen 4 - Ihre Homepage bei Arcor
Werbung
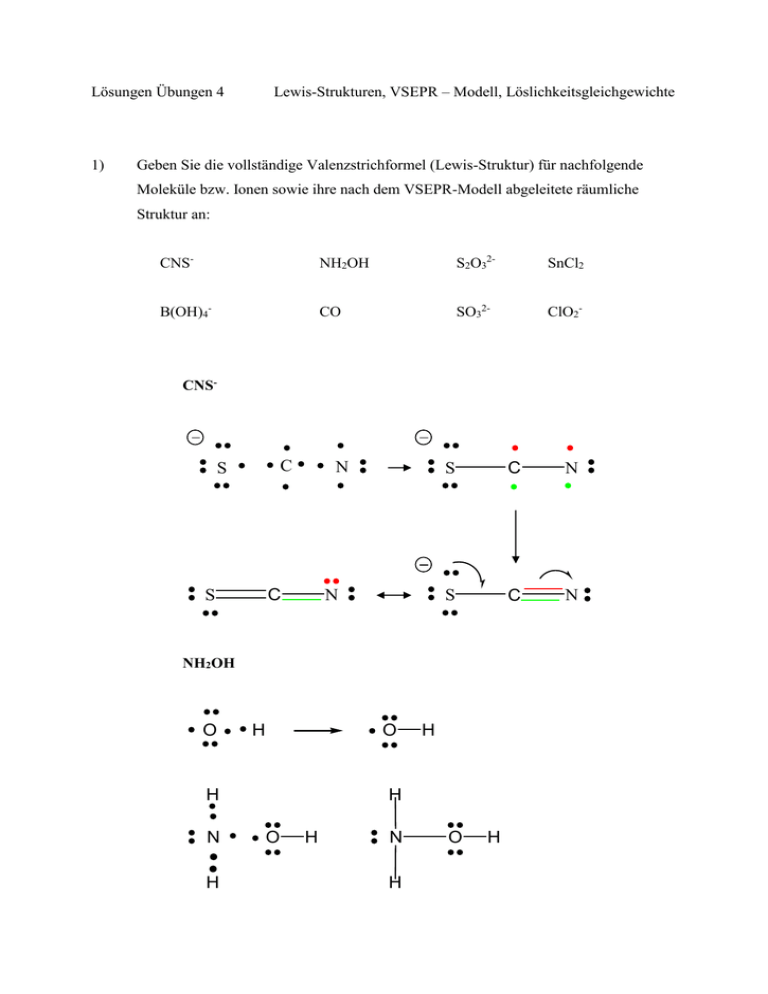
Lewis-Strukturen, VSEPR – Modell, Löslichkeitsgleichgewichte Lösungen Übungen 4 1) Geben Sie die vollständige Valenzstrichformel (Lewis-Struktur) für nachfolgende Moleküle bzw. Ionen sowie ihre nach dem VSEPR-Modell abgeleitete räumliche Struktur an: CNS- NH2OH S2O32- SnCl2 B(OH)4- CO SO32- ClO2- CNS- C S N C S N S C N S C N NH2OH O H O H N H H H O H N H O H räumlicher Bau: Anwendung des VSEPR-Modells N besitzt 1 freies EP (E) => AX3E N . S2O32 H leitet sich von AX4 (Tetraeder) ab OH H Thiosulfat Hier ist es günstig sich zunächst das zweite S-Atom durch O zu ersetzen: SO42Wir bestimmen also die Struktur von Sulfat: O O O S O O O S O O räumliche Struktur und Übergang zu Thiosulfat O ersetzt O ersetzt O durch S durch S S O O O O S S S O O O O S O 2) Wie groß ist die Bleikonzentration in einer gesättigten Bleiiodid-Lösung? KL = 8,3 * 10-9 PbI2 Pb2+ + 2 I- KL = [Pb2+][I-]2 =>mit [Pb2+]/[I-] = ½ KL = [Pb2+](2[Pb2+])2 => [Pb2+] = 3) 3 KL/4 = 1,27*10-3 Welchen pH-Wert besitzt eine gesättigte Magnesiumhydroxid-Lösung? KL = 8,9*10-12 Mg2+ + 2 OH- Mg(OH)2 => [OH-] = 3 4) KL = [Mg2+][OH-]2 = ([OH-]/2)[OH-]2 = 2,61*10-4 => pOH = 3,58 => pH = 10,42 2*KL Ist die Sulfat-Konzentration in einer gesättigten Strontiumsulfat-Lösung groß genug, um bei Zugabe von 0,001 Mol Ba2+ -Ionen BaSO4 zu fällen? KL ( BaSO4) = 1,5*10-9; KL ( SrSO4) = 7,6*10-7 Sulfatkonzentration einer gesättigten SrSO4-Lösung: [SO42-] = KL = 8,72*10-4 Zur Ausfällung von BaSO4: Produkt aus [SO42-] und [Ba2+] muß größer sein als KL ( BaSO4): 8,72*10-4 * 0,001 = 8,72 * 10-7. BaSO4 wird gefällt.