Labor_HCl
Werbung
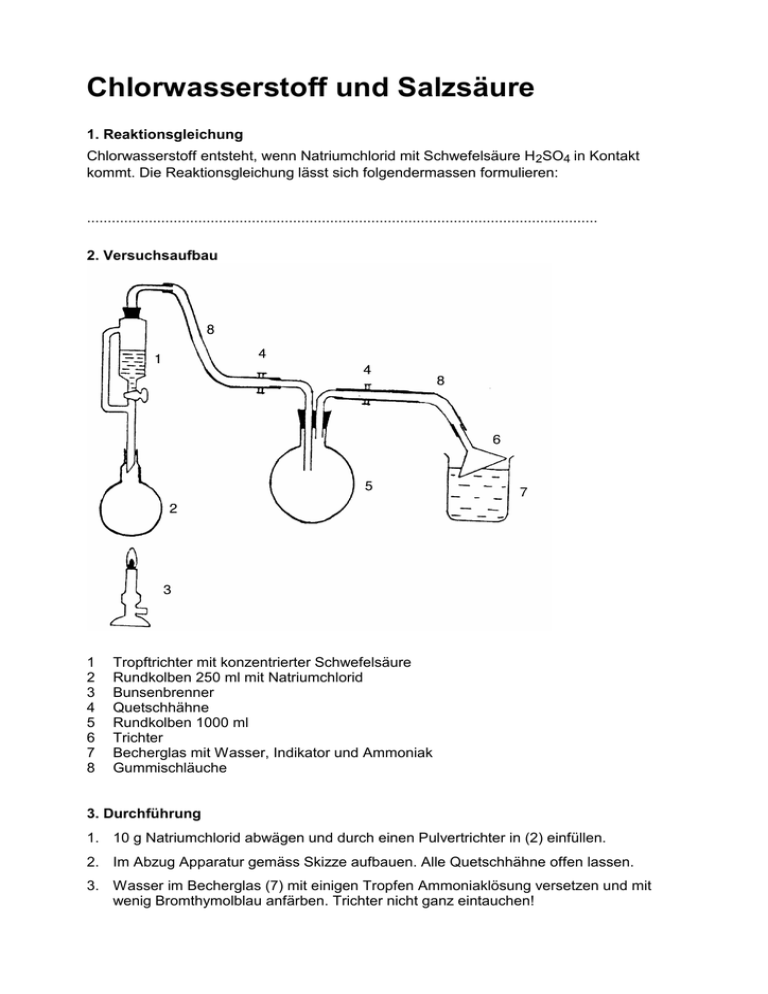
Chlorwasserstoff und Salzsäure 1. Reaktionsgleichung Chlorwasserstoff entsteht, wenn Natriumchlorid mit Schwefelsäure H 2SO4 in Kontakt kommt. Die Reaktionsgleichung lässt sich folgendermassen formulieren: ............................................................................................................................ 2. Versuchsaufbau 1 2 3 4 5 6 7 8 Tropftrichter mit konzentrierter Schwefelsäure Rundkolben 250 ml mit Natriumchlorid Bunsenbrenner Quetschhähne Rundkolben 1000 ml Trichter Becherglas mit Wasser, Indikator und Ammoniak Gummischläuche 3. Durchführung 1. 10 g Natriumchlorid abwägen und durch einen Pulvertrichter in (2) einfüllen. 2. Im Abzug Apparatur gemäss Skizze aufbauen. Alle Quetschhähne offen lassen. 3. Wasser im Becherglas (7) mit einigen Tropfen Ammoniaklösung versetzen und mit wenig Bromthymolblau anfärben. Trichter nicht ganz eintauchen! 4. Schwefelsäure verätzt Augen und Haut! Deshalb von nun an Schutzbrille tragen und auch nicht einen Tropfen Schwefelsäure auf den Arbeitsplatz fallen lassen. Im Messzylinder ungefähr 25 ml konzentrierte Schwefelsäure abmessen und in den Tropftrichter einfüllen. 5. Schwefelsäure zutropfen. Woran sehen Sie, dass jetzt Chlorwasserstoff entsteht? Wenn alle Schwefelsäure zugetropft ist, den Rundkolben (2) mit dem Bunsenbrenner leicht erwärmen (handwarm). Dabei darf der Schaum nicht höher als wenige Zentimeter steigen. 6. Plastikwanne bis 3 cm unter den Rand mit Leitungswasser füllen und mit Bromthymolblau deutlich anfärben. 7. Wenn praktisch kein Chlorwasserstoff mehr gebildet wird, Übergangsstück (zwischen 1 und 8) abheben und sofort die Quetschhähne schliessen. Übergangsstück und Trichter von den Schläuchen lösen. 8. Den grossen Rundkolben (5) umgekehrt ins Wasser tauchen und - wie im Bild gezeigt - den Schlauch unter Wasser vom längeren Rohr abstreifen. Das jetzt offene Rohr und der Schlauch am kürzeren Rohr dürfen nicht aus dem Wasser ragen. Beobachten. 4. Entsorgung Schutzbrille aufsetzen und im Abzug arbeiten. Den Inhalt des grossen Rundkolbens (5) und des Becherglases (7) in die Wanne leeren. Den Tropftrichter (1) in die Wanne tauchen, damit sich die anhaftende Säure im Wasser löst. Den Tropftrichter mit einer Zange aus dem Wasser heben und abtropfen lassen. Alle Glaswaren mit viel kaltem Wasser spülen und in die Abwaschwanne legen. Portionenweise 10 % Natronlauge in die Wanne leeren und rühren bis die Farbe nach blau umschlägt. Jetzt ist die Säure neutralisiert und die Lösung kann in die Kanalisation geleert werden. Wie immer - heute aber ganz besonders - sollten Sie am Ende der praktischen Arbeit die Hände waschen. 5. Fragen 1. Wie lautet die Reaktionsgleichung für die Herstellung von Chlorwasserstoff? Wo liegt das Gleichgewicht? 2. Zeichnen Sie in der Apparatur ein, wo Chlorwasserstoff entsteht und wohin er geht. 3. Welche Stoffe bleiben im Kolben (2) zurück? 4. Warum löst sich Chlorwasserstoff sehr gut in Wasser? 5. Weshalb wird Bromthymolblau in das Becherglas (7) gegeben? 6. Wie erklären Sie den Springbrunnen-Effekt? Weitere Fragen Christian Bold Reaktionsgleichung aufstellen 2 NaCl + H2SO4 Na2SO4 + 2 HCl Weshalb findet die Reaktion statt? Säure-Base-Reaktionen sind Gleichgewichtsreaktionen. HCl entweicht aus der Lösung. Rückreaktion kann nicht mehr stattfinden. (HCl wäre ja eigentlich die stärkere Säure wie H2SO4…) Sie setzen 10 g reines Natriumchlorid ein. Wie viel H2SO4 (95%, Dichte: 1.84 g/ml) müssten Sie zudosieren, wenn Sie genau 1 Äquivalent zugeben möchten? 10g / 58.44 g/mol = 0.171 mol NaCl 0.171 mol / 2 = 0.0856 mol H2SO4 0.0856 mol x 98.08 g/mol = 8.39 g pures H2SO4 8.39 g / 0.95 g/g / 1.84 g/ml = 4.80 ml H2SO4 Wieviel Na2SO4 entsteht? 0.0856 mol x 142.04 g/mol = 12.16 g Na2SO4 Wie viele Gramm und Milliliter HCl Gas entstehen (1 mol = 22.41 l Gas)? 0.171 mol x 36.46 g/mol = 6.23 g HCl Gas 0.171 mol x 22.41 l/mol = 3.83 l HCl Gas Weshalb erwärmt man anschliessend an die Zugabe die Reaktionslösung? Löslichkeit von Gasen nimmt mit steigender Temperatur ab, so verdrängt man das HCl aus der Lösung. Formulieren Sie die Reaktionsgleichung der Neutralisation des HCl Gases mit Ammoniak. HCl(g) + NH3(g) NH4Cl(s) Weshalb füllt sich der Kolben mit Wasser, wenn man ihn im Wasserbecken eintaucht? Das HCl löst sich im Wasser (deshalb wird die bromthymolblaue Lösung auch gelb), zurück bleibt ein Vakuum. Durch das Vakuum wird Wasser entgegen der Gravitation in den Kolben gesogen. Chlorwasserstoff und Salzsäure. Material Tag Datum Lektion Klasse Gruppenzahl ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... Pro Gruppe in den Abzügen: eine mit der Zeichnung übereinstimmende Apparatur bestehend aus: 1 100 ml Tropftrichter 1 250 ml Rundkolben 1 1000 ml Rundkolben mit Gummistopfen und Glasrohren 2 Quetschhähne 2 passende Schlauchstücke 1 150 ml Becherglas 1 Pulvertrichter 1 kleine graue Wanne 1 Laborboy Bei den Waagen: 1 1 1 Allgemein: 1 1 0,5 L Natriumchlorid Polylöffel Mörser mit Pistill Korkring für 250 ml Rundkolben 2 M Ammoniak konzentrierte Schwefelsäure, Flasche maximal zu ¾ gefüllt 50 ml Messzylinder aus Kunststoff (möglichst breit) Kunststofftrichter Durchmesser ca. 5 cm für Schwefelsäure ca. 10 % Natronlauge einige Schläuche als Ersatz Fassung vom 11. Dez. 2015 Testat zum Labor Schülerinnen und Schüler, die das Labor verpasst haben, müssen nachweisen, dass sie sich mit dem Thema befasst haben. Chlorwasserstoff und Salzsäure 1. Was ist Chlorwasserstoff? 2. Was ist Salzsäure? 3. Was ist Bromthymolblau? 4. Beantworten Sie alle Fragen aus der Laboranleitung. Termin: 14 Tage nach dem verpassten Labor Umfang: 4 Seiten Handschrift Voraussetzungen Es empfiehlt sich das Labor erst dann durchzuführen, wenn die Schülerinnen Bindungslehre, zwischenmolekulare Kräfte, Stöchiometrie, Gleichgewicht und SäureBase-Reaktionen aus dem Theorieunterricht kennen. Literatur http://daten.didaktikchemie.uni-bayreuth.de/umat/saeure-base/saeure-base.htm Häusler, K, et. al, Experimente für den Chemieunterricht, Oldenbourg Schulbuchverlag, München, 2.Ed., S. 110 - 112 (1995) Wie die Erfahrung zeigt, läuft der Versuch wesentlich leichter ab, wenn das Kochsalz vor Versuchsbeginn schwach angefeuchtet (nicht gelöst!) wird.











