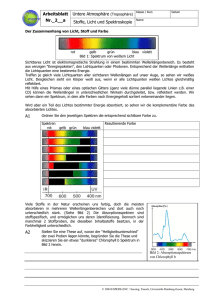
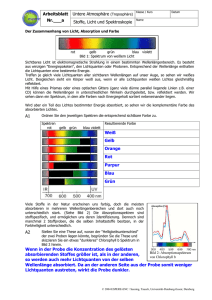
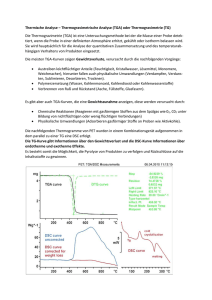
Thermische Analyse - Grundlagen
Werbung

Thermische Analyse - Grundlagen, Anwendungen und Informationsgewinn1 Michael Feist Institut für Chemie der Humboldt-Universität zu Berlin Email: [email protected] Abstract Die Grundlagen der meistverwendeten thermischen Analysenmethoden werden vorgestellt; dazu kommt ein kleiner Exkurs in die Dynamische Differenzkalorimetrie (DDK, engl. DSC). Fünf praktische Beispiele illustrieren das experimentelle Herangehen bei der Anlage der Messungen und erläutern deren Interpretation. Inhalt 1. Einleitung 2. Historisches 3. Methoden der Thermischen Analyse (TA) 3.1. Konventionelle TA und Simultanthermoanalyse (STA) 3.2. Einflüsse auf Form und Güte von thermoanalytischen Kurven 4. Differential Scanning Calorimetry (DSC), Thermooptische Analyse (TOA) und die Untersuchung mechanischer Einwirkungen (TMA, DMA, µTA) 5. Kopplungstechniken - Evolved Gas Analysis (EGA) 5.1. Kopplung mit der Massenspektrometrie (TA-MS) 5.2. Pulse Thermal Analysis, PulseTA 6. Literatur 1. Einleitung Wenn der Chemiker Stoffe miteinander zur Reaktion bringen will, so greift er als erstes Mittel zur Temperaturerhöhung der innig vermengten Reaktanden, um entweder die Reaktion zwischen ihnen zu starten oder die Reaktionsgeschwindigkeit zu erhöhen. Das gilt sowohl für Flüssigkeiten oder für Lösungen fester Stoffe (wo der innige Kontakt schon durch Rühren erzielt wird) als auch für Feststoffgemenge. In jedem Falle ist eine Voraussetzung für das Verständnis der Vorgänge unter Erwärmung zunächst die Kenntnis des Verhaltens der 1 Deutsche Fassung von DOI: 10.1007/s40828-015-0008-y 2 beteiligten Einzelstoffe, um dann das Verhalten der gemischten Systeme zu deuten. Diese als thermisches Verhalten zusammengefassten Stoff- und Systemeigenschaften werden ihrerseits mit den Methoden der Thermischen Analyse (TA) untersucht und beschrieben. Als korrekte Definition dieser Vielzahl physikalisch-chemischer Messmethoden gilt aktuell: Thermische Analyse bedeutet die Verfolgung der Änderungen eines oder mehrerer physikalischer Parameter einer Probe als Funktion der Temperatur oder der Zeit unter dem Einfluss eines kontrollierten Temperaturprogramms [1,2]. Hinter dieser Definition steht die Erkenntnis, dass in vielen (nicht in allen!) Fällen die temperaturabhängigen Änderungen der Eigenschaften einer Phase diese genauso eindeutig charakterisieren können wie ihre chemische Formel oder ihre Struktur [3]. TA-Methoden ermitteln Eigenschaften - sie sind keine Methode der Strukturaufklärung, wenngleich die Kenntnis der Struktur (zumeist der Kristallstruktur) fast immer die Deutung thermischer Prozesse erleichtert, zuweilen auch erst möglich macht. 2. Historisches Mit Blick auf die Geschichte der Naturwissenschaften ist es nicht übertrieben zu sagen, dass die TA die „ … späte Frucht der Liebe der Naturforscher ist, die Stoffe zu analysieren“ [4]. Seit Aristoteles (384-322 v.Chr.) galt das Dogma „Feuer ist der allgemeine Analysator der Stoffe“, und erst Robert Boyle (1626-1691) widersprach dem in seinem berühmten Buch The Sceptical Chymist (1661) mit dem Hinweis, dass die Wechselwirkung mit dem Feuer nicht allgemeine Bedeutung für die Naturerkenntnis haben könne, da doch das Feuer destruktive Wirkung hat [5]. Hundert Jahre später, 1763, unterschied Joseph Black (1728-1799) erstmalig zwischen latenter und sensibler (fühlbarer!) Wärme - wichtig für das Verständnis von Phasenumwandlungen - sowie zwischen Temperatur (quality of heat) und Wärme (quantity of heat). Stofflich gesehen ist der Ausgangspunkt neuzeitlicher thermischer Analysenmethoden die Untersuchung von Tonmineralen. Antoine Laurent de Lavoisier (1743-1794) war vermutlich der erste, der nach heutigen Maßstäben eine thermische Analyse vornahm: im Rahmen seiner Untersuchungen zu den Massenänderungen bei Oxidationen untersuchte er auch ein Schichtsilikat unter Erhitzen; Cronstedt gab dem Mineral 1788 den Namen Montmorillonit [6]. Bei Lavoisier noch aus dem Blickwinkel der Massenänderung war es Jahrzehnte später eher der Aspekt der Temperatur bzw. der Wärme, unter dem Henri Le Chatelier (1850-1936) seine wichtige Arbeit über die Tone veröffentlichte (1887) [7]. Auf ihn geht auch die Einführung des Pt-PtRh10-Thermoelements zur Messung hoher Temperaturen 3 zurück. Weitere wichtige Beiträge zur heutigen TA sind die Differenzschaltung von Thermoelementen, die Einführung des inerten Vergleichskörpers (vgl. Abschn. 3.1) sowie die Phasenregel von Josiah Willard Gibbs (1839-1903). 3. Methoden der Thermischen Analyse Ein mögliches Unterscheidungsmerkmal für eine Einteilung der zahlreichen TA-Methoden ist der gemessene physikalische Parameter (Masse, Temperatur bzw. Wärmefluss, sowie mechanische und andere Größen)2. Das Schema in Abbildung 1 erfasst jedoch nicht alle Verfahren, die den TA-Methoden zuzuordnen sind. Es fehlt z.B. die Reaktionskalorimetrie, die in großer apparativer Vielfalt entwickelt ist [8]. Reaktionskalorimetrie wird meist in Abbildung 1. Parameter und Methoden in der Thermischen Analyse deutlich größeren Gefäßen betrieben als üblicherweise TA oder Kalorimetrie, z. B. in Glasgefäßen unter adiabatischen Verhältnissen. Sie dient z.B. auch der Maßstabsvergrößerung von Reaktoren (sog. Up-Scaling) für industriell genutzte chemische Prozesse [9]. 2 Korrekterweise ist zu unterscheiden zwischen Analyse (setzt sich zusammen aus Messmethode [oder -verfahren], Auswertung und Interpretation) und Methode, was jedoch selbst in staatlichen Normen nicht konsequent gehandhabt wird (z.B. TG vs. TGA oder DTA vs. Differenzthermometrie [1]). Wir verwenden hier die in Wissenschaft und Laborpraxis fest etablierten Begriffe, also z.B. TG neben DTA (und nicht DTM) oder TMA anstelle von Thermomechanometrie. 4 Schließlich verdient die thermometrische Titration [10,11] Erwähnung, die heute vor allem bei biochemischen Vorgängen eingesetzt wird (z.B. acidimetrische Bestimmung von Fettsäuren in nicht-wässrigen Medien über die bei Neutralisationsreaktionen entwickelte Wärme). 3.1. Konventionelle TA und Simultanthermoanalyse (STA) Klassische oder konventionelle TA zu betreiben hieß, die Temperatur einer Probe unter Aufheizen und/oder Abkühlen zu verfolgen - also T=f(T) oder T=f(t) aufzunehmen. In der (ursprünglich meist anorganischen) Chemie der Phasengleichgewichte ließ sich das sehr einfach auch im Studentenpraktikum durchführen, zunächst mit reinen Stoffen (Abb. 2), dann auch für binäre Systeme. Für das System Sn-Pb beispielsweise bereitet man Porzellantiegel mit Gemengen unterschiedlicher Bruttokonzentration, positioniert ein Thermometer oder Abbildung 2. Anwendung der Gibbs’schen Phasenregel auf das Aufschmelzen und Erstarren eines Feststoffes. Links ein Aufheizen mit konstanter linearer Heizgeschwindigkeit über den Schmelzpunk (m.p.) hinaus, rechts „freies“ Abkühlen (gestrichelt) gemäß Newton’schem Abkühlgesetz sowie der Temperaturverlauf für das Erstarren mit invariantem Plateau (F=0). Für konstanten Druck erhält man die sogenannte „reduzierte“ Phasenregel, die die Anzahl verfügbarer Freiheitsgrade F des Systems in Abhängigkeit von der Zahl koexistierender Phasen P in dem System aus K Komponenten ermittelt. Thermoelement in der Probe, schmilzt diese dann auf, homogenisiert vorsichtig und überlässt die Tiegel anschließend der Abkühlung. Die Messung des Temperaturverlaufs liefert u.U. Halte- und/oder Knickpunkte, die das Erstarrungsverhalten wiedergeben. Mit dieser einfachen Anordnung ließen sich nicht zu komplizierte Phasendiagramme mit Eutektika und/oder Dystektika aufnehmen, und auch Montanwissenschaftler im 19. Jh. gingen zunächst nicht 5 wesentlich anders vor, wenn es um die phasenanalytische Charakterisierung von Mineralen ging. Durch die Einführung einer thermisch inerten Vergleichssubstanz, die demselben Heiz- oder Kühlprogramm unterworfen wird wie die Probe, und durch die Entwicklung der Differenzschaltung von Thermoelementen (W. C. Roberts-Austen, 1899 [12]) wurde aus der TA die DTA (Differenzthermoanalyse)3. Statt T=f(T) wurde nun T=f(T) aufgenommen (Abb. 3). R S + PtRh10 - T Pt TR TS m.p. TR TS time T Abbildung 3. Differenzschaltung zweier Pt/PtRh10-Thermoelemente zur gleichzeitigen Erfassung der Temperaturen TS von Probe S und TR von Referenzsubstanz R sowie der zwischen ihnen anliegenden Temperaturdifferenz T. Rechts schematisch die Entstehung des DTA-Signals für einen endothermen Phasenübergang 1. Ordnung, z.B. einen Schmelzprozess. Am Punkt der Phasenumwandlung (m.p.) wird die durch Heizen zugeführte Energie nicht zur Temperaturerhöhung der Probe, sondern für das Durchlaufen der Umwandlung genutzt. Anschließend eilt TS der linear weiter gestiegenen TR hinterher. Bei gleicher Heizleistung wird T umso größer, je größer die Probenmenge ist. DTA-Effekte sind also einwageabhängig und notwendigerweise asymmetrisch. Links ein kommerziell verfügbarer DTA-TG-Probenträgerkopf mit Pt-Bechern; die Tiegel sitzen auf den Schweißperlen der Thermoelemente und sorgen so für guten thermischen Kontakt. Anders als in der schematischen Darstellung in Abbildung 3 weisen experimentell gemessene DTA-Kurven natürlich fließende Übergänge auf, die stark von experimentellen Faktoren beeinflusst werden und reproduzierbare (und zwischen Laboren vergleichbare) 3 Nicht nur im Englischen (Differential Thermal Analysis), auch im Deutschen findet sich noch oft der Terminus Differentialthermoanalyse, der angesichts des Aufzeichnens von Differenzen (die aus messtechnischen Gründen auch noch möglichst groß sein sollen) nicht verwendet werden sollte. Dagegen ist die 1. Ableitung der TGKurve nach der Zeit zu Recht als Differentialthermogravimetrie (DTG) zu bezeichnen. 6 Auswertungen erschweren. Extrapolationsverfahren werden empfohlen, die vor allem für die Bestimmung des Beginns von Effekten bedeutsam sind (Abb. 4). Die Benennung der Temperaturen ist in internationalen Vereinbarungen geregelt [13]. Bei der Deutung von DTA-Effekten ist zu bedenken, dass für Phasenumwandlungen 1. Ordnung (z.B. das Schmelzen) einzig die Onset-Temperatur Tonex, nicht aber die PeakTemperatur relevant ist. Die Peak-Temperatur TP ist gemäß dem Schema in Abbildung 3 nur der Punkt maximaler Temperaturdifferenz zwischen Probe und Referenzsubstanz, was wegen der Abhängigkeit von der Probenmenge aber von sekundärer Bedeutung ist4. Im Falle Abbildung 4. Informationsgehalt eines DTA-Signals mit den Hilfslinien (gestrichelt) zur Ermittlung der charakteristischen Temperaturen (Onset-; extrapolierte Onset-, Peak- und extrapolierte End-Temperatur). Die Basislinie für die Peakfläche A ist hier nur als Gerade angenähert. A kann nach Ermittlung eines gerätetypischen Faktors Fcal für enthalpimetrische Messungen genutzt werden - Grundlage hierfür ist die aus dem 1. Hauptsatz der Thermodynamik hergeleitete Aussage, dass die isobar ausgetauschte Wärme dqP gleich der Enthalpieänderung ist (rechts). Der Unterschied der wärmephysikalischen Eigenschaften vor und nach dem Effekt verursacht einen Grundlinienversatz, der proportional CP ist. Die vor allem von der Heizgeschwindigkeit beeinflusste Asymmetrie des DTA-Signals wird durch den Formfaktor a/b beschrieben und kann u.U. zu kinetischen Auswertungen herangezogen werden. „richtiger“ chemischer Reaktionen repräsentiert das Peak-Maximum den maximalen Wärmeumsatz der Reaktion; messtechnisch ist es der Punkt, an dem Wärmezufuhr und -verbrauch gerade gleich sind. Man sollte daher bei der Beschreibung thermoanalytischer Kurven Formulierungen wie „Die Reaktion oder Umwandlung bei der Temperatur X °C“ vermeiden, wenn man Tp diskutiert. Richtig wären Formulierungen wie „Die bei Tonex °C einsetzende …“ oder „Die zwischen Tonex und … ablaufende Reaktion …“ 4 7 Wenn man mehrere Parameter in einer Messapparatur verfolgt, spricht man von Simultanthermoanalyse (STA), was am häufigsten in der Kombination DTA-TG angetroffen wird. Vereinfacht gesprochen: man montiert eine DTA-Messzelle auf eine empfindliche Waage, was kommerziell zuerst mit dem Derivatographen5 der Ungarischen Optischen Werke MOM verwirklicht wurde [14]. Inzwischen ist eine große Vielzahl unterschiedlich Abbildung 5. Aufbau einer einfachen STA-Apparatur mit mechanischem Wägesystem. Die Waageteile werden auf eine konstante Temperatur thermostatiert, während die Tiegel für Probe und Referenz bei Messtemperatur liegen - das führt zu Unterschieden im Auftrieb und verfälscht die TG-Auswertung. Korrekturkurven (meist Leermessungen) schaffen Abhilfe (Darstellung adaptiert aus [16]). konzipierter Gerätesysteme allein für die Kombination DTA-TG (Abb. 5) kommerziell verfügbar, wobei alle Unterschiede in der Bauart natürlich Vor- und Nachteile haben, die letztlich der Gerätebetreiber abwägen muss (z.B. auf- oder absteigende Führung der Spülgase, horizontale oder vertikale Anordnung des Probenträgers, hängende oder aufgesteckte Probentiegel u.a.). In praktisch jedem einführenden Text in die Praxis der TA wird zumindest eine dieser Substanzen mit einer Messkurve vorgestellt: Calciumoxalat-Monohydrat, CaC2O4 H2O, oder 5 Derivatograph war der Handelsname eines Messgeräts, nicht der Name einer Methode. Er spielt an auf die ebenfalls vom Gerät vorgenommene Ableitung der TG-Kurve nach der Zeit (Differentialthermogravimetrie, DTG) - er lebt fort in dem zuweilen im Laborjargon (nicht korrekt) verwendeten Begriff „Derivatogramm“; gemeint ist aber Diagramm, Thermogramm, TA-Aufnahme etc. 8 Kupfer(II)-sulfat-Pentahydrat, CuSO4 5 H2O. In der Tat sind sie sehr klare Beispiele und darüberhinaus die bestgeeigneten Testsubstanzen für den Laboralltag: Ihr thermisches Verhalten ist sehr gut bekannt, sie verändern sich nahezu nicht bei Lagerung6, und die TAKurven weisen Effekte mit unzweideutiger Form und Lage auf. Für diese Substanzen sei daher auf die gut etablierte Lehrbuch-Literatur verwiesen [3,15,16], während hier zwei weniger bekannte, jedoch nicht minder aussagekräftige Messungen erläutert werden sollen. Zudem machen diese Beispiele den besonderen Wert sinnvoll angelegter Messprogramme deutlich (zyklisches Heizen und Kühlen (Abb. 6), Gaswechsel (Abb. 7), u.a.), wodurch oft mehrere wichtige Probeneigenschaften durch Messung nur an einer Probe ermittelt werden können. Anlass für die Messung in Abbildung 6 war eine Literaturangabe, wonach bei 130 °C getrocknetes NaClO4 in einer Reaktionslösung als Trocknungsmittel verwendet werden sollte - alle Ansätze misslangen jedoch. Als Ergebnis unserer Überprüfung durch eine Messung mit zyklischem Heizen und Kühlen ergab sich, (a) dass die Trocknungstemperatur zu gering war, denn NaClO4 bildet auch ein Hemihydrat, NaClO4 0,5 H2O (statt zu trocknen kam es also zu einem „definiertem Wassereintrag“ von 0,5 mol H2O pro mol Trocknungsmittel in die Reaktionslösung), (b) dass einmaliges Erhitzen über 160 °C zu vollständig entwässertem NaClO4 führt, welches (c) an feuchter Raumluft nicht rehydratisiert. Einzig für die erste Entwässerungsstufe des CuSO4 5 H2O werden oft etwas geringere Massenverluste gefunden, weil das pulverförmige Hydrat doch mit der Zeit leicht entwässert - nicht dagegen CaC2O4 H2O. Dieses ist zudem noch ein guter Indikator für Sauerstoffspuren im Spülgas: Der zweite von drei endothermen Reaktionsschritten wird dann von exothermen Anteilen überlagert, weil aus dem Oxalat-Ion abgespaltenes CO zu CO2 weiterreagiert. 6 9 Abbildung 6. STA-Kurven von NaClO4 H2O und seinem Entwässerungsprodukt NaClO4 als Ergebnis von zyklischem Heizen und Kühlen unter Stickstoff, gefolgt von einem isothermen Programmschritt an feuchter Raumluft zum Test auf mögliche Rehydratation des NaClO4. Gezeigt sind jeweils TG und DTA für das erste Aufheizen bis 350 °C und das erste Kühlen (oberer Teil der Abb.). Darunter TG und DTA für das zweite Aufheizen wieder bis 350 °C. Weil die Kurven von erstem und zweitem Kühlen identisch sind, wurde aus Gründen der Übersichtlichkeit das zweite Kühlen weggelassen. Anschließend wurde der Ofen hochgefahren und 2 h an normaler Raumluft gemessen - infolge von Konvektion ist TG daher stärker verrauscht. Anstelle einer y-Skalierung für TG (in mg oder %) und DTG (in mg/min oder %/min) ist eine schematische Skala für TG in Mol Kristallwasser, nH2O, gegeben. Folgende Informationen können entnommen werden: (1) Nach zweistufiger Dehydratation schmilzt das wasserfreie NaClO4 mit Tonex 303 °C auf; (2) Der anschließende Wechsel von Heizen zu Kühlen bewirkt einen Grundlinienversatz der DTA-Kurve (punktiert); (3) Unter Kühlen wird der Kristallisationspeak ohne das Auftreten von Unterkühlung registriert; (4) Erneutes Aufheizen führt zu abermaligem Aufschmelzen von NaClO4 bei gleicher Temperatur, Massenverluste treten vor dem Schmelzen nun nicht mehr auf; (5) Nach dem Schmelzpeak tritt ein Grundlinienversatz in der DTA-Kurve auf (CPUnterschiede zwischen fester und flüssiger Phase); (6) Ein Massenzuwachs wird an feuchter Luft in 2 h nicht beobachtet. Abbildung 7 zeigt den Einfluss von wechselnder Gasatmosphäre auf den Verlauf von TAKurven. Hier sind zwei separate Messungen gegenübergestellt; man kann den Gaswechsel 10 auch während eines laufenden Temperaturprogramms vornehmen, z. B. bei organischem Material, wo nach thermischer Zersetzung in anaerober Atmosphäre bis zu einem konstanten TG /% 100 DTA /(uV/mg) - 1,92 % 412 8 - 5,62 % 80 6 293 Straw 4 60 2 Air 40 exo 0 - 63,75 % DTA N2 -2 20 - 86,85 % [7,53 % ash] TG 0 -4 -6 200 400 600 T /°C 800 1000 1200 Abbildung 7. STA-Kurven von gehäckseltem, luftgetrocknetem Stroh in Luft (15,10 mg) und in Stickstoff (16,94 mg) in Pt-Tiegeln. Für Luft wird der wahre Wassergehalt ermittelt (5,62 %), während für die Messung in N2 zur Einstellung einer definierten Gasatmosphäre vor Messbeginn mehrfach evakuiert und mit N2 geflutet wird - dadurch kommt es schon zu einer Vor-Entwässerung des Materials. Mit Kenntnis der hier nicht gezeigten DTA-Basislinie (die „thermische Asymmetrie“ des Systems) kann festgestellt werden, dass für die Reaktionen unter N2 (Pyrolyse, entspricht dem in der Organischen Chemie gebräuchlichen „trockenen Erhitzen“) praktisch keine Wärmetönung gemessen wird - das ist unerwartet, mag aber auch an der ungünstigen Probengeometrie (geschnittene Fasern) und dem folglich schlechten thermischen Kontakt mit dem Tiegel liegen. Dagegen ist die starke Exothermie des in zwei Hauptstufen verbrennenden Strohs offensichtlich - die Reaktion ist mit ca. 500 °C erstaunlich früh beendet. TG-Plateau anschließend das vollständige Ausbrennen des Rückstandes bis zur Bildung des Ascheanteils verfolgt werden soll. Beim Entwerfen sinnvoller Temperaturprogramme kann der erfahrene Experimentator viel Phantasie und Geschick entfalten und mittels TA eine oft überraschende Fülle an Informationen gewinnen. Die Abbildungen 6 und 7 zeigen sehr deutlich die Breite der möglichen Aussagen, die über praktisch bedeutsame Stoffeigenschaften erzielt werden können. Ein noch höherer Erkenntnisgewinn wird erreicht, wenn außerdem die freiwerdenden Gase qualitativ oder sogar quantitativ erfasst werden. Dies ist möglich mit Hilfe der seit etwa 1975 existierenden unterschiedlichen Formen der Kopplung der TA mit spektroskopischen Methoden - man 11 nennt sie EGA-Techniken (Evolved Gas Analysis) [17-19]. Sie werden inzwischen nicht nur zur Untersuchung von Zersetzungen, sondern allgemein von Reaktionen unter Variation der Gasatmosphäre erfolgreich eingesetzt, eine besonders leistungsfähige Variante hiervon ist die Pulse Thermal Analysis, PulseTA [20-22] (vgl. Abschnitt 5). 3.2. Einflüsse auf Form und Güte von thermoanalytischen Kurven Bei der Diskussion der thermoanalytischen Befunde aus den Abbildungen 6 und 7 wurde deutlich, dass nicht nur die numerischen Werte, z. B. für Massenverluste oder Temperaturen, sondern auch die Signalform im Kontext aller experimentellen Bedingungen wichtige weitere Informationen liefert. Die meisten dieser äußeren Bedingungen kann der Operator in gewissen Grenzen beeinflussen. Tabelle 1 gibt einen Überblick über die wichtigsten Tendenzen und ergänzt sie mit einigen experimentellen Erfahrungen. 12 Tabelle 1. Einflüsse auf Form und Güte thermoanalytischer Kurven Einflussfaktor Tendenz Kommentar Probenmenge Große Einwage: große DTA-Effekte Temperaturgradienten in der Probe groß; schlechtere Abdiffusion von Produkten Kleine Einwage: für TG eher günstiger m ~ 0,5 µg gut messbar Heiz- bzw. Kühlgeschwindigkeit Schnelles Heizen: größere DTA-Effekte „Überfahren“ von Effekten kann stören Tiegelmaterial Metalle: Höhere Wärmeleitfähigkeit erlaubt empfindlicher zu messen (Pt, Al, Ni, W-Re) a) Salzschmelzen können kriechen b) PH3, CHx, C greifen Pt an (T 900 °C) c) BaCO3 zerstört Pt-Tiegel (T 900 °C) d) Metallfluoride greifen Pt an (T 400 °C) e) Nanoskopische Phasen (vor allem Fluoride) greifen Pt auch bei milden Temp. deutlich stärker an als erwartet f) Langer Gebrauch bei hohen Temp. führt zu Rekristallisation des Pt (sogar an Tiegelwand sichtbar) Keramik u.a.: u.U. chemisch resistenter (-Al2O3, Si3N4, Graphit) Korundtiegel werden z. B. von Gemischen Cu2O/CuO bei ~1000 °C penetriert !; Graphit-Tiegel nicht in Luft verwenden Bei CO-Bildung durch Gegenwart von O2 sogar Umkehr der Wärmetönung endo exo möglich (bei CaC2O4 H2O beachten!) Spülgas / Reaktivgas SpülgasFlussgeschwindigkeit 100 ml/min, auch weniger gelten als optimal He und H2 haben spezielle Wärmeleitfähigkeiten und fluiddynamische Eigenschaften (DTA-Effekte können u.U. unterdrückt werden!) Höhere Gasflussgeschwindigkeit liefert bei PulseTA tendenziell schmalere Signale Referenzsubstanz Inert Inert zeigt im untersuchten Temperaturbereich keine Umwandlungen Aktiv (z.B. SiO2) Inert hat definierte Umwandlung, ermöglicht z.B. kalorische Kalibrierung (- -Umwandlung von SiO2 bei 571 °C) Keine Messung gegen leeren Tiegel ist oftmals mit akzeptabler Qualität möglich 13 4. Differential Scanning Calorimetry (DSC), Thermooptische Analyse (TOA) und die Untersuchung mechanischer Einwirkungen (TMA, DMA, µTA) Aus Abbildung 4 ging hervor, dass mittels DTA auch enthalpimetrische Messungen durchgeführt werden können - ihre Genauigkeit ist jedoch wegen der starken Abhängigkeit der DTA-Signale von experimentellen Bedingungen begrenzt (Abweichungen 10-15 %). Diesen Nachteil gleicht die Dynamische Differenz-Kalorimetrie, DDK (Differential Scanning Calorimetry, DSC) aus [23]. Ein der DTA verwandter, jedoch deutlich weniger von äußeren Einflüssen abhängiger Aufbau erlaubt genauere Messungen gerade für kalorische Größen, insbesondere zur Bestimmung von CP. Inzwischen überwiegt der Einsatz der DSC bei weitem den der DTA, vor allem im riesigen Bereich organischer Polymere [24], aber auch bei Pharmazeutika [25] und in der Prozessanalyse, besonders der Sicherheitskalorimetrie [26]. Die apparative Vielfalt der DSC reicht von kleinen Tischgeräten7 bis zu wägenden Systemen (DSC-TG). Abbildung 8 zeigt den der DTA entlehnten prinzipiellen Aufbau zweier Varianten der DSC. Im Fall der historisch älteren Wärmestrom-DSC sind beide Tiegel (bzw. Pfännchen mit Abbildung 8. Wärmestrom-DSC (Heat flux DSC) mit definierter Wärmeleitungsstrecke und Umgebungsheizung durch den Ofen (Probe und Referenz folgen passiv). Im Unterschied dazu die Leistungskompensation (Power-compensated DSC) mit zwei getrennten Heizern. flachem Boden, ggf. auch mit Deckel) leitend verbunden. Anliegende Temperaturdifferenzen werden daher schnell ausgeglichen - der hierfür fließende Wärmestrom ist das eigentliche Messsignal. Es ist offensichtlich, dass eine solche Messanordnung weniger abhängig ist von äußeren Einflüssen, z. B. von thermischen Asymmetrien oder vom Spülgasfluss. Probe und Referenz können auch separat geheizt werden - hier ist das Messsignal die unterschiedliche Heizleistung, die erforderlich ist, um Probe und Referenz bei gleicher Temperatur zu halten. Power-compensated DSC kann inzwischen als State-of-the-art 7 Beispielsweise auch an Bord von Tankern: Vor Bunkerung der Fracht kann ein kurzer Heizlauf in Luft vorgenommen werden. Die Peakfläche des DSC-Signals liefert ein Maß für die Exothermie der Oxidation, die näherungsweise den Brennwert des Rohöls und damit ein Qualitätskriterium darstellt. 14 bezeichnet werden, sicher auch als eine Folge des Fortschritts der Steuer- und AuswerteElektronik.8 Die DSC ist infolge ihrer gegenüber der DTA höheren kalorischen Empfindlichkeit besonders geeignet für die Abbildung 9 zeigt eine Untersuchung von Strukturumwandlungen in Polymeren. Aufnahme von Polyethylenterephthalat, PET, mit der charakteristischen Abfolge von (1) dem Glasübergang mit Tg (ein komplexer Relaxationsprozess mit endothermer Stufenversetzung der Basislinie), (2) der Kaltkristallisation (vollständige oder anteilige Ordnungsvorgänge in der ungeordneten Matrix, exotherm) und schließlich (3) dem Aufschmelzen der kristallinen Anteile (endotherm). Alle drei Schritte sind in besonderer Weise abhängig von der thermischen Vorgeschichte des Materials und erklären die große Bedeutung dieser Messungen bzw. Einflussgrößen für die Materialwissenschaft. Abbildung 9. DSC-Kurve des zweiten Aufheizens (20 K/min) von Polyethylenterephthalat (3,003 mg) in Al-Pfännchen unter N2 (aus [27]). Um zwischen Substanz- und Probeneigenschaften unterscheiden zu können, ist ein erstes Aufheizen bis über den Schmelzpunkt hinaus zu empfehlen. Vorausgesetzt, die Abkühlgeschwindigkeit (hier ebenfalls 20 K/min) ist hoch genug, um eine Erstarrung im Glaszustand zu ermöglichen, zeigt der zweite Heizlauf die substanzspezifischen Eigenschaften deutlicher ausgeprägt. Außerdem ist nach Aufschmelzen der Probe der thermische Kontakt zum Tiegel bzw. Pfännchen besser. 8 Es muss daran erinnert werden, dass die Einführung der Scanning-Methoden in die Kalorimetrie (Anfang der 1970er Jahre) unter den Kalorimetrikern heftig umstritten war: Scanning könne keinesfalls als richtige Kalorimetrie betrachtet werden. Klassische Kalorimetrie erforderte oft viele Stunden der Messvorbereitung (Temperaturgleichgewicht) und der Messungen selbst - die neuen Scanning-Methoden arbeiteten dagegen mit Heizgeschwindigkeiten von 5 oder 20 K/min und behaupteten, ernstzunehmende Resultate zu erbringen! Unbeschadet dessen ist grundsätzlich natürlich der Unterschied von Gleichgewichts- und Nichtgleichgewichtsmessungen in die Beurteilung von Ergebnissen einzubeziehen. 15 Auch ein anderes Feld neuer kalorimetrischer Methoden, die temperaturmodulierten Techniken, sind nur möglich geworden dank der extremen Leistungsfähigkeit moderner Elektronik für Steuerung und Auswertung: in der Modulated-Temperature DSC, MTDSC [28], wird dem linearen Temperaturanstieg eine sinusförmige Modulation mit ständig wechselndem Überheizen und Nachhinken der Temperatur aufgeprägt. Zusammen mit einer geradezu faszinierenden Miniaturisierung der Messfühler bzw. der Kalorimeter (sog. ChipKalorimetrie) sind außergewöhnliche Fortschritte bei der thermischen Charakterisierung von Polymeren [29] erzielt worden. Darüberhinaus sind die Möglichkeit chiraler Diskriminierung durch Chip-Kalorimetrie [30] oder - sicher besonders spektakulär - die sogenannte elektronische Nase zu erwähnen, auch sie ermöglicht durch extreme Miniaturisierung der kalorimetrischen Sensoren [31,32]. Die Thermooptische Analyse (TOA), auch als Thermomikroskopie bezeichnet, ist in ihrer einfachsten Variante verwirklicht in Form des Heiztischmikroskops (z.B. nach Kofler), das seit Jahrzehnten im Labor zur Bestimmung von Schmelzpunkten genutzt wird. Neben Start A Meniskuspunkt B Schmelze C Abbildung 10. Videounterstützte Untersuchung von Phasenumwandlungen: Die Lichtintensität hinter den Proberöhrchen steigt am Schmelzpunkt (Punkte B, C) drastisch an. Der nutzbare Temperaturbereich ist natürlich eingeschränkt (Abb. adaptiert aus [34]). einfacher mikroskopischer Beobachtung temperaturabhängiger Veränderungen (z.B. die beim Schmelzen eintretende Transparenz zerfließender Kristalle) können Strukturumwandlungen in fester Phase auch im polarisierten Licht unter Aufheizen oder Kühlen verfolgt werden. Besonders verbreitet ist die Anwendung der TOA in der Pharmazeutischen Chemie, vor allem 16 für die Unterscheidung von Modifikationen [33]. Eine interessante Weiterentwicklung der TOA nutzt LED-Lichtleiter und eine Videokamera zur Detektion von Schmelzpunkten über die Lichtdurchlässigkeit schmelzender Feststoffe [34] (Abb. 10). Es soll hier nicht verschwiegen werden, dass trotz aller bewundernswerten messtechnischen Entwicklungen der letzten Jahrzehnte ein ganz wichtiger Teil fehlt, der vor allem in der anorganischen Feststoffchemie immer wieder als Einschränkung für die Forschung empfunden wird: die Möglichkeit der visuellen Beobachtung von Proben bei sehr hohen Temperaturen (also letztlich eine Variante von TOA). Die Frage nach dem Auftreten flüssiger Phasen z.B. bei Sinterprozessen ist grundsätzlich sehr wichtig, kann aber fast immer nur indirekt beantwortet werden [35]. Der Einsatz temperaturfester Fenster wäre technisch möglich; so werden z.B. in Anlagen für die Kristallzüchtung polierte Saphir-Scheiben genutzt [36]. Nur in Messapparaturen für den Laborbetrieb ist diese (zugegeben extreme) Herausforderung für den wissenschaftlichen Gerätebau noch nicht angenommen worden. Zwei Gründe sind als wichtigste zu vermuten: Zum einen ist sicher die Zahl potentieller Nutzer insgesamt zu gering, als dass sich Entwicklungen wirtschaftlich lohnen würden; zum anderen ist es schwer vorstellbar, wie ein DTA-Ofen mit homogenem Temperaturfeld (!) für sehr hohe Temperaturen aussehen könnte, der eine visuelle Inspektion des Tiegelinneren von oben erlauben würde. Ein sehr großes Betätigungsfeld der Materialwissenschaften tut sich auf mit der temperaturabhängigen Änderung mechanischer Eigenschaften. Die Thermomechanische Analyse (TMA) verfolgt die Dimensionsänderung einer Probe unter konstanter Belastung mit einer Kraft. Die Methode wird genutzt für die Bestimmung von Längenänderungen 9, von Schwindungen (beim Sintern) sowie des Erweichens und Schrumpfens von Polymeren. Auch die Dynamisch-Mechanische Analyse (DMA) erfasst das Fließverhalten und viskoelastische (rheologische) Eigenschaften von Proben, jedoch unter periodischer (und ggf. ansteigender) Krafteinwirkung. Es werden zeit- und frequenzabhängige Eigenschaftsänderungen beschrieben, die zur Ermittlung von Glasübergängen, des Biegebruchverhaltens und anderer Eigenschaften wie Schalldämpfung, Schlagfestigkeit, Spannungsrelaxation u. a. m. unverzichtbar sind. 9 Auch mit der Thermodilatometrie (TD; dilatare - sich ausdehnen), diese jedoch mit vernachlässigbarer Krafteinwirkung 17 Abbildung 11. Schematische Darstellung des Prinzips der Dynamisch-Mechanischen Analyse mit dem Modell eines nach Lasteinwirkung (Pfeil) seine Ausgangsform wiederherstellenden Körpers. Abbildung 11 erklärt, wie die beiden wichtigsten Parameter der DMA hergeleitet werden. Mit den ermittelten Größen E’ und E’’ wird die Tatsache beschrieben, dass feste Materialien äußere Krafteinwirkungen „speichern“ oder sie auch wieder „vergessen“ können eine außerordentlich folgenreiche Eigenschaft, die bei der Entwicklung, Eignungsprüfung, Lebensdauerabschätzung etc. von Werkstoffen bekannt sein, also gemessen und quantifiziert werden muss. Umfangreiche Datensammlungen und Tagungsreihen widmen sich allein diesen Methoden TMA, DMA, u.a. [37, 38]. Die mikrothermische Analyse (µTA) ist eine Kombination hochauflösender Rasterkraftmikroskopie mit der TA. Im Unterschied zur üblichen Rasterkraftmikroskopie wird die verwendete Spitze hier aus einem Wollaston-Draht gefertigt, dessen Kern ein 5 µm starker Platindraht ist, der über eine geringe Distanz freigelegt ist und als Temperatursonde fungiert. Auf diese Weise wird die thermische Leitfähigkeit von Probenoberflächen ermittelt und eine Oberflächentopographie dargestellt [37]. Das ist von großer Bedeutung für die Untersuchung dünner Filme, von Lackschichten (Alterungsverhalten, Strahlungsresistenz) und von Verbundwerkstoffen. 5. Kopplungstechniken - Evolved Gas Analysis (EGA) 5.1. Kopplung mit der Massenspektrometrie (TA-MS) Mit den Darlegungen im Abschnitt 3.1. bedarf es eigentlich keiner weiteren Begründung, warum die qualitative und quantitative Charakterisierung von bei Reaktionen freigesetzten 18 gasförmigen Produkten ganz entscheidende Bedeutung für die vollständige und korrekte Beschreibung der Vorgänge hat. Seit etwa 1975 sind Gerätesysteme für die EGA in großer Variabilität verfügbar, wobei inzwischen Kopplungen mit der Massenspektrometrie (TA-MS) und der Fourier-Transform Infrarot-Spektroskopie (TA-FTIR) am weitesten verbreitet sind. Inzwischen ist es State-of-the-art, Untersuchungen zum thermischen Verhalten nur noch unter Hinzuziehen solcher Methoden vorzunehmen. Abbildung 5 ist an der Stelle des Gasauslasses um eine Ankopplung an ein Gerät zur Gasanalyse zu ergänzen - so erhält man den prinzipiellen Aufbau von EGA-Apparaturen. Deren große Vielfalt ergibt sich nun aus den unterschiedlichen apparativen Lösungen für diese Ankopplung, d.h. für einen unverfälschten Gastransfer vom TA-Tiegel zum Spektrometer. Alternativ kann auch zwischen TA-Messzelle und Spektrometer noch ein GC geschaltet werden, um Produkte vor der Charakterisierung aufzutrennen [39]. Auf experimentelle und apparative Details muss hier verzichtet werden, stattdessen sei auf exzellente Überblicke bei Symposien oder Einzeldarstellungen in der Literatur verwiesen [40-42]. Der erhebliche Informationsgewinn durch TA-MS soll hier nur an einem Beispiel demonstriert werden - Abbildung 12 zeigt eine Ergänzung der Messungen aus Abbildung 7 Abbildung 12. TA-MS-Kurven von gehäckseltem, luftgetrocknetem Stroh in Stickstoff (16,94 mg) in Pt-Tiegeln. Zusätzlich zu den DTA- und TG-Kurven in Abb. 7 sind hier die Ionenstrom (IC)-Kurven für die Massenzahlen m/z = 16(CH4+), 18(H2O+), 44(CO2+ u.a.) und 48(SO+) gezeigt. 19 durch die Ionenstrom (IC)-Signale, aufgenommen im Multiple Ion Detection (MID) Mode. Eine chemische Interpretation ergibt sich zunächst durch die An- oder Abwesenheit bestimmter Fragmente. Sie muss ergänzt werden durch die Bewertung des qualitativen Intensitätsverlaufs betrachteter Massenzahlen - dieser entscheidet über die Herkunft eines Fragments aus einem oder aus verschiedenen Molekülen bzw. über einander überlagernde Vorgänge. Für den Temperaturbereich zwischen 200 und 400 °C ist der qualitative Verlauf von m1610, m18, m44 und m48 annähernd gleich, nicht dagegen um 100 °C, hier hat nur m18 ein Intensitätsmaximum. Deshalb ist die Wasserabgabe um 100 °C ein Trocknen, während die um 300 °C „Reaktionswasser“ darstellt, das in dem komplizierten Mitteltemperaturschritt (starke Strukturierung der Signale) gemeinsam mit den anderen Pyrolyseprodukten gebildet wird (CH4, CO2, SO2, u.a.). 5.2. Pulse Thermal Analysis, PulseTA In der Forschung über heterogene Katalyse sind Puls-Techniken, also das Injizieren von definierten, meist kleinen Volumina gasförmiger Reaktanden in ein Reaktionssystem seit Jahrzehnten etabliert. Zugunsten von Informationen über die Gasphasenzusammensetzung sowie über Konversionsraten und Selektivitäten vernachlässigt der Katalytiker aber oft die Veränderungen, die die feste Phase vor und während der katalytischen Reaktion erleidet. Dem wurde abgeholfen durch die Entwicklung der PulseTA (PTA) [20], die eine Adaption dieser Techniken an die Gegebenheiten von TA-Apparaturen darstellt, denn in aller Regel erfassen moderne TA-MS- und/oder TA-FTIR-Kopplungen natürlich auch TG, so dass wichtige Informationen einschließlich der Probenmasse in einer Simultanmessung (!) ermittelt werden können. Die PTA erweitert herkömmliche EGA-Systeme um eine Gasdosiereinheit für bis zu zwei Permanentgase und basiert auf quantitativer Signalauswertung für Edukt- wie Produktgasgemische nach vorausgegangener Kalibrierung der jeweiligen Massen- bzw. Wellenzahl, die charakteristisch für eine der freigesetzten Substanzen ist. Diese Kalibrierung kann ex situ in einem vorausgehenden separaten TA-Experiment mit einer geeigneten Kalibriersubstanz definierten Verhaltens erfolgen. Sie kann auch in situ vorgenommen werden, z.B. durch Injektion der Kalibriersubstanz vor oder nach dem eigentlichen Reaktionsschritt, in dem die Abgabe dieser Substanz erfolgt. Eine interessante Variante von quantitativer PTA stellt z. B. die „maßgeschneiderte Synthese“ von stufenweise anreduzierten 10 Korrekt als m/z = 16 (CH4+) zu formulieren - hier jedoch in der verkürzten Schreibweise verwendet; entsprechend in Text und Abbildungen auch für die anderen Massenzahlen. 20 Metalloxiden durch Wasserstoffpulse dar, verfolgbar über den Massenverlust (H2O) pro Puls und die integrale Signalintensität entsprechender Massenzahlen [20]. Der qualitative Aspekt von PTA tritt dann in den Vordergrund, wenn quantitative Signalauswertung nicht verlässlich möglich ist. Dann kann ein TA-MS-Gerät, ausgestattet mit einer PTA-Box, auch „nur“ als Reaktor genutzt werden, und man beschränkt sich auf qualitative Signalauswertung. Ungeachtet dieser Einschränkung ist auch mit qualitativer PTA zur Aufklärung eines Reaktionsmechanismus’ [43] oder von Adsorptionsprozessen [22] beigetragen worden. Mittels selbstgebauter heizbarer septum-gedichteter Injektoren ist nicht nur das Pulsen von Gasen, sondern auch die Aufgabe von Flüssigkeiten (H2O, MeOH, sogar 40% HF [44]) möglich, die nach Verdampfen als Gase mit der Probe wechselwirken. Abbildung 13. Isotherme PTA-Messung einer vorbehandelten (2h 250 °C; Vakuum) Probe von -AlF3 (43.81 mg) in N2 mit der IC-Kurve für m/z = m31 (CH3O+). (1) Vier Injektionen von je 3 µL flüssigem CH3OH, die im Injektor (110 °C) verdampfen, werden auf die Probe aufgegeben; (2) Der erste Puls bewirkt einen persistenten Massenzuwachs von 70 µg, der auf Adsorption des Methanols zurückzuführen ist. Daher ist (3) das damit verbundene DTA-Signal exotherm. Bereits der zweite Puls zeigt eine andere Signalform bei (4) TG und (5) DTA: der leichte Überschwung der TG-Stufe geht im Spülgasstrom auf ein konstantes Niveau zurück, so dass ein geringerer persistenter Massenzuwachs (50 µg) registriert wird als zuvor. Ursache ist die Desorption von nur physisorbiertem Methanol, diese bewirkt (5) den endothermen Nacheffekt des DTA-Signals. Durch zunehmende Sättigung der Oberfläche wird (6) der persistente Massenzuwachs immer geringer; auch (7) die Form der DTA-Signale verändert sich qualitativ nicht weiter. Die Probe bräuchte für vollständige Beladung mit Methanol noch ein oder zwei weitere Pulse; hier wird mit den vier TG-Stufen (m = +150 µg) eine Beladung von 0.107 mmol/g (0.9 mol%) CH3OH ermittelt. Dieser hohe Wert erklärt sich mit der großen Oberfläche der Probe (ca. 200 m2/g) [21]. 21 Abbildung 13 erläutert ein solches Experiment. Es ist ein besonders aussagekräftiges Beispiel für die Interpretation von PTA-Kurven, weil es alle wesentlichen Elemente des Herangehens an die Anlage der Messungen und ihrer Deutung enthält - nur auf dieser Grundlage lässt sich das vergleichsweise ungewöhnliche Experiment in Abbildung 14 verstehen. Es enthält zwei Abbildung 14. PTA-Kurven von MIVO2 (37,07 mg) in N2 mit Injektionen von jeweils 1 mL HF(g)11 während zweier isothermer Segmente bei 145 und 350 °C. Zur Schaffung frischer Oberflächen war die Probe zuvor bei 170 °C ausgeheizt worden (m = 0,32%). Das Probenverhalten kann nur im Vergleich mit einer Leermessung richtig gedeutet werden (Blank, TG und DTA blau). Es wird in gleicher Weise injiziert wie mit Probe, aus Gründen der Übersichtlichkeit sind hier nur die Injektionspulse für die Probemessung (TG und DTA rot) gezeigt. (1) Weder ein TG- noch ein DTA-Effekt werden für drei Injektionen von 1 mL HF in den leeren Rezipienten registriert; (2) Der erste Puls auf MIVO2 hat geringere ICIntensität als die folgenden; (3) Die ersten beiden Pulse bewirken einen geringen Massenzuwachs, dann ist die Oberfläche gesättigt; (4) Die exothermen DTA-Effekte zeigen keine endothermen Nacheffekte; es liegt also reine Chemisorption vor; (5) Die Kurvenversätze im Bereich des Übergangs zum nächsten Isotherm-Segment sind nicht gezeigt; (6) Bei 350 °C wird erneut dreimal 1 mL HF injiziert; (7) Die DTA-Effekte sind deutlich schärfer, es werden jedoch (8) keine TG-Stufen registriert, weil (9) relativ intensive endotherme Nacheffekte sofortige Desorption des nur schwach physisorbierten HF anzeigen. Der Massenzuwachs von insgesamt 0,018 mg ergibt eine Beladung von 0,2 mol-% HF, was mit der Vorstellung eines anfluorierten F-MIVO2 gut vereinbar ist. 11 Gasförmige HF wurde folgendermaßen injiziert: der in einem septum-gedichteten PE-Gefäß über 100 % HF stehenden Gasphase wurden mit einer einfachen PE-Spritze Proben entnommen und injiziert; die Spritze wurde vor den Injektionen 2-3 mal mit der entnommenen HF gespült. Wie schon bei anderen Untersuchungen ist der Volumenfehler bei manuell vorgenommener Injektion relativ gering - er kann bei den Leermessungen zuvor abgeschätzt werden und betrug z. B. bei Tests mit H2O nur etwa 3-5 %. In diesem Fall deutet die besonders kleine Fläche des ersten Peaks eher auf einen Manipulationsfehler hin. 22 isotherme Temperatur-Segmente (145 und 350 °C), deren Wahl sich aus den chemischen Fragestellungen ableitete: (a) Lässt sich die in der chemischen Industrie bei 140 °C praktizierte Formierung eines MIVO2-Katalysators mit gasförmigem Fluorwasserstoff in einem PTA-Experiment simulieren, und (b) lassen sich ggf. zusätzliche, evtl. quantitative Informationen gewinnen? Lässt sich (c) auch bei der Einsatztemperatur des Katalysators (350 °C) eine Wechselwirkung mit HF beobachten? Als Ergebnis dieser Messungen lässt sich zusammenfassen: (a) Die Formierung des Katalysators konnte gut nachvollzogen werden; (b) Die Beladung mit HF ergibt einen sinnvollen Wert; (c) Bei 350 °C lässt sich erwartungsgemäß keine Adsorption mehr nachweisen, jedoch scheint schwache Physisorption aufzutreten; (d) Überraschenderweise zeigt sich bei Injektion von HF(g) in die leere Apparatur weder ein TG- noch ein DTA-Signal (was andererseits die Leermessung als verwertbares blank experiment gelten ließ). Ein vergleichbar aussagekräftiges Beispiel ist Eisen(III)-dotiertes Cer(IV)-oxid, Ce0.9Fe0.1O2-x, das mit CO2 bei 50 und 135 °C gepulst wurde; es ist in [45] ausführlich dokumentiert. Danksagung Herrn Dr. Ekkehard Füglein (Netzsch-Gerätebau GmbH, Selb) bin ich für intensive Diskussion und wertvolle Hinweise bei der Endredaktion sehr zu Dank verpflichtet. 6. Literatur [1] DIN 51005:2005-08, Thermische Analyse (TA) - Begriffe, Beuth Verlag, Berlin. [2] ASTM E 473-00, Standard Definition of Terms Relating to Thermal Analysis, 2000. [3] K. Heide: Dynamische Thermische Analysenmethoden, Deutscher Verlag für Grundstoffindustrie, Leipzig, 2. Aufl., 1982, S. 15. [4] D. Linke, unveröffentlicht, 1984. [5] http://www.gutenberg.org/files/22914/22914-h/22914-h.htm (Abschnitt 24) [6] http://de.wikipedia.org/wiki/Lavoisier [7] H. LeChatelier, Bull. Soc. Fr. Minéral. Cristallogr. 10 (1887) 204-11; deutsch in : Z. Phys. Chem. 1 (1887) 396-402. [8] A. Rémi, M. Giordano, C. Mathonat, R. Naumann, Thermochim. Acta 405 (2003) 43-50. [9] H.-U. Moritz and K.-H. Reichert Eds., Proc. 7th Intern. Workshop on Polymer Reaction Engineering, DECHEMA Monographien 137, Wiley-VCH, Weinheim, 2001. [10] L. Stäudel, A. Stille, H. Wöhrmann, GIT Laborfachzeitschrift 23 (1979) 291-3. 23 [11] www.food.metrohm.com/de/Titration/Thermometric/Applications.html [12] W. C. Roberts-Austen, Metallographist 2 (1899) 186. [13] J. O. Hill: For Better Thermal Analysis, special Edn. of the International Confederation for Thermal Analysis and Calorimetry, ICTAC, University of Rome, 1981. [14] J. Paulik, F. Paulik: Simultaneous thermoanalytical examination by means of the Derivatograph, in: Compr. Anal. Chem., vol. XII, G. Svehla Ed., Elsevier, 1981. [15] D. Schultze: Differentialthermoanalyse, Deutscher Verlag der Wissenschaften, Berlin, 2. Aufl., 1971. [16] W. F. Hemminger, H. K. Cammenga: Methoden der Thermischen Analyse, Springer Verlag, Berlin & Heidelberg, 1989. [17] H.-G. Wiedemann, G. Bayer: Trends and Applications of Thermogravimetry, in: Topics in Current Chemistry, Vol. 77, Springer-Verlag Berlin, 1978. [18] W.-D. Emmerich, E. Post, J. Therm. Anal. 49 (1997) 1007-12. [19] M. Fischer, S. Wohlfahrt, M. Saraji-Bozorgzad, G. Matuschek , E. Post, T. Denner, T. Streibel, R. Zimmermann, J. Therm. Anal. Calor. 113 (2013) 1667-73. [20] M. Maciejewski, A. Baiker: Pulse Thermal Analysis, in: Handbook of Thermal Analysis and Calorimetry, M. E. Brown and P. K. Gallagher Eds., Elsevier, 2008, Vol. 5, ch.4, pp. 93-132 [21] M. Feist, R. König, S. Bässler, E. Kemnitz, Thermochim Acta. 498 (2010) 100-5. [22] M. Feist, K. Teinz, S. Robles Manuel, E. Kemnitz, Thermochim Acta. 524 (2011) 170-8. [23] G. Höhne, W. Hemminger, H.-J. Flammersheim: Differential Scanning Calorimetry An Introduction for Practitioners, Springer Verlag Berlin & Heidelberg, 1995. [24] G. W. Ehrenstein, G. Riedel, P. Trawiel: Thermal Analysis of Plastics: Theory and Practice, Carl Hanser Verlag, München, 2004. [25] E. Marti Ed., PharmacyAndThermalAnalysis (PhandTA), Symposium proceedings at: http://www.eurostar-science.org/index.htm [26] F. Stoessel: Thermal Safety of Chemical Processes: Risk Assessment and Process Design, Wiley-VCH, Weinheim, 2008. [27] E. Füglein, Thermische Analyse und Rheologie, Vorlesungsskript WS 2013/14, Fachbereich Angewandte Chemie, TH Georg-Simon-Ohm, Nürnberg. [28] M. Reading, D. J. Hourston Eds.: Modulated-Temperature Differential Scanning Calorimetry, Springer Verlag, Berlin & Heidelberg, 2006. [29] C. Schick, Eur. Phys. J. Special Topics 189 (2010) 3-36. 24 [30] R. Kirchner, J. Seidel, G. Wolf, G. Wulff, Proc. 14th Ulm-Freiberger Kalorimetrietage, TU Bergakademie Freiberg, 21.-23.03.2001; www.gefta.org/gefta_ufk2001.html [31] J. Lerchner, T. Maskow, G. Wolf, Chem. Engin. Processing 47 (2008) 991-9. [32] J. Lerchner, D. Caspary, G. Wolf, Sensors and Actuators B70 (2000) 57-66. [33] R. A. Carlton: Pharmaceutical Microscopy, Springer Verlag, Berlin & Heidelberg, 2011. [34] M. Wagner, TA UserCom 29 (2009); www.mt.com/TA-webinars [35] R. Neher, T. Gestrich, M. Herrmann, Proc. GEFTA-STK-Symposium, Universität des Saarlandes, Saarbrücken, Oct. 10-12, 2012, p.20; http://www.gefta.org/gefta_jt2012.html [36] R. Uecker, P. Reiche, S. Ganschow, P.-M. Wilde, D.-C. Uecker, H. Worzala, D. Schultze, J. Cryst. Growth 174 (1997) 320-3. [37] R. Häßler, W. Kunze: Thermische Eigenschaften polymerer Werkstoffe, Stoffsammlung DMA-DSC-TGA-TMA-µTA, Eschborn, 2007; ISBN 978-3-940184-00-9-01-6. [38] W. Kunze, Ed.: Charakterisierung von Polymeren mit Hilfe von Thermischer Analyse und Rheologie, Proc. Würzburger Tage TAInstruments GmbH, Alzenau, 2004. [39] E. Füglein, J. Hanss, E. Post, Proc. Central & Eastern Eur. Conf. Therm. Anal. Calorim., August 27-30, 2013, Vilnius, Lithuania, OP4.09; www.ceec-tac.org/conf2/welcome.html [40] E. Kaisersberger, E. Post, Thermochim. Acta 295 (1997) 73-93. [41] J. Hanss, A. Kalytta, A. Reller, Hyphenated Techniques in Thermal Analysis, Proc. 5th Selber Kopplungstage, Eds. E. Kapsch, M. Hollering, Bad Orb, Germany, May 25-28, 2003, p. 151-63. [42] A. Kettrup: Thermogravimetrie - Differenzthermoanalyse, in: Analytiker-Taschenbuch, Bd. 4, Springer Verlag, Berlin Heidelberg, 1984. S. 85-106. [43] M. Feist, I. K. Murwani, E. Kemnitz, J.Therm. Anal. Calor. 72 (2003) 75. [44] M. Feist, E. Kemnitz, Thermochim. Acta 446 (2006) 84. [45] M. Feist, GIT Laborfachzeitschrift 58 (4) (2014) 31-4.