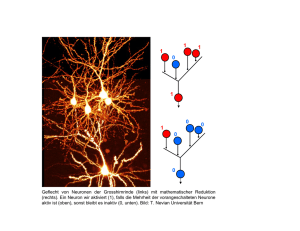
Untersuchungen zur Kartenbildung richtungsselektiver Neuronen
Werbung

Physik-Department Untersuchungen zur Kartenbildung richtungsselektiver Neuronen Diplomarbeit von Joachim Noll Technische Universität München Untersuchungen zur Kartenbildung richtungsselektiver Neuronen Diplomarbeit von Joachim Noll 7.Februar.2002 Aktuelle Kontaktinformationen Dez. 2003 eMail: mailto:[email protected] Internet: http://www.jnoll.de/ Physik-Department der TU München Theoretische Biophysik Prof. Dr. J. Leo van Hemmen Inhaltsverzeichnis Einleitung...........................................................................................................................3 1 Biologische Grundlagen.................................................................................................5 1.1 Die Karte im Kopf.......................................................................................................5 1.2 Großhirnrinde..............................................................................................................8 1.3 Die Nervenzelle...........................................................................................................9 1.4 Synapsen....................................................................................................................10 1.5 Veränderungen in der synaptischen Übertragung - der Lernprozeß...........................11 2 Das Sehsystem..............................................................................................................15 2.1 Die Sehbahn ..............................................................................................................15 2.1.1 Die Retina............................................................................................................................16 2.1.2 Der Lateral Geniculate Nucleus..........................................................................................17 2.1.3 Der primäre visuelle Cortex ...............................................................................................18 2.2 Orientierungs- und Richtungskarten..........................................................................20 2.3 Zeitliche Entwicklung des Sehsystems......................................................................23 3 Modell...........................................................................................................................25 3.1 Richtungsselektivität.................................................................................................25 3.2 Beschreibung des Modells und der Simulationen.....................................................28 3.2.1 Netzwerk und Verschaltung.................................................................................................28 3.2.2 Rezeptive Felder..................................................................................................................29 3.2.3 Arborisierung.......................................................................................................................30 3.2.4 Neuronenmodell..................................................................................................................31 3.3 Lernregel....................................................................................................................34 3.3.1 Maximaler Lernbeitrag........................................................................................................35 3.3.2 Lernschwelle.......................................................................................................................36 3.3.3 Normierung..........................................................................................................................36 3.3.4 Zusammenfassung der Lernterme.......................................................................................37 4 Datenanalyse ................................................................................................................39 4.1 Auswertung analog zum Experiment.........................................................................40 4.2 Geometrische Auswertung der intracorticalen Rezeptiven Feld Struktur..................44 4.3 Vergleich der verschiedenen Verfahren......................................................................47 5 Netzwerkdynamik.........................................................................................................51 5.1 Veranschaulichung der Netzwerkdynamik................................................................51 5.2 Initialisierung des Netzwerkes ..................................................................................52 5.3 Analyse der Netzwerkdynamik..................................................................................53 6 Analyse der Strukturbildungsprozesse..........................................................................57 6.1 Lernen durch einen Stimulus.....................................................................................57 6.1.1 Wirkung der LTP auf ein rezeptives Feld ...........................................................................58 6.1.2 Wirkung der LTD auf ein rezeptives Feld ..........................................................................60 6.1.3 Zusammenspiel von LTP mit LTD......................................................................................62 6.2 Lernen durch die Netzwerkdynamik..........................................................................64 6.2.1 Strukturänderung durch eine Aktivitätsblase......................................................................64 6.2.2 Strukturbildung über einen längeren Zeitraum...................................................................66 6.2.3 Lernen mit Lernschwelle.....................................................................................................69 6.2.4 Zeitliche Entwicklung der Karten.......................................................................................72 Zusammenfassung und Ausblick.....................................................................................75 Abbildungsverzeichnis....................................................................................................81 Literaturverzeichnis.........................................................................................................83 Einleitung Eine der größten Herausforderungen im neuen Jahrtausend wird sicherlich sein, einen tieferen Einblick in die Funktionsweise des Gehirns zu erlangen. Durch den rasant wachsenden Bereich der Informationstechnologie wird es immer wieder neue Methoden und Strategien geben, die Fülle an Aufgaben und Problemstellungen der Gehirnforschung zu lösen. Das Ziel der Forschungen in diesem komplexen Bereich muß darin bestehen, das eigentliche Funktionsprinzip, eines wenn auch kleinen Teils des Gehirns, zu verstehen und einfache realisierbare Modelle zu entwickeln, ob im analytischen oder im numerischen Bereich, mit deren Hilfe die Realität möglichst gut wiedergegeben werden kann. Das Gehirn eines Menschen besteht aus etwa 1011 Nervenzellen und etwa 1015 Synapsen. Dem gegenüber steht die begrenzte Anzahl der Gene. Die DNA höherer Säugetiere, also auch die des Menschen, enthält rund 100.000 Gene. Etwa 50.000 davon steuern die Entwicklung des Nervensystems (Thompson 1994). Es stellt sich die Frage, auf welche Art und Weise synaptische Gewichte eingestellt werden können. Einerseits könnte diese Einstellung von visuellen Erfahrungen abhängen, es würde sich somit um eine aktivitätsgetriebene Selbstorganisation handeln. Andererseits könnte sie genetisch stattfinden. Die Möglichkeit, daß sämtliche Gewichte jedoch genetisch vorgegeben sein könnten, erscheint angesichts der immensen Zahl an Synapsen im Vergleich zu der Anzahl der Gene schier unmöglich. Speziell im visuellen System ist bekannt, daß die subcorticalen Fasern erst etwa eine Woche nach der Entwicklung des visuellen Cortex einwachsen. Dies berechtigt zu der Annahme, daß dort schon eine von früheren Verarbeitungsstufen im visuellen System unabhängige Strukturierung erfolgen könnte. In dieser Arbeit wird daher untersucht, wie sich sogenannte neuronale Orientierungs- und Richtungskarten im primären visuellen 5 Cortex, während der frühkindlichen Entwicklungsphase eines höheren Säugetiers oder sogar der dem Menschen sehr ähnlichen Primaten ohne extracorticalen Input entwickeln könnten. Ausgehend von einem zweischichtigen Modell aus Spike-Response-Neuronen und einfachen Lernregeln wird dargestellt, inwieweit durch starke, lokal korrelierte neuronale Aktivität (Aktivitätsblasen) eine Selbstorganisierung der intracorticalen synaptischen Strukturen stattfinden könnte. Für diese Untersuchung wurde ein parallelisiertes C-Programm entwickelt, mit dem verschiedene corticale Architekturen simuliert werden können. Das Programm läuft auf nahezu beliebigen Rechnern mit sehr guter Skalierung. Da es sich um ein komplexes dynamisches System handelt sind die Simulationen sehr rechenzeitintensiv. Daher wurde ein Teil der Simulationen auf dem Landeshöchstleistungsrechner HITACHI SR8000/F1 des LRZ-München durchgeführt und ausgewertet. Die vorliegende Arbeit ist folgendermaßen aufgebaut: In Kapitel 1 wird ein Überblick über die biologischen Grundlagen des Gehirns gegeben. Im zweiten Kapitel wird speziell das visuelle System betrachtet, wobei der primäre visuelle Cortex im Mittelpunkt steht. Das dritte Kapitel beschreibt ein einfaches Modell des visuellen Cortex, welches als Grundlage für die Simulationen dient. Im vierten Kapitel wird besprochen, wie die in den Simulationen „gelernten“ Strukturen, im Hinblick auf die Interpretation als eine neuronale Karte, analysiert werden können. Im fünften Kapitel wird die Netzwerkdynamik genauer betrachtet, dabei speziell die Entstehung kleiner Aktivitätsblasen. Im sechsten Kapitel wird untersucht, inwiefern diese Blasen, aufgrund einer sogenannten spikezeit-auflösenden Lernregel, synaptische Strukturen für richtungsselektive Zellantworten entstehen lassen können. 6 1 Biologische Grundlagen 1 Biologische Grundlagen Kapitel 1 Biologische Grundlagen In diesem Kapitel wird ein Überblick darüber gegeben, was der Begriff „Karte“ für das Gehirn und speziell die neuronale Verarbeitung im visuellen Cortex bedeutet und welche Karten „im Kopf“ zu finden sind. Anschließend werden zunehmend detaillierter die zugrunde liegenden Funktionseinheiten untersucht: Angefangen vom groben Aufbau der Großhirnrinde über das Funktionsprinzip einer einzelnen Nervenzelle bis zur Wirkungsweise der zentralen Einheit „Synapse“, dem Verbindungsglied zweier Nervenzellen. Weiterhin wird erläutert, wie die Übertragungsstärke einer einzelnen Synapse, das synaptische Gewicht, gelernt werden kann, und wie auf diese Weise ermöglicht würde, auf einer sehr großen Zeitskala „Information“ zu speichern. 1.1 Die Karte im Kopf Im Großhirn (lat. Cerebrum), genauer in der Großhirnrinde (lat. Cortex cerebri) wird die„sensorische Umwelt“ in sogenannten Karten repräsentiert. Dabei handelt es sich um die neuronale Abbildung raumzeitlicher neuronaler Aktivität eines Sinnesorgans. Der Tastsinn zum Beispiel bildet die „somatosensorische Karte“, bei der die gesamte Körperoberfläche auf die entsprechenden Areale der Großhirnrinde projiziert wird. Genau wie bei der „motorischen Karte“, durch die die Muskelbewegungen repräsentiert werden, ist dort der gesamte Körper topographisch abgebildet (Abb.1.1). Es zeigt sich, daß die verschiedenen Körperbereiche flächenmäßig unterschiedlich groß repräsentiert sind. Die Größe der einzelnen Bereiche ist abhängig von der Einsatzhäufigkeit und Empfindlichkeit der entsprechenden Region. Die Hand etwa ist verhältnismäßig stark und daher großflächig repräsentiert, während der Rücken nur einen sehr kleinen Cortexbereich in Anspruch nimmt. 7 1 Biologische Grundlagen Abbildung 1.1 Die Karten des somatosensorischen und motorischen Cortex Eine neuronale Karte repräsentiert die neuronale Abbildung raumzeitlicher neuronaler Aktivität eines Sinnesorgans. Dem Tastsinn entspricht die „somatosensorische Karte“ (rechts), durch die die gesamte Körperoberfläche auf die entsprechenden Areale der Großhirnrinde abgebildet wird. Analog wird in der „motorischen Karte“ (links) die gesamte Körpermuskulatur in topographischer Weise abgebildet. (aus Edelmann 2000,S.5) Auch im visuellen System findet sich eine derartige Kartierung. Schon 1943 wurde von Hubel und Wiesel entdeckt, daß das gesamte Gesichtsfeld retinotop auf den primären visuellen Cortex abgebildet wird, d.h. benachbarte Punkte im Sehfeld sind auch im visuellen Cortex benachbart repräsentiert. Weiter fanden sie heraus, daß der visuelle Cortex eine Säulenstruktur aufweist. Sticht man etwa mit einer Elektrode senkrecht unterschiedlich tief in die Oberfläche des Cortex, so mißt man für die Mehrzahl der Zellen die gleiche Antwortpräferenz. Das bedeutet im visuellen Cortex, daß die Zellen auf eine bestimmte Art von visuellem Reiz besonders gut antworten. Man unterscheidet dabei Okulardominanz, Orientierungs- und Richtungsselektivität (Diese Begriffe werden im zweiten Kapitel detailliert behandelt). Wandert man mit der Elektrode hingegen horizontal über den Cortex, so findet man für benachbarte Zellen langsam ändernde Antwortpräferenzen(vgl. Abb. 1.2). Diese Organisation scheint ein allgemeines Prinzip im Aufbau der Großhirnrinde zu sein. Für die Orientierungsselektivität findet sich entsprechend in der Literatur der Begriff der Orientierungssäule (Thompson 1994). 8 1 Biologische Grundlagen Abbildung 1.2 Säulenstruktur im visuellen Cortex Durch Elektroden wird die Orientierungsselektivität der Hirnrinde untersucht. Diese werden dabei entweder senkrecht oder fast horizontal in die Rinde gestochen und gleichzeitig die durch visuelle Stimuli verursachte Antwortstärke gemessen. Es zeigt sich, daß die bevorzugten Orientierungsselektivitäten bei vertikaler Positionsänderung der Elektrode gleichbleiben, während sie sich horizontal langsam ändert. (aus Blasdel 1992) Je nachdem, welche Selektivität man betrachtet, finden sich verschiedene Kartierungen, wie die der sogenannten Okulardominanz, der Orientierungs- und der Richtungsselektivität (Abb. 1.3). Allen Karten gemeinsam ist die retinotope Anordnung. Speziell auf die Orientierungs- und Richtungskarten ist das Hauptaugenmerk dieser Arbeit gerichtet, sie werden in den nächsten Kapiteln detailliert behandelt. a) b) c) Abbildung 1.3 Karten im visuellen Cortex Im primären visuellen Cortex findet man für die unterschiedlichen Qualitäten von Selektivitäten der Zellen, verschiedene Karten. In a) ist die Okulardominanzkarte (Dudel 1996) dargestellt. Die schwarzen Bereiche erhalten bevorzugt Signale vom linken Auge, während die weißen Bereiche überwiegend Signale vom rechten Auge erhalten. In b) und c) ist je eine Orientierungs- (Hübener 1997) und Richtungskarte (Shmuel 1996) dargestellt. Die bevorzugte Orientierungs- bzw. Richtungsselektivität der Zellen sind entsprechend in der jeweiligen Legende farbcodiert dargestellt. 9 1 Biologische Grundlagen 1.2 Großhirnrinde Die Großhirnrinde, in der die eben vorgestellten Karten repräsentiert sind, besteht aus einer stark gefalteten ca. 1 bis 3 mm dicken Schicht (siehe Abb. 1.1 oben, schraffierte Schicht) von Nervenzellen, die beim Menschen eine Fläche von 1350 cm2 hat. Bei einer Dichte von ca. 105 Nervenzellen pro Quadratmillimeter entspricht dies einer Anzahl von 1011 Nervenzellen. Jede Nervenzelle ist durch etwa 104 bis 105 Synapsen mit anderen Nervenzellen verbunden. Die ergibt die unvorstellbar großen Zahl von etwa 1015 Synapsen.(Thompson 1994) Betrachtet man einen Schnitt durch den Cortex, erkennt man mehrere Schichten, bestehend aus Gruppen von Zellkörpern und Fasern (vgl. Abb. 1.4). Es gibt insgesamt sechs Schichten, wobei diese von der Cortexoberfläche her aufsteigend numeriert sind. Schicht I liegt ganz oben während Schicht VI die Basis darstellt. ca. 2 mm Abbildung 1.4 Querschnitt durch die Großhirnrinde. Die Großhirnrinde läßt in sechs Schichten einteilen. Typische Zellen dieser Schichten sind auf der linken Seite dargestellt, das Erscheinungsbild der Zellkörper in der Mitte. Rechts sieht man die Verteilung der Faserzüge, die die Neuronen untereinander verbinden. (aus Thompson 1994,Seite 33) Nervenzellen, die Informationen aus tieferliegenden Bereichen des Gehirns zu der Großhirnrinde projizieren, enden fast ausschließlich in Schicht IV, deshalb ist diese Schicht z.B. im visuellen Cortex auch stark vergrößert. Neuronen, die Informationen zu anderen Arealen des Gehirns leiten, liegen meist in Schicht V und VI. 10 1 Biologische Grundlagen 1.3 Die Nervenzelle Die funktionellen Einheiten des Gehirns sind die Nervenzellen, auch Neuronen genannt. Es handelt sich hierbei um spezielle Zellen, die Informationen mittels eines Spannungssignals verarbeiten können. Ein Neuron besteht aus einem Zellkörper, dem sogenannten Soma, den Dendriten und einem Axon. Die Dendriten bilden direkt am Neuron eine baumartige Struktur, den sogenannten Dendritenbaum, über den Signale von anderen Neuronen aufgenommen werden. Das Axon besteht nur aus einer einzigen Faser, über die das Neuron seine „verarbeitete Information“ an die Dendriten nachfolgender Neuronen weitergibt (Abb. 1.5). Abbildung 1.5 Nervenzelle Schematische Darstellung einer typischen Nervenzelle. Man erkennt den Dendritenbaum, der mit dem Soma verbunden ist. Das Axon ist eine einzelne Faser, welche sich nach einer Weile aufteilt und somit den Axonbaum bildet. (aus Thompson 1994, Seite 47) Die Zellmembran trennt das Innere des Neurons vom extrazellulären Raum. Im Ruhezustand besteht zwischen der Innenseite des Neurons und seinem Umfeld eine Potentialdifferenz von etwa -70 mV. Dieses Membranpotential kommt durch eine unterschiedliche Ionenzusammensetzung der intra- und extrazellulären Flüssigkeiten zustande. Senkt sich das Membranpotential unter diesen Ruhewert, so spricht man von einer Hyperpolarisierung, bei einer Erhöhung von einer Depolarisierung des Neurons. Übersteigt die Membranspannung einen Schwellwert von etwa -50 mV, entsteht am Axonhügel, dem Ansatzpunkt des Axons am Soma, durch spannungsgesteuerte Ionenkanäle ein Spannungspuls, das sogenannte Aktionspotential (engl. Spike), welches 11 1 Biologische Grundlagen sich entlang des Axons ausbreitet. Nach einer Zeit von wenigen Millisekunden, der Refraktärphase, in der kein weiterer Spike ausgelöst werden kann, kehrt das Membranpotential des Neurons zum Ruhezustand zurück. Ein Anstieg bzw. Abfall der Membranspannung wird durch synaptische Verbindungen mit anderen Neuronen verursacht, wobei das Soma als integrierende Einheit mit einem Schwellwert die eigentliche informationsverarbeitende Einheit darstellt (Thompson 1994). 1.4 Synapsen Eine Synapse verbindet das Axon des sogenannten präsynaptischen Neurons mit einem Dendriten des zugehörigen postsynaptischen Neurons. Zwischen der Synapse und dem postsynaptischen Neuron befindet sich der etwa 20 nm breite synaptische Spalt. Erreicht ein präsynaptisches Aktionspotential die Synapse, werden aus kleinen Flüssigkeitsbläschen, den Vesikeln, in diesen Spalt Neurotransmitter freigesetzt (Abb. 1.6). Die Neurotransmitter diffundieren über den synaptischen Spalt zu den Rezeptoren auf der postsynaptischen Zellseite, wo sie an Rezeptormoleküle koppeln, die Ionenkanäle öffnen und dadurch ein sogenanntes postsynaptisches Potential erzeugen. Abbildung 1.6 Synaptische Übertragung Hier ist die synaptische Signalübertragung schematisch dargestellt. Auf der präsynaptischen Seite ist ein Vesikel abgebildet, welches, ausgelöst durch ein präsynaptisches Aktionspotential, die in ihm enthaltenen Neurotransmitter in den synaptischen Spalt ausschüttet. Dort diffundieren diese zu postsynaptischen Rezeptoren und bewirken dort ein Öffnen von Ionenkanälen. Dadurch entsteht auf der postsynaptischen Seite eine Potentialänderung, das sogenannte postsynaptische Potential. (aus Thompson 1994, Seite 53) 12 1 Biologische Grundlagen In Abhängigkeit des Neurotransmitters und den vorhandenen Rezeptoren wird die postsynaptische Zelle durch Einströmen verschiedener Ionen entweder de- oder hyperpolarisiert. Bei einer Depolarisierung spricht man von einem exzitatorischen postsynaptischen Potential (EPSP), bei einer Hyperpolarisierung hingegen spricht man von einem inhibitorischen postsynaptischen Potential (IPSP). Da diese beiden Arten erzeugter Potentiale aber durch verschiedene Kanäle und durch unterschiedliche Ionen verursacht werden, ist die Abklingzeit der Potentiale im allgemeinen sehr verschieden. In der Regel wirkt ein IPSP länger als ein EPSP (vgl. Abb. 1.7). Die Effizienz mit der eine Synapse wirken kann, das heißt wie stark die verursachte Änderung des Membranpotentials ist, nennt man synaptisches Gewicht. Abbildung 1.7 EPSP und IPSP Dargestellt ist der zeitliche Verlauf des postsynaptischen Membranpotentials bei einem EPSP mit kurz darauffolgendem IPSP. (aus Gil 1996) Da ein Neuron auf andere Neuronen nur entweder exzitatorisch oder inhibitorisch wirken kann, wird es dementsprechend als exzitatorisches oder inhibitorisches Neuron bezeichnet. 1.5 Veränderungen in der synaptischen Übertragung - der Lernprozeß Das Gewicht einer Synapse und damit die Amplitude des postsynaptischen Potentials kann sich im Laufe der Zeit ändern, was die Antworteigenschaften der postsynaptischen Zelle beeinflußt. Für synaptische Lernprozesse hat schon 1949 D. Hebb folgende These formuliert: „When an axon of cell A is near enough to excite a cell B and repeatly or persistently takes part in firing it, some growth process or metabolic change takes place in one or both cells such that A's efficiency, as one of the cells firing B, is increased.“ (Hebb 1949) Solch ein Lernprozeß ist z.B. die Langzeitpotenzierung (engl. long-term-potentiation; LTP). Sie zeichnet sich dadurch aus, daß das synaptische Gewicht durch sie verstärkt wird. Im Gegensatz dazu findet man eine Langzeitdepression (engl. long-termdepression; LTD), die das synaptische Gewicht verringert. Die LTP kann durch drei Aspekte charakterisiert werden: Kooperation, Assoziativität und Spezifität.„Kooperation“ bedeutet, daß durch einen schwachen Reiz oder eine Reizserie 13 1 Biologische Grundlagen alleine noch keine Gewichtsänderung hervorgerufen werden kann (Abb. 1.8 a), es werden auch starke Gewichte benötigt. Werden der Zelle jedoch gleichzeitig schwache und starke Reize präsentiert, so spricht man von „Assoziativität“. Es wird dabei durch alle eintreffenden Signale ein Lernprozeß ausgelöst. Es werden sowohl die starken als auch die schwachen Synapsen verstärkt (Abb. 1.8 b). Wird die Zelle nur durch starke Reize erregt, spricht man von „Spezifität“ (Abb. 1.8 c). Die Synapsen der starken Signale werden zwar verstärkt, die schwachen Synapsen jedoch bleiben unberührt. (Kandel 1995) Abbildung 1.8 Langzeitpotenzierung (LTP) Hier wird dargestellt, wie durch die LTP eine synaptische Gewichtsänderung hervorgerufen werden kann. In a) ist die Kooperation gezeigt: Schwache Signale alleine reichen nicht aus einen Lerneffekt zu bewirken. In b) wird das Prinzip der Assoziativität gezeigt: Erhält die Zelle gleichzeitig starke und schwache Inputs, so werden alle Synapsen verstärkt. In c) ist die „Spezifität“ dargestellt: Treffen an der Zelle nur starke Signale ein werden diese verstärkt, während die schwachen Synapsen nicht verändert werden. (aus Kandel, 1995; Seite 700) Neuere Untersuchungen (Song 2000, Markram 1997, Feldmann 2000) haben gezeigt, daß die zwei langanhaltenden Veränderungen der synaptischen Übertragung, LTP und LTD ein sogenanntes „Lernfenster“ aufspannen, welches von dem präzisen Timing der prä- und postsynaptischen Spikes abhängt (Abb. 1.9). Abbildung 1.9 Lernfenster Gemessene Veränderung des synaptischen Gewichtes im visuellen Cortex in Abhängigkeit der präund postsynaptischen Feuerzeitpunkte. Auf der Zeitachse ist die Zeitdifferent von präsynaptischen zu postsynaptischen Spike dargestellt. Getriggert durch einen postsynaptischen Spike (zum Zeitpunkt t=0 ms) werden alle Synapsen, die kurz vorher (t>0) aktiviert wurden, verstärkt. Diese Zellen haben zum Feuern der Zelle beigetragen und werden somit „belohnt“. Die Synapsen jedoch, die erst Auslösung des postsynaptischen Spikes aktiv werden (t<0) tragen zum Feuern der Zelle nicht mehr bei. Sie werden abgeschwächt. (aus Feldmann 2000) 14 1 Biologische Grundlagen Getriggert von einem postsynaptischen Spike werden durch den LTP-Anteil all diejenigen Synapsen verstärkt, die zur Spikeauslösung des postsynaptischen Neurons beigetragen haben, also kurz vor der Spikeauslösung aktiv waren. Sie werden „belohnt“. Bei denjenigen Inputs, deren Synapsen hingegen kurz nach dem postsynaptischen Feuern aktiviert werden, wirkt der LTD-Anteil. Sie werden abgeschwächt, also „bestraft“. Der genau zugrunde liegende Mechanismus ist noch nicht geklärt. Das postsynaptische Potential könnte an den Ort der Synapse jedoch mittels eines im Experiment festgestellten rückwärtslaufenden Ca2+ Potentials übermittelt werden (van Hemmen 2001, Feldmann 2000). Für solch eine synaptische Verstärkung sind in Abbildung 1.10 experimentelle Daten gezeigt. Durch gezielte Stimulation einzelner Zellen, wodurch Aktionspotentiale künstlich erzeugt werden, wird ein Lernprozeß ausgelöst. Die Veränderungen der synaptischen Gewichte werden aufgezeichnet. Deutlich erkennt man die Erhöhung des Gewichtes durch LTP oder die Verringerung durch LTD. Abbildung 1.10 Experimentell gemessene Veränderungen des synaptischen Gewichtes In A1) und A2) wird der LTP-Anteil des Lernfensters untersucht. Es werden künstlich Aktionspotentiale erzeugt, die im Bereich dieses Fensters liegen und die Änderung nach einer Zeit auf Minutenskala gemessen. Es zeigt sich eine signifikante Erhöhung der Amplitude des postsynaptischen Potentials, ersichtlich am erhöhten Mittelwert der Meßpunkte ab t=25 min. In B1) und B2) wird analog der LTD-Anteil des Lernfensters untersucht. Hier zeigt sich eine Absenkung des Gewichtes. (nach Feldmann 2000) 15 1 Biologische Grundlagen 16 2 Das Sehsystem 2 Das Sehsystem Kapitel 2 Das Sehsystem In diesem Kapitel werden die einzelnen Stufen der Verarbeitung im Sehsystem entlang der sogenannten Sehbahn besprochen. Es wird darauf eingegangen, wie die Orientierungs- und Richtungsselektivität im visuellen Cortex kartiert ist, wie solch eine Karte gemessen werden kann und welche speziellen Eigenschaften diese Karten auszeichnet. Am Schluß des Kapitels wird die zeitliche Entwicklung des Sehsystems angesprochen. 2.1 Die Sehbahn Die visuellen Informationen werden beim Säugetier über die Augen aufgenommen und dann über den jeweiligen Sehnerv (lat. nervus opticus) an den LGN (eng. lateral geniculate nucleus) weitergeleitet. Dort laufen Fasern aus beiden Augen zusammen und projizieren zum primären visuellen Cortex (Abb. 2.1). Über den gesamten Übertragungsweg bleibt aber, wie schon erwähnt, immer die Retinotopie erhalten, das heißt benachbarte Punkte im Gesichtsfeld sind auch im LGN und im primären visuellen Cortex benachbart. Sowohl vom LGN als auch vom primären visuellen Cortex werden die Informationen zu anderen Arealen weitergeleitet. 17 2 Das Sehsystem Abbildung 2.1 Die Sehbahn Die visuellen Informationen gelangen von den Augen über die Sehnerven zum LGN. Dort laufen die Signale beider Augen zusammen und werden zum visuellen Cortex projiziert. (aus Thompson 1994, Seite 274) 2.1.1 Die Retina Am Anfang der Sehbahn steht das Sinnesorgan Auge. Durch die Linse wird ein scharfes Bild der Umgebung auf die Netzhaut (lat. Retina) projiziert, wo das eingehende Licht von den Photorezeptoren aufgenommen wird. Man findet zwei Arten von Photorezeptoren, die sogenannten Stäbchen und Zapfen. Stäbchen sind für die Hell/Dunkel-Wahrnehmung verantwortlich. Die Zapfen finden ihre Spezialisierung im Detail- und Farbensehen. Die Fovea centralis oder Sehgrube, diejenige Region der Retina, mit dem der Mittelpunkt des Gesichtsfeldes wahrgenommen wird, ist ausschließlich aus dicht gepackten Zapfen aufgebaut. Beim Fixieren eines Punktes wird dieser immer auf die Fovea projiziert, da dies die Zone des schärfsten Sehens ist. Nach außen nimmt die Anzahl der Zapfen ab und die der Stäbchen zu. Die Signale der Photorezeptoren werden nachfolgend von Ganglienzellen der Retina weiterverarbeitet, die den Ausgangspunkt des Sehnervs bilden. Jede Ganglienzelle erhält auch Informationen von benachbarten Photorezeptoren. Den Winkelbereich, den eine Ganglienzelle erfassen kann, nennt man ihr „rezeptives Feld“. Bei den Ganglienzellen sind die rezeptiven Felder rotationssymmetrisch. Sie bestehen aus einem zentralen Bereich, dem „center“, und einem Umfeld-Bereich, dem „surround“. Je nach „center“-Eigenschaft unterscheidet man sogenannte ONbzw. OFF- Zellen (vgl. Abb. 2.2). 18 2 Das Sehsystem Eine ON-Zelle wird erregt, wenn ein Lichtreiz im Zentrum präsentiert wird. Sie feuert dann also stärker als im Ruhezustand. Sie wird hingegen gehemmt, wenn man den Lichtpunkt im Umfeld, dem OFF-Bereich, zeigt. Die Feuerrate nimmt dann entsprechend ab. Bei der OFF-Zelle verhält es sich genau komplementär (Dudel 1996, Kandel 1995 und Thompson 1994). ON OFF OFF ON Abbildung 2.2 Die zwei verschiedenen Arten rezeptiven Felder in der Retina In der Retina, wie auch im LGN, sind die rezeptiven Felder rotationssymmetrisch. Sie bestehen aus einem zentralen Bereich, dem „center“, und einem Umfeld-Bereich, dem „surround“. Präsentiert man in einem ON-Bereich einen Lichtpunkt, so wird die Zelle erregt, bei der Präsentation in einem OFF-Bereich jedoch gehemmt. Je nach „center“-Eigenschaft unterscheidet man sogenannte ON- bzw. OFF- Zellen. 2.1.2 Der Lateral Geniculate Nucleus Der LGN besteht aus mehreren Schichten. Die retinalen Ganglienzellen projizieren in diese verschiedenen Schichten, getrennt sowohl nach linkem und rechten Auge als auch bezüglich ON- oder OFF -Typus. Die räumliche Struktur der rezeptiven Felder im LGN ähnelt sehr stark denen der Ganglienzellen. Es gibt nur den „Center-Surround“-Typ (Dudel 1996). Die genaue Funktion des LGN ist bis heute noch nicht geklärt. Räumlich scheint nur eine Kontrastverstärkung stattzufinden, wohingegen man bei der Katze auch Unterschiede im zeitlichen Antwortverhalten findet. Einige Zellen weisen dort eine Verzögerung in der Zellantwort auf. Man bezeichnet sie daher als lagged (verzögerte) Zellen und nonlagged (nicht verzögerte) Zellen (Dong 1995). 19 2 Das Sehsystem 2.1.3 Der primäre visuelle Cortex Der visuelle Cortex läßt sich in mehrere Areale einteilen. Die erste „Verarbeitungsstufe“ ist dabei der primäre visuelle Cortex, der hier genauer betrachtet wird. Wie im gesamten Cortex lassen sich aufgrund morphologischer Merkmale auch im primären visuellen Cortex sechs Schichten unterscheiden. Heranführende Verbindungen, sogenannte Afferenzen, aus dem LGN enden bevorzugt im Schicht IV. Schicht II und III sind gekennzeichnet durch die vorherrschenden Pyramidalzellen. Von ihnen gehen intra- und interareale Projektionen aus. Schicht V ist ebenfalls durch ihre großen Pyramidalzellen charakterisiert, von denen corticofugale Projektionen in den contralateralen Cortex und ins Mittelhirn ausgehen. Neurone der Schicht VI projizieren zurück zum LGN(Kandel 1995). Aufgrund der Struktur der rezeptiven Felder corticaler Zellen kann man noch eine weitere Unterscheidung treffen: Erhalten diese Zellen direkten Input aus abgegrenzten ON-OFF Unterregionen, nennt man sie „einfache Zellen“. Diese treten bevorzugt in der Eingangsschicht IV auf. Sind sie im rezeptiven Feld nicht abgrenzbar, nennt man sie „komplexe“ Zellen. Diese treten bevorzugt in den Schichten II,III,V,VI auf (Kande l 1995). Viele der corticalen Neuronen antworten bevorzugt auf die Orientierung oder Richtung eines präsentierten Stimulus. Das Antwortverhalten einer Zelle mißt man durch sogenannte „Tuningkurven“, wie in in Abbildung 2.3 dargestellt. Dabei wird im Gesichtsfeld des Versuchstiers ein Stimulus mit einer bestimmten Richtung bzw. Orientierung angelegt. Dieser wird dann schrittweise um insgesamt 180° bzw. 360° gedreht und die Antwort einer Zelle protokolliert. Die Antwortstärke wird dann in Abhängigkeit des Winkels aufgetragen. In Abbildung 2.3 a ist eine, mittels Elektrode, gemessene Tuningkurve für Orientierung dargestellt. in Abbildung 2.3 b analog eine Tuningkurve für Richtung. Man findet ein Maximum bei der sogenannten „Vorzugsorientierung“ bzw. „Vorzugsrichtung“. Weiterhin kann man den Zellen Selektivitätsindizes zuordnen, die angeben, wie stark die Selektivität ausgeprägt ist. Der Orientierungsselektivitätsindex (OSI) wird folgendermaßen definiert: OSI =1 O np Op mit O p der Stärke der Zellantwort in Vorzugsorientierung und O np in orthogonaler Orientierung. Der Richtungsselektivitätsindex (DSI) wird analog definiert: DSI =1 D np Dp mit D p der Stärke der Zellantwort in Vorzugsrichtung und D np in gegensätzlicher Richtung. Der OSI bzw. DSI kann also Werte zwischen Null und eins annehmen. Null bedeutet dabei keine Selektivität, während eins die maximale Selektivität bedeutet. 20 2 Das Sehsystem a) b) Abbildung 2.3 Experimentelle Tuningkurven Hier sind sogenannte „Tuningkurven“ dargestellt. Dabei wird im Gesichtsfeld des Versuchstiers ein Stimulus mit einer bestimmten Richtung bzw. Orientierung angelegt. Dieser wird dann schrittweise um insgesamt 180° bzw. 360° gedreht und die Antwort einer Zelle protokolliert. Die Antwortstärke wird dann In Abhängigkeit des Winkels aufgetragen. In a) ist eine, mittels Elektrode, gemessene Tuningkurve für Orientierungsantworten dargestellt (aus Swindale 1997), in b) analog eine Tuningkurve für die Richtungsantworten (aus Snowden 1994). Man erkennt ein Maximum bei einer bestimmten Orientierung bzw. Richtung. Dies ist die Vorzugsrichtung der Zelle. Das dieser Orientierungsselektivität zugrunde liegende Funktionsprinzip gilt heutzutage als gesichert und läßt sich, nach Hubel und Wiesel (1959), dadurch beschreiben, daß das rezeptive Feld in ON- und OFF-Unterbereiche aufgeteilt ist. Ist diese Untergliederung nicht rotationssymmetrisch, wie bei den rezeptiven Feldern in der Retina und im LGN, können die Zellen orientierungsselektiv antworten. Wird einer Zelle ein heller Balken z.B. derart präsentiert, daß er sich maximal mit dem ON-Unterbereich überschneidet, während der OFF-Unterbereich im rezeptiven Feld unbeleuchtet bleibt. So wird diese Zelle maximal angeregt, da der Balken also ihrer Vorzugsorientierung entspricht (siehe Abb. 2.4a). Dreht man den Balken aus der Vorzugsorientierung heraus (siehe Abb. 2.4 b und c) so wird der ON-Input auf die Zelle schwächer und somit auch deren Antwort. Bei diesem Modell ist also die vorwärtsgerichtete Verschaltung vom LGN zum Cortex der entscheidende Faktor für das Auftreten der Orientierungsselektivität . 21 2 Das Sehsystem a) b) c) Abbildung 2.4 Zustandekommen von Orientierungsselektivität nach Hubel und Wiesel Das rezeptive Feld teilt sich in ON- (grau) und OFF-Unterbereiche (weiß) auf. Ist diese Aufteilung nicht rotationssymmetrisch können die Zellen orientierungsselektiv antworten. In a) ist ein Balken in Vorzugsorientierung über das rezeptive Feld gelegt. Die Überschneidung mit den Unterbereichen des rezeptiven Feldes ist maximal. In b) und c) wird der Balken mehr und mehr gedreht. Die Überschneidung ist bei c) minimal, also wird hier auch die Zellantwort minimal ausfallen. Die meisten corticalen Neuronen antworten jedoch nicht nur bevorzugt auf eine bestimmte Orientierung sondern auch auf die Richtung, mit der ein Stimulus präsentiert wird. Wie solch eine Richtungsselektivität jedoch zustande kommen könnte, ist im Gegensatz zur Entstehung der Orientierungsselektivität sehr umstritten. Es gibt verschiedene Ansätze, wie sie zustande kommen könnte. Diese werden im Kapitel 3 erläutert. 2.2 Orientierungs- und Richtungskarten Da, wie schon angesprochen, ähnliche Selektivitäten im Cortex benachbart angeordnet sind, stellt sich die interessante Frage, wie diese Anordnung speziell bei Orientierungsund Richtungsselektivität realisiert ist, ob also eine Orientierungs- bzw. Richtungskarte existiert. Um nun eine Orientierungs- oder Richtungskarte zu erhalten, werden dem Versuchstier nacheinander Balken verschiedener Orientierung und Richtung gezeigt. Gleichzeitig wird in V1 die Aktivität durch „optical-imaging“ gemessen und protokolliert. Hierbei wird die Cortexoberfläche mit einem spannungsabhängigen Farbstoff benetzt. Mittels einer CCD-Kamera können dadurch in vivo die Aktivitäten in Abhängigkeit des Stimulus direkt sichtbar gemacht werden (Dudel 1996). Mit diesem Verfahren erhält man sogenannte „single-condition maps“ (SCMs) (siehe Abb. 2.5). Jede dieser Karten gibt die Aktivität im Cortex für die Stimulierung mit einem bewegtem Gitter (Grating) in einer bestimmten Richtung wieder. Diese Karten werden auf den sogenannten „Cocktail Blank“ normiert. der die Summe über alle SCMs darstellt. 22 2 Das Sehsystem Abbildung 2.5 Single condition maps Ein Gitter wird mit verschiedenen Bewegungsrichtungen präsentiert und gleichzeitig durch „optical imaging“ die Aktivität in V1 aufgezeichnet. Man erhält damit „single-condition maps“ (SCMs), die als Grundlage für die weitere Berechnung der Richtungs- und Orientierungspräferenzen dienen. (aus Shmuel 1996) Wie aus solchen SCMs Orientierungs- bzw. Richtungskarten ermittelt werden, ist in der Literatur uneinheitlich „definiert“. Zum Ermitteln der Richtungsselektivität werden sogenannte „differential SCMs“ erzeugt. Dabei werden je zwei SCMs mit gleicher Orientierung aber gegensätzlicher Richtung voneinander subtrahiert (Weliky 1996 und Shmuel 1996) oder dividiert (Kisvarday 2001). Diese „Differenzkarten“ werden dann pixelweise vektoriell addiert, wobei die Richtungspräferenz einer SCM als Vektorrichtung verwendet wird. Die Richtungen der resultierenden Vektoren gibt die bevorzugten Richtungen an den verschiedenen Cortexpositionen an. Bei der Ermittlung von Orientierungskarten werden je zwei SCMs mit gleicher Orientierung aber gegensätzlicher Richtung addiert, zu sogenannten „orientation SCMs“. Diese werden dann entweder vektoriell addiert, um die Orientierungspräferenz zu erhalten (Kisvarday 2001 und Hübener 1997), oder es werden, als Zwischenschritt, wieder Differenzkarten der Orientierung erzeugt (Weliky 1996, Shmuel 1996 und Blasdel 1992). Dabei werden je zwei „orientation SCMs“ mit orthogonaler Orientierung voneinander subtrahiert. Pixelweise vektoriell aufaddiert ergibt sich dann die bevorzugte Orientierung. Für eine mathematische Formulierung siehe Kapitel 4.1. Nach welchem Verfahren man auch die bevorzugten Selektivitäten berechnet, die erhaltenen Richtungs- bzw. Orientierungsvektoren werden üblicherweise farbcodiert dargestellt (siehe Abb. 2.6). Bei der Darstellung der Richtungskarten entsprechen dabei 360° einem vollen Farbkreis, während bei der Orientierung bereits 180° einem vollen Farbkreis entsprechen, da gegensätzliche Richtungen der gleichen Orientierung entsprechen. 23 2 Das Sehsystem a) b) Abbildung 2.6 Orientierungs- und Richtungskarte In a) ist eine Orientierungskarte (aus Hübener 1997) dargestellt. Der Farbcode gibt dabei die bevorzugte Orientierung an einer bestimmten Cortexposition an. Die den Farben entsprechende Balkenorientierung ist in der Legende rechts abgebildet. In b) ist eine Richtungskarte (aus Shmuel 1996) dargestellt. Die bevorzugte Richtung wird durch den farbcodierten Pfeil an der Seite dargestellt. Sowohl in den Karten der Orientierungs- als auch der Richtungsselektivität gibt es Singularitäten, die im folgenden näher besprochen werden. Bei der Orientierungskarte findet man in der Natur zwei Arten von Singularitäten, sogenannte Pinwheels. Ähnlich wie bei einem Windrad dreht sich die Orientierung um eine Orientierungssingularität um 180°. Dabei können sich die Pinwheels in der Umlaufrichtung unterscheiden (Abb. 2.7 a und b). Orientierungssingularitäten, bei denen eine Orientierung zweimal (Abb. 2.7 c) vorkommt, findet man in der Natur nicht. „Pinwheel“ „Pinwheel“ a) vorhanden b) vorhanden c) nicht vorhanden Abbildung 2.7 Orientierungssingularitäten In der Natur kommen bei den Orientierungskarten nur Pinwheels von 180° vor. Wie in a) und b) dargestellt, unterscheiden sich diese Pinwheels im Umlaufsinn. 360° Pinwheels wie in c) finden sich im Experiment nicht. (nach Weliky 1996) Bei den Richtungskarten zeigen sich andere Singularitäten. Hier findet man auch 360° Pinwheels in der Natur, d.h. die Richtungen sind mit einer vollständigen Drehung um eine punktförmige Singularität angeordnet(Abb. 2.8a). Desweiteren findet man 24 2 Das Sehsystem sogenannte „Fractures“(Abb. 2.8b). Dies sind längliche Bereiche, die eine „Quelle“ oder „Senke“ darstellen. Nicht beobachtet wurden punktförmige „360° Quellen“ bzw. „360° Senken“ (Abb. 2.8c). (Weliky 1996) „Pinwheel“ „Fracture“ a) vorhanden b) vorhanden c) nicht vorhanden Abbildung 2.8 Richtungssingularitäten In der Natur kommen bei den Richtungssingularitäten zwei verschiedene Arten von Singularitäten vor: In a) rotieren die Richtungen um eine punktförmige Singularität oder es gibt b) lange Bereiche, die eine Quelle oder Senke darstellen. Nicht beobachtet wurden punktförmige „360° Quellen“ oder „360° Senken“ (nach Weliky 1996). 2.3 Zeitliche Entwicklung des Sehsystems Anatomische Studien am visuellen System der Katze haben gezeigt (Issa 1999), daß die genikulären Axone am embryonalen Tag 29 (E 29) den LGN in Richtung Cortex verlassen. Um E 36 erreichen die ersten Fasern die sogenannte „subplate“, eine Vorstufe zum Cortex, die später jedoch abstirbt. Dort warten sie bis etwa E 50, während die corticalen Zellen „geboren“ werden. Dieser Vorgang dauert für Schicht IV von E 36 bis E 42. Gegen E 50 beginnen die genikulären Axone in den Cortex einzuwachsen und dort Synapsen zu bilden. Es gibt also in der Entwicklung der Katze eine Phase (E 42 bis E 50), bei der die corticalen Zellen zwar schon vollständig ausgebildet sind, aber noch keine genikulären Informationen erhalten. Die Hypothese in dieser Arbeit ist nun folgende: Es wird angenommen, daß schon zu diesem frühen Zeitpunkt durch einen Lernprozeß eine Veränderung der synaptischen Gewichte stattfindet, so daß man den Zellen eine Richtungs- und Orientierungsselektivität zuordnen kann. Durch diesen „Seed“ könnte dann auch das Einwachsen der genikulären Axone beeinflußt werden. Für eine detailliertere Zusammenfassung siehe auch Bartsch (2000). 25 2 Das Sehsystem 26 3 Modell 3 Modell Kapitel 3 Modell In diesem Kapitel wird vorgestellt, wie Richtungsselektivität in einem neuronalem Schaltkreis zustande kommen könnte. Im Anschluß wird ein spezialisiertes Modell eines zweischichtigen Netzwerks aus Spike Response Neuronen vorgestellt. Dadurch wird ein kleiner Ausschnitt des primären visuellen Cortex möglichst wirklichkeitsgetreu dargestellt. Es wird die Verschaltung der einzelnen Neuronen mit axonaler Verzögerung erläutert, das Berechnungsmodell eines einzelnen Neurons diskutiert, und besprochen, wie Richtungsselektivität durch spikezeitauflösendes Lernen in der frühen Entwicklungsphase eines Lebewesens gelernt werden könnte. 3.1 Richtungsselektivität Es gibt verschiedene Theorien darüber, wie Richtungsselektivität entstehen kann. Allen diesen Theorien ist jedoch gemeinsam, daß es im Prinzip eine Verzögerung ∆ T zwischen den Messungen an zwei räumlich getrennten Punkten geben muß. In Abbildung 3.1 ist dies schematisch gezeigt: Ein Stimulus wandert mit der Geschwindigkeit v von links nach rechts über das rezeptive Feld einer Zelle. Dieses soll in diesem einfachen Beispiel aus zwei Punkten P1 und P2 mit Abstand s bestehen. Den Punkt P1 erreicht der Stimulus zum Zeitpunkt T1, den Punkt P2 zum Zeitpunkt T2. Die Laufzeit, die der Stimulus benötigt, um die Strecke s zu durchwandern, ist t=s ⁄ v . Ist die Verzögerung ∆ T =t gewählt und die Schwelle der Zelle derart, daß sie nur durch mehrere gleichzeitige Signale angeregt werden kann, so kann sie nur auf den Stimulus antworten, der sich von links nach rechts bewegt. Bei Bewegung des Stimulus in Gegenrichtung würden klarerweise die Signale von P1 und P2 nicht gleichzeitig am Neuron eintreffen, da zwischen ihnen ein Zeitabstand ∆ t=∆ T s ⁄ v läge. 27 3 Modell Neuron ∆T s 1 2 v t= s v Abbildung 3.1 schematische Erklärung der Richtungsselektivität Ein Stimulus (rot) wandert mit der Geschwindigkeit v von links nach rechts. Zum Zeitpunkt T1 läuft er an Punkt P1 vorbei und löst dort ein Signal aus. Nach einer Laufzeit t erreicht er Punkt P2 und löst auch dort ein Signal aus. Damit die Zelle die Bewegungsrichtung des Stimulus detektieren kann, muß sie die Informationen von P1 und P2 zeitgleich erhalten. Dies ist nur dann der Fall, wenn das Signal von P1 eine Verzögerung durchläuft. Diese Verzögerung muß der Laufzeit t des Stimulus entsprechen. Es gibt verschiedene Auffassungen darüber, wie solch eine zeitliche Verzögerung in der Natur und somit die Richtungsselektivität zustande kommen könnte: Einerseits kann sie durch vorwärtsgerichtete Verbindungen aus dem LGN vermittelt werden, zum Beispiel durch das unterschiedliche zeitliche Antwortverhalten genikulärer Zellen, den sogenannten lagged und non-lagged Zellen (Wimbauer 1996 und Wimbauer 1997). Durch eine Summation der verzögerten und nicht verzögerten Signale aus dem LGN erhält das Neuron raumzeitliche Information über den Stimulus und kann daher richtungsselektiv antworten. Ein anderer Ansatz geht neben gewöhnlichen auch von sogenannten „depressing“ Synapsen aus (Senn 2000 und Buchs 2000). Bei diesem Synapsentyp werden die, bei jeder synaptischen Signalübertragung verbrauchten, Vesikel nur langsam wieder aufgefüllt. Dadurch wird für einen bewegten Stimulus, zum Beispiel ein Gitter, die Phase verschoben. Kommt dieser Synapsentyp im Zentrum eines rezeptiven Feldes vor, so kann im Zusammenspiel mit „non-depressing“ Synapsen im Umfeld eine richtungsselektive Zellantwort erzeugt werden. 28 3 Modell Andererseits könnte die notwendige Signalverzögerung auch durch intracorticale Verzögerungen zustande kommen. Messungen von Bringuier (1999) haben gezeigt, daß die intracorticalen Verbindungen axonale Verzögerungen von bis zu 30 ms aufweisen können (Abb. 3.2 a). Diese resultieren aus einer relativ langsamen axonalen Leitungsgeschwindigkeit von etwa v=0,1 m/s (Abb. 3.2 b). Besteht in der intracorticalen Verschaltungsstruktur eine räumliche Asymmetrie des synaptischen Inputs, und nehmen die Verzögerungen vom Zentrum zum Umfeld hin zu, so treffen in der Vorzugsrichtung der Zelle, die Signale von anderen Zellen in einem sehr kleinen Zeitraum ein und summieren sich stark auf. In der Gegenrichtung ist dieses Zeitraum jedoch sehr viel breiter und die Summation deshalb sehr viel schwächer. Es entsteht eine richtungsselektive Zelle. 2 mm a) b) Abbildung 3.2 Verzögerungen im Input-Feld In a) ist die gemessene Verzögerung im Input-Feld einer corticalen Zelle dargestellt. Diese resultiert nach Bringuier (1999) wie in b) dargestellt aus einer axonalen Leitungsgeschwindigkeit von etwa vA=0,1 m/s. Besteht in dem intracorticalen rezeptiven Feld eine räumliche Asymmetrie des synaptischen Inputs, so kann die Zelle richtungsselektiv antworten. (aus Bringuier 1999) Zusätzlich können durch intracorticale Asymmetrien auch Orientierungsselektivitäten entstehen (Bartsch 2000). Es ist zwar eine mittlerweile allgemein akzeptierte Tatsache, daß Orientierungsselektivität durch vorwärtsgerichtete Verbindungen vom LGN vermittelt wird. Im folgenden Modell jedoch wird angenommen (vgl. auch Bartsch 2000), daß anfängliche Orientierungsselektivität durch intracortical asymmetrisch verknüpfte Synapsenstrukturen bestimmt ist. Beim Einwachsen der Afferenzen aus dem LGN könnte nämlich eine vorgegebene Asymmetrie dazu führen, daß sich die vorwärtsgerichteten Verbindungen an die bereits existierende intracorticale Struktur anpassen. 29 3 Modell 3.2 Beschreibung des Modells und der Simulationen Um die Entstehung dieser asymmetrischen intracorticalen rezeptiven Felder zu untersuchen, wurde ein Programm entwickelt, in dem diese intracorticalen Verzögerungen implementiert sind. Im Folgenden wird der Aufbau eines neuronalen Netzwerkes und die mathematisch zugrunde liegenden Formeln für die Simulationen beschrieben. 3.2.1 Netzwerk und Verschaltung Das gesamte Netzwerk besteht aus zwei Schichten mit je 64×64 Neuronen. Die erste Schicht besteht aus exzitatorischen Neuronen, die exzitatorisch sowohl in die eigene Schicht projizieren als auch zu der zweiten, bestehend aus inhibitorischen Neuronen. Diese projizieren ihrerseits inhibitorisch auf die exzitatorischen Neuronen (Abb. 3.3). Die Verknüpfungen innerhalb der inhibitorischen Schicht wurden aus Rechenzeitgründen in den Simulationen noch nicht aktiviert. Inhibitorische Neuronenschicht Exzitatorische Neuronenschicht Abbildung 3.3 Neuronales Netzwerk Schematische Beschreibung der Verschaltung des neuronalen Modell-Netzwerkes. Es besteht aus zwei Neuronenschichten, einer exzitatorischen und einer inhibitorischen. Exzitatorische Neuronen projizieren auf die eigene Schicht und auf die inhibitorischen Neuronen (rot), während die inhibitorische Neuronen nur auf die exzitatorischen Neuronen projizieren (blau). Das Ziel solch eines Modell-Netzwerkes ist, einen kleinen Ausschnitt aus dem primären visuellen Cortex nachzubilden. Im realen visuellen Cortex ändern sich durch die retinotope Abbildungsweise Nachbarschaftsbeziehungen im visuellen Pfad nicht. Benachbarte Punkte im Gesichtsfeld sind auch in der neuronalen Repräsentation im visuellen Cortex benachbart. Weiterhin zeigt das Experiment (vgl. Kapitel 1.1), daß der Cortex eine Säulenstruktur mit nahezu periodisch angeordneten funktionalen Gruppen aufweist. Daher scheint es gerechtfertigt für die Simulation eine zweidimensionale Approximation des dreidimensionalen Cortex zu benutzen. Weiterhin ist das Netzwerk mit periodischen Randbedingungen ausgestattet. Dies ist durch die im Experiment festgestellte Periodizität begründbar und zusätzlich wird eine „Verschmutzung“ der Netzwerkdynamik durch Randeffekte verhindert. 30 3 Modell 3.2.2 Rezeptive Felder Man nennt den Bereich, aus dem ein Neuron seine Informationen erhält, sein „rezeptives Feld“. In dieser Arbeit wird dieser Begriff im Sinne eines synaptischen Input-Feldes verstanden. Bezieht man sich dabei nur auf den räumlichen Anteil, so spricht man vom „räumlichen“ rezeptiven Feld. Bei der Berücksichtigung von zeitlichen Strukturen spricht man von einem „raumzeitlichen“ rezeptiven Feld. Das rezeptive Feld erstreckt sich in diesem Modell räumlich über 7 Nachbarneuronen, d.h. 15 Neuronen im Durchmesser, und zeitlich über eine Verzögerungsspanne bis 20 ms. Es ist zu beachten, daß sich das rezeptive Feld der inhibitorischen Neuronen nur aus den Verbindungen von der exzitatorischen Schicht zusammensetzt, wohingegen die exzitatorischen Neuronen Informationen aus beiden Schichten erhalten. Die Zeit, die ein Signal von der Spikeauslösung bis zum Erreichen des Somas der postsynaptischen Zelle benötigt, setzt sich zusammen aus axonaler, synaptischer und dendritischer Verzögerung. Wie u.a. von Bringuier (1999) gemessen, breitet sich ein axonales Signal ungefähr mit konstanter Geschwindigkeit aus, und es entsteht eine entfernungsabhängige Verzögerung, die für eine starke Richtungsselektivität erforderlich ist. Weiterhin addiert sich eine synaptische und dendritische Verzögerung von etwa 3 ms auf. In der Simulation wurde die Verzögerung nach folgender Formel berechnet: ∆ T (d ij )=∆ T min d ij ( ∆ T max ∆ T min ) (3.1) ∆T [ms] relative y-Position mit d ij dem auf eins normierten Abstand von prä- und postsynaptischen Neuron ( d ij =1 für den Rand des rezeptiven Feldes). Die minimale Verzögerung, die den synaptischen und dendritischen Anteil darstellt, und die maximale Verzögerung, durch welche die axonale Laufzeit dargestellt wird, sind frei einstellbar. Im Hinblick auf die experimentellen Randbedingungen (Bringuier 1999) wurde ∆ T Max =20 ms und ∆ T min =3 ms gewählt. relative x-Position a) dij b) Abbildung 3.4 Rezeptive Felder In a) ist das rezeptive Feld (weiß innerhalb, schwarz außerhalb des rezeptiven Feldes), in b) die zeitliche Verzögerung im rezeptiven Feld abgebildet. Dargestellt ist die minimale Verzögerung (blau) durch den synaptischen und dendritischen Anteil, die entfernungsabhängige axonale Verzögerung (grün) und die gesamte, in den Simulationen benutzte Verzögerung (schwarz). 31 3 Modell 3.2.3 Arborisierung Es wird angenommen, daß die gesamte maximale Kopplungsstärke, mit der zwei Zellen Signale austauschen, abhängig von der Dichte des gesamten Axonbaums und des Dendritenbaums ist, da die Anzahl der möglichen synaptischen Verbindungen mit wachsender Entfernung ausdünnt. Diese Abschwächung wird durch eine sogenannte Arborfunktion A folgendermaßen beschrieben: ( ) A(d ij )=exp d ij κex,inh , (3.2) A(dij) Relative y-Position mit dem normierten Abstand d ij zwischen Neuron i und j. Für die exzitatorischen Neuronen wurde κex =1 und für die inhibitorischen Neuronen κinh =10 gewählt (siehe Abb. 3.5), so daß die inhibitorischen Neuronen eine größere effektive Reichweite aufweisen. Relative x-Position a) dij b) Abbildung 3.5 rezeptives Feld mit Arborisierung In a) ist das mit der Arborfunktion gewichtete rezeptive Feld für die exzitatorischen Neuronen gezeigt. In der Mitte (weiß) ist das Gewicht maximal und fällt nach außen ab. In b) sind die verschiedenen Arborisierungen für die exzitatorischen (rot) und die inhibitorischen Neuronen (blau) gezeigt. In diesem Modell werden vereinfachend nur monosynaptische Verbindungen zwischen zwei corticalen Neuronen i und j betrachtet. Um der abnehmenden gesamten Kopplungsstärke gerecht zu werden, wird die Arborisierung in diesem Modell als eine multiplikative Verringerung des Gewichtes einer Synapse J ij verstanden. Die effektive Wirkung J eff ij einer Synapse lautet mit berücksichtigter Arborfunktion J eff ij =J ij A(d ij ) . 32 (3.3) 3 Modell Diese Einführung der Arborisierung hat den Vorteil, daß sowohl beim Lernen als auch bei einer Normierung des synaptischen Gewichtes nur das einfache synaptische Gewicht J ij betrachtet werden muß. Da ferner die Arborisierung für alle Neuronen eines Typs als gleich angenommen wird, kann A(d ij ) vereinfacht werden zu: Aij := A(d ij ) . (3.4) 3.2.4 Neuronenmodell Für die in dieser Arbeit durchgeführten Simulationen wurden die Neuronen mittels des Spike-Response-Modells (SRM) (Gerstner und van Hemmen 1994) genähert. Der Zustand eines Neurons ist im SRM durch sein Membranpotential eindeutig festgelegt. Dieses wird für das Neuron i durch die Variable hi (t) dargestellt, die Feuerzeitpunkte dieses Neurons werden mit t if bezeichnet. Das postsynaptische Neuron i ist mit den präsynaptischen Neuronen j über Synapsen mit den Gewichten J ij verbunden. Diese Gewichte werden durch die Arborfunktion A(d ij ) verringert. Die Laufzeit eines Spikes vom Soma des präsynaptischen Neurons bis zum Soma des postsynaptischen Neurons ist ∆ T (d ij ) . Ein präsynaptisches Aktionspotential kann je nach Synapsentyp entweder ein EPSP oder ein IPSP erzeugen. Beide synaptischen Anteile werden in diesem Modell vereinfacht als exponentiell abfallend angenommen, wobei sie sich jedoch dem Experiment entsprechend in der Abklingzeit unterscheiden (Abb. 3.6). Der durch synaptischen Input erzeugte Anteil des Membranpotentials lautet dann: h syn,ex,inh (t)= ∑ ∑ Aij J ij ε ex,inh (tt fj ∆ T (d ij )) . i j t jf ≤t (3.5) Hier wurde der Kern ε ex,inh { (t)= ( ) exp t ex,inh τε für t>=0 0 für t<0 (3.6) ex inh eingeführt mit Zeitkonstanten τ ε =6 ms für ein EPSP und τ ε =30 ms für ein IPSP. Unbeachtet dessen, daß ein EPSP oder IPSP eigentlich in mV zu messen ist, wird in dieser Beschreibung und den Simulationen auf solche Einheiten verzichtet, da nur die relativen Verhältnisse der Zahlenwerte untereinander von Bedeutung sind. 33 εinh(t) εex(t) 3 Modell t [ms] Abbildung 3.6 Zeitlicher Verlauf von EPSP und IPSP mit unterschiedlichen Zeitkonstanten Darstellung der exzitatorischen (rot) und der inhibitorischen (blau) postsynaptischen Antwort auf einen präsynaptischen Spike gemäß Formel (3.6). Um der experimentell gefundenen verminderten Feuerfähigkeit eines Neurons nach Spikeemission Rechnung zu tragen, wird mit dem Kern { refr ( ) für t≥0 0 für t<0 η0 exp η = t τη (3.7) ein sogenanntes „Refraktärpotential“ refr hrefr (tt if ) i (t)= ∑ η t≥t if (3.8) eingeführt, welches zum Membranpotential addiert wird und weiteres Feuern durch starkes Absenken des Membranpotentials verhindert. Als Zeitkonstante wurde τη=10 ms und als Stärke { η 0= 40 für exzitatorische Neuronen 100 für inhibitorische Neuronen gewählt. Die Parameter sind so eingestellt, daß sich das Neuron selbst bei einer maximalen Aktivierung durch das Netzwerk bei Feuerraten unter 100 Hz einpendelt. Dadurch ergibt sich effektiv eine Refraktärphase von etwa 10 ms. Mit einer frei wählbaren externen Stimulierung h ext setzt sich das gesamte instantane Membranpotential folgendermaßen zusammen: 34 3 Modell syn,inh,ex hi (t)=hi refr ext (t)hi (t)hi (t) . (3.9) Die Feuerwahrscheinlichkeit eines Neurons zu einem bestimmten Zeitpunkt ist gemäß des SRM eindeutig durch das Membranpotential gegeben und wird durch folgende Formel berechnet: { ( P F (h(t) ; δ t)= 1exp (h i (t)θ ex,inh ) ex,inh T )} 1 ⋅δ t , (3.10) wobei eine Schwelle von { 2 für exzitatorische Neuronen 3 für inhibitorische Neuronen θ ex,inh = und ein „Rauschfaktor“, der die Breite des Übergangs beeinflußt, eingeführt wird. Dieser wird festgelegt auf { 0,5 0,4 für exzitatorische Neuronen . für inhibitorische Neuronen Pf (h(t)) T ex,inh = h(t) Abbildung 3.7 Aktivierungsfunktion des Neurons Aktivierungsfunktionen für exzitatorische Neuronen (rot) und inhibitorische Neuronen (blau) gemäß Formel (3.10). 35 3 Modell 3.3 Lernregel Beim Lernen der Synapsenstärken kommt es in erster Linie auf das präzise Timing der prä- und postsynaptischen Feuerzeitpunkte an (Song 2000 und Feldmann 2000). Trifft ein präsynaptisches Aktionspotential an der Synapse ein kurz bevor die postsynaptische Zelle feuert, wird deren Gewicht erhöht (vgl. Kapitel 1.5). Trifft es hingegen nach einem postsynaptischen Spike ein, so wird das Gewicht verringert. Man nennt die Erhöhung des Synapsengewichtes Langzeit-Potenzierung (LTP), die Verringerung der Synapsenstärke Langzeit Depression (LTD). In den Simulationen wurde das Lernfenster W folgendermaßen gewählt (Abb. 3.8) : {( t prä t post exp W LTP (t prä t post )= τ LTP 0 ) für t prä t post <0 (3.11) sonst mit τ LTP=11 ms für den LTP Anteil und W LTD (t prä t post { )= (t prä t post ( t prä t post )exp τ LTD 0 ) für t prä t post >0 (3.12) sonst ∆J (tprä-tpost) mit τ LTD =20 ms für den LTD-Anteil, vgl. auch Abb. 1.9, in der das experimentell bestimmte Lernfenster abgebildet ist. tprä-tpost [ms] Abbildung 3.8 Lernfenster Darstellung des in den Simulationen benutzen Lernfensters. Es setzt sich zusammen aus LTP- (rot) und LTD-Anteil (blau) (vgl. Kapitel 1.5). In den Simulationen kann man das Lernfenster variieren und den LTP- und LTD-Teil separat „einschalten“ bzw. „ausschalten“. 36 3 Modell 3.3.1 Maximaler Lernbeitrag In der Literatur findet man verschiedene Interpretationen, wie eine Gewichtsänderung durch das Lernfenster anzuwenden ist. Eine Interpretation nimmt die Änderung absolut an (Song 2000), das bedeutet, daß unabhängig von anderen Faktoren, zum Beispiel dem aktuellen Gewicht, die Änderung immer gleich bleibt, also starke Synapsen im selben Maße gelernt werden wie Synapsen mit dem Gewicht Null. Eine andere Interpretation ist, die Änderung proportional zum aktuellen Gewicht zu berechnen. Das bedeutet, daß starke Synapsen auch stark gelernt werden können, während schwache Synapsen nur sehr schwach bis gar nicht verändert werden. Um dieses Modell so variabel wie möglich zu halten, sollten beide Varianten leicht und flexibel zu implementieren sein. Es wird dazu eine zusätzlich Variable V (J ) eingeführt, die eine „Lernamplitude“ ausdrückt. Bei V (J )=1 ist eine synaptische Änderung absolut vorzunehmen, während mit V (J )=J eine Änderung proportional wirkt. In diesem Modell wurde die Lernamplitude so gewählt, daß die maximale Änderung der synaptischen Gewichte bei J m , dem Mittelwert zwischen J min und J max , liegt: J m=J min (J max J min ) . 2 Die Gleichung für die Lernamplitude lautet somit |J m J| V (J )=V 0(1V 0 ) |J max J m| (3.13) V0 Lernamplitude V(J) mit einer minimalen Amplitude V 0 (vgl. Abb. 3.9) Jmin Jm Jmax Synapsengewicht J Abbildung 3.9 Lernamplitude Die Lernamplitude ändert sich mit dem aktuellen Gewicht. Hat das Gewicht entweder das Maximum oder das Minimum erreicht, so ist die Amplitude, das heißt die maximal mögliche Änderung des Gewichtes nur sehr klein, während, wenn das Gewicht genau zwischen den beiden Extrema liegt, die Amplitude maximal wird. 37 3 Modell 3.3.2 Lernschwelle Da in diesem Modell die Neuronenaktivität auf stochastischer Spontanaktivität beruht, kann es sich als günstig erweisen, eine Lernschwelle einzuführen. So werden nur korrelierte Signale gelernt, der Beitrag des Rauschens hingegen unterdrückt. Lernbeiträge sollen nur dann gelernt werden, wenn das Membranpotential hi eine Lernschwelle Ξ überschreitet. Deshalb wurde ein „Schalter“ folgendermaßen eingeführt: { Ωi (hi (t))= 0 1 für hi (t)<Ξ . für hi (t)≥Ξ (3.14) 3.3.3 Normierung Schon alleine das Lernfenster bewirkt eine Normierung (Kempter 2001), bei den Untersuchungen zur Strukturbildung wurden auch die Auswirkungen der einzelnen Teile des Lernfensters, LTP und LTD, untersucht. Es war daher erforderlich, die Summe der synaptischen Gewichte einer Zelle auf einem konstanten Level zu halten, d.h. zu normieren. Da außerdem, ohne explizite Normierung, oft das Problem besteht, daß die rezeptiven Felder einiger Neuronen sehr viel mehr synaptisches Gewicht auf sich „ziehen“ als andere. Daher wurde ein „Schalter“ eingebaut, mit dem man das gesamte Gewicht des rezeptiven Feldes auf einen festen Wert normieren kann, d.h. ∑ J ij=const für alle i nach jedem Lernschritt . j Nach jedem Zeitschritt und somit direkt nach jedem Lernvorgang wird das neue Gesamtgewicht einer Synapsenart berechnet. Danach wird es unter Berücksichtigung der minimalen und maximalen Gewichte auf alle Synapsen verteilt. Dabei kann es zu minimalen Abweichungen bei der Erhaltung der Gesamtsumme kommen, die aber unerheblich sind, da die synaptischen Veränderungen immer nur sehr klein sind. 38 3 Modell 3.3.4 Zusammenfassung der Lernterme Die Änderung des Gewichtes von Verbindungen, die exzitatorische Neuronen untereinander verbinden, lautet mit LTP- und LTD-Anteil, zusammengefaßt: { } ∆ J ij =Ωi (hij )V (J ij ) S i (t) ηLTP ∑ W LTP ( ∆ t ij )ηLTD ∑ W LTD ( ∆ t ij ) (3.15) t fj <t t fj <t wobei der Spiketrain des postsynaptischen Neurons i durch S i (t)= ∑ δ(tt if ) t≤t if (3.16) und damit die Zeitdifferenz von prä- und postsynaptischen Spike durch ∆ t ij =tt fj ∆ T (d ji ) , (3.17) gegeben ist. einem Schalter Ω , mit dem die komplette Lerngleichung ein- oder ausgeschaltet werden kann, einer Lernamplitude V (J ) , dem Lernfenster W LTP,LTD und die Wachstumsgeschwindigkeit η up,down . Durch die Wachstumsgeschwindigkeit wird die Geschwindigkeit des Lernprozesses bestimmt. Zusätzlich wird das Gewicht nach oben durch ein Maximalgewicht von typischerweise J max=0,8 beschränkt. Nach unten ist das Gewicht exzitatorischer Synapsen systematisch dadurch beschränkt, daß sie nicht kleiner als Null werden können. Es wurde jedoch auch die Möglichkeit vorgesehen ein Minimalgewicht J min ≥0 einzuschalten. In diesem Modell werden durch das Lernfenster nur diejenigen Synapsen gelernt, die exzitatorische Neuronen miteinander verbinden. Die Synapsen, die auf die inhibitorischen Neuronen projizieren, lernen nicht durch das Lernfenster, sondern werden von einem Grundgewicht ausgehend bei jedem präsynaptischen Spike um einen bestimmten Wert µ erhöht: ∆ J ij =S j (t)µ , (3.18) wobei der präsynaptische Spiketrain S j (t) analog Formel 3.16 berechnet wird. Die inhibitorischen Gewichte, also die Verbindungsstärke der inhibitorischen auf die exzitatorischen Neuronen, werden in diesem Modell festgehalten. Diese Gewichte haben die „Aufgabe“, zu starke Aktivität zu drosseln. In den Simulationen werden diese Gewichte stärker als die exzitatorischen Gewichte gewählt, so daß die Effektivität der Inhibition unabhängig von der genauen Stärke ist. Sie äußert sich lediglich darin, wie stark das Neuronist, aber nicht, ob es inhibiert wird. 39 3 Modell 40 4 Datenanalyse 4 Datenanalyse Kapitel 4 Datenanalyse Zur Untersuchung des Strukturbildungsprozesses aufgrund der Lerngleichung (3.15) muß geklärt werden, welche Erkenntnisse man aus einer vorgegebenen synaptischen Gewichtsverteilung gewinnen kann und auf welche Art eine Datenanalyse durchzuführen ist. In diesem Kapitel werden daher zwei Methoden vorgestellt, um aus der Gesamtheit der synaptischen Gewichte eine Karte zu erhalten. Beide sollten möglichst dasselbe Resultat liefern. Bei dem ersten Verfahren wird analog zum Experiment ein Stimulus an das Netzwerk angelegt und die Aktivität protokolliert, mittels derer anschließend Richtungs- und Orientierungskarten berechnet werden. Das zweite Verfahren wertet die intracorticalen rezeptiven Felder geometrisch aus und ermöglicht so eine Interpretation hinsichtlich Richtungs- und Orientierungsselektivität. Desweiteren wird eine Testkarte eingeführt, mit welcher man die Qualität und auch Abweichungen der beiden Auswertungsmethoden voneinander überprüfen kann. 41 4 Datenanalyse 4.1 Auswertung analog zum Experiment Bei der Auswertung mit einem Stimulus wird dem simulierten Cortex ein bewegtes Gitter (eng. Grating) „präsentiert“. Der Unterschied zum Experiment besteht darin, daß vorgeschaltete Verarbeitungsstufen im einfachen corticalen Modell nicht explizit berücksichtigt werden. Die Amplitude des Stimulus wird bei dieser Auswertung zu jedem Zeitschritt als „EPSP“ direkt in das Membranpotential „geschrieben“. Dies kann als monosynaptischer Input aus dem LGN interpretiert werden. Eine Umrechnung in eine Feuerrate des genikulären Neurons bleibt hingegen vernachlässigt. Ein oft unbeachtetes Problem ergibt sich bei der Präsentation eines sogenannten fullfield-Stimulus an ein Netzwerk mit periodischen Randbedingungen (Abb. 4.1 a). Zur besseren Ansicht wurde hier das Netzwerk so verschoben, daß dessen Ränder in der Mitte der Bilder liegen. Dies ist durch die periodischen Randbedingungen immer möglich. Damit es an diesen Rändern keinen Phasensprung gibt muß die Periodizität des Gitters an das Netzwerk angepaßt werden. Die Ausdehnung des Netzwerkes muß ein ganzzahliges Vielfaches einer einzelnen Periode des Gitters sein. Bei einer Drehung des Gitters ändert sich die Richtung dieser Periodizität, nicht aber das statische Netzwerk. Das Gitter paßt also nicht mehr in das vorgegebene Netzwerk. Es kommt an den Rändern zu einem Phasensprung (Abb. 4.1 b). a) b) c) Abbildung 4.1 Stimuluspräsentation zur Datenauswertung In a) ist ein full-field-Stimulus dargestellt. Die Periode des Stimulus kann in Abhängigkeit von der Netzwerkausdehnung nur bestimmte diskrete Werte annehmen, damit an den Rändern des Netzes kein Phasensprung entsteht. Um dies zu veranschaulichen, wurde der Rand des Netzwerkes in allen Bildern in die Bildmitte geschoben. In b) wurde der Stimulus etwas gedreht. Man erkennt sofort den Phasensprung. Um ein beliebiges Muster an das Netzwerk anlegen zu können, muß es auf einen bestimmten Bereich eingeschränkt werden wie in c), da es sonst zu Problemen mit den periodischen Randbedingungen kommt. Allerdings erscheint dem System fälschlicherweise an den Rändern des Mantels eine bestimmte Orientierung. 42 4 Datenanalyse Um dennoch ein beliebiges Muster anlegen zu können wurde daher folgendermaßen vorgegangen: Man definiert eine kreisförmige Mantelfunktion H, durch welche der fullfield-Stimulus auf einen Ausschnitt um ein Zentrum (x0, y 0 ) begrenzt wird (Abb. 4.1 c), so daß im Gegensatz zum unbeschränkten Stimulus keine Phasensprünge mehr auftreten können. In den Simulationen wurde hierfür H (x,y)=( 1e 2 2 β ( (xx o ) ( y y o ) h ) 1 ) (4.1) gewählt. Über diese Mantelfunktion kann nun ohne auf periodische Randbedingungen zu achten, ein beliebiger Stimulus S (x,y,t) angelegt werden. Gesamtfläche des simulierten Cortex mit periodischen Randbedingungen Bereich, in dem Muster verschiedener Phase und verschiedener Richtungen präsentiert werden Bereich, in dem Spiketrains der Neuronen für die Auswertung protokolliert werden, das „Protokollfenster“ Abbildung 4.2 Auswertung mit Gitter im Schema Dargestellt sind die verschiedenen Zonen der Auswertung. Da in einem Netzwerk mit periodischen Randbedingungen kein full-field-Stimulus ohne Randeffekte präsentiert werden kann, muß der Stimulus an verschiedenen Orten des Netzwerkes präsentiert werden. Da die Aktivität immer nur in einem kleinen, zentralen Bereich nicht durch Randeffekte „verschmutzt“ ist, wird nur das Protokollfenster im Stimuluszentrum für die Auswertung benutzt. Um die Aktivitäten im Netzwerk zu interpretieren, muß man beachten, daß durch diesen Trick aber auch Randeffekte an den Kanten der Mantelflächen eingeführt werden. Dort erscheint dem System fälschlicherweise eine bestimmte Orientierung (Abb. 4.1 c). Um diesen neuen Randeffekt zu unterdrücken, gibt es zwei Möglichkeiten: Entweder man weicht den Rand stark auf, läßt ihn also sehr langsam ansteigen, so daß es keine Kante mehr gibt. Um dies zu erreichen, muß lediglich in Formel 4.1 der Parameter β sehr klein gewählt werden. Oder man wählt die Kanten sehr hart, verwendet aber nur einen kleinen Teil im Inneren des Mantels, das Protokollfenster, für die Auswertung, wie in Abbildung 4.2 dargestellt. 43 4 Datenanalyse Bei einem bewegten Stimulus treten desweiteren Netzwerkeffekte auf. In Bewegungsrichtung des Stimulus kann sich die Aktivität ausgehend vom Rand des Mantels im Netzwerk langsam aufschaukeln bis ein Gleichgewicht erreicht ist. Dies ist ein Effekt, der nicht leicht „auszublenden“ ist. Bei der Methode mit einer harten Schwelle und Protokollfenster treten diese Randeffekte nur in sehr viel geringerem Maße auf. Deshalb wurde in den Auswertungen diese Methode gewählt. In einem kompletten Auswertungslauf wird ein gemanteltes Gitter nacheinander an neun verschiedenen Positionen (x0, y 0 ) des Netzwerkes präsentiert. Die Positionen sind so gewählt, daß jedes Neuron mindestens einmal innerhalb des Protokollfensters liegt. Dies gewährleistet eine gleichmäßige Abdeckung des Netzwerkes durch die Stimuli. Während der Präsentation an einer bestimmten Stelle wird das Gitter zusätzlich um den Winkel φn = 2π n n=0... N 1 , N (4.2) gedreht, so daß an jedem Ort jede Stimulusrichtung einmal gezeigt wird. Das bewegte Gitter in Richtung φ n läßt folgendermaßen formulieren: S (x,y,t)=cos { [( 2π λ cos φn sin φn )( ) ]} x v t y (4.3) mit der Wellenlänge λ und der Geschwindigkeit v als Parameter des bewegten Gitters. Der mit der Mantelfunktion veränderte Stimulus S H (x,y,t)=S (x,y,t) H (x,y) (4.4) wird an das Netzwerk angelegt und die Aktivität im Protokollfenster { 2 2 P (x, y)= 1 für (xx0 ) ( y y 0 ) < p 0 sonst (4.5) mit einem Radius p, der in den Simulationen zu p=22 gewählt wurde, mitprotokolliert. Die Anzahl der Spikes von in diesem Fenster liegenden Neuronen, wird protokolliert. Sie entspricht für eine Zelle an der Position (x,y) in der Richtung φn der Aktivität A(x,y, φn ) . (4.6) Diejenigen Neuronen, die in mehreren Protokollfenstern zugleich liegen, werden nur einfach gezählt. Die weitere Auswertung verläuft analog zum Experiment (vgl. Shmuel 1996). Um die Aktivitäten zu normieren, wird der sogenannte “cocktail-blank“ . 44 4 Datenanalyse N 1 C (x,y)= ∑ A(x,y, φ n ) (4.7) n =0 eingeführt. Dieser gibt die Summe der Aktivität über alle Richtungen an. Um die sogenannten „single-condition-maps“ (SCMs) zu erhalten, wird die Aktivität A(x,y, φ n ) auf C (x,y) normiert: SCM (x,y, φn )= A(x,y,φn ) , C (x,y) n=0.. N 1 . (4.8) Aus diesen SCMs wird durch pixelweise vektorielle Addition der SCMs ein Richtungsvektor R ermittelt N 1 R (x,y)= ∑ e i φn n =0 SCM (x,y, φn ) , (4.9) Dieser Vektor gibt die bevorzugte Richtung der Zelle an der Stelle (x,y) an. Für die Berechnung der bevorzugten Orientierung werden sogenannte „orientation SCMs“ erzeugt. SCM O (x,y, φm )= A(x,y, φ m ) A(x,y,φ m N ⁄ 2 C (x,y) m=0.. N ⁄21 , (4.10) , wobei hier die Aktivitäten über gegensätzliche Richtungen φ n aber gleiche Orientierung summiert wurden. Der Index m läuft daher nur bis m=N ⁄21 . Die bevorzugte Orientierung ergibt sich durch vektorielle Addition der „orientation SCMs“ zu N 1 2 O (x,y)= ∑ e 2 i φm SCM O (x,y, φ m ) . (4.11) m=0 Es ist zu beachten, daß die bevorzugte Orientierung zwar zwischen 0° und 180° liegt, O (x,y) aber durch den Faktor 2 in der Exponentialfunktion auf 360° gestreckt wurde. Um ein Maß für die Stärke der Richtungs- bzw. Orientierungsselektivität zu erhalten, werden Selektivitätsindizes nach De Angelis (1993) für Richtung und Orientierung eingeführt. Die Definition für den Richtungsselektivitätsindex (DSI) lautet 45 4 Datenanalyse DSI =1 R np , Rp (4.12) mit R p der Antwortstärke einer Zelle in bevorzugter Richtung und R np in der Gegenrichtung. Der entsprechende Orientierungsselektivitätsindex (OSI) ist entsprechend OSI =1 O np , Op (4.13) Mit O p der Antwortstärke einer Zelle in bevorzugter Orientierung und O np für die orthogonale Orientierung. 4.2 Geometrische Auswertung der intracorticalen Rezeptiven Feld Struktur Alternativ zu der an das Experiment angelehnten Art der Auswertung kann man für die intracorticalen raumzeitlichen rezeptiven Felder auch eine „schnelle“, rein geometrische Analyse anwenden, die ohne detaillierte Berechnung der Netzwerkaktivitäten auskommt und allein aufgrund der räumlichen Anordnung der synaptischen Verbindungsstrukturen erfolgt. Dabei wird ein Balken mit wechselnden Richtungen φn über ein herausgegriffenes rezeptives Feld bewegt (Abb. 4.3). Bei N Berechnungsdurchläufen sind die verschiedenen Richtungen des bewegten Balkens φn = 2π n n=0... N 1 , N (4.14) wobei die Balkenorientierung natürlich orthogonal zur Bewegungsrichtung verläuft. Desweiteren wird eine Responsefunktion R (t) definiert. Sie gibt den zeitlichen Verlauf der Überschneidung des bewegten Balkens mit den synaptischen Strukturen innerhalb des rezeptiven Feldes, also eine „lineare“ Approximation der Zellantwort wieder. Für jeden Punkt des rezeptiven Feldes wird hierfür die Zeit bestimmt, die der Balken benötigt, einen bestimmten Punkt (x,y) zu erreichen. 46 4 Datenanalyse v φ y v d xy (xStart , y Start ) z xy ∆y ∆x φ ψ (x, y) r x Abbildung 4.3 Berechnung der Richtungsselektivität Für die „schnelle“, d.h. geometrische Auswertung wird ein Balken in verschiedenen Richtungen über das rezeptive Feld bewegt. Der Eintrittspunkt in das rezeptive Feld ist (xStart,yStart). Aus den jeweiligen berechneten Antworten der Zelle, es wird an dieser Stelle ein lineares Neuron angenommen, kann man die Orientierungs- bzw. Richtungsselektivität einer vorgegebenen synaptischen Verbindungsstruktur berechnen. 47 4 Datenanalyse Die Startposition des Balkens sei (vgl. Abb. 4.3) ( ) ( ) xStart =r 1cos(φ) 1sin (φ) y Start . (4.15) Damit ist der Abstand des Punktes (x, y) vom Eintrittspunkt des Balkens in das rezeptive Feld (xStart , y Start ) bestimmt durch z xy = (xStart x)2( y Start y)2 , (4.16) womit der Winkel ψ , der von z xy und d xy eingeschlossen wird, als ( ) π ∆x ψ= φarctan 2 ∆y (4.17) gegeben ist. Die Projektion d xy von z xy auf die Bewegungsrichtung ist d xy = z xy cos ( ψ) (4.18) und die Zeit, die der Balken nun benötigt, um den Punkt (x, y) zu erreichen beträgt folglich T xy = d xy . v (4.19) Da die Verbindungen der Zellen untereinander gemäß Formel (3.1) verschiedene Verzögerungen aufweisen, muß bei der Responsefunktion noch eine Verbindungsverzögerung ∆ T gemäß Formel (3.1) beachtet werden. Die Responsefunktion lautet somit ∑ R (t)= 2 [( J xy B v tT xy ∆ T ( (xr)2( yr)2 ) 2 x,y, (xr ) ( y r ) ≤r 2 )] . (4.20) B (x) beschreibt dabei den Balken zentriert um den Ursprung, nämlich { B (x)= 1 für |x|≤b 0 sonst (4.21) mit einer Balkenbreite von b=0,7 . Bei einem rezeptiven Feld mit einem Radius von 7 Pixeln und einer max. Verzögerung des Inputsignals von 20 ms am Rand des rezeptiven Feldes wird die maximale 48 4 Datenanalyse Zellantwort bei einer Geschwindigkeit von ca. v=7 Pix⁄20 ms auftreten. Das bedeutet, daß die Dauer der Antwort einer einzelnen Synapse bei etwa 2 ms liegt. Um analog zu Kapitel 4.1 SCMs zu erhalten, wird für die betrachtete Zelle das Maximum der Responsefunktionen in den jeweiligen Richtungen berechnet, d.h. A(φn )=max [ R (t,φn )] . (4.22) Die Ermittlung der Karten mit den entsprechenden Selektivitätsindizes erfolgt analog Kapitel 4.1. 4.3 Vergleich der verschiedenen Verfahren Um Übereinstimmungen oder Unterscheidungen der beiden beschriebenen Methoden zu zeigen, wird eine „Testkarte“ erzeugt, in der die typischen synaptischen Gewichtsverteilungen auf möglichst vielfältige Art repräsentiert sind. Sie wurde folgendermaßen erzeugt: Ein kreisförmiger Bereich F mit Radius b rotiert um das Zentrum des rezeptiven Feldes (Abb. 4.4 a). An den Stellen, an denen dieser Bereich mit dem rezeptiven Feld überlappt, wird das Gewicht auf einen festen Wert gesetzt. Die anderen Stellen des rezeptiven Feldes werden auf Null gesetzt. Die Größe der Drehung ψ des Bereiches F wird mit der x-Koordinate in der Karte (Abb. 4.4 b) variiert. Über die ganze Breite des Netzwerkes sollen sich vier Perioden erstrecken, d.h. ψ=sin ( ) 8π x Nx , wo N x die Ausdehnung des Netzes in x-Richtung darstellt. Nach jeder Periode von ψ wird der Radius b des Kreisbereichs F schrittweise zwischen 2 und 8 erhöht. Gleichzeitig wird in Abhängigkeit von y der Abstand a vom Mittelpunkt von F zum Mittelpunkt des rezeptiven Feldes variiert, also | ( )| a= cos πy Ny , wo N y die Ausdehnung des Netzes in y-Richtung darstellt. 49 4 Datenanalyse F a b ψ b a b) y ψ x Abbildung 4.4 Testbild Künstlich erzeugte Teststruktur zum Testen und Vergleichen der verschiedenen Auswertungsverfahren. In a) wird dargestellt, wie ein kleiner Bereich F (rot) um das Zentrum des rezeptiven Feldes kreist. Der Überschneidungsbereich mit dem rezeptiven Feld (grau) wird auf ein festes Gewicht eingestellt, während der Rest auf Null gestellt wird. In b) ist die Berechnung der Bewegung des Bereiches F für das gesamte Netzwerk dargestellt. Der Abstand a von F (rot) zum rezeptiven Feld (grau) wird schrittweise erhöht. Der Radius b wird periodisch über die Höhe des Cortex variiert, der Bereich F(rot) dreht sich zyklisch mit ψ um das Zentrum des rezeptiven Feldes. 50 4 Datenanalyse Mittels der so erzeugten Karte kann man die verschiedenen Auswertungsverfahren nun sehr gut überprüfen und vergleichen. In Abbildung 4.5 sind die durch die verschiedenen Methoden ermittelten Karten dieser Teststruktur gezeigt. Die berechneten Karten der geometrischen Auswertung für Richtung und Orientierung (Abb. 4.5 a und b) stimmen mit den erkennbaren Richtungs- und Orientierungspräferenzen der Teststruktur überein. Die mittels eines bewegten Gitters erzeugten Karten (Abb. 4.5 c und d) stimmen sehr gut mit den geometrisch berechneten überein. Dies erkennt man besonders gut in der zweiten Spalte. Dort sind die mit dem DSI, bzw. OSI gewichteten Karten dargestellt. Lediglich an Stellen mit einer Selektivität nahe Null findet man Differenzen. Diese sind auf Netzwerkeffekte bei der Auswertung mit einem Gitter zurückzuführen. Aufgrund von Diskretisierungseffekten in diesem Modell sind für die Auswertungen der Orientierung nur sehr wenige synaptische Verbindungen vorhanden. Daher sind die Orientierungskarten in beiden Verfahren weit weniger gut aufgelöst. Auch wurden bei den Auswertungen verschiedene Balkenbreiten und Geschwindigkeiten variiert. Die sich ergebenden Karten sind qualitativ sehr ähnlich. Durch diesen Vergleich werden unter anderem auch andere Arbeiten bestätigt (Miller 1994, Wimbauer 1996, Wimbauer 1997, Bartsch 2000), die zur Vorhersage der Selektivitäten lediglich die synaptische Struktur der rezeptiven Felder benutzen. 51 4 Datenanalyse a) b) c) d) Abbildung 4.5 Vergleich der Karten In a) und b) sind die berechneten Karten der geometrischen Auswertung dargestellt, in c) und d) die Karten durch die Auswertung mit einem bewegten Gitter. In der linken Spalte sind die errechneten bevorzugten Selektivitäten eingetragen. In der zweiten Spalte sieht man Karten mit einer Gewichtung durch den entsprechenden Selektivitätsindex (farbsättigung). In der Spalte rechts ist die jeweilige Legende, ein Histogramm über die Richtungen, bzw. Orientierungen und ein Histogramm über die Selektivitätsindizes. Deutlich ist in der zweiten Spalte zu sehen, daß die mit den Selektivitäten gewichteten Karten sehr gut übereinstimmen. Lediglich an Stellen mit einer Selektivität nahe Null findet man Differenzen. Diese sind auf Netzwerkeffekte bei der Auswertung mit einem Gitter zurückzuführen. 52 5 Netzwerkdynamik 5 Netzwerkdynamik Kapitel 5 Netzwerkdynamik In diesem Kapitel wird die Netzwerkdynamik untersucht und anhand von Aktivitätsbildern des Netzwerks veranschaulicht. Es wird beschrieben, wie diese Bilder erstellt werden und welche Aussagekraft sie haben. Ferner werden verschiedene Szenarien vorgestellt, in denen sich die Aktivität bewegen kann. Speziell der Zustand kleiner lokaler Aktivitätswellen (Aktivitätsblasen) wird genauer besprochen, da er im Zusammenhang mit der Strukturbildung für richtungsselektive Zellantworten eine wesentliche Rolle spielt. 5.1 Veranschaulichung der Netzwerkdynamik Um sowohl die räumliche als auch zeitliche Dynamik des Netzwerkes zu veranschaulichen, reicht es nicht aus, lediglich die Spikes in einem bestimmten Zeitintervall darzustellen. Vielmehr ist man bei einer Visualisierung daran interessiert, den aktuellen Zustand der Neuronen des Netzwerkes für einen bestimmten Zeitpunkt und möglichst auch die Vorgeschichte, die zu diesem Zustand geführt hat, zu erkennen. Der aktuelle Zustand des Netzwerkes wird durch das instantane Membranpotential der Zellen an den verschiedenen Orten festgelegt, denn daraus berechnen sich die Wahrscheinlichkeiten für weitere Feuerereignisse. In den Abbildungen des Membranpotentials (vgl. Abb. 5.1 , 5.3 und 5.3) wird ein negatives Potential, in diesem Modell also Einflüsse von Inhibition und Refraktärpotential in Blau dargestellt. Ein positives Membranpotential, also Exzitation, hingegen wird in Rot codiert. Je nach Stärke des Potentials wird die Farbsättigung 53 5 Netzwerkdynamik variiert, d.h. je stärker das Potential, desto intensiver wird die Farbe. Da die Inhibition in den Simulationen stärker als die Exzitation gewählt wurde, werden beide Anteile getrennt voneinander so skaliert, daß in den Farbbereichen der Bildern die volle Dynamik erfaßt wird. Man kann dann zwar nicht direkt erkennen, aus welchen Anteilen sich das gesamte Membranpotential zusammensetzt (EPSP, IPSP und Refraktärpotential), dieses Wissen wird jedoch durch Betrachtung einer Folge von Bildern mit den dazugehörigen Spikes vermittelt. Bei der Darstellung der Spikes ist für einen betrachteten Zeitpunkt die zeitliche Abfolge in der näheren Vergangenheit interessant. Um diese darzustellen, wird der Spiketrain von Neuron i, d.h. S i (t)= ∑ δ(tt if ) (5.1) f t≤t i an jedem Punkt mit dem Kern {() µ(t)= 0 t exp τµ für t<0 für t≥ 0 (5.2) und τ µ=5 ms gefaltet zu einer zeitlich gewichteten Funktion M i (t =S i (t)∗µ(t) = ∑ µ(tt if ) . t if (5.3) In den Aktivitätsbildern wird der momentane Wert dieser gewichteten Funktion in einem Farbcode dargestellt. Rot bedeutet dabei, daß die Zelle gerade gefeuert hat, wohingegen der Übergang zu Blau andeutet, daß der letzte Feuerzeitpunkt schon etwas zurückliegt. 5.2 Initialisierung des Netzwerkes Ein Problem, das bei Simulationen nicht außer Acht gelassen werden darf, ist die Frage nach den Startwerten. Wie sind die Gewichte unter den Neuronen zu verteilen und mit welchem Membranpotential sollen die Neuronen am Start initialisiert werden? Bei den Gewichten ist dieses Problem sehr einfach damit zu lösen, daß man entweder eine homogene oder eine zufällige Gewichtsverteilung annimmt. Bei der Initialisierung des Membranpotentials ist die Sache komplizierter, denn es setzt sich aus mehreren Komponenten zusammen, die verschiedene Abfallszeiten haben. Welche Initialisierung man auch immer wählt, es wäre eine starke Beeinflussung der Dynamik. Vor allem in Hinblick auf das Lernen der Gewichte könnte sich eine falsche Wahl als dominierender Faktor im Strukturbildungsprozeß erweisen. In den Simulationen wurde das Membranpotential mit Null gestartet. Am 54 5 Netzwerkdynamik Anfang„explodiert“ dann zwar die Aktivität, pendelt sich aber nach einem „Einschwingvogang“ von typischerweise 1000 Zeitschritten auf einen Gleichgewichtszustand ein. Erst nach dieser Zeit wird die Lerngleichung eingeschaltet. 5.3 Analyse der Netzwerkdynamik Durch intensive Simulation der neuronalen Dynamik in verschiedensten Parameterbereichen hat sich gezeigt, daß die Netzwerkdynamik in einem großen Bereich sehr stabile und lokal begrenzte Aktivitätswellen (Aktivitätsblasen) zeigt. Wie solch eine Blase zustande kommt, wird im folgenden erklärt. Dazu wurde bei allen Läufen in diesem Kapitel nur die Aktivität betrachtet und das Lernen „ausgeschaltet“. Die variierten Parameter der Läufe sind in Tabelle 1 eingetragen. Abb. J ex->ex 0 J ex->inh 0 J inh->ex 0 5.1, 5.3 0,3 0,5 1,0 5.2 0,45 0,05 1,0 Tabelle 1 Variierte Parameter für die Aktivitätsläufe In dieser Tabelle sind die variierten Parameter für die Aktivitätsläufe in diesem Kapitel eingetragen. Alle anderen Parameter wurden analog Kapitel 3 gewählt, jedoch wurde im Vergleich zu dort das Lernen ausgeschaltet. In Abbildung 5.1 sind Aktivitätsbilder des Netzwerkes dargestellt, die im 3 ms Takt aufgenommen wurden. Zunächst soll nur auf die Blasenentstehung näher eingegangen werden. Die entscheidenden Stellen hierfür sind in den Bildern markiert. Am Anfang einer typischen Blasenbildung befinden sich die exzitatorischen Neuronen des Netzwerkes in einem durch die Inhibition geregelten Zustand. In Abbildung 5.1 a ist das Membranpotential dieser Neuronen gezeigt. Deutlich erkennt man am abklingenden Blau, daß es Stellen abnehmender Inhibition gibt. Dies bedeutet, daß dort die Feuerwahrscheinlichkeit steigt. In Abbildung 5.1 b sind die Spikes der exzitatorischen Neuronen dargestellt. Man erkennt, daß die Neuronen bevorzugt an den Stellen abnehmender Inhibition feuern, sie werden im folgenden daher als „Keimneuronen“ bezeichnet. Aufgrund der durch diese Neuronen erzeugten EPSPs werden weitere Neuronen in der Nachbarschaft zum feuern angeregt, die ihrerseits weitere Neuronen stimulieren. Durch geeignete Wahl des Refraktärpotentials wird aber vermieden, daß Neuronen, die gerade gefeuert haben, sofort ein weiteres Mal angeregt werden können. Gleichzeitig werden auch die inhibitorischen Neuronen angeregt. Diese sind in Abbildung 5.1 c und d dargestellt. Das Membranpotential steigt bei diesen Neuronen durch das Feuern exzitatorischer Neuronen an, feuern aber durch eine steilere Aktivierungsfunktion erst etwas später. 55 5 Netzwerkdynamik Bereich nachlassender Inhibition, Spontanrauschen wird ermöglicht Die ersten Keimneuronen fangen an zu feuern Keimneuronen fangen an, die Nachbarschaft zu erregen, Erregungsausbreitung beginnt. Durch das Refraktärpotential wird verhindert, daß ein Neuron gleich nach dem Feuern ein weiters Mal feuern kann a) Membranpotential - exzitatorische Neuronen b) Spikes - exzitatorische Neuronen c) Spikes - inhibitorische Neuronen d) Membranpotential- inhibitorische Neuronen T0 + 3 ms + 6 ms + 9 ms + 12 ms +15 ms +18 ms Inhibitorische Neuronen sind so stark angeregt, daß erste Neuronen zu feuern beginnen. Erregung der Inhibition steigt langsam an Farbskala für das Membranpotential -5 0 2 Farbskala für den Spiketrain Abbildung 5.1 Blasenbildung (3 ms Takt) [ms ] In den Bildern sind jeweils zwei typische Situationen der Aktivitätsdynamik dargestellt. Eine Blase, die sich gerade ausdehnt, und eine weitere, die gerade beginnt, sich zu entwickeln. Aus einem Bereich nachlassender Inhibition entsteht ein Keim, der sich ausbreitet. Die wichtigsten Szenarien dieser Entwicklungsphase werden anhand der Anmerkungen in der Abbildung erläutert. Die Ausdehnungsphase ist in Abbildung 5.3 noch besser zu erkennen. 56 +21 ms 5 Netzwerkdynamik Bei gleichmäßiger Gewichtsverteilung innerhalb des rezeptiven Feldes entsteht aus einem Keim eine konzentrisch vom ihm ausgehende Wellenfront in der Aktivierung der exzitatorischen Neuronenschicht. Diese Aktivierung wird sich ohne regelnden Eingriff der Inhibition immer weiter ausbreiten. Um dies zu demonstrieren, wurde in Abbildung 5.2 die Kopplung der exzitatorischen auf die inhibitorischen Neuronen sehr klein gewählt. Dies führt in der exzitatorischen Schicht (Abb. 5.2a und b) zu einer sehr massiven, nahezu unbeschränkten Kopplung über das ganze Netzwerk. Selbst durch eine Vergrößerung des Netzes könnte diese nicht unterbunden werden, da die Aktivität durch nichts gestoppt wird. Aufgrund der periodischen Randbedingungen kommt es allerdings zu einer unrealistischen Selbstbeeinflussung der Blasenaktivität. In der Realität kann aber nur eine begrenzte Aktivitätsausbreitung sinnvoll sein, da sonst eine lokalisierte Anregung immer eine Komplettaktivierung des gesamten Cortex bewirken würde. a) Membranpotential - exzitatorische Neuronen b) Spikes - exzitatorische Neuronen c) Spikes - inhibitorische Neuronen d) Membranpotential- inhibitorische Neuronen T0 + 20 ms + 40 ms + 60 ms + 80 ms +100 ms +120 ms +140 ms Abbildung 5.2 Welle koppelt mit sich selbst (20 ms Takt) Ein Beispiel zu hoher Aktivität ist in dieser Folge gezeigt. Entstehende Blasen können durch die zu schwach „eingestellte“ Kopplung zu den inhibitorischen Neuronen nicht mehr gestoppt werden. Durch die periodischen Randbedingungen des Netzwerkes koppelt die Welle allerdings mit sich selbst. Dieses Szenario ist daher nicht nur unnatürlich, sondern es ist durch diese massive Kopplung nahezu unmöglich, voneinander unabhängige Blasen zu erhalten. 57 5 Netzwerkdynamik Damit sich diese Aktivitätsfront nicht ungebremst über das gesamte Netzwerk ausbreitet, muß durch geeignete Wahl der Kopplungsstärken zwischen den verschiedenen Schichten die Ausbreitung der Aktivitätsfront gestoppt werden. Da die feuernden exzitatorischen Neuronen gleichzeitig auch auf inhibitorische Neuronen projizieren, steigt dadurch auch bei diesen die Feuerwahrscheinlichkeit an. In Abbildung 5.3 wurde das Gewicht der Kopplung von exzitatorischen auf inhibitorische Neuronen stärker gewählt. Durch die Aktivität in der exzitatorischen Schicht bildet sich nun auch hier eine Welle. Sie startet zwar zeitlich verzögert, kann jedoch bei geeigneter Parameterwahl durch die breitere Arborisierung die exzitatorische Welle „einholen“ und bei ausreichend stark hemmender Rückprojektion diese auch vernichten. Das hemmende Gewicht wurde dabei so stark gewählt, daß die Inhibition selbst bei maximaler exzitatorischer Erregung effektiv wirken kann. Durch Variation der Stärke der Kopplung von den exzitatorischen zu den inhibitorischen Neuronen kann der „Startzeitpunkt“ der inhibitorischen Welle eingestellt werden. Dadurch wird die Größe der maximalen Ausbreitung in der exzitatorischen Schicht beeinflußt (siehe Abb. 5.3). Eine derartige lokal begrenzte Aktivitätswelle wird im Folgenden immer als „Aktivitätsblase“ oder einfach „Blase“ bezeichnet. Die Neuronen, die solch eine Blase auslösen, werden „Keimneuronen“ genannt. Diejenigen Neuronen, die durch die Erregung der Keimneuronen feuern, also im „Umfeld“ des Keims liegen, werden als „Umfeldneuronen“ bezeichnet. a) Membranpotential - exzitatorische Neuronen b) Spikes - exzitatorische Neuronen c) Spikes - inhibitorische Neuronen d) Membranpotential- inhibitorische Neuronen T0 + 10 ms + 20 ms + 30 ms + 40 ms +50 ms +60 ms Abbildung 5.3 Blasenbildung (10 ms Takt) Dieselbe Aktivität wie in Abbildung 5.1 aber im 10 ms Takt aufgenommen. Man erkennt die Blasenbildung. Die Zeitdauer der Blasenbildung von der Entstehung bis zur Vernichtung ist abhängig vom Zeitpunkt des Einsetzens der Inhibition, die die Größe der Blase regelt. Eine übliche Größenordnung liegt bei etwa bei 50 - 100 ms. 58 +70 ms 6 Analyse der Strukturbildungsprozesse 6 Analyse der Strukturbildungsprozesse Kapitel 6 Analyse der Strukturbildungsprozesse In diesem Kapitel wird untersucht, wie sich die Gewichtsverteilungen der raumzeitlichen rezeptiven Felder der exzitatorischen Neuronenschicht in Abhängigkeit von der Netzwerkdynamik und von verschiedenen Parametern der Lerngleichung verändern. Auf die Verbindungen der exzitatorischen Neuronen untereinander wird der LTP-Anteil der gefensterten Lernregel angewendet. Die Verbindungen zu den inhibitorischen Neuronen werden nur insoweit „gelernt“, als es zur Aufrechterhaltung eines durch die Startparameter der Simulation eingestellten, Gleichgewichts-Netzwerkzustandes erforderlich ist. 6.1 Lernen durch einen Stimulus Die gefensterte Lernregel (vgl. Kapitel 3.3) besteht, wie bereits erwähnt, aus zwei unterschiedlich wirkenden Teilen. Durch den LTP-Anteil werden diejenigen Synapsen verstärkt, die zum Feuern der Zelle beitragen haben, also kurz vor dem postsynaptischen Spike aktiviert wurden. Der LTD-Anteil verringert hingegen das Gewicht derjenigen Synapsen, die nach dem postsynaptischen Spike aktiviert wurden. Um die Wirkung der einzelnen Komponenten der Lerngleichung, LTP und LTD, auf ein einzelnes rezeptives Feld zu untersuchen, ist es hilfreich zu wissen, wie sich die Gewichte auf einen bewegten Balken oder ein bewegtes Gitter als Stimulus anpassen. 59 6 Analyse der Strukturbildungsprozesse In den folgenden Untersuchungen wird daher ein bewegter Balken an das Netzwerk angelegt, indem an den Stellen, wo sich der Balken zu einem bestimmten Zeitpunkt befindet, das externe Membranpotential hext auf einen vorgegebenen Wert gesetzt wird. An den Stellen neben dem Balken wird h ext auf Null gesetzt. Die Geschwindigkeit des Balkens ist dabei so gewählt, daß sie genau der Verzögerung im rezeptiven Feld entspricht, also 20 ms für die Durchquerung des halben rezeptiven Feldes. Wie in Abschnitt 4.1 besprochen, ist es nicht unproblematisch, einen full-field-Stimulus anzulegen. Deshalb wird dieser Stimulus nur auf einem durch die Mantelfunktion H beschränkten Bereich angelegt, und es werden nur diejenigen Neuronen betrachtet, die in der Mitte dieses Bereichs liegen. 6.1.1 Wirkung der LTP auf ein rezeptives Feld Für die Untersuchung der Wirkung von LTP werden Läufe mit verschiedenen Varianten des Lernfensters durchgeführt: Zwei Läufe mit einer exponentiell abfallenden LTP mit Zeitkonstante τ=11 ms und zwei Läufe mit einer LTP in Form einer α-Funktion { α(t)= ( ) für t≥0 0 für t<0 t exp t τα (6.1) ∆J (tprä-tpost) mit Zeitkonstante τ=5 ms. Diese Funktionen sind in Abbildung 6.1 dargestellt. tprä-tpost [ms] Abbildung 6.1 Untersuchte Variationen der LTP Für die Untersuchung der Auswirkung der Form der LTP wurden zwei Funktionen mit je verschiedenen Zeitkonstanten gewählt. Eine Exponentialfunktion (durchgezogene Kurve) mit Zeitkonstante τ=11 ms und eine α-Funktion (gestrichelt) mit Zeitkonstante τ=5 ms 60 6 Analyse der Strukturbildungsprozesse Um das Gesamtgewicht während des Lernvorgangs konstant zu halten, wird mit einer expliziten Normierung gearbeitet. Das Gesamtgewicht selbst wird bei den folgenden Läufen aber ebenfalls variiert, um ein besseres Verständnis für die Größenordnungen der Gewichte zu erhalten. Die Läufe werden mit einer homogenen Gewichtsverteilung J 0 gestartet. Die variierten Parameter sind in Tabelle 2 verzeichnet. Lauf Explizite Normierung J0 W LTP τ LTP W LTD τ LTD Abb. 6.2 a Ja 0,35 Exp 11 ms - - Abb. 6.2 b Ja 0,5 Exp 11 ms - - Abb. 6.2 c Ja 0,35 α 5 ms - - Abb. 6.2 d Ja 0,5 α 5 ms - - Abb. 6.4 a Ja 0,35 - - Exp 11 ms Abb. 6.4 b Ja 0,35 - - α 5 ms Abb. 6.4 c Ja 0,35 - - α 20 ms Abb. 6.5 a Nein 0,35 Exp 11 ms Exp 11 ms Abb. 6.5 b Nein 0,35 Exp 11 ms α 5 ms Abb. 6.5 c Nein 0,35 Exp 11 ms α 20 ms Tabelle 2 Parameter für die Läufe mit Stimulus Das Gewicht kann sich zwischen J min =0 und J max =0,8 bewegen. Die Änderungen der Gewichte werden im 5 s Takt protokolliert. Das letzte Bild wird nach 100 s simulierter Echtzeit aufgenommen. Die Balken werden von links nach rechts über die rezeptiven Felder „gefahren“. Nach der Stimulierung mit einer Folge bewegter Balken ändern sich die Gewichte derart, daß sie alle entweder das Minimum oder das Maximum erreichen. In Abbildung 6.2 a und b sind Läufe dargestellt, die mit einer exponentieller LTP mit Zeitkonstante τ=11 ms durchgeführt wurden, in Abbildung 6.2 b und c sind Läufe mit einer α-förmigen LTP mit Zeitkonstante τ=5 ms dargestellt. Man erkennt, daß sich bei allen Läufen die Maximalen Gewichte auf der linken Seite sammeln. Durch den von links eintreffenden Balkenstimulus sind die Neuronen und entsprechenden Synapsen auf der linken Seite des rezeptiven Feldes aktiv, bevor das postsynaptische Neuron feuert. Erreicht der Stimulus die Mitte des rezeptiven Feldes, ist die Wahrscheinlichkeit, daß die postsynaptische Zelle feuert, am höchsten. Wandert der Balken weiter und aktiviert Neuronen auf der rechten Seite, können die Gewichte durch LTP nicht mehr verstärkt werden, weil die interessierende postsynaptische Zelle bereits gefeuert hat. Die explizite Normierung bewirkt somit eine Abnahme der Gewichte auf dieser Seite, da hier im Gegensatz zur linken rezeptiven Feld Hälfte, keine Gewichtszunahme durch LTP erfolgt ist. 61 6 Analyse der Strukturbildungsprozesse a) b) c) d) 0s 5s 10 s 15 s 100 s Abbildung 6.2 Untersuchung von LTP mit expliziter Normierung Änderung der Gewichte im rezeptiven Feld bei Stimulierung durch eine Folge einzelner, bewegter Balken. Diese werden von links nach rechts über die rezeptiven Felder „gefahren“. In a) und b) sind Läufe mit exponentieller LTP mit einer Zeitkonstante von τ=11 ms, in c) und d) Läufe mit einer αförmigen LTP mit einer Zeitkonstante von τ=5 ms dargestellt. Die Läufe wurden mit einer homogenen Gewichtsverteilung gestartet. Die Änderungen der Gewichte werden im 5 s Takt protokolliert, das letzte Bild wird nach 100 s simulierter Echtzeit aufgenommen. Man erkennt in allen Läufen gleichermaßen, daß die Gewichte auf der linken Seite verstärkt werden. Diese Synapsen sind aktiv, bevor das postsynaptische Neuron feuert. Auf der rechten Seite werden die Gewichte durch LTP nicht verstärkt, die explizite Normierung bewirkt aber eine Abnahme der Gewichte auf dieser Seite. 6.1.2 Wirkung der LTD auf ein rezeptives Feld Analog zur Überprüfung der Wirkung von LTP auf die Gewichte des rezeptiven Feldes mittels eines Balkens werden auch für LTD einige Untersuchungen vorgenommen. Hierzu werden Läufe mit verschiedene Varianten des Lernfensters durchgeführt, wie in Abb. 6.3 dargestellt: Eine exponentiell abfallende LTD mit Zeitkonstante τ=11 ms, zwei α-Funktionen mit den Zeitkonstanten τ=5 ms und τ=20 ms. 62 ∆J (tprä-tpost) 6 Analyse der Strukturbildungsprozesse tprä-tpost [ms] Abbildung 6.3 Variationen der LTD Für die Untersuchung der Auswirkung der Form der LTD wurden verschiedenen Zeitkonstanten gewählt. Eine exponentielle LTD mit Zeitkonstante τ=11 ms (groß gestrichelt), eine α-Funktion mit Zeitkonstante τ=5 ms (klein gestrichelt) und eine α-Funktion mit Zeitkonstante τ=20 ms (durchgezogen). Die LTP wird in den Läufen, in denen sie eingeschaltet war, immer mit einer exponentiell abfallenden Funktion mit einer Zeitkonstante von τ=11 ms angenommen. Der LTD-Anteil schwächt diejenigen Synapsen ab, die erst nach dem postsynaptischen Spike aktiviert werden. Die größten Verzögerungen im rezeptiven Feld betragen 20 ms. Bewegt man einen Balken über das rezeptive Feld, so erreichen die letzten Signale des Balkens die Zelle im Zentrum erst 20 ms nachdem er das rezeptive Feld verlassen hat. Im ersten Fall einer exponentiell abfallenden LTD mit Zeitkonstante τ=11 ms bei fester Normierung und Stimulierung durch einen von links nach rechts bewegten Balken zeigt sich (Abb. 6.4 a), daß in erster Linie diejenigen Gewichte verringert werden, die sich auf der linken Seite des rezeptiven Feldes befinden. Im Gegensatz zur Wirkung von LTP, durch die die Gewichte auf der linken Seite verstärkt werden, bewirkt solch eine exponentiell Wahl der LTD also genau das Gegenteil. Dieser Effekt ist auf die Verzögerungen im rezeptiven Feld zurückzuführen, da die Synapsen auf der rechten Seite erst bis zu 40 ms nach dem Feuern der postsynaptischen Zelle aktiviert werden. Dadurch kann die exponentielle LTP kaum noch eine Wirkung erzielen, weil die Synapsen auf der linken Seite alle gleichermaßen durch den LTD-Anteil verringert werden. Der gleiche Effekt tritt ein bei der Wahl einer α-Funktion mit Zeitkonstante τ=5 ms (Abb. 6.4 b). Auf der linken Seite im rezeptiven Feld findet man aber einen kleinen Bereich, der durch die LTD nun weniger stark erfaßt wird. Dies kommt dadurch zustande, daß das Maximum der LTD bei einer α-Funktion nicht bei t post t pre =0 liegt, sondern bei t post t pre =τ . Somit kann der LTD-Anteil weniger auf diejenigen Synapsen wirken, die die Zelle auch anregen könnten, nämlich die auf der linken Seite. Beim LTD-Lernen mit einer der Realität am ehesten entsprechenden α-Funktion mit Zeitkonstante τ=20 ms (vgl. Abb. 6.4 c) erkennt man bei den gelernten Gewichten keinen Unterschied mehr zu denen, die mit LTP gelernt werden (vgl. Abb. 6.2). Auf der linken Seite werden die Gewichte nicht mehr verringert, was sich durch die explizite 63 6 Analyse der Strukturbildungsprozesse Normierung als eine Verstärkung äußert. Auf der rechten Seite hingegen werden alle Gewichte verringert, auch die weit rechts außen liegenden Synapsen werden durch diese größere Zeitkonstante sehr gut erfaßt und abgesenkt. a) b) c) 0s 5s 10 s 15 s 100 s Abbildung 6.4 Untersuchung von LTD mit expliziter Normierung Bei diesen Untersuchungen wurde ein Balken von links nach rechts über das rezeptive Feld bewegt und die Auswirkungen von LTD auf die Gewichtsverteilung der rezeptiven Felder untersucht. In a) wird eine exponentiell abfallende LTD mit Zeitkonstante τ=11 ms gewählt. Man sieht, daß rechts außen in den rezeptiven Feldern keine Verringerung der Gewichte stattfindet, dieser Teil wird durch die explizite Normierung langsam hochgeregelt. Dies kommt durch die Verzögerungen im rezeptiven Feld zustande, denn die rechts außen liegenden Synapsen werden erst bis zu 40 ms nach dem postsynaptischen Spike aktiviert. In b) wird für die LTD eine α-Funktion mit Zeitkonstante τ=5 ms gewählt. Man erkennt, daß die Gewichte auf der linken Seite aufgrund der Verschiebung des Maximums der LTD weniger abgeschwächt werden. In c) wird eine α-Funktion mit Zeitkonstante τ=20 ms gewählt. Hier sieht man, daß die Gewichte auf der linken Seite nicht mehr abgeschwächt werden, auf der rechten Seite hingegen jetzt eine vollständige Absenkung erfolgt, also auch der Synapsen, die zuvor nur vernachlässigbar abgeschwächt wurden. 6.1.3 Zusammenspiel von LTP mit LTD Im Zusammenspiel von LTP mit einer geeignet gewählten LTD ist das Besondere, daß man die explizite Normierung fallen lassen kann, denn das Lernfenster mit beiden Anteilen wirkt, quasi als Nebeneffekt, normierend und stabilisiert die Gewichtsstruktur (vgl. Bartsch 2000 und Kempter 2001). Als LTP wurde im Folgenden immer eine Exponentialfunktion mit Zeitkonstante τ=11 ms gewählt und nur noch die LTD variiert. In Abbildung 6.5 a wurde beispielsweise für die LTD eine Exponentialfunktion mit Zeitkonstante τ=11 ms 64 6 Analyse der Strukturbildungsprozesse angesetzt. Man sieht, daß die Wirkung der LTP durch die LTD auf der linken Seite der rezeptiven Felder stark unterdrückt wird, während rechts keine Verringerung der Gewichte erfolgt. In Abbildung 6.5 b wurde eine α-Funktion mit Zeitkonstante τ=5 ms gewählt. Man erkennt auf der linken Seite des rezeptiven Feldes, daß die LTP nicht mehr so stark unterdrückt wird, jedoch werden auf der rechten Seite die Gewichte noch nicht ausreichend verringert, um sie vollständig auf Null abzusenken. Für Abbildung 6.5 c wurde daher eine α-Funktion mit Zeitkonstante τ=20 ms gewählt Hier ist die Lerngleichung optimal eingestellt: Auf der linken Seite werden die Gewichte durch LTP verstärkt, der LTD Anteil kann aufgrund der vergrößerten Zeitkonstante noch nicht wirken, auf der rechten Seite werden die Gewichte durch LTD nun aber derart abgeschwächt, daß auch die weit rechts außen liegenden Synapsen stark genug verringert werden. a) b) c) 0s 3s 6s 9s 20 s Abbildung 6.5 Untersuchung von gleichzeitiger LTP und LTD ohne explizite Normierung Es sind drei Läufe dargestellt, wobei in allen Läufen die explizite Normierung ausgeschaltet wurde. Das Endgewicht entspricht ungefähr dem Anfangsgewicht, da das LTP-LTD-Lernfensters zu einer automatischen Normierung fähig ist. Es wurde nun die Form der LTD variiert, LTP wurde immer exponentiell abfallend mit einer Zeitkonstante von τ=11 ms gewählt. In a) wurde für die LTD eine Exponentialfunktion mit Zeitkonstante τ=11 ms gesetzt. Es zeigt sich, daß die Wirkung der LTP durch die LTD auf der linken Seite der rezeptiven Felder stark unterdrückt wird, während rechts keine Verringerung der Gewichte stattfindet. In b) und c) wurden für die LTD α-Funktionen gewählt: In b) mit Zeitkonstante τ=5 ms und in c) mit Zeitkonstante τ=20 ms. In b) ist auf der linken Seite des rezeptiven Feldes die LTP nicht mehr so stark unterdrückt wie in a), jedoch werden auf der rechten Seite die Gewichte noch nicht ausreichend verringert. In c) ist die Lerngleichung optimal eingestellt: Auf der linken Seite werden die Gewichte nur durch LTP verstärkt, auf der rechten Seite nur durch LTD abgeschwächt. Diese Abschwächung betrifft auch die weit rechts außen liegenden Synapsen. 65 6 Analyse der Strukturbildungsprozesse 6.2 Lernen durch die Netzwerkdynamik Die ersten Untersuchungen mit einem bewegten Balken ergaben, daß die Änderung im rezeptiven Feld durch den LTP-Anteil mit expliziter Normierung der Änderung von LTP und LTD ohne Normierung entspricht. In den weiteren Betrachtungen wird daher nur der LTP-Anteil mit expliziter Normierung zum Lernen genutzt. Dadurch konnte die Rechenzeit und der Speicheraufwand reduziert werden. Auch wird für den Strukturbildungsprozeß kein Stimulus mehr angelegt, sondern lediglich die Eigendynamik des Neuronalen Netzes benutzt. Das Charakteristische dieser Dynamik sind, wie in Kapitel 5.3 gezeigt, kleine lokal begrenzte Aktivitätsblasen. 6.2.1 Strukturänderung durch eine Aktivitätsblase Im Folgenden wird für den Lernprozeß die Auswirkung einer einzelnen Blase auf die Gewichtsverteilungen betrachtet. Durch den LTP-Anteil der gefensterten Lernregel, verstärken sich für eine feuernde Zelle alle Synapsen des rezeptiven Feldes, die zu ihrer Aktivierung beigetragen haben. Da für die hier gezeigten Läufe das Lernfenster nur auf die Verbindungen der exzitatorischen Neuronen untereinander wirkt, beschränkt sich die Betrachtung des Lernprozesses und die Darstellung der rezeptiven Felder nur auf diese Verbindungen. Ausgehend von einem Aktivitätskeim, der durch die stochastische Aktivität des Netzwerkes entsteht, bildet sich bei homogener Gewichtsverteilung, also im noch ungelernten Zustand, eine konzentrische, lokal begrenzte Aktivitätsblase (vgl. Kapitel 5.3). Bei der Untersuchung der Lerneffekte können zwei verschiedene Bereiche der Blase unterschieden werden, das Zentrum der Blase mit den „Keimneuronen“ und das Umfeld mit den „Umfeldneuronen“. Die Keimneuronen werden bevorzugt durch Input von Synapsen angeregt, die nahe des Zentrums des rezeptiven Feldes liegen, da diese im Vergleich zu dezentralen Synapsen eine kleinere Verzögerung aufweisen. Die im rezeptiven Feld weiter außen, also „dezentral“, liegenden Verbindungen sind je mit bis zu 20 ms verzögert, tragen also zum Feuern der Keimzellen nur noch unwesentlich bei. Somit kann die LTP bei Keimneuronen also nur die zentral im rezeptiven Feld liegenden Synapsen deutlich verstärken. Durch einen Normierungsprozeß wird das gesamte rezeptive Feld nach jedem Lernschritt auf einen festen Wert korrigiert. Dadurch werden die dezentral liegenden Synapsen effektiv abgeschwächt. Es entsteht eine Gewichtsverteilung im rezeptiven Feld, wie sie in Abbildung 6.6 a dargestellt ist. 66 6 Analyse der Strukturbildungsprozesse Die Umfeldneuronen werden durch den Keim zum Feuern angeregt. Je nachdem, wie weit ein Neuron vom Keim entfernt ist, können die dezentralen Synapsen lernen. Die Laufzeit der Welle (Blase) vom Keim zu dem betrachteten Umfeldneuron entspricht dabei der Verzögerung der im rezeptiven Feld dezentral gelegenen Verbindungen. Je weiter das Umfeldneuron entfernt ist, desto weiter außen im rezeptiven Feld kann die LTP wirken. Dies ist in Abbildung 6.6 b dargestellt. Ab einer Entfernung in der Größenordnung des rezeptiven Feldes tragen in erster Linie nur noch die dezentralen Verbindungen zum Feuern der postsynaptischen Zelle bei und werden somit verstärkt. Die an dieser Stelle gelernten rezeptiven Felder entsprechen denen, die mit einem bewegten Balken-Stimulus gelernt worden sind. Sie sind schematisch in Abbildung 6.6 c angedeutet. Alle „Lernbereiche“ einer Aktivitätsblase zusammengenommen erzeugen eine punktförmige Richtungssingularität und daher gleichzeitig ein 360° Orientierungspinwheel. Dies ist in Abbildung 6.6 d in zwei Dimensionen dargestellt. Zur besseren Übersicht wurden hier die verschiedenen Stationen der Blasenausbreitung eingetragen. In der Natur wurden jedoch solche Singularitäten nicht gefunden (vgl. Kapitel 2.2). Das Lernen dauert solange an, wie sich eine Blase ausbreitet. Feuert eine Zelle nicht 67 6 Analyse der Strukturbildungsprozesse mehr, so kann sie auch nichts lernen, d.h. der Lernprozeß ist postsynaptisch getriggert. Das bedeutet aber auch, daß die gelernte Strukturgröße genau so groß ist wie die der einzelnen Blasen. Ist die Blasengröße groß, sind auch die Unterstrukturen groß, was bewirkt, daß eine starke Asymmetrie gelernt werden kann. Ist die Blasengröße hingegen sehr klein, können nur die zentralen Gewichte im rezeptiven Feld gelernt werden, es wird also keine Asymmetrie gelernt. 6.2.2 Strukturbildung über einen längeren Zeitraum Eine einzelne Blase sagt allerdings noch nichts über einen Lernprozeß aus, der „ursächlich“ sein soll für eine Kartenbildung. Um die Langzeitauswirkungen der Netzwerkdynamik mit lokaler Blasenbildung zu untersuchen, sind sehr viel längere Zeiträume ausschlaggebend als der einer einzelnen Blase von etwa 50 ms. In den Simulationsläufen zur Kartenbildung wurde daher eine Zeitdauer von 107 ms, also drei Stunden, gewählt. Die variierten Parameter der nun folgenden Läufe sind in Tabelle 3 eingetragen. Abb. J ex->ex J ex->ex J ex->ex 0 min max V0 η up J ex->inh 0 µ 0,3 -∞ 10-4 0,4 1,0 2,0 -4 0,4 1,0 2,0 0,3 0,1 0,8 0,0 0,005 0,5 0 6.10, 6.11 0,35 0,1 0,8 0,4 0,05 0,2 0,35 0,0 0,8 0,1 0,05 0,35 Ξ 0,5 6.7, 6.8 6.12 J ex->inh J inh->ex max 0 10 Tabelle 3 Parameter für die Läufe der Abbildungen 6.7 bis 6.12 Bei diesen länger andauernden Läufen erwartet man, daß die Gewichtsänderungen, die durch eine einzelne Blase induziert werden, bevorzugt eine weitere Blase an derselben Stelle entstehen lassen. Dieser Lernprozeß wiederholt sich solange, bis sich eine stabile Struktur ausgebildet hat und alle Gewichte ihr Maximum oder Minimum erreicht haben. Bei langen Läufen zeigt sich, daß die einzelnen durch Blasen gelernten „Unterstrukturen“ benachbart angeordnet sind, und die gelernte Strukturgröße denen der Blasen entspricht. In Abbildung 6.7 ist ein Ausschnitt der rezeptiven-Feld Struktur des Netzwerkes dargestellt. sehr gut sind wabenförmige Unterstrukturen zu erkennen. Der mittlere Bereich einer einzelnen Unterstruktur wird durch den Keim einer Blase gelernt (siehe Abb. 6.7 a). Deshalb sind hier nur die zentralen Gewichte verstärkt worden. In den Außenbereichen der Unterstrukturen hingegen erkennt man eine starke Asymmetrie (vgl. Abb. 6.7 c). An diesen Stellen konnten die Neuronen auch stärker verzögerte Verbindungen des rezeptiven Feldes lernen. 68 6 Analyse der Strukturbildungsprozesse Abbildung 6.7 Wabenförmige Unterstrukturen einer Rezeptiven Feld Karte In dieser Abbildung ist ein Ausschnitt aus den Verteilungen der rezeptiven Felder gezeigt. Diese Struktur wurde nach 107 ms aufgenommen. Gut erkennt man die einzelnen wabenförmigen Unterstrukturen. In der Mitte einer Unterstruktur (a) sind die zentralen Gewichte erhöht, während an den Randbereichen (c) sehr starke Asymmetrien gelernt wurden. In der Mitte einer Unterstruktur (a) bildet sich eine punktförmige Richtungssingularität und ein 360° Orientierungspinwheel. An den Punkten, an denen sich mehrere Unterstrukturen treffen (b), bildet sich ein „natürliches“ 180° Orientierungspinwheel. In (c) treffen zwei gegensätzliche Richtungsselektivitäten aufeinander. Auch solch ein Szenario ist in der Natur zu finden, als sogenannte „Fractures“. Durch diese Art der Strukturbildung entwickeln sich jedoch Karten, die nicht ganz den experimentell gefundenen entsprechen. Die Bereiche, die inmitten einer Unterstruktur liegen (Abb. 6.7 a), stellen eine punktförmige Richtungssingularität bzw. ein 360° Pinwheel dar, während die Stellen, an denen drei Unterstrukturen aufeinander treffen (Abb. 6.7 b) ein „natürliches“ Orientierungspinwheel erzeugen. Die Orientierung ändert sich um diese Singularität nur um 180°. An den Grenzbereichen zweier Unterstrukturen (Abb. 6.7 c) treffen zwei gegensätzliche Richtungsselektivitäten aufeinander. Auch solch ein Szenario ist in der Natur zu finden. Dies sind sogenannte „Fractures“. In Abbildung 6.8 a ist die zugehörige Richtungskarte, in Abbildung 6.8 b die entsprechende Orientierungskarte dargestellt. In der ersten Spalte ohne Darstellung der Selektivitäten, in der zweiten Spalte mit DSI gewichtet. In der dritten Spalte ist die 69 6 Analyse der Strukturbildungsprozesse Verteilung der Richtungen bzw. Orientierungen mit den entsprechenden Selektivitäten dargestellt. Klar sind die erwarteten punktförmigen Richtungs- und 360° Orientierungssingularitäten zu sehen. Charakteristisch für diese Struktur ist die dem Experiment widersprechende, stark unterschiedliche Größe der Iso-Orientierungsbereiche im Vergleich zu den IsoRichtungsbereichen. Um jede punktförmige Richtungsselektivität ist jede Richtung genau einmal, jede Orientierung dagegen zweimal vertreten. Die in diesen Simulationsläufen entstandenen Kartenstrukturen entsprechen also immer noch nicht den im Experiment gefundenen (vgl. Abb. 2.6). a) b) Abbildung 6.8 Richtungs- und Orientierungskarte In dieser Abbildung sind die zugehörigen Karten zur rezeptiven Feld Struktur in Abbildung 6.7 dargestellt. In a) ist die Richtungskarte dargestellt, in der ersten Spalte ohne Gewichtung durch den Selektivitätsindex, in der zweiten Spalte mit Gewichtung. Deutlich erkennt man punktförmige Richtungssingularitäten. Von einem Punkt aus zeigt die Richtungspräferenz strahlförmig nach außen. Genau bei dieser Singularität geht der DSI gegen Null (weiße Stellen in den gewichteten Karten). In der rechten Spalte ist die Verteilung der verschiedenen Richtungen und der DSIs dargestellt. Man erkennt, daß die Verteilung sehr homogen ist, wie es sich auch im Experiment zeigt. Die Verteilung der DSI erstreckt sich über einen großen Bereich bis über 0,5, einer bereits relativ hohen Selektivität. In b) ist die Orientierungskarte dargestellt, in der man 360° Pinwheels findet. An den Stellen, um eine punktförmige Richtungssingularität rotiert die Orientierung um 360°. Man erkennt, daß die Verteilung der Orientierungen ebenfalls sehr homogen ist. 70 6 Analyse der Strukturbildungsprozesse 6.2.3 Lernen mit Lernschwelle Das Spontanrauschen, durch das eine Blase auslöst wird, kommt bereits durch ein sehr kleines oder sogar negatives Membranpotential zustande (vgl. Kapitel 5.3 und Formel 3.12). Um den Einfluß des Spontanrauschens am Lernprozeß zu unterdrücken, wurde eine Lernschwelle in Abhängigkeit vom Membranpotential eingeführt ( vgl. Kapitel 3.3.2). Erst sobald das Membranpotential einen gewissen Level erreicht hat, wird hiermit die LTP wirksam. Bei einer Blasenausbreitung feuern die Keimneuronen spontan. Das Membranpotential liegt noch unter der Schwelle. Somit wird das für Keimneuronen typische Lernen im zentralen Bereich der rezeptiven Felder unterbunden. Die Umfeldneuronen werden vom Keim angeregt. Je weiter sie vom diesem entfernt sind, desto stärker können sie stimuliert werden, das Membranpotential wird bei der Spikeauslösung also immer größer. Bei einer Ausdehnung der Blase in der Größenordnung des rezeptiven Feldes ist das Membranpotential maximal, denn es können auch die dezentralen Synapsen einen Beitrag leisten. Selbst bei einer weiteren Ausdehnung der Blase kann nun kein weiterer Beitrag mehr geleistet werden, da die Reichweite des rezeptiven Feldes nicht ausreicht, das Membranpotential ist „gesättigt“. Durch das Einstellen der Schwelle kann man bestimmen, ab welcher Ausdehnung der Blase der Lernprozeß starten soll. Diese Schwelle muß unter der Sättigung des Membranpotentials liegen, da sonst keine LTP stattfindet. Sie muß aber auch möglichst nahe an der Sättigung liegen, damit möglichst viele dezentrale Synapsen gelernt werden. Der Lernprozeß startet also erst nach einer gewissen Laufzeit der Aktivitätsfront. Nach 20 ms fangen auch die dezentralen Synapsen an zu lernen. Um starke Asymmetrien für hohe Richtungsselektivitäten zu lernen, muß die Ausbreitung einer Blase also mindestens 20 ms andauern. Gestoppt wird die Ausbreitung durch das Einsetzen der Inhibition. Diese muß so gewählt sein, daß sie erst kurz nach Überschreiten der Sättigung des Membranpotentials einschreitet und dann natürlich sehr stark und effizient wirkt. Setzt die Inhibition zu spät ein, wird die Ausdehnung der Blase und damit die Strukturgröße sehr groß. Das Lernen findet mit Lernschwelle also in einem Ring um die Keimneuronen statt, wie in Abbildung 6.9 veranschaulicht. 71 6 Analyse der Strukturbildungsprozesse Abbildung 6.9 Einschränkung des Lernbereiches durch Einführung einer Lernschwelle Dargestellt sind hier die verschiedenen Bereiche der Blasenausbreitung. In der Mitte der Abbildung (grau) befindet sich ein Aktivitätskeim. Hier ist das Membranpotential noch nicht groß genug, um die Lernschwelle zu überschreiten. Bei der weiteren Ausbreitung steigt das Membranpotential, und die Lernschwelle wird überschritten (rot schraffiert). Das System kann hier lernen. Ab einer bestimmten Blasengröße greift die Inhibition (blau) und das Membranpotential liegt wieder unterhalb der Schwelle, so daß hier nicht mehr gelernt wird. Setzt die Inhibition zu spät ein, wird die Ausdehnung der Blase und damit die Strukturgröße in der Karte sehr groß. Das Lernen findet mit Lernschwelle also in einem Ring um die Keimneuronen statt. Das Ziel dieser Lernschwelle ist, zu verhindern, daß im Keimbereich der Blase Strukturen gelernt werden, die keine Asymmetrie aufweisen. Ein Blick auf die Struktur der gelernten rezeptiven Felder wie in Abbildung 6.10, zeigt, daß die Asymmetrien sehr gleichmäßig über die Karte verteilt sind. Man erkennt im Gegensatz zu Abbildung 6.7 keine wabenförmigen Unterstrukturen mehr, die von Blasen herrühren. Durch die Lernschwelle wurde bei jeder entstehenden Blase nur der äußere Bereich gelernt, also eine Asymmetrie im rezeptiven Feld, aber nicht der Bereich des Zentrums. Abbildung 6.10 Rezeptive Felder in einer mit Lernschwelle gelernten Karte Ausschnitt einer mit Lernschwelle gelernten rezeptiven Feld Struktur. Man erkennt im Gegensatz zu Abb. 6.7 keine so deutlichen Unterstrukturen mehr, die von Blasen herrühren. Durch die Lernschwelle wurde bei jeder Blase nur der äußere Bereich gelernt aber nicht aber der Bereich des Zentrums. Es ergeben sich deutlich asymmetrische und somit richtungsselektive Verknüpfungsstrukturen. 72 6 Analyse der Strukturbildungsprozesse Die Folge von solch einer „Einstellung“ ist (Abb. 6.11), daß die Bildung von punktförmigen Richtungssingularitäten und 360° Pinwheels unterbunden wird. Diese Karten sind den experimentell gefundenen Karten sehr ähnlich. a) b) Abbildung 6.11 Richtungs- und Orientierungskarte nach Lernen mit Schwelle Mit Lernschwelle gelernte Karten. In a) ist die Richtungskarte, in b) die Orientierungskarte mit den entsprechenden Histogrammen dargestellt. Es zeigt sich, daß keine punktförmigen Richtungssingularitäten und keine 360° Orientierungspinwheels mehr auftreten. Die Histogramme zeigen eine gleichmäßige Verteilung der Richtungs- und Orientierungspräferenzen und gute Selektivitätsindizes. 73 6 Analyse der Strukturbildungsprozesse 6.2.4 Zeitliche Entwicklung der Karten Im zeitlichen Verlauf zeigt sich, daß die Entwicklung von Strukturen in den Karten nicht immer stabil verläuft. Die exzitatorischen Gewichte bewegen sich in einem Bereich von einem Minimalgewicht J min bis zu einem Maximalgewicht J max . Die zum Keim gerichteten synaptischen Gewichte bestimmen den Anstieg des Membranpotentials in Richtung Umfeld der Blase. Werden diese Gewichte verstärkt, so vergrößert sich deren Ausdehnung, da die Inhibition nicht mehr schnell genug wirken kann. Die Position, an der das Membranpotential die Lernschwelle überschreitet, wandert in Richtung Keimzentrum. Für die Stabilität der Blasenausdehnung während eines Lernprozesses, also auch der Strukturbildung, müssen daher auch die Kopplungen von der exzitatorischen auf die inhibitorische Schicht gelernt werden, da dadurch die Größe der einzelnen Blasen variiert werden kann. Diese Kopplungen müssen mit steigender Asymmetrie zwischen den exzitatorischen Neuronen verstärkt werden. Hierfür wurde (vgl. Kapitel 3.3) ein Term in die Lerngleichung aufgenommen, der bei jeder Aktivierung einer Verbindung eines exzitatorischen Neurons auf ein inhibitorisches Neuron das entsprechende Gewicht langsam hochreguliert, bis schließlich ein Wert erreicht ist, der bei maximaler exzitatorischer Kopplung die Ausdehnung einer Blase in einem Größenordnungsbereich hält, der dem des rezeptiven Feldes entspricht. Da die Inhibition jetzt schon früher zu wirken beginnt, rückt auch die Position, an der die Lernschwelle wirkt, wieder zurück in das Umfeld. Die zeitliche Entwicklung der Kartenentstehung eines typischen Laufes mit Lernschwelle, expliziter Normierung und einem Lernen der Kopplungen von exzitatorischen auf inhibitorische Neuronen ist in Abbildung 6.12 gezeigt. Deutlich sieht man hier, daß sich die Struktur langsam bildet und immer schärfer wird. Die Strukturgröße ändert sich bei diesem Prozeß nicht. 74 6 Analyse der Strukturbildungsprozesse a) b) c) d) t=1⋅106 ms t=2⋅106 ms t=3⋅106 ms t=10⋅106 ms Abbildung 6.12 Zeitliche Entwicklung einer Richtungs- und Orientierungskarte Hier ist die zeitliche Entwicklung einer Kartenstruktur dargestellt. Das erste Bild ist nach 1 Mio. Lernschritten aufgenommen. Die jeweiligen Zeiten stehen unter den Bildern. In a) ist die Entwicklung der Richtungskarte, in c) der Orientierungskarte dargestellt. Sehr schön erkennt man, wie sich langsam eine Struktur bildet und dann immer mehr etabliert. Nach 10 Mio. Lernschritten, das entspricht fast 3 h simulierte Echtzeit, ist eine deutliche Unterteilung der Karten in IsoOrientierungs und Iso-Richtungs-Bereiche gegeben. Wie in den Histogrammen b) und d) zu erkennen, ist auch die Verteilung der Richtungen bzw. Orientierungen sehr homogen. Die Verteilung der Selektivitätsindizes der Richtung, den DSIs, ist sehr gut und erreicht etwa den Maximalwert, den man gemäß der Teststruktur aus Kapitel 4.3 erwarten kann. 75 76 Zusammenfassung und Ausblick In dieser Arbeit wurde untersucht, wie in einem verrauschten Netzwerk, bestehend aus Spike- Response Neuronen, mit zwei Neuronenschichten, einer exzitatorischen und einer inhibitorischen, aus einer anfänglichen Verteilung der synaptischen Gewichte (homogen oder verrauscht) ein Strukturbildungsprozeß stattfinden kann. Die Verbindungen der einzelnen Neuronen sind in diesem Modell entfernungsabhängig verzögert. Dadurch bewirkt eine Asymmetrie in der Gewichtsverteilung eine starke Richtungsselektivität. Als Erstes wurden verschiedene Szenarien der intracorticalen Dynamik untersucht. Speziell ein Aktivitätsregime erschien interessant. Hier entstehen kleine Aktivitätsblasen, die stark lokal korreliert sind und nach einer Laufzeit von etwa 50 ms durch Inhibition vernichtet werden. Im Folgenden wurde das Lernfenster „eingeschaltet“ und untersucht, welche Strukturbildung man beobachten kann. Um für diese Analyse LTP und LTD getrennt untersuchen zu können, wurde in einem Teil der Läufe eine explizite Normierung eingeschaltet, die nach jedem Lernvorgang die Gewichte eines Neurons auf ein 77 vorgegebenes Gesamtgewicht normiert. Es stellte sich heraus, daß für eine Strukturbildung ein exponentiell abfallender LTPAnteil des Lernfensters völlig ausreichend ist. Bei Aktivierung des LTD-Anteils wurde auf eine α-Funktion mit einer Zeitkonstante von τ=20 ms zurückgegriffen. Dies war nötig, um ein gleichmäßiges Entlernen in diesem Aktivitätsregime zu ermöglichen. Weiterhin zeigte sich, daß die entstehenden Strukturen so noch nicht mit dem Experiment übereinstimmen. Es fanden sich 360° Pinwheels und punktförmige Richtungssingularitäten. Dies wurde dadurch verursacht, daß das System im gesamten Bereich einer Blase lernte. Durch die Einführung einer Lernschwelle konnte der Lernprozeß verändert werden. Sie bewirkte, daß der Anteil des Rauschens am Lernen minimiert wurde. Insbesondere die Neuronen, die eine Aktivitätsblase auslösten (Keimneuronen), hätten ohne diese Schwelle nur die zentralen Gewichte gelernt. Mit dieser Schwelle jedoch wurde das Lernen auf einen konzentrischen Ring um die Keimneuronen eingeschränkt. Es bildeten sich daher Strukturen, die den im Experiment gefundenen Karten besser entsprechen. Für eine Erweiterung oder Fortführung dieser Untersuchungen wären vor allem folgende Fragestellungen von Interesse, die ansatzweise schon in den Simulationen und Auswertungen implementiert sind, aber noch weiterführende Untersuchungen erfordern: Wie wachsen die vorwärtsgerichteten Verbindungen aus dem LGN in den Cortex ein, wenn dort schon eine gelernte Struktur vorhanden ist? Untersuchungen hierfür wurden bereits von Armin Bartsch (2000) gemacht. Allerdings wurde dort nur die Orientierungsselektivität betrachtet. Es wäre von großem Interesse, die verschiedenen Kanäle vom LGN (lagged und non lagged) einzeln und im Zusammenwirken miteinander zu untersuchen. Wie entwickeln sich die Strukturen durch visuelle Erfahrungen? Hierzu gibt es Experimente, in denen beobachtet wird, wie sich die Kartenbildung verhält, wenn das Versuchstier in einer Umgebung aufwächst, in der es nur eine Bewegungsrichtung gibt (Cynader 1975), oder wenn es in der frühkindlichen Wachstumsphase nur stroboskopisches Licht sieht (Cynader 1973, Tretter 1975). In den Simulationen im Rahmen dieser Arbeit wurde auch das Lernen unter dem Einfluß eines Stimulus getestet, hier aber nur für den Spezialfall eines unidirektional bewegten Balkens gezeigt (Kapitel 6.1). Welchen Einfluß auf die Richtungsselektivität und die entsprechenden Karten haben Netzwerkeffekte? Um die Richtungsselektivität zu erklären, gibt es den Ansatz, daß asymmetrische Inhibition die entscheidende Rolle spielt (Sabatini 1999, Livingstone 1998). In den, während dieser Arbeit durchgeführten Simulationen, wurde festgestellt, daß bei der Betrachtung der raumzeitlichen rezeptiven Felder auch bei einer homogenen Gewichtsverteilung der inhibitorischen Synapsen eine Asymmetrie entsteht. Diese Untersuchung wurde aber aus Zeitgründen nicht weiter verfolgt. Wie verändert sich das hier betrachtete Szenario mit vorwiegend axonaler Verzögerung unter dem Einfluß von dendritischer Verzögerung? Die Lerngleichung wäre dahingehend umzustellen, daß die dendritischen Laufzeiten auch für das Lernfenster berücksichtigt werden. Nach einem postsynaptischen Spike müßte die Information erst über ein Signal an die Synapse „gesendet“ werden. Diese Laufzeit würde zu einer Verschiebung des Lernfensters in Richtung des LTD-Anteils führen. Beschreibung der Simulation und der Programmiertechnik 78 Ein Großteil der bei dieser Diplomarbeit verfügbaren Zeit wurde benötigt, ein massiv parallelisierbares Programm zu entwickeln, welches ein Netzwerk spikender Neuronen simuliert. Dabei wurde Wert darauf gelegt, daß möglichst viele Szenarien simuliert werden können. Vor allem für Untersuchungen zur Entstehung der Richtungsselektivität mußte ein besonderes Augenmerk darauf gelegt werden, daß die zeitliche Struktur sehr variabel gehalten und in den Simulationsläufen einfach variiert werden konnte. Da jedoch die verfügbare Zeit sehr beschränkt war, wurde das Hauptaugenmerk auf die intracorticale Strukturbildung gerichtet, obwohl im Programm bereits genikuläre Kopplungen implementiert waren. Auch sollte das Programm auf möglichst jeder Rechnerarchitektur lauffähig sein. Deshalb wurde es in C geschrieben in einem nahezu plattformunabhängigen Code. Für die Parallelisierung wurde auf die MPI-Library zurückgegriffen, die heutzutage hierfür einen quasi-Standard darstellt. So konnte das Programm auch recht schnell auf dem Großrechner HITACHI SR-8000 am Leibniz-Rechenzentrum in München zum Einsatz gebracht werden. Der Speed-up war sehr gut: Selbst bei acht Prozessoren rechnete das Programm dank pseudovektorisierbarer Risc-Prozessoren etwa zehn mal schneller als auf den institutseigenen Intel bzw. AMD Workstations. Bei den etwa 1000 verfügbaren Prozessoren könnte man theoretisch riesige Simulationen laufen lassen. Leider war die HITACHI SR-8000 von anderen Benutzern lange Zeit sehr massiv ausgelastet, so daß man auf die Ausführung eines Jobs mit 8 Prozessoren etwa eine Woche lang warten mußte, so daß von größeren Simulationen Abstand genommen und das Hauptaugenmerk auf verschiedene kleinere Parameterstudien gelegt wurde. Bei der großen Zahl an Simulationsläufen, von denen in dieser Arbeit nur die wichtigsten vorgestellt wurden, war es immer wieder erforderlich, das Programm anzupassen damit neue Parameter und neue Szenarien getestet werden konnten. Es besteht mit der momentanen Fassung des Programms die Hoffnung, daß größere Simulationen durchgeführt werden können, die dann bedeutend größere und noch eindrucksvollere Karten ergeben. 79 80 Danksagung Abschließend möchte ich mich bei all denjenigen bedanken, die mich das ganze Jahr unterstützt haben. Für die Vergabe des Themas und die Ermöglichung in diesem interessanten Forschungsbereich meinen Beitrag zu leisten, möchte ich Herrn Professor Dr. J. Leo van Hemmen danken. Großer Dank auch an Oliver Wenisch für die vielen Diskussionen, Denkanstöße, Unterstützung in „Mathematica“, das Korrekturlesen dieser Arbeit und die allgemeine Unterstützung bei dieser Arbeit. Weiterhin möchte ich Christian Leibold, Moritz Franosch und Marion Sobotka für die gute Arbeitsatmosphäre im vergangenen Jahr danken. Ein ganz besonderer Dank geht an meine Mutter und an meine Oma für die moralische und finanzielle Unterstützung. Speziell für die Formeln 4.17 und 4.18 und vielerlei andere Unterstützung danke ich Susanne Herrmann. Für die Möglichkeit die HITACHI-SR8000 zu benutzen vielen Dank an das Leibniz Rechenzentrum in München. 81 82 Abbildungsverzeichnis Abbildung 1.1 Die Karten des somatosensorischen und motorischen Cortex...............................6 Abbildung 1.2 Säulenstruktur im visuellen Cortex........................................................................7 Abbildung 1.3 Karten im visuellen Cortex....................................................................................7 Abbildung 1.4 Querschnitt durch die Großhirnrinde.....................................................................8 Abbildung 1.5 Nervenzelle.............................................................................................................9 Abbildung 1.6 Synaptische Übertragung ....................................................................................10 Abbildung 1.7 EPSP und IPSP.....................................................................................................11 Abbildung 1.8 Langzeitpotenzierung (LTP)................................................................................12 Abbildung 1.9 Lernfenster...........................................................................................................12 Abbildung 1.10 Experimentell gemessene Veränderungen des synaptischen Gewichtes...........13 Abbildung 2.1 Die Sehbahn ........................................................................................................16 Abbildung 2.2 Die zwei verschiedenen Arten rezeptiven Felder in der Retina..........................17 Abbildung 2.3 Experimentelle Tuningkurven..............................................................................19 Abbildung 2.4 Zustandekommen von Orientierungsselektivität nach Hubel und Wiesel...........20 Abbildung 2.5 Single condition maps..........................................................................................21 Abbildung 2.6 Orientierungs- und Richtungskarte......................................................................22 Abbildung 2.7 Orientierungssingularitäten..................................................................................22 Abbildung 2.8 Richtungssingularitäten........................................................................................23 Abbildung 3.1 schematische Erklärung der Richtungsselektivität..............................................26 Abbildung 3.2 Verzögerungen im Input-Feld..............................................................................27 Abbildung 3.3 Neuronales Netzwerk...........................................................................................28 Abbildung 3.4 Rezeptive Felder...................................................................................................29 Abbildung 3.5 rezeptives Feld mit Arborisierung........................................................................30 Abbildung 3.6 Zeitlicher Verlauf von EPSP und IPSP mit unterschiedlichen Zeitkonstanten...32 Abbildung 3.7 Aktivierungsfunktion des Neurons......................................................................33 Abbildung 3.8 Lernfenster...........................................................................................................34 Abbildung 3.9 Lernamplitude......................................................................................................35 Abbildung 4.1 Stimuluspräsentation zur Datenauswertung.........................................................40 Abbildung 4.2 Auswertung mit Gitter im Schema.......................................................................41 Abbildung 4.3 Berechnung der Richtungsselektivität.................................................................45 Abbildung 4.4 Testbild.................................................................................................................48 Abbildung 4.5 Vergleich der Karten............................................................................................50 Abbildung 5.1 Blasenbildung (3 ms Takt)...................................................................................54 Abbildung 5.2 Welle koppelt mit sich selbst (20 ms Takt).........................................................55 Abbildung 5.3 Blasenbildung (10 ms Takt).................................................................................56 Abbildung 6.1 Untersuchte Variationen der LTP........................................................................58 Abbildung 6.2 Untersuchung von LTP mit expliziter Normierung.............................................60 Abbildung 6.3 Variationen der LTD............................................................................................61 Abbildung 6.4 Untersuchung von LTD mit expliziter Normierung.............................................62 Abbildung 6.5 Untersuchung von gleichzeitiger LTP und LTD ohne explizite Normierung.....63 Abbildung 6.6 Strukturbildung durch eine Aktivitätsblase schematisch.....................................65 Abbildung 6.7 Wabenförmige Unterstrukturen einer Rezeptiven Feld Karte.............................67 Abbildung 6.8 Richtungs- und Orientierungskarte......................................................................68 Abbildung 6.9 Einschränkung des Lernbereiches durch Einführung einer Lernschwelle..........70 Abbildung 6.10 Rezeptive Felder in einer mit Lernschwelle gelernten Karte............................70 Abbildung 6.11 Richtungs- und Orientierungskarte nach Lernen mit Schwelle.........................71 Abbildung 6.12 Zeitliche Entwicklung einer Richtungs- und Orientierungskarte......................73 83 84 Literaturverzeichnis A. P. Bartsch. Orientation Maps in Primary Visual Cortex: A Hebbian Model of Intracortical and Geniculocortical Plasticity. Dissertation 2000, TU München. A. P. Bartsch, J. L. van Hemmen. Combined Hebbian development of geniculocortical and lateral connectivity in a model of primary visual cortex. Biol. Cybern. 84:41-55 (2001) M.F. Bear, B.W.Connors, M.A. Paradiso. Neuroscience: Exploring the Brain, Williams & Wilkins (1995) G. G. Blasdel. Differential imaging of ocular dominance and orientation selectivity in monkey striate cortex. J. Neurosci. 12:3115-3138 (1992a) G. G. Blasdel. Orientation selectivity, preference, and continuity in monkey striate cortex. J. Neurosci. 12:3139-3161 (1992b) G. G. Blasdel, D. Fitzpatrick. Physiological organization of layer 4 in macaque striate cortex. J. Neurosci. 4:880-895 (1984) G. G. Blasdel, D. E. Mitcell, D. W. Muir, J. D. Pettigrew. A physiological and behavioural study in cats of the effect of early visual experience with contours of a single orientation. J. Physiol. (Lond.) 265:615-636 (1977) T. Bonhoeffer, I. Gödecke. Organization of the visual cortex. Nature 382:306-307 (1996) T. Bonhoeffer, A. Grinvald. Iso-orientation domains in cat visual cortex are arranged in pinwheel-like patterns. Nature 353:429-431 (1991) T. Bonhoeffer, A. Grinvald. The layout of iso-orientation domains in area 18 of cat visual cortex: Optical imaging reveals a pinwheel-like organization. J. Neurosci. 13:4157-4180 (1993) V. Bringuier, F. Chavane, L. Glaeser, Y. Fregnac. Horizontal propagation of visual activity in the synaptic integration field of area 17 neurons. Science 283:695-699 (1999) N. J. Buchs, W. Senn. Development of direction selective simple cells through spike-based synaptic modifications: simulations results. J. Computational Neuroscience, 2001, Submitted. P. Buser, M. Imbert. Vision. The MIT Press, Cambridge (1992) M. Cynader, G. Chernenko. Abolition of direction selectivity in the visual cortex of the cat. Science 193:504-505 (1976) M. Cynader, N. Berman, A. Hein. Cats reared in stroboscopic illumination: effects on receptive fields in visual cortex. Proceedings of the National Academy of Sciences. 70:1353-1354 (1973) M. Cynader, N. Berman, A. Hein. Cats Raised in a One-Directional World: Effect on Receptive Fields in Visual Cortex and Superior Colliculus. Exp. Brain Res. 22:267-280 (1975) D. W. Dong, J. J. Atick. Temporal decorrelation: a theory of lagged and nonlagged responses in the lateral geniculate nucleus. Network 6:159-178 (1995) J. Dudel, R. Menzel, R. F. Schmidt. Neurowissenschaft: Vom Molekül zur Kognition. Springer (1996) W. Edelmann. Lernpsychologie. Kösel-Verlag. 6.Auflage. (2000) D. E. Feldmann. Timing-Based LTP and LTD at Vertical Inputs to Layer II/III Pyramidal Cells in Rat Barrel Cortex. Neuron. 27:45-56 (2000) W. Gerstner, R. Kempter, J. L. van Hemmen, H. Wagner. A neuronal learning rule for submillisecond temporal coding. Nature 383:76-81 (1996) 85 W. Gerstner, J. L. van Hemmen. Coding and information processing in neural networks. In E. Domany, J. L. van Hemmen, K. Schulten (editors). Models of neural networks II, (1-93), New York. Springer-Verlag (1994) Z. Gil, Y. Amitai. Properties of convergent thalamocortical and intracortical synaptic potentials in single neurons of neocortex. J Neurosci 16:6567-6578 (1996) D. O. Hebb. The organization of behavior. Wiley, New York (1949) D. Hubel, T.N. Wiesel. Receptive fields of single neurones in the cat's striate cortex. J. Phyiol. 148:574-592 (1959) M. Hübener, D. Shoham, A. Grinwald und T. Bonhoeffer. Spatial Relationships among Three Columnar Systems in Cat Area 17. J. Neuroscience. 17:9270-9284 (1997) E. R. Kandel, J. H. Schwartz, Spektrum (1995) T. M. Jessell. Neurowissenschaften: Eine Einführung. R. Kempter, W. Gerstner, J. L. van Hemmen. Hebbian learning and spiking neurons. Physical Review 59:4498-4514 (1998) R. Kempter, W. Gerstner, J. L. van Hemmen. Intrinsic Stabilization of Output Rates by SpikeBased Hebbian Learning. Neural Comp. (2001) Z. F. Kisvarday, P. Buzas, U. T. Eysel. Calculating direction maps from intrinsic signals revealed by optical imaging. Cereb. Cortex. 11:636-47 (2001) R. Linsker. From basic network principles to neural architecture: Emergence of orientation columns. Proc. Natl. Acad. Sci. USA 83:8779-8783 (1986) S. M. Livingstone. Mechanisms of Direction Selectivity in Macaque V1. Neuron 20:509526(1998) C. von der Malsburg. Self-organization of orientation selective cells in the striate cortex. Kybernetik 14:85-100 (1973) H. Markram, J. Lübke, M. Frotscher, B. Sakmann. Regulation of Synaptic Efficacy by Coincidence of Postsynaptic APs and EPSPs. Science 275:213-215 (1997) K. D. Miller. A model for the development of simple cell receptive fields and the ordered arrangement of orientation columns through activity-dependent competition between ON- and OFF-center inputs. J. Neurosci. 14:409-441 (1994) C. Piepenbrock, H. Ritter, K. Obermayer. The joint development of orientation and ocular dominance: role of constraints. Neural Comput. 9:959-970 (1997) S. P. Sabatini, F. Solari. An architectural hypothesis for direction selectivity in the visual cortex: the role of spatially asymmetric intrinsic intracortical inhibition. Biol. Cybern. 80:171183(1999) W. Senn, N. J. Buchs. Development of direction selective simple cells through spike-based synaptic modifications: mathematical analysis. J. Computational Neuroscience. 2001. Submitted. A. Shmuel, A. Grinvald. Functional organization for direction of motion and its relationship to orientation maps in cat area 18. J. Neurosci. 16:6945-6964 (1996) R. J. Snowden. Motion processing in the primate cerebral cortex. In A. T. Smith & R. J. Snowden (Hrsg.) Visual Detection of Motion, (51-83). Academic Press, London (1994) S. Song, K. D. Miller, L. F. Abbott. Competitive Hebbian Learning Through Spike-Timing Dependent Synaptic Plasticity. Nature Neurosci. 3:919-926 (2000) N. V. Swindale. Orientation tuning curves: empirical description and estimation of parameters. Biol. Cybern. 78:45-56 (1998) R. F. Thompson. Das Gehirn. Spektrum, 2. Aufl. (1994) 86 F. Tretter, M. Cynader, W. Singer. Modification of direction selectivity of neurons in the visual cortex of kittens. Exp. Brain Res. 84:143-149 (1975) J. L. van Hemmen. Die Karte im Kopf: Wie stellt das Gehirn seine Umwelt dar? Phys. Blätter 57,2:37-42 (2001) M. Weliky, W. Bosking, D. Fitzpatrick. A systematic map of direction preference in primary visual cortex. Nature 379:725-728 (1996) M. Weliky, L. C. Katz. Disruption of orientation tuning in visual cortex by artificially correlated neuronal activity. Nature, 386:680-685 (1997) M. Weliky, L. C. Katz. Correlational structure of spontaneous neu-ronal activity in the developing lateral geniculate nucleus in vivo. Science, 285:599-604 (1999) E. L. White, A. Keller. Cortical Circuits: synaptic organization of the cerebral cortex- structure, function, and theory. Birkhäuser (1989) S. Wimbauer. Raumzeitliche rezeptive Felder: Modellierung von Antworteigenschaften und Entwicklung einfacher Zellen im visuellen Cortex. volume 62 of Reihe Physik. Harri-Deutsch Verlag, Frankfurt/Main. Dissertation 1996, TU München. S. Wimbauer, O. G. Wenisch, K. D. Miller, J. L. van Hemmen. Development of spatio-temporal receptive fields of simple cells: I. Model formulation. Biol. Cybern. 77:453-461 (1997) S. Zeki. A Vision of the Brain. Blackwell Scientific Publications, Oxford (1994) L. I. Zhang, H. W. Tao, C. E. Holt, W. A. Harris, M. M Poo. A critical window for cooperation and competition among developing retinotectal synapses. Nature 395:37-44 (1998) 87 88 89